BAB 2
TINJAUAN PUSTAKA
2.1 Sabun
Sabun adalah dari senyawa garam asam-asam lemak tinggi, seperti natrium stearat C17H35COO-Na+. Aksi pencucian dari sabun banyak dihasilkam dari kekuatan pengemulsian dan kemampuan menurunkan tegangan permukaaan dari air. Konsep ini dapat dipahami dengan mengingat kedua sifat dari anion sabun. Suatu gambaran dari stearat terdiri dari ion karboksil sebagai “kepala” dengan hidrokarbon yang panjang sebagai “ekor” (Rukaesih, 2004).
Sabun merupakan produk pembersih untuk kulit manusia. Seperti detergen, sabun mempunyai gugus hidrofobik yang berinteraksi dengan minyak dan ujung anionik yang larut air. Mekanisme sabun mengangkat minyak/ lemak dari benda adalah molekul sabun larut dalam air dan ujung hidrofobik mengepung molekul minyak sedangkan ujung anion terlarut dalam air membentuk misel sehingga minyak terlepas dari benda.
Minyak nabati seperti sawit merupakan bahan utama pembuat sabun. Minyak hewani seperti lemak sapi dan babi juga sering dimanfaatkan untuk pembuatan sabun. Molekul sabun terdiri atas rantai hidrokarbon dengan gugus COO- pada ujungnya. Bagian hidrokarbon bersifat hidrofob artinya tidak suka pada air atau tidak mudah larut dalm air, sedangkan gugus COO- bersifat hidrofil, artinya suka akan air, jadi dapat larut dalam air. Oleh karena adanya dua bagian itu, molekul sabun tidak sepenuhnya larut dalam air, tetapi membentuk misel yaitu kumpulan rantai hidrokarbon dengan ujung yang bersifat hidrofil dibagian luar (Poejiadi, 2007).
Sementara itu SNI (1994) menjelaskan bahwa sabun mandi merupakan pembersih yang dibuat dengan mereaksikan secara kimia antara basa natrium atau basa kalium dan asam lemak yang berasal dari minyak nabati dan atau lemak hewani yang umumnya ditambahkan zat pewangi atau antiseptik dan digunakan untuk membersihkan tubuh manusia dan tidak membahayakan kesehatan. Sabun tersebut dapat berwujud padat, lunak atau cair, berbusa dan digunakan sebagai pembersih.
2.1.1 Sejarah Sabun
Tidak ada catatan pasti kapan sejarah pembuatan sabun dimulai. Pada waktu dahulu kala di tahun 600 SM masyarakat Funisia di mulut Sungai Rhone sudah membuat sabun dari lemak kambing dan abu kayu khusus. Mereka juga membarterkannya dalam berdagang dengan bangsa Kelt, yang sudah bisa membuat sendiri sabun dari bahan serupa.
Tahun 700-an di Italia membuat sabun mulai dianggap sebagai seni. Seabad kemudian muncul bangsa Spanyol sebagai pembuat sabun terkemuka di Eropa. Sedangkan Inggris baru memproduksi tahun 1200-an. Secara bersamaan Marseille, Genoa, Venice, dan Savona menjadi pusat perdagangan karena berlimpahnya minyak zaitun setempat serta deposit soda mentah. Akhir tahun 1700-an Nicolas Leblanc, kimiawan Perancis, menemukan larutan alkali dapat dibuat dari garam meja biasa. Sabun pun makin mudah dibuat, alhasil sabun terjangkau bagi semua orang. (Tambun, 2006)
2.1.2 Sifat – sifat Sabun:
1. Sabun adalah garam alkali dari asam lemak sehingga akan dihidrolisis parsial oleh air. Karena itu larutan sabun dalam air bersifat basa.
CH3(CH2)16COONa + H2O →CH3(CH2)16COOH + OH
-2. Jika larutan sabun dalam air diaduk maka akan menghasilkan buih, peristiwa ini tidak akan terjadi pada air sadah. Dalam hal ini sabun dapat menghasilkan buih setelah garam-garam Mg atau Ca dalam air mengendap.
CH3(CH2)16COONa + CaSO4 → Na2SO4 + Ca(CH3(CH2)16COO)2
3. Sabun mempunyai sifat membersihkan. Sifat ini disebabkan proses kimia koloid, sabun (garam natrium dari asam lemak) digunakan untuk mencuci kotoran yang bersifat polar maupun non polar, karena sabun mempunyai gugus polar dan non polar. Molekul sabun mempunyai rantai CH3(CH2)16 yang bertindak sebagai ekor yang bersifat hidrofobik (tidak suka air) dan larut dalam zat organik sedangkan COONa+ sebagai kepala yang bersifat hidrofilik (suka air) dan larut dalam air. ( Pratiwi, 2013)
2.1.3 Kegunaan Sabun
Pertama, rantai hidrokarbon sebuah molekul sabun larut dalam zat-zat non-polar, seperti tetesan-tetesan minyak. Kedua, ujung anion molekul sabun, yang tertarik pada air, ditolak oleh ujung anion molekul-molekul sabun yang menyembul dari tetesan minyak lain. Karena tolak-menolak antara tetes-tetes sabun-minyak, maka minyak itu tidak dapat saling bergabung tetapi tetap tersuspensi. (Ralph J, Fessenden, 1992)
2.1.4 Jenis – jenis Sabun
Jenis sabun yang utama adalah sabun mandi dan sabun cuci, kedua jenis sabun ini dibuat
dengan beberapa cara. Ada beberapa cara untuk mengklasifikasikan sabun. Salah satunya adalah penggolongan berdasarkan bentuk fisik dan fungsi.
1. Sabun batang
Terbuat dari lemak netral yang padat dan dikeraskan melalui proses hidrogenasi. Jenis alkali yang digunakan adalah natrium hidroksida dan sukar larut dalam air. Kebanyakan orang mulai meninggalkan sabun batang karena alasan kurang higienis dan berisiko menjadi tempat perpindahan bakteri, namun sabun batang dipercaya irit dan memiliki wangi yang lebih tahan lama. Terbukti, sebesar 43% dari 100 orang yang disurvei masih menggunakan sabun batang hingga kini. Jenis sabun batangan lainnya adalah sabun mandi kecantikan. Sabun mandi kecantikan adalah suatu produk
sabun untuk perawatan kecantikan kulit wajah dan tubuh dengan formulasi yang sesuai
untuk kulit. Memberikan zat-zat gizi dan nutrisi yang sangat diperlukan kulit dan
membantu memelihara kulit dengan mempertahankan kelembaban kulit serta membantu
pertumbuhan sel-sel baru jika terjadi kerusakan sel kulit. Pada sabun kecantikan busa
harus lembut dan sifat basanya lebih rendah. (Luis Spitz, 1996).
2. Sabun cair
3. Shower gel
Sabun dengan kandungan emulsi berupa cocamide DEA, lauramide DEA, linoleamide DEA, dan oleamide DEA ini berfungsi sebagai substansi pengental untuk mendapatkan tekstur gel. Sabun jenis ini memang belum terlalu populer dan biasanya lebih sering digunakan oleh wanita yang hobi berendam karena menghasilkan busa yang cenderung lebih banyak.
4. Sabun antisepik
Mengandung bahan aktif antibacterial, seperti triclosan, triclocarban/ trichlorocarbamide, yang berguna untuk membantu membunuh bakteri dan mikroba,
namun tidak efektif untuk menonaktifkan virus.
2.1.5 Cara Kerja Sabun Sebagai Penghilangan Kotoran
1. Sabun di dalam air menghasilkan busa yang akan menurunkan tegangan permukaan sehingga kain menjadi bersih dan air meresap lebih cepat kepermukaan kain.
2. Molekul sabun akan mengelilingi kotoran dengan ekornya dan mengikat molekul kotoran. Proses ini disebut emulsifikasi karena antara molekul kotoran dan molekul sabun membentuk suatu emulsi.
Sedangkan bagian kepala molekul sabun didalam air pada saat pembilasan menarik molekul kotoran keluar dari kain sehingga kain menjadi bersih. ( Pratiwi, 2013)
2.1.6 Pembuatan Sabun dalam Industri 1. Saponifikasi (Penyabunan)
tertentu dimana pembentukan produk sabun mempengaruhi proses emulsi kedua reaktan tadi, menyebabkan suatu percepatan pada kecepatan reaksi.
Proses reaksi saponifikasi adalah proses mereaksikan minyak dan NaOH pada reaktor pada suhu ± 1250C dengan bantuan pemanas steam. Komposisi antara minyak dan NaOH dengan perbandingan 3 : 1, jika tidak maka akan didapati reaksi yang tidak setimbang sehingga akan didapat sabun yang kurang sempurna. Reaksi dilakukan selama 10 menit dengan bantuan agitator dan recycle pompa ke reaktor. Minyak dan NaOH yang berada dalam storage tank (tangki penyimpanan) diumpankan ke reaktor lalu diinjeksikan steam sebesar 2 bar, selanjutnya ditambahkan larutan garam NaCl (brine) 22%. Hal ini dilakukan guna memperkaya elektrolit sehingga hasil reaksi antara minyak dan NaOH mudah dipisahkan pada proses selanjutnya.
O
CH2 O C R1 CH2 OH R1COONa O
CH O C R2 + 3NaOH CH OH + R2COONa O
CH2 O C R3 CH2 OH R3COONa Trigliserida Natrium hidroksida Gliserol Asam Lemak
Minyak yang direaksikan adalah campuran dari beberapa minyak (dalam satuan %b/%b) yang digunakan sebagai bahan baku pembuatan sabun yaitu palm oil, palm stearine, dan palm kernel oil dengan perbandingan yang berbeda-beda sesuai dengan formulasi yang telah ditetapkan untuk sabun yang akan diproduksi.
Setelah reaksi sempurna maka sabun dipompakan ke static separator untuk memisahkan antara sabun dan gliserol. Gliserol yang didapat hasil proses saponifikasi ini yang dijadikan sebagai bahan baku untuk proses pembuatan gliserin yang disebut dengan spent lye dengan kemurnian gliserin 20-30%.
memisahkan sabun, half spent lye, magnesium, dan logam-logam lain yang terkandung di dalamnya. Half spent lye yang dihasilkan diumpankan kembali ke reaktor. Fresh lye (larutan pencuci) yang akan dimasukkan (dicampurkan) ke dalam washing coloumn ini terdiri dari larutan NaOH 48%, larutan NaCl 22%, dan air atau H2O. (PT. Oleochem and Soap Industri, 2010)
Minyak dan lemak mempunyai sifat yang berbeda selama proses pembuatan sabun seperti laju penyabunan, jumlah alkali yang dibutuhkan untuk saponifikasi dan kekuatan elektrolit untuk penggaraman. Keduanya juga mempunyai hasil sabun setengah jadi dan gliserin yang bervariasi.
2. Netralisasi
Setelah sabun telah dipisahkan di washing coloumn selanjutnya dimasukkan ke Centrifuge (Cf). Didalam centrifuge ini sabun ini juga dipisahkan antara lye dan neat soap. Lye yang telah dipisahkan dikembalikan lagi ke washing coloumn sedangkan sabunnya dilanjutkan ke Neutralizer. Didalam neutralizer ini aditif yang dicampur adalah Palm Kernel Oil (PKO) dan EDTA (Ethylene Diamine Tetra Acetate). PKO ditambahkan dengan tujuan untuk memastikan kandungan kadar NaOH dalam neat soap sebesar 0,025% - 0,045%. dan selanjutnya di transfer ke Crutcher. Didalam crutcher ini neat soap masih dicampur aditif yaitu EDTA dan Turpinal, kemudian diaduk agar homogen kemudian dilanjutkan ke Feed Tank. (PT. Oleochem and Soap Industri, 2010)
Reaksi asam basa antara asam dengan alkali untuk menghasilkan sabun berlangsung lebih cepat daripada reaksi trigliserida dengan alkali. Jumlah alkali (NaOH) yang dibutuhkan untuk menetralisasi suatu paduan asam lemak dapat dihitung sebagai berikut :
NaOH = {berat asam lemak x 40) / MW asam lemak Berat molekul rata rata suatu paduan asam lemak dapat dihitung dengan persamaan :
Dimana AV (angka asam asam lemak paduan) = mg KOH yang dibutuhkan untuk menetralisasi 1 gram asam lemak
3. Pengeringan Sabun
Setelah feed tank telah terisi maka neat soap direcycle untuk tahap pengeringan (drying) dan kemudian direcycle dengan cara dipanaskan melalui Heat Exchanger (HE) dengan speed VLS 50% dan dengan speed feed tanknya 42% dengan tekanan 1,5 bar. Disetting secara perlahan-lahan. Setelah semuanya dalam kondisi yang telah disetting maka saatnya diumpankan (feeding) ke atomizer dengan menjaga tekanan dan temperatur agar jangan sampai drop. Sabun yang sudah dikeringkan dan didinginkan tersimpan pada dinding ruang vakum dan dipindahkan dengan alat pengerik sehingga jatuh di plodder, yang mengubah sabun ke bentuk lonjong panjang atau butiran yang kemudian disimpan dalam suatu wadah penyimpanan soap noodle dikenal dengan nama Silo. (PT. Oleochem & Soap Industri, 2010)
Sabun banyak diperoleh setelah penyelesaian saponifikasi (sabun murni) yang umumnya dikeringkan dengan vacum spray dryer. Kandungan air pada sabun dikurangi dari 30-35% pada sabun murni menjadi 8-18% pada sabun butiran atau lempengan. Jenis jenis vacum spray dryer, dari sistem tunggal hingga multi sistem, semuanya dapat digunakan pada berbagai proses pembuatan sabun. Operasi vacum spray dryer sistem tunggal meliputi pemompaan sabun murni melalui pipa heat exchanger dimana sabun dipanaskan dengan uap yang mengalir pada bagian luar pipa. Dryer dengan mulai memperkenalkan proses pengeringan sabun yang lebih luas dan lebih efisien dari pada dryer sistem tunggal.
4. Penyempurnaan Sabun
sabun batangan sesuai dengan ukuran dan bentuk yang diinginkan. Proses pembungkusan, pengemasan, dan penyusunan sabun batangan merupakan tahap akhir. (Pratiwi, 2013)
2.2 Bahan Baku Utama Pembuatan Sabun 2.2.1 Minyak Atau Lemak
Minyak dan lemak yang umum digunakan dalam pembuatan sabun adalah trigliserida dengan tiga buah asam lemak yang tidak beraturan diesterifikasi dengan gliserol. Masing- masing lemak mengandung sejumlah molekul asam lemak dengan rantai karbon panjang antara C12 (asam laurat) hingga C18 (asam stearat) pada lemak jenuh dan begitu juga dengan lemak tak jenuh. Campuran trigliserida diolah menjadi sabun melalui proses saponifikasi dengan larutan natrium hidroksida membebaskan gliserol. Sifat-sifat sabun yang dihasilkan ditentukan oleh jumlah dan komposisi dari komponen asam asam lemak yang digunakan. Komposisi asam asam lemak yang sesuai dalam pembuatan sabun dibatasi panjang rantai dan tingkat kejenuhan. Pada umumnya, panjang rantai yang kurang dari 12 atom karbon dihindari penggunaanya karena dapat membuat iritasi pada kulit, sebaliknya panjang rantai yang lebih dari 18 atom karbon membentuk sabun yang sukar larut dan sulit menimbulkan busa. Terlalu besar bagian asam lemak tak jenuh menghasilkan sabun yang mudah teroksidasi bila terkena udara. Alasan-alasan diatas, faktor ekonomis dan daya jual menyebabkan lemak dan minyak yang dibuat menjadi sabun terbatas.
Asam lemak tak jenuh memiliki ikatan rangkap sehingga titik lelehnya lebih rendah daripada asam lemak jenuh yang tak memiliki ikatan rangkap, sehingga sabun yang dihasilkan juga akan lebih lembek dan mudah meleleh pada temperatur tinggi.
dan menentukan nilai gizinya. Secara alami, asam lemak bisa berbentuk bebas (sebagai lemak yang terhidrolisis) maupun terikat sebagai
Asam lemak tidak lain adalah rumus kimia R-COOH atau R-CO2H. Contoh yang cukup sederhana misalnya adalah
H-COO
Karena berguna dalam mengenal ciri-cirinya, asam lemak dibedakan menjadi asam lemak jenuh dan asam lemak tak jenuh. Asam lemak jenuh hanya memiliki jenuh memiliki paling sedikit satu penyusunnya.
Asam lemak merupaka Umumnya berfase cair atau padat pada suhu ruang (27° Celsius). Semakin panjang rantai C penyusunnya, semakin mudah membeku dan juga semakin sukar larut. Asam lemak jenuh bersifat lebih stabil (tidak mudah bereaksi) daripada asam lemak tak jenuh. Ikatan ganda pada asam lemak tak jenuh mudah bereaksi dengan oksigen (mudah teroksidasi). Karena itu, dikenal istila
Keberadaan ikatan ganda pada asam lemak tak jenuh menjadikannya memiliki dua bentuk: (dilambangkan dengan "Z", singkatan dari bentuk trans (trans fatty acid, dilambangkan dengan "E", singkatan dari bahasa Jerman entgegen) hanya diproduksi oleh sisa metabolisme hewan atau dibuat secara sintetis. Akibat polarisasi atom H, asam lemak cis memiliki rantai yang melengkung. Asam lemak trans karena atom H-nya berseberangan tidak mengalami efek polarisasi yang kuat dan rantainya tetap relatif lurus.
berbagai produk ini.
Karena mudah terhidrolisis dan teroksidasi pada suhu ruang, asam lemak yang dibiarkan terlalu lama akan turun nilai gizinya. Pengawetan dapat dilakukan dengan menyimpannya pada suhu sejuk dan kering, serta menghindarkannya dari kontak langsung dengan udara.
Asam lemak jenuh :
1. Bersifat non essensial 2. Dapat disintesis oleh tubuh 3. Padat pada suhu kamar
4. Diperoleh dari sumber zat hewani contoh mentega 5. Tidak ada ikatan rangkap
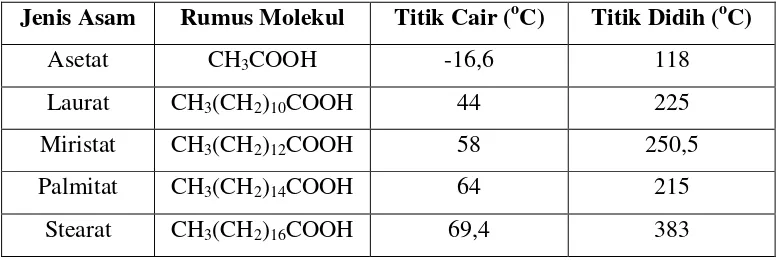
Tabel 2.1 Asam Lemak Jenuh Dalam Minyak Sawit
Jenis Asam Rumus Molekul Titik Cair (oC) Titik Didih (oC)
Asetat CH3COOH -16,6 118
Laurat CH3(CH2)10COOH 44 225
Miristat CH3(CH2)12COOH 58 250,5 Palmitat CH3(CH2)14COOH 64 215
Stearat CH3(CH2)16COOH 69,4 383
Asam lemak tidak jenuh :
1. Bersifat essensial
2. Tidak dapat diproduksi tubuh 3. Cair pada suhu kamar
Tabel 2.2 Asam Lemak Tidak Jenuh Dalam Minyak Sawit Jenis
Asam Rumus Molekul
Titik Cair (oC)
Titik Didih
(oC) Oleat CH3(CH2)7CH=CH(CH2)7COOH 14 360 Linoleat CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH 5 230 Linolenat CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH 11 231
2.2.2 Alkali
Jenis alkali yang umum digunakan dalam proses saponifikasi adalah NaOH, KOH, Na2CO3, NH4OH, dan ethanolamines. NaOH, atau yang biasa dikenal dengan soda kaustik dalam industri sabun, merupakan alkali yang paling banyak digunakan dalam pembuatan sabun keras. KOH banyak digunakan dalam pembuatan sabun cair karena sifatnya yang mudah larut dalam air. Na2CO3 (abu soda/natrium karbonat) merupakan alkali yang murah dan dapat menyabunkan asam lemak, tetapi tidak dapat menyabunkan trigliserida (minyak atau lemak).
Ethanolamines merupakan golongan senyawa amin alkohol. Senyawa tersebut dapat digunakan untuk membuat sabun dari asam lemak. Sabun yang dihasilkan sangat mudah larut dalam air, mudah berbusa, dan mampu menurunkan kesadahan air.
2.3 Bahan-Bahan Pendukung Pembuatan Sabun
Bahan baku pendukung digunakan untuk membantu proses penyempurnaan sabun hasil saponifikasi (pengendapan sabun dan pengambilan gliserin) sampai sabun menjadi produk yang siap dipasarkan. Bahan-bahan tersebut adalah NaCl (garam) dan bahan-bahan aditif.
2.3.1 Garam (NaCl)
NaCl merupakan komponen kunci dalam proses pembuatan sabun. Kandungan NaCl pada produk akhir sangat kecil karena kandungan NaCl yang terlalu tinggi di dalam sabun dapat memperkeras struktur sabun. NaCl yang digunakan umumnya berbentuk air garam (brine) atau padatan (kristal). NaCl digunakan untuk memisahkan produk sabun dan gliserin. Gliserin tidak mengalami pengendapan dalam brine karena kelarutannya yang tinggi, sedangkan sabun akan mengendap. NaCl harus bebas dari besi, kalsium, dan magnesium agar diperoleh sabun yang berkualitas.
2.3.2 Bahan Aditif
Bahan aditif merupakan bahan-bahan yang ditambahkan ke dalam sabun yang bertujuan untuk mempertinggi kualitas produk sabun sehingga menarik konsumen. Bahan-bahan aditif tersebut antara lain : builders, fillers inert, anti oksidan, pewarna, dan parfum.
a. Builders (Bahan Penguat)
adalah senyawa - senyawa kompleks fosfat, natrium sitrat, natrium karbonat, natrium silikat atau zeolit.
b. Fillers (Bahan Pengisi)
Bahan ini berfungsi sebagai pengisi dari seluruh campuran bahan baku. Pemberian bahan ini berguna untuk memperbanyak atau memperbesar volume. Keberadaan bahan ini dalam campuran bahan baku sabun semata mata ditinjau dari aspek ekonomis. Pada umumnya, sebagai bahan pengisi sabun digunakan sodium sulfat. Bahan lain yang sering digunakan sebagai bahan pengisi, yaitu tetra sodium pyrophosphate dan sodium sitrat. Bahan pengisi ini berwarna putih, berbentuk bubuk, dan mudah larut dalam air.
c. Coloring Agent ( Zat Pewarna)
Bahan ini berfungsi untuk memberikan warna kepada sabun. Ini ditujukan agar memberikan efek yang menarik bagi konsumen untuk mencoba sabun ataupun membeli sabun dengan warna yang menarik. Biasanya warna warna sabun itu terdiri dari warna merah, putih, hijau maupun orange.
d. Fragrance (Bahan Pewangi)
Parfum termasuk bahan pendukung. Keberadaaan parfum memegang peranan besar dalam hal keterkaitan konsumen akan produk sabun. Artinya, walaupun secara kualitas sabun yang ditawarkan bagus, tetapi bila salah memberi parfum akan berakibat fatal dalam penjualannya. Parfum untuk sabun berbentuk cairan berwarna kekuning kuningan dengan berat jenis 0,9. Dalam perhitungan, berat parfum dalam gram (g) dapat dikonversikan ke mililiter. Sebagai patokan 1 g parfum = 1,1ml. Pada dasarnya, jenis parfum untuk sabun dapat dibagi ke dalam dua jenis, yaitu parfum umum dan parfum ekslusif.
menggunakan jenis parfum yang ekslusif. Artinya, aroma dari parfum tersebut sangat khas dan tidak ada produsen lain yang menggunakannya. Kekhasan parfum ekslusif ini diimbangi dengan harganya yang lebih mahal dari jenis parfum umum. Beberapa nama parfum yang digunakan dalam pembuatan sabun diantaranya bouquct deep water, alpine, dan spring flower. (Fitri, 2013)
e. Antioksidan
EDTA (ethylene diamine tetra acetate) ditambahkan dalam sabun untuk membentuk kompleks (pengkelat) ion besi yang mengkatalis proses degradasi oksidatif. Degradasi oksidatif akan memutuskan ikatan rangkap pada asam lemak membentuk rantai lebih pendek, aldehid dan keton yang berbau tidak enak. EDTA adalah reagen yang bagus, selain membentuk kelat dengan semua kation, kelat ini juga cukup stabil untuk metode titriametil. (Supena, 2007)
Bahan antioksidan pada sabun juga dapat menstabilkan sabun terutama pada bau tengik atau rancid. Natrium silikat, natrium hiposulfid, dan natrium tiosulfat diketahui dapat digunakan sebagai antioksidan. Stanous klorida juga merupakan antioksidan yang sangat kuat dan juga dapat memutihkan sabun atau sebagai bleaching agent. (Farid Kurnia, 2009)
2.4 Kadar Air
Keberadaan air dalam suatu produk sangat menentukan mutu produk tersebut tak terkecuali sabun padat. Splitz (1996) berpendapat kuantitas air yang terlalu banyak dalam sabun akan membuat sabun tersebut mudah menyusut dan tidak nyaman saat akan digunakan. Keberadaan air dan udara dapat memicu terjadinya oksidasi.
asam-asam lemak bebas. Senyawa aldehid dan keton yang dihasilkan dari lanjutan reaksi oksidasi ini memiliki sifat mudah menguap seperti alkohol .
2.5 Kadar Alkali Bebas (Dihitung Sebagai NaOH)
Sabun dihasilkan melalui reaksi safonifikasi antara asam lemak dalam minyak/ lemak dengan alkali/ basa. Sabun yang baik adalah sabun yang dihasilkan dari reaksi yang sempurna antara asam lemak dan alkali dan diharapkan tidak terdapat residu/ sisa setelah reaksi . Namun tidak selamanya reaksi yang diharapkan dapat berlangsung sempurna. Untuk itu diperlukan pengujian kadar alkali setelah beraksi karena dalam pembuatan sabun padat ini digunakan alkali berupa NaOH maka kadar alkali bebas dihitung sebagai NaOH.
Di dalam buku SNI (1994) dijelaskan bahwa alkali bebas ialah alkali dalam sabun yang tidak terikat sebagai senyawa. Kelebihan alkali dalam sabun mandi tidak boleh melebihi 0,1%. Kelebihan alkali pada sabun mandi dapat disebabkan jumlah alkali yang melebihi jumlah alkali yang digunakan untuk melakukan saponifikasi keseluruhan minyak menjadi sabun. Keberadaan alkali bebas yang berlebihan dapat membahayakan kulit.
2.6 Kadar Asam Lemak Bebas
2.7 Bilangan Peroksida
Bilangan peroksida merupakan jumlah miliekivalen peroksida per 1000 gram sampel, yang dioksidasi kalium iodida.
Minyak atau lemak bersifat tidak larut dalam semua pelarut berair, tetapi larut dalam pelarut organik seperti misalnya : petroleum eter, dietil eter, alkohol panas, khloroform dan benzena. Dimana asam lemak rantai pendek sampai panjang rantai atom karbon sebanyak delapan bersifat larut dalam air. Makin panjang rantai sehingga akan terbentuk gugus karboksil yang tidak bermuatan. Kemudian dilakukan ekstraksi menggunakan pelarut non-polar seperti petroleum. Asam lemak jenuh sangat stabil terhadap oksidasi, akan tetapi asam lemak tidak jenuh sangat mudah terserang oksidasi. Dimana lemak tidak dapat meleleh pada satu titik suhu, akan tetapi lemak akan menjadi lunak pada suatu interval suhu tertentu. Hal ini disebabkan karena pada umumnya lemak merupakan campuran gliserida dan masing-masing gliserida mempunyai titik cair sendiri-sendiri (Tranggono & Setiaji, 1989).
Reaksi oksidasi bergantung pada banyak frekuensi reaksi dari lemak dalam bahan makanan. Ini biasanya terdiri oleh atmosfer oksigen, frekuensi yang sedikit oleh ozon, peroksida, logam dan agen oksidasi yang lain. Dalam penambahan untuk oksigen dan ozon, lemak dapat dirusak oleh pembentukan reaksi lain, seperti anion superoksida (O2) dan radikal (O2), radikal perhidrosilik (HO2), hidrogen peroksida dan hidrosil radikal (HO). Asam peroksida diproduksi oleh autoxidasi dari aldehid, dan mungkin reaksi dengan molekul lain dari produk aldehid asam karboksilat.
Bilangan peroksida adalah nilai terpenting untuk menentukan derajat kerusakan pada lemak dan minyak. Asam lemak tidak jenuh dapat mengikat oksigen pada ikatan rangkapnya sehingga membentuk peroksida. Peroksida dapat ditentukan dengan metode iodometri. Cara yang sering digunakan untuk menentukan bilangan peroksida, berdasarkan pada reaksi antara alkali iodida dalam larutan asam dengan ikatan peroksida. Iod yang dibebaskan pada reaksi ini kemudian dititrasi dengan natrium tiosulfat. Penentuan peroksida ini kurang baik dengan cara iodometri biasa meskipun bereaksi sempurna dengan alkali iod. Hal ini disebabkan karena peroksida jenis lainnya hanya bereaksi sebagian. Di samping itu dapat terjadi kesalahan yang disebabkan oleh reaksi antara alkali iodida dengan oksigen dari udara (Ketaren, 1986).
Menurut Buckle et al. (1997) ada dua tipe kerusakan yang utama pada minyak dan lemak, yaitu :
a. Ketengikan terjadi bila komponen cita-rasa dan bau yang mudah menguap terbentuk sebagai akibat kerusakan oksidatif dari lemak dan minyak tak jenuh. Komponen-komponen ini menyebabkan bau dan cita-rasa yang tak diinginkan dalam lemak dan minyak produk-produk yang mengandung lemak dan minyak itu.
b. Hidrolisa minyak dan lemak menghasilkan asam-asam lemak bebas yang dapat mempengaruhi cita-rasa dan bau daripada bahan itu. Hidrolisa dapat disebabkan oleh adanya air dalam lemak atau minyak atau karena kegiatan enzim.
Menurut Soedarmo et al (1988), kerusakan karena proses hidrolisa terutama banyak terjadi pada minyak atau lemak yang mengandung asam lemak jenuh dalam jumlah cukup banyak seperti pada minyak kelapa yang mengandung asam laurat, sedangkan bau yang tengik ditimbulkan oleh asam lemak bebas yang terbentuk selama proses hidrolisa. Proses hidrolisa pada minyak atau lemak umumnya disebabkan oleh aktifitas enzim dan mikroba. Proses hidrolisa dapat dipercepat dengan kondisi kelembaban yang tinggi, kadar air tinggi serta temperatur tinggi. Proses hidrolisa pada minyak dan lemak akan menghasilkan ketengikan hidrolitik, dimana terjadi pembebasan asam-asam lemak yang mempengaruhi rasa dari minyak tersebut. Enzim yang dapat menimbulkan ketengikan hidrolitik adalah enzim lipase. Ketengikan pada minyak dan lemak nabati terjadi karena berkurangnya kandungan vitamin E (tocopherol) yang dapat berfungsi sebagai anti oksidan.
proses ini akan dipercepat dengan adanya logam-logam yang bersifat katalisator seperti Zn, Cu. (Soedarno & Girindra, 1988)
2.7.1 Titrasi Iodometri
Pada titrasi iodometri, analit yang dipakai adalah oksidator yang dapat bereaksi dengan I- (iodide) untuk menghasilkan I2. I2 yang terbentuk secara kuantitatif dapat dititrasi dengan larutan tiosulfat. Dari pengertian diatas maka titrasi iodometri adalah dapat dikategorikan sebagai titrasi kembali.
Iodida adalah reduktor lemah dan dengan mudah akan teroksidasi jika direaksikan dengan oksidator kuat. Iodida tidak dipakai sebagai titrant hal ini disebabkan karena faktor kecepatan reaksi dan kurangnya jenis indikator yang dapat dipakai untuk iodide. Oleh sebab itu titrasi kembali merupakan proses titrasi yang sangat baik untuk titrasi yang melibatkan iodida.
tepat hilang. Reaksi yang terjadi pada titrasi iodometri untuk penentuan iodat adalah sebagai berikut :
IO3- + 5 I- + 6H+ → 3I2 + H2O I2 + 2S2O32-→ 2I- + S4O62-
Setiap mmol IO3- akan menghasilkan 3 mmol I2 dan 3 mmol I2 ini akan tepat bereaksi dengan 6 mmol S2O32- (1 mmol I2 tepat bereaksi dengan 2 mmol S2O3 2-sehingga mmol IO3- ditentukan atau setara dngan 1/6 mmol S2O32- Kita menitrasi langsung antara tiosulfat dengan analit, alasannya adalah karena analit yang bersifat sebagai oksidator dapat mengoksidasi tiosulfat menjadi senyawaan yang bilangan oksidasinya lebih tinggi dari tetrationat dan umumnya reaksi ini tidak stoikiometri. Alasan kedua adalah tiosulfat dapat membentuk ion kompleks dengan beberapa ion logam seperti Besi(II).
Beberapa hal yang perlu diperhatikan dalam melakukan titrasi Iodometri adalah sebagai berikut: Penambahan amilum sebaiknya dilakukan saat menjelang akhir titrasi, dimana hal ini ditandai dengan warna larutan menjadi kuning muda (dari oranye sampai coklat akibat terdapatnya I2 dalam jumlah banyak), alasannya kompleks amilum- I2 terdisosiasi sangat lambat akibatnya maka banyak I2 yang akan terabsorbsi oleh amilum jika amilum ditambahkan pada awal titrasi, alasan kedua adalah biasanya iodometri dilakukan pada media asam kuat sehingga akan menghindari terjadinya hidrolisis amilum. Titrasi harus dilakukan dengan cepat untuk meminimalisasi terjadinya oksidasi iodida oleh udara bebas. Pengocokan pada saat melakukan titrasi iodometri sangat diwajibkan untuk menghindari penumpukan tiosulfat pada area tertentu, penumpukkan konsentrasi tiosulfat dapat menyebabkan terjadinya dekomposisi tiosulfat untuk menghasilkan belerang. Terbentuknya reaksi ini dapat diamati dengan adanya belerang dan larutan menjadi bersifat koloid (tampak keruh oleh kehadiran S).
Pastikan jumlah iodida yang ditambahkan adalah berlebih sehingga semua analit tereduksi dengan demikian titrasi akan menjadi akurat. Kelebihan iodida tidak akan mengganggu jalannya titrasi redoks akan tetapi jika titrasi tidak dilakukan dengan segera maka I- dapat teroksidasi oleh udara menjadi I2.
2.7.2 Natrium Tiosulfat
Larutan Natrium tiosulfat tidak stabil dalam waktu lama. Bakteri yang memakai belerang akhirnya masuk ke larutan itu, dan proses metaboliknya akan mengakibatkan pembentukan SO32-, SO42- dan belerang koloidal. Belerang ini akan menyebabkan kekeruhan, bila timbul kekeruhan larutan harus dibuang. Biasanya air yang digunakan untuk menyiapkan larutan tiosulfat dididihkan agar steril, dan sering ditambahkan boraks atau natrium karbonat sebagai pengawet. Oksidasi tiosulfat oleh udara berlangsung lambat. Tetapi runutan tembaga sering kadang-kadang terdapat dalam air suling akan mengkatalisis oksidasi oleh udara. Tiosulfat diuraikan dalam larutan asam dengan membentuk belerang sebagai endapan mirip susu. (A.L. Underwood, 1986).
Larutan standard yang digunakan dalam kebanyakan proses iodometri adalah natrium tiosulfat. Lazimnya garam ini dibeli sebagai pentahidrat, Na2S2O3.5H2O. Larutan tak boleh distandarisasikan berdasarkan penimbangan langsung, melainkan harus distandarisasikan terhadap standard primer.
S2O32- + 2H+→ H2S2O3 → H2S2O3 + S(s)
Tetapi reaksi lambat dan tak terjadi bila tiosulfat dititrasikan ke dalam larutan iod yang asam, jika larutan diaduk dengan baik. Reaksi antara iod dan tiosulfat jauh lebih cepat daripada reaksi penguraian.
Dalam larutan netral atau sedikit sekali basa, oksidasi menjadi sulfat itu tidak terjadi, jika digunakan iod sebagai titran. Banyak zat pengoksid kuat, seperti pereaksi dichromat, permanganat dan garam serium (IV), mengoksidasi tiosulfat menjadi sulfat, namun reaksinya tidak kuantitatif. (A.L. Underwood, 1986)
2.7.3 Kanji (Starch)
Larutan kanji mudah terurai oleh bakteri, suatu proses yang dapat dihambat dengan jalan sterilisasi atau dengan penambahan suatu zat pengawet. Hasil peruraiannya memakai iodium dan berubah menjadi kemerah-merahan. Merkurium (II) iodida, asam borat atau asam furoat dapat digunakan sebagai pengawet. Kondisi yang menimbulkan hidrolisis atau koagulasi kanji hendaklah dihindari. Kepekaan indikator berkurang dengan naiknya temperatur dan oleh beberapa zat organik, seperti metil dan etil alkohol.
Warna larutan iod 0,1 N cukup kuat sehingga iodium dapat bertindak sebagai indikator sendiri. Iodium juga memberikan warna ungu atau merah lembayung yang kuat kepada pelarut-pelarut seperti karbon tetraklorida atau kloroform, dan kadang-kadang hal ini digunakan untuk mengetahui titik akhir reaksi. Akan tetapi lebih umum digunakan suatu larutan (dispersi koloid) kanji, dari warna biru tua kompleks pati-iodium berperan sebagai uji kepekaan terhadap pati-iodium.
2.8 Uji Organoleptik
Menurut Soekarto (1981), penilaian dengan indera disebut penilaian organoleptik atau penilaian sensorik merupakan suatu cara penilaian yang paling primitif. Penilaian dengan indera banyak digunakan untuk meneliti mutu komoditi hasil pertanian dan makanan. Penilaian cara ini banyak disenangi karena dapat dilaksanakan dengan cepat dan langsung. Kadang – kadang penilaian ini dapat memberikan hasil penelitian yang teliti. Dalam beberapa hal penilaian dengan indera bahkan melebihi ketelitian alat yang paling sensitif.
Sistem penelitian organoleptik telah dapat dibakukan dan dijadikan alat penilai dalam laboratorium, dunia usaha dan perdagangan. Laboratorium penilaian organoleptik pun telah menjadi umum di industri maupun di lembaga-lembaga penelitian. Penelitian organoleptik telah pula digunakan sebagai metode dalam penelitian dan pengembangan. Untuk melaksanakan suatu penilaian organoleptik diperlukan panel. Panel adalah satu atau sekelompok orang yang bertugas untuk menilai sifat atau mutu benda berdasarkan kesan subjektif. Orang yang menjadi anggota panel disebut panelis. Ada 6 macam panel yang biasa digunakan dalam penilaian organoleptik yaitu :
1. Pencicip perorangan (individual expert)
Pencicip perorangan disebut juga pencicip tradisional. Pencicip demikian telah lama digunakan dalam industri-industri makanan seperti pencicip teh, kopi, es krim atau penguji bau pada industri minyak wangi (parfum).
2. Panel pencicip terbatas
3. Panel terlatih
Anggota panel terlatih yaitu antara 15 – 25 orang. Tingkat kepekaan yang diharapkan tidak perlu setinggi panel pencicip terbatas. Untuk menjadi anggota panel ini perlu diseleksi dan yang terpilih kemudian dilatih. Panel terlatih ini juga berfungsi sebagai alat analisa, dan pengujian-pengujian yang dilakukan biasanya terbatas pada kemampuan membedakan.
4. Panel tak terlatih
Jika panel terlatih biasanya untuk menguji pembedaan (different test), maka panel tak terlatih umumnya untuk menguji kesukaan (preference test). Pemilihan anggota dilakukan bukan terhadap kepekaan calon anggota tetapi pemilihan itu lebih mengutamakan segi sosial seperti latar belakang pendidikan, asal daerah ekonomi, dalam masyarakat dan sebagainya.
5. Panel konsumen
Panel ini biasanya mempunyai anggota yang besar jumlahnya dari 30 sampai 1000 orang. Pengujiannya biasanya mengenai uji kesukaan (preference test) dan dilakukan sebelum pengujian pasar. Hasil uji kesukaan dapat digunakan untuk menentukan apakah suatu jenis komoditi dapat diterima oleh masyarakat.
6. Panel agak terlatih