IDA ERNANI
P EN GA RUH KEASAMAN L A R U T A N P E N Y A N G G A
ASAM ASETAT D A N IO N SEJENIS KALSIUM
SERTA FOSFAT T E R H A D A P K E L A R U TA N
F LU O R A P A TIT
FA K U L T A S FA R M A S I U N I V E R S I T A S A I R L A N G G A
PSKGARUH KSAoAIiAH LARUTAN PrJlfiAI'JGGA ASAM ASETAT DAI'T ION UiiJ^HIS KALSIUM SERTA FOSFAT
JJ2RHA35AP KELARUTAN FLUORAPATIT
S l c r i p s i
Dibuet untuk memenuhi tugas akhir mencapai gelar sarjana farmasi
peda Fakultas Farmasi Universitas Airlangga
1988 f f I J i / a &
€ f . / )
oleh
IDA ERIUNI
058110426
R V I L I C
* !MVHKM
—
KATA PESGANTAR
Dengan memanjatkan puji syukur kehadirat Allah - Yang Maha Pengasih dan Penyayang atas kekuatan dan
kesabaran yang diberikan, sehingga aaya dapat menyelesai-
kan tugas skripsi ini yang merupakan ayarat untuk menca
pai gelar Sarjana Farmasi pada Fakultas Farmasi Univer
sitas Airlangga.
Dalam pelaksanaan penelitian dan penyusunan skripsi
ini banyak kesulitan-kesulitan yang harus diatasi, berkat
bantuan dari berbagai pihak khususnya dosen-dosen pembim-
bing maka akhirnya skripsi ini dapat saya selesaikan.
Kepada Eapak Dr. Muhammad Zainuddin, Kepala labora-
torium Analisis Farmasi Fakultas Farmasi Universitas Air
langga dan Ibu Dra. Yuniar Suryono, dosen Laboratorium
Analisis Farmasi Fakultas Farmasi Universitas Airlangga
beserta Ibu Drg. Tri Budi W. Rahardjo, dosen Fakultas
kedokteran gigi Universitas Indonesia, saya sampaikan rasa
terima kasih yang sedalam-dalamnya atas bimbingan, petun-
juk, saran-saran dan fasilitas yang telah diberikan dalam
penyelesaian skripsi ini.
Rasa terima kasih yang tulus saya sampaikan pula
kepada staf dosen beserta seluruh karyawan Laboratorium
Analisis Farnasi yang telah memberikan fasilitas dan ban
tuan untuk penelitian-ini.
Kepada Ayah, Ibu (aim) dan kakak-kakak saya tercinta
saya ucapkan terima kasih atas segala bantuan moril dan
materiil, hingga skripsi ini dapat saya selesaikan.
Tidak lupa pula saya sampaikan rasa terima kasih
yang tidak terhingga kepada Ir. Tonny W. Paramita, suami
saya tercinta atas segala bantuannya.
Akhirnya kepada panitia skripsi yang telah berkenan
raemeriksa skripsi ini, saya sampaikan pula rasa terima
kasih yang dalam semoga Allah SWT memberikan balasan yang
setimpal atas kebaikan yang telah diberikan.
Harapan saya mudah- mudahan hasil skripsi ini ber-
manfaat bagi kita semua, amien
DAFTAR ISI
KATA PENGANTAR... ... . ii
DAFTAR 131 ... .... iV BAB. I. PENDAHULUAN ... .... 1
IX. TINJAUAN PUSTAKA ... .... 5
1. Fluorapatit ... .... 5
2. Mekanisme melarut ... .... 9
2.1. Difusion layer model ... 9
2.2. Interfacial barier model ... 10
2.3. Dankwerts model ... .... 10
3. Kelarutan, hasil kali kelarutan dan fak 11 tor-faktor yang mempengaruhi kelarutan. 3.1. K e l a r u t a n ... .... 11
3.2. Hasil kali kelarutan... 12
3.3. Faktor-faktor yang mempengaruhi ke la rut an • 13 - Pengaruh derajad keasaman terha- hadap k e l a r u t a n ... . 13
- Pengaruh ion sejenis terhadap k<e l a r u t a n ... ... 14
4. Spektrofotometri infra merah ... 15
5. opektrofotometri sinar tampak ... .... 17
-.Prinsip penetapan kadar fosfat secara Spektrofotometri sinar tampak . . . . 18
halaman
6. Spektrofotometri serapan a t o m ...18
- Prinsip penetapan kadar kalsium secare spek trofotometri’serapan atom ...2\
III, KETODE PEKELimi'J ... 1, Alat - slat ... 22
2, Bahan ... ..22
3. Penyediaan bahan-bahan. percobaan...24
3.1* Larutan kalsium asetat 0,1 M ...24
3.2. Larutan yang berisi ammonium dihidrogen -fosfat 0 , 0 6 1,1 dan natrium fluorida 0,0 2 5M 2 4 3.3* Larutan ammonium asetat 1,3 M ... 24
3.4. Larutan stamio khlorida ...24
3.5. Larutan ammonium molibdat ...25
3.6. Larutan lanthanum oksida 20 % ... ..25
3.7. Larutan penyangga asam asetat-natrium ase tat dengan pH 3,5 ; pH 4,0 ; pH 4 , 5 ; pH 5,0 ; pH 5 , 5 ... 25
3.8. Larutan penyangga asam asetat berbagai pH yang mengandung ion sejenis fosfat . . . 2 6 3.9. Larutan penyafcgga asara^ fcsetat berbagai pH yang mengandung ion‘ sejenia kalsiura . . . 2 6 3.10. Larutan baku kalsium ...27
3.11. Larutan baku fosfat ... 27
3.12. Pembakuan fluorapatit ...28
4. Pelaksanaan percobaan ...30
4.1.1. Vembuaton spektra infra merah fluorapatit
dengan rnetode onektrofotometri infra me -
rah... 30
4.1.2. Analisis kualitatif ion kalsium ... 31
4.1.3. Analisis kualitatif ion fosfat ... 32
4.1.4. Analisis kualitatif ion fluor ... 33
4.2. Analisis kuantitatif fluorapatit ... 33
4.2.1. Analisis kuantitatif kadar kalsium dalam fluorapatit dengan metode spektrofotome - ; tri serapan a t o m ... 33
- Pembuatan kurva baku kalsium ... 33
- Penetapan kadar kalsium dalam fluorapa tit ... ... 34
4.2.2. Analisis kuantitatif kadar fosfat dalam fluorapatit dengan metode spektrofotome - trt sinar tampak... 34
- Penentuan panjang gelombang maksimum, . 34 - Pembuatan kurva baku fosfat * * . . . . 35
Penetapan kadar fosfat dalam fluorapa -tit ... 3 5 4.3. Uji kelarutan fluorapatit ... 36
4.3.3. Uji kelarutan fluorapatit dalam larutan
penyangga aaam asetat "berbagai pH de
ngan penambahan ion sejenis kalsium ber
bagsi konsentrasi... 3 8
4.4. Penetapan kadar kalsium yang larut dari
fluorapatit dengan metode spektrotometri
serapan atom ... 3 9
4.5. Penetapan kadar fosfat yang larut dari -
fluorapatit dengan metode spektrofotome
-tri sinar t a m p a k ..., . 3 9
IV. HASIL PiSBiiLITIAH
1. Analisis kualitatif fluorapatit ... 4 1
1.1. Spektra serapan sinar infra merah fluor
apatit dengan metode spektrofotometri -
infra m e r a h ... 4 1
1.2. Analisis kualitatif ion kalsium . . . . 43
1.3. Analisis kualitatif ion fosfat . . . . 45
1.4- Analisis kualitatif ion fluor . . . . 4 6
2. Analisis kuantitatif fluorapatit; 4 6
2,1# Analisis kuantitatif'kalsium'dalam fluor
apatit dengan.metode spektrofotometri S£
rapan atom' . . . > . ... 46
- Persama am kurv a balru kalsiu m . . ; . ;
46
- Penetapan kadar kalsium dalam fluora -
2.2. Analisis kuantitatif fosfat dalam fluorapa
tit dengan metode spekbrofotometri sinar -
t a m p a k ... ' 4 9
- Penentuan panjang gelombang maksimum . , 49
- Persamaan kurva baku fosfat ... 50
- Penetapan kadar fosfat dalam fluorapatit 51
3. Penetapan kadar kalsium yang larut dari fluor
-apatit dengan metode spektrofotometri serapan -
atom ... 52
3.1. Penetapan kadar kalsiuin yang larut dalam -
larutan penyangga asam asetat berbagai pH. 52
3.2. Penetapan kadar kalsium yang larut dalam la
rutan penyangga asam asetat berbagai pH det*-
ngen ion sejenis fosfat berbagai konseatrasi 56
4. Penetapan kadar fosfat yang larut dari fluorapa
tit dengsn metode spektrofotometri sinar tampak 6 4
4.1. Penetapan kadar fosfat yang larut dalam la
rutan penyangga asam asetat berbagai pH. . 6 4
4.2. Penetapan kadar fosfat yang larut dalam la
rutan penyangga asam asetat berbagai pH de t ngan penambahan ion sejenis kalsium berba-
bagi konsentrasi ... 6 8
V. PEMBAHASAN... ... 7 6
VI. KESIMPULAH DAN SARAH ... 7 9
. RINGKASAN . . . ... 80
LAMPIRAN ... 82
DAl'TAR TABBL
I, Susunan senyawa anorganik email dan dentin
dengan prosen berat lebih dari 0 , 0 1 . . . . 5
II. Komposisi endapan apatit (9)... . . . 7
III*. Serapan dari berbagai konsentrasi kalsium
dengan metode spektrofotometri serapan atom 4 7
IV. Hasil penetapan kadar kalsium dalam fluor -
apatit dengan metode spektrofotometri sera£
an atom . , ... 4 8
V, Serapan dari berbagai konsentrasi fosfat d£
ngan metode spektrofotometri sinar tampak . 50
VI. Hasil penetapan kad8r fosfat dalam fluor
apatit dengan metode spektrofotometri sinar
t a m p a k ... 51
VII. Kada!r kalsium yang larut dalam larutan pe
-nyangga asam asetat berbagai pH ... 54
VIII, Luas daerah dibawah kurva (ug hari/mg) dari
kalsium yang larut dalam larutan penyangga
asam aset8t berbagai pll dalam 14 hari . . . 56
IX. Kadar kalsium yang larut dalam larutan pe -
ayengga asam asetat berbagai pH deng8n pe -
nambahan ion sejenis fosfat 12 mg % . . . . 5 7
X, Kadar kalsium yang larut dalam larutan pe
-nynn/ys« ion sejenis fosfat 14,5 mg % . . . 58
XI, Kadar kalsium yang larut dalam larutan pengang-
ga asam asetat berbagai pH dengan penambahan
ion sejeni3 fosfat 17 mg ^ ...
. XII, Lues daerah dibawah kurva (ug hari/mg) dari kal
si urn yang larut dalam larutan penyangga asam -
asetat berbagai pH dengan penambahan ion aeje -
nis fosfnt berbagni konsetvtrasi dalam waktu 14.
h a r i ... ...
' XIII. Kadar fosfat yang larut dalam larutan penyangga
asam asetat berbagai pH ...
XIV, Lua3 daerah ditambah kurva dari fosfat yang la
rut' dalam larutan penyangga asam asetat berba
-gai pH dalam waktu 14 hari...
XV. Kadar fosfat yang larut dalam larutan penyan&ga
asam asetat berbagai pll dengan penambahan ion
sejenis kalsiuin 4 mg % ...
XVI. Kadar fosfat yang larut dalam larutan penyangga
asam aaetat berbagai pH dengan penambahan ion
sejeni3 kr. .sium 8 mg % ...
XVII. Kadar fosfat yang larut dalam larutan penyangga
asam asetat berbagai pH dengan penambahan ion
sejenis kalsium 12 mg % ... . . . , .
XVIII, Luas daerah dibawa kurva dari fosfat yang larut
dalam larutan penyangga asam asetat berbagai pH
dengan penambahan ion sejenis kalsium berbagai
DAFTAR GAMBAR
1. Spektra serapan infra merah. dari fluorapatit (9) 7
2. Mekonisme melarut dalam cera "Diffession layer" 9
3. Mekanisme melarut dengan cara "Inter facial her
l e t " ... 10
4. Mekanisme melarut dengan cara "Dankwerts model" 11
5. Alat yang digunakan pembuatan fluorapatit . . . 28
6. Spektra serapan fluorapatit pada spektrofotome
tri infra merah Perkin Elmer dengan Pellet KBr 42
7. Kristal kalsium sulfat . . . 43
8. Kristal kalaium oksalat ... 44
9. Kristal magnesium ammonium fosfat ... 45
10. Kurve serapan larutan fosfat kadar 3,0 ppm dan
5,0 ppm terhadap penjang gelombang (run) . . . . 49
11. Kurva kadar kalsium yang larut rata - rata da -
lam larutan penyangga asam asetat pH 3,4;pH 4 , 0
pH 4,5 ; pH 5,0 dan pH 5,5 terhadap waktu . . . 55
12. Kurva kadar kalsium yang larut rata-rata dalam
larutan penyangga asam asetat pH 3t5 ; pH 4,0 ;
pH 4,5 ; pH 5,0 dan pH 5 , 5 terhadap waktu de
ngan penambahan ion sejenis fosfat konsentrasi
12 mg cr ... 6 0
13; Kurva kadar kalsium yang larut rata - rata dalam larutan penyangga asam asetat pH 3,5 ; pH 4,0 ;
pH 4>5 *, pH 5>0 dan pH 5>5 terhadap waktu dengan
penambahan ion sejenis fosfat konsentrasi 1 4,5ing$ 61
14* Kurva kadar kalsium yang larut rata - rata dalam
larutan penyangga asam asetat pH 3,5 pH 4,0 *,
pH 4*5 \ pH 5,0 dan pH 5,5 terhadap waktu dengan
penambahan ion sejenis fosfat konsentrasi 17 mg# 6 2
15. Kurva kadar rata - rata fosfat yang larut dalam
larutan penyangga asam asetat pH 3,5 ', pH 4,0 \
pH '5 i pH 5,0 dan pH 5,5 . ^... 67
16. Kurva k-adar rata - rata fosfat yang larut dalam
larutan penyangga asam asetat pH 3,5 ’, pH 4,0 \
pH 4,5 i pH 5|0 ; pH 5»5 dengan penambahan ion
sejenis kalsium if mg % ... -72
17. Kurva kadar rata - rata fosfat yang larut dalam
larutan penyangga asam asetat pH 3,5 ; pH 4,0 *,
pH 4,5 \ pH 5*0 *, pH 5,5 dengan penambahan ion -
sejenis kalsium Q mg % ... 73
18. Kurva kadar rata - rata fosfat yang larut dalam
larutan penyangga asam asetat pH 3,5 *, pH 4,0 *,
pH 4,5 , pH 5,0 *, pH 5,5 dengan penambahan ion i
sejenis kalsium 12 mg % ... 7 4
BAB I
PENDAHULUAN
1. Permaaalahan penelitian
Hidroksiapatit adalah garam rangkap yang terdiri
dari ion kalsium dan fosfat serta gugus hidroksida-
Di dalam tubuh manusia dan hewan, hidroksiapatit meru-
pakan senyawa anorganik penyusun jaringan keras gigi,
yaitu enamel dan dentin (1 ).
Sebagai komponen utama senyawa anorganik pada
jaringan keras gigi, hidroksiapatit ternyata tidak cu-
kup kuat sehingga dapat rusak oleh karena faktor-fak-
tor dari. dalam rongga raulut, misalnya asam laktat ha
sil metabolisme sisa makanan oleh mlkroorganisme dan
faktor-faktor dari luar rongga mulut, misalnya keasam-
an dari makanan-minuman (2).
Usaha untuk memperkuat hidroksiapatit terhadap
faktor-faktor penyebab kerusakan gigi tersebut diatas
■ dilakukan dengan mengganti sebagian ion hidroksi de
ngan ion fluor sehingga terbentuk senyawa fluorapatit
(3,4).
Telah dilaporkan bahwa jaringan keras gigi da
pat mengalami erosi yaitu kerusakan (lesi) gigi tanpa
adanya aktifitas bakteri misalnya keasaman dari sari
Erosi gigi pads dasarnya adalah proses kelarutan
enamel gigi ke dalam media yang mengelilinginya, yaitu
saliva yang mengandung berbagai zat yang dapat menyebab-
kan proses pelarutan tersebut,
Sebagaimana diketehui bahwa kelarutan suatu senya
wa garam pada umumnya semakin meningkat dengan peningkat
nya derajad keasaman (6), Berdasarkan teori ini maka tira
bul pertanyaan, apakah meningkatnya keasaman (menurunnya
pH) dapat meningkatkan kelarutan fluorapatit,
Di samping keasaman ada faktor lain yang dapat mem
pengaruhi kelarutan suatu asam, yaitu adanya ion sejenis,
dimana ion sejenis dapat mengurangi kelarutan suatu ga -
ram (6).
Peneliti terdahulu telah melaporkan bahwa saliva -
dapat menghambat kelarutan jaringan keras gigi (7).
Seperti telah diketahui bahwa saliva terdiri dari senya-
wa anorganik antara lain : ion kalsium, kalium, natrium,
magnesium, khlorida dan ion fosfat serta senyawa organik
seperti mucoid, karbohidrat, asetilglikoprotein, asam
sialinat, enzim ptialin, globulin dan asam amino bebas -
(2). Dinyatakan pula bahwa ion kalsium dalam saliva rela
tif cukup tinggi yaitu antara 4 - 12 mg % 9 demikian juga
kadar ion fosfat sebagai fosfor 12 - 17 % (8). Kedua ion
ini merupakan kenyataan yang diuraikan di atas, maka tim
bul pula pertanyaan : seberapa besar ion sejenis khusus-
kelarut-Fluorapatit buatan sebagai bahan penelitian telah
berhasil dibuat secara aederhana dengan mereaksikan ammo
nium foafat, kalium asetat dan natrium fluorida dengan
perbandingan tertentu (9). Dengan fluorapatit buatan ini
dapat dilakukan penelitian tentang kelarutan yang terae-
but dalam permaaalahan di atas.
Aaam asetat banyak digunakan untuk memberi rasa -
asam pada makanan, misalnya kuah pempek yang mempunyai
pH 3,8 (10), sayur asinan yang mempunyai pH 4,5 - 5,0
.dan manisan basah buah - buahan dengan pH 5,0 - 5,8.
2. Tu.juan penelitian
Untuk menjawab pertanyaan - pertanyaan teraebut di
atas maka perlu dilakukan penelitian dengan tujuan seba
gai berikut.
2.1, Mengukur kelarutan fluorapatit, yaitu kadar kalaium -
dan foafat yang terlarut dalam larutan penyangga asam
asetat dari pH 3,5 - 5,5 aelama selang waktu 0 - 14 ha
ri.
2.2. Mengukur kelarutan fluorapatit, yaitu kadar kalaium -
dan fosfat yang terlarut dalam larutan penyangga asam
aaetat berbagai pH dengan penambahan ion sejenia kalsi
um dan fosfat berbagai konsentrasi.
3. Hipotesa penelltlan
Berdasarkan penelaahan kepustakaan yang telah
dilakukan, maka dapat dirumuskan hipotesa penelltlan
sebagai berikut:
3.1. Menurunnya pH akan meningkatkan kelarutan fluorapa
tit-3.2. Adanya ion kalsium dan ion fosfat dapat menurunkan
BAB II
1« Fluorapatit
Gigi manusia terdiri dari . jaringan keras gigi
(email dan dentin) dan jaringan lunak (pulpa) dengan
auaunan kimia sebagai berikut : email terdiri dari
9 2 - 90 % zat organik, 3 - 4 % zat anorganik dan 5 -
6 % air; dentin terdiri dari 70 % zat anorganik 10 %
zat organik dan 2 0 % air; pulpa terdiri dari 2 5 % zat
organik, 75 % air (1) auaunan senyawa anorganik dari
email dan dentin dapat dilihat pada tabel berikut ini
dengan persen berat lebih, dari' O',01 (11. )*
TABEL : I TINJAUAN PUSTAKA
SUSUNAN SENYAWA ANORGANIK EMAIL DAN DENTIN DENGAN PRO
SEN BERAT LEBIH DARI 0,01.
Komponen % berat
Ca 36,4
P0|- sebagai P 17,4
Mg 0,4
Na 0 , 6 6
K 0,03
Ion kalsium dan fosfat yang terdapat dalam jum-
lah besar tersusun sebagai garam rangkap hidroksi apa-
tit dengan rumus kimia : 3Ca(P0^ ) 2 Ca(OH) 2 kalsium fos
fat hidroksida, Caio kalsium orto fosfat
basa, Ca^ (OH) (PO^)^ penta kalsium orto fosfat (12),
Sebagai komponen anorganik utama email gigi dan
dentin, hidrolfaiopetit tidak cukup kuat terhadap fak -
tor - faktor yang merusaknya antara lain : faktor dari
asam laktat hasil metabolisme sisa makanan oleh mikro-
organisme dan faktor dari luar rongga mulut misalnya
dari makanan - minuman.
Terdapatnya unsur fluor dalam komponen anorga -
nik gigi ternyata dapat mengurangi kelarutan jaringan
keras gigi, oleh karena fluor mengganti gugus hidroksi ( dari hidroksiapatit sehingga terbentuk fluorapatit,
Berdasarkan kenyataan ini maka t^juan utama pemakaian
fluoride dalam pasta gigi ditujukan untuk pembentukan
fluorapatit (1 2, 13).
Fluorapatit mempunyai rumus kimia Oa^Q(PO^)g
(Fg) dan Ca^ (PO^)^ F (14). Tiruan fluorapatit dapat
dibuat dengan mereaksikan ammonium fosfat, kalsium as<9
tat dan natrium fluorida, dan berdasarkan hasil anali
sis kuantitatif dengan menetapkan kadar kalsium,fosfat
dan fluor serta analisis kualitatif dengan infra merah
seperti terlihat pada tabel I dan gambar 1.
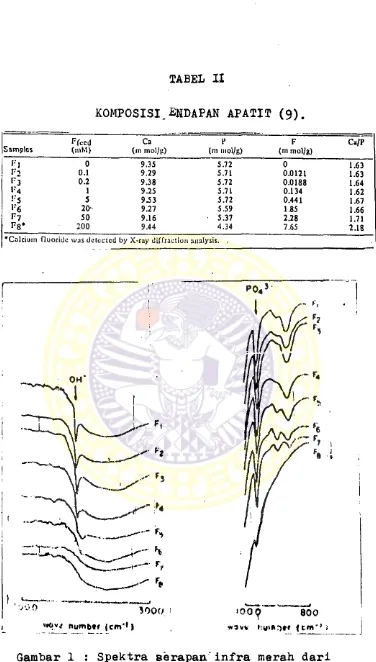
TABEL XI
KOMPOSISI.fiHDAPAN APATIT (9).
S a m p l e s
F f o c d ( m M )
C a ( m m o l/ g )
P ( m m o l/ g )
F ( m m o l/ g )
C a/ P
P j 0 9 . 3 5 5 . 7 2 0 1 . 6 3
r-T 0 . 1 9 . 2 9 5 . 7 1 0 . 0 1 2 1 1 . 6 3
‘ : 3 0 . 2 9 . 3 8 5 . 7 2 0 . 0 1 8 8 1 . 6 4
i ' 4 1 9 . 2 5 5 . 7 1 0 . 1 3 4 1 . 6 2
« : 5 5 9 . 5 3 5 . 7 2 0 . 4 4 1 1 . 6 7
*‘ 6 2 0 - 9 . 2 7 5 . 5 9 1 .8 5 1 . 6 6
f 7 SO 9 . 1 6 ■ 5 . 3 7 2 . 2 8 1 . 7 1
F 8 * 2 0 0 9 . 4 4 4 . 3 4 7 . 6 5 2 . 1 8
' C a l c i u m f l u o x i d c w a s d e t e c t e d b y X - r a y d i f f r a c t i o n a n a l y s i s . ,
P0 4 3 ’
Pada penam'bahan fluor 0 - 5 mM terbentuk senyawa hidroksi
apatit, dengan rumus kimia ^ai o ^ °4 ^ 6 * ha'*‘ *ni ***“
tunjukkan oleh spektra infra merahnya dimana pada panjang
—1
gelombang 1000 - 3000 Cm masih menunjukkan adanya pun ~
dek serapan gugus hidroksi demikian pula pada bilangan ge,
lombang 1000 - 800 Cm"*"1 terdapat puncak serapan gugus fo^
fat. Spektra infra merah yang dihasilkan pada penambahan
fluor 2 0 50 mM menunjukkan bahwa pada bilangan gelom
-—1
bang 1000 - 3000 Cm tidak terdapat puncak serapan gugus
hidroksi hal ini menunjukkan baliwa gugus fluor telah
men-substitusi gugus hidroksi, dan pada bilangan gelombang
- 1
1000 - 800 Cm masih terdapat puncak gugus fosfat, dari
gambar spektra ini dapat disimpulkan bahwa pada penambah
an fluor 20 - 50 mM terbentuk senyawa fluorapatit dengan
rumus kimia Ca^Q (P0^ )g( Pg). Sedangkan pada penambahan -
fluor lebih dari 50 mM terbentuk kalsium florida oleh ka-
rena spektra infrk merah yang dihasilkan raemperlihatkan
bahwa pada bilangan gelombang 10 0 0 - 3 0 0 0 Cm dan pada
bilangan gelombang 1000 - 800 Cm-*^ tidak tordapat''puncak
serapan gugus hidroksi dan fosfat.
2. Mekanisme melarut. (15, 16)
■Mekanisme terlarutnya suatu zat ada 3 mapam.
Suatu zat. d,apat terlarut dengan salah satu mekanisme .atau merupakan. gabungan dari ketiga mekanisme tersebut, ,* Ketiga -
makanlsme itu ma ping-sia sing adalah.sebagai berikut :
2. 1# "Diffusion layer model".
Teori ini beranggapan bahwa jika bahan padat dilarutkan
dalam suatu pelarut, maka akan terjadi suatu lapisan ti
pis dari pelarut dan zat padat yang bersifat statis dan
membungkus permukaan bahan padat tersebut. Lapisan ini
disebut “diffusion layer". Disini akan terjadi transpor-
tasi zat yang terlarut dengan kadar jenuh C pada permu-
kaan zat padat kedalam pelarut yang kadarnya lebih kecil
yaitu C sejauh h. Kecepatan melarut ditentukan oleh kece-
patan difusi menembus "diffusion layer" tersebut. Teori
ini dilukiskan seperti gambar berikut :
•h
C
Gambar 2. Mekanisme melarut dengan cara "diffusion
2.2, "interfacial barier model "
Teori ini beranggapan bahwa pada permukaan zat
padat mempunyai kadar Cs# dimana antara permu
kaan zat padat dengan pelarutnya mempunyai
lapisan batas antar permukaan atau "Interfacial
barier". Untuk terjadinya peristiwa melarut
dari permukaan zat padat kedalam pelarut dengan
kadar C 9 dibutuhkan suatu energi bebas yang
tinggi, Keadaan ini dilukiskan pada gambar 3 : ,
Gambar 3 : Mekanisme melarut dengan cara
"Interfacial barier".
2.3. "Dankwerts model s
Teori ini berdasarkan anggapan bahwa terjadi
transportasi pelarut ke permukaan zat padat
dalam bentuk kantong-kantong atau "macrosoopic
pocket". Pelarut dalam bentuk kantong- kantong
^rang melekat pada permukaan zat padat menyerap
zat padat secara difusi dan selanjutnya kantong
yang telah berisi bahan terlarut ini diganti
pai tercapai kesei»ubangan kelarutannya. Keadaan
ini dilukiskan seperti gambar 4 berikut ini :
G a m b a r 4 : M e k a n i s m e m e l a r u t d e n g a n c a r a " D a n k w e r t s m o d e l " .
Kelarutan. hasil kali kelarutan dan faktor - faktor
yang mempengaruhi kelarutan.
1. Kelarutan.
Secara kuantitatif kelarutan didefinisikan
sebagai konsentrasi zat terlarut dalam suatu lar
utan jenuh pada suhu tertentu dan secara kualita
tif sebagai interaksi spontan dua atau lebih zat
untuk membentuk suatu dispersi molekul yang homo
gen (29).
Pada dasarnya pengukuran kelarutan terdiri
tiga tahap, tahap pertama adalah pencampuran se~
jumlah bahan dengan pelarut, tahap kedua adalah
menentukan tercapainya saat kesetimbangan kelarut
an, artinya jumlah bahan yang terlarut tetap pada
tertentu dan tahap ketiga adalah memisahkan bahan
terlarut dari pelarut; aerta menetapkan kadar
bahan yang terlarut ( 17 )•
3.2. Hasil kali kelarutan.
Hasil kali kelarutan dapat dijelaskan beri
kut : Jika kation E bereaksi dengan anion A maka
akan terjadi garam BA. Reaksinya adalah :
B + + A " BA
Jika reaksi ini mencapai kesetimbangan, maka dapat
diterapkan hukum aksi massa sebagai berikut :
(:b + ) . (a- )
--- s K
( BA )
dimana (B+), (A") dan (BA) masing masing adalah
konsentrasi kation B, arion A dan garam BA. Bila
pengaruh elektrolit terhadap aktivitas BA diabai-
kan maka hasil kali konsentrasi zat-zat yang be
reaksi pada persamaan diatas dapat ditulis :
( B + ) . ( A ' ) . S BJt
dimana adalah hasil kali kelarutan yang mem
punyai harga tetap pada suhu tertentu.
3#3. Faktor-faktor yang mempengaruhi kelarutan.
Hal-hal yang mempengaruhi kelarutan antara lain;
a. faktor'fisika diantaranya suhu, ukuran partikel dan
faktor sterik dari molekul bahan yang terlarut.
b. faktor kimia diantaranya terbentuknya senyawa kom-
pleks, reaksi asam basa, derajad keasaman media,
adanya ion tak sejenis dan penambahan ion sejenis..
Tinjauan tentang faktor-faktor yang mempengaruhi
kelarutan dibatasi hanya pada faktor pengaruh derajad
kesaman dan pengaruh penambahan ion sejenis terhadap ke
larutan.
Pengaruh dera.jad keasaman terhadap kelarutan.
Pengaruh derajad keasaman terhadap kelarutan dapat dije-
laskan sebagai berikut, Misalnya su$tu garam BA yang sedikit
larut, dilarutkan dalam air maka sebagian akan terurai menja-
di kation B dan anion A * Jika kedalam larutan tersebut di-
tambahkan asam lemah HX maka H+ bereaksi dengan anion A mem-
bentuk senyawa HA. Reaksinya adalah sebagai berikut:
BA < = L B+ + A"
HX -=± H+ + X~________________________
BA + HX --4 B+ + X* + H+ + X” .. i BX + HA.
Jika dalam reaksi ini terbentuk BX dan HA yang larut, maka
akibatnya semakin banyak BA yang larut sampai tercapai harga
Dengan demikian makin besar (H+), makin beaar BA
yang terlarut. Hal ini berarti pada garam tipe ini,
makin kecil pH makin besar kelarutannya,
Fenffaruh ion sejenis terhadap kelarutan.
Pengaruh ion sejenis terhadap kelarutandapat di
jelaskan sebagai berikut, Misalnya dalam suatu larutan
garam BA ditambahkan kation B maka konsentrasi B+ menjadi
lebih besar dari semula. Dengan demikian kelarutan ga~
ram BA ditentukan oleh konsentrasi anion A. Berdasarkan
persamaan hasil kali kelarutan garam BA dibawah ini,
S r (B+ ) . (A ), maka (A ) 2
BA (B )
Oleh karena (B ) lebih besar dari semula, sedang SBA
tetap maka (A“) menjadi kecil, artinya kelarutan garam BA
menurun. Demikian pula jika dalam larutan yang berisi
garam BA ditambahkan anion A, maka kelarutan garam BA di
tent ukan oleh konsentrasi B + oleh karena, SBA SEA » (B ) . (A ). maka (b ) s
W )
karena ( A ) lebih besar dibandingkan semula, sedang SBA
tetap maka (B+) menjadi kecil artinya kelarutan garam BA
menurun.
. 4 , Spektrofotometri infra merah (18,19,29)
Radiasi elektromagnetik terdiri dari paket-paket energi
yang disebut foton yang bergerak membentuk gelombang. 3esar-
nya energi dari foton tersebut sebanding dengan frekwensi ge-
lombangnya. Jika radiasi elektromagnetik melewati lapisan
transparan dari suatu zat padat, zat cair atau gas maka frek-
wensi-frekwensi tertentu dari radiasi elektromagnetik secara
selektif akan mengalami proses absorbsi. Froses absorbsi ini
dapat terjadi bila energi foton yang diabsorbsi tepat sama
dengan perubahan energi atom atau molekul dari keadaan dasar
ke keadaan tereksitasi.
Sinar infra merah merupakan salah satu radiasi elektro
magnetik. Daerah infra merah terbagi atas infra merah dekat
dengan panjang gelombang 0.78 - 2.5 um atau bilangan gelom
bang 12800 - 4 0 0 0 cm"1, infra merah tengah dengan panjang ge
lombang 2.5 - 50 um atau bilangan gelombang 4 0 0 0 - 2 0 0 cm™1
dan infra merah jauh dengan panjang gelombang 50 - 10 0 0 um
atau bilangan gelombang 200 - 100 cm*"1. Daerah sinar merah
yang paling banyak digunakan dalam spektrofotometri infra me
rah adalah panjang gelombang 2 . 5 - 50 um atau bilangan gelom
bang 4 0 0 0 - 6 70 cm-1.
Letak atom yang satu terhadap yang lain di dalam satu
molekul tidak tetap, selalu berubah-ubah sebagai akibat ter-
jadinya getaran (vibrasi). Selisih antara tingkat-tingkat
ener-gi sinar infra merah. Jenls vibrasi molekul ada
dua yaitu vibrasi ulur (stretching vibration ) dan
vibrasi tekuk (banding vibration).
Adanya gugus fungsionil dalam molekul, dapat
dilihat dari adanya puncak-puncak serapan pada da
erah panjang gelombang atau bilangan gelombang
infra merah tertentu. Misalnya pada daerah vibrasi
ulur hidrogen dengan bilangan gelombang 3700 cm”*-
2700 cm ditemukan gugus 0-H yaitu pada bilangan
gelombang sekitar 3500 cnr1 .
Perbedaan kecil pada struktur dan substitusi
gugus: menghasilkan perubahan yang cukup berarti ter
hadap puncak-puncak serapan pada daerah sidik jari
(finger print), yang terletak pada daerah bilangan
gelombang 1500 - 700 cm"1. Beberapa gugus penting
yang ditemukan pada daerah ini raisalnya fosfat m e r
nyerap sinar infra merah pada bilangan gelombang
sekitar 1200 cm-1.
Berdasarkan sifat-sifat diatas maka spektro
fotometer infra merah dapat digunakan untuk identi-
fikasi suatu senyawa tertentu. Sebagai contoh ada
lah spektra infra merah dari fluorapatit, dimana
substitusi ion fluor terhadap hidroksida terlihat
dengan tidak n;unculnya puncak serapan sinar infra
merah pada bilangan gelombang 3700 cm"1 dan terlihat
puncak serapan ion fosfat pada bilangan gelombang
51 Spektrofotometri sinar .tampak ( 18,19*21 *).
Metode spektrofotometri sinar tampak merupakan
salah satu metode instrumental yang dapat digunakan
untuk melakukan analisis baik untuk tujuan kualita
tif maupun kuantitatif,
Dasar analisis kuantitatif spektrofotometri
sinar tampak adalah hukum Lambert - Beer, yang.dapat
dituliskan dalam bentuk persamaan :
A - a.b.c dimana :
A ; Serapan.
a ! Absorbtivitas atau koefisien ekstingsi. atau daya serap.
b : Tebal medium yang dilewati cahaya.
c : Kadar dalam medium.
Penetapan kadar secara spektrofotometri sinar1
tampak didasarkan pada kemampuan dari larutan bahan
untuk menyerap sinar monokromatis yang melaluinya,
serapan ini terjadi pada daerah sinar tampak yaitu
pada panjang gelombang 380 - 780 nm.
Alat spektrofotometer sinar tampak pada dasarnya
terdiri dari sumber sinar, monokromator, tempat sel
untuk zat yang diperiksa, detektor, penguat arus dan
Penetapan kadar secara spektrofotometri untuk
zat tunggal dapat dilakukan dengan cara memakai nilai
ekstingsi spesifik, cara kurva baku, cara pembanding
larutan baku zat murni dan dengan memakai nilai eks -
tinggi molar,
Prinsip penetapan kadar fosfat secara spektrofotome -
tri sinar tampak (2 0).
Penetapan kadar ion fosfat dilakukan dengan ca
ra kurva baku. Prinsip dasar penetapan kadar fosfat
adalah berdasarkan reaksi terbentuknya asam fosfomo. -
libdat antara ammonium dengan larutan fosfat yang se-
lanjutnya direduksi oleh larutan stanno khlorida men
jadi senyawa kompleks berwarna biru. Kompleks yang
berwarna biru inilah yang diamati serapannya pada ge
lombang maksimumnya.
Besarnya serapan yang diamati adalah berbanding lurus
dengan kadar fosfat.
6 . Spektrofotometri serapan atom ( 18, 19, 23 ).
lVletode spektrofotometri serapan atom terutama
-digunakan untuk melakukan analisis kuantitatif.
Seprti halnya metode spektrofotometri sinar tampak di
sini berlaku pula hukum Lambert - Beer.
Kekhususan metode ini didasarkan pada kemainpuannya
untuk pengukuran kadar logam dibawah 1 ppm.
Prinsip penetapan kadar dengan cara spektrofotometri
serapan atom dapat dijelaskan sebagai berikut,
Bila larutan yang mengandung komponen logam dibakar
( dengan api yang berssol dari udara - asetilen maka
akan terjadi proses yang dapat digambarkan sebagai -
berikut :
nebulasi evaporasi
I
|
M+ X ~ --- ■> M+ X " - - - ■> MX
(laruten) (kahut) (padat)
X + M
(uap) (uap)
pengukuran absorpsi
disosiasi
4
---vaporasx
m .
(uap)
absorpsi energi cahaya
M (tereksitasi)
Mula - mula terjadi penguapan pelarut sehingga
meninggalkan residu padat, Kemudian terjadi penguapan
zat padat tersebut yaitu perubahan dari fase padat
dalam bentuk gas ini terdisoslasi menjadi atom-
atom netral dimana atom ini.berada pada tingkat
energi dasar (M). Atom-atom pada tingkat energi
dasar ini dieksitasi oleh kuantum energi radiasi
spesifik ke tingkat energi yang lebih tinggi (M*).
Energi radiasi tersebut berasal dari energi cahaya
yang panjang gelorabangnya sama dengan panjang gelom
bang cahaya yang dipancarkan oleh unsur tersebut
jika turun dari tingkat energi tereksitasi ke ting
kat energi dasar,
. Penetapan kadar dengan cara spektrofotometri
serapan atom dapat dilakukan dengan cara kurva baku,
interpolasi kadar baku yang terdekat dan cara pe
nambahan standar dalam.
Untuk memperoleh hasil yang tepat dan telifci
harus dipilih kondisi analisis sedemikian rupa se-
hingga faktor yang mempengaruhi hasil dapat dihindari
Faktor yang cukup besar. pengaruhnya terhadap hasil
adalah faktor kimiawi misalnya terbentuknya senyawa
yang tahan terhadap jauhu nyala, misalnya kalsium
pirofosfat yang merupakan hasil reaksi antara kalsium
dengan fosfat. Akibatnya pada analisis kuantitatif
ion kalsium yang berada bersamai dengan ion fosfat
serapan yang dihasilkan lebih kecil dari harga se
rapan yang sesungguhnya. Kesulitan ini dapat diatasi
lanthanum nitrat sehingga fosfat terikat dan tidak
bereaksi dengan kalsium.
Prinsip penetaoan kadar kalsium seoera spektrofotometri
serapan atom (2 4).
Penetapan leader ion kalsium dilakukan dengan cara
kurva baku dengan prinsip penetapan,mengendapkan lebih
dulu fosfat yang terdapat dalam fluorapatit, dengan pe
BAB III
Mt/rODii‘ Pi^i'JELITIAN
1. Alat - alat
- Ayakan : mesh 100
- Labu ukur : 10,0 ml, 50,0 ml, 1 0 0 , 0 ml, 500,0ml,
1 0 0 0 , 0 ml.
- Penangas air berpengocok : Kottermann ( Kotterman
shaking water bath ).
- Pengaduk : Fisher model 155
- Pen.yaring millipore : type IIA dengan ukuran lubang:
0,45 pm,
- pH meter : Fisher Accumet model 250 A
- Pipet volume : 0,5 ml, 1,0 ml, 2,0 ml, 3,0 ml,4,0 ml
5 , 0 ml , 1 0 , 0 ml, 2 0 , 0 ml, 2 5 , 0 ml, 3 0 , 0 ml.
- Termometer : 0 - 100°C
- Timbangan analitis : Sartorius type 2472
- Spektrofotometer Absorbsi Atom : Perkin Elmer 380
- Spektrofotometr Infra Merah ; Perkin Elmer 735 B
- Spektrofotometer Lembayung Ultra - sinar tampak :
Hitachi 557
2. Bahan - bahan.
Jika tidak disebut lain, maka bahan yang
kan mempunyai derajad kemurnian pro analisis dan air
yang dipakai adalah air bebas mineral ( aqua deminera-
lisata ).
- Ammonium asetat
- Ammonium dihidrogen i'osfafc
- Ammonium hidroksida
- Ammonium mblibdat
- Asam nitrat
- Asam asetat
- Asam khlorida
- Asam oksalat
- Asam'sulfat
- Gliserin
- Kalium bromide khusus untuk spektrofotometer infra
merah
- Kalium ferosianida
- Kalsium asetfet
- Kalsium karbonat
- Lanthanum oksida
- Magnesium mixture
- Natri.un asetat
3* Penyediaan bahan - bahan percobaan.
3.1* Larutan kalsium asetat 0,1 M
Ditimbang seksama 7,9085 gram kalsium asetat di
masukkan dalam beker gelas dan dilarutkan dalam.air.
Kemudian secara kuantitatif dipindahkan dalam labu u-
kur 500,0 ml, selanjutnya ditambah air sampai garis
tanda.
3*?* Larutan yang berisi ammonium dihidrogen fosfat 0„06 M
dan natrium fluorida 0,025 M
Ditimbang seksama 3,4509 gram ammonium dihidro-
gen fosfat, dan 0,5125 gram natrium fluorida, Kedua -
nya dimasukkan dalam beker gelas, dilarutkan ■. dalam
air, Kemudian secara kuantitatif dipindahkan dalam la
bu ukur 500,0 ml, selsnjutnya ditambah. air-'sampai ga
ris tanda.
3.3. Larutan ammonium asetat 1.3 M .
Ditimbang seksama 100,204 gram ammonium asetat,
Dimasukkan dalam beker gelas*dan dilarutkan dalam.air.
Kemudian secaa» ;kv^n.titatif' dipindahkan dalam„ labn . ukur
1000,.mi;. selanjuln^A ditsunbali:airv-ftampfiX.garLs...tanda.
3*4* Larutan stanno khlorida ( 22 )•
i
Ditimbang 2,5 gram stanno khlorida, dilarutkan
dalam 100 ml gliserolr Kemudian dipanaskan diatas pe-
nangas air dan diaduk terus sampai larut.
3.5. Larutan Ammonium Molibdat ( 22 ).
Ditimbang 25. gram ammonium molibdat dilarut -
kan dalam 175 ml air. Kedalam beker gelas berisi 400
ml air ditambahkan. melalui dinding beker gelas, sedi.
kit demi sedikit 280 ml larutan asam sulfat p e k a t dan d i d i n g i n k a n . Selanjutnya larutan ammonium molibdat ditambahkan kedalam larutan asam sulfat dan diaduk -
sampai homogen. Kemudian ditambah air sampai 1 liter.
3.6* Larutan Lanthanum Oksida 20 % ( 24. )
Ditimbang seksoma 23,5 gram lanthanum oksida,
dilarutkan dalam 50 rnl larutan asam nitrat pekat, di.
encerkan dengan air sampai 10 0 ml.
3.7. Larutan penyangga asam asetat-natrium asetat dengan
pH 35-. pH 4.0: tfH 4.5: pH 5.0 :pH 5.5 ( 6 )
Pembuatan larutan penyangga asam asetat-natri
um asetat dilakukan dengan cara raencampurkan sejum -
lah 0,_2 M asam asetat dan 0,2 M natrium asetat de -
ngan perbandingan sebagai berikut :
ml 0,2 M asam ml 0,2 M natrium pH yang
asetat asetat d i k e h e n d a k i
950 50 3,5
800 2 0 0 4 , 0
6 0 0 . 400 4,5
Setelah dicampur, masing - masing larutan diukur pH-
nya dengan pH meter dan ditambahkan 0,2 U asam ase - :
tst atau 0,2 M natrium ssetat untuk mendapatkan pH
yang dikendaki.
3.8. Larutan penyangga asam asetat berbagai pH yang me -
ngandung ion se.jenis fosfat.
Ditimbang seksama kalium dihidrogen fosfat yang t&lah dikeringkan 105°C selama-1. jam, masingr.raasing
sebanyak 0,0527 gram;- 0.,0637 gram; 0,0746 gram. . Ma-
sing-masing dilarutkan dalam larutan penyangga .asam
asetat pH 3,5 sampai volumenya 100,0 ml, kemudian di-
kocok sampai homogen.
Kadar fosfat yang didapat, dihitung sebagai fos-
for masing-masing adalah 1 2 mg#; 14 mg% dan 17 mg%.
Dengan cara yang sama seperti diataa dibuat ju
ga dengan pelarut larutan penyangga asam asetat pH
-4,0 ; pH 4,5 ; pH 5,0 dan pH 5,5.
3.9. Larutan penyangga asam asetat berbagai pii .yang me~ -
ngandung ion se.jenis kalsium.
Ditimbang seksama 100,1 mg kalsium karbonat di_
larutkan dalam larutan pengangga asam asetat pH 3,5
sampai volume 1 0 0 , 0 ml, kemudian dikocok sampai homo,
gen. Larutan ini mencaudung ion kalsium dalam larut
an penyangga asam asetat pH 3,5 sebanyak 400 ppm.
3 0 , 0 ml dimasukkan dalam lebu ukur 10 0 ml dan ditam
bahkan larutan penyangga asam asetat pH 3,5 sampai
garis tanda dan dikocok sampai homogen.
Masing - ma3ing larutan ini berturut - turut
mengandung ion sejenis kalsium 4 mg % ; 8 mg % . dan
12 mg %.
Dengan caro yang sama seperti diatas .dibuat
juga dengan pelarut larutan penyangga asam asetat
pH 4,0 J pH 4,5 pH 5,0 dan pH 5,5.
3.10. Larutan baku kalsium (24)
Ditimbang ‘seksama 1,2375 gram kalsium karbonat
dimasukkan dalam beker gelas, dilarutkan dalam asam
nitrat pekat sebanyak 3 ml, kemudian secara kuanti
tatif dipindahkan dalam labu ukur 5 0 0 , 0 ml.
Selanjutnya ditambah air sampai garis tanda dan di
kocok sampai homogen. Larutan ini mengandung kadar
kalsium 4 9 , 4 6 ppm.
3.. 11. Larutan baku fosfat ( 22 _)
Ditimbang seksama 2,1950 gram kalsium dihidro
gen fosfat yang telah dikeringkan pada suhu 105°C
selama 1 jam, dimasukkan dalam beker gelas dan dila
rutkan dengan air. Larutan ini dipindahkan . secara
kuantitatif kedalam labu ukur 5 0 0 , 0 ml, ditambah -
selanjutnya dari larutan ini dipipet 5 , 0 ml dimasuk
kan dalam labu ukur 1 0 0 , 0 ml, ditambahkan air sam
pai garis tanda dan dikocok sampai homogen.
Larutan ini men/zandun^ fosfat sebagai fosfar seba -
nyak 50 ppm.
3.12* Pembuatan fluorapatit (9).
Pembuatan fluorapatit dilakukan dengan cara
sebagai berikut. Untuk lebih jelasnya digambarkan
dengen skema pada gambar dibawah ini :
Gambar 5. Alat yang digunakan pada pembuatan fluor
apatit.
A. Buret untuk mengalirkan 300 ml larutan 0,1 M kal sium asetat.
B • Buret untuk mengalirkan 500 ml larutan yang me
ngandung 0,06 M'ammonium dihidrogen fosfat dan -
0,025';M natrium fluorida.
C. Beker gelas 2 liter yang berisi 1 liter larutan -
1,3 M ammonium asetat.
D. Pengaduk magnit dan pemanas
T. Termometer.
Hula - mula dalam beker g$l'&s„ (C) dipanaskan, suhu 80°-0 ■+ iPc .
Pengaduk dijalankan dengan kecepatan tetap. Kemudian
secara bersamaan larutan dari buret A dan B dialir -
kan dengan kecepatan.tetap yaitu 2 5 0 ml/jam.
Sampai masing - masing larutan habis dialirkan. Sus-
pensi yang terbentuk didinginkan sampai suhu kamar
dan diatur pH nya sampai'pH 7,4 ( pH diukur dengan -
pH iriQter ) dengan monambahkan ammonium Hidroksida pe
kat atau asam asetat pekat secukupnya. Suspensi diaduk
lagi selama 3 jam pada suhu kamar, dan didiamkan se
lama 2 4 jam. Kndapan disaring dengan kertas saring
Whatman 4-3 dsn dicuol. dengan air sampai hebas ion
ammonium asetat, dan natrium, akhirnya endapan dike
ringkan dalam almari pondering pada suhu 110°C sela
ma 2 4 jam.
4. Pel8kaanaan percobaan.
4.1. Analisis kualitatif fluorapatit.
4.1.1. Pembuatan spektra infra merah fluorapatit dengan -
metode spektrofotometri infra merah (9).
Ditimbang seksama 10,0 mg fluorapatit dan
3 0 0 , 7 mg kalsium bromida untuk infra merah, kedu -
nya dicampur dan digerus dalam mortir khusus sam -
pai homogen. Campuren ini ditekan dengan penekan -
hidrolik dengan kekuatan 180 kg/Cm sampai terben-
tuk cuplikan yang transparan. Kemudian puplikan -
ini diamati pada spelctrofotometer infra merah dari
panjang gelombang 400 nm - 4000 nm, Berdasarkan -
spektra teraebut dapat diidentifikasi adanya gugus
fosfat dan substitu3i fluor terhadap gugus hidrolc-
si.
4.1.2. Analisis kualitatif ion kalsium ( 25*26 ).
Fluorapatit dilarutkan dalam asam khlorida
6 N, selanjutnya larutan yang diperoleh dilakukan
analisis terhadap ion kalsium dengan pereaksi se
bagai berikut :
Pereaksi asam sulfat encer
Larutan fluorapatit dipekatkan, kemudian -
ditambahkan larutan asam sulfat ecer, kristal yang
terjadi diamati dengan mikroskop,
Pereaksi asam oksa'lat
Larutan fluorapatit ditambah larutan ammo
nium hidroksida sampai sedikit alkalis, kemudian
ditambah larutan asam oksalat, Kristal yang terja
di, diamati dengan mikroskop dan dicoba dilarut -
kan dalam asam asetat dan asam sulfat pekat.
Pereaksi kalium ferosianida
Larutan fluorapatit ditambah larutan ammo
nium hidroksida sampai alkalis, kemudian ditambah
larutan kalium ferosianida dalam volume yang sama,
endapan yang terjadi dicoba dilarutkan dalam asam
asetat.
Uji n.yola
: Kav/at nikel yang sudah dibersihkan dengan
sampai kawat tidak ber_warna. Kemudian didinginkan
dan dikenakan pada larutan fluorapatit, selanjut-.
nya -dikenakan pada nyala bunsen.lagi* Diamati
warna nyala.yang terjadi.
4.1.3. Analisis kualitatif ion fosfat ( 25,26 )
Fluoriapatit 'dilarutkan dalam asam khlorida -
6 N, selanjutnya larutan yang diperoleh, dilakukan
analisis terhadap ion fosfat dengan pereaksi seba -
gai berikut :
Pereaksi magnesium mixture
Larutan fluorapatit dipekatkan ditambah la -
rutan magnesium mixture, kristal yang terjadi di. -
amati dengan mikroskop.
Pereaksi perak nltrat’
: Larutan fluorapatitditambah larutan perak
nitrat, endopan yang terjadi dicoba dilarutkan da
lam asam nitrot encer dan ammonium hidroksida.
Pereaksi ammonium molibdat
Larutan ammonium molibdat 2 - 3 ml dipanaskan
50 - 60°C, kemudian ditambahkan larutan fluorapav—
tit tetes derni. tetes, diamati warna endapan yang
terjod i.
4.1*4. Analisis kualitatif ion fluor
Fluorapatit dilarutkan dalam asam khlorida
6 N, selanjutnya larutan yang diperoleh dilakukan
analisis terhadap ion fluor dengan pereaksi asam
sulfat pekat seperti berikut ini.
Fluorapatit kering dimasukkan dalam tabung
reaksi ditutup dengan gabus yang dilubangi, mela-
lui pipet kecil diteteskan asam sulfat pekat le -
wat lubang gabus. Secepatnya diganti pipet berisi
air dan dibiorkan dimulut tabung bebera saat.
Selanjutnya diamati perubahan kekeruhan pada air.
4.2. Analisis kuantitatif fluorapatit.
4.2.1. Analisis kuantitatif kadar kalsium dalam fluorapa
tit dengan metode spektrofotometri serapan atom(9).
Pembuaten kurva baku kalsium (24).
Dipipet masing - masing 0,5 ml; 1,0 ml; 2,0
ml; 3 *0 ml; 4 , 0 ml 5 , 0 ml dan 1 0 , 0 ml larutan kal
sium induk kadar 4 9 , 4 6 ppm ke dalam labu ukur
50,0 ml, kemudian ditambahkan 2 , 5 ml larutan 2 0 %
lanthanum oksida, dan ditambahkan air sampai ga -
ris tanda, kemudian dikocok sampai homogen.
Larutan ini masing - masing mengandung kalsium -
0,4946 ppm; 0,9891 ppm; 1,9782 ppm; 2,9673 ppm;
Selanjutnya larutan ini disaring dengan kertas sa
ring Whatman 43. Filtrat pertama dibuang dan fil-
trat selanjutnya ditampung. Filtrat ini diamati -
serapannya pada spektrofotometer serapan atom pa
da panjang gelombang 4 2 2 , 7 nm, terhadap blanko la
rut pereaksi dengan perlakuan yang sama.
Penetapan kadar kalaium dalam fluorapatit (9).
Ditimbang seksama 50 mg fluorapatit, dila -
rutkan dalam asam nitrat pekat 0 , 3 ml secara kuan
titatif dipindahkan dalam labu ukur 2 0 0 , 0 ml, se
lanjutnya ditambah air sampai garis tanda, dan di
kocok sampai homogen. Dari larutan ini dipipet
3 . 0 ml, dimasukkan dalam labu ukur 1 0 0 , 0 ml,ditam
bah 5 , 0 ml larutan 2 0 % lanthanum oksida, selan -
jutnya ditambah air sampai garis tanda, dikocok
sampai homogen dan disaring dengan kertas Whatman
43. Selanjutnya larutan ini diamati serapannya pa
da panjang gelombang 422,7 nm terhadap blaako la
rutan pereaksi dengan perlakuan yang sama.
4.2.2. Analisis kuantitatif kadar fosfat dalam fluorapa
tit dengan metode spektrofotometer sinar tampak.
Penentuan pan.jan^ Relombang maksimum.
Dipipet 3,0 ml dan 5,0 ml larutan fosfat ka
dar 5*0 ppm ke dalam labu ukur 50,0 ml. Ditambah
4 . 0 ml larutan ammonium molibdat, dikocok dan
tambeh 0,5 ml larutan stano khlorida. Selanjutnya
larutan ini dikocok sampai homogen dan dibiarkan
selama 45 menit, larutan ini diamati serapannya
pada panjang gelombang 6 0 0 nm sampai 750 nm.
Panjang gelombang maksimura adalah panjang gelom -
bang ’dimana serapannya terbe'sar.
Pembuatan kurva baku fosfat (22)
Dipipet masing - masing 0,5 ml; 1,0 ml; 2,0
ml; 3,0 ml; 4,0 ml; 5>0 ml; 10,0 ml larutan induk
fosfat kadar 50 ppm ke dalam labu ukur 50,0 ml.
Ditambah 4,0 ml larutan ammonium molibdat,dikocok
dan ditambah 0 , 5 nil larutan stano khlorida. Selan
jutnya ditambah air sampai garis tanda dan diko -
cok sampai homogen serta dibiarkan selama 4 5 me -
nit. Larutan ini masing - masing mengandung fos -
fat dihitung sebagai fosfor 0 , 5 ppm; 2 , 0 ppm; 3 , 0
ppm; 4,0 ppm; 5,0 ppm; 10,0 ppm# Larutan ini di -
amati serapannya pada panjang gelombang raaksimum
yang dihasilkan terhadap larutan pereaksi dengan
perlakuan yang sama,
Penetapan kadar fosfat dalam fluorapatit (9).
Ditimbang seksama 50 mg fluorapatir dilarut.
kan dalam asam sulfat pekat 0 , 3 ml, secara kuanti
tatif dipindahkan dalam labu ukur 2 0 0 , 0 ml selan -
sampai homogen. Dari larutan ini dipipet 3^0. ml
di-masukkan dalam labu ukur 1 0 0 , 0 ml, ditambah 4 , 0 ml
larutan ammonium molibdat dan dikocok sampai homo
gen, kemudian ditambah 0,5 ml larutan stanno khlo
rida.: Larutan ini ditambah air dan dikocok lagi
sampai. homogen.serta.dibiarkan sglaraa. 4J5.menit.
Selanjutnya diamati serapannya.pada panjang gelom
bang maksimum yang dihasilkan terhadap blanko pe
reaksi. dengan perlakuan yang sama,
4*3. U.11 .kelarutan .fluorapatit ‘ {21)
4.3.1. U.1i kelarutan fluoroapatit dalam larutan penyangga -
asam asetat berbagai pH.
Penangas air berpengocok dijalankan pada suhu
37°C. Tujuh buah tabung reaksi' besar yang berisi
15,0 ml larutan penyangga asam asetat pH 3,5, dima -
sukkan kedalam penangas air tadi. Suhu larutan dalam
salah satu tabung reaksi diukur dengan termometer.
Jika suhu larutan dalam tabung reaksi telah mencapai
37°C, maka ke delam enam tabung reaksi dimasukkan ma
sing - masing kurang lebih 10 0 mg fluorapatit.' -
Sedangkan ke dalam salah satu tabung reaksi tidak di
masukkan fluorapatit dengan maksud larutan yang a
da didalomnya digunakon sebagai blanko. Selanjutnya
pengaduk dijolankan dengan kecepatan tetap yaitu 170
frekueiisi permenit.
Pada setiap rentang waktu 43 jam .diambil satu ta bung reakai, larutan di.dalamnya disaring melalui
millipore dan filtratnya ditetapkan kadar kalsium
dan fosfatnya.
Dengan cara yang sama dilakukan uji kelarut
an fluorapatit dalam larutan penyangga asam asetat
pH 4,0; pH 4,5; pH 5,0 dan pH 5,5.
4.3.2. Uji kelarutan fluorapatit.. dalam larutan penyangga
asam asetat berbagai pH dengan penambahan ion se-
.jenis fosfat berbaroi konsentrasi.
Penangag air berpengocok dijalankan pada su
hu 37°C. Tujuh buah tabung reaksi besar berisi
15,0 ml larutan penyangga asam asetat pH 3,5 yang
mengandung ion fosfat 12 mg % t dimasukkan ke dalam
penangas air. Salah satu tabung reaksi diukur su-
hunya dengan termometer. Jika suhu larutan dalam
tabung reaksi telah mencapai 37°C, maka ke dalam
enam tabung reaksi yang lain dimasukkan masing-ma-
sing kurang lebih 100 mg fluorapatit.. Sedangkan
salah satu tabung reaksi tidak dimasukkan fluor -
apatit, dengan maksud larutan yang ada di dalamnya
digunakan sebagai blanko. Selanjutnya pengocok di^
jalankan dengan kecepatan tetap yaitu 170 frekuensi
permenit. Pada setiap rentang waktu 48 jam diambil
Dengan cara yang sama dilakukan uji kelarutan
fluorapatit dalam larutan penyangga pH 3,5 dengan
penambahan ion sejenis fosfat 14*5 mg % dan 17 mg %.
Dengan cara yang sama pula dilakukan uji ke
larutan fluorapatit dalam larutan penyangga asam
asetat pH 4,0; pH 4,5i pH 5,0; pH 5f5 dengan penam
bahan ion sejenis fosfat 12 mg 14*5 mg % dan
17 mg 96.
4.3.3. U.11 kelarutan fluorapatit dalam larutan penyangga
asam asetat berbagai pH dengan penambahan ion se
jenis kalsium berbagai konsentrasi.
Penangas air berpengocok dijalankan pada
suhu 37 °C# .Tujuh buah tabung reaksi besar yang
berisi 15,0 ml larutan penyangga asam asetat pH 3,5
yang mengandung kalsium 4 mg %, dimasukkan ke dalam
penangas air tadi. Suhu larutan dalam satu tabung
reaksi diukur dengan termometer. Jika suhu larut
an dalam tabung reaksi telah mencapai 37°C, maka
ke dalam enam tabung reaksi yang lain dimasukkan
masing-masing kurang lebih 100 mg fluorapatit.
Sedangkan salah satu tabung reaksi tidak dimasukkan
fluorapatit, dengan maksud larutan yang ada dida-
lamnya digunakan sebagai larutan blanko. Selanjut
nya alat pengocok dijalankan dengan kecepatan tetap
yaitu 170 frekuensi permenit. Pada setiap rentang
waktu 48 jam diambil salah satu tabung reaksi,
rutan didelaranya disaring melalui millipore dan fil
tratnya ditetapkan leader fo3fatnya.
Dengan cars yang sama dilakukan uji kelarut -
an fluorapatit dalam larutan penyangga pH 3,5 de -
ngan penambahan ion aejenis kalsium 8 mg % dan 12
mg %.
Dengan cara yang sama pula dilakukan uji kela
rutan fluorapatit dalam larutan penyangga asam ase-
tat pH 4,0 ; pH 4,5 ; pH 5,0 ; pH 5,5 dengan penam
bahan ion sejenis kalaium 4 mg %, 8 mg % dan 12 mg%
4.4. Penetapan kadar kalaium .yang larut dari fluorapa -
tit dengan metode spektrofotometri serapan atom.
Dipipet 0,5 ml filtrat setelah uji kelarutan,
kemudian dimasukkan dalam labu ukur 1 0 , 0 ml, ditam-
bah 0 , 5 ml larutan 2 0 % lanthanum oksida dan ditam-
bah air sampai garis tanda. Larutan ini dikocok sam
pai homogen, kemudian disaring dengan kertas What -
man 4 3. Filtrat pertama dibuang, dan filtrat selan-
jutnya ditampung. Filtrat terakhir kemudian diamati
serapannya dengan spektrofotometer serepan atom pa
da panjang gelombang 4 2 2 , 7 nm terhadap blanko larut.
an pereaksi dengan perlakuan yang sama.
4.5. Penetapan kadar fosfat yanft larut dari fluorapatit
dengan apektrofotometri sinar tampak.
Selanjutnya ditambahkan 4*0 ml larutan.ammonium mo-
libdat dan dikocok sampai homogen, kemudian ditam -
bah 0,5 ml larutan stano khlorida* Selanjutnya di -
tambah air sampai garis tanda dan dikocok sampai ho
mogen. Larutan ini diamati serapannya dengan spek -
trofotometer pada panjang gelombang maksimum yang
dihasilkan terliadap blnko larutan pereaksi dangan -
perlakuan yang same.
BAB XV
HASIL PEN13LITIAN
1• Anelisia kualitatif fluorapatit.
1.1. Spektra serapan sinar infra merah fluorapatir de ^
n/y.an metode spektrofotometri infra merah.
Spektra serapan infra merah dari fluorapatit
yang diperoleh adalah seperti tercantum pada gambar
6. Pada bilangan gelombang 900 - 1000 cm-"* terlihat
puncak serapan ion fosfat dan pada bilangan gelom -
bang 3 6 0 0 - 3200 cm""' tidak terlihat adanya puncak
serapan ion hidroksida. Hal ini berarti bahwa kese-
luruhan ion hidroksida telah disubstusi oleh ion -
• fluor, Dengan membandingkan profil spektra serapan
sinar infra merah fluorapatit pada gambar 1 dapat
disirapulkan bahwa zat yang didapat adalah fluorapa
1.2. Analisis kualitatif ion kalsium
Hasil analisis kualitatif ion kalsium dalam
larutan fluorapatit dengan pereaksi asam sulfat
encer, terbentuk endapan kalsium sulfat dengan ben-
tuk kristal seperti gambar berikut (gambar 7 ).
Gambar
7
: kristal kalsium sulfat.Adapun hasil pengendapan dengan asam oksalat"
diperoleh endapan derigan bentuk kristal seperti
Gambar 8 : kristal kalsium oksalat
Hasil reaksi dengan larutan kalium feroeianida terbentuk endapan berwarna putih kekuningan yang
larut dalam asam asetat.
Sedangkan hasil u;ji nyala dengan kawat nikel
terlihat nyala merah kekuningan.
Dari analisis ion kalsium tersebut diatas
dapat disimpulkan bahwa fluorapatit yang diperoleh
Hasil analisis kualitatif ion fosfat dengan
pereaksi "magnesium mixture" diperoleh endapan
magnesium ammonium fosfat yang berwarna putih , dan
terlihat bentuk kristal seperti gambar 9. 1.3. flftalttls kualitatif Ion fosfat.
Hasil reaksi dengan larutan perak nitrat ter -
bentuk endapan berwarna putih dari perak fosfat.
Endapan ini larut dalam larutan asam nitrat dan la
rutan ammonium hidroksida.
Sedangkan hasil reaksi dengan larutan ammonium
moli'bdat terbentuk endapan kuning dari ammonium fos-
fo molibdat.
Dari analisis ion fosfat tersebut diatas dapat
disimpulkan bahwa fluorapatit yang diperoleh mengan-
dung ion fosfat,
1.4. Analisis kualitatif ion fluor.
Hasil analisis kualitatif dengan asam sulfat pes
kat, terlihat kekeruhan pada air didalam pipet.
Dari analisis ion fluor tersebut diatas dapat disim-
pulkan bahwa fluorapatit yang diperoleh mengandung -
ionfluor,
2. Analisis kuantitatif fluorapatit.
2.1. Analisis kuantitatif kalsium dalam fluorapatit.
Denp.an metode spektrofotometri serapan atom.
Persamaan kurva baku kalsium.
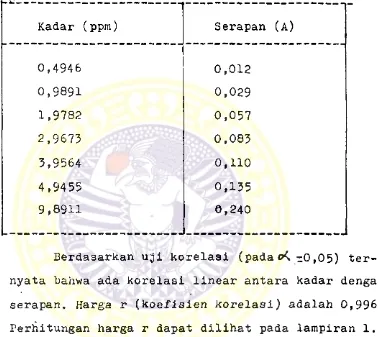
Harga serapan dari berbagai konsentrasi ion -
kelsium dengan spektrofotometri serapan atom pada
panjang gelombang 4 2 2 , 7 nm dapat dilihat pada tabel
SERAPAN DARI BERBAGAI KONSBNTRASI KALSIUM DE
NGAN METODE SPEKTROFOTOMETRI SERAPAN ATOM..
TABEL III.
Kadar (ppm) Serapan (A)
0,4946 0,012
0,9891 0,029
1,9782 0,057
2,9673 0,083
3,9564 0,110
4,9455 0,135
9,8911 e,240
Berdasarkan uji korelasi (pada rO ,05) ter-
nyata bahwa ada korelasi linear antara kadar dengan
serapan, Harga r (koefisien korelasi) adalah 0,9966
Perhitungan harga r dapat dilihat pada lampiran 1.
Selanjutnya dari harga Berapan ion kalsium dapat
dihitung persamaan kurva baku. Perhitungan dapat
dilihat pada lampiran 1. Persamaan kurva baku yang
diperoleh adalah
Hasil penetapan kadar ion kalsiura dalam fluorapatit
dengan metode spektrofotometer serapan atom pada panjang
gelombang /t22,7 nm , dapat dilihat pada tabel IV'.-Penetapan kadar kolgium dalam fluorapatit,
TABEL IV,
HASIL PENETAPAN KADAR KAL3IUM DALAM-FLUORAPATIT W .
NGAN METODE SPEKTROFOTOMETRI SERAPAN ATOM.
Berat penimbangan (‘ mg )
Serapan ( A )
Kadar ion kalsiura ( mmol/gram )
'*9,8 0,073 8,9699
50,1 0,073 9,2122
^0,2 0,076 9,1938
Rata - rata 9,1320
Contoh perhitungannya adalah sebagai berikut.
Y = 0,02Zf1 X + 8,2629 10-5
Y = 0,073
Maka kadar kalsium adalah
2,6862 ug/ml x ^ 2 x ^ x = O . w v mmol
dalarn Zf9 > 8 mg fluorapatit terdapat kalsium dengan kadar
49^8^ ^ x 1000 ~ 6,9899 mraol/gram.
2.2. Analisis kuantitatif fosfat dalam fluorapatit dengan
m e t o d e s p e k t r o f o m e t r i s i n a r t a m p a k .
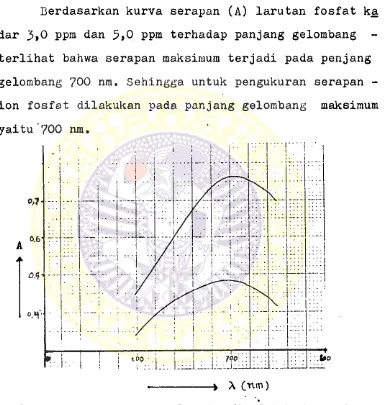
P e n e n t u a n p a n . i a n g g e l o m b a n g m a k s i m u m .
Berdasarkan kurva serapan (A) larutan fosfat ka
dar 3,0 ppm dan 5*0 ppm terhadap panjang gelorabang
terlihat bahwa serapan maksimum terjadi pada penjang
gelombang 700 nm. Sehingga untuk pengukuran serapan -
ion fosfat dilakukan pada panjang gelombang maksimum
yaitu'700 nm.
Gambar 10 : Kurva serapan larutan fosfat kadar 3,0 ppm
dan 5>0 ppm terhadap panjang gelombang(nm).
Persamaan kurva baku fosfat.
Harga serapan dari berbagai konsentrasi ion fosfat
dengan metode spektrofotometri sinar tampak pada panjang
gelombang 700 nm dapat dilihat pada tabel V berikut ini.
: TABEL V
SERAPAN DARI BERBAGAI KONSENTRASI FOSFAT DE -
NGAN METODE SPEKTROFOTOMETRI SINAR TAMPAK,
Kadar ( ppm ) Serapan ( A )
0,5 0,055
1,0 0,168
2,0 0,317
3,0 0 ,W3
kfO 0,591
5,0 0,763
10,0 1,526
Berdasarkan uji korelasi ( padaoC = 0,05 ) ternyata bahwa
ada korelasi linear antara kadar dengan serapan Harga r -
( koefisien korelasi ) adalah 0,9993» Perhitungan kadar r
dauat dilihat pada lampiran 2. Selanjutnya dari harga rata
- rata serapan ion fosfat dapat dihitung persamaairkurva
baku. Perhitungan dapat dilihat pada lampiran 2, Persama
an kurva baku yang diperoleh odalah :
Y = 0,1523 X + 2,7863 • 10~3
P e n e t a p a n k a d a r f o s f a t d o l o r i f l u o r a p a t i t , . .
Hasil penetapan kadar ion fosfat dalam fluorapatit
dengan metode spektrofotometri sinar tampak pada panjang
gelombang 700 nm dapat dilihat pada tabel 'VI
TABEL “VI
HASIL PENETAPAN KADAR FOSFAT DALAM FLUORAPATIT DE~
NGAN METODE .SPEKTROFOTOMETRI SINAR
TAMPAK,-B e r a t p e n i m b a n g a n
( mg )
S e r a p a n
( A )
K a d a r f o s f a t
( m m o l / g r a m )
50,0 0,193 5,3719
49,9 0,191 5,3260
47,9 0,183 5,3125
R a t a - r a t a 5,3368
Contoh perhitungan adalah seperti bcrikut :
Y = 0,1523 X + 2,7863 . 10-3
Y = 0,193
maka kadar fosfat adalah :
1,2 4 8 9 x ^ 2 x 2|0 x _ J _ = o,2686 mmol
dalam 30,0 mg fluorapatit terdapat fosfat dengan kadar
3. Penetapan kadar kalsium .yang larut dari fluorapatit.
Dengan metode spektrofotometri serapan atom.
3.1 * Penetapan kadar kalsium yang larut dalam larutan pe
n.yangga asam asetat berbagai pH.
Hasil penetapan kadar kalsium yang larut da -
. lam larutan penyangga asam asetat pH 3,5 ; pH 4j0 ,
pH 4*5 ; pH 5|0 dan pH 5,5 dapat dilihat pada tabel
VIE Contoh perhitungan kadar kalsium yang larut ada
lah sebagai berikut :
Y = 0,0241 X + 8,2629 . 10~3
Y = 0,137
Maka kadiar kalsium yang larut setiap mg fluorapatit
dalam larutan penyangga asam asetat pH 3,5 adalah
5,3418 ug/ml x x 15 ml
--- :---— = 16,7279 Ug/mg 95,8 mg
Selanjutnya dari kalsium yang larut pada tabel
• VII,dibuat kurva hubungan kadar rata - rata kalsium
yang larut dalem larutan penyangga asam asetat pH
3,5 ; pH 4,0 ; pH 4,5 ; pH 5,0 dan pH 5,5 terhadap-
waktu. ICurva yang didapat seperti terlihat pada gam
bar 11.
Dari gambar 11 dilakukan perhitungan luas da-
erah dibawah kurvn. (.Aig hari/mg ). Hasilnya dapat -
Hasil uji P menunjukkan bahwa harga luas da -
erah dibav/ah kurva dari kalsium yang larut untuk sa
tiap pH larutan penyangga asam asetat menunjukkan -
perbedaan yang bermakna c< a 0,05.
--- ;— ^ V/ aktu ( h a r l)
Ga m b a r 1 1 : K u r v a k a d a r k a l s i u r a y a n g l a r u t r a t a - r a t a d a
. lain larutan ponyang^a asam asctat pH 3»5 ]
pH 4,0 ; pH 4,5 ; pH 5*0 dan pH 5»5 terhadap
LUAS DAERAH DIB AIV AH KURVA (ug hari/rog) DARI KALSIUM YANG
LARUT DALAM LARUTAN PENYANGGA ASAM ASETAT BERBAGAI pH DA
LAM WAKTU 14. HARI.
REPLIKASI * PT* 3,5 ’ pH 4,0 1 pH 4,5 1 pH 5,0 * pH 5,5
1 *290,0822 '238,5431*231, 6767'190,5123' 154,4221
2 *302,704 *236,2451'2 1 0,7102*186,5493' 1 5 4 , 1 2 4 0
3.2. Penetapan kadar kalsium yang larut dalam larutan pe
-nyangga asam asetat berbagai pH dengan penambahan ion
se,ienis fosfat berbagai konaentrasi.
Dengan perhitungan yang sama seperti pada 3 . 1
didapatkan kadar kalsium yang larut dalam larutan pe
nyangga asam asetat pH 3,5 ; pH 4,0 ; pH 4,5 ; pH 5,0
dan pH 5,5 dengan penambahan ion sejenis fosfat
masing-masing dengan konsentrbsi 12 14,5 nig#, dan*i7 %
Hasil perhitungan tercantum pada tabel IX, X dan XI.
Selanjutnya dari data tabel IX, X dan XI dibu-
et kurva hubungan kadar kalsium yang larut dengan pe
nambahan ion sejenia fosfat 12 mg %; 1 4 , 5 mg % dan 17
mg % dalam larutan penyangga asam asetat pH 3,5; pH
4,0 ; pH 4,5 ; pH 5,0 dan pH 5,5 terhadap waktu.
Kurva yang didepat seperti terlihat pada gambar 12 ;
gambar 13 ; gambar 1 4.
....■ ■> Waktu (hari)
■Gambar 12 : Kurva kadar rata rata kalsium yang larut da.
-lam larutan penyangga asam asetat pH 3,5 »pH.4jO;
pH 4*5 ; pH 5,0 dan pH 5,5 dengan penambahan
-ion sejenis fosfat konsentrasi 12 rag %.
.... ■> Waktu (hari)
Gambar 14 : Kurva kadar rata - rata kalsium yang larut da
lam larutan penyan^a asam asetat pH 3,5 *,
pH 4,0 ; pH 4,5 ', pH 5,0 £an pH 5,5 dengan pe