PENENTUAN POHON FILOGENETIK BAKTERI
XILANOLITIK SISTEM ABDOMINAL RAYAP TANAH
BERDASARKAN 16S rRNA
SKRIPSI
SEPTHIA DWI SUKARTININGRUM
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
PENENTUAN POHON FILOGENETIK BAKTERI XILANOLITIK SISTEM ABDOMINAL RAYAP TANAH BERDASARKAN
16S rRNA
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Kimia pada Fakultas Sains dan
Teknologi Universitas Airlangga
Disetujui Oleh :
Pembimbing I,
Prof. Dr. Ni Nyoman Tri Puspaningsih, M.Si NIP. 19630615 198701 2 001
Pembimbing II,
Dr. Ni’matuzahroh
LEMBAR PENGESAHAN SKRIPSI
Judul : Penentuan Pohon Filogenetik Bakteri Xilanolitik Sistem Abdominal Rayap Tanah berdasarkan 16S rRNA Penyusun : Septhia Dwi Sukartiningrum
NIM : 080810518
Pembimbing I : Prof. Dr. Ni Nyoman Tri Puspaningsih, M.Si Pembimbing II : Dr. Ni’matuzahroh
Tanggal seminar : 23 Juli 2012
Disetujui Oleh : Pembimbing I,
Prof. Dr. Ni Nyoman Tri Puspaningsih, M.Si NIP. 19630615 198701 2 001
Pembimbing II,
Dr. Ni’matuzahroh
NIP. 19680105 199203 2 003
Mengetahui,
Ketua Program Studi S1 Kimia Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
Dr. Alfinda Novi Kristanti, DEA NIP. 19671115 199102 2 001
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan Universitas Airlangga. Diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan seijin penulis dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
KATA PENGANTAR
Puji syukur kehadirat Allah S.W.T yang telah melimpahkan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan skripsi yang berjudul “Penentuan Pohon Filogenetik Bakteri Xilanolitik Sistem Abdominal
Rayap Tanah berdasarkan 16S rRNA”
Skripsi ini dibuat untuk memenuhi persyaratan akademis pendidikan sarjana sains dalam bidang kimia Fakultas Sains dan Teknologi Universitas Airlangga.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Prof. Dr. Ni Nyoman Tri Puspaningsih, M.Si selaku dosen pembimbing I atas bimbingan dan nasehatnya selama penyusunan dan penyelesaian skripsi ini, 2. Dr. Ni’matuzahroh selaku dosen pembimbing II atas bantuan dan kesabaran
dalam memberikan bimbingan kepada penulis,
3. Dr. Sri Sumarsih, M.Si selaku penguji I atas nasehat dan sarannya kepada penulis,
4. Drs. Hamami, M.Si selaku penguji II atas saran dan masukannya kepada penulis,
5. Dra. Aning Purwaningsih, M.Si selaku dosen wali atas kesabaran, saran, dukungan serta bimbingannya kepada penulis,
6. Dr. Alfinda Novi Kristanti, DEA selaku Ketua Departemen Kimia yang telah memberikan fasilitas serta arahan selama penyusun belajar di Departemen Kimia,
7. Bapak dan ibu dosen Departemen Kimia Universitas Airlangga yang telah senantiasa membagikan ilmu dan nasehat kepada penulis,
8. Bapak dan ibu selaku orang tua yang memberikan kasih sayang, doa, kepercayaan, dan dukungan baik secara moril maupun materi,
9. Ibu A.A. Istri Ratna Dewi yang telah menemani dan memberi saran saat penelitian,
10. Seluruh keluarga besar Departemen Kimia dan FSAINTEK yang telah memberikan banyak ilmu, nasehat, dan dukungan,
11. Teman-teman satu penelitian (Amaliah dan Previta) yang telah banyak membantu dalam mengerjakan penelitian, memberi saran dan dukungan yang sangat berharga, memberi keceriaan serta hiburan ketika penulis bersedih, 12. Sahabat-sahabat tercinta (Laudita, Faya, Yudistia, Yudha, Dyah Respati,
Mella, Mala) yang telah sabar menampung dan mendengarkan segala keluh kesah dan isak tangis, memberi saran dan dukungan, serta memberikan tempat berteduh ketika penulis lelah,
13. Teman-teman seperjuangan Biokimia (Resti, Siska, Dita, dan seluruh anggota Biokim BLAST) atas bantuan, dukungan, dan semangat yang diberikan kepada penulis selama pengerjaan skripsi ini,
14. Teman–teman S1 Kimia angkatan 2008 yang senantiasa menemani dalam menuntut ilmu, memberikan banyak dukungan serta semangat selama penulis menjalankan masa pendidikan S1 di Universitas Airlangga,
15. Kakak-kakak di laboratorium Proteomik, TDC (mbak Nita, mbak One, mbak Laura, mas Ivan, mbak Titin) atas kesabaran dalam membagikan ilmu dan menuntun penulis dari awal sampai akhir penelitian,
16. Serta pihak–pihak yang tidak dapat disebutkan satu persatu yang banyak memberikan saran, masukan, dan pengalamannya,
Penulis menyadari bahwa masih terdapat banyak kekurangan dalam penyusunan skripsi ini, oleh karena itu kritik dan saran yang besifat membangun untuk kesempurnaan penulisan skripsi ini sangat diperlukan. Semoga skripsi ini dapat bermanfaat bagi semua pihak.
Surabaya, Juli 2012 Penulis,
Sukartiningrum, S.D., 2012, Penentuan Pohon Filogenetik Bakteri Xilanolitik Sistem Abdominal Rayap Tanah berdasarkan 16S rRNA. Skripsi ini di bawah bimbingan Prof. Dr. Ni Nyoman Tri Puspaningsih, M.Si., dan Dr. Ni’matuzahroh, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
ABSTRAK
Penelitian bertujuan untuk mengetahui hubungan kekerabatan bakteri xilanolitik isolat B dan 7 penghasil endo-β-1,4-xilanase hasil isolasi dari sistem abdominal rayap tanah Macrotermes sp. Identifikasi dilakukan dengan cara mendesain pohon filogenetik berdasarkan sekuen gen penyandi 16S rRNA. Sekuen gen penyandi 16S rRNA didapatkan dengan cara mengamplifikasi gen penyandi 16S rRNA menggunakan teknik PCR. Amplifikasi gen penyandi 16S rRNA menggunakan primer forward B27F dan primer reverse U1492R. Dari proses amplifikasi gen penyandi 16S rRNA dengan teknik PCR, didapatkan sekuen gen penyandi 16S
rRNA milik bakteri xilanolitik isolat B dan isolat 7 sebesar 1460 bp dan 1423 bp.
Desain pohon filogenetik menunjukkan bahwa bakteri xilanolitik sistem abdominal rayap tanah isolat B mempunyai hubungan kekerabatan terdekat dengan Bacillus anthracis dan bakteri xilanolitik sistem abdominal rayap tanah isolate 7 mempunyai hubungan kekerabatan terdekat dengan Escherichia fergusonii.
Sukartiningrum, S.D., 2012, Determination of Phylogenetic Tree of Xylanolitic Bacteria Abdominal System Soil Termite based on 16S rRNA. This script is supervised by Prof. Dr. Ni Nyoman Tri Puspaningsih, M.Si., and Dr. Ni’matuzahroh, Department of Chemistry, Faculty of Science and Technology, Airlangga University, Surabaya.
ABSTRACT
The purpose of research is to determine the relationship of isolates B and 7 from endo-β-1,4-xylanase-producing xylanolitic bacteria. Identification was done by designed a phylogenetic tree based on molecular identification of genes encoding 16S rRNA. Sequences of genes encoding 16S rRNA can be obtained by amplification of genes encoding 16S rRNA using PCR technique. Amplification for 16S rRNA gene encoding using B27F forward primer and U1492R reverse primer. From gene coding for 16S rRNA amplification by PCR technique, it has been found the sequences of gene encoding 16S rRNA sequences belonging xylanolitic isolates B and isolates 7 of 1460 bp and 1423 bp. Design of a phylogenetic tree showed that the xylanolitic bacteria abdominal system soil termite isolate B has a closest relathionship with Bacillus anthracis and the xylanolitic bacteria abdominal system soil termite isolate 7 has a closest relathionship with Escherichia fergusonii.
DAFTAR ISI
HALAMAN JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
LEMBAR PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR ... v
ABSTRAK ... viii
ABSTRACT ... ix
DAFTAR ISI ... x
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN 1.1 Latar Belakang Masalah ... 1
1.2 Rumusan Masalah ... 4
1.3 Tujuan Penelitian ... 4
1.4 Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA 2.1 Keberadaan Mikroorganisme Penghasil Xilanase pada Rayap ... 6
2.1.1 Protozoa pada rayap... 6
2.1.2 Bakteri pada rayap ... 6
2.2 Xilanase... 7
2.2.1 Endo-β-1,4-xilanase……….... 7
2.3 Identifikasi Bakteri ... 8
2.3.1 Ribosom RNA ... 9
2.3.1.1 16S rRNA ... 10
2.3.1.2 Primer universal 16S rRNA ... 11
2.4 Pohon Filogenetik ... 12
2.4.1 Struktur pohon filogenetik... 12
2.4.2 Program BLAST sebagai penunjang pembuatan pohon filogenetik ... … 13
2.5 Polymerase Chain Reaction (PCR) ... 14
2.5.1 Komponen PCR ... 14
2.5.2 Tahapan PCR ... 14
2.5.3 Aplikasi teknik PCR ... 16
2.6 Elektroforesis Gel Agarosa ... 17
BAB III METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian ... 20
3.2 Sampel dan Bahan Penelitian ... 20
3.2.1 Sampel penelitian ... 20
3.2.2 Bahan penelitian ... 20
3.3 Alat Penelitian ... 21
3.4 Diagram Alir Penelitian ... 22
3.5 Prosedur Penelitian ... 23
3.5.1 Pembuatan larutan... 3.5.1.1 Pembuatan 50 mM bufer TE ... 23
3.5.1.2 Pembuatan 3 M Na-asetat ... 23
3.5.1.3 Pembuatan bufer Loading Dye ... 24
3.5.1.4 Pembuatan bufer TAE ... 24
3.5.2 Pembuatan media Luria-Bertani padat dan cair ... 24
3.5.3 Peremajaan bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7... 25
3.5.4 Perbanyakan sel dan isolasi DNA kromosom bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7 ... 25
3.5.5 Penentuan konsentrasi DNA kromosom ... 26
3.5.6 Elektroforesis gel agarosa ... 27
3.5.7 Proses amplifikasi gen penyandi 16S rRNA dengan teknik PCR ... 27
3.5.8 Sekuensing gen penyandi 16S rRNA ... 28
3.5.9 Desain pohon filogenetik ... 28
BAB IV HASIL DAN PEMBAHASAN 4.1 Isolasi DNA Kromosom Bakteri Xilanolitik Sistem Abdominal Rayap Tanah Isolat B dan Isolat 7 ... 30
4.2 Amplifikasi Gen Penyandi 16S rRNA dengan Teknik PCR ... 31
4.3 Desain Pohon Filogenetik Bakteri Xilanolitik Sistem Abdominal Rayap Tanah Isolat B dan Isolat 7 ... 35
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 45
5.2 Saran ... 45
DAFTAR PUSTAKA ... 46 LAMPIRAN
DAFTAR TABEL
Nomor Judul Tabel Halaman
2.1 Komposisi ribosom pada prokaryot dan eukaryot... 9 2.2 Primer universal untuk amplifikasi 16S rRNA... 12 2.3 Macam-macam bufer elektroforesis... .. 18 4.1 Hasil BLAST bakteri xilanolitik sistem abdominal rayap tanah
isolat B……….. 38 4.2 Hasil BLAST bakteri xilanolitik sistem abdominal rayap tanah
DAFTAR GAMBAR
Nomor Judul Gambar Halaman
2.1 2.2 2.3 2.4 2.5 2.6 4.1 4.2 4.3 4.4 4.5
Sistem enzimatis dan aspek metabolisme rayap…...………. Enzim xilanolitik pada xilan tumbuhan ……… Struktur 16S rRNA………... Struktur pohon filogenetik ………...……. (a) Reaksi PCR, (b) Alat PCR ………….………..… (a) Gel agarosa, (b) Alat elektroforesis …...……….. Elektroforesis hasil isolasi DNA kromosom (A) isolat A, (B) isolat B, (7) isolat 7 ... Elektroforesis hasil amplifikasi gen penyandi 16S rRNA bakteri xilanolitik sistem abdominal rayap tanah dengan primer B27F dan U1492R suhu 530 C. Lajur 1 adalah pita DNA gen penyandi 16S rRNA isolat B; 2 adalah GeneRulerTM 1 kb DNA ladder; 3 adalah pita DNA gen penyandi 16S rRNA isolat 7………... Desain pohon filogenetik bakteri xilanolitik sistem abdominal rayap tanah isolat B……….………. Desain pohon filogenetik bakteri xilanolitik sistem abdominal rayap tanah isolat 7………..………. Desain pohon filogenetik bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7……….. 7 8 11 13 16 19 30 34 40 40 41
DAFTAR LAMPIRAN
Nomor Judul
1 Perhitungan Pembuatan Media Luria-Bertani Padat dan Cair 2 Perhitungan Pembuatan Larutan untuk Isolasi DNA Kromosom 3 Perhitungan Pembuatan Larutan dan Bahan untuk Elektroforesis 4 Perhitungan Larutan Kerja untuk Reaksi PCR
5 Proses Alignment Sekuen Gen Penyandi 16S rRNA Bakteri Xilanolitik Menggunakan Program Clone Manager
6 Proses Pelacakan Sekuen Gen Penyandi 16S rRNA Bakteri Xilanolitik dengan Sekuen Gen Penyandi 16S rRNA Bakteri Lain di Genbank
7 Proses Multiple Sequence Alignmet dari Data BLAST yang Diperoleh dengan Menggunakan Program ClustalW dan MEGA5 8 Proses Pendesainan Pohon Filognetik Menggunakan Program
DAFTAR LAMPIRAN
Nomor Judul
1 Perhitungan Pembuatan Media Luria-Bertani Padat dan Cair 2 Perhitungan Pembuatan Larutan untuk Isolasi DNA Kromosom 3 Perhitungan Pembuatan Larutan dan Bahan untuk Elektroforesis 4 Perhitungan Larutan Kerja untuk Reaksi PCR
5 Proses Alignment Sekuen Gen Penyandi 16S rRNA Bakteri Xilanolitik Menggunakan Program Clone Manager
6 Proses Pelacakan Sekuen Gen Penyandi 16S rRNA Bakteri Xilanolitik dengan Sekuen Gen Penyandi 16S rRNA Bakteri Lain di Genbank
7 Proses Multiple Sequence Alignmet dari Data BLAST yang Diperoleh dengan Menggunakan Program ClustalW dan MEGA5 8 Proses Pendesainan Pohon Filognetik Menggunakan Program
BAB II
TINJAUAN PUSTAKA
2.1 Keberadaan Mikroorganisme Penghasil Xilanase pada Rayap
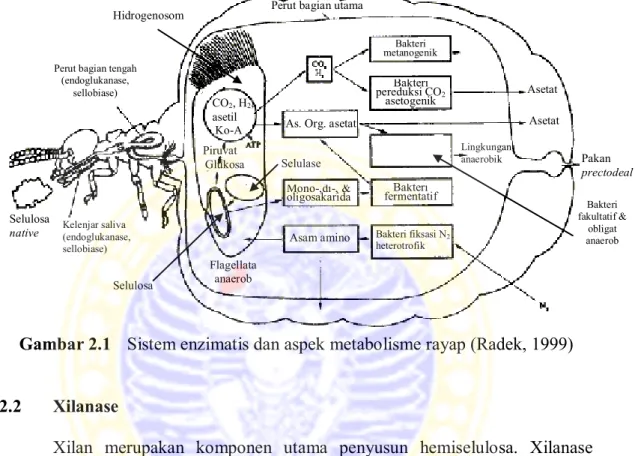
Rayap termasuk serangga perusak kayu yang sangat potensial karena rayap dapat mencerna material-material yang terkandung di dalam kayu. Material-material tersebut berupa selulosa, hemiselulosa, dan lignin. Adanya kemampuan pencernaan khusus tersebut dikarenakan di dalam sistem pencernaan rayap terdapat suatu mikroorganisme khusus yang membantu mencerna dan merombak material-material tersebut (Setford, 2005) (Gambar 2.1). Mikroorganisme tersebut antara lain metazoa, protozoa atau protista, bakteri, dan fungi (Purwadaria dkk., 2004). Enzim yang berfungsi untuk mencerna dan merombak hemiselulosa adalah enzim xilanolitik. Mikroorganisme penghasil enzim xilanolitik tersebut dapat juga ditemukan di dalam sistem pencernaan rayap.
2.1.1 Protozoa pada rayap
Protozoa dapat ditemukan di dalam sistem pencernaan rayap jenis
Mastotermitidae, Kalotermitidae, dan Rhinotermitidae. Protozoa tersebut
berperan dalam melumatkan selulosa sehingga dapat dicerna dan diserap oleh rayap.
2.1.2 Bakteri pada rayap
Pada rayap famili Termitidae (Macrotermes, Odontotermes, dan
Microtermes), mikroorganisme yang berperan untuk melakukan perombakan
yang berperan sebagai penghasil enzim xilanolitik, yaitu Bacillus sp. (Shimizu et
al., 1998) dan Bacillus pumilus (Purwadaria dkk., 2004).
Gambar 2.1 Sistem enzimatis dan aspek metabolisme rayap (Radek, 1999) 2.2 Xilanase
Xilan merupakan komponen utama penyusun hemiselulosa. Xilanase merupakan enzim ekstraseluler yang menghidrolisis polisakarida β-1,4-xilan yang merupakan komponen utama hemiselulosa pada tumbuhan. Berdasarkan substrat yang dihidrolisis, xilanase dapat diklasifikasikan sebagai β-1,4-xilosidase, eksoxilanase, dan endo-β-1,4-xilanase (endoxilanase) (Richana, 2002). Gambar 2.2 menunjukkan sisi pemotongan rantai xilan dari enzim-enzim xilanolitik.
2.2.1 Endo-β-1,4-xilanase
Endo-β-1,4-xilanase merupakan salah satu kelompok xilanase yang mampu menguraikan rantai utama xilan menjadi xilooligosakarida rantai pendek dan xilosa dan juga mampu memutus ikatan β-1,4 pada bagian dalam rantai xilan
Selulosa
native Kelenjar saliva (endoglukanase,
sellobiase) Perut bagian tengah
(endoglukanase, sellobiase)
Perut bagian utama
Flagellata anaerob Asam amino Hidrogenosom CO2, H2, asetil Ko-A Piruvat Glukosa Selulase Selulosa
As. Org. asetat
Mono-,di-, & oligosakarida Bakteri metanogenik Bakteri pereduksi CO2 asetogenik Asetat Asetat Pakan prectodeal Lingkungan anaerobik Bakteri fakultatif & obligat anaerob Bakteri fermentatif Bakteri fiksasi N2 heterotrofik
secara teratur (Bravman et al, 2001). Ikatan yang diputus ditentukan berdasarkan panjang rantai substrat, derajat percabangan, ada tidaknya gugus substitusi, dan pola pemutusan dari enzim hidrolase (Richana, 2002).
Gambar 2.2 Enzim xilanolitik pada xilan tumbuhan (Collins et al., 2005) 2.3 Identifikasi Bakteri
Proses identifikasi bakteri mengalami perkembangan dari tahun ke tahun. Pada awal perkembangannya, pengklasifikasian bakteri hanya didasarkan pada morfologinya. Dari identifikasi morfologi inilah muncul nama-nama bakteri seperti Bacillus, Coccus, Streptococcus, dan lain-lain. Pada tahap perkembangan selanjutnya, pengklasifikasian bakteri menggunakan metode pendekatan fisiologi. Sistem penamaan bakteri yang didasarkan pada penggabungan sifat morfologi dan fisiologi menjadi semakin sulit dan kompleks, sehingga dilakukan perkembangan pengklasifikasian lebih lanjut.
Pada tahun 1940-an muncul metode pengklasifikasian bakteri secara molekular dengan pendekatan genetik. Pendekatan genetik digunakan untuk mengukur kedekatan dan kekerabatan antara isolat-isolat bakteri. Proses pengklasifikasian tersebut terus dikembangkan sampai akhirnya ditemukan metode baru, yaitu metode analisis urutan DNA yang menyandi gen 16S rRNA
(Murray and Holt in Boone et al., 2001). Metode ini digunakan untuk menentukan kebaharuan isolat bakteri yang ditemukan dari alam.
2.3.1 Ribosom RNA
Ribosom merupakan organel kecil dan padat dalam sel yang terdiri atas protein dan molekul RNA (ribonucleic acid). Ribosom berfungsi dalam proses translasi (sintesis protein). Suatu sel dapat mengandung sampai 10.000 ribosom sehingga massa selnya dapat mencapai 40% dari massa total sel bakteri (Yuwono, 2007). Ribosom RNA merupakan molekul yang sempurna karena mempunyai fungsi yang konstan pada tiap organisme, tersebar secara universal, dan mempunyai urutan sekuen yang terkonservasi dengan baik diantara anggota filogenetik yang luas (Madigan et al., 2000).
Ribosom disusun oleh molekul-molekul RNA dan beberapa macam protein. Ribosom tersusun atas dua subunit, yaitu subunit kecil dan subunit besar.
Tabel 2.1 Komposisi ribosom pada prokaryot dan eukaryot (Yuwono, 2007)
Subunit RNA Protein
Prokaryot 30S 50S 16S 5S 23S 21 macam 31 macam Eukaryot 40S 60S 18S 5S 5,8S 28S 33 macam 49 macam
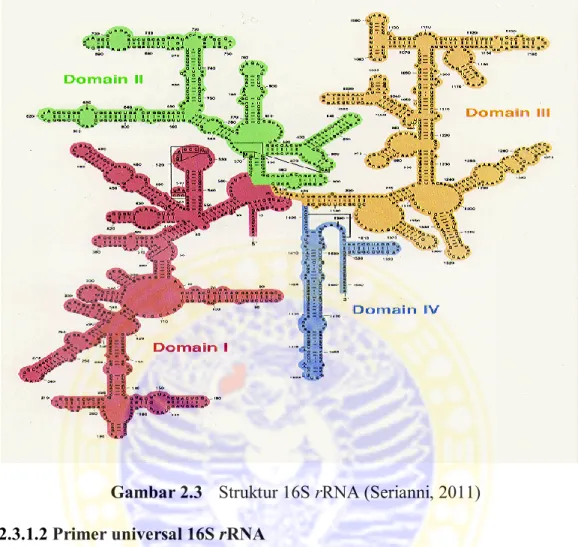
Molekul 16S rRNA mempunyai ukuran sekuen 1541 bp (Gambar 2.3), molekul 23S rRNA mempunyai ukuran sekuen 2904 bp, dan molekul 5S rRNA mempunyai ukuran sekuen 120 bp.
Carl Woese (1967) menampilkan tiga domain dari “theory of life” berdasarkan gen yang mengkode ribosom RNA, meliputi eubacteria, archaea, dan eukariot. Gen yang mengkode ribosom RNA bersifat conserved (dipertahankan) oleh suatu spesies dan tersebar di seluruh organisme. Urutan DNA pengkode
rRNA, yaitu rDNA, digunakan untuk merekonstruksi filogenetik,
mengidentifikasi golongan taksonomi suatu organisme, memperkirakan hubungan suatu golongan dengan golongan lainnya, serta mengestimasi tingkat perbedaan suatu spesies dengan spesies lainnya. Ribosom DNA (rDNA) ini penting dalam pembuatan pohon filogenetik yang berkaitan dengan evolusi.
2.3.1.1 16S rRNA
16S RNA ribosom atau 16S rRNA adalah komponen dari subunit kecil 30S pada ribosom prokariot. Sekuen dari 16S rRNA mencapai 1500 bp. Sekuen basa tersebut digunakan untuk merekonstruksi filogeni. 16S rRNA mempunyai fungsi, antara lain menerjemahkan posisi protein dari ribosom, berinteraksi dengan 23S dan membantu dalam pengikatan dua subunit ribosom yaitu unit 50S dan 30S, serta menstabilkan pasangan kodon-antikodon melalui pembentukan ikatan hidrogen antara atom N1 dari adenine dengan 'OH pada mRNA.
Gen 16S rRNA digunakan untuk mempelajari filogenetik dari bakteri maupun archaea karena kedua mikroorganisme tersebut mempunyai hubungan kekerabatan yang sangat dekat (Weisburg et al., 1991; Coenye et al., 2003).
Gambar 2.3 Struktur 16S rRNA (Serianni, 2011) 2.3.1.2 Primer universal 16S rRNA
Analisis 16S rRNA dilakukan dengan bantuan primer universal. Primer
universal menargetkan dan memperkuat wilayah lestari gen 16S rRNA agar dapat
mengamplifikasi seluruh urutan 16S rRNA secara lengkap. Primer universal terdiri dari primer forward (mengamplifikasi bagian awal) dan primer reverse (mengamplifikasi bagian akhir) (Huber et al., 2002). Pasangan primer universal yang umum digunakan adalah B27F dan U1492R (Tabel 2), yang dirancang oleh Weisburg et al (1991).
Tabel 2.2 Primer universal untuk amplifikasi 16S rRNA (Weidner et al., 1996) Nama Primer Urutan (5' 3')
B27F AGA GTT TGA TCC TGG CTC AG
U1492R GGT TAC CTT GTT ACG ACT T
928F TAA AAC TYA AAK GAA TTG ACG GG
336R ACT GCT GCS YCC CGT AGG AGT CT
1100F YAA CGA GCG CAA CCC
1100R GGG TCG TTG LKP TTG
337F GAC TAC TCC GGG AGG CWG CAG
907R CCG TCA ATT CCT TTR AGT TT
785F GGA TTA GAT ACC CTG GTA
805R GAC TAC CAG GGT ATC TAA TC
533F GTG CCA GCM GCC GCG GTA A
518R GTA TTA CCG CGG CTG CTG G
2.4 Pohon Filogenetik
Dalam ilmu biologi, filogeni atau filogenesis adalah kajian mengenai hubungan antara kelompok-kelompok organisme yang dikaitkan dengan proses evolusi. Filogenetik merupakan ilmu yang mempelajari hubungan evolusi beberapa kelompok organisme yang berbeda (contohnya spesies atau populasi). Dalam studi filogenetik, cara yang paling tepat untuk menghubungkan beberapa kelompok organisme adalah dengan membuat atau mendesain pohon filogenetik. Pohon filogenetik digunakan untuk membatasi taksa masing-masing kelompok individu yang saling terhubung.
2.4.1 Struktur pohon filogenetik
Sebuah pohon filogenetik terdiri dari node dan cabang. Masing-masing
node mewakili unit taksonomi berupa individu, spesies, dan populasi.
pohon filogenetik dapat menghubungkan dua node yang mempunyai kekerabatan. Pola percabangan pohon ini disebut topologi.
Gambar 2.4 Struktur pohon filogenetik (Theobald, 2004)
Struktur pohon filogenetik pada Gambar 2.4 di atas terdiri dari root,
branch, node, branch length, dan clade. Root merupakan nenek moyang semua
taksa. Branch mendefinisikan hubungan antara taksa. Node mewakili unit taksonomi dan dapat berupa suatu spesies yang telah ada. Branch Length mewakili jumlah perubahan yang telah terjadi. Clade berupa kelompok dua taksa atau lebih.
2.4.2 Program BLAST sebagai penunjang pembuatan pohon filogenetik
Program BLAST dapat digunakan untuk membandingkan urutan terpenting dari semua urutan yang tersimpan dalam GenBank maupun NCBI. Jika nama ilmiah atau hubungan kekerabatan suatu organisme tidak diketahui, NCBI menyediakan link langsung ke beberapa organisme yang umum digunakan dalam proyek penelitian molekular.
2.5 Polymerase Chain Reaction (PCR)
Polymerase chain reaction atau reaksi rantai polimerase adalah teknik
ilmiah dalam biologi molekular yang digunakan untuk mengamplifikasi beberapa basa DNA menjadi ribuan sampai jutaan kopi basa. PCR dikembangkan oleh Kary Mullis pada 1983 (Bartlett et al., 2003). Reaksi PCR merupakan reaksi replikasi DNA yang terjadi di luar tubuh makhluk hidup.
2.5.1 Komponen PCR
Reaksi polymerase chain reaction membutuhkan beberapa komponen. Komponen-komponen tersebut meliputi primer, dNTP, bufer, kation divalen, DNA cetakan, dan DNA polimerase.
Primer adalah sepasang DNA untai tunggal atau oligonukleotida rantai pendek yang menginisiasi gen DNA target. dNTP alias building blocks berfungsi sebagai ‘batu bata’ penyusun DNA yang baru. dNTP terdiri atas 4 macam sesuai dengan basa penyusun DNA, yaitu dATP, dCTP, dGTP, dan dTTP. Bufer berfungsi untuk mengkondisikan reaksi dan menyediakan lingkungan kimia yang cocok agar PCR berjalan optimum dan menstabilkan DNA polimerase. Kation divalen yang umum digunakan dalam reaksi PCR adalah magnesium (Mg2+). Kation divalen berfungsi sebagai kofaktor DNA polimerase. DNA cetakan merupakan sumber gen DNA target. DNA polimerase berfungsi sebagai enzim. DNA polimerase mempunyai suhu optimal sekitar 700C (Sambrook et al., 2001).
2.5.2 Tahapan PCR
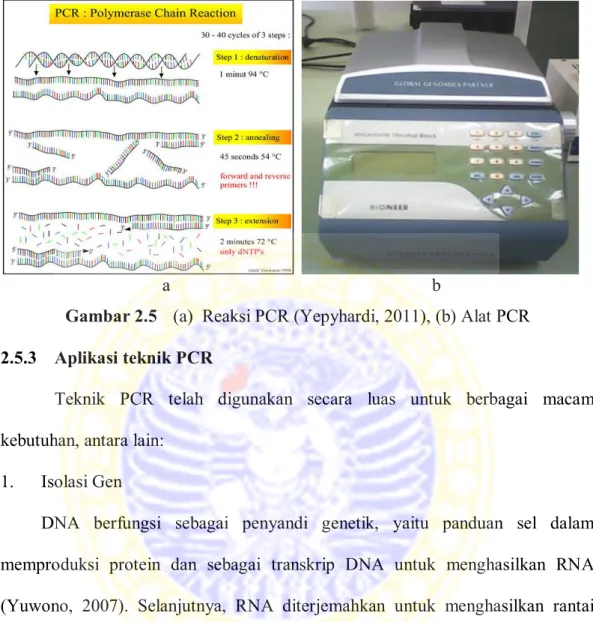
Reaksi PCR dilakukan dalam sebuah alat pengendali suhu yang dapat memanaskan dan mendinginkan tabung reaksi dalam waktu singkat (Gambar
2.5(b)). Reaksi PCR mempunyai siklus optimal antara 20 - 40 siklus, dimana masing-masing siklus terdiri dari 2 - 3 suhu berbeda (Rychlik et al., 1990). Reaksi PCR mempunyai beberapa tahapan, antara lain inisiasi, denaturasi, annealing,
extension, dan elongasi akhir (Gambar 2.5(a)).
Tahap inisiasi dilakukan pada suhu 94- 960 C selama untuk 1 - 9 menit. Tahap denaturasi dilakukan pada suhu 94- 980 C selama 30 - 60 detik. Pada suhu ini, DNA untai ganda akan memisah menjadi DNA untai tunggal. Tahap
annealing merupakan tahap yang memberikan kesempatan bagi primer untuk
menempel pada DNA cetakan di tempat yang komplemen dengan sekuen primer. Suhu reaksi yang dipakai pada saat annealing berkisar antara 50- 650 C selama 20 - 40 detik. Biasanya suhu annealing diturunkan tiga sampai lima derajad celcius di bawah Tm dari primer yang digunakan. Perpanjangan atau extension adalah tahapan dimana DNA polimerase akan mensintesis untai DNA baru untuk melengkapi untai DNA cetakan (DNA template) dengan menambahkan dNTP dalam arah 5' ke 3'. Suhu yang umum dipakai pada tahap extension adlah 720C.
Elongasi akhir merupakan tahap paling akhir dalam reaksi PCR. Tahap ini terjadi
setelah semua siklus PCR terpenuhi. Tahap elongasi akhir berfungsi untuk memastikan bahwa setiap DNA untai tunggal yang tersisa telah diperpanjang seluruhnya. Suhu yang umum digunakan pada tahap ini berkisar antara 70- 740 C selama 5 - 15 menit (Sharkey et al., 1994).
a b
Gambar 2.5 (a) Reaksi PCR (Yepyhardi, 2011), (b) Alat PCR 2.5.3 Aplikasi teknik PCR
Teknik PCR telah digunakan secara luas untuk berbagai macam kebutuhan, antara lain:
1. Isolasi Gen
DNA berfungsi sebagai penyandi genetik, yaitu panduan sel dalam memproduksi protein dan sebagai transkrip DNA untuk menghasilkan RNA (Yuwono, 2007). Selanjutnya, RNA diterjemahkan untuk menghasilkan rantai asam amino atau protein.
Untuk mengisolasi gen, diperlukan DNA yang dikenal dengan nama ‘probe’. DNA probe memiliki urutan basa nukleotida yang sama dengan gen target yang akan diisolasi. Probe dibuat dengan teknik PCR dengan menggunakan primer yang sesuai dengan gen tersebut.
2. Sekuensing DNA
termination method) yang sudah dimodifikasi menggunakan dye-dideoxy
terminator, dimana pada proses awal reaksi PCR hanya menggunakan satu primer dan tambahan dideoxynucleotide yang diberi label fluorescent. Warna fluorescent setiap basa berbeda. Perbedaan warna tersebut digunakan untuk membedakan dan menentukan urutan basa suatu DNA yang tidak diketahui.
2.6 Elektroforesis Gel Agarosa
Menurut Yuwono (2007), elektroforesis adalah suatu teknik pemisahan molekul sel berdasarkan massa dan bentuk molekulnya dengan menggunakan medan listrik yang dialirkan pada suatu medium yang mengandung sampel yang akan dipisahkan. Elektroforesis memanfaatkan muatan listrik yang ada pada makromolekul, yaitu DNA yang bermuatan negatif. Jika molekul yang bermuatan negatif dilewatkan melalui suatu medium, kemudian dialiri arus listrik dari kutub positif ke kutub negatif, maka molekul tersebut akan bergerak dari kutub negatif ke kutub positif.
Teknik elektroforesis dapat digunakan untuk menganalisis DNA, RNA, maupun protein. Elektroforesis DNA digunakan untuk menganalisis fragmen-fragmen DNA hasil pemotongan enzim restriksi, hasil isolasi DNA kromosom, produk PCR, dan lain sebagainya. Elektroforesis DNA memerlukan gel agarosa (Gambar 2.6(a)). Agarosa merupakan suatu bahan semi-padat berupa polisakarida yang diekstraksi dari rumput laut.
Gel agarosa dibuat dengan melarutkan serbuk agarosa dalam suatu bufer dan dibantu pemanasan. Jenis bufer yang digunakan untuk melarutkan agarosa ada
beberapa macam. Macam-macam bufer yang digunakan untuk elektroforesis dan melarutkan agarosa dapat dilihat pada Tabel 2.3.
Tabel 2.3 Macam-macam bufer elektroforesis (Sambrook, 2001)
Buffer Working solution Concentrated stok solution (per
liter) Tris-acetate (TAE) 1x : 0.04 M Tris-acetate 0.001 M EDTA 50x : 242 g Tris base
57.1 mL glacial acetic acid 100 mL 0.5 M EDTA (pH 8.0) Tris-phosphate (TPE) 1x : 0.09 M Tris-phospate 0.002 M EDTA 10x : 108 g Tris base 15.5 mL 85% phosphoric acid (1.679 g/mL) 40 mL 0.5 M EDTA (pH 8.0) Tris-borate (TBE) 0.5x : 0.045 M Tris-borate 0.001 M EDTA 5x : 54 g Tris base 27.5 g boric acid 20 mL 0.5 M EDTA (pH 8.0) Alkaline 1x : 50 mN NaOH 1 mM EDTA 1x : 5 mL 10 N NaOH 2 mL 0.5 M EDTA (pH 8.0) Tris-glycine 1x : 25 mM Tris 250 mM glycine 0.1% SDS 5x : 15.1 g Tris base 94 g glycine (electrophoresis grade) (pH 8.3) 50 mL 10% SDS (electrophoresis grade)
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Februari 2012 sampai dengan Juni 2012 di Laboratorium Proteomik, ITD, Universitas Airlangga.
3.2 Sampel dan Bahan Penelitian 3.2.1 Sampel penelitian
Sampel penelitian ini adalah isolat bakteri xilanolitik sistem abdominal rayap tanah (isolat A, isolat B, dan isolat 7) yang merupakan koleksi bakteri xilanolitik milik Ratnadewi dkk (2007).
3.2.2 Bahan penelitian
Bahan- bahan yang digunakan dalam penelitian ini adalah HCl, EDTA, Na-asetat, asam asetat glasial, sukrosa, NaCl, MgSO4, NaOH, Sodium Dodecyl
Sulfat (SDS), Bacto Agar, Tryptone, Yeast Extract, agarosa, etanol absolut, etanol
70%, fenol, tris-base (H2NC(CH2OH)3), Bromophenol Blue (C19H10Br4O5S, BPB), lisosim, proteinase K, Taq polymerase, bufer Taq 10x, dNTP, MGSO4, primer B27F, primer U1492R, dan GeneRuler™ 1 Kb Ladder (Intron).
3.3 Alat Penelitian
Peralatan yang digunakan dalam penelitian ini adalah autoklaf (TOMY
High-Pressure Steam Strelizer ES-315), laminair air flow cabinet (Kottermann
8580), sentrifuga Hermle (tipe Z 400 K), timbangan analitik (Ohaus Gold Series), pH meter (Metro-ohm 744), oven (Memmert, Jerman), lemari pendingin -200C (Samsung Sansio SCF-240), pipet mikro (Eppendorf), waterbath (Gemmyco YCW-010), thermoshake (Gerhardt), alat PCR Thermal Cycler (Bioneer MyGenie96 Thermal Block), Nanodrop (Spectrophotometer ND-1000), seperangkat alat elektroforesis (Life Technologies model 250) dengan power
supply, UV transluminator, peralatan gelas yang lazim digunakan di laboratorium,
kamera digital, dan Notebook A*Note Centurion C-9462 dengan spesifikasi Intel
3.4 Diagram Alir Penelitian
Isolasi DNA kromosom bakteri xilanolitik sistem abdominal rayap tanah isolat A, B, dan 7
Penentuan konsentrasi dan kemurnian DNA kromosom
Amplifikasi gen 16S rRNA dengan teknik PCR
Elektroforesis gel agarosa
Sequensing produk PCR
Desain pohon filogenetik
Peremajaan bakteri xilanolitik sistem abdominal rayap tanah isolat A, B, dan 7
3.5 Prosedur Penelitian 3.5.1 Pembuatan larutan
Pembuatan larutan meliputi pembuatan 0,05 M bufer TE (bufer Tris-Cl, EDTA), 3 M Na-asetat, bufer Loading Dye, bufer TAE (Tris-asetat EDTA).
3.5.1.1 Pembuatan 50 mM bufer TE
0,05 M bufer TE dibuat dari larutan stok 0,5 M tris-Cl pH 8 dan 0,5 M EDTA pH 8.
Larutan stok 0,5 M tris-Cl pH 8 dibuat sebanyak 50 mL. Ditimbang 3,0285 gr tris-base kemudian dilarutkan dalam 25 mL akuades. Selanjutnya ditambahkan HCl 1 M dan diukur pH-nya sampai mencapai pH 8. Lalu ditambahkan akuades hingga mencapai volume 50 mL.
Larutan stok 0,5 M EDTA dibuat sebanyak 50 mL. Ditimbang 9,306 EDTA kemudian dilarutkan dalam 50 mL akuades. Lalu ditambahkan NaOH 1 N sampai mencapai pH 8.
0,05 M bufer TE dibuat sebanyak 50 mL. Dicampur 5 mL 0,5 M tris-Cl pH 8 dan 5 mL 0,5 M EDTA pH 8, kemudian diencerkan dengan akuades hingga mencapai volume 50 mL.
Ketiga larutan di atas disterilkan menggunakan autoklaf pada suhu 1210C selama 15 menit.
3.5.1.2 Pembuatan 3 M Na-asetat
Ditimbang 2,4606 gr Na-asetat, kemudian dilarutkan dalam 10 mL akuades. Selanjutnya disterilkan menggunakan autoklaf pada suhu 1210C selama 15 menit.
3.5.1.3 Pembuatan bufer Loading Dye
Bufer Loading Dye dibuat dari campuran 0,25% Bromophenol Blue dan 40% sukrosa. Ditimbang 0,0125 gr Bromophenol Blue dan 2 gr sukrosa, kemudian dilarutkan dalam 5 mL akuades. Bufer Loading Dye disimpan di dalam lemari pendingin -200C.
3.5.1.4 Pembuatan bufer TAE
Bufer TAE dibuat dari campuran tris-base, asam asetat glasial, dan EDTA pH 8. Ditimbang 48,4 gr tris-base, 11,42 gr asam asetat glasial, dan 20 mL 0,5 M EDTA pH 8, kemudian dilarutkan dalam 200 mL akuades.
3.5.2 Pembuatan media Luria-Bertani padat dan cair
Media Luria-Bertani padat dibuat dari campuran 1% Tryptone, 1% NaCl, 2% Bacto Agar, dan 0,5% Yeast Exstract. Ditimbang 0,5 gr Tryptone, 0,5 gr NaCl, 0,25 gr Yeast Exstract, dan 1 gr Bacto Agar. Semua bahan dilarutkan dalam 50 mL akuades. Selanjutnya media tersebut dipindahkan ke dalam Erlenmeyer dan disterilkan menggunakan autoklaf pada suhu 1210C selama 15 menit. Media steril yang masih hangat-hangat kuku dihomogenkan kemudian dituang ke dalam cawan Petri steril. Media yang telah memadat disimpan dalam lemari pendingin 40C.
Media Luria-Bertani cair dibuat dari campuran 1% Tryptone, 1% NaCl, dan 0,5% Yeast Exstract. Ditimbang 0,6 gr Tryptone, 0,6 gr NaCl, dan 0,3 gr
Yeast Exstract. Semua bahan dilarutkan dalam 60 mL akuades, kemudian
3.5.3 Peremajaan bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7
Proses peremajaan bakteri dimulai dari mengambil biakan bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7 dari kultur sebelumnya dengan menggunakan kawat ose. Kawat yang mengandung biakan bakteri digoreskan pada media Luria-Bertani padat menggunakan metode streak. Selanjutnya biakan diinkubasi pada oven dengan suhu 370C selama 18 jam.
3.5.4 Perbanyakan sel dan isolasi DNA kromosom bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7
Proses perbanyakan sel bakteri xilanolitik dilakukan dengan menumbuhkan bakteri pada media Luria-Bertani cair. Kultur bakteri di-shaker dengan kecepatan 150 rpm selama 18 jam pada suhu 370C.
Diambil 10 mL kultur bakteri lalu disentrifugasi dengan kecepatan 10.000 rpm selama 2 menit pada suhu 40C. Pelet yang terbentuk disuspensikan dengan 500 µL bufer TE dan diinkubasi selama 30 menit pada suhu -200C. Kemudian ditambahkan 500 µL larutan lisosim 10 mg/mL pada sel beku. Sel diinkubasi kembali selama 45 menit di dalam es, kemudian ditambahkan 100 µL larutan STEP (SDS 0,5%, 50 mM tris-Cl pH 7,5, 0,4 M EDTA, proteinase K) pada suspensi sel. Suspensi sel ini kemudian diinkubasikan di waterbath selama 1 jam pada suhu 500C. Setelah langkah inkubasi, ditambahkan 600 µL fenol jenuh dan dicampur sampai terbentuk emulsi. Emulsi yang terbentuk disentrifugasi dengan kecepatan 12.000 rpm selama 10 menit pada suhu 40C. Fasa paling atas hasil sentifugasi dipindahkan pada tabung Eppendorf baru. Kemudian ditambahkan 3 M Na-asetat sebanyak 0,1x volume total, etanol absolut dingin sebanyak 2x
volume total campuran, kemudian dicampur secara perlahan, dan diinkubasi selama 12 jam pada suhu -200C. Setelah diinkubasi, campuran disentrifugasi pada kecepatan 12.000 rpm selama 5 menit suhu 40C. Supernatan yang terbentuk dibuang, pelet yang ada di dasar tabung dicuci dengan 500 µL etanol 70%, lalu disentrifugasi kembali dengan kecepatan 12.000 rpm selama 10 menit suhu 40C. Supernatan dibuang dan pelet yang terbentuk dikeringkan selama beberapa menit pada temperatur ruang. Pelet yang telah kering dilarutkan dalam 30 µL ddH2O.
Larutan lisozim berfungsi untuk proses lisis dinding sel bakteri. Penambahan larutan STEP (SDS, Tris-cl, EDTA, Proteinase-K) berfungsi untuk penyempurnaan kerusakan dinding dan membran sel bakteri secara kimiawi dan enzimatis. Penambahan fenol jenuh berfungsi untuk memisahkan protein dari DNA. Pada tahap ini akan terbentuk tiga lapisan, yaitu lapisan atas merupakan larutan DNA dan RNA yang larut dalam fasa air, lapisan tengah merupakan larutan protein, dan lapisan bawah merupakan sisa fenol. Natrium asetat dan etanol absolut dingin berfungsi untuk presipitasi DNA (Brown, 2001).
3.5.5 Penentuan konsentrasi DNA kromosom
Larutan DNA kromosom hasil isolasi diukur konsentrasinya menggunakan nilai absorbansi pada panjang gelombang 260 nm. Konsentrasi larutan DNA ditentukan dengan cara mengasumsikan bahwa setiap satu satuan A260nm sebanding dengan 50 µg.ml-1 DNA untai ganda. Pengukuran konsentrasi DNA kromosom isolat B dan 7 hasil isolasi menggunakan alat Nanodrop Spectrophotometer ND-1000.
3.5.6 Elektroforesis gel agarosa
Elektroforesis DNA menggunakan gel agarosa 1%. Gel agarosa 1% dibuat dari 0,4 gr agarosa yang dilarutkan dalam 40 mL bufer TAE 0,5x. Sampel DNA kromosom dicampur dengan bufer Loading Dye dengan perbandingan 3:1, kemudian dielektroforesis pada tegangan 60 - 70 Volt sampai warna biru bermigrasi sepanjang 3 4 gel. Gel agarosa kemudian direndam dalam larutan EtBr 0,5 g/mL dalam bufer TAE 0,5x selama 5 - 10 menit. Pita-pita DNA diamati dengan sinar UV dan didokumentasi dengan kamera digital.
3.5.7 Proses amplifikasi gen penyandi 16S rRNA dengan teknik PCR
Bahan yang digunakan untuk proses amplifikasi gen penyandi 16S rRNA dengan teknik PCR adalah 2,5 µL bufer PCR 10x (KCl 0,5 M, Tris-HCl 0,1 M pH 8,0, MgCl2 0,015 M), 1 µL dNTP 0,01 M, 2 µL MgSO4, 2 µL primer B27F (5’AGAGTTTGATCCTGGCTCAG 3’), 2 µL primer U1492R (5’ -GGTTACCTTGTTACGACTT- 3’), 6 µL DNA cetakan, 1 µL Taq DNA polimerase 5 units/ µL, dan 5 µL ddH2O.
Proses amplifikasi gen penyandi 16S rRNA dari bakteri xilanolitik sistem abdominal rayap tanah isolat B dan isolat 7 dilakukan pada kondisi denaturasi pada suhu 950C selama 1 menit, annealing pada suhu 530C dan 550C selama 1 menit, dan extension pada suhu 720C selama 1 menit 30 detik dengan jumlah siklus 30 kali. Proses amplifikasi diawali dengan inisiasi pada suhu 950C selama 5 menit dan diakhiri dengan elongasi akhir yang dilakukan pada suhu 720 C selama 10 menit. Produk PCR kemudian dielektoforesis untuk mengetahui ukuran pasang basanya.
3.5.8 Sekuensing gen penyandi 16S rRNA
Sekuensing gen penyandi 16S rRNA dilakukan di laboratorium Macrogen, Singapura dengan menggunakan primer forward B27F dan primer reverse U1492R.
3.5.9 Desain pohon filogenetik
Pohon filogenetik didesain menggunakan perbandingan sekuen 16S rRNA dari bakteri lain pada program pelacakan database Basic Local Alignment Search
Tool (BLAST) dengan alamat situs http://blast.ncbi.nlm.nih.gov/Blast.cgi. Alignment divisulisasikan menggunakan program ClustalW. Pembentukan pohon
filogenetik dilakukan dengan menggunakan program MEGA5. Langkah-langkah pembuatan pohon filogenetik adalah sebagai berikut:
1. Sekuen 16S rRNA milik bakteri xilanolitik didesain menggunakan program
Clone Manager dengan langkah-langkah:
a. Buka program Clone Manager.
b. Pilih menu Align Align multiple sequences.
c. Pilih tipe alignment Multi-Way dan align sequences as DNA next. d. Masukkan data basa nukleotida hasil sekuen primer forward dan reverse
finish.
e. Gabungkan basa-basa nukleotida hasil sekuen 16S rRNA dan simpan dalam format text document (.txt).
2. Perbandingan sekuen gen penyandi 16S rRNA bakteri xilanolitik dengan sekuen gen penyandi 16S rRNA bakteri lain yang ada di GenBank dilacak dengan menggunakan langkah-langkah sebagai berikut:
a. Buka program BLAST pada alamat situs http://blast.ncbi.nlm.nih.gov/. b. Klik pilihan nucleotide blast.
c. Masukkan data 16S rRNA pada kolom upload file, klik pilihan Others pada menu Database, ganti dengan 16S ribosomal RNA sequences.
d. Klik BLAST.
e. Pilih beberapa data sekuen bakteri yang diperlukan get selected
sequences.
f. klik Send to file pilih format FASTA ok.
3. Multiple sequence alignmet dari data BLAST yang diperoleh dibuat dengan menggunakan program ClustalW dan MEGA5 dengan langkah sebagai berikut:
a. Klik kanan pada data hasil BLAST format FASTA open with MEGA5. b. Pada tampilan layar M5: Alignment Explorer, pilih menu Alignment
Align by Clustal W ok, tunggu sampai proses berhenti.
c. Pilih menu Data Export alignment MEGA format. 4. Pohon filognetik didesain menggunakan program MEGA5.
a. Buka program MEGA5.
b. Pada toolbar, pilih Phylogeny Construct/Test Neighbor-Joining Tree. c. Pilih data hasil multiple sequence alignmet dalam format MEGA open
compute.
d. Setelah desain filogenetik muncul, klik Image simpan desain pohon filogenetik dalam format TIFF file.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Isolasi DNA Kromosom Bakteri Xilanolitik Sistem Abdominal Rayap Tanah Isolat B dan Isolat 7
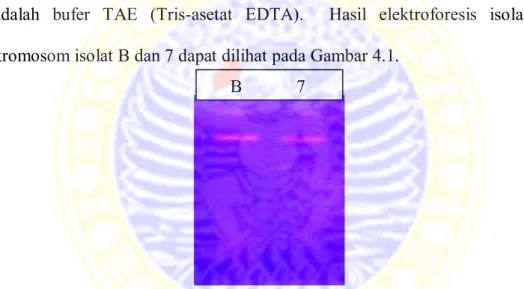
Isolasi DNA kromosom bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7 menggunakan metode Sambrook et al (1989). Hasil isolasi DNA kromosom dicek dengan elektroforesis gel agarosa 1%. Bufer yang digunakan adalah bufer TAE (Tris-asetat EDTA). Hasil elektroforesis isolasi DNA kromosom isolat B dan 7 dapat dilihat pada Gambar 4.1.
Gambar 4.1 Elektroforesis hasil isolasi DNA kromosom (B) isolat B, (7) isolat 7
Hasil isolasi DNA kromosom dari kedua isolat diukur konsentrasi dan kemurniannya menggunakan alat Nanodrop Spectrophotometer ND-1000. Tujuan pengukuran adalah untuk memastikan DNA yang akan digunakan untuk proses amplifikasi 16S rRNA dengan teknik PCR mempunyai konsentrasi dan kemurnian yang sesuai untuk amplifikasi. Hasil pengukuran menunjukkan bahwa isolat B mempunyai konsentrasi sebesar 500,5 ng/µL dengan nilai kemurnian 1,89 dan isolat 7 mempunyai konsentrasi sebesar 183,4 ng/µL dengan nilai kemurnian
DNA kromosom dianggap murni apabila rasio kemurniannya berada diantara nilai 1,8 – 2,0 (Brown, 2001). DNA kromosom yang mempunyai nilai kemurnian < 1,8 menandakan bahwa DNA kromosom tersebut belum murni karena terkontaminasi dengan protein. Adanya kontaminasi protein tersebut disebabkan oleh beberapa faktor, salah satunya adalah human error. Pada tahap penambahan larutan fenol proses isolasi DNA kromosom akan terbentuk tiga lapisan, dimana fasa DNA terdapat pada lapisan atas dan fasa protein terdapat pada lapisan tengah. Ketika melakukan pemisahan fasa DNA, ketidak hati-hatian akan menyebabkan fasa protein ikut terambil bersamaan dengan fasa DNA. Fasa protein yang terbawa akan ikut mengalami presipitasi bersama dengan DNA pada tahap penambahan natrium asetat dan etanol absolut sehingga menyebabkan DNA kromosom tidak murni.
DNA kromosom dapat digunakan untuk proses amplifikasi dengan teknik PCR apabila mempunyai konsentrasi antara 100 – 500 ng/µL (Grunenwald, 2003). Nilai konsentrasi tersebut ditentukan dengan cara mengukur nilai absorbansi DNA pada panjang gelombang 260 nm. Setiap satu satuan A260nm sebanding dengan 50 µg.ml-1 DNA untai ganda. Nilai kemurnian dan konsentrasi yang tidak sesuai akan menyebabkan DNA cetakan mengalami kerukasakan sehingga gen target tidak dapat teramplifikasi (Lindahl and Nyberg, 1972).
4.2 Amplifikasi Gen Penyandi 16S rRNA dengan Teknik PCR
PCR (Polymerase Chain Reaction) merupakan metode yang digunakan untuk mengamplifikasi sekuen DNA spesifik secara cepat dalam kondisi in vitro
(Bartlett, 2003). Bahan-bahan yang diperlukan dalam proses amplifikasi gen penyandi 16S rRNA dengan teknik PCR adalah DNA cetakan, sepasang primer, Mg2+, dNTPs, bufer PCR, dan Taq DNA polymerase. Untuk amplikasi 16S rRNA bakteri xilanolitik sistem abdominal rayap tanah isolat B dan isolat 7, digunakan pasangan primer B27F dan U1492R dengan urutan basa nukleotida sebagai berikut:
Primer forward B27F : 5’ -AGAGTTTGATCCTGGCTCAG- 3’ Primer reverse U1492R : 5’ -GGTTACCTTGTTACGACTT- 3’.
DNA cetakan bertindak sebagai sumber gen 16S rRNA yang akan diamplifikasi. dNTPs mengandung kelompok-kelompok basa, yaitu dATP, dCTP, dGTP dan dTTP yang berfungsi sebagai sumber basa nukleotida ketika DNA polimerase mensintesis untai DNA target yang baru. Primer merupakan oligonukleotida yang akan mengenali dan menempel pada wilayah DNA yang ditargetkan sehingga memungkinkan terjadinya proses amplifikasi. Primer hanya akan mengamplifikasi wilayah DNA tertentu yang dibatasi oleh primer forward dan reverse (Brown, 2001). Bufer berfungsi menstabilkan DNA polimerase. Mg2+ berfungsi sebagai kofaktor dari DNA polimerase (Sambrook and Russel, 2001). DNA polimerase berfungsi sebagai enzim yang mensintesis untai baru DNA. Untuk proses PCR, diperlukan DNA polimerase yang termostabil seperti Taq polimerase yang sudah umum digunakan dalam reaksi PCR.
Tiga tahapan penting dalam teknik PCR adalah denaturasi, penempelan primer (annealing), dan perpanjangan (extension). Proses denaturasi melibatkan pemanasan pada suhu tinggi. Pemanasan ini merusak ikatan hidrogen yang
mengikat untai-untai DNA sehingga DNA mengalami denaturasi dari rantai ganda menjadi rantai tunggal (Brown, 2001). Proses annealing memberikan kesempatan bagi primer untuk menempel pada DNA cetakan yang mempunyai pasangan basa yang komplemen dengan primer. Suhu annealing yang optimal untuk suatu primer didasarkan pada komposisi basa, sekuen nukleotida, serta panjang dan konsentrasi primer. Suhu annealing yang disarankan adalah 50C dibawah Tm primer (Grunenwald, 2003). Annealing harus dilakukan pada suhu yang tepat. Apabila suhu terlalu tinggi, primer tidak akan menempel pada sisi DNA target. Bila suhu terlalu rendah, dapat menyebabkan primer menempel pada daerah yang tidak spesifik dan menghasilkan lebih dari satu gen yang diamplifikasi. Proses extension merupakan proses perpanjangan rantai DNA oleh DNA polimerase. Perpanjangan rantai ini telah dibatasi oleh primer yang menempel pada saat
annealing. DNA polimerase berfungsi sebagai enzim yang bertugas mensintesis
untai DNA baru untuk melengkapi untai DNA cetakan dengan menambahkan dNTP dalam arah 5' ke 3'. Umumnya pada proses extension digunakan suhu 720 C, yaitu suhu optimum dari Taq polimerase.
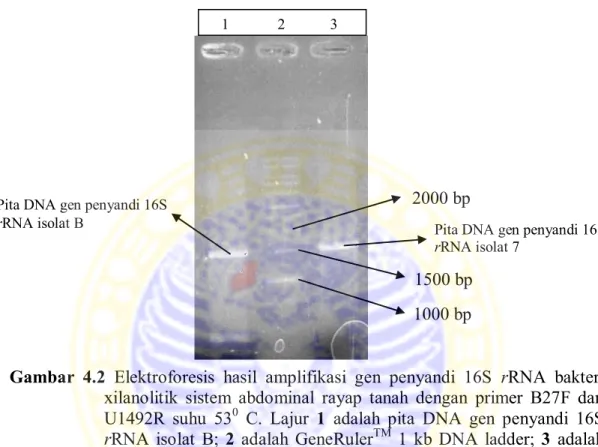
Pada proses amplifikasi gen penyandi 16S rRNA bakteri xilanolitik sistem abdominal rayap tanah isolat B dan isolat 7 dilakukan variasi suhu annealing, yaitu 530C dan 550C. Tujuan dilakukan variasi suhu adalah untuk menentukan suhu optimal dari primer agar dapat menempel pada DNA cetakan secara sempurna. Dari hasil variasi suhu tersebut, gen penyandi 16S rRNA bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7 dapat teramplifikasi sebesar 1500 bp pada suhu annealing 530C. Pada suhu annealing 550C, tidak
ditemukan pita DNA hasil amplifikasi 16S rRNA. Hal tersebut menunjukkan bahwa suhu 550C terlalu tinggi untuk proses annealing sehingga primer tidak menempel pada sisi DNA target dan tidak terjadi amplifikasi.
Gambar 4.2 Elektroforesis hasil amplifikasi gen penyandi 16S rRNA bakteri
xilanolitik sistem abdominal rayap tanah dengan primer B27F dan U1492R suhu 530 C. Lajur 1 adalah pita DNA gen penyandi 16S
rRNA isolat B; 2 adalah GeneRulerTM 1 kb DNA ladder; 3 adalah
pita DNA gen penyandi 16S rRNA isolat 7.
Amplikon bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7 yang diperoleh selanjutnya dimurnikan untuk menghilangkan sisa-sisa zat reaksi PCR. Pemurnian dilakukan untuk memperoleh DNA cetakan yang ditargetkan dan menghilangkan amplikon yang kurang spesifik. Pemurnian DNA dilakukan dengan menggunakan kit pemurnian Gene Clean dari QIAGEN. Setelah dimurnikan, amplikon diukur konsentrasi dan rasio kemurniannya menggunakan alat Nanodrop Spectrophotometer ND-1000. Amplikon isolat B mempunyai konsentrasi sebesar 124,8 ng/µL dengan nilai kemurnian 1,93. Amplikon isolat 7
Pita DNA gen penyandi 16S
rRNA isolat B Pita DNA gen penyandi 16S rRNA isolat 7
2000 bp
1500 bp 1000 bp
basa nukleotida penyandi gen 16S rRNA isolat B dan isolat 7 didapatkan dari hasil sekuensing yang dilakukan di laboratorium Macrogen, Singapura dengan menggunakan primer forward B27F dan primer reverse U1492R.
4.3 Desain Pohon Filogenetik Bakteri Xilanolitik Sistem Abdominal Rayap Tanah Isolat B dan Isolat 7
Pohon filogenetik didesain dengan menggunakan sekuen gen penyandi 16S rRNA milik bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7. Sekuen gen penyandi 16S rRNA merupakan molekul yang sempurna karena memiliki daerah conserved (dipertahankan) dan fungsi yang konstan pada tiap organisme, tersebar secara universal, dan mempunyai urutan sekuen yang terkonservasi dengan baik diantara anggota filogenetik yang luas (Madigan et al., 2000). Selain itu, pada uji konvensional sebelumnya diketahui bahwa kedua isolat ini termasuk dalam jenis prokariot, sehingga untuk mendapatkan sekuen yang universal, digunakan molekul 16S rRNA.
Primer forward B27F dan primer reverse U1492R digunakan untuk proses sekuensing basa nukleotida. Proses sekuensing dengan kedua primer akan menghasilkan urutan basa nukleotida secara menyeluruh. Sekuen lengkap gen penyandi 16S rRNA diperlukan untuk melakukan proses BLAST. Hasil sekuen yang telah lengkap diproses dengan menggunakan program Clone Manager.
Penyusunan sekuen gen penyandi 16S rRNA dari bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7 dilakukan setelah proses alignment terhadap hasil sekuensing 16S rRNA dari kedua primer selesai. Hasil alignment adalah sebagai berikut:
1. Gen penyandi 16S rRNA bakteri xilanolitik sistem abdominal rayap tanah isolat B mempunyai sekuen 1460 bp
CCT GGG GTG TGG GGG GCC TAC TCA TGC ACG TCG TAG CGA GGT AAC TAG GAG CTT GCT CTT ATG AAG TTA GCG GCG GAC GGG TGA GTA ACA CGT GGG TAA CCT GCC CAT GAG ACT GGG ATA ACT CCG GGA AAC CGG GGC TAA TAC CGG ATA ACA TTT TGA ACC GCA TGG TTC GAA ATT GAA AGG CGG CTT CGG CTG TCA CTT ATG GAT GGA CCC GCG TCG CAT TAG CTA GTT GGT GAG GTA ACG GCT CAC CAA GGC AAC GAT GCT TAT CCG ACC TGA GAG GGT GAT CGG CCA CAC TGG GAC TGA GAC ACG GCC CAA ACT CCT ACG GGA GGC AGC AGT AGG GAA TCT TCC GCA ATG GAC GAA AGT CTG ACG GAA CAA CGC CGC GGG AGT GAT GAA GGC TTT CGG GTC CAA AAA CTC TGT TGT TAG GGA AGA ACA AGT GCT AGT TGA ATA AGC TGG CAC CTT GAC GGT ACC TAA CCA GAA AGC CAC GGC TAA CTA CGT GCC AGC AGC CGC GGT AAT ACG TAG GTG GCA AGC GTT ATC CGG AAT TAT TGG GCG TAA AGC GCG CGC AGG TGG TTT CTT AGT CTG ATG TGA AAG CCC ACG GCT CAA CCG TGG AGG GTC ATT GGA ACT GGA GAG ACT TGA GTG CAG AAG AGG AAA GTG GGA TTC CAT TGT GTA GCG GTG AAA TGC GTA GAG ATA TGG AGG AAC ACC AGT GGC GAA GGC GAC TTT CTG GTC GGT AAC TGA CAC TG AGG CGC GAA AGC GTG GGG AGC AAA CAG GAT TAG ATA CCC TGG TAG TCC ACG CCG TAA ACG ATG AGT GCT AAG TGT TAG AGG GTT TCC GCC CTT TAG TGC TGA AGT TAA CGC ATT AAG CAC TCC GCC TGG GGA GTA CGG CCG CAA GGC TAA ACT CAA AGG AAT GAC GGG GGC CCG CAC AAG CGG TGG AGC ATG TGG TTT AAT TCG AAG CAA CGC GAA GAA CCT TAC CAG GTC TTG ACA TCC TCT GAC AAC CCT AGA GAT AGG GCT TCT CCT TCG GGA GCA GAG TGA CAG GTG GTG CAT GGT TGT CGT CAG CTC GTG TTA GAG GTT GAT CGT TTA ACT CCA GCA GGA AGC GCA TCC CTA TTT CTT ATT CCC CAT CAT TAA TTC GGC CAC TTT AAG CTG ACG ACC GTT GAC AAA CCG GCG AAA GTT GGG GAG GAC GTC AAA CCA TCA TAC CCC TAA TGT CCG GGG CAG CAC TCG GGC CAC ACT TGT CGT TCC AAC GAC AAG CAG GAC CTC GAG GTG GAG CTA TTC TCA TAA AAC CGT TCT CAG TTC GGA ATT GTA GCC TGC AAT TGG CCT CCA TGA AGC TGC AAT CGC TAG TAA TCG CGG TCC ACC ATG CCG CGG TGA ATA CGT TCC CTG GCC TAG ACT TCA CCT CCC GTC ACA CCC CGA TGA CTT TCA TCC CCC GAC GTC CGT GAG TTG ATC ATG CTC ACA TCA GAC GCT GGC GCC GCT GCC GTC
2. Gen penyandi 16S rRNA bakteri xilanolitik sistem abdominal rayap tanah isolat 7 mempunyai sekuen 1423 bp
GTA AAA CAA TGG TAA CCA GGC AGC TTG CTT GTT TGC TGA CGA GTG GCG GAC GGG TGA GTA ATG TCT GGG AAA CTG CCT GAT GGA GGG GGA TAA CTA CTG GAA ACG GTA GCT AAT ACC GCA TAA CGT CGC AAG ACC AAA GAG GGG GAC CTT CGG GCC TCT TGC CAT CGG ATG TGC CCA GAT GGG ATT AGC TAG TAG GTG GGG TAA CGG CTC ACC TAG GCG ACG GTC CCT AGC TGG TTT GAA AGG ATG ACC AGC CCC ACT GGA ACT GAG ACC CGG TCC AGA TTC CTA CGG GAG GCA GCA GTG GGA ATA TTG CAC AAT GGG CGC AAG CCT GAT GCA GCC ATG CCG CGT GTA TGA AGA AGG CCT TCG GGT TGT AAA GTA CTT TCA GCG GGG AGG AAG GGA GTA AAG TTA ATA CCT TTG CTC ATT GAC GTT ACC CGC AGA AGA AGC ACC GGC TAA CTC CGT GCC AGC AGC CGC GGT AAT ACG GAG GGT GCA AGC GTT AAT CGG AAT TAC TGG GCG TAA AGC GCA CGC AGG CGG TTT GTT AAG TCA GAT GTG AAA TCC CCG GGC TCA ACC TGG GAA CTG CAT CTG ATA CTG GCA AGC TTG AGT CTC GTA GAG GGG GGT AGA ATT CCA GGT GTA GCG GTG AAA TGC GTA GAG ATC TGG AGG AAT ACC GGT GGC GAA GGC GGC CCC CTG GAC GAA GAC TGA CGC TCA GGT GCG AAA GCG TGG GGA GCA AAC AGG ATT AGA TAC CCT GGT AGT CCA CGC CGT AAA CGA TGT CGA CTT GGA GGT TGT GCC CTT GAG GCG TGG CTT CCG GAG CTA ACG CGT TAA GTC GAC CGC CTG GGG AGT ACG GCC GCA AGG TTA AAA CTC AAA TGA ATT GAC GGG GGC CCG CAC AAG CGG TGG AGC ATG TGG TTT AAT TCG ATG CAA CGC GAA GAA CCT TAC CTG GTC TTG ACA TCC ACG GAA GTT TTC AGA GAT GAG AAT GTG CCT TCG GGA ACC GTG AGA CAG GTG CTG CAT GGC TGT CGT CAG CTC GTG TTG TGA AAT GTT GGG TTA AGT CCC GCA ACG AGC GCA ACC CTT ATC CTT TGT TGC CAG CGG TCC GGC CGG GAA CTC AAA GGA GAC TGC CAG TGA TAA ACT GGA GGA AGG TGG GGA TGA CGT CAA GTC ATC ATG GCC CTT ACG ACC AGG GCT ACA CAC GTG CTA CAA TGG CGC ATA CAA AGA GAA GCG ACC TCG CGA GAG CAA GCG GAC CTC ATA AAG TGC GTC GTA GTC CGG ATT GGA GTC TGC AAC TCG ACT CCA TGA AGT CGG AAT CGC TAG TAA TCG TGG ATC AGA ATG CCA CGG TGA ATA CGT TCC CGG GCC TTG TAC ACA CCG CCC GTC ACA CCA TGG GAG TGG GTT GCA AAA GAA GTA CGT GAG TTG ATC ATG CTC AGA TAA ACG CTG CGC AGC TAC GCT TAC C
Hasil sekuen gen penyandi 16S rRNA dari isolat B dan isolat 7 dilacak homologinya terhadap sekuen 16S rRNA milik bakteri lainnya yang ada di dalam
GenBank melalui program BLAST dengan alamat situs
http://blast.ncbi.nlm.nih.gov/Blast.cgi. sekuen-sekuen 16S rRNA yang didapat dari program BLAST disimpan dalam format FASTA dan diolah kembali menggunakan program ClustalW dan MEGA5 untuk mendapatkan multiple
sequence alignmet (MSA). Hasil MSA disimpan dalam format MEGA.
Tabel 4.1 Hasil BLAST bakteri xilanolitik sistem abdominal rayap tanah isolat B
Kode NCBI Nama Spesies Panjang
sekuen (bp) Persentase Homologi - Isolat B 1460 100% NR_041248.1 Bacillus anthracis 1306 94% NR_043403.1 Bacillus thuringiensis 1486 93% NR_024697.1 Bacillus weihenstephanensis 1531 92% NR_036880.1 Bacillus mycoides 1513 92% NR_025240.1 Bacillus marisflavi 1506 89% NR_041942.1 Bacillus acidicola 1548 89% NR_025511.1 Bacillus luciferensis 1502 89% NR_026144.1 Bacillus halmapalus 1504 89% NR_025373.1 Bacillus shackletonii 1503 89% NR_043774.1 Bacillus acidiceler 1495 88%
Tabel 4.2 Hasil BLAST bakteri xilanolitik sistem abdominal rayap tanah isolat 7
Kode NCBI Nama Spesies Panjang
sekuen (bp) Persentase Homologi - Isolat 7 1423 100% NR_027549.1 Escherichia fergusonii 1473 99% NR_024570.1 Escherichia coli 1450 99% NR_025569.1 Escherichia albertii 1494 99% NR_026332.1 Shigella dysenteriae 1487 99% NR_041527.1 Citrobacter youngae 1490 97%
NR_044371.1 Salmonella enterica subsp. houtenae 1437 97% NR_044370.1 Salmonella enterica subsp. indica 1414 97% NR_041696.1 Salmonella enterica subsp. arizonae 1491 97% NR_044373.1 Salmonella enterica subsp. diarizonae 1368 97%
NR_024640.1 Enterobacter asburiae 1422 96%
Kedua tabel hasil BLAST menunjukkan kedekatan antara bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7 dengan bakteri lainnya yang ada di dalam GenBank. Dari Tabel 4.1 diketahui bahwa bakteri xilanolitik sistem abdominal rayap tanah isolat B mempunyai homologi terdekat sebesar 94% dengan Bacillus anthracis (kode NCBI NR_041248.1). Dari Tabel 4.2 diketahui bahwa bakteri xilanolitik sistem abdominal rayap tanah isolat 7 mempunyai homologi terdekat sebesar 99% dengan Escherichia fergusonii (kode NCBI NR_027549.1).
Pohon filogenetik didesain menggunakan program MEGA5. Metode yang digunakan untuk mendesain pohon filogenetik adalah Neighbor-Joining Tree. Hasil desain pohon filogenetik bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7 ditampilkan pada gambar sebagai berikut:
Gambar 4.3 Desain pohon filogenetik bakteri xilanolitik sistem abdominal rayap
Gambar 4.5 Desain pohon filogenetik bakteri xilanolitik sistem abdominal rayap
Pada Gambar 4.3 menunjukkan bahwa bakteri xilanolitik sistem abdominal rayap tanah isolat B tidak berada pada cabang maupun node yang sama dengan bakteri-bakteri yang ada di dalam pohon filogenetik. Bakteri xilanolitik isolat B mempunyai cabang tersendiri yang terpisah dari kesepuluh bakteri yang ada dalam pohon filogenetik. Tetapi di dalam tabel homologi BLAST (Tabel 4.1), diketahui bahwa isolat B mempunyai homologi sekuen 16S rRNA paling dekat dengan Bacillus anthracis. Hal tersebut menunjukkan bahwa secara filogenetik, bakteri xilanolitik isolat B tidak mempunyai kesamaan spesies dengan kesepuluh spesies bakteri di dalam pohon filogenetik, tetapi mempunyai kemiripan urutan basa sebesar 94% dengan Bacillus anthracis.
Pada Gambar 4.4 menunjukkan bahwa bakteri xilanolitik sistem abdominal rayap tanah isolat 7 berada pada cabang yang sama dengan Escherichia fergusonii. Dua isolat yang berada pada cabang yang sama menandakan kesamaan spesies (Ludwig and Klenk, 2001). Pada tabel homologi BLAST (Tabel 4.2) juga ditunjukkan bahwa bakteri xilanolitik sistem abdominal rayap tanah isolat 7 mempunyai homologi sekuen 16S rRNA paling dekat dengan Escherichia
fergusonii. Dari hasil pohon filogenetik dan homologi BLAST, diketahui bahwa
bakteri xilanolitik isolat 7 mempunyai kesamaan spesies dengan Escherichia fergusonii dan mempunyai homologi sekuen 16S rRNA sebesar 99%.
Pada Gambar 4.5 menunjukkan hubungan kekerabatan satu bakteri dengan bakteri lain. Dari desain pohon filogenetik tersebut dapat dismpulkan bahwa isolat B dan isolat 7 tidak berada dalam satu cabang filogenetik, satu clade (spesies), maupun satu node (genus) yang sama. Hal tersebut menandakan bahwa isolat B
dan 7 tidak mempunyai kemiripan urutan basa nukleotida maupun kedekatan filogenetik satu sama lain. Kedua isolat mempunyai root (nenek moyang) yang sama tetapi mengalami perubahan yang berbeda satu sama lain ketika berevolusi. Selain itu, kedua isolat bakteri xilanolitik (isolat B dan 7) bukan merupakan spesies bakteri baru karena nilai homologi kedua isolat bakteri xilanolitik berada diantara 94 – 99 %. Bakteri bisa dikatakan spesies baru apabila memiliki kemiripan homologi basa nukleotida < 70% (Wayne, 1987). Hal ini dikemukan oleh Wayne, dimana suatu spesies dapat dikatakan memiliki hubungan dengan salah satu kelompok spesies yang telah ada apabila mempunyai nilai homologi gen lebih besar dari 70% bila dibandingkan dengan seluruh gen yang mengalami hibridisasi DNA-DNA. Nilai total gen yang mengalami hibidrisasi DNA-DNA merupakan kunci utama dari penentuan dan pembatasan hubungan kekerabatan spesies baru tersebut dengan spesies yang telah ada.
Belum ada rekomendasi cara yang pasti untuk menentukan pembatasan homologi genus bakteri maupun untuk menentukan level tertinggi kemiripan suatu genus bakteri. Menurut Stackebrandt and Goebel (1994), suatu isolat bakteri yang baru ditemukan dapat dikatakan berada dalam satu kelompok genus dengan bakteri yang telah ada di data GenBank apabila memiliki homologi sekuen gen 16S rRNA dengan nilai antara 97 – 99 %. Jika nilai homologi sekuen gen 16S
rRNA kurang dari 97%, maka bakteri tersebut belum dapat disebut sebagai
bakteri baru maupun digolongkan sebagai bakteri yang berbeda genus. Untuk mengetahui posisi taksonomi yang pasti dari bakteri baru tersebut, perlu dilakukan beberapa pengevaluasian. Evaluasi tersebut meliputi evaluasi posisi filogenetik
bakteri dengan keseluruhan grup filogenetik pada GenBank, evaluasi kemotaksonomi, dan evaluasi fenotip dari bakteri-bakteri yang mempunyai hubungan kekerabatan filogeni terdekat. Apabila hasil evaluasi fenotip dan kemotaksonomi mendukung hasil evaluasi filogenetik, maka bakteri tersebut sudah dapat ditentukan kelompok taksanya dan diberi nama sesuai genus yang telah dievaluasi.
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Dari penelitian ini dapat disimpulkan bahwa :
1. Identifikasi molekular berdasarkan 16S rRNA hanya dapat dilakukan pada bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7 yang menghasilkan sekuen gen penyandi 16S rRNA sebesar 1460 bp dan 1423 bp.
2. Hubungan kekerabatan bakteri xilanolitik sistem abdominal rayap tanah isolat B dengan Bacillus anthracis sebesar 94% dan hubungan kekerabatan bakteri xilanolitik sistem abdominal rayap tanah isolat 7 dengan Escherichia fergusonii sebesar 99% pada program pelacakan database Basic Local Alignment Search Tool (BLAST) dapat diketahui berdasarkan desain pohon filogenetik yang telah dibuat.
5.2 Saran
Diharapkan dapat dilakukan penelitian lebih lanjut untuk mengetahui identifikasi dan karakteristik dari bakteri xilanolitik sistem abdominal rayap tanah isolat B dan 7 secara lengkap. Serta dapat dilakukan penelitian lanjutan untuk bakteri xilanolitik sistem abdominal rayap tanah isolat A agar dapat diketahui hubungan kekerabatannya dengan bakteri lain yang ada pada program pelacakan database
DAFTAR PUSTAKA
Bartlett, J.M., Stirling, D., 2003, A short history of the polymerase chain reaction,
Methods Mol Biol., 226: 3-6
Bravman, T., Mechaly, A., Shulami, S., Belakhov, V., Baasov, T., Shoham, G., Shoham, Y., 2001, Glutamic acid 160 is the acid-base catalyst of β-xylosidase from Bacillus stearothermophilus T-6: a family 39 glycoside hydrolase, FEBS Letters, 495 : 115–119
Brown, T.A, 2001, Gene Cloning and DNA Analysis An Introduction, Fourth Edition, Blackwell Publishings, United Kingdom
Coenye T., Vandamme P., 2003, Intragenomic heterogeneity between multiple 16S ribosomal RNA operons in sequenced bacterial genomes, FEMS
Microbiol. Lett., 228 (1): 45–49
Collins, T., Gerday, C., and Feller, G., 2005, Xylanases, xylanase families and extremophilic xylanases, FEMS Microbiology Reviews, 29 (2005) : 3-23 Gillis, M., Vandamme, P., Vos, P.D., Swings, J., Kersters, K., 2001, Polyphasic
Taxonomy, In Boone, Castenholz and Garrity (Editors), Bergey’s Manual
of Systematic Bacteriology, 2nd Edition, Volume 1, The archaea and the
deeply branching and phototrophic bacteria, Springer, New York, 43-48 Grunenwald, H., 2003, Optimization of polymerase chain reactions, In Bartlett
and Stirling (Editors), PCR Protocols, Methods in Molecular Biology.,
226: 89-98
Huber, H., Hohn, M.J., Rachel, R., Fuchs, T., Wimmer, V.C., and Stetter, K.O., 2002, A new phylum of Archaea represented by a nanosized hyperthermophilic symbiont, Nature, 417 (6884): 63–7
Lindahl, T., Nyberg, B., 1972, Rate of depurination of native deoxyribonucleic acid, Biochemistry 11, 3610–3618
Ludwig, W., Klenk, H.P., 2001, Overview: A phylogenetic backbone and taxonomic framework for procaryotic systematic, In Boone, Castenholz and Garrity (Editors), Bergey’s Manual of Systematic Bacteriology, 2nd Edition, Volume 1, The archaea and the deeply branching and phototrophic bacteria, Springer, New York, 49–65
Madigan, M.T., Martinko, J.M., and Parker, J., 2000, Biology of Microorganisms 9th ed, Prentice Hall Inc, New Jersey