PEMANFAATAN LIMBAH TULANG IKAN NILA
(Oreochromis niloticus) SEBAGAI GELATIN DAN PENGARUH
LAMA PENYIMPANAN PADA SUHU RUANG
M. AZWAR HARIS
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2008
RINGKASAN
M. AZWAR HARIS. C34104071 Pemanfaatan Limbah Tulang Ikan Nila (Oreochromis niloticus) sebagai Gelatin dan Pengaruh Lama Penyimpanan pada Suhu Ruang. Dibimbing oleh MALA NURILMALA dan TATI NURHAYATI.
Ikan nila merupakan salah satu ikan budidaya yang banyak diminati oleh masyarakat. Selain memiliki rasa yang gurih, daging yang tebal, tidak lunak, dan durinya sedikit harga ikan nila pun terjangkau. Ikan nila dijual dalam bentuk utuh maupun bentuk fillet. Limbah hasil fillet antara lain berupa kepala, tulang, sirip, dan jeroan. Sampai saat ini, limbah fillet ikan nila belum termanfaatkan secara optimal.
Tulang ikan nila (Orechromis niloticus) merupakan limbah yang belum dimanfaatkan dengan baik dan didalamnya terdapat kolagen sehingga dapat dibuat menjadi gelatin. Penelitian pembuatan gelatin tulang ikan nila dibagi menjadi 2 tahap. Tahap pertama, yaitu penentuan gelatin terpilih dari perlakuan konsetrasi HCl (4 %, 5 % dan 6 %) dengan lama perendaman 1 dan 2 hari. Tahap kedua, yaitu proses penyimpanan gelatin terpilih selama 1 bulan. Parameter yang dianalisis meliputi pH, viskositas, kekuatan gel, proksimat, titik gel, titik leleh, titik isoelektrik, aktivitas emulsi, stabilitas emulsi, derajat putih, dan organoleptik (warna dan bau).
Gelatin tulang ikan nila yang diperoleh pada penelitian ini mempunyai nilai rendemen sebesar 10,18–13,27 %; nilai pH sebesar 3,31-4,01; nilai viskositas sebesar 4,80-6,00 centipoise (cP); dan nilai kekuatan gel berkisar antara 65,43-126,98 bloom. Dari kombinasi perlakuan yang diberikan diperoleh gelatin terpilih, yaitu gelatin dengan perlakuan konsentrasi HCl 4 % dan lama perendaman 2 hari. Parameter fisika dan kimia gelatin terpilih, yaitu uji proksimat dengan nilai kadar air sebesar 7,03%; kadar abu sebesar 0,93 %; kadar lemak sebesar 1,63 %; dan kadar protein sebesar 84,85 %. Nilai titik gel sebesar 7 oC, titik leleh 29 oC, titik isoelektrik sebesar 7, aktivitas dan stabilitas emulsi sebesar 0,464 dan 21 menit serta derajat putih sebesar 25 %. Parameter bau dan warna gelatin tulang ikan nila lebih rendah nilainya dibandingkan gelatin komersial.
Selama proses penyimpanan, gelatin mengalami perubahan pH, viskositas, dan kekuatan gel. Nilai pH selama penyimpanan cenderung menurun dari 4,33 menjadi 3,77. Nilai viskositas mengalami penurunan dari 6,15 cP menjadi 5,70 cP, sedangkan nilai kekuatan gel menurun dari 171,90 bloom menjadi 134,51 bloom. Hasil analisis menunjukkan bahwa penyimpanan gelatin memberikan pengaruh yang signifikan dengan taraf (α<0,05) terhadap parameter pH, viskositas, dan kekuatan gel.
PEMANFAATAN LIMBAH TULANG IKAN NILA
(Oreochromis niloticus) SEBAGAI GELATIN DAN PENGARUH
LAMA PENYIMPANAN PADA SUHU RUANG
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh: M. Azwar Haris
C 34104071
PROGRAM STUDI TEKNOLOGI HASIL PERIKANAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
2008
Judul Skripsi : PEMANFAATAN LIMBAH TULANG IKAN NILA (Oreochromis niloticus) SEBAGAI GELATIN DAN PENGARUH LAMA PENYIMPANAN PADA SUHU RUANG
Nama : M. Azwar Haris NRP : C 34104071
Proram Studi : Teknologi Hasil Perikanan
Menyetujui,
Pembimbing I
Mala Nurilmala, S.Pi, M.Si. NIP. 132 315 793
Pembimbing II
Dr. Tati Nurhayati, S.Pi, M.Si NIP. 132 149 436
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 131 578 799
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi “Pemanfaatan limbah tulang
ikan nila (Oreochromis niloticus) sebagai gelatin dan pengaruh lama penyimpanan pada suhu ruang” adalah karya saya sendiri dan belum diajukan daam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir skripsi.
Bogor, Oktober 2008
M. Azwar Haris C34104071
RIWAYAT HIDUP
Penulis bernama lengkap M. Azwar Haris. Dilahirkan pada tanggal 14 Oktober 1986 di Gresik dari pasangan Bapak Rasmo dan Ibu Khariro. Penulis merupakan anak ke empat dari lima bersaudara.
Pendidikan formal penulis dimulai pada tahun 1990 di TK Ambeng-ambeng Watang Rejo dan lulus pada tahun 1992. Pada tahun yang sama penulis melanjutkan kejenjang sekolah dasar di SDN Ambeng-ambeng dan lulus pada tahun 1998. Kemudian dilanjutkan ke SMP N 2 Kebomas Gresik dan lulus pada tahun 2001. Selanjutnya penulis melanjutkan pendidikan di SMU N 1 Manyar Gresik dan lulus pada tahun 2004.
Pada tahun 2004 penulis diterima di Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur Seleksi Penerimaan Mahasiswa Baru.
Selama kuliah penulis aktif di beberapa organisasi di lingkungan kampus Fakultas Perikanan dan Ilmu Kelautan, seperti Himpunan Profesi Mahasiswa Teknologi Hasil Perikanan serta sebagai pengurus Dewan Perwakilan Mahasiswa Fakultas Perikanan dan Ilmu Kelautan. Penulis juga pernah mengikuti berbagai seminar kewirausahaan dan beberapa pelatihan pembuatan produk perikanan. Selain itu penulis juga aktif dalam kegiatan kepanitiaan dan pernah mengikuti Program Kreatifitas Mahasiswa yang diselenggarakan oleh DIKTI pada tahun 2005 dan 2008.
Sebagai salah satu syarat memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, penulis melakukan penelitian dan penulisan skripsi dengan judul “Pemanfaatan Limbah Tulang Ikan Nila
(Oreochromis niloticus) sebagai Gelatin dan Pengaruh Lama Penyimpanan pada Suhu Ruang”. Dibimbing oleh Mala Nurilmala, S.Pi, M.Si dan Dr. Tati Nurhayati S.Pi, M.Si.
KATA PENGANTAR
Puji syukur penulis panjatkan atas kehadirat Allah SWT, karena berkat Rahmat serta Hidayah-Nya, penulis dapat menyelesaikan penulisan skripsi dengan judul “Pemanfaatan Limbah Tulang Ikan Nila (Oreochromis niloticus)
sebagai Gelatin dan Pengaruh Lama Penyimpanan pada Suhu Ruang”.
Skripsi ini merupakan salah satu syarat untuk memperoleh Gelar Sarjana di Program Studi Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada:
1) Ibu Mala Nurilmala S.Pi, M.Si dan Ibu Dr. Tati Nurhayati S.Pi, M.Si selaku dosen pembimbing yang telah memberikan arahan, bimbingan, nasihat serta motivasi dalam menyelesaikan tugas akhir ini;
2) Bapak Dr. Ir. Agoes Mardiono Jacoeb dan Ibu Ir. Anna C. Erungan, MS selaku dosen penguji atas saran dan arahan yang berharga;
3) Bapak dan Ibu yang telah memberikan kasih syang, ukungan, motivasi, dan doa yang tak terbatas, serta Kakak (Cak Yudi, Cak Penk, Cak Ton), (adekQ Elip), mba’ Lanjar yang telah memberikan bantuan moril maupun materiil dalam melakukan dan menyelesaikan skripsi ini;
4) Dosen-dosen, staf administrasi, staf labolatorium;
5) Etty Hasmawati, terimaksih atas perhatian, dukungan, dan kasih sayang yang telah diberikan kepada penulis;
6) Sahabatku di Gresik (Lifah, Zety, Afif, Ifan, Nizar, Antok, dan Deni atas persahabatan yang telah terjalin;
7) Rijal dan keluarga yang telah memberi masukan dan semangat, Teteg sekeluarga (Dek Pandan, dek Tegar dan dek Tatag) yang telah membantu penulis selama penelitian di Semarang serta Mas Bari sekeluarga yang memfasilitasi dan membantu dalam memperoleh bahan baku penelitian;
8) Teman seperjuangan (Iis, Ranti, dan Yugha ) yang terus semangat dalam memberi semangat selama mengerjakan penelitian sehingga saya dapat menyelesaikan pembuatan skripsi;
9) Teman kosQ “Al-Hikmah 17+” (Andika, Andi, An’im, Windika, dan Tyas) atas kenangan yang telah diberikan selama ini;
10) Al-Demi 2005 (amel, iis, enif, estrid, ayu) yang telah memberi banyak bantuan;
11) Penghuni wisma Gopiss ( Nunu, Edo, Wahyu, Teteg, Fery, Jay, Afi, Juan, Yudi, Cecep, Iwan, dan Windi) atas kenangan yang diberikan selama bersama di wisma Gopiss;
12) Ima, Anggi, Pur, dan Dhias yang telah berjasa membantu penelitian ini;
13) Vera, Ima, Ari, Indah, Alim, Rijan, Yudha, Dery, Gilang, An’im, Anang, Erlangga, dan keluarga besar THP 41 yang tidak bisa disebutkan satu persatu;
14) Rekan-rekan THP 39, 40, 42, dan 43 atas kebersamaan dan semangatnya
15) Semua pihak yang telah membaca dan menggunakan karya ilmiah ini sebagai bahan acuan ataupun kegunaan lainnya.
Penulis menyadari bahwa dalam penyusunan skripsi ini masih terdapat kekurangan. Namun, penulis berharap semoga skripsi ini bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Oktober 2008
M. Azwar Haris C3404071
DAFTAR ISI
Halaman
DAFTAR TABEL... ix
DAFTAR GAMBAR... x
DAFTAR LAMPIRAN... xi
DAFTAR SINGKATAN... xiii
1. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan... 3
2. TINJAUAN PUSTAKA... 4
2.1. Karakteristik Ikan Nila ... 4
2.2. Kolagen... 5
2.3. Gelatin ... 7
2.4. Sifat Fisika Kimia Gelatin ... 10
2.5. Asam Amino Gelatin... 11
2.6. Kegunaan Gelatin... 13
2.7. Pembuatan Gelatin ... 14
2.8. Penyimpanan ... 15
3. METODOLOGI... 16
3.1. Waktu dan Tempat ... 16
3.2. Bahan dan Alat... 16
3.3. Rancangan Penelitian ... 16
3.3.1. Penelitian tahap pertama ... 17
3.3.2. Penelitian tahap kedua ... 19
3.4. Analisis Gelatin... 19
(1). Identifikasi gelatin (JECFA 2003)... 19
(2). Rendemen (AOAC 1995)... 19
(3). Viskositas (British Standard 757 1975) ... 19
(4). Kekuatan gel (British Standard 757 1975)... 20
(5). Titik gel (Suryaningrum dan Utomo 2002)... 20
(6). Titik leleh (Suryaningrum dan Utomo 2002) ... 20
(7). Aktivitas emulsi (Pearce dan Kinsella 1978) ... 21
(8). Stabilitas emulsi (Pearce dan Kinsella 1978) ... 21
(9). Derajat putih (Kett Electric Labolatory 1981) ... 21
(11). Kadar air (AOAC 1995)... 22
(12). Kadar abu (AOAC 1995) ... 22
(13) Kadar lemak (AOAC 1995) ... 22
(14). Kadar protein (AOAC 1995)... 22
(15). Kadar karbohidrat (AOAC 1995) ... 23
(16). Titik isoelektrik protein (Weinewright 1977) ... 23
(17). Asam amino (Nur et al. 1992)... 23
(18). Uji mutu hedonik (Rahayu 2001) ... 23
3.5. Rancangan Percobaan dan Analisis Data ... 24
4. HASIL DAN PEMBAHASAN ... 26
4.1 Penelitian Tahap Pertama... 26
4.1.1. Sifat fisika gelatin ... 29
(1). rendemen gelatin ... 29
(2). viskositas gelatin ... 30
(3). kekuatan gel gelatin... 32
(4). titik gel gelatin... 33
(5). titik leleh gelatin... 34
(6). aktivitas dan stabilitas emulsi gelatin ... 34
(7). derajat putih ... 36
4.1.2. Sifat kimia gelatin... 36
(1). nilai pH gelatin ... 36
(2). analisis proksimat gelatin tulang ikan nila... 38
(a). kadar air ... 38
(b). kadar abu... 39
(c). kadar lemak... 40
(d). kadar protein ... 40
(3). titik isoelektrik protein... 41
(4). asam amino gelatin... 42
4.1.3. Perbandingan sifat fisika-kimia gelatin... 43
4.1.4. Uji mutu hedonik ... 44
4.2. Penelitian Tahap Kedua ... 45
4.2.1. Derajat keasaman (pH) gelatin selama penyimpanan... 46
4.2.2. Viskositas gelatin selama penyimpanan ... 47
4.2.3. Kekuatan gel gelatin selama penyimpanan ... 48
5. KESIMPULAN DAN SARAN ... 50
5.1. Kesimpulan... 50
5.2. Saran ... 51
DAFTAR PUSTAKA... 52
DAFTAR TABEL
Halaman
1. Komposisi kimia ikan nila (Oreochromis niloticus)... 5
2. Sifat gelatin tipe A dan tipe B... 8
3. Standar mutu gelatin ... 9
4. Persyaratan gelatin berdasarkan FAO ... 9
5. Data import gelatin Indonesia... 10
6. Komposisi asam amino gelatin kulit sapi dan gelatin kulit ikan cod (g/100 g protein) ... 12
7. Penggunaan gelatin dalam industri pangan dan non pangan di dunia pada tahun 1999 ... 13
8. Hasil analisis proksimat tulang ikan nila... 26
9. Aktivitas emulsi gelatin tulang ikan nila, gelatin komersial, dan gelatin tulang ikan kakap merah ... 35
10. Hasil analisis proksimat gelatin tulang ikan nila, gelatin komersial, gelatin tulang ikan kakap merah dan gelatin tulang ikan patin ... 38
11. Komposisi asam amino gelatin tulang ikan nila, gelatin komersial, gelatin tulang ikan kakap merah, dan gelatin tulang ikan patin (g/100g protein) ... 43
12. Perbandingan sifat fisika-kimia gelatin tulang ikan nila, gelatin komersial, gelatin tulang ikan kakap merah, dan gelatin tulang ikan patin ... 44
DAFTAR GAMBAR
Halaman
1. Ikan nila (Oreochromis niloticus)... 4
2. Urutan tahap pada pembentukan kolagen (Gross 1961) ... 6
3. Struktur kimia gelatin (Poppe 1992)... 8
4. Tahapan pembuatan gelatin tulang ikan nila (Oreochromis niloticus) (*Modifikasi dari Hadi 2005) ... 18
5. Prosedur penelitian tahap kedua ... 19
6. Limbah tulang ikan nila (Oreochromis niloticus) ... 27
7. Tulang ikan nila kering ... 27
8. Konversi kolagen menjai gelatin (Glicksman 1969) ... 28
9. Nilai rendemen tulang ikan nila (Oreochromis niloticus) ... 29
10. Nilai viskositas gelatin tulang ikan nila (Oreochromis niloticus) ... 31
11. Nilai kekuatan gel gelatin tulang ikan nila (Oreochromis niloticus)... 32
12. Analisis aktivitas dan stabilitas emulsi gelatin tulang ikan nila, gelatin komersial, dan gelatin tulang ikan kakap merah... 35
13. Nilai pH gelatin tulang ikan nila (Oreochromis niloticus) ... 37
14. Nilai kadar protein gelatin pada berbagai pH... 41
15. Rata-rata uji mutu hedonik gelatin tulang ikan nila dengan gelatin komersial... 44
16. Perubahan derajat keasaman (pH) gelatin tulang ikan selama penyimpanan ... 46
17. Perubahan viskositas gelatin tulang ikan nila selama penyimpanan ... 47
DAFTAR LAMPIRAN
Halaman
1. Format uji mutu hedonik gelatin ... 57
2. Gambar proses demineralisasi... 58
3. Gambar proses ekstraksi ... 58
4. Nilai rendemen gelatin tulang ikan nila (Oreochromis niloticus) ... 58
5. Hasil analisis ragam rendemen gelatin tulang ikan nila (Oreochromis niloticus) ... 59
6. Hasil uji lanjut Duncan parameter rendemen ... 59
7. Nilai viskositas gelatin tulang ikan nila (Oreochromis niloticus) ... 59
8. Hasil analisis ragam viskositas gelatin tulang ikan nila (Oreochromis niloticus) ... 59
9. Hasil uji lanjut Duncan parameter viskositas ... 60
10. Nilai kekuatan gel gelatin tulang ikan nila (Oreochromis niloticus)... 60
11. Hasil analisis ragam kekuatan gel gelatin tulang ikan nila (Oreochromis niloticus) ... 60
12. Hasil uji lanjut Duncan parameter kekuatan gel gelatin ... 60
13. Nilai pH gelatin tulang ikan nila (Oreochromis niloticus) ... 61
14. Hasil analisis ragam pH gelatin tulang ikan nila (Oreochromis niloticus) 61 15. Hasil uji lanjut Duncan parameter pH ... 61
16. Grafik hasil pengujian asam amino dengan HPLC ... 62
17. Data mentah uji organoleptik ... 65
18. Gambar gelatin ... 66
19. Nilai pH gelatin tulang ikan nila (Oreochromis niloticus) selama penyimpanan... 66
20. Hasil analisis ragam nilai pH gelatin tulang ikan nila (Oreochromis niloticus) selama penyimpanan... 66
21. Hasil uji lanjut Duncan perubahan pH gelatin tulang ikan nila (Oreochromis niloticus) selama penyimpanan... 67
22. Nilai Viskositas gelatin tulang ikan nila (Oreochromis niloticus) selama penyimpanan... 67
23. Hasil analisis ragam nilai viskositas gelatin tulang ikan nila (Oreochromis niloticus) selama penyimpanan... 67
24. Hasil uji lanjut Duncan perubahan viskositas gelatin tulang ikan nila
(Oreochromis niloticus) selama penyimpanan... 67 25. Nilai kekuatan gel gelatin tulang ikan nila (Oreochromis niloticus)
selama penyimpanan ... 68 26. Hasil analisis ragam nilai kekuatan gel gelatin tulang ikan nila
(Oreochromis niloticus) selama penyimpanan ... 68 27. Hasil uji lanjut Duncan perubahan kekuatan gel gelatin tulang ikan nila
(Oreochromis niloticus) selama penyimpanan ... 68 28 Sifat gelatin menurut Poppe (1992) ... 68 29. Grafik kekuatan gel gelatin tulang ikan nila (Oreochromis niloticus)... 69 30. Grafik kekuatan gel penyimpanan gelatin pada suhu ruang
DAFTAR SINGKATAN
SDS : Sodium Dodesil Sulfat cP : Centipoise
HPLC : High Performance Liquid Cromatography GMIA : Gelatin Manufacturers Institute of America
1. PENDAHULUAN
1.1. Latar Belakang
Gelatin merupakan salah satu bahan yang semakin luas penggunaannya, baik untuk produk pangan maupun produk non pangan. Bagi industri pangan ataupun industri non pangan, gelatin merupakan bahan yang tidak asing, hal ini terkait dengan manfaatnya antara lain sebagai bahan penstabil, pembentuk gel, pengikat, pengental, pengemulsi, perekat, pembungkus makanan. Industri pangan yang menggunakan bahan gelatin ini antara lain, yaitu industri permen, industri es krim, industri jelly (sebagai pembentuk gel), sedangkan industri non pangan yang biasa menggunakan bahan gelatin antara lain industri fotografi (sebagai pengikat bahan peka cahaya), industri kertas (sebagai sizing paper), farmasi (bahan kapsul, pengikat tablet), industri kosmetik (bahan sabun, lotion), dan produk kosmetik lainnya.
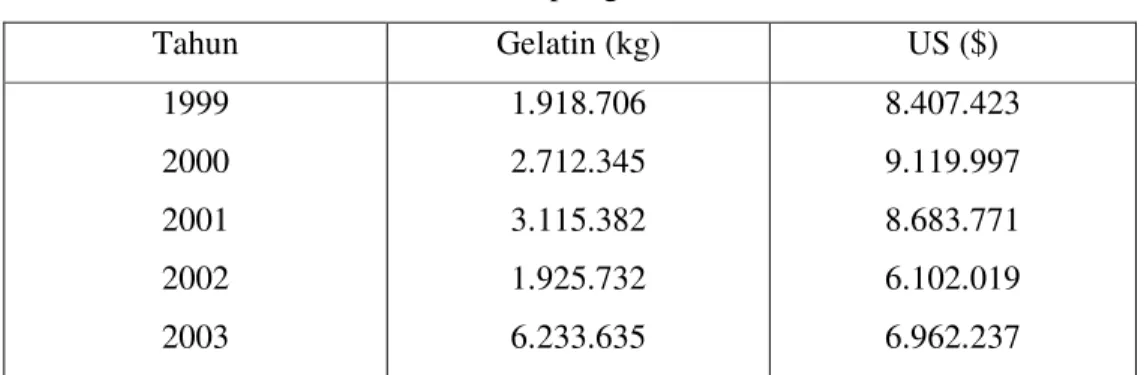
Kebutuhan gelatin dari tahun ke tahun cenderung semakin meningkat. Meningkatnya kebutuhan gelatin di Indonesia tsernyata tidak banyak direspon oleh industri di dalam negeri untuk diproduksi secara komersial sehingga masih impor. Untuk kebutuhan dalam negeri, Indonesia mengimpor lebih dari 6.200 ton gelatin pada tahun 2003 atau senilai US$ 6.962.237 dari berbagai negara (Perancis, Jepang, Brazil, Jerman, Cina, Argentina, dan Australia), padahal pada tahun 2000 hanya mengimpor gelatin sebanyak 3.092 ton (www.iptekda.lipi.go.id 2007).
Selama ini sumber bahan baku utama gelatin yang banyak dimanfaatkan oleh industri adalah dari kulit dan tulang dari sapi atau babi. Menurut data SKW
biosystem suatu perusahaan multinasional bahwa produk gelatin dunia pada tahun 1999 sebanyak 254.000 ton terdiri dari kulit jangat sapi sebanyak 28,7 %; kulit babi sebanyak 41,4 %; serta kontribusi tulang sapi sebesar 29,8 %; dan sisanya dari ikan (SKW biosystem 2001).
Penggunaan kulit dan tulang babi sebagai bahan baku gelatin tidaklah tepat bila diterapkan di negara yang mayoritas penduduknya beragama Islam seperti Indonesia. Hal ini dikarenakan babi merupakan hewan yang diharamkan untuk dikonsumsi, sedangkan penggunaan gelatin dari bahan baku sapi juga masih
dikhawatirkan karena adanya wabah penyakit yang di bawa oleh ternak antara lain penyakit anthrax dan penyakit sapi gila (Gudmundsson 2002). Oleh karena itu perlu dikembangkan produk gelatin dengan bahan baku hewan yang lain diantaranya adalah ikan.
Ikan dapat digunakan sebagai bahan baku pembuatan gelatin. Hal ini dikarenakan pada bagian tertentu dari ikan, misalnya tulang dan kulit, terdapat kolagen yang dengan penambahan perlakuan asam atau alkali serta proses pemanasan menyebabkan kolagen tersebut dapat dikonversi menjadi gelatin. Kandungan kolagen dari ikan keras (teleostei) berkisar dari 15-17 %, sedangkan pada ikan bertulang rawan (Elasmobranchi) berkisar antara 22-24 % (Nurilmala 2004).
Ikan nila merupakan salah satu jenis ikan air tawar yang dibudidayakan oleh masyarakat Indonesia. Permintaan akan daging fillet nila sangat tinggi. Tercatat ekspor fillet ikan nila dalam bentuk beku Indonesia di pasar Amerika Serikat menduduki peringkat ke dua setelah Cina. Tahun 2004 ekspor fillet nila mencapai 4.250 ton atau meningkat sebanyak 18,6 % dibandingkan tahun sebelumnya yang hanya mencapai 3.583 ton (Anonima 2007). Disamping permintaan yang cenderung meningkat, budidaya ikan nila di Indonesia juga dari tahun ke tahun semakin meningkat. Pada tahun 2006 jumlah jumlah produksi perikanan budidaya nila sebesar 169.390 ton, sedangkan pada tahun 2007 jumlah produksinya sebesar 195.000 ton meningkat sebesar 15,12 %. Menurut perkiraan DKP sementara, pada tahun 2008 jumlah produksi ikan nila mencapai 233.000 ton dan pada tahun 2009 akan mencapai 337.000 ton (Ferinaldy 2008).
Sampai sekarang, baru ada beberapa perusahaan yang menggarap pasar ekspor ikan nila, seperti PT Aquafarm Nusantara, PT Dharma Samudra Fishing Industries, PT Kelola Mina Laut, dan PT Bumi Agro Bahari Nusantara. Namun perusahaan yang mampu mengekspor nila secara kontinu dengan volume besar baru Aquafarm. Untuk menghasilkan fillet siap ekspor, setiap hari Aquafarm mengolah 73 ton nila yang masih hidup dan masih segar (Dadang et al. 2007). Tingginya jumlah ikan nila yang diekspor akan menyebabkan limbah tulang yang dihasilkan juga tinggi
Penelitian mengenai gelatin yang diekstrak dari tulang ikan keras hingga kini masih sedikit dilakukan, diantaranya adalah dari gelatin tulang ikan kakap merah oleh Hadi pada tahun 2005 dan gelatin tulang ikan patin oleh Nurilmala pada tahun 2004. Dalam penelitian ini, akan dilakukan penelitian pembuatan gelatin dari tulang ikan nila (Oreochromis sp). Limbah tulang ikan dalam penelitian ini akan digunakan menjadi bahan baku gelatin. Gelatin yang diperoleh akan dianalisis fisik dan kimia serta dilakukan proses penyimpanan selama satu bulan.
1.2. Tujuan
Tujuan umum dari penelitian ini adalah untuk memanfaatkan limbah tulang ikan nila sebagai gelatin dan mempelajari pengaruh lama penyimpanan terhadap mutu gelatin. Secara khusus penelitian ini bertujuan untuk:
1) mendapatkan gelatin dari bahan baku tulang ikan nila;
2) mengetahui nilai parameter fisika dan kimia dari gelatin yang terpilih kemudian membandingkan dengan gelatin komersial;
3) mengetahui pengaruh penyimpanan pada suhu ruang terhadap derajat keasaman (pH), viskositas, dan kekuatan gel dari gelatin yang terpilih.
2. TINJAUAN PUSTAKA
2.1. Karakteristik Ikan Nila
Ikan nila (Oreochromis niloticus) merupakan jenis ikan yang diintroduksi dari luar negeri. Bibit ini didatangkan ke Indonesia secara resmi oleh Balai Penelitian Perikanan Air Tawar pada tahun 1969. Setelah melalui masa penelitian dan adaptasi, barulah ikan ini disebarluaskan kepada petani di seluruh Indonesia. Gambar ikan nila (Oreochromis niloticus) dapat dilihat pada Gambar 1. Klasifikasi ikan nila (Trewavas 1982 diacu dalam Suyanto 1994) adalah sebagai berikut:
Filum : Chordata Sub-filum : Vertebrata Kelas : Osteichtyes Sub-kelas : Acanthopterigii Ordo : Perchomorphi Famili : Cichlidae Genus : Oreochromis
Spesies : Oreochromis niloticus
Gambar 1. Ikan nila (Oreochromis niloticus)
Ikan ini memiliki rasa yang gurih, daging yang tebal, tidak lunak, harga terjangkau dan durinya sedikit. Ikan ini banyak dipelihara di kolam dan keramba jaring apung (Suyanto 1994). Ikan nila diperkenalkan pada negara berkembang dan dibudidayakan untuk memenuhi kebutuhan akan protein. Ikan nila ini sangat populer di Amerika dan hampir terdapat di semua restoran yang ada sebagai menu. Untuk konsumsi Eropa, ikan nila masih belum terkenal sehingga pasar persaingan masih terbuka lebar. Sekarang ini, fillet nila segar maupun dalam bentuk
deep skinned, asap, sashimi dan dengan penambahan CO (karbon monoksida). Komposisi ikan nila dapat dilihat pada Tabel 1.
Tabel 1. Komposisi kimia ikan nila (Oreochromis niloticus)
Senyawa kimia Jumlah (%)
Air 79,44 Protein 12,52 Karbohidrat 4,21 Lemak 2,57 Abu 1,26 Sumber: Suyanto (1994)
Keunggulan yang dimiliki oleh ikan nila antara lain toleran terhadap lingkungan (hidup di air tawar dan payau pada kisaran pH 5-11), pertumbuhannya cepat, yaitu dalam jangka waktu 6 bulan benih berukuran 30 g dapat tumbuh mencapai 300-500 g, dapat dipijahkan setelah umur 5-6 bulan dan dapat dipijahkan kembali setelah 1-1,5 bulan kemudian, serta tahan terhadap kekurangan oksigen dalam air (Suyanto 1994).
2.2. Kolagen
Kolagen adalah protein serabut (fibril) yang mempunyai sifat fisiologis yang unik, terdapat di jaringan ikat pada kulit, tendon, tulang, kartilago dan lain-lain (Wong 1989). Protein ini memiliki sifat kurang larut, amorf, dapat memanjang dan berkontraksi. Protein serabut ini tidak larut dalam pelarut encer, sukar dimurnikan, susunan molekulnya dari rantai molekul yang panjang sejajar dan tidak membentuk kristal (Winarno 1997).
Eastoe (1977) menerangkan bahwa bahan dasar dan kelompok hewan yang mempunyai sumber kolagen yang tertinggi dan dapat dijadikan gelatin adalah sebagai berikut:
(a) tulang: mamalia (sapi, babi, kelinci), burung, reptile, ikan (cod, halibut,
elasmobranchs);
(b) kulit: mamalia, reptil (buaya, ular), ikan, (elasmobranchs); (c) tulang rawan: burung/ayam, ikan;
(d) tendon: burung/ayam.
Unit struktural pembentuk kolagen adalah tropokolagen yang mempunyai struktur batang dengan BM 300.000, didalamnya terdapat tiga rantai polipeptida
yang sama panjang, bersama-sama membentuk struktur heliks (Bennion 1980). Tiap tiga rantai polipeptida dalam unit tropokolagen membentuk struktur heliks tersendiri, menahan bersama-sama dengan ikatan hidrogen antara grup NH dari residu glisin pada rantai yang satu dengan grup CO pada rantai lainnya. Cincin pirolidin, prolin, dan hidroksiprolin membantu pembentukan rantai polipeptida dan memperkuat triple heliks (Wong 1989). Urutan tahap pada pembentukan kolagen dapat dilihat pada Gambar 2.
Kolagen murni sangat sensitif terhadap reaksi enzim dan kimia. Perlakuan alkali menyebabkan kolagen mengembang dan menyebar, yang sering dikonversikan menjadi gelatin. Di samping pelarut alkali, kolagen juga larut dalam pelarut asam (Bennion 1980).
Tropokolagen akan terdenaturasi oleh pemanasan atau perlakuan dengan zat, seperti asam, basa, urea, dan potasium permanganat (Piez 1967 diacu dalam Hadi 2005). Selain itu, serabut kolagen dapat mengalami penyusutan jika dipanaskan di atas suhu penyusutannya (Ts). Suhu penyusutan (Ts) kolagen ikan adalah 45 oC. Jika kolagen dipanaskan pada T>Ts (misalnya 65-70 oC), serabut
triple heliks yang dipecah menjadi lebih panjang. Pemecahan struktur tersebut menjadi lilitan acak yang larut dalam air inilah yang disebut gelatin. Kolagen kulit ikan lebih mudah hancur daripada kolagen kulit hewan. Kedua jenis kolagen ini akan hancur oleh proses pemanasan dan aktivitas enzim (Skeist 1977 diacu dalam Hadi 2005).
2.3. Gelatin
Gelatin adalah derivat protein dari serat kolagen yang ada pada kulit, tulang, dan tulang rawan. Susunan asam aminonya hampir mirip dengan kolagen, dimana glisin sebagai asam amino utama dan merupakan 2/3 dari seluruh asam amino yang akan menyusunnya, 1/3 asam amino yang tersisa diisi oleh prolin dan hidroksiprolin (Charley 1982).
Berat molekul gelatin berbeda-beda, berat rata-rata dapat berkisar dari nilai 50.000-200.000 atau lebih. Menurut Clark dan Courts (1977) berat molekul gelatin mencapai 90.000, sedangkan rata-rata berat molekul gelatin komersial berkisar antara 20.000-70.000 (Ward dan Courts 1977).
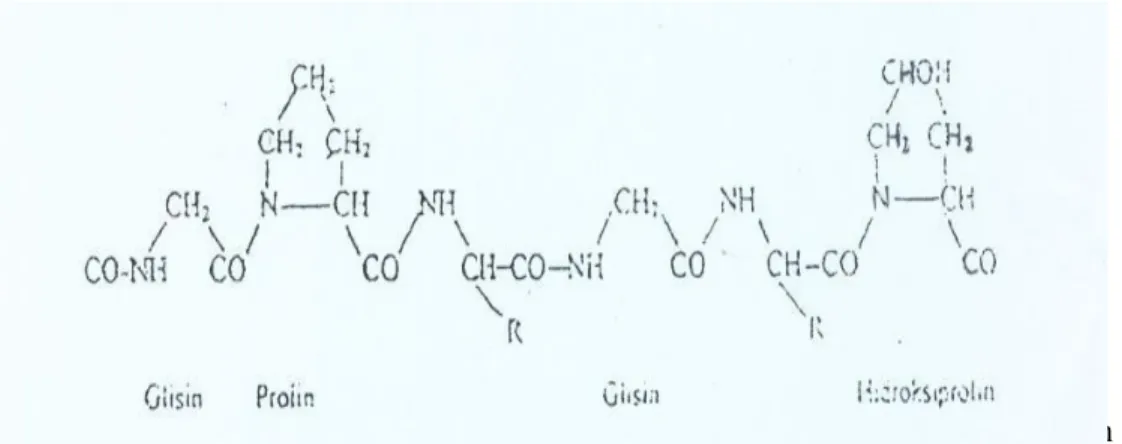
Asam-asam amino saling terikat melalui ikatan peptida membentuk gelatin. Susunan asam amino gelatin berupa Gly-X-Y dimana X umumnya asam amino prolin dan Y umumnya asam amino hidroksiprolin (Poppe 1992). Protein ini tidak memiliki asam amino triptopan sehingga tidak dapat digolongkan sebagai protein lengkap (Parker 1982). Struktur kimia gelatin dapat dilihat pada Gambar 3.
CH2 CHOH
CH2 CH2 CH2 CH2
CH2 N — CH NH CH2 NH N — CH
CO — NH CO CO CH — CO — NH CO CH – CO CO
R R
Glisin Prolin Y Glisin X Hidroksiprolin Gambar 3. Struktur kimia gelatin (Poppe 1992)
Bahan baku yang biasanya digunakan pada proses asam adalah tulang dan kulit babi, sedangkan bahan baku yang biasa digunakan pada proses basa adalah tulang dan kulit jangat sapi. Gelatin larut dalam air, asam asetat, dan pelarut alkohol, seperti gliserol, propilen glikol, sorbitol, dan manitol, tetapi tidak larut dalam alkohol, aseton, karbon tetraklorida, benzena, petroleum eter dan pelarut organik lainnya (Viro 1992). King (1969) menyatakan bahwa gelatin mudah larut pada suhu 71,1 oC dan cenderung membentuk gel pada suhu 48,9 oC; sedangkan pemanasan yang dilakukan untuk melarutkan gelatin sekurang-kurangnya 49 oC atau biasanya pada suhu 60-70 oC (Johns 1977). Beberapa sifat penting gelatin adalah kekuatan gel, viskositas, kadar abu, pH, dan titik isoelektrik. Sifat penting gelatin dapat dilihat pada Tabel 2.
Tabel 2. Sifat gelatin tipe A dan tipe B
Sifat Tipe A Tipe B
Kekuatan gel (bloom) Viskositas (cP) Kadar abu (%) pH Titik isoelektrik 50-300 1,5-7,5 0,3-2,0 3,8-6,0 7,0-9,0 50-300 2,0-7,5 0,5-2,0 5,0-7,1 4,7-5,4 Sumber: GMIA (2001) diacu dalam Amiruldin (2007)
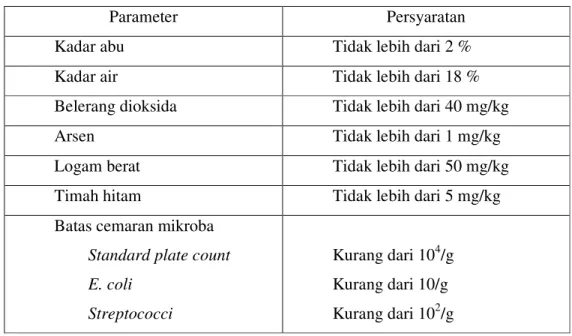
Sifat fisik secara umum dan kandungan unsur-unsur mineral tertentu dalam gelatin dapat digunakan untuk menilai mutu gelatin. Standar mutu gelatin (SNI 1995) disajikan pada Tabel 3. Persyaratan gelatin untuk makanan berdasarkan standar FAO disajikan pada Tabel 4. Gelatin di Indonesia sebagian
berasal dari impor, terutama Eropa. Jumlah impor gelatin di Indonesia disajikan pada Tabel 5.
Tabel 3. Standar mutu gelatin
Karakteristik Syarat Warna Bau, rasa Kadar air Kadar abu Logam berat Arsen Tembaga Seng Sulfit
Tidak berwarna-kekuningan pucat Normal (dapat diterima konsumen) Maksimum 16 % Maksimum 3,25 % Maksimum 50 mg/kg Maksimum 2 mg/kg Maksimum 30 mg/kg Maksimum 100 mg/kg Maksimum 1000 mg/kg Sumber: SNI 06-3735-1995
Tabel 4. Persyaratan gelatin berdasarkan FAO
Parameter Persyaratan
Kadar abu Tidak lebih dari 2 %
Kadar air Tidak lebih dari 18 %
Belerang dioksida Tidak lebih dari 40 mg/kg
Arsen Tidak lebih dari 1 mg/kg
Logam berat Tidak lebih dari 50 mg/kg
Timah hitam Tidak lebih dari 5 mg/kg
Batas cemaran mikroba
Standard plate count E. coli Streptococci Kurang dari 104/g Kurang dari 10/g Kurang dari 102/g Sumber: JECFA (2003)
Tabel 5. Data impor gelatin Indonesia Tahun Gelatin (kg) US ($) 1999 2000 2001 2002 2003 1.918.706 2.712.345 3.115.382 1.925.732 6.233.635 8.407.423 9.119.997 8.683.771 6.102.019 6.962.237 Sumber: Pusat data dan informasi Deperindag (2004)
2.4. Sifat Fisika Kimia Gelatin
Sifat fungsional gelatin sangat penting dalam aplikasi terhadap suatu produk. Adapun sifat fungsional dari suatu protein (gelatin) dapat berupa kriteria berikut ini: organoleptik meliputi warna dan bau; hidrasi meliputi pembentukan gel, viskositas, dan sineresis; permukaan meliputi pengemulsian, pembuihan, dan pembentukan film; struktur meliputi kekenyalan, adhesifitas, dan pembentukan adonan (Kinsella 1982).
Sifat fungsional merupakan sifat fisika dan kimia yang mempengaruhi perilaku gelatin dalam makanan selama proses, penyimpanan, penyiapan, dan pengkonsumsian (Kinsella 1982). Adapun sifat fisika dari gelatin meliputi kekuatan gel, viskositas, titik gel, titik leleh, aktivitas dan stabilitas emulsi serta derajat putih, sedangkan sifat kimia dari gelatin meliputi kadar air, kadar abu, kadar lemak, kadar protein, dan pH.
Viskositas adalah daya aliran molekul dalam suatu larutan baik dalam air, cairan organik sederhana dan suspensi serta emulsi encer (deMan 1989). Sistem koloid dalam larutan dapat meningkat dengan cara mengentalkan cairan sehingga terjadi adsorpsi dan pengembangan koloid (Glicksman 1969). Viskositas gelatin merupakan interaksi hidrodinamik antara molekul gelatin dalam larutan (Stainsby 1977).
Kekuatan gel adalah salah satu parameter dari tekstur suatu bahan dan merupakan gaya untuk menghasilkan deformasi tertentu (deMan 1989). Kekuatan gel gelatin diidentifikasikan sebagai besarnya kekuatan yang diperlukan oleh probe untuk menekan gel sampai pada kedalaman 4 mm dengan kecepatan 0,5 mm/s.
Titik gel gelatin adalah suhu pada waktu larutan gelatin membentuk gel secara perlahan-lahan ketika didinginkan pada suhu chilling (Stainsby 1977). Titik leleh gelatin adalah suhu ketika gelatin yang telah membentuk gel mencair ketika dipanaskan perlahan-lahan (Stainsby 1977).
Gel yang terbentuk dari protein seperti gelatin, kelarutan, dan pembentukan gelnya dipengaruhi oleh titik isoelektrik (Stainsby 1977). Titik isoelektrik protein (pl) adalah pH dimana protein mempunyai jumlah muatan ion positif dan negatif yang sama. Pada pH titik isoelektrik, kelarutan protein rendah sehingga terjadi penggumpalan atau pengendapan protein (Lehninger 1982).
Derajat putih gelatin ditentukan oleh bahan baku dan proses pembuatan gelatin (Poppe 1992). Derajat putih gelatin akan berpengaruh pada aplikasi suatu produk (Glicksman 1969).
Emulsi merupakan sistem yang heterogen, terdiri atas cairan yang tidak tercampurkan dan terdispersi dengan baik sekali dalam cairan yang lain, berbentuk tetesan dengan diameter biasanya lebih dari 0,1 µm (Becher 1965).
2.5. Asam Amino
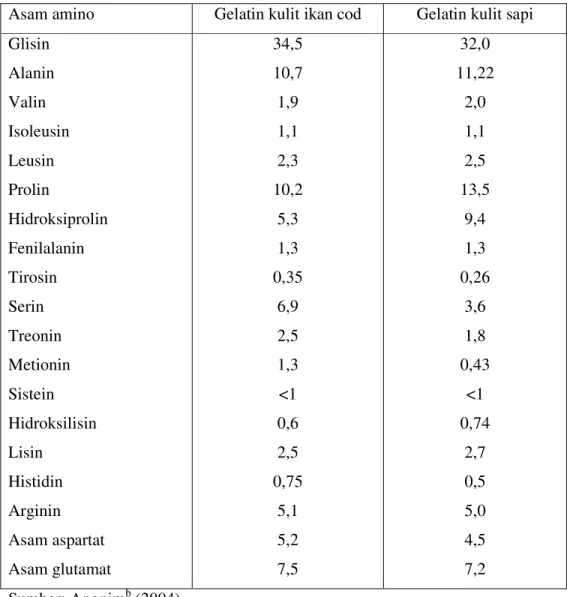
Asam amino merupakan struktur yang membentuk protein. Asam amino bisa didapatkan dari makanan sesudah diserap melalui darah dan sebagian disintesis di dalam tubuh (Suhardjo 1987). Diantara keduapuluh asam amino yang umum didapatkan dalam protein, terdapat asam amino esensial dan non-esensial. Tabel 6 menunjukkan komposisi asam amino yang terdapat di dalam gelatin kulit ikan cod dan gelatin kulit sapi.
Asam amino esensial adalah asam amino yang tidak dapat disintesis oleh tubuh tetapi sangat diperlukan oleh tubuh dan harus disuplai dalam bentuk jadi, yang terdiri dari isoleusin, leusin, lisin, metionin, fenilalanin, treonin, triptofan, valin, arginin, dan histidin (esensial untuk anak-anak). Asam amino non-esensial adalah asam amino yang dapat disintesis di dalam tubuh dengan mengkonversikan satu asam amino menjadi asam amino yang lain dalam sel-sel tubuh, yang terdiri dari alanin, aspargin, asam aspartat, sistein, asam glutamat, glisin, ornitin, prolin (dapat berada dalam bentuk hidroksiprolin), serin, dan tirosin (Gaman 1992).
Tabel 6. Komposisi asam amino gelatin kulit ikan cod dan gelatin kulit sapi (g/100 g protein)
Sumber: Anonimb (2004)
Gelatin disusun oleh 19 asam amino dalam rantai polimer yang panjang. Asam amino yang terdapat di dalam gelatin merupakan asam amino tidak lengkap karena tidak adanya asam amino triptofan. Triptofan merupakan salah satu asam amino esensial yang dibutuhkan oleh tubuh (Glicksman 1969). Diantara gelatin kulit sapi dan gelatin kulit ikan terdapat perbedaan antara jumlah asam amino prolin dan hidroksiprolin. Di dalam gelatin kulit ikan, jumlah asam amino tersebut lebih rendah daripada yang terdapat di dalam gelatin kulit sapi. Hal tersebut mengakibatkan rendahnya ikatan hidrogen dari gelatin terhadap air, sehingga mempengaruhi titik gel dan titik leleh gelatin (Anonima 2004).
Asam amino Gelatin kulit ikan cod Gelatin kulit sapi Glisin Alanin Valin Isoleusin Leusin Prolin Hidroksiprolin Fenilalanin Tirosin Serin Treonin Metionin Sistein Hidroksilisin Lisin Histidin Arginin Asam aspartat Asam glutamat 34,5 10,7 1,9 1,1 2,3 10,2 5,3 1,3 0,35 6,9 2,5 1,3 <1 0,6 2,5 0,75 5,1 5,2 7,5 32,0 11,22 2,0 1,1 2,5 13,5 9,4 1,3 0,26 3,6 1,8 0,43 <1 0,74 2,7 0,5 5,0 4,5 7,2
2.6. Kegunaan Gelatin
Kegunaan gelatin terutama untuk mengubah cairan menjadi padatan yang elastis, atau mengubah bentuk sol menjadi gel. Reaksi pada pembentukan gel ini bersifat reversibel karena bila gel dipanaskan akan terbentuk sol dan bila didinginkan akan membentuk gel lagi. Keadaan tersebut membedakan gelatin dengan gel dari pektin, low metoxy pektin, alginat, albumin telur, dan protein susu yang gelnya irreversibel (Johns 1977).
Gelatin dapat digunakan sebagai penstabil (stabilizer), pembentuk gel (gelling agent), pengikat (binder), pengental (thickener), pengemulsi (emulsifier), perekat (adhesive) dan pembungkus makanan yang bersifat dapat dimakan (edible
coating) (Jones 1977).
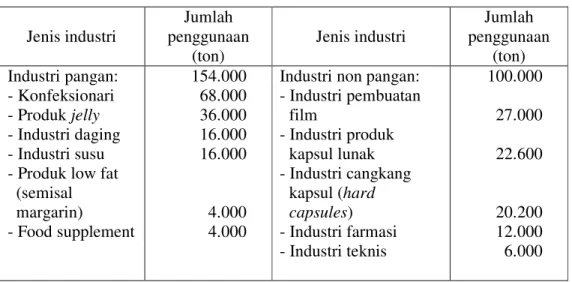
Gelatin sebagai pembentuk gel karena mempunyai sineresis yang rendah dan mempunyai kekuatan gel antara 220 atau 225 gram bloom (Jones 1977) sehingga dapat digunakan dalam pembuatan produk jelly. Sebagai pengemulsi gelatin bisa diaplikasikan ke dalam sirup lemon, susu, mentega, margarin, pasta, dan mayonnaise. Gelatin sebagai penstabil dapat digunakan dalam pembuatan es krim dan yoghurt. Sebagai bahan pengikat, gelatin dapat digunakan dalam produk-produk daging (Jones 1977). Penggunaan gelatin dalam industri dapat dilihat pada Tabel 7.
Tabel 7. Penggunaan gelatin dalam industri pangan dan non pangan di dunia pada tahun 1999 Jenis industri Jumlah penggunaan (ton) Jenis industri Jumlah penggunaan (ton) Industri pangan: 154.000 Industri non pangan: 100.000 - Konfeksionari - Produk jelly 68.000 36.000 - Industri pembuatan film 27.000 - Industri daging - Industri susu - Produk low fat
(semisal margarin) - Food supplement 16.000 16.000 4.000 4.000 - Industri produk kapsul lunak - Industri cangkang kapsul (hard capsules) - Industri farmasi - Industri teknis 22.600 20.200 12.000 6.000 Sumber: SKW Biosystem (2001)
2.7. Pembuatan Gelatin
Pada prinsipnya proses pembuatan gelatin dapat dibagi menjadi dua macam, yaitu proses asam dan proses basa. Perbedaan kedua proses ini terletak pada proses perendamannya. Berdasarkan kekuatan ikatan kovalen silang protein dan jenis bahan yang diekstrak, maka penerapan jenis asam maupun basa organik dan metode ekstraksi lainnya seperti lama hidrolisis, pH, dan suhu akan berbeda-beda (Pelu et al. 1998).
Proses produksi utama gelatin dibagi dalam tiga tahap: 1) tahap persiapan bahan baku antara lain penghilangan komponen non kolagen dari bahan baku, 2) tahap konversi kolagen menjadi gelatin, dan 3) tahap pemurnian gelatin dengan penyaringan dan pengeringan (Hinterwaldner 1977).
Pada tahap persiapan dilakukan pencucian pada kulit dan tulang. Kulit atau tulang dibersihkan dari sisa-sisa daging, sisik dan lapisan luar yang mengandung deposit-deposit lemak yang tinggi. Untuk memudahkan pembersihan maka sebelumnya dilakukan pemanasan pada air mendidih selama 1-2 menit (Pelu et al. 1998). Proses penghilangan lemak dari jaringan tulang yang biasa disebut degreasing, dilakukan pada suhu antara titik kelarutan lemak dan suhu koagulasi albumin tulang, yaitu antara 32-80 oC, sehingga dihasilkan kelarutan lemak yang optimum (Ward dan Courts 1977).
Sebelum dilakukan penggembungan pada tulang, terlebih dahulu dilakukan proses demineralisasi yang bertujuan untuk menghilangkan garam kalsium dan garam lainnya dalam tulang, sehingga diperoleh tulang yang sudah lumer atau disebut ossein (Ward dan Courts 1977). Asam yang biasa digunakan dalam proses demineralisasi adalah asam klorida dengan konsentrasi 4-7 % (Hadiwiyoto 1983 diacu dalam Hadi 2005). Proses demineralisasi ini sebaiknya dilakukan dalam wadah tahan asam selama beberapa hari sampai dua minggu (Hinterwaldner 1977).
Asam mampu mengubah serat kolagen triple heliks menjadi rantai tunggal, sedangkan larutan perendam basa hanya mampu menghasilkan rantai ganda. Hal ini menyebabkan pada waktu yang sama jumlah kolagen yang dihidrolisis oleh larutan asam lebih banyak daripada larutan basa. Karena itu perendaman dalam
larutan basa membutuhkan waktu yang lebih lama untuk menghidrolisis kolagen (Ward dan Courts 1977).
Hasil penelitian Nurilmala (2004) dalam pembuatan gelatin dari tulang ikan patin dan penelitian Hadi (2005) pembuatan gelatin gelatin tulang ikan kakap merah menunjukkan secara berturut-turut bahwa rendemen gelatin yang dihasilkan berkisar antara 2-15,8 % dan 5,88-18,47 %; nilai pH gelatin berkisar antara 3-6,06 dan 3,82-5,11; nilai viskositas gelatin berkisar antara 4-8 cP dan 3,43-6,73; serta kekuatan gel berkisar antara 70,4-588,6 gram bloom dan 23,47-226,8 gram bloom. Dengan hasil yang diperoleh tersebut, maka diduga bahwa gelatin dari tulang ikan keras dapat diaplikasikan dalam industri makanan, kosmetik maupun farmasi.
2.8. Penyimpanan
Penyimpanan merupakan usaha untuk melindungi bahan pangan yang disebabkan oleh berbagai hal, seperti mikroorganisme, serangga, tikus, dan kerusakan fisiologis atau biokimia (Damayanti dan Mudjajanto 1995). Penyimpanan bahan pangan atau hasil pertanian merupakan bagian yang tidak dapat dipisahkan dari pengolahan khususnya pengawetan dan pengemasan bahan pangan. Penyimpanan berfungsi sebagai pengendali persediaan makanan.
Cara penyimpanan bahan pangan selama proses pengolahan dan tingkat distribusi serta penjualan merupakan salah satu faktor dalam menentukan keamanan dan mutu bahan pangan (Buckle et al. 1985).
Kerusakan bahan pangan dapat diartikan sebagai perubahan yang terjadi pada bahan pangan (mentah atau olahan) dimana sifat-sifat kimia, fisik, dan organoleptik bahan pangan telah ditolak oleh konsumen. Suatu bahan pangan dikatakan rusak bila menunjukan adanya penyimpangan yang melebihi batas yang dapat diterima secara normal oleh panca indra atau parameter lain yang digunakan (Muchtadi 1989).
3. METODOLOGI
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret sampai Juli 2008 di Laboratorium Karakteristik Bahan Baku Hasil Perikanan, dan Laboratorium Biokimia Hasil Perikanan Departemen Teknologi Hasil Perairan, Laboratorium Teknologi Pangan dan Gizi, Balai Pusat Pasca Panen, Pusat Antar Universitas (PAU), Institut Pertanian Bogor.
3.2. Bahan dan Alat
Bahan baku yang digunakan pada pembuatan gelatin dari tulang ikan nila (Oreocrhomis niloticus) adalah tulang ikan nila yang diperoleh dari PT Aquafarm Semarang, akuades, asam klorida (HCl) teknis, dan gelatin komersial. Bahan-bahan kimia yang digunakan untuk analisis adalah NaCl, alkohol 70 %, H2SO4,
H3BO3, HCl, larutan standar pH 4 dan 7.
Alat-alat yang digunakan dalam pembuatan gelatin dari tulang ikan nila antara lain kompor listrik, panci, termometer, sikat gigi, para-para, pisau, toples plastik, pH meter, kain blacu, kapas, oven, blender, nampan, plastik tahan panas,
trash bag, kertas label, timbangan. Alat-alat analisa yang digunakan adalah lembar penilaian (score sheet), pena, piring, timbangan, TA-Texture Analizer merk LFRA, brookfield synchro-lecric viscometer, kaca obyek, pipet, melting
point apparatus merk Fisher Jones, pH-meter, inkubator, desikator, cawan tahan panas, tanur pengabuan, oven, labu kjeldahl, alat pemanas, alat destilasi, erlenmeyer, soxhlet, kertas saring, dan labu lemak.
3.3. Rancangan Penelitian
Penelitian ini dibagi menjadi dua tahap. Tahap pertama, yaitu proses pembuatan gelatin dari tulang ikan nila (Oreocrhomis niloticus) dan dilakukan analisis sifat-sifat fisika kimia gelatin yang terpilih. Tahap kedua, yaitu penyimpanan gelatin terpilih pada suhu ruang dan analisis derajat keasaman (pH), viskositas, dan kekuatan gel dari gelatin.
3.3.1. Penelitian tahap pertama
Pada tahap pertama dilakukan proses pembuatan gelatin dari bahan baku tulang ikan nila. Gelatin dengan parameter nilai pH, viskositas, dan kekuatan gel terbesar ditentukan sebagai gelatin terpilih. Gelatin terpilih kemudian dilakukan analisis sifat fisika kimia.
Prosedur pembuatan gelatin dari tulang ikan nila meliputi proses
degreasing dengan cara limbah tulang ikan nila direbus selama 30 menit pada suhu 80 °C, selanjutnya tulang dibersihkan dan dikeringkan. Tulang ikan nila yang telah kering dipotong menjadi 2-3 cm. Proses selanjutnya adalah
demineralisasi, yaitu penghilangan kalsium dan garam-garam mineral dari tulang dengan cara perendaman dalam larutan HCl 4 %, 5 %, dan 6 % dengan lama perendaman 1 dan 2 hari. Perbandingan tulang dan larutan HCl adalah 1:4. Pada proses perendaman dengan larutan HCl selama 2 hari, larutan HCl diganti setiap hari. Tulang ikan nila yang telah menjadi ossein kemudian dicuci sampai pH-nya (5-7). Kemudian dilakukan ekstraksi ossein pada suhu 85±2,5 °C selama 6 jam dengan akuades. Filtrat hasil ekstraksi selanjutnya disaring dengan kain blacu dan kapas kemudian dikeringkan menggunakan oven pada suhu 55 °C selama ±2 hari hingga didapatkan lembaran gelatin. Lembaran gelatin yang diperoleh dihancurkan menggunakan blender untuk dijadikan tepung gelatin. Diagram alir penelitian tahap pertama dapat dilihat pada Gambar 4.
Setelah tepung gelatin diperoleh kemudian dilakukan analisis diantaranya, yaitu analisis rendemen, pH, viskositas, dan kekuatan gel. Gelatin dengan nilai parameter pH, viskositas, dan kekuatan gel terbesar ditentukan sebagai gelatin terpilih. Gelatin terpilih kemudian dilakukan proses pengujian meliputi uji proksimat, titik gel, titik leleh, titik isoelektrik, aktivitas emulsi, stabilitas emulsi, derajat putih, dan asam amino. Gelatin tersebut kemudian dilakukan uji perbandingan dengan gelatin komersial (gelatin sapi) meliputi warna dan aroma (bau).
Gambar 4. Tahapan pembuatan gelatin tulang ikan nila (Oreochromis niloticus) (*Modifikasi dari Hadi 2005)
Ket : = proses = bahan
Tulang ikan nila
Degreasing (Perebusan selama 30 menit pada suhu 80 oC)
Pembersihan
Pengeringan dengan sinar matahari
Pengecilan ukuran 2-3 cm
Demineralisasi (perendaman dalam HCl 4 %, 5 %, dan 6 % (1 : 4) selama 1 dan 2 hari ) Setiap 1 hari larutan HCl diganti*
Pencucian sampai pH netral (5-7)
Ekstraksi pada suhu 85±2,5 °C selama 6 jam (ossein tidak sampai hancur)*
Penyaringan
Pengeringan menggunakan oven pada suhu 55 °C (±2 hari)
Penghancuran lembaran gelatin menggunakan blender
Tepung gelatin
3.3.2. Penelitian tahap kedua
Pada penelitian tahap kedua dilakukan pembuatan gelatin dengan perlakuan yang sama seperti gelatin terpilih. Gelatin tersebut kemudian dilakukan proses penyimpanan selama 1 bulan dan tiap minggu dilakukan uji terhadap derajat keasaman (pH), viskositas, dan kekuatan gel dari gelatin tersebut.
Gambar 5. Prosedur penelitian tahap kedua
3.4. Analisis gelatin
Gelatin yang dihasilkan pada penelitian tersebut akan dianalisis sebagai berikut:
(1). Identifikasi gelatin (JECFA 2003)
Secara fisik gelatin yang dihasilkan akan larut dalam air panas dan membentuk gel ketika didinginkan pada suhu 10 oC selama ±17 jam. Jika gel dipanaskan akan cair kembali dan membentuk gel jika didinginkan seperti pada proses awal.
(2). Rendemen (AOAC 1995)
Rendemen diperoleh dari perbandingan berat kering tepung gelatin yang dihasilkan dengan berat bahan (tulang kering yang telah dicuci bersih). Besarnya rendemen dapat diperoleh dengan menggunakan rumus:
% 100 bahan Berat kering Berat Rendemen = ×
(3). Viskositas (British Standard 757 1975)
Larutan gelatin dengan konsentrasi 6,67 % (b/b) disiapkan dengan akuades kemudian diukur viskositasnya menggunakan alat brookfield synchro-lecric
viscometer. Pengukuran dilakukan pada suhu 60 oC dengan kecepatan 60 rpm. Nilai viskositas dinyatakan dalam satuan centipoises (cP).
Analisis H-0, H-1, H-2, H-3, dan H-4 (1 minggu sekali selama 1 bulan) Jenis analisis:
derajat keasaman (pH), viskositas, kekuatan gel Gelatin
(4). Kekuatan gel (British Standard 757 1975)
Larutan gelatin dengan konsentrasi 6,67 % (b/b) disiapkan dengan akuades (7,5 gram gelatin ditambah akuades 105 ml). Larutan diaduk menggunakan
magnetic stirrer sampai homogen kemudian dipanaskan sampai suhu 80 oC selama 15 menit. Larutan dituang dalam Standard Bloom Jars (botol dengan diameter 58–60 mm, tinggi 85 mm), ditutup dan didiamkan selama 2 menit. Kemudian diinkubasi pada suhu 10 °C selama 17±2 jam.
Kekuatan gel diukur dengan menggunakan alat Texture Analyzer merek STEVEN- LFRA. Alat ini menggunakan probe dengan luas 0,1923 cm2. Sampel diletakkan dibawah probe dan dilakukan penekanan dengan beban 97 gram. Tinggi kurva kemudian diukur dengan menggunakan jangka sorong. Kekuatan gel diukur dengan menggunakan rumus:
Kekuatan gel (dyne/cm2) = FG×980
Kekuatan gel (bloom) = 20 + (2,98 x 10-3) x D
Keterangan: F = Tinggi kurva G = Konstanta (0,07)
D = Kekuatan gel (dyne/cm2)
(5). Titik gel (Suryaningrum dan Utomo 2002)
Larutan gelatin dengan konsentrasi 6,67 % (b/b) disiapkan dengan akuades dan disimpan dalam tabung reaksi yang dihubungkan dengan termometer digital, kemudian diberikan es pada sekeliling luar bagian tabung reaksi. Titik gel adalah suhu ketika larutan gelatin mulai menjadi gel dan suhu ini ditentukan pada saat sensor dapat mengangkat gel dalam tabung reaksi
(6). Titik leleh (Suryaningrum dan Utomo 2002)
Larutan gelatin dengan konsentrasi 6,67 % (b/b) disiapkan dengan akuades. Sampel dinkubasi pada suhu 10 oC selama 17±2 jam. Pengukuran titik leleh dilakukan dengan cara memanaskan gel gelatin dalam waterbath. Diatas gel gelatin tersebut diletakkan gotri dan ketika gotri jatuh ke dasar gel gelatin, maka suhu tersebut merupakan suhu titik leleh.
(7). Aktivitas emulsi (Pearce dan Kinsella 1978)
Disiapkan larutan emulsi yang terdiri dari 1 gram minyak kedelai dan diambil 3 ml larutan gelatin dalam larutan buffer asam maleat (0,1 M pH 7,0) dengan ketentuan 1 mg protein/ml pada larutan gelatin tersebut (untuk menentukan 1 mg protein/ml larutan gelatin ditentukan dengan penentuan protein metode Lowry (Copeland 1994)). Selanjutnya larutan emulsi dihomogenkan menggunakan homogenizer HG30 pada 18000 rpm selama 1 menit pada suhu 20 oC.
Diambil 100 µl dari dasar tabung menggunakan pipet mikro. Larutan gelatin tersebut segera setelah dihomogenkan dimasukkan ke dalam 5 ml larutan SDS (Sodium Dodesil Sulfat) 0,1 %. Kemudian disiapkan 6 tabung larutan SDS tersebut yang akan digunakan pada 0, 1, 2, 3, 5, 10 menit. Pada 0 menit langsung dilakukan pembacaan absorbansi. Absorbansi ditentukan pada 500 nm (Shimadzu UV-Vis spectrophotometer 1201). Absorbansi pada 0 menit dapat dinyatakan sebagai aktivitas emulsi.
(8). Stabilitas emulsi (Pearce dan Kinsella 1978)
Penentuan stabilitas emulsi merupakan lanjutan dari aktivitas emulsi. Stabilitas emulsi dilakukan dengan melanjutkan absorbansi sampai 10 menit. Kemudian jika nilai absorbansi sudah mencapai 50 % dari absorban 0 menit maka nilai tersebut adalah stabilitas emulsi, jika belum diteruskan sampai 10 menit selanjutnya. Stabilitas emulsi ditentukan dalam satuan menit.
(9). Derajat putih (Kett Electric Labolatory 1981)
Analisis warna dilakukan menggunakan Kett digital whiteness powder C–100. Sampel dalam bentuk tepung dimasukkan ke dalam cawan sampel, selanjutnya cawan tersebut dimasukkan ke dalam alat. Nilai dapat langsung dibaca pada layar dan dinyatakan dalam persentase derajat putih. Standar derajat putih blanko adalah 85,4 %.
(10). Derajat keasaman (pH) (British Standard 757 1975)
Sampel sebanyak 0,2 gram ditimbang dan didispersikan ke dalam 20 ml akuades pada suhu 80 oC. Sampel dihomogenkan dengan magnetic stirrer, kemudian diukur derajat keasamannya pada suhu kamar dengan pH meter.
(11). Kadar air (AOAC 1995)
Cawan porselen dikeringkan pada suhu 105 °C selama 1 jam. Kemudian didinginkan dan ditimbang. Contoh yang akan ditentukan kadar airnya ditimbang sebanyak 5 gram. Cawan yang telah berisi contoh dimasukkan ke dalam oven bersuhu 105 °C sampai beratnya konstan. Kadar air dihitung berdasarkan persamaan berikut: % 100 contoh Berat ) A -B ( abu Kadar = ×
Keterangan: A = berat cawan + contoh kering (gram)
B = berat cawan + contoh basah (gram)
(12). Kadar abu (AOAC 1995)
Contoh yang telah diuapkan airnya dimasukkan ke dalam tanur bersuhu 600 °C, sebelumnya berat cawan kering dan berat contoh telah diketahui. Proses penguapan dilakukan sampai semua bahan berubah warna menjadi abu–abu, kemudian contoh ditimbang. Kadar air dihitung berdasarkan persamaan berikut:
% 100 sampel Berat abu Berat abu Kadar = ×
(13). Kadar lemak (AOAC 1995)
Sebanyak 5 gram sampel dibungkus dalam kertas saring dan dimasukkan ke dalam labu soxhlet (labu sebelumnya dikeringkan dalam oven, dimasukkan ke dalam desikator lalu ditimbang). Dimasukkan pelarut hexana kemudian dilakukan
reflux selama 6 jam. Lalu labu berisi hasil reflux dipanaskan dalam oven dengan suhu 105 °C. Setelah itu didinginkan dalam desikator dan ditimbang. Kadar lemak ditentukan dengan rumus:
% 100 sampel Berat lemak Berat lemak Kadar = ×
(14). Kadar protein (AOAC 1995)
Sebanyak ±0,25 gram sampel kering, ditempatkan dalam labu kjeldahl 100 ml dan ditambahkan 0,25 gram selenium dan 3 ml H2SO4 pekat. Kemudian
dilanjutkan dengan proses destruksi (pemanasan dalam keadaan mendidih) selama 1 jam sampai larutan jernih. Setelah dingin ditambahkan 50 ml akuades dan 20 ml
NaOH 40 %, lalu didestilasi. Hasil destilasi ditampung dalam labu erlenmeyer yang berisi campuran 10 ml H3BO3 2 % dan 2 tetes indikator Brom Crsol Green-Methyl Red berwarna merah muda. Setelah volume hasil tampungan (destilat) menjadi 10 ml dan berwarna hijau kebiruan, destilasi dihentikan dan hasil destilasi dititrasi dengan HCl 0,0235 N sampai berwarna merah muda. Perlakuan yang sama juga dilakukan terhadap blangko. Dengan metode ini diperoleh kadar nitrogen total yang dihitung dengan rumus:
1000 (mg) sampel Berat % 100 14,007 HCl N B) -(S N % × × × × =
Kadar protein = % N x faktor protein (6,25)
(15). Kadar karbohidrat (AOAC 1995)
Pengukuran kadar karbohidrat dilakukan menggunakan metode analisis karbohidrat by difference. Kadar karbohidrat ditentukan dengan rumus:
Kadar karbohidrat = 100 % - (% Air + % Abu + % Lemak + % Protein)
(16). Titik isoelektrik protein (Weinewright 1977)
Sebanyak 0,2 gram sampel ditambah dengan 40 ml akuades sebagai pelarut dengan kisaran pH 4,5-10,5 (interval 0,5). Pengaturan pH dilakukan dengan menambahkan NaOH 0,5 N untuk menaikkan pH dan HCl 0,5 N untuk menurunkan pH. Setelah kondisi pH tercapai, dilanjutkan dengan pengadukan selama 30 menit untuk menyempurnakan ekstraksi. Larutan yang dihasilkan dipisahkan dengan bagian yang tidak larut dengan cara disentrifuse, kemudian disaring dengan kertas saring Whatman 41. Filtrat dianalisis kadar nitrogennya dengan metode kjeldahl. Kadar nitrogen terlarut yang paling rendah ditentukan sebagai titik isoelektrik (pl).
(17). Asam amino (Nur et al. 1992)
Sebanyak 0,2 gram sampel disiapkan dalam tabung reaksi tertutup dan ditambahkan 10 ml HCl 6 N. Sampel dimasukkan kedalam oven pada suhu 100 oC selama 24 jam, selanjutnya sampel disaring dengan menggunakan kertas saring
whatman 40. Hasil hidrolisis dipipet sebanyak 30 µl kemudian ditambahkan larutan pengering (methanol, trimetyl amine, dan Na asetat) sebanyak 30 µl lalu dikeringkan. Sampel yang telah dikeringkan ditabahkan larutan derivatisasi
(methanol, picoiotiocianat, dan trietyl amine) sebanyak 30 µl dan dibiarkan selama 30 menit. Sampel selanjutnya diencerkan dengan 200 µl larutan pengencer (asetonitril 60 %). Sampel siap dianalisis menggunakan HPLC. Kondisi HPLC pada saat analisis:
Temperatur kolom : 38 oC
Kolom : pico tag 3,9 X 150 nm coulomb Kecepatan alir : 1 ml/menit
Batas tekanan : 3000 psi
Program : sistem linear gradien Fase gerak : Asetonitril 60 %
Buffer Na asetat 1M, pH 5,75 Detektor : UV, panjang gelombang 254 nm
Konsentrasi asam amino dapat ditentukan dengan menggunakan rumus:
g) ( sampel Bobot 100 BM FP C standar area Luas sampel area Luas amino asam i Konsentras µ × × × × =
Keterangan: C = Konsentrasi standar asam amino (2,5 µg) FP = Faktor pengenceran (25 ml)
BM = Bobot molekul dari masing-masing asam amino (g/mol)
(18). Uji mutu hedonik (Rahayu 2001)
Uji mutu hedonik adalah uji sensori yang bertujuan untuk mengetahui kesan mutu yang bersifat spesifik dari produk melalui penilaian dengan 5 skala penilaian. Parameter mutu uji hedonik adalah warna dan bau. Skala nilai untuk uji mutu hedonik berbeda-beda pada tiap parameter. Skala uji mutu hedonik gelatin dapat dilihat pada Lampiran 1. Uji mutu hedonik ini menggunakan 30 orang panelis
3.5. Rancangan Percobaan dan Analisis Data
Pada penelitian tahap pertama, rancangan percobaan yang digunakan adalah rancangan acak lengkap faktorial dengan dua faktor yaitu konsentrasi HCl (4 %, 5 % dan 6 %) dan lama perendaman (1 hari dan 2 hari). Metode rancangan yang digunakan adalah sebagai berikut (Steel dan Torrie 1995):
Keterangan:
Yij : Nilai hasil pengamatan
µ : Rataan umum
Ai : Pengaruh konsentrasi HCl
Bj : Pengaruh lama perendaman
ABij : Pengaruh interaksi antara konsentrasi HCl dan lama perendaman
∑ij : Faktor galat
Jika analisis ragam berbeda nyata maka dilakukan uji lanjut menggunakan Duncan (Gaspersz 1994). Analisis data terhadap uji organoleptik menggunakan analisis ragam dengan dua perlakuan yaitu gelatin tulang ikan nila dan gelatin komersial.
Pada penelitian tahap kedua, rancangan percobaan yang digunakan adalah rancangan acak lengkap dengan satu faktor, yaitu lama penyimpanan. Metode rancangan yang digunakan adalah sebagai berikut:
Yi = µ + Ai + ∑i
Keterangan:
Yi : Nilai hasil pengamatan
µ : Rataan umum
Ai : Pengaruh lama pennnyimpanan
∑i : Faktor galat
Jika hasil analisis ragam berbeda nyata maka dilakukan uji lanjut menggunakan Duncan (Gaspersz 1994).
Rumus uji Duncan:
Sy = √(KTS/r)
Rp = qα’ x Sy
Keterangan:
Sy = significant range
KTS = jumlah kuadrat sisa
qα’ = significant studentized range (Tabel A7. di dalam Steel dan Torrie 1989)
r = ulangan
4. HASIL DAN PEMBAHASAN
4.1. Penelitian Tahap Pertama
Pada penelitian tahap pertama dilakukan uji analisis proksimat pada bahan baku yang digunakan. Berdasarkan hasil analisis proksimat tulang ikan nila kering, diketahui bahwa kandungan protein tulang ikan nila sebesar 20,85 %. Hasil analisis proksimat tulang ikan nila dapat dilihat pada Tabel 8.
Tabel 8. Hasil analisis proksimat tulang ikan nila Jumlah (%) Parameter Tulang ikan nila Tulang ikan kakap merah* Tulang sapi** Tulang ikan patin*** Kadar air 7,92 8.06 8.20 11,35 Kadar abu 62.56 59.21 69.70 42,54 Kadar protein 20,85 26.91 19.86 14,55 Kadar lemak 6,86 4.12 1.25 31,35
* Hadi (2005) ** Eastoe (1977) *** Nurilmala (2004)
Kandungan protein yang terdapat pada tulang ikan nila lebih kecil dari kandungan protein tulang ikan kakap merah 26,91 % dan lebih besar dari protein tulang sapi sebesar 19,86 % serta tulang ikan patin 14,55 %. Tulang ikan nila diduga masih bisa digunakan dalam pembuatan gelatin.
Bahan baku tulang ikan nila yang digunakan dalam pembuatan gelatin harus diperhatikan kesegarannya. Tulang ikan dalam kondisi segar dapat mempengaruhi kualitas ossein dan gelatin yang dihasilkan. Hinterwaldner (1977) menyatakan bahwa semakin segar tulang ikan yang digunakan maka kualitas gelatin yang dihasilkan juga lebih baik. Bahan baku limbah tulang ikan nila dapat dilihat pada Gambar 6.
Bahan baku tulang dilakukan proses degreasing, yaitu proses penghilangan daging, kotoran, dan lemak yang masih menempel pada tulang ikan. Proses ini dilakukan menggunakan suhu 80 oC selama 30 menit. Suhu tersebut sesuai dengan titik kelarutan dari lemak dan suhu koagulasi dari albumin, yaitu berkisar antara 32-80 oC. Penggunaan suhu lebih dari 80 oC, maka akan mengurangi banyaknya kolagen yang dihasilkan. Waktu 30 menit pada proses
degreasing merupakan waktu yang optimum untuk mengurangi jumlah lemak yang terdapat pada tulang (Hadi 2005).
Gambar 6. Limbah tulang ikan nila (Oreochromis niloticus)
Tulang ikan yang telah dibersihkan dari daging, kotoran dan lemak kemudian dikeringkan di bawah sinar matahari selama kurang lebih 2-3 hari. Tulang ikan nila kering dapat dilihat pada Gambar 7.
Gambar 7. Tulang ikan nila kering
Pengecilan ukuran tulang dilakukan sebelum proses demineralisai dan ekstraksi. Pengecilan ukuran tulang bertujuan untuk memperluas bidang permukaan sehingga pada proses demineralisasi dan ekstraksi, reaksi berlangsung lebih cepat.
Demineralisasi merupakan proses penghilangan kalsium dan garam-garam mineral yang terdapat didalam tulang sehingga tulang yang dihasilkan menjadi lunak atau disebut ossein yang terdapat kolagen didalamnya. Proses
demineralisasi (Lampiran 2) dilakukan menggunakan larutan asam klorida (HCl) dengan perlakuan konsentrasi 4 %, 5 %, dan 6 % serta lama perendaman 1 dan 2 hari. Pada perendaman 2 hari larutan HCl diganti setiap harinya (Hadi 2005).
Penggunaan konsentrasi HCl yang sering digunakan, yaitu sebesar 2-6 % dan lama perendaman yang relatif singkat, yaitu beberapa hari (Hinterwaldner 1997).
Tahapan selanjutnya adalah proses ekstraksi (Lampiran 3) menggunakan suhu 85±2,5 oC selama 6 jam. Suhu tersebut diatas suhu susut dari kolagen, yaitu diatas 60–70 oC. Jika suhu dinaikkan sampai sekitar 80 oC maka kolagen akan menjadi gelatin (Gross 1961). Pada proses ini terjadi konversi dari kolagen menjadi gelatin (Gambar 8). Waktu 6 jam merupakan waktu yang optimum karena jika dilanjutkan maka ossein akan hancur dan larut bersama akuades (Hadi 2005).
Gambar 8. Konversi kolagen menjadi gelatin (Glicksman 1969)
Larutan gelatin yang telah dihasilkan kemudian disaring menggunakan kain blacu dan kapas. Setelah itu dilakukan proses pengeringan menggunakan oven pada suhu 55 oC selama ±2 hari. Gelatin yang sudah berbentuk lembaran kemudian dihancurkan menjadi tepung menggunakan blender. Selanjutnya gelatin diidentifikasi secara fisik dengan cara melarutkan gelatin ke dalam air panas dan membentuk gel apabila didinginkan pada suhu 10 oC selama ±17 jam. Jika gel dipanaskan akan kembali mencair dan menjadi gel kembali jika didinginkan seperti pada proses awal.
Gelatin yang telah diidentifikasi secara fisik, selanjutnya dilakukan pengujian analisis derajat keasaman (pH), viskositas, dan kekuatan gel. Hasil analisis ini dilakukan untuk mengetahui proses yang terpilih dalam mendapatkan gelatin dari tulang ikan nila.
4.1.1. Sifat fisika gelatin
Sifat fisika gelatin merupakan sifat fungsional dari gelatin yang meliputi rendemen, viskositas, kekuatan gel, titik gel, titik leleh, aktivitas dan stabilitas emulsi serta derajat putih.
(1). Rendemen gelatin
Rendemen merupakan salah satu parameter penting dalam pembuatan gelatin. Jumlah rendemen gelatin yang optimal akan menentukan efisiensi perlakuan dalam pembuatan gelatin. Berdasarkan hasil penelitian diperoleh rendemen gelatin yang berkisar antara 10,18–13,27 %. Hasil rendemen gelatin tulang ikan nila dapat dilihat pada Lampiran 4.
Berdasarkan hasil penelitian, nilai rendemen gelatin tertinggi dihasilkan oleh perlakuan konsentrasi HCl 6 % dengan lama perendaman 1 hari, yaitu sebesar 13,27 %, sedangkan nilai rendemen gelatin terendah dihasilkan oleh perlakuan konsentrasi 6 % dengan lama perendaman 2 hari, yaitu sebesar 10,18 %. Nilai rendemen gelatin tulang ikan nila dapat dilihat pada Gambar 9.
*huruf superscript menunjukan hasil uji Duncan
Gambar 9. Nilai rendemen gelatin tulang ikan nila (Oreochromis niloticus)
Pada konsentrasi HCl 6 % dengan lama perendaman 1 hari merupakan perlakuan yang optimum bagi ion H+ menghidrolisis kolagen dari rantai triple
helix menjadi rantai tunggal, sehingga rendemen gelatin yang diperoleh lebih banyak. Pada konsentrasi HCl 6 % dengan lama perendaman 2 hari diduga terjadi hidrolisis lanjutan. Hal ini ditunjukan oleh kondisi ossein yang diperoleh menjadi rapuh dan mudah hancur. Pada proses penetralan pH, ossein larut bersama air