PRAKTIKUM MANAJEMEN KUALITAS AIR
STUDI KUALITAS AIR PADA EKOSISTEM SUNGAI DI DESA
TAPAK, KELURAHAN TUGUREJO, KECAMATAN TUGU
SEMARANG
PROPOSAL
Disusun oleh : Kelompok 3
AGHRE PAHLAWAN K2B 009 072
BENEDIKTUS R.I.G. K2B 009 016
FAHMI ROYAN K2B 009 041
HAYU ANINDYA A K2B 009 054
AYU WULANDARI K2B 009 036
YENI TRISNAWATI K2B 009 002
MOH ADITYA P K2B 009 034
ISTIKHANAH 26010210130066
PUNGKY NANDA P 26010210130100
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
UNIVERSITAS DIPONEGORO
I. PENDAHULUAN
1.1. Latar BelakangManajemen Kualitas Air adalah ilmu yang mempelajari tentang pengelolaan terhadap mutu air agar sesuai dengan kebutuhan makhluk hidup. Ilmu ini menjadi sangat penting peranannya dalam dunia perikanan, terutama upaya untuk mendukung dan melengkapi ilmu-ilmu yang lain seperti planktonologi, ekologi perairan, dan lain sebagainya (Hutabarat dan Evans, 2000).
Air merupakan zat yang berperan dalam kehidupan makhluk hidup. Karakteristik badan air dicirikan oleh tiga komponen utama yaitu hidrologi, fisika-kimia, dan biologi. Air juga menjadi bagian terbesar pembentuk tumbuh-tumbuhan dan binatang termasuk ikan. Air merupakan media tempat terjadinya berbagai reaksi kimia baik di dalam maupun di luar tubuh mahluk hidup. Air menutupi sekitar 70% permukaan bumi dengan jumlah kurang lebih 1368 juta km2. Penilaian kualitas harus meliputi ketiga aspek tersebut (Angel
dan Wolseley, 1992).
Selama ini kita melihat bahwa penanganan masalah air masih belum terprogram dan terealisasi sesuai dengan laju perkembangan pembangunan dan pertumbuhan penduduk. Pertumbuhan penduduk yang semakin meningkat menimbulkan kerusakan lingkungan, seperti kualitas yang tidak sesuai lagi dengan standar yang telah ditetapkan. Masalah pengelolaan air dalam dunia perikanan merupakan tantangan yang harus dicari jalan keluarnya, karena dampaknya secara langsung mempengaruhi kehidupan organisme dan komponen biologi lainnya yang ada didalam suatu ekosistem perairan (Effendi, 2003).
Berdasarkan hal-hal tersebut, praktikum Manajemen Kualitas Air menjadi sangat penting untuk dipelajari. Mahasiswa diharapkan dapat mengetahui sekaligus dapat mengelola dan mengatur kualitas air agar sesuai dengan peruntukkannya, khususnya dalam dunia perikanan.
1.2. Pendekatan dan Perumusan Masalah
Usaha budidaya ikan atau organisme air lainnya, diperlukan manajemen kualitas air yang baik yang dapat berpengaruh terhadap kelangsungan hidup ikan. Kualitas air ini dapat kita uji menggunakan parameter-parameter yang yang ada, meliputi parameter fisika dan kimia. Hal ini tentu akan mengacu pada produktivitas dan perkembangan ikan yang pada akhirnya dapat meningkatkan produtivitas perairan tersebut.
1.3. Tujuan Praktikum
Tujuan dilaksanakannya Praktikum Manajemen Kualitas Air antara lain: 1. Untuk memperkirakan kelayakan ekosistem tambak untuk dijadikan sebagai
lokasi budidaya.
2. Untuk mengetahui kualitas tanah dan tekstur tanah yang ada di ekosistem tambak.
1.4 Manfaat Praktikum
Praktikum Manajemen Kualitas Air ini menjadikan mahasiswa dapat mengetahui kualitas air dan kondisi lingkungan di kawasan tambak ..., sehingga kualitas air di tambak ... dapat dipertahankan dan dimanfaatkan semaksimal mungkin.
1.5. Lokasi dan Waktu
Pelaksanaan sampling lapangan dilaksanakan pada hari ..., ... Mei 2012 dan bertempat di Tambak, Semarang mulai pukul ... WIB sampai selesai. Analisis laboratorium dimulai hari ..., .... Mei 2012 sampai hari ..., ... Mei 2012 bertempat di Laboratorium Budidaya Perairan, Gedung C Tembalang, Fakultas Perikanan dan Ilmu Kelautan, Universitas Diponegoro, Semarang.
2.1. Kualitas Air 2.1.1. Parameter fisika A. Suhu air
Suhu suatu badan air dipengaruhi oleh musim, lintang (latitude), ketinggian dari permukaan laut (altitude), waktu dalam hari, sirkulasi udara, penutupan awan, dan aliran serta kedalaman badan air. Perubahan suhu berpengaruh terhadap proses fisika, kimia, dan biologi badan air. Suhu juga sangat berperan mengendalikan kondisi ekosistem perairan. Organisme akuatik memiliki kisaran suhu tertentu, yang sesuai untuk pertumbuhannya (Haslam, 1995).
Beberapa ekosistem perairan suhu permukaan terkadang dapat mencapai 35oC atau lebih sehingga berada di luar batas optimal bagi ikan, namun demikian
apabila keadaan tersebut terjadi maka ikan secara alamiah akan berada di dasar dimana suhunya lebih rendah. Ikan pada umumnya mempunyai toleransi yang rendah, terhadap perubahan suhu yang mendadak. Pemindahan ikan secara mendadak ke tempat yang suhunya jauh lebih tinggi atau sangat rendah perlu dihindari. Perubahan suhu seringkali mendadak sebesar 5oC dapat menyebabkan
ikan stres atau mati. Suhu air juga dipengaruhi oleh tinggi rendahnya tempat dan permukaan air, oleh karena itu dalam pemindahan ikan perlu diperhatikan.Suhu air di permukaan dipengaruhi oleh kondisi meteorologi. Faktor-faktor meteorologi yang berpengaruh ialah curah hujan, penguapan, kelembaban udara, kecepatan angin dan intensitas radiasi matahari, sehingga suhu di permukaan biasanya mengikuti pola musiman (Hutabarat, 1984).
Kecerahan air tergantung pada warna dan kekeruhan. Kecerahan merupakan ukuran transparansi perairan, yang ditentukan secara visual dengan menggunakan secchi disk. Nilai kecerahan dinyatakan dalam satuan meter. Nilai ini sangat dipengaruhi oleh keadaan cuaca, waktu pengukuran, kekeruhan, dan padatan tersuspensi, serta ketelitian orang yang melakukan pengukuran. Pengukuran kecerahan sebaiknya dilakukan pada saat cuaca cerah (Jeffries dan Mills, 1996).
Menurut Hutabarat dan Evans (2000), kedalaman perairan merupakan petunjuk keberadaan parameter limnologi pada suatu habitat akuatik tertentu. Organisme membutuhkan cahaya sinar matahari dalam melakukan fotosintesis. Penyinaran cahaya matahari akan berkurang dengan semakin tingginya kedalaman, itulah sebabnya organisme yang berperan sebagai produsen makanan utama hanya mampu melakukan fotosistesis pada kedalaman tertentu dimana masih mendapatkan penyinaran cahaya matahari yang cukup.
Kedalaman yang ideal untuk pemeliharaan atau budidaya ikan adalah 60 – 150 cm. Dasar kolam dan permukaan air yang dalam di suatu kolam, akan menambah luas ruang gerak ikan. Salah satu pertimbangan dalam menentukan kedalaman suatu kolam, yaitu kemampuan sinar matahari untuk menembus ke dasar kolam (Susanto, 1986).
C. Warna air
menyebabkan air berwarna kecokelatan atau kehitaman. Kadar besi sebanyak 0,3 mg/L dan kadar mangan sebanyak 0,05 mg/L sudah cukup dapat menimbulkan warna pada perairan.
Warna dapat diamati secara langsung atau diukur berdasarkan skala platinum kobalt (dinyatakan dengan satuan PtCo), dengan membandingkan warna air sampel dan warna standar. Air yang memiliki nilai kekeruhan rendah biasanya memiliki nilai warna tampak dan warna sesungguhnya yang sama dengan standar. Intesitas warna cenderung meningkatdengan meningkatnya nilai pH (Sawyer dan Mc Carty, 1978).
Warna perairan biasanya dikelompokkan menjadi dua, yaitu warna sesunguhnya (true color) dan warna tampak (apparent color). Warna sesungguhnya adalah warna yang hanya disebabkan oleh bahan-bahan kimia terlarut. Penentuan warna dilakukan dengan memisahkan bahan-bahan tersuspensi yang dapat menyebabkan kekeruhan terlebih dahulu. Warna tampak adalah warna yang tidak hanya disebabkan oleh bahan terlarut, tetapi juga oleh bahan tersuspensi (Effendi, 2003).
D. Bau
Bau air biasanya terdapat pada air normal dan air yang telah diolah. Bau tersebut dapat berupa bau tanah liat, amis, jamuran, klorin atau bau-bauan yang menyerupai iodoform (Winarno, 1986).
H2S biasa dideteksi dari lumpur dasar yang berwarna hitam dan berbau
belerang. Pergantian air dan pengerukan tanah dasar waktu persiapan adalah cara terbaik untuk menghilangkan H2S. Pada konsentrasi oksigen terlarut tinggi H2S
didasar perairan. Gas hidrogen sulfida (H2S) dapat cepat larut dalam air. Gas ini
menyebabkan bau busuk yang cukup tajam dan sangat beracun bagi ikan. H2S
merupakan hasil penguraian bahan organik, terutama protein dalam keadaan anaerob (tidak ada oksigen). Gas ini jarang terdapat dalam akuarium atau bak yang teraerasi penuh (Hawks, 1978).
Menurut Wardoyo (1983) banyak dari bau yang tidak sedap itu disebabkan karena adanya campuran dari nitrogen, sulfur dan fosfor dan juga berasal dari pembusukan protein serta bahan organik yang terdapat di dalam air. Bau yang paling menyengat adalah bau yang berasal dari hidrogen sulfida. Bau merupakan faktor yang penting dalam penentuan kondisi air diperkuat pula oleh kenyataan bahwa konsentrasi yang sangat kecil daripada sesuatu zat tertentu dapat ditelusuri dari baunya
E. Salinitas
Salinitas adalah konsentrasi dari total ion yang terdapat di perairan. Salinitas menggambarkan padatan total di dalam air setelah semua karbonat dikonversi menjadi oksida, semua bromida dan iodida telah digantikan oleh klorida, dan semua bahan organik telah dioksidasi. Salinitas dinyatakan dalam satuan gram/kg atau promil ( o/
oo) (Effendi, 2003).
Salinitas dinyatakan sebagai konsentrasi total dari semua ion yang terlarut dalam air. Semakin besar jumlah ion yang terkonsentrasi di dalam air, maka tingkat salinitas dan kepekatan osmolar larutan semakin tinggi, sehingga tekanan osmotik media semakin besar. Ion-ion yang dominan dalam
menentukan tekanan osmotik air laut adalah Na+ dan Cl- dengan
ini mempengaruhi efek osmotik yang ditimbulkan, baik secara langsung maupun tidak langsung terhadap proses penetasan telur dan perkembangan larva ikan (Anggoro, 1992).
Nilai salinitas perairan tawar biasanya < 0,5 promil, perairan payau 0,5 – 30 promil dan perairan laut 30 – 40 promil. Salinitas perairan hipersaline bisa mencapai kisaran 40 – 80 promil. Nilai salinitas pada perairan pesisir sangat dipengaruhi oleh masukan air tawar dari sungai (Effendi, 2003).
F. Muatan padat tersuspensi
Padatan total (residu) adalah bahan yang tersisa setelah air sampel mengalami evaporasi dan pengeringan pada suhu tertentu. Residu dianggap sebagai kandungan total bahan terlarut dan tersuspensi dalam air. Selama penentuan residu ini, sebagian besar bikarbonat yang merupakan anion utama di perairan telah mengalami transformasi menjadi karbondioksida, sehingga karbondioksida dan gas-gas lain menghilang pada saat pemanasan tidak tercakup dalam nilai padatan total (Effendi, 2003).
Menurut Effendi (2003), padatan tersuspensi total (Total Suspended Solid atau TSS) adalah bahan-bahan tersuspensi (diameter > 1µm) yang
tertahan pada saringan millipore dengan diameter pori 0,45 µm. TSS terdiri atas lumpur dan pasir halus serta jasad-jasad renik, yang terutama disebabkan oleh kikisan tanah atau erosi tanah yang terbawa ke badan air.
Settleable solid adalah jumlah padatan tersuspensi yang dapat diendapkan
bahan-bahan terlarut (diameter < 10-6 mm) dan koloid (diameter 10-6 mm - 10-3
mm) yang berupa senyawa-senyawa kimia dan bahan-bahan lain, yang tidak tersaring pada kertas saring berdiameter 0,45 µm (Effendi, 2003).
2.1.2. Parameter kimia A. Derajat keasaman (pH)
Menurut Ghufron (2007), derajat keasaman lebih dikenal dengan istilah pH. pH (singkatan dari puissance negative deH), yaitu logaritma dari kepekatan ion-ion H (hidrogen) yang terlepas dalam suatu cairan. Derajat keasaman atau pH air menunjukkan aktivitas ion hidrogen dalam larutan tersebut dan dinyatakan sebagai konsentrasi ion hidrogen (dalam mol/l) pada suhu tertentu atau dapat ditulis : pH = - log (H)+.
Ekosistem perairan, fluktuasi pH sangat dipengaruhi oleh respirasi, karena berhubungan dengan karbondioksida yang dihasilkannya. Kolam yang banyak dijumpai algae dan tumbuhan lain pH air pada pagi hari mencapai 6,5, sedangkan pada sore hari mencapai 8,9. Hubungan antara karbondioksida dengan pH bersifat berbanding terbalik, pada karbondioksida tinggi, maka pH akan cenderung rendah. Kolam dengan sistem resirkulasi, air cenderung menjadi asam karena proses nitrifikasi dari bahan organik akan mengahasilkan karbondioksida dan ion hidrogen. Sebagian ikan dapat beradaptasi dengan baik pada lingkungan perairan yang mempunyai derajat keasaman (pH antara 5 – 9) (Cholik, 1986).
terlalu basa dan dapat membunuh ikan. Untuk mengambil pH air, bisa diukur dengan beragam alat misalnya kertas lakmus atau sekarang banyak diproduksi alat baru yang disebut pH meter yang berguna untuk mengukur pH air dan tanah (Susanto, 1986).
B. Oksigen terlarut
Menurut Rejeki (2001), oksigen merupakan parameter kualitas air yang diperlukan bagi semua organisme hidup untuk pernafasan, memproduksi organisme yang diperlukan, untuk proses pencernaan dan asimilasi makanan, menjaga keseimbangan osmotik serta untuk aktifitasnya. Oksigen terlarut merupakan salah satu faktor pembatas dalam lingkungan perairan. Ditinjau dari segi ekosistem, kadar oksigen terlarut sangat menentukan kecepatan metabolisme dan respirasi serta sangat penting bagi kelangsungan dan pertumbuhan biota air.
Menurut Rejeki (2001), kandungan DO akan berkurang dengan naiknya suhu dan salinitas. Perairan dengan suhu yang sama konsentrasi oksigen terlarut sama dengan jumlah kelarutan oksigen yang ada diperairan, maka air tersebut dapat dikatakan sudah jenuh dengan oksigen terlarut. Oksigen terlarut di perairan diperoleh dari difusi gas oksigen oleh atmosfer dan fotosintesa tumbuhan hijau.
Faktor utama yang mempengaruhi kandungan oksigen dalam air adalah komunitas alga planktonik. Pada siang hari, produksi oksigen meningkat karena adanya proses fotosintesis dan pada malam hari terjadi penurunan karena oksigen digunakan untuk respirasi, jika populasi alga meningkat, maka terjadi super-saturasi oksigen di siang hari dan terjadi sub-super-saturasi di malam hari yang dapat mengakibatkan stres pada ikan. Kolam yang produktif kisaran DO bisa mencapai 7 – 8 ppt (Boyd, 1988).
C. Karbondioksida (CO2)
Menurut Cholik (1986), karbondioksida merupakan salah satu komponen udara yang dihasilkan oleh proses respirasi maupun penguraian bahan organik. Meningkatnya konsentrasi gas karbondioksida bebas (CO2) pada wadah tertutup
sebelum pengangkutan ikan merupakan masalah utama di daerah tropis. Pengaruh CO2 terhadap ikan sangat dipengaruhi oleh konsentrasi oksigen terlarut di
perairan tersebut. Konsentrasi oksigen berada pada tingkat maksimal, pengaruh gas karbondioksida dapat diabaikan.
D. Alkalinitas
Alkalinitas adalah gambaran kapasitas air untuk menetralkan asam, atau dikenal dengan sebutan acid-neutralizing capacity (ANC) atau kuantitas anion dalam air yang dapat menetralkan kation hidrogen.Alkalinitas juga diartikan sebagai kapasitas penyangga (buffer capacity) terhadap perubahan pH perairan.Penyusun alkalinitas adalah anion bikarbonat (HCO3-), karbonat (CO32-)
dan hidroksida (OH-). Borat (H
2BO3-), silikat (HSiO3-), fosfat (HPO4
2-dan H2PO4-), sulfida (HS-), dan ammonia (NH3) juga memberikan kontribusi
terhadap alkalinitas, namun pembentuk alkalinitas yang utama adalah bikarbonat, karbonat dan hidroksida. Diantara ketiga ion tersebut, ion bikarbonat merupakan ion paling banyak terdapat pada perairan alami (Effendi, 2003).
Sebagai media hidup ikan, kondisi alkalinitas air kolam perlu diketahui, karena alkalinitas merupakan salah satu parameter kimia yang dapat dipakai untuk mengetahui kebasaan air. Kisaran pH suatu perairan kadang mengalami fluktuasi atau perubahan cukup drastis. Hal ini kurang menguntungkan, sebab akan mempengaruhi kehidupan ikan yang dipelihara. Fluktuasi atau perubahan nilai pH yang drastis disuatu perairan dapat dicegah apabila perairan tersebut mempunyai sistem buffer yang memadai, apabila suatu perairan mengandung mineral karbonat, bikarbonat, borat, dan silikat, maka pada perairan tersebut akan memiliki pH diatas netral (bersifat basa) dan sekaligus dapat mencegah terjadinya penurunan pH secara drastis (Cholik, 1986).
Menurut Afrianto dan Liviawaty (1988), perairan dengan total alkalinitas kurang dari 15 atau 20 mg/l biasanya mengandung sedikit CO2 sedangkan total
Perairan dengan alkalinitas rendah mempunyai daya tangkap yang kurang atau rendah terhadap perubahan pH.
E. Kesadahan
Kesadahan (hardness) adalah gambaran kation logam divalent (valensi dua). Kation-kation ini dapat bereaksi dengan sabun (soap) membentuk endapan atau presipitasi maupun dengan anion-anion yang terdapat di dalam air membentuk endapan atau karat pada peralatan logam. Perairan tawar, kation divalen yang paling berlimpah adalah kalsium dan magnesium, sehingga kesadahan pada dasarnya ditentukan oleh jumlah kalsium dan magnesium.Kalsium dan magnesium berikatan dengan anion penyusun alkalinitas, yaitu bikarbonat dan karbonat (Effendi, 2003).
Konsentrasi total dari ion logam yang bervalensi dua terutama Ca dan Mg dinyatakan dalam mg/l setara CaCO3 menunjukkan tingkat kesadahan air. Total
alkalinitas dan kesadahan air umumnya sama, namun pada beberapa perairan tertentu lebih besar atau sebaliknya. Tingkat total alkalinitas dan kesadahan air yang diperlukan untuk budidaya ikan umumnya pada deret 20 – 300 mg/l. Bila total alkalinitas dan kesadahan air lebih rendah dapat ditingkatkan dengan pemberian kapur, sedangkan bila terlalu tinggi belum ditemukan cara yang praktis untuk menurunkannya (Cholik, 1986).
lebih banyak disebabkan oleh aktivitas bakteri di dalam tanah, yang banyak mengeluarkan karbondioksida.
2.1.3. Parameter biologi A. Produktivitas primer
Produktivitas primer di perairan menggambarkan jumlah energi cahaya yang diserap dan disimpan oleh jasad produser (phytoplankton) dalam bentuk bahan makanan (bahan organik), lewat proses fotosintesa dan kemosintesa dalam periode waktu tertentu. Nilai produktivitas primer yang dihasilkan oleh organisme-organisme autotrof (phytoplankton) di perairan dapat diduga dari kemampuannya berfotosintesa (Fakultas Perikanan ITB, 1992).
Menurut Hutabarat (1984), produktivitas primer (primary production) oleh tanaman hijau di beberapa habitat akan berbeda satu dengan yang lain. Perhitungan dilakukan dengan menggunakan skala harian maupun tahunan. Hal ini dapat disebabkan terdapatnya faktor yang secara langsung atau tidak langsung mempengaruhi aktivitas produksi. Faktor-faktor yang mempengaruhinya antara lain suhu, transparansi, arus, cahaya dan konsentrasi gas atau garam-garam biogenik. Aktivitas tumbuhan hijau akuatik dalam berfotosintesa merupakan produktivitas primer yang utama dalam perairan. Bahan organik yang terbentuk dalam proses produktivitas umumnya dinyatakan dalam jumlah gram karbon (grC) yang terikat ke dalam ikatan-ikatan organik per meter persegi per hari atau tahun (grC/m3/jam). Produksi primer di lautan bebas menunjukkan tingkat yang
relatif rendah yaitu berkisar antara 0,005 – 0,5 grC/m3/jam. Daerah paparan benua
tinggi yaitu diantara grC/m3/jam. Sekalipun demikian nilai-nilai ini masih rendah
jika dibandingkan dengan daerah tanah pertanian (sekitar 10 grC/m3/jam).
Menurut Hutabarat (1984), produktivitas primer dapat turun seiring dengan bertambahnya kedalaman karena tumbuhan berklorofil semakin berkurang. Produktivitas primer akan 0,5 – 1,25 berhenti pada kedalaman antara 30 – 100 m tergantung pada kedalaman perairan. Produktivitas primer akan naik jika perairan itu kaya akan fitoplankton dan bahan organik. Fitoplankton merupakan penyokong dari perairan. Pengamatan fitoplankton dapat dijadikan ukuran biomassa dan produktivitas perairan. Kelayakan produktivitas primer dalam suatu perairan berkisar 124,995gC/m3/jam.
2.2. Kualitas Tanah 2.2.1.Parameter kimia a. Warna tanah
berwarna biru hijau. Kuarsa umumnya berwarna putih. Batu kapur berwarna putih, kelabu, dan ada kala berwarna olive-hijau. Feldspar berwarna merah. Liat berwarna kelabu, putih, bahkan berwarna merah, ini tergantung proporsi tipe mantel besinya (Anonim, 2009).
Menurut Hardjowigeno (1992) bahwa warna tanah berfungsi sebagai penunjuk dari sifat tanah, karena warna tanah dipengaruhi oleh beberapa faktor yang terdapat dalam tanah tersebut. Penyebab perbedaan warna permukaan tanah umumnya dipengaruhi oleh perbedaan kandungan bahan organik. Makin tinggi kandungan bahan organik, warna tanah makin gelap. Sedangkan di lapisan bawah, di mana kandungan bahan organik umumnya rendah, warna tanah banyak dipengaruhi oleh bentuk dan banyaknya senyawa Fe dalam tanah. Di daerah berdrainase buruk, yaitu di daerah yang selalu tergenang air, seluruh tanah berwarna abu-abu karena senyawa Fe terdapat dalam kondisi reduksi (Fe2+). Pada
tanah yang berdrainase baik, yaitu tanah yang tidak pernah terendam air, Fe terdapat dalam keadaan oksidasi (Fe3+) misalnya dalam senyawa Fe
2O3 (hematit)
yang berwarna merah, atau Fe2O3.3H2O (limonit) yang berwarna kuning cokelat,
sedangkan pada tanah yang kadang-kadang basah dan kadang-kadang kering, maka selain berwarna abu-abu (daerah yang tereduksi) didapat pula becak-becak karatan merah atau kuning, yaitu di tempat-tempat dimana udara dapat masuk, sehingga terjadi oksidasi besi ditempat tersebut. Keberadaan jenis mineral kwarsa dapat menyebabkan warna tanah menjadi lebih terang.
b. Tekstur tanah
terkandung pada tanah (Badan Pertanahan Nasional) dari ketiga jenis fraksi tersebut partikel pasir mempunyai ukuran diameter paling besar yaitu 2 - 0.05 mm, debu dengan ukuran 0.05 - 0.002 mm dan liat dengan ukuran < 0.002 mm (penggolongan berdasarkan USDA). Keadaan tekstur tanah sangat berpengaruh terhadap keadaan sifat-sifat tanah yang lain seperti struktur tanah, permeabilitas tanah, porositas dan lain-lain (Anonim, 2009).
Menurut Anonim (2009), tekstur tanah menunjukkan kasar halusnya tanah dan dibagi menjadi beberpa kelompok antara lain; kasar (pasir, pasir berlempung), agak kasar (lempung berpasir, lempung berpasir halus), sedang (lempung berpasir sangat halus, lempung, lempung berdebu, debu), agak halus (lempung liat, lempung liat berpasir, lempung liat berdebu), halus (liat berpasir, liat berdebu). Selain itu, tanah mempunyai perbedaan dalam memegang air, kemampuan ini tergantung pada teksturnya. Tekstur tanah dapat dibahas dan dikemukakan tentang bahan mineral seperti pasir, debu dan liat dalam susunan tanah yang penting bagi berbagai kehidupan di muka bumi. Partikel-partikel tanah yang dikelompokkan berdasarkan atas ukuran tertentu disebut fraksi(partikel) tanah, fraksi tanah ini dapat kasar ataupun halus.
c. Salinitas tanah
pengaruh kimiawi, salah satunya adalah berhubungan dengan kadar bromium dan sulfat.
Estuarin atau eustaria atau air payau dapat digolongkan sebagai oligo-,meso- atau polyhalin, menurut salinitas rata-ratanya. Salinitas di tempat tertentu berbeda-beda dalam waktu satu hari, satu minggu dan satu tahun. Kecuali pada eustaria daerah tropika tertentu, keragaman merupakan karakteristik pokok dan organisme yang hidup pada habitat ini harus memiliki toleransi yang tinggi yaitu euryhalin dan eurythermal (Hutabarat, 1984).
2.2.2. Parameter kimia a. Derajat keasaman (pH)
Derajat keasaman air sangat berperan penting dalam kehidupan ikan. Derajat keasaman yang cocok untuk semua jenis ikan berkisar antara 6,7 - 8,6. Akan tetapi ada jenis ikan yang hidup pada daerah rawa yang mempunyai ketahanan untuk tetap bertahan hidup pada kisaran pH yang sangat rendah maupun tinggi yaitu 4 – 9, misalnya ikan sepat siam (Sutanto, 1994).
Tanah yang produktif untuk dijadikan tambak adalah tanah yang mempunyai pH netral sampai basa. Tanah demikian kaya akan garam dan nutrien, yang dapat merangsang pertumbuhan klekap menjadi lebih cepat. Klekap dapat tumbuh dengan baik pada tanah yang mempunyai kiasaran pH antara 6,5 – 7,5 karena pada kisaran demikian unsur hara dan kandungan phosfor mencapai tingkat terbaik untuk pertumbuhan klekap (Afrianto dan Liviawati, 1991).
b. Bahan organik
Bahan organik memiliki peranan sangat penting di dalam tanah.Bahan organik tanah juga merupakan salah satu indikator kesehatan tanah.Tanah yang sehat memiliki kandungan bahan organik tinggi, sekitar 5%, sedangkan tanah yang tidak sehat memiliki kandungan bahan organik yang rendah.Kesehatan tanah penting untuk menyamin produktivitas pertanian.
III. MATERI DAN METODE
3.1. Materi3.1.1. Alat
Alat yang digunakan dalam Praktikum Manajemen Kualitas Air ini tersaji pada Tabel 1.
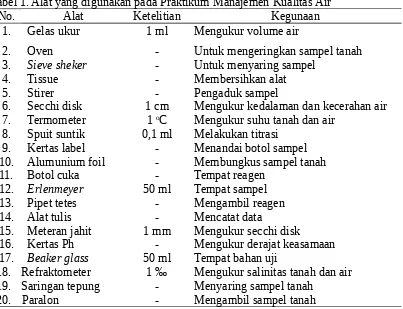
Tabel 1. Alat yang digunakan pada Praktikum Manajemen Kualitas Air
No. Alat Ketelitian Kegunaan
3. Sieve sheker - Untuk menyaring sampel
4. Tissue - Membersihkan alat
5. Stirer - Pengaduk sampel
6. Secchi disk 1 cm Mengukur kedalaman dan kecerahan air 7. Termometer 1 oC Mengukur suhu tanah dan air
8. Spuit suntik 0,1 ml Melakukan titrasi
9. Kertas label - Menandai botol sampel
10. Alumunium foil - Membungkus sampel tanah
11. Botol cuka - Tempat reagen
12. Erlenmeyer 50 ml Tempat sampel
13. Pipet tetes - Mengambil reagen
14. Alat tulis - Mencatat data
15. Meteran jahit 1 mm Mengukur secchi disk
16. Kertas Ph - Mengukur derajat keasamaan
17. Beaker glass 50 ml Tempat bahan uji
18. Refraktometer 1 ‰ Mengukur salinitas tanah dan air 19. Saringan tepung - Menyaring sampel tanah
20. Paralon - Mengambil sampel tanah
Lanjutan Tabel 1. Alat yang digunakan pada Praktikum Manajemen Kualitas Air
No. Alat Ketelitian Kegunaan
21. Mortar - Menumbuk sampel tanah
22. Bola arus - Mengukur kecepatan arus air
23. Botol BOD - Mengambil sampel air
24. Porselen - Alas untuk menumbuk tanah
25. Botol aqua - Wadah sampel air
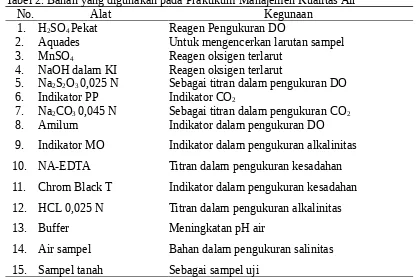
Bahan yang digunakan dalam Praktikum Manajemen Kualitas Air ini tersaji pada Tabel 2.
Tabel 2. Bahan yang digunakan pada Praktikum Manajemen Kualitas Air
No. Alat Kegunaan
1. H2SO4 Pekat Reagen Pengukuran DO
2. Aquades Untuk mengencerkan larutan sampel
3. MnSO4 Reagen oksigen terlarut
4. NaOH dalam KI Reagen oksigen terlarut
5. Na2S2O3 0,025 N Sebagai titran dalam pengukuran DO
6. Indikator PP Indikator CO2
7. Na2CO3 0,045 N Sebagai titran dalam pengukuran CO2
8.
Lokasi sampling ditentukan dengan melihat kondisi sekitarnya, apakah ada indikasi terjadi gangguan air ataupun tanah oleh kegiatan di sekitarnya, seperti keberadaan pabrik, ataupun perubahan lingkungan geogafisnya, seperti pengaruh air laut. Kegiatan pelaksanaan praktikum sampling Manajemen Kualitas Air dilaksanakan di Mangkang dengan 4 lokasi sampling yaitu muara, sungai, tambak dan pantai.
a. suhu
Metode yang di lakukan dalam pengukuran suhu adalah memasukkan termometer ke dalam perairan kemudian mendiamkan beberapa saat, kira-kira sekitar 5 menit. membaca skala yang tertera pada termometer.
b. kecerahan dan kedalaman
Metode yang dilakukan pada pengukuran kecerahan dan kedalaman adalah dengan memasukkan secchidisk ke dalam perairan. Secchidisk meturunkan pelan-pelan dan mencatat kedalaman secchidisk saat terlihat jelas, samar-samar, dan tidak terlihat. Jumlah batas samar-samar menambah batas tidak terlihat di bagi dua merupakan tingkat kecerahan. mengukur kedalaman dengan cara menurunkan tongkat secchidisk hingga menyentuh dasar perairan. Hasil pembacaan skala kemudian memasukkan ke dalam rumus:
D =
2 2
1 K
K
Dimana: D = kedalaman kecerahan air
K1 = kedalaman secchidisk tidak terlihat K2 = kedalaman secchidisk samar-samar c. warna air
Metode yang di gunakan pada pengukuran warna air dari perairan yaitu dengan melihatnya secara organoleptik.
d. bau
Metode yang digunakan dalam pengukuran salinitas adalah menggunakan refraktometer yang sudah dikalibrasi. Mengkalibrasi refraktometer dengan cara membersihkan kaca prisma dengan aquades dan tissu. Meneteskan beberapa aquades pada kaca prisma. Menutup kaca prisma hingga rapat dan tidak terdapat gelembung. mengkalibrasi refraktometer sehingga saat dilihat, menunjukkan skala 0. Mengukur salinitas air dan meneteteskan ke prisma refraktometer yang telah dikalibrasi. Tutup prisma dan membaca skala yang ditunjukkan pada refraktometer.
f. muatan padatan tersuspensi
Metode yang digunakan dalam pengukuran muatan padatan tersuspensi adalah menimbang kertas saring. Timbang sampel air dengan kertas saringan 250 µm menggunakan vacum pump. Oven sampel kemudian hingga menghasilkan nilai konstan. Masukkan kedalam rumus :
MPT (mg/l) =
Keterangan: A (mg) = berat filer
B (mg) = berat filer + sampel setelah pemanasan C (mg) = jumlah sampel
3.2.3. Pengukuran parameter kimia air a. derajat keasaman (pH)
Prosedur yang dilakukan dalam pengukuran derajat keasaman adalah memasukkan kertas lakmus ke dalam air kemudian menyocokkan warna dengan skala yang sudah ditentukan.
b. oksigen terlarut (DO)
Metode yang digunakan dalam pengukuran oksigen terlarut adalah mengambil sampel air dengan menggunakan botol BOD 250 ml. Menambahkan 1 ml MnSO4 dan 1 ml NaOH dalam KI (alkali yodida), kemudian menutup botol
dan kocok hingga larutan mengendap. Tambahkan 1 ml H2SO4 pekat kemudian
menutup botol BOD, mengocok sampai larutan berwarna kuning. Memasukkan 25 ml sampel ke dalam erlenmeyer 250 ml. Melakukan titrasi dengan 0,025 N Na2S2O3 hingga larutan berwarna kuning muda. Menambahkan 2 tetes indikator
amilum, apabilaberubah menjadi biru, titrasi melanjutkan dengan 0,025 N Na2S2O3 hingga larutan menjadi bening (warna biru hilang). membaca skala
penurunan titrasi pada spuit suntik kemudian masukkan banyaknya ml titrasi ke dalam rumus:
DO (mg/l) =
c. karbondioksida (CO2)
Metode yang digunakan dalam pengukuran CO2 bebas adalah mengambil
sampel air 25 ml dan memasukkan ke tabung Erlenmeyer. Menambahkan 2 tetes indikator PP, apabila setelah menambahkan indikator PP warna larutan sampel menjadi merah muda, maka karbondioksida adalah 0. Apabila tidak merah muda, mentitrasi lagi larutan sampel dengan 0,045 N natrium karbonat (Na2CO3) hingga
berwarna merah muda. Membaca skala banyaknya penurunan titran pada spuit suntik. Banyaknya ml titran memasukan ke dalam rumus:
CO2 (mg/l) =
d. alkalinitas
Metode yang digunakan dalam pengukuran alkalinitas adalah mengambil sampel air 50 ml dan memasukkan ke tabung Erlenmeyer. Menambahkan 2 tetes
(ml titran x N titran x 8 x 1000) (ml sampel)
indikator PP bila terjadi warna merah muda melanjutkan titrasi dengan 0,025 N HCl hingga warna merah muda hilang, mencatat jumlah HCl yang digunakan (A) dan memasukkan ke dalam rumus. Kemudian menambahkan 1-2 tetes indikator MO, kemudian mentitrasi dengan larutan HCl 0,025 N hingga berwarna merah seulas. Membaca skala penurunan titran pada spuit suntik, banyaknya HCL yang menggunakan menghitung sebagai nilai (B), memasukkan banyaknya ml titran pada rumus:
P (parsial) =
P (total) = e. kesadahan
Metode yang digunakan dalam pengukuran kesadahan adalah mengambil air sampel 10 ml dan mengencerkan sampai 50 ml dengan aquadest. Mambahkan 1-2 ml larutan buffer hingga pH 10 (biasanya cukup 1 ml). Tambahkan indikator Chrom black T, hingga warna berubah menjadi ungu violet. Titrasi mempercepat dengan menggunakan Na-EDTA sampai warna berubah menjadi biru. Apabila warna tidak berubah menjadi biru (sebelum 5 menit) ada kemungkinan indikator sudah rusak atau air contoh perlu menambah indikator yaitu 5 g Na2S9H2O atau
3,7 g Na2S5HO dalam 100 ml aquadest. Perlu diketahui larutan ini mudah rusak
oleh udara sehingga harus menutup rapat-rapat, pemakaian indikator cukup 1 ml per 25 ml air sampel. Setelah mengetahui jumlah Na-EDTA yang digunakan, lalu memasukkan ke dalam rumus :
Kesadahan = A x 150 (mg/l) Dimana: A = ml Na-EDTA
(A+B) x N HCl x 50 x 1000 ppm ml sampel
A
3.2.4. Pengukuran parameter biologi air a. produktivitas primer
Metode yang digunakan dalam pengukuran produktivitas primer adalah mengambil air sampel dengan menggunakan 2 botol BOD (gelap dan terang). memasukkan botol tersebut dan merendam selama 4 jam. Mengambil botol setelah 4 jam lalu mengukur oksigen terlarutnya. melakukan penghitungan PP berdasarkan perbedaan kelarutan oksigen di botol gelap dan botol terang dengan rumus:
PP (gC/m³/jam)= 1000( / )
32 12
I mg Pq x x X
BG BT
Keterangan: BT : botol terang BG : botol gelap X : waktu inkubasi pq : 1,2
3.2.5. Pengukuran parameter fisika tanah a. warna tanah
Menentukan warna tanah dengan mencatat warna yang ada secara organoleptik.
Menentukan tekstur tanah mengikuti metoda dari Buchanan (1992). Fraksi pasir adalah partikel-partikel yang berdiameter 0,0625 mm. Memisahkan fraksi pasir dengan metoda penyaringan basah (Wet sieving).
1. Teknik pengambilan sampel
Mempersiapkan alat untuk mengambil sampel tanah (paralon diameter 5 cm). Memasukkan paralon sedalam 30 cm ke dalam tanah yang agak lunak. Mengambil sampel tanah yang ada dalam paralon, kemudian mengeringkan sampel tanah. Menganalisa sampel tanah di laboratorium.
2. Teknik lapangan
Menyiapkan papan kayu berukuran 1x1x0,1 m. Mengambil sampel tanah dan menimbang 100 g. Melemparkan sampel tanah ke papan kayu. Menghitung fraksi lempung (yang menempel pada papan kayu) dan fraksi pasir (yang tidak menempel pada papan kayu) dengan timbangan.
3. Teknik laboratorium
Mengeringkan sampel tanah dengan oven sampai kering. Setelah kering, menumbuk sampel tanah dengan mortar sampai halus. Menyaring sampel tanah yang sudah halus dengan saringan tepung. Menimbang sampel tanah sebanyak 25 g dan memasukkan ke dalam cawan. Melakukan penyaringan basah (dengan air)
dengan saringan mesh size 53 m. Memasukkan tanah yang tersaring ke dalam
gelas ukur berisi 1 l.
Memasukkan sisa tanah yang tidak tersaring ke dalam cawan dan mengoven sampai kering, menyaring dengan sieve shaker (penyaring bertingkat), memasukkan sisa tanag yang lolos ke dalam gelas ukur 1 l diatas. Menimbang
tanah yang tidak tersaring pada masing-masing saringan menurut ukuran saringannya. Berat total tiap saringan merupakan berat pasir (sand).
Masukkan ke rumus Fraksi Pasir =
Melakukan pemipetan pada tanah di dalam gelas ukur 1 l, dengan langkah-langkah gelas ukur menggojok (membolak-balikkan). Melakukan pemipetan I setelah 58 s, memasukkan pipet hisap sedalam 20 cm dan menghisap air sebanyak 20 ml air, kemudian memasukkan ke dalam cawan A. Melakukan pemipetan II setelah 1 m 56 s, ke dalam pipet 10 cm dan isi pipet sebanyak 20 ml, kemudian memasukkan ke dalam cawan B. melakukan pemipetan III setelah 7 m 44 s, ke dalam pipet 10 cm dan isi pipet sebanyak 20 ml, kemudian memasukkan ke dalam cawan C. melakukan pemipetan IV setelah 31 m, ke dalam pipet 10 cm dan isi pipet sebanyak 20 ml, kemudian memasukkan ke dalam cawan D. melakukan pemipetan V setelah 2 jam 3 m’, ke dalam pipet 10 cm dan isi pipet sebanyak 20 ml, kemudian memasukkan ke dalam cawan E. Memasukkan cawan A, B, C, D, dan E ke dalam oven, mengoven sampai kering, kemudian menimbang. Setelah kering masukkan kedalam rumus sebagai berikut :
Fraksi Lempung =
Menambahkan aquades sebanyak 250 ml untuk mengencerkan tanah. Mengaduk tanah dengan stirrer selama 30 menit. kemudian memasukkan air tanah hasil saringan ke dalam refraktometer kemudian membaca skala salinitasnya. 3.2.6. Pengukuran parameter kimia tanah
a. derajat keasaman (pH) tanah
Metode yang digunakan dalam pengukuran pH tanah adalah mengambil sampel tanah kering sebanyak 20 g. Memasukkan sampel tanah ke dalam gelas
beker 500 ml gelas beaker. Mengukur pH larutan tanah tersebut dengan kertas pH.
b. bahan organik
Teknik lapangan pada pengamatan bahan organik yaitu yang pertama dengan mengambil sampel tanah dengan menggunakan paralon diameter 5 cm dengan cara paralon memasukkan sedalam 30 cm dalam tanah. Mengambil sampel tanah dalam paralon dan mengeringkan dengan cara mengangin-anginkan. Menganalisa sampel tanah di laboratorium.
Teknik laboratorium pada pengamatan bahan organik yaitu dengan cara memasukkan sampel tanah dalam cawan kemudian mengoven sampai kering, kemudian menggerus sampai halus dengan mortar pada mangkok porselen. Mengambil tanah sebanyak 1 g dan masukkan dalam cawan 5 ml, kemudian masukkan dalam mesin pengabuan (furnace) pada suhu 550o C selama 4 jam.
Mengeluarkan cawan dari mesin pengabuan kemudian memasukkan dalam desikator selama ± 10 menit untuk menstabilkan suhu. Menimbang berat tanah setelah mengoven (wa) dan memasukkan dalam rumus:
BO = x 100%
Keterangan:
BO = Bahan organik
DAFTAR PUSTAKA
Anonim, 2009. Dasa-Dasar Ilmu Tanah. http://dasar2ilmutanah.blogspot.com/. Diakses tanggal 18 Juni 2009.
Anonim, 2009. http://dydear.multiply.com/journal/item/8/Tekstur Tanah. Diakses tanggal 18 Juni 2009.
Boyd, C.E. 1988. Water Quality in Warmwater Fish Ponds. Fourth Printing . Auburn University Agricultural Experiment Station, Alabama, USA. ______. 1993. Bottom, Sediment and Pond Aquaculture. Departement of Fisheries
and Allied Aquaculture at Aubum University, Alabama, New York.
Cholik, et al, 1986. Pengelolaan Kualitas Air Kolam Ikan. UNFISH dan IDRC, Jakarta.
Darmawijaya, M.I. 1990. Tekstur Tanah dalam Lahan Berair di Indonesia. Fakultas Pertanian. Universitas Gadjah Mada. Yogyakarta.
Effendi, Hefni. 2003. Telaah kualitas air. Kanisius. Yogyakarta.
Hawks. 1978. Od Plankton and Produktifity On the Ocean. Pergamon Press. Oxford.
Hutabarat, S. 1984. Produktivitas Perairan dan Plankton. Universiatas Diponegoro. Semarang.
________ dan Evans. 2000. Pengantar Oceanografi. Universitas Indonesia Press, Jakarta.
Lesmana, D. S.2001.Budidaya Ikan Hias Air Tawar Populer. Penebar Swadaya. Jakarta.
Pramono, Sidik. 2009. Soil Texture. http://a
buzadan.staff.uns.ac.id/2009/09/25/Soil-texture/trackback. Sastrawijaya, A.T. 2000. Pencemaran Lingkungan. Rineka Cipta, Jakarta.
Soedarsono, P dan Suminto. 1989. Petunjuk Identifikasi Plankton di Perairan Jepara. Universitas Diponegoro. Semarang.
Sutedjo. 1991. Budidaya Ikan di Pekarangan. Penebar Swadaya. Jakarta.
Wardoyo, S.T.H. 1983. Kriteria Kualitas Air untuk Keperluan Pertanian dan Perikanan. Seminar Pengendalian Pencemaran. Direktorat Jenderal Pengairan. Departemen Pekerjaan Umum, Bandung.