OPTIMISASI TAMBAHAN GLUKOSA PADA SIFAT
TERMOGELASI KITOSAN-GLISEROFOSFAT
SEBAGAI BAHAN PERANCAH GIGI
DIAN SUSANTHY
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Optimisasi Tambahan Glukosa pada Sifat Termogelasi Kitosan-Gliserofosfat sebagai Bahan Perancah Gigi adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
DIAN SUSANTHY. Optimisasi Tambahan Glukosa pada Sifat Termogelasi Kitosan-Gliserofosfat sebagai Bahan Perancah Gigi. Dibimbing oleh PURWANTININGSIH SUGITA dan SUMINAR SETIATI ACHMADI.
Hidrogel kitosan-gliserofosfat dapat digunakan sebagai bahan perancah gigi karena bersifat termosensitif, dapat bergelasi pada suhu tubuh, mempunyai pH di sekitar pH fisiologis, bersifat biokompatibel, dan dapat menyediakan lingkungan untuk proliferasi dan diferensiasi sel. Penambahan glukosa memperlambat proses gelasi dan memberikan beberapa perubahan pada ciri fisik hidrogel kitosan-gliserofosfat, yaitu menurunkan viskositas larutan, kekuatan mekanik gel, serta ukuran pori hidrogel. Penambahan glukosa tidak memberikan pengaruh yang nyata terhadap pH larutan. Komposisi optimum penambahan glukosa berdasarkan waktu gelasi adalah formula dengan konsentrasi awal kitosan 2.5% (b/v), gliserofosfat 50% (b/v), dan glukosa 10% (b/v) dengan nisbah volume 3.8:1.0:0.2. Sifat termogelasi larutan kitosan/glukosa-gliserofosfat dipengaruhi oleh komposisi larutan, pH larutan, suhu lingkungan, serta proses sterilisasi yang dilakukan. Hidrogel kitosan/glukosa 10%-gliserofosfat berpotensi menjadi bahan perancah gigi, tetapi belum dapat mengungguli hidrogel kitosan-gliserofosfat.
Kata kunci: bahan perancah gigi, glukosa, hidrogel kitosan-gliserofosfat, termogelasi
ABSTRACT
DIAN SUSANTHY. Optimization of Glucose Addition to The Thermogellation Property of Chitosan-Glycerophosphate as Dental Scaffold. Supervised by PURWANTININGSIH SUGITA dan SUMINAR SETIATI ACHMADI.
Chitosan-glycerophosphate hydrogel can be used as dental scaffold due to its thermosensitiveness, can be gellated at body temperature, pH at body condition, biocompatibility, and can provide good environment for cell proliferation and differentiation. Glucose addition decreased the gellation rate and some physical characteristics of chitosan-glycerophosphate hydrogel, such as solution viscosity, mechanical strength of the gel, and the hydrogel pore size. Meanwhile, the glucose addition did not give any significant differences to pH of the solution. The optimum composition of glucose addition based on gellation time was volume ratio of chitosan:glycerophosphate:glucose of 3.8:1.0:0.2 and initial chitosan concentration of 2.5% (b/v), 50% (b/v) glycerophosphate, and 10% (b/v) glucose. The thermogellation property of chitosan/glucose-glycerophosphate hydrogel depends on composition, pH, temperature, and sterilization process of the solution. The hydrogel is potential to become a dental scaffold, but still cannot compete with the chitosan-glycerophosphate hydrogel.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
OPTIMISASI TAMBAHAN GLUKOSA PADA SIFAT
TERMOGELASI KITOSAN-GLISEROFOSFAT
SEBAGAI BAHAN PERANCAH GIGI
DIAN SUSANTHY
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Optimisasi Tambahan Glukosa pada Sifat Termogelasi Kitosan-Gliserofosfat sebagai Bahan Perancah Gigi
Nama : Dian Susanthy NIM : G44100028
Disetujui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Pembimbing I
Prof Ir Suminar S Achmadi, PhD Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur kepada Allah SWT atas limpahan rahmat dan nikmat-Nya sehingga penulis dapat menyelesaikan karya ilmiah skripsi dengan judul Optimisasi Tambahan Glukosa pada Sifat Termogelasi Kitosan-Gliserofosfat sebagai Bahan Perancah Gigi.
Penulis mengucapkan terima kasih kepada Prof Dr Dra Purwantiningsih Sugita, MS dan Prof Ir Suminar S Achmadi, PhD yang telah membimbing penulis selama penelitian berlangsung.Selain itu, penghargaan penulis sampaikan kepada Dr drg Tien Suwartini serta Ir Basril Abbas yang telah membantu penelitian ini.
Penulis juga menyampaikan terima kasih kepada Mamah dan Alm. Papah tercinta, serta keluarga yang telah memberikan dukungan moral dan materil selama kegiatan penelitian dan tugas akhir. Selain itu juga untuk teman-teman Activator Chemist 47, Organik 47, keluarga besar Al Hurriyyah IPB, teman-teman KSR PMI Unit I IPB, dan keluarga Bakti Nusa IPB atas bantuan dan dukungannya selama penelitian dan penyusunan skripsi ini berlangsung. Semoga karya ilmiah ini dapat memberikan manfaat sebesar-besarnya.
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 2
Tempat dan Waktu Penelitian 2
Alat dan Bahan 3
Tahapan Penelitian 3
Pembuatan Larutan Kitosan/Glukosa-Gliserofosfat 3
Pengujian Waktu Gelasi 3
Optimisasi Tambahan Glukosa 4
Pengukuran Viskositas dan pH 4
Analisis SEM 4
Analisis Spektrum FTIR 4
Pengujian Kapasitas Pembengkakan Hidrogel 4
Pengukuran Kekuatan Mekanik Gel 5
HASIL DAN PEMBAHASAN 5
Larutan Kitosan/Glukosa-Gliserofosfat 5
Nisbah Volume dan Konsentrasi Glukosa Optimum 8 Interaksi Kitosan, Gliserofosfat, dan Kitosan 10 Pengaruh Tambahan Glukosa pada Ciri Fisik Hidrogel
Kitosan-Gliserofosfat 12
Morfologi Hidrogel Kitosan/Glukosa-Gliserofosfat 13
SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1 Waktu gelasi hidrogel kitosan 2.5% (b/v), gliserofosfat 50% (b/v), dan
glukosa 50% (b/v) 9
2 Waktu gelasi hidrogel kitosan/glukosa-gliserofosfat dengan nisbah kitosan :
gliserofosfat : glukosa 3.8:1.0:0.2 10
3 Ciri fisik hidrogel kitosan-gliserofosfat dan kitosan/glukosa-gliserofosfat 12
DAFTAR GAMBAR
1 Mekanisme kerja bahan perancah 1
2 Interaksi gugus amina yang terprotonasi pada rantai kitosan dengan gugus
fosfat pada gliserofosfat 6
3 Pengaruh pH pada interaksi kitosan terprotonasi dengan gliserofosfat 6 4 Larutan kitosan tanpa glukosa sebelum diautoklaf; tanpa glukosa setelah
diautoklaf; dan dengan glukosa setelah diautoklaf 7 5 Larutan kitosan/glukosa setelah diautoklaf dengan konsentrasi glukosa
(b/v) 0.5%; 1.0%; 1.5%; 2.0%; 2.5%; 3.0%; 3.5%; 4.0%; 4.5%; dan 5.0% 7 6 Larutan kitosan-gliserofosfat sebelum dan setelah gelasi 8 7 Hubungan konsentrasi glukosa dengan waktu gelasi 10 8 Spektrum FTIR kitosan, hidrogel kitosan-gliserofosfat Sigma Aldrich,
kitosan-gliserofosfat Bioshop, kitosan-gliserofosfat dengan tambahan glu-kosa 10% (b/v), dan kitosan-gliserofosfat dengan tambahan gluglu-kosa 50%
(b/v) 11
9 Morfologi hidrogel kitosan-gliserofosfat Bioshop perbesaran 100× dan 500×; hidrogel kitosan-gliserofosfat Sigma-Aldrich perbesaran 100× dan 500×; hidrogel kitosan/glukosa 10%-gliserofosfat perbesaran 100× dan 500×; serta hidrogel kitosan/glukosa 50%-gliserofosfat perbesaran 100×
dan 1250× 14
DAFTAR LAMPIRAN
1 Bagan alir penelitian 18
2 Data spektrum FTIR kitosan, kitosan-gliserofosfat (GP), dan
kitosan/glu-kosa-gliserofosfat 19
3 Uji ANOVA dan uji berganda Duncan pada ciri fisik larutan
PENDAHULUAN
Karies gigi (gigi berlubang) menyebabkan nyeri, infeksi, abses, dan tanggal gigi. Bahan perancah (scaffold) merupakan salah satu solusi untuk masalah ini. Bahan perancah dapat digunakan sebagai kerangka 3-dimensi untuk migrasi dan pertumbuhan sel-sel serta menyediakan lingkungan yang memungkinkan proliferasi dan diferensiasi sel (Hou et al. 2004). Mekanisme kerja bahan perancah tersebut dapat dilihat pada Gambar 1. Dengan bahan perancah sebagai media penumbuhan jaringan pulpa pada gigi yang berlubang, fungsi jaringan pulpa gigi dapat dikembalikan dan mampu memperbaiki dirinya setelah terjadi cedera atau karies. Ketidakteraturan dalam rongga pulpa gigi yang mengalami karies membutuhkan bahan perancah yang berwujud cair pada suhu luar tubuh, tetapi segera memadat menjadi hidrogel saat berada pada suhu tubuh. Beberapa syarat bahan perancah yang harus dipenuhi ialah porositas yang tinggi dan ukuran pori yang cukup untuk memfasilitasi pemberian nutrisi bagi sel dan difusi melalui semua struktur sel (>20 µm) (Horst et al. 2012). Selain itu, bahan perancah harus mempunyai biodegradabilitas dan biokompatibilitas yang baik (Hao et al. 2010).
Gambar 1 Mekanisme kerja bahan perancah (Tan dan Marra 2010)
Saat ini terdapat banyak hidrogel alami maupun sintetik yang dapat digunakan sebagai bahan perancah, antara lain kolagen/gelatin, kitosan, kondroitin sulfat, asam hialuronat, agar/agarosa, fibrin (Tan dan Marra 2010), alginat (Moshaverinia et al. 2012), dan hidroksiapatit (Akkouch et al. 2014). Di antara semua bahan tersebut, kitosan paling banyak dipilih karena ketersediaannya yang melimpah, bersifat biokompatibel, biodegradabel, serta produk degradasinya yang tidak berbahaya bagi tubuh (Heinemann et al. 2008). Larutan hidrogel kitosan-gliserofosfat bersifat termosensitif dan akan mengalami gelasi pada suhu tubuh (sekitar 37 °C). Nilai pH larutan ini berada di sekitar pH fisiologis. Hidrogel kitosan-gliserofosfat juga bersifat biokompatibel dan dapat menyediakan lingkungan untuk proliferasi dan diferensiasi sel (Chenite et al. 2000, Ahmadi dan de Bruijn 2008).
Berdasarkan penelitian sebelumnya, semakin tinggi konsentrasi gliserofosfat yang digunakan dalam bahan perancah kitosan-gliserofosfat, semakin meningkat laju gelasi larutan tersebut, tetapi dapat mengurangi kemampuan hidrogel untuk
2
mendukung proliferasi sel, bahkan dapat bersifat sitotoksik. Sebaliknya, kitosan dengan konsentrasi gliserofosfat yang rendah (5−10%) dapat mendukung proliferasi sel dengan sangat baik, tetapi memiliki waktu gelasi yang cukup panjang (Ahmadi et al. 2005). Laju gelasi hidrogel kitosan-gliserofosfat dapat diperbaiki dengan menambahkan senyawa poliol seperti gliserol, sorbitol, glukosa, dan poli(etilena glikol) (PEG). Selain itu, tambahan senyawa poliol juga dapat meningkatkan sifat mekanik hidrogel. Di antara beberapa senyawa poliol tersebut, glukosa memberikan hasil yang paling baik, yaitu dengan waktu gelasi paling cepat dan pH akhir larutan pada kisaran pH fisiologis (Jarry et al. 2002). Penambahan senyawa poliol juga dapat menurunkan viskositas larutan sebelum gelasi, sehingga larutan lebih mudah disuntikkan ke dalam rongga pada gigi berlubang. Hidrogel dengan viskositas dan pH larutan sebelum gelasi yang sesuai dengan kondisi tubuh serta kekuatan mekanik dan kecepatan gelasi yang baik, sangat ideal untuk digunakan sebagai bahan perancah gigi.
Selama ini, belum ada kajian tentang tambahan glukosa optimum dalam larutan kitosan untuk menghasilkan kemampuan gelasi dan ciri hidrogel kitosan-gliserofosfat terbaik, serta interaksi yang terjadi antara kitosan, glukosa, dan gliserofosfat. Secara umum, penelitian ini bertujuan menentukan komposisi campuran glukosa, kitosan, dan gliserofosfat yang optimum untuk mendapatkan laju gelasi hidrogel kitosan-gliserofosfat yang terbaik serta dapat digunakan sebagai bahan perancah gigi. Selain itu, percobaan ini juga bertujuan membandingkan ciri hidrogel kitosan-gliserofosfat dengan dan tanpa tambahan glukosa. Ciri hidrogel yang dievaluasi meliputi pH dan viskositas larutan sebelum gelasi, waktu gelasi pada suhu 37 °C, struktur morfologi pori hidrogel dengan menggunakan mikroskop elektron pemayaran (SEM), kapasitas pembengkakan, serta kekuatan mekanik gel yang dihasilkan. Interaksi yang terjadi antara kitosan, glukosa, dan gliserofosfat dalam hidrogel diamati menggunakan spektrofotometer inframerah transformasi Fourier (FTIR). Penambahan glukosa pada hidrogel kitosan-gliserofosfat diharapkan dapat mempercepat waktu gelasi, meningkatkan ukuran pori, meningkatkan kekuatan mekanik gel, serta menurunkan viskositas larutan, tanpa memengaruhi secara nyata pH larutan sebelum gelasi, sehingga tetap sesuai dengan kondisi tubuh.
METODE
Tempat dan Waktu Penelitian
3 Alat dan Bahan
Alat-alat yang digunakan adalah autoklaf Tomy High-Pressure Steam Sterilizer ES-315, viskometer TV-10 Toki Songyo, Co. Ltd., pH-meter HM-205 DKK TOA Comp., pengering beku Christ Beta 1, spektrofotometer FTIR Shimadzu IRPrestige-21, SEM EVO M10, dan penganalisis tekstur TA-XT2i.
Bahan utama yang digunakan adalah medical grade chitosan yang didapat dari PT Biotech Surindo. Kitosan tersebut mempunyai bobot molekul sekitar 4.54×105 g/mol, derajat deasetilasi 91.44%, kadar air 8.68% berdasarkan bobot basah, dan kadar abu 0.79%. Kitosan disimpan dalam kondisi anhidrat (kelembapan <10%) sampai saat digunakan. Garam dinatrium β-gliserofosfat (GP) dibeli dari Bioshop Canada Inc. dan Sigma Aldrich Pte Ltd. (Singapura). Garam dinatrium gliserofosfat pentahidrat dari Bioshop Canada Inc. memiliki bobot molekul 306.0 dan kemurnian >98%, sedangkan garam dinatrium gliserofosfat anhidrat dari Sigma Aldrich memiliki bobot molekul 216.04 dengan kemurnian
≥99%. Serbuk ᴅ-(+)-glukosa (GLU) dibeli dari Sigma-Aldrich Pte Ltd. (Singapura).
Tahapan Penelitian
Penelitian ini terdiri atas 7 tahap, yaitu pembuatan hidrogel kitosan/glukosa-gliserofosfat, pengujian waktu gelasi, optimisasi tambahan glukosa, pengukuran viskositas dan pH larutan, analisis SEM dan FTIR, uji kapasitas pembengkakan gel, serta pengukuran kekuatan mekanik gel.
Pembuatan Larutan Kitosan/Glukosa-Gliserofosfat
Larutan kitosan 2.5% (b/v) diperoleh dengan melarutkan kitosan dalam larutan asam asetat 0.14 M, dan diaduk dengan pengaduk bermagnet selama 24 jam. Larutan kitosan disterilkan dalam autoklaf pada 121 oC selama 20 menit. Larutan glukosa yang telah dipasteurisasi kemudian ditambahkan dan larutan diaduk selama 30 menit sebelum didinginkan pada 4 oC. Larutan gliserofosfat 50% (b/v) dingin yang telah disaring dengan Microfilter 0.22 µm ditambahkan tetes demi tetes ke dalam larutan kitosan/glukosa pada penangas es dengan pengaduk bermagnet. Larutan diaduk pada suhu 4 oC selama 30 menit (modifikasi metode Jarry et al. (2002) dan Yan et al. (2010)).
Pengujian Waktu Gelasi
4
sebagai waktu gelasi, yang ditandai dengan tidak mengalirnya hidrogel dalam botol pada saat tabung dibalik dan warna larutan menjadi buram (Ahmadi et al. 2005).
Optimisasi Tambahan Glukosa
Tambahan glukosa dioptimisasi dengan meragamkan nisbah volume kitosan 2.5% (b/v)-gliserofosfat 50% (b/v)-glukosa 50% (b/v) sehingga didapatkan nisbah volume terbaik berdasarkan waktu gelasi yang dihasilkan. Pada nisbah volume terbaik, konsentrasi glukosa yang dimasukkan diragamkan, yaitu 0%, 10%, 30%, dan 50% (b/v). Konsentrasi glukosa optimum juga ditentukan berdasarkan waktu gelasi yang dihasilkan.
Pengukuran Viskositas dan pH
Viskositas larutan hidrogel kitosan-gliserofosfat diukur dengan menggunakan viskometer digital pada suhu ruang, dan dicatat dalam satuan cP. Sementara pH larutan hidrogel kitosan-gliserofosfat diukur dengan menggunakan pH-meter pada suhu ruang. Setiap formula diukur sebanyak 3 kali ulangan (triplo).
Analisis SEM
Sampel hidrogel kitosan-gliserofosfat dikeringkan dengan proses pengeringan beku selama 72 jam. Bahan perancah hidrogel kering dipotong, kemudian disalut menggunakan Coater Coating IB-2 Ion. Morfologi pori bahan perancah kitosan-gliserofosfat diamati dengan SEM. Diameter pori rata-rata ditentukan dengan Image G berdasarkan hasil foto SEM.
Analisis Spektrum FTIR
Interaksi antara kitosan, gliserofosfat, dan glukosa diamati berdasarkan perubahan serapan dalam spektrum FTIR. Sampel kering dipreparasi dengan serbuk KBr dan dipayar pada rentang bilangan gelombang 4000 sampai 400 cm-1.
Pengujian Kapasitas Pembengkakan Hidrogel
5 air yang menetes. Kantung ditimbang kembali dan kapasitas pembengkakan dihitung dengan persamaan berikut:
Keterangan: a = Bobot sampel sebelum perendaman (g) b = Bobot sampel setelah perendaman (g)
Pengukuran Kekuatan Mekanik Gel
Kekuatan mekanik gel diukur dengan menggunakan penganalisis tekstur TA-XT2i. Sampel hidrogel dimasukkan ke dalam cetakan berbentuk tabung dengan diameter 2 cm dan tinggi 2 cm, kemudian dipanaskan hingga menjadi gel. Gel lalu diletakkan di tempat sampel dan alat dioperasikan untuk mengukur gaya maksimum yang diperlukan agar gel pecah. Pengukuran dilakukan sebanyak 3 kali ulangan.
HASIL DAN PEMBAHASAN
Larutan Kitosan/Glukosa-Gliserofosfat
Larutan kitosan-gliserofosfat peka terhadap pH dan suhu. Tambahan glukosa diharapkan tidak menurunkan kepekaan tersebut. Sifat larutan kitosan/glukosa-gliserofosfat dipengaruhi oleh beberapa faktor penting, antara lain derajat deasetilasi kitosan, keasaman pelarut, metode sterilisasi larutan, suhu pembuatan larutan, dan komposisi larutan.
6
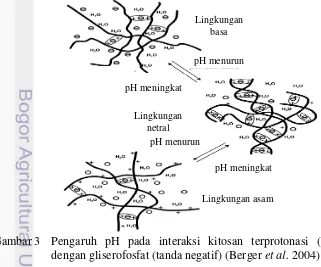
Gambar 2 Interaksi gugus amina yang terprotonasi pada rantai kitosan (tanda positif) dengan gugus fosfat pada gliserofosfat (tanda negatif) (Berger et al. 2004)
Larutan kitosan dibuat dengan melarutkan kitosan dalam asam asetat 0.14 M. Asam asetat dengan konsentrasi lebih rendah (0.10 M) tidak dapat melarutkan kitosan hingga 2.5% (b/v). Hal ini menyebabkan gel yang dihasilkan tidak homogen. Asam asetat dengan konsentrasi lebih tinggi (0.17 M) dapat melarutkan kitosan hingga 6% (b/v), tetapi gelasi terjadi sangat lama, lebih dari 24 jam. Kedua hal tersebut menunjukkan bahwa banyaknya kitosan yang dapat larut berbanding lurus dengan konsentrasi asam asetat yang digunakan, karena semakin tinggi konsentrasi asam, semakin baik protonasi dan semakin larut kitosan dalam air. Namun, waktu gelasi justru berbanding terbalik dengan konsentrasi asam asetat tersebut. Hal ini sesuai dengan hasil penelitian Han et al. (2004) bahwa semakin rendah pH larutan kitosan, semakin tinggi suhu gelasinya, sehingga gelasi akan terjadi lebih lambat. Peningkatan suhu dan waktu gelasi tersebut menunjukkan bahwa jumlah gugus amonium pada rantai kitosan merupakan faktor penting dalam proses gelasi. Semakin rendah pH larutan kitosan, semakin banyak jumlah gugus amonium (Gambar 3). Tolakan elektrostatik akan meningkat sehingga proses gelasi lebih sulit terjadi. Sebaliknya, semakin tinggi pH larutan kitosan, semakin sedikit jumlah gugus amonium, sehingga semakin cepat gelasi berlangsung.
Gambar 3 Pengaruh pH pada interaksi kitosan terprotonasi (tanda positif) dengan gliserofosfat (tanda negatif) (Berger et al. 2004)
Lingkungan basa
pH menurun
pH meningkat
pH menurun
pH meningkat Lingkungan
netral
7 Larutan kitosan/glukosa-gliserofosfat disiapkan dalam kondisi aseptis untuk meminimumkan kontaminasi bakteri selama proses pembuatan dan penyimpanan. Hasil penelitian ini menunjukkan bahwa larutan kitosan/glukosa mengalami pencokelatan ketika disterilisasi menggunakan autoklaf (Gambar 4). Pencokelatan tersebut tetap berlangsung walaupun glukosa yang ditambahkan hanya 0.5% (b/v). Semakin banyak glukosa yang ditambahkan, semakin gelap warna larutan yang dihasilkan (Gambar 5). Hasil ini berbeda dengan temuan Jarry et al. (2002) yang melaporkan bahwa larutan kitosan/glukosa dapat disterilkan dengan autoklaf dan hanya akan sedikit mengubah warna larutan pada konsentrasi glukosa 5% (b/v). Perbedaan ini dapat terjadi karena adanya langkah tambahan sebelum autoklaf yang dilakukan oleh Jarry et al. (2002), tetapi hasilnya tidak dilaporkan. Oleh karena itu, larutan induk disterilisasi secara terpisah sesuai dengan sifat larutan masing-masing. Larutan kitosan yang tahan panas diautoklaf, larutan glukosa yang mudah mengalami karamelisasi jika terpapar panas berlebihan dipasteurisasi, dan larutan gliserofosfat yang harus berada dalam kondisi dingin disaring dengan Microfilter 0.22 µm.
Gambar 4 Larutan kitosan tanpa glukosa sebelum diautoklaf (a); tanpa glukosa setelah diautoklaf (b); dan dengan glukosa setelah diautoklaf (c)
Gambar 5 Larutan kitosan/glukosa setelah diautoklaf dengan konsentrasi glukosa (b/v) 0.5% (a); 1.0% (b); 1.5% (c); 2.0% (d); 2.5% (e); 3.0% (f); 3.5% (g); 4.0% (h); 4.5% (i); dan 5.0% (j)
Larutan glukosa yang telah dipasteurisasi dimasukkan ke dalam larutan kitosan yang telah diautoklaf. Pencampuran ini berbeda dengan metode Jarry et al. (2002) yang menambahkan glukosa dalam bentuk serbuk ke dalam kitosan sebelum diautoklaf. Akan tetapi, pada penelitian ini hal tersebut didapati mencokelatkan larutan pada saat diautoklaf. Pencokelatan ini disebabkan oleh terjadinya reaksi Maillard, ketika suatu bahan yang mengandung gugus amina dan gula pereduksi terpapar oleh panas sehingga senyawa-senyawa yang ada di dalamnya tertata ulang membentuk senyawa-senyawa baru. Reaksi tersebut mengubah struktur, warna, aroma, dan cita rasa (Somoza dan Fogliano 2013). Reaksi Maillard dapat dicegah dengan menggunakan pelarut yang lebih asam sehingga gugus amina pada rantai kitosan terprotonasi sempurna, atau dengan mengubah metode penambahan glukosa.
f g h i j
a b c d e
8
Larutan gliserofosfat 50% (b/v) dimasukkan ke dalam larutan kitosan/glukosa dingin dengan nisbah volume 4:1, sehingga konsentrasi akhir kitosan sekitar 2% (b/v) dan gliserofosfat kira-kira 10% (b/v). Penambahan gliserofosfat dengan konsentrasi lebih rendah, yaitu 25% (b/v) telah dilakukan pada penelitian pendahuluan dengan nisbah volume yang sama, tetapi waktu gelasi yang dihasilkan sangat lama, yaitu sekitar 60 menit. Hal ini sesuai dengan penjelasan Han et al. (2004) bahwa semakin tinggi konsentrasi gliserofosfat yang digunakan dan semakin tinggi pH akhir larutan, semakin cepat gelasi akan berlangsung, tetapi semakin tinggi pula toksisitas larutan. Garam dinatrium β -gliserofosfat pentahidrat mempunyai 3 peran penting dalam pembentukan hidrogel kitosan, yaitu (1) menaikkan pH larutan kitosan hingga mendekati pH fisiologis (6.7−7.4); (2) mencegah terjadinya gelasi atau pengendapan seketika; dan (3) memungkinkan proses pembentukan hidrogel yang dapat diatur dengan
meningkatkan suhu larutan. Garam β-gliserofosfat merupakan basa lemah yang dapat menetralkan larutan kitosan hingga mencapai pH fisiologis serta melindungi rantai kitosan dengan gugus gliserolnya, sehingga dapat mencegah terjadinya pengendapan seketika (Chenite et al. 2001).
Nisbah Volume dan Konsentrasi Glukosa Optimum
Gelasi merupakan proses pembentukan jejaring baru dari banyak molekul yang berinteraksi (Han 2007). Proses gelasi larutan kitosan-gliserofosfat ditandai dengan meningkatnya kekeruhan dan kekentalan larutan seiring dengan kenaikan suhu hingga terbentuknya hidrogel (Gambar 6). Waktu yang dibutuhkan oleh larutan untuk berubah menjadi gel sempurna disebut sebagai waktu gelasi. Proses gelasi larutan kitosan-gliserofosfat sangat dipengaruhi oleh pH larutan dan suhu lingkungannya (Han et al. 2004).
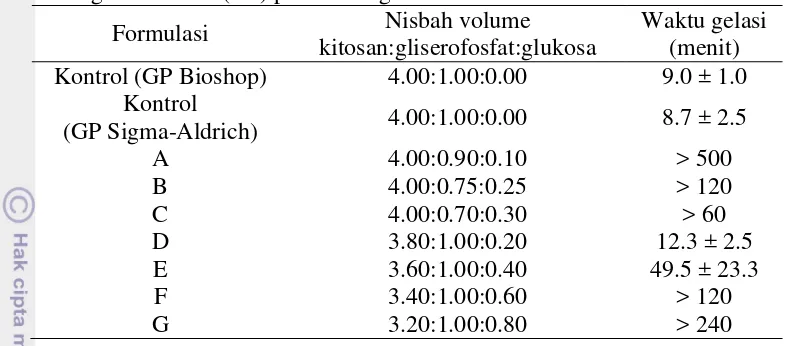
9 Tabel 1 Waktu gelasi hidrogel kitosan 2.5% (b/v), gliserofosfat 50% (b/v), dan
glukosa 50% (b/v) pada berbagai nisbah volume
Formulasi Nisbah volume
(GP Sigma-Aldrich) 4.00:1.00:0.00 8.7 ± 2.5
A 4.00:0.90:0.10 > 500
Tabel 1 menunjukkan bahwa hidrogel kitosan-gliserofosfat Sigma-Aldrich dan Bioshop memiliki waktu gelasi yang sedikit berbeda. Perbedaan ini dapat disebabkan oleh perbedaan bobot molekul gliserofosfat yang digunakan. Bobot molekul gliserofosfat Sigma-Aldrich adalah 216.04, sedangkan bobot molekul gliserofosfat Bioshop adalah 306.0. Bobot molekul yang lebih besar menyebabkan jumlah mol lebih sedikit walaupun massanya sama. Jumlah mol gliserofosfat yang lebih banyak dapat membentuk taut-silang yang lebih banyak, sehingga gel lebih cepat terbentuk. Di antara semua formulasi tersebut, formula 3.80:1.00:0.20 menunjukkan hasil terbaik dengan waktu gelasi sekitar 12 menit. Hal ini sesuai dengan syarat bahan perancah yang disebutkan oleh Wang dan Stegemann (2010), yaitu waktu gelasi hidrogel kitosan-gliserofosfat harus kurang dari 30 menit, sebab pemaparan gliserofosfat 2.5−15% selama 30 menit tidak toksik terhadap sel. Setelah 30 menit, gliserofosfat yang berlebih diharapkan dapat dihilangkan dengan pembilasan setelah gel terbentuk. Hal tersebut dapat mengurangi sitotoksisitas hidrogel kitosan-gliserofosfat.
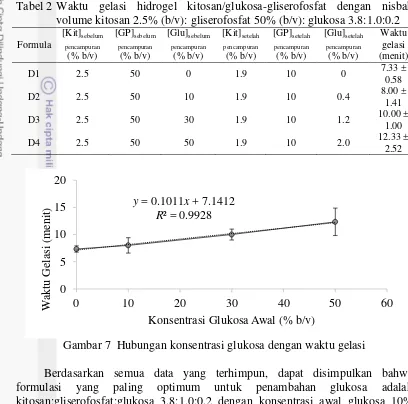
Setelah nisbah volume kitosan, glukosa, dan gliserofosfat optimum didapatkan, konsentrasi glukosa yang optimum ditentukan untuk mengevaluasi pengaruh tambahan glukosa pada waktu gelasi hidrogel kitosan-gliserofosfat. Hasil waktu gelasi larutan dapat dilihat pada Tabel 2 dan Gambar 7. Peningkatan konsentrasi glukosa mempunyai hubungan yang sebanding dengan peningkatan waktu gelasi melalui persamaan regresi linear y = 0.1011x + 7.1412 dengan nilai R² = 0.9928. Berdasarkan hubungan ini, peningkatan konsentrasi glukosa akan memperlambat proses gelasi. Hal ini dapat terjadi karena gugus hidroksil yang dimiliki glukosa dapat berinteraksi dengan gugus hidroksil dalam rantai kitosan sehingga mencegah terjadinya interaksi antarrantai kitosan.
10
10% (b/v) karena memberikan waktu gelasi yang paling cepat, menghasilkan gel yang lebih seragam, dan cukup stabil pada suhu ruang.
Tabel 2 Waktu gelasi hidrogel kitosan/glukosa-gliserofosfat dengan nisbah volume kitosan 2.5% (b/v): gliserofosfat 50% (b/v): glukosa 3.8:1.0:0.2
Formula
Gambar 7 Hubungan konsentrasi glukosa dengan waktu gelasi
Berdasarkan semua data yang terhimpun, dapat disimpulkan bahwa formulasi yang paling optimum untuk penambahan glukosa adalah kitosan:gliserofosfat:glukosa 3.8:1.0:0.2 dengan konsentrasi awal glukosa 10% (b/v). Konsentrasi akhir glukosa yang digunakan pada formula ini adalah 0.4% (b/v). Nilai ini lebih rendah daripada konsentrasi penambahan glukosa yang digunakan oleh Jarry et al. (2002), yaitu 1−5% (b/v).
Interaksi Kitosan, Gliserofosfat, dan Glukosa
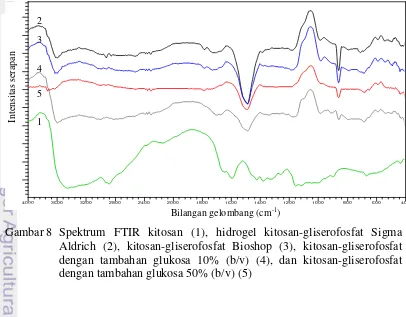
Interaksi kitosan dengan gliserofosfat dan glukosa dapat diamati dengan membandingkan spektrum inframerah kitosan, kitosan-gliserofosfat, dan kitosan/glukosa-gliserofosfat (Gambar 8 dan Lampiran 2). Puncak-puncak serapan pada spektrum dibandingkan dengan tabel korelasi yang dilaporkan oleh Pavia et al. (2009). Serapan di sekitar daerah 3400 cm-1 menunjukkan keberadaan gugus NH2primer pada rantai kitosan, seperti yang diperoleh Xu et al. (2005). Serapan pada daerah 1500−1650 cm-1 dan 1000−1200 cm-1 juga semakin menunjukkan adanya gugus amina pada rantai kitosan. Ketiga puncak ini menjadi lebih kecil, atau bahkan hilang sama sekali setelah menjadi hidrogel kitosan-gliserofosfat. Hal
11 ini menunjukkan bahwa gugus amina primer pada rantai kitosan telah terprotonasi menjadi kation amonium, yang diperlihatkan dengan serapan sedang di 2500−3300 cm-1 dan serapan kuat di sekitar 1500 cm-1.
Perbedaan merek gliserofosfat yang digunakan tidak berpengaruh pada ikatan yang terbentuk. Hal ini ditunjukkan oleh pita serapan hidrogel kitosan-gliserofosfat Sigma-Aldrich (pita 2) maupun Bioshop (pita 3) yang hampir serupa.
Serapan di daerah 1300−1240 cm-1 dan 845−850 cm-1 menunjukkan keberadaan gugus ester fosfat pada hidrogel.
Pita serapan lebar yang terdapat di sekitar daerah 3600 cm-1 menunjukkan keberadaan gugus hidroksil bebas dari molekul air yang dilepaskan saat terbentuknya ikatan glikosida antara gugus hidroksil pada rantai kitosan dan gugus hidroksil pada gliserofosfat atau glukosa. Luas puncak serapan terkoreksi sebesar 0.002 pada pita 2 dan pita 4, dan meningkat menjadi sebesar 0.085 pada pita 5. Peningkatan intensitas ini menunjukkan bahwa tambahan glukosa meningkatkan jumlah gugus hidroksil bebas atau air yang terbentuk. Serapan sedang di daerah
1100−1300 cm-1
juga mendukung keberadaan ikatan glikosida. Pita 2 mempunyai luas puncak serapan terkoreksi sebesar 2.147, pita 4 sebesar 1.750, dan pita 5 sebesar 0.801. Serapan pita 4 dan pita 5 di daerah tersebut seharusnya lebih tinggi daripada pita 2. Luas puncak serapan yang lebih rendah dapat disebabkan oleh ketidakseragaman jumlah sampel yang dianalisis sehingga analisis kuantitatif sulit dilakukan. Dapat disimpulkan bahwa tambahan glukosa dapat menambah banyaknya ikatan glikosida yang terbentuk dan menambah banyaknya molekul air bebas sehingga viskositas larutan menjadi menurun.
Gambar 8 Spektrum FTIR kitosan (1), hidrogel kitosan-gliserofosfat Sigma Aldrich (2), kitosan-gliserofosfat Bioshop (3), kitosan-gliserofosfat dengan tambahan glukosa 10% (b/v) (4), dan kitosan-gliserofosfat dengan tambahan glukosa 50% (b/v) (5)
12
Pengaruh Tambahan Glukosa pada Ciri Fisik Hidrogel Kitosan-Gliserofosfat
Glukosa merupakan salah satu bahan aditif polimer yang sering digunakan pada kitosan untuk melindungi kitosan selama proses pemanasan maupun radiasi saat sterilisasi. Penambahan glukosa pada hidrogel kitosan-gliserofosfat diharapkan mampu meningkatkan ciri fisik hidrogel sehingga dapat menjadi bahan perancah gigi yang lebih baik. Beberapa ciri tersebut adalah pH, viskositas, dan kapasitas pembengkakan.
Tabel 3 menunjukkan hasil pengukuran viskositas, pH, kapasitas pembengkakan, serta kekuatan mekanik hidrogel kitosan-gliserofosfat dan kitosan/glukosa-gliserofosfat. Tambahan glukosa dapat menurunkan viskositas larutan yang terbentuk secara nyata tanpa banyak memengaruhi pH larutan tersebut (hasil uji ANOVA dapat dilihat pada Lampiran 3). Nilai pH yang
diperoleh memenuhi syarat nilai pH bahan perancah, yaitu 6.7−7.3. Penurunan
viskositas tersebut dapat membantu bahan perancah agar lebih mudah berinteraksi dengan cairan tubuh. Viskositas yang lebih rendah dapat menurunkan risiko matinya sel karena ketidaksesuaian tingkat osmolalitas larutan hidrogel dan larutan tubuh. Penurunan viskositas ini diduga terjadi karena peran glukosa yang mempunyai banyak gugus hidroksil, sehingga dapat berinteraksi dengan gugus hidroksil pada rantai kitosan dan mengurangi ikatan hidrogen dan interaksi hidrofobik yang terbentuk antarrantai kitosan. Peran glukosa tersebut hampir menyerupai peran gliserol yang dilaporkan oleh Chenite et al. (2001).
Tabel 3 Ciri fisik hidrogel kitosan-gliserofosfat dan hidrogel kitosan/glukosa-gliserofosfat
4.55±0.33 6.97±0.04 -0.35±0.05 29.40±16.54
Kitosan-berbeda nyata terhadap kitosan-gliserofosfat (GP Bioshop) berdasarkan uji ANOVA dengan taraf nyata 0.05
13 dari ikatan glikosidik antara gugus hidroksil yang ada pada rantai kitosan dan gugus hidroksil pada glukosa. Konsentrasi air yang lebih tinggi di dalam hidrogel daripada di luar hidrogel atau di larutan menyebabkan air berosmosis dari dalam ke luar hidrogel sehingga hidrogel menyusut. Hal ini dapat dilihat dari semakin menurunnya bobot hidrogel pada kitosan/glukosa 50%-gliserofosfat. Semakin banyak glukosa yang terdapat dalam larutan, semakin banyak molekul air yang dibebaskan, semakin besar pula penyusutan bobot yang terjadi. Hasil tersebut berbeda dengan nilai kapasitas pembengkakan atau jumlah penyerapan air yang dilaporkan oleh Nwe et al. (2009) yang menyatakan bahwa hidrogel kitosan dapat menyerap air 30−55 g/g sampel. Perbedaan ini dapat disebabkan oleh perbedaan metode pembuatan hidrogel. Nwe et al. membuat hidrogel kitosan dengan menggunakan basa kuat sehingga gelasi terjadi secara cepat dan tidak ada molekul air bebas yang dihasilkan.
Selain menurunkan viskositas larutan, tambahan glukosa juga menurunkan kekuatan mekanik gel yang terbentuk (Tabel 3). Penurunan tersebut dapat terjadi karena glukosa menyelimuti rantai kitosan sehingga mengganggu keseimbangan interaksi hidrofobik dan ikatan hidrogen yang terbentuk antarrantai kitosan. Terganggunya keseimbangan tersebut dapat berdampak pada menurunnya kekuatan mekanik hidrogel karena keseimbangan tersebut merupakan faktor penentu terbentuknya hidrogel kitosan-gliserofosfat yang baik (Qiu et al. 2011). Penurunan kekuatan mekanik seiring dengan penambahan glukosa juga dapat disebabkan oleh banyaknya molekul air bebas yang terdapat di dalam larutan sehingga larutan menjadi kurang pekat dan gel yang dihasilkan kurang kuat.
Morfologi Hidrogel Kitosan/Glukosa-Gliserofosfat
Morfologi hidrogel kitosan-gliserofosfat dan kitosan/glukosa-gliserofosfat dapat dilihat pada Gambar 9. Hidrogel kitosan-gliserofosfat mempunyai banyak pori berbentuk bulat dengan ukuran pori sekitar 35.36 µm untuk gliserofosfat Bioshop (Gambar 9a dan 9b) dan 24.62 µm untuk gliserofosfat Sigma-Aldrich (Gambar 9c dan 9d). Hidrogel kitosan/glukosa 10%-gliserofosfat (formula D2) mempunyai pori lebih besar, sekitar 49.57 µm, tetapi jumlah porinya lebih sedikit (Gambar 9e dan 9f). Glukosa membuat pori hidrogel menjadi lebih rapat dan lebih padat. Hal ini terjadi karena gugus hidroksil pada glukosa dan yang ada di rantai kitosan, dapat berinteraksi membentuk ikatan glikosida antara kitosan dan glukosa dengan melepaskan gugus H2O, sehingga mendekatkan jarak antarrantai kitosan menjadi lebih rapat. Pengaruh glukosa lebih terlihat pada hidrogel kitosan/glukosa 50%-gliserofosfat (formula D4). Pori-pori hidrogel menjadi sangat rapat dan berukuran sangat kecil, sekitar 7.8 µm (Gambar 9g dan 9h).
Menurut kajian yang dilakukan oleh Horst et al. (2012), diameter sebagian besar sel manusia berukuran 10−30 µm, diameter serat saraf 0.2−20 µm, dan diameter sebagian besar arteri pulpa lebih kecil dari 100 µm. Dengan demikian, selain kitosan/glukosa 50%-gliserofosfat, bahan perancah yang dibuat pada penelitian ini berpotensi mendukung regenerasi jaringan pulpa gigi.
14
keempat hidrogel tersebut, interkoneksitas antarpori yang terbaik ditunjukkan oleh hidrogel kitosan-gliserofosfat karena memiliki jumlah pori yang lebih banyak, lebih halus, dan lebih seragam daripada hidrogel kitosan/glukosa-gliserofosfat.
Gambar 9 Morfologi hidrogel kitosan-gliserofosfat Bioshop perbesaran 100× (a) dan 500× (b); hidrogel kitosan-gliserofosfat Sigma-Aldrich perbesaran 100× (c) dan 500× (d); hidrogel kitosan/glukosa 10%-gliserofosfat perbesaran 100× (e) dan 500× (f); serta hidrogel kitosan/glukosa 50%-gliserofosfat perbesaran 100× (g) dan 1250× (h).
h g
f e
d c
15
SIMPULAN DAN SARAN
Simpulan
Tambahan glukosa memperlambat proses gelasi dan memberikan beberapa perubahan pada ciri fisik hidrogel kitosan-gliserofosfat, yaitu menurunkan viskositas larutan, kekuatan mekanik gel, serta ukuran pori hidrogel. Tambahan glukosa tidak nyata memengaruhi pH larutan. Komposisi optimum tambahan glukosa berdasarkan waktu gelasi adalah formulasi dengan konsentrasi awal kitosan 2.5% (b/v), gliserofosfat 50% (b/v), dan glukosa 10% (b/v) serta nisbah volume 3.8:1.0:0.2. Sifat termogelasi larutan kitosan/glukosa-gliserofosfat dipengaruhi oleh komposisi larutan, pH larutan, suhu lingkungan, serta proses sterilisasi yang dilakukan. Hidrogel kitosan/glukosa 10%-gliserofosfat berpotensi menjadi bahan perancah gigi, tetapi belum dapat mengungguli hidrogel kitosan-gliserofosfat.
Saran
Hidrogel harus dipreparasi dengan lebih cermat, misalnya dengan metode sterilisasi yang lebih baik, penangas air yang lebih stabil, serta waktu dan kecepatan pengadukan yang lebih seragam. Sebaiknya potensi hidrogel kitosan/glukosa-gliserofosfat sebagai bahan perancah gigi dikaji lebih lanjut untuk mengetahui kemampuannya meregenerasi kompleks dentin-pulpa gigi serta laju degradasi hidrogel tersebut. Pembandingan dengan bahan perancah gigi komersial juga perlu dilakukan untuk mengetahui keunggulan hidrogel kitosan/glukosa-gliserofosfat sebagai bahan perancah gigi. Penggantian glukosa atau tambahan aditif lain perlu dikaji untuk meningkatkan waktu gelasi serta sifat fisik gel.
DAFTAR PUSTAKA
Ahmadi R, de Bruijn JD. 2008. Biocompatibility and gelation of chitosan-glycerol phosphate hydrogels. J Biomed Mater Res. 86A(3):824-832. doi:10.1002/jbm.a.31676.
Ahmadi R, Zhou M, de Bruijn JD. 2005. The use of thermo-sensitive chitosan as an injectable carrier for bone tissue engineering. Eur Cells Mater. 10(2):61. Akkouch A, Zhang Z, Rouabhia M. 2014. Engineering bone tissue using human
dental pulp stem cells and an osteogenic collagen-hydroxyapatite-poly(ʟ -lactide-co-ɛ-caprolactone) scaffold. J Biomater Appl. 28(6):922-36. doi:10.1177/0885328213486705.
16
Cao W, Jing D, Li J, Gong Y, Zhao N, Zhang X. 2005. Effects of the degree of deacetylation on the physicochemical properties and schwann cell affinity of chitosan films. J Biomater Appl. 20:157-177. doi:10.1177/0885328205049897.
Chenite A, Chaput C, Wang D, Combes C, Buschmann MD, Hoemann CD, Leroux JC, Atkinson BL, Binette F, Selmani A. 2000. Novel injectable neutral solutions of chitosan form biodegradable gels in situ. Biomaterials. 21(21):2155-2161. doi:10.1016/S0142-9612(00)00116-2.
Ganji F, Abdekhodaie MJ, Ramazani ASA. 2007. Gelation time and degradation rate of chitosan-based injectable hydrogel. J Sol-Gel Sci Technol. 42(1):47-53. doi: 10.1007/s10971-006-9007-1.
Han CD. 2007. Rheology and Processing of Polymeric Materials. New York (NY): Oxford Univ Pr.
Han HD, Nam DE, Seo DH, Kim TW, Shin BC, Choi HS. 2004. Preparation and biodegradation of thermosensitive chitosan hydrogel as a function of pH and temperature. Macromol Res. 12(5):507-511.
Hao T, Wen N, Cao JK, Wang HB, Lu SH, Liu T, Lin QX, Duan CM, Wang CY. 2010. The support of matrix accumulation and the promotion of sheep articular cartilage defects repair in vivo by chitosan hydrogels. Osteoarthr Cartilage. 18:257-265. doi:10.1016/j.joca.2009.08.007.
Heinemann C, Heinemann S, Bernhardt A, Worch H, Hanke T. 2008. Novel textile chitosan scaffolds promote spreading, proliferation, and differentiation of osteoblasts. Biomacromolecules. 9(10):2913-2920. doi:10.1021/bm800693d.
Horst OV, Chavez MG, Jheon AH, Desai T, Klein OD. 2012. Stem cell and biomaterials research in dental tissue engineering and regeneration. Dent Clin N Am. 56:495-520. doi:10.1016/j.cden.2012.05.009.
Hou Q, De Bank PA, Shakesheff KM. 2004. Injectable scaffold for tissue regeneration. J Mater Chem. 14:1915-1923. doi:10.1039/B401791A.
Jarry C, Leroux JC, Haeck J, Chaput C. 2002. Irradiating or autoclaving chitosan/polyol solutions: effect on thermogelling chitosan-β -glycerophosphate systems. Chem Pharm Bull. 50(10):1335-1340.
Moshaverinia A, Chen C, Akiyama K, Ansari S, Xu X, Chee WW, Schricker SR, Shi S. 2012. Alginate hydrogel as a promising scaffold for dental-derived stem cells: an in vitro study. J Mater Sci: Mater Med. 23:3041-3051. doi:10.1007/s10856-012-4759-3.
Nwe N, Furuike T, Tamura H. 2009. The mechanical and biological properties of chitosan scaffolds for tissue engineering templates are significantly enhanced by chitosan from Gongronella butleri. Materials. 2:374-398. doi:10.3390/ma2020374.
Pavia DL, Lampman GM, Kriz GS, Vyvyan JR. 2009. Introduction to Spectroscopy Edisi ke-4. Belmont (USA): Brooks/Cole.
Qiu X, Yang Y, Wang L, Lu S, Shao Z, Chen X. 2011. Synergistic interactions during thermosensitive chitosan-β-glycerophosphate hydrogel formation. RSC Adv. 1:282-289. doi:10.1039/C1RA00149C.
17 Tan H, Marra KG. 2010. Injectable, biodegradable hydrogels for tissue engineering applications. Materials. 3:1746-1767. doi:10.3390/ma3031746. Tiğli RS, Karakeçili A, Gümüşderelioğlu M. 2007. In vitro characterization of
chitosan scaffolds: influence of composition and deacetylation degree. J Mater Sci: Mater Med. 18:1665-1674. doi:10.1007/s10856-007-3066-x. Wang L, Stegemann JP. 2010. Thermogelling chitosan and collagen composite
initiated with β-glycerophosphate for bone tissue. Biomaterials. 31(14):3976-3985. doi:10.1016/j.biomaterials.2010.01.131.
Xu YX, Kim KM, Hanna MA, Nag D. 2005. Chitosan-starch composite film: preparation and characterization. Ind Crop Prod. 21(2):185-192. doi:10.1016/j.indcrop.2004.03.002.
Yan J, Yang L, Wang G, Xiao Y, Zhang B, Qi N. 2010. Biocompatibility evaluation of chitosan-based injectable hydrogels for the culturing mice mesenchymal stem cells in vitro. J Biomater Appl. 24:625-36. doi:10.1177/0885328208100536.
18
19
20
Lampiran 3 Uji ANOVA pada ciri fisik larutan kitosan-gliserofosfat dengan perlakuan penambahan glukosa
Between Groups 113074.250 3 37691.417 43.675 .000
Within Groups 6904.000 8 863.000
Total 119978.250 11
H0: Jenis kelompok tidak berpengaruh pada viskositas praperlakuan
H1: Ada kelompok yang berpengaruh pada viskositas praperlakuan
Nilai p kurang dari α = 0.05, maka H0 ditolak, sehingga dapat dilanjutkan ke uji Duncan untuk
H0: Jenis kelompok tidak berpengaruh pada pH praperlakuan
H1: Ada kelompok yang berpengaruh pada pH praperlakuan
Nilai p lebih dari α = 0.05, maka H0 diterima, sehingga tidak perlu dapat dilanjutkan ke uji Duncan.
Kapasitas pembengkakan gel
H0: Jenis kelompok tidak berpengaruh pada kapasitas pembengkakan gel praperlakuan
H1: Ada kelompok yang berpengaruh pada kapasitas pembengkakan gel praperlakuan
Nilai p lebih dari α = 0.05, maka H0 diterima, sehingga tidak perlu dapat dilanjutkan ke uji Duncan.
Kekuatan mekanik gel
H0: Jenis kelompok tidak berpengaruh pada kekuatan mekanik gel praperlakuan
H1: Ada kelompok yang berpengaruh pada kekuatan mekanik gel praperlakuan
21
RIWAYAT HIDUP
Penulis lahir di Jakarta pada tanggal 6 Januari 1993, sebagai anak bungsu dari 3 bersaudara dari pasangan Drs AM Shodikin HS (Alm.) dan Parilah Shandy. Penulis lulus dari SMAN 1 Kota Bekasi pada tahun 2010 dan diterima untuk melanjutkan studi di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur PMDK.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum Kimia Dasar 1 tahun ajaran 2011/2012, praktikum Kimia Organik Layanan tahun ajaran 2013/2014, praktikum Kimia Polimer tahun ajaran 2013/2014, serta mengajar mata kuliah Kimia Dasar di beberapa lembaga bimbingan belajar. Penulis pernah meraih prestasi sebagai Mahasiswa Berprestasi Peringkat 2 Tingkat IPB pada tahun 2014, Peringkat 2 tingkat Provinsi Jawa Barat Semifinal Olimpiade Sains Nasional Pertamina pada tahun 2012, Peringkat 1 Lomba Pengantar Matematika tingkat TPB IPB tahun 2010, penerima dana Program Kreativitas Mahasiswa bidang Penelitian pada tahun 2011, dan partisipan, baik sebagai presentator maupun sebagai peserta, dalam beberapa seminar internasional pada tahun 2013-2014.
Penulis juga pernah aktif sebagai Wakil Ketua Lembaga Pengajaran
Al-Qur’an (LPQ) Al Hurriyyah IPB pada tahun 2013, anggota Departemen HRD