ABSTRAK
MOLASE SEBAGAI SUMBER MIKRO NUTRIEN PADA BUDIDAYA PHYTOPLANKTONNannochloropsissp., SALAH SATU ALTERNATIF
PEMANFAATAN HASIL SAMPING PABRIK GULA
Oleh EMY RUSYANI
Nannochloropsissp. merupakan salah satu mikroalga laut dari jenis alga hijau yang mempunyai kandungan gizi tinggi, mudah tumbuh dalam berbagai kondisi
lingkungan dan memiliki manfaat yang sangat besar. Salah satu kendala dalam kultur Nannochloropsissp. adalah penggunaan media tumbuh yang mahal seperti media Guillard dan Conwy sehingga perlu dicari alternatif lain seperti penggunaan hasil samping pabrik gula yaitu molase yang lebih ekonomis karena selain ramah
lingkungan, mudah diperoleh, lebih efektif dan efisien untuk media tumbuh tanaman. Molase mengandung unsur hara, terutama mikro nutrien danchelator agent yang dibutuhkan untuk pertumbuhanNannochloropsissp. Chelator agentberfungsi untuk mengikat unsur hara sehingga bisa dimanfaatkan olehNannochloropsissp. dan sangat berperan penting dalam proses penyerapan, transportasi, dan aktivitas
metabolik beberapa kation essensialtrace element. Sedangkan sumber Makro nutrien berasal dari Urea dan TSP. Penelitian dilakukan di Laboratorium pakan alami, Balai Besar Pengembangan Budidaya Laut Lampung pada bulan Juli–Nopember 2011, dengan 7 perlakuan dan 4 ulangan. Perlakuan A (Dosis molase 0 ppm), B (3 ppm), C (5 ppm), D (7 ppm), E (10 ppm), F (12 ppm), dan G (Conwy).
terrendah perlakuan A yaitu sebesar 0,3644 sel/ml/hari. Perlakuan B, C, D, dan F untuk laju pertumbuhan relatif sama (0,4493–0,4579 sel/ml/hari). Waktu generasi tercepat dicapai oleh perlakuan G yaitu mencapai 44,1867 jamdan E sebesar 45,137 jam, setelah itu pada perlakuan B, C, D, dan F relatif sama 51,099 - 52,065 jam dan dan waktu generasi terlama perlakuan A sebesar 56,442 jam. Kandungan gizi Nannochloropsissp. tertinggi dicapai oleh perlakuan E ; protein 24,221 %, karbohidrat 37,898 % dan Lemak 4,126 % berat kering. Serapan CO2biomassa Nannochloropsissp hasil penelitian sebesar 0,1607 mg
Hasil penelitian menunjukkan bahwa pemberian molase dalam media urea dan TSP pada kulturNannochloropsissp. berpengaruh nyata terhadap kepadatan populasi maksimum, Waktu maksimum, laju pertumbuhan spesifik, waktu penggandaan, dan kandungan gizi. Dosis molase sebanyak 10 ppm merupakan dosis yang paling efektif untuk mendukung pertumbuhanNannochloropsissp.
ABSTRACT
MOLASSES AS A SOURCE OF MICRO NUTRIENT ON PHYTOPLANKTON Nannochloropsissp. CULTURE, ALTERNATIVE USE OF SUGAR MILL BY
PRODUCT
By
EMY RUSYANI
Nannochloropsissp. is one of the marine microalgae species of green algae that have a high nutrient content, easy to grow in a wide range of environmental conditions and has a huge benefit. One of the problems in the culture ofNannochloropsissp. is the use of expensive growth media such as media Guillard and Conwy. So need to look for other alternatives such as the use of the sugar mill byproduct of molasses, which is more economical because in addition to eco-friendly, easily available, more effective and efficient for plant growth media.
Molasses contains nutrients, especially micro-nutrients and chelator agent required for the growth ofNannochloropsissp. Chelator agent serves to bind nutrients that can be used byNannochloropsissp. and the very important role in the process of
absorption, transport, and metabolic activity of some essential trace element cations. While the source of macro nutrients derived from urea and TSP. Laboratory studies were conducted on natural food, Main Center for Marine Aquaculture Development Lampung in July - November 2011, with seven treatments and four replications. The treatment consisted of A (dose of molasses 0 ppm), B (3 ppm), C (5 ppm), D (7 ppm), E (10 ppm), F (12 ppm), and G (Conwy).
ml / day, and the lowest obtained in the treatment of A is equal to 0.3644 cells / ml / day. Treatment B, C, D, and F has the same relative growth rate (0.4493 to 0.4579 cells / ml / day). The most rapid generation time achieved on treatment G and E which is 44.1867 and 45.137 hours, followed by treatment B, C, D, and F are relatively similar from 51.099 to 52.065 hours and the longest obtained in treatment of A which amounted to 56.442 hours. The highest nutrient content of
Nannochloropsissp. is achieved by treatment of E which consists of 24.221%
protein, 37.898% carbohydrates and 4.126% fats. CO2 uptake ofNannochloropsissp biomass in this study amounted to 0.1607 mg.
The results showed that the addition of molasses in urea and TSP medium for
Nannochloropsissp. culture significantly affect the maximum population density, the maximum time, specific growth rate, generation time, and nutrient content. Molasses dose of 10 ppm is the most effective dose to support the growth ofNannochloropsis sp.
I. PENDAHULUAN
1.1. Latar Belakang
Indonesia adalah negara yang mempunyai garis pantai terpanjang di dunia yaitu ± 80.791,42 Km (Dahuri dkk, 2011). Di laut, tumbuh dan berkembang berbagai jenis mikroalga laut yang berpotensi sebagai biotarget industri. Sinar matahari sebagai sumber fotosintesa tumbuhan menunjang perkembangbiakan biota lautnya jauh lebih tinggi dibanding di daerah subtropis. Beragam sumber daya hayati perairan, jenis mikroalga (fitoplanton) kini mulai menjadi fokus penelitian karena manfaatnya sangat besar. Selama ini sejumlah phytoplankton telah dikembangkan untuk menunjang budidaya perikanan, sebagai bahan baku kosmetik dan farmasi, biosorben logam berat, pereduksi emisi gas rumah kaca, dan sebagai bahan baku penghasil Bahan Bakar Nabati atau BBN (Astin, 2008 ; Sukardi, 2005 ; Fulk and Main, 1991).
Phytoplankton yang merupakan sumber rantai makanan di laut sebagai produsen biasa disebut alga mikroskopis atau mikroalga. Mikroalga adalah jasad renik yang termasuk tumbuhan bersel tunggal, berkembangbiak sangat cepat dengan daur hidup relatif pendek (Panggabean, 1998).
merusak lapisan ozon yang dapat berakibat pada terjadinya pemanasan global (global warming) dan perubahan iklim global (Global Climate Change). Nannochloropsissp. merupakan organisme autotrof yang mempunyai klorofil, mampu menyerap karbon untuk proses fotosintesis dengan menghasilkan oksigen (Sunarto, 2008). Nannochloropsissp. tumbuh dan berkembang dengan
memanfaatkan sinar matahari sebagai sumber energi dan nutrien anorganik sederhana seperti CO2, komponen nitrogen terlarut dan fosfat. Penyerapan karbon tersebut dapat mengurangi jumlah karbon yang ada diatmosfir. Fitoplankton Nannochloropsissp. dapat dimanfaatkan secara optimal untuk mengurangi emisi CO2 . (Astin, 2008 ; Bishop dan Davis, 2000). Nannochloropsissp. merupakan salah satu mikroalga laut dari jenis alga hijau yang mempunyai kandungan gizi tinggi, mudah tumbuh dalam berbagai kondisi lingkungan dan memiliki manfaat yang sangat besar. PertumbuhanNannochloropsissp. membutuhkan nutrien yang cukup, sehingga perlu dilakukan usaha pemupukan dalam kulturnya (Martosudarmo dan Wulani, 1990).
menjadi lebih ekonomis karena selain ramah lingkungan, mudah diperoleh, lebih efektif dan efisien untuk media tumbuh tanaman ( Priyono, 2009).
Molase merupakan hasil samping pabrik gula yang mengandung unsur hara yang dibutuhkan untuk pertumbuhanNannochloropsissp. Jumlah molase di Indonesia mencapai 1,3 juta ton/ tahun, yang akan mengalami peningkatan sampai 1,8 juta ton/tahun ( Utami, 2009). Molase mengandung konsentrasi terbesar belerang, potassium, besi dan mikronutrien yang dibutuhkan untuk pertumbuhan tumbuhan (Priono, 2009), sedangkan menurut Lusiningtyas (2007) molase memiliki
kandungan yang bermanfaat bagi pertumbuhan tumbuhan, zat–zat tersebut antara lain kalsium, magnesium, potassium, dan besi. Molase juga merupakan agent chelating yang sangat baik, karena mampu mengubah beberapa nutrisi kimia menjadi bentuk yang mudah tersedia untuk organisme tumbuhan (Anwar dan Suganda, 2002).
Berdasarkan alasan tersebut maka diharapkan dalam percobaan
penambahan molase sebagai penyedia nutrien khususnya mikro nutrien, dapat meningkatkan pertumbuhan dan kandungan giziNannochloropsissp. Menurut Fulk and Main (1991) secara alamiahNannochloropsissp. mempunyai
kemampuan untuk berkembang biak pada media yang mengandung unsur makro dan unsur mikro nutrien. Molase yang digunakan dalam penelitian ini adalah jenisblack strapdari PT. Gunung Madu Plantation.
Menurut Brownet al(1997) agen pengkelat dalam media air laut berfungsi sebagai penahan beberapa logam dalam larutan sehingga dapat dipastikan sampai ke sel. Pengkelat penting dalam proses penyerapan, transportasi, dan aktivitas metabolik beberapa kation essensialtrace element(Fogg, 1987). Menurut Brown et al(1997) agen pengkelat yang biasa digunakan adalah ethylene diamine tetra acetic (EDTA).
Media alternatif yang dipergunakan dalam penelitian ini adalah Urea dan TSP (sebagai penyumbang unsur makro) dan ditambahkan molase (sebagai penyumbang unsur mikro dan sebagai agen pengkelat) untuk mengetahui pengaruhnya terhadap pertumbuhan dan kandungan giziNannochloropsissp.
1.2. Batasan Penelitian
Penelitian ini dilakukan untuk mengetahui pengaruh penambahan molase (sebagai sumber mikro nutrien dan sebagai agen pengkelat) dengan dosis yang berbeda dalam media Urea dan TSP pada kultur fitoplanktonNannochloropsissp. Parameter yang diamati adalah pertumbuhan dan kandungan gizi yang dihasilkan pada skala laboratorium.
1.3. Tujuan dan Manfaat
Tujuan dari penelitian ini adalah untuk :
1. Mengetahui pengaruh penambahan molase terhadap pertumbuhan Nannochloropsissp.
2. Memperoleh dosis molase terbaik yang ditambahkan pada media Urea dan TSP bagi pertumbuhanNannochloropsissp., meliputi kepadatan populasi
tertinggi dan waktu generasi tercepat)
3. Mengetahui kandungan giziNannochloropsissp. dari media tumbuh molase
Manfaat penelitian ini adalah :
Sebagai informasi mengenai manfaat molase sebagai pupuk tambahan (unsur mikro) bagi mikroalga, baik pada kultur skala laboratorium maupun skala massal.
1.4. Kerangka Pemikiran
perkembangan sel–selNannochloropsissp. tersebut. Salah satu media alternatif yang dicoba dalam media tumbuhNannochloropsissp. adalah dengan
menggunakan molase, karena molase mengandung unsur–unsur hara mikro yang dibutuhkan olehNannochloropsissp. untuk tumbuh dan berkembang biak.
Namun penambahan molase tersebut perlu dilakukan dengan hati – hati, karena sebagai unsur mikro kebutuhan dalam nutrisi relatif kecil, sehingga dosis yang ditambahkan dalam media harus efektif dan efisien. Diharapkan dengan menemukan dosis yang tepat pada molase yang ditambahkan untuk media tumbuh Nannochloropsis sp. dapat meningkatkan pertumbuhan dan perkembangan mikroalga tersebut. Selain itu dengan diperoleh komposisi media tumbuh untuk mikroalga tersebut dapat dikembangkan dalam kultur massal untuk mendukung budidaya perikanan, bahan baku Biofuel, dan mengurangi gas rumah kaca dengan kemampuannya dalam penyerapan CO2.
1.5. Hipotesis
II. TINJAUAN PUSTAKA
2.1. ManfaatNannochloropsissp 2.1.1. Menyerap emisi Karbondioksida
Isu lingkungan yang menjadi permasalahan internasional saat ini adalah pemanasan global (global warming), yang disebabkan oleh peningkatan gas rumah kaca di atmosfer, seperti CO2 menyebabkan terjadinya efek rumah kaca (green house effect) (Ikawati, 2009). Peningkatan CO2berasal dari pembakaran bahan bakar fosil seperti pemakaian bensin dan solar pada kendaraan, batu bara untuk industri. Dampak dari meningkatnya CO2di atmosfer antara lain:
meningkatnya suhu permukaan bumi, naiknya permukaan air laut, anomali iklim, timbulnya berbagai penyakit pada manusia dan hewan (Astin,2008).
Berbagai upaya dilakukan untuk menekan laju peningkatan emisi CO2di atmosfer. Upaya terbesar untuk mengatasi peningkatan emisi CO2di tingkat internasional adalah dengan meratifikasi Protokol Kyoto tahun 1997 dalam persetujuan Internasional mengenai pemanasan global. Semua negara di dunia diwajibkan untuk mendukung terwujudnya Protokol Kyoto dengan memanfaatkan seluruh potensi sumber daya yang ada. Salah satu sumber daya yang dapat
organisme autotrof yang mempunyai klorofil sehingga dapat melakukan proses fotosintesis. Mikroalga sebagai tumbuhan mikroskopis bersel tunggal yang hidup di lingkungan yang mengandung air, tumbuh dan berkembang dengan
memanfaatkan sinar matahari sebagai sumber energi dan nutrien anorganik
sederhana seperti CO2, komponen nitrogen terlarut dan fosfat. Fitoplankton dapat dimanfaatkan secara optimal untuk mengurangi emisi CO2 karena meskipun jumlah biomasa fitoplankton hanya 0,05% biomassa tumbuhan darat namun jumlah karbon yang dapat digunakan dalam proses fotosintesis sama dengan jumlah C yang difiksasi oleh tumbuhan darat (~50-100 PgC/th) ( Bishop dan Davis, 2000).
Fitoplankton mampu memanfaatkan CO2 dari cerobong asap, melalui mekanisme fotosintesis. Hal tersebut terbukti dengan perubahan konsentrasi gas CO2 yang terlarut dalam media kultur fitoplankton dari konsentrasi awal gas CO2 sebesar 10 % berkurang menjadi di bawah 5% setelah hari 5, dan pada hari ke-10 telah berada di bawah 3% (Setiawan dkk, 2008). Salah satu jenis fitoplankton yang mudah dibudidayakan dan cepat berkembang biak adalahNannochloropsis sp.
2.1.2. Sebagai Bahan Bakar Nabati (Biofuel)
mikroalga juga dapat dimaksimalkan dengan bantuan teknologi fotobioreaktor. Mikroalga merupakan mikroorganisme laut dengan kandungan minyak tinggi mencapai lebih dari 50% ( Susilaningsih dkk, 2009), dan sampai saat ini masih menjadi sumber minyak terbaik di dunia. Hampir semua minyak yang kita peroleh dari perut bumi berasal dari sisa mikroalga yang hidup ribuan tahun lalu (Bachtiar, 2007).
Selain itu Mikroalga memiliki fungsi serupa dengan kebanyakan tumbuhan, yakni memanfaatkan karbondioksida dari atmosfer dan menghasilkan oksigen melalui fotosintesis. Tubuh mikroalga terkandung protein, lemak, dan
karbohidrat, yang semuanya dapat dimanfaatkan antara lain lemak diolah menjadi minyak diesel melalui proses ekstraksi, karbohidrat dari mikroalga diolah menjadi etanol (alkohol) dengan proses fermentasi (Sebayang, 2006, dan Kabinawa, 2001). Tantangan yang dihadapi adalah bagaimana cara menumbuhkan mikroalga yang bisa memenuhi konsumsi energi dunia. Metode yang dikembangkan untuk menumbuhkan mikroalga berbasis pada daratan, yakni kolam-kolam, bioreaktor tertutup, dan kolam terbuka berbentuk terusan dangkal. Sejak 2006, Mujizat Kawaroe dan timnya dari Surfactant and Bioenergy Research Center Institut Pertanian Bogor (SBRC-IPB) telah menemukan bukti tingginya keragaman mikroalga dan produktivitasnya ( Suara karya, 2008). Empat lokasi pesisir yang diteliti selama dua tahun terakhir, yaitu Kepulauan Seribu, Manado, Kawasan Laut Arafura, dan Pulau Batam, ditemukan 11 spesies mikroalga. Mikroalga yang potensial sebagai BBN diantaranya Chlorellamemiliki kandungan minyak
Kelebihan mikroalga adalah mampu menyerap karbondioksida dan nutrien secara efektif dan dapat tumbuh cepat, bisa dipanen dalam empat hingga sepuluh hari, produktivitasnya 30 kali lebih banyak dibanding tumbuhan darat (Zuhdi, 2003). Kelapa sawit, misalnya, perlu waktu 5 bulan, sedangkan jatropa atau jarak pagar perlu 3 bulan. Jika dibanding minyak bumi yang sulit mencari sumbernya dan perlu proses yang rumit dan mahal dalam pengolahannya, maka mikroalga merupakan pilihan yang lebih tepat. Pada 1 hektar ladang minyak bumi hanya bisa disedot 0,83 barrel minyak per hari, sedangkan pada luas yang sama budidaya mikroalga menghasilkan 2 barrel BBN (Sukardi, 2005).
Kelebihan lain dari mikroalga merupakan sumber energi terbarukan dan ramah lingkungan. Pada tahap budidaya, perkembangbiakan mikroalga juga meningkat 2,5 kali bila ke dalam kolom air dipasok CO2, dibandingkan hanya dengan aerasi atau suplai O2 ( Astin, 2008). Hal ini berarti kultivasi mikroalga berpeluang mengatasi masalah lingkungan global, karena selama ini CO2jadi gas pencemar dominan yang menyebabkan efek rumah kaca penyebab pemanasan global. Pada tahap pengolahan mikroalga menjadi BBN, tidak menimbulkan pencemaran karena limbahnya 100 persen jadi pakan ternak (Bahtiar, 2007).
2.1.3. Sebagai Penunjang Budidaya Perikanan
akan pakan dapat tercukupi, karena ikan mempunyai daya jelajah pada spektrum yang relatif luas.
Permasalahan akan kebutuhan pakan biasanya baru muncul pada saat organisme berada dalam lingkungan budidaya. Ketersediaan pakan sangat
bergantung pada manusia yang memelihara baik dari jumlah, jenis maupun waktu pemberian. Masalah pakan makin kompleks, jika organisme yang dipelihara masih dalam stadia larva. Sebagian besar stadia awal larva ikan (fin fish non fin fish), memerlukan pakan hidup baik fitoplankton atau zooplankton. Menurut
Fulks and Main (1991), fitoplankton (mikroalga) sangat dibutuhkan dalam kegiatan budidaya yang bersifat komersial, seperti pada jenis ikan (larva dan atau dewasa), Crustacea (stadia awal larva), Holothuriide (larva, juvenil dan dewasa), Bivalvia dan Moluska (larva, juvenil dan dewasa). Menurut Coutteau (1996), fitoplankton merupakan dasar dari suatu mata rantai dalam ekosistem perairan laut, dapat dimanfaatkan langsung untuk pakan organisme budidayanon finfish dan sebagai pakan zooplankton.
Saat ini, lebih dari 40 spesies fitoplankton yang telah berhasil
dibudidayakan, guna menunjang kegiatan pembenihan ikan. Pemilihan jenis pakan hidup untuk organisme budidaya merupakan prakultur yang harus dicermati dengan baik. Menurut Villegas (1995), spesies yang dikultur di unit pembenihan harus berpedoman pada spesies target. Beberapa faktor lain yang perlu
merupakan pakan utama pada larva stadia awal, karena memang memenuhi persyaratan seperti yang telah disebutkan ( Yuwana dkk, 1999).
Fungsi pakan hidup pada tingkatan tertentu masih belum dapat digantikan oleh pakan buatan, karena kemampuan larva mencerna pakan buatan masih sangat terbatas ( Rusyani dkk, 2007). Pakan hidup yang diperlukan dalam pembenihan kerapu terdiri atas dua jenis yaitu fitoplankton dan zooplankton. Pada
pemeliharaan larva fitoplankton tidak langsung dimanfaatkan sebagai pakan larva tetapi sebagai pakan zooplankton. Disamping itu, fitoplankton ditambahkan ke dalam media pemeliharaan untuk mengurangi intensitas cahaya yang masuk dan dapat mengurangi gas beracun yang ada dalam media pemeliharaan, merupakan penstabil kualitas air dalam media pemeliharaan larva ( Coutteau, 1996).
Persyaratan mutlak yang harus dimiliki oleh pakan hidup yang diperuntukkan sebagai jasad pakan adalah sebagai berikut : mudah dibudidayakan secara massal, cocok ukuran, mudah dicerna dan bernilai gizi tinggi. Fitoplankton yang sudah dikembangkan untuk menunjang kegiatan pembenihan ikan laut antara lain: Nannochloropsissp.,Tetraselmissp.,Dunaliellasp.,Chaetocerossp.,Isochrysis sp. danScenedesmussp. (Martosudarmo dan Wulani, 1990)
2.1.4.Sebagai biosorben logam berat
Dalam pengolahan limbah industri yang mengandung logam berat, pemanfaatan alga baik dalam bentuk biomassa bebas maupun yang
Biomassa alga dari beberapa spesies alga efektif untuk mengikat ion logam pada lingkungan aquatik. Berberapa spesies alga yang umumnya
dimanfaatkan biomassanya adalah dari jenis alga coklat dan alga hijau. Pemilihan biomassa alga ini sebagai biosorben dilakukan karena spesies alga ini memiliki toleransi yang tinggi terhadap pengambilan logam berat, mudah dibudidayakan, dan dapat diperoleh dari sejumlah laboratorium-laboratorium pengkoleksian kultur di berbagai negara (Zipora dkk, 2008).
Pemanfaatan sistem adsorpsi untuk pengambilan logam-logam berat dari perairan telah banyak dilakukan. Beberapa spesies alga telah ditemukan
mempunyai kemampuan yang cukup tinggi untuk mengadsorpsi ion-ion logam, baik dalam keadaan hidup maupun dalam bentuk sel mati (biomassa). Berbagai penelitian telah membuktikan bahwa gugus fungsi yang terdapat dalam alga mampu melakukan pengikatan dengan ion logam. Gugus fungsi tersebut terutama adalah gugus karboksil, hidroksil, sulfudril, amino, iomodazol, sulfat, dan sulfonat yang terdapat didalam dinding sel dalam sitoplasma (Putra, 2007b ).
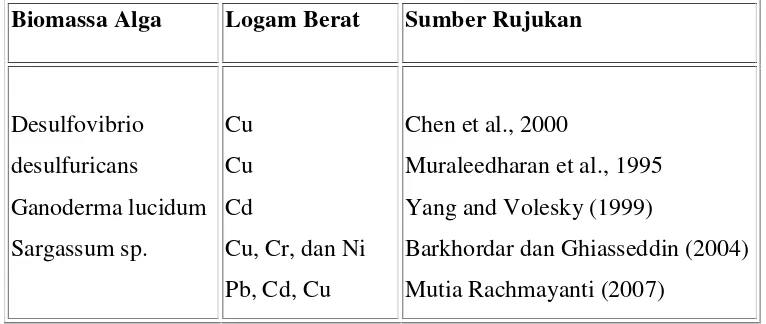
Nannochloropsissp. merupakan salah satu contoh biomassa alga yang potensial sebagai biosorben seperti pada tabel 1.
Tabel 1. Biomassa Alga yang Potensial sebagai Biosorben Biomassa Alga Logam Berat Sumber Rujukan
Sargassum
Alga hijau, alga merah ataupun alga coklat merupakan sumber potensial senyawa bioaktif yang sangat bermanfaat bagi pengembangan industri farmasi seperti sebagai anti bakteri, anti tumor, anti kanker atau sebagai reversal agent dan industri agrokimia terutama untuk antifeedant, fungisida dan herbisida.
Kemampuan alga untuk memproduksi metabolit sekunder terhalogenasi yang bersifat sebagai senyawa bioaktif dimungkinkan terjadi, karena kondisi
Nannochloropsis sp. mengandung komponen antioksidan yang tinggi seperti karotenoid, astaxantin, kantaxantin, flavoxantin, loraxanthin, neoxantin, dan sebatian fenolik (Hasegawa, 1990). Penelitian di Malaysia melaporkan bahwa Nannochloropsis sp. berkhasiat sebagai antikanker pada sel hepar (Mukti dalam Bahtiar, 2007)
2.2. Biologi FitoplanktonNannochloropsissp. 2.2.1. Klasifikasi dan Morfologi
a. Klasifikasi
Klasifikasi Nannochloropsis sp. menurut Adehog (2001) dan Garofalo (2009) adalah sebagai berikut :
Kingdom : Protista
Super Divisi : Eukaryotes Divisi : Chromophyta
Kelas : Eustigmatophyceae Ordo : Eustigmatales
Familia : Monodopsidaceae Genus : Nannochloropsis
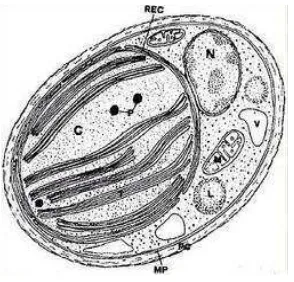
Spesies : Nannochloropsissp b. Morfologi
memiliki dinding sel yang terbuat dari komponen selulosa (Sleigh, 1989 ; Brown et al, 1997).
Gambar 1. gambar morfologi selNannochloropsissp (Adehoog, 2001)
Nannochloropsissp bersifat kosmopolit dapat tumbuh pada salinitas 0-35 ppt, salinitas optimum untuk pertumbuhannya adalah 25-35 ppt, suhu 25-30oC merupakan kisaran suhu yang optimal, kisaran pH 8-9,5 dan intensitas cahaya 1000 - 10000 lux (Isnansetyo dan Kurniastuty, 1995). Nannochloropsissp lebih dikenal dengan nama Chlorela laut dikultur untuk pakan zooplankton karena mengandung Vitamin B12 dan Eicosapentaenoic acid (EPA) masing - masing 30,5 % , total kandungan omega 3 Higly unsaturated Fatty acids (HUFAs) sebesar 42,7%, serta mengandung protein 57,02 % dan vitamin B12, yang sangat penting untuk pertumbuhan populasi zooplankton (rotifer) dan EPA penting untuk nilai nutrisinya sebagai pakan larva dan juvenile ikan laut (Fulks dan Main 1991). Komposisi asam lemak padaNannochloropsissp. dibandingkan jenis
Tabel 2. Komposisi Asam Lemak Beberapa Jenis Fitoplankton
JENIS FITOPLANKTON EPA TOTALω3 HUFAs
Tetraselmis 6,4 8,1
Nannochloropsis 30,5 42,7
Pavlova 13,8 23,5
Isochrysis galbana 3,5 22,5 Phaeodactylum 8,6 9,6 Skeletonema 13,8 15,5 Sumber :(Fulk and Main, 1991)
2.3. Pola Pertumbuhan Fitoplankton
Pertumbuhan adalah biosintesis yang menyebabkan bertambahnya substansi atau protoplasma berupa perbanyakan sel, pembesaran sel, dan
Pelczaret al(1986) menjelaskan bahwa pertumbuhan dan produktivitas sel jasad hidup, termasuk mikroba dipengaruhi oleh faktor lingkungan. Perubahan– perubahan yang terjadi dalam lingkungan dapat mengakibatkan perubahan sifat morfologi dan sifat fisiologi. Faktor lingkungan tersebut antara lain ;
a. Faktor biotik meliputi : bentuk sel (individu), sifat jasad dari mikroalga dan , pertumbuhan (kepadatan sel, nilai gizi, dan kemampuan jasad untuk
menyesuaikan diri).
b. Faktor abiotik meliputi : susunan dan jumlah senyawa di dalam media, dan faktor lingkungan seperti temperatur, cahaya, tekanan osmosis serta senyawa–senyawa yang mungkin dapat bersifat toksik
PerkembanganbiakanNannochloropsissp. terjadi secara aseksual yaitu dengan pembelahan sel atau pemisahan autospora dari sel induknya. Reproduksi sel ini diawali dengan pertumbuhan sel yang membesar. Periode selanjutnya adalah terjadinya peningkatan aktifitas sintesa sebagai bagian dari persiapan pembentukan sel anak, yang merupakan tingkat pemasakan awal. Tahap selanjutnya terbentuknya sel induk muda yang merupakan tingkat pemasakan akhir, yang disusul dengan pelepasan sel anak (Borowitzka, 1988).
mengalami penurunan, dan mencapai fase puncak pertumbuhan pada hari ke 5. Padat penebaran yang ideal berkisar antara 3–5 juta sel/ml (Rusyani dkk, 2007). Waktu yang dibutuhkan untuk mencapai kepadatan tertinggi bervariasi,
tergantung pada beberapa faktor, yaitu ; kualitas bibit, padat penebaran, intensitas cahaya, pupuk, dan kualitas air.
PertumbuhanNannochloropsissp. dalam kultur dengan media yang terbatas umumnya sangat dipengaruhi oleh suhu, salinitas, cahaya, pH, aerasi dan nutrisi. Pertambahan sel dalam kultur tersebut akan mengikuti pola tertentu, yaitu kurva s atau sigmoid. Pelczaret al(1986) membagi pola pertumbuhan atau kurva pertumbuhan tersebut menjadi lima fase pertumbuhan seperti gambar 2 ;
Gambar 2. Pola Pertumbuhan Fitoplankton (sumber Laven and Sorgeloos, 1996)
Keterangan : 1. fase lag
hidup, namun tidak berkembang biak. Lamanya fase lag tergantung pada inokulan yang dimasukkan. Sel–sel yang diinokulasikan pada awal fase logaritmik akan mengalami fase lag yang amat singkat. Inokulan yang berasal dari kultur yang sudah tua akan mengalami fase lag yang lama, karena
membutuhkan waktu untuk menyusun enzim–enzim yang tidak aktif lagi (Pelzar et al, 1986).
2. Fase Logaritmik / eksponensial
Fase ini ditandai dengan naiknya laju pertumbuhan hingga kepadatan populasi meningkat beberapa kali lipat. Fase eksponensial karena pesatnya laju pertumbuhan hingga kepadatan populasi meningkat melalui pembelahan sel dan apabila dihitung secara matematis membentuk fungsi logaritma. Pada fase ini sel alga sedang aktif berkembang biak. Ciri metabolisme selama fase eksponensial ini adalah tingginya aktivitas yang berguna untuk pembentukan protein dan komponen penyusun plasma sel yang dibutuhkan dalam pertumbuhan. (Laven and Soorgeloos, 1996).
3. Fase penurunan laju pertumbuhan
Fase ini ditandai dengan terjadinya penurunan laju pertumbuhan jika dibandingkan dengan fase eksponensial. Fase penurunan karena terjadi
penurunan pertambahan populasi persatuan waktu bila dibandingkan dengan fase eksponensial (Pelczaret al, 1986).
4. Fase Stasioner
Jumlah sel cenderung tetap diakibatkan sel telah mencapai titik jenuh.
Pertumbuhan sel yang baru dihambat oleh keberadaan sel yang telah mati dan faktor pembatas lainnya. Faktor lain yang dapat menghambat pertumbuhan kultur yang terlalu padat sehingga terbentuk bayangan oleh mikroalga itu sendiri,
sehingga terjadi pembatasan dalam bentuk penggunaan cahaya (laven and Sorgeloos, 1996).
5. Fase Kematian
Fase ini ditandai dengan kepadatan populasi yang terus berkurang, hal ini dikarenakan laju kematian yang lebih tinggi dari pada laju pertumbuhan (Pelczar et al, 1986).
2.4. Media Pertumbuhan
Dalam budidaya fitoplankton media kultur digunakan sebagai tempat untuk bertumbuh dan berkembang biak. Menurut Suriawira (1985), susunan bahan baik bahan alami maupun bahan buatan yang digunakan untuk
Kimbal (1999) menjelaskan, tidak semua bahan yang telah tersedia secara langsung dapat diserap dan dipergunakan oleh sel. Beberapa persyaratan sangat diperlukan antara lain:
1. Bentuk dan sifat bahan. 2. Konsentrasi bahan . 3. Enzim.
4. Lingkungan yang menyertainya.
Media atau substrat tempat tumbuh dan berkembangnya alga, terdiri dari komponen kimia yang diramu atau dikombinasikan sedemikian rupa dalam bentuk formula media, sehingga akan menghasilkan pertumbuhan dan produksi sel yang tinggi. Seperti halnya pada semua mahluk hidup, untuk dapat
berkembang biak dan melakukan aktifitas secara wajar memerlukan sumber makanan yang lengkap dan seimbang. Jika salah satu unsur nutrien berlebihan atau kurang maka pertumbuhanpun akan terganggu.
Media tersusun oleh unsur-unsur makro dan mikro yang sesuai dengan kandungan unsur-unsur tersebut di dalam sel mikroba. Masing-masing jenis fitoplankton berbeda pula medianya kulturnya. Berdasarkan jenis yang telah dibudidayakan di Balai Besar Pengembangan Budidaya Laut Lampung, ternyata hampir semua jenis fitoplankton tumbuh dengan cepat dalam media sintetik anorganik seperti jenisNannochloropsissp.,Tetraselmissp.,Dunaliellasp., Chaetocerossp.,Isochrysis galbana, danNitzschiasp. Berbagai kegiatan baik yang terjadi di dalam sel ataupun yang terjadi pada keseluruhan kehidupan,
serta sangat berpengaruh untuk berbagai kegiatan, berbentuk senyawa organik ataupun senyawa anorganik, yaitu senyawa yang tersusun dari unsur makro ataupun unsur mikro.
Selanjutnya menurut Chen and Shetty (1991) menyatakan bahwa,
pertumbuhan dan perkembangan fitoplankton memerlukan berbagai nutrien yang diabsorbsi dari luar (media). Hal ini berarti ketersediaan unsur makro nutrien dan mikro nutrien dalam media tumbuhnya mutlak diperlukan.
Menurut Round (1973), media kultur bagi fitoplankton berupa unsur utama (macro elememts) seperti N, P, K, S, dan Mg, serta unsur–unsur tambahan yana dibutuhkan dalam jumlah kecil (trace elements atau micro elements) seperti Si, Zn, Cu, Mn, Co, Fe, dan Bo. Masing–masing spesies kebutuhan unsur tesebut tidak sama, tergantung pada komposisi kimia. Berdasarkan studi penelitian dinyatakan bahwa unsur N dalam bentuk nitrat dan P dalam bentuk Fosfor merupakan dua unsur pokok yang harus tersedia dalam media kultur fitoplankton (Laven and Soorgeloos, 1996 , Fogg, 1987, dan Bougis, 1979). Sedangkan formula yang dianggap cocok untuk kulturNannochloropsissp. antara lain formula EDTA (Kurniastuty dan Julinasari, 1995), formula Alen-Nelson dan formula Miquel (Borowitzka, 1988), formula Guillard ( Laven and Sorgeloos, 1996), dan Media Conwy (Brown, 1997).
Suriawiria (1985), menjelaskan bahwa agar organisme dapat tumbuh dan berkembang dengan baik di dalam media, diperlukan persyaratan tertentu yaitu : 1. Di dalam media harus tersedia unsur hara yang diperlukan untuk pertumbuhan
dan perkembangbiakan.
sesuai.
3. Media harus dalam keadaan steril.
Jasad hidup memerlukan bahan makanan untuk keperluan hidupnya. Juga fitoplankton, untuk kehidupannya memerlukan bahan-bahan organik dan
anorganik yang diambil dari lingkungannya. Bahan-bahan tersebut dinamakan nutrien, sedang penyerapannya disebut nutrisi. Bahan-bahan yang telah diserap kedalam sel akan digunakan oleh sel melalui proses yang disebut metabolisme, menurut Campbellet al(2004) terbagi menjadi dua yaitu katabolisme dan anabolisme. Katabolisme atau disimilasi atau bioenergi adalah reaksi yang mengurai molekul senyawa organik untuk mendapatkan energi, sedangkan anabolisme atau asimilasi atau biosíntesis adalah reaksi yang merangkai senyawa organik dari molekul- molekul tertentu untuk diserap oleh tubuh.
Pada proses bioenergi nutrien berfungsi sebagai sumber energi atau penerima electron. Energi yang dihasilkan berupa energi kimia yang berfungsi untuk aktifitas sel misalnya : perkembangbiakan, pembentukan spora, pergerakan, biosintesis dan sebagainya. Pada biosintesis nutrien berfungsi sebagai bahan baku , tanpa adanya nutrien proses biosintesis tidak akan berjalan (Lakitan, 2007).
Semua proses biologis seperti nutrisi, bioenergi dan biosintesis
nutrien (bahan makanan) yang terdapat di dalam media harus terdiri dari : air, sumber energi, sumber karbon, sumber aseptor elektron, sumber mineral dan faktor pertumbuhan (vitamin atau asam amino).
Unsur nutrien yang diperlukan fitoplankton dalam jumlah besar yang disebut makro nutrien adalah : Nitrogen, Fosfor, Sulfur, Magnesium, Kalium dan Kalsium. Sedangkan unsur hara yang dibutuhkan dalam jumlah yang relatif sedikit ( Mikro nutrien) adalah : Tembaga, Mangan, Seng, Boron, Besi Molibdenum, dan Cobalt (Borowitzka, 1988).
2.4.1. Unsur Makro Nutrien a. Nitrogen (N)
Unsur N merupakan komponen utama dari protein sel yang merupakan bagian dasar kehidupan organisme. Nitrogen yang dibutuhkan untuk media kultur terdiri dari beberapa substansi berikut : KNO3; NaNO3; NH4CI ; (NH2)2CO (urea), dan lain-lain ( Chen and Shetty, 1991).
b. Fosfor (P)
Unsur P sangat dibutuhkan dalam proses protoplasma dan inti sel. Fosfor juga merupakan bahan dasar pembentuk asam nukleat, fosfolifida, enzim dan vitamin. Fosfor sangat berperan nyata dalam semua aktifitas kehidupan
fitoplankton. Fosfor yang dibutuhkan untuk kultur fitoplankton dapat diperoleh dari : KH2PO4; NaH2PO4; Ca3PO4(TSP) dan lain-lain. Menurut Dwijoseputro (1994), P dibutuhkan untuk pembentukan pospolipida dan nukleoprotein.
c. Besi (Fe)
Unsur Fe berperan penting dalam pembentukan kloroplas dan sebagai komponen esensial dalam proses oksidasi. Unsur besi juga merupakan bahan dasar sitrokrom dan heme atau nonheme protein, kofaktor untuk beberapa enzim. Pada kultur alga komponen besi dapat diperoleh dari : FeCI3; FeSO4dan FeCaH5 O7( Brown, 1997).
d. Kalium (K)
Unsur K selain berperan dalam pembentukan protoplasma juga berperan penting dalam kegiatan metabolisme, satu kation anorganik utama di dalam sel dan kofaktor untuk beberapa koenzim (Kurniastuty dan Julinasari ,1995). Sumber K dapat di peroleh dari : KCL ; KNO3dan KH2PO4. Unsur K juga dapat di jumpai secara melimpah dalam air laut. Penggunaan K sangat di butuhkan dalam media kultur jika akan di gunakan air laut buatan (Brownet al, 1997., Chen and Shetty, 1991., Watanabeet al, 1985., dan Suriawiria,1985).
e. Magnesium (Mg)
Unsur magnesium merupakan kation sel yang utama dan bahan dasar klorofil . Kation sel yang utama, kofaktor anorganik untuk banyak reaksi
f. Sulfur ( S)
Sulfur juga merupakan salah satu elemen penting yang di butuhkan dalam pembentukan protein. Sulfur untuk media kultur alga dapat diperoleh dari
NH4SO4(ZA) ; CUSO4dan lain–lain (Watanabe, 1985).
g. Kalsium (Ca)
Unsur Ca berperan dalam penyelarasan dan pengaturan aktifitas protoplasma dan kandungan pH di dalam sel. Sumber Ca antara lain : CaCl2 dan Ca (NO3)2. (Chen and Shetty, 1991 )
2.4.2 UnsurTrace Element(Mikro Nutrien)
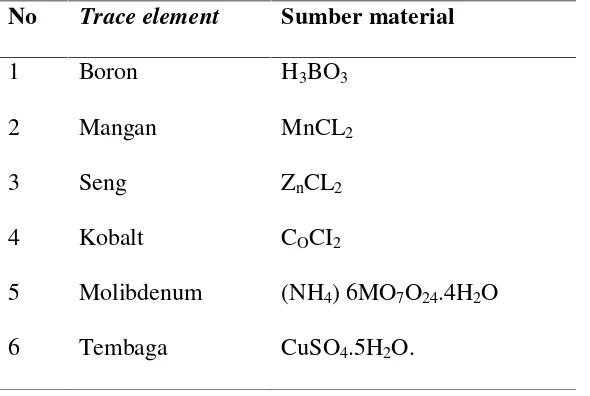
Unsur mikro nutrien juga dibutuhkan untuk kehidupan fitoplankton, meskipun dibutuhkan dalam jumlah sedikit namun keberadaannya sangat mempengaruhi pertumbuhan dan perkembangan fitoplankton (Chen and Shetty, 1991). Beberapa unsur hara mikro tersebut dalam penggunaannya pada media kultur dapat dilihat pada Tabel 3.
Tabel 3. Jenis dan sumber unsur hara mikro untuk budidaya Fitoplankton No Trace element Sumber material
1 Boron H3BO3
2 Mangan MnCL2
3 Seng ZnCL2
4 Kobalt COCI2
5 Molibdenum (NH4) 6MO7O24.4H2O
2.4.3. Faktor-faktor Lingkungan yang Berpengaruh Terhadap pertumbuhan Nannochloropsissp.
Pertumbuhan fitoplankton sangat erat kaitannya dengan ketersediaan hara makro dan mikro serta kondisi lingkungan di dalam media kulturnya. Faktor-faktor lingkungan yang berpengaruh terhadap pertumbuhan fitoplankton antara lain cahaya, suhu, pH, kandungan CO2bebas dan salinitas.
a. Cahaya
Fitoplankton merupakan organisme autotrof yang mampu membentuk senyawa organik dari senyawa-senyawa anorganik melalui proses fotosintesis. Dengan demikian cahaya mutlak diperlukan sebagai sumber energi. Proses fotosintesis pada fitoplankton dapat dituliskan dalam persamaan reaksi sebagai berikut (Borowitzka,1988a):
cahaya
6 CO2+ 6 H2O ---C6H12O6+ 6O2
Dimana H2O bertindak sebagai donor hidrogen, sedangkan C6H12O6 adalah glukosa. Proses ini memerlukan energi yang diperoleh dari penyerapan cahaya oleh pigmen-pigmen fotosintetik. Pada alga hijau pigmen yang menyerap cahaya adalah klorofil-a, disamping pigmen lain seperti karatinoid, xantofil pada jenis fitoplankton lainnya (Borowitzka, 1988a).
intesitas cahaya bagi pertumbuhan fitoplankton adalah 2000-8000 lux (Laven and Sorgeloos, 1996).
b. Suhu
Suhu merupakan salah satu faktor penting yang sangat berpengaruh terhadap kehidupan dan laju pertumbuhan fitoplankton. Suhu secara langsung mempengaruhi efisiensi fotosintesis dan merupakan faktor yang menentukan dalam pertumbuhan fitoplankton. Kondisi labotorium, perubahan suhu air dipengaruhi oleh suhu ruangan dan intesitas cahaya, sedangkan kondisi di luar ruangan dalam kultur skala massal, suhu dipengaruhi oleh keadaan cuaca (Coutteau, 1996).
Lakitan (2007), menjelaskan di dalam reaksi kimia kenaikan suhu akan menaikan kecepatan reaksi. Setiap kenaikan 100C dapat mempercepat reaksi 2-3 kali lipat. Di dalam proses metabolisme terjadi suatu rangkaian reaksi kimia maka kenaikan suhu sampai pada batas nilai tertentu, dapat mempercepat proses
metabolisme, tetapi pada suhu tinggi yang melebihi suhu maksimum akan menyebabkan denaturasi protein dan enzim. Hal ini akan menyebabkan terhentinya proses metabolisme dalam sel. Menurut pendapat DwijoSeputro (1994) temperatur tinggi 400C dapat menon-aktifkan atau mematikan enzim di dalam tubuh organisme. Kisaran suhu optimum bagi pertumbuhan fitoplankton umumnya adalah 250C–320C.
c. pH
satuan pH (Kimball, 1999). Batas pH untuk pertumbuhan jasad merupakan suatu gambaran dari batas pH bagi kegiatan enzim (Van Den Hoek, 1995). Selanjutnya dijelaskan oleh Dwijoseputro (1994) ion H+sangat berpengaruh terhadap
kegiatan enzim. Jika suatu enzim menunjukkan kegiatannya pada pH tertentu, kenaikan atau penurunan pH dapat menyebabkan kegiatan enzim itu berubah. Pada pH tertentu suatu enzim mengubah substrat menjadi hasil akhir, maka perubahan pH dapat membalik aktifitas enzim dengan merubah hasil akhir kembali menjadi substrat. Umumnya fitoplankton dapat tumbuh baik pada kisaran pH 8,0 - 8,5.
d. Kandungan CO2Bebas
Tersedianya CO2di dalam media kultur merupakan faktor penting untuk fitoplankton, karena secara langsung dipakai sebagai bahan untuk membentuk molekul-molekul organik melalui proses fotosintesa. Dalam Budidaya
fitoplankton suplai O2terlarut ke dalam media kultur biasanya dilakukan dengan pemberian aerasi melalui blower (pompa udara), aerasi juga berfungsi untuk meratakan sebaran nutrien yang ada (Burkhard and Riebesell, 1999).
e. Salinitas
fitoplankton air laut hidup normal pada salinitas optimum 25–35 ‰ (Rusyani
dkk, 2007)
2.5. KulturNannochloropsissp. 2.5.1. Isolasi
Prinsip dasar isolasi adalah usaha untuk memurnikan spesies mikroalga yang tercampur jenis lain, atau memilih spesies mikroalga tertentu apabila diperoleh dari perairan alam. Teknik isolasi yang biasa dilakukan ada 3 macam yakni : metode mikro pipet, media agar dan kultur berulang (Isnansetyo dan Kurniastuty, 1995).
2.5.2. Kultur Murni
Pada dasarnya persiapan kultur fitoplankton adalah sama yaitu sterilisasi alat dan media kultur yang bertujuan untuk membunuh organisme yang tidak
diinginkan. Peralatan yang digunakan, harus dalam keadaan bersih, kemudian disterilisasi dengan oven atau autoclave. Sedangkan media kultur yang akan digunakan dapat digunakan media air laut buatan atau media air laut biasa. Sterilisasi air media dapat menggunakan autoclave, memasak air laut maupun sterilisasi secara kimiawi (Chlorinisasi), kemudian dinetralisir dengan Natrium Thiosulfate ( Matosudarmo dan Wulani, 1990).
kultur 1 liter, 3 liter, dan 5 liter, dengan pemberian pupuk yang sesuai (Rusyani dkk, 2007).
2.6. Molase
Menurut Utami (tahun 2009) Molase merupakan bahan sisa dari industri pembuatan gula dan industri yang biasa memanfaatkan molase adalah pabrik alkohol dan MSG (Monosodium Glutamat).United Molasesmendefinisikan molase sebagai “end product” pembuatan gula yang tidak mengandung lagi gula yang dapat dikristalkan dengan cara konvensional (Olbrich, 1973). Molase adalah sejenis sirup yang merupakan sisa dari proses pengkristalan gula pasir. Molase tidak dapat dikristalkan karena mengandung banyak glukosa dan fruktosa yang sulit untuk dikristalkan. Molase mengandung sejumlah besar gula, baik sukrosa maupun gula pereduksi. Total kandungan gula berkisar 48-56% dan pHnya sekitar 5,5-5,6 (Sa’id, 1987).Pada industri gula (molase) termasuk kategori limbah dengan kandungan energi tinggi, tetapi rendah kandungan nitrogen. Selain itu, molase juga tinggi akan kandungan karbohidrat tetapi rendah kandungan protein (Pramana, 2008). Komposisi kimia molase dapat dilihat pada tabel 4 dan 5. Tabel 4. Komposisi kimia Molase
Komposisi Presentase (%)
Bahan Kering
Tabel 5. Komposisi molase (Dellweg, 1983) :
Residu soda dan karbonat (sebagai CO2) Residu sulfat (sebagai SO3)
Titrimetri
Menurut Meade and Chem (1977) molase dari tebu dapat dibedakan menjadi 3 jenis, yaitu molase kelas 1, kelas 2 dan kelas 3. Molase kelas 1 didapatkan saat pertama kali jus tebu dikristalkan. Saat dikristalkan terdapat sisa jus yang tidak mengkristal dan berwarna bening. Jus ini diambil sebagai molase kelas 1. Molase kelas 2 diperoleh saat kristalisasi kedua. Warnanya agak
kecoklatan sering disebut juga dengan istilah “Dark”. Molase terakhir atau kelas 3 diperoleh dari kristalisasi terakhir, berwarna mendekati hitam (coklat tua)
kandungan yang bermanfaat, zat–zat tersebut antara lain kalsium, magnesium, potassium, dan besi (Chapmanet al, 1965 dan Simanjuntak, 2009).
Pemilihan molase sebagai bahan baku industri didasarkan pada hal-hal berikut : 1. Pabrik gula di Indonesia cukup banyak, sehingga limbah molase yang
dihasilkan juga banyak.
2. Memanfaatkan limbah industri menjadi produk yang bersifat komersial
3. Kandungan unsur hara dalam molase bisa sebagai media tumbuh fitoplankton 4. Produk asam sitrat yang didapatkan dalam industri menggunakan limbah padat,
sehingga perlu diusahakan pembuatan dari bahan cair secara komersial. Asam sitrat merupakan salah satu asam organik yang banyak digunakan dalam industri makanan dan minuman (60 % dari total produksi), antara lain berfungsi sebagai pemberi rasa asam, antioksidan dan pengemulsi. Flavor sari buah, ekstrak sari buah, es krim, marmalade diperkuat dan diawetkan dengan menambahkan asam sitrat. Selain itu juga banyak digunakan dalam industri farmasi, kosmetik dan detergent. Dalam industri farmasi (10 % dari total produksi), digunakan sebagai bahan pengawet dalam penyimpanan darah atau sebagai sumber zat besi dalam bentuk Feri-sitrat. Pada industri kimia 25 % dari total produksi digunakan sebagai antibuih dan bahan pelunak (Rahman, 1992).
2.7. Penggunaan Molase Untuk Pupuk
III. METODE PENELITIAN
3.1. Waktu Dan Tempat Pelaksanaan Penelitian
Penelitian ini dilaksanakan pada bulan Juli - Nopember 2011, dilakukan di Laboratorium Fitoplankton, divisi pakan hidup, Balai Besar Pengembangan Budidaya Laut, Desa Hanura, Kecamatan Padang Cermin, Kabupaten Pesawaran.
3.2. Bahan Dan Alat 3.2.1. Bahan
Bahan yang digunakan untuk penelitian adalah ; fitoplankton Nannochloropsis sp., molase, urea, TSP, alkohol 70 %, pupuk conwy, aquabidest, aquadest, air laut steril, dan air tawar steril.
3.2.2. Alat Penelitian
Alat yang digunakan dalam penelitian dapat dilihat pada tabel 6 dan tabel 7 ; Tabel 6. Alat-alat yang digunakan untuk kulturNannochloropsissp. selama
penelitian
Nama Alat Ukuran/ Ketelitian
Kegunaan
Tabung kaca 3 L Sebagai wadah uji kultur Nannochloropsis sp.
Beaker glass 100 mL Untuk mengambil bahan uji Nannochloropsissp.
Kertas Saring 10 µm Untuk menyaringNannochloropsissp. Timbangan - Untuk menimbang bahan–bahan pupuk Botol gelap 500 ml Untuk wadah larutan pupuk
Stirer - Sebagai pengaduk dalam pembuatan larutan pupuk
Biuret 25 mL Mengambi llarutan pupuk Pipet tetes 1 ml Untuk mengambil bahan uji Haemocytometer 104sel/ml Untuk menghitung Kepadatan
Nannochloropsissp. Mikroskop - Untuk mengamati Kualitas
Nannochloropsis sp.
Hand counter - Sebagai alat bantu Menghitung kepadatan Nannochloropsissp.
Lampu TL 20 watt Sebagai sumber cahaya dalam pemeliharaan Nannochloropsissp.
Batu aerasi, selang, dan aerator (Hi-Blower)
- Untuk aerasi media pemeliharaan Nannochloropsissp.
Cartridge filter - Untuk menyaring air media
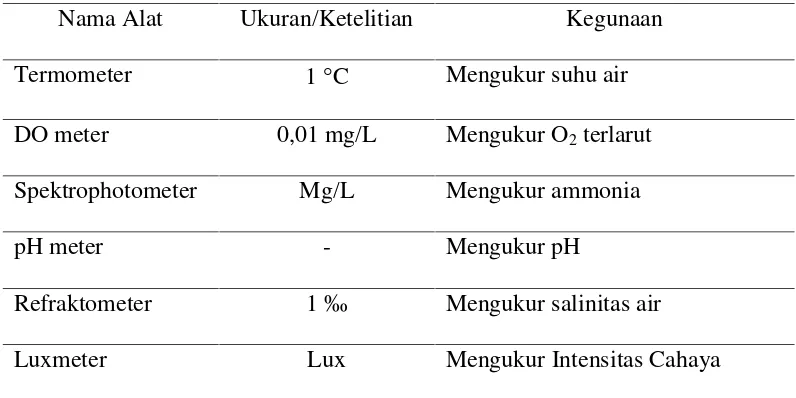
Tabel 7. Alat yang digunakan untuk pengukuran kualitas air
Nama Alat Ukuran/Ketelitian Kegunaan Termometer 1C Mengukur suhu air DO meter 0,01 mg/L Mengukur O2terlarut Spektrophotometer Mg/L Mengukur ammonia
pH meter - Mengukur pH
Refraktometer 1 ‰ Mengukur salinitas air Luxmeter Lux Mengukur Intensitas Cahaya
3.3. Metode Penelitian
Penelitian ini menggunakan Rancangan acak lengkap dengan 7 perlakuan dan masing–masing dalam 4 ulangan. Rancangan ini digunakan karena satuan yang homogen, dalam arti keragaman antar satuan percobaannya kecil (Steel dan Torrie, 1995). Perlakuan dalam penelitian ini adalah pemberian molase dengan dosis yang berbeda dalam media urea 30 ppm dan TSP 10 ppm. Dosis urea dan TSP yang digunakan berdasarkan uji coba yang sudah dilakukan BBPBL Lampung dan dosis tersebut yang biasa digunakan untuk kulturNannochloropsissp. di Divisi Pakan Alami, Balai Besar Pemgembangan Budidaya Laut Lampung. Perlakuan dosis molase perlakuan berdasarkan hasil penelitian pendahuluan yaitu sebagai berikut : Perlakuan A : Molase 0 ppm
D : Molase 7 ppm E : Molase 10 ppm F : Molase 12 ppm G : Conwy
Tata letak wadah penelitian hasil pengacakan dapat dilihat pada Gambar 3.
Gambar 3. Tata letak wadah uji selama penelitian
3.4. Pelaksanaan penelitian
3.4.1. Persiapan
Persiapan yang dilakukan sebelum penelitian dimulai meliputi bahan, persiapan alat, pembuatan media kultur, dan pelaksanaan penelitian.
a. Persiapan media dan peralatan uji
Persiapan media dan peralatan meliputi sterilisasi media kultur seperti air laut dan alat, dengan cara :
F3 D3
C3
D2 E1 C2 G2
B1 A2 E4
B4
F2 A3
A1 D4 E2 C1 G3 B2 F4
B3 F1 G1 A4 D1 E3 C4
1. Air laut disaring dengan 3 tahap penyaringan, yaitu dengan saringan 10 µm, 5 µm, dan 1 µm yang befungsi untuk menyaring partikel atau bahan organik.
2. Air laut yang telah disaring dengancartridge filterdisterilisasi kembali dengan sinar ultra violet
3. Setelah itu air laut hasil penyaringan direbus sampai mendidih. 4. Air/media kultur yang telah steril dimasukkan ke dalam wadah uji Selanjutnya dilakukan sterilisasi peralatan uji yang meliputi ;
1. Peralatan uji di cuci dengan sabun dan dibilas air tawar sampai bersih 2. Setelah itu disemprot dengan alkohol 70 %
3. Peralatan aerasi seperti selang dan batu aerasi direbus sampai mendidih.
4. Peralatan gelas seperti pipet, tabung reaksi, gelas ukur, petridish, dan erlehmeyer disterilisasi dengan alat autoclave atau oven
b. Penyediaan bahan uji
Penyediaan Bahan uji meliputi pembuatan larutan pupuk dan kultur
Nannochloropsissp. Pupuk yang digunakan pada skala laboratorium ini terbuat dari bahan kimia PA (pro analis) dengan dosis pemakaian 1 ml pupuk untuk 1 liter volume kultur. Jenis dan formula pupuk adalah yang sudah umum digunakan yaitu Conwyatau Walne’s medium (tabel 9). Untuk memudahkan pemakaiannya, terlebih dahulu dibuat stok pupuk cair. Pupuk Conwy umum digunakan untuk fitoplankton Chlorophycea atau fitoplankton yang berwarna hijau.
digunakan ditimbang dan dilarutkan satu-persatu secara berurutan ke dalam gelas ukur. Trace metal dan vitamin dibuat tersendiri untuk mempermudah pemakaiannya (Tabel 10). Setelah seluruh bahan larut sempurna, pupuk cair disimpan dalam botol gelap dan siap digunakan. Komposisi dan bahan-bahan pembuatan larutan pupuk dapat dilihat pada Tabel 8, Tabel 9, dan Tabel 10.
Tabel 8. Komposisi larutan Pupuk perlakuan No. Bahan Dosis (ppm)
1. Urea 30
2. TSP 10
3. Molase 3-12
Tabel 9. Komposisi Pupuk Untuk KulturNannochloropsissp. Skala Laboratorium (Borowitzka, 1988)
Keterangan : Stock Larutan pupuk Conwy 1000 ml digunakan untuk kulturNannochloropsissp. Sebanyak 1000 liter
Tabel 10. KomposisiTrace Metal Solution
Cara pembuatan Larutan Pupuk adalah sebagai berikut:
1. Bahan–bahan Kimia untuk pembuatan larutan pupuk ditimbang.
2. Bahan–bahan kimia yang telah ditimbang sesuai dengan takaran dimasukkan satu–persatu sesuai dengan urutan ke dalam gelas ukur yang telah berisi aquabides, lalu diaduk dengan alat stirer.
3. Setelah teraduk rata dan bahan–bahan kimia benar–benar larut, ditambahkan Aquabidest sampai menjadi 1 liter
4. Larutan pupuk ditempatkan dalam botol gelap.
3.4.2. Persiapan BibitNannochloropsissp.
Prosedur Penyiapan bahan ujiNannochloropsis sp. adalah sebagai berikut: a. Kultur media agar
dimurnikan dengan menginokulasikan ke dalam media agar. Mula-mula bacto-agar ditimbang sebanyak 1,5 gram dan dilarutkan dalam 100 ml air laut, kemudian dipanaskan sampai mendidih dan larutan agar menjadi jernih. Selama pemanasan berlangsung, larutan agar selalu diaduk agar tidak terjadi penggumpalan. Setelah mendidih larutan bacto-agar tersebut diangkat dan setelah agak dingin ditambahkan pupuk sesuai dengan jenisNannochloropsissp. yang akan diinokulasi. Selanjutnya larutan dituangkan ke dalam cawan petri yang sudah steril dengan ketebalan 3–5 mm. Penumbuhan inokulumNannochloropsissp. dalam media agar dengan metode gores menggunakan jarum ose yang sebelumnya telah dibakar dengan lampu bunsen agar steril.
Untuk mencegah kontaminasi dengan mikroorganisme lain, cawan petri yang telah ditanami bibitNannochloropsissp. disegel atau ditutup dengan selotip,
kemudian diletakkan di rak kultur yang disinari dengan lampu TL. Cawan petri diletakkan dalam keadaan terbalik untuk mencegah terjadinya penetesan embun dari bagian tutup ke media agar yang bisa mengganggu pertumbuhanNannochloropsissp.
b. Kultur Di Media Cair
kultur yang dilengkapi dengan lampu TL. Selama masa kultur tabung reaksi dikocok sesering mungkin, minimal 3 kali sehari dengan tujuan untuk menghindari terjadinya pengendapan dan untuk difusi udara. BibitNannochloropsissp. dalam tabung reaksi yang telah tumbuh dan meningkat kepadatannya (mencapai 20 x 104sel/ml),
dipindahkan ke erlemeyer volume 100–250 ml. Nannochloropsissp. di panen setelah 7 hari kultur.
3.4.3. Pelaksanaan penelitian
3.4.3.1. Penelitian pendahuluan
Penelitian pendahuluan dilakukan untuk menentukan dosis molase yang tepat dalam media ujiNannochloropsissp., tahapan tersebut yaitu :
1. 9 buah tabung kaca volume 3 liter diisi air laut dengan salinitas 28 ppt. 2. BibitNannochloropsissp. dimasukkan dalam wadah kultur. Kepadatan awal tebar dihitung dengan rumus (Villegas 1995) :
V1 x N1 = V2 x N2 Keterangan :
V1 = volume BibitNannochloropsissp. dalam biakan murni (mL) N1 = kepadatan bibitNannochloropsissp dalam biakan murni (sel/mL) V2 = volume media kulturNannochloropsissp. yang dikehendaki (mL) N2 = kepadatan awalNannochloropsissp. yang dikehendaki (sel/mL) 3. BibitNannochloropsis sp. yang sudah disaring dimasukkan ke dalam wadah
4. Pupuk UREA dengan dosis 30 ppm dan TSP 10 ppm dimasukkan kedalam masing–masing wadah uji
5. Molase perlakuan dimasukkan berturut-turut dengan dosis 1, 10 dan 15 ppm ke dalam wadah kultur dengan ulangan 3 kali.
6. Perlakuan diberi aerasi dan diletakkan pada rak kultur, yang diberi pencahayaan dari 2 buah lampu TL 40 watt dengan intensitas cahaya berkisar 2750–3500 lux dan ditempatkan pada ruang AC
7. Dilakukan penghitungan kepadatan populasi Nannochloropsissp. perlakuan setiap hari sampai terjadi penurunan populasi
8. Dari hasil data kepadatanNannochloropsissp. uji pendahuluan yang terbaik, ditentukan dosis molase perlakuan yang tepat.
Hasil dari penelitian pendahuluan selama 8 hari kultur diperoleh hasil pada dosis molase 1 ppm kepadatanNannochloropsissp. mencapai 55 juta sel/ml pada hari ke 7, pada dosis 10 ppm didapatkan hasil 82 juta sel/ml pada hari ke 6, dan dosis 15 ppm didapatkan hasil 67 juta sel/ml pada hari ke 7. Penentuan dosis terbaik yaitu 10 ppm dengan kepadatan Nannochloropsis sp. paling tinggi yaitu 82 juta sel/ml. Dari hasil penelitian pendahuluan dapat diketahui pemberian dosis molase yang ditambahkan dalam kultur Nannochloropsissp. adalah > 1 ppm < 15 ppm.
3.4.3.2. Penelitian utama
1. BibitNannochloropsissp. dikultur pada wadah kultur volume 2 liter dengan kepadatan sebanyak 5 x 106sel/ml.
2. BibitNannochloropsissp. dibiakkan dengan media Urea (30 ppm) dan TSP (10 ppm) sehinggaNannochloropsissp. dapat beradaptasi dengan media tersebut.
3. Hasil kultur, dikembangkan lagi dengan melakukan kultur pada media yang sesuai dengan perlakuan yaitu penambahan molase dengan dosis 3, 5, 7, 10, dan 12 ppm.
4. Hasil kultur digunakan sebagai bibitNannochloropsissp. untuk penelitian. Adapun tahapan penelitian utama adalah sebagai berikut :
1. Tabung kaca (toples) volume 3 liter sebanyak 27 buah diisi dengan air laut salinitas 28 ppt .
2. BibitNannochloropsissp. yang sudah disaring dengan kertas saring dimasukkan dalam wadah kultur supaya sel- sel yang mati tidak terbawa dalam kultur. Kepadatan awal inokulum (KAI) adalah 5 x 106sel/mL. 3. Pupuk UREA dengan dosis 30 ppm dan TSP 10 ppm dimasukkan kedalam
masing–masing wadah uji
4. Sebagai perlakuan, molase dimasukkan berturut-turut dengan dosis 1, 10 dan 15 ppm ke dalam wadah kultur dengan ulangan 4 kali.
5. Perlakuan diberi aerasi dan diletakkan pada rak kultur, yang diberi
6. Dilakukan penghitungan kepadatan populasi Nannochloropsissp. perlakuan setiap hari sampai terjadi penurunan populasi (selama 11 hari kultur)
7. Selama pengujian dilakukan pengamatan pertumbuhan, yang meliputi penghitungan kepadatanNannochloropsissp.
8. pada awal dan akhir penelitian ( 11 hari ) dilakukan pengukuran kualitas air. 9. Dilakukan analisis proksimat pada akhir penelitian untuk mengetahui
kandungan giziNannochloropsissp. pengujian.
3.5. Pengamatan PertumbuhanNannochloropsissp.
Pengamatan pertumbuhan Nannochloropsis sp. dilakukan setiap hari selama awal penelitian hingga populasi mencapai titik tetinggi (maksimal) dan sampai terjadi penurunan kepadatanNannochloropsissp. pada akhir penelitian.
Karakteristik pertumbuhanNannochloropsissp. yang diamati adalahdoubling time(waktu generasi), laju pertumbuhan relatif, kandungan klorofil, dan waktu maksimum saat mencapai puncak populasi. Waktu maksimum menentukan lamanya waktu pemanenan. Karakteristik pertumbuhanNannochloropsissp. terbaik adalah yang menghasilkan laju pertumbuhan yang tertinggi,doubling time yang singkat serta memiliki kandungan gizi (protein, karbohidrat, dan lemak) yang tinggi.
kepadatan sel Nannochloropsis sp. menggunakan alat Haemacytometer model Neubreur dan diamati dibawah mikroskop dengan pembesaran 100 - 400 kali. Penghitungan dilakukan setiap hari, dimulai dari hari pertama sampai kepadatan sel menurun. Sampel yang diamati sebanyak 3 kali ulangan, dengan jumlah sampel 100 mL. Estimasi penghitungan jumlah sel menurut Fatuchri (1985) adalah sebagai berikut :
(a) Dalam 400 kotak (bila kepadatan rendah) Jumlah sel x 104/ml = ...sel/mL
(b) Dalam beberapa kotak yang dipilih secara acak (bila kepadatan tinggi) Rata–rata jumlah sel perkotak x 400 x 104/mL = ...sel/ml
Hasil dari data kepadatan populasi dihitung laju pertumbuhan spesifik. Laju pertumbuhan spesifik diukur berdasarkan jumlah populasi pada awal penelitian hingga hari dimana jumlah populasi mencapai titik tetinggi (maksimal) (Suminto dan Hirayama, 1997).
Pengukuran kandungan klorofil dilakukan dengan metoda Carl J. Lorenzen ( Danakusuma, 1985) dengan cara ;
- Ditakar sampelNannochloropsissp. ke dalam gelas ukur sebanyak 200 ml
- Disaring dengan kertas saring, whatman GF/C diameter 4.7 cm, diameter pori–pori 1,2 mikron dengan tebal 0,26 mm dengan pompa vakum
- Di potong–potong dengan gunting kertas saring yang telah berisi endapan Nannochloropsissp. dan dilarutkan dengan aceton 90 % kedalam centrifuge tube
sehingga timbul endapan dan cairan jernih berfluoresensi kuning
- Dimasukkan cairan tersebut ke cuvette spektrofotometer, diperiksa dengan 750 nm dan 665 nm. Sebagai blanko digunakan aceton 90 %.
Penghitungan :
A = Koofisien absorbsi chlorofil, yaitu 11,0
K = Faktor reduksi pada absorbance karena konsentrasi klorofil, yaitu 1.7 : 0.7 = 2,43
665o = Absorban sebelum acidifikasi 665a = Absorban sesudah acidifikasi
V = Volume aceton 90 % (ml) yang dipakai untuk ekstraksi Vf = Banyaknya sampel air (liter yang difilter)
I = Panjang (path length) dari cuvette spectrofotometer (cm)
3.6. Pengamatan kandungan gizi
Pengamatan kandungan gizi dilakukan dengan melakukan analisa proksimat. Analisa ini dilakukan untuk mengetahui jumlah kandungan protein, karbohidrat, dan lemak. Penentuan kadar lemak dengan Metode Soxhlet (SII 2453-90), penentuan kadar Karbohidrat dengan penetapan kadar glukosa standar untuk, dan penentuan kadar protein dengan Metode Semi mikro Kjedahl. Analisa dilakukan di
3.7. Parameter Kualitas Air Media Pemeliharaan
Sebagai data pendukung maka dilakukan pengukuran beberapa parameter fisika–kimia, seperti suhu, pH, salinitas, DO, pH, dan NH3.
1. Suhu
Suhu media pemeliharaan di ukur dengan menggunakan thermometer. Thermometer di masukkan ke dalam air selama kurang lebih dua menit kemudian pembacaan nilai suhu dilakukan pada saat thermometer masih berada di dalam air agar nilai suhu yang terukur tidak dipengaruhi oleh suhu udara. Pembacaan nilai suhu sampai menunjukkan nilai yang konstan (Hutagalung dkk, 1997).
2. Salinitas
Pengukuran salinitas dilakukan dengan menggunakan alat Hand Refractometer. Refraktometer dikalibrasi dengan akuades sampai skala 0 ppt.
Pengukuran salinitas dilakukan dengan cara meneteskan sampel air media pemeliharaan pada prisma refraktometer dengan menggunakan pipet tetes. Nilai yang tertera pada skala refraktometer menyatakan salinitas air laut (Hutagalung dkk, 1997). Oksigen Terlarut
Pengukuran oksigen terlarut dilakukan dengan menggunakan DO meter, yaitu dengan cara memasukkan salah satu elemen DO meter ke dalam air sampel,
3. pH
Pengukuran pH dilakukan dengan menggunakan alat pH meter. Mula–mula ujung elektroda dibilas dengan akuades, kemudian dimasukkan dalam larutan
penyangga untuk kalibrasi. Kontrol pada pH meter diatur sampai terbaca pH larutan penyangga. Ujung elektroda dibilas kembali dengan akuades, lalu dimasukkan ke dalam air sample sampai beberapa saat sampai skala menunjukkan angka yang konstan. Nilai yang terbaca menunjukkan nilai pH (Hutagalung dkk, 1997). 4. Amoniak
Pengukuran kadar amoniak dalam air laut dilakukan menggunakan spektofotometer dengan metode spektrofotometrik yang didasarkan pada pembentukan senyawa indifenol berwarna biru.
1. Pembuatan Reagen - Larutan pereaksi A
1,5 g fenol (C6H5OH) dan 0,02 g (Na2Fe(CN)5NO.2H2O) dinatrium nitroprusid dihidrat dilarutkan dalam 50 ml air suling bebas amoniak, lalu disimpan dalam botol gelap dan dimasukkan dalam refrigerator.
- Larutan pereaksi B
20 g kristal natrium sitrat (C6H5Na3O7.2H2O) dan 1,1 g NaOH dilarutkan dalam 40 ml air suling bebas amoniak. Setelah larut, tambahan 1,5 ml natrium hipoklorit (NaClO). Kemudian di encerkan menjadi 50 ml dengan air suling bebas amoniak
2. Prosedur Analisis
- Contoh air sebanyak 10 ml disaring dengan kertas saring yang berukuran pori 0,45 µm dan di masukkan dalam tabung gelas, lalu ditambahkan 0,5 ml larutan pereaksi A, lalu dikocok dengan hati-hati selanjutnya ditambahkan 0,5 ml larutan pereaksi
B, lalu dikocok dengan hati-hati.
- Tabung gelas ditutup dengan parafilm dan di simpan di tempat gelap selama 24 jam. - Absorbansinya diukur dengan menggunakan spektrofotometer pada panjang
gelombang 630 nm (Hutagalung dkk, 1997).
3.8. Pengumpulan dan Analisa Data 3.8.1. Pengumpulan data
Data yang diambil dalam penelitian ini adalah pengamatan pertumbuhan dan kandungan gizi Nannochloropsis sp. selama 11 hari. Pengamatan tersebut meliputi kepadatan puncak populasi, dan kepadatan akhir populasi, dan laju pertumbuhan spesifik serta dilakukan analisa proksimat yang meliputi kadar protein, lemak dan karbohidrat.
Karakter pertumbuhan Nannochloropsis sp. dianalisis dengan Kurva pertumbuhan mikroalga yang dibuat berdasarkan data yang didapatkan persatuan waktu. Dari data tersebut dapat dihitung waktu generasi (generated/doubling time) dan pertumbuhan relatif berbagai jenis mikroalgae hasil kultur. Rumus pendugaan waktu generasi ( Stevenson, 1986 dalam Kurniastuty dan Julinasari, 1995) adalah :
Keterangan : G : generated time
t : waktu dari Wo ke Wt (jam)
Wt : jumlah sel setelah waktu t (sel/mL) Wo : jumlah sel awal (sel/mL)
3,3 : konstanta
Menurut Fogget al.(1975), laju pertumbuhan spesifik (k) dihitung dengan rumus :
T lnWo -lnWt k
Keterangan :
k = Laju Pertumbuhan spesifik
Wt = Jumlah sel setelah waktu t (sel/mL) Wo = Jumlah sel awal ( sel/mL)
T = Waktu dari Wo ke Wt (hari)
3.8.2. Analisis Data
V. SIMPULAN DAN SARAN
5.1. Simpulan
1. Pemberian molase dalam media urea dan TSP dalam kulturNannochloropsis sp. menunjukkan perbedaan yang nyata terhadap kepadatan populasi
maksimum, waktu maksimum, laju pertumbuhan spesifik, waktu penggandaan, dan kandungan gizi (protein, Karbohidrat dan Lemak).
2. Penambahan molase sebanyak 10 ppm dalam media Urea dan TSP merupakan dosis yang paling efektif untuk menunjang pertumbuhanNannochloropsissp. 3. Kandungan giziNannochloropsissp. yang terbaik terdapat pada perlakuan
penambahan molase 10 ppm.
5.2. Saran
1. Perlu dilakukan penelitian lanjutan untuk mengetahui kualitas sel
Nannochloropsissp. yang dihasilkan terutama kandungan gizi pada setiap fase pertumbuhan
MOLASE SEBAGAI SUMBER MIKRO NUTRIEN PADA BUDIDAYA PHYTOPLANKTONNannochloropsissp., SALAH SATU ALTERNATIF
PEMANFAATAN HASIL SAMPING PABRIK GULA
(Tesis)
Oleh EMY RUSYANI
PROGRAM STUDI MAGISTER ILMU LINGKUNGAN FAKULTAS PASCASARJANA
UNIVERSITAS LAMPUNG BANDAR LAMPUNG
MOLASE SEBAGAI SUMBER MIKRO NUTRIEN PADA BUDIDAYA PHYTOPLANKTONNannochloropsissp., SALAH SATU ALTERNATIF
PEMANFAATAN HASIL SAMPING PABRIK GULA
Oleh EMY RUSYANI
Tesis
Sebagai Salah Satu Syarat untuk Mencapai Gelar Magister Ilmu Lingkungan
Pada
Program Pascasarjana Magister Ilmu lingkungan Fakultas Pascasarjana Universitas Lampung
PROGRAM STUDI MAGISTER ILMU LINGKUNGAN FAKULTAS PASCASARJANA
UNIVERSITAS LAMPUNG BANDAR LAMPUNG
Judul Tesis : MOLASE SEBAGAI SUMBER MIKRO NUTRIEN PADA BUDIDAYA PHYTOPLANKTON
Nannochloropsissp., SALAH SATU ALTERNATIF PEMANFAATAN HASIL SAMPING PABRIK GULA
Nama Mahasiswa : EMY RUSYANI Nomor Pokok Mahasiswa : 0920011018
Program Studi : Magister Ilmu Lingkungan
Konsentrasi : Pengelolaan Sumber Daya Alam Dan Lingkungan Pembimbing : 1. Drs. TUGIYONO, MS. Ph.D
Judul Tesis : MOLASE SEBAGAI SUMBER MIKRO NUTRIEN PADA BUDIDAYA PHYTOPLANKTON
Nannochloropsissp., SALAH SATU ALTERNATIF PEMANFAATAN HASIL SAMPING PABRIK GULA
Nama Mahasiswa : EMY RUSYANI Nomor Pokok Mahasiswa : 0920011018
Program Studi : Magister Ilmu Lingkungan Fakultas : Pasca Sarjana
MENYETUJUI Komisi Pembimbing
Drs. TUGIYONO, MS. Ph.D Dra. SRI MURWANI, M.Sc NIP 196411191990031001 NIP 195307091984032001
MENGETAHUI
Ketua Program Studi Magister Ilmu Lingkungan Universitas Lampung
DAFTAR GAMBAR
Halaman
1. GambarNannochloropsissp. ………16 2. Pola Pertumbuhan Fitoplankton ……….. 19 3. Tata Letak Wadah Uji Penelitian ………. 39 4. Grafik Kepadatan rerata PopulasiNannochloropsissp. pada masing–masing
DAFTAR ISI
Halaman KATA PENGANTAR ... i DAFTAR ISI ... ii DAFTAR TABEL ... iv DAFTAR GAMBAR... v DAFTAR LAMPIRAN ... vi
I. PENDAHULUAN ………. 1
1.1. Latar Belakang………. 1 1.2. Batasan penelitian……… 4 1.3. Tujuan dan Manfaat... 5 1.4. Kerangka Pemikiran ... 5 1.5. Hipotesis ... 6 II. TINJAUAN PUSTAKA
2.4. Media Pertumbuhan ... 21 2.4.1. Unsur Makro Nutrien ... 25 2.4.2. UnsurTrace element(Mikro nutrien) …..………... 27 2.5. Faktor Lingkungan yang Berpengaruh Terhadap Pertumbuhan
Nannochloropsissp. ...………...……….... 28 2.5.1. Cahaya ..……….. 28 2.5.2. Temperatur (Suhu) ...……….. 29 2.5.3. pH ………... 29 2.5.4. Kandungan CO2bebas ……….….. 30 2.5.5. Salinitas ………..… 30 2.6. KulturNannochloropsissp. ……… 31 2.6.1.Isolasi ………. 31 2.6.2. Kultur Murni……….. 31
2.7. Molase……… 32
2.8. Penggunaan Molase Untuk Pupuk………... 34 III. METODE PENELITIAN ... 36
IV. HASIL DAN PEMBAHASAN……… 54 4.1. Kepadatan PopulasiNannochloropsissp. ... 54 4.2. Waktu Maksimum (hari)Nannochloropsissp. ... 58 4.3. Kepadatan populasi MaksimumNannochloropsissp. ... 60 4.4. Laju Pertumbuhan SpesifikNannochloropsissp. ... 62 4.5. Waktu Generasi MaksimumNannochloropsissp. ... 64 4.6. Kandungan GiziNannochloropsissp. ... 66 4.7. Serapan CO2Nannochlororpsissp.………71 4.8. Kualitas Air ... 73
DAFTAR PUSTAKA
Adehog. 2001. WWW.thealgasource.net/chromophyta. dikunjungi pada tanggal 12 April 2011 jam 21.10.
Amirasari, R. 2008. Pengembangan Phytoplankton Dengan Sistem Fotobioreaktor untuk mereduksi CO2. BBPT. Badan Pengkajian dan Penerapan Tekhnologi. Jakarta.
Anggadiredja, J.T. 2009. Daya Serap Gas Karbon Oleh Rumput Laut. Deputi
Tekhnologi Pengembangan Sumberdaya Alam. BBPT. Badan Pengkajian dan Penerapan Tekhnologi. Jakarta.
Anwar dan Suganda. 2002. Pupuk Limbah Industri. Pupuk Organik Dan Pupuk Hayati. Pemanfaatan Limbah Cair Pabrik Gula Tebu Bagi Upaya
Meningkatkan Kesuburan lahan. Proyek Pengkajian Tekhnologi Pertanian Partisipasif (PAATP). Badan penelitian dan pengembangan pertanian. Departemen pertanian.2002
Astin, 2008. peranan Mikroalga Dalam Mengurangi Efek Rumah Kaca. Institut Tekhnologi Bandung. Bandung.
Bahtiar, E. 2007. Penelusuran Sumber Daya Hayati Laut (Alga) Sebagai
Biotarget Industri. Makalah. Universitas padjadjaran Fakultas perikanan dan ilmu kelautan Jatinangor
Bishop, J.K.B. and R.E. Davis. 2000. Autonomous Observing Strategies for the Ocean Carbon Cycle. Lawrence Berkeley National Laboratory. Paper LBNL-46860.
Borowitzka, M.A. 1988. Algal Growth Media And Sources Of Algal Cultures. In : Borowitzka, M.A & L.J Borowitza (Eds) Microalga Biotechnology. Cambridge University Press: Cambridge. pp. 456-465.
Bougis, P. 1979. Marine Plankton Ecology. American Elseiver Publishing Company, New York.
Burkhard, S.J. Zondervan & U. Riebesell. 1999. Effect Of CO2 Concentration On C:N:P Ratio In Marine Phytoplankton : A Species Comparison. Limnol. And Ocean. 44 (3) : 683–690.
Campbell, J. B. Reece, L. G dan Mitchell. 2004.Biologi. Edisi kelima. Jilid 3. Jakarta : Penerbit Erlangga.
Chapman, H.L., R.W. Kidder, M. Koger, J.R. Crockett and W.K. McPherson. 1965, Blackstrap molasses for beef cows. Fla. Agr. Exp. Sta. Bull. 701. Chen, J and H.P.C. Shetty.1991. Culture Of Marine Feed Organisms. National Inland
Institute Kasetsart University Campus. Bangkhen, Bangkok, Thailand.38 P. Coutteau P., 1996, Micro Algae. Dalam Manual on the Production and Use of Live
Food for Aquaculture, Laboratory of quaculture and Artemia Reference Center University of Gent, Belgium, FAO, p : 7-30.
Dahuri, R., J. Rais, S.P. Ginting, M.J. Sitepu. (2001). Pengelolaan Sumber Daya
Wilayah Pesisir dan Lautan Secara Terpadu. Edisi Revisi. Pradnya Paramita: Jakarta
Danakusumah, E. 1985. Penentuan Kualitas Perairan. Mariculture Research and development Project (ATA 192). JICA.
Dellweg, 1983, (ed) “Biotechnology”, Vol 3, Chemie, Weinheim,
Doucha, J., F. Straka & K. Livansky. 2005. Utilization of flue gas for cultivation of microalgae (Chlorellasp.) in an outdoor thin-layer photobioreactor.J. Appl.Phycol.,17:403-412.
Dwijoseputro., 1994.Pengantar Fisiologi TumbuhanPT. Gramedia Pustaka Utama : Jakarta. 205 hal
Fahmi, T dan Sujitno, E. 2003. Penggunaan Urea Molases Block (UMB) Pada Ternak Sapi Perah Di Kec. Ciwidew, Kab. Bandung. Prosiding Seminar nasional. Pemanfaatan Sumberdaya Pertanian Melalui Akselerasi Pemasyarakatan. Balai Pengkajian Teknologi Pertanian Jawa Barat.
Fardiaz, S. 1992. Mikrobiologi Pangan. Gramedia. 30 hal.
Fatuchri, M. 1985. Budidaya Rotifera (Brachionus plicatilis O.F Muller). Proyek Penelitian dan Pengembangan Budidaya Laut. ATA-192. hal. 9–16.