ANALISIS BIOMOLEKULER GEN
INTERNAL
TRANSCRIBED SPACER
(ITS) DALAM STUDI FILOGENETIK
Zingiber loerzingii
Valeton (ZINGIBERACEAE)
CINTHYA LESTARI HERTIANTI DEWI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
CINTHYA LESTARI HERTIANTI DEWI. Analisis Biomolekuler Gen
Internal
Transcribed Spacer
(ITS) dalam Studi Filogenetik
Zingiber loerzingii
Valeton
(Zingiberaceae). Dibimbing oleh I MADE ARTIKA dan MARLINA ARDIYANI.
Zingiberaceae terdiri atas 50 genus dan 1400 spesies yang tersebar di
seluruh dunia khususnya pada daerah tropik dan subtropik. Pusat
keanekaragamannya berada di Asia Selatan dan Asia Tenggara.
Zingiber
loerzingii hanya ditemukan di Sumatera. Tidak seperti spesies lainnya, pengkajian
Zingiber loerzingii
belum banyak dilakukan sehingga informasi yang ada masih
terbatas sedangkan kejelasan identitas dari suatu tumbuhan bersifat sangat penting
untuk digunakan dalam pemanfaatannya. Penelitian ini bertujuan mengkaji
hubungan kekerabatan
Zingiber loerzingii dengan spesies dari famili
Zingiberaceae
lain khususnya
Zingiber
berdasarkan gen
Internal Transcribed
Spacer (ITS). DNA sampel diisolasi menggunakan metode modifikasi Doyle &
Doyle (1987) yang berbasis setiltrimetilamonium bromida. Amplifikasi daerah
ITS menghasilkan amplikon ± 700 bp.
Sequencing
menghasilkan sekuen ITS
Zingiber loerzingii berukuran 813 bp yang memperlihatkan daerah dengan laju
evolusi tinggi. Rekonstruksi pohon filogenetik dilakukan menggunakan program
Phylogenetic Analysis Using Parsimony dengan hasil yang menunjukkan bahwa
genus Zingiber membentuk suatu kelompok dengan nilai bootstrap sebesar 61.9%
yang terdiri atas dua buah kelompok yaitu kelompok I dengan nilai bootstrap 62%
dan kelompok II dengan
bootstrap 70.8%. Dengan demikian dapat disimpulkan
bahwa genus
Zingiber
kemungkinan besar merupakan genus yang monofiletik.
Zingiber loerzingii bersarang dalam kelompok I dengan sister taxa yaitu Zingiber
rubens, Zingiber orbiculatum dan Zingiber fragile.
ABSTRACT
CINTHYA LESTARI HERTIANTI DEWI. Biomolecular Analysis of Internal
Transcribed Spacer (ITS) Gene in Phylogenetic Study of
Zingiber loerzingii
Valeton (Zingiberaceae). Under the direction of I MADE ARTIKA and
MARLINA ARDIYANI.
Zingiberaceae consists of 50 genera and 1400 species distributed in tropical
and subtropical areas. The center of the diversity of Zingiberaceae is South Asia
and Southeast Asia.
Zingiber loerzingii
is only found in Sumatera. Unlike other
species, this species has not been well studied so the information is still limited,
whereas the clarity of plant identity is very crucial. The present study was aimed
to determine phylogenetic relationship of Zingiber loerzingii and its relative based
on the Internal Transcribed Spacer (ITS) gene. DNA sample was isolated using
cetyltrimethylammonium bromide based method of Doyle & Doyle modification.
Amplification of ITS region resulted in ± 700 bp amplicon. Sequencing of ITS
region of Zingiber loerzingii produced 813 bp DNA sequences that has high rate
of evolution. Recontruction of phylogenetic tree was analysed using the
Phylogenetic Analysis Using Parsimony program. The results of phylogenetic
analysis showed that the genus of Zingiber formed a clade with bootstrap value of
61.9%. The clade consisted of two clades, clade I with bootstrap 62% and clade II
with bootstrap 70.8%. Therefore, we conclude that the genus Zingiber
is possibly
monophyletic.
Zingiber loerzingii
is nested in clade I with the nearest or sister
taxa: Zingiber rubens, Zingiber orbiculatum dan Zingiber fragile.
ANALISIS BIOMOLEKULER GEN
INTERNAL
TRANSCRIBED SPACER
(ITS) DALAM STUDI FILOGENETIK
Zingiber loerzingii
Valeton (ZINGIBERACEAE)
CINTHYA LESTARI HERTIANTI DEWI
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Analisis Biomolekuler Gen
Internal Transcribed Spacer
(ITS)
dalam
Studi
Filogenetik
Zingiber
loerzingii
Valeton
(Zingiberaceae)
Nama
: Cinthya Lestari Hertianti Dewi
NRP
: G84080049
Tanggal Lulus :
Disetujui
Komisi pembimbing
Dr. Ir. I. Made Artika, M.App.Sc.
Ketua
Dr. Marlina Ardiyani, M.Sc
Anggota
Diketahui
PRAKATA
Syukur Alhamdulillah kehadirat Allah SWT atas segala limpahan kekuatan
dan hidayah-Nya sehingga penelitian dan karya ilmiah yang berjudul
“
Analisis
Biomolekuler Gen
Internal Transcribed Spacer
(ITS) dalam Studi Filogenetik
Zingiber loerzingii
Valeton (Zingiberaceae)
” telah penulis selesaikan.
Shalawat
dan salam semoga tercurahkan kepada Rasulullah SAW yang menjadi
kebanggaan dan teladan umat Islam sampai akhir zaman. Penelitian yang
dilakukan semenjak bulan Januari 2012 di Laboratorium Sistematika Molekuler
Tumbuhan, Pusat Penelitian Biologi, LIPI, Bogor ini diharapkan dapat
memberikan informasi ilmiah mengenai identitas Zingiber loerzingii yang selama
ini masih belum jelas.
Penulis mengucapkan terimakasih kepada semua pihak yang telah
membantu dalam penyelesaian penelitian ini baik secara langsung maupun tidak
langsung. Ucapan terimakasih penulis sampaikan kepada bapak Dr. Ir. I. Made
Artika, M.App.Sc. dan ibu Dr. Marlina Ardiyani, M.Sc selaku pembimbing yang
telah memberikan bimbingan, dukungan, kritik dan saran yang begitu berharga
bagi penulis. Penghargaan terbesar penulis haturkan kepada kedua orang tua
tercinta, teteh dan aa terkasih, Aldrich, Agus Setio, dan seluruh keluarga atas
curahan kasih sayang, doa, perhatian, dan dukungan yang tak henti-hentinya
diberikan kepada penulis. Semoga Allah SWT senantiasa membalas kebaikan
mereka. Ungkapan terima kasih penulis sampaikan pula kepada ibu Kepala
Bidang Botani, Puslit Biologi, LIPI, Dr. Joeni S Rahajoe, yang telah memberikan
izin untuk bekerja bersama Dr. Marlina Ardiyani, kepada ibu Yunita Nuresthi, ibu
Susila, dan teh Yesi di Laboratorium Sistematika Molekuler Tumbuhan, Pusat
Penelitian Biologi, LIPI atas peran dan kerjasamanya.
Penulis juga mengucapkan terimakasih kepada rekan-rekan selama
penelitian Yudith dan Aina atas bantuan dan motivasi yang diberikan. Tak lupa
pula penulis ucapkan terima kasih kepada sahabat seperjuangan Biokimia 45,
Arena, Putri, Sari, Azizah, Riris, Tati, Bambang, Gilang, David, Reza, dan
sahabat-sahabat yang tidak dapat disebutkan satu persatu atas segala bantuan,
motivasi, dan saran yang diberikan. Penulis berharap penelitian ini bermanfaat
baik bagi penulis maupun bagi masyarakat pada umumnya serta semua pihak
yang membutuhkan.
.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 7 Agustus 1990 dari ayah
bernama Tatang Hendarsah dan ibu bernama Mei Kuspitaningsih. Penulis adalah
anak kedua dari dua bersaudara. Pendidikan penulis dimulai dari TK Putra
Bahagia Bandung, SD Muara Beres Cibinong-Bogor, kemudian melanjutkan ke
SLTP Negeri 2 Cibinong. Tahun 2008 penulis menyelesaikan pendidikan Sekolah
Menengah Pertama di SMA Negeri 3 Bogor dan pada tahun yang sama lolos
seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis
memilih program studi mayor Biokimia, Fakultas Matematika dan Ilmu
Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA... 1
Penerapan Bioinformatika dalam Studi Filogenetik ... 1
Zingiber loerzingii ... 2
Internal Transcribed Spacer (ITS) rDNA ... 3
Teknik Isolasi DNA Tumbuhan ... 4
Polymerase Chain Reaction (PCR) ... 5
Sequencimg DNA ... 6
Elektroforesis Fragmen DNA ... 6
BAHAN DAN METODE ... 6
Bahan dan Alat ... 6
Metode ... 7
HASIL DAN PEMBAHASAN ... 8
Hasil Determinasi Zingiber loerzingii ... 8
DNA Zingiber loerzingii Hasil Isolasi ... 10
Hasil Amplifikasi DNA Zingiber loerzingii ... 11
Sekuen DNA Zingiber loerzingii ... 12
Analisis Filogenetik Berdasarkan Gen ITS ... 13
SIMPULAN DAN SARAN ... 17
Simpulan ... 17
Saran ... 17
DAFTAR PUSTAKA ... 17
DAFTAR GAMBAR
Halaman
1 Tumbuhan Zingiber loerzingii (Dokumentasi Marlina Ardiyani 2010) ... 2
2 Unit transkripsi ITS (Osterbauer & Rehms 2002) ... 3
3 Tahapan-tahapan dalam PCR (Jorde 2000) ... 5
4 Struktur tumbuhan Zingiber loerzingii: perawakan zingiber loerzingii (A);
Spesimen tipe Herbarium Kebun Raya Bogor (B); Bentuk perbungaan
Zingiber loerzingii (C); Spesimen perbungaan Zingiber loerzingii (D) ... 9
5 Bunga: Sketsa bunga
Zingiber loerzingii
(A); Bunga
Zingiber loerzingii
(B) (a. Daun pelindung; b. Anak daun pelindung; c. Bibir bunga; d. Daun
bunga dorsal; e. Daun bunga lateral; f. Kepala sari) ... 10
6 DNA
Zingiber loerzingii (ZL2) hasil isolasi metode modifikasi Doyle &
Doyle ... 11
7 Profil pita DNA Zingiber loerzingii (ZL2) hasil amplifikasi PCR ITS ... 12
8 Elektroferogram hasil
sequencing
DNA
Zingiber loerzingii; (a) Sekuen
forward; (b) Sekuen reverse. (Merah) basa T, (hitam) basa G, (hijau) basa
A, (biru) basa C ... 13
9 Penyatuan sekuen
forward dan sekuen
reverse
Zingiber loerzingii
menggunakan program ChromasPro. (Merah) basa T, (hitam) basa G,
(hijau) basa A, (biru) basa C ... 14
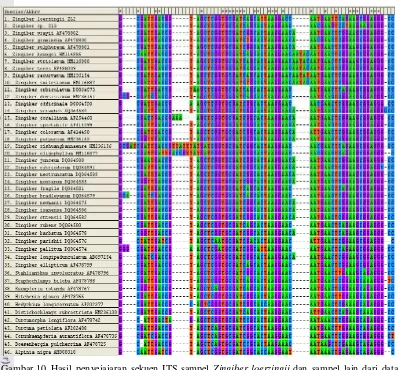
10 Hasil penyejajaran sekuen ITS sampel Zingiber loerzingii dan sampel lain
dari data GenBank. (Merah) basa T, (ungu) basa G, (hijau) basa A, (biru)
basa C ... 15
DAFTAR LAMPIRAN
Halaman
1 Diagram alir kegiatan secara umum ... 21
2 Tahap isolasi DNA (modifikasi Doyle & Doyle 1987) ... 22
3 Tahap purifikasi, sequencing DNA, dan dan analisis filogenetik ... 23
4 Sekuen DNA ITS Zingiberaceae dari GenBank ... 24
5 Hasil penyatuan
sekuen ITS sampel
Zingiber loerzingii.
(Merah) basa T,
(hitam) basa G, (hijau) basa A, (biru) basa C ... 25
PENDAHULUAN
Zingiberaceae merupakan salah satu famili dalam tumbuhan berbunga yang beberapa diantaranya termasuk ke dalam tanaman obat aromatik. Famili Zingiberaceae adalah bagian dari ordo Zingiberales, kelas Liliopsida, divisi Magnoliophyta. Tanaman ini memiliki pertumbuhan secara horizontal. Famili Zingiberaceae terdiri atas 50 genus dan 1400 spesies yang tersebar hampir di seluruh dunia khususnya di sepanjang daerah tropik dan subtropik, meliputi tropikal Afrika, Asia, dan Amerika. Pusat keanekaragamannya berada di Asia bagian selatan dan Asia Tenggara (Takano & Okada 2003).
Beberapa tumbuhan dari famili Zingiberaceae sudah banyak dimanfaatkan sebagai tanaman budidaya yang digunakan untuk obat alami, bumbu masak, maupun sebagai pestisida alami. Seiring dengan berkembangnya ilmu pengetahuan dan teknologi, kajian mengenai famili Zingiberaceae ini pun semakin meningkat, namun masih terbatas pada bidang kajian dan spesies tertentu, seperti pada Zingiber officinale (jahe), Curcuma zanthorrhiza (temu lawak), Zingiber littorale (Lempuyang pahit), dan Kaempferia galanga (kencur) yang didasarkan pada karakter morfologi, polen, kandungan kimia, dan yang saat ini sedang dikembangkan adalah berdasarkan pada karakter molekuler.
Zingiber merupakan salah satu genus dari Zingiberaceae. Salah satu spesies Zingiber yang terdapat di Indonesia yaitu Zingiber loerzingii. Zingiber loerzingii merupakan tumbuhan herba yang memiliki bentuk daun yang panjang dan meruncing. Memiliki satu atau lebih perbungaan (inflorescence) pada setiap tanamannya. Zingiber spesies ini di Indonesia ditemukan di daerah Sumatera. Tidak seperti spesies lainnya, pengkajian Zingiber loerzingii belum banyak dilakukan sehingga informasi yang ada masih terbatas sedangkan kejelasan identitas dari suatu tumbuhan bersifat sangat penting untuk digunakan dalam pemanfaatannya, misalnya untuk penelitian. Suatu penelitian tidak dapat diulang atau diuji kebenarannya jika identitas dari objek yang diteliti meragukan.
Filogenetik digambarkan sebagai klasifikasi secara taksonomi dari organisme berdasarkan pada sejarah evolusinya (Mount 2001). Studi filogenetik merupakan metode yang sering digunakan dalam sistematika untuk memahami keanekaragaman makhluk hidup melalui rekonstruksi hubungan
kekerabatan. Studi filogenetik dengan data morfologi memiliki kekurangan yaitu sangat mudah dipengaruhi oleh faktor lingkungan dan rentan terhadap subjektifitas peneliti. Seiring dengan berkembangnya bioinformatika, studi filogenetik dapat dilakukan menggunakan analisis biomolekuler. Data molekuler memiliki beberapa keunggulan, yaitu menyediakan karakter dalam jumlah besar sehingga cenderung banyak digunakan karena lebih akurat.
Analisis biomolekuler yang dilakukan dalam studi filogenetik Zingiber loerzingii menggunakan marka molekuler Internal Transcribed Spacer (ITS). Menurut Odorico dan Miller (1997) bagian ini telah dimanfaatkan untuk menentukan sistematika molekuler pada tingkat spesies. Tujuan penelitian ini adalah untuk mengkaji hubungan kekerabatan tumbuhan Zingiber loerzingii dengan spesies dari famili Zingiberaceae khususnya spesies Zingiber lain menggunakan pendekatan molekuler. Hipotesis pada penelitian ini yaitu analisis biomolekuler gen ITS dapat dilakukan dalam mengkaji filogenetik Zingiber loerzingii. Penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai identitas Zingiber loerzingii yang selama ini masih belum jelas dan dapat memberikan informasi mengenai kekerabatan Zingiber loerzingii dengan spesies lainnya berdasarkan data molekuler sehingga dapat dimanfaatkan untuk studi selanjutnya.
TINJAUAN PUSTAKA
Penerapan Bioinformatika dalam Studi Filogenetik
2
mendeskripsikan keanekaragaman suatu organisme serta merekonstruksi hubungan kekerabatan dengan organisme lainnya (Gravendeel 1998). Sistematika yang cakupannya lebih luas meliputi taksonomi, studi evolusi, dan filogenetik (Stuessy 1989). Analisis sistematika dilakukan melalui konstruksi sejarah evolusi dan hubungan evolusi antara keturunan dengan nenek moyangnya berdasarkan pada kemiripan karakter sebagai dasar dari perbandingan. Jenis analisis yang diketahui dengan baik adalah analisis filogenetika atau disebut kladistik yang berarti klade atau kelompok keturunan dari satu nenek moyang yang sama (Brinkman & Leipe 2001).
Filogenetik merupakan salah satu metode yang paling sering digunakan dalam sistematika untuk memahami keanekaragaman makhluk hidup melalui rekonstruksi hubungan kekerabatan (phylogenetic relationship). Pohon filogenetik merupakan grafik yang digunakan untuk menggambarkan hubungan kekerabatan antartaksa yang terdiri atas sejumlah nodus dan cabang dengan hanya satu cabang yang menghubungkan dua nodus paling berdekatan. Setiap nodus mewakili unit-unit taksonomi dan setiap cabang mewakili hubungan antar unit yang menggambarkan hubungan keturunan dengan leluhur. Pola percabangan yang terbentuk dari suatu pohon filogenetik disebut topologi (Li & Graur 1991).
Analisis filogenetik tidak terlepas dari evolusi biologis. Evolusi adalah proses bertahap, suatu organisme yang memungkinkan spesies sederhana menjadi lebih komplek melalui akumulasi perubahan dari beberapa generasi. Keturunan akan mempunyai beberapa perbedaan dari nenek moyangnya sebab sedang berubah dalam sebuah evolusi (Estabrook 1984). Karakter morfologi telah lama digunakan dalam banyak penelitian filogenetik. Dalam pendekatan filogenetik, sebuah kelompok organisme yang anggotanya memiliki banyak kesamaan karakter atau ciri dianggap memiliki hubungan yang sangat dekat dan diperkirakan diturunkan dari satu nenek moyang. Nenek moyang dan semua keturunannya akan membentuk sebuah kelompok monofiletik (Hidayat & Pancoro 2008).
Filogenetik molekuler mengkombinasikan teknik biologi molekuler dengan statistik untuk merekonstruksi hubungan kekerabatan. Pemikiran dasar penggunaan sekuen DNA dalam studi filogenetik adalah bahwa terjadi perubahan basa nukleotida menurut waktu,
sehingga akan dapat diperkirakan kecepatan evolusi yang terjadi dan akan dapat direkonstruksi hubungan evolusi antara satu kelompok organisme dengan yang lainnya. Sekuen DNA telah menarik perhatian para praktisi taksonomi dunia untuk dijadikan karakter dalam penelitian filogenetik karena beberapa fakta, salah satunya yaitu sekuen DNA menawarkan data yang akurat melalui pengujian homologi yang lebih baik terhadap karakter-karakter yang ada (Baldwin et al. 1995). Dengan pesatnya perkembangan biologi molekuler, seperti polymerase chain reaction (PCR) dan pengurutan basa (sequencing) DNA, penggunaan sekuen DNA dalam penelitian filogenetik telah meningkat pesat dan telah dilakukan pada semua tingkatan taksonomi.
Zingiber loerzingii
Zingiberaceae merupakan famili tumbuhan berbunga yang beberapa diantaranya termasuk ke dalam tanaman obat aromatik. Tanaman ini memiliki pertumbuhan secara horizontal dengan perbungaan yang khas untuk setiap spesiesnya. Famili Zingiberaceae adalah bagian dari ordo Zingiberales, kelas Liliopsida, divisi Magnoliophyta. Dari ke delapan famili yang termasuk ke dalam ordo Zingiberales, famili Zingiberaceae merupakan salah satu famili terbesar yang terdiri atas 50 genus dan 1400 spesies yang tersebar hampir di seluruh dunia khususnya di sepanjang daerah tropik dan subtropik, meliputi tropikal Afrika, Asia, dan Amerika. Pusat keanekaragamannya berada di selatan Asia dan Asia Tenggara (Takano & Okada 2003).
Klasifikasi famili Zingiberaceae ini diusulkan pertama kali pada tahun 1889 oleh Petersen dan disempurnakan menjadi empat subfamili dan empat puak yang didasarkan pada data molekuler (Kress et al. 2002).
3
Penelitian menggunakan data molekuler saat ini dilakukan untuk mengeksplorasi hubungan filogenetik dalam famili Zingiberaceae (Searle & Hedderson 2000; Wood et al. 2000). Penelitian lainnya juga telah dilakukan dalam beberapa genus, yaitu genus Hedychium oleh Wood et al. (2000), genus Alpinia oleh Rangsiruji et al. (2000), genus Roscoea oleh Ngamriabsakul et al. (2000), dan genus Aframomum oleh Harris et al. (2000). Penelitian-penelitian tersebut telah berhasil dalam menjelaskan pola hubungan evolusi untuk beberapa tingkat, namun secara umum jumlah sampel yang dianalisis masih terbatas.
Zingiber merupakan salah satu genus dari famili Zingiberaceae. Nama Zingiber kemungkinan berasal dari bahasa Arab “Zanjabil” yang dalam bahasa sansekerta “Singabera” yang berarti berbentuk seperti tanduk, mengacu pada morfologi rimpang dari anggota genus Zingiber atau famili Zingiberaceae sedangkan dalam bahasa Yunani menjadi “Zingaber” dan dilatinkan menjadi Zingiber. Kata Zingiber sebenarnya mengacu pada jahe yang diperdagangkan, dalam bahasa Melayu dikenal dengan nama “Halia” dan nama ilmiahnya yaitu Zingiber officinale (Larsen et al. 1999).
Genus Zingiber adalah genus yang cukup besar dengan jumlah anggota mencapai 100 spesies (Theilade 1996). Pusat keanekaragaman spesies dari genus tersebut diperkirakan terdapat di Asia Tenggara. Menurut Valeton (1918), keunikan yang dimiliki genus Zingiber terdapat pada karakter bunga. Letak perbungaan Zingiber muncul langsung pada rimpang (rhizoma). Valeton (1918) mengelompokkan genus Zingiber ke dalam empat seksi, yaitu Lampuzia, Inflexa, Cassumunar, dan Fusiforma. Pengelompokkan tersebut dibuat berdasarkan karakter khas pada perbungaan (tipe bulir) dan bunga.
Zingiber loerzingii (Gambar 1) adalah salah satu spesies yang berasal dari famili Zingiberaceae. Zingiber loerzingii merupakan
tumbuhan herba yang memiliki bentuk daun yang panjang dan meruncing. Memiliki beberapa perbungaan pada setiap tanamannya. Perbungaan Zingiber loerzingii sangat khas dengan teksturnya yang berlendir. Zingiber spesies ini, di Indonesia baru ditemukan di daerah Sumatera. Tidak seperti spesies lainnya yang relatif sudah banyak dikaji, spesies ini belum banyak dikaji. Hal ini dikarenakan oleh sangat minimnya informasi dan kajian taksonomi pada spesies ini.
Internal Transcribed Spacer (ITS) rDNA
Deoxyribonucleic acid (DNA) adalah penyimpan utama dari informasi genetik. Informasi genetik ini disalin dan dipindahkan ke molekul RNA, sekuen nukleotida yang mengandung kode untuk sekuen asam amino yang khas. Protein kemudian disintesis dalam suatu proses translasi dari RNA. Pada organisme tinggi seperti manusia, ternak dan tumbuhan DNA biasanya terdapat di dalam inti sel dan beberapa organ lain di dalam sel seperti mitokondria dan kloroplas. Molekul DNA adalah dua rangkaian nukleotida yang tersusun secara linier dan saling berikatan membentuk susunan berpilin (double helix). Satu rangkaian nukleotida merupakan susunan dari banyak nukleotida yang diikat satu sama lain oleh ikatan fosfodiester sedangkan kedua rangkaian nukleotida tersebut direkatkan oleh ikatan hidrogen. Setiap nukleotida disusun oleh tiga komponen, yaitu molekul gula pentosa, gugus fosfat, dan basa nitrogen (Nicholas 1993).
Salah satu studi filogenetik dengan pendekatan molekuler adalah menggunakan karakter DNA dari organisme target. Karakter DNA diketahui lebih konsisten dalam membangun hubungan filogenetik dibandingkan dengan karakter morfologi. Salah satu karakter molekuler yang dapat digunakan adalah genom nuklear. Genom nuklear atau inti yang sering digunakan untuk menyimpulkan suatu filogenetik adalah DNA ribosomal yang disebut rDNA. rDNA adalah daerah genom inti pengkode RNA ribosomal.
4
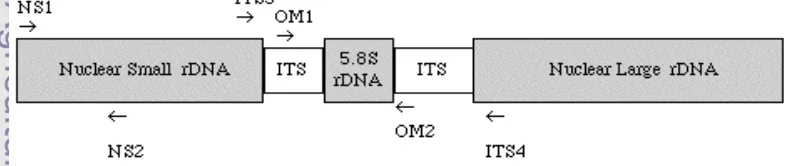
Daerah DNA pengkode yang sangat terkonservasi (18S, 28S rDNA) merupakan daerah evolusi utama yang sering digunakan sebagai pembanding tingkat spesies dan genus terkait. Setiap unit rDNA dalam satu rangkaian kromosom memiliki daerah pengkode yaitu 18S, 5.8S, dan 28S yang mengapit ITS1 dan ITS2 (Soltis & Soltis 1998). Gen 18S rDNA, berikut dua daerah ITS dan gen 5.8S rDNA memiliki panjang total 2600 bp, terpisah dari gen 28S rDNA yang memiliki panjang 3300 bp (McCullough et al. 1998).
Marka molekuler yang dapat digunakan untuk studi taksonomi dan filogenetik pada tingkat spesies untuk Zingiber salah satunya adalah marka molekul ITS (Kress et al. 2002). Menurut Soltis & Soltis (1998) ITS pada daerah 18S-28S rDNA nuklear menjadi fokus utama untuk digunakan pada rekonstruksi filogenetik. Hal ini dikarenakan daerah ITS memiliki tingkat variasi yang tinggi dibandingkan dengan daerah lainnya pada rDNA subunit kecil dan subunit besar. Baldwin et al. (1995) menambahkan, daerah ITS berukuran kecil yaitu kurang lebih 700 pasang basa dan memiliki salinan yang banyak di dalam genom inti. Karakter ini menyebabkan daerah ITS mudah diisolasi, diamplifikasi, dan dianalisis.
Unit rDNA dapat dilihat pada Gambar 2. Pada bagian antara daerah 18S dan daerah 5.8S terdapat beberapa ratus pasang basa DNA yang disebut ITS1 dan di antara daerah 5.8S dengan 28S terdapat daerah ITS2. Daerah ITS mempunyai kelebihan dibandingkan dengan daerah molekuler target lain, diantaranya yaitu memiliki tingkat sensitivitas tinggi karena mempunyai sekitar 100 ulangan dalam genom. Daerah ITS juga memiliki laju evolusi yang tinggi dan terdapat pada semua gen rDNA eukaryot (Jorgensen et al. 1987).
Teknik Isolasi DNA Tumbuhan
Setiap individu memiliki pola DNA yang berbeda sehingga DNA dapat digunakan dalam identifikasi suatu organisme. Pengisolasian DNA dari masing-masing organisme memiliki perbedaan. Untuk tumbuhan, DNA dapat diisolasi melalui daun, batang, buah, dan bagian tanaman lainnya. Secara umum isolasi DNA memiliki beberapa tahapan, yaitu isolasi sel, lisis dinding dan membran sel, ekstraksi dalam larutan, purifikasi, dan presipitasi. Prinsip dasar isolasi DNA dari jaringan adalah dengan memecah dan mengekstraksi jaringan tersebut sehingga
akan terbentuk ekstrak sel yang terdiri atas sel jaringan, DNA, dan RNA yang kemudian dilakukan purifikasi agar didapatkan ekstrak DNA murni (Faatih 2009).
Berbagai teknik atau metode dapat dilakukan untuk mengisolasi DNA tergantung dari jenis tumbuhan, organ tumbuhan, atau jaringan tumbuhan yang digunakan. Untuk setiap sumber DNA tentunya memiliki cara tertentu dalam pengisolasian DNA. Tetapi pada dasarnya ada tiga faktor penentu dalam ekstraksi dan purifikasi DNA secara optimal yaitu penghomogenan jaringan tumbuhan, komposisi penambahan larutan bufer pada saat penggerusan daun atau jaringan tumbuhan sampel, dan penghilangan enzim penghambat polisakarida khususnya untuk tumbuhan tahunan. Pada umumnya, teknik isolasi DNA pada tumbuhan tahunan memerlukan berbagai modifikasi dari teknik standar umumnya, seperti penambahan antioksidan polivinilpolipirolidon (PVPP) dan merkaptoetanol, ataupun penggunaan nitrogen cair untuk membantu menghancurkan jaringan serta penyimpanan lebih lama (over night) sebelum dilakukan purifikasi (Syafaruddin & Santoso 2011).
Terdapat beberapa metode yang dapat digunakan untuk mengisolasi DNA tumbuhan, diantaranya yaitu metode Zheng et al. (1995) yang menggunakan bufer pengekstrak SDS; metode Wang et al. (1993) yang hanya menggunakan larutan NaOH 0.5M untuk tahap lisis sehingga metode tersebut hanya dapat digunakan untuk tanaman tertentu seperti jagung (Zea mays), tembakau (Nicotiana tabacum), gula bit (Beta vulgaris), kanola (Brassica napus), dan kentang (Solanum tuberosum); metode Doyle & Doyle (1987) yang berbasis setiltrimetilamonium bromida (CTAB); metode Porebski et al. (1997) yang tepat digunakan untuk tumbuhan dengan polisakarida yang tinggi; serta masih banyak lagi metode lainnya. Namun tidak semua metode isolasi tersebut cocok untuk semua jenis tumbuhan.
5
pita-pita DNA yang terbentuk pada elektrogram tidak dapat terlihat dengan jelas (smear). Selain itu, keberadaan polisakarida juga akan menghambat aktivitas Taq DNA polimerase pada amplifikasi DNA (Fang & Rosee 1997). Oleh karena itu, diperlukan suatu teknik isolasi DNA tumbuhan yang tepat sehingga diperoleh kualitas DNA yang baik bagi amplifikasi DNA.
Polymerase Chain Reaction (PCR)
Polymerase Chain Reaction (PCR) atau reaksi berantai polimerase adalah suatu metode enzimatis untuk memperbanyak secara komponensial suatu sekuen nukleotida tertentu secara in vitro. Reaksi polimerasi DNA pertama kali dikembangkan pada tahun 1985 oleh Kary Mullis seorang peneliti dari CETUS Corporation (Saiki et al. 1985). PCR dapat melipatgandakan, memperbanyak molekul DNA, memisahkan molekul DNA, dan memisahkan gen-gen (Yuwono 2006).
Teknik PCR merupakan kunci dalam genetik molekuler yang hanya menggunakan sedikit potongan kecil dari DNA (atau RNA) untuk analisis, sehingga memiliki efisiensi yang sangat tinggi dalam menggandakan potongan atau sekuen DNA tertentu dalam jumlah besar (amplifikasi). Keuntungan dari teknik PCR adalah teknik ini lebih baik dari teknik kloning biasa karena tidak perlu pemurnian. Teknik PCR ideal untuk menganalisis campuran DNA kompleks dari jaringan atau cairan biologi (Bintang 2010). Selain itu, teknik PCR bekerja dengan cepat dan dapat dilakukan pada tahap dini dengan teknik isolasi DNA sederhana.
Komponen-komponen yang dibutuhkan dalam reaksi PCR adalah DNA target, primer yang merupakan oligonukleotida pendek yang menempel pada fragmen DNA target, Taq DNA polimerase, bufer PCR, dan deoksiribonukleotidatrifospat (dNTP) yang terdiri atas dATP, dCTP, dGTP, dan dTTP (Mullis 1990). Hal-hal yang mempengaruhi keberhasilan dalam reaksi PCR adalah sekuen primer, dNTP, enzim polimerase, dan suhu annealing (penempelan primer) (Muladno 2002; Graham & Newton 1997). Reaksi PCR membutuhkan suatu bufer yang mengandung MgCl2 karena aktivitas enzim polimerase dipengaruhi oleh konsentrasi ion Mg2+. Magnesium (Mg) dapat meningkatkan aktivitas enzim secara maksimal pada konsentrasi 2 mM, namum pada konsentrasi yang lebih tinggi dapat menghambat aktivitas Taq DNA polimerase (Sambrook & Russell 2001).
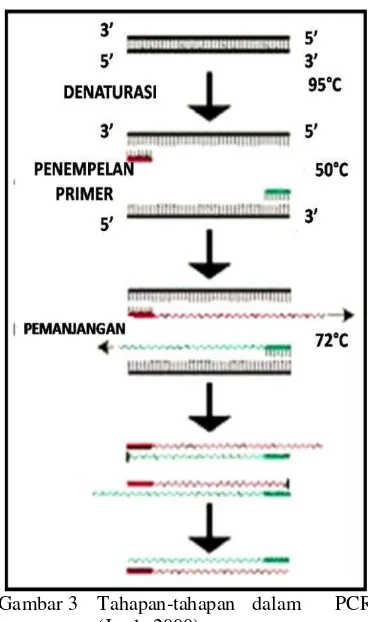
Reaksi PCR secara umum dilakukan dalam empat tahap. Gambar 3 memperlihatkan tahapan dalam proses PCR. Tahap denaturasi merupakan tahap awal reaksi yang berlangsung pada suhu tinggi, yaitu 94–96°C sehingga ikatan hidrogen DNA terputus atau terdenaturasi dan DNA menjadi berutas tunggal. Pemisahan ini menyebabkan DNA tidak stabil dan siap menjadi DNA template bagi primer. Tahap kedua adalah penempelan primer atau annealing. Primer menempel pada bagian DNA template yang komplementer urutan basanya. Hal ini dilakukan pada suhu antara 45–60°C. Penempelan primer ini bersifat spesifik. Tahap ketiga adalah pemanjangan atau elongasi. Suhu untuk proses ini tergantung dari jenis DNA-polimerase yang digunakan. Proses ini biasanya menggunakan Taq DNA polimerase dan dilakukan pada suhu 72°C. Durasi tahap ini biasanya 1 menit. Setelah tahap tiga, siklus diulang kembali mulai dari tahap pertama. Tahap empat menunjukkan perkembangan yang terjadi pada siklus-siklus selanjutnya. Jumlah DNA yang dihasilkan berlimpah karena penambahan terjadi secara eksponensial (Mullis 1990). Banyaknya siklus amplifikasi tergantung pada konsentrasi DNA target di dalam campuran reaksi (Yuwono 2006).
6
Sequencimg DNA
Sequencing merupakan metode untuk menentukan urutan basa DNA suatu organisme. Frederick Sanger, Allan Maxam, dan Walter Gilbert merintis pengembangan metode ini. Metode Maxam-Gilbert dilakukan dengan cara mendegradasi fragmen DNA secara kimiawi sedangkan metode Sanger dilakukan dengan cara mensintesis molekul DNA dan memberhentikan sintesis tersebut pada basa tertentu. Pada dasarnya tiap metode meliputi pembuatan serangkaian benang tunggal berlabel yang panjangnya bervariasi dan dimulai dari salah satu ujung fragmen yang sedang disekuens. Ukuran fragmen yang dapat dibaca pada metode Maxam-Gilbert berkisar 250 basa dan 1000 basa pada metode Sanger. Metode yang umum digunakan saat ini adalah metode Sanger yang bertumpu pada penggunaan analog dari rantai deoksinukleotida tripospat (dNTP) normal yaitu dideoksinukleotida tripospat (ddNTP). Analog ini sama dengan deoksinukleotida tripospat normal tetapi tidak memiliki gugus hidroksil pada ujung 3’-nya. Ujung 5’ molekul ddNTP dapat bereaksi dengan ujung 3’ dNTP normal pada rantai DNA yang disintesis dengan bantuan enzim DNA polimerase. Komponen reaksi sequencing terdiri atas potongan DNA target, primer, campuran dNTP (dATP, dGTP, dCTP, dan dTTP yang salah satunya diberi label radioaktif 32P), dan enzim polimerase (Sanger 1980).
Hasil akhir dari reaksi tersebut adalah sejumlah potongan DNA yang panjangnya bervariasi tetapi semuanya berakhir dengan nukleotida A (jika dNTP dicampur dengan ddATP), berakhir dengan nukleotida C (jika dNTP dicampur dengan ddCTP), berakhir dengan nukleotida G (jika dNTP dicampur dengan ddGTP), dan berakhir dengan nukleotida T (jika dNTP dicampur dengan ddTTP). Untuk mendeskripsikan hasil elektroforesis dari metode ini adalah dengan menggunakan label yang berbeda (deoksinukleotida yang mengandung radioaktif atau label fluoresen pada primer, dNTP atau ddNTP) atau dengan pendekatan staining (silver staining) (Nicholas 1993).
Saat ini sequencing dapat dilakukan menggunakan mesin canggih yang dihubungkan dengan komputer sehingga pembacaan basa DNA tidak menggunakan metode elektroforesis melainkan langsung dideteksi menggunakan bantuan laser dan detektor yang terhubung dengan komputer sehingga kemudian urutan basa DNA akan muncul langsung pada program komputer .
Elektroforesis Fragmen DNA
Elektroforesis adalah suatu teknik pemisahan molekul berdasarkan atas ukurannya menggunakan medan listrik yang dialirkan pada suatu medium yang mengandung sampel yang akan dipisahkan. Teknik ini dapat digunakan dengan memanfaatkan muatan listrik yang terdapat pada makromolekul, misalnya DNA yang bermuatan negatif (Yuwono 2010).
Elektroforesis gel merupakan salah satu teknik utama dalam biologi molekuler. Prinsip dasar teknik ini adalah molekul DNA, RNA, atau protein dapat dipisahkan berdasarkan laju perpindahannya oleh gaya gerak listrik di dalam matriks gel. Laju perpindahan tersebut bergantung pada ukuran molekulnya. Yuwono (2010) menjelaskan bahwa elektroforesis DNA dilakukan misalnya untuk menganalisis fragmen-fragmen DNA hasil pemotongan dengan enzim restriksi. Fragmen molekul DNA yang telah dipotong-potong dapat ditentukan ukurannya.
Pemisahan DNA dapat menggunakan teknik elektroforesis gel agarosa (Wilson & Walker 2000). Agarosa adalah polimer linear dari D-galaktosa dan 3,6-anhidrigalaktosa yang diisolasi dari rumput laut. Gel agarosa mempunyai daya pemisahan lebih rendah dibandingkan dengan gel poliakrilamid, tetapi mempunyai rentan pemisahan lebih besar. DNA dari 200 bp sampai dengan 50 Kb dapat dipisahkan menggunakan gel agarosa dengan berbagai konsentrasi agarosa (Sudjadi 2008).
Menurut Bintang (2010), molekul DNA bermuatan negatif di dalam medan listrik dan molekul DNA bergerak melalui gel pada kecepatan yang berbeda karena tergantung ukurannya. Molekul DNA yang kecil dapat dengan mudah melewati gel sehingga bergerak lebih cepat dibandingkan molekul yang lebih besar. Keuntungan khusus yang diperoleh menggunakan elektroforesis gel adalah pita DNA yang dideteksi dengan kepekaan tinggi. DNA dengan ukuran sampai 0.05 µg dalam suatu pita juga dapat terdeteksi sebagai fluoresensi yang tampak apabila gel disinari cahaya ultraviolet.
BAHAN DAN METODE
Bahan dan Alat
7
bufer tris-EDTA (TE), larutan bufer tris-borat-EDTA (TBE), agarosa, larutan etidium bromida (EtBr), DNA ladder, larutan bufer PCR, enhancer buffer, Taq polimerase, larutan MgCl2, primer ITS5P, primer ITS8P, dNTPs, DNA hasil isolasi, DNA hasil amplifikasi, dan larutan dH2O.
Alat-alat yang digunakan dalam penelitian ini yaitu neraca analitik, shaker, gelas kimia berukuran 250-500 mL, gelas ukur (100-500 mL), labu Erlenmeyer (100 mL dan 250 mL), microwave, vortex, tabung Eppendorf (0.2 mL dan 1.5 mL), pipet mikro, mortar, sudip, penangas air, mesin sentrifus Kubota 6800, lemari pendingin, elektroforesis, inkubator, Takara PCR Thermal Cycle, sentrifus mikro, dan gel-documentation (perangkat dokumentasi gel), dan sequencer.
Metode
Determinasi Zingiber loerzingii
Determinasi sampel dilakukan dengan membandingkan sifat morfologi tumbuhan secara langsung dengan spesimen tipe herbarium dari Zingiber loerzingii yang merupakan koleksi Herbarium Kebun Raya Bogor dengan nomor XI.B.V.86 dan koleksi spesimen basah dengan nomor 5269. Kolektor dari spesimen tersebut adalah Lörzing. Selain itu, dilakukan juga perbandingan sifat morfologi dengan protolog Valeton (1918) mengenai Zingiber loerzingii.
Isolasi DNA Zingiber loerzingii
Sampel yang digunakan pada penelitian yaitu sampel tumbuhan Zingiber loerzingii (ZL2) yang dikoleksi oleh Marlina Ardiyani dari Kebun Raya Bogor dan berasal dari Aceh Tenggara, Sumatera. DNA sampel diisolasi menggunakan metode isolasi DNA modifikasi Doyle & Doyle (1987) yang berbasis CTAB. Isolasi diawali dengan memanaskan 500 µL larutan CTAB pada suhu 60oC selama 15 menit. Sebanyak 20 mg daun, pasir kuarsa, dan PVP digerus hingga halus menggunakan mortar. Bubuk yang terbentuk dimasukkan ke dalam tabung Eppendorf yang berisi CTAB hangat, kemudian ditambahkan dengan larutan 2% merkaptoetanol dan diinkubasi dalam penangas air bersuhu 60oC selama 1 jam. Selanjutnya, larutan sampel disimpan pada suhu ruang selama 15 menit, kemudian disentrifus dengan kecepatan 13000 rpm selama 15 menit.
Supernatan diambil sebanyak 400 µL, kemudian ditambahkan dengan 400 µL larutan kloroform-isoamilalkohol. Sampel yang telah dicampur disentrifus kembali
dengan kecepatan 13000 rpm selama 10 menit. Supernatan diambil sebanyak kurang lebih 250 µL, kemudian ditambahkan dengan 250 µL larutan kloroform-isoamilalkohol dan dihomogenisasi. Selanjutnya, larutan campuran tersebut disentrifus dengan kecepatan 13000 rpm selama 10 menit dan supernatan yang terbentuk diambil sebanyak 200 µL. Supernatan tersebut ditambahkan dengan larutan isopropanol dingin sebanyak 2/3 volume supernatan kemudian dihomogenisasi. Larutan disimpan selama kurang lebih 24 jam pada -20oC. Selanjutnya, larutan sampel disentrifus dengan kecepatan 13000 rpm selama 10 menit. Supernatan dibuang dan pelet diinkubasi selama 1 jam dalam inkubator 37oC. Pelet yang sudah kering ditambahkan dengan TE pH 8.0 sebanyak 30 µL dan dihomogenisasi.
Analisis Kualitatif DNA Zingiber loerzingii
Hasil Isolasi
Analisis kualitatif DNA dilakukan untuk mengetahui kualitas DNA hasil isolasi. Analisis dilakukan dengan menggunakan elektroforesis gel agarosa. Elektroforesis diawali dengan pembuatan gel agarosa. Sebanyak 0.2 gram agarosa ditambah dengan 20 mL TBE 0.5x, lalu dipanaskan hingga larut. Setelah larut dengan sempurna, larutan dibiarkan sampai hangat, kemudian dituang ke dalam cetakan yang dilengkapi dengan sisir dan didiamkan selama 30 menit sampai gel tersebut membeku. Gel kemudian dimasukkan dalam alat elektroforesis dan direndam dengan bufer TBE 0.5x.
8
yang dapat dicetak menggunakan printer khusus yang langsung terhubung.
Amplifikasi DNA Zingiber loerzingii
dengan Teknik PCR
Amplifikasi bertujuan untuk memperbanyak DNA daerah ITS. Amplifikasi pada sampel DNA hasil isolasi menggunakan primer ITS5P (GGA AGG AGA AGT CGT AAC AAG) sebagai primer forward (White et al. 1990) dan ITS8P (CAC GCT TCT CCA GAC TAC A) sebagai primer reverse (Moller et al. 1997). Volume untuk satu reaksi PCR adalah 25µL dengan komposisi larutan yaitu, 2.5 µL 5x bufer, 1.5 µL larutan MgCl2, 1.5 µL primer ITS5P, 1.5 µL primer ITS8P, 0.5 µL dNTP mix, 0.5 µL DNA hasil isolasi sebagai cetakan, 0.2 µL Taq polimerase, dan 16.8 µL dH2O. Selanjutnya, setiap larutan dihomogenisasi hingga tercampur rata.
Amplifikasi DNA dilakukan menggunakan alat PCR thermal cycle. Untuk mengamplifikasi daerah ITS proses PCR dilakukan sebanyak 30 siklus dengan kondisi tiap siklus yaitu 3 menit tahap pradenaturasi pada suhu 94oC, 1 menit tahap denaturasi pada suhu 94oC, 1 menit tahap penempelan primer pada suhu 55oC, 90 detik tahap sintesis pada suhu 72oC, 5 menit tahap pemanjangan berikutnya pada suhu 72oC, dan tahap penyimpanan pada suhu 4oC.
Analisis Kualitatif Hasil Amplifikasi DNA Zingiber loerzingii
Analisis kualitatif bertujuan untuk melihat kualitas dari hasil amplifikasi yang akan digunakan pada proses selanjutnya, yaitu sequencing. Analisis kualitatif menggunakan metode elektroforesis gel agarosa. Konsentrasi gel agarosa yang digunakan yaitu 1% dengan mencampurkan 0.2 g agarosa dan 20 mL larutan TBE 0.5x. Sebelum elektroforesis, 2 μL sampel hasil amplifikasi dicampurkan dengan 1 μL loading dye dan dimasukkan ke dalam sumur elektroforesis. Gel dialiri arus listrik sebesar 100 volt selama 25 menit, kemudian gel hasil elektroforesis tersebut direndam dalam larutan EtBr dan selanjutnya diamati dengan bantuan sinar ultraviolet pada perangkat dokumentasi gel.
Purifikasi dan Sequencing DNA Zingiber
loerzingii
Purifikasi dan sequencing DNA Zingiber loerzingii berguna untuk memperoleh data urutan nukleotida daerah ITS dari sampel Zingiber loerzingii. Purifikasi dan sequencing
pada penelitian ini dilakukan menggunakan jasa perusahaan Biologi Molekuler 1st BASE Singapura. Produk hasil amplifikasi DNA Zingiber loerzingii dijadikan sampel dalam reaksi sequencing.
Analisis Sekuen DNA dan Analisis
Filogenetik Zingiber loerzingii
Data sekuen DNA Zingiber loerzingii pada daerah ITS diolah dengan menggunakan program ChromasPro versi trial untuk mendapatkan urutan nukleotida daerah rDNA. Sekuen sampel kemudian disejajarkan bersama sekuen spesies Zingiberaceae lain yang terdapat pada GenBank berdasarkan marka molekul ITS. Data sekuen yang diambil dari GenBank mengacu kepada penelitian Wood et al. (2000) dan Kress et al. (2002) mengenai Zingiberaceae.
Alignment (penyejajaran) dilakukan menggunakan program Muscle yang terintegrasi pada program MEGA. Selanjutnya, dilakukan proses rekonstruksi pohon filogenetik berdasarkan metode maximum parsimony (Felsentein 1985; Mort et al. 2000) menggunakan program Phylogenetic Analysis Using Parsimony (PAUP) versi 4.0b10 (Swofford 2002). Evaluasi pohon filogenetik dilakukan dengan menggunakan analisis bootstrap sebanyak 1000 ulangan (Swofford 1996). Indeks konsistensi (CI) dan indeks retensi (RI) dihitung dari pohon filogenetik. Pohon filogenetik dilihat menggunakan program TreeView (win32).
HASIL DAN PEMBAHASAN
Hasil Determinasi Zingiber loerzingii
Determinasi yang merupakan proses membandingkan suatu tumbuhan dengan satu tumbuhan lain yang sudah dikenal sebelumnya merupakan langkah awal dalam mengenal tumbuhan yang menjadi fokus dalam penelitian untuk memastikan bahwa tumbuhan tersebut merupakan Zingiber loerzingii. Morfologi yang diamati meliputi bentuk dan ukuran organ tumbuhan tersebut seperti lamina (daun), leafy shoot (teruk berdaun), dan inflorescences (perbungaan).
9
Zingiber loerzingii. Dari hasil determinasi diketahui bahwa Zingiber loerzingii merupakan tumbuhan herba dengan tinggi antara 1.5-2.5 m (Gambar 4A). Daun Zingiber loerzingii berbentuk lanset-bulat panjang (lanceolato-oblonga) dengan ujung daun meruncing dan bagian pangkal agak lancip. Ukuran daun dewasa mencapai 63x15 cm. Daun memiliki petiole (tangkai daun) yang tipis dan berbentuk kanal dengan panjang mencapai 5 cm. Pada bagian teruk berdaun terdapat ligula dengan tekstur membran tipis dan kering dengan berkisar 1-3.5 cm.
Perbungaan Zingiber loerzingii berbentuk bulat-panjang dengan ukuran mencapai 15x12 cm. Bagian perbungaan yang masih muda berwarna putih pucat (Gambar 4C) dan bagian perbungaan yang sudah lebih tua berwarna merah terang agak kuning (coralred yellow). Perbungaan yang sudah tua akan memiliki ukuran yang lebih panjang dibandingkan dengan perbungaan muda. Bractea (daun pelindung) berbentuk seperti perahu runcing dengan ujung lancip dan melengkung ke bawah. Ukuran daun pelindung mencapai 5 cm. Bracteole (anak daun pelindung) berbentuk lebih bulat, dengan ujung lancip,
dan membentuk tabung simetris dengan ukuran berkisar 4x1.6 cm (Gambar 4C).
Bunga Zingiber loerzingii (Gambar 5B) berwarna kuning pucat dengan panjang mencapai 6-7 cm. Labellum (bibir bunga) berwarna jingga kemerahan dan berbentuk sedikit rompang (subtruncatus) dengan tiga gigi pendek yang tidak simetris. Petalum dorsale (daun bunga dorsal) berbentuk lanset dengan ujung lancip dan bertaji (cucullatum), sedangkan petalum laterales (daun bunga lateral) berbentuk bulat, lebih panjang, dan tidak terlalu runcing (obtusa). Calyx (kelopak tambahan) bunga bertekstur tipis dengan panjang berkisar 20 mm. Bunga dilengkapi dengan sepasang anther (kepala sari) yang panjangnya mencapai 15 mm. Appendix (ujung tambahan) kepala sari yang berwarna merah membengkok bersama dengan stylus (tangkai putik) di antara dua kepala sari tersebut. Tangkai putik berbentuk silinder, linear, dan meruncing ke ujung dengan panjang berkisar 5-7 mm. Corolla tube (tabung mahkota) berukuran 40x15 mm. Di dalam tabung mahkota terdapat ovarium yang bertekstur tipis dan berbulu dengan ukuran berkisar 5-10 mm.
Gambar 4 Struktur tumbuhan Zingiber loerzingii: perawakan zingiber loerzingii (A); spesimen tipe Herbarium Kebun Raya Bogor (B); bentuk perbungaan Zingiber loerzingii (C); spesimen perbungaan Zingiber loerzingii (D).
D C
10
Gambar 5 Bunga: sketsa bunga Zingiber loerzingii (A); bunga Zingiber loerzingii (B) (a. daun pelindung; b. anak daun pelindung; c. bibir bunga; d. daun bungadorsal; e. daun bunga lateral; f. kepala sari).
DNA Zingiber loerzingii Hasil Isolasi
Deoxyribonucleic Acid (DNA) merupakan bagian penting yang dibutuhkan dan berpengaruh pada penelitian mengenai analisis biomolekuler dalam studi filogenetik Zingiber loerzingii. Isolasi DNA pada penelitian ini dilakukan menggunakan protokol berbasis CTAB yang merupakan modifikasi metode isolasi DNA Doyle & Doyle (1987). Metode ini dipilih karena prosedurnya sederhana dan waktu pengerjaannya tidak terlalu lama. Selain itu, metode isolasi DNA ini juga dipilih berdasarkan pada pengalaman penelitian sebelumnya mengenai tumbuhan famili Zingiberaceae (Kress et al. 2002; Williams et al. 2004; Kress et al. 2005). Bagian tumbuhan yang digunakan pada isolasi DNA yaitu daun. Organ ini dipilih karena memiliki banyak sel sehingga mengandung banyak DNA. Selain itu daun mudah dihancurkan ketika proses lisis sel. Daun yang digunakan merupakan daun sehat sehingga isolasi DNA dapat dilakukan dengan baik.
Hasil isolasi DNA dianalisis secara kualitatif untuk mengetahui kualitas DNA yang didapat dari sampel Zingiber loerzingii. Analisis kualitatif DNA menggunakan metode elektroforesis gel agarosa 1%. Pada konsentrasi 1% gel dalam bufer yang mengandung air dalam kadar tinggi, struktur seratnya baik, ukuran porinya besar, dan tahan terhadap gesekan sehingga profil pita yang terbentuk untuk setiap ukuran tidak terlalu jauh dan tidak terlalu dekat. Marker yang digunakan pada elektroforesis yaitu DNA ladder dengan ukuran 1000 bp. Secara kualitatif, hasil isolasi DNA sampel Zingiber loerzinggi memiliki profil pita DNA yang baik. Hal ini ditunjukkan oleh intensitas pita
DNA sampel yang nampak jelas dan terang dengan sedikit smear seperti terlihat pada Gambar 6. Adanya pita pada bagian awal migrasi menunjukkan bahwa DNA yang dihasilkan termasuk DNA total. Hal tersebut juga terlihat dari ukuran DNA yang dihasilkan besar yakni lebih dari 3000 bp. Secara umum, DNA total terdiri atas bentuk superkoil, linier, dan sirkular. Variasi bentuk DNA tersebut tidak berpengaruh besar terhadap proses PCR karena komponen tersebut bukan senyawa fenolik atau polisakarida yang mempengaruhi kerja enzim Taq polimerase (Bangun 2002).
Kualitas DNA yang dihasilkan dipengaruhi oleh pengerjaan tiap tahapan isolasi. Tahap lisis yang dilakukan untuk mendapatkan DNA Zingiber loerzingii menggunakan bufer CTAB hangat. Bufer pelisis mengandung EDTA yang akan membentuk kompleks dengan ion logam. Selain itu, bufer pelisis juga mengandung detergen yang melisis membran sel sehingga membentuk kompleks dengan asam nukleat. EDTA merupakan pengkelat yang dapat mengikat Mg2+ karena ion magnesium ini merupakan kofaktor pada sebagian besar enzim nuklease dan bufer diemulsikan dengan fenol-kloroform untuk mendenaturasi protein dan memisahkannya dari DNA. Bufer CTAB dengan kandungan garam yang tinggi dapat memisahkan polisakarida dari dinding sel (Surzycki 2000; Santoso 2005). Setelah penambahan bufer CTAB, terbentuk larutan sangat kental yang menunjukkan tingginya kadar polisakarida. Setelah larutan disentrifus, terbentuk dua bagian yaitu supernatan yang mengandung DNA dan pelet yang mengandung komponen sel selain DNA. Penggunaan bufer CTAB sebagai pengganti nitrogen cair untuk mengisolasi DNA
A B
11
tumbuhan dapat menghasilkan produk DNA dengan kualitas baik yang ditunjukkan oleh terangnya profil pita DNA genom. Pada
isolasi DNA juga terdapat penambahan
antioksidan PVP dan senyawa pereduksi merkaptoetanol yang mencegah oksidasi senyawa fenolik sehingga menghambat aktifitas radikal bebas yang dihasilkan oleh oksidasi fenol terhadap asam nukleat (Wilkins & Smart 1996).
Smear yang terlihat pada elektroferogram memperlihatkan masih adanya senyawa kontaminan dengan jumlah yang tidak terlalu banyak. Keberadan polisakarida dan senyawa metabolit sekunder dalam sel tanaman sering menyulitkan isolasi asam nukleat. Untuk
menghilangkan adanya kontaminan
polisakarida tersebut maka pada isolasi DNA
ditambahkan larutan
kloroform-isoamilalkohol dengan perbandingan 24:1 yang menyebabkan terbentuknya tiga fase setelah disentrifus yaitu fase air pada bagian atas tempat DNA berada, fase tengah tempat protein koagulasi berada, dan fase fenol-kloroform pada bagian bawah (Ausubel et al. 1998). Fase bagian atas yang diambil sebagai larutan DNA sehingga pada hasil akhir, profil pita DNA tampak jelas.
Pada penelitian kali ini tidak dilakukan analisis kuantitatif DNA karena informasi mengenai kualitas DNA yang terlihat baik cukup untuk mengetahui bahwa DNA Zingiber loerzingii yang terisolasi dapat digunakan dalam amplifikasi. Menurut Ausubel et al. (1998), isolasi DNA dengan metode CTAB dapat menghasilkan 100-500 µg DNA per gram panjang jaringan tanaman yang segar dan muda. Panjang DNA minimal 50 kb bila DNA tidak terpotong.
Gambar 6 DNA Zingiber loerzingii (ZL2) hasil isolasi metode modifikasi Doyle & Doyle.
Hasil Amplifikasi DNA Zingiber loerzingii
Amplifikasi DNA Zingiber loerzingii dalam penelitian ini dilakukan dengan metode PCR menggunakan satu pasang primer yaitu ITS5P dan ITS8P. Kedua primer berfungsi untuk membatasi daerah DNA yang akan diamplifikasi. Primer ini merupakan urutan basa penanda untuk daerah genom inti pengkode rDNA. Menurut Mulando (2002) dan Graham (1997), Urutan basa penanda dan kuantitasnya (kandungan penanda dalam setiap reaksi) ini sangat berpengaruh terhadap keberhasilan amplifikasi DNA menggunakan teknik PCR.
Amplifikasi DNA dengan menggunakan primer ITS menghasilkan amplikon berupa pita DNA pada elektroforegram setelah diuji menggunakan metode elektroforesis gel agarosa 1%. Hasil amplifikasi menunjukan profil pita jelas dan tebal untuk sampel Zingiber loerzingii. Dari profil pita sampel dapat diketahui fragmen DNA hasil amplifikasi berukuran sekitar 700 bp, terlihat pada Gambar 7. Hal ini menunjukkan bahwa hasil amplifikasi berasal dari daerah ITS yang menjadi target amplifikasi karena sesuai dengan panjang fragmen yang diharapkan. DNA hasil amplifikasi (amplikon) sampel Zingiber loerzingii dari amplifikasi menggunakan primer ITS yang memiliki kualitas baik untuk digunakan sebagai DNA target dalam sequencing.
Tahapan dalam proses PCR sangat mempengaruhi kualitas amplikon yang dihasilkan. Pada penelitian ini, PCR diawali dengan tahap pradenaturasi dengan suhu 94oC untuk memastikan rantai DNA telah terpisah sempurna menjadi rantai tunggal. Tahap predenaturasi kemudian dilanjutkan dengan 30 siklus yang terdiri atas tahap denaturasi, penempelan primer, dan pemanjangan. Hal tersebut bertujuan untuk memperoleh kualitas produk PCR yang baik. Jumlah siklus yang digunakan masih berada pada kisaran jumlah siklus optimal untuk proses PCR. Menurut Fairbanks dan Andersen (1999), siklus optimal PCR yaitu 25-45 siklus. Tahap denaturasi dilakukan pada suhu 94oC selama 1 menit. Proses ini menyebabkan utas ganda DNA menjadi tidak stabil sehingga terpisah menjadi utas tunggal yang siap menjadi DNA cetakan.
Keberhasilan amplifikasi DNA juga ditentukan oleh kesesuaian kondisi PCR seperti kondisi saat penempelan primer. Tahap penempelan dua primer pada kedua rantai dilakukan pada suhu 55oC. Suhu penempelan primer ditentukan sesuai dengan primer yang
Marker ZL2
12
digunakan. Primer berfungsi sebagai pancingan awal dalam pelipatgandaan segmen DNA. Spesifisitas primer menentukan keberhasilan proses PCR. Spesifisitas merupakan kemampuan primer untuk menempel pada sekuen target. Penempelan primer membutuhkan suhu optimum sesuai dengan primer tersebut. Suhu penempelan primer sangat menentukan amplifikasi karena suhu yang tidak tepat akan menyebabkan primer tidak menempel pada DNA cetakan (Muladno 2002; Graham 1997).
Tahap selanjutnya adalah tahap pemanjangan pada suhu 72oC selama 90 detik. Pada proses ini primer akan memperpanjang urutan basanya dengan memperoleh tambahan basa nukleotida yang terdapat pada dNTP dan kemudian menjadi sepanjang segmen DNA yang dilipatgandakan. Proses ini dibantu oleh adanya enzim DNA polimerase yang bekerja optimum pada suhu tertentu. Tahap pemanjangan juga mempengaruhi keberhasilan amplifikasi. Setelah siklus PCR berakhir, dilakukan penyempurnaan pemanjangan pada suhu 72oC selama 5 menit untuk menjamin semua rantai DNA telah terbentuk. Tahapan PCR dilakukan berulang-ulang sampai jumlah kelipatan segmen terpenuhi. Salah satu keuntungan penggunaan analisis keragaman genetik tanaman dengan menggunakan teknik molekuler yang memanfaatkan teknologi amplifikasi PCR adalah kuantitas DNA yang diperlukan hanya sedikit.
Gambar 7 Profil pita DNA Zingiber loerzingii (ZL2) hasil amplifikasi PCR ITS.
Sekuen DNA Zingiber loerzingii
Purifikasi dan Sequencing DNA sampel dilakukan dengan bantuan salah satu perusahaan penyedia jasa sequencing yaitu 1st BASE di Singapura. Amplikon dipurifikasi dan kemudian digunakan sebagai DNA target pada sequencing. Dalam penelitian ini, untuk mendapatkan sekuen daerah ITS digunakan satu pasang primer yaitu ITS5P (GGA AGG AGA AGT CGT AAC AAG) (White et al. 1990) dan ITS8P (CAC GCT TCT CCA GAC TAC A) (Moller et al. 1997).
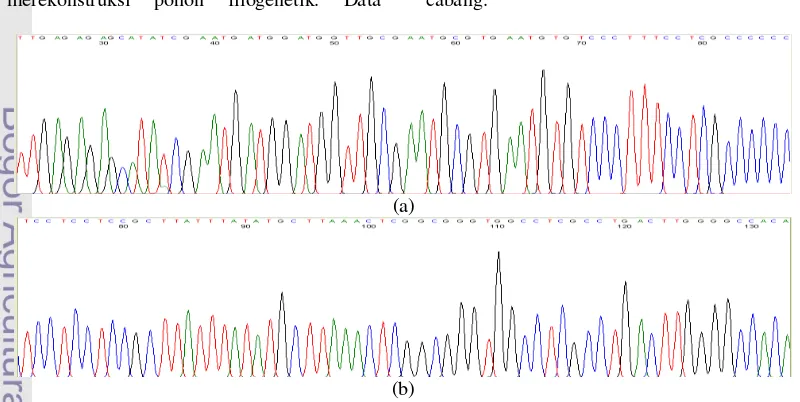
Purifikasi dan sequencing menghasilkan elektroferogram berupa grafik yang mewakili basa nukleotida hasil pembacaan mesin sequencing. Peak (puncak) dari grafik tersebut diterjemahkan menjadi basa-basa nitrogen untuk memudahkan analisis sekuen DNA target. Elektroferogram hasil sequencing sampel Zingiber loerzingii memperlihatkan dua sekuen yaitu sekuen forward yang menggunakan primer ITS5P dan sekuen reverse yang menggunakan primer ITS8P. Puncak dari grafik yang dihasilkan pada kedua sekuen memiliki kualitas yang cukup baik, hanya pada beberapa bagian saja puncak grafik bertumpukan dan memiliki pemisahan yang kurang jelas namun untuk keseluruhan sekuen masih dapat terbaca dengan baik. Gambar 8 menunjukkan elektroferogram hasil sequencing. Untuk lebih mengakuratkan hasil pembacaan basa, setiap puncak diperiksa kembali secara manual.
Sekuen forward dan sekuen reverse dari sampel Zingiber loerzingii kemudian disatukan untuk mendapatkan sekuen lengkap daerah rDNA. Contig (penyatuan) sekuen dilakukan dengan bantuan software ChromasPro versi trial untuk mencari daerah overlapping dari kedua sekuen sehingga dapat menghasilkan sekuen satu unit rDNA dengan ukuran sekuen yaitu 813 bp (Gambar 9). Langkah penyatuan sekuen diawali dengan memotong bagian ujung setiap sekuen yang memiliki kualitas puncak yang kurang bagus, baik pada sekuen forward maupun sekuen reverse dari sampel. Untuk menyatukan kedua sekuen agar didapat satu unit sekuen utuh dilakukan beberapa modifikasi terhadap sekuen tersebut, seperti dilakukannya reverse, complement, atau reverse-complement pada salah satu sekuen. Terkadang, terjadi ketidakcocokan beberapa basa antara sekuen forward dan sekuen reverse. Basa yang tidak cocok tersebut diganti secara manual dengan melihat kualitas puncak terbaik pada salah satu sekuen. Amplikon 3000 bp 2500 bp 2000 bp 1500 bp 1000 bp 900 bp 800 bp 700 bp 600 bp 500 bp 400 bp 300 bp 200 bp 100 bp
13
Analisis Filogenetik Berdasarkan Gen ITS
Langkah awal yang dilakukan dalam melakukan analisis filogenetik adalah menyejajarkan sekuen DNA ITS sampel Zingiber loerzingii bersama dengan sekuen dari spesies Zingiberaceae lain yang diambil dari database GenBank. Data sekuen dari GenBank tersebut mengacu kepada penelitian Wood et al. (2000) dan Kress et al. (2002) mengenai Zingiberaceae.
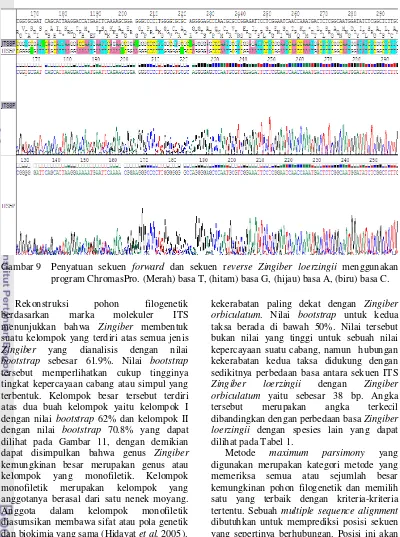
Alignment (penyejajaran) dilakukan menggunakan program Muscle yang terintegrasi di program MEGA. Jumlah sekuen yang dianalisis yaitu 43 sekuen yang terdiri atas 1 sekuen sampel Zingiber loerzingii 31 sekuen spesies Zingiber beserta 11 spesies dari genus lain (Lampiran 4). Daerah DNA yang diperbandingkan yaitu mulai dari daerah ITS1, daerah 5.8S, dan daerah ITS2. Penyejajaran dilakukan dengan tujuan untuk menentukan tingkat homologi dari urutan basa DNA sampel yang dianalisis. Hasil penyejajaran menunjukkan tingkat homologi yang tinggi diantara sampel yang diamati. Pada hasil penyejajaran muncul gap (ditandai oleh garis putus-putus) yang disebabkan oleh sifat dari daerah ITS1 dan ITS2 yang variatif. Gap menunjukkan terjadinya proses mutasi baik berupa delesi maupun insersi (Gambar 10). Dari hasil penyejajaran juga terlihat bahwa daerah ITS merupakan daerah dengan evolusi cepat, diperlihatkan oleh banyaknya perbedaan basa di daerah tertentu pada sekuen antara masing-masing spesies.
Selanjutnya hasil penyejajaran sekuen DNA ITS dianalisis menggunakan program PAUP 4.b10 (Swofford 2002) untuk merekonstruksi pohon filogenetik. Data
dianalisis menggunakan metode maximum parsimony (Felsensein 1985; Mort et al. 2000). Pohon filogenetik yang telah direkonstruksi diuji secara statistik untuk meningkatkan nilai kepercayaan. Pada penelitian kali ini, pohon filogenetik diuji secara statistik menggunakan metode bootstrap sebanyak 1000 ulangan (Swofford 1996). Panjang karakter yang dianalisis yaitu 837 dengan 471 karakter konstan, 156 karakter bersifat tidak informatif, dan 210 karakter bersifat informatif.
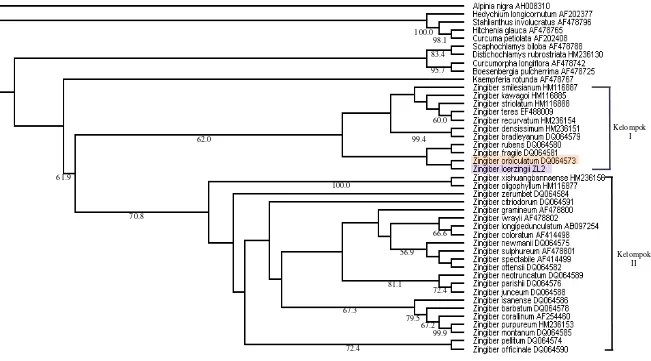
Rekonstruksi pohon filogenetik dilakukan dengan menempatkan salah satu spesies Alpinia yaitu Alpinia nigra sebagai outgroup. Penambahan outgroup dilakukan guna mendapatkan informasi yang meyakinkan dari sekuen yang berhubungan. Outgroup ini sangat dibutuhkan untuk menghasilkan polarisasi karakter atau ciri, yaitu karakter apomorfik dan plesiomorfik. Karakter apomorfik adalah karakter yang berubah dan diturunkan pada ingroup sedangkan karakter plesiomorfik merupakan karakter primitif yang terdapat pada outgroup (Hidayat & Pancoro 2008). Dari hasil analisis berdasarkan kriteria parsimony diperoleh 92 pohon filogenetik dengan nilai indeks konsistensi (CI) sebesar 0.601 dan indeks retensi (RI) sebesar 0.652. Nilai CI dan RI menunjukkan konsistensi dan resolusi yang cukup tinggi dari pohon yang dihasilkan (Swofford 1998). Gambar 11 merupakan pohon konsesus dari 92 pohon filogenetik yang terbentuk. Angka yang terdapat di bawah setiap cabang pohon filogenetik memperlihatkan nilai bootstrap. Nilai tersebut merupakan nilai kepercayaan suatu cabang.
(a)
(b)
14
Gambar 9 Penyatuan sekuen forward dan sekuen reverse Zingiber loerzingii menggunakan program ChromasPro. (Merah) basa T, (hitam) basa G, (hijau) basa A, (biru) basa C.
Rekonstruksi pohon filogenetik berdasarkan marka molekuler ITS menunjukkan bahwa Zingiber membentuk suatu kelompok yang terdiri atas semua jenis Zingiber yang dianalisis dengan nilai bootstrap sebesar 61.9%. Nilai bootstrap tersebut memperlihatkan cukup tingginya tingkat kepercayaan cabang atau simpul yang terbentuk. Kelompok besar tersebut terdiri atas dua buah kelompok yaitu kelompok I dengan nilai bootstrap 62% dan kelompok II dengan nilai bootstrap 70.8% yang dapat dilihat pada Gambar 11, dengan demikian dapat disimpulkan bahwa genus Zingiber kemungkinan besar merupakan genus atau kelompok yang monofiletik. Kelompok monofiletik merupakan kelompok yang anggotanya berasal dari satu nenek moyang. Anggota dalam kelompok monofiletik diasumsikan membawa sifat atau pola genetik dan biokimia yang sama (Hidayat et al. 2005). Pohon filogenetik juga memperlihatkan hubungan kekerabatan pada masing-masing spesies. Zingiber loerzingii yang merupakan fokus bahasan dalam penelitian ini disokong cukup kuat dengan nilai bootstrap sebesar 62.0% sebagai bagian dari kelompok I Zingiber dengan sister taxa yaitu Zingiber orbiculatum, Zingiber rubens, dan Zingiber fragile. Sister taxa merupakan spesies yang sangat erat kekerabatannya. Selain itu, dari rekonstruksi pohon filogenetik terlihat bahwa Zingiber loerzingii memiliki hubungan
kekerabatan paling dekat dengan Zingiber orbiculatum. Nilai bootstrap untuk kedua taksa berada di bawah 50%. Nilai tersebut bukan nilai yang tinggi untuk sebuah nilai kepercayaan suatu cabang, namun hubungan kekerabatan kedua taksa didukung dengan sedikitnya perbedaan basa antara sekuen ITS Zingiber loerzingii dengan Zingiber orbiculatum yaitu sebesar 38 bp. Angka tersebut merupakan angka terkecil dibandingkan dengan perbedaan basa Zingiber loerzingii dengan spesies lain yang dapat dilihat pada Tabel 1.
15
Gambar 10 Hasil penyejajaran sekuen ITS sampel Zingiber loerzingii dan sampel lain dari data GenBank. (Merah) basa T, (ungu) basa G, (hijau) basa A, (biru) basa C.
Metode maximum parsimony berguna untuk sekuen yang mirip dan dalam jumlah yang sedikit. Alogaritma yang digunakan tidak rumit tetapi dijamin untuk dapat menemukan pohon filogenetik yang terbaik, sebab semua kemungkinan pohon filogenetik yang dibentuk berhubungan dengan kelompok sekuen yang diperiksa (Dharmayanti 2011). Pengujian statistik pohon filogenetik pada penelitian kali ini menggunakan metode bootstrap yaitu metode pengacakan ulang karakter-karakter menjadi set data baru
dengan jumlah karakter yang sama seperti set data awal dan selanjutnya dilakukan rekonstruksi pohon filogenetik baru. Penggunaan metode bootstrap dalam menentukan tingkat kepercayaan pohon berdasarkan kenyataan bahwa distribusi karakter dalam data sangat dipengaruhi oleh efek acak sehingga semakin besar nilai bootstrap yang digunakan maka semakin tinggi tingkat kepercayaan topologi pohon hasil rekonstruksi tersebut (Ubaidillah & Sutrisno 2009).
Tabel 1 Perbedaan basa pada daerah ITS1, 5.8S, dan daerah ITS2 beberapa spesies Zingiber.
Zingiber
loerzingii
Zingiber
fragile
Zingiber
rubens
Zingiber
officinale
Zingiber
orbiculatum,
Zingiber loerzingii - - - - -
Zingiber fragile 52 bp - - - -
Zingiber rubens 49 bp 23 bp - - -
Zingiber officinale 141 bp 138 bp 116 bp - -
16
Gambar 11 Pohon filogenetik Zingiber loerzingii dengan kerabatnya berdasarkan sekuen daerah ITS.
56.9
72.4
99.9 67.2 79.5 67.3
72.4 81.1
66.6 61.9
62.0
70.8
100.0 98.1 83.4
100.0
95.7
60.0
99.4
16
Kelompok I
17
SIMPULAN DAN SARAN
Simpulan
Zingiber loerzingii termasuk ke dalam genus Zingiber. Analisis biomolekuler gen ITS mampu mengungkapkan hubungan kekerabatan (filogenetik) Zingiber loerzingii. Berdasarkan hasil analisis diketahui bahwa genus Zingiber kemungkinan besar merupakan genus yang monofiletik. Pohon filogenetik menunjukkan Zingiber loerzingii bersarang dalam kelompok Zingiber dengan bootstrap 62.0%. Rekonstruksi pohon filogenetik juga memperlihatkan Zingiber loerzingii memiliki hubungan kekerabatan yang dekat dengan Zingiber orbiculatum.
Saran
Saran yang dapat diberikan yaitu menambah penggunaan marka molekul untuk analisis filogenetik Zingiber loerzingii berbasis molekuler dalam penelitian selanjutnya agar hubungan kekerabatan Zingiber loerzingii dengan spesies lainnya dapat dikaji lebih mendalam. Selain itu, perlu dilakukan penelitian untuk mendapatkan sekuen DNA gen tertentu dari Zingiber loerzingii guna menambah data sekuen pada bank data.
DAFTAR PUSTAKA
Ausubel FM et al. 1998. Current Protocols Molecular Biology. USA: John Willey and Son.
Baldwin BG et al. 1995. The ITS region of nuclear ribosomal DNA: A valuable sources of evidence on Angiospermae phylogeny. Ann.Missouri Bot. Gard 247-277.
Bangun SII. 2002. Analisis Genotipe Normal dan Abnormal pada Klon Kelapa Sawit (Elaeis gueineensis Jacq.) dengan RAPD. [tesis]. Bogor: Sekolah Pasca Sarjana, Institut Pertanian Bogor.
Bintang M. 2010. Teknik Penelitian Biokimia. Jakarta: Penerbit Erlangga.
Brinkman F, Leipe D. 2001. Phylogenetic Analysis. Di dalam: Baxevanis AD, Ouellette BFF, Editor. Bioinformatics: A Practical Guide to the Analisys of Gene and Protein. John Willey & Sons. pp.
Dharmayanti NLPI. 2011. Filogenetika molekuler: Metode taksonomi organisme
berdasarkan sejarah evolusi. [Makalah]. Bogor: Balai Besar Penelitian Veteriner.
Doyle JJ, Doyle JL. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin 19: 11-15.
Estrabrook G. 1984. Phylogenetic trees and character state trees. Di dalam: Duncan T and T Stuessy, editor. Perspectives on the Reconstruction Evolutionary History Cladistics. Columbia University Press.
Faatih M. 2009. Isolasi dan digesti DNA kromosom. Jurnal Penelitian Sains & Teknologi 10: 61-67.
Fairbank DJ, Andersen WR. 1999. Genetics: The continuity of life. London International Thomsom Publishing Company: 277-282.
Fang DQ, Roose ML. 1997. Identification of closely related Citrus cultivars with Inter Simple Sequence Repeats Markers. Theoredical Genetics 95:408-417.
Felsenstein J. 1985. Confidence intervals on phylogenies: An approach using the bootstrap. Evolution 39: 783-791.
Graham A, Newton CR. 1997. PCR (Polimerase Chain Reaction). Ed Ke-2. New York: Springer Verlag.
Gravendeel B. 1998. Phylogeny of Coelogyne Lindl. (Orchidaceae) based on morphology and cpDNA RFLP data. Acta Bot. Neerl. 47: 23-264.
Harris DJ, Poulsen AD, Frimodt-Moller C, Preston J, Cronk QCB. 2000. Rapid radiation in Aframomum (Zingiberaceae): evidence from nuclear ribosomal DNA internal transcribed spacer (ITS) sequences. Edinburgh Journal of Botany 57: 377–395.
Hidayat T, Yukawa T, Ito M. 2005. Molecular phylogenetics of subtribe Aeridinae (Orchidaceae): Insights from plastid matK and nuclear ribosomal ITS sequences. J Plant Res. 18:271-284.
Hidayat T, Pancoro A. 2008. Kajian filogenetika molekuler dan peranannya dalam menyediakan informasi dasar untuk meningkatkan kualitas sumber genetik anggrek. Jurnal AgroBiogen 4: 35-40.
18
Jorgensen RA, Cueller RE, Thomson WF, Kavanagh TA. 1987. Structure and variation in ribosomal RNA gene of Pea. Plant Mol. Biol. 8:3-12.
Kress WJ, Prince LM, Williams KJ. 2002. The phylogeny and a new classification of ginger (Zingiberaceae): Evidence from molecular data. American Journal of Botany 89: 1682-1696.
Kress WJ, Liu AZ, Newman M, Li QJ. 2005. The Molecular Phylogeny of Alpinia (Zingiberaceae): A complex and polyphyletic genus of gingers. American Journal of Botany 92: 167-178.
Larsen K, Ibrahim H, Khaw SH, Saw LG. 1999. Ginger of Peninsular, Malaysia, and Singapore. Natural History Publication (Borneo), Kota Kinabalu, Malaysia.
Li W, Graur D. 1991. Fundamental of Molecular