PERKEMBANGAN EMBRIO SAPI SETELAH FERTILISASI
MENGGUNAKAN METODE INTRACYTOPLASMIC SPERM
INJECTION (ICSI) DAN AKTIVASI DENGAN STRONTIUM
MUHAMMAD GUNAWAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis Perkembangan Embrio Sapi setelah Fertilisasi Menggunakan Metode Intracytoplasmic Sperm Injection (ICSI) dan Aktivasi dengan Strontium adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2013
Muhammad Gunawan
RINGKASAN
MUHAMMAD GUNAWAN. Perkembangan Embrio Sapi setelah Fertilisasi Menggunakan Metode Intracytoplasmic Sperm Injection (ICSI) dan Aktivasi dengan Strontium. Dibimbing oleh MOKHAMAD FAHRUDIN dan ARIEF BOEDIONO.
Intracytoplasmic Sperm Injection (ICSI) merupakan metode fertilisasi berbantuan dengan menginjeksikan spermatozoa tunggal langsung kedalam sitoplasma oosit. Perlakuan mekanik pada ICSI dapat menyebabkan kurang optimalnya spermatozoa dalam melakukan aktivasi pada oosit. Aktivasi buatan setelah ICSI dengan menggunakan strontium bertujuan untuk meningkatkan perkembangan embrio sapi secara in vitro.
Penelitian pertama dilakukan untuk mengetahui perkembangan embrio partenogenetik hasil aktivasi dengan perbedaan konsentrasi strontium yang dikultur selama 6 jam. Perkembangan embrio partenogenetik yang tertinggi pada konsentrasi 20 mM dengan memperoleh embrio 2 sel (23,08%) dan blastosis (3,08%).
Penelitian kedua dilakukan untuk mengetahui pengaruh kombinasi ICSI dan aktivasi dengan strontium untuk mengetahui perkembangan pronukleus. Kombinasi ICSI dan strontium 20 mM meningkatkan perkembangan pronukleus 2-PN mencapai 43,59%.
Penelitian ketiga untuk mengetahui hasil perkembangan embrio sampai tahap blastosis. Hasil perkembangan embrio pada perlakuan kombinasi ICSI dan strontium 20 mM mencapai tingkat perkembangan 2-4 sel (50,5%), 8-16 sel (43,73%) dan blastosis (15,63%).
Kesimpulan dari hasil penelitian ini adalah kombinasi ICSI dengan aktivasi strontium 20 mM, mampu menghasilkan perkembangan in vitro embrio sapi yang lebih baik.
SUMMARY
MUHAMMAD GUNAWAN. The Development of Bovine Embryo after Fertilization by Intracytoplasmic Sperm Injection (ICSI) Method and Strontium Activation. Supervised by MOKHAMAD FAHRUDIN and ARIEF BOEDIONO.
Intracytoplasmic Sperm Injection (ICSI) is an in vitro fertilization method by injecting single sperm into oocyte cytoplasmic. The mechanic treatment on ICSI causes the sperm less optimal in oocytes activation. The oocyte activation after ICSI using strontium has a purpose to improve in vitro development of bovine embryo.
The first experiment was conducted to find out the development of parthenogenetic embryo result using different strontium concentration for 6 hours. The second experiment was conducted to find out the influence of combination ICSI and strontium activation in order to find out pronucleous development. Combination ICSI and 20 mM of strontium increased development to pronucleous stage 2-PN up to 43,59%.
The third experiment is to evaluate the in vitro development of embryo after ICSI followed by strontium activation. The development of embryo after ICSI treatment and 20 mM strontium up to 2-4 cells was 50,5%, 8-16 cells was 43,73%, and blastosyst was 15,63%.
The conclusion of the experiments is the fertilization by ICSI method followed by activation using strontium 20 mM gives better results of bovine in vitro embryo development.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Anatomi dan Perkembangan Hewan
PERKEMBANGAN EMBRIO SAPI SETELAH FERTILISASI
MENGGUNAKAN METODE INTRACYTOPLASMIC SPERM
INJECTION (ICSI) DAN AKTIVASI DENGAN STRONTIUM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Perkembangan Embrio Sapi setelah Fertilisasi Menggunakan Metode Intracytoplasmic Sperm Injection (ICSI) dan Aktivasi dengan Strontium
Nama : Muhammad Gunawan NIM : B152090031
Disetujui oleh Komisi Pembimbing
drh Mokhamad Fahrudin, Ph.D Ketua
Prof drh Arief Boediono, Ph.D, PAVet(K) Anggota
Diketahui oleh
Ketua Program Studi
Anatomi dan Perkembangan Hewan
Dr drh Ita Djuwita, M.Phil
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2011 ini ialah “Perkembangan Embrio Sapi setelah Fertilisasi Menggunakan Metode
Intracytoplasmic Sperm Injection (ICSI) dan Aktivasi dengan Strontium”.
Terima kasih penulis ucapkan kepada Ibu Dr. drh. Ita Djuwita MPhil, selaku ketua program studi Anatomi dan Perkembangan Hewan, Bapak Dr drh Mokhamad Fahrudin dan Bapak Prof Dr drh Arief Boediono selaku pembimbing, serta drh Ni Wayan Kurniani Karja, MP. Ph.D selaku penguji, yang telah memberikan arahan, masukan dan bimbingan selama penulis melaksanakan penelitian dan penulisan tesis. Penghargaan penulis sampaikan kepada Bapak Dr Ir Witjaksono, M.Sc selaku Kepala Pusat Penelitian Bioteknologi-LIPI, Bapak Prof Dr Bambang Prasetya (Kapuslit Bioteknologi periode 2005 – 2011), Ibu Dr Puspita Lisdiyanti selaku Kepala Bidang Biologi Sel dan Jaringan Puslit Bioteknologi-LIPI, dan Bapak Prof Dr Ir Baharuddin Tappa selaku Kepala Laboratorium Biologi Sel dan Jaringan Hewan, atas dukungan, ijin, sarana dan prasarana, serta kebijaksanaannya selama penulis menempuh pendidikan pascasarjana IPB. Terima kasih kepada rekan-rekan di Puslit Bioteknologi-LIPI, atas partisipasinya baik langsung maupun tidak, terutama rekan-rekan yang tergabung dalam kelompok penelitian Hewan: Dra. Ekayanti M. Kaiin, M.Si, Dr. Ir. Syahrudin Said, Fifi Afiati, M.Si, Nova Dilla Yanthi, M.Si, drh. Nina Herlina, Edi Sophian, S.Pt, Tulus Maulana S.Pt, atas bantuan dan dukungannya sejak mulai penelitian sampai proses penyelesaian tesis ini. Terima kasih kepada seluruh staf Pengajar dan Tata Usaha program studi Anatomi Perkembangan Hewan (APH) serta rekan-rekan APH angkatan 2009 Devi dan Yeni, atas kerjasama yang baik selama penulis menempuh pendidikan pascasarjana IPB. Terakhir penulis sampaikan terima kasih yang tulus kepada Istri dan anakku, Listiyaning Handayani dan Fadhil Al Khairiy, atas kesabaran dan pengertiannya selama ini. Serta kepada Mas Tri Suryono, Mas Yoga dan Mas Yoyok atas dukungannya selama penulis menempuh pendidikan pascasarjana IPB.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2013
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Maturasi Oosit In Vitro 3
Spermatozoa 4
Intracytoplasmic Sperm Injection (ICSI) 5
Fertilisasi dan Aktivasi Oosit 6
3 METODE 8
Tempat dan Waktu Penelitian 8
Metode Penelitian 8
Rancangan Percobaan 11
4 HASIL DAN PEMBAHASAN 12
Perkembangan Embrio Parthenogenetik 12
Perkembangan Pronukleus setelah ICSI dan Aktivasi dengan Strontium 13 Perkembangan Embrio setelah ICSI dan Aktivasi dengan Strontium 16
5 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 18
LAMPIRAN 23
DAFTAR TABEL
1 Perkembangan embrio partenogenetik hasil aktivasi dengan strontium 12 2 Perkembangan pronukleus hasil ICSI dan aktivasi dengan strontium 13 3 Perkembangan embrio sapi setelah ICSI dan aktivasi dengan
strontium 16
DAFTAR GAMBAR
1 Mekanisme aktivasi oosit oleh spermatozoa dalam mekanisme fertilisasi (Alberio et al. 2001; dengan modifikasi) 6 2 Perkembangan pronukleus setelah ICSI dan aktivasi yang diamati
dengan mikroskop fluoresen dan pewarnaan Hoecsht 33342. (A) oosit berkembang 1-PN, (B) oosit berkembang 2-PN. Bar = 20 µm 14 3 Proses ICSI. (A) Aspirasi spermatozoa, (B) Proses ICSI dan oosit
dengan badan kutub I. Bar = 40 µm 14
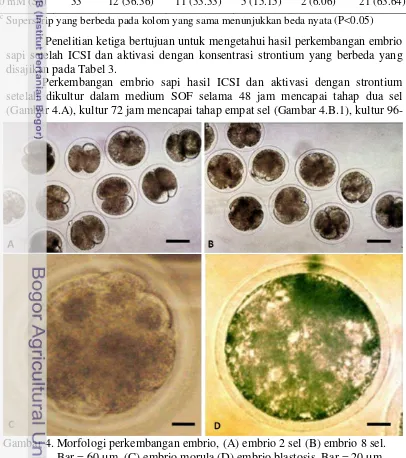
4 Morfologi perkembangan embrio, (A) embrio 2 sel (B) embrio 8 sel. Bar = 60 µm. (C) embrio morula (D) embrio blastosis. Bar = 20 µm. 16
DAFTAR LAMPIRAN
1 Medium koleksi oosit sapi 24
2 Medium maturasi 25
3 Medium BO 27
4 Medium kultur Syntetic Oviduk Fluid (SOF) 28
1
PENDAHULUAN
Latar Belakang
Bioteknologi embrio telah berkembang dalam produksi embrio in vitro
(PEIV) sebagai salah satu teknologi reproduksi berbantuan (Assisted Reproductive Technology, ART). Penggunaan teknologi reproduksi berbantuan pada hewan ternak, satwa langka dan manusia telah berlangsung dalam waktu yang lama, seperti penggunaan teknik Inseminasi Buatan (IB), Fertilisasi In Vitro (FIV) dan teknologi Intracytoplasmic Sperm Injection (ICSI). Aplikasi teknologi reproduksi berbantuan dapat digunakan untuk upaya peningkatan kualitas genetik ternak dan membantu mengatasi masalah yang berkaitan dengan keinginan untuk mempunyai keturunan.
Teknologi reproduksi berbantuan yang telah banyak diterapkan pada hewan percobaan dan manusia adalah fertilisasi mikro dengan cara ICSI, pada metode tersebut spermatozoa secara mekanik dimasukkan secara langsung ke dalam sitoplasma sel telur dengan bantuan mikromanipulator (Boediono 2001). Walaupun teknik ICSI dianggap sederhana, tetapi dalam aplikasinya melibatkan berbagai macam persoalan termasuk masalah peralatan dan kemampuan teknik operator sehingga akan mempengaruhi tingkat keberhasilan ICSI. Keberhasilan fertilisasi dengan metode ICSI untuk memproduksi embrio sampai kelahiran anak telah dilaporkan pada kelinci (Iritani dan Hoshi 1989), sapi (Goto et al. 1990) dan manusia (Palermo et al.1992).
2
2005). Meo et al. (2005) menggunakan strontium sebagai aktivasi tunggal pada oosit sapi untuk tujuan parthenogenesis dengan diperoleh embrio sampai tahap blastosis. Melihat potensi pemanfaatan teknologi reproduksi berbantuan yaitu metode ICSI dalam mengatasi hambatan dalam fertilisasi dan metode aktivasi dalam perbaikan tingkat perkembangan embrio, maka penelitian ini ditujukan untuk mengetahui perkembangan embrio sapi setelah fertilisasi menggunakan metode ICSI dan aktivasi dengan konsentrasi strontium yang berbeda.
Perumusan Masalah
Produksi embrio in vitro (PEIV) telah berkembang dengan teknologi reproduksi berbantuan menggunakan metode intracytoplasmic sperm injection
(ICSI). Metode ini mampu memasukkan spermatozoa ke dalam sitoplasma oosit yang telah matang secara mekanik dengan bantuan mikromanipulator. Mekanisme perkembangan oosit setelah fertilisasi dipengaruh oleh proses aktivasi oosit. Proses aktivasi oosit dapat berlangsung secara alami dan buatan. Aktivasi secara alami disebabkan dari spermatozoa dan faktor internal dari oosit sendiri. Pada kondisi in vitro aktivasi oosit dapat mengalami gangguan dan tidak normal, sehingga diperlukan aktivasi bantuan yang dapat dilakukan secara kimiawi dengan menambahkan strontium klorida. Berdasarkan pada beberapa hal tersebut, perlu dilakukan pengamatan perkembangan embrio sapi setelah fertilisasi menggunakan metode intracytoplasmic sperm injection (ICSI), dan dilanjutkan dengan aktivasi menggunakan strontium klorida.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui perkembangan embrio sapi setelah fertilisasi menggunakan metode Intracytoplasmic Sperm Injection (ICSI) dan aktivasi dengan strontium klorida.
Manfaat Penelitian
Hasil penelitian ini diharapkan akan bermanfaat untuk:
1. Memperoleh informasi tingkat perkembangan embrio sapi hasil fertilisasi menggunakan metode Intracytoplasmic Sperm Injection (ICSI)
2. Memperoleh informasi tingkat konsentrasi strontium klorida yang optimum untuk aktivasi setelah ICSI pada sapi.
3
2
TINJAUAN PUSTAKA
Maturasi Oosit In Vitro
Maturasi oosit hewan mamalia secara umum mengalami dua hal yaitu pematangan inti dan pematangan sitoplasma untuk dapat mengalami proses fertilisasi dan perkembangan embrio. Pematangan inti meliputi berbagai perubahan kronologis tahapan meiosis sedangkan pematangan sitoplasma merupakan penambahan kompetensi biologis oosit yang meliputi berbagai perubahan struktur dan biokimia di dalam sel yang memungkinkan oosit untuk mengekspresikan potensi perkembangannya setelah fertilisasi dan mampu mendukung pembentukan dan perkembangan embrio preimplantasi (Gordon 2003), ditandai dengan sejumlah kriteria termasuk organisasi sitoskeletal dari oosit seperti migrasi kortikal granula ke oolemma, peningkatan mitokondria dan lipid droplet, akan menyebabkan perubahan susunan aparatus golgi dan keberadaan reticulum endoplasmik granular, aktivitas maturation promoting factor (MPF) dan metabolism oosit (Rahman et al. 2008). Kriteria lain yang juga sering digunakan sebagai indikator pematangan adalah pematangan sel-sel kumulus yang dinilai berdasarkan ekspansi sel-sel kumulus. Kriteria ini sering digunakan karena adanya indikasi yang kuat antara dinamika ekspansi sel-sel kumulus pada oosit dari hewan tertentu dengan morfologi yang normal, kemampuan untuk difertilisasi dan kemampuan perkembangan oosit setelah difertilisasi (Setiadi 2001).
Morfologi sel kumulus yang mengelilingi oosit umumnya digunakan sebagai kriteria utama seleksi untuk maturasi in vitro (Lonergan et al. 1994) dan tingkat dari ekspansi sel kumulus dapat digunakan sebagai salah satu indikator morfologi dari kualitas oosit (Veeck 1988). Sel-sel kumulus pada oosit sapi mulai ekspansi setelah 12 jam maturasi in vitro ketika oosit pada tahap metaphase I (M-I). Ekspansi sel kumulus sedikit demi sedikit meningkat hingga 18 jam inkubasi dan tetap bertahan setelahnya (Syamsuddin et al. 1993).
Proses pematangan inti oosit berhubungan dengan aktivitas sintesis RNA, ditandai dengan perubahan inti dari fase diploten ke metaphase II. Membran inti akan mengadakan penyatuan dengan vesikel membentuk germinal vesicle (GV) dan kemudian akan mengalami pelepasan membrane inti membentuk germinal vesicle breakdown (GVBD). Setelah GVBD terbentuk, kromosom dibungkus oleh mikrotubulus dan mikrofilamen yang sangat mempengaruhi keberhasilan pembelahan meiosis. Oosit yang telah mengalami GVBD selanjutnya akan mencapai tahap metaphase I (M-I). Pada oosit sapi metaphase I terjadi setelah 12 - 14 jam inkubasi dan diikuti oleh tahap anaphase I (A-I) dan telophase I (T-I) yang berlangsung relatif singkat (14-18 jam) setelah inkubasi (Chohan dan Hunter 2003). Perkembangan selanjutnya akan mencapai tahap metaphase II (M-II) yang ditandai dengan terbentuknya badan kutub I sebagai oosit matang yang siap untuk difertilisasi (Pawshe et al. 1994).
4
mRNA, perkembangan regulasi kalsium, perubahan aktivitas dari maturation promoting factor (MPF) dan mitogen activated protein kinase (MAPK) dan redistribusi organel seluler (Anguita et al. 2007). Hal ini dibutuhkan untuk mencapai kemampuan perkembangan oosit dan juga membantu kemampuan perkembangan embrionik (Watson 2007).
Spermatozoa
Spermatozoa terdiri dari kepala dan ekor yang keseluruhannya diselubungi oleh membran plasma. Pada bagian kepala terdapat inti sel dengan DNA-nya yang merupakan materi genetik jantan dan akrosom dengan enzim-enzim hidrolitik dan proteolitik yang dibutuhkan untuk menembus kumulus oophorus dan dinding ovum pada saat fertilisasi (Johnson et al. 1997). Sedangkan Gilbert (1994) menyatakan bahwa spermatozoa terdiri dari inti haploid, sistem penggerak spermatozoa dan kumpulan enzim yang dapat membantu inti memasuki sitoplasma oosit pada saat fertilisasi. Kebanyakan organel pada sitoplasma spermatozoa akan menghilang pada saat maturasi berlangsung dan tinggal beberapa organel termodifikasi yang tetap menjalankan fungsi spermatozoa. Selain itu inti haploid juga mengalami perubahan, demikian halnya dengan DNA-nya akan mengalami pemadatan. Lebih lanjut dikatakan bahwa di depan inti sel spermatozoa terdapat akrosom yang berasal dari apparatus golgi dan mengandung banyak enzim-enzim pencerna protein dan gula.
Struktur yang melindungi bentuk tiga dimensi inti sel disebut matriks inti. Matriks ini tersusun atas jalinan benang-benang protein yang meliputi seluruh permukaan inti sel, nukleus, RNA, polisakarida dan selubung yang berisi pori-pori inti. Matriks sama sekali tidak mempunyai histon dan lipid serta hanya mengandung 5% DNA dalam keadaan terlindungi. Beberapa hipotesis telah dibangun untuk menerangkan faktor internal dan eksternal yang berpengaruh terhadap struktur inti. Faktor internal melibatkan perubahan bentuk kromatin dan aktivitas elemen kontraktil dalam inti. Sedangkan faktor eksternal merupakan pengaruh kerja aktin mikrofilamen, intermedit filament dan mikrotubul yang menyusun sitoskeleton. Selubung inti bertaut dengan filament sitoplasma intermedit yang menjulur ke plasma membran (Meistrich 1993).
Poccia (1986) menyatakan bahwa spermatozoa merupakan sel yang tidak dapat lagi melakukan replikasi atau tidak dapat dibagi lagi menjadi beberapa bagian. Hal ini berhubungan dengan tidak aktifnya sintesis RNA. Kromatin inti sel spermatozoa sangat padat dan mengandung struktural protein pengikat DNA yang sangat spesifik. Selanjutnya dilaporkan oleh Bellve (1982) bahwa protein kromosom (protamin) berfungsi sebagai penentu kondensasi kromatin. Protein inti terdiri atas lebih dari 90% protamin, suatu polipeptida yang kaya akan arginin dan berfungsi untuk menghilangkan histon, menyebabkan kondensasi kromatin dan menghambat ekspresi gen pada proses spermiogenesis. Walaupun pada kebanyakan mamalia, protamin mengandung banyak arginin, tetapi molekul protamin mempunyai sekuens primer yang unik dengan bagian terminal karboksinya yang sangat bervariasi. Variasi filogeni pada protamin ini diduga dapat menggambarkan fungsinya sebagai penentu bentuk nukleus.
5 heterogen. Struktur kromatin spermatozoa yang kompak tersebut dapat melindungi integritas genetik spermatozoa selama transportasi dari saluran reproduksi jantan ke saluran reproduksi betina untuk melakukan fertilisasi.
Intracytoplasmic Sperm Injection (ICSI)
ICSI sebagai suatu teknik yang memungkinkan untuk memasukkan spermatozoa ke dalam sel telur untuk tujuan fertilisasi dengan bantuan alat mikromanipulator, teknik ini telah mampu meningkatkan angka fertilisasi spermatozoa. Alat mikromanipulator terdiri dari sebuah mikroskop inverted yang dilengkapi peralatan pelengkap yang mampu menggerakkan pipet injection
(berdiameter luar 10 μm dan diameter dalam 8 μm) dan holding (berdiameter luar 100-150 μm dan diameter dalam 20-40 μm) dalam melaksanakan ICSI.
Kelebihan utama teknik ICSI adalah dapat menggunakan spermatozoa tanpa mempertimbangkan motilitasnya yang merupakan syarat mutlak pada IVF (Okada
et al. 1999; Kuramoto et al. 1997). Seleksi spermatozoa normal untuk ICSI dilakukan untuk memperoleh perkembangan embrio yang lebih tinggi, walaupun menurut Nagy et al. (1995) mengemukakan bahwa peningkatan jumlah spermatozoa yang abnormal dalam semen bukan merupakan faktor kritis yang menurunkan tingkat fertilisasi setelah ICSI. Said et al. (2003) mendukung hal tersebut, dari penelitiannya dimana spermatozoa tikus yang telah mati karena dilakukan pemisahan kepala spermatozoa dengan ekor spermatozoa, selanjutnya hanya kepala spermatozoa saja yang dimasukkan ke dalam oosit ternyata mampu tumbuh dan membelah.
Pada setiap pelaksanaan ICSI, sebelum spermatozoa diinjeksikan ke dalam oosit dilakukan immobilisasi atau menghentikan pergerakan spermatozoa. Hal ini dilakukan agar mudah memasukkan spermatozoa ke dalam pipet injeksi dan spermatozoa tidak melakukan pergerakan. Immobilisasi spermatozoa umumnya dilakukan dengan menekan ekor spermatozoa dengan pipet injeksi ke dasar petri (Dozortzev et al. 1995). Boediono (2001) menyatakan bahwa perlakuan immobilisasi spermatozoa kambing sebelum dilakukan ICSI akan dapat meningkatkan angka pembelahan pada tahap awal perkembangan embrio.
Beberapa jenis hewan telah lahir dari hasil ICSI yang menggunakan spermatozoa immotile (Yanagimachi, 2001). Satu hal yang perlu dicatat bahwa ICSI dalam aplikasinya telah berkembang dengan berbagai teknik yang berbeda untuk menghasilkan pembuahan normal. Beberapa penelitian telah melaporkan tentang keberhasilan ICSI dalam mendukung pembentukan pronukleus dan perkembangan embrio hingga tahap blastosis, serta keberhasilan ICSI pada hewan dalam menghasilkan anak. Beberapa kelahiran anak hewan hasil ICSI telah dilaporkan pada kelinci (Hosoi et al. 1988 dan Iritani, 1989), mencit (Kimura dan Yanagimachi, 1995), kucing (Pope et al. 1998), kuda (Cochran et al. 1998), domba (Gomez et al. 1998), sapi (Hamano et al. 1999) dan tikus (Said et al. 2003).
6
Fertilisasi dan Aktivasi Oosit
Keberhasilan perkembangan embrio didahului dengan terjadinya proses fertilisasi antara oosit dengan spermatozoa. Oosit dari ovulasi alami atau in vitro maturasi adalah dalam kondisi matang (siap untuk dibuahi) yaitu pada kondisi Metafase II (M-II) dengan terdapatnya badan polar I, perkembangan selanjutnya terjadi karena aktivasi oleh spermatozoa atau aktivasi buatan dengan cara elektrik atau kimiawi. Rekayasa aktivasi oosit merupakan metode yang sangat berguna untuk meningkatkan keberhasilan ICSI (Yanagimachi 2005).
Secara ilustrasi (dengan sedikit modifikasi), proses aktivasi oosit oleh spermatozoa pada proses fertilisasi digambarkan oleh Alberio et al. (2001) pada Gambar 1. Terlihat pada gambar tersebut, spermatozoa sebagai activator menempel pada membran plasma oosit pada bagian sperm receptor (SR). Reseptor yang terdapat pada permukaan membran oosit adalah CD9 dan α1β6. Pertemuan tersebut selanjutnya mengaktifkan protein G atau Protein Tyrosine Kinase (PTK) yang kemudian mengaktifkan phospholipase C (PLC). Aktifnya PLC membuat proses hidrolisa phosphatidylinositol 4,5-bisphosphate (PIP2) pada membran plasma dapat berjalan. Hidrolisa PIP2 menghasilkan diacylglicerol
(DAG) dan inositol 1,4,5-triphosphate (IP3).
Meningkatnya konsentrasi Ca2+ menyebabkan terjadinya dua kejadian penting pada fertilisasi yaitu pelepasan CG dan inisiasi berlanjutnya siklus pembelahan meiosis sel. Pelepasan CG (tersusun dari enzyme dan glycoprotein) kedalam ruang perivitellin oosit dan kemudian mengubah kondisi zona pelucida menjadi keras untuk mencegah polyspermi, sementara inisiasi berlanjutnya siklus pembelahan meiosis sel keluar dari penahanan pada tahap M-II ditandai dengan menurunkan aktivitas MPF (Machaty dan Prather 1998; Alberio et al. 2001; Jones
7 2007). Kejadian lain yang mengikuti peningkatan Ca2+ adalah meningkatnya pH, sehingga terjadi pertukaran antara Na+ dari luar sel dan H+ dari dalam oosit. Peningkatan pH penting artinya untuk menstimulasi replikasi DNA, perkembangan konduktan K+ dan perubahan metabolism seluler lainnya (Machaty dan Prather 1998).
Aktivasi oosit oleh spermatozoa terjadi pada proses fertilisasi dimana spermatozoa melakukan inisiasi terhadap fluktuasi Ca2+ didalam oosit sampai terbentuk pronukleus. Hal pokok yang mengakibatkan oosit aktif adalah peranan dan keberadaan ion Ca2+ yang dapat dilihat dari serangkaian fluktuasi konsentrasi Ca2+ intracellular yang dilepaskan dari reticulum endoplasma. Fluktuasi ini penting artinya untuk mendukung perkembangan. Fluktuasi Ca2+ dimulai beberapa saat setelah fusi gamet, terjadi pada berbagai frekuensi, dan berhenti pada saat pembentukan pronukleus (Ozil 1990; Toth et al. 2006; Jones, 2007). Konsentrasi ion Ca2+ dengan batas minimum diperlukan agar oosit dapat aktif (Toth et al. 2006). Fluktuasi Ca2+ selama fertilisasi terjadi beberapa jam sampai terbentuknya pronukleus kemudian berhenti dan terjadi lagi pada saat membran inti pecah pada awal pembelahan mitosis embrio. Dijelaskan oleh Jones (2007) bahwa fluktuasi ini penting untuk memastikan seluruh proses aktivasi oosit berlangsung. Terdapat dua faktor yang menentukan fluktuasi Ca2+ , yaitu faktor inisiasi dari spermatozoa dan faktor dari oosit. Faktor dari spermatozoa dikontrol oleh suatu protein spermatozoa yaitu PLC-zeta, yang terdapat pada inti spermatozoa. Fluktuasi Ca2+ berhenti ketika terbentuk pronuklei karena PLC-zeta dilokalisir dalam membran pronuklei bersama inti sehingga tidak dapat mempengaruhi fluktuasi Ca2+. Sedangkan faktor dari oosit adalah keberadaan IP3 dan receptornya yang mengatur keluarnya Ca2+.
Fluktuasi Ca2+ akan menurunkan aktivitas MPF (heterodimer CDK1 dan cyclin B) dengan mendegradasi cyclin B (Madgwick et al. 2005). Dijelaskan lebih lanjut fluktuasi Ca2+ akan mengaktifkan calmodulin-dependent protein kinase II (CaMK-II) yang selanjutnya mengaktivasi anaphase-promoting complex / cyclosome (APC/C). Aktifnya APC/C disebabkan oleh hilangnya early mitotic inhibitor 2 (Emi2) (Madgwick & Jones 2007) karena diphosporilasi oleh CaMK-II. Selain itu, CaMK-II bekerja menurunkan fluktuasi Ca2+, tetapi penurunan ini akan meningkatkan spindle checkpoint yang menghambat aktivasi APC/C. Keberadaan APC/C hasil stimulasi CaMK-II bersama dengan senyawa proteolysis 26S Proteosome, selanjutnya akan mendegradasi cyclin B. Degradasi cyclin B berakibat menurunnya MPF, sehingga oosit akan segera melakukan meiosis ke dua yang ditandai dengan keluarnya PB-II dan kemudian membentuk pronukleus betina. Berdasarkan informasi-informasi yang dikumpulkan Markoulaki et al. (2003), selain Ca2+, CaMK-II juga berfluktuasi selama fertilisasi untuk memastikan keberadaan aktivitas enzim yang diperlukan selama fertilisasi. Aktivitas enzim meningkat sebesar 370% selama fluktuasi Ca2+ dan 185% pada fluktuasi CaMK-II (Markoulaki et al. 2003). Sehingga dapat disimpulkan bahwa keluarnya oosit dari fase M-II dan perkembangannya ditentukan oleh fluktuasi Ca2+ dan CaMK-II.
8
tikus (Tomashov-Matar et al. 2005) dan oosit sapi (Meo et al. 2005). Strontium klorida (SrCl2) dapat mengaktivasi osilasi kalsum (Ca2+) internal oosit tikus melalui reseptor inositol triphosphate (IP3) (Tomashov-Matar et al. 2005). Meo et al. (2005) menggunakan strontium sebagai aktivasi tunggal pada oosit sapi untuk tujuan parthenogenesis dengan diperoleh embrio sampai tahap blastosis. Strontium merupakan multiple activator yang dapat menginduksi peningkatan Ca2+ dan menginduksi pelepasan Ca2+ dari intracellular di dalam oosit (Kline dan Kline 1992).
Penggunaan strontium sebagai aktivator partenogenesis oosit dengan tujuan menginduksi peningkatan kalsium intraseluler. Perlakuan oosit dengan strontium akan menyebabkan peningkatan konsentrasi kalsium secara bergelombang seperti yang terjadi pada saat aktivasi oosit oleh sperma (Kline dan Kline 1992; Bos-Mikich et al. 1995; Rogers et al. 2004). Strontium menginduksi peningkatan kalsium intraseluler melalui berbagai mekanisme seperti melalui stimulasi adenylyl cyclase type VIII (Gu et al. 2000), Ca2+-dependent Ca2+ release (Jallerete
et al. 2000), dan inositol 1,4,5-trisphosphate (IP3)-induced calcium release (IICR) (Zhang et al. 2005). Pola aktivasi dengan strontium memerlukan waktu yang lebih lama (3-6 jam) dibandingkan dengan ethanol (5-7 menit). Lamanya waktu aktivasi oleh strontium karena peningkatan kalsium secara bergelombang dan mampu mengaktivasi oosit muda dan oosit tua (Wu et al. 1998). Strontium dapat meningkatkan sensivitas reseptor IP3, strontium dapat memicu eksositosis kalsium yang cepat dengan peningkatan pada calcium-binding site dari IP3 reseptor. Ada dua calcium interaction site pada reseptor IP3 yaitu: stimulatory site
yang sensitive terhadap strontium dan inhibitory site yang tidak sensitif terhadap strontium (Marshall dan Taylor 1994).
3
METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Embriologi, Departemen Anatomi, Fisiologi, dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor dan Laboratorium Biologi Sel dan Jaringan Hewan, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia, Cibinong mulai dari bulan Agustus 2011 hingga bulan Oktober 2012.
Metode Penelitian
Koleksi dan Maturasi Oosit Sapi
9 stereo (Nikon, SMZ-2T, Japan), kemudian dilakukan maturasi in vitro dalam drop 50 µl medium maturasi yaitu TCM-199 (Sigma, M4530, USA), ditambah FBS (Sigma, F4135, USA) 10%, Follicle Stimulating Hormone/FSH (OvagenTM, New Zealand) 10 µg/ml, human Chorionic Gonadotrophin/hCG (Intervet Internasional BV, Chorulon, Boxmeer, Holland) 10 µg/ml, Estradiol (Sigma, E4389, USA) 1 µg/ml, gentamicyn (Sigma, G1272, USA) 10 mg/ml, sodium pyruvate (GibcoBRL, 11840-030, USA) 0,25 mM (Meo et al. 2007) dan ditutup mineral oil (Sigma, M8410, USA). Setiap drop 50 µl media maturasi diisi 10 oosit dan diinkubasi selama 24 jam dalam inkubator (Forma, Steri-Cycle) CO2 5%, suhu 38,80C (Meo
et al. 2007). Kematangan oosit dievaluasi dengan melihat perkembangan sel-sel kumulus dan keluarnya badan kutub I (tahap M-II) yang digunakan untuk penelitian.
Aktivasi Partenogenetik
Aktivasi partenogenetik menggunakan strontium klorida/SrCl2 (Sigma, 255521, USA) dengan perlakuan konsentrasi 0 mM, 10 mM, 20 mM dan 30 mM dalam modifikasi medium BO (Brackett dan Oliphant 1975) tanpa Ca2+ dan Mg2+, ditambah BSA (Sigma, A3311, USA) 10 mg/ml. Oosit hasil maturasi dilepaskan dari sel-sel kumulus dengan 0,2% hyaluronidase (Sigma, H4272, USA) dalam medium DPBS (Sigma, D8537, USA) ditambah 10% FBS (Sigma, F4135, USA) dan 10 mg/ml gentamicyn (Sigma, G1272, USA) selama 10 menit. Oosit dengan badan kutub I kemudian dipindahkan ke dalam drop perlakuan aktivasi dan dikultur selama 6 jam di dalam inkubator CO2. Embrio partenogenetik satu sel dipindahkan dalam drop 50 µl medium kultur Synthetic Oviductal Fluid (SOF) yang mengandung 5 mg/ml BSA (Sigma, A3311, USA), 2,5% FBS (Sigma, F4135, USA) (Meo et al. 2007) dan ditutup mineral oil (Sigma, M8410, USA), dikultur dalam inkubator CO2. Pengamatan perkembangan embrio partenogenetik dilakukan setiap 24 jam dan penggantian medium setiap 48 jam.
Pembuatan Pipet Mikromanipulasi Injeksi dan Holding
Bahan pipet mikromanipulasi adalah tabung borosilikat gelas kapiler tanpa filament (Sutter Instrument, B100-75-10, Novato, CA). Pipet mikromanipulasi injeksi dibuat dengan menggunakan alat micro-puller (Sutter Instrument P-87, Novato, CA) dan micro-forge (Narishige, MF-79, Japan). Pipet mikromanipulasi injeksi berdiameter bagian luar 10 μm dan diameter dalam 5-7 μm untuk aspirasi spermatozoa. Bagian ujung mikromanipulasi injeksi dibuat tajam dengan micro-grinder (Narishige, Japan) agar dapat menembus masuk ke sitoplasma sel telur. Pipet mikromanipulasi holding berdiameter bagian luar 100-150 μm dan berdiameter dalam 20-40 μm untuk memfiksir oosit selama proses ICSI.
Penyiapan Oosit dan Sperma Sapi untuk ICSI
10
rpm, selama 5 menit dalam 5 ml medium DPBS (Gibco, 21600-010, Invitrogen, USA) ditambah BSA (Sigma, A2153, USA) 10 mg/ml dan gentamicyn (Sigma, G1272, USA) 10 mg/ml. Hasil sentrifus diperoleh supernatant dan pellet, bagian supernatan dibuang dan didapatkan pellet, kemudian diatas pellet ditambahkan secara perlahan 1 ml medium DPBS (Sigma, D8537, USA) ditambah 10% FBS (Sigma, F4135, USA) dan 10 mg/ml gentamicyn (Sigma, G1272, USA). Selanjutnya diinkubasi pada suhu 370C selama 10-15 menit agar spermatozoa mengurai dari kelompoknya dan bergerak ke arah permukaan larutan. Spermatozoa diambil pada bagian permukaan yang selanjutnya digunakan untuk ICSI.
Pelaksanaan ICSI dan Aktivasi
Metode ICSI yang digunakan pada penelitian ini mengikuti prosedur Boediono (2001) dengan modifikasi. Tutup cawan petri 60 mm (Corning, 430196, USA) digunakan sebagai tempat membuat drop medium untuk ICSI. Medium ICSI dan manipulasi menggunakan medium DPBS (Sigma, D8537, USA) ditambah 10% FBS (Sigma, F4135, USA) dan 10 mg/ml gentamicyn (Sigma, G1272, USA) dalam bentuk lima drop 5 µl, masing-masing berisi 2-5 oosit dibuat disebelah kiri. Bagian kanan dibuat empat buah drop manipulasi spermatozoa masing-masing 10 µl dibuat memanjang, dua drop 5 µl berisi media manipulasi sedangkan satu drop 10 µl dibuat memanjang berisi medium manipulasi yang mengandung PVP (Sigma, P5288, USA) 5% (w/v), yang digunakan untuk mencuci jarum injeksi dan holding. Proses ICSI menggunakan mikroskop inverted
(Nikon Diapot, Japan) dan micromanipulator (Narisige, Japan), dimulai dengan melakukan aspirasi spermatozoa menggunakan jarum injeksi. Oosit difiksir menggunakan pipet holding dan diarahkan sedemikian rupa sehingga badan kutub I berada pada posisi arah jam 12 atau jam 6. Spermatozoa diinjeksikan pada arah jam 3 yang merupakan sudut 900 terhadap badan kutub I untuk menghindari rusaknya inti sel yang berada di dekat badan kutub I. Selanjutnya spermatozoa diinjeksikan ke dalam sitoplasma oosit dan pipet injeksi ditarik kembali keluar. Oosit setelah ICSI kemudian diaktivasi menggunakan strontium (Sigma, 255521, USA) dengan perlakuan konsentrasi 0 mM, 10 mM, 20 mM dan 30 mM dalam modifikasi medium BO (Brackett dan Oliphant 1975) tanpa Ca2+ dan Mg2+, ditambah BSA (Sigma, A3311, USA) 10 mg/ml, dan dikultur selama 6 jam dalam inkubator CO2.
Kultur dan Perkembangan Pronukleus
Oosit setelah ICSI dan aktivasi kemudian dipindahkan dalam drop 50 µl medium kultur SOF yang mengandung 5 mg/ml BSA (Sigma, A3311, USA), 2,5% FBS (Sigma, F4135, USA) dan ditutup mineral oil (Sigma, M8410, USA), selanjutnya dikultur dalam inkubator 5% CO2, suhu 38,80C (Meo et al. 2007). Evaluasi kemampuan fertilisasi oosit dilakukan 18 jam setelah ICSI dan aktivasi, dengan melihat terbentuknya pronukleus (PN). Pengamatan PN dilakukan dengan oosit dikultur selama 10-15 menit dengan pewarnaan 10 µg/ml Hoechst 33342 (Sigma, B2261, USA) dalam medium DPBS (Sigma, D8537, USA) (Meo et al. 2007), dengan menempatkan oosit pada tengah slide glass dan ditutup cover glass
11 vernish. Pengamatan dilakukan dengan mikroskop flouresen (Imager.Z2, Carl Zeiss) dengan panjang gelombang 330-385 nm.
Kultur dan Perkembangan Embrio
Embrio satu sel hasil ICSI dan aktivasi kemudian dipindahkan dalam drop 50 µl medium kultur SOF yang mengandung 5 mg/ml BSA (Sigma, A3311, USA), 2,5% FBS (Sigma, F4135, USA) dan ditutup mineral oil (Sigma, M8410, USA), selanjutnya dikultur dalam inkubator 5% CO2, suhu 38,80C (Meo et al. 2007). Pengamatan perkembangan embrio tahap satu sel sampai tahap blastosis dilakukan setiap 24 jam dan penggantian medium setiap 48 jam.
Rancangan Percobaan
Perkembangan Embrio Partenogenetik
Pada penelitian ini, variabel respon yang diukur adalah jumlah keberhasilan sel embrio partenogenetik mencapai perkembangan tahap 2-4 sel, 8-16 sel, morula dan blastosis dari perlakuan aktivasi menggunakan strontium dengan konsentrasi 0 mM, 10 mM, 20 mM dan 30 mM.
Perkembangan Pronukleus Hasil ICSI dan Aktivasi dengan Strontium
Pada penelitian ini, variable respon yang diukur adalah jumlah keberhasilan oosit hasil ICSI dan aktivasi dengan strontium untuk mencapai perkembangan pronukleus dari perlakuan kontrol negatif (oosit diinjeksi tanpa spermatozoa dan aktivasi), kontrol positif (ICSI tanpa aktivasi) dan kombinasi ICSI dengan aktivasi menggunakan strontium konsentrasi 0 mM, 10 mM, 20 mM dan 30 mM.
Perkembangan Embrio Hasil ICSI dan Aktivasi dengan Strontium
Pada penelitian ini, variabel respon yang diukur adalah jumlah keberhasilan sel embrio mencapai perkembangan tahap 2-4 sel, 8-16 sel, morula dan blastosis dari perlakuan kombinasi ICSI dan aktivasi menggunakan strontium.
Analisa Data
12
4
HASIL DAN PEMBAHASAN
Perkembangan Embrio Parthenogenetik
Penelitian pertama ini bertujuan untuk mendapatkan konsentrasi strontium dalam medium aktivasi untuk perkembangan embrio partenogenetik pada sapi (Tabel 1).
Dalam perlakuan aktivasi ini, menggunakan strontium yang dilarutkan dalam medium BO (Brackett dan Oliphant 1975) tanpa Ca2+ dan Mg2+, untuk meningkatkan efisiensi pemakaian strontium pada saat aktivasi. Hal ini seperti pendapat Kline (1992) yang menyatakan bahwa strontium dalam medium Tyrode`s Albumin Lactate Pyruvate (TALP) tanpa Ca2+ dan Mg2+ lebih baik dibandingkan medium TALP dengan Ca2+ dan Mg2+. Medium TALP tanpa Ca2+ dan Mg2+ membutuhkan sedikit konsentrasi strontium pada saat aktivasi. Kemungkinan hal ini disebabkan oleh terjadinya reduksi sintesis protein yang lebih baik pada kultur oosit mencit tanpa Ca2+ dan Mg2+ (Bos-Mikich 1995). Penggunaan medium BO sebagai medium fertilisasi in vitro telah umum digunakan seperti pada medium TALP, sehingga digunakan dalam perlakuan aktivasi.
Hasil penelitian ini menunjukkan nilai terbaik perkembangan embrio partenogenetik diperoleh pada perlakuan aktivasi dengan strontium adalah konsentrasi 20 mM (Tabel 1.). Penggunaan medium BO sebagai medium untuk melarutkan strontium mampu mengaktivasi oosit sehingga berkembang menjadi embrio partenogenetik. Modifikasi medium BO tanpa Ca2+ dan Mg2+ pada perlakuan penambahan strontium 20 mM menghasilkan perkembangan embrio partenogenetik terbaik dibandingkan konsentrasi strontium yang lebih rendah yaitu 10 mM dan konsentrasi strontium yang lebih tinggi yaitu 30 mM, sehingga diperoleh konsentrasi optimum strontium pada penelitian ini sebanyak 20 mM. Konsentrasi strontium yang optimum dalam medium TALP untuk menghasilkan embrio partenogenetik pada sapi telah dilaporkan oleh Meo et al., (2005) dengan hasil aktivasi terbaik menggunakan strontium 20 mM selama 6 jam dalam medium TALP tanpa Ca2+ dan Mg2+, dengan tingkat pembelahan embrio partenogenetik sebanyak 66.7% dan blastosis sebanyak 13.3%. Tingkat Tabel 1. Perkembangan embrio partenogenetik hasil aktivasi dengan strontium
Perlakuan SrCl2
Kultur embrio
(n)
Jumlah (%) embrio berkembang mencapai Tidak
berkembang
13 perkembangan embrio partenogenetik yang rendah pada tingkat blastosis dalam penelitian ini mungkin disebabkan tidak dikombinasikannya aktivasi strontium dengan cytochalasin B. Penggunaan cytochalasin B untuk menghambat pengeluaran badan kutub II sehingga menghasilkan sel telur diploid (Otaegui 1999). Tidak digunakannya cytochalasin B pada penelitian ini karena untuk mengetahui pengaruh tunggal dari strontium dalam aktivasi oosit untuk menghasilkan embrio partenogenetik. Strontium chloride dalam proses aktivasi oosit dapat menyebabkan peningkatan kalsium intraseluler secara bergelombang seperti yang terjadi pada saat aktivasi oosit oleh sperma (Bos-Mikich et al. 1995). Strontium chloride menginduksi peningkatan kalsium intraseluler melalui berbagai mekanisme seperti melalui stimulasi adenylyl cyclase type VIII (Gu et al. 2000), Ca2+-dependent Ca2+ release (Jallerete et al. 2000), dan inositol 1,4,5-triphosphate (IP3)-induced calcium release (IICR) (Zhang et al. 2005). Penggunaan strontium untuk aktivasi oosit memerlukan waktu aktivasi selama 6 jam, karena strontium dalam proses aktivasi menyebabkan peningkatan kalsium secara bergelombang dan mampu mengaktivasi oosit muda dan tua (Wu et al. 1998).
Pada perkembangan embrio secara normal membutuhkan keberadaan materi genetik dari maternal dan paternal. Tingkat perkembangan embrio partenogenetik yang rendah kemungkinan karena pada embrio partenogenetik ini hanya memiliki salah satu materi genetik tersebut, sehingga menyebabkan fenomena genomic imprinting, dimana suatu gen diekspresikan hanya dari salah satu gen paternal atau maternal saja. Kegagalan genomic imprinting adalah kegagalan mekanisme molekuler untuk mengontrol ekspresi gen spesifik parental asal, berdasarkan modifikasi epigenetic seperti metilasi DNA (Kono 2006).
Perkembangan Pronukleus setelah ICSI dan Aktivasi dengan Strontium
Penelitian kedua bertujuan untuk mengetahui keberhasilan ICSI dan aktivasi dengan konsentrasi strontium yang berbeda dilihat dari perkembangan pronukleus (Tabel 2). Terdapat lima kelompok perlakuan yaitu kontrol negatif (ICSI tanpa spermatozoa dan tanpa aktivasi), kontrol (ICSI dengan spermatozoa dan tanpa aktivasi/S0), ICSI dan aktivasi dengan strontium konsentrasi 10 mM
(S1), 20 mM (S2) dan 30 mM (S3).
Keberhasilan fertilisasi dievaluasi dengan melihat perkembangan pronukleus 18 jam setelah ICSI dan aktivasi dengan strontium.
Tabel 2. Perkembangan pronukleus hasil ICSI dan aktivasi dengan strontium Perlakuan
14
Perkembangan pronukleus dilihat dengan pewarnaan Hoechst 33342 yang mampu berikatan dengan DNA inti sehingga terlihat berpendar menggunakan mikroskop fluoresen. Parameter yang di evaluasi dari perkembangan terbentuknya PN dengan kategori terbentuk 1-PN, terbentuk 2-PN dan tidak teridentifikasi.
Perkembangan pronukleus dengan terbentuknya 1-PN pada semua
perlakuan tidak menunjukkan perbedaan. Perkembangan 1-PN yang teramati selama penelitian ini kemungkinan merupakan perkembangan salah satu dari pronukleus jantan atau pronukleus betina tanpa diikuti oleh pronukleus pasangannya. Bila pronukleus jantan yang berkembang, kemungkinan dari spermatozoa yang diinjeksikan mengalami proses pemecahan ikatan disulfide membran inti spermatozoa, kemudian dilanjutkan dengan inisiasi dekondensasi kromosom membentuk pronukleus jantan tanpa diikuti perkembangan pronukleus betina. Kemungkinan lain 1-PN yang terbentuk merupakan pronukleus betina dimana oosit teraktivasi oleh strontium membentuk pronukleus betina, tanpa diikuti dengan perkembangan pronukleus jantan. Hal ini didukung pendapat Hayasaka et al, (2006) yang melaporkan bahwa pada aktivasi dengan bahan kimia menyebabkan sentrosom maternal mempengaruhi mikrotubul sitoplasma untuk membentuk pronukleus betina.
Gambar 3. Proses ICSI. (A) Aspirasi spermatozoa, (B) Proses ICSI dan oosit dengan badan kutub I. Bar = 40 µm
15 Pembentukan pronukleus dengan terbentuknya 2-PN pada perlakuan ICSI dan aktivasi dengan strontium 20 mM mencapai 43.59% lebih tinggi (P<0.05) dari strontium 30 mM dan kontrol. Perkembangan pronukleus dengan terbentuknya 2-PN pada penelitian ini menggambarkan terjadinya kombinasi proses aktivasi oleh spermatozoa dan aktivasi dengan strontium telah mampu menginisiasi fluktuasi Ca2+ pada oosit sehingga terbentuk pronukleus betina dan pronukleus jantan. Pembentukan pronukleus betina pada oosit dimulai dengan terjadinya proses aktivasi oleh faktor spermatozoa yang disebut sperm oocyte activating factor
(SAF) yang akan melepaskan oosit dari tahap M-II sehingga berlanjut ke tahap selanjutnya. Adapun prosesnya dimulai dengan inisiasi fluktuasi Ca2+ dari dalam reticulum endoplasma sehingga aktivitas maturation promoting factor (MPF) menurun. Pembentukan pronukleus jantan kemungkinan disebabkan terdapatnya kandungan Glutathion (GSH) pada sitoplasma yang relatif tinggi sehingga mendukung pula inisiasi awal pembentukan pronukleus jantan. Proses setelah spermatozoa diinjeksikan ke dalam oosit dan dilanjutkan aktivasi dengan strontium menyebabkan terjadinya proses biokimia yang simultan dan saling berkesinambungan antara oosit dan spermatozoa sampai masing-masing terbentuk pronukleus. Hal ini didukung oleh Maedomari et al. (2007) yang menyatakan bahwa konsentrasi GSH dalam oosit menunjukkan tingkat kematangannya dan mempengaruhi keberhasilan dalam perkembangan embrio selanjutnya. Kombinasi perlakuan ICSI dan aktivasi dengan strontium 20 mM dengan waktu kultur 6 jam memperoleh hasil pembentukan pronukleus yang optimum, hal ini kemungkinan pada kombinasi ICSI dan strontium konsentrasi 10 mM serta 30 mM belum mampu mendukung aktivasi oosit secara optimal sehingga pembentukan 2-PN diperoleh jumlah yang lebih rendah. Efisiensi penggunaan strontium dalam aktivasi ini seperti yang dilaporkan oleh Meo et al. (2005) bahwa strontium dalam medium aktivasi menyebabkan gelombang pengeluaran calcium oscillation bertahap dalam waktu yang panjang seperti pada proses fertilisasi oleh sperma. Calcium oscillation menyebabkan pelepasan cortical granulose dan pembentukan mRNA maternal pada proses miosis dan perkembangan pronukleus.
Perkembangan oosit yang tidak teridentifikasi dengan tidak adanya perkembangan pronukleus pada perlakuan ICSI dan aktivasi dengan strontium 20 mM mencapai 33.3%, lebih rendah (P<0.05) dibandingkan perlakuan yang lain. Oosit yang tidak teridentifikasi dalam penelitian ini, adalah oosit yang diamati tidak terdapat spermatozoa yang terkondensasi membentuk pronukleus jantan dan pronukleus betina. Hal ini diduga terdapat konsentrasi GSH di dalam sitoplasma oosit yang rendah sehingga tidak mampu mendukung proses pecahnya membran inti spermatozoa dan inisiasi dekondensasi kromosom. Kondisi ini seperti yang dinyatakan oleh Lee et al. (2003) bahwa faktor utama yang mengakibatkan kegagalan pembentukan pronukleus jantan setelah ICSI pada oosit babi adalah konsentrasi GSH, dimana konsentrasi GSH sitoplasma oosit hasil maturasi in vitro
16
ditambahkan tidak mampu mendukung pengeluaran kalsium intraseluler dan penurunan MPF sehingga oosit tidak berkembang membentuk pronukleus betina.
Perkembangan Embrio setelah ICSI dan Aktivasi dengan Strontium
Penelitian ketiga bertujuan untuk mengetahui hasil perkembangan embrio sapi setelah ICSI dan aktivasi dengan konsentrasi strontium yang berbeda yang disajikan pada Tabel 3.
Perkembangan embrio sapi hasil ICSI dan aktivasi dengan strontium setelah dikultur dalam medium SOF selama 48 jam mencapai tahap dua sel (Gambar 4.A), kultur 72 jam mencapai tahap empat sel (Gambar 4.B.1), kultur 96-Tabel 3. Perkembangan embrio sapi setelah ICSI dan aktivasi dengan strontium
Perlakuan
SrCl2
Kultur embrio
(n)
Jumlah (%) embrio berkembang mencapai Tidak
berkembang
(%) 2-4 sel
(%)
8-16 sel
(%)
Morula
(%)
Blastosis
(%)
Kontrol (-) 35 0 (0.00)a 0 (0.00)a 0 (0.00)a 0 (0.00)a 35 (100.00)c
0 mM (S0) 31 11 (35.48)b 10 (32.26)b 5 (16.13)b 1 (3.33)ab 20 (64.52)b
10 mM (S1) 33 14 (42.42)bc 12 (36.36)bc 7 (21.21)b 3 (9.09)abc 19 (57.58)ab
20 mM (S2) 32 16 (50.00)c 14 (43.75)c 9 (28.13)b 5 (15.63)c 16 (50.00)a
30 mM (S3) 33 12 (36.36)b 11 (33.33)b 5 (15.15)b 2 (6.06)ab 21 (63.64)b
a, b, c
Superskrip yang berbeda pada kolom yang sama menunjukkan beda nyata (P<0.05)
17 120 jam mencapai tahap delapan sel (Gambar 4.B.2), kultur 144-168 jam mencapai tahap morula (Gambar 4.C) dan kultur 192 jam mencapai blastosis (Gambar 4.D).
Data yang diperoleh dalam penelitian ini menunjukkan bahwa perkembangan embrio sapi hasil ICSI dan aktivasi dengan strontium di peroleh nilai tertinggi pada perlakuan S1 dan S2 dibandingkan perlakuan kontrol/S0 dan S3. Kombinasi ICSI dan aktivasi dengan strontium mencapai tingkat perkembangan embrio yang dikultur dalam medium Syntetic Oviduk Fluid (SOF) mencapai dua sel 50% dan blastosis 15.63%. Pada penelitian lain dengan menggunakan medium SOF untuk kultur setelah ICSI dan aktivasi oosit mampu mendukung perkembangan embrio sapi mencapai tahap blastosis. Penelitian yang dilakukan oleh Suttner et al. (2000) telah melaporkan perkembangan embrio hasil kombinasi ICSI dan aktivasi dengan calcium ionophore yang dikultur dalam medium SOF mencapai pembelahan embrio 79.6% dan blastosis 28.2%.
Perkembangan embrio secara normal merupakan proses lanjutan setelah terjadinya fertilisasi oosit oleh spermatozoa, yang menghasilkan zygot. Zygot kemudian akan berkembang dan melakukan pembelahan sel secara bertahap, sehingga diperoleh embrio yang baik dan siap diimplantasikan (transfer). Perkembangan embrio sapi secara in vitro secara langsung dipengaruhi oleh medium kultur yang digunakan. Media kultur sangat penting untuk perkembangan embrio, karena media kultur dapat menyediakan nutrisi yang dibutuhkan oleh zygot untuk berkembang dan melakukan pembelahan sel.
Perkembangan embrio dalam penelitian ini pada setiap perlakuan menunjukkan penurunan, sejalan dengan adanya pembelahan sel lebih lanjut. Penurunan pertumbuhan embrio semakin meningkat, terutama setelah embrio melalui tahap morula. Hal ini terjadi kemungkinan karena semakin lama embrio dikultur dalam medium, maka zat nutrisi yang tersedia untuk pertumbuhan dan perkembangan embrio akan semakin berkurang, akibat dari metabolisme yang semakin aktif, sehingga penggantian atau penambahan medium kultur baru dalam penelitian ini dilakukan setiap 24 jam untuk mempertahankan nutrisi yang dibutuhkan.
Perkembangan embrio in vitro tahap dua sel mencapai blastosis dapat dipengaruhi oleh lingkungan luar untuk mendukung perkembangannya. Tingkat keberhasilan perkembangan embrio yang dihasilkan dengan menggunakan media kultur sangat beragam, khususnya embrio yang diperoleh melalui proses fertilisasi
in vitro, jumlah dan daya hidup embrio yang dihasilkan masih rendah dapat disebabkan salah satunya adalah kondisi kultur yang suboptimum (Djuwita et al. 2000). Pengaruh lain yang kemungkinan mempengaruhi kondisi kultur dapat disebabkan oleh perubahan osmolaritas dan pH medium, serta kondisi kultur yang meliputi suhu, keseimbangan gas O2 dan CO2 (Boediono et al. 2000). Penurunan perkembangan embrio sapi secara in vitro untuk mencapai tahap blastosis dapat disebabkan karena pada saat perkembangan embrio mengalami kerusakan oleh tingkat pembentukan reactive oxygen species (ROS) dan hydrolytic enzymes
18
sintesa faktor maternal yang diperlukan untuk menunjang proses maturasi, fertilisasi dan perkembangan embrio tahap awal (Boediono et al. 2000).
5
SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian yang telah dilakukan dapat disimpulkan bahwa kombinasi ICSI dan aktivasi dengan strontium konsentrasi 20 mM dalam medium BO tanpa Ca2+ dan Mg2+ selama 6 jam, kemudian dilanjutkan kultur dalam medium SOF dapat meningkatkan keberhasilan fertilisasi dan perkembangan embrio dari tahap 2 sel sampai dengan blastosis.
Saran
Perlu dilakukan penelitian lebih lanjut penggunaan aktivasi lain yang dikombinasikan dengan strontium setelah ICSI untuk memperolah perkembangan embrio sapi yang optimal.
DAFTAR PUSTAKA
Alberio R, Zakhartchenko V, Motlik J, Wolf E. 2001. Mammalian oocyte activation: lessons from the sperm and implication for nuclear transfer. Int J Dev Biol. 45:797-809.
Anguita B et al. 2007. Effect of oocyte diameter on meiotic competence, embryo development, p34(cdc2) expression and MPF activity in prepubertal goat oocytes. Theriogenology 67:526-536.
Bellve AR. 1982. Biogenesis of the mammalian spermatozoon: Transformation of the nucleus during spermiogenesis. Di dalam: Amann RP, Seidel Jr GE, editor.
Prospects for Sexing Mammalian Sperm. USA: Colorado Associated University Pr. hlm:69-102.
Berland M, Frei M, Peralta O, Ratto M. 2011. Time exposure period of bovine oocyte to sperm in relation to embryo development rate and quality. ISRN Veterinary Science doi:10.5402/2011/257627.
Boediono A, Rusianto Y, Mohamad K, Djuwita I, Herliatien. 2000. Perkembangan oosit kambing setelah maturasi, fertilisasi dan kultur in vitro.
Media Vet. 7(4):11-17.
Boediono A. 2001. Sperm immobilization prior to introcytoplasmic sperm injection (ICSI) and oocyte activation improves early development of microfertilized goat oocyte. Reprotech 1:29-34.
Bos-Mikich A, Wood MJ, Candy CJ, Whittingham DG. 1995. Cytogenetical analysis and developmental potential of vitrified mouse oocytes. Biol Reprod. 53:780-785.
19 Cochran R, Meintjes M, Roggio B, Hylan D. 1998. Live foals produced from sperm injected oocytes derived from pregnant mares. J Equine Vet Sci 18:736-740.
Djuwita I, Amalia L, Widjiati, Mohamad K. 2000. Efek konsentrasi glukosa dalam medium dengan dan tanpa fosfat terhadap perkembangan embrio preimplantasi mencit secara in vitro. Media Vet. 7(1):9-12.
Dozortzev D, Rybouchkin A, Sutter P, Qian C, Dhont M. 1995. Human oocyte activation following intracytoplasmic sperm injection: the role of the sperm cell. Hum Reprod 10:403-407.
Fraser L. 2004. Structural damage to nuclear DNA in mammalian spermatozoa: its evaluation techniques and relationship with male infertility. J Vet Sci 7:311-321.
Gilbert SF. 1994. Developmental Biology. Ed ke-4. Massachusetts: Sinauer Associates Inc.
Gomez MC, Catt JW, Evans G, Maxwell WMC. 1998. Cleavage, development and competence of sheep embryos fertilized by intracytoplasmic sperm injection and in vitro fertilization. Theriogenology 49:1143-1154.
Gordon I. 2003. Laboratory production of cattle embryos. London: CABI Publishing 11th ed.
Goto K, Kinoshita A, Takuma Y, Ogawa K. 1990. Fertilization of bovine oocytes by the injection of immobilized, killed spermatozoa. Ve. Rec. 127:517-520. Gu C, Cooper DM. 2000. Ca2+, Sr2+ and Ba2+ identity distinct regulatory sites on
adenylys cyclase (AC) types VI and VIII and consolidate the apposition of capacitative cation entry channels and CA2+-sensitive Acs. J Biol Chem
275:6980-6986.
Hamano K, Li X, Qian XQ, Funauchi F, Furudate M, Minato Y. 1999. Gender preselection in cattle with intracytoplasmically injected, flow cytometrically sorted sperm heards. Biol Reprod 60:1195-1197
Hayasaka S, Terada Y, Morita J, Tachibana M, Shima-Morito Y, Kakoi-Yoshimoto T, Nakamura S, Murakami T, Yoegashi N, Okamura K. 2006. Mini review, Post-ICSI cytoskeletal dynamics during fertilization. J Mamm. Ova Res
23:21-26.
Hosoi Y, Miyake M, Utsumi K, Iritani A. 1988. Development of rabbit oocytes after microinjection of spermatozoa. In: Proceedings of the 11th International Conggress on Animal Reproduction and Artificial Insemination. Abst.Pp.331. Iritani A, Hoshi Y. 1989. Microfertilization by various methods in mammalian
species. Progress in Clinical and Biological Research. 294:145-149.
Jellerette T, He CL, Wu H, Parys JB, Fissore RA. 2000. Down-regulation of the inositol 1,4,5-trisphosphate receptor in mouse eggs following fertilization or parthenogenetic activation. Dev Biol 233:238-250.
Johnson L, Blanchard TL, Warner DD, Scrutchfield WL. 1997. Factors affecting spermatogenesis in the stallion. Theriogenology 48:1199-1216.
Jones KT. 2007. Intracellular calcium in the fertilization and development of mammalian eggs. Proc Aust Phys Soc. 38:35-41.
Kimura Y, Yanagimachi R. 1995. Intracytoplasmic sperm injection in the mouse.
Biol Reprod. 52:709-720.
20
Kono T. 2006. Genomic imprinting is a barrier to parthenogenesis in mammals.
Cytogenet Genome Research. 113:31-35.
Kuramoto T, Boediono A, Sugioka M, Umebayashi T, Fukuda K, Motoishi M, Komatsu K. 1997. Pregnancies from obstructive azoospermia patients after intracytoplasmic sperm injection (ICSI) with testicular spermatozoa. In:
Proceedings of 10th World Congress on In Vitro Fertilization and Assisted Reproduction, Vancouver Canada 24-28 May 1997. Pp.523-525
Lee J, Tian XC, Yang X. 2003. Failure of male pronucleus formation is the major cause of lack of fertilization and embryo development in pig oocytes subjected to intracytoplasmic sperm injection. Biol Reprod. 68:1341-1347.
Lonergan P, Monagham P, Rizos D, Boland MP, Gordon L. 1994. Effect of follicle size of bovine oocyte quality and developmental competence following maturation, fertilization and cultur in vitro. Mol Reprod Dev 37:48-53.
Machaty Z, Prather RS. 1998. Strategies for activating nuclear transfer oocytes.
Reprod Fertil Dev 10:599-613.
Madgwick S, Jones KT. 2007. How egg arrest at metaphase II: MPF stabilization plus APC/C inhibition equals Cytostatic Factor. Cell Devision 2(4):1-7.
Madgwick S, Levasseur M, Jones KT. 2005. Calmadulin-dependent protein kinase II, and not protein kinase C, is sufficient for triggering cell-cycle resumption in mammalian eggs. J Cell Sci. 118:3849-3859.
Maedomari N, Kikuchi K, Ozawa M, Noguchi J, Ohmuna K, Nakai M, Shino M, Nagai T, Kashiwazaki N. 2007. Cytoplasmic glutathione regulated by cumulus cells during procine oocyte maturation affects fertilization and embryonic development in vitro. Theriogenology. 67:983-993.
Markoulaki S, Matson S, Abbott AL, Ducibella T. 2003. Oscillatory CaMKII activity in mouse egg activation. Dev. Biology. 248:464-474.
Marshall IC, Taylor CW. 1994. Two calcium-binding sites mediate the interconversion of liver inositol 1,4,5-trisphosphate receptors between three conformational states. Biochem J 301:591-598.
Meistrich ML. 1993. Nuclear morphogenesis during spermiogenesis. Di dalam: de Kretser D, editor. Molecular Biology of the Male Reproductive System. USA: Academic Pr. hlm:67-97.
Meo SC, W Yamazaki, CLV Leal, JA de Oliveira, JM Garcia. 2005. Use of strontium for bovine oocyte activation. Theriogenology. 63:2089-2102.
Meo SC, Yamazaki W, Ferreira CR, Perecin F, Saraiva NZ, Leal CLV, Garcia JM. 2007. Parthenogenetic activation of bovine oocytes using single and combined strontium, ionomycin and 6-dimethylaminopurine treatments. Zygote. 15:295-306.
Nagy ZP, Liu J, Joris H, Verheyen G, Tournayr H, Camus M, Derde MC. 1995. The result of intracytoplasmic sperm injection is not related to any of the three basic sperm parameters. Hum Reprod 10:1123-1129.
Okada H, Fujioka H, Tatsumi N, Fujisawa M. 1999. Assisted reproduction for infertile patients with immotile spermatozoa associated with autosomal dominant polystic kidney disease. Hum Reprod 14:110-113.
Otaegui PJ, O`Neill GT, Wilmut I. 1999. Parthenogenetic activation of mouse oocytes by exposure to strontium as a source of cytoplasts for nuclear transfer.
21 Ozil JP. 1990. The parthenogenetic development of rabbit oocytes after repetitive
pulsatile electrical stimulation. Development 109:117-127.
Palermo G, Joris H, Devroey P, Steirteghem ACV. 1992. Pregnancies after intracytoplasmic injection of single spermatozoa into an oocyte. Lancet.
340:17-18.
Pawshe CH, Appa Rao KBC, Jain SK, Totey SM. 1994. Biochemical studies on goat oocytes: timing of nuclear progresian, effect of protein inhibitor and pattern of polypeptide synthesis during in vitro maturation. Theriogenology
42:307-320.
Poccia D. 1986. Remodeling of nucleoproteins during gametogenesis, fertilization and early development. Int Rev Cytol 105:1-65.
Pope CE, Johnson CA, McRae MA, Keller GL, Dresser BL. 1998. Development of embryos produced by intracytoplasmic sperm injection of domestic cat oocytes. Anim Reprod Sci. 53:221-236
Rahman ANMA, Abdullah RB, Wan Khadijah WE. 2008. In vitro maturation of oocytes with special reference to goat: A review. Biotechnology 7(4):599-611. Rogers NT et al. 2004. Phospholipase C causes Ca2+ oscillations and
parthenogenetic activation of human oocytes. Reproduction 128:697-702. Said S, Saili T, Tappa B. 2003. Pengaktifan dan pembuahan oosit tikus setelah
disuntik dengan kepala spermatozoa. Hayati 10:96-99.
Setiadi MA. 2001. Tinjauan mekanisma pemekaran sel-sel cumulus oosit pada kondisi in vivo dan in vitro: Review. Media Veteriner 8(3):66-69.
Sirard MA, Richard F, Blondin P, Robert C. 2006. Contribution of the oocyte to embryo quality. Theriogenology 65:126-136.
Suttner R, Zakhartchenko V, Stojkovic P, Muller S, Alberio R, Medjugorac I, Brem G, Wolf E, Stojkovic M. 2000. Intracytoplasmic sperm injection in bovine: effects of oocyte activation, sperm pretreatment and injection technique.
Theriogenology. 54:935-948.
Syamsuddin M, Larsson B, Rodriguez-Martinez H. 1993. Maturation related changes in bovine oocytes under defferent culture conditions. Anim Reprod
31:49-60.
Tomashov-Matar R, Tchetchik D, Eldar A, Kaplan-Kreicer R, Oron Y, Shalgi R. 2005. Strontium-induced rat egg activation. Reproduction 130:467-474.
Toth S, Huneau D, Banrezes B, Ozil J. 2006. Egg activation is the result of calcium signal summation in the mouse. Reproduction 131:27-34.
Veeck LL. 1988. Oocyte assessment and biological performance. Ann New York Acad Sci 541:259-274.
Wakayama T, Yanagimachi R. 1998. Development of normal mice from oocytes injected with freeze-dried spermatozoa. Nature Biotechnology. 16:639-641. Watson AJ. 2007. Oocyte cytoplasmic maturation: A key mediator of oocyte and
embryo developmental competence. J Anim Sci 85:E1-E2.
Wu H, He CL, Jehn B, Black SJ, Fissore RA. 1998. Partial characterization of the calcium-releasing activity of porcine sperm cytosolic ecracts. Dev Biol
203:369-381.
22
Yanagimachi R. 2005. Intracytoplasmic injection of spermatozoa and spermatozoatogenic cells: its biology and applications in humans and animals.
Reprod. Biomedicine Online (www.rbonline.com) 10(2):247-288.
23
24
Lampiran 1. Medium koleksi oosit sapi
1. DPBS + CaCl2 + MgCl26H2O
DPBS powder Sigma, D5652 1 pak
CaCl2 Merck, 1.02382 0,1 gram
MgCl26H2O Merck, 1.05833 0,1 gram
Milli-Q 1 liter
Cara melarutkan:
1. DPBS powder dimasukkan dalam botol scott 1000 ml, kemudian dilarutkan dengan Milli-Q sebanyak 500 ml.
2. Timbang CaCl2 dan MgCl26H2O dalam Erlenmeyer 100 ml, kemudian dilarutkan dengan Milli-Q sebanyak 50 ml.
3. Gabungkan no. 2 ke dalam no. 1 4. Tambahkan Milli-Q sampai 1 liter
2. Stok Antibiotik (Pen-Strep)
Penicillin G (sigma) Sigma, P7794 0,1275 gram
Streptomisin sulfat Sigma, S6501 0,2000 gram
NaCl fisiologis PT. Widrata Bhakti 2 ml
Cara pembuatan:
1. Semua bahan dicampur dalam satu eppendorf 2,5 ml 2. Penyimpanan pada suhu 50C, selama 1 bulan
3. Medium koleksi oosit
DPBS 97 ml 194 ml
Fetal Bovine Serum (FBS) 3 ml 6 ml
Antibiotik (Pen-Strep) 100 µl 200 µl
Cara pembuatan:
1. Semua bahan dicampur dalam satu botol scott 250 ml
2. Sterilisasi dengan filter 0,2 µm, dan ditempatkan pada botol scott baru 3. Penyimpanan pada suhu 50C, selama 1 bulan
25
1. Semua bahan dicampur dalam satu botol scott 50 ml
2. Difilter dengan filter siringe 0,2 µm, dan ditempatkan pada botol scott baru
3. Penyimpanan pada suhu 50C, selama 1 minggu
4. Medium maturasi dibuat drop pada petri dish 35 mm sebanyak 50 µl (4 - 6 drop), kemudian ditutup mineral oil (Sigma, M8410)
5. Medium maturasi disiapkan dan equilibrasi dalam inkubator pada sore hari sebelum koleksi oosit.
6. Oosit sapi diinkubasi dalam medium maturasi 10-15 oosit / drop selama 24 jam
1. Stok FSH
Cara pembuatan:
a. Kemasan Ovagen 17,6 mg
b. Kebutuhan stok: 17,6 mg / 17,6 ml (pelarut) = 1 µg / µl
c. Aliquot 100 µl (mengandung 100 µg FSH) dalam eppendorf 0,5 ml, simpan pada suhu -200C
d. Dosis pemakaian 100 µl / 10 ml medium maturasi Cara pembuatan:
a. Kemasan 1500 IU
b. Larutkan 1500 IU dengan 1,5 ml pelarut, sehingga diperoleh 1000 IU/ml
c. Aliquot 100 µl (mengandung 100 IU FSH) dalam eppendorf 0,5 ml, simpan pada suhu -200C
d. Dosis pemakaian 100 µl / 10 ml medium maturasi 2. Stok HCG
Cara pembuatan: a. Kemasan 1500 IU
b. Larutkan 1500 IU dengan 1,5 ml pelarut, sehingga diperoleh 1000 IU/ml
c. Aliquot 100 µl (mengandung 100 IU HCG) dalam eppendorf 0,5 ml, simpan pada suhu -200C
26
3. Stok Estradiol Cara pembuatan:
a. Kemasan estradiol 42 mg
b. Kebutuhan stok: 42 mg x 0,025 g (Estradiol yang ditimbang) = 1,05 mg, dilarutkan dalam 1 ml menjadi 1050 µg / 1 ml = 1,05 µg/µl c. Aliquot 10 µl (mengandung 10,5 µg Estradiol) dalam eppendorf 0,5
ml, simpan pada suhu -200C
d. Dosis pemakaian 10 µl / 10 ml medium maturasi 4. Stok Sodium Pyruvate 0,25 mM (1000 kali)
Cara pembuatan:
a. Timbang Sodium Pyruvate: 0,028 gr, kemudian dilarutkan dengan 1 ml Milli-Q
b. Aliquot 100 µl (mengandung 1000 µg Sodium Pyruvate) dalam eppendorf 0,5 ml, simpan pada suhu -200C
27 Lampiran 3. Medium BO (Brackett and Oliphant, 1975)
1. Stok A Medium BO (Brackett and Oliphant, 1975)
NaCl Merck, 1.06404 1,0773 gr
KCl Merck, 1.04936 0,0494 gr
NaH2 PO4.2H2O Merck, 1.06345 0,0210 gr CaCl2.2H2O (terpisah) Merck, 1.02382 0,0543 gr MgCl2.6H2O (terpisah) Merck, 1.05833 0,0174 gr
Phenol red (0,5%) Sigma, P.4633 25 µl
Milli-Q 125 ml
Cara pembuatan:
a. Larutkan semua bahan dalam Erlenmeyer 250 ml, kecuali CaCl2.2H2O dan MgCl2.6H2O dalam Erlenmeyer 50 ml, setelah larut kemudian dicampurkan.
b. Pembuatan stok 0,5% phenol red = 0,025 gr dilarutkan dalam 5 ml H2O. 2. Stok B Medium BO (Brackett and Oliphant, 1975)
NaHCO3 Merck, 1.06329 0,6468 gr
Phenol red (0,5%) Sigma, P.4633 10 µl
Milli-Q 50 ml
Cara pembuatan:
a. Larutkan semua bahan dalam Erlenmeyer 100 ml 3. Medium BO
Stok A medium BO 76 ml
Stok B medium BO 24 ml
Sodium Pyruvate 0,0138 gr
Antibiotik (Pen-Strep) 100 µl
Cara pembuatan:
28
Lampiran 4. Medium kultur Syntetic Oviduk Fluid (SOF)
1. Stok A medium SOF (konsentrasi 10 kali)
NaCl Merck, 1.06404 5,830 gr
KCl Merck, 1.04936 0,534 gr
KH2PO4 Merck, 0,162 gr
MgCl2.6H2O (terpisah) Merck, 1.05833 0,100 gr
Na Lactate (syrup) Merck, 0,616 ml
Glucose Merck, 8342 0,270 gr
Penicillin Sigma, P7794 0,060 gr
Streptomycin Sigma, S6501 0,050 gr
Milli-Q 100 ml
2. Stok B medium SOF (konsentrasi 10 kali)
NaHCO3 Merck, 1.06329 2,101 gr
Phenol red Sigma, P.4633 0,01 gr
Milli-Q 100 ml
3. Stok C medium SOF (konsentrasi 100 kali)
Sodium Pyruvate Gibco, 11840 0,036 gr
Milli-Q 10 ml
4. Stok D medium SOF (konsentrasi 100 kali)
CaCl2.2H2O Merck, 1.02382 0,252 gr
Milli-Q 10 ml
5. Stok E medium SOF (konsentrasi 100 kali)
L-Glutamin Sigma, G-8540 0,146 gr
Milli-Q 10 ml
6. Medium SOFaa (SOF + BSA + Asam Amino)
Stok A 1,0 ml
Stok B 1,0 ml
Stok C 0,1 ml
Stok D 0,1 ml
Stok E 0,1 ml
MEM Non Essensial AA 0,1 ml
BME Essensial AA 0,2 ml
Milli-Q 7,4 ml