PEMANFAATAN AMMONIUM KLORIDA (NH
4Cl)
DAN SODIUM NITRIT (NaNO
2)
DALAM MENGATASI DAMPAK
NEW TANK SYNDROME
SAIFULLAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Pemanfaatan Ammonium klorida (NH4Cl) dan Sodium nitrit (NaNO2) dalam Mengatasi Dampak New Tank
Syndrome adalah karya saya dengan arahan dari Komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2013
ABSTRACT
SAIFULLAH. The Use of Ammonium chloride and Sodium nitrite to avoid new tank syndrome effect. Under direction of KUKUH NIRMALA and IMAN RUSMANA
This research was conducted to evaluate the use of ammonium chloride and sodium nitrite to enhance growth of nitrifying bacteria in order avoiding the new tank syndrome effect. This experiment used two factors of ammonium chloride and sodium nitrite treatment and time to put fish into tank after addition of ammonium chloride and sodium nitrite. The experiment conducted using completely randomized design with three replications. The fish used in this experiment was common carp with initial body weight of 5±0,42 g/fish. Survival rate, total bacteria, ammonia, nitrite, nitrate, pH, temperature, dissolved oxygen and hardness were determined. The result showed that elevated dose of material could increase the number of ammonia oxidizing bacteria (AOB) and nitrite oxidizing bacteria (NOB), even though the increasing did not stand longer. Furthermore there were differences in the survival rates of common carp between timing treatment of putting fish into the tank of three days and six days after ammonium chloride and sodium nitrite treatments. However the treatments have not eliminated all effect of new tank syndrome yet.
RINGKASAN
SAIFULLAH. Pemanfaatan Ammonium klorida (NH4Cl) dan Sodium nitrit
(NaNO2) Dalam Mengatasi Dampak New Tank Syndrome. Dibimbing oleh
KUKUH NIRMALA dan IMAN RUSMANA.
Pemanfaatan akuarium sebagai tempat budidaya ikan, terutama dengan kepadatan yang tinggi seringkali mengalami permasalahan berupa kematian ikan yang baru dimasukkan ke dalam akuarium secara mendadak. Kematian ikan ini biasanya terjadi walaupun kadar oksigen dalam perairan cukup, tanpa ada indikasi serangan penyakit, dan biasanya terjadi pada wadah budidaya yang baru. Kondisi inilah yang dikenal sebagai new tank syndrome. Untuk memecahkan masalah tersebut, maka penelitian dalam mengatasi dampak new tank syndrome melalui pemanfaatan ammonium klorida dan sodium nitrit sebagai sumber energi untuk menumbuhkan bakteri nitrifikasi merupakan hal penting untuk dilaksanakan.
Hasil percobaan menunjukkan peningkatan dosis bahan dapat meningkatkan jumlah bakteri AOB-nya. Jumlah bakteri AOB tertinggi diperlihatkan oleh perlakuan D, diikuti oleh perlakuan C, B dan A dengan nilai masing-masing pada H-3 adalah D1 460 CFU/ml, D2 516,67 CFU/ml, C1 247,67
CFU/ml, C2 264,33 CFU/ml, B1 62 CFU/ml, B2 45,33 CFU/ml, A1 9,8 CFU/ml
dan A2 11,2 CFU/ml.
Sementara itu, untuk tingkat kelangsungan hidup ikan, terdapat perbedaan tingkat kelangsungan hidup dari ikan yang dimasukkan pada H-3 dan H-6. Perbedaan waktu memasukkan ikan berpengaruh terhadap tingkat kelangsungan hidupnya. Ikan yang dimasukkan pada H-3, tingkat kelangsungan hidupnya langsung menurun tajam, sementara ikan yang dimasukkan pada H-6, tingkat kelangsungan hidupnya lebih tinggi sampai beberapa hari, sebelum mengalami penurunan. Tingkat kelangsungan hidup tertinggi diperlihatkan oleh perlakuan A (A1 sampai hari ke-5, sintasannya 22,2% dan perlakuan A2 sampai hari ke-10,
© Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PEMANFAATAN AMMONIUM KLORIDA (NH
4Cl)
DAN SODIUM NITRIT (NaNO
2)
DALAM MENGATASI DAMPAK
NEW TANK SYNDROME
SAIFULLAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul tesis : Pemanfaatan Ammonium klorida (NH4Cl) dan Sodium nitrit (NaNO2) dalam Mengatasi Dampak New Tank Syndrome
Nama : Saifullah NIM : C151100201
Disetujui Komisi Pembimbing
Dr. Ir. Kukuh Nirmala, M.Sc Dr. Ir. Iman Rusmana, M.Si
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Akuakultur
Prof. Dr. Enang Harris Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2011 ini ialah new tank syndrome, dengan judul Pemanfaatan Ammonium klorida dan Sodium nitrit dalam Mengatasi Dampak New Tank Syndrome.
Terima kasih penulis ucapkan kepada Bapak Dr. Kukuh Nirmala dan Bapak Dr. Iman Rusmana selaku pembimbing, Bapak Prof. Dr. Enang Harris dan Ibu Julie Ekasari, S.Pi., M.Sc yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada staf Lab. Lingkungan Departemen Budidaya Perairan, FPIK IPB dan staf Lab. Mikrobiologi Departemen Biologi FMIPA IPB yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas do’a dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Serang pada tanggal 5 Oktober 1981 dari ayah H. Hasyim dan ibu Hj. Huriyah. Penulis merupakan putra keempat dari lima bersaudara.
DAFTAR ISI
Manfaat Penelitian ... 3
Hipotesis ... 3
TINJAUAN PUSTAKA ... 5
New Tank Syndrome ... 5
Bakteri Nitrifikasi ... 6
Ammonium Klorida dan Sodium Nitrit ... 7
BAHAN DAN METODE ... 9
Waktu dan Tempat Penelitian ... 9
Bahan dan Alat ... 9
Rancangan Penelitian ... 9
Prosedur Penelitian ... 11
Penelitian Pendahuluan ... 11
Persiapan Penelitian ... 11
Penelitian Utama ... 11
Parameter yang diamati ... 12
Evaluasi Parameter ... 12
Analisis Data ... 16
HASIL DAN PEMBAHASAN ... 17
Jumlah Bakteri Total ... 17
Gambaran yang Terjadi pada Masing-masing Perlakuan ... 17
Peran Ammonium klorida (NH4Cl) dan Sodium nitrit (NaNO2) Dalam Menambah Bakteri Nitrifikasi ... 27
Pengaruh Pemberian Bahan Ammonium klorida (NH4Cl) dan Sodium nitrit (NaNO2) Terhadap Tingkat Kelangsungan Hidup Ikan ... 29
Parameter Kualitas Air Pendukung ... 31
KESIMPULAN ... 33
DAFTAR PUSTAKA ... 35
DAFTAR TABEL
DAFTAR GAMBAR
Halaman 1 a) Jumlah Bakteri AOB dan NOB b) Konsentrasi Ammonia,
Nitrit dan Nitrat c) Tingkat Kelangsungan Hidup dari Perlakuan A1 ... 18
2 a) Jumlah Bakteri AOB dan NOB b) Konsentrasi Ammonia,
Nitrit dan Nitrat c) Tingkat Kelangsungan Hidup dari Perlakuan A2 ... 19
3 a) Jumlah Bakteri AOB dan NOB b) Konsentrasi Ammonia,
Nitrit dan Nitrat c) Tingkat Kelangsungan Hidup dari Perlakuan B1 ... 20
4 a) Jumlah Bakteri AOB dan NOB b) Konsentrasi Ammonia,
Nitrit dan Nitrat c) Tingkat Kelangsungan Hidup dari Perlakuan B2 ... 21
5 a) Jumlah Bakteri AOB dan NOB b) Konsentrasi Ammonia,
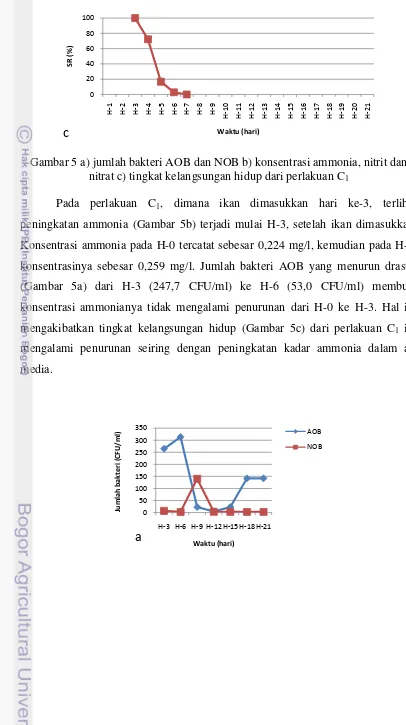
Nitrit dan Nitrat c) Tingkat Kelangsungan Hidup dari Perlakuan C1 ... 23
6 a) Jumlah Bakteri AOB dan NOB b) Konsentrasi Ammonia,
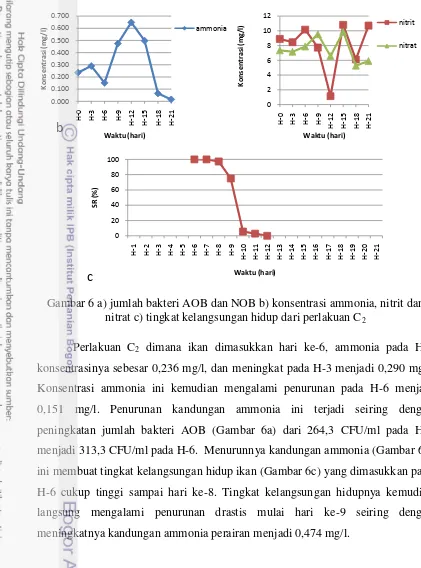
Nitrit dan Nitrat c) Tingkat Kelangsungan Hidup dari Perlakuan C2 ... 24
7 a) Jumlah Bakteri AOB dan NOB b) Konsentrasi Ammonia,
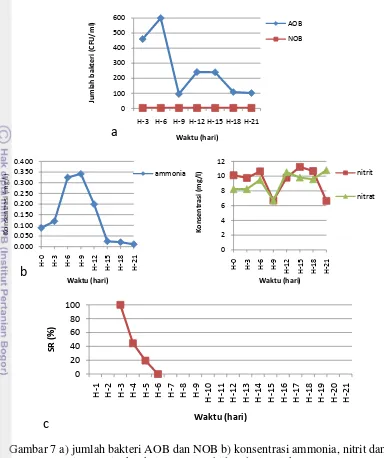
Nitrit dan Nitrat c) Tingkat Kelangsungan Hidup dari Perlakuan D1 ... 25
8 a) Jumlah Bakteri AOB dan NOB b) Konsentrasi Ammonia,
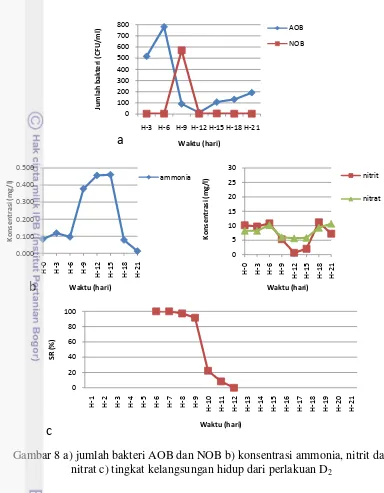
Nitrit dan Nitrat c) Tingkat Kelangsungan Hidup dari Perlakuan D2 ... 26
9 Pertumbuhan Bakteri Nitrifikasi a) AOB dan b) NOB ... 28 10 Tingkat Kelangsungan Hidup dari Masing-masing Perlakuan ... 29 11 Ammonia a) Perlakuan Ikan yang Dimasukkan pada H-3
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar BelakangPemanfaatan akuarium untuk kegiatan budidaya perikanan telah banyak dilakukan, terutama untuk jenis-jenis ikan hias. Semakin terbatasnya lahan untuk budidaya dan kesulitan dalam memperoleh kualitas air yang sesuai, menjadi salah satu alasan dipilihnya akuarium maupun bak untuk kegiatan budidaya. Namun demikian, pemanfaatan akuarium sebagai tempat budidaya ikan, terutama dengan kepadatan yang tinggi seringkali mengalami permasalahan berupa kematian ikan yang baru dimasukkan ke dalam akuarium secara mendadak. Kematian ikan ini biasanya terjadi walaupun kadar oksigen dalam perairan cukup, tanpa ada indikasi serangan penyakit, dan biasanya terjadi pada wadah budidaya yang baru. Kondisi inilah yang dikenal sebagai new tank syndrome. New tank syndrome terjadi pada akuarium atau wadah budidaya yang baru digunakan, dimana kehadiran bakteri nitrifikasi masih dalam jumlah yang sedikit, sementara ammonia yang diekskresikan oleh ikan meningkat ke level toksik. Kondisi tersebut menyebabkan kematian pada ikan, akibat ammonia perairan lebih tinggi daripada dalam tubuh ikan. Hal ini terjadi karena bakteri tersebut tidak dalam jumlah yang cukup untuk berkembang biak ke titik yang mampu bersaing dengan output limbah dari ikan.
2
Tingkat toksisitas ammonia yang dilaporkan dari berbagai penelitian yang telah dilakukan, menunjukkan hasil yang beragam. Avnimelech (2009), melaporkan tingkat toksisitas ammonia berada pada kisaran 1-2 mg/L, tergantung dari jenis ikannya. El-Sherif dan El-Feky (2008), melaporkan bahwa pada benih ikan nila dengan berat rata-rata 19±1,0 g dapat dipelihara pada perairan dengan konsentrasi ammonia antara 0,004 – 0,01 mg/L untuk menghasilkan performa pertumbuhan yang optimal dan tingkat kelangsungan hidup yang tinggi. Sementara itu, Durborow et al. (1997) menyatakan tingkat toksisitas yang menyebabkan kematian dimulai pada konsentrasi 0,6 mg/L. Biswas et al. (2006) menunjukkan paparan terus menerus ammonia pada konsentrasi 0,1 mg/L menyebabkan 100% kematian pada ikan mas (cyprinus carpio) yang diuji.
Ammonia di dalam air terdapat dalam dua bentuk, NH3 (yang tidak
terionisasi) dan NH4+ (terionisasi) atau ammonium. Pada konsentrasi yang sama,
ammonia yang bersifat toksik berasal dari bentuk yang tidak terionisasi (NH3).
Randall dan Tsui (2002) menyatakan ammonia yang masuk ke dalam tubuh organisme berasal dari bentuk yang tidak terionisasi (NH3), dimana proporsi NH3
dan toksisitasnya lebih dipengaruhi oleh pH dibandingkan oleh perubahan tekanan dan suhu. Spotte (1970) juga menyatakan toksisitas ammonia ini terutama dipengaruhi oleh oksigen terlarut dan pH. Pada saat pH perairan lebih tinggi dari pH dari cairan intraseluler (dalam darah), jaringan dengan pH yang lebih rendah (dimana konsentrasi ion H+ lebih banyak) menarik NH3.
Menurut Lovell (1989), aliran NH3 dari sel epithelium insang dapat
terbalik pada saat konsentrasi NH3 air meningkat. Selanjutnya nitrogen ammonia
3
Perumusan Masalah
Ammonia dapat diubah menjadi menjadi nitrat (yang bersifat tidak toksik terhadap organisme akuatik) melalui proses nitrifikasi. Nitrifikasi sendiri merupakan proses oksidasi ammonia menjadi nitrit dan nitrat yang dilakukan oleh bakteri AOB (ammonia oxidizing bacteria) dan NOB (nitrite oxidizing bacteria). Jenis bakteri yang berperan dalam nitrifikasi diantaranya adalah Nitrosomonas
dan Nitrobacter. Kedua jenis bakteri tersebut merupakan bakteri kemotrofik, yaitu bakteri yang mendapatkan energi dari proses kimiawi (Effendi, 2003). New tank syndrome disebabkan karena belum tumbuhnya bakteri nitrifikasi pada wadah budidaya, sehingga keadaan tersebut membuat ikan mengalami kematian akibat level ammonia yang membuat stres yang tinggi pada ikan atau mencapai tingkat toksik.
Pendekatan masalah yang dilakukan dalam penelitian ini adalah dengan memberikan sumber energi bagi bakteri nitrifikasi, diharapkan bakteri nitrifikasi tersebut dapat tumbuh secara mapan sehingga mampu mengubah ammonia menjadi nitrit dan nitrit menjadi nitrat. Menurut Dwidjoseputro (2010), kebutuhan bakteri nitrifikasi akan nitrogen diperoleh dari ion-ion NH4+ dan NO2-. Selain itu,
menurut Durborow et al. (1997) menjaga kelarutan oksigen tetap tinggi melalui aerasi dapat mengurangi toksisitas ammonia.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji pengaruh penambahan ammonium klorida dan sodium nitrit dalam mengatasi dampak new tank syndrome
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi solusi alternatif dalam mengatasi new tank syndrome yang mudah untuk diaplikasikan
Hipotesis
5
TINJAUAN PUSTAKA
New Tank Syndrome
New tank syndrome biasanya terjadi pada akuarium, yang umum digunakan sebagai wadah budidaya untuk ikan hias. Hal ini yang membuat istilah
new tank syndrome lebih dikenal pada budidaya ikan hias. New tank syndrome
adalah sindrom yang digambarkan dengan kematian ikan yang terjadi secara massal pada wadah yang baru digunakan karena belum sepenuhnya mapan (not yet fully cycled), sementara akumulasi ammonia di wadah tersebut mencapai konsentrasi yang mematikan bagi ikan.
Umumnya new tank syndrome terjadi pada kepadatan ikan yang tinggi yang menggunakan wadah budidaya yang baru, tanpa ada indikasi serangan penyakit dan terjadi walaupun kadar oksigen dalam perairan cukup. Ketiadaan koloni bakteri nitrifikasi membuat konsentrasi ammonia (yang terutama diekskresikan oleh ikan) meningkat ke level toksik. Namun new tank syndrome ini dapat pula terjadi pada wadah yang telah lama digunakan. Selain karena ketiadaan bakteri nitrifikasi, juga akibat dari pemberian pakan yang berlebih atau kepadatan ikan yang sangat tinggi.
Ammonia dalam budidaya perikanan terutama berasal dari limbah metabolisme yang diekskresikan oleh ikan. Ammonia yang bersifat toksik berasal dari bentuk yang tidak terionisasi (NH3). Spotte (1970) menyatakan ammonia
yang tidak terionisasi (NH3) yang tampaknya menjadi racun bagi organisme
perairan. Hal ini dimungkinkan karena NH3 dapat melewati jaringan penghalang
(tissue barriers). Pada saat pH perairan lebih tinggi dari pH dari cairan intraseluler (dalam darah), jaringan dengan pH yang lebih rendah (dimana konsentrasi ion H+ lebih banyak) menarik NH3.
Tingkat toksisitas ammonia terutama dipengaruhi oleh pH dan oksigen terlarut (Spotte, 1970). Pada perairan dengan pH yang lebih tinggi, jumlah ammonia (NH3) yang terdapat pada perairan itu juga cenderung lebih tinggi. Pada
saat konsentrasi NH3 air meningkat, aliran NH3 dari sel epithelium insang dapat
6
Merkens dan Downing (1957) melakukan penelitian terhadap ikan air tawar dalam rangka menguji hubungan toksisitas ammonia dengan kandungan oksigen terlarut. Hasil penelitiannya menunjukkan adanya peningkatan toksisitas ammonia seiring dengan menurunnya kandungan oksigen terlarut di air. Durborow et al. (1997) menyatakan kadar oksigen terlarut yang tinggi dapat meningkatkan aktivitas bakteri aerobik sehingga berdampak terhadap penurunan kadar TAN di perairan. Hal ini juga diperkuat oleh Camargo dan Alonso (2006) yang menyatakan reduksi nilai oksigen terlarut di perairan dapat meningkatkan resiko ikan terhadap toksisitas ammonia.
Bakteri Nitrifikasi
Nitrifikasi merupakan proses oksidasi ammonia menjadi nitrit dan nitrat yang dilakukan oleh bakteri AOB (ammonia oxidizing bacteria) dan NOB (nitrite oxidizing bacteria). Kedua kelompok bakteri ini secara umum digolongkan sebagai bakteri kemoautotrof, karena kemampuannya memanfaatkan energi dari bahan anorganik (Hagopian dan Riley, 1998).
Tahapan proses nitrifikasi (Boyd, 1979), digambarkan sebagai berikut : NH4+ + 1,5O2 NO2- + 2H+ + H2O (1)
NO2- + 0,5O2 NO3- (2)
NH4+ + 2O2 NO3- + 2H+ + H2O (keseluruhan tahapan)
Tahap pertama disebut nitritation (Rheinheimer, 1991) yang dilakukan oleh bakteri AOB dan tahap kedua disebut nitratation (Rheinheimer, 1991) oleh bakteri NOB. Organisme ini, membutuhkan substrat anorganik (NH4 dan NO2)
sebagai sumber energi dan menggunakan karbon dioksida sebagai sumber karbonnya (Spotte, 1970; Boyd, 1979). Hasil dari metabolisme AOB adalah nitrit, dan hasil dari metabolisme NOB adalah nitrat.
Avnimelech (2009) menyatakan proses nitrifikasi dipengaruhi oleh beragam parameter, diantaranya adalah konsentrasi oksigen terlarut. Jika konsentrasi oksigen berkurang, NH4 masih dapat dioksidasi, namun NO2 dapat
7
Ammonium klorida dan Sodium nitrit
Ammonium klorida (NH4Cl) adalah garam yang tidak berwarna dan
mudah larut dalam air. Ammonium klorida merupakan bahan anorganik yang dapat dijadikan sumber energi bagi bakteri nitrifikasi. Di dunia pertanian, ammonium klorida merupakan sumber nitrogen dalam pupuk. Sodium nitrit merupakan bahan anorganik dengan rumus kimia NaNO2. Warnanya putih hingga
kekuningan dan mudah larut dalam air. Selain itu, bahan ini bersifat higroskopik. Sebagai bahan anorganik, ammonium klorida dan sodium nitrit dapat digunakan sebagai sumber energi bagi bakteri nitrifikasi kemoautotrof. Bakteri kemotrof mendapatkan sumber energinya dari oksidasi senyawa anorganik (Pelczar dan Chan, 2008). Dwidjoseputro (2010) dan Boyd (1979) menyatakan bahwa kebutuhan bakteri nitrifikasi akan nitrogen diperoleh dari ion-ion NH4 dan
9
BAHAN DAN METODE
Waktu dan TempatPenelitian ini dilaksanakan pada bulan November 2011 – Mei 2012 di Laboratorium Lingkungan Departemen Budidaya Perairan FPIK IPB Bogor. Analisa parameter perlakuan dilakukan di lab. Lingkungan Departemen Budidaya Perairan FPIK dan lab. Mikrobiologi Departemen Biologi FMIPA Institut Pertanian Bogor.
Bahan dan Alat
Bahan ammonium klorida dan sodium nitrit yang digunakan dalam penelitian ini diperoleh dari PT. Brataco Bogor. Bahan lain yang dibutuhkan adalah kalsium karbonat dan bioball. Ikan uji yang digunakan dalam penelitian ini adalah ikan mas, dengan berat rata-rata 5±0,42 g/ekor. Ikan mas yang digunakan berasal dari satu induk yang diperoleh dari pembudidaya ikan mas di Bogor. Pakan yang diberikan merupakan pakan komersial untuk ikan mas. Wadah percobaan menggunakan akuarium sebanyak 24 buah dengan dimensi 20x20x20 cm3 dan diisi air sebanyak 4 liter.
Rancangan Penelitian
Metode yang digunakan dalam penelitian ini adalah metode eksperimen dengan menggunakan pola Rancangan Acak Lengkap (RAL) Faktorial dengan perlakuan kombinasi bahan (NH4Cl & NaNO2) dengan dosis berbeda dan
perbedaan waktu inkubasi sebelum ikan dimasukkan. Dosis bahan (NH4Cl &
NaNO2) yang digunakan mengacu pada dosis yang disarankan oleh Forteath
(1993). Lama pengamatan perlakuan adalah 21 hari. Faktor A :
Perlakuan A : Tanpa penambahan ammonium klorida dan sodium nitrit (kontrol)
Perlakuan B : Dosis ammonium klorida dan sodium nitrite (23 mg/l dan 37 mg/l)
10
Perlakuan D : Dosis ammonium klorida dan sodium nitrit (92 mg/l dan 148 mg/l)
Faktor B :
Perlakuan 1 : ikan dimasukkan tiga hari setelah bahan dimasukkan Perlakuan 2 : ikan dimasukkan enam hari setelah bahan dimasukkan
Maka kombinasi perlakuannya adalah :
A1 : Tanpa penambahan ammonium klorida dan sodium nitrit, ikan dimasukkan tiga hari setelah bahan dimasukkan
A2 : Tanpa penambahan ammonium klorida dan sodium nitrit, ikan dimasukkan enam hari setelah bahan dimasukkan
B1 : Dosis ammonium klorida dan sodium nitrite (23 mg/l dan 37 mg/l), ikan dimasukkan tiga hari setelah bahan dimasukkan
B2 : Dosis ammonium klorida dan sodium nitrite (23 mg/l dan 37 mg/l), ikan dimasukkan enam hari setelah bahan dimasukkan
C1 : Dosis ammonium klorida dan sodium nitrite (46 mg/l dan 74 mg/l), ikan dimasukkan tiga hari setelah bahan dimasukkan
C2 : Dosis ammonium klorida dan sodium nitrite (46 mg/l dan 74 mg/l), ikan dimasukkan enam hari setelah bahan dimasukkan
D1 : Dosis ammonium klorida dan sodium nitrit (92 mg/l dan 148 mg/l), ikan dimasukkan tiga hari setelah bahan dimasukkan
D2 : Dosis ammonium klorida dan sodium nitrit (92 mg/l dan 148 mg/l), ikan dimasukkan enam hari setelah bahan dimasukkan
11
βj = pengaruh kelompok ke-j
εijk = pengaruh acak pada perlakuan ke-i dan kelompok ke-j
Prosedur Penelitian Penelitian Pendahuluan
Penelitian pendahuluan dilakukan dengan tujuan untuk melihat efek bahan (ammonium klorida dan sodium nitrit) yang akan digunakan terhadap ikan uji. Penelitian pendahuluan ini juga dilakukan untuk penentuan padat tebar ikan yang akan digunakan.
Persiapan Penelitian
Ikan mas yang akan digunakan sebagai ikan uji, diaklimatisasi terlebih dahulu sebelum diberi perlakuan. Akuarium yang akan digunakan dicuci bersih dan dikeringkan. Air dari bak tandon yang akan digunakan disiapkan selang beberapa hari sebelum penelitian dimulai. Selain itu, air dari bak tandon ini juga tidak dikaporit atau diberi tawas untuk mencegah ketiadaan bakteri. Bioball yang akan digunakan diaktifasi terlebih dahulu agar dapat menjadi substrat bagi pertumbuhan bakteri nitrifikasi menggunakan ammonium klorida (46 mg/l) dan sodium nitrit (73 mg/l) mengacu pada dosis yang disarankan oleh Forteath (1993). Sehari sebelum penelitian dimulai, air dimasukkan kedalam akuarium penelitian diberi aerasi untuk meningkatkan kadar oksigen terlarut dalam air, ditambahkan CaCO3, dan bioball yang telah diaktifasi.
Penelitian Utama
12
Parameter yang Diamati
Parameter yang diamati adalah jumlah bakteri, ammonia, nitrit, nitrat, pH, suhu, oksigen terlarut, kesadahan dan tingkat kelangsungan hidup.
Evaluasi Parameter Parameter Pengamatan
1. Jumlah Bakteri Total
Penghitungan jumlah total bakteri dilakukan dengan menggunakan Metode Plate Count (MPC). Sampel air yang diuji total bakterinya dicuplik sebanyak 100 mL, kemudian dipipet sebanyak 0,1 mL dan dilakukan pengenceran hingga 107 sehingga diperoleh 7 tabung sampel yang akan diuji total bakterinya. Sampel dari masing-masing tabung diambil sebanyak 100µL dan disebarkan dalam cawan petri yang mengandung media TSA. Setelah itu sampel diinkubasikan selama 48 jam dengan suhu 25oC. Total bakteri dihitung dengan menggunakan rumus : Total bakteri = faktor pengencer x ∑koloni
2. Jumlah bakteri AOB dan NOB
Metode yang digunakan untuk menghitung kelimpahan bakteri penghasil senyawa amonium dan nitrit adalah metode Most Probable Number (MPN). Sampel yang akan diuji dibuat dalam 10 seri tabung pengenceran. Setiap 1 mL sampel pengenceran diinokulasikan ke dalam tabung tiga seri untuk diinkubasikan. Kelimpahan bakteri dihitung berdasarkan nilai pada Tabel MPN (USFDA Bacterial Analytical Manual).
Media yang digunakan untuk bakteri nitrifikasi adalah:
Media AOB / Ammonium Oxidizing Bacterium (Bhaskar & Charluyu, 2005) :
(NH4)2SO4 0,235 g
KH2PO4 0,2 g
13
MgSO4.7H2O 0,04 g
FeSO4.7H2O 0,005 g
NaEDTA.7H2O 0,005 g
Air distilasi 1000 ml
Media ini dipanaskan, kemudian dimasukkan ke dalam test tube masing-masing 9ml, selanjutnya disterilisasi di dalam autoclave. Pertumbuhan bakteri AOB dikonfirmasi dengan perubahan warna dari putih bening menjadi merah (pink) setelah ditetesi reagen sulfanilamid dan NED.
Media NOB / Nitrite Oxidizing Bacterium (Bhaskar & Charluyu, 2005) :
NaNO2 0,06 g
Air distilasi 1000 ml
Media ini dipanaskan, kemudian dimasukkan ke dalam test tube masing-masing 9ml, selanjutnya disterilisasi di dalam autoclave. Pertumbuhan bakteri NOB dikonfirmasi dengan tidak terjadinya perubahan warna media setelah ditetesi reagen sulfanilamid dan NED.
3. Ammonia
14
nitrogen, dibuat grafik atau persamaan regresi dari larutan standar. Konsentrasi ammonia tak terionisasi (NH3) dihitung dengan mengkalikan
dengan faktor konversi (pada Tabel ammonia).
4. Nitrit
Kadar nitrit diukur dengan menggunakan metode Sulfanilamide (APHA 1989). Sampel air sebanyak 10 mL dimasukkan ke dalam gelas piala. Teteskan sulfanilamide sebanyak 0,2 mL (±4 tetes), lalu biarkan selama 2-4 menit. Tambahkan 0,2 mL (±4 tetes) NED, aduk sampai homogen. Kemudian dibuat larutan blanko dari 10 mL akuades. Nilai absorbansi diukur dengan spektrofotometer pada panjang gelombang 543 nm. Untuk menentukan konsentrasi nitrit nitrogen, dibuat grafik atau persamaan regresi dari larutan standar.
Kosentrasi nitrit diperoleh dengan rumus : NO2- (mg/L) = [NO2-N] x 3,28
5. Nitrat
Pengukuran kadar nitrat menggunakan metode Reduksi Cadmium (APHA 1989). Sampel diambil sebanyak 25 mL, ditambah 75 mL larutan NH4Cl-EDTA dan campuran. Kemudian campuran sampel dituangkan ke
dalam kolom dan mulai dikumpulkan pada tingkat 7-10 mL/menit. Sebanyak 25 mL yang pertama dibuang, sisanya dikumpulkan di botol sampel. Reagen warna sebanyak 2,0 mL ditambahkan untuk 50 mL sampel dan campuran. Setelah itu, dibuat satu seri larutan standar. Nilai absorbansinya diukur pada panjang gelombang 543 nm terhadap reagen akuades. Bandingkan setidaknya satu NO2- standar untuk mereduksi NO3
-standar pada konsentrasi yang sama untuk memverifikasi efisiensi kolom reduksi. Lalu dibuat kurva standar dengan memplotkan absorbansi standar terhadap konsentrasi NO3-N. Konsentrasi sampel dihitung langsung dari
15
6. pH
Pengukuran pH dilakukan in situ dengan menggunakan pHmeter.
7. Suhu
Pengukuran suhu dilakukan in situ dengan menggunakan Thermometer.
8. Oksigen Terlarut
Pengukuran kandungan oksigen terlarut dilakukan in situ dengan menggunakan DOmeter.
9. Kesadahan Ca2+
Kesadahan Ca2+ diukur dengan menggunakan metode titrasi. Sampel sebanyak 100 mL dimasukkan ke dalam erlenmeyer, ditambah 4 mL NaOH 1N, aduk, tambahkan 0,1 – 0,2 g murexide, aduk. Kemudian titrasi dengan Na-EDTA hingga terjadi perubahan warna dari merah (pink) ke ungu. Nilai kesadahan dihitung menggunakan rumus :
10.Tingkat Kelangsungan Hidup (Sintasan)
Tingkat kelangsungan hidup ikan diketahui dengan membandingkan jumlah ikan yang hidup di awal penelitian dengan jumlah ikan yang tersisa di akhir penelitian. Tingkat kelangsungan hidup dihitung berdasarkan rumus :
16
Analisis Data
17
HASIL DAN PEMBAHASAN
Jumlah bakteri total
Tabel 1 menunjukkan hasil penghitungan jumlah bakteri total yang dilakukan terhadap sampel air sebelum diberi perlakuan. Pada penelitian ini diupayakan untuk tidak menambahkan inokulasi bakteri dari luar ke dalam akuarium uji. Dalam rangka mendukung hal tersebut, dilakukan pengujian jumlah bakteri total terhadap air tandon untuk mengetahui jumlah koloni bakterinya.
Tabel 1 Jumlah bakteri total
Sampel Jumlah Koloni Bakteri
(CFU/ml)
Air Tandon 5,2x101
Hasil pengujian menunjukkan jumlah koloni bakteri awal yang terdapat pada air tandon sebesar 5,2 x 101 CFU/ml (Tabel 1). Keberadaan bakteri ini, meskipun dalam jumlah yang kecil, menjadi modal untuk mengatasi dampak new tank syndrome melalui penambahan bahan kimia tertentu yang dapat dijadikan sebagai sumber energi bagi pertumbuhannya. Rendahnya kandungan bahan organik yang terdapat di air tandon membuat jumlah bakterinya juga rendah. Selain ketersediaan bahan organik, menurut Hogg (2005) keberadaan bakteri pada lingkungan perairan dipengaruhi juga oleh keberadaan oksigen dan cahaya.
Gambaran yang terjadi pada masing-masing perlakuan
18
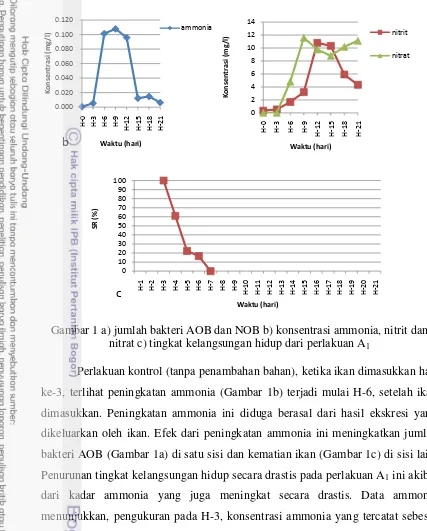
Gambar 1 a) jumlah bakteri AOB dan NOB b) konsentrasi ammonia, nitrit dan nitrat c) tingkat kelangsungan hidup dari perlakuan A1
Perlakuan kontrol (tanpa penambahan bahan), ketika ikan dimasukkan hari ke-3, terlihat peningkatan ammonia (Gambar 1b) terjadi mulai H-6, setelah ikan dimasukkan. Peningkatan ammonia ini diduga berasal dari hasil ekskresi yang dikeluarkan oleh ikan. Efek dari peningkatan ammonia ini meningkatkan jumlah bakteri AOB (Gambar 1a) di satu sisi dan kematian ikan (Gambar 1c) di sisi lain. Penurunan tingkat kelangsungan hidup secara drastis pada perlakuan A1 ini akibat
19
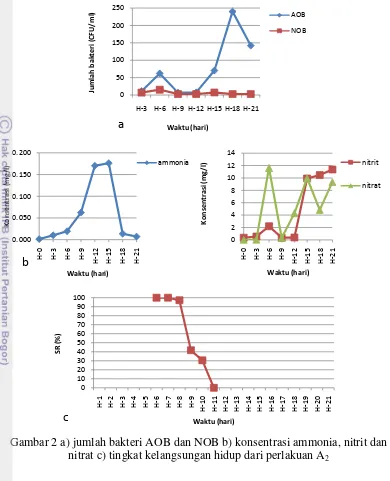
Gambar 2 a) jumlah bakteri AOB dan NOB b) konsentrasi ammonia, nitrit dan nitrat c) tingkat kelangsungan hidup dari perlakuan A2
Ketika ikan dimasukkan hari ke-6 pada perlakuan kontrol (tanpa penambahan bahan), terlihat peningkatan ammonia (Gambar 2b) terjadi mulai H-9, setelah ikan dimasukkan. Peningkatan ammonia ini diduga berasal dari hasil ekskresi yang dikeluarkan oleh ikan. Efek dari peningkatan ammonia ini meningkatkan jumlah bakteri AOB (Gambar 2a) di satu sisi dan kematian ikan (Gambar 2c) di sisi lain. Tingkat kelangsungan hidup dari perlakuan A2 ini
20
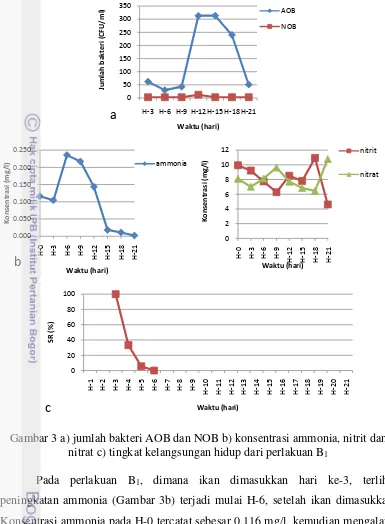
Gambar 3 a) jumlah bakteri AOB dan NOB b) konsentrasi ammonia, nitrit dan nitrat c) tingkat kelangsungan hidup dari perlakuan B1
Pada perlakuan B1, dimana ikan dimasukkan hari ke-3, terlihat
peningkatan ammonia (Gambar 3b) terjadi mulai H-6, setelah ikan dimasukkan. Konsentrasi ammonia pada H-0 tercatat sebesar 0,116 mg/l, kemudian mengalami penurunan pada H-3, yaitu 0,104 mg/l. Setelah ikan dimasukkan, tercatat kandungan ammonianya meningkat menjadi 0,235 mg/l (H-6). Peningkatan ammonia ini diduga berasal dari hasil ekskresi yang dikeluarkan oleh ikan. Tingginya kandungan ammonia awal sebagai akibat dari penambahan ammonium klorida dan sodium nitrit, meningkatkan jumlah bakteri AOB di awal. Jumlah bakteri AOB ini kemudian mengalami penurunan pada H-6, setelah konsentrasi
21
ammonia pada H-3 mengalami penurunan. Efek dari peningkatan ammonia dari H-3 ke H-6 meningkatkan jumlah bakteri AOB (Gambar 3a) di satu sisi juga menyebabkan kematian ikan (Gambar 3c) di sisi lain. Tingkat survival rate dari perlakuan B1 ini mengalami penurunan seiring dengan peningkatan kadar
ammonia dalam air media.
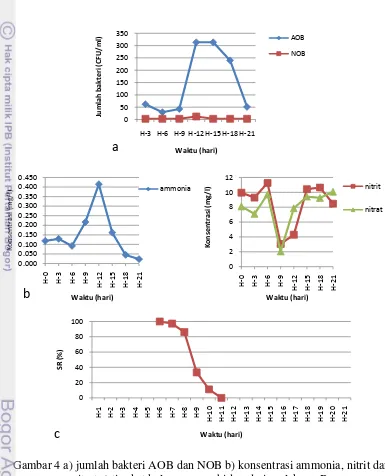
Gambar 4 a) jumlah bakteri AOB dan NOB b) konsentrasi ammonia, nitrit dan nitrat c) tingkat kelangsungan hidup dari perlakuan B2
Perlakuan B2 dimana ikan dimasukkan hari ke-6, terlihat peningkatan
22
kembali mengalami penurunan pada H-6 (0,092 mg/l). Tingginya kandungan ammonia awal sebagai akibat dari penambahan ammonium klorida dan sodium nitrit, meningkatkan jumlah bakteri AOB di awal. Jumlah bakteri AOB ini mengalami penurunan pada H-6, akibat konsentrasi ammonia pada H-6 mengalami penurunan. Peningkatan ammonia yang kembali terjadi pada H-9 memberikan dampak tersendiri. Efek dari peningkatan ammonia ini meningkatkan jumlah bakteri AOB (Gambar 4a) di satu sisi juga menyebabkan kematian ikan (Gambar 4c) di sisi lain. Tingginya tingkat kelangsungan hidup mulai dari ke-6 (ketika ikan dimasukkan) sampai hari ke-8 terjadi karena terjadi penurunan kandungan ammonia pada H-6. Meningkatnya konsentrasi ammonia pada H-9 yaitu sebesar 13,522 mg/l, diduga menjadi penyebab penurunan tingkat survival rate-nya. Hal ini diperparah lagi karena pada H-12, konsentrasi ammonia tercatat sebesar 25,898 mg/l. Tingkat survival rate dari perlakuan B2 ini mengalami
penurunan seiring dengan peningkatan kadar ammonia dalam air media.
23
Gambar 5 a) jumlah bakteri AOB dan NOB b) konsentrasi ammonia, nitrit dan nitrat c) tingkat kelangsungan hidup dari perlakuan C1
Pada perlakuan C1, dimana ikan dimasukkan hari ke-3, terlihat
peningkatan ammonia (Gambar 5b) terjadi mulai H-3, setelah ikan dimasukkan. Konsentrasi ammonia pada H-0 tercatat sebesar 0,224 mg/l, kemudian pada H-3, konsentrasinya sebesar 0,259 mg/l. Jumlah bakteri AOB yang menurun drastis (Gambar 5a) dari H-3 (247,7 CFU/ml) ke H-6 (53,0 CFU/ml) membuat konsentrasi ammonianya tidak mengalami penurunan dari H-0 ke H-3. Hal ini mengakibatkan tingkat kelangsungan hidup (Gambar 5c) dari perlakuan C1 ini
24
Gambar 6 a) jumlah bakteri AOB dan NOB b) konsentrasi ammonia, nitrit dan nitrat c) tingkat kelangsungan hidup dari perlakuan C2
Perlakuan C2 dimana ikan dimasukkan hari ke-6, ammonia pada H-0
konsentrasinya sebesar 0,236 mg/l, dan meningkat pada H-3 menjadi 0,290 mg/l. Konsentrasi ammonia ini kemudian mengalami penurunan pada H-6 menjadi 0,151 mg/l. Penurunan kandungan ammonia ini terjadi seiring dengan peningkatan jumlah bakteri AOB (Gambar 6a) dari 264,3 CFU/ml pada H-3 menjadi 313,3 CFU/ml pada H-6. Menurunnya kandungan ammonia (Gambar 6b) ini membuat tingkat kelangsungan hidup ikan (Gambar 6c) yang dimasukkan pada H-6 cukup tinggi sampai hari ke-8. Tingkat kelangsungan hidupnya kemudian langsung mengalami penurunan drastis mulai hari ke-9 seiring dengan meningkatnya kandungan ammonia perairan menjadi 0,474 mg/l.
25
Gambar 7 a) jumlah bakteri AOB dan NOB b) konsentrasi ammonia, nitrit dan nitrat c) tingkat kelangsungan hidup dari perlakuan D1
Pada perlakuan D1, dimana ikan dimasukkan hari ke-3, terlihat
peningkatan ammonia (Gambar 7b) terjadi mulai H-3, setelah ikan dimasukkan. Konsentrasi ammonia pada H-0 tercatat sebesar 0,088 mg/l, kemudian pada H-3, konsentrasinya sebesar 0,119 mg/l. Jumlah bakteri AOB (Gambar 7a) yang menurun drastis dari H-6 (600 CFU/ml) ke H-9 (95,3 CFU/ml) membuat konsentrasi ammonia pada H-6 (0,324 mg/l) meningkat menjadi 0,341 mg/l pada H-9. Hal ini mengakibatkan tingkat kelangsungan hidup (Gambar 7c) dari perlakuan D1 ini mengalami penurunan yang drastis seiring dengan kadar
ammonia yang juga meningkat secara drastis dalam perlakuan ini.
26
Gambar 8 a) jumlah bakteri AOB dan NOB b) konsentrasi ammonia, nitrit dan nitrat c) tingkat kelangsungan hidup dari perlakuan D2
Perlakuan D2 dimana ikan dimasukkan hari ke-6, terlihat peningkatan
27
mengakibatkan ammonia meningkat kembali. Efek dari peningkatan ammonia ini menyebabkan kematian ikan (Gambar 8c). Meningkatnya konsentrasi ammonia pada H-9 yaitu sebesar 0,378 mg/l, diduga menjadi penyebab penurunan sintasannya. Hal ini diperparah lagi karena pada H-12, konsentrasi ammonia tercatat sebesar 0,456 mg/l. Tingkat kelangsungan hidup dari perlakuan D2 ini
mengalami penurunan seiring dengan peningkatan kadar ammonia dalam air media.
Peran ammonium klorida (NH4Cl) dan sodium nitrit (NaNO2) dalam menambah bakteri nitrifikasi
Pemberian ammonium klorida dan sodium nitrit sebagai sumber energi bagi bakteri nitrifikasi dalam penelitian ini dapat menambah jumlah bakteri AOB dari perlakuan B, C dan D. Tanpa penambahan bakteri, menurut Perfettini dan Bianchi (1990), dibutuhkan waktu sampai 40 hari untuk membuat komunitas bakteri nitrifikasi menjadi mapan. Penggunaan ammonium klorida dan sodium nitrit dengan dosis masing-masing 46 mg/L dan 73 mg/L membutuhkan waktu 20 hari untuk membuat bakteri tumbuh secara mapan pada biofilter (Forteath, 1993). Waktu yang dibutuhkan untuk membuat bakteri nitrifikasi mapan menjadi lebih pendek ketika diberikan inokulan bakteri dan sumber energi bagi bakteri tersebut untuk tumbuh. Grommen et al. (2002) menunjukkan hanya dibutuhkan waktu beberapa hari untuk membuat bakteri tumbuh secara mapan dan mampu mengoksidasi ammonia.
Hovanec dan DeLong (1996) menyatakan bakteri AOB dan NOB membutuhkan aerasi yang cukup dan sumber energi (ammonia/nitrit) untuk dapat tumbuh secara mapan (established). Sebagaimana terlihat dari Gambar 9, grafik pertumbuhan bakteri AOB tertinggi diperlihatkan oleh perlakuan D (dosis NH4Cl
dan NaNO2 masing-masing 92 dan 148 mg/L), diikuti oleh perlakuan C (46 dan
28
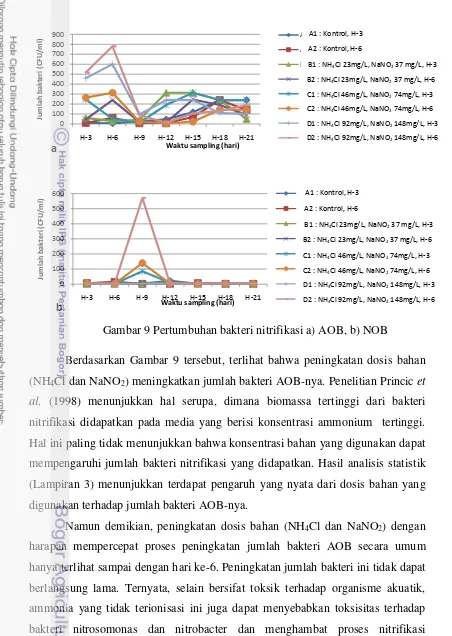
Gambar 9 Pertumbuhan bakteri nitrifikasi a) AOB, b) NOB
Berdasarkan Gambar 9 tersebut, terlihat bahwa peningkatan dosis bahan (NH4Cl dan NaNO2) meningkatkan jumlah bakteri AOB-nya. Penelitian Princic et
al. (1998) menunjukkan hal serupa, dimana biomassa tertinggi dari bakteri nitrifikasi didapatkan pada media yang berisi konsentrasi ammonium tertinggi. Hal ini paling tidak menunjukkan bahwa konsentrasi bahan yang digunakan dapat mempengaruhi jumlah bakteri nitrifikasi yang didapatkan. Hasil analisis statistik (Lampiran 3) menunjukkan terdapat pengaruh yang nyata dari dosis bahan yang digunakan terhadap jumlah bakteri AOB-nya.
Namun demikian, peningkatan dosis bahan (NH4Cl dan NaNO2) dengan
harapan mempercepat proses peningkatan jumlah bakteri AOB secara umum hanya terlihat sampai dengan hari ke-6. Peningkatan jumlah bakteri ini tidak dapat berlangsung lama. Ternyata, selain bersifat toksik terhadap organisme akuatik, ammonia yang tidak terionisasi ini juga dapat menyebabkan toksisitas terhadap bakteri nitrosomonas dan nitrobacter dan menghambat proses nitrifikasi (Anthonisen et al. 1976; Russo, 1985). Selain hal itu, ketersediaan media substrat dalam jumlah yang cukup turut berperan dalam proses peningkatan jumlah bakteri
29
yang diharapkan. Pertumbuhan bakteri nitrifikasi, menurut Mc Carty dan Haug (1971) dipengaruhi oleh keberadaan senyawa toksik, suhu, pH, kandungan oksigen terlarut, salinitas dan substrat untuk menempelnya bakteri.
Tingginya jumlah bakteri AOB di awal penelitian juga tidak dapat langsung menurunkan ammonia pada media pemeliharaan. Mota et al. (2005) menyatakan bahwa efisiensi penurunan ammonia tidak hanya berasosiasi dengan tingginya jumlah bakteri AOB atau keragamanan bakterinya. Kondisi bakteri yang belum mapan inilah yang diduga menjadi penyebab tidak efektifnya penurunan ammonia pada media pemeliharaan. Padahal, kasus new tank syndrome sendiri terjadi karena ammonia yang mencapai level toksik sementara bakteri nitrifikasi belum tumbuh pada wadah budidayanya.
Pengaruh pemberian bahan ammonium klorida (NH4Cl) dan sodium nitrit (NaNO2) dan perbedaan waktu inkubasi sebelum ikan dimasukkan
terhadap tingkat kelangsungan hidup ikan
Harapan untuk mengatasi dampak new tank syndrome dengan cara menumbuhkan bakteri nitrifikasi melalui penambahan ammonium klorida dan sodium nitrit dalam penelitian ini belum sepenuhnya berhasil dilakukan. Penambahan bahan (NH4Cl dan NaNO2) belum dapat menumbuhkan bakteri
nitrifikasi dalam jumlah yang mapan untuk mengurangi ammonia dalam waktu yang cepat. Dampak new tank syndrome yang terjadi pada perlakuan A (yang ditandai dengan penurunan SR dengan cepat), belum dapat diatasi dengan penambahan ammonium klorida dan sodium nitrit. Tingkat kelangsungan hidup dari perlakuan B, C dan D tidak jauh berbeda dengan perlakuan A (Gambar 10).
Gambar 10 Tingkat kelangsungan hidup dari masing-masing perlakuan
30
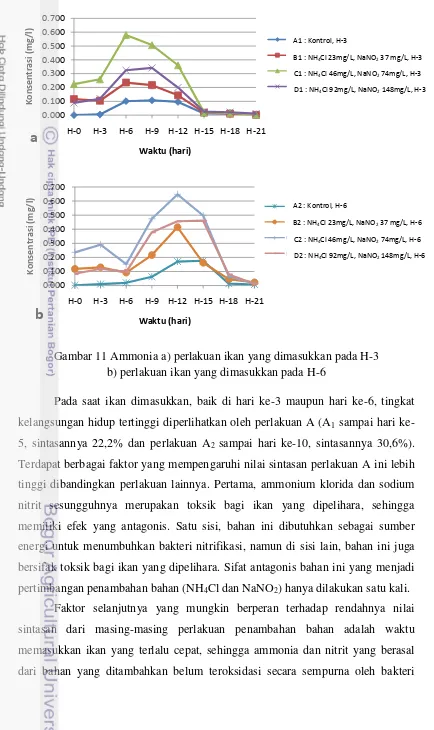
Gambar 11 Ammonia a) perlakuan ikan yang dimasukkan pada H-3 b) perlakuan ikan yang dimasukkan pada H-6
Pada saat ikan dimasukkan, baik di hari ke-3 maupun hari ke-6, tingkat kelangsungan hidup tertinggi diperlihatkan oleh perlakuan A (A1 sampai hari
ke-5, sintasannya 22,2% dan perlakuan A2 sampai hari ke-10, sintasannya 30,6%).
Terdapat berbagai faktor yang mempengaruhi nilai sintasan perlakuan A ini lebih tinggi dibandingkan perlakuan lainnya. Pertama, ammonium klorida dan sodium nitrit sesungguhnya merupakan toksik bagi ikan yang dipelihara, sehingga memiliki efek yang antagonis. Satu sisi, bahan ini dibutuhkan sebagai sumber energi untuk menumbuhkan bakteri nitrifikasi, namun di sisi lain, bahan ini juga bersifak toksik bagi ikan yang dipelihara. Sifat antagonis bahan ini yang menjadi pertimbangan penambahan bahan (NH4Cl dan NaNO2) hanya dilakukan satu kali.
Faktor selanjutnya yang mungkin berperan terhadap rendahnya nilai sintasan dari masing-masing perlakuan penambahan bahan adalah waktu memasukkan ikan yang terlalu cepat, sehingga ammonia dan nitrit yang berasal dari bahan yang ditambahkan belum teroksidasi secara sempurna oleh bakteri
31
nitrifikasi. Grafik yang ditunjukkan pada Gambar 10 memperlihatkan perbedaan ini, dimana pada perlakuan ikan dimasukkan pada hari ke-3, tingkat kelangsungan hidupnya langsung menurun dengan tajam. Sementara pada perlakuan ikan dimasukkan pada hari ke-6, tingkat kelangsungan hidupnya lebih tinggi sampai beberapa hari, sebelum mengalami penurunan.
Berdasarkan grafik ammonia (Gambar 11), terlihat pada perlakuan 2 (ikan dimasukkan pada hari ke-6) kandungan ammonianya mengalami penurunan dari hari ke-3 sampai hari ke-6 (kecuali pada perlakuan A). Namun kemudian meningkat kembali setelah ikan dimasukkan pada perlakuan ini. Hal ini menunjukkan jika ikan dimasukkan terlalu cepat, ketika bakteri belum tumbuh secara mapan, akan meningkatkan kembali kandungan ammonianya.
Parameter kualitas air pendukung
Parameter kualitas air lain (pH, suhu, DO dan kesadahan) berada dalam kisaran yang masih dapat ditoleransi, baik bagi organisme yang dibudidayakan (ikan mas) maupun bagi bakteri nitrifikasi. Menurut Wedemeyer (1996), nilai pH dan suhu optimum untuk ikan tropis masing-masing berada pada kisaran 6-9 dan 20-30 oC, oksigen terlarut > 4 mg/l. Sementara itu, nilai konsentrasi kesadahan yang diharapkan berada pada kisaran 50 – 200 mg/l. Meskipun demikian, menurut Wedemeyer (1996) air yang kesadahannya rendah (soft water) masih dapat ditoleransi jika pemberian pakannya cukup.
32
Tabel 2 Kisaran parameter kualitas air selama penelitian
Perlakuan pH Suhu DO Kesadahan
A1 7,14 - 7,5 27 5,3 - 5,4 76,076
A2 7 - 7,3 26,5 – 27 5,4 - 5,6 76,076
B1 7,4 - 7,6 26 – 27 5 - 5,2 76,076
B2 7,35 - 7,54 26,5 – 27 5 - 5,1 76,076
C1 7,65 - 7,82 26 – 27 4,5 - 4,7 76,076
C2 7 - 7,75 26 – 27 4,5 - 4,6 76,076
D1 7,25 - 7,5 26 – 27 4,8 - 4,9 76,076
D2 7 - 7,3 26 – 27 5 - 5,2 76,076
33
SIMPULAN
Peningkatan dosis ammonium klorida (NH4Cl) dan sodium nitrit (NaNO2)
dapat meningkatkan jumlah bakteri AOB (ammonia oxidizing bacteria). Jumlah bakteri AOB tertinggi diperlihatkan oleh perlakuan D, diikuti oleh perlakuan C, B dan A dengan nilai masing-masing pada H-3 adalah D1 460 CFU/ml, D2 516,67
CFU/ml, C1 247,67 CFU/ml, C2 264,33 CFU/ml, B1 62 CFU/ml, B2 45,33
CFU/ml, A1 9,8 CFU/ml dan A2 11,2 CFU/ml. Selain itu, lamanya inkubasi
sebelum ikan dimasukkan juga mempengaruhi tingkat kelangsungan hidup ikan yang dipelihara. Namun demikian, perlakuan yang diberikan pada penelitian ini belum dapat mengatasi seluruh dampak new tank syndrome yang terjadi.
35
DAFTAR PUSTAKA
Affandi R, Tang MU. 2002. Fisiologi Hewan Air. Pekanbaru. Unri Pr.
Agustiyani D, Imamuddin H, Faridah EN, Oedjijono. 2004. Pengaruh pH dan substrat organik terhadap pertumbuhan dan aktivitas bakteri pengoksidasi amonia. Biodiversitas 5:43-47.
Anthonisen AC, Loehr RC, Prakasam TBS, Srinath EG. 1976. Inhibition of nitrification by ammonia and nitrous acid. J Water Pollut Control Fed 48:835-852.
[APHA] American Public Health Association. 1989. Standard Methods For the Examination of Water and Wastewater. 15th ed. Washington. APHA inc.
Avnimelech Y. 2009. Biofloc Technology - A Practical Guide Book. Lousiana. World Aquaculture Soc.
Bhaskar KV, Charluyu, PBBN. 2005. Effect of environmental factors on nitrifying bacteria isolated from the rhizosphere of Setaria italica
(L.) Beauv. Afri J Biotechnol 4:1145 – 1146.
Biswas JK, Sarkar D, Chakraborty P, Bhakta JN, Jana BB. 2006. Density dependent ambient ammonium as the key faktor for optimization of stocking density of common carp in small holding tanks.
Aquaculture 261:952-959.
Boyd CE. 1979. Water Quality in Warmwater Fish Ponds. Auburn. Auburn Univ. Camargo JA, Alonso A. 2006. Ecological and toxicological effects of inorganic nitrogen pollution in aquatic ecosystems : a global assessment.
Environ Int 32:831-849.
Durborow RM, Crosby DM, Brunson MW. 1997. Ammonia in fish pond. Revised, June. Southern Regional Aquaculture Center. Publication no.463
Dwidjoseputro D. 2010. Dasar-dasar Mikrobiologi. Cetakan ketujuh belas. Jakarta. Djambatan.
Effendi H. 2003. Telaah Kualitas Air Bagi Pengelolaan Sumberdaya dan Lingkungan Perairan. Yogyakarta. Kanisius.
36
[FDA] Food and Drugs Administration. Bacterial Analytical Manual. Appendix 2. http://www.fda.gov/Food/ScienceResearch/LaboratoryMethods/Bact eriologicalAnalyticalManualBAM/ucm109656.htm. [26 Jan 2012]
Forteath N. 1993. The Biological Filter. Structure and Function. Di dalam : Hart P, O’Sullivan D, editor. Recirculation Systems. Design, Construction and Management. Australia. Aquaculture sourcebook. Hlm 55-63. Grommen R, Van Hauteghem I, Van Wambeke M, Verstraete W. 2002. An
improved nitrifying enrichment to remove ammonium and nitrite from freshwater aquaria systems. Aquaculture 211:115-124.
Hagopian DS, Riley JG. 1998. A closer look at the bacteriology of nitrification.
Aquaculture Eng 18:223-244.
Hogg S. 2005. Essential Microbiology. Chichester. J Wiley.
Hovanec TA, DeLong EF. 1996. Comparative analysis of nitrifying bacteria associated with freshwater and marine aquaria. Appl Environ Microbiol 62:2888-2896.
Lovell RT. 1989. Nutrition and feeding in fish. New York. Van Nostrand.
Mc Carty PL, Haug RT. 1971. Nitrogen removal from wastewater by biological nitrification and denitrification. Di dalam : Sykes G, Skinner FA, editor. Society for applied bacteriological symposium series no.1. microbial aspect of pollution. London. Academic Pr.
Merkens JC, Downing KM. 1957. The effects of tension of dissolved oxygen on the toxicity of un-ionized ammonia to several species of fish. Ann Appl Biol 45:521-527.
Mota C, Head MA, Ridenoure JA, Cheng JJ, de los Reyes III FL. 2005. Effects of aeration cycles on nitrifying bacterial populations and nitrogen removal in intermittently aerated reactors. Appl Environ Microbiol
71:8565-8572.
Pelczar MJJr, Chan ECS. 1986. Dasar-dasar mikrobiologi. Volume ke-1, 2. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari : Elements Microbiol.
37
Princic A, Mahne I, Megusar F, Paul EA, Tiedje JM. 1998. Effect of pH and oxygen and ammonium concentrations on the community structure of nitrifying bacteria from wastewater. Appl Environ Microbiol
64:3584-3590.
Randall DJ, Tsui TKN. 2002. Ammonia toxicity in fish. Mar Pollut Bull 45:17-23.
Rheinheimer G. 1991. Aquatic Microbiology. Chichester. J Wiley. .
Russo RC. 1985. Ammonia, nitrite and nitrate. Di dalam : Rand GM, Petrocelli SR, editor. Fundamentals of aquatic toxicology. Washington DC. Hemisphere.
Spotte S. 1970. Fish and Invertebrate Culture. New York. J Wiley.
Tomasso JR. 1994. Toxicity of nitrogenous wastes to aquaculture animals. Rev Fish Sci 2:291-314.
Wedemeyer GA. 1996. Physiology of fish in intensive culture systems. New York. Chapman & Hall.
39
41
Lampiran 1 Contoh perhitungan MPN
Sampel Pengenceran Nilai
MPN*
10¯¹ 10¯² 10¯³
0 1 0
1A1 0 1 0
1 1 0
1 3 0 1-3-0 16
1 0 0
2A1 0 0 0
0 0 1
1 0 1 1-0-1 7,2
0 0 0
3A1 0 1 0
0 1 0
0 2 0 0-2-0 6,2
rata-rata 9,8
42
Lampiran 2 Uji F terhadap tingkat kelangsungan hidup ikan (% sintasan pada 3 hari setelah ikan dimasukkan)
Perlakuan Ulangan Dosis Bahan
A B C D
1 (H-3)
1 0 0 8,3 33,7
2 66,7 0 41,7 0
3 0 16,7 0 25
2 (H-6)
1 41,7 33,3 41,7 100
2 41,7 0 91,7 100
3 41,7 66,7 91,7 75
ANOVA
Source of
Variation SS df MS F P-value F crit
Time 11841,48 1 11841,48 20,944* 0,00031 4,493998
Dose 4513,668 3 1504,556 2,661104 0,083312 3,238872
Interaction 2791,041 3 930,3471 1,645502 0,21857 3,238872
Within 9046,207 16 565,3879
43
Lampiran 3 Uji F terhadap jumlah bakteri AOB
Perlakuan Ulangan Perlakuan
A B C D
Interaction 7022,626 4 1755,657 0,092104 0,984599 2,525215
Within 1143697 60 19061,62
44
Lampiran 4 uji F terhadap jumlah bakteri NOB
Perlakuan Ulangan Perlakuan
A B C D
Interaction 18005,19 4 4501,297 0,908534 0,464869 2,525215
Within 297267,8 60 4954,464
45
Lampiran 5 Uji F terhadap Ammonia
Perlakuan
(Waktu memasukan ikan) Ulangan
Perlakuan (Dosis)
Interaction 0,006256 3 0,002085 0,08998 0,965264 2,769431
Within 1,297834 56 0,023176
46
Lampiran 6 Uji F terhadap Nitrit
Perlakuan
(Waktu memasukan ikan) Ulangan
Perlakuan (Dosis)
Interaction 15,24576 3 5,08192 0,449822 0,718416 2,769431
Within 632,6674 56 11,29763
47
Lampiran 7 Uji F terhadap Nitrat
Perlakuan
(Waktu memasukan ikan) Ulangan
Perlakuan (Dosis)
Interaction 7,015414 3 2,338471 0,281465 0,838553 2,769431
Within 465,2598 56 8,30821