i
Moduza procris
CRAMER (LEPIDOPTERA: NYMPHALIDAE)
PADA JABON MERAH DAN PUTIH (
Anthocephalus
spp.)
PERKEMBANGAN DAN PREFERENSI MAKAN
MARTINI WALI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Moduza procris
Cramer (Lepidoptera: Nymphalidae) pada Jabon Merah dan Putih (Anthocephalus
spp.): Perkembangan dan Preferensi Makan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2014
Martini Wali
RINGKASAN
MARTINI WALI. Moduza procris Cramer (Lepidoptera: Nymphalidae) pada
Jabon Merah dan Putih (Anthocephalus spp.): Perkembangan dan Preferensi
Makan. Dibimbing oleh NOOR FARIKHAH HANEDA dan NINA MARYANA. Jabon putih (Anthocephalus cadamba Miq.) dan jabon merah (A. macrophyllus Roxb. Havil) termasuk dalam famili Rubiaceae. Tanaman ini
mempunyai banyak keunggulan serta merupakan tanaman yang dibudidayakan pada hutan tanaman industri dan hutan rakyat saat ini. Moduza procris
(Lepidoptera: Nymphalidae) adalah hama baru yang menyerang daun jabon, dengan pola serangan daun dimakan dari ujung dan meninggalkan tulang daun.
Penelitian ini bertujuan mengamati perkembangan dan preferensi makan hama M. procris, serta mengkaji kandungan kimia (senyawa primer dan senyawa
metabolik sekunder) yang terdapat pada kedua jenis daun jabon tersebut. Metode penelitian preferensi makan dilakukan dengan metode pilihan (choise) dan tanpa
pilihan (no choise) pada larva instar 4. Pengujian kandungan kimia daun
dilakukan dengan menggunakan analisis proksimat dan analisis fitokimia.
Hasil penelitian menunjukkan bahwa rata-rata perkembangan lama stadia M. procris lebih singkat pada jabon merah daripada jabon putih. Larva terdiri dari 5
instar. Rata-rata stadium instar larva pada jabon merah 16.00 hari dan pada jabon putih 17.20 hari. Pupa menempel pada daun dengan bantuan juluran ujung posterior (kremaster). Stadium pupa yaitu 8.70 hari pada jabon merah dan 8.10
hari pada jabon putih. Stadium imago betina 11.75 hari dan imago jantan 11.50 hari pada jabon merah. Stadium imago betina 15.25 hari dan imago jantan 14.50 hari pada jabon putih. Sebaliknya rata-rata ukuran M. procris relatif lebih besar
pada daun jabon putih daripada jabon merah.
Pengujian proksimat menunjukkan bahwa kandungan nutrisi penting seperti kadar air, protein, karbohidrat (serat dan BETA-N), nitrogen, ADF (Acid Detergent Fiber) dan lignin lebih banyak pada jabon putih yaitu berturut-turut
96.35%, 16.44%, (14.49%, 56.29%), 2.63%, 38.72% dan 24.21%. Sebaliknya kandungan lemak dan selulosa banyak terdapat pada jabon merah yaitu berturut-turut 3.15% dan 10.13%, sedangkan kandungan lainnya seperti kadar abu, Ca, P dan silika dalam jumlah yang relatif sama yaitu berturut-turut 6.72%, 1.47%, 0.25% dan 0.04 pada jabon putih; dan 6.95%, 1.84%, 0.32%, 0.07% pada jabon merah. Kandungan garam (NaCl) dalam persentase yang sama yaitu 0.03%. Pengujian fitokimia menunjukkan ada dua senyawa yang terdeteksi yaitu senyawa kuinon dan steroid. Kedua senyawa yang terdeteksi ini lebih banyak terdapat pada daun jabon merah dibandingkan jabon putih.
Rata-rata kemampuan makan larva instar 4 secara berturut-turut adalah 105.61 cm2 pada jabon merah dan 18.11 cm2 pada jabon putih untuk metode pilihan. Sebaliknya pada metode tanpa pilihan rata-rata kemampuan makan yaitu 130.08 cm2 pada jabon merah dan 141.23 cm2 pada jabon putih.
Kata kunci: Anthocephalus spp., lama perkembangan, Moduza procris,
SUMMARY
MARTINI WALI. Moduza procris Cramer (Lepidoptera: Nymphalidae) on Red
Jabon and White Jabon (Anthocephalus spp.): Development and Eating
Preference. Supervised by NOOR FARIKHA HANEDA and NINA MARYANA.
Red jabon (Anthocephalus macrophyllus Roxb. Havil) and white jabon
(Anthocephalus cadamba Miq.) are included in the Rubiaceae family. This plant has a lot of advantages as well as many industrial plants cultivated in the forest and forest community today. Moduza procris Cramer is a new pest that attack jabon leaf. The leaves eaten from the edge and leave the venation.
This study’s aims were to observe the development, the eating preference of
M. procris and examines the chemical contents (compound primary and secondary metabolic compound) that found on both species of jabon. Choise and no choise treatmenst were conducted on the fourth instar larvae eating preference. The chemical contents of leaves were tested by using proximate analysis and phytochemical analysis.
The results showed that the development time of M. procris on red jabon was shorter than white jabon. M. procris has 5 instar larvae. The average stadium of each instar larvae were 16.00 days on red jabon, and 17.20 days on white jabon. Posterior part of the pupae attached to the leaf with silk (kremester). Pupae stadium was 8.70 days on red jabon and 8.10 days on white jabon. Longevity of male and female on red jabon were 11.50 and 11.75 days respectively, and in white jabon were 14.50 and 15.25 days respectively. Otherwise the average size of each phase of M. procris were bigger respectively on white jabon than red jabon.
Proximate test showed that the content of essential nutrients such as water content, protein, carbohidrates (fiber and BETA-N), nitrogen, ADF (Acid Detergent Fiber), and lignin were more on white jabon i.e. 96.35%, 16.44%,
(14.49%, 56.29%), 2.63%, 38.72% and 24.21%. Otherwise the fat content and cellulose were more founded in red jabon i.e 6.72%, 1.47%, 0.25% dan 0.04 respectively, while other ingredient such as ash content, Ca, P and silica in the some relative amounts i.e 6.72%, 1.47%, 0.25% and 0.04 on white jabon, and 6.95%, 1.84%, 0.32%, 0.07% on red jabon. The content of salt (NaCl) was in the same percentage 0.03%. Phytochemical tests showed two compounds were quinones and steroid. This compounds were more concentration in red jabon’s leaf than white jabon.
The larvae prefer ate red jabon leaf (105.61 ± 25.82 cm2) than white jabon
(18.11 ± 10.02 cm2) in choise treatment. In contras, the larvae prefer to ate white jabon than red jabon in no choise treatment. The average leaf width that consumed by larvae on white jabon were 130.08 ± 23.06 cm2, and on red jabon were 141.23 ± 19.85 cm2.
Keywords: Anthocephalusspp., development time, eating preference, Moduza
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
i
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Silvikultur Tropika
Moduza procris
CRAMER (LEPIDOPTERA: NYMPHALIDAE)
PADA JABON MERAH DAN PUTIH (
Anthocephalus
spp.)
PERKEMBANGAN DAN PREFERENSI MAKAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Moduza procris Cramer (Lepidoptera: Nymphalidae) pada Daun
Jabon Merah dan Putih (Anthocephalus spp.): Perkembangan dan
Preferensi Makan Nama : Martini Wali NRP : E451120041
Disetujui oleh Komisi Pembimbing
Dr Ir Noor Farikhah Haneda, MS
Ketua Dr Ir Nina Maryana, MSi Anggota
Diketahui oleh
Ketua Program Studi/ Mayor Silvikultur Tropika
Prof Dr Ir Sri Wilarso Budi R, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian:
PRAKATA
Alhamdulillah penulis haturkan kehadirat Allah SWT, karena telah melimpahkan rahmat, hidayah serta inayah-Nya sehingga penulis dapat menyelesaikan karya ilmiah dengan judul “Moduza procris Cramer (Lepidoptera:
Nymphalidae) pada Jabon Merah dan Putih (Anthocephalus spp.): Perkembangan
dan Preferensi Makan”. Melalui kesempatan ini penulis ingin menyampaikan terima kasih dan rasa hormat kepada ibu Dr. Ir. Noor Farikhah Haneda MS. dan Dr. Ir. Nina Maryana M.Si. selaku pembimbing 1 dan pembimbing 2 yang dengan segenap perhatian, kesabaran, waktu, tenaga, serta pikirannya memberikan arahan, bimbingan dan masukan, sehingga penulis dapat menyelesaikan penulisan tesis.
Ucapan terima kasih disampaikan kepada Rektor Universitas Iqra Buru, Dekan Fakultas Pertanian dan Kehutanan Universitas Iqra Buru, atas kerendahan hatinya telah memberikan kesempatan kepada penulis untuk melanjutkan studi S-2 di Sekolah Pascasarjana IPB; Rektor IPB, Dekan Sekolah Pascasarjana IPB, dan Ketua Program Studi Silvikultur Tropika atas kesempatan yang diberikan kepada penulis untuk mengikuti pendidikan di SPs IPB. Ucapan terima kasih juga ditujukan kepada seluru staf pengajar, dan administrasi IPB atas ilmu, kelancaran studi dan administrasi selama penulis menjadi mahasiswa di SPs IPB, tak lupa pula kepada Direktorat Pendidikan Tinggi yang telah memberikan Beasiswa Studi kepada penulis. Ucapan terima kasih juga kepada ibu Elly Zulaikha atas segala bantuannya selama penyelesaian riset di Laboratorium Entomologi Hutan, Kak Neng, teman-teman seperjuangan Silvikultur Tropika, terutama sahabat-sahabat terkasih mbak Santy, Lola, Rara dan Alisa serta semua pihak yang telah membantu selama penelitian.
Ungkapan terima kasih yang mendalam kepada kedua orangtua tercinta Ayahanda (Abdullah Wali) dan Ibunda (Sakinah Sanmardy) atas kesabaran, doa tulus, harapan serta motivasi yang tiada hentinya kepadaku, Ninie, Keluarga Besar Sanmardy, Keluarga Besar Wali.
Penulis menyadari bahwa penyusunan karya ilmiah ini masih jauh dari kesempurnaan, oleh karena itu dengan kerendahan hati penulis mengharapkan kritik dan saran yang sifatnya membangun demi perbaikan. Akhir kata penulis berharap semoga karya ilmiah ini dapat bermanfaat dan menjadi acuan ilmu bagi yang membutuhkan.
Bogor, Desember 2014
DAFTAR ISI
Halaman
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 3
Hipotesis Penelitian 3
2 BAHAN DAN METODE 4
Tempat dan Waktu 4
Metode Penelitian 4
Analisis Data 9
3 HASIL DAN PEMBAHASAN 10
Habitat dan Morfologi Jabon 10
Perkembangan M. procris 11
Parasitoid M. procris 15
Kandungan Kimia Daun 16
Preferensi Makan M. procris 18
4 SIMPULAN DAN SARAN 22
Simpulan 22
Saran 22
DAFTAR PUSTAKA 23
LAMPIRAN 26
DAFTAR TABEL
Halaman 1. Perbedaan ciri morfologi jabon merah dan jabon putih 10 2. Rata-rata stadium larva, dan pupa serta lama hidup imago
Moduza procris pada jabon merah dan jabon putih 11
3. Ukuran pradewasa dan imago Moduza procris pada jabon merah
dan jabon putih 12
4. Parasitoid yang keluar dari pupa Moduza procris 15
5. Hasil analisis kandungan senyawa primer pada daun jabon merah
dan jabon putih 17
6. Hasil pengujian kimia sama amino pada daun jabon merah dan
jabon putih 17
7. Hasil pengujian senyawa metabolik sekunder pada daun jabon
merah dan jabon putih 18
8. Jumlah luas daun jabon merah dan jabon putih yang dimakan oleh
larva Moduza procris instar 4 pada metode pilihan dan tanpa pilihan 19
DAFTAR GAMBAR
Halaman 1. Pengukuran bagian tubuh larva Moduza procris 5
2. Pengukuran imago Moduza procris 5
3. Telur Moduza procris 11
4. Larva Moduza procris 12
5. Pupa Moduza procris 14
6. Imago Moduza procris 15
7. Parasitoid pada pupa Moduza procris 16
8. Luas daun yang dimakan oleh larva per hari pada jabon merah
dan putih dengan metode pilihan dan tanpa pilihan 19
DAFTAR LAMPIRAN
Halaman 1. Stadium larva dan pupa serta lama hidup imago Moduza procris
pada jabon merah 26
2. Stadium larva dan pupa serta lama hidup imago Moduza procris
pada jabon putih 26
3. Ukuran pradewasa Moduza procris pada jabon merah 27
4. Ukuran pradewasa Moduza procris pada daun jabon putih 28
5. Ukuran imago pada jabon merah dan jabon putih 29 6. Jumlah parasitoid yang ditemukan pada fase pupa 30 7. Jumlah luas daun yang dimakan larva per hari dengan metode
tanpa pilihan 30
PENDAHULUAN
Latar Belakang
Jabon merah (Anthocephalus macrophyllus Roxb. Havil) dan jabon putih (A. cadamba Miq.) termasuk dalam famili Rubiaceae. Tanaman ini merupakan jenis
pohon yang memiliki prospek tinggi untuk hutan tanaman industri maupun hutan rakyat yang ada di Indonesia. Pertumbuhan tanaman ini relatif cepat, mampu beradaptasi pada berbagai kondisi tempat tumbuh, serta perlakuan silvikulturnya relatif mudah. Jabon juga diharapkan menjadi semakin penting bagi industri perkayuan di masa mendatang, terutama ketika bahan baku kayu pertukangan dari hutan alam diperkirakan akan semakin berkurang (Krisnawati et al. 2011).
Pemanfaatan kayu jabon digunakan sebagai bahan bangunan non-konstruksi, meubelir atau furniture, bahan plywood, papan, peti, korek api dan
sebagainya. Pemanfaatan non kayu lainnya sebagai obat tradisional yaitu digunakan sebagai obat kumur dengan cara diekstrak terlebih dahulu. Daun segar dimanfaatkan oleh masyarakat sebagai pakan ternak. Kayu jabon merah bisa dimanfaatkan juga sebagai arang aktif. Arang yang dihasilkan dari jabon merah tidak memiliki bau dan tidak mengeluarkan asap atau percikan, namun nilai energi yang dihasilkan tergolong rendah yaitu 19.800 kJ/kg (Halawane et al. 2011).
Namun sebagai suatu ekosistem yang homogen, kawasan hutan tanaman rentan terhadap berbagai kendala di antaranya serangan hama. Populasi tanaman hutan yang homogen akan mudah diserang dan berpotensi terjadi ledakan (outbreak)
hama, baik di lapangan maupun di persemaian (Krisnawati et al. 2011).
Hama Moduza procris Cramer (Lepidoptera: Nymphalidae) tergolong hama
baru yang menyerang jabon. Penelitian tentang hama ini belum banyak dilakukan. Beberapa penelitian yang telah dilakukan yaitu di India, sedangkan di Indonesia hama ini dilaporkan menyerang jabon putih di persemaian, dengan pola serangan acak sehingga daun berbentuk tak beraturan. Intensitas serangan yang dilaporkan relatif kecil, akan tetapi pada fase larva dipandang sebagai hama yang serius karena memakan daun-daun jabon dalam waktu yang relatif singkat daun dapat habis (Darwiati et al. 2010).
Perkembangan suatu hama di lapangan dapat dilihat dari biologi dan tingkat preferensi makannya. Pengetahuan aspek biologi yang diperlukan antara lain meliputi perilaku, siklus hidup, perkembangan dan morfologi hama. Populasi serangga dalam suatu areal tertentu ditentukan oleh dua faktor yaitu kemampuan hayati atau potensi biotik dan hambatan lingkungan (Dadang 2006).
Beberapa penelitian biologi khususnya dari famili Nymphalidae yang pernah dilakukan diantaranya oleh Urich dan Emmel (1990), Brower et al. (1992)
dan Rayalu et al. (2011). Studi biologi famili Nymphalidae jenis Acraea violae
Fabricius, pada inang Passiflora edulis menunjukkan siklus hidup yang bervariasi,
telur diletakkan secara berkelompok, jumlah instar pada larva tidak tetap yang terdiri dari 5 ˗ 7 instar. Larva hidup berkelompok dan memakan daun tumbuhan inangnya (Andrianti 2011). Selain jabon putih, larva M. procris juga menyerang
jabon merah. Hama ini lebih banyak ditemukan pada persemaian dan tegakan jabon merah dengan umur yang bervariasi. Studi dan referensi mengenai hama M. procris dan gejala serangannya pada jabon merah belum ditemukan. Menurut
2 Tingkat preferensi makan serangga tergantung pada berbagai kandungan kimia pada tanaman yang mempengaruhi penerimaan dan penolakan hama tersebut. Hal ini terkait dengan senyawa primer dan senyawa metabolik sekunder yang terdapat pada tumbuhan inang, serta bisa menjadi salah satu faktor pembatas bagi serangga hama untuk memakan jaringan tumbuhan. Perilaku biologi serangga sangat berkaitan dengan tersedianya tanaman sebagai sumber pakan yang berkualitas untuk menjamin keberlangsungan hidup larvanya (Price 2000).
Penelitian yang dilakukan oleh Nuringtyas et al. (2007) terhadap larva Attacus atlas L. (Lepidoptera: Saturniidae), pada 4 jenis pakan menunjukkan
bahwa larva cenderung memilih pakan dengan kandungan senyawa primer yang lebih tinggi dan senyawa metabolik sekunder yang sedikit. Senyawa primer mengandung nutrisi sedangkan senyawa metabolik sekunder berperan sebagai penolak dan perlindungan terhadap hama. Penelitian perkembangan dan preferensi makan pada hama M. procris belum pernah dilakukan di Indonesia, sementara
informasi perkembangan ini sangat diperlukan dalam pengelolahan hama M. procris kaitannya dengan intensitas serangan dan waktu yang tepat dalam
melakukan pengendalian. Oleh karena itu penelitian ini dipandang perlu dilakukan.
Perumusan Masalah
Jabon merah dan putih merupakan jenis tanaman yang mempunyai sifat fast growing, dan mempunyai banyak keunggulan. Akan tetapi sebagai tanaman hutan
yang homogen jabon dihadapkan pada serangan hama di lapangan maupun di persemaian. Salah satu hama yang dilaporkan menyerang jabon adalah M. procris.
Meskipun intensitas serangan pada jabon di persemaian relatif sedikit, akan tetapi pada fase larva dipandang sebagai hama yang serius karena memakan daun-daun jabon dalam waktu yang relatif singkat daun dapat habis. Hal ini tentunya mengakibatkan proses fotosintesis pada daun akan terganggu, sehingga dapat mempengaruhi pertumbuhan tanaman.
Di Indonesia kajian studi tentang perkembangan dan preferensi makan dari hama M. procris pada jabon belum pernah dilakukan. Sementara informasi
perkembangan sangat penting karena dapat digunakan sebagai dasar untuk melakukan pengelolaan dan penentuan waktu yang tepat untuk melakukan pengendalian serangan hama ini di lapangan. Preferensi makan berkaitan dengan pemilihan pakan yang sesuai antara jabon putih dan jabon merah, sehingga dapat diketahui hama ini lebih berpotensi sebagai hama pada jenis jabon yang mana.
Mencermati uraian di atas maka penelitian ini dilakukan untuk menjawab beberapa pertanyaan berikut ini:
1) Bagaimana perkembangan dan preferensi makan M. procris pada dua
tumbuhan inang A. macrophyllus dan A. cadamba,
2) Apakah ada perbedaan kandungan kimia daun dari kedua jenis famili Rubiaceae tersebut.
Tujuan Penelitian
Tujuan dari penelitian ini adalah mengamati perkembangan dan preferensi makan hama M. procris serta mengkaji kandungan kimia (senyawa primer dan
3 Manfaat Penelitian
Penelitian ini diharapkan dapat bermanfaat bagi petani jabon dan masyarakat luas sebagai referensi dan bahan acuan informasi yang dapat digunakan dalam pengembangan budidaya jabon merah dan jabon putih.
Hipotesis Penelitian
Hipotesis penelitian yang akan dilakukan adalah sebagai berikut:
1) Perkembangan hama M. procris dipengaruhi oleh kandungan nutrisi yang
terdapat pada pakan yang dikonsumsi.
2) Diduga preferensi makan hama M. procris lebih besar pada jabon merah
daripada jabon putih.
4
BAHAN DAN METODE
Tempat dan Waktu
Penelitian perkembangan dan preferensi makan dilakukan di Laboratorium Entomologi Hutan, Departemen Silvikultur, Fakultas Kehutanan, IPB. Pengujian kandungan kimia daun dilaksanakan di dua laboratorium yang berbeda, yaitu pengujian proksimat dilakukan di Laboratorium Teknologi Pakan, Fakultas Peternakan, IPB dan pengujian fitokimia dilaksanakan di Laboratorium Kimia Organik, Fakultas MIPA, IPB. Penelitian dimulai dari bulan November 2013 sampai Agustus 2014.
Metode Penelitian Pemeliharaan Tanaman Uji
Tanaman yang digunakan sebagai inang yaitu bibit jabon merah dan putih yang masing-masing berumur 3 bulan yang didapatkan dari persemaian di sekitar kampus IPB. Tanaman dipelihara di dalam sungkup beratap paranet hitam. Bibit tanaman disiram setiap hari. Kedua jenis tanaman ini disiapkan untuk pengamatan perkembangan dan preferensi makan M. procris.
Pemeliharaan Serangga Uji
Larva dan pupa M. procris diperoleh dari Hutan Rakyat yang ada di sekitar
Dramaga. Larva dan pupa dibawa ke laboratorium Entomologi Hutan dan ditempatkan di dalam wadah plastik berukuran 17 x 12 x 11 cm3 sampai menjadi imago. Imago yang keluar dibedakan jenis kelaminnya, kemudian dipilih 10 pasang imago dan dimasukkan ke dalam kurungan serta diberi makan larutan madu 10% yang diserapkan pada kapas, kemudian digantung di bagian atas kurungan. Dalam kurungan tersebut juga diletakkan media peletakan telur (bibit jabon merah dan putih) untuk tempat bertelur kupu-kupu betina.
Pengamatan Perkembangan
Penelitian perkembangan dimulai dengan menggunakan 10 larva M. procris
sebagai ulangan, masing-masing pada daun jabon merah dan putih. Pengamatan dilakukan setiap hari dan dimulai dari larva instar 1 atau 2 sampai imago.
Khusus untuk fase telur, pengamatan dilakukan pada telur hasil pembedahan abdomen betina karena proses peneluran oleh imago di laboratorium mengalami hambatan. Pengamatan dilakukan terhadap ukuran dan stadium telur.
Larva yang diperoleh dari lapangan diletakkan di dalam wadah plastik pengamatan berukuran 17 x 12 x 11 cm3, masing-masing wadah berisi 1 ekor larva. Fase larva diamati mulai dari instar pertama sampai instar terakhir. Pengamatan larva meliputi jumlah instar, morfologi, perilaku dan stadium tiap instar. Pengukuran larva meliputi ukuran panjang dan lebar kepala larva setiap instar (Gambar 1). Pada fase pupa selain dilakukan pengukuran, juga dilakukan pengamatan stadium dan perilaku.
5
Gambar 1 Pengukuran bagian tubuh larva Moduza procris
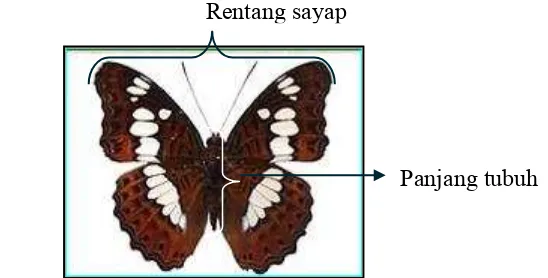
perbandingan jantan dan betina tidak mencapai 1 : 1, maka jantan dipindahkan beberapa kali ke dalam beberapa kurungan imago betina agar semua imago dapat berkopulasi. Kupu-kupu kemudian diberi makan cairan madu 10% yang diserapkan pada kapas dan digantung di bagian atas kurungan. Pengamatan imago meliputi morfologi, nisbah kelamin, lama hidup dan jumlah telur yang diletakkan (keperidian). Pengamatan dilakukan setiap hari sampai kupu-kupu tersebut mati, sehingga diperoleh data lama hidup imago. Pengukuran panjang tubuh dan rentang sayap dilakukan langsung setelah imago mati. Cara pengukuran terhadap imago dapat dilihat pada Gambar 2.
Gambar 2 Pengukuran imago Moduza procris.
Pada penelitian ini dilakukan juga pengamatan terhadap parasitoid yang menyerang hama di lapangan. Jenis parasitoid yang diperoleh dari lapangan disimpan di dalam botol koleksi berisi alkohol 70%, selanjutnya untuk menentukan jenis perasitoid yang ditemukan diidentifikasi menggunakan buku acuan (identifikasi Lembaga Ilmu Pengetahuan Indonesia). Selain itu suhu dan kelembaban diukur sebagai faktor yang mempengaruhi perkembangan hama di laboratorium. Pengukuran suhu ruangan dilakukan tiga kali sehari yaitu pada pukul 07.30, 13.30 dan 17.30 WIB (Bariyah 2011). Rata-rata suhu dan kelembaban relatif laboratorium yaitu berturut-turut 27.12 °C dan 64.93%.
Pengujian Preferensi Makan
Pengujian preferensi makan dilakukan dengan dua cara yaitu metode pilihan (choise) dan metode tanpa pilihan (no choise). Metode pilihan dilakukan dengan
menempatkan 1 ekor larva insar empat pada wadah pengamatan, dan diberi pakan daun jabon merah dan putih dalam wadah yang sama. Sebelumnya daun jabon dipetakan di atas kertas milimeter blok untuk mengetahui luas daun yang
Kepala
Panjang tubuh
6 dijadikan pakan. Pangkal daun diberi kapas yang telah dibasahi air untuk menjaga daun tetap segar. Pergantian pakan daun dilakukan setiap hari. Daun yang telah dimakan keesokan harinya dipetakan kembali di atas kertas milimeter blok dan dihitung jumlah luasan daun yang dimakan larva per hari.
Metode tanpa pilihan dilakukan dengan memasukkan satu jenis daun jabon merah atau putih ke dalam wadah plastik. Ukuran daun yang digunakan sebagai pakan dalam metode pilihan atau tanpa pilihan relatif sama. Pada setiap metode dilakukan dengan lima ulangan. Jumlah luasan daun yang dimakan dihitung setiap hari, hingga larva berganti kulit menjadi instar 5.
Pengujian Kandungan Kimia Daun Jabon
Bahan tanaman uji yang digunakan adalah daun jabon merah dan putih yang berada pada posisi ke tiga dari tunas dan masih berwarna hijau. Daun yang digunakan sebagai sampel merupakan daun yang diambil pada pohon jabon berumur 7 bulan, yang diambil secara acak berasal dari Hutan Rakyat Desa Cibanteng, Kecamatan Ciampea, Kabupaten Bogor. Pada tahap awal daun jabon dibersihkan dengan air kemudian dikering udarakan tanpa terkena cahaya matahari langsung atau dikeringkan di dalam oven dengan suhu tidak melebihi 50 °C. Setelah kering, daun dihaluskan dan sampel siap untuk diuji.
Uji Proksimat (Senyawa Primer)
Uji proksimat terdiri dari uji kadar air, kadar abu, protein kasar, serat kasar dan kandungan lemak total. Uji mineral meliputi kandungan Ca, P dan NaCl. Analisis serat meliputi ADF (Acid Detergent Fiber), selulosa, lignin dan silika
serta uji asam amino (AOAC. 2005; SNI 01-2891-1992).
Pengujian Kadar Air. Cawan porselin yang sebelumnya telah dipanaskan pada oven 105 oC didinginkan selama ± 1 jam di dalam eksikator, kemudian ditimbang berat cawan (X). Sampel yang telah ditimbang sebanyak ± 5 g (Y), kemudian diletakkan ke dalam cawan. Ke dalam oven 105 oC sampel dimasukkan selama ± 4 – 6 jam (tercapai bobot tetap). Sampel diangkat, kemudian didinginkan dalam eksikator selama 10 menit. Berat sampel ditimbang dan dicatat. Tahapan tersebut diulangi sampai diketahui berat stabilnya (Z). Perhitungan kadar air dilakukan dengan rumus:
Kadar Air pada 105 oC = x 100%
Pengujian Kadar Abu. Cawan porselin yang sebelumnya telah dipanaskan pada tanur 400 – 600 oC kemudian didinginkan di dalam eksikator, dan ditimbang (X). Sampel ± 5 g dimasukkan ke dalam cawan kemudian ditimbang (Y), selanjutnya sampel dibakar di atas hot plate sampai tidak berasap. Setelah proses
pembakaran selesai sampel dimasukkan ke dalam tanur dengan suhu 800 °C selama 1 jam. Sampel kemudian diangkat dan didinginkan dalam eksikator lagi selama 30 menit. Berat sampel ditimbang dan dicatat (Z). Perhitungan kadar abu dilakukan dengan rumus:
Kadar Abu = x 100% X x Y – Z Y
7 Pengujian Serat Kasar. Sampel ditimbang sebanyak ± 1 g (X), kemudian dimasukkan ke dalam gelas piala. Sampel dimasukkan ke dalam alat Heater extract dan ditambah dengan 50 ml H2SO4 0.3 N, kemudian diekstrak selama 30 menit. Setelah diekstrak sampel ditambahkan dengan 25 ml NaOH 1.5 N dan diekstrak kembali selama 30 menit. Selanjutnya sampel ditempatkan pada kertas saring Whatman 41 yang telah dipanaskan dalam oven 105 oC selama 1 jam, dan
ditimbang kembali (a). Cairan kemudian disaring menggunakan Whatman 41 dan
dimasukkan ke dalam corong buchner. Penyaringan tersebut dilakukan dengan
labu pengisap yang dihubungkan dengan pancar air. Sampel yang telah selesai disaring kemudian dicuci berturut-turut dengan menggunakan 50 ml air panas, 50 ml H2SO4 0.3 N, 50 ml air panas dan 25 ml aseton. Kertas saring Whatman 41
beserta isinya dimasukkan ke dalam cawan porselen, selanjutnya dikeringkan dengan oven 105 oC selama 1 jam. Sampel diangkat dan didinginkan dalam eksikator kemudian ditimbang beratnya (Y). Setelah ditimbang sampel ditempatkan pada cawan dan dimasukkan ke dalam tanur selama 1 jam dengan suhu mencapai 800 °C, sampel diangkat dan didinginkan kemudian ditimbang beratnya (Z). Perhitungan kandungan serat kasar dilakukan dengan rumus:
% Serat Kasar = x 100%
Pengujian Protein Kasar. Pengujian protein kasar dilakukan dalam beberapa tahapan. Tahapan pertama yaitu tahap destruksi, sampel ditimbang sebanyak ± 0.3 g, kemudian ditambakan ± 1.5 g katalis Selenium Mixture.
Selanjutnya sampel dimasukkan ke dalam labu Kjeldahl dan ditambahkan 20 ml
H2SO4 pekat, dan didestruksi sampai warna larutan menjadi hijau-kekuningan-jernih. Tahap kedua yaitu tahapan destilasi, setelah proses destruksi sampel didinginkan selama ± 15 menit. Ke dalam sampel ditambahkan 300 ml aquadest, kemudian didinginkan kembali, setelah proses pendinginan ke dalam sampel ditambahakan 100 ml NaOH 40 % (teknis) dan dilakukan destilasi. Proses destilasi ini berlangsung selama ± 30 menit sampai terjadinya letupan. Tahapan ketiga yaitu proses titrasi. Hasil destilasi dicampur dengan 10 ml H2SO4 0.1 N yang sudah ditambah 3 tetes indikator campuran Methylen Blue dan Methylen Red
dengan NaOH 0.1 N sampai terjadi perubahan warna dari ungu menjadi biru-kehijauan. Pada proses titrasi ini juga dilakukan penetapan blanko (sebagai pembanding), 10 ml H2SO4 0.1 N dipipet dan ditambah 2 tetes indikator PP (Phenol Phtalein), kemudian dititrasi dengan NaOH 0.1 N. Perhitungan protein
kasar dilakukan dengan rumus: % Protein =
x 100%
Pengujian Kadar Lemak. Labu penyari (labu lemak) disiapkan sebelumnya, dengan batu didih di dalamnya yang telah dipanaskan sebelumnya pada suhu 105 - 110 oC dan didinginkan di dalam eksikator. Berat labu penyari ditimbang (a). Sampel daun yang telah dihaluskan ditimbang ± 1 g (x), dan dimasukkan ke dalam selongsong penyaring, kemudian ditutup dengan menggunakan kapas tidak berlemak. Selongsong penyaring ini dimasukkan ke
Y – Z – a X
8 dalam alat soxlet, selanjutnya disaring menggunakan petroleum benzin.
Selanjutnya ekstraktor dihubungkan dengan kondensor, proses ini dilakukan menggunakan alat FATEX-S. Labu penyari diangkat dari alat FATEX-S, kemudian
dikeringkan dalam oven 105 - 110 oC sampai bobotnya tetap (± 4 - 6 jam). Sampel diangkat dari oven, kemudian didinginkan di dalam eksikator selama 30 menit, selanjutnya ditimbang bobot akhirnya (b). Perhitungan lemak kasar dilakukan dengan rumus:
% Lemak = x 100%
Pengujian Van Soest. Sistem analisis Van Soest merupakan kelanjutan dari
uji serat, yaitu menggolongkan zat pakan menjadi isi sel (cell content) dan dinding
sel (cell wall). Analisis serat yang dilakukan dalam penelitian ini meliputi analisis
ADF, selulosa dan lignin. Analisis ADF mewakili selulosa dan lignin dinding sel tanaman.
Prinsip dasar dari analisis ADF adalah mengukur bagian dinding sel tanaman yang tidak dapat larut dalam larutan detergen asam dengan komposit utama CTAB (Cetyl Trimethyl Ammonium Bromide) pada pemanasan satu jam.
Larutan detergent asam atau Acid Detergent Solution (ADS) dibuat dengan
melarutkan CTAB 20 g dalam 27.5 asam sulfat 1 N dan ditambahkan aquadest hingga volumenya menjadi 1 liter. Sampel ditimbang sebanyak 1 g (A), selanjutnya dimasukkan ke dalam gelas piala 600 ml, dan ditambahkan dengan 100 ml larutan ADS. Sampel kemudian diekstraksi selama 60 menit dari mulai mendidih. Sampel hasil ekstraksi disaring menggunakan cawan kaca masir yang telah ditimbang sebelumnya (B). Residu hasil ekstraksi dibilas menggunakan air panas dan aseton. Sampel dikeringkan pada oven 105 °C selama ± 4 jam sampai beratnya stabil, selanjutnya cawan diangkat dan didinginkan di dalam eksikator. Setelah dingin, cawan dikeluarkan dari eksikator dan ditimbang (C).
Analisis selulosa merupakan lanjutan dari analisa ADF. Sampel analisis ADF yang sudah ditimbang (C) ditambah dengan larutan asam sulfat (H2SO4) 72% sampai terendam selama 3 jam. Setelah 3 jam, residu dibilas menggunakan air panas dan aseton. Selanjutnya dikeringkan pada oven 105 °C selama ± 4 jam sampai beratnya stabil, angkat dan dinginkan dalam eksikator. Setelah dingin, cawan dikeluarkan dari eksikator dan ditimbang (D).
Analisis lignin merupakan kelanjutan dari analisis ADF dan selulosa. Sampel yang sudah dikeringkan (D), selanjutnya dibakar di dalam tanur dengan tempratur ± 600 °C. Sampel yang ditempatkan di dalam cawan diangkat dan didinginkan dalam eksikator dan ditimbang beratnya (E). Analisis Van Soest dapat dihitung dengan persamaan berikut:
% ADF = x 100%
% Selulosa = x 100%
% Lignin = x 100% b – a x
9 Uji Fitokimia (Senyawa Metabolik Sekunder)
Analisis fitokimia daun yang dilakukan mengacu pada metode Harborne (1987).
Uji Alkaloid. Sebanyak 500 mg sampel dilarutkan di dalam 5 ml kloroform dan dibasakan dengan beberapa tetes NH4OH, kemudian sampel disaring ke dalam tabung reaksi. Ekstrak kloroform kemudian ditambahi 10 tetes H2SO4 2M lalu dikocok hingga terbentuk dua lapisan. Lapisan asam yang berada di atas di ambil, kemudian diteteskan pada pelat tetes dan diuji berturut-turut dengan pereaksi Meyer, pereaksi Wagner, dan pereaksi Dragendrof. Uji positif bila didapat endapan berturut-turut putih, cokelat, dan merah jingga.
Uji Flavonoid. Pada 500 mg sampel ditambahkan 10 ml air panas kemudian dididihkan selama 5 menit dan disaring. Ke dalam 5 ml filtratnya ditambahkan 0.5 g serbuk Mg, 1 ml HCl pekat, dan 1 ml amil alkohol kemudian dikocok dengan kuat. Hasil uji positif bila muncul warna merah, kuning atau jingga pada lapisan amil alkohol.
Uji Kuinon. Sebanyak 500 mg sampel ditambahkan ke dalam 10 ml air panas dan sampel dididihkan selama 5 menit lalu disaring. Filtrat ditambahi 3 tetes NaOH. Uji positif bila ditandai dengan munculnya endapan merah.
Uji Tanin. Sebanyak 500 mg sampel ditambahkan ke dalam 50 ml air panas dan dididihkan selama 15 menit lalu disaring. Filtratnya ditambahi 10 ml FeCl3 1%. Uji positif bila ditandai dengan munculnya warna hijau kehitaman.
Uji Saponin. Pada 500 mg sampel ditambahkan 10 ml air panas dan dididihkan selama 5 menit lalu disaring. Sebanyak 10 ml filtrat dikocok di dalam tabung reaksi tertutup selama 10 detik kemudian dibiarkan selama 10 menit. Adanya saponin ditunjukkan dengan terbentuknya buih yang stabil.
Uji Triterpenoid dan Steroid. Uji ini menggunakan pereaksi Lieberman-Burchard. Pada pengujian ini, sebanyak 500 mg sampel dimaserasi dengan 25 ml etanol panas selama 1 jam, disaring dan residunya ditambah eter. Filtrat ditambah 3 tetes asam asetatanhidrat dan 1 tetes asam sulfat pekat secara berurutan. Larutan dikocok perlahan dan dibiarkan beberapa menit. Uji positif ditandai dengan terbentuknya warna merah atau ungu untuk triterpenoid dan warna hijau atau biru
untuk steroid.
Analisis Data
Data pengamatan perkembangan dianalisis secara deskriptif, data hasil penelitian ditampilkan dalam bentuk tabel dan gambar. Data preferensi makan dengan metode pilihan dan tanpa pilihan dianalisis dengan uji t pada taraf nyata 5%, menggunakan software SAS versi 9.1. Data pengujian kandungan kimia
10
HASIL DAN PEMBAHASAN
Habitat dan Morfologi Jabon
Jabon merah (A. macrophyllus) merupakan tanaman pioner yang toleran
cahaya, dapat hidup di dataran rendah sampai ketinggian 50 - 1000 m dpl. Penyebaran alami jabon merah di Indonesia lebih sempit bila dibandingkan dengan jabon putih, yang meliputi Sulawesi, Maluku dan Papua. Tinggi pohon jabon merah bisa mencapai 40 meter dengan batang bundar dan tegak lurus mencapai 70% - 80% dengan lingkar batang mencapai lebih dari 150 cm (diameter lebih dari 50 cm). Daya tumbuh di lahan kritis juga cukup baik, bahkan bisa dijadikan sebagai buffer zone untuk kepentingan konservasi atau daerah
penyangga karena memiliki perakaran yang dalam. Di Hungoyono, Kabupaten Bone Bolango, Gorontalo, jabon merah ditemukan tumbuh dengan subur diatas bukit karst dekat sumber air panas tempat peneluran burung maleo (Macrocephalon maleo) (Halawane et al. 2011).
Jabon putih (A. cadamba) merupakan tanaman pionir yang dapat tumbuh
baik pada tanah-tanah aluvial yang lembab dan umumnya dijumpai di hutan sekunder di sepanjang bantaran sungai dan daerah transisi antara daerah berawa, daerah yang tergenang air secara permanen maupun secara periodik. Beberapa pohon jabon terkadang juga ditemukan di areal hutan primer. Jenis ini tumbuh baik pada berbagai jenis tanah, terutama pada tanah-tanah yang subur dan beraerasi baik (Soerianegara & Lemmens 1993).
Penyebaran jabon putih di Indonesia cukup luas meliputi seluruh Sumatera, Jawa Barat, Jawa Timur, Kalimantan Timur, Kalimantan Selatan, seluruh Sulawesi, Nusa Tenggara Barat dan Papua. Jabon tumbuh pada daerah lembab di pinggir sungai, rawa dan kadang-kadang terendam air. Jabon tersebar dari daerah pantai hingga ketinggian 1000 m dpl (Heyne 1987). Jabon termasuk jenis kayu daun lebar yang lunak (ringan). Kayu teras berwarna putih kekuningan sampai kuning terang, tidak dapat dibedakan dengan jelas warnanya dari kayu gubal (Martawijaya et al. 1989). Beberapa ciri morfologi yang membedakan jabon
merah dari jabon putih dapat dilihat pada Tabel 1.
Tabel 1 Perbedaan ciri morfologi jabon merah dan jabon putih No Karakteristik Jabon merah Jabon putih
Berwarna merah kehitaman
Berwarna kehitaman
Buah masak fisiologis berwarna coklat kemerahan
Buah masak fisiologis berwarna kuning
11 Perkembangan M. procris
M. procris merupakan serangga yang mengalami metamorfosis sempurna
(holometabola), yaitu terdiri dari telur, larva yang terdiri dari lima instar, pupa dan
imago. Perubahan setiap instar larva ditandai dengan terjadinya pergantian kulit pada setiap fase larva. Lama perkembangan M. procris mulai dari telur, larva,
pupa sampai imago dengan pakan jabon merah dan putih tersaji pada Tabel 2. Data stadium dan ukuran pradewasa dan dewasa M. procris ditunjukkan pada
Lampiran 1 - 5.
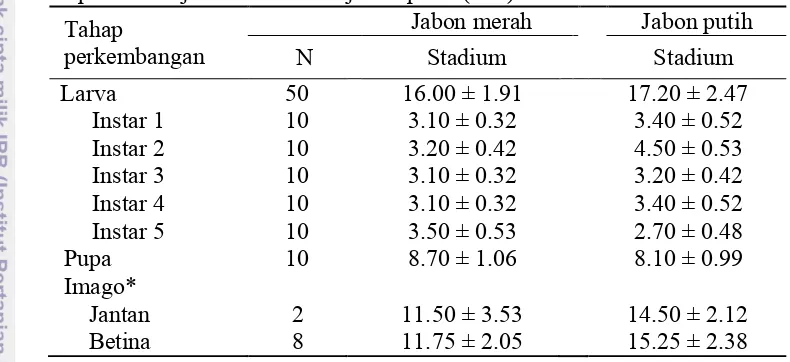
Tabel 2 Rata-rata stadium larva dan pupa serta lama hidup imago Moduza procris
pada daun jabon merah dan jabon putih (hari) Tahap
Telur berbentuk agak bulat berwarna hijau kekuningan dan terdapat rambut-rambut halus seperti duri pada permukaannya (Gambar 3a). Telur yang diperoleh dari hasil pembedahan imago betina rata-rata berukuran 1.32 mm untuk pakan dengan daun jabon merah, dan 1.36 mm pada jabon putih (Tabel 3). Menurut Morrell (1948), telur M. procris berukuran 1 mm, dengan lama fase telur 3.5 hari.
12 Keterangan: * = lebar pada larva adalah lebar kepala, N = jumlah ulangan (individu)
** = lebar pada imago adalah rentang sayap imago
Gambar 4 Larva Moduza procris, (a) instar 1 awal, (b) instar 1 akhir,
(c) instar 2, (d) instar 3, (e) instar 4, (f) instar 5. Larva
Larva M. procris berbentuk silindris (erusiform). Larva tua berwarna coklat
tua sampai hitam. Pada ruas tubuh terdapat sejumlah duri. Kepala berwarna coklat tua sampai coklat kemerahan dengan bercak-bercak merah. Pada kepala terdapat ciri khas yaitu adanya semacam tanduk bercabang pada bagian ujung. Larva memakan daun dengan cara menggigit dari ujung daun tanaman dan meninggalkan tulang daun. Semakin besar ukuran stadium larva semakin banyak daun yang dimakan. Larva yang akan berganti kulit berhenti makan untuk sementara waktu. Pergantian kulit ditandai dengan adanya sisa bekas kulit (eksuvia). Eksuvia ini akan dimakan kembali oleh larva kecuali eksuvia kepala.
13 Larva akan merespon bila diganggu, dan mengeluarkan cairan berwarna hijau sebagai perlindungan diri dari serangan musuhnya.
Larva Instar 1. Larva instar 1 memiliki panjang awal 3 mm dan berwarna coklat kehijauan, sesuai dengan warna daun yang dimakan (Gambar 4a). Setelah keluar dari telur larva mencari pakan di sekitarnya dan mulai memakan tepi daun dalam jumlah yang sedikit serta gerakan larva masih lambat. Rambut-rambut tubuh belum terbentuk. Kepala larva agak bulat dengan lebar 0.91 mm (Gambar 4b). Rata-rata stadium larva instar 1 pada pakan daun jabon merah relatif lebih singkat (3.10 hari), daripada pakan daun jabon putih (3.40 hari) (Tabel 2). Menurut Morrell (1948), umumnya larva hidup secara soliter pada setiap ujung daun tanaman inangnya. Bourinbaiar dan Huang (2006) menambahkan bahwa aktifitas larva muda relatif rendah, sehingga keberadaannya masih di sekitar daerah peletakkan telur.
Larva Instar 2. Larva instar 2 yang baru berganti kulit mempunyai panjang tubuh sekitar 8 mm. Larva berwarna merah kecoklatan. Pada instar 2 ini larva mulai banyak makan daripada instar sebelumnya. Akhir instar 2, larva memiliki panjang tubuh 10 mm (Gambar 4c). Rata-rata stadium larva instar 2 dengan pemberian pakan daun jabon merah relatif lebih singkat (3.20 hari) daripada jabon putih (4.50 hari). Sebaliknya ukuran larva instar 2 relatif lebih besar pada pakan daun jabon putih daripada jabon merah (Tabel 3). Morrell (1948) melaporkan bahwa larva instar 2 mempunyai panjang tubuh sekitar 6 – 6.5 mm dengan lama stadium 3 hari.
Larva Instar 3. Larva instar 3 memiliki panjang tubuh awal sekitar 13 mm, dengan warna tubuh coklat kehitaman. Pada akhir instar larva mempunyai panjang tubuh sekitar 18 mm, dengan warna yang sama coklat kehitaman. Serabut tubuh mulai tumbuh dan sepasang serabut yang lebih panjang pada bagian kepala yang menyerupai tanduk pada bagian ujung (Gambar 4d). Pada instar 3 larva mulai intens makan akan tetapi tidak dalam jumlah yang banyak. Larva makan untuk mencukupi kebutuhan tubuh dan proses moulting. Rata-rata stadium larva instar 3
dengan pemberian pakan daun jabon merah relatif lebih singkat (3.10 hari) daripada jabon putih (3.20 hari). Sebaliknya ukuran larva relatif lebih besar pada pakan daun jabon putih daripada jabon merah (Tabel 3). Morrell (1948) melaporkan bahwa pada fase ini panjang tubuh larva sekitar 15 - 16 mm dengan lama hidup 3 hari.
Larva Instar 4. Larva instar 4 memiliki panjang tubuh awal sekitar 20 mm, dengan warna tubuh coklat kehitaman (Gambar 4e). Rata- rata stadium larva instar 4 lebih singkat pada pakan daun jabon merah (3.10 hari) daripada daun jabon putih (3.40 hari). Sebaliknya ukuran relatif lebih besar pada pakan daun jabon putih (Tabel 3). Morrell (1948) melaporkan bahwa pada fase ini lama hidup larva berlangsung selama 4 hari, dengan panjang tubuh mencapai 23 - 24 mm.
14 pada pakan daun jabon putih relatif lebih singkat (2.70 hari) daripada jabon merah (3.50 hari). Sebaliknya ukuran relatif lebih besar pada pakan daun jabon putih (Tabel 3). Menurut Morrell (1948), pada fase akhir ini lama hidup larva berlangsung selama 3 hari dengan panjang tubuh 31 mm. Rata-rata stadium larva secara keseluruhan pada pemberian pakan daun jabon merah relatif lebih singkat (16.00 hari) daripada jabon putih (17.20 hari).
Pupa
Bentuk pupa berlekuk-lekuk dan terlihat seperti daun kering yang menggulung. Pupa berwarna coklat kekuningan atau coklat kehitaman. Bagian posterior pupa menempel pada batang atau daun dan terikat oleh benang sutra tipis (kremaster) (Gambar 5). Rata-rata stadium pupa dengan pakan daun jabon
putih relatif lebih singkat (8.10 hari) daripada jabon merah (8.70 hari). Sebaliknya ukuran pupa baik jantan maupun betina relatif lebih besar pada pakan daun jabon putih daripada daun jabon merah (Tabel 3).
Gambar 5 Pupa Moduza procris, (a) ventral, (b) dorsal, (c) lateral.
Imago
Imago yang baru keluar dari pupa sayapnya masih pendek, lunak, dan berkerut. Setelah beberapa saat, sayap-sayap akan berkembangdan mengeras, pigmentasi akan terbentuk, dan imago siap melanjutkan perkembangannya. Kupu-kupu M. procris
berwarna hitam, coklat kemerahan dengan spot putih berbentuk huruf V, bagian ventral berwarna putih kehijauan, warna pada betina dan jantan sulit dibedakan karena sangat mirip (Gambar 6a dan 6b). Perbedaan antara jantan dan betina dapat dilihat dari ukuran tubuh. Ukuran tubuh pada jantan relatif lebih kecil dari betina. Selain itu pada abdomen betina dicirikan dengan adanya ovipositor, sedangkan pada jantan tidak terdapat ciri tersebut.
Proses kopulasi pada kupu-kupu berlangsung selama 50 menit (Gambar 6c). Pada akhir kopulasi biasanya sayap imago rusak. Kupu-kupu betina lebih banyak dari jantan dengan nisbah kelamin 8 : 2. Imago betina yang melakukan kopulasi dengan cahaya matahari yang cukup, setelah dilakukan pembedahan mampu menghasilkan telur 17 - 43 butir. Morrell (1948) melaporkan bahwa imago betina hanya meletakkan 1 telur pada satu daun tumbuhan inangnya. Jumlah telur yang diletakkan tergantung kecukupan nutrisi dan cahaya matahari. Morrell (1960) juga melaporkan bahwa semua spesies Nymphalidae terbang dengan kuat dan cepat. Kebanyakan imago jantan sangat menyukai cahaya matahari, sehingga kopulasi dilakukan pada tempat yang banyak terdapat cahaya.
15
Gambar 6 Imago Moduza procris, (a) jantan, (b) betina, (c) kopulasi
jantan dan betina.
Lama hidup imago betina yang diberi pakan daun jabon merah relatif lebih singkat (11.75 hari) daripada jabon putih (15.25 hari) (Tabel 2). Hasil yang sama juga terjadi pada imago jantan dengan lama hidup 11.50 hari pada pakan daun jabon merah, dan 14.50 hari pada pakan daun jabon putih. Sebaliknya rata-rata ukuran imago betina maupun jantan relatif lebih besar pada pakan daun jabon putih daripada jabon merah (Tabel 3). Secara keseluruhan hasil pengamatan lama stadium dan ukuran M. procris tidak menunjukkan hasil yang berbeda nyata
antara jabon merah dan jabon putih.
Parasitoid M. procris
Selama penelitian ditemukan dua jenis parasitoid pada pupa, yaitu Theronia
sp. (Hymenoptera: Ichneumonidae), dan Brachymeria lassus (Hymenoptera:
Chalcididae) (Gambar 7a dan 7b). Jumlah kedua jenis parasitoid ini tersaji pada Tabel 4. Data pengamatan parasitoid yang ditemukan selama penelitian dapat dilihat pada Lampiran 6.
Tabel 4 Parasitoid yang keluar dari pupa Moduza procris (ekor)
Parasitoid Jumlah pupa terparasit Jumlah parasitoid yang keluar Jumlah parasitoid per inang
Theronia sp. 6 6 1
Brachymeria lasus 5 69 11 - 17 b
1 cm 1 cm
a
16 Parasitoid merupakan serangga yang bersifat sebagai parasit pada serangga atau binatang Arthropoda yang lain. Parasitoid bersifat parasitik pada fase pradewasa (larva) sedangkan pada fase dewasanya biasanya hidup bebas dan tidak terikat pada inangnya. Jumlah parasitoid yang ditemukan lebih banyak pada jabon merah, akan tetapi selama pengamatan tidak ditemukan gejala awal larva atau pupa yang terserang parasitoid. Menurut Untung (1996), kebanyakan famili Ichneumonidae merupakan parasitoid soliter, yaitu hanya ada satu individu yang muncul dalam satu pupa. Purnomo (2000) juga menyatakan bahwa Ichneumonidae merupakan famili yang banyak bertindak sebagai parasitoid pada bermacam inang. Menurut Soviani (2012), yang melaporkan bahwa sebagian besar famili Chalcididae merupakan parasitoid primer Lepidoptera.
Gambar 7 Parasitoid pada Moduza procris, (a) Theronia sp.,
(b) Brachymeria lassus.
Selain parasitoid yang ditemukan, ada beberapa jenis parasitoid yang diketahui menyerang hama jabon di lapangan. Menurut Susanty (2014), yang melaporkan bahwa ada lima jenis parasitiod yang menyerang hama Artrochista hilaralis. Kelima jenis parasitoid tersebut yaitu Phanerotoma sp., Chelonus sp., Apanteles sp., Tetrastichus sp., dan Ooencyrtus sp..
Kandungan Kimia Daun 1. Uji Proksimat
Analisis proksimat pertama kali dikembangkan di Weende Experiment Station Jerman oleh Hennerberg dan Stokmann. Oleh karena itu analisis ini sering
juga dikenal dengan analisis Weende. Analisis proksimat dilakukan untuk
mengetahui komponen utama dari suatu bahan. Analisis ini menjadi perlu untuk dilakukan karena menyediakan data kandungan utama dari suatu bahan makanan atau pakan (Soejono 1990). Faktor lain adalah karena analisis proksimat dalam makanan berkenaan dengan kadar gizi dari bahan makanan tersebut (Hui 2006).
Berdasarkan hasil pengujian proksimat, daun jabon putih mengandung kadar air, protein, serat kasar, nitrogen, ADF dan lignin dalam jumlah yang lebih banyak daripada daun jabon merah. Sebaliknya daun jabon merah lebih banyak mengandung lemak dan selulosa. Kandungan lainnya seperti kadar abu, Bahan Ekstra Tanpa Nitrogen (BETA-N), Ca, P dan silika dalam jumlah yang relatif
b
7 mm 11 mm
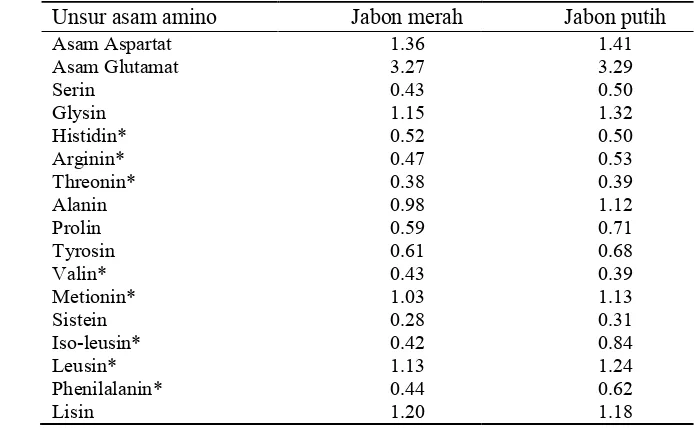
17 berbeda. Kandungan asam amino daun jabon merah lebih rendah dari pada daun jabon putih. Kandungan asam amino tertentu seperti asam aspartat, asam glutamat, serin, glysin, alanin, prolin, tyrosin dan sistein relatif lebih tinggi pada jabon putih. Golongan asam amino esensial seperti arginin, threonin, metionin, iso-leusin, leusin dan phenilalanin lebih tinggi pada jabon putih. Pada jabon merah kandungan asam amino esensial paling tinggi adalah histidin dan valin (Tabel 6).
Tabel 6 Hasil pengujian kimia asam amino pada daun jabon merah dan jabon putih (%)
Unsur asam amino Jabon merah Jabon putih
18 2. Uji Fitokimia
Fitokimia merupakan suatu metode untuk menentukan ciri senyawa aktif penyebab efek racun atau efek yang bermanfaat. Senyawa hasil identifikasi ditunjukkan oleh ekstrak tumbuhan kasar yang diuji dengan sistem biologi (Harborne 1987). Hasil uji golongan senyawa metabolik sekunder ini ditandai dengan terjadinya perubahan warna dari serbuk daun jabon setelah ditambahkan pereaksi sesuai dengan uji senyawa yang dilakukan.
Hasil identifikasi dari warna yang dihasilkan pada pengujian fitokimia, diperoleh dua jenis senyawa yaitu kuinon dan steroid (Tabel 7). Senyawa kuinon merupakan senyawa berwarna dan mempunyai kromofor dasar seperti kromofor pada benzokuinon, yang terdiri atas dua gugus karbonil yang berkonjugasi dengan dua ikatan rangkap karbon-karbon (Harborne 1987). Senyawa kuinon hasil uji termasuk dalam kelompok antrakuinon. Hal ini sejalan dengan Robinson (1991) yang menyatakan bahwa golongan kuinon alam terbesar terdiri atas antrakuinon dan keluarga tumbuhan yang kaya akan senyawa jenis ini, salah satunya adalah tumbuhan dari famili Rubiacea.
Tabel 7 Hasil pengujian senyawa metabolik sekunder pada daun jabon merah dan jabon putih
Senyawa aktif Jabon merah Hasil identifikasi Jabon putih Alkaloid
Flavanoid Kuinon Tanin Saponin Steroid Triterpenoid
- - ++
- - ++
-
- - + - - + - Keterangan: (-) = negatif, (+) = positif tetapi lemah, (++) = positif dan kuat
Senyawa kedua yang terdeteksi yaitu steroid. Steroid adalah terpenoid yang kerangka dasarnya terbentuk dari sistem cincin siklopentana prehidrofenantrena. Menurut Robinson (1995), steroid merupakan golongan senyawa metabolik sekunder yang banyak dimanfaatkan sebagai obat. Kedua senyawa yang terdapat pada tumbuhan ini diduga berperan sebagai pelindung dari serangga dan serangan mikroba yang bersifat merugikan (Harborne 1987, Robinson 1995).
Preferensi Makan M. procris
Pada metode pilihan, rata-rata luas daun yang dimakan oleh larva instar 4 pada jabon merah lebih banyak (105.61 ± 25.82 cm²) daripada jabon putih (18.11 ± 10.02 cm²) (Tabel 8). Sebaliknya pada metode tanpa pilihan, larva relatif lebih banyak memakan daun jabon putih (141.23 ± 19.85 cm²) daripada daun jabon merah (130.08 ± 23.06 cm²). Data luasan daun yang dimakan larva per hari pada metode pilihan dan tanpa pilihan ditunjukkan pada Lampiran 7 - 8.
19 Tabel 8 Jumlah luasan daun jabon merah dan jabon putih yang dimakan oleh larva Moduza procris instar 4 pada metode pilihan dan tanpa pilihan
(cm²)
Metode Jabon merah Jabon putih P*
Pilihan 105.61 ± 25.82 18.11 ± 10.02 0.0001 Tanpa pilihan 130.08 ± 23.06 141.23 ± 19.85 0.4360
* P > 0,05 menunjukkan hasil yang tidak berbeda nyata
daun jabon putih daripada daun jabon merah, meskipun tidak menunjukkan hasil yang berbeda nyata.
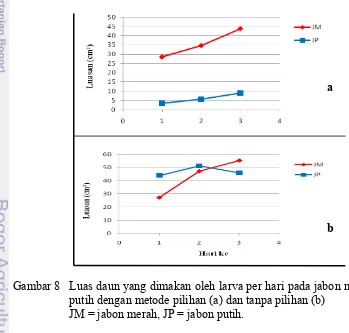
Pengamatan selama tiga hari menunjukkan bahwa untuk metode pilihan jumlah luasan daun jabon merah yang dikonsumsi larva jauh lebih banyak dan terjadi peningkatan dari hari pertama sampai hari ke-tiga sebelum larva mulai berganti kulit menjadi instar 5 (Gambar 8a). Sebaliknya pada pakan daun jabon putih konsumsi daun tidak terlalu banyak walaupun terjadi peningkatan dari hari pertama sampai hari ke-tiga. Pada metode tanpa pilihan, larva memakan daun jabon merah dan daun jabon putih dalam jumlah yang relatif sama. Namun pada pakan daun jabon putih terdapat penurunan konsumsi pada hari terakhir instar 4, sedangkan pada pakan daun jabon merah hal tersebut tidak terjadi (Gambar 8b).
Gambar 8 Luas daun yang dimakan oleh larva per hari pada jabon merah dan putih dengan metode pilihan (a) dan tanpa pilihan (b)
JM = jabon merah, JP = jabon putih.
Pada preferensi makan dengan metode tanpa pilihan larva instar 4 relatif lebih banyak makan daun jabon putih daripada daun jabon merah. Hal ini diduga kandungan nutrisi (senyawa primer) lebih banyak terdapat pada daun jabon putih.
a
20 Nutrisi tersebut diantaranya adalah kadar air, protein kasar, karbohidrat (serat kasar dan BETA-N), ADF dan lignin. Kebutuhan akan air untuk proses metabolisme tubuh tergantung pada kandungan air yang terdapat di dalam daun (pakan yang di konsumsi). Hal ini sejalan dengan Purnomo et al. (2008) yang
melaporkan bahwa kandungan air yang tinggi pada suatu pakan berkorelasi positif dengan pemilihan inang bagi serangga fitofag.
Nutrisi penting kedua yang dibutuhkan oleh larva M. procris dalam
perkembangannya yaitu nutrisi protein kasar dan karbohidrat (serat kasar dan BETA-N). Protein dan karbohidrat banyak terdapat pada daun jabon putih. Protein adalah nutrisi utama yang dibutuhkan oleh serangga fitofag, dan ini paling sering menjadi nutrisi pembatas untuk pertumbuhan optimal serangga. Protein juga termasuk salah satu zat penting yang sangat dibutuhkan tubuh untuk pertumbuhan dan memperbaiki jaringan tubuh yang rusak. Selain itu, protein juga mempengaruhi kualitas makanan secara keseluruhan, dalam hal ini berhubungan dengan keseimbangan asam amino esensial yang tersedia dalam protein (Bernays & Chapman 1994). Kandungan karbohidrat pada suatu pakan diduga berperan membantu mengoptimalkan pertumbuhan larva (Ahmad & Kamal 2001).
Selain nutrien penting di atas yang tak kalah penting yaitu lemak, kadar abu dan nutrisi pendukung lainnya, seperti ADF, lignin dan selulosa. Lemak merupakan bentuk simpanan energi paling utama dalam tubuh disamping sebagai sumber gizi esensial bagi serangga fitofag (Bernays & Chapman 1994). Kadar abu pada analisis proksimat tidak memberikan nilai nutrisi yang penting karena abu tidak mengalami pembakaran sehingga tidak menghasilkan energi. Jumlah abu dalam bahan pakan hanya penting untuk menentukan perhitungan BETA-N. Nilai ADF pada daun mewakili kandungan lignin dan selulosa dinding sel tanaman. Selain itu nilai ADF ini juga secara khusus berhubungan langsung dengan kemampuan cerna pakan pada hewan (Soejono 1990).
Makanan serangga fitofagus umumnya mempunyai kandungan nitrogen dan air yang tinggi dibutuhkan untuk mempercepat pertumbuhannya. Kadar nitrogen dan air dalam daun dapat berfluktuasi karena berhubungan dengan musim dan fenologi tumbuhan, keadaan ini dapat mempengaruhi kehidupan (performance)
serangga ini (Ahmad & Kamal 2001). Selain itu, Sanchez (1992) juga melaporkan bahwa kehilangan nitrogen dari tanah disebabkan oleh penguapan, pencucian, denitrifikasi, pengikisan dan penyerapan oleh tanaman. Pada lapisan atas biasanya kandungan N lebih tinggi yaitu sekitar 95% dan umumnya menurun dengan kedalaman tanah yaitu sekitar 60%. Hasil pengujian fitokimia menunjukan bahwa kandungan kuinon dan steroid yang terdeteksi pada daun jabon putih dalam jumlah yang lebih sedikit, sehingga menyebabkan dipilihnya pakan daun jabon putih oleh larva ini. Hal ini sejalan dengan hasil penelitian yang dilakukan oleh Nuringtyas et al. (2007) yang melaporkan bahwa larva cenderung memilih pakan
21 dalam jumlah yang banyak dapat menjadi faktor terjadinya antifeedant. Hal ini
sejalan dengan Syahputra (2005) yang melaporkan bahwa serat dan lignin diduga dapat mempengaruhi laju konsumsi larva, sehingga berhenti makan dan mulai memilih pakan lain yang lebih sedikit kandungan serat kasar dan lignin.
Kandungan nitrogen yang tinggi pada jabon putih juga kurang berperan pada larva instar akhir, karena kandungan nitrogen lebih banyak dibutuhkan oleh larva instar awal daripada larva instar akhir (Bernays & Chapman 1994). Selain itu pada pakan daun jabon merah kandungan lemak dalam persentase yang lebih banyak daripada pakan daun jabon putih (Tabel 5). Disamping berfungsi sebagai sumber energi, lemak juga berperan sebagai struktur membran dan yang paling penting yaitu sebagai komponen kulit pelindung, karena salah satu jenis lemak dalam bentuk sterol merupakan prekursor hormon moulting exdison (Bernays &
Chapman 1994). Schoonhoven (1997) juga melaporkan bahwa lemak berperan sebagai salah satu lini pertahanan bagi serangga. Hal ini disebabkan aktivitas MFO (Mixed-Function-Oxidase) juga berlangsung pada jaringan lemak tubuh
larva.
Menurut Ahmad (1982), larva Lepidoptera generalis memiliki aktivitas MFO yang lebih tinggi daripada serangga spesialis. Sistem polisubstrat monooksigenase (PSMOs) atau sistem MFO sebenarnya secara genetik sudah ada
pada tubuh serangga. Hal ini dapat menyebabkan larva M. procris mampu
beradaptasi dan bersifat toleran terhadap senyawa-senyawa metabolik yang dihasilkan oleh tanaman inangnya. Perilaku beradaptasi terhadap lingkungan sangat diperlukan oleh serangga untuk mengatasi rintangan yang merupakan pertahanan tumbuhan misalnya rintangan kandungan allelokimia, fisik tanaman dan ekologi. Keadaan ini membuat serangga harus dapat mematahkan pertahanan tanaman, baik pertahaan kimia maupun pertahanan fisik agar tetap bertahan hidup (survive). Menurut Schoonhoven (1997), hal serupa juga terjadi pada ulat
tembakau Spodoptera frugiperda, yang mampu beradaptasi dengan senyawa
nikotin yang dihasilkan oleh tanaman tembakau. Syahputra et al. (2004) juga
melaporkan bahwa, sistem metabolisme senyawa aktif pada serangga tersebut membentuk konjugat yang larut dalam air. Konjugat ini kemudian dikeluarkan dari tubuh bersama-sama dengan kotoran serangga.
Berdasarkan hasil tersebut diatas, maka daun jabon putih dapat dijadikan sumber pakan penting pada fase awal pertumbuhan larva. Hal ini disebabkan pada daun jabon putih lebih banyak mengandung nutrisi penting yang dibutuhkan larva untuk tumbuh dan berkembang. Sebaliknya daun jabon merah mengandung beberapa senyawa primer penting yang berperan sebagai pelindung dan sistem pertahanan bagi larva M. procris terhadap senyawa kimia yang terdapat pada daun
22
SIMPULAN DAN SARAN
Simpulan
Rata-rata perkembangan pradewasa dan lama hidup imago M. procris pada
daun jabon merah relatif lebih singkat daripada daun jabon putih. Sebaliknya rata-rata ukuran pradewasa dan imago relatif lebih besar pada daun jabon putih daripada daun jabon merah. Larva lebih memilih pakan daun jabon merah daripada daun jabon putih pada preferensi makan metode pilihan. Daun jabon putih lebih banyak mengandung senyawa primer daripada jabon merah. Sebaliknya pada daun jabon merah konsentrasi kandungan senyawa metabolik sekunder kuinon dan steroid lebih banyak daripada daun jabon putih.
Saran
Perlu adanya penelitian lanjutan tentang kandungan kimia baik senyawa primer maaupun senyawa metabolik sekunder dari daun jabon merah dan putih pada umur yang bervariasi. Terkait dengan sistem MFO dapat dilakukan uji lanjut secara genetika pada larva M. procris terhadap jenis kandungan senyawa-senyawa
23
DAFTAR PUSTAKA
Ahmad I, Kamal M. 2001. Consumption and utilization of complete defined diets containing various carbohydrate by Spodoptera exempta (Lepidoptera:
Noctuidae). BIOTA VI (3): 99-104.
Ahmad S. 1982. Roles of mixed-fuction oxidates in insects herbivory. Proc. 5th
int, Symp. Insect-Plant Relationships. Wageningen University (NL).
Andrianti T. 2011. Siklus hidup dan dinamika populasi stadia pradewasa kupu-kupu Acraea violae Fabricius (Lepidoptera: Nymphalidae). [tesis]. Fakultas
MIPA, Jurusan Biologi, Universitas Andalas, Padang. (ID).
[AOAC] Association of Official Analytical Chemists. 2005. Official methods of analysis of the AOAC. AOAC Inc. Arlington. Virginia (US). Bab 4. Butir 4.5.
Bariyah H. 2011. Hubungan antara panjang probosis kupu-kupu dengan preferensi pakan di areal Kampus 1 Universitas Islam Negeri Syarif Hidayatullah. [skripsi]. Fakultas Sains dan Teknologi, Jurusan Biologi, Universitas Islam Negeri Syarif Hidayatullah, Jakarta. (ID).
Bernays EA, Chapman RF. 1994. Host-plant selection by phytophagous insects.
Chapman and Hall. International Thomson Publishing Company. New York (US).
Borror DJ, Triplehorn CA, Johnson NF. 1989. Pengenalan Pelajaran Serangga.
Partosoedjono S. Penerjemah. Brotowidjoyo MD. Penyunting. Gadjah Mada University Pr. Yogyakarta (ID). Terjemahan dari: An Introduction to The Study of Insects. 1083 pp.
Bourinbaiar AS, Huang SL. 2006. The insect activity of plant. J Entomol. 32:
141-153.
Brower LP, Ivie MA, Fink LS, John RW, Raymond AM. 1992. Life history of
Anetia Briarea and its bearing on the evolutionary relationships of the
Danainae (Lepidoptera: Nymphalidae). J Tropic Lepidop. (IN). 3(2): 64-73.
Coley PD. 1988. Effects of Plant Growth Rate and Leaf Lifetime on The Amount and Type of Anti-Herbivore Defense. Oecologia (Berlin). 74:531-536.
Corbet AS, Pendlebury HM. The butterflies of the malay peninsula 4th Edition,
Malay Nat Soc. [internet]. [diunduh 2013 Desember 02].
Dadang. 2006. Konsep hama dan dinamika populasi. Workshop Hama dan Penyakit Tanaman Jarak (Jatropha curcas Linn.): Potensi Kerusakan dan
Teknik Pengendaliannya. Departemen Proteksi Tanaman, Fakultas Pertanian, IPB.Bogor (ID).
Darwiati W, Lelana NE, Anggraeni I. 2010. Limenitis procris (Moduza procris):
Serangga yang berpotensi sebagai hama jabon (A. cadamba Miq). Prosiding
Pusat Penelitian Hasil Hutan Tanaman. Bogor (ID). Hlm: 273-276.
Halawane JE, Hidayah HN, Kinho J. 2011. Prospek Pegembangan Jabon Merah (Anthocephalus macrophyllus Roxb. Havil) Solusi Kebutuhan Kayu Masa
Depan. Balai Penelitian dan Pengembangan Kehutanan Manado. (ID). Harborne JB. 1987. Metode Fitokimia. Diterjemahkan oleh Padmawinata K.
Soediro I. ITB, Bandung (ID). Hlm: 5-15.
Heyne K. 1987. Tumbuhan Berguna Indonesia Jilid III. Badan Litbang Kehutanan
24 Hui YH. 2006. Handbook of Food Science, Technology, and Engineering Volume
1. Taylor and Francis Group. Boca Raton.
Krisnawati H, Kallio M, Kanninem M. 2011. Anthocepalus cadamba Miq.
Ekologi, Silvikultur, dan Produktivitas. CIFOR. Bogor (ID).
Martawijaya A, Kartasujana I, Mandang YI, Prawira SA, Kadir K. 1989. Atlas Kayu Indonesia Jilid II. Pusat Penelitian dan Pengembangan Hasil Hutan.
Bogor (ID): Indonesia.
Morrell R. 1948. Notes on the larvae of some common Malayan butterflies. Malay Nat J. 3(2): 1-8.
Morrell R. 1960. Malayan Natural Hanbook. Common Malayan Butterflies.
Longman (MY).
Nuringtyas TR, Purwanto H, Rochayati A. 2007. Senyawa metabolik sekunder pada daun muda dan tua empat jenis tanaman pakan alami ulat Attakus (Attacus atlas). [abstrak]. Fakultas Biologi, Universitas Gajah Mada.
Yogyakarta (ID). Berkala Ilmiah Biologi (6) 1:63-70.
Price PW. 2000. Host plant resource quality, insect herbivores and biocontrol.
Proceedings of The X International Symposium on Biological Control of Weeds 583. 14 July 1999, Montana State University, Bozeman, Montana.
(US). Pp. 583-590.
Purnomo H. (2010). Pengantar Pengendalian Hayati. Penerbit: CV. Andi Offset.
Yogyakarta. (ID).
Purnomo, Rauf A, Sasromarsono S, Santoso T. 2008. Kesesuaian dan preferensi
Liriomyza huidobrensis (Blanchard) (Diptera: Agromyzidae) pada berbagai
tumbuhan inang. J HPT Trop. 8(2): 102-109.
Rayalu MB, Naidu MT, Atluri JB, Reddi CS. 2011. Life history and larval performance of the Joker butterfly, Byblia ilithyia (Lepidoptera:
Nymphalidae). J Entomol SocIran. (IR). 31(1): 71-85.
Robinson T. 1991. The Organic Constituen of Higher Plants. 6th Edition.
Department of Biochemistry. University of Massachusetts. (US).
Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi. ITB : Bandung
Sanches PA. 1992. Sifat dan Pengelolaan Tanah Tropika. Jurusan Ilmu Tanah tropika. Terjemahan Properties and Management in The Tropics. ITB, Bandung. (ID).
Schoonhoven LM, Jermy T, Van Loon JJA. 1997. Insect-Plant Biology (from Physiology to Evolution). Chapman and Hall. London-Glasgow. (GB)
Soejono. 1990. Petunjuk Laboratorium Analisis dan Evaluasi Pakan. Fakultas Peternakan Universitas Gadjah Mada. Yogyakarta. (ID).
Soerianegara I, Lemmens RHMJ. 1993. Plant resources of south-east asia timber trees: Major commercial timbers. Pudoc Scientific Publishers 5th. Wageningen, Belanda. (NL).
Soviani E. 2012. Identifikasi parasitoid pada Erionota thrax yang terdapat dalam
daun pisang (Musa paradiciaca). [skripsi]. Fakultas Biologi, Universitas
Pendidikan Indonesia. Bandung (ID).
Susanty SC. 2014. Bioekologi Hama Arthroschista hilaralis (Lepidoptera:
Pyralidae) pada Tanaman Jabon (Anthocephalus cadamba Miq.). [tesis].
25 Syahputra E. 2005. Bioaktivitas insektisida botani Calophyllum soulattri Burm.
F. (Clusiaceae) sebagai pengendali hama alternatif [disertasi]. Bogor (ID). Sekolah Pascasarjana, Institut Pertanian Bogor.
Syahputra E, Manuwoto S, Darusman LK, Dadang, Prijono D. 2004. Aktivitas insektisida bagian tumbuhan Calophyllum soulattri Burm. F. (Clusiaceae) terhadap larva Lepidoptera. J HPT Trop 4:23-31.
Untung K. 1996. Pengantar Pengelolaan Hama Terpadu. Yogyakarta: Gadjah
Mada University Pr.
Urich FC, Emmel TC. 1990. Life histories of neotropical butterflies from trinidad.
26
DAFTAR LAMPIRAN
Lampiran 1 Stadium larva dan pupa serta lama hidup imago Moduza procris
pada jabon merah (hari)
Keterangan: L = larva
SD = standar deviasi
Lampiran 2 Stadium larva dan pupa serta lama hidup imago Moduza procris pada
2 Lampiran 4 Ukuran pradewasa Moduza procris pada jabon putih (mm)
Ulangan Telur Larva 1 Larva 2 Larva 3 Larva 4 Larva 5 Pupa betina Pupa jantan Keterangan: PT = panjang tubuh larva
3 Lampiran 5 Ukuran imago Moduza procris pada daun jabon merah dan putih (mm)
Keterangan: PT = panjang tubuh imago RS = rentang sayap imago SD = standar deviasi
Lampiran 6 Jumlah parasitoid yang ditemukan pada fase pupa (ekor) Sampel
pupa Jumlah parasitoid per pupa Parsitoid yang keluar Asal pupa 1
Lampiran 7 Jumlah luas daun yang dimakan larva per hari dengan metode tanpa pilihan (cm2)
Ulangan Hari Jabon merah Jabon putih
ke-1 Hari ke-2 Hari ke-3 Hari ke-1 Hari ke-2 Hari ke-3
Lampiran 8 Jumlah luas daun yang dimakan larva per hari dengan metode pilihan (cm2)
Ulangan Hari Jabon merah Jabon putih