PRODUKSI ALKOHOL OLEH
Saccharomyces ellipsoideus
DENGAN
TETES TEBU (MOLASE) SEBAGAI BAHAN BAKU UT AMA
Oleh
WAHYUDI
L--F 30.1573
1997
FAKULTASTEKNOLOGIPERTANIAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
Penggunaan etanol sebagai bahan kimia dewasa ini cukup luas, antara lain untuk keperluan kosmetik, obat-obatan, bahan pelarut, bahan bakar, bahan pengawet dan untuk pembuatan bahan kimia lain, seperti asam asetat, aseton, eter, dan lain-lain. Penggunaan etanol dalam skala industri dari tahun ke tahun semakin meningkat sesuai dengan penggunaannya.
Tujuan penelitian ini adalah untuk mencari kondisi yang optimal, terutama konsentrasi starter dan substrat untuk pertumbuhan mikroorganisme penghasil alkohol yaitu Saccharomyces e/lipsoideus agar menghasilkan kadar alkohol dengan rendemen produk-substrat (Yp/s) yang tinggi.
Tetes tebu (molase) adalah salah satu hasil samping pabrik gula tebu yang masih mempunyai nilai ekonomi yang cukup disebabkan kandungan gulanya yang tinggi sekitar 52 persen (Baikow, 1982), sehingga memungkinkan dijadikan bahan baku berbagai industri. Industri yang memanfaatkan tetes diantaranya adalah industri yang menghasilkan produk distilasi seperti rum, a1kohol; industri fermentasi seperti monosodium glutamat, L-lisin, asam sitrat, vinegar, protein sel tunggal, aseton-butanol, gum xanthan dan sebagainya.
dengan kadar alkohol 9,29 persen.
TETES TEBU (MOLASE) SEBAGAI BAHAN BAKU UTAMA
Oleh
WAHYUDI
F 30.1573
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Jurusan Teknologi Industri Pertanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
1997
FAKULTASTEKNOLOGIPERTANIAN
INSTITUT PERTANIAN BOGOR
PRODUKSI ALKOHOL OLEH
Saccharomyces ellipsoideus
DENGAN
TETES TEBU (MOLASE) SEBAGAI BAHAN BAKU UTAMA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada JUl'usan Teknologi Industri Peltanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
WAHYUDI
F 30.1573
Dilahirkan pada tanggal 6 Desember 1974 di Cirebon
Dr. Ir. Khaswar Syamsu, MSc Dosen Pembimbing II
Bismillaahirrohmaanirrohiim
Segala puji dan syukur senantiasa penulis panjatkan kehadirat Allah SWT, kl1l'ena hanya atas rahmat dan hidayah-Nya penelitian dan penulisan skripsi ini dapat diselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat kelulusan dan memperoleh gelar Sarjana Teknologi Pertanian pada jurusan Teknologi Industri Pcrtanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Penyelesaian penulisan skripsi ini tentlmya tidak terlepas dari dukungan berbagai pihak. Oleh karena itu pada kesempatan ini penulis dengan segala hormat dan setulus-lulusnya menyampaikan banyak terima kasih kepada Ir. H. A. Sjaiful Alim selaku pilllPinan PT Spiritus Palimanan, Cirebon dan Ir. M. Sugirwan, BSc selaku Pj Chemiker Kcpala PT Spiritus Palimanan, Cirebon yang telah memberikan ijin, kesempatan dan kemudahan kepada penulis untuk melakukan penelitian di
PT
Spiritus Palimanan, Cirebon, seluruh staf dan karyawanPT
Spiritus Palimanan, Cirebon atas kerarnahan dan bantuannya selama penulis melakukan penelitian ini. Terima kasih pula penulis sampaikan kepada Dr. Ir. H. Abdul Aziz DaIwis, MSc dan Dr. Ir. Khaswar Syarnsu, MSc selaku dosen pembimbing yang telah begitu sabar dan ikhlas meluangkan banyak waktunya yang sangat berharga untuk memberikan masukan, saran dan bimbingannya kcpada penulis serta Dr. Ir. Djumali Mangunwidjaja, DEA dan Drs. Purwoko selaku dosen penguji atas masukan dan saran-sarannya. Terakhir penulis ucapkan terima kasih kepada kedua orang tua dan saudara-saudara penulis yang telah banyak memberikan1111.
Akhimya dengan segala kerendahan hati, penulis menyampaikan permohonan
Illaar atas segala kesalahan dan kekurangan dalam penulisan skripsi ini. Semua kritik
dall saran yang membangun kearah penyempumaan skripsi ini sangat penulis hargai. Mudah-mudahan skripsi ini dapat bermanfaat bagi yang memerlukannya.
Bogor, September 1997
Penulis
KATA PENGANTAR ... 111
DAFTAR lSI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
I)AFTAR LAMPIRAN ... ix
I. PENDAHULUAN A. LATARBELAKANG ... . B. TUJUAN PENELITIAN ... 3
II. TINJAUAN PUSTAKA A. TETES TEBU ... 4
B. KHAMIR ... 7
C. PERTUMBUHAN MIKROBIAL ... 10
D. FERMENTASI ALKOHOL ... 13
III. METODOLOGI A. BAHAN DAN ALA T 1. Bahan ... 18
2. Alat ... 18
B. METODA PENELITIAN 1. Penelitian Pendahuluan ... .... ... ... ... ... ... ... .... .... ... .... ... ... ... .... ... ... 19
b. Proses Fermentasi Alkohol ... 20
3. Perlakuan... ... ... ... ... ... ... ... . .. 22
c.
PARAMETER KINETIKA FERMENTASI ... 22D. ANALISIS ... 23
E. W AKTU DAN TEMP A T ... 28
IV. HASIL DAN PEMBAHASAN A. PENELITIAN PENDAHULUAN 1. Analisis Bahan Baku ... 29
2. Seleksi Starter ... 31
B. PENELITIAN LANJUT AN I. pH ... : ... 33
2. Kadar Alkohol ... 35
3. Kadar Gula Sisa Tak Terfermentasi ... 39
4. Efisiensi Penggunaan Substrat ... 40
V. KESIMPULAN DAN SARAN A. KESIMPULAN ... 43
B. SARAN ... 43
I)AFTARPUSTAKA ... 45
1.I\MPlRAN ... 47
Tabel 1. Komposisi kimiawi tetes tebu (molase) ... 5 Tabel2. Kandungan vitamin tetes tebu (mo1ase) ... 6 Tubel3. Hasil analisis komposisi tetes tebu (mo1ase) ... 7 Tabel4. Hasil analisis komposisi tetes tebu (molase) dari PT Spiritus
Palimanan, Cirebon ... ... ... ... . .. 30 Tabel 5. Perbandingan produksi alkohol oleh Saccharomyces ellipsoideus
selama tujuh hari ... 38 l'ube! 6. Efisiensi penggunaan substrat pada substrat 22 °Brix, 24 °Brix,
dan 26 °Brix ... 42
Gambar I. Bagan alir proses fermentasi alkohol dari tetes tebu (molase) ... 21
Gambar 2. Perbandingan produksi alkohol dengan konsentrasi starter 10 %, 15 %, dan 20 % (v/v) ... 32
(,ambar 3. Profil pH selama fermentasi ... 33
Uambar 4. Profil kadar alkohol selama fermentasi ... 36
Gambar 5 .. Profil kadar gula sisa tak terfermentasi selama fermentasi ... 39
-
.-Gambar 6. Profil efisiensi penggunaan substrat selama fermentasi ... 41Lampiran 1. Rekapitulasi data hasil fermentasi alkohol pada substrat 20 °Brix ... 47
Lampiran 2. Perbandingan produksi alkohol oleh Saccharomyces ellipsoideus pada substrat 20 °Brix ... 48
I.Hmpiran 3. Rekapitulasi data hasil fermentasi alkohol pada konsentrasi starter 15 % (v/v) ... ... 49
I.ampiran 4. Produksi alkohol oleh Saccharomyces ellipsoideus pada substrat 20 °Brix ... 52
I ,Hlllpiran 5. Perbandingan hasil fermentasi alkohol antar konsentrasi starter pada substrat 20 °Brix selama 7 hari ... 53
I ,:lInpiran 6. Produksi alkohol oleh Saccharomyces ellipsoideus pada konsentrasi starter 15 % (v/v) ... 54
I.Hmpiran 7. Perbandingan hasil fermentasi alkohol antar substrat pada konsentrasi starter 15 % (v/v) selama 7 hari (rataan dua kali ulangan) ... 55
1.:lInpiran 8. Perbandingan efisiensi penggunaan substrat selama fermentasi alkohol oleh Saccharomyces ellipsoideus ... 56
I.Hmpiran 9. Hubungan antara koreksi suhu pada penentuan Brix tetes ... 57
Lampiran 10. Hubungan antara skala alkoholmeter dengan suhu ... 58
1.:lInpiran 11. Tetapan untuk cara inversi menurut STEUERWALD ... 59
dalam tetes secara iodometrik) ... 60 Lampiran 13. lumlah gram gula invert sesuai dengan selisih titrasi yang meningkat
dengan 0,1 dan dalam larutan titrasi terdapat 0 gram sakarosa... 61
A. LATARBELAKANG
'f.
Etanol merupakan bahan kimia yang mempunyai kegunaan luas, antara lain untuk keperluan kosmetik, obat-obatan, bahan pelarut, bahan bakar, bahan pengawet dan Lmtuk pembuatan bahan kimia lain, seperti asam asetat, aseton, eter dan lain-lain. Penggunaan etanol dalam skala industri dari tahun ke tahun semakin meningkat sesuai dengan penggunaalmya.
Alkohol, etanol khususnya dapat dibuat dari berbagai bahan hasil pertanian. Secara umum bahan-bahan terse but dapat dibagi dalam tiga golongan yaitu bahan yang mengandung turunan gula, sebagai golongan pertama antara lain molase, gula tebu, gula bit dan sari buah anggur. Golongan kedua adalah bahan-bahan yang mengandung pati seperti biji-bijian (misalnya gandum), kentang dan tapioka. Jenis atau golongan yang terakhir adalah bahan yang mengandung selulosa seperti kayu dan beberapa limbah pertanian. Selain itu, khususnya etanol dapat dibuat juga dari bahan yang l11erupakan hasil proses lain, contohnya adalah elilen.
dengan bantuan aktivitas kehidupan mikroorganisme untuk mengubah bahan baku menjadi etanol. Bahan baku untuk pembuatan etanol secara fermentasi urnurnnya berupa bahan yang mengandung gula, seperti buah-buahan, ubi kayu, beras, tetes tebu (molase) dan lainnya.
Beberapa jenis khamir digunakan dalam fermentasi alkohol. Saccharomyces cerevisiae var. ellipsoideus (Amerine el al., 1987) sering digunakan karena mampu menghasilkan etanol dengan rendemen yang tinggi (16 - 18 persen) pada media yang dirancang dengan baik. Khamir lain yang dapat digunakan adalah
Schizosaccharomyces sp, Saccharomyces uvarum dan Kluyveromyces sp (Rehm dan Reed, 1981).
Karakteristik suatu proses industri alkohol tergantung pada pilihan mikroorganisme yang digunakan dalam fermentasi. Mikroorganisme yang digunakan harus menghasilkan etanol yang tinggi, toleran terhadap kadar etanol tinggi, mampu hidup pada suhu tinggi, tetap stabil selama proses fermentasi dan pada pH rendah (Rehm dan Reed, 1981).
B. TUJUAN PENELITIAN
A. TETES TEBU
Tetes tebu (molase) adalah salah satu hasil samping yang berasal dari proses pembuatan gula tebu (sukrosa). Tetes tebu ini merupakan cairan kental sisa industri gula yang tidak dapat lagi membentuk kristal sukrosa pada proses kristalisasi (Paturall. 1982). Komposisi tetes tebu dipengaruhi oleh varietas dan kel11atangan tebll. kondisi iklil11 dan tanah. Selain itu kondisi proses di dalal11 pabrik gula juga l11empengaruhi kOl11posisi tetes tebu (Baker, 1980).
Setiap ton tebll akan l11enghasilkan sekitar 2,7 persen tetes tebu, tetapi hal ini dipengaruhi oleh beberapa fal<tor sepelii varietas tebu, keadaan tanah, iklil11 dan sebagainya. Pada Ul11Ul11nya tetes tebu yang diperoleh bervariasi antara 2,2
3,7 persen (PatUl'au, 1982).
Tetes tebu tersusun dari bahan organik, anorganik dan air. Sekitar 52 persen dari tetes tebu l11erupakan total gula (sukrosa, dekstrosalglukosa, dan laevulosa/fruktosa), sekitar 10 persen atau lebih adalah garal11 anorganik atau abu, 10 - 20 persen air dan selebihnya bahan organik non gula. Kandungan gula dalal11 tetes tebu bervariasi tergantung dari varietas tebu, periode penanal11an dan pel11anenan, cara pengolahan di perusahaan dan lain sebagainya (Baikow, 1982).
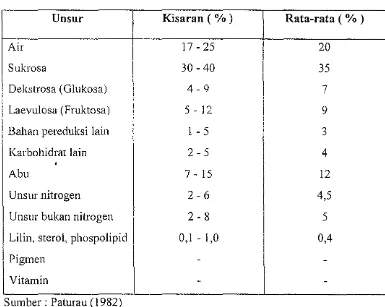
yang lebih keci!. Kadar bukan gula terutama tersusun oleh asam organik dan protein. Mineral yang terdapat pada tetes tebu terutama terdiri dari kalium, kalsium, dan magnesium. Komposisi kimiawi tetes tebu disajikan pada Tabel 1. Tabel I. Komposisi kimiawi tetes tebu (molase)
Unsur Kisaran (%) Rata-rata ( % )
Air 17 - 25 20
Sukrosa 30 - 40 35
I
Dekstrosa (Glukosa) 4-9 7
,
Laevulosa (Fruktosa) 5 - 12 9
I
!
Bahan pereduksi lain I - 5 3
Karbohidrat lain 2-5 4
•
Abu 7 - 15 12
Unsur nitrogen 2-6 4,5
Unsur bukan nitrogen 2-8 5
Lilin, sierol, phospolipid 0,1 - 1,0 0,4
Pigmen -
-Vitamin
-
-Sumber: Paturau (1982)
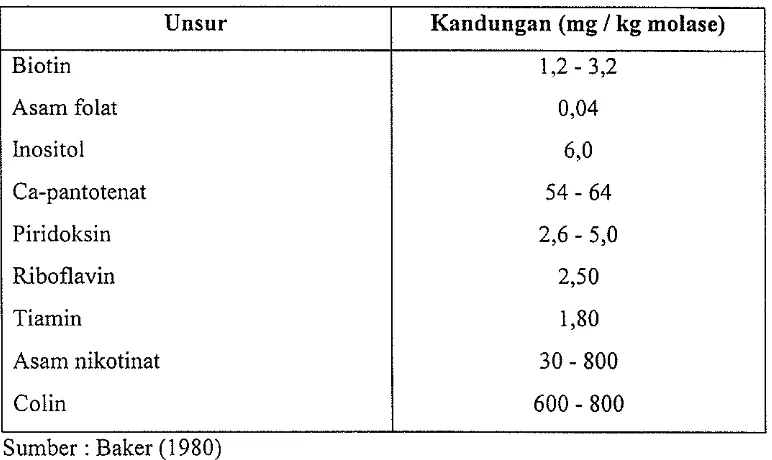
[image:18.600.145.530.289.596.2]Tabel 2. Kandlmgan vitamin tetes tebu (molase)
Unsur Kandungan (mg / kg molase)
Biotin 1,2 - 3,2
Asam folat 0,04
Inositol 6,0
Ca-pantotenat 54 - 64
Piridoksin 2,6 - 5,0
Riboflavin 2,50
Tiamin 1,80
Asam nikotinat 30 - 800
Colin 600 - 800
Sumber : Baker (1980)
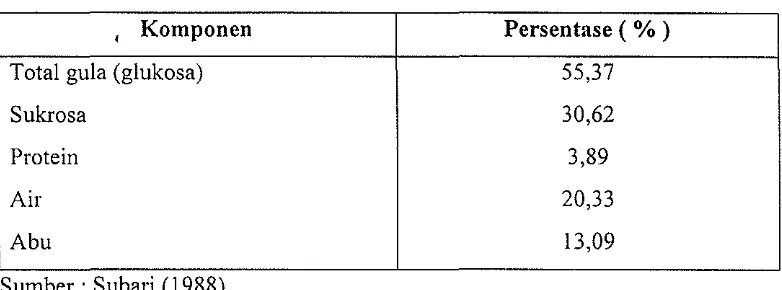
[image:19.595.144.530.152.382.2]Tabel 3. Hasil anal isis komposisi tetes tebu (molase)
•
Komponen Persentase ( % )Total gula (glukosa) 55.37
Sukrosa 30,62
Protein 3,89
Air 20,33
Abu 13,09
Sumber : Suban (1988)
Tetes tebu yang dihasilkan pabrik biasanya mengandung gula sekitar 48
-55 persen. Konsentrasi gula tersebut terlalu pekat untuk pertumbuhan khamir. Konsentrasi gula yang terlalu pekat kurangbaik karena akan mengbasilkan alkohol yang terlalu tinggi konsentrasinya sehingga menghambat pertumbuhan khamir. Tetes tebu yang akan digunakan diencerkan' terlebih dahulu sehingga kadar gulanya mencapai 12 - 17 persen atau secara kasar satu volume tetes tebu diencerkan menjadi empat volume total (Wanto dan Soebagyo, 1980).
B.KHAMIR
Khamir adalah mikroorganisme bersel tunggal dengan bentuk oval tak beraturan dan berukuran antara 5 - 20 mikron (Paturau, 1982). Bentuk khamir terdiri dari berbagai macam, seperti bentuk bola (spheroidal), bentuk telur
(ovoidal), bentuk silinder (cylindrical), bentuk lengkung (ogival), bentuk segitiga
[image:20.597.139.530.150.295.2]induknya setelah pembelahan maka akan terjadi bentuk yang disebut
pseudomiselium dan beberapa jenis khamir membentuk kapsul di sebelah luar (Buckle et ai., 1985).
Khamir tidak bergerak, karena itu tidak mempunyai struktur tambahan di bagian luamya seperti flagella. Khamir dapat tumbuh dalam media cair dan padat. Pembelahan selnya terjadi secara aseksual dengan pembentukan tunas. Mula-mula timbul tunas kecil dari permukaan sel induk, tunas ini secara bertahap membesar dan setelah mencapai ukuran yang sarna dengan induknya, teIjadi pengerutan yang akan melepaskan tunas dari induknya, sel baru terbentuk selanjutnya memasuki tahap pertunasan kembali (Buckle et ai., 1985).
Fungsi utama khamir dalam pembuatan etanol adalah mengubah gula dalam substrat menjadi etil alkohol dan karbon dioksida. Menurut Frazier (1977), enzim yang dihasilkan khamir adalah enzim inveltase yang berfungsi sebagai pemecah sukrosa menjadi monosakarida (glukosa dan fruktosa), serta enzim zimase yang mengubah monosakarida terse but menjadi etanol pada proses fermentasi.
khlorin. Di sampmg itu, juga dibutuhkan dalam jumlah sedikit unsur-unsur mineral sepelti Mn, Zn, Ba dan Fe. Faktor pertumbuhan (growth factor) yang paling penting dibutuhkan untuk meningkatkan pertumbuhan dan rendemen sel khamir adalah inositol, tiamin, pantothenat, vitamin, asam nikotinat dan biotin. Menurut Fiechter (1982), kebutuhan nitrogen biasanya dipenuhi dalam bentuk amonia atau garam amonium, terutama amonium sulfat dan untuk alasan ekonomis biasanya digunakan urea.
Produktivitas sel khamir merupakan fungsi dari konsentrasi glukosa, oksigen dan konsentrasi etanol (beberapa variabel kontrol juga berpengaruh seperti suhu dan pH). Glukosa merupakan reaktan dasar untuk metabolisme khamir. Pada konsentrasi glukosa rendah (lebih kecil dari 10 mgll) kecepatan konsumsi glukosa meningkat secal'a linear sebanding dengan konsentrasi glukosa. Pada konsentrasi tinggi (lebih besar dari 150 gil), glukosa akan menghambat kerja enzim dengan menekan rantai oksidasi. Pada konsentrasi glukosa sedang (3 - 100 gil), glukosa dapat menahan reaksi oksidasi katabolit sehingga memungkinkan produksi etanol, bahkan pada kondisi jumlah oksigen dalam substrat beriebih (Fiechter, 1982).
(lebih kecil dari 20 gil) pengaruh ini dapat diabaikan, Menurut Wanto dan Soebagyo (1980), etanol pada konsentrasi tinggi dapat mendenaturasi protein dan melarutkan lemak, sehingga dinding sel rusak dan plasma membeku, akibatnya mikroorganisme akan mati,
Produksi etanol oleh khamir adalah proses anaerobik, meskipun pertumbuhan sel baru memerlukan oksigen, dan sedikit oksigen masih diperlukan untuk menunjang kehidupan sel penghasil etanol. Pada aras metabolik cara pengaturan produksi etanol dari glukosa cukup kompleks, konsentrasi substrat, oksigen dan produk (etanol), semua mempengaruhi metabolisme khamir, daya hidup sel, pertumbuhan sel, pembelahan sel dan produksi etanol. Oleh karena itu pemilihan strain khamir yang tepat untuk konsentrasi substrat dan etanol tinggi merupakan syarat utama untuk dapat meningkatkan hasil atau produk (Higgins
,
et ai" 1984),C. PERTUMBUHAN MIKROBIAL
Pettumbuhan sel merupakan puncak aktivitas fisiologis yang saling mempengaruhi secat'a beraturan, Proses pertlmlbuhan ini sangat kompleks mencakup pemasukan nutrien dasar dari lingkungan ke dalatn sel, konversi bahan-bahan nutrien menjadi energi datl berbagai konstituen sel yang vital serta perkembangbiakan (Moat, 1979),
pertumbuhan tergantung pada lingktmgan fisik dan kimianya (Rehm dan Reed, 1981). Pada keadaan lingkungan tertentu pertumbuhan mikrobial dapat dinyatakan dalam persamaan sebagai berikut,
dx = fl x - a x (Rehm dan Reed, 1981) ... (1)
dt
keterangan : x
=
konsentrasi sel t = waktu fermentasifl = laju pertumbuhan spesifik
a = laju lisis sel yang menghambat pertumbuhan
Pada kondisi yang sesuai maka penunman massa sel sangat kecil sehingga a dapat diabaikan dan persamaan (1) menjadi,
dx
=
fl x (Rehm dan Reed, 1981) ... (2) dtIntegrasi dari persamaan (2) untuk menghasilkan nilai penillgkatan massa sel pada suatu selang waktu teltentu adalah,
X2 t2
f
dx =f
fl dt (Rehm dan Reed, 1981) ... (3)Xl x tl
akan diperoleh persamaall,
Ln (X2! Xil
=
fl llt (Rehm dan Reed, 1981) ... (4)Laju peltumbuhan spesifik (fl) bersifat tidak konstan tergantung pada
metabolik yang menghambat pertumbuhan masih rendall (Rehm dan Reed, 1981 ).
Frazier (1977) membagi laju pertumbuhan mikrobial menjadi tujuh tallapan, yaitu tahap persiapan, tallap pertumbuhan dipercepat, tallap pertumbuhan logaritmik (eksponensial), tallap pertumbuhan diperlambat, tahap pertumbuhan tetap, tahap kematian dipercepat dan tahap kematian.
Menurut Frazier (1977), pada tahap persiapan sel mikroorganisme tidak mengalami pertumbuhan atau bahkan penurunan. jumlall. Pada tahap pertumbuhan dipercepat mikroorganisme mengalami pertumbuhan yang meningkat. Pertumbuhan mikrobial mencapai nilai maksimal pada tallap pertumbuhan logaritmik. Rehm dan Reed (1981) menyatakan ballwa tallap pertumbuhan logaritmik terjadi pada saat terdapat kelebihan nutrien dan semua
mikroorganisme memplmyai kemampuan untuk berkembangbiak. Laju
pertumbuhan mikrobial menurun pada tahap pertumbuhan diperiambat. Jumlah mikroorgaisme tidak bertambah pada tallap pertumbuhan tetap. Laju kematian meningkat pada tallap kematian dipercepat. Laju kematian mencapai nilai konstan pada tahap kematian (Frazier, 1977).
kultur dengan menggunakan spektrofotometer, dan (3) pengukuran tidak langsung massa sel, antara lain dengan mengukur konsumsi substrat atau nutrien (misalnya konsumsi sumber karbon, nitrogen, oksigen dan sebagainya) dan analisis komposisi sel.
D. FERMENTASI ALKOHOL
Fermentasi adalah suatu proses perubahan kimia pada substrat organik, baik karbohidrat, protein, lemak atau lainnya, melalui kegiatan biokatalis dan
dikenal sebagai enzim yang dihasilkan oleh jenis mikroorganisme spesifik (Prescott dan Dunn, 1981). Fermentasi anaerob adalah fermentasi yang tidak memerlukan oksigen, sedangkan fermentasi aerob adalah fermentasi yang memerlukan oksigen (Wanto dan Soebagyo, 1980).
Paturau (1982) mendefinisikan fermentasi sebagai proses yang menyebabkan terjadinya perubahan-perubahan kimia di dalam substrat organik melalui katalis biokimiawi (enzim) yang dihasilkan oleh mikroorganisme tertentu yang hidup didalamnya. Sedangkan Wang et al. (1979) mendefmisikan fermentasi sebagai semua kegiatan mikrobial atau ekstrak dari sel dalam menggunakan senyawa organik dan anorganik, yang meliputi kegiatan pertumbuhan, asimilasi, biosintesis dan disimilasi.
piruvat yang dihasilkan akan didekarboksilasi menjadi asetaldehida yang kemudian mengalami dehidrogenasi menjadi etanol.
Proses fermentasi yang ideal menurut persamaan Gay-Lussac akan memberikan hasil 51, I persen etanol dan 48,9 persen karbon dioksida. Hasil optimal yang diharapkan bila dinyatakan dari persentase gula yang difermentasi adalah (dinyatakan dengan persen berat) etil alkohol 48,4 persen, karbon dioksida 46,6 persen, gliserol 3,3 persen, asam suksinat 0,6 persen, selulosa dan lainnya 1,2 persen. Hasil etil alkohol 48,4 persen Pasteur adalah sekitar 94,5 persen dari nilai teoritis Gay-Lussac (51,1 persen). Dalam kenyataannya jarang di perusahaan diperoleh efisiensi fermentasi lebih besar dari 90 persen total gula invert yang diubah menjadi etanol (Paturau, 1982).
Menurut Wang et al. (1979), fermentasi dibedakan berdasarkan rancang bangun prosesnya menjadi tiga macam. Ketiga proses dasar ini adalah sistem nir-sinambung (batch), sistem semi sinambung (jed batch), dan sistem sinambung
(continuous ).
dalam pembentukan alkohol dari gula, contohnya dalam pembentukan heksosa dan triosa fosfat (Prescott dan Dunn, 1981).
Menurut Sastramihardja (1985), bahan baku yang dapat digunakan dalam pembuatan alkohol secara fermentasi dapat dibagi menjadi tiga macam, yaitu bahan-bahan seperti gula tebu, gula bit, tetes dan cairan buah-buahan, bahan pati yang terdiri dari bahan-bahan seperti padi-padian dan kentang serta bahan selulosa seperti kayu.
Pada permulaan proses, khamir memerlukan oksigen untuk
pertumbuhannya. Oleh karena itu perlu diberi oksigen. Sesudah terjadi gas CO2
dan reaksi menjadi anaerob, maka dimulai pembentukan alkohol. Persamaan Gay-Lussac menunjukkan reaksi dalam fermentasi alkohol seperti berikut ini,
(glukosa) (etanol) (karbon dioksida)
Konsentrasi alkohol yang tinggi akan bersifat racun terhadap khamir. Alkohol akan menghalangi fermentasi lebih lanjut setelah tercapai konsentrasi 13 - 15 persen volume dan biasanya maksimal pada konsentrasi 13 persen volume. Hambatan konsentrasi alkohol terhadap fermentasi tergantung pada suhu dan jenis khamir yang digunakan (Prescott dan Dunn, 1981).
tidak semua gula dapat difermentasi. Sebaliknya jika konsentrasi gula terlalu rendah akan mengakibatkan biaya produksi meI1iadi lebih tinggi (Kirk dan Othmer, 1963). Wanto dan Soebagyo (1980), menyatakan bahwa tetes tebu diencerkan sehingga kadar gulanya 12 - 17 persen atau dengan menambahkan air sebanyak empat kali volume tetes tebu. Paturau (1982), menyatakan bahwa bahan bergula tersebut harus dipasteurisasi dahulu sebelum inokulasi sehingga mikroorganisme yang mengganggll fermentasi alkohol tidak aktif.
Suhu yang diperlukan untuk fermentasi alkohol adalah 20 - 30°C, kadang-kadang mencapai 35°C pada akhir fermentasi (Wanto dan Soebagyo,
1980). Menurut Prescott dan Dunn (1981), suhu optimal untuk fermentasi alkohol adalah 25 - 35°C. Kenaikan suhu akan menllrunkan ketahanan khamir terhadap alkohol yang dihasilkan dan akan meningkatkan pembentukan asam asetat yang bersifat racun (Prescott dan Dunn, 1981). Sedangkan Frazier dan Westhoff (1978) menyatakan bahwa sllhll optimal pertllmbuhan khamir pada fermentasi antara 25 - 30°C.
Derajat keasaman (pH) diatur antara 4,5 - 5,0 dengan menambahkan asam sulfat 1 - 2 liter per 1000 liter substrat (Paturau, 1982). Menurut Prescott dan Dunn (1981), pH yang digunakan dalam fermentasi alkohol dari tetes tebu adalah pH 4,0 - 4,7. Wanto dan Soebagyo (1980), mengemukakan bahwa pH yang diperlukan adalah 4,0 - 5,0.
sampmg. Pengaruh pH terhadap pertumbuhan khamir juga tergantung pada konsentrasi gula. Frazier dan Westhoff (1978), menyatakan bahwa pH akan mempengaruhi kecepatan fermentasi, pH optimal untuk pertumbuhan khamir adalah 4,0 - 4,5. Untuk menurunkan pH dapat digunakan asam sulfat dan untuk menaikkan pH digunakan natrium benzoat.
Paturau (1982) menyatakan bahwa fennentasi alkohol memakan waktu 30 72 jam. Sedangkan menurut Prescott dan Dunn (1981) walctu fennentasi alkohol yang diperlukan adalah 3 - 7 hari.
A. BAHAN DAN ALAT
1. Bahan
Bahan utama yang digunakan dalam penelitian ini adalah tetes tebu (molase) yang diperoleh dari PT Spiritus Palimanan, Cirebon dan biakan
Saccharomyces ellipsoideus diperoleh dari Laboratorium Mikrobiologi dan Teknologi Bioproses, jurusan Teknik Kimia ITB, Bandung.
Bahan-bahan kimia yang digunakan antara lain adalah asam klorida (HCI). natrium hidroksida (NaOH), as am sulfat (H2S04), serta bahan-bahan kimia untuk
anal isis bah an baku maupun anal isis produk fermentasi.
2. Ala!
B. METODA PENELITIAN
Penelitian ini dilakukan dalam dua tahapan, yaitu penelitian pendahuluan dan penelitian lanjutan.
I. Penelitian Pendahuluan
Penelitian pendahuluan ini dimaksudkan untuk mengetahui komposisi tetes tebu (molase) yaitu kadar sakarosa, kadar gula reduksi dan total kandungan gula. serta tmtuk mengetahui Brix tetes yang terdapat dalam tetes tebu.
2. Penelitian Lanjutan
a. Persia pan Starter
Pembuatan starter dilakukan secara bertahap dengan maksud untuk membantu proses adaptasi dari sアN」セィ。イッュケ」・ウ@ ellipsoideus terhadap media pertumbuhannya sehingga dapat melakukan aktivitas pertumbuhannya dengan baik dan mencapai kondisi optimal. Pembuatan starter dimulai dari volume 20 ml dalam tabung reaksi sampai 2000 ml dalam erlenmeyer, kemudian dilanjutkan dalam jerigen sampai volume 5000 ml.
Pada awalnya. satu ose biakan Saccharomyces ellipsoideus
lebih kurang 30°C. lsi tabung reaksi kemudian dipindahkan ke dalam erlenmeyer 250 ml dan ditambah tetes tebu baru sebanyak 180 ml, sehingga substratnya menjadi 13 °Brix dan diinkubasi pada suhu 30°C selama 24 jam. Dengan cara yang sarna pembuatan starter dilanjutkan menjadi volume 1000 ml, 2000 ml sampai 5000 mi. Pada setiap tahap ini dilakukan penambahan nutrisi masing-masing TSP 5 mg/l, Urea 5 mg/I dan MgS04 I mg/I.
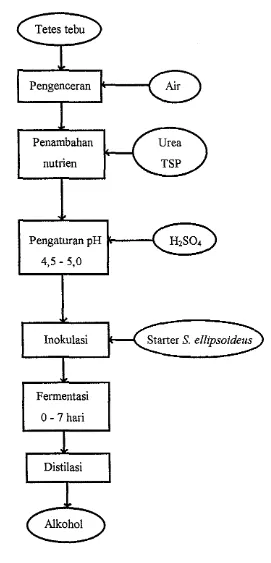
b. Proses Fermentasi Alkohol
Larutan tetes tebu dan air dibuat dalam jerigen yang telah disterilkan sampai 20 °Brix dengan volume 10 liter dan diaduk sampai merata. Setelah ilu ditambahkan tiga gram pupuk urea dan dua gram TSP, dikocok sampai laru!. Untuk mengatur pH hingga 4,5 - 5,0 ditambahkan larutan asam sulfat (H2S04) teknis. Larutan ini dicampur dengan starter dan mulut jerigen disumbat dengan penutup plastik. Inkubasi dilakukan selama tujuh hari. Terbentuknya gelembung-gelembung udara menunjukkan proses fermentasi pembentukan alkohol sedang beljalan.
Tetes tebu
Pengenceran
Penambahan nutrien
Pengaturan pH セMMサ@ 4,5 - 5,0
Inokulasi
Fermentasi 0-7hari
Distilasi
Alkohol
Starter S. ellipsoideus
[image:34.602.252.523.109.672.2]3. Perlakuan
F aktor-faktor yang digunakan pada penelitian ini adalah, a. Konsentrasi Starter Khamir
Konsentrasi starter khamir yang digunakan adalah 10 persen (v/v), 15
persen (v/v), dan 20 persen (v/v) dengan waktu fermentasi selama tujuh hari.
b. Substrat (Tetes tebu)
Perlakuan substrat dilakukan setelah mendapatkan konsentrasi starter khamir dengan kadar alkohol yang tinggi pada perlakuan sebelumnya. Substrat (tetes tebu) yang digunakan adalah 22, 24, dan 26 °Brix dengan waktu fermentasi selama tujuh hari dan dua kali ulangan.
(. PARAMETER KINETIKA FERMENT AS}
Parameter kinetika fermentasi yang diamati adalah,
I. Efisiensi Penggunaan Substrat
Efisiensi penggunaan substrat oleh mikroorganisme dapat dihitung dengan runms di bawah ini,
So - Si
(Pirt, 1975)
So
dimana, So = Konsentrasi substrat awal (gil)
2. Yield Produk (Yp/s)
Yield produk (Yp/s) adalah rendemen produk yang terbentuk per substrat yang dikonsumsi. Jadi.
Yp/s
=
D. ANALISIS L'.P L'.S
(Pirt, 1975)
l. Brix Tetes (Gandana dan Ananta, 1974)
Ditimbang 150 gram tetes tebu dalam panci bersih, kemudian ditambahkan 1350 ml aquades atau pengenceran 1500 : 150
=
10 kaJi dan diaduk sampai tetes melarut semua. Gelas mohl yang bersih diisi dengan larutan tetes tebu tersebut sampai penuh dan meluap. Dibiarkan beberapa detik agar gelembung-gelembung udara ke atas permukaan dan dihilangkan dengan meniupnya perlahan.2. Kadar Sakal'osa (Gandana dan Ananta, 1974)
Ditimbang dengan teliti 35,75 gram tetes tebn dari suatu contoh yang telah diaduk dalam sebuah cawan yang mempunyai tanda tera. Kemudian dilarutkan sedikit aquades, dengan sebuah corong dimasukkan ke dalam labu takar 250 011. Sambil digoncang-goncang ditambahkan berturut-turut 30 011 larutan timbal nitrat 50 persen dan 30 011 NaOH 8 persen. Kemudian ditambahkan aquades sampai batas lehel' (jangan digoncang-goncang). Apabila teljadi buih dihilangkan dengan beberapa tetes eter dan diisi sampai garis tanda 250 011. Setelah leher labu dikeringkan, gojog baik-baik dan ditapis, beberapa 011 filtrat pertama dibuang.
Filtl'at yang jernih dimasukkan ke dalam labu takar 100 / 110 011 sampai garis tanda 100 m1. Ditambahkan larutan alumunium sulfat 30 persen sampai garis tanda 110 ml. Keringkan lehel' labu, tambahkan satu sendok tanah infuserialkiselgur, gojog dan ditapis (beberapa filtrat pertama dibuang). Dari filtrat ini diamati pada polarimeter dengan menggunakan pembulu 200 mm. Dengan sebuah pipet 50 011 filtrat sisa penentuan polarisasi sebelum inversi tadi dimasukkan ke dalam labu takar 100 m1. Kemudian ditambahkan 30 011 HCI 1 : 1, goncang-goncang dan dibiarkan dalam keadaan tertutup selama dua jam, jika suhu ruang di atas 25°C atau selama tigajamjika suhu kurang dari 25°C.
suhu cruran dalam pembulu (tt) dan suhu polarimeter (t2) dengan termometer
ketelitian 0,1 ·C.
Kadar Sakarosa, 100 S
Z =
_-=---:-=-_
C - 1/2 t1
dimana, Z = Kadar sakarosa (persen)
S = Jumlah pengamatan polarisasi sebelum dan sesudah inversi dan tandanya dibalik lalu dikalikan dua (2)
C = Tetapan inversi menurut STEUERWALD (Lampiran 11)
t1 = Suhu cairan eC)
3. Kadar Gula Reduksi dengan Metoda Schrool (Gandana dan Ananta. 1974)
Ditimbang enam gram tetes tebu pada neraca analitik, diberi sedikit aquades
dan diaduk serta larutan dituangkan ke dalam labu takar 250 ml. Dicuci tempat
untuk menimbang tadi dengan aquades dan dimasukkan larutan basuhan ini ke
dalam labu yang digunakan. Kemudian ditambahkan 15 ml pb. asetat netral 10
persen, sesudah dicampur labu diisi terus dengan aquades sampai tepat garis tanda
250 ml, leher labu dikeringkan dan digojog serta disaring dengan kertas saring lipat
yang kering (filtrat pertama dibuang).
Filtrat diambil sebanyak 50 ml dengan pipet dan dimasukkan ke dalam labu
takar 100 ml, ditambahkan lima ml larutan campuran natrium phospat kalium
leher labu kemudian digojog dan disaring (filtrat pertama dibuang). Lima puluh 1111 filtrat kedua (0,6 gram tetes tebu) dipipet dan dimasukkan ke dalam labu erlenmeyer 300 ml, ditambahkan 50 ml larutan Fehling normal (25 ml Fehling 1 dan 25 ml Fehling II), pengambilan larutan Fehling kedua menggunakan pipet.
,
Diberi beberapa potong batu timbal dan diletakkan labu erlenmeyer di atas asbes kemudian dipanaskan dengan brander. Pemanasan ini diatur pendidihannya selama dua menit. Setelah pendidihan segera labu ditutup dengan gelas kimia kecil dan didinginkan cepat di bawah aliran air.
4. Kadar Gula Sisa Tak Terfermentasi (Gandana dan Ananta, 1974)
Diambil 20 ml contoh beslag dari fermentasi serta ditambahkan satu ml Hel pekat dan aquades kira-kira volume menjadi 50 ml di dalam erlenmeyer 300 m!, kemudian dipanaskan selama dua menit (dihitung setelah mendidih) dengan pendingin tegak didinginkan dengan air mengalir, setelah dingin dinetralkan dengan NaOH 8 persen dengan indikator metil merah sampai warna menjadi wama semula (warna beslag). Kemudian dimasukkan ke dalam labu 200 ml dan ditambahkan enam ml Lood asetat netral 10 persen dan diisi penuh sampai garis tanda tera dengan aquades, bila timbul buih ditetesi dengan eter. Ditambahkan satu sendok tanah infuserialkiselgur, lalu dikocok dan disaring (saringan
n
filtrat pertama jangan ditadahi, penyaril1gan dilakukan 2 - 3 kali hingga larutan jemih.Dipipet 15 ml ke dalam labu 100 ml dan ditambahkan dua ml larutan natrium fosfat kalium oksalat 10 persen sampai batas labu dengan aquades kemudian disaring (saringan II). 25 ml hasil saringan II dipipet dan dimasukkan ke dalam erlenmeyer 300 ml dan ditambahkan larutan Luuf lalu dididihkan selama lima menit dan didinginkan cepat dengan air yang mengalir. Kemudian ditambahkan 15 ml Kl 20 persen, 25 ml H2S04 25 persen hati-hati lalu dititrasi
Perhitungan
=
(Titrasi blanko - Titrasi contoh) x ml Thio yang diperoleh atau dipergunakan oleh contoh dijadikan ml thio 0,1 N. Kemudian daftar Luuf, dicari berapa mg sakarosa (gula) yang setara dengan ml thio yang dipergunakan. Tabel jumlah gram gula invert disajikan pada Lampiran 13.Kadar Gula Invert
=
mg sakarosa x pengenceran x 100 % mg contoh5. Kadar Alkohol (Gandana dan Ananta, 1974)
Beslag hasil fermentasi sebanyak 1000 ml didistilasi dan distilatnya ditampung sampai volume 400 ml, kemudian diukur dengan alkoholmeter bersamaan dengan suhu. Misal, angka yang ditunjukkan pada skala alkoholmeter 0,5 dan suhunya 30 ·C. Maka kadar alkohol sebenarnya adalah 0,7 x 0,4 liter = 0,28 persen. Hubungan antara skala alkoholmeter dengan suhu disajikan pada Lampiran 10.
6. pH dan Suhu
Pengukuran pH dilakukan dengan menggunakan pH meter, sedangkan temperatur diukur menggunakan termometer.
E. WAKTU DAN TEMPAT
A. PENELlTIAN PENDAHULUAN
1. Analisis Bahan Baku
Hasil analisis komposisi tetes tebu (molase) dari PT Spiritus Palimanan. Cirebon disajikan pada Tabel 4. Pada Tabel 4 terlihat bahwa total kandungan gula tetes tebu cukup tinggi, yaitu sekitar 49,59 persen sehingga cukup potensial dijadikan sebagai bahan baku fermentasi alkohol. Hasil analisis tersebut sesuai dengan pendapat Wanto dan Soebagyo (1980) yang menyatakan bahwa tetes tebu yang dihasilkan oleh pabrik mengandung gula sekitar 48 - 55 persen. Sedangkan menurut Baikow (1982) kandungan gula dalam tetes tebu sekitar 52 persen. Kandungan gula tetes tebu dari hasil analisis tersebut terdiri dari kadar sakarosa 30,88 persen dan gula reduksi 17,09 persen, sedangkan Brix tetes yang terdapat dalam tetes tebu 79,60 °Brix.
Menurut Higgins et al. (1984), konsentrasi gula yang baik untuk fermentasi alkohol adalah 16 - 25 persen, yang akan menghasilkan alkohol sebesar 6 - 12 persen. Pada konsentrasi gula substrat sekitar 16 persen dapat membantu mempercepat pertumbuhan khamir pada awal fermentasi. Apabila konsentrasi alkohol yang dihasilkan lebih besar dari 12 persen, alkohol akan
,
Tabel4. Hasil analisis komposisi tetes tebu (molase) dari PT Spiritus Palimanan, Cirebon
Komposisi Kandungan ( % )
Sakarosa 30,88
Gula reduksi 17,09
Total gula 49,59
Komposisi tetes tebu dipengaruhi oleh varietas dan kematangan tebu, kondisi iklim dan tanah. Selain itu kondisi proses di dalam pabrik gula juga mempengaruhi komposisi tetes (Baker, 1980). Baikow (1982) menyatakan bahwa kandungan gula dalam tetes tebu tergantung dari varietas tebu, peri ode penanaman dan pemanenan, serta cara pengolahan di perusahaan.
Perlakuan setelah pengenceran terhadap tetes tebu adalah pengendapan dan pasteurisasi yang beliujuan untuk mendapatkan tetes tebu jemih yang steril sehingga dapat mencegah adanya kontaminasi terhadap media ferrnentasi. Wanto dan Soebagyo (1980) menyatakan bahwa konsentrasi gula yang terlalu pekat kurang baik' untuk digunakan karena akan menghasilkan alkohol terlalu tinggi konsentrasinya sehingga menghambat perturnbuhan khamir.
Unsur pokok yang dibutuhkan untuk pertumbuhan mikroorganisme, seperti karbon dan hidrogen telah terpenuhi oleh total gula reduksi yang ada dalam tetes tebu. Selain unsurpokok tersebut, mikroorganisme juga memerlukan mineral seperti Mn, Zn, Ba dan Fe dalam jumlah yang relatif sangat keeil (Fiechter, 1982).
2. Seleksi Starter
-tl-Konsentras; starter 15 % (vlv)
-+-Kensentras; starter 20 % (vlv)
GambaI' 2. Perbandingan produksi alkohol dengan konsentrasi starter 10 %, 15%
,
dan 20 % (v/v)
B. PENELITIAN LANJUT AN
I. pH
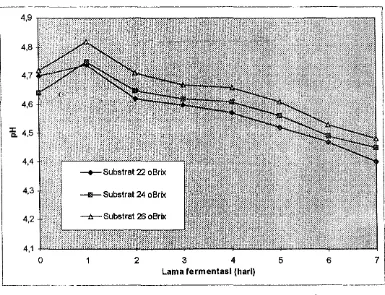
Dari hasil pengamatan (Gambar 3 dan Lampiran 3) terlihat babwa nilai derajat keasaman (pH) bervariasi pada masing-masing substrat yang digunakan pada saat fermentasi. Untuk substrat 22 °Brix pH-nya berkisar antara 4,40 - 4,74, substrat 24 °Brix pH-nya berkisar antara 4,45 - 4,75, sedangkan pH untuk substrat 26 °Brix berkisar antara 4,48 - 4,82. Profil pH (rata an dua kali ulangan) selama fermentasi untuk setiap substrat yang berbeda disajikan pada Gambar 3.
セMMNセM
. TNYセ⦅@
4,8
4,7
4,6
a
4,54,4
--+-Subs!ra! 22 oBrix
4,3
--II-Subs!ra! 24 oBrix
4,2 -tr--Subs!ra! 26 oBrix
4,1
0 2 3 4 5 6 7
Lama fermentasl (harl)
- -
.. .-Gambar 3. Profil pH selama fermentasi
[image:46.599.135.520.362.657.2]organik sepel1i asam laktat, asetat dan piruvat yang terbentuk selama proses fermentasi (Said, 1987).
Peningkatan nilai pH terjadi pada saat fermentasi telah bedangsung selama satu hari dan pada hari berikutnya pH cenderung mengalami penurunan. Peningkatan nilai pH ini dikarenakan adanya penguraian snmber nitrogen dan amino organik yang terkandung dalam media menjadi senyawa yang lebih sederhana, seperti nitrat dan nitrit yang mampu meningkatkan nilai pH. Said (1987) menyebutkan bahwa senyawa-senyawa amino organik digunakan sebagai media untuk tumbuh, maka pH cenderung meningkat, karena senyawa-senyawa tersebut dideaminasi.
Pada awal fermentasi, pH cairan dibuat 4,5 - 5,0 dengan menambahkan asam sulfat (H2S04) agar Saccharomyces ellipsoideus dapat tumbuh secara
optimal. Frazier dan Westhoff (1978) mengatakan bahwa pH akan
Proses terjadinya penurunan pH disebabkan oleh terbentuknya asam-asam selama proses fermentasi beriangslmg. Menurut Reed dan Peppler (1973), asam-asam yang terbentuk seperti asam-asam asetat, asam-asam piruvat, dan asam-asam laktat dapat menurunkan pH, sedangkan asam-asam lainnya seperti asam butirat dan asam lemak lainnya hanya sedikit berpengaruh dalam penurunan pH cairan. Menurut Amerine et al. (1987), bakteri-bakteri asam asetat, seperti Acetobacter aceti. Acetobacter pasteurianlls, Acetobacter peroxidans, dan Acetobacter coseum berperan menghasilkan asam asetat.
Penurunan pH cairan hasil fermentasi juga disebabkan oleh ionisasi H+ dan penggunaan pupuk ZA (amonium sulfat) sebagai sumber nitrogen. Amonium sulfat dalam larutan akan terdisosiasi menjadi ion NH/. Khamir mengkonsumsi senyawa ini untuk membentuk massa sel dalam bentuk R - NH3 + •
dimana R adalah rantai karbon. Pengikatan NH3 + akan melepaskan
If'
ke lingkungannya, sehingga selama fermentasi, ionIf'
pada larutan akan semakin banyak dan mengakibatkan penurunan pH fermentasi (Wang et al., 1979). Menurut Fardiaz (1989), perubahan pH dapat terjadi selama fermentasi karena H dilepaskan selama konsumsi NH/ dan dikonsumsi selama metabolisme N03' dan penggunaan asam amino sebagai sumber karbon.2. Kadar Alkohol
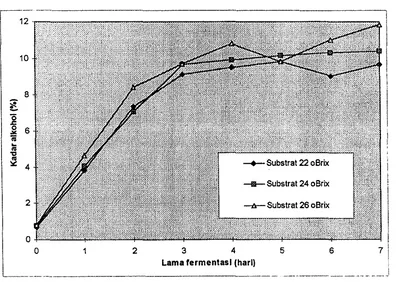
Kadar alkohol cairan hasil fermentasi yang diperoleh bervariasi dari 0,68
antara 0,68 -'9,81 persen, substrat 24 °Brix kadar alkoholnya berkisar antara 0,77 - 10,38 persen, sedangkan kadar alkohol untuk substrat 26 °Brix berkisar antara 0,84 -11,85 persen. Profil kadar alkohol (rataan dua kali ulangan) untuk setiap substrat yang berbeda disajikan pada Gambar 4.
10
8
セ@
"0
セ@ 6
...
1i
セ@
..
""
セ@ 4-m-Subs!ra! 24 oBrix
2 -I>-Subs!ra! 26 oBrix
0
Lama fermenta.1 (harl)
Gambar 4. Profil kadar alkohol selama fermentasi
[image:49.599.134.531.233.515.2]Kadar alkohol yang dihasilkan dengan substrat 22 °Brix mengalami penurunan pada hari keenam dan naik kembali pada hari ketujuh. Begitu juga kadar alkohol dengan substrat 26 °Brix mengalami penurunan pada hari kelima dan naik kembali pada hari keenam dan ketujuh. Pada keadaan dimana kadar alkohol mengalami penurunan kemungkinan proses fermentasi sudah terhenti. Hal ini disebabkan oleh kandungan gula dan nutrien di dalam substrat yang semakin kecil. Penurunan kadar alkohol terse but disebabkan alkohol diubah menjadi senyawa-senyawa lain. Winamo dan Fal'diaz (1979) menyebutkan bahwa bakteri asam asetat akan mengoksidasi alkohol menjadi asam asetat.
Peningkatan kadar alkohol yang dihasilkan disebabkan oleh peningkatan aktivitas fermentasi. Setelah itu aktivitas fermentasi menurun, sedangkan aktivitas penguraian alkohol menjadi asam asetat terus berJangsung. Hal ini sesuai dengan hasil penelitian Amerine dan Cruess (1967) yang menyatakan bahwa proses pemecahan gula menjadi alkohol dan karbon dioksida disebabkan oleh aktivitas khamir. Reaksi pemecahan gula menjadi alkohol dan karbon dioksida adalah,
C6H1206
=====================>
2 C2HsOH + 2 CO2(glukosa) (etanol) (karbon dioksida)
Pemecahan alkohol menjadi asam asetat disebabkan oleh aktivitas Acetobacter
(etanol) (oksigen) (asam asetat) (air)
Rose dan Harrison (1969) menyatakan bahwa gula dalam proses fermentasi akan terurai menjadi etanol dan gas karbon dioksida dengan perbandingan sebagai berikut,
100 bag ian gula ========> 51, I bagian etanol + 48,9 bagian karbon dioksida Perbandingan tersebut hanya merupakan nilai teoritis saja, sebab dalam kenyataannya tidak semua gula akan diubah menjadi etanol tetapi hanya sekitar
90 - 95 persen. Perbandingan produksi alkohol oleh Saccharomyces ellipsoideus
disajikan pada Tabel 5.
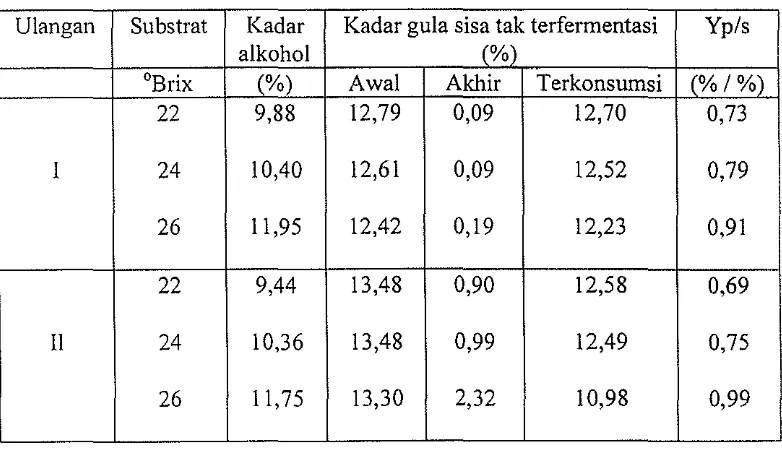
Tabel 5. Perbandingan produksi alkohol oleh Saccharomyces ellipsoideus
selama tujuh hari
Ulangan Substrat Kadar Kadar gula sis a tak terfermentasi Yp/s
alkohol (%)
°Brix (%) Awal Akhir Terkonsurnsi (%/%)
22 9,88 12,79 0,09 12,70 0,73
I 24 10,40 12,61 0,09 12,52 0,79
26 11,95 12,42 0,19 12,23 0,91
22 9,44 13,48 0,90 12,58 0,69
II 24 10,36 13,48 0,99 12,49 0,75
26 11,75 13,30 2,32 10,98 0,99
[image:51.599.137.528.448.675.2]karena menghasilkan kadar alkohol dan rendemen produk-substrat (Yp/s) yang maksimal masing-masing yaitu 11,85 persen dan 0,95 (rataan dua kali ulangan).
3. Kadar Gula Sisa Tak Terfermentasi
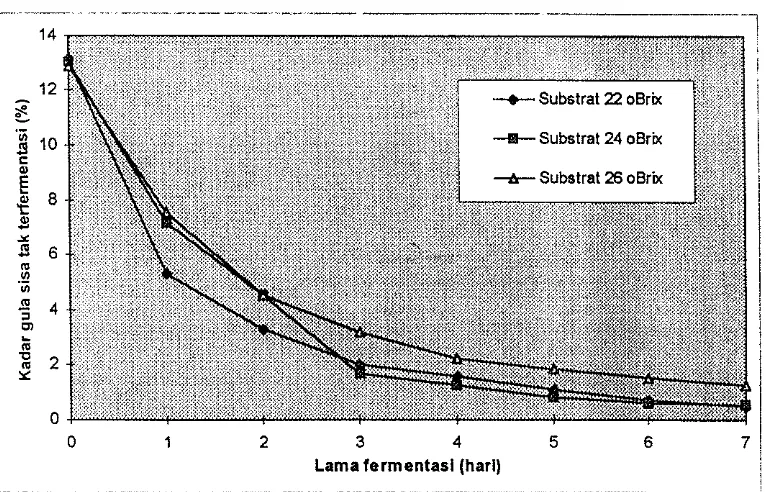
Kadar gula sisa tak terfermentasi nilainya bervariasi dari 0,50 - 13,14 persen. Kadar gula sisa tak terfermentasi berkurang sesuai dengan bertambahnya waktu fermentasi. Kadar gula sisa tak terfermentasi (rataan dua kali ulangan) disajikan pada Gambar 5 dan seeara rinei pada Lampiran 3
o 2 3 4 5 6 7
Lama fermenta.1 (harl)
' - - - . _ . . . . Gambar 5. Profil kadar gula sisa tak terfermentasi selama fermentasi
Kadar gula sisa tak terfermentasi pada substrat 26 "Brix dihari ketujuh sebesar 1,26 persen. Kadar gula sisa tak terfermentasi dihari ketujuh ini masih
,
[image:52.595.137.520.342.588.2]substrat yang lainnya. Hal ini menunjukkan bahwa setelah fermentasi berlangsung selama tujuh hari, masih terdapat banyak gula. Gula berkurang sesuai dengan bertambalmya waktu fermentasi, karena gula diubah menjadi alkohol oleh khamir Saccharomyces ellipsoideus.
Dengan bellambahnya waktu fermentasi, maka aktivitas khamir berkurang sesuai dengan berkurangnya substrat dan nutrien yang tersedia. Hasil ini sesuai dengan penemuan Prescott dan Dunn (1981) yang menunjukkan bahwa aktivitas khamir menurun dengan berkurangnya konsentrasi substrat dan nutrien yang tersedia. Penurunan aktivitas khamir ini akan mengurangi jumlah asam organik yang terbentuk sebagai hasil samping dalam pembuatan alkohol.
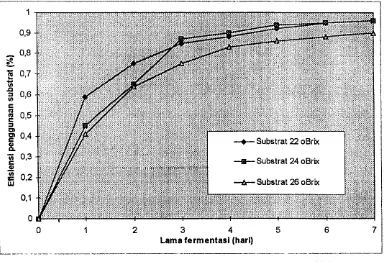
4. Efisiensi Penggunaan Substrat
E
:8
::0'"
C
セ@
::0
Cl
g> 0,4
8-1
0,3'"
iii
--+-Substrat 22 oBrix
- t I -Substrat 24 oBrix
-Ir-Substrat 26 oSrile
°
2 3 4 5 6 7Lama fermenlasl (harl)
Gambar 6, Profil efisiensi penggunaan substrat selama fermentasi
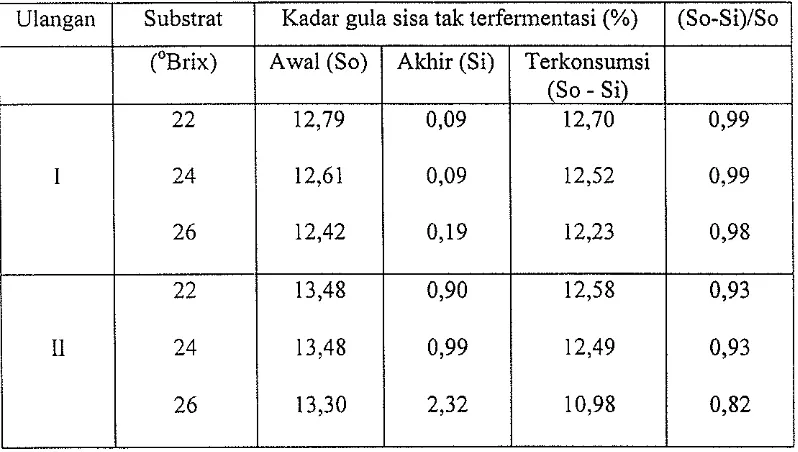
[image:54.595.139.523.123.385.2]Tabel 6. Efisiensi penggunaan substrat pada substrat 22 °Brix, 24 °Brix, dan 26 °Brix.
Ulangan Substrat Kadar gula sisa tak terfennentasi (%) (So-Si)/So
(oBrix) Awal (So) Akhir (Si) Terkonsumsi
(So - Si)
22 12,79 0,09 12,70 0,99
1 24 12,61 0,09 12,52 0,99
26 12,42 0,19 12,23 0,98
22 13,48 0,90 12,58 0,93
Il 24 13,48 0,99 12,49 0,93
26 13,30 2,32 10,98 0,82
[image:55.595.136.535.172.398.2]A. KESIMPULAN
Hasil penelitian tahap pendahuluall menunjukkan bahwa komposisi tetes tebu (molase) yang diperoleh yaitu kadar sakarosa 30,88 persen, kadar gula reduksi 17,09 persen, dan total kandungan gula tetes tebu sebesar 49,59 persen, sedangkan Brix tetes yang terdapat dalam tetes tebu 79,60 °Brix.
Konsentrasi starter 15 persen (v/v) menghasilkan alkohol yang maksimal sehingga digunakan untuk percobaan selanjutnya, karena dari hasil seleksi konsentrasi starter IS persen (v/v) menghasilkan kadar alkohol dan rendemen produk-substrat (Yp/s) lebih tinggi dari konsentrasi yang dihasilkan starter lainnya yaitu masing-masing sebesar 9,29 persen dan 0,69.
Kondisi optimal yang dihasilkan selama fermentasi yaitu konsentrasi starter IS persen (v/v), substrat 26 °Brix dengan waktu fermentasi selama tujuh hari yang menghasilkan kadar alkohol maksimal sebesar 11,85 persen (rataan dua kali ulangan), rendemen produk-substrat (Yp/s) 0,95 dan efisiensi penggunaan substrat 90 persen.
B. SARAN
Amerine, M. A. dan W. V. Cruess. 1967. The Technology of Wine Making. The AVI Publishing Co. Inc., Westport, Connecticut.
Alllcrine, M. A., H. W. Berg dan R. E. Kunkee, C. S. Ough, V. I. Singleton dan A. D. Webb. 1987. Technology of Wine Making. The AVI Pub!. Co. Inc., Westport, Connecticut.
1I11ikow, V. E. 1982. Manufacture and Refining of Raw Cane Sugar. Elsevier Scientific Publishing Company, Amsterdam-Oxford-New York.
llaker, B. P. 1980. Composition, Properties and Uses of Molasses and Related Products. United Molasses Trading Company Limited.
Ikrry, D. R. dan C. Brown. 1987. Physiology of Yeast Growth. Di dalam Berry, D. R., G. G. Stewart dan 1. Russell (cds). Yeast Biotechnology. Allan dan
Unwin, Sydney.
Iluckle, K. A., R. A. Edwards, G. H. Fleet, dan M. Wooton. 1985. Ilmu Pangan. Diterjemahkan oleh Pumomo, H. dan Adiono. 1985. Universitas Indonesia Press, Jakarta.
(asida, L. E. 1980. Industrial Microbiology. Jolm Wiley and Sons Inc., New York. Joiechter, A. 1982. Advances in Biochemical Engineering. Springer-Verlag, Berlin. I'razier, W. C. 1977. Food Microbiology. Tata Mc Graw - Hill Pub!. Co. Ltd., New
Delhi.
I'razier, W. C. dan D. C. Westhoff. 1978. Food Microbiology. Tata Mc Graw - Hill Book Pub!. Co. Ltd., New Delhi.
(iandana, S. G. dan T. Ananta. 1974. Penuntun Pengawasan Pabrikasi. Pusat Penelitian Perkebunan Gula Indonesia, Pasuruan Jawa Timur.
I liggins, 1. J., D. J. Best, dan J. Jones. 1984. Biotechnology Principles and Applications. Blackwell Scientific Pub!., London.
Mllrloyo, Theresia, E. S. Bambang dan Bachtiar. 1991. Diktat Analisis Kadar Gula Total dalam Tetes (Molase). Pusat Penelitian Perkebunan Gula Indonesia, Pasuruan.
rvloat, A. G. 1979. Microbial Physiology. John Wiley and Sons Inc., New York. l'alurau, J. M. 1982. By - Product of the Cane Sugar Industry. Elsevier Scientific
Pub!. Co., Amsterdam.
l'irl, S. J. 1975. Principles of Microbe and Cell Cultivation. Blackwell Scientific Publ., London.
Prescott, S. C. dan C. G. DWll. 1981. Industrial Microbiology. Mc Graw - Hill Book Co. Ltd., New York.
Reed, G. dan H. J. Peppler. 1973. Yeast Technology. AVI Publishing Company Inc .. WestpOlt, Connecticut.
Rehm, H. J. dan G. Reed. 1981. Biotechnology. Volume l. Microbial Fundamentals. Verlag Chemi Gmbh, Weinheim.
Rose, A. H. dan J. S. Harrison. 1969. The Yeast: Biology of Yeast. Volume l. Academic Press, New York.
Said, E. G. 1987. Bioindustri: Penerapan Teknologi Fermentasi. Mediyata111a Sarana Perkasa, Jakarta.
Sastramihardja, I. 1985. Pengantar Rekayasa Mikroba. Laboratorium Mikrobiologi dan Teknologi Fer111entasi ITB, Bandung.
Slibari, T. E. B. 1988. Imobilisasi Sel Saccharomyces cerevisiae dan Saccharomyces uvarum dengan Aiginat sebagai Matriks Poli111er untuk Pembuatan Etanol dari Molase. Skripsi. Fateta IPB, Bogor.
Wang, D. I. C., C. L. Cooney, A. I. Demain, P. Dunnil, A. E. Humprey dan M. D. Lily. 1979. Fermentation and Enzyme Technology. John Wiley and Sons Inc., New York.
Wanto, E. P. dan A. Soebagyo. 1980. Dasar-dasar Mikrobiologi Industri. Departemen Pendidikan dan Kebudayaan RI, Jakmta.
Lampiran 1. Rekapitulasi data hasil fermentasi alkohol pada substrat 20 °Brix
Konsentrasi Waktu pH Suhu Kadar Kadar gula sisa
starter (% v/v) fermentasi (hari)
CC)
alkohol tak telfermentasi(%) (%)
0 5,09 36,5 0,28 13,34
1 4,40 30,6 2,16 6,57
2 4,36 29,8 5,48 3,83
10 3 4,31 29,2 8,08 1,28
4 4,27 28,5 8,44 1,03
5 4,26 28,2 8,69 0,86
6 4,30 28,1 8,90 0,76
7 4,31 28,6 9,16 0,57
0 4,62 37,3 0,76 13,52
1 4,50 30,8 3,04 4,98
2 4,35 30,1 6,08 3,18
15 3 4,27 29,3 8,88 1,20
4 4,29 28,6 9,29 1,11
5 4,28 28,1 8,77 0,95
6 4,33 28,0 8,67 0,86
7 4,44 28,6 8,67 0,76
0 4,54 36,1 0,52 13,17
I 4,51 30,8 2,72 6,14
2 4,43 30,0 4,84 2,60
20 3 4,34 29,3 7,88 1,11
4 4,35 28,6 • 8,44 1,03
5 4,40 28,2 9,01 0,86
6 4,54 28,2 8,96 0,67
Lampiran 2. Perbandingan produksi alkohol oleh Saccharomyces ellipsoidells pada substrat 20 "Brix
Lampiran 2a. Produksi alkohol oleh Saccharomyces ellipsoidells pada konsentrasi starter
10%
v/v)
Waktu fermentasi Kadar gula sisa tak Kadar alkohol (%) Yp/s
(hari) terferrnentasi (%)
0 13,34 0,28 0,00
1 6,57 2,16 0,28
2 3,83 5,48 0,55
3 1,28 8,08 0,65
4 1,03 8,44 0,66
5 0,86 8,69 0,67
6 0,76 8,90 0,68
7 0,57 9,16 0,69
Lampiran 2b. Produksi alkohol oleh Saccharomyces ellipsoideus pada konsentrasi starter 15 %
v/v)
Waktu fermentasi
Kadar
gUla sisa tak Kadar alkohol (%) Yp/s(hari) terfermentasi (%)
0 13,52 0,76 0,00
1 4,98 3,04 0,27
2 3,18 6,08 0,51
3 1,20 8,88 0,66
4 1,11 9,29 0,69
5 0,95 8,77 0,64
6 0,86 8,67 0,62
7 0,76 8,67 0,62
Larnpiran 2e. Produksi alkohol oleh Saccharomyces ellipsoideus pada konsentrasi starter
20%
v/v)
Waktu ferrnentasi Kadar glila sisatak Kadar alkohol (%) Yp/s
(hari) terferrnentasi (%)
0 13,17 0,52 0,00
1 6,14 2,72 0,31
2 2,60 4,84 0,41
3 1,11 788 0,61
4 1,03 8,44 0,65
5 0,86 9,01 0,69
6 0,67 8,96 0,67
Lampiran 3. Rekapitulasi data hasil fermentasi alkohol pada konsentrasi starter 15 % (v/v)
Lampiran 3a. Rekapitulasi data hasil fermentasi alkohol pada konsentrasi starter 15 % (v Iv) (ulangan I)
Substrat Waktu fermentasi pH Suhu Kadar Kadar gula sisa
("Brix) (hari)
ee)
alkohol (%) tak terfermentasi(%)
0 4,87 27,6 0,60 12,79
1 4,89 29,4 3,27 4,32
2 4,80 28,9 6,71 2,51
22 3 4,80 27,9 9,11 0,47
4 4,75 27,4 9,60 0,38
5 4,73 27,2 9,90 0,19
6 4,66 27,8 9,07 0,09
7 4,56 28,1 9,88 0,09
°
4,68 27,6 0,50 12,611 4,87 30,3 3,32 5,90
"
4,84 29,1 6,23 3,17..
24 3 4,83 28,3 9,78 0,57
4 4,82 27,6 10,12 0,29
5 4,78 27,4 10,28 0,19
6 4,68 27,9 10,37 0,09
7 4,64 28,0 10,40 0,09
°
4,80 27,7 0,76 12,421 4,96 29,6 4,56 7,07
2 4,90 28,9 8,16 4,15
26 3 4,87 28,4 9,77 2,44
4 4,89 28,0 10,96 1,20
5 4,85 27,5 9,79 0,67
6 4,76 27,9 11,09 0,29
Lampiran 3b. Rekapitulasi data hasil fermentasi alkohol pada konsentrasi starter 15 % (v/v) (ulangan II)
Substrat Waktu fermentasi pH Suhu Kadar Kadar gula sisa
("Brix) (hari)
COC)
alkohol (%) tak terfermentasi(%)
0 4,53 28,0 0,76 13,48
1 4,58 30,8 4,34 6,27
2 4,44 28,7 7,99 4,11
22 3 4,40 28,2 9,16 3,54
4 4,39 28,0 9,39 2,72
5 4,31 27,1 9,72 1,99
6 4,27 27) 9,04 1,32
7 4,24 27,9 9,44 0,90
0 4,60 28,1 1,04 13,48
1 4,62 31,5 4,81 8,45
2 4,46 29,2 7,86 5,94
24 3 4,41 28,5 9,52 2,80
4 4,40 28,2 9,70 2,23
5 4,34 27,0 10,00 1,48
6 4,29 27,5 10,28 1,14
7 4,26 278 10,36 0,99
0 4,63 28,1 0,92 13,30
1 4,68 31,7 4,75 8,03
2 4,52 29,1 8,69 4,94
26 3 4,46 28,5 9,62 3,95
4 4,43 28,1 10,62 3,21
5 4,37 27,2 9,82 2,97
6 4,30 27,5 10,96 2,72
Lampiran 3 c. Rekapitulasi data hasil fermentasi alkohol pada konsentrasi starter 15 %
(v/v) (rataan dua kali ulangan)
Substrat Waktu fermentasi pH Suhu Kadar Kadar gula sisa
("Brix) (hari)
COC)
alkohol (%) tak terfermentasi(%)
0 4,70 27,8 0,68 13,14
1 4,74 30,1 3,81 5,30
2 4,62 28,8 7,35 3,31
22 3 4,60 28,1 9,14 2,01
4 4,57 27,7 9,50 1,55
5 4,52 27,2 9,81 1,09
6 4,47 27,6 9,06 0,71
7 4,40 28,0 9,66 0,50
0 4,64 27,9 0,77 13,05
1 4,75 30,9 4,07 7,18
2 4,65 29,2 7,05 4,56
24 3 4,62 28,4 9,65 1,69
4 4,61 27,9 9,91 1,26
5 4,56 27,2 10,14 0,84
6 4,49 27,7 10,33 0,62
7 4,45 27,9 10,38 0,54
0 4,72 27,9 0,84 12,86
1 4,82 30,7 4,66 7,55
2 4,71 29,0 8,43 4,55
26 3 4,67 28,5 9,70 3,20
4 4,66 28,1 10,79 2,21
5 4,61 27,4 9,81 1,82
6 4,53 27,7 11,03 1,51
Lampiran 4. Produksi alkohol oleh Saccharomyces ellipsoideus pada substrat 20 "Brix Lampiran 4a. Tabel ferrnentasi alkohol pada konsentrasi starter 10 % (v/v) selama
7 hari
Parameter Waktu ferrnentasi (hari)
0 1 2 3 4 5 6
Kadar alkohol (%) 0,28 2,16 5,48 8,08 8,44 8,69 8,90
Kadar gula sisa tak 13,34 6,57 3,83 1,28 1,03 0,86 0,76
terferrnentasi (%)
Lampiran 4b. Tabel ferrnentasi alkohol pada konsentrasi starter 15 % (v/v) selama 7hari
Parameter Waktu ferrnentasi (hari)
0 1 2 3 4 5 6
Kadar alkohol (%) 0,76 3,04 6,08 8,88 9,29 8,77 8,67
Kadar gula sisa tak 13,52 4,98 3,18 1,20 1,11 0,95 0,86
terferrnentasi (%)
Lampiran 4c. Tabel ferrnentasi alkohol pada konsentrasi starter 20 % (v/v) selama
7 hari
Parameter Waktu ferrnentasi (hari)
0 1 2 3 4 5 6
Kadar alkohol (%) 0,52 2,72 4,84 7,88 8,44 9,01 8,96
Kadar gula sisa tak 13,17 6,14 2,60 I,ll 1,03 0,86 0,67
terferrnentasi (%)
•
Lampiran 5. Perbandingan hasil fermentasi alkohol antar konsentrasi starter pada substrat 20 "Brix selama 7 hari
a. Grafik Kadar Alkohol
10
9
8
7
l
6"
-g
5""
"iiiセ@
..
4"
..
-+-Konsentrasi starter 10 % (v/v)"
3 - I i -Konsentrasi starter 15 % (v/v)2
- A -Konsentrasi starter 20 % (v/v)
I
0 0 1 2 3 4 5 6L_. ___ . ____ _
Lama fermentasl (harl)セMMM ...
- - - -
- - - - _ . _ - _ . _ - _ .b. Grafik Kadar Sisa Gula Tak Terfermentasi
14
12
l
-+---Konsentrasi starter 10 % (v/v)Vi
10
セ@セ@ ----ta-Konsentrasi starter 15 % (v/v)
E - l r -Konsentrasi starter 20 % (v/vl
セ@
8
セ@
.s
""
J!..
6 :;'"
..
0 4;;;
セ@
..
"
..
2"
0 2 3 4 5 6
Lama fermentasl (harl)
_ . _ _ . _ _ . _
---', , ,
7
Lampiran 6. Produksi alkohol oleh Saccharomyces el/ipsoideus pada konsentrasi starter 15 % (v/v)
Lampiran 6a. Tabel fennentasi alkohol pada substrat 22 "Brix selama 7 hari (rataan dua kali ulangan )
Parameter Waktu fermentasi (hari)
0 1 2 3 4 5 6 7
Kadar alkohol (%) 0,68 3,81 7,35 9,14 9,50 9,81 9,06 9,66
Kadai gula sisa tak 13,14 5,30 3,31 2,01 1,55 1,09 0,71 0,50
terfennentasi (%)
Lampiran 6b. Tabel fennentasi alkohol pada substrat 24 "Brix selama 7 hari (rataan dua kali ulangan)
Parameter Waktu fermentasi (hari)
0 1 2 3 4 5 6 7
Kadar alkohol (%) 0,77 4,07 7,05 9,65 9,91 10,14 10,33 10,38
Kadar
gula sisS: tak 13,05 7,18 4,56 1,69 1,26 0,84 0,62 0,54 terfennentasi (%)-Lampiran 6c. Tabel fennentasi alkohol pada substrat 26 "Brix selama 7 hari (rataan dua kali ulangan)
Parameter Waktu fermentasi (hari)
0 1 2 3 4 5 6 7
Kadar alkohol (%) 0,84 4,66 8,43 9,70 10,79 9,81 11,03 11,85
Kadargula sisa tak 12,86 7,55 4,55 3,20 2,21 1,82 1,51 1,26
Lampiran 7. Perbandingan hasil ferrnentasi alkohol antar substrat pada konsentrasi starter 15 % (v/v) selama 7 hari (rataan dua kali ulangan)
イMMMNMMMMMMMMMMNMMMMNMMMセMNMMMセ@ .. - - - ...
a. Grafik Kadar Alkohol
-+-Substrat 22 oBrix
-LI-Substrat 24 oBrix
-I::s-Substrat 26 oBrix
2 3 4 5 6 7
Lama fermentasi (harl)
L.. _ _ _ _ .. _. _ _ _ _ _ _ _ _ _ _ _ _ _ セN@ _ _ _ ... _.
セMMMMMMMMMMMMMMMMMM . . --.---.... - - . -. . . - - - _ .
b. Grafik Kadar Sisa Gula Tak Terfermentasi
2 3 4 5 6 7
J
Lama fermentasl (harl)
Lampiran 8. Perbandingan efisiensi penggunaan substrat selama fermentasi alkohol oleh
Saccharomyces ellipsoideus
Lampiran 8a. Efisiensi penggunaan substrat pada substrat 22 "Brix, 24 °Brix, dan 26 "Brix (ulangan I)
Waktu ferrnentasi Substrat CBrix)
(hari) 22 24 26
°
0,00 0,00 0,001 0,66 0,53 0,43
2 0,80 0,74 0,66
3 0,96 0,95 0,80
4 0,97 0,97 0,90
5 0,98 0,98 0,95
6 0,99 0,99 0,97
7 0,99 0,99 0,98
Lampiran 8b. Efisiensi penggunaan substrat pada substrat 22 "Brix, 24 °Brix, dan 26 "Brix (ulangan II)
Waktu ferrnentasi Substrat ("Brix)
(hari) 22 24 26
°
0,00 0,00 0,001 0,53 0,37 0,39
2 0,69 0,56 0,62
3 0,74 0,79 0,70
4 0,79 0,83 0,76
5 0,85 0,89 0,77
6 0,90 0,91 0,79
Lampiran 9. Hubungan antara koreksi suhu pada penentuan Brix tetes
Suhu ( "Brix )
°C 8,0 8,1 8,2 8,3 8,4 8,5 8,6
27,0 0,044 0,044 0,045 0,045 0,045 0,045 0,045 N
27,1 0,038 0,038 0,038 0,038 0,038 0,038 0,038 E
27,2 0,031 0,031 0,031 0,031 0,031 0,032 0,032 G
27,3 0,024 0,024 0,025 0,025 0,025 0,025 0,025 A
27,4 0,018 0,018 0,018 0,018 0,018 0,018 0,018 T
27,5 0,011 0,011 0,011 0,012 0,012 0,012 0,012 I
27,6 0,005 0,005 0,005 0,005 0,005 0,005 0,005 F
27,7 0,002 0,002 0,002 0,002 0,002 0,001 0,001 P
27,8 0,009 0,008 0,008 0,008 0,008 0,008 0,008
27,9 0,015 0,015 0,015 0,015 0,015 0,015 0,015 0
28,0 0,022 0,022 0,022 0,022 0,022 0,021 0,021
28,1 0,029 0,029 0,029 0,028 0,028 0,028 0,028 S
28,2 0,036 0,035 0,035 0,035 0,035 0,035 0,035
28,3 0,043 0,042 0,042 0,042 0,042 0,042 0,042 I
28,4 0,049 0,049 0,049 0,049 0,049 0,049 0,049
28,5 0,056 0,056 0,056 0,056 0,056 0,056 0,056 T
28,6 0,063 0,063 0,063 0,063 0,063 0,063 0,063
28,7 0,070 0,070 0,070 0,070 0,070 0,070 0,070 I
28,8 0,077 0,077 0,077 0,077 0,077 0,076 0,076
28,9 0,084 0,084 0,084 0,084 0,084 0,084 0,084 F
Lampiran 1 0. Hubungan antara skala alkoholmeter dengan suhu
Suhu Skala alkoholmeter
·C
0,50 0,55 0,60 0,65 0,70 0,75 0,80 0,85 0,90 0,9524,0 1,7 2,1 2,4 2,7 3,1 3,4 3,8 4,2 4,5 4,8
24,5 1,6 2,0 2,3 2,6 3,0 3,3 3,7 4,1 4,4 4,7
25,0 1,5 1,9 2,2 2,6 2,9 3,3 3,6 4,0 4,3 4,6
25,5 1,5 1,8 2,1 2,5 28 3,2 3,5 3,9 4,2 4,5
26,0 1,4 1,7 2,0 2,4 2,7 3,1 3,4 3,8 4,1 4,4
26,5 1,3 1,6 2,0 23 2,6 3,0 3,3 3,7 4,0 4,3
27,0 1,2 1,5 1,9 2,2 2,5 2,9 3,2 3,6 3,9 4,2
27,5 1,1 1,4 1,8 2,1 2,4 2,8 3,1 3,5 3,8 4,1
28,0 1,0 1,4 1,7 2,0 2,3 2,7 3,0 3,3 3,6 3,9
28,5 0,9 1,3 1,6 1,9 2,2 2,6 2,9 3,2 3,5 3,8
29,0 0,9 1,2 1,5 1,8 2,1 2,5 2,8 3,1 3,4 3,7
29,5 0,8 1,1 1,4 1,7 2,0 2,4 2,7 3,0 3,3 3,6
Lampiran 11. Tetapan untuk cara inversi menurut STEUERWALD
Pembacaan dalam Suhu polarimeter ( °C )
tabung 200 mm sesudah inversi
32 30 28 26 24 22 20
- 18
-
-
-
-
-
145,51 145,54- 17
-
-
-
145,39 145,42 145,46 145,49- 16
-
145,27 145,30 145,34 145,37 145,41 145,44- 15 145,18 145,22 145,25 145,28 145,32 145,35 145,39
- 14 145,12 145,16 145,19 145,23 145,26 145,30 145,34
-13 145,06 145,10 145,13 145,17 145,21 145,25 145,29
- 12 145,00 145,04 145,08 145,12 145,16 145,20 145,24
-11 144,94 144,98 145,02 145,07 145,11 145,15 145,19
-10 144,88 144,93 144,97 145,01 145,06 145,10 145,14
-9 144,82 144,87 144,91 144,96 145,00 145,05 145,10
-8 144,77 144,81 144,86 144,90 144,95 145,00 145,05
-7 144,71 144,75 144,79 144,84 144,90 144,95 145,00
- 6 144,65 144,70 144,74 144,79 144,84 144,89 144,95
- 5 144,59 144,64 144,69 144,74 144,79 144,84 144,90
-4 144,53 144,58 144,63 144,68 144,74 144,79 144,85
- 3 144,47 144,52 144,58 144,63 144,69 144,74 144,80
-2 144,41 144,46 144,52 144,58 144,63 144,69 144,75
Lampiran 12. Kadar gula reduksi setrup dari polarisasi dan banyaknya mg tembaga yang dipisahkan oleh 0,6 gram setrup (untuk pemeriksaan glukosa dalam tetes secara iodometrik)
mg Polarisasi
tembaga
10 20 30 40 50 60 70 80
170 14,93 14,85 14,79 14,76 14,73 14,70 14,69
-172 15,10 15,03 14,97 14,94 14,91 14,88 14,86
-174 15,28 15,21 15,15 15,12 15,09 15,06 15,05
-176 15,"46 15,40 15,33 15,30 15,27 15,24 15,22
-178 15,65 15,59 15,51 15,48 15,45 15,42 15,40
-180 15,84 15,78 15,69 15,66 15,63 15,60 15,58
-182 16,03 15,96 15,87 15,84 15,81 15,78 15,76
-184 16,22 16,14 16,05 16,02 15,99 15,96 15,94
-186 16,41 16,32 16,23 16,21 16,17 16,14 16,12
-188 16,60 16,50 16,41 16,40 16,35 16,32 16,30
-190 16,80 16,69 16,59 16,59 16,53 16,50 16,48
-192 16,98 16,87 16,77 16,77 16,71 16,68 16,66
-194 17,16 17,06 16,96 16,95 16,90 16,86 16,86
-196 17,34 17,25 17,15 17,13 17,09 17,05 17,03
-198 17,52 17,44 17,34 17,31 17,28 17,24 -
-200 17,70 17,63 17,53 17,50 17,47 17,43
-
-202 17,88 17,82 17,72 17,68 17,65 17,61
-
-204 18,06 18,01 17,92 17,86 17,83 17,78
-
-Lampiran 13. Jumlah gram gula invert sesuai denga