ANALISIS FILOGENETIK SPESIES DAN
BIOAKTIVITAS SEKRESI KULIT KATAK
TERHADAP Streptococcus pneumoniae
JAJANG SUHYANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Analisis Filogenetik Spesies dan Bioaktivitas Sekresi Kulit Katak Terhadap Streptococcus pneumoniae
adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Jajang Suhyana
RINGKASAN
JAJANG SUHYANA. Analisis Filogenetik Spesies dan Bioaktivitas Sekresi Kulit Katak terhadap Streptococcus pneumoniae. Dibimbing oleh I MADE ARTIKA dan DODI SAFARI.
Indonesia memiliki sekitar 450 spesies katak. Sekresi kulit katak diduga dapat dijadikan sumber alternatif bahan antibakteri Streptococcus pneumoniae
terkhusus spesies multi-drug resistant (MDR). Tujuan penelitian adalah melakukan analisis filogenetik spesies katak dan menguji aktivitas antibakteri sekresi kulit yang dihasilkan terhadap isolat S. pneumoniae multi-drug resistant (MDR). Penelitian ini menggunakan dua spesies katak yaitu Fejervarya limnocharis dan
Limnonectes macrodon. Analisis filogenetik dilakukan berdasarkan sekuen fragmen gen sitokrom oksidase subunit I (COI) mitokondria. Pengeluaran sekresi kulit katak distimulasi dengan menggunakan hormon efinefrin. Aktivitas antibakteri sekresi kulit katak diuji menggunakan teknik sumuran dan teknik perendaman kertas cakram. Hasil analisis filogenetik menunjukkan bahwa katak F. limnocharis memiliki hubungan kekerabatan dekat dengan Fejervarya sp asal Bali. Sekresi kulit katak F. limnocharis diindikasikan mengandung senyawa antibakteri
S. pneumoniae multi-drug resistant (MDR) SPN1307 yang lebih kecil dibandingkan kontrol kloramfenikol. Sebaliknya, sekresi kulit katak spesies L. macrodon tidak menunjukkan aktivitas antibakteri terhadap S. pneumoniae multi-drug resistant (MDR) SPN1307. Oleh karena itu, sekresi kulit katak F.limnocahris
mempunyai kemampuan untuk dijadikan suatu sumber bahan antibakteri S. pneumoniaemulti-drug resistant (MDR) SPN1307.
Hasil penelitian menunjukkan bahwa sekresi kulit katak dari F. limnocharis
mampu menjadi agen antibakteri terhadap S. pneumoniae MDR/non-MDR. Kemampuan bioaktivitas terhadap S. pneumoniae SPN1307 dan ATCC49619 ditunjukkan dengan metode sumuran yaitu menghasilkan diameter zona bening sebesar 9.00±0.001 mm dan 8.00±0.001 mm, sedangkan untuk L. macrodon tidak menunjukkan adanya kemampuan antibakteri. Hasil pada metode perendaman
paper disk selama 5 menit sampel F. limnocharis terhadap S. pneumoniae SPN1307 dan ATCC49619 adalah 11.33±0.057 mm dan 9.70±0.001 mm, serta untuk perendaman paper disk 30 menitnya adalah 9.00±0.032 mm terhadap SPN1307 dan 8.90±0.044 mm pada ATCC49619. Penentuan filogenetik berdasarkan DNA COI
untuk memastikan spesies katak yang digunakan adalah benar spesies
F. limnocharis dengan kesamaan 97% terhadap spesies F. limnocharis lain yang sebelumnya pernah diteliti di Bali, Indonesia.
SUMMARY
JAJANG SUHYANA.Spesies Filogenetic Analysis and Bioactivity Frog Skin Secretion Against Streptococcus pneumoniae. Supervised by I MADE ARTIKA and DODI SAFARI.
Indonesia houses about 450 frog species. Frog skin secretions are considered to be a potential alternative source of antibacterial agents against
Streptococcus pneumoniae especially multi-drug resistant (MDR) species. The aims of the study are to analyze the phylogenetic of frog species and test antibacterial activity of its skin secretions against S. pneumoniae multi-drug resistant (MDR). The study utilized two species of frog, Fejervarya limnocharis
and Limnonectes macrodon. Phylogenetic analysis was carried out based on DNA sequence of a partial fragment of mitochondrial cytochrome oxidase subunit I (COI) gene. The release of skin secretion was stimulated by epinephrine injection. Antibacterial activity of the skin secretions was tested using the well and paper disc methods. Phylogenetic analysis showed that the frog F. limnocharis is closely related to Fejervarya sp from Bali. Skin secretions of F. limnocharis indicated antibacterial activity against S. pneumoniae multi-drug resistant (MDR) SPN1307 smaller than chloramphenicol. On the other hand, skin secretions of Limnonectes macrodon failed to inhibit the growth of S. pneumoniae multi-drug resistant (MDR) SPN1307. Therefore the skin secretions of F. limnocharis had the potential to be used as a source of antibacterial agents against S. pneumoniae multi-drug resistant (MDR) SPN1307.
Results showed that skin secretion from frog species F. limnocharis could be used antibacterial agent for S. pneumoniae MDR/non-MDR. Bioactivity for S. pneumoniae SPN1307 dan ATCC49619 showed with using the well method that its results for clear zone 9.00±0.001 mm and 8.00±0.001 mm, whereas L. macrodon
did not have antibacterial activity. Results of paper disc method for 5 minute F. limnocharis sample against S. pneumoniae SPN1307 dan ATCC49619 were 11.33±0.057 mm and 9.70±0.001 mm, with result of paper disc method for 30 minute was 9.00±0.032 against SPN1307 and 8.90±0.044 mm in ATCC49619. Molecular-based phylogeny based on DNA COI to ensure that frog species being used in this research really as F. limnocharis with 97% related in another F. limnocharis species in Bali, Indonesia.
Keywords: Antimicrobial agent, Frog skin secretion, Molecular-based phylogeny,
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
JAJANG SUHYANA
Judul Tesis : Analisis Filogenetik Spesies dan Bioaktivitas Sekresi Kulit Katak terhadap Streptococcus pneumoniae
Nama : Jajang Suhyana NIM : G851130041
Disetujui oleh Komisi Pembimbing
Dr Ir I Made Artika, M.App,Sc Ketua
Dodi Safari, Ph.D Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2014 ini ialah Analisis Filogenetik Spesies dan Bioaktivitas Sekresi Kulit Katak terhadap
Streptococcus pneumoniae.
Terima kasih penulis ucapkan kepada Bapak Dr Ir I Made Artika, M.App,Sc dan Bapak Dodi Safari, Ph.D selaku pembimbing, serta Sdr Miftahuddin Majid Khoeri dan rekan peneliti pada Laboratorium Bakteriologi Lembaga Eijkman. Di samping itu, penghargaan penulis sampaikan kepada Ibu Dr. Mirza D. Kusrini beserta staf Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan IPB Darmaga. Ungkapan terima kasih juga disampaikan kepada papa, ibuk, bapak serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
DAFTAR ISI vi
DAFTAR TABEL vi
DAFTAR GAMBAR vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 4
Tujuan Penelitian 6
Hipotesis Penelitian 6
Manfaat Penelitian 6
Ruang Lingkup Penelitian 6
2 METODE 7
Waktu dan Tempat Penelitian 7
Bahan 7
Alat 9
Persiapan Sampel 9
Persiapan Larutan 11
Pengukuran Karakteristik Fisik Katak 11
Isolasi DNA Genom Katak 12
Amplifikasi Fragmen DNA Penyandi COI 12
Sekuensing DNA dan Konstruksi Pohon Filogenetik 13 Uji Aktivitas Antibakteri Sekresi Kulit Katak 13
Analisis Data 14
3 HASIL 15
4 PEMBAHASAN 22
5 SIMPULAN DAN SARAN 277
Simpulan 27
Saran 27
DAFTAR PUSTAKA 28
LAMPIRAN 33
DAFTAR TABEL
1 Bioaktif peptida dari katak Pelophylax nigromaculatus 5 2 Aktivitas beberapa antibiotik terhadap ATCC 49619 8
3 Aktivitas beberapa antibiotik terhadap SPN1307 9
4 Karakteristik fisik dan dosis injeksi epinefrin pada F. limnocharis 15 5 Karakteristik fisik dan dosis injeksi epinefrin pada L macrodon 16 6 Konsentrasi DNA isolasi F. limnocharis dan L. macrodon 16 7 Aktivitas antibakteri sekresi spesies F. limnocharis (FL) dan L.
macrodon (LM) terhadap S. pneumoniae SPN1307 dan ATCC 49619
menggunakan metode sumuran 19
8 Aktivitas antibakteri sekresi spesies F. limnocharis (FL) dan L. macrodon (LM) terhadap S. pneumoniae SPN1307 dan ATCC 49619 dengan perendaman sterile paper disk selama 5 menit 20 9 Aktivitas antibakteri sekresi spesies F. limnocharis (FL) dan L.
macrodon (LM) terhadap S. pneumoniae SPN1307 dan ATCC 49619 dengan perendaman sterilepaper disk pada 30 menit 20
DAFTAR GAMBAR
1 S. pneumoniae ATCC 49619 7
2 Kultur S. pneumoniae pada cawan petri 8
3 S. pnuemoniae SPN1307 9
4 Katak tegalan (F. limnocharis) 10
5 Bangkong batu (L. macrodon) 11
6 Lapisan kulit katak 12
7 Hasil elektroforesis fragmen DNA COI F. limnocharis menggunakan
pasangan primer LCO1490/ HCO2198 17
8 Hasil elektroforesis fragmen DNA COI L. macrodon menggunakan
pasangan primer LCO1490/ HCO2198 17
9 Pohon filogenetik berdasar sekuensing basa a partial fragment of mitochondrial cytochrome oxidase subunit I COI dari F. limnocharis
terhadap beberapa spesies hewan 18
10 Aktivitas antibakteri sekresi spesies F. limnocharis terhadap S. SPN1307
(A) dan ATCC 49619 serta L. macrodon (C) 19
11 Aktivitas antibakteri sekresi spesies F. limnocharis terhadap S. pneumoniae SPN1307 pada perendaman 5 menit (A) dan 30 menit (B)
serta L. macrodon (C) 20
DAFTAR LAMPIRAN
1 Bagan alir penelitian 34
2 Analisis BOLD Systems F. limnocharis 35
3 S. pneumoniae non-MDR/ATCC49619 35
4 Sampling dan Persiapan Sampel 36
1
PENDAHULUAN
Latar Belakang
Saat ini organisme multidrug resistant/MDR (MDRO) merupakan suatu fenomena global, dalam penyebarannya terdapat perbedaan tiap-tiap daerah secara signifikan (Kaspar et al, 2015). Multidrug resistant/MDR (MDRO) diketahui sebagai pengaruh negatif dari pasien (menyebabkan terjadinya penundaan dan keterbatasan opsi pengobatan antibiotik) dan menjadikan suatu pertimbangan pengobatan terhadap kesehatan masyarakat karena dapat ditransmisikan dari satu orang ke orang lainnya (Lepelletier et al, 2011). Eropa, sebagai contoh, rata-rata persentase resistensi terhadap Klebsiella pneumonia meningkat dalam kurun beberapa tahun terakhir (21.5% pada 2009 menjadi 25.7% di tahun 2012) (ECDC, 2012).
Perkembangan yang cepatnya transportasi dan komunikasi, perubahan lingkungan dan migrasi populasi menciptakan kesempatan penyebaram luas penyakit infeksi terkhusus spesimen mutan yang telah mengalami kekebalan terhadap bebagai antibiotik. Kemunculan dan perluasan dari patogenik dan epidemik telah berlangsung selama 30 tahun belakangan. Terminologi tersebut menggambaran perhatian terhadap evolusi resistensi obat dan kesulitan dalam hal penanganan infeksi bakteri di saat ini dan kemudian hari (Livermore, 2009). Level tertinggi resistensi yang mana saat ini berupa hasil observasi dari penggunaan berlebih antibiotik, terhadap manusia maupun hewan telah diteliti lebih kurang selama 50 tahun terakhir (American society for microbiology, 2009). Resistensi antibiotik tidak terjadi dikarenakan patogen saja tapi juga dan mungkin kolonisasi beberapa bakteri secara individual (baik manusia maupun hewan). Hal tersebut sulit terdeteksi dikarenakan gejala bawaan.
Data yang berasal dari Badan Kesehatan Dunia/WHO (2014) menunjukkan bahwa di seluruh dunia terjadi peningkatan signifikan jenis bakteri yang resisten terhadap beberapa obat antibakteri (Multidrug Resistant/MDR). Salah satu spesies bakteri yang sering menginfeksi masyarakat baik di dunia maupun di Indonesia adalah Streptococcus pneumoniae. Namun, di Indonesia, permasalahan ini belum menjadi prioritas dan perhatian utama bidang kesehatan. Walaupun telah dilakukan riset resistensi antimikroba di Indonesia. Riset atas resistensi antimikroba di Indonesia: pravalensi dan pencegahan (AMRIN) telah coba dilakukan antara tahun 2001 hingga 2005 (Hadi et al, 2013).
Antibiotik penisilin memberikan perubahan besar pada kesembuhan pasien (90%) terhadap S. pneumoniae, namun resistensi terhadap turunan antibiotik penisilin juga dilaporkan sejak awal penggunaannya di dunia medis tahun 1940. Selanjutnya, hingga tahun 2014, WHO mencatat adanya infeksi S. pneumoniae
yang mengakibatkan lebih dari 826.000 kasus kematian di seluruh dunia akibat resistensi S. pneumoniae terhadap penisilin yang mencapai 69%. Tidak mengherankan, resistensi beberapa spesies bakteri terkhusus S. pneumoniae
terhadap antibiotik dengan cepat menjadi isu global.
2
Berdasarkan data WHO (2005) di seluruh dunia, hampir 1,6 juta orang meninggal karena infeksi S. pneumoniae, termasuk 700.000 hingga 1 juta jiwa anak usia rata-rata 1-59 bulan menjadi korban (WHO, 2014). Sejak tahun 1960an, S. pneumoniae
dianggap memiliki resintensi terhadap penisilin, namun tes yang sensitif terhadap dugaan tersebut sulit dilakukan. Appelbaum, P.C tahun 1977 menyatakan bahwa riset yang dimulai tahun 1965 hingga 1967 di Australia, untuk pertama kalinya berhasil mengisolasi spesies S. pneumoniae yang resisten terhadap penisilin. Margaret et al (1999) melaporkan S. pneumoniae yang resisten terhadap penisilin juga telah diisolasi di Papua New Guinea dan Afrika Utara. Selain itu, 0.3% hingga 9% isolat S. pneumoniae dilaporkanresisten terhadap penisilin di Jerman.
Hingga kini terdapat hampir 4000 senyawa di dunia dengan kemampuan sebagai antibiotik. Antibiotik digunakan untuk mengobati dan mencegah infeksi pada hewan. Zhang (2014) menyatakan bahwa antibiotik didapat dari tiga sumber: mold atau jamur, bakteri, senyawa sintetik atau non-sintetik. Mereka dapat digunakan salah satunya di dalam tubuh dan salah satu fungsinya adalah untuk menghambat pertumbuhan patogen atau membunuhnya. Antibiotik dapat juga dibagi menjadi jenis bakteriostatik yang hanya menghambat pertumbuhan patogen dan bakteriosidal dengan kemampuan membunuh bakteri. Walau begitu, perbedaan dari keduanya tidaklah mutlak dan tergantung konsentrasi obat, spesies bakteri dan fase pertumbuhan bakteri tersebut.
Subpopulasi dari bakteria dapat bertahan pada dosis maksimal antibiotik yang menjadikannya resisten sementara waktu dan juga tidak serta merta sifat tersebut diturunkan, disebut persistensi. Studi yang dilakukan Dorr et al (2009) menunjukkan bahwa sebagian persistensi terhadap quinolone ciprofloxacin muncul pada penggunaan antibiotik.
Pengaruh antibiotik pada bakteria mengakibatkan rata-rata elevasi mutasi (hiper-mutator atau mutator). Ketika kemampuan alel tersebut bertambah karena sokongan mutasi, maka dapat mengakselarasikan laju evolusi di berbagai kondisi. Selama proses tersebut, mutator bakteria dapat menyesuaikan populasi hanya dengan dua tahap seleksi sel, disebut ‘hitchhiking’ (Rojas et al, 2013).
Antibiotik melawan bakteria dengan menghambat proses vital tertentu pada metabolisme selnya. Berdasarkan prosesnya, antibiotik dapat dibagi menjadi lima kelas utama:
1. Inhibitor dinding sel, contohnya penisilin dan vancomycin
2. Inhibitor sintesis asam nukleat, contohnya fluoroquinolon yang menghambat sintesis DNA dan rifamin menhambat sintesis RNA
3. Inhibitor sintesis protein, contohnya aminoglikosida 4. Anti-metabolit, contohnya obat sulfa
5. Antibiotik yang dapat menghancurkan membran sel, contohnya polymyxin B, gramicidin dan daptomycin.
3 adaptif. Hal ini secara normal membuktikan bahwa mutasi adaptif disebabkan resitensi antibiotik, walaupun, hal ini mungkin terjadi, secara khusus pada non-pertumbuhan bakteria.
Terdapat lima mekanisme utama drug resistant antibiotik yang dikarenakan mutasi kromosomal:
1. Reduksi permeabilitas dan penyerapan 2. Meningkatkan kebocoran obat dari target 3. Inaktivasi secara enzimatis
4. Perubahan atau ekspresi berlebih dari target obat
Hilangnya enzim yang terlibat dalam aktivasi obat. Mekanisme ini relatif baru
Masalah resistensi antibiotik telah menjadi perhatian yang berkelanjutan dalam riset peptida antimikrobial. Secara umum terjadinya pencarian terhadap antimikrobial pada berbagai jenis organisme dan juga menggunakan proses sintesis
de novo peptida secara umum juga dihubungkan dengan kimia (Nguyen et al, 2011). Berbagai cara dilakukan untuk mengidentifikasi peptida antimikrobial salah satunya menyangkut modifikasi fragmen peptida dari protein dengan massa besar menjadi sekuen baru. Salah satu strategi ini digunakan untuk mengidentifikasi jumlah sekuen antimikroba termasuk lactoferin dan lactoferrampin (Haney et al, 2013), kedua derivat peptida antimikrobial berasa dari atom besi yang mengikat protein, lactoferin. Contoh lain isolasi peptida antimikrobial dari protein besar termasuk derivat dari lisosim (Hunter et al, 2005) dan histon (Kawasaki et al, 2008 ; Tsao et al, 2009) yang butuh keahlian khusus. Sehingga diperlukan cara sederhana lain yang dilakukan untuk mencari peptida antimikrobial dari alam terkhusus pada hewan penghasil sekresi semisal katak.
Indonesia memiliki sekitar 450 spesies katak (Wulandari et al. 2013). Cairan yang disekresikan dari kulit katak merupakan salah satu bahan baku potensial untuk dikembangkan sebagai antibakteri multidrug resistant/MDR. Secara klinis, laporan hasil penelitian yang dilakukan oleh Conlon dan Sonnevend (2011), menunjukkan bahwa ada bioaktivitas sekresi kulit katak terhadap bakteri yang telah resisten antibiotika. Selain itu Amiche et al. (2000) telah berhasil mengisolasi 32-residu peptida dinamakan dermatoksin dari spesimen katak pohon Phyllomedusa bicolor
yang berasal dari Amerika Utara, menunjukkan daya hambat terhadap mollicute
(eubakteria berdinding sel tipis) dan eubacteria Gram positif serta eubacteria Gram negatif.
4
antibakteri sekresinya terhadap isolat S. pneumoniae terkhusus MDR dan non-MDR.
Perumusan Masalah
Berdasarkan data penelitian tentang resistensi S. pneumoniae terhadap penisilin, seperti yang dilaporkan Overweg et al pada tahun 1999 memberikan informasi genetis mengenai berbagai variasi spesies multidrug resistant (MDR) S. pneumoniae terhadap penisilin di Polandia. Merujuk hal tersebut di atas maka diperlukan upaya bersama untuk menanggulangi permasalahan resistensi S. pneumoniae terhadap antibiotika. Salah satu upaya yang dilakukan adalah pengembangan senyawa antibakteri baru yang secara efektif dan efisien dalam menanggulangi permasalahan tersebut.
Permasalahan ini memberikan tantangan besar bagi Ilmu Pengetahuan Sains dan Kedokteran untuk terus berinovasi menemukan senyawa bioaktif pengganti penisilin. Sekresi kulit katak berupa senyawa aktif menunjukkan prospek cerah pengganti penisilin di masa depan, salah satu penelitian Wang et al di tahun 2012 menunjukkan bahwa peptida yang diisolasi dari kulit katak odorous Hainan, Cina secara positif menghambat pertumbuhan bakteri Gram positif (Enterococcus sp.,
Staphylococus sp., Bacillus sp. dan Rhodococcus sp.), Gram negatif (Salmonella
sp., Pseudomonas sp., E. coli, Psychrobacter sp.) serta jamur (Slime mould dan
Candida albicans). Oleh karena itu, perlu dilakukan eksplorasi dan uji aktivitas senyawa bioaktif sekresi kulit katak di Indonesia yang dapat aktif menghambat spesies multidrug resisistant (MDR) S. pneumoniae.
Menurut Song et al (2013), mulanya peptida antimikroba, margainin, diisolasi dari Xenopus laevis, hingga kemudian lebih dari 2000 peptida antimikroba berhasil diidentifikasi dari kulit amfibi. Beberapa tahun terakhir, banyak peptida dengan kemampuan bioaktivitas berbeda diidentifikasi, termasuk inhibitor protease dan peptida antioksidan. Keseluruhan bioaktif peptida tersebut memiliki fungsi biologis yang penting. Peptida antimikroba merupakan baris pertahanan pertama pada keimunitasan sel menghadapi invasi mikroba. Beberapa petogen memproduksi protease ekstraseluler dan mendegradasi peptida antimikroba. Sebagai contohnya, protease dari Staphylococcus aureus mendegradasi LL-37 dan laktoferisin B. Membran terluar protease Salmonella enteria serovar typhimurium
menunjukkan resistensi terhadap peptida (alfa heliks) antimikroba.
Faktor lingkungan memberi dampak terhadap kemampuan organisme terutama pada jenis amfibi secara umum berubah-ubah dari suatu waktu dan ruang dan variasi yang seringkali menyebabkan ketidakcocokan antara fenotip dan lingkungan. Lebih jauh, pada beberapa kasus terjadi variasi pada skala waktu tertentu dimana keadaan yang tidak kondusif untuk menciptakan respon konstitutif yang evolusioner. Akibatnya, kebanyakan organisme, dalam hal ini katak, menunjukkan beberapa kapasitas untuk mengulang bentuk respon fenotip selama siklus kehidupan agar dapat selaras anatar fenotip dan pengaruh lingkungan (Maher
et al, 2013), seperti adanya polusi dan penyakit.
5 dari kulit Rana graham dan 197 bioaktif peptida diidentifikasi dari Odorrana andersonii melalui screening yang dilakukan pada pustaka cDNA sebagai acuan (Song et al,2013).
Peptida antimikrobial adalah satu komponen penting dari sistem imun yang dari awal kehidupan dari vertebrata dan memainkan peranan utama sebagai satu jalur pertahanan pada perhanan selaput lendir (Zasloff, 2002; Hancock et al, 2012). Seperti banyak spesies katak lain, kulit dari Rana pipiens memiliki dua set kelenjar khusus. Kelenjar mucus menghasilakan suatu material yang kaya akan mucin (glikoprotein mucus) terglikosilasi dan mukopolisakida, yang secara kontinu keluar untuk melembabkan kulit katak. Antimikrobial peptida dan peptida defensif lainnya diproduksi di kelenjar granular (terkadang disebut kelenjar racun) pada bagian dalam lapisan kulit. Isi dari kelenjar granular akan kosong hingga lapisan tipis dari mukus terproduksi secara khusus oleh kelenjar mukus (Gammill et al, 2012). R. pipiens menunjukkan sekresi kontinu antimikrobial peptida dengan kapasitas yang rendah serta tetap berlangsung beberapa jam setelah pengeluaran pertama. Tampak juga sekresi tersebut tetap mengalir pada jumlah yang kecil dari antimikrobial peptida untuk menghalangi patogen di kulit (Pask et al, 2012).
Penelitian variasi peptida antimikroba dari Lithobates chiricahuensisi di Arizona utara dan tengah menghasilkan dua jenis peptida (brevinin-1CHc dan palustrin-2Cha). Katak bercak hitam (Pelophylax nigromaculatus) terdistribusi luas di Cina, Jepang, Korea dan Rusia, dari daerah dingin ke kawasan tropis, dari dataran tinggi (pegunungan) ke dataran rendah (lembah). Distribusi P. nigromaculatus ini mengindikasikan adaptasi spesies terhadap berbagai bentuk lingkungan hidup. Sehingga, menghasilkan dua jenis peptida antimikroba yaitu, nigrocin-1 dan nigrocin-2, kemudian dengan menggunakan teknik kloning cDNA berhasil didapatkan delapan antimikroba.
Tabel 1 Bioaktif peptida dari katak Pelophylax nigromaculatus (Song et al, 2013) Nama Sekuen asam amino
Nigrocin-1 GLLDSIKGMAISAGKGALQNLLKVASCKLDKTC
Nigrocin-2 GLLSKVLGVGKKVLCGVSGLC
6
Tujuan Penelitian
Berdasarkan perumusan masalah di atas, maka penelitian ini bertujuan: 1. Menginduksi dan mengisolasi senyawa sekresi dari kulit katak
2. Mnguji aktivitas senyawa sekresi terhadap isolat S. pneumoniae MDR/non-MDR.
3. Menganalisis dan karakterisasi hubungan kekerabatan spesies DNA katak
Hipotesis Penelitian
Hipotesis penelitian ini adalah senyawa bioaktif dari sekresi kulit katak memiliki kemampuan sebagai antibakteri S. pneumoniae multidrug resistant
(MDR)/non-MDR di Indonesia. Bioaktif sekersi kulit katak yang memiliki kemampuan sebagai antibakteri merupakan golongan senyawa peptida.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan penemuan baru dalam pengeksplorasian berbagai senyawa bioaktif terkhusus dari sekresi kulit katak Jawa Barat terkhusus daerah Bogor yang mampu menjadi antibakteri S. pneumoniae
terutama bagi multidrug resistant (MDR) di Indonesia.
Ruang Lingkup Penelitian
7
2
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Agustus 2014 sampai Januari 2015. Penelitian dikerjakan di laboratorium Biokimia IPB dan Lembaga Eijkman Jakarta.
Bahan
Bahan yang digunakan dalam penelitian ini adalah spesies katak yang didapat dari areal persawahan Kampus IPB Dramaga, Jalan Sawah Baru, Kelurahan Babakan, Kecamatan Dramaga, Bogor-Jawa Barat. Eksplorasi dalam pencarian katak dilakukan secara bebas dan acak di setiap sawah untuk mengetahui seberapa besar kemungkinan spesies katak yang memiliki keunggulan sebagai antibakteri. Bakteri uji adalah S. pneumoniae non-MDR/ATCC49619 serta yang telah mengalami multi drug resistant (MDR)/SPN1307 berasal dari pustaka Eijkman Institute, larutan buffer, epinefrin, media Mueller Hinton+Blood, Go taq Green, kloramfenikol.
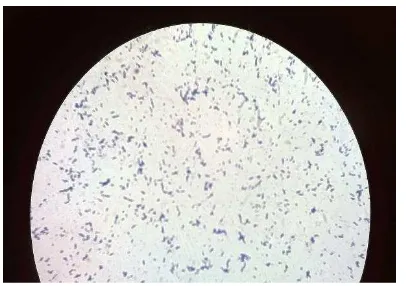
Streptococcus pnuemoniae adalah bakteri dengan karakteristik bentuk bulat berantai, Gram positif, organisme fakultatif anaerobik. Pneumococcal Disease The Pink Book Course Textbook - 12th Edition Second Printing (2012) menyebutkan bahwa bakteri ini secara khusus ditemukan berpasangan (diplococci) namun terkadang bentuk secara tunggal atau rantai pendek. Beberapa pneumococcus memiliki kapsul, yang terdiri dari kompleks polisakarida.
Gambar 1 S. pnuemoniae ATCC 49619 (Koleksi Pribadi)
Streptococcus merupakan suatu spesies yang mendominasi komposisi bakteri dalam plak. Bakteri ini merupakan mikroflora normal rongga mulut yang harus mendapat perhatian khusus karena kemampuannya membentuk plak dari sukrosa, melebihi jenis bakteri lainnya (Angelina, 2011). Kebanyakan Streptococcus
8
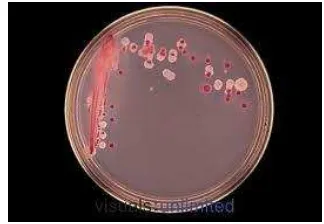
Gambar 2 Kultur S. pneumoniae pada cawan petri(Angelina, 2011)
Pneumococcus terdapat di bagian nasofaring dan seringkali bersama dengan bakteri terkapsulasi, seperti Haemophilus influenza dan Moraxella catarrhalis. Penyebarannya melalui pernafasan. Anak-anak merupakan sumber utama transmisi kepada orang dewasa. Secara global, rata-rata penyebaran tertinggi pada anak-anak usia muda (40-60%), untuk usia anak lebih tua (12%), remaja (6-10%) dan dewasa (3-4%). Kolonisasi pneumococcus adalah proses yang dinamis seperti yang dinyatakan oleh Mehr, S dan Wood, N (2012).
Martinez RM (2013) menyebutkan S. pneumoniae memproduksi kapsul yang memproteksi lapisan, menyelubungi sel. Fungsi kapsul untuk menghindari sistem imunitas dari inang dan memainkan peranan penting pada kolonisasi dari bagian saluran pernasafan. Sebagai tambahan, fungsi kapsul pada S. pneumoniae yaitu mengekspresikan berbagai faktor virulensi yang berkontribusi terhadap faktor penyebab penyakit.
S. pneumoniae adalah bakteri α-hemolitik. α-hemolitik dikarakterisasi dengan seringkali adanya warna agak kehijauan disekitaran koloni. Reaksi ini dihasilkan dari hemolisis parsial dari sel darah merah dalam medium. Streptococcus
berdasarkan pada grup ini biasa disebut sebagai “Viridans” Streptococcus
(Microlab, 2007).
Tabel 2 Aktivitas beberapa antibiotik terhadap S. pneumoniae ATCC 49619 Golongan Antibiotik Nama Antibiotik Hasil Aktivitas
Chloramphenicol Chloramphenicol Sensitif
Lincosamide Clindamycin Sensitif
Macrolide Erytrhomycin Sensitif
Trimethoprim Trimethoprim Sensitif
Penicillin Oxacillin Resisten
Tetracyclines Tetracyclines Intermediate
9
Gambar 3 S. pnuemoniae SPN1307 (MDR) (
Koleksi Pribadi)
Pengamatan secara morfologi pada isolat S. pneumoniae ditunjang juga dengan data lain berupa kemampuannya terhadap antibiotik sehingga dapat dipastikan bahwa isolat tersebut merupakan Multi Drug Resistant (MDR) atau tidak. Tabel 3 Aktivitas beberapa antibiotik terhadap S. pneumoniae SPN1307
Golongan Antibiotik Nama Antibiotik Hasil Aktivitas
Glycopeptide Vancomycin Sensitif
Chloramphenicol Chloramphenicol Sensitif
Ansamycin Rifampin Sensitif
Trimethoprim Trimethoprim Resisten
Tetracyclines Tetracyclines Resisten
Macrolide Azithromycin
Erytrhomycin
Resisten Resisten
Quinolones Levofloxacin Sensitif
Alat
Alat yang digunakan adalah seperangkat alat Applied Biosystems 3100-Avant Genetic Analyzer di Eijkman Institute, seperangkat alat Nanodrop
Spectrophotometer ND-1000, seperangkat alat freeze dryer Christ alpha 1-2/ LD plus laboratorium Biokimia Pusat Studi Biofarmaka Bogor, kontainer plastik, inkubator, HYUNDAI Micro syringe filter membran 0,22 µm (Cat. No. HM020P25), jarum ose, micropipet, pipet tetes, pH meter, neraca analitik, tabung reaksi, Erlenmeyer, serta autoklaf HIRAYAMA Hiclave HVE-50.
Persiapan Sampel
10
spesies sebanyak 9 ekor. Rancangan penelitian yang digunakan adalah rancangan acak lengkap (RAL).
Pengendalian kehidupan hewan uji mengacu dari Robertson et al (2013) dan Amiche et al (2000). Hewan uji yang digunakan adalah dari famili dicroglossidae
yaitu spesies Fejervarya limnocharis dan Limnonectes macrodon yang secara morfologi telah diidentifikasi oleh Dr. Mirza D. Kusrini beserta staf Departemen Konservasi Sumberdaya Hutan dan Ekowisata, Fakultas Kehutanan IPB Darmaga. Penggunaan kedua jenis katak ini dimaksudkan untuk mengeksplorasi spesies hidup di lingkungan pinggiran kota dan terbiasa terpapar polutan daerah perkotaan sehingga memliki sekresi yang mampu menjadi agen antibakteri.
Katak tegalan, Grass Frog, memiliki ciri khusus tubuh berukuran kecil, kepala runcing, dan pendek dengan tekstur kulit berkerut yang tertutup oleh bintil-bintil panjang yang tampak tipis. Bintil-bintil-bintil ini biasanya memanjang, paralel, dengan sumbu tubuh. Ujung jari tangan tumpul dan tidak melebar. Jari tangan pertama lebih panjang dari yang kedua. Jari kaki runcing dengan ujung yang tidak melebar. Kulit mempunyai benjolan-benjolan di bagian atas, benjolan sering berbentuk tidak teratur. Penelitian genetik menunjukkan bahwa katak tegalan F. limnocharis di Jawa merupakam jenis kompleks dan terdiri dari paling tidak dua spesies yang berbeda yaitu F. limnocharis dan F. Iskandari (Kusrini, 2013).
Gambar 4 Katak tegalan (F. limnocharis) (IPB)
Jenis ini menghuni sawah dan padang rumput di daratan rendah, jarang sampai 700 m dan dijumpai juga di sekitaran kolam dan sungai. Iskandar (1998) memisahkan jenis yang serupa dengan katak tegalan ini yang dijumpai di dataran tinggi F. Iskandari.
Bangkong batu, Stone Creek Frog, menurut Kusrini (2013) katak berukuran sangat besar dengan kepala yang besar. Kulit halus dengan beberapa bintil yang tersebar dan pada bagian belakang pelupuk mata terdapat bintil-bintil dengan jari kaki berselaput sampai ujungnya. Kepala lebih panjang atau sama lebarnya.
Typanum jelas. Ujung jari melebar, jari pertama lebih panjang daripada yang kedua. Bintil subarticular berbentuk sempurna. Ujung jari kaki melebar membentuk disk
kecil. Jari kaki penuh atau hampir dipenuhi selaput, selaput lebar mencapai disk
11
Gambar 5 Bangkong batu (L. macrodon) (IPB)
Bakteri uji yang digunakan adalah S. pneumoniae non-MDR/ATCC49619 serta yang bersifat multi drug resistant (MDR)/SPN1307 yang berasal dari koleksi Lembaga Biologi Molekuler Eijkman, Jakarta. Isolat SPN1307 digolongkan MDR jika tidak dapat terinhibisi minimal tiga jenis antibiotik pada konsentrasi tertentu (Clinical and Laboratory Standards Institute/CLSI) yaitu golongan makrolida (azithromycin, erythromycin) dan tetracycline.
Persiapan Larutan
Larutan HCl 1% dibuat dari HCl pekat (37%) sebanyak 6,8 mL dan diencerkan menggunakan akuades hingga volume tepat 250 mL. Sedangkan larutan buffer garam asetat dibuat dari garam NaCl (2,9225 g) + CH3COONa (2,05075 g) hingga tepat volumenya 1 L, dan pH tepat 7,0 (Makhir larutan buffer adalah 50 mM NaCl, 500 mL dan 25 mM CH3COONa, 500 mL).
Pengukuran Karakteristik dan Koleksi Sekresi Kulit Katak
Pengeluaran sekresi kulit katak dirangsang dengan penyuntikan epinefrin. Jumlah epinefrin yang diinjeksikan dihitung berdasarkan berat tubuh sampel katak. Karakteristik fisik sampel katak yang diukur meliputi SVL (Snout Vent Length) dan berat tubuh, hal ini dilakukan untuk menstandarisasi katak ukuran katak yang akan dijadikan sampel serta sebagai penentu jumlah senyawa stimulant yang akan diinduksikan. Pengukuran SVL dilakukan dengan menggunakan jangka sorong. Pengukuran standar SVL dimulai dari ujung mulut pada katak diteruskan secara vertikal hingga mencapai ujung tulang ekor katak. Pengukuran dilakukan sebelum injeksi senyawa stimulan dilakukan.
12
menggunakan alat freeze dryer dengan konsep pengeringan vakum pada suhu dingin (-20º C), lalu dilarutkan dalam buffer fosfat (PBS) ±1-2 mL dan disterilkan dengan menggunakan membran 0,22 µm (Hyundai Micro, Cat. No. HM020P25) dan selanjutnya digunakan dalam uji aktivitas antibakteri.
Gambar 6 Lapisan kulit katak (McGran-Hill Companies)
Isolasi DNA Genom Katak
Analisis filogenetik katak dilakukan berdasarkan sekuen fragmen DNA penyandi partial fragment of mitochondrial cytochrome oxidase subunit I COI
mitokondria. Sampel DNA genom diisolasi dari potongan jari depan dan jari belakang katak. Semua tahap pengerjaan ekstraksi DNA menggunakan DNeasy Blood & Tissue Kit keluaran Qiagen, pengerjaannya menggunakan Protainase K dan inkubasi selama ±3-6 jam, lalu ditambahkan beberapa kali washing buffer dan sentrifus 8000-14000 rpm hingga diperoleh DNA murni. DNA hasil isolasi dari sampel katak diukur konsentrasinya menggunakan seperangkat alat Nanodrop SpectrophotometerND-1000 pada λ=260.
Amplifikasi Fragmen DNA Penyandi COI
Fragmen DNA COI diamplifikasi menggunakan metode PCR dengan dua pasang primer, kondisi PCR yang dilakukan: 95° C 5 menit, 94° C 4 menit, 46º C 1 menit, 72° C 1 menit, 72º C 10 menit, 25° C ∞, 35 siklus. Penggunaan 2 pasang primer merujuk Che et al. (2011) yang bertujuan untuk memilih primer terbaik dari
Universal COI Primer (a partial fragment of mitochondrial cytochrome oxidase subunit I COI) yaitu :
(a) LCO1490: 5’-GGTCAACAAATCATAAAGATATTGG-3’ (Forward)
(b) HCO2198: 5’-TAAACTTCAGGGTGACCAAAAAATCA-3’ (Reverse)
(c) LepF1 : 5’-ATTCAACCAATCATAAAGATATTGG-3’ (Forward)
(d) LepR1 : 5’-TAAACTTCTGGATGTCCAAAAAATCA-3’ (Reverse)
13 menggunakan Bio-Rad Gel Doc kemudian dimurnikan dengan PCR DNA
Fragments Extraction Kit keluaran Geneaid (Cat. No. DF300). Pengerjaan dilakukan sesuai instruksi rinci dari kit tersebut.
Sekuensing DNA dan Konstruksi Pohon Filogenetik
Penentuan sekuen DNA dilakukan dengan merujuk prosedur pengerjaan oleh Gonser & Collura (1996). Sekuensing DNA menggunakan sampel hasil amplifikasi PCR yang sebelumnya telah divalidasi kebenaran pita tunggalnya melalui proses elektroforesis agarosa. Cycle Sequencing dilakukan dengan menggunakan BigDye Terminator Sequencing. Campuran larutan PCR untuk cycle sequencing: BigDye sebanyak 6 µL+ primer forward/reverse (konsentrasi 2 µM) sebanyak 1.5 µL + DNA 1 µL serta ddH2O hingga volume total 15 µL. Kondisi PCR yang digunakan yaitu: 96° C 3 menit, 96° C 10 detik, 50° C 5 detik dan 60° C 4 menit, 35 siklus. Hasil PCR dilanjutkan dengan tahapan presipitasi. Precipitation mix (Fresh) dibuat sebagai berikut: EDTA 125 µM (0.75 µL EDTA 250 µM + 0.75 µL H2O) lalu tambahkan 1.5 µL NaAc 3 M serta ethanol absolute 37.5 µL. Larutan divortex kemudian inkubasi pada suhu ruang 10 menit, lalu pada 4° C selama 10 menit. Selanjutnya dilakukan sentrifugasi pada 15000xg selama 20 menit pada 4°C. Supernatan dibuang, lalu ditambahkan 250 µL ethanol 70%. Larutan divortex dan disentrifus 15000xg selama 10 menit pada suhu 4° C. Supernatan dibuang, kemudian di vacuum vortex ±10 menit. Sampel siap dibaca dengan menggunakan
DNA Sequencer: Applied Biosystems 3100-Avant Genetic Analyzer. Pohon filogenetik dikonstruksi menggunakan software MEGA6 dengan membandingkan sekuen fragmen DNA COI hasil percobaan terhadap sekuen fragmen DNA COI dari beberapa spesies yang tersimpan di GenBank dan BOLD System.
Uji Aktivitas Senyawa Sekresi Kulit Katak
Sebelum digunakan untuk pengujian aktivitas antibakteri, bakteri uji diremajakan. Regenerasi bakteri multi drug resistant (MDR)/non-MDR isolat S. pneumoniae yaitu SPN1307 dan ATCC49619, dilakukan dengan menggoreskan masing-masing koloni ke dalam cawan petri yang berisi media Mueller Hinton+Blood (MHB) menggunakan jarum ose. Biakan disimpan dalam inkubator selama 24 jam dengan suhu 37° C dan 5% CO2. Setelah inkubasi, biakan bakteri yang telah diregenerasi diambil 1 jarum ose kemudian dimasukkan ke dalam tabung berisi larutan steril NaCl 0.9%, lalu dilakukan pengenceran hingga konsentrasi menjadi 3x108 CFU/mL (Mc Farland). Hasil pengenceran tersebut diambil secukupnya lalu digoreskan pada media padat biakan bakteri (Mueller Hinton+Blood). Uji aktivitas antibakteri menggunakan teknik sumuran dan sterile paper disk. Penggunaan kedua teknik ini merupakan suatu cara sederhana dalam
14
kloramfenikol. Konsentrasi kontrol positif antibiotik kloramfenikol adalah 0.4 mg/mL sebanyak 40 µL (Pinontoan, 2012). Setelah dilakukan inkubasi selama 24 jam pada suhu 37° C dan 5% CO2. Zona bening yang terbentuk diukur sebagai indikator aktivitas antibakteri. Selain itu juga digunakan teknik paper disk, melalui perbandingan lama perendaman sterile paper disk dalam senyawa sekresi kulit katak, yaitu pada selang waktu 5 menit dan 30 menit. Teknik uji menggunakan metode paper disk dilakukan dengan cara merendam paper disk sterile ke dalam larutan sekresi kulit katak selama selang waktu 5 menit dan 30 menit. Setelah itu,
paper disk hasil perendaman ditempelkan di permukaan media MHB yang sebelumnya telah diinokulasikan bakteri S. pneumoniae MDR/non-MDR. Sehingga interpretasi hasil akan menunjukkan adanya zona bening jika dapat menghambat pertumbuhan bakteri setelah masa inkubasi selesai.
Analisis Data
15
3
HASIL
Karakteristik Fisik Sampel Katak dan Dosis Epinefrin
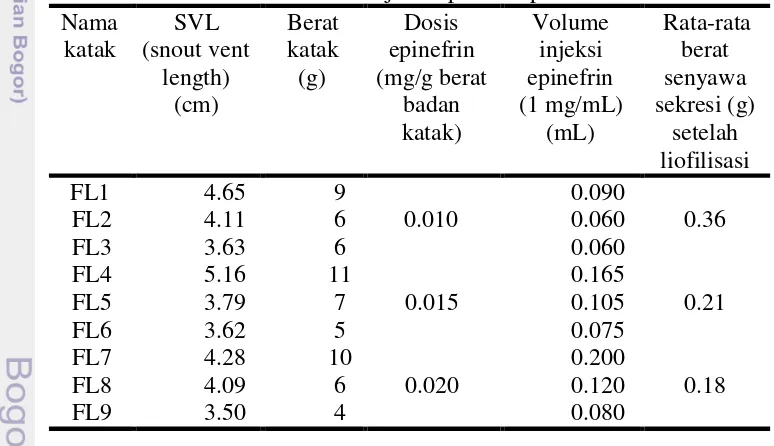
Pengeluaran sekresi kulit katak distimulasi dengan penyuntikan hormon epinefrin. Volume hormon epinefrin yang diinjeksikan bergantung pada berat badan katak. Hasil pengamatan yang ditampilkan pada Tabel 4 dan 5 menunjukkan bahwa aktivitas fisik katak berkurang setelah penyuntikan senyawa stimulan epinefrin, bahkan beberapa ekor katak memperlihatkan tidak adanya stres berlebih.
Hasil pengukuran baik berupa SVL maupun berat katak masing-masing menunjukkan bahwa katak yang digunakan memiliki panjang rata-rata antara 3.00-5.00 cm serta 4.00-11.00 g pada pengukuran spesies F. limnocharis, sedangkan untuk pengukuran SVL dan berat pada L. macrodon masing-masingnya adalah rata-rata antara 6.00-8.00 cm dan 33.00-66.00 g. hasil pengukuran ini akan sikron dengan standar minimal rata-rata kebutuhan katak dewasa.
Hasil pengamatan menunjukkan aktivitas fisik katak berkurang setelah dilakukan stimulasi dengan senyawa stimulan epinefrin, bahkan untuk beberapa ekor katak menyebabkan efek yaitu tidak gelisah dan tidak menunjukkan adanya stres berlebihan. Bagian bola mata katak yang sebelumnya normal tampak menjadi hitam keseluruhan disebabkan pengaruh stimulan yang efektif.
16
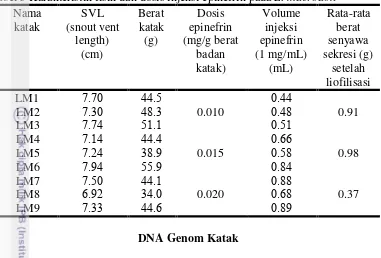
Tabel 5 Karakteristik fisik dan dosis injeksi epinefrin pada L. macrodon Nama limnocharis berkisar antara 13-59 ng/µ L. Konsentrasi DNA genom katak spesies
L. macrodon berkisar antara 11-65 ng/µ L.
Tabel 6 Konsentrasi DNA isolasi F. limnocharis (FL) dan L. macrodon (LM) Nama katak Konsentrasi
Amplikon Fragmen Gen Sitokrom Oksidase Subunit I
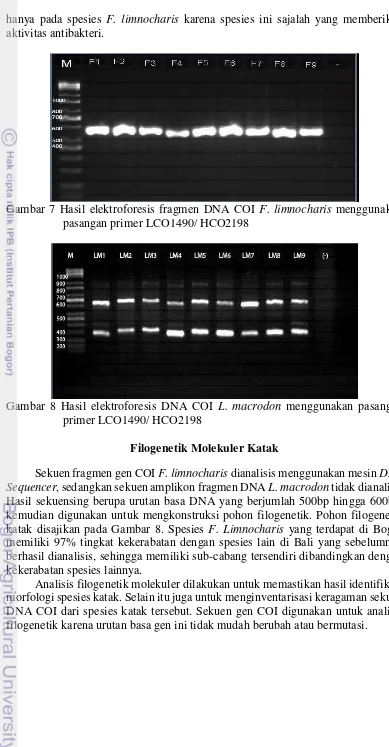
17 hanya pada spesies F. limnocharis karena spesies ini sajalah yang memberikan aktivitas antibakteri.
Gambar 7 Hasil elektroforesis fragmen DNA COI F. limnocharis menggunakan pasangan primer LCO1490/ HCO2198
Gambar 8 Hasil elektroforesis DNA COI L. macrodon menggunakan pasangan primer LCO1490/ HCO2198
Filogenetik Molekuler Katak
Sekuen fragmen gen COI F. limnocharis dianalisis menggunakan mesin DNA Sequencer, sedangkan sekuen amplikon fragmen DNA L. macrodon tidak dianalisis. Hasil sekuensing berupa urutan basa DNA yang berjumlah 500bp hingga 600bp, kemudian digunakan untuk mengkonstruksi pohon filogenetik. Pohon filogenetik katak disajikan pada Gambar 8. Spesies F. Limnocharis yang terdapat di Bogor memiliki 97% tingkat kekerabatan dengan spesies lain di Bali yang sebelumnya berhasil dianalisis, sehingga memiliki sub-cabang tersendiri dibandingkan dengan kekerabatan spesies lainnya.
18
Gambar 9 Pohon filogenetik berdasar sekuensing basa a partial fragment of mitochondrial cytochrome oxidase subunit I COI dari F. limnocharis
terhadap beberapa spesies hewan
Hasil analisis genetik menggunakan BOLD Systems sebagai rujukan data DNA COI menunjukkan 97% kekerabatan dengan spesies F. limnocharis yang telah diidentifikasi sebelumnya di Bali. Pohon filogenetik yang ditampilkan juga mencakup analisis kekerabatan dengan beberapa data DNA COI spesies lain dari GenBank. Tingkat kekerabatan yang tidak mencapai 100% bila dibandingkan dengan spesies lain di Bali terjadi karena ada beberapa perbedaan dalam sekuen DNA COI spesies.
Aktivitas Antibakteri Sekresi Kulit Katak
Isolat bakteri MDR/SPN1307 dan non-MDR/ATCC49619 yang ditumbuhkan dalam media MHB agar selama 24 jam pada 37° C dan 5% CO2 menunjukkan profil isolat S. pneumoniae yaitu kokus tunggal berbentuk bulat dan tersusun dalam bentuk rantai. Ciri khusus spesies ini adalah kemampuannya untuk melakukan reaksi hemolitik pada agar darah, dikenal sebagai α-hemolitik (hemolisis sebagian).
19
Gambar 10 Aktivitas antibakteri sekresi spesies F. limnocharis terhadap S.
SPN1307 (A) dan ATCC 49619 serta L. macrodon (C)
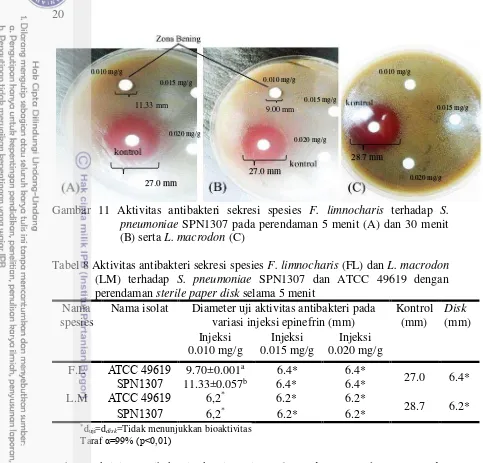
Hasil zona bening pada kontrol yaitu kloramfenikol adalah rata-rata berkisar 29.5-31.00 mm pada pengujian menggunakan metode sumuran dan 27.00-29.00 untuk pengukuran pada metoda paper disk, sehingga memang dapat dipastikan bahwa penggunaan antibiotik kloramfenikol konsentrasi 0.4 mg/ml masih sangat sensitive untuk uji terhadap S. pneumonia. Walaupun begitu, peneliti menyarankan menggunakan metode sumuran untuk riset selanjutnya dikarenakan adanya kontak langsung bakteri terhadap senyawa antibiotik dibandingkan menggunakan paper disk yang terlebih dahulu menyerap senyawa antibotik. Sehingga dikhawatirkan ketidakmaksimalan dalam proses penyerapan senyawa antibiotik.
Tabel 7 Aktivitas antibakteri sekresi spesies F. limnocharis (FL) dan L. macrodon
(LM) terhadap S. pneumoniae SPN1307 dan ATCC 49619 menggunakan metode sumuran
Nama spesies
Nama isolat Diameter uji aktivitas antibakteri pada variasi injeksi epinefrin (mm)
uji=dsumuran=Tidak menunjukkan bioaktivitas
20
Gambar 11 Aktivitas antibakteri sekresi spesies F. limnocharis terhadap S. pneumoniae SPN1307 pada perendaman 5 menit (A) dan 30 menit (B) serta L. macrodon (C)
Tabel 8 Aktivitas antibakteri sekresi spesies F. limnocharis (FL) dan L. macrodon
(LM) terhadap S. pneumoniae SPN1307 dan ATCC 49619 dengan perendaman sterile paper disk selama 5 menit
Nama spesies
Nama isolat Diameter uji aktivitas antibakteri pada variasi injeksi epinefrin (mm)
Tabel 9 Aktivitas antibakteri sekresi spesies F. limnocharis (FL) dan L. macrodon
(LM) terhadap S. pneumoniae SPN1307 dan ATCC 49619 dengan perendaman sterile paper disk pada 30 menit
Nama spesies
21 Hasil uji sekresi kulit katak F. limnocharis diindikasikan memiliki kemampuan menghambat pertumbuhan sel bakteri S. pneumoniae MDR maupun yang non-MDR. Namun, cairan sekresi kulit katak L. macrodon tidak menunjukkan kemampuan antibakteri. Melalui dua metode uji berupa sumuran dan paper disk
dapat diketahui bahwa sekresi kulit katak spesies F. limnocharis ternyata memiliki kemampuan kecil sebagai antibakteri, tidak sebesar kemampuan hambat dibandingkan dengan kontrol antibiotik kloramfenikol.
22
4
PEMBAHASAN
Riset yang telah dilakukan merupakan suatu eksplorasi dan analisis bioaktivitas sekresi kulit katak Indonesia. Hewan coba yang digunakan adalah katak famili dicroglossidae yaitu F. limnocharis dan L. macrodon. Kedua katak ini dipilih karena keberadaannya yang dekat dengan pemukiman manusia dan ruang lingkup daerah pinggiran perkotaan. Selain itu, sekaligus untuk mengindentifikasi seberapa besar eksistensi yang tersisa di alam dari kedua jenis katak tersebut. Pemilihan jenis katak pada penelitian ini berdasarkan hasil riset yang telah dilakukan pada tahun 2012 oleh Pinontoan, dimana penggunaan spesies katak hutan yang terancam punah ternyata memiliki kemampuan bioaktivitas pada uji mikrobiologinya. Hasil pada penelitian ini ternyata belum sebaik pada penelitian yang telah dilakukan oleh Pinontoan tersebut dalam hal uji biokativitasnya. Hal ini terjadi kemungkinan dikarenakan bahwa spesies katak daerah pinggiran perkotaan menghasilkan senyawa sekresi yang fungsinya lebih kepada regulasi fisiologis daripada pertahanan terhadap predator/mikrooganisme apabila dibandingkan dengan katak hutan di penelitian-penelitian sebelumnya. Sehingga secara khusus spesies katak yang hidup pada lingkungan yang kaya dengan flora mikroba memiliki mekanisme tingkat ketahanan imun yang lebih baik (Rebecca, 2008).
Kulit dari beberapa spesies katak telah menunjukkan produksi bermacam-macam susunan dari antimikrobial peptida yang memiliki aktivitas terhadap bakteri Gram positif dan Gram negatif, virus dan jamur (Nicholas and Mor, 1995; Pukala
et al, 2006; Rollin-Smith, 2009). Setiap spesies memiliki pustaka jenis antimikrobial peptidanya sendiri-sendiri (Conlon et al, 2004). Peptida disintesis sebagai prekursor peptida dengan suatu sekuen sinyal dan acidic propiece yang dipotong untuk dapat melepaskan peptida aktif sebelum atau saat waktu sekresi berlangsung (Amiche et al, 1999). Peptida dipaketkan dengan rapat menuju kelenjar dengan struktur syncytial dari kelenjar beracun untuk dilepaskan (Bovbjerg, 1963; Dockray dan Hopkins, 1975; Amiche et al, 1999). Kelenjar berada dikelilingi oleh sel mioepitel disuplai oleh saraf simpatik. Ketika adanya sinyal atau luka, sistem saraf simpatik diaktivasi, neurotransmiter mengikutsertakan reseptor
adrenergic (Benson dan Hadley, 1969; Holmes dan Balls, 1978) dan isi dari kelenjar dilepaskan keluar lapisan kulit (Dockray dan Hopkins, 1975). Ketika kelenjar distimulasi, kelenjar mengandung peptida dirilis sebagai suatu yang telah dideskripsikan sebagai “holocrine” (Dockray dan Hopkins, 1975). Walaupun
begitu, terminologi tersebut menyarankan bahwa membram sel dari produksi sel terganggu dan keselurhan isi tertekan keluar. Disebabkan sel miopiteil di sekeliling kelenjar memiliki reseptor energi alfa-adrenergic, eksperimen pelepasan konten dari kelenjar dapat diinduksi dengan injeksi menggunakan senyawa noradrenaline serta turunannya (Dockray dan Hopkins, 1975).
23 hasil menunjukkan bahwa penyuntikan yang merujuk pada literatur sebelumnya (Pinontoan, 2012) yakni berkisar 0.01 mg/g berat hewan coba menghasilkan sekresi senyawa yang lebih baik. Pada penyuntikan dengan varisai lain yaitu 0.015 dan 0.02 mg/g berat tubuh dapat menyebabkan tingkat stres berlebih pada hewan coba, sehingga diduga tidak terjadi sekresi senyawa yang diinginkan melainkan justru memberikan efek kelainan detak jantung serta peredaran darah yang tidak teratur pada hewan coba. Pada tingkat tertentu dapat menyebabkan kematian. Selain menggunakan metode ini, ada beberapa metode lain yang telah disebutkan dalam penelitian di dunia, seperti kejut listrik, penggosokan kulit secara kontinu atau mengkondisikan lingkungan stres berlebih pada hewan coba.
Hasil sekresi kulit katak berupa campuran berbagai macam senyawa akan tidak sangat efektif dan begitu riskan jika secara langsung diuji bioaktivitasnya. Sehingga dilakukan proses liofilisasi terlebih dahulu. Teknik ini adalah suatu metode pengering bekuan menggunakan suhu rendah. Pelarut berupa air atau senyawa organik lain bercampur dan segera akan teruapkan dengan cepat tanpa merusak struktur senyawa sekresi yag diharapkan. Hasilnya berupa kristal padat. Kristal padat hasil liofilisasi dilarutkan dan disaring menggunakan syringe sterile
dengan diameter 0.22 µm untuk mencegah adanya kontaminan lain seperti spora jamur atau bakteri. Sehingga sekresi kulit katak dapat diindikasikan benar-benar steril dari berbagai kontaminan dan dapat dilakukan uji bioaktivitasnya.
Pada studi ini, sekresi kulit katak F. limnocharis memiliki kemampuan menghambat sel bakteri S. pneumoniae MDR maupun yang non-MDR. Namun, cairan sekresi kulit katak L. macrodon tidak menunjukkan kemampuan antibakteri. Melalui dua metode uji berupa sumuran dan paper disk dapat diketahui bahwa sekresi kulit katak spesies F. limnocharis ternyata memiliki kemampuan kecil sebagai antibakteri, walau tidak sebesar kemampuan hambat bila dibandingkan dengan kontrol antibiotik kloramfenikol. Sedangkan aktivitas antibakteri yang tidak ditunjukkan senyawa sekresi kulit katak L. macrodon, kemungkinan dikarenakan efektivitas senyawa sekresi yang dihasilkannya terhadap bakteri uji begitu rendah sehingga tidak dapat dideteksi dengan menggunakan metode pada saat riset dilakukan. Selain itu juga dapat disebabkan karena kemampuannya sebagai senyawa antibakteri tidak bisa menginhibisi jenis bakteri (Gram positif) yang digunakan, kemungkinan untuk bakteri yang lebih lemah (Gram negatif) seperti
Escherichia coli dan sebagainya.
Salah satu contoh kemampuan sekresi kulit katak dalam hal pembenaran kemampuannya terhadap patogen adalah infeksi dari chytridiomycosis yang disebabkan oleh jamur Batrachochytrium dendrobatidis (Skerratt et al, 2007; Collins, 2010). Kemungkianan mekanisme dari adanya antimikrobial peptida dalam usaha untuk proteksi dari infeksi adalah keyakinan bahwa pelepasan antimicrobial peptida ke dalam mukus menyediakan garis pertahanan pertama melawan patogen (Roolin-Smith dan Conlon, 2005; Roliins-Smith, 2009; Ramsey et al, 2010; Pask
24
pertumbuhannnya oleh pertahanan kimia mukus dari inang. Pertahanan termasuk antimikrobial peptidpeptidesim, antibodi mukosal dan metabolisme bakteri (Rollins-Smith et al, 2011). Sehingga dari penelitian terdahulu tersebut dipastikan bahwa faktor lingkungan terkhusus karena terpaparnya patogen tertetu pada suatu spesies amfibi dalam memberikan kemampuan antimikrobial peptida yang lebih besar ketimbang jenis katak yang tidak terpapar langsung patogen.
Penggunaan bakteri MDR (SPN1307) sebagai uji bioaktivitas senyawa sekresi kulit katak menunjukkan bahwa ada alternatif lain dalam pengembangan obat yang mampu menekan pertumbuhan bakteri mutan yang lebih menekankan pada proses lisis dinding sel bakteri, berbeda dengan cara kerja antibiotik yaitu inhibisi sintesis protein. S. pneumoniae SPN 1307 salah satunya resisten terhadap antibiotik golongan makrolida seperti eritromisin dikarenakan adanya gen resisten
mefA, ermB dan ermTR. Solusi lain dari penggunaan antibiotik pada S. pneumoniae
adalah pengembangan vaksin oligosakarida sintetik, didasari atas polisakarida kapsular yang menjadi faktor virulensi utama S. pneumoniae (Safari, 2010).
Hasil analisis antibakteri untuk senyawa sekresi dari F. limnocharis pada tiap-tiap metode yakni sumuran maupun sterile paper disk dengan menggunakan analisis statistik pada α=99% menghasilkan kesimpulan yang cukup mendasar bahwa untuk penggunaan bakteri uji baik MDR maupun non-MDR tidak berbeda nyata kecuali pada isolat MDR SPN1307 yang akan lebih efektif ketika direndam dengan sterilepaper disk selama 5 menit. Hal ini justru berbeda ketika dilakukan perendaman 30 menit, sehingga pembahasan yang mungkin dapat disampaikan adalah absorpsi permukaan paper disk terhadap peptida akan lebih maksimal pada perendaman 5 menit bila dibandingkan dengan perendaman 30 menit. Perendaman 30 menit diduga akan memungkinkan daerah pada permukaan paper disk justru lebih dulu mengikat pelarut ketimbang peptida. Ada daya saing antar pengikatan peptida dengan pelarut pada permukaan paper disk. Selain itu, kemungkinan lain yang bisa dijelaskan adalah konsentrasi senyawa antibakteri dalam sekresi kulit katak yang kecil justru akan semakin bertambah kecil ketika keseluruhan pelarut terabsorpsi secara sempurna pada bagian pori-pori permukaan paper disk.
Pada penggunaan di laboratorium mikrobiologi di Indonesia, tes kepekaan antimikrobial (Antimicrobial susceptibility testing/AST) masih menggunakan metode difusi disk di seluruh dunia (Felmingham dan Brown, 2001) dan zona penghambatan ditentukan secara manual dengan menggunakan penggaris atau jangka sorong. Hak manual seperti ini terkadang dapat menimbulkan ketidakeektifan dan ketidakakuratan pada saat pengukuran berlangsung seperti halnya dalam penelitian kali ini, sehigga beberapa penelitian mencoba menyempurnakan kemampuan difusi disk. The aura image system (Oxoid, Basingstoke, UK) mengkombinasikan manfaat difusi disk dan bekerja secara otomatis. Pengukuran yang otomatis dan penentuan zona serta memberikan interpertasi terhadap peneliti turut menunjukkan ketiadaan keterbatasan metode difusi disk (Lestari et al, 2008). Riset di kemudian hari diharapkan dapat menggunakan metode sensitif ini, terutama dalam hal uji antibiotik terhadap spesimen bakteri yang telah bermutasi dan memiliki kemmapuan MDR.
25 dibandingkan kontrol. Senyawa sekresi ini diduga memiliki aktivitas kationik dan komposisi hidrofobik, sehingga menjadikannya mampu untuk berinteraksi dengan membran sitoplasma mikroba yang khususnya bersifat anionik, kaya lipid. Interaksi pada membran terluar mikroba adalah terjadinya pengrusakan konten anionik lipid karena kontribusi eletrostatik. Senyawa sekresi kulit katak kemungkinan dapat menghilangkan gradien elektrokimia melewati membran plasma mikroba setelah beberapa saat interaksi terjadi. Senyawa sekresi kulit katak kemungkinan juga dapat secara cepat melewati tipisnya lapisan proteoglikan bakteri Gram positif (Wimley, 2010).
Potensi besar yang ditunjukkan antimikrobial peptida sebagai suatu terapi alternatif pengganti antibiotik komersial memberikan publikasi besar literatur-literatur yang bertujuan untuk mengetahui bagaimana antimikrobial peptida berinteraksi dengan membran sel. Sebajagian besar riset tersebut menggunakan model sistem membrane, salah satunya sebagai pendukung lapisan ganda lipid, gelembung dan lamellae serta menunjukkan bahwa beberapa antimikrobial peptida mampu menyebabkan terjadinya lisis biomembran dan membentuk pori membrane melalui mekanisme yaitu barrel stave dan pori toroidal (He et al, 1995; Huang et al, 1991;1999; Wu et al, 1995; Ludtke et al, 1994). Sehingga, saat ini diasumsikan bahwa antimikrobial peptida membunuh sel bakteri melalui mekanisme pembentukan pori-pori yang sama dimana terutama terjadi kerusakan sitoplasma. Walaupn begitu, sangat sedikit riset yang mengeksplorasi interaksi peptida-lipid pada sel hidup. Menurut riset Gee et al (2013) menyatakan bahwa sedikit sekali riset yang menentukan mekanisme interaksi antimikrobial peptida dalam bakteri hidup. Data dari riset tersebut memvisualisasikan interaksi kinetik dari melilitin, suatu derivat peptida, yang dilabel senyawa berfluoresensi (DPPC) dan mentransfernya ke dalam sel hidup E.coli menggunakan e-GFP. Hasilnya secara mengejutkan menampilkan aktivitas lisis yang dilakukan antimikrobial membran adalah ketidaksignifikan dari pembentukan pori dalam sel hidup bakteri tersebut, dibandingkan dengan sistem membrane buatan. Pada keadaan yang tidak sesuai dugaan ini, terdapat mekanisme cepat peptida masuk ke dalam sel bakteri dan secara bersamaan terjadi kerusakan sel sitoplasma. Hal ini secara kuat meyakinkan bahwa mekanisme interaksi lipid-peptida dalam sel bakteri hidup adalah suatu proses yang dinamis dimana menyebabkan gangguan sesaat membran sel tanpa merusak satu kesatuan utuh strukturnya.
26
DNA hasil isolasi didapat dengan melakukan ekstraksi dari jaringan tubuh katak (kuku). Lisis yang terjadi pada jaringan tersebut menggunakan proteinase-K sesuai aturan dari penggunaan kit ekstraksi jaringan dan darah hewan (Qiagen). Proteinase-K adalah suatu enzim serine protease yang berperan dalam proses lisis jaringan. Penggunaan Proteinase-K disebabkan kemampuan dan daya tahan terhadap suhu tinggi dibandingkan enzim lain. Selama proses ekstraksi DNA, terdapat berbagai bentuk protein kontaminan yang harus dihilangkan. Enzim ini memotong ikatan peptida pada protein kontaminan bagian gugus karboksil dari residu asam amino hidrofobik (alifatik dan aromatik), terutama pada pemotongan enzim DNAse yang dapat mendenaturasi DNA yang kita inginkan. Sehingga konsentrasi DNA hasil ekstraksi mencapai hasil maksimal.
Uji filogenetik dilakukan untuk meyakinkan hasil riset ini bahwa hewan coba yang digunakan adalah spesies yang benar berdasarkan analisis tingkat morfologi dan genetik. Selain itu juga untuk menginventarisasi keragaman sekuen DNA COI dari kedua jenis spesies tersebut terkhusus di Indonesia, gen COI digunakan karena urutan gen ini tidak mudah berubah atau bermutasi.
Kedua pasang primer yang digunakan pada uji genetik berdasarkan gen COI telah dipublikasikan sebelumnya oleh Che et al (2011). Hasilnya mampu mengindentifikasi lebih dari 36 jenis katak dan salamander di Cina. Namun untuk wilayah Asia lain seperti di Indonesia belum diidentifikasi. Hasil terbaik ditunjukkan pada analisis menggunakan pasangan primer LCO1490/HCO2198 yang lebih cocok untuk penentuan COI spesies katak sedangkan primer LepF1/LepR1 tidak memberi hasil apapun. Penggunaan primer LCO1490/HCO2198 pada penentuan pita DNA COI spesies L. macrodon
menunjukkan ketidakspesifikan target gen, sehingga muncul dua pasang pita yaitu 300bp dan 700bp. Hal ini dikarenakan primer yang digunakan adalah DNA COI universal sehingga perlu dilakukan optimasi pada tiap-tiap target gen. Untuk mendapatkan hasil spesifik penentuan DNA L. macrodon bisa juga dilakukan desain primer spesifik DNA COI spesies L. macrodon. Tingkat sekuen DNA hingga hubungan kekerabatan dilakukan hanya terhadap spesies F. limnocharis saja disebabkan spesies ini yang memberikan hasil positif pada uji antibakteri terhadap
S. pneumoniae MDR/non-MDR.
27
5
SIMPULAN DAN SARAN
Simpulan
Pencapaian studi ini berhasil menjawab hipotesis dan tujuan utama penelitian yang dilakukan. S. pneumoniae non-MDR terkhusus Multi Drug Resistant (MDR) diasumsikan dapat dihambat pertumbuhannya menggunakan sekresi kulit katak F. limnocharis. Aktivitas antibakteri dengan menggunakan sekresi kulit katak F. limnocharis melalui metode uji berupa sumuran dan sterile paper disk memberikan hasil yang baik. Aktivitas antibakteri dari metode sumuran tidak memberikan perbedaan nyata baik pada S. pneumoniae MDR maupun non-MDR. Sedangkan untuk metode sterile paper disk, perendaman terbaik selama 5 menit terhadap isolat S. pneumoniae Multi Drug Resistant (MDR) yaitu 1,133±0,057 cm. Pada L. macrodon, tidak menunjukkan adanya bioaktivitas antibakteri pada metode sumuran maupun sterile paper disk.
Penentuan filogenetik berdasarkan DNA COI untuk memastikan spesies katak yang digunakan adalah benar secara morfologi berhasil mengidentifikasi spesies F. limnocharis. Hasil ini ditunjukkan dengan analisis sekuen DNA tersebut pada BOLD Systems dan menghasilkan kesamaan 97% dengan spesies F. limnocharis lain yang sebelumnya pernah diteliti di Bali, Indonesia.
Saran
Namun, saran untuk kegiatan penelitian selanjutnya adalah optimasi metode lain dalam penentuan bioaktivitas senyawa sekresi kulit katak. Hal ini bertujuan agar dapat diketahui metoda lain yang mempunya sensitifitas lebih baik serta menunjukkan hasil pada uji antibakteri. Uji filogenetik DNA COI sebaiknya dilakukan dengan adanya primer spesifik lain yang dapat menghasilkan kecocokan yang akurat jika dibandingkan dengan berbagai data DNA COI yang sebelumnya telah ditemukan.
28
DAFTAR PUSTAKA
[ASM] American Society for Microbiology. 2009. Antibiotic resistance: an ecological perspective on old problem. http://www.asm.org/.
Amiche M, Seon AA, Pierre TN, Nicolas P. 1999. The dermaseptin precursors: a protein family with a common preproregion and a variable C-terminal antimicrobial domain. FEBS Lett. 456: 352-356.
Amiche M, Seon AA, Wroblewski H, Nicolas P. 2000. Isolation of dermatoxin from frog skin, an antibacterial peptide encoded by a novel member of the dermaseptin genes family. Eur J Biochem. 267: 4583-4592.
Angelina. 2011. Studi Streptococcus pneumoniae pada Rongga Mulut [Skripsi]. Makassar (ID): Universitas Hasannudin.
Appelbaum PC. 1992. Antimicrobial Resistance in Streptococcus pneumoniae: An Overview. Clin Infect Dis. 15(1):77-83.
Benson BJ, Hadley ME. 1969. In vitro characterization of adrenergic receptors controlling skin gland secretion in two anurans Rana pipiens and Xenopus laevis.
Comp Biochem Physiol. 30: 857-864.
Berger L, Speare R, Daszak P, Green DE, Cunningham, AA, Goggin CL, Slocombe R, Ragan MA, Hyatt AD, McDonald KR. 1998. Chytridiomycosis causes amphibian mortality associated with population declines in the rain forests of Australia and Central America. Proc Natl Acad Sci. 95: 9031-9036.
Berger L, Hyatt AD, Speare R, Longcore JE. 2005. Life cycle stages of the amphibian chytrid Batrachochytrium dendrobatidis. Dis Aquat Org. 68: 51-63. Bovberg AM. 1963. Development of the glands of the dermal plicae in Rana pipiens.
J Morphol. 113: 231-243.
Cairns J, Overbaugh J, Miller S. 1988. The origin of mutants. Nature Journal. 335: 142-145. doi: 10.1038/335142a0.
Centers for Disease Control and Prevention. 2012. Epidemiology and prevention of vaccine-preventable diseases. The pink book: course textbook-12th edition (233-248). Atlanta.
Che J, Chen HM, Yang JX, Jin JQ, Jiang K, Yuan ZY, Murphy RW, Zhang YP. 2011. Unversal COI primers for DNA barcoding amphibians. Molecular Ecology Recources. doi: 10.1111/j.1755-0998.2011.03090.x
Cobo F, Teresa M, Isabel M. 2012. Streptococcus pneumoniae bacteremia: clinical and microbiological epidemiology in a health area of Southern Spain. Infectious Diasease Report. doi: 10.4081/idr.2012.e29.
Collins JP. 2010. Amphibian decline and extinction: what we know and what we need to learn. Dis Aquat Org. 92: 93-99.
Conlon JM, Sonnevend A. 2011. Clinical application of amphibian antimicrobial peptides. J Med Sci. 4(2): 62-72.
Dockray G, Hopkins CR. 1975. Caerulein secretion by dermal glands in Xenopus laevis. J Cell Biol. 64: 724-733.
Dorr T, Lewis K, Vulic M. 2009. SOS response induces persistance to fluoroquinolones in Escherichia coli. PloS Genetics. 5(12). doi: 10.1371/journal.pgen.1000760.