EMBRIOGENESIS SOMATIK TIDAK LANGSUNG JERUK
KEPROK BATU 55 (Citrus reticulata L) HASIL PERLAKUAN
KOLKISIN
MOHAMAD PRAYOGI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Dengan ini saya menyatakan bahwa skripsi berjudul Embriogenesis Somatik Tidak Langsung Jeruk Keprok Batu 55 (Citrus reticulata L) Hasil Perlakuan Kolkisin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya saya ini kepada Institut Pertanian Bogor.
Bogor, Desember 2014
Mohamad Prayogi
Batu 55 (Citrus reticulata L) Hasil Perlakuan Kolkisin. Dibimbing oleh AGUS PURWITO dan MIA KOSMIATIN.
Penelitian ini bertujuan untuk mendapatkan metode regenerasi melalui embriogenesis somatik kalus jeruk keprok batu 55 hasil poliploidisasi dengan kolkisin. Penelitian ini terdiri dari kegiatan: proliferasi kalus, pendewasaan embrio somatik, perkecambahan embrio somatik, pemanjangan akar dan tunas. Konsentrasi pemadat phytagel terbaik untuk proliferasi kalus adalah 2.5 g/l dengan media dasar MS modifikasi dengan pertambahan Vitamin MW, dan 500 mg/l ekstrak malt. Pendewasaan embrio somatik dengan konsentrasi ABA 0.5 mg/l pada media dasar MS modifikasi dengan pertambahan, vitamin MW, 100 mg/l ekstrak malt merupakan media terbaik untuk menghasilkan ES dewasa (kotiledon). Media MS dengan penambahan vitamin MS + 2.5 mg/l GA3 + 500 mg/l ekstrak malt
merupakan media terbaik untuk pembentukan planlet dengan persentase perkecambahan ES 43%. Pemanjangan akar dan tunas dapat menggunakan media MS dengan penambahan vitamin MS + IBA 0.5 mg/l + 500 mg/l ekstrak malt untuk mendapatkan hasil yang terbaik.
Kata kunci: ekstrak malt, protein, vitamin , zat pengatur tumbuh
ABSTRACT
MOHAMAD PRAYOGI. Indirect Somatic Embryogenesis of Mandarin Citrus Var Batu 55 (Citrus reticulata L) Derived from Colchicine Treatment. Supervised by AGUS PURWITO and MIA KOSMIATIN.
This study was aimed to find the best method of regeneration through somatic embryogenesis Mandarin var Batu 55 best as results of in vitro poliploidization by colchicine. This study consists of: the proliferation of callus, maturation of somatic embryo, germination of somatic embryos, elongation of roots and shoots. The best concentration of phytagel for callus proliferation was 2.5 g/l with MS modified Vitamin MW, and 500 mg/l of malt extract. Maturation of somatic embryos with ABA concentration of 0.5 mg/l on MS basic medium, vitamins MW, 100 mg/l malt extract was the best medium to produce cotyledons. MS modified by the addition of vitamin MS + 2.5 mg/l GA3 + 500 mg/l malt extract
was the best medium for the formation of plantlets with a percentage of 43%. Elongation of roots and shoots can use MS medium with vitamins MS + IBA 0.5 mg/l + 500 mg/l malt extract to get the best results.
EMBRIOGENESIS SOMATIK TIDAK LANGSUNG JERUK
KEPROK BATU 55 (Citrus reticulata L) HASIL PERLAKUAN
KOLKISIN
MOHAMAD PRAYOGI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
NIM : A24100120
Disetujui oleh,
Dr Ir Agus Purwito, MSc. Agr Dr Mia Kosmiatin, SSi MSi
Dosen Pembimbing I Dosen Pembimbing II
Diketahui oleh
Dr Ir Agus Purwito, MSc. Agr Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga laporan penelitian ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2014 hingga September 2014 ini adalah bioteknologi, dengan judul Embriogenesis Somatik Tidak Langsung Jeruk Keprok Batu 55 (Citrus reticulata
L) Hasil Perlakuan Kolkisin.
Penulis menyampaikan terima kasih kepada Dr Ir Agus Purwito, MSc. Agr dan Dr Mia Kosmiatin, SSi MSi selaku dosen pembimbing skripsi, Prof Dr Ir Slamet S, MSc selaku dosen pembimbing akademik, yang telah membantu penulis dalam menyelesaikan penelitian ini. Selain itu, ungkapan terima kasih juga disampaikan kepada kediua orang tua, teman-teman, yang telah membantu dalam memberi dukungan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2014
DAFTAR ISI
DAFTAR TABEL ii
DAFTAR GAMBAR ii
DAFTAR LAMPIRAN ii
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
Hipotesis 2
TINJAUAN PUSTAKA 2
Jeruk Keprok Batu 55 (Citrus reticulata L) 2
Kultur Jaringan 3
Media Kultur Jaringan 3
Poliploid 4
Kolkisin 5
Embriogenesis Somatik 5
METODE PENELITIAN 6
Lokasi dan Waktu Percobaan 6
Bahan Penelitian 6
Peralatan Penelitian 6
Prosedur Percobaan 6
Rancangan Percobaan 8
Prosedur Analisis Data 8
HASIL DAN PEMBAHASAN 9
Proliferasi Kalus Embriogenik 9
Pendewasaan Embrio Somatik 11
Perkecambahan Embrio Somatik 15
Pemanjangan Akar dan Tunas 20
SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 24
LAMPIRAN 28
ii
DAFTAR TABEL
1 Jumlah ES fase globular jeruk keprok hasil poliploidisasi pada media proliferasi kalus embriogenik, sampai minggu ke-7 setelah pengkulturan
9
2 Rata-rata jumlah embrio somatik yang membentuk fase jantung sampai minggu ke-9 setelah pengkulturan pada media pendewasaan dengan penambahan ABA
11
3 Pengaruh ZPT terhadap pertambahan tinggi tunas dan pertambahan panjang akar pada 4 MST
20
DAFTAR GAMBAR
1 (a) Globular pada kalus, (b) Perlakuan Phytagel 2.5 g/l, (c) Perlakuan Phytagel
3 g/l, (d) Perlakuan Phytagel 3.5 g/l, (e) Perlakuan Phytagel 4 g/
10
2 Grafik rata-rata jumlah embrio somatik pada fase torpedo sampai minggu ke-9 setelah pengkulturan pada media pendewasaan dengan penambahan ABA
12
3 Grafik rata-rata jumlah embrio somatik pada fase kotiledon sampai minggu ke-9 setelah pengkulturan pada media pendewasaan dengan penambahan ABA
12
4 Jumlah embrio somatik pada media pendewasaan dengan penambahan ABA, 9 minggu setelah pengkulturan
14
5 (a) ES Fase Jantung, (b) ES Fase Terpedo, (c) ES Fase Kotiledon, (d) Kotiledon abnormal
16
6 Persentase perkecambahan ES pada media perkecambahan dengan penambahan vitamin yang berbeda
16
7 Persentase planlet yang terbentuk setiap minggu pada media perkecambahan dengan penambahan vitamin yang berbeda.
17
8 Persentase kotiledon yang berkecambah, kecambah abnormal dan kecambah normal pada media perkecambahan dengan penambahan vitamin yang berbeda
18
9 (a) Kondisi akar pada perlakuan vitamin MS, (b) Kondisi akar pada perlakuan vitamin MW, (c) Perkecambahan pada perlakuan vitamin MS, (d) Planlet yang mulai muncul pada perlakuan vitamin MS, (e) Perkecambahan pada perlakuan vitamin MW, (f) Planlet yang mulai muncul pada perlakuan vitamin MW.
19
10 (a) Planlet pada media perlakuan vitamin MS di minggu kesepuluh, (b) Planlet
pada media perlakuan vitamin MW di minggu ke-10
20
11 Pengaruh vitamin dan ZPT terhadap pertambahan tinggi tunas pada 4 MST` 21 12 Pengaruh vitamin dan ZPT terhadap pertambahan panjang akar pada 4 MST 22 13 Kondisi planlet di perlakuan vitamin MS dengan ZPT; (a) NAA, (b) IAA, (c)
IBA di perlakuan vitamin MW dengan ZPT; (d) NAA, (e) IAA, (f) IBA pada 4 MST pada 4 MST.
23
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Tanaman jeruk (Citrus.sp) berasal dari China, sedangkan jeruk yang ada di Indonesia diintroduksi oleh peneliti Belanda yang mendatangkan jeruk manis dan keprok dari Amerika dan Italia (Prihatman 2000). Sekitar 70-80% jeruk yang dikembangkan di Indonesia adalah jeruk siam, dan sisanya adalah jeruk keprok unggulan daerah dan jeruk lainnya (Suyamto et al. 2005) dengan produksi total jeruk mencapai 1 411 229 ton pada tahun 2013 (BPS 2014). Jeruk siam memiliki bentuk yang lebih kecil, biji yang lebih banyak, kulit buah yang tidak menarik bila dibandingkan dengan jeruk keprok.
Jeruk impor di Indonesia hanya menguasai pasar domestik dengan jumlah total 240 000 ton pada tahun 2013-2014 (BPS 2014). Apabila jumlah total produksi jeruk di Indonesia dibandingkan dengan jeruk impor, jeruk impor hanya sebesar 17% dari total jeruk yang diproduksi. Namun impor buah jeruk tetap dilakukan karena kualitas yang lebih unggul dibandingkan jeruk lokal sehingga permintaan jeruk impor tinggi. Salah satu jeruk yang diimpor adalah jeruk keprok mandarin. Jeruk keprok mandarin merupakan jeruk yang banyak diminati masyarakat karena memiliki penampilan yang menarik, rasa yang manis, kulit yang mudah terkelupas (Merigo 2011).
Impor jeruk keprok yang mendominasi pasar modern di Indonesia mengharuskan jeruk keprok lokal ditingkatkan kualitasnya sehingga mampu bersaing dengan produk impor dan dapat diterima pada pasar internasional. Salah satu inovasi untuk meningkatkan kualitas jeruk yang dapat dilakukan adalah membuat tanaman jeruk lokal tipe baru yaitu jeruk tanpa biji (seedless) dengan warna yang menarik (pigmented). Buah yang tidak membentuk biji, dapat meningkatkan produktivitas, mutu buah, dan daya saing di pasar global (Khan 2008).
Buah jeruk tanpa biji dapat dirakit dengan beberapa cara dan diantaranya adalah teknik pemuliaan (konvensional), non konvensional, dan gabungan dari kedua teknik tersebut (Martasari 2008). Teknik konvensional relatif murah dan mudah bila dibandingkan dengan non konvensional, namun waktu yang dibutuhkan pada teknik non konvensional lebih singkat dibandingkan dengan konvensional sehingga akan lebih cepat mengetahui hasil akhir dari perakitan jeruk tanpa biji pada teknik non konvensional. Teknik non konvensional yang dapat dilakukan adalah fusi protoplas, mutasi dengan radiasi, kultur endosperm, dan poliploidisasi.
Hasil poliploidisasi (penggadaan kromosom) in vitro yang diregenerasikan melalui embriogenesis somatik dapat menghasilkan tanaman dengan jumlah kromosom yang diharapkan tetraploid (4n). Teknik poliploidisasi berbeda dengan teknik non konvensional lainnya karena untuk menghasilkan jeruk tanpa biji, hasil dari teknik poliploidisasi berupa tanaman jeruk (tetraploid) dijadikan sebagai tanaman induk untuk persilangan dengan tanaman jeruk lainnya (diploid) sehingga dapat menghasilkan buah jeruk tanpa biji (triploid). Teknik poliploidisasi in vitro
2
(Husni 2007). Embriogenesis somatik adalah sistem regenerasi sel in vitro yang memungkinkan untuk meregenerasikan 1 sel menjadi tanaman lengkap (Kosmiatin
et al. 2014). Sehingga sel yang sudah berubah, dalam hal ini poliploid, akan beregenerasi menjadi tanaman poliploid juga.
Metode regenerasi dan mikropropagasi tanaman jeruk telah banyak dilakukan untuk mendapatkan tanaman seedless, (Ali dan Mirza 2006). Metode regenerasi tanaman melalui somatic embryogenesis (ES) dengan keberhasilan yang tinggi dapat membantu dalam mendapatkan varietas atau genotipe unggul melalui pemuliaan non konvensional. Embriogenesis somatik memiliki beberapa tahapan dan faktor penting yang mempengaruhinya seperti, tahap proliferasi yang dapat dipengaruhi oleh konsentrasi pemadat, tahap pendewasaan yang dapat dipengaruhi dari konsentasi ABA, tahap perkecambahaan yang dapat dipengaruhi oleh penggunaan konsentrasi GA3 dan formulasi vitamin, serta tahap pemanjangan akar
dan tunas yang dapat dipengaruhi oleh konsentrasi auksin seperti IAA, NAA, IBA.
Tujuan
Penelitian ini bertujuan untuk mendapatkan metode regenerasi melalui embriogenesis somatik (proliferasi kalus embriogenik, pendewasaan embrio somatik, perkecambahan embrio somatik, pemanjangan akar dan tunas) terbaik jeruk keprok batu 55 hasil perlakuan kolkisin.
Hipotesis
1. Terdapat konsentrasi pemadat (phytagel) yang tepat untuk memperbanyak embrio somatik fase globular pada proliferasi kalus embriogenik.
2. Terdapat konsentrasi ABA terbaik pada formulasi media untuk mendewasakan embrio somatik sehingga mendapat ES fase kotiledon yang banyak.
3. Terdapat komposisi vitamin yang tepat dalam media perkecambahan sehingga persentasi pembentukan planlet dapat terjadi dengan optimal.
4. Terdapat minimal satu jenis ZPT yang tepat untuk pemanjangan akar dan tunas.
TINJAUAN PUSTAKA
Jeruk Keprok Batu 55 (Citrus reticulata L)
varietas-varietas komersial seperti Batu 55, Garut, SoE, dan Konde. Perbaikan sifat melalui kultur jaringan telah lama dikembangkan dan terbukti memberikan hasil yang baik (Husni 2010).
Jeruk keprok batu 55 merupakan jeruk yang banyak disukai karena sifat unggul yang secara alami telah dimiliki seperti aroma dan rasa yang khas yang tidak terdapat pada jeruk umumnya. Jeruk keprok batu 55 memiliki penampilan yang menarik dengan warna kulit jingga dan warna daging buah kemerahan serta rasa yang manis. Selain penampilan yang menarik jeruk keprok batu 55 memiliki manfaat lain dari kulitnya yang mengandung beberapa senyawa metabolit sekunder (Copriady et al. 2005). Senyawa pada kulit jeruk keprok ini memiliki aktivitas antikanker seperti tangeritin dan nobelitin. Tangeritin merupakan senyawa
methoxyflavone yang mempunya potensi sebagai gen antikanker (Ardiani et al.
2008).
Kultur Jaringan
Kultur jaringan merupakan teknik menumbuh dan mengembangkan bagian tanaman baik berupa sel, jaringan atau organ dalam kondisi aseptik secara in vitro
(Yusnita 2003). Perbanyakan melalui kultur in vitro dapat dilakukan melalui 3 cara, yaitu pembentukan tunas adventif, proliferasi tunas lateral, dan embriogenesis somatik. Perbanyakan dengan teknik kultur in vitro jauh lebih tinggi dari cara konvensional (Mariska dan Sukmadjaja 2003). Karena teknologi ini lebih menjamin keseragaman, bebas penyakit, dan biaya pengangkutan yang lebih murah.
Kultur jaringan pada tanaman jeruk merupakan cara untuk mendapatkan tanaman atau bibit dalam jumlah banyak dengan waktu yang singkat, tanaman yang bebas penyakit, pemeliharaan plasma nutfah yang bebas penyakit (Alkhyari dan Albahrany 2001). Keberhasilan teknik kultur jaringan pada tanaman jeruk sangat dipengaruhi oleh faktor-faktor seperti kondisi bahan tanaman (eksplan), media tumbuh, zat pengatur tumbuh (ZPT), dan asam amino (Carimi 2005). Menurut Yuwono (2008) Perbaikan sifat jeruk melalui kultur jaringan dapat dilakukan dengan berbagai cara seperti teknik embriogenesis somatik, induksi mutasi, fusi protoplas, variasi somaklonal, dan seleksi in vitro.
Media Kultur Jaringan
4
perbanyakan tanaman melalui kultur jaringan. Media kultur secara fisik dapat berbentuk cair atau padat (Yusnita 2003). Penambahan ZPT pada media kultur merupakan salah satu kunci keberhasilan baik pada tahap induksi maupun elongasi tunas.
Zat pengatur tumbuh merupakan faktor yang menentukan arah pertumbuhan dan perkembangan eksplan. Zat pengatur tumbuh memainkan peranan yang sangat penting terhadap pertumbuhan dan perkembangan, pembelahan, pembesaran dan diferensiasi sel (Zulkarnain 2009). Tanpa ZPT pertumbuhan dan perkembangan tanaman dapat terganggu sebab untuk pembelahan sel dan pembesaran volume sel suatu jaringan memerlukan ZPT tertentu terutama dari golongan auksin dan sitokinin (Wattimena 1998). Interaksi dan perimbangan antara ZPT yang diberikan dalam media dan yang diproduksi secara endogen menentukan arah perkembangan suatu kultur. Pemberian auksin yang lebih tinggi dari sitokinin akan menyebabkan diferensiasi mengarah kepada pertumbuhan akar, sebaliknya jika sitokinin lebih tinggi dari auksin, diferensiaisi akan mengarah kepada pertumbuhan tunas (Santoso dan Nursandi 2001). Zat Pengatur tumbuh merupakan senyawa organik bukan nutrisi yang dalam konsentrasi rendah dapat bersifat mendorong, menghambat atau secara kualitatif mengubah pertumbuhan dan perkembangan tanaman (Watimena 1992). Zat pengatur tumbuh dapat menstimulasi pembelahan dan perkembangan sel, terkadang jaringan atau eksplan dapat memproduksi ZPT sendiri (endogen). Penggunaan konsentrasi ZPT yang tepat dapat menghasilkan perkembangan sel ke arah yang dikehendaki. Auksin (NAA, IBA, IAA, 2,4D) biasa digunakan untuk menginduksi pembentukan kalus, kultur suspensi, dan akar, dengan memacu pemanjangan dan pembelahan sel di dalam jaringan kambium (Pierik 1987), Sitokinin (BA, Kinetin, Zeatin) digunakan untuk pembentukan tunas, Zat penghambat seperti ABA berfungsi sebagai penghambat pembelahan sel pada embrio sehingga pendewasaan sel terjadi dengan perkecambahan yang terhambat dan inhibitor tanaman. Giberelin (GA) untuk pembentukan tunas bersama-sama dengan auksin (Lestari 2011).
Poliploid
Poliploid merupakan kondisi susunan kromosom yang menjadi lebih dari dua set kromosom. Sel-sel pada tanaman poliploidi menjadi lebih besar sehingga ukuran tanaman poliploidi biasanya lebih besar dari tanaman normal pada umumnya. Hal ini dapat meningkatkan nilai produktivitas dibandingkan tanaman yang tidak mengalami poliploidi. Tanaman poliploidi juga lebih subur dan memiliki pertumbuhan yang cepat (Griffith 2000).
Poliplodisasi banyak digunakan untuk meningkatkan produktivitas pada tanaman seperti Solanum, Citrus, Scutelia baicalansis, Alocasia, Allium cepa, dan
Azalia. Poliploidisasi dilakukan dengan berbagai alasan seperti, menghasilkan tanaman tanpa biji, meningkatkan senyawa metabolit sekunder, mendapatkan varietas baru dan meningkatkan plasma nutfah untuk memenuhi kebutuhan pangan (Madon et al. 2006).
yang terbentuk dari proses mitosis. Sel-sel yang mengalami penggandaan kromosom, fase S tidak akan terlewati pada siklus sel dan gamet diploid akan terbentuk (Segraves et al. 1999). Poliploidisasi dapat dilakukan dalam laboratorium dengan menginduksi sel yang akan membelah dengan berbagai zat kimia salah satunya kolkisin.
Kolkisin
Kolkisin adalah senyawa alkaloid yang berasal dari tanaman Colchicum autumnale Linn yang memiliki sifat sangat toksik (Eigisti dan Dustin 1995). Larutan kolkisin yang mengganggu depolimerisasi protein mikrotubulus, mencegah terbentuknya benang-benang spindel sehingga pemisahan kromosom pada anaphase tidak terjadi, akibatnya terjadi penggandaan kromosom tanpa pembentukan dinding sel (Griffith 2000).
Larutan kolkisin dapat mengakibatkan penundaan pertumbuhan akibat jaringan yang rusak dan memerlukan waktu yang lama untuk tumbuh. Konsentrasi kolkisin yang tidak sesuai akan memberikan pengaruh berbeda pada pertumbuhan tanaman seperti jumlah daun, berat basah tunas, berat basah akar, berat kering tunas, dan berat kering akar. Rendahnya kalus yang beregenerasi pada perlakuan kolkisin diduga karena pemberian kolkisin dengan konsentrasi yang tinggi pada awal perlakukan dan mengakibatkan kerusakan fisiologis pada tanaman (Mariska 1996) sehingga konsentrasi yang tepat diperlukan untuk regenerasi yang baik.
Embriogenesis Somatik
Embriogenesis somatik merupakan proses berkembangnya sel-sel somatik (haploid maupun diploid), berkembang membentuk tumbuhan baru melalui tahapan perkembangan embrio yang spesifik tanpa melalui fusi gamet. Tahapannya terdiri dari pembentukan kalus embrionik, pendewasaan, dan tahap pengecambahan (Yuwono 2008). Pierik (1987) menyatakan bahwa embrio somatik dapat terjadi secara langsung dan tidak langsung. Secara langsung terjadi dengan terbentuknya embrio tanpa melalui proses pembentukan kalus sedangkan untuk yang tidak langsung terjadi karena pembentukan embrio melalui proses pembentukan kalus. Faktor yang mempengaruhi keberhasilan embriogenesis somatik adalah jenis eksplan, sumber nitrogen, dan gula serta ZPT (Purnamaningsih 2002)
Teknik embriogenesis somatik pada tanaman jeruk telah banyak diteliti untuk mendapatkan tanaman yang seragam dan bebas virus serta sebagai bahan untuk perbaikan sifat genetik. Sawy et al. (2006) menyatakan bahwa bibit jeruk yang bebas penyakit terutama virus penting didapatkan sehingga embrio somatik pada jeruk terus berkembang. Konsep regenerasi tanaman melalui embrio somatik pada tanaman jeruk tidak berbeda dengan tanaman dikotil lainnya. Namun keberhasilan regenerasi embrio somatik dipengaruhi oleh beberapa faktor, seperti: eksplan, zat pengatur tumbuh, media tanam dan lingkungan pengkulturan (Yujin dan Xiuyin 2002).
6
penambahan ABA, tetapi jumlahnya menurun bila ABA yang ditambahkan lebih dari 0.5 mg/l (Kosmiatin et al. 2014).
METODE PENELITIAN
Lokasi dan Waktu Percobaan
Percobaan dilaksanakan di Laboratorium In vitro Kelompok Peneliti Biologi Sel dan Jaringan BB - BIOGEN, Bogor. Percobaan ini dilaksanakan pada bulan Maret 2014 sampai dengan bulan September 2014.
Bahan Penelitian
Bahan yang digunakan sebagai bahan penelitian adalah kalus Jeruk Keprok Batu 55 (Citrus reticulata L) hasil poliplodisasi dengan kolkisin berkonsentrasi 0.2 ml. Media dasar yang digunakan adalah Murashige danSkoog dengan kombinasi ZPT (ABA, GA, IAA, NAA, dan IBA) dan ekstrak Malt. Vitamin yang digunakan meliputi vitamin MS, dan MW (Morel dan Weitmore).
Peralatan Penelitian
Alat yang digunakan saat di laboratorium adalah peralatan gelas (botol kultur, botol ukur, gelas piala, cawan petri, gelas ukur, dan corong gelas), autoclaf,
laminar airflow cabinet, dan peralatan-peralatan seperti pinset, gunting, dan
sclapel, lampu spiritus, rak kultur, botol sprayer, plastik, dan karet gelang.
Prosedur Percobaan
Botol dan alat tanam yang akan digunakan, dicuci bersih dengan menggunakan air bersih dan detergen, kemudian disterilkan dalam oven pada temperatur 150°C selama 3 jam. Alat tanam yang disterilkan sebelum penanaman adalah pinset, scalpel, pisau tanam, dan cawan petri.
Semua media disterilkan dalam autoclaf pada suhu 121°C dengan tekanan 0.15 MPA selama 15 menit. Media yang telah dibuat disimpan didalam ruang kultur.
Penelitian ini dilakukan dalam empat tahapan kegiatan yaitu proliferasi kalus embriogenik, pendewasaan embrio somatik, perkecambahan embrio somatik dan pemanjangan akar dan tunas.
Proliferasi Kalus Embriogenik
Tahap proliferasi kalus bertujuan untuk memperbanyak embrio somatik (ES) fase globular. Eksplan yang digunakan pada percobaan ini merupakan kalus yang didapatkan dari hasil penelitian sebelumnya (Yulianti 2014). Kalus ini disubkultur pada media perlakuan proliferasi kalus. Tahap proliferasi kalus menggunakan media dasar MS modifikasi dengan penambahan Vitamin MW + Ekstrak Malt 500 mg/l dan perlakuan konsentrasi pemadat (phytagel) 2.5 g/l, 3 g/l, 3.5 g/l, 4 g/l. Setiap perlakuan diulang sebanyak 5 kali sehingga terdapat 20 satuan percobaan. Setiap ulangan terdiri dari satu botol kultur yang berisikan 3 clump yang berdiameter 1-2 cm. Pengamatan pada tahap ini dilakukan setiap minggu dan yang diamati adalah jumlah ES fase globular pada kalus. Rancangan yang digunakan pada percobaan ini adalah rancangan acak lengkap (RAL) faktorial dengan 1 faktor.
Pendewasaan Embrio Somatik
Pendewasaan yang bertujuan untuk mendapatkan populasi embrio dewasa (fase kotiledon). Pada tahap ini media dasar yang digunakan adalah MS + Vitamin MW + Ekstrak Malt 100 mg/l dengan perlakuan konsentrasi ZPT ABA sebesar 0, 0.1, 0.3, dan 0.5 mg/l. Eksplan yang digunakan pada tahap ini adalah ES fase globular hasil dari percobaan proliferasi kalus. Setiap perlakuan ZPT diulang sebanyak 6 kali sehingga terdapat 24 satuan percobaan. Setiap ulangan terdiri dari 1 botol dengan 5 eksplan. Pengamatan pada tahap ini dilakukan setiap minggu dan yang diamati adalah jumlah fase jantung, torpedo, dan kotiledon yang terbentuk. Rancangan yang digunakan pada percobaan ini adalah rancangan acak lengkap (RAL) faktorial dengan 1 faktor.
Perkecambahan Embrio Somatik
Perkecambahan bertujuan untuk menghasilkan planlet yaitu ES yang berkecambah sehingga memiliki akar dan tunas. Pada tahap ini digunakan media dasar MS + Ekstrak malt 500 mg/l GA3 2.5 ml/l dengan formulasi perlakuan
vitamin MS dan vitamin MW. Eksplan yang digunakan pada tahap ini adalah ES dewasa (kotiledon) hasil dari percobaan pendewasaan embrio somatik. Setiap perlakuan vitamin diulang sebanyak 16 kali sehingga terdapat 32 satuan percobaan. Setiap ulangan terdiri dari 1 botol dengan 4 eksplan. Pengamatan pada tahap ini dilakukan setiap minggu dan yang diamati adalah persentase perkecambahan dan pembentukan planlet. Rancangan yang digunakan pada percobaan ini adalah rancangan acak lengkap (RAL) faktorial dengan 1 faktor.
Pemanjangan Akar dan Tunas
8
yang digunakan pada tahap ini adalah planlet yang terbentuk dari percobaan perkecambahan ES. Setiap kombinasi media diulang sebanyak 5 kali sehingga terdapat 30 satuan percobaan. Setiap ulangan terdiri dari 1 botol dengan 1 planlet. Pengamatan pada tahap ini dilakukan setiap minggu dan yang diamati adalah pertumbuhan dari akar dan tunas di minggu keempat. Rancangan yang digunakan pada percobaan ini adalah rancangan acak lengkap (RAL) faktorial dengan 2 faktor.
Rancangan Percobaan
Rancangan yang digunakan pada percobaan proliferasi kalus, pendewasaan embrio somatik, perkecambahan embrio somatik adalah rancangan acak lengkap (RAL) faktorial satu faktor dengan konsentrasi pemadat (phytagel), ABA, dan formulasi vitamin sebagai faktor.
Model rancangan yang digunakan :
Yik = μ + αi + εik
Yik = respon pengaruh konsentrasi pemadat (phytagel), ABA, formulasi vitamin ke-i pada ulangan ke-k
μ = rataan umum
αi = pengaruh perlakuan konsentrasi pemadat (phytagel), ABA, formulasi vitamin klon ke-i
εik = galat pada perlakuan konsentrasi pemadat (phytagel), ABA, fomulasi vitamin ke-i pada ulangan ke-k.
i = 1,2,3,4
k = 1,2,3,4,5
Rancangan yang digunakan dalam percobaan pemanjangan akar dan tunas adalah rancangan acak lengkap (RAL) faktorial dua faktor yaitu vitamin dengan dua taraf yaitu MS dan MW dan jenis ZPT dengan tiga taraf yaitu IAA, NAA, IBA. Model rancangan yang digunakan :
Yijk = μ + αi +βj + (αβ)ij +εijk
Yijk = respon pengaruh tipe vitamin ke-i, jenis ZPT ke-j, dan ulangan ke-k
μ = rataan umum
αi = pengaruh tipe vitamin ke-i
βj = pengaruh jenis ZPT ke-j
εik = galat pada tipe vitamin ke-i, jenis ZPT ke-j, dan ulangan ke-k.
i = 1,2
k = 1,2,3
k = 1,2,3,4,5
Prosedur Analisis Data
HASIL DAN PEMBAHASAN
Proliferasi Kalus Embriogenik
Proliferasi kalus embriogenik merupakan salah satu tahap embriogenesis somatik yang bertujuan untuk memperbanyak ES fase globular. Jumlah ES fase globular yang terbentuk pada kalus merupakan salah satu indikasi kapabilitas atau kemampuan regenerasi pada kalus. Tingkat kepadatan media regenerasi dengan cekaman air dapat mempengaruhi frekuensi regenerasi (Jian et al. 1996). Pada percobaan ini kalus diproliferasi pada media dasar MS + Vitamin MW + 500 mg/l ekstrak malt dengan penambahan bahan pemadat phytagel berkonsentrasi 2.5 g/l, 3 g/l, 3.5 g/l, dan 4 g/l. Phytagel dengan konsenstrasi 2.5 g/l merupakan konsentrasi yang sering digunakan, karena bila konsentrasinya dibawah 2.5 g/l dikhawatirkan media tidak memiliki kepadatan yang baik sehingga mudah hancur.
Tabel 1 Jumlah ES fase globular jeruk keprok hasil poliploidisasi pada media proliferasi kalus embriogenik, sampai minggu ke 7 setelah pengkulturan.
Perlakuan
phytagel
(gr/l)
Minggu ke-
1 3 5 7
2.5 17.6 a 16.0 16.6 18.8a
3.0 8.0 b 11.6 14.6 7.8 b
3.5 13.6 ab 11.0 12.0 10.4b
4.0 9.8 b 12.6 12.8 10.8b
Uji F * tn tn *
aAngka pada kolom yang sama, diikuti oleh huruf yang berbeda menunjukkan berbeda nyata pada taraf uji
5% (uji DMRT) dengan menggunakan transformasi data √� + 0.5.
Analisis data dilakukan pada minggu 1, 3 , 5, dan 7. Sebelum dilakukannya analisis data dengan uji F, data ditransformasi terlebih dahulu untuk mengurangi koefisien keragaman dan menormalkan data. Tabel 1 menunjukkan bahwa perlakuan konsentrasi pemadat phytagel mempengaruhi jumlah ES fase globular yang dihasilkan. Jumlah globular yang dihasilkan perlakuan pemadat phytagel
dengan konsentrasi 2.5 g/l berbeda nyata dengan konsentrasi 3 g/l, 3.5 g/l, dan 4 g/l pada minggu pertama dan ketujuh. Uji F pada Tabel 1 menunjukkan bahwa minggu ketiga dan kelima antar konsentrasi perlakuan phytagel tidak ada perbedaan jumlah globular. Meski demikian, bila melihat jumlah globular yang dihasilkan antar perlakuan pada minggu ketiga dan kelima, pemadat phytagel 2.5 g/l memiliki hasil yang terbaik. Tabel 1 menunjukan bahwa perlakuan phytagel dengan konsentrasi 2.5 g/l memiliki jumlah globular terbanyak di setiap minggunya. ES globular juga dapat berkembang setiap minggunya membentuk ES dewasa (jantung, torpedo, kotiledon). Terutama pada media dengan konsentrasi phytagel yang lebih tinggi.
10
perlakuan konsentrasi pemadat ini juga menunjukkan adanya perkembangan ES fase globular ke ES dewasa. Hal ini ditunjukkan dengan penurunan jumlah ES pada minggu berikutnya pada kedua perlakuan tersebut. Penurunan jumlah ES fase globular menunjukkan bahwa sebagian ES mengalami pendewasaan pada peningkatan konsentrasi phytagel sebesar 1-2 g/l. Hasil secara keseluruhan menunjukkan bahwa ES fase globular paling banyak dihasilkan pada konsentrasi pemadat phytagel 2.5 g/l dibandingkan yang konsentrasi yang lain dengan jumlah globular dari 16-18.8.
Konsentrasi pemadat phytagel 2.5 g//l merupakan konsentrasi yang optimum karena diduga media memiliki kepadatan yang baik sehingga cekaman air pada media tidak tinggi (Inez et al. 1997), dan unsur-unsur hara yang dibutuhkan eksplan dapat diserap dengan baik. Pemadat phytagel dengan konsentrasi 2.5 g/l juga baik untuk mempertahankan ES pada fase globular karena memiliki ES fase globular terbanyak dan belum berkembang menjadi ES dewasa. Media dengan peningkatan konsentrasi gel pemadat akan menurunkan potensial matriks media sehingga ketersediaan air untuk diserap berkurang dan menyebabkan kandungan air dalam ES menjadi rendah, kondisi ini baik untuk pendewasaan ES (Kosmiatin et al. 2014). Media dengan peningkatan konsentrasi pemadat lebih baik digunakan untuk pendewasaan ES daripada untuk proliferasi kalus embriogenik.
Gambar 1 Kondisi eksplan pada minggu ke-7 (a) Globular pada kalus, (b) Perlakuan
Phytagel 2.5 g/l, (c) Perlakuan Phytagel 3 g/l, (d) Perlakuan Phytagel 3.5 g/l, (e) Perlakuan Phytagel 4 g/l.
Gambar 1 mempelihatkan terbentuknya globular pada kalus (a). Keragaman pembentukan globular pada media dengan konsentrasi phytagel terlihat pada Gambar 1. Kalus dengan perlakuan pemadat phytagel berkonsentrasi 2.5 g/l (Gambar 1b) terlihat lebih banyak menghasilkan globular (spot hijau) dibandingkan kalus dengan perlakuan pemadat yang lain. Kalus dengan perlakuan pemadat
phytagel berkonsentrasi 3 g/l (Gambar 1c) terlihat tidak sebaik pada pemadat
phytagel berkonsentrasi 3.5 g/l (Gambar 1d) dan 4 g/l (Gambar 1e) yang relatif sama dalam membentuk ES fase globular. Embrio somatik dewasa (jantung,
(a) (b) (c)
torpedo, kotiledon) dapat langsung terbentuk pada media yang sama yaitu pada semua perlakuan terutama pada media dengan konsentrasi pemadat lebih tinggi. Hal ini menguntungkan karena proliferasi dan pendewasaan embrio dapat berlangsung dalam satu tahap pengkulturan.
Media dasar sangat mempengaruhi pertumbuhan dan perkembangan kalus. Sehingga komposisi media dasar menjadi faktor penting dalam pertumbuhan dan perkembangan kalus. Vitamin Morel dan Weitmore (MW) adalah vitamin yang lebih lengkap komposisinya dibandingkan dengan vitamin MS, karena mengandung Ca-pantotenat dan biotin yang dapat memacu pertumbuhan jaringan (Merigo 2011). Shanty et al. (2004) dan Badawy et al. (2009) menyatakan bahwa pemberian biotin mempengaruhi perkembangan kalus embrionik.
Ekstrak malt menjadi salah satu komposisi media dasar yang digunakan dalam pertumbuhan dan perkembangan kalus, karena ekstrak malt merupakan bahan organik yang mudah diserap oleh kalus. Penambahan bahan organik (Casein Hidrolisat atau Ekstrak Malt) pada tanaman Dianthus dapat meningkatkan 1.5 kali pembentukan embrio somatik (Pareek dan Kothari 2003). Ketersediaan bahan organik yang tinggi dalam medium dapat meningkatkan akumulasi asam amino sebagai penyusun protein, sehingga akumulasi protein juga turut meningkat (Kosmiatin et al. 2014). Pembentukan protein terutama protein simpanan dalam sel dibutuhkan untuk membentuk ES (Deo et al. 2010).
Pendewasaan Embrio Somatik
Pendewasaan embrio somatik merupakan perkembangan ES fase globular sampai menjadi kotiledon. Globular berkembang menjadi fase jantung, torpedo, dan terakhir ke fase kotiledon. Pendewasaan embrio somatik merupakan tahapan penting dalam keberhasilan embriogenesis somatik (Kosmiatin et al. 2014). Pendewasaan embrio somatik pada tanaman jeruk sangat tergantung pada komposisi ZPT yang diberikan kepada eksplan (Husni 2010). Pendewasaan embrio somatik dipengaruhi beberapa faktor yang salah satunya adalah konsentrasi dari ABA (Anjaneyulu dan Giri 2008). Asam absisik (ABA) merangsang embrio menjadi dewasa dengan menghambat pembelahan sel dan mendewasakan sel (Egerstsdotter 1999).
Tabel 2 Rata-rata jumlah embrio somatik yang membentuk fase jantung sampai minggu ke-9 setelah pengkulturan pada media pendewasaan dengan penambahan ABA.
Perlakuan ABA (mg/l)
Minggu ke-
3 5 7 9
0.0 0.6b 4.5 ab 6.3 5.5
0.1 2.8a 2.8 b 6.5 5.2
0.3 3.0a 4.1 ab 8.5 6.2
0.5 2.0a 7.3 a 10.6 7.6
Uji F * * tn tn
aAngka pada kolom yang sama, diikuti oleh huruf yang berbeda menunjukkan berbeda nyata pada taraf uji
12
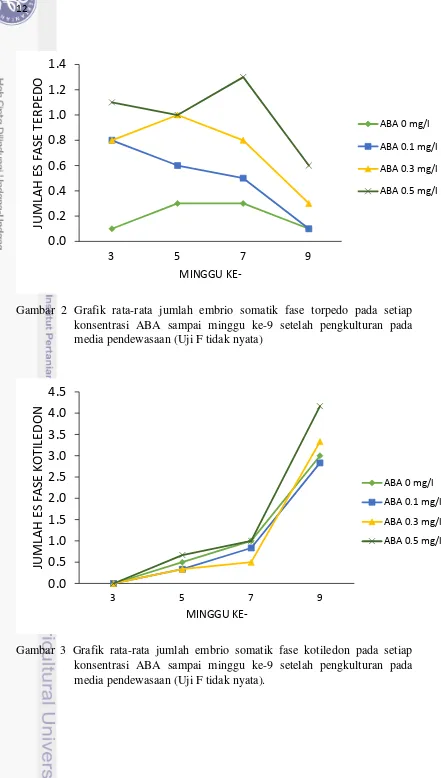
Gambar 2 Grafik rata-rata jumlah embrio somatik fase torpedo pada setiap konsentrasi ABA sampai minggu ke-9 setelah pengkulturan pada media pendewasaan (Uji F tidak nyata)
Gambar 3 Grafik rata-rata jumlah embrio somatik fase kotiledon pada setiap konsentrasi ABA sampai minggu ke-9 setelah pengkulturan pada media pendewasaan (Uji F tidak nyata).
0.0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
3 5 7 9
JU
MLAH
E
S F
AS
E
TER
P
EDO
MINGGUKE-ABA 0 mg/l
ABA 0.1 mg/l
ABA 0.3 mg/l
ABA 0.5 mg/l
0.0
0.5
1.0
1.5
2.0
2.5
3.0
3.5
4.0
4.5
3 5 7 9
JU
MLAH
E
S F
AS
E
K
O
TI
LEDO
N
MINGGUKE-ABA 0 mg/l
ABA 0.1 mg/l
ABA 0.3 mg/l
Analisis data dilakukan pada minggu 3, 5, 7, dan 9. Uji F dilakukan setelah data ditransformasi agar nilai koefisien keragam tidak melebihi 20%. Tabel 2 menunjukkan bahwa media pendewasaan embrio somatik dengan perlakuan ABA berpengaruh terhadap pembentukan ES fase jantung dibandingkan media pedewasaan tanpa perlakuan ABA pada minggu ketiga dan kelima. Minggu pertama menunjukan ketiga media pendewasaan perlakuan ABA berbeda nyata bila dibandingkan dengan media pendewasaan tanpa perlakuan ABA. Minggu kelima menunjukkan bahwa perlakuan ABA dengan konsentrasi 0.5 mg/l berbeda nyata dibandingkan dengan perlakuan konsentrasi ABA lainnya. Minggu ketujuh dan kesembilan ES fase jantung yang terbentuk tidak berbeda nyata antar perlakuan konsentrasi ABA, meski demikian perlakuan ABA berkonsentrasi 0.5 mg/l memiliki jumlah ES fase jantung terbanyak pada minggu ketujuh dan kesembilan. Media pendewasaan tanpa ABA memiliki jumlah ES fase jantung yang relatif sama dengan perlakuan ABA 0.1 mg/l pada minggu ketujuh dan kesembilan.
Tabel 2 menunjukkan bahwa penambahan 0.5 mg/l ABA memiliki hasil terbaik hampir disetiap minggunya pada ES fase jantung. Embrio somatik pada ES fase jantung yang terbentuk diduga berkembang ke fase selanjutnya pada minggu ke-9 karena terjadi penurunan jumlah ES fase jantung. Hasil terbaik jumlah embrio somatik fase jantung terlihat pada minggu ke-7 dengan rata-rata jumlah 6.3 – 10.6. Analisis data pada perlakuan media pendewasaan dengan ABA tidak berpengaruh nyata terhadap pembentukan ES fase torpedo dan ES fase kotiledon. Meski demikian Gambar 2 dan Gambar 3 menunjukkan bahwa penambahan 0.5 mg/l ABA memiliki hasil rata-rata terbaik hampir disetiap minggunya dalam membentuk ES fase torpedo dan ES fase kotiledon. Berdasarkan Gambar 2, setiap minggunya torpedo yang dihasilkan berbeda-beda dan cenderung menurun. Hal ini diduga karena ES fase torpedo berkembang menjadi ES fase selanjutnya yaitu kotiledon. Rata-rata jumlah ES fase torpedo yang terbentuk berkisar dari 0.1 – 1.3. Minggu ke-7 merupakan minggu terbaik pada rata-rata jumlah ES fase torpedo yang terbentuk dari media pendewasaan dengan perlakuan ABA berkonsentrasi 0.5 mg/l. Media pendewasaan dengan perlakuan ABA berkonsentrasi 0.3 mg/l menghasilkan ES fase torpedo terbaik pada minggu ke-5. Sedangkan perlakuan ABA berkonsentrasi 0.1 mg/l dengan media tanpa ABA terlihat menghasilkan ES fase torpedo yang sama pada minggu ke-9.
14
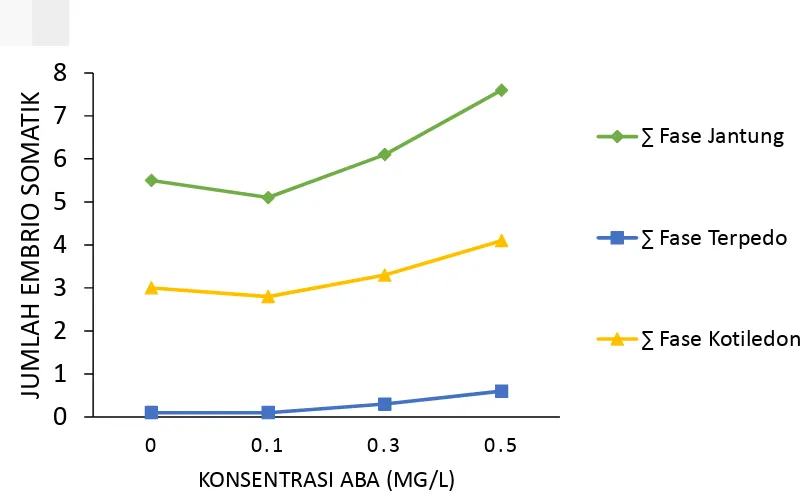
Gambar 4 Jumlah embrio somatik pada media pendewasaan dengan penambahan ABA, 9 minggu setelah pengkulturan (Uji F tidak nyata)
Pada Gambar 4 terlihat bahwa perkembangan embrio somatik membentuk fase jantung, torpedo, dan kotiledon meningkat seiring dengan penambahan konsentrasi ABA. Pemberian ABA 0.5 mg/l terlihat memiliki hasil yang terbaik dari fase jantung, fase torpedo, dan fase kotiledon. Pemberian konsentrasi 0.5 mg/l ABA pada kalus yang diinduksi dari nuselus menunjukkan adanya fase pendewasaan embrio somatik yang dimulai dari globular kemudian jantung dan kotiledon (Cardoza et al. 2002). Penambahan ABA 0.5 mg/l dalam media dapat mendewasakan embrio somatik (Husni 2010). Pada penelitian ini persentase
pendewasaan (∑ kotiledon/∑ total ES x 100%) terbaik diperoleh pada formulasi
media dengan penambahan ABA 0.5 mg/l sebesar 82%. Hal ini juga sesuai dengan pernyataan bahwa peningkatan efisiensi pendewasaan embrio somatik dapat dilakukan dengan penambahan etilen antagonis seperti ABA, spermidine, dan
AgNO3 pada konsentrasi tinggi (10 μM) (Renukdas et al. 2006)
Pemberian ABA pada embrio somatik bertujuan untuk menyeragamkan fase pendewasaan sehingga didapatkan kotiledon yang siap dikecambahkan. Pemberian ABA juga dapat menekan terjadinya pertumbuhan embrio yang prematur (Merigo 2011). Gambar 4 memperlihatkan rata-rata jumlah ES fase jantung yang berkisar dari 5.5 - 7.6, ES fase torpedo dari 0.1 – 0.6, dan ES fase kotiledon dari 3.0 – 4.1. Rata-rata jumlah ES fase torpedo terlalu sedikit dibandingkan dengan jumlah ES fase jantung, dan ES fase kotiledon. Hal ini menunjukkan bahwa ES fase jantung berkembang ke fase kotiledon pada minggu terakhir, sedangkan ES fase torpedo sudah berkembang menjadi kotiledon pada minggu sebelumnya.
0
1
2
3
4
5
6
7
8
0 0 . 1 0 . 3 0 . 5
JU
MLAH
EMBR
IO
SOMA
TI
K
KONSENTRASI ABA (MG/L)
∑ Fase Jantung
∑ Fase Terpedo
Gambar 5 (a) ES Fase Jantung, (b) ES Fase Terpedo, (c) ES Fase Kotiledon, (d) Kotiledon abnormal pada minggu ke-9.
Gambar 5 menunjukan bentuk dari ES fase jantung, ES fase torpedo, dan ES fase kotiledon yang dihasilkan melalui proses pendewasaan embrio somatik. Embrio somatik fase jantung (Gambar a) merupakan struktur awal dari pembentukan kotiledon dimana fase ini memiliki struktur awal bipolar, yang akan berkembang menjadi fase terpedo (Gambar b). Saat ES fase torpedo terbentuk, sel akan mengarahkan pertumbuhannya kearah bawah dan membentuk meristem akar yang ditandai dengan terbentuknya struktur akar. Pematangan embrio akan berakhir pada bentuk kotiledon sempurna dimana meristem akar dan meristem tunas mulai terbentuk (Gambar c). Beberapa ES fase kotiledon berukuran abnormal dan membentuk lebih dari 2 kotiledon (Gambar d).
Pada perlakuan ABA 0.5 mg/l pada minggu ke-9 didapatkan kotiledon-kotiledon yang banyak, namun morfologinya abnormal karena memiliki ukuran yang lebih besar dari kotiledon normal (Gambar d). Morfologi abnormal ini diduga karena adanya akumulasi protein simpanan yang berlebih pada aktivitas biotin yang terdapat pada formulasi vitamin MW serta ekstrak malt sebagai bahan organik yang mudah diserap oleh tanaman (Dodeman et al. 1997). Akumulasi protein simpanan yang berlebih akan menghambat akumulasi protein LEA (Late Embryogenesis Abundant) yang berperan dalam pendewasaan embrio somatik sehingga embrio somatik menjadi abnormal.
Perkecambahan Embrio Somatik
Perkecambahan merupakan fase setelah fase pendewasaan dan sangat dipengaruhi oleh beberapa faktor seperti faktor lingkungan (suhu dan cahaya) serta komposisi ZPT yang terdapat pada media perkecambahan (Merigo 2011). Zat pengatur tumbuh diperlukan pada tanaman karena merupakan senyawa organik yang mampu mendorong, mengatur, dan menghambat fase fisiologis tanaman
(a) (b)
[image:31.595.112.512.96.516.2]16
sehingga pertumbuhan tanaman dapat dikendalikan. Menurut Davies (2004) salah satu ZPT yang berperan dalam proses perkecambahan embrio somatik adalah GA3.
Vitamin memiliki fungsi yaitu untuk membantu pertumbuhan dan perkembangan eksplan. Formulasi vitamin MS pada umumnya digunakan untuk perkecambahan induk, sedangan formulasi vitamin MW biasa digunakan untuk menyeragamkan pertumbuhan dari eksplan.
Hasil analisis data dilakukan pada persentase perkecambahan embrio yang sempurna (akar dan tunas) di minggu ke- 2, 4, 6, 8, dan 10. Perlakuan jenis vitamin hanya memberikan pengaruh terhadap pembentukan planlet pada minggu kedelapan. Perlakuan vitamin MS merupakan vitamin yang mampu menghasilkan planlet lebih baik dibandingkan dengan perlakuan vitamin MW pada minggu kedelapan. Namun pada minggu terakhir tidak ada perbedaan dari kedua perlakuan vitamin. Hal ini diduga karena pengaruh vitamin dalam perkecambahan dan pembentukan planlet tidak berpengaruh, berbeda dengan ZPT seperti GA3 yang
sangat berperan penting dalam pembentukan akar dan planlet.
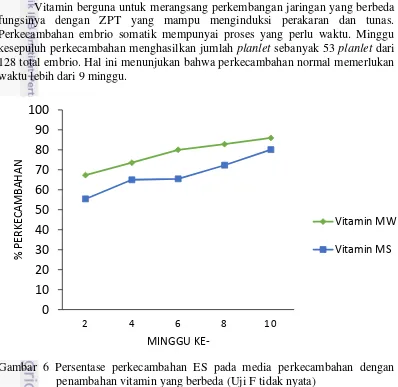
Vitamin berguna untuk merangsang perkembangan jaringan yang berbeda fungsinya dengan ZPT yang mampu menginduksi perakaran dan tunas. Perkecambahan embrio somatik mempunyai proses yang perlu waktu. Minggu kesepuluh perkecambahan menghasilkan jumlah planlet sebanyak 53 planlet dari 128 total embrio. Hal ini menunjukan bahwa perkecambahan normal memerlukan waktu lebih dari 9 minggu.
Gambar 6 Persentase perkecambahan ES pada media perkecambahan dengan penambahan vitamin yang berbeda (Uji F tidak nyata)
Pada Gambar 6 terlihat bahwa perlakuan vitamin MW memiliki hasil yang lebih baik dibandingkan dengan perlakuan vitamin MS dalam perkecambahan embrio somatik. Persentase kecambah yang diamati merupakan gabungan antara kecambah normal dan abnormal. Persentase kecambah yang dihasilkan pada
0
10
20
30
40
50
60
70
80
90
100
2 4 6 8 1 0
[image:32.595.87.485.292.679.2]perlakuan vitamin MW sebesar 67.2% - 85.9%. Sedangkan persentase kecambah yang dihasilkan pada perlakuan vitamin MS sebesar 55.4% - 80.1%. Peningkatan persentase kecambah pada perlakuan vitamin MW cenderung lebih stabil dibandingkan dengan perlakuan vitamin MS pada minggu kedua sampai minggu keenam. Keduanya menunjukkan adanya peningkatan persentase perkecambahan hingga minggu kesepuluh.
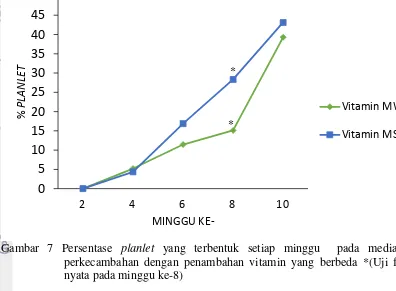
Gambar 7 Persentase planlet yang terbentuk setiap minggu pada media perkecambahan dengan penambahan vitamin yang berbeda *(Uji f nyata pada minggu ke-8)
Gambar 7 memperlihatkan bahwa perkecambahan yang sempurna (planlet)
muncul pertama pada minggu keempat. Perlakuan vitamin MW sebesar 5.2% terlihat lebih baik dibandingkan perlakuan vitamin MS dengan persentase sebesar 4.3% pada minggu keempat. Kedua perlakuan memperlihatkan peningkatan yang terus terjadi pada stiap 2 minggu. Peningkatan persentase pembentukan kecambah yang sempurna (planlet) pada perlakuan vitamin MS terlihat normal dimulai dari minggu keempat. Sedangkan pada perlakuan vitamin MW terjadi peningkatan persentase kecambah normal yang signifikan pada minggu kedelapan.
Pembentukan planlet pada perlakuan vitamin MS memiliki persentase sebesar 4.3 – 43.1 %, dan perlakuan vitamin MW memilik persentase sebesar 5.2 – 39.2 %. Perlakuan Vitamin MS terlihat lebih baik dibandingkan dengan vitamin MW dengan persentase pembentukan planlet diakhir berturut-turut 43.1% dan 39.2%. Hal ini diduga karena adanya biotin pada vitamin MW yang berkombinasi dengan ekstrak malt pada media dasar. Kombinasi biotin dengan bahan organik yang ditambahkan secara eksogen akan mengakibatkan akumulasi protein yang berlebihan dalam sel sehingga justru menghambat proses embriogenesis (Dodeman
et al. 1997).
0
5
10
15
20
25
30
35
40
45
50
2 4 6 8 1 0
[image:33.595.113.509.199.490.2]18
Penelitian Merigo (2011) pada perkecambahan embrio somatik, menghasilkan planlet dengan persentase yang terbentuk sebesar 84% dengan perlakuan GA3 berkonsentrasi 2.5 mg/l. Persentase embrio somatik pada fase
kotiledon yang membentuk kecambah sempurna (planlet) , kurang baik hasilnya diduga karena adanya peningkatan ploidi pada eksplan yang mempengaruhi perkecambahan embrio somatik.
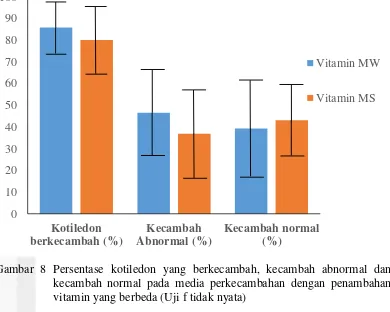
Gambar 8 Persentase kotiledon yang berkecambah, kecambah abnormal dan kecambah normal pada media perkecambahan dengan penambahan vitamin yang berbeda (Uji f tidak nyata)
Pada Gambar 8 menunjukkan bahwa persentase kotiledon yang hanya membentuk akar (abnormal) lebih tinggi pada perlakuan vitamin MW dibandingkan dengan kotiledon yang membentuk akar dan tunas (normal) sebesar 45.5 % dan 39.2%. Namun pada perlakuan vitamin MS, persentase kotiledon yang berkecambah abnormal lebih kecil dibandingkan dengan kotiledon yang berkecambah dengan normal sebesar 36.9% dan 43.1%. Seluruh kotiledon yang membentuk akar (normal dan abnormal) terlihat jauh lebih tinggi dibandingkan dengan kotiledon yang membentuk tunas (normal). Hal ini terjadi karena fase perkecambahan embrio somatik dimulai ketika kotiledon mulai membuka atau terbentuk (fase kotiledon yang berbentuk seperti terompet) yang ditandai dengan terbentuknya akar. Pembentukan akar yang terlebih dahulu dan cepat akan menghambat perkembangan tunas, sehingga planlet tidak terbentuk.
0 10 20 30 40 50 60 70 80 90 100
Kotiledon berkecambah (%)
Kecambah Abnormal (%)
Kecambah normal (%)
Vitamin MW
[image:34.595.90.480.209.521.2]Gambar 9 (a) Kondisi akar pada perlakuan vitamin MS, (b) Kondisi akar pada perlakuan vitamin MW, (c) Perkecambahan pada perlakuan vitamin MS, (d) Planlet yang mulai muncul pada perlakuan vitamin MS, (e) Perkecambahan pada perlakuan vitamin MW, (f) Planlet yang mulai muncul pada perlakuan vitamin MW.
Gambar 9 menunjukkan adanya perbedaan pada jumlah akar yang terbentuk pada perlakuan vitamin MS dan vitamin MW. Media perkecambahan perlakuan vitamin MW (b) terlihat memiliki jumlah akar yang lebih banyak dibandingkan dengan perlakuan vitamin MS (a).
Perkecambahan embrio yang sempurna (planlet) ditandai dengan adanya pembentukan akar dan munculnya tunas (Gmiter dan Moore 1986). Kotiledon yang belum membentuk planlet pada perlakuan vitamin MS dan MW (c, e) dapat dilihat perbandingannya dengan kotiledon yang telah membentuk planlet (d, f) pada Gambar 9.
(a) (b)
(c) (d)
[image:35.595.109.520.108.552.2]20
Gambar 10 (a) Planlet pada media perlakuan vitamin MS di minggu kesepuluh, (b)
Planlet pada media perlakuan vitamin MW di minggu kesepuluh.
Setelah embrio berkecambah dengan normal, Gambar 10 memperlihatkan bahwa media perkecambahan dengan perlakuan vitamin MW memiliki tinggi tunas yang lebih baik (Gambar 10b) dibandingkan dengan panjang tunas pada media perkecambahan perlakuan vitamin MS (Gambar 10a). Hal ini diduga karena vitamin MW memiliki komposisi yang lebih lengkap dibandingkan dengan vitamin MS, sehingga pertumbuhan jaringan pada tunas akan lebih baik. Pertumbuhan dan perkembangan planlet dioptimalkan dengan dipindah ke media tanpa ZPT. Hal ini dilakukan agar resiko penuaan pada eksplan akibat induksi oleh ZPT terhadap perkembangan sel yang terjadi secara cepat dapat dikurangi (Merigo 2011).
Pemanjangan Akar dan Tunas
Pemanjangan tunas dan akar merupakan tahapan yang bertujuan untuk mengoptimalkan tinggi tunas dan akar agar nantinya dapat diaklimatisasi dan dianalisis ploidinya. Hasil pemanjangan akar dan tunas dapat dioptimalkan dengan memodifikasi media dasar seperti dengan menambahkan vitamin dan ZPT. Zat pengatur tumbuh auksin dapat merangsang pembelahan jaringan merismatik yang baik untuk pertumbuhan tanaman. Vitamin juga baik digunakan untuk membantu pertumbuhan dan perkembangan eksplan. Formulasi vitamin yang digunakan adalah vitamin MS dan vitamin MW. Zat pengatur tumbuh yang digunakan adalah dari golongan dari auksin berupa NAA, IAA, IBA dengan konsentrasi penambahan pada medium sebanyak 0.5 mg/l.
[image:36.595.76.477.66.457.2]Tabel 3 Pengaruh formulasi vitamin dan ZPT terhadap pertambahan tinggi tunas dan pertambahan panjang akar pada 4 MST.
Perlakuan Pemanjangan Tunas (cm) Pemanjangan Akar (cm) Vitamin
Vitamin MS 0.44 0.21
Vitamin MW 0.34 0.26
Uji F tn tn
ZPT
NAA 0.28 b 0.19
IAA 0.29 b 0.22
IBA 0.59 a 0.31
Uji F * tn
Interaksi tn tn
aAngka pada kolom yang sama, diikuti oleh huruf yang berbeda menunjukkan berbeda nyata pada taraf uji
5% (uji DMRT) dengan menggunakan transformasi data √� + 0.5.
Hasil analisis data secara statistik (Tabel 3) menunjukkan bahwa perlakuan ZPT berpengaruh nyata terhadap pertambahan tinggi tunas dan tidak berpengaruh nyata terhadap pertambahan panjang akar. Perlakuan vitamin secara statistik juga tidak berpengaruh terhadap pertambahan tinggi tunas dan panjang akar. Interaksi diantara perlakuan vitamin dan ZPT juga tidak ada.
Uji lanjut dengan Uji DMRT (Duncan Multiple Range Test) dengan selang kepercayaan 95% menunjukkan bahwa ZPT IBA berkonsentrasi 0.5 mg/l merupakan ZPT yang mampu mendukung pertumbuhan tunas dengan baik dibandingkan ZPT lainnya baik itu ditambahkan dengan vitamin MS maupun vitamin MW. ZPT NAA dan IAA pada pemanjangan tunas tidak berbeda hasilnya. Pemanjangan akar meskipun pengaruh ZPT tidak nyata namun hasilnya dari yang terbaik adalah IBA, IAA, lalu NAA.
Gambar 11 Pengaruh vitamin dan ZPT terhadap pertambahan tinggi tunas pada 4 MST (Uji f tidak nyata).
0.00 0.10 0.20 0.30 0.40 0.50 0.60 0.70
NAA 0.5 mg/l IAA 0.5 mg/l IBA 0.5 mg/l
[image:37.595.110.501.480.723.2]22
Gambar 12 Pengaruh vitamin dan ZPT terhadap pertambahan panjang akar pada 4 MST (Uji f tidak nyata).
Gambar 11 menunjukkan bahwa perlakuan vitamin MS lebih baik dalam pertambahan tinggi tunas dibandingkan dengan perlakuan vitamin MW. Rata-rata pertambahan tinggi tunas pada perlakuan vitamin MS adalah 0.3 cm – 0.6 cm sedangkan vitamin MW adalah 0.2 – 0.5 cm. Media dasar dengan perlakuan ZPT IBA berkonsentrasi 0.5 mg/l juga memperlihatkan perbedaan yang besar dibandingkan dengan ZPT NAA dan IAA pada pertambahan tinggi tunas. Sedangkan pertambahan tinggi tunas dengan ZPT NAA berkonsentrasi 0.5 mg/l memiliki nilai rata-rata terkecil yaitu 0.2 cm.
Perlakuan vitamin MS juga lebih baik dalam pertambahan panjang akar dibandingkan dengan perlakuan vitamin MW (Gambar 12). Rata-rata pertambahan panjang akar pada perlakuan vitamin MS adalah 0.2 cm – 0.3 cm sedangkan pada vitamin MW adalah 0.1 – 0.2 cm. Media dasar dengan perlakuan ZPT IBA berkonsentrasi 0.5 mg/l memperlihatkan pertambahan panjang akar yang lebih baik dibandingkan ZPT NAA dan IAA dengan konsentrasi yang sama. Hal ini sesuai dengan laporan MZ Abidin dan A llah pada tahun 2007 yang berhasil memanjangkan akar pada tanaman Cichorium untybus L dengan media MS dengan pertambahan IBA.
Menurut Polat dan Caliskan (2009) IBA merupakan ZPT yang sangat respon terhadap pertambahan panjang dan jumlah akar. Zat pengatur tumbuh IBA kandungan kimianya lebih stabil dan persistensinya lebih lama (Islam et al. 2005). Pemanjangan akar dengan vitamin MW dan ZPT NAA berkonsentrasi 0.5 mg/l memiliki nilai rata-rata terkecil yaitu 0.1 cm. Hal ini diduga karena konsentrasi NAA yang kurang tepat memperkecil peluang terbentuknya akar (Ghopitha et al.
2010). ). ZPT IAA juga merupakan ZPT yang mudah menyebar kebagian lain sehingga menghambat perkembangan akar. Hasil dari pertambahan panjang akar dibandingkan dengan hasil dari pertambahan tinggi tunas sangat berbeda. Hal ini diduga karena tunas dapat diinduksi pemanjangannya dengan ZPT auksin yang pada konsentrasi rendah dapat memacu pemanjangan akar.
0.00 0.05 0.10 0.15 0.20 0.25 0.30 0.35 0.40
NAA 0.5 mg/l IAA 0.5 mg/l IBA 0.5 mg/l
Gambar 13 Kondisi planlet di perlakuan vitamin MS dengan ZPT; (a) NAA, (b) IAA, (c) IBA di perlakuan vitamin MW dengan ZPT; (d) NAA, (e) IAA, (f) IBA pada 4 MST pada 4 MST.
Pada Gambar 13 menunjukan kondisi planlet yang telah bertambah tinggi tunas dan panjang akarnya pada minggu ke-4. Perlakuan ZPT dengan vitamin MS menghasilkan planlet yang sempurna (Gambar a, b, c). Planlet yang sempurna memiliki daun yang banyak, tunas dengan ruas buku, ada cabang tunas lainnya, dan akar (Merigo 2011). Tumbuhnya tunas yang lain pada planlet terjadi pada media dasar dengan vitamin MW (Gambar d, e, f) lebih banyak dibandingkan dengan vitamin MS (Gambar a, b, c). Hal ini diduga karena pada vitamin MW terdapat biotin yang dapat meningkatkan terjadinya multiplikasi tunas. Menurut penelitian Merigo (2011) biotin yang ditambahkan pada formulasi media dasar dapat meningkatkan efisiensi multiplikasi tunas yang dihasilkan dan jumlah tunas yang dihasilkan juga lebih banyak.
(a) (b) (c)
24
SIMPULAN DAN SARAN
Simpulan
Proliferasi kalus embriogenik dapat menghasilkan jumlah globular dengan baik pada media dasar MS vitamin MW + 500 mg/l ekstrak malt dengan pemadat
phytagel berkonsentrasi 2.5 g/l. Pendewasaan embrio somatik dengan media dasar MS vitamin MW + 100 mg/l ekstrak malt + ABA 0.5 mg/l dapat menghasilkan embrio somatik dewasa (kotiledon) yang baik. Media dasar MS vitamin MS + GA3
2.5 mg/l + 100 mg/l ekstrak malt merupakan media terbaik untuk mengecambahkan kotiledon menjadi planlet dengan persentase 43.1%. Pemanjangan akar dan tunas terjadi secara optimum dengan media dasar MS vitamin MS + 0.5 mg/l IBA + 500 mg/l ekstrak malt.
Saran
Sebaiknya perlu dilakukan pengujian ploidi pada planlet yang terbentuk untuk melihat keberhasilan dari poliploidisasi dengan kolkisin. Embrio somatik yang jumlah ploidinya tidak diketahui membuat hasil dari regenerasi beragam, sebaiknya jumlah ploidi dapat diketahui sebelum diregenerasikan. Aklimatisasi juga sebaiknya dilakukan pada planlet yang sudah baik.
DAFTAR PUSTAKA
Ali S, Mirza B. 2006. Micropropagation of rough lemon (Citrus jambhiri Lush.): Effect of explant type and hormone concentration. Acta Bot. Croat. 65(2):137-146.
Alkahyari MJ, Albahrany MA. 2001. Invitro micropropagation of Citrus auranty folia (lime). Current science. 81(9):1-5.
Anjaneyulu C, Girri CC. 2008 Factors influencing somatic embryo maturation, high frequencygermination and plantlet formation in Terminalia chebula Retz. Plant Biotechnol Rep 2:153–161.
Ardiani M, Puspita N, Fina G, Septiani, Meiyanto. 2008. Ekstrak etanolik kulit buah jeruk keprok (Citrus reticulata) memacu proliferasi danekspresi cox-2 pada sel kanker kolon WiDr. Prosiding Kongres Ilmiah XVI ISFI. Jakarta. Badan Pusat Statistik. 2014. Import buah-buahan Indonesia 1995-2013.
[internet].[Diunduh:21 Desember 2014]. Tersedia: pada:www.bps.go.id. Badawy EM, Habib AM, El-Banna AA, Yousry GM. 2009. Effect of ome factors
on somatic embryos formation from callus suspensions culture in phoenix dactylifera L. Cv. Sakkoty. 4th Conference on Recent Technologies in Agriculture. 593-599.
Carimi F. 2005. Protocol Somatic Embryogenesis: citrus sp in Book : Protocol for Somatic Embryogenesis in Woody Plants. Edd by Jain SM & Gupta PK. Pages : 321-343. Forestry science vol 77. Springer.
Copriady J, Yasmi E, Hidayanti. 2005. Isolasi dan karakterisasi senyawa kumarin dari kulit buah jeruk purut (Citrus hystrix DC). Jurnal Biogenesis 1:13-1. Davies. J.P 2004. Palnt hormones Biosynthesis, signal transduction, Action Kuwer
Academic publisher Dordrecht/ Boston / London.
Deo PC, Tyagi AP, Taylor M, Harding R, Becker D. 2010. Factors affecting somatic embryogenesis and transformation in modern plant Breeding. The South Pacific J. Nat. Appl. Sci. 28:27-40.
Dodeman, VL, Ducreux G, Kreis M. 1997. Zygotic embryogenesis versus somatic embryogenesis. J. Exp. Bot. 48:1493-1509.
Egertsdotter U. 1999. Somatic embriogenesis in picea suspensions culture, p.51-60. In : Hall DR. (Ed.), Plant Cell Culture Protocols. Humana Press.New Jersey.
Eigisti PJ, Dustin PJ. 1995. Colchichine in Agricultur, Medicine Biology and Chemistry. Lowa: The lowa State Collage Pr. 275 h
Gopitha K, Bhavani L, Senthilmanickam J. 2010. Effect of the different auxins and cytokinins in callus induction, shoot,root regeneration in sugarcane. International Journal of Pharma and Bio Sciences 1:3-11
Gmiter F, Moree GA. 1986 Plant regeneration from undeveloped ovules and embryogenic calli of Citrus: Embryo production, germination, and plant Survival. Plant Cell, Tissue and Organ Culture 6:139-14.
Griffith AI. 2000. An Introduction to genetic Analysis. WH Freeman. New York. hlm 207-215. Ed ke-7.
Husni A. 2007. Penerapan teknologi fusi protoplas dalam perakitan jeruk lokal tipe baru. Laporan Akhir Penelitian, Kerja Sama BB-Biogen dengan Menristek. 26 hlm.
Husni A, Kosmiatin M, Mariska I, Martasari C. 2008. Studi isolasi protoplas pada jeruk siam. Prosiding Seminar Nasional Jeruk; 2007 Jun 13-14; Yogyakarta, Indonesia. 472 hlm.
Husni A. 2010. Fusi Interspesies antara Jeruk Siam Simadu (Citrus nobilis Lour) dengan Mandarin Satsuma (Citrus Unshlu Marc.) [Disertasi]. Bogor: Program Pasca Sarjana. Institut Pertanian Bogor.
Inez HS, Made SP, ahkam subroto M, Sri hartati, Hutajulu S, Rahayu W, Rahayu AS, Ceng O, Yenny A, Mussadarini B, Supriyatna, Suhendar E, Lasimur, Sajam M, Sumardiman T, Purnawan A. 1997. Perbaikan Mutu Varietas Padi melalui Rekayasa Genetika. Puslitbang Bioteknologi – LIPI.
Islam AM, Zubair H, Imtiztiaz N, Chaudhary AF. 2007. Production of in vitro root cultures of Cicer arietinum. International journal of Agriculture & Biology
7(4):621–626.
Jain RK, Jain S, Wu R. 1996. Stimulatory effect of water stress on plant regeneration in aromatic indica rice varieties. Plant Cell Rep. 15:449-454. Khan SRA. 2008. Citrus quality to meet global demand (Agri Overview).
[Internet].[Diunduh 2013 Nov 27]. Tersedia pada : www.pakissan.com. Kosmiatin M, Purwito A, Wattimena GA, Mariska I. 2014. Induksi Embriogenesis
26
Lestari EG. 2011. Peranan Zat Pengatur Tumbuh dalam Perbanyakan Tanaman melalui Kultur Jaringan. Jurnal AgroBiogen 7(1):63-68.
Madon M, Clyde MM, Hashim H, Mohd Yusuf Y, Mat H, Saratha S. 2005. Polyploidy introduction of oil palm through colchicines and oryzalin treatments. Journal of Oil Palm Research. 17:110-123.
Mariska I. 1996. Penyelamatan Embrio Hasil Persilangan Antara Panili Budidaya dan Panili Luar. Balitbio. 1(1):1-5.
Mariska, Hobir I, Mulya K, Husni A, Rahayu S. Purnamaningsih R, Kosmiatin M, Sihachakr D. 2001. Improvement of bacterial wilt resistance of eggplant through protoplast fusion. J Litbangtan. 20(1).
Martasari C. 2008. Teknologi Perbaikan Jeruk Tanpa Biji. [Internet]. [Diunduh 2014 Feb 25]. Tersedia pada :www.balitjestro.litbang.deptan.go.id. Merigo JA. 20111. Studi Regenerasi Tanaman Jeruk Keprok Batu 55 (Citrus
reticulata L) Melalui Jalur Embriogenesis Somatik.[Tesis]. Bogor: Program Pasca Sarjana. Institut Pertanian Bogor.
Abdin MZ, LLah A. 2007. Plant Regeneration through somatic embryogenesis from stem andpetiole explants of Indian chicory (Chichorium untybus L.). Indian Journal of Biotechnology vol 6 pp 250 – 255.
Pareek A, Kothari SL. 2003. Direct somatic embryogenesis and plant regeneration from leaf cultures of ornamental species of Dianthus. Sci. Hort. 98:449-459. Pierik RLM. 1987. In vitro culture of higher plants. M. Nijhoff (Dordrecht and
Boston and Hingham, MA). V 344 p.
Polat AO, Caliskan O. 2008. Effect of indolebutyric acid (iba) on rooting of cutting in various pomegranate genotypes. SHS Acta Horticulturae 818: 1-7. Prihatman K. 2000. Sistem Informasi Manajemen Pembangunan di Pedesaan.
Jakarta (ID): BAPPENAS.142 hlm.
Purnamaningsih R. 2002. Regenerasi Tanaman melalui Embriogenesis Somatik dan Beberapa Gen yang Mengendalikannya. Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Buletin AgroBio 5(2):51-58.
Renukdas NN, Mohan ML, Khuspe SS, Rawal SK. 2006. Influence of phytohormones, culture conditions, and ethylene antagonist on somatic embryo maturation and plant regeneration in papaya. International Journal of Agricultural Research 1 (2): 151-160.
Seagraves KA, Thompson JN, Soltis PS, Soltis PE. 1999. Multiple Origins of polyploidy and the Geographic Structure of Heuchera grossulariifolia. Molecular Ecology. 7: 252-262.
Shiaty OH, Sharabasy SF, Kareim A. 2004. Effect of some amino acids and biotin on callus and proliferation of Date palm (Phoenix dactylifera L.) Sewy cultivar Arab J. Biotech. 7 (2): 265-272.
Suyamto, Arry S, Adang A, Anang T, Winarni M. 2005. Prospek dan Arah Pengembangan Agribisnis Jeruk. Badan Penelitian dan Pengembangan Pertanian. Jakarta (ID): Departemen Pertanian. 235 hlm.
Suryowinoto M. 1996. Pemuliaan Tanaman Secara In Vitro. Yogyakarta (ID): Kanisius.
Sawy EA, Gomma A, Reda A, Danial N. 2006. Somatic Embryogensis and Plant Regeneration From Undeveloped Ovules Of Citrus. Arab J. Biotech. 9(1):189-202.
Wattimena GA. 1992. Bioteknologi Tanaman. Departemen Pendidikan dan Kebudayaan. IPB Bogor.
Wattimena GA. 1998. Zat pengatur Tumbuh Tanaman. Pusat Antar Universitas Institut Pertanian Bogor. 145 hlm.
Winarno M. 2004. Keunggulan dan Kelemahan Jeruk Siam di Indonesia. Budi Marwoto, editor. Prosiding Seminar Jeruk Siam Nasional 2004; 2004 Jun 15-16; Surabata, Indonesia. Jakarta (ID): Pusat Penelitian dan Pengembangan Hortikultura.
Yusnita. 2003. Kultur Jaringan Cara memperbanyak tanaman secara efisien.
Jakarta (ID): AgroMedia Pustaka. hlm 2.
Yujin H, Xiuxin D. 2002. Stress treatment and DNA methylation affect the somatic embryogenesis of citrus callus. Acta Botanica Sinica. 44(6):673- 677. Yuwono T. 2008. Bioteknologi Pertanian. Yogyakarta (ID): UGM Pr.
28
Lampiran 1. Komposisi media dasar kultur, vitamin dan komponen lainya.
Komposisi MS (mg/l) MW (mg/l) Makcronutrient
KNO3 1900.000 1900.000
NH4Cl - -
NH4NO3 1650.000 1650.000
(NH4)2SO4 - -
MgSO47H2O 180.540 180.540
CaCl22H2O 332.020 332.020
NaH2PO4.2H2O - -
K2HPO4 170.000 170.000
KH2PO4 - -
KCl - -
Micronutrient
Na2EDTA - -
FeSO4 7H2O - -
FeNaEDTA 36.700 36.700
MnSO4 4H2O 16.900 16.900
ZnSO4.7H2O 8.600 8.600
CuSO4.5H2O 0.025 0.025
CoCl2.6H2O 0.025 0.025
Kl 0.830 0.830
H3BO3 6.200 6.200
Na2MoO4.2H2O 0.250 0.250
Vitamin
Myo inositol 10.000 10.000
Nicotinic acid 0.500 1.000
Pyridoxine HCL 0.500 1.000
Thiamine HCL 0.100 1.000
Biotin - 1.000
Ca-panthotenat - 0.500
Nicotinamide 0.500 1.000
Ph 5.800 5.800
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 15 Mei 1992 dari Bapak Herman
Syafi’i dan Ibu Ati Siti Sundari. Penulis adalah putra pertama dari tiga bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 5 Bogor dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Ujian Talenta Mandiri (UTM) dan diterima di Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
Penulis aktif pada kegiatan kampus sebagai anggota Himpunan Mahasiswa Agronomi (HIMAGRON), panitia Masa Perkenalan Departemen AGH 48 divisi PDD, Panitia TEGAR (Temu Keluarga Agronomi) 2012 sebagai PDD, Panitia AGS divisi PDD, Panitia FBBN 2013 dan 2014 divisi lomba, dan kegiatan-kegiatan non formal lainnya.