NENG HERAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Kloning dan Ekspresi Human Interferon-Alfa2a pada Yeast Metilotropik Pichia pastoris adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2013
NENG HERAWATI. Kloning dan Ekspresi Human Interferon-alfa2a pada Yeast Metilotropik Pichia pastoris. Dibimbing oleh RETNO. D. SOEJOEDONO dan ADI SANTOSO
Interferon (IFN) merupakan kelompok protein yang disekresikan oleh sel vertebrata akibat adanya paparan biologis seperti: virus, bakteri, protozoa dan senyawa lainnya. Terdapat 3 jenis interferon, yaitu: alfa (α), beta ( ) dan gamma ( ). Interferon-α2a termasuk jenis interferon tipe I. Protein ini memiliki berat molekul 21,550 kDa dan jumlah total asam amino sebanyak 188 (23 asam amino signal peptide + 166 asam amino mature protein). Interferon-α2a juga diketahui dapat digunakan untuk terapi penyakit hepatitis C dan sebagai salah satu obat anti tumor dan anti virus.
Gen regulator untuk produksi IFN dalam kondisi normal, berada pada posisi off hingga IFN tidak diproduksi. Tetapi pada saat ada rangsangan dari luar, baik infeksi virus maupun bakteri, switch gen regulator ini menjadi on dan sistem produksi IFN berjalan. Pada saat mendapat serangan dari berbagai agen penyakit sebenarnya tubuh akan memproduksi IFN, namun umumnya jumlah yang diproduksi tidak mencukupi untuk melawan agen penyakit yang berkembang biak sangat cepat. Karena itu asupan IFN dari luar diperlukan. Inilah yang menjadi awal penggunaan IFN sebagai obat (Utama, 2004).
Kelompok yeast bisa menjadi alternatif sebagai inang (sistem) untuk mengekspresikan gen human interferon dan sebagai produsen protein IFN. Pichia pastoris termasuk kelompok yeast metilotropik yang menggunakan metanol sebagai sumber energi dan sumber karbonnya. Sistem ekspresi P. pastoris menawarkan beberapa keuntungan untuk produksi protein rekombinan, diantaranya adalah: tingkat ekspresi protein rekombinan yang sangat tinggi, kemudahan melakukan scaling-up dalam fermentor, ongkos produksi yang jauh lebih murah dibandingkan kultur sel mamalia, dan kemudahan teknik transformasi dan seleksi sel transforman seperti pada bakteri. Adanya inducible promotor AOX1 yang sangat kuat, dapat mengontrol dengan mudah ekspresi protein rekombinan dengan cara induksi. AOX1 adalah promotor yang mengontrol ekspresi gen alkohol oksidase untuk metabolisme metanol.
Penelitian ini bertujuan untuk melakukan kloning gen human interefron-α2a (hifnα2a) pada bakteri E. coli serta mengekspresikannya di dalam yeast metilotropik P. pastoris. Plasmid atau vektor merupakan salah satu persyaratan penting yang dibutuhkan jika kita hendak melakukan kloning dan ekspresi suatu gen. Plasmid yang digunakan adalah pPICZαB (Invitrogen). Proses penggabungan antara insert (gen hifn-α2a) dan vektor (pPICZαB) dilakukan menggunakan enzim ligase, yang berfungsi mensintesis pembentukan ikatan fosfodiester yang menghubungkan nukleotida insert dengan nukleotida vektor sehingga dihasilkan plasmid rekombinan (pPICZαB-hifnα2a). Proses masuknya DNA rekombinan ke sel bakteri disebut transformasi. Plasmid rekombinan ini ditansformasi ke dalam sel XL1 blue (E . coli) menggunakan metode Heat shock.
diharapkan (in frame).
Plasmid rekombinan yang telah dianalisis kebenaran sekuensnya (klon 6) dilinearisasi menggunakan enzim BstX1 sebelum ditransformasikan ke sel X33 P.
pastoris. Transformasi ke dalam sel P. pastoris menggunakan metode elektroporasi. Galur sel P. pastoris yang digunakan untuk mengekspresikan human interferon-α2a adalah X33. X33 termasuk galur dengan fenotip Mut+
(methanol utilization plus) dan dapat digunakan untuk seleksi positif transforman menggunakan zeocin. Tahap kerja produksi protein menggunakan strain Mut+ terjadi melalui dua fase. Fase pertama penggunaan gliserol untuk memperoleh jumlah biomassa tertentu sehingga densitas sel tinggi. Fase kedua adalah reduksi gliserol dan penggunaan metanol untuk biosintesis protein rekombinan.
Analisis level ekspresi hIFN-α2a, diidentifikasi menggunakan metode Dot blot, SDS PAGE dan Western blot. Dot blot adalah uji serologis yang fungsinya sama dengan Western blot, yaitu untuk mendeteksi kespesifikan reaksi antara antigen dan antibodi, namun BM protein tidak bisa diketahui. Uji ini sangat cocok dilakukan untuk mengidentifikasi sampel protein yang jenisnya banyak. SDS PAGE dapat memberikan informasi tentang ukuran (bobot molekul) dari protein IFN dengan cara membandingkan pita yang dihasilkan dengan ukuran marker dalam satuan kiloDalton (kDa) (Gambar 12). Western blot mengidentifikasi antibodi spesifik pada protein yang telah dipisahkan, sekaligus dapat diketahui BM dari protein tersebut dengan cara membandingka pita protein dengan pita pada protein marker. Tingkat ekspresi protein dapat dilihat dengan cara membandingkan pita dari protein dengan kontrol (Gambar 13). Adanya pola pita protein pada ukuran 24,050 kDa menunjukkan bahwa protein yang disekresikan ke media oleh sel P. pastoris adalah hIFN-α2a.
Data-data yang telah diperoleh pada penelitian ini membuktikan bahwa kloning gen hifn-α2a pada sel prokariot bakteri E. coli dan ekspresi pada P. pastoris telah berhasil dilakukan.
the methylotrophic Yeast Pichia pastoris. Supervised by RETNO. D. SOEDJOEDONO and ADI SANTOSO.
Interferon (IFN) is a group of proteins that are secreted by body cells as a result of exposure to biological vertebrates such as: viruses, bacteria, protozoa and other compounds. There are three types of interferon, namely: alpha (α), beta ( ) and gamma ( ) IFN. Interferon-α2a belongs to the type I interferon. This protein has a molecular weight of 21.550 kDa and consists of 188 amino acids (23 amino acid of signal peptide and 166 amino acids of mature protein). Interferon-α2a is also known to be used for the treatment of hepatitis C and as tumor and anti-virus agents.
Regulator gene for IFN production under normal conditions, is in the off position to IFN is not produced. But when there are external stimuli, both viral and bacterial infections, a regulator gene switches on, and IFN production system running. At the time of an attack from a variety of disease agents actually the body will produce IFN, but generally the amount produced is not sufficient to fight the disease agents that multiply very quickly. Therefore IFN intake from outside is needed. This is the beginning of the use of IFN as a drug.
Genetic engineering is an activity to manipulate the genes to get new products by creating recombinant DNA through gene insertion. Recombinant DNA technology has been used to produce IFN. Yeast such as Pichia pastoris can be an alternative as the host (system) to express human interferon genes and as a producer of IFN protein. Expression system P. pastoris offers several advantages for the production of recombinant proteins, such as: the high level expression of recombinant proteins, ease of scaling-up fermenter, low cost and ease of transformation techniques and selection of transformed cells such as bacteria . The existence of inducible AOX1 promoter is very strong, easily control the expression of recombinant proteins by induction. AOX1 is a promoter that controls gene expression of alcohol oxidase to metabolize methanol as carbon source of P. pastoris.
Therefore,this study aimed to clone human interefron-α2a (hifnα2a) gene in E. coli and express it in metylotrophic yeast P. pastoris. Vector used in this study is pPICZαB (Invitrogen). Ligation process between insert (hifn-α2a gene) and vector (pPICZαB) performed by using T4 DNA ligase, which functions synthesize the formation of phosphodiester bonds linking the nucleotides with nucleotide insert plasmid vectors to produce recombinant (pPICZαB-hifnα2a). This recombinant plasmid transformed into XL1 blue cells (E. coli) by Heat shock method. The results of sequencing analysis (clone 6) using 5'AOX and 3'AOX primers indicate that DNA base sequence of human IFN-α2a genes has been subclone into pPICZαB vector (in frame).
Recombinant plasmid (clone 6) linearized using BstX1 enzyme before transformed into X33 yeast cell. Transformation into cell was done by
Electroporation. The X33 cell P. pastoris strain was used to express human
second phase is the reduction of glycerol and methanol for recombinant protein biosynthesis.
The level expression of hifn-α2a was identified using Dot blot, SDS PAGE and Western blot. Dot blot is a serological test, which is specific for the detection of reactions between antigens and antibodies, and suitable to identify many types of protein samples. Moreover, SDS PAGE can provide information about the size (MW) of IFN protein by comparing the resulting bands marker size in kiloDalton (kDa) (Figure 12), while Western blot identify specific antibodies to proteins that have been separated. Protein expression levels can be seen by comparing the bands of protein with the control (Figure 13). The existence of protein pattern on the size of 24.050 kDa showed that the protein is secreted into the medium by P. pastoris is hIFN-α2a. These results showed that hifn-α2a gene has been succesfully cloned in E. coli and expressed in P. pastoris.
©
Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau
menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau
tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan
yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya tulis
NENG HERAWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada
Program studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi: Dr. drh. Sri Murtini, M.Si
NRP : P051100191
Disetujui oleh Komisi Pembimbing
Prof.Dr. drh. Retno D. Soejoedono, MS Ketua
Dr. Adi Santoso Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof. Dr. Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc. Agr.
Puji syukur kehadirat Allah SWT penulis ucapkan, karena dengan restunya jualah penulis dapat menyelesaikan peneltian dengan judul Kloning dan Ekspresi Human Interferon-alfa2a pada Yeast Metilotropik Pichia pastoris. Andil yang sangat besar diberikan oleh berbagai pihak kepada penulis dalam menyelesaikan penulisan tesis ini.
Pada kesempatan ini dengan segala kerendahan hati, penulis mengaturkan terima kasih dan rasa hormat yang sebesar-besarnya kepada Ibu Prof.Dr. drh Retno D. Soejoedono dan bapak Dr. Adi Santoso sebagai komisi pembimbing yang dengan penuh kesabaran meluangkan waktu untuk senantiasa memberikan motivasi, bimbingan, arahan dan masukan pada penulis, sejak proses penyusunan dari awal hingga akhir penyusunan tesis ini. Terima kasih atas segala masukan, kritikan dan saran demi penyempurnaan tesis ini baik dari segi substansi maupun penulisan. Penulis juga mengucapkan terimakasih kepada Kementrian Negara Riset dan Teknologi (KNRT) atas bantuan dana dan kesempatan yang diberikan kepada penulis melalui program Beasiswa KNRT 2010.
Tidak lupa penulis memberikan penghargaan kepada segenap staf pengajar, karyawan dan rekan-rekan angkatan 2010 di program studi Bioteknologi Pascasarjana IPB yang telah berbagi ilmu dan nasehat kepada penulis selama menjalankan studi. Ucapan terima kasih juga penulis sampaikan kepada rekan-rekan satu tim di Laboratorium protein Terapetik dan Vaksin, Puslit Bioteknologi LIPI yang telah membantu kelancaran penelitian ini. Tidak lupa juga ucapan terimakasih kepada ibu dan saudara-saudaraku atas doa, kasih sayang dan dukungan yang diberikan.
Dengan segala kerendahan hati penulis mengharapkan masukan dari semua pihak yang sifatnya membangun demi kesempurnaan tesis ini sehingga dapat bermanfaat bagi semua pihak. Terima kasih.
Bogor, Januari 2013
Halaman
Produksi IFN-α2a dengan Teknologi DNA Rekombinan 7
Yeast Pichia pastoris 7
3. METODE 10
Waktu dan Tempat Penelitian 10
Bahan 10 Alat 10
Prosedur kerja 10
Amplifikasi Kerangka baca terbuka human ifn-α2a 10
Preparasi vektor pPICZαB 10
Sintesis Plasmid Rekombinan 11
Analisis Sekuensing 12
Linearisasi Plasmid Rekombinan 12
Transformasi Plasmid Rekombinan Linear ke dalam Sel Pichia pastoris
12
Skrining Sel Pichia pastoris yang membawa Plasmid Rekombinan 13 Ekspresi ke dalam Pichia pastoris 13
Analisis Dot blot 13
Analisis SDS PAGE (Sodium Dodecyl Sulfate Poly Acrylamide Gel Electrophoresis) dengan Pewarnaan Comassie Brilliant Blue (CBB)
14
Analisis Western Blot 14
4. HASIL DAN PEMBAHASAN 15
Amplifikasi Gen human Interferon-α2a 15
Analisis Plasmid Rekombinan 15
Purifikasi Plasmid Rekombinan untuk Analisis Sekuensing 16
Analisis Sekuensing 17
Linearisasi Plasmid Rekombinan 18
Analisis Western Blot 21
Pembahasan 21
5. SIMPULAN DAN SARAN 27
Simpulan 27
Saran 27
DAFTAR PUSTAKA 28
LAMPIRAN 32
RIWAYAT HIDUP 42
Halaman
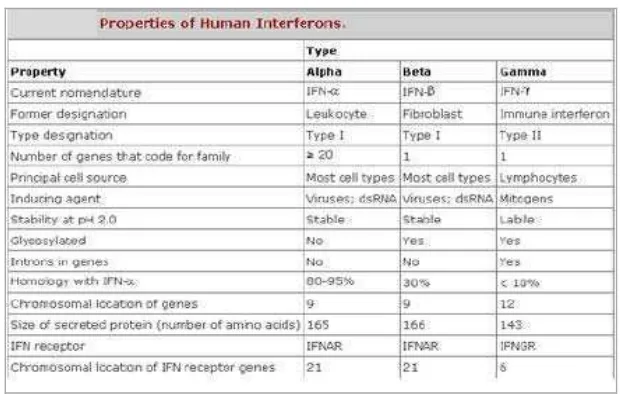
Tipe dan Karakteristik human Interferon 6
DAFTAR GAMBAR
Halaman
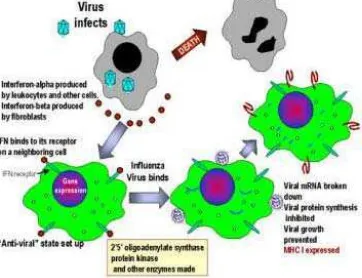
Mekanisme aksi IFN tipe I 7
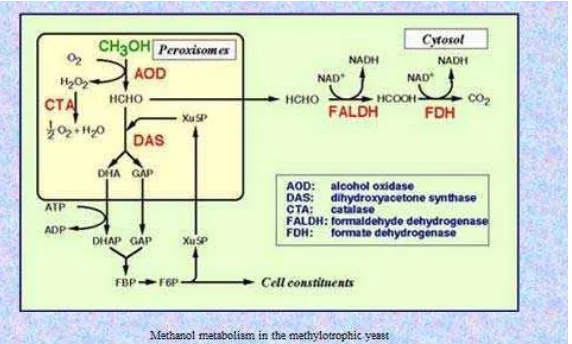
Jalur Metabolisme Metanol 9
Visualisasi hasil PCR gen human interferon-α2a 15 Hasil restriksi plasmid rekombinan hifnα2a-pPICZαB dengan enzim Xho1
dan Xba1 16
Hasil purifikasi plasmid rekombinan klon 6 (Maxiprep) 16 Hasil pensejajaran urutan nukleotida gen hifn-α2a pada plasmid rekombinan
pPICZαB-hifnα2a dengan primer 5’AOX 17
Hasil pensejajaran urutan nukleotida gen hifn-α2a pada plasmid rekombinan pPICZαB-hifnα2a dengan primer 3’AOX
18
Hasil linearisasi klon 6 18
Koloni-koloni rekombinan P. pastoris pada media YPDS+100µg/ml zeocin 19 Koloni-koloni hasil seleksi transforman pada media YPDS+2000µg/ml zeocin
19
SDS PAGE IFN-α2a dengan pewarnaan CBB 20
Analisis Western blot IFN-α2a 20
Vektor pPICZαB 21
Visualisasi vektor pPICZαB pada agarosa 1% 37
DAFTAR LAMPIRAN
Halaman Elektropherogram hasil sekuensing plasmid rekombinan pPICZαB-hifnα2a dengan primer 5’AOX
33
Elektropherogram hasil sekuensing plasmid rekombinan pPICZαB-ifnα2a dengan primer 3’AOX
35
Hasil Elektroforesis Vektor pPICZαB pada Gel Agarosa 1% 37 Hasil pengukuran konsentrasi plasmid rekombinan klon 6 dengan Nanofotometer
38
Sekuens DNA plasmid pPICZαB 39
Sekuens DNA human ifn-α2a 40
1.
PENDAHULUAN
Latar Belakang
Dewasa ini biofarmasetika digunakan dalam penanganan terhadap beberapa penyakit yang secara luas diaplikasikan dengan memproduksi molekul-molekul organik yang disintesis dari mikroba, misalnya antibiotik, analgetik, hormon, serta jenis farmasetika lainnya seperti protein terapetik (Bruce, 2002).
Biofarmasetika mewakili satu dari beberapa segmen industri farmasi yang perkembangannya sangat cepat. Terdapat lebih dari 20 produk biofarmasi telah beredar di pasaran. Sebagian besar adalah protein terapeutik. Kemajuan teknologi DNA rekombinan telah mendorong perkembangan berbagai cara produksi protein rekombinan menggunakan inang yang aman dan relatif mudah dikultur sehingga protein dapat diproduksi pada skala industri.
Interferon (IFN) merupakan kelompok protein yang disekresikan oleh sel vertebrata akibat adanya rangsangan biologis seperti: virus, bakteri, protozoa dan senyawa lainnya. Berdasarkan jenis sel yang menghasilkannya, terdapat 3 jenis IFN, yaitu: alfa (dihasilkan oleh leukosit), beta (dihasilkan oleh fibroblas dan dapat bekerja pada hampir semua sel di dalam tubuh manusia) dan gamma (dihasilkan oleh limfosil sel T helper dan hanya bekerja pada sel-sel tertentu seperti: makrofage, sel endotelial, fibroblas, sel T sitotoksi dan limfosit B) (Konstek & Konssekova, 1997). IFNα dan digolongkan menjadi IFN tipe I, sedangkan IFN termasuk IFN tipe II. Berdasarkan publikasi oleh Biophoenix yang berjudul Biosimilars, Biogenerics and Follow-on Biologics, interferon termasuk salah satu dari 20 produk top biosimilar.
Interferon alfa memiliki peran penting dalam pertahanan terhadap infeksi virus. IFN alfa adalah bagian dari sistem imun non-spesifik dan akan terinduksi pada tahap awal infeksi virus, sebelum sistem imun spesifik merespon infeksi tersebut. Pada saat rangsangan atau stimulasi biologi, seperti oleh virus double stranded RNA, maka virus tersebut akan melakukan replikasi di dalam sel dan menstimulasi proses transkripsi dan translasi gen interferon. Interferon yang dihasilkan oleh sel terinfeksi selanjutnya dikeluarkan dan berikatan dengan reseptor yang terdapat pada sel disekitarnya, lalu masuk ke dalam sitoplasma. Ikatan ini menyebabkan terjadinya transkripsi dan translasi inaktif protein antiviral (AVP). Sementara itu sel pertama yang terinfeksi virus akan mati dan mengeluarkan virusnya. Ketika sel kedua diinfeksi dengan virus, RNA double stranded dari virus mengaktifkan AVP. Aktifnya AVP ini mendegradasi mRNA dan mengikat ribosom yang menghentikan sintesis protein dan replikasi virus, sehingga sel kedua terlindungi dari infeksi virus (Meager, 2006).
satu obat anti tumor dan anti virus, yang telah banyak diproduksi oleh negara-negara maju (Gutlerman, 1994).
Gen regulator untuk produksi IFN dalam kondisi normal, berada pada posisi off hingga IFN tidak diproduksi. Tetapi pada saat ada rangsangan dari luar, baik infeksi virus maupun bakteri, switch gen regulator ini menjadi on dan sistem produksi IFN berjalan. Pada saat mendapat serangan dari berbagai agen penyakit sebenarnya tubuh akan memproduksi IFN, namun umumnya jumlah yang diproduksi tidak mencukupi untuk melawan agen penyakit yang berkembang biak sangat cepat. Karena itu asupan IFN dari luar diperlukan. Inilah yang menjadi awal penggunaan IFN sebagai obat (Utama, 2004).
Teknologi DNA rekombinan,telah digunakan untuk memproduksi IFN. Ekspresi gen interferon yang dilakukan pada kelompok bakteri E. coli (Royet al. 2005). Bakteri ini merupakan sistem yang paling sering digunakan untuk produksi protein rekombinan. Walaupun bakteri dapat digunakan untuk memproduksi IFN tetapi proses produksi dengan bakteri masih mempunyai kelemahan, salah satunya karena sel bakteri merupakan sel prokariot sehingga protein rekombinan yang diekspresikan seringkali menghasilkan protein tidak aktif yang terakumulasi dalam sel dan beragregasi membentuk protein tidak larut yang disebut badan inklusi (inclusion body). Selain itu terdapat beberapa kelemahan dari sel prokariot yaitu keberadaan endotoksin yang terkadang dapat mengontaminasi protein yang diekspresikan pada E .coli (Shi et al. 2007). Bentuk badan inklusi tidak diinginkan karena memiliki rendemen perolehan rendah, memerlukan optimasi pelipatan ulang, dan hasilnya seringkali tidak mencapai aktivitas biologi yang diharapkan.
Kelompok yeast bisa menjadi alternatif lain sebagai produsen protein IFN. Yeast metilotropik Pichia pastoris menawarkan suatu sistem ekspresi yang sangat menguntungkan untuk produksi protein rekombinan. Sistem ekspresi P. pastoris menawarkan beberapa keuntungan untuk produksi protein rekombinan, diantaranya adalah: tingkat ekspresi protein rekombinan yang sangat tinggi, kemudahan melakukan scaling-up dalam fermentor, ongkos produksi yang jauh lebih murah dibandingkan kultur sel mamalia, kemudahan teknik transformasi dan seleksi sel transforman seperti pada bakteri. P. pastoris dapat ditumbuhkan dalam medium yang sederhana dan tumbuh hingga kerapatan sel yang sangat tinggi. Adanya inducible promotor AOX1 yang sangat kuat, dapat mengontrol dengan mudah ekspresi protein rekombinan dengan cara induksi (Skoko et al. 2003). AOX1 adalah promotor yang mengontrol ekspresi gen alkohol oksidase untuk metabolisme metanol. Yeast adalah sel eukariot yang juga melakukan proses modifikasi pasca translasi. Berbeda dengan Saccharomyces cerevisiae yang telah dikenal sebelumnya, pada P. pastoris tidak terjadi proses glikosilasi yang berlebih (over-glycosilation). Protein rekombinan mengalami proses pasca-translasi , termasuk protein folding dan glikosilasi.
Banyak teknik yang dikembangkan pada S. cerevisae dapat diaplikasikan pada P. pastoris, ditambah lagi genetik nomenklatur yang ada pada S. Cerevisae diaplikasikan pula pada P. pastoris (Rainer et al.1999; Byung-Kwon et al. 2003; Stephan et al. 2006). Misalnya, Histidinol dehidrogenase, dikode oleh gen his4 yang ada pada S. cerevisae, terdapat juga pada P. pastoris sehingga signal ekspresi faktor-α dari S. cerivisiae untuk sekresi protein rekombinan secara ekstraselular pun bisa diaplikasikan pada P. pastoris. Keuntungan adanya
faktor-α ini akan memudahkan proses hilir dari ekspresi hIFN-α2a, khususnya pada saat purifikasi.
Tujuan Penelitian
2.
TINJAUAN PUSTAKA
Rekayasa Genetika
Sejarah rekayasa genetika dimulai sejak Mendel menemukan faktor yang diturunkan. Ketika Oswald Avery (1944) menemukan fakta bahwa DNA (Deoxyribonucleic acid) membawa materi genetik, makin banyak penelitian yang dilakukan terhadap DNA. Ilmu terapan ini dapat dianggap sebagai cabang biologi maupun sebagai ilmu-ilmu rekayasa (keteknikan). Dapat dianggap, awal mulanya adalah dari usaha-usaha yang dilakukan untuk menyingkap material yang diwariskan dari satu generasi ke generasi yang lain. Ketika orang mengetahui bahwa kromosom adalah material yang membawa bahan terwariskan itu (disebut gen) maka itulah awal mula ilmu ini. Rekayasa genetika merupakan kegiatan memanipulasi gen untuk mendapatkan produk baru dengan cara membuat DNA rekombinan melalui penyisipan gen. DNA rekombinan adalah DNA yang urutannya telah direkombinasikan agar memiliki sifat-sifat atau fungsi yang kita inginkan sehingga organisme penerimanya mengekspresikan sifat atau melakukan fungsi yang kita inginkan tersebut. Beberapa tahapan yang digunakan dalam rekayasa genetika yaitu isolasi DNA, manipulasi DNA, perbanyakan DNA dan visualisasi hasil manipulasi DNA, DNA rekombinan, dan kloning gen (Muladno, 2002).
Kloning merupakan suatu teknik untuk menghasilkan banyak salinan dari satu gen tunggal, kromosom, atau keseluruhan individu. Kloning DNA adalah memasukkan DNA asing ke dalam plasmid suatu sel bakteri. DNA yang dimasukkan ini akan bereplikasi dan diturunkan pada sel anak pada waktu sel tersebut membelah. Jadi gen asing ini tetap melakukan fungsi seperti sel asalnya, walaupun berada pada sel bakteri (Muladno, 2002; Nur Azhar, 2008).
Teknologi DNA rekombinan telah memungkinkan bagi kita untuk mengisolasi DNA dari berbagai organisme, menggabungkan DNA yang berasal dari organisme yang berbeda sehingga terbentuk DNA rekombinan, memasukkan DNA rekombinan ke dalam sel organisme prokariot maupun eukariot hingga DNA rekombinan tersebut dapat bereplikasi dan dapat diekspresikan. Sekarang teknologi ini digunakan untuk memenuhi kebutuhan dan desakan manusia. Manfaat dari teknologi ini telah dirasakan bagi kehidupan manusia sehari-hari maupun bagi perkembangan ilmu pengetahuan. Beberapa jenis obat-obatan, vaksin, bahan pangan, bahan pakaian dan lainnya telah diproduksi dengan memanfaatkan teknologi DNA rekombinan.
Ekspresi Gen
Ekspresi gen ialah proses penterjemahan informasi yang terkandung pada struktur gen menjadi proses metabolisme atau pola kehidupan organisme. Gen berperanan dalam proses kehidupan melalui pengendalian pembentukan enzim dan protein (Jusuf, 2001).
dalam organisme eukariot ada tahapan proses tertentu sebelum menghasilkan RNA, yaitu RNA processing, kemudian diikuti tahap translasi yang akhirnya menghasilkan polipeptida. Jika dalam proses tersebut ada tahapan yang tidak terjadi, maka dalam hal ini tidak termasuk dalam kategori bahwa gen tersebut telah terekspresi atau dengan kata lain tidak terjadi ekspresi gen. Jadi ekspresi gen terbagi menjadi dua tahapan, yaitu transfer informasi genetik dari DNA ke dalam RNA (transkripsi), dan selanjutnya penterjemahan informasi genetik yang terdapat pada RNA ke dalam polipeptida (translasi) (Jusuf, 2001).
Gen dapat diekspresikan, jika dikelilingi oleh kumpulan signal (isyarat) yang dapat dikenal oleh sel tuan rumah. Signal-signal tersebut (yang biasanya merupakan urutan nukleotida pendek) akan memberitahukan adanya gen dan memberikan instruksi untuk alat-alat transkripsi dan translasi sel. Tiga signal yang paling penting adalah: 1) Promotor, yang menandai titik dimulainya transkripsi gen. 2) Terminator, yang menandai titik pada ujung gen tempat trankripsi gen berhenti. 3) Tempat ikatan ribosom (ribosome binding site), merupakan urutan nukleotida pendek yang dikenal oleh ribosom sebagai titik tempat ribosom harus melekat pada mRNA (Praseno, 1991).
Interferon (IFN)
Suatu unsur penting dalam sistem kekebalan alamiah adalah interferon (IFN), yang juga ikut mengatur sistem kekebalan yang didapat. Interferon adalah salah satu protein dari famili sitokin. Sitokin merupakan kelompok protein regulator dengan berat molekul rendah dan disekresikan oleh sel darah putih dan beberapa sel lain di dalam tubuh akibat adanya suatu rangsangan. Sitokin berikatan pada reseptor spesifik dari membran sel target. Sejarah penemuan IFN dimulai pada tahun 1954 ketika Nagano dan Kojima menemukannya pada virus di kelinci. Tiga tahun kemudian Isaacs dan Lindenmann berhasil menemukan molekul yang serupa pada kultur sel ayam yang diinfeksi dengan virus influenza. Molekul tersebut kemudian diberi nama interferon (Butler, 1987).
Tabel 1 Tipe dan Karakteristik human Interferon
Interferon (IFN) Tipe I
Interferon tipe I dinamakan leukosit IFN (IFN-α) dan fibroblast IFN (IFN-). Sifat fisikokimia IFN ini adalah stabil pada suhu 65°C dan pH 2. Reseptor yang dikenali oleh IFN tipe I dapat dikelompokkan menjadi dua subunit, yaitu IFNAR-1 dan IFNAR-2 (Jonasch & Franck, 2001). Mikroorganisme seperti virus, bakteri, mycoplasma, protozoa, bakterial lipopolysaccharide (LPS), RNA double-stranded dan mitogen menginduksi produksi IFN tipe I (Meager, 2006).
Mekanisme Kerja IFN tipe I
Interferon terbentuk karena rangsangan virus, disamping itu sebagai akibat induksi oleh beberapa mikroorganisme, asam nukleat, antigen, mitogen dan polimer sintetik (Peters 1989). IFN tidak menghambat virus secara langsung, namun melalui mekanisme pencegahan replikasi pada sel-sel sekitar sel yang terinfeksi. Pencegahan replikasi dilakukan melalui pengikatan IFN pada reseptor permukaan sel yang mengaktifkan gen-gen pengkode protein yang menghalangi replikasi virus.
Interferon yang telah diproduksi bekerja melalui beberapa mekanisme utama sebagai berikut:
1. Efek antivirus
2. Efek Immunomodulasi
Intereron memperbaiki sistem imun, baik sistem kekebalan alamiah maupun sistem kekebalan yang didapat melalui beberapa jalan: 1). Meningkatkan fagositosis makrofag dan daya sitotoksik sel Natural killer (NK), 2). Meningkatkan ekspresi Human Leukocyte antigen (HLA) pada permukaan sel yang terinfeksi oleh virus. HLA tersebut bersama antigen virus pada permukaan sel akan dikenali oleh limfosit T sitotoksik yang menyebabkan lisis sel, 3). Ikut dalam lymphokine cascade dan produksi interleukin 1 dan 2 (Peters, 1989; Thomas, 1988).
3. Efek antiproliferatif
Interferon menghambat proliferasi sel tumor dengan mekanisme yang masih belum jelas. Dalam pengamatan pada biakan jaringan ternyata sifat contact inhibition sel dipulihkan. Efek ini menekan daya metastasis tumor (Peters, 1989).
Gambar 1. Mekanisme aksi IFN tipe I
Interferon alfa (IFN-α)
besar IFNα tidak memiliki rantai samping karbohidrat, namun beberapa merupakan glikoprotein dengan derajat glikosilasi berbeda.
Human interferon alfa (hIFN-α) telah banyak diaplikasikan untuk protein terapetik karena memiliki aktivitas antiviral, antiproliferativ dan immunomodulator. Lokus gen hifn-α2 terdiri atas tiga allelik, yaitu hifn-α2a, hifn-α2b dan hifn-α2c (Ceaglio et al.2010). Dua rekombinan IFN-α (2a dan 2b) pada tahun 1986 telah diakui oleh US FDA sebagai protein terapetik untuk treatmen Hepatitis dan kanker. Diketahui hIFN-α2a adalah yang paling banyak digunakan secara klinis untuk mengatasi Hepatitis B dan C kronis (Ferenci, 1993) dan beberapa jenis kanker seperti melanoma, AIDS dan angioblastama.
Interferon- α2a (IFN-α2a)
Protein IFN-α2a memiliki 166 asam amino yang merupakan protein aktif. Jika dilihat dari strukturnya IFN-α2a hampir memiliki persamaan struktur dengan IFN α-2b dan murine interferon- . Perbedaan antara IFN α-2a dengan IFN α-2b terletak pada asam amino nomor 23, untuk IFN pertama asam amino nomor 23 adalah lisin (K) sedangkan IFN kedua adalah arginin (R) (Klaus et al. 1997). Kerangka baca terbuka gen ifn-α2a terdiri atas 522 pasang basa.
Produksi Interferon-α2a dengan Teknologi DNA Rekombinan
Sediaan IFNα2a sudah tersedia secara komersial, misalnya Roferon A. Umumnya protein ini diproduksi dalam E. coli (Meager, 2006). Melalui teknologi DNA rekombinan gen hifn-α2a diperoleh dengan mengisolasi mRNA ifn-α2a yang diproduksi di sel leukosit. Selanjutnya mRNA diubah menjadi cDNA ifn-α2a dengan metode RT PCR. cDNA diligasi dengan vektor kloning dan hasil ligasi ditransformasikan ke dalam E. coli.
Yeast Pichia pastoris
Pichia pastoris termasuk kelompok yeast metilotropik yang menggunakan metanol sebagai sumber energi dan sumber karbonnya. Yeast ini jika ditumbuhkan pada media yang mengandung metanol, maka enzim yang terlibat dalam metabolisme metanol akan terinduksi dengan kuat dan organel-organel yang terikat pada membran seperti peroksisom akan bertambah secara besar-besaran. Kondisi inilah yang sangat menarik untuk menjadikan yeast metilotropik sebagai inang untuk memproduksi protein heterologous (Yurimoto et al. 2011).
dalam peroksisom bersama dengan catalase (CTA), dan akan merusak hidrogen peroksida menjadi oksigen dan H2O. DHA dan GAP terasimilasi di dalam sitosol.
DHA difosforilasi oleh dihydroxyacetone kinase (DHAK), selanjutnya dihydroxyacetone phosphate (DHAP) dan GAP membentuk fructose 1,6-bisphosphate yang kemudian digunakan untuk regenerasi Xu5P dan untuk biosintesis material-material sel. Sebagian lagi formaldehid dioksidasi menjadi CO2 pada jalur disimilasi sitosol. Formaldehid digenerasi oleh reaksi
nonenzimatik AOD dengan mereduksi glutathione (GSH) menjadi S-hydrroxymethyl glutathione (S-HMG). S-HMG kemudian dioksidasi menjadi CO2
melalui jalur oksidasi GSH di sitosol. CO2 kemudian dibuang ke alam (Yurimoto
et al. 2011).
Gambar 2. Jalur metabolisme metanol pada P. pastoris
3. METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan mulai bulan September 2011- Juli 2012 di Laboratorium Protein Terapetik dan Vaksin Pusat Penelitian Bioteknologi Lembaga Ilmu Pengetahuan Indonesia, Cibinong Science Center (CSC).
Bahan
Kerangka baca terbuka hifn-α2a diamplifikasi dari plasmid rekombinan pcDNA3.1+IFN-gene, vektor yang digunakan untuk kloning di E. coli dan ekspresi pada P. pastoris adalah plasmid pPICZαB (Invitrogen), galur E. coli XL1 blue, dan galur X33 P. pastoris (Invitrogen).
Alat
Peralatan yang digunakan pada penelitian ini adalah: mesin PCR (BIOMETRA), Mini Polyacrylamide Gel System (BIORAD), Mini Trans-Blot® Cell (BIORAD), dan Gene Pulser Xcell Electroporation Systems (BIO-RAD).
Prosedur Kerja Amplifikasi gen human ifn-α2a
Gen human ifn-α2a diamplifikasi dari rekombinan pcDNA3.1 + IFN-gene yang telah terinsersi gen hifn-α2a menggunakan teknik PCR dan sekaligus menambahkan situs restriksi pada kedua ujungnya. Primer dua arah yang digunakan adalah : F-IFN : 5 ‘CCG CTC GAG AAA AGA GAG GCT GAA GCT TGT GAT CTG CCT CAA 3’, dan R-IFN : 5’GCT CTA GAG CTT CCT TAC TTC TTA AAC T 3’. Primer PCR dirancang untuk mengamplifikasi gen hifn-α2a dengan tambahan oligonukleotida yang mengkode situs pemotongan Kex2 dan Ste13 dari vektor pPICZαB serta oligonukleotida pengkode asam amino pengkode KBT hifn-α2a, serta penambahan urutan pengenal enzim restriksi pada ujung-ujungnya (Invitrogen, 2001).
Reaksi polimerisasi dilakukan dengan siklus sebagai berikut: denaturasi pada 94 ºC selama 1 menit, penempelan primer (annealing) 50ºC selama 1 menit, dan polimerisasi 72oC selama 1 menit. Produk PCR dikarakterisasi dengan metoda elektroforesis pada medium agarosa 1%. Gel diwarnai dengan larutan EtBr dan diamati di bawah sinar UV. Hasil yang diharapkan adalah pita-pita pada daerah sekitar 500 pasang basa (bp). Setelah itu, pita dengan ukuran tersebut dipotong dan dipurifikasi dengan kit Agarosa DNA ekstraksi.
Preparasi Vektor pPICZαB
Setelah diisolasi, DNA plasmid (vektor) dipotong dengan dua macam enzim restriksi, yaitu Xho1 dan Xba1. Tahap selanjutnya dielektroforesis pada gel agarosa 1% dengan tegangan 90 volt, lalu dilihat ukuran dan pola pita DNA-nya dibawah lampu UV (Lampiran 3).
Sintesa Plasmid Rekombinan
Plasmid yang berfungsi sebagai vektor untuk membawa gen target adalah plasmid pPICZαB. Gen human ifn-α2a dan plasmid pPICZαB yang mengandung situs restriksi XhoI dan XbaI dipotong dengan enzim restriksi yang sama (XhoI dan XbaI). Plasmid yang telah terbuka selanjutnya diligasikan dengan gen ifn-α2a menggunakan enzim T4 DNA ligase. Sebelum ditransformasikan sel XL1 blue dibuat menjadi sel kompeten. Koloni tunggal XL1 blue diinokulasi dalam 2 ml media LB cair yang mengandung antibiotik tetrasiklin pada suhu 37°C dan 200 rpm selama 18 jam. Sebanyak 100 µl kultur ditambahkan ke dalam erlemeyer yang berisi medium LB 100 ml. Kultur diinkubasi lagi selama 4 jam pada suhu 37°C dan 200 rpm. Sebanyak 30 ml kultur disentrifugasi pada 6500 rpm selama 15 menit pada suhu 4°C. Pelet ditambahkan dengan 4 ml larutan CaCl2 60mM
lalu diaduk perlahan sampai pelet larut. Selanjutnya diinkubasi selama 30 menit pada suhu dingin. Sel disentrifugasi seperti prosedur sebelumnya, lalu pelet ditambahkan kembali dengan 4 ml larutan CaCl2 60mM kemudian diinkubasi lagi
selama 30 menit pada suhu dingin. Setelah itu sel disentrifugasi, kemudian pelet dilarutkan dengan 1 ml larutan CaCl2 60mM.
Transformasi dilakukan dengan cara mencampurkan 100 ul sel kompeten dengan 10 ul campuran ligasi. Selanjutnya campuran diinkubasi selama 30 menit pada suhu dingin. Campuran reaksi kemudian ditransformasi menggunakan metode Heat shock pada suhu 42°C selama 2 menit, selanjutnya tabung mikro yang berisi campuran tersebut diinkubasi selama 5 menit pada suhu dingin. Ditambahkan 100 ul media LB tanpa antibiotik lalu diinkubasi selama 1 jam pada suhu 37°C, 100 rpm.
Metode sebar dilakukan untuk menumbuhkan hasil transformasi pada media padat LB low salt yang mengandung antibiotik zeocin dengan konsentrasi 25 ug/ml untuk proses seleksi transforman. Koloni yang tumbuh selanjutnya diisolasi DNA plasmid rekombinannya dengan metode Minipreparation of Plasmid DNA. Sebelum diisolasi koloni-koloni tunggal pada media padat LB low salt ditumbuhkan semalaman pada suhu 37°C di dalam 2 ml media LB low salt cair. Setelah itu diambil 1,5 ml kultur dan dipindahkan ke dalam tabung mikro lalu disentrifugasi pada 13.200 g selama 5 menit. Larutan 1 sebanyak 100 ul (20 mM Glukosa, 10 mM EDTA, 20 mM Tris dan 5000 ul ddH2O) ditambahkan pada pelet
sambil dilarutkan. Selanjutnya diinkubasi pada 4°C selama 5 menit. Untuk tahap selanjutnya ditambahkan 200 ul larutan 2 (0,3 N NaOH, 1% SDS dan 4 ml ddH2O), diaduk perlahan kemudian didinginkan selama 5-10 menit. Ke dalam
yang diambil tadi. Tabung dikocok sebentar lalu disentrifugasi kembali selama 5 menit. Lapisan atas cairan diambil lalu dipindahkan ke tabung mikro baru untuk ditambahkan etanol absolut sebanyak 2,5 volume awal. Tabung mikro yang berisi plasmid rekombinan kemudian disimpan pada suhu -20°C selama 24 jam, lalu disentrifugasi pada suhu 4°C dengan kecepatan 13.200 g selama 30 menit. Supernatan dibuang lalu pelet dicuci dengan etanol 70% dan dikering anginkan pada suhu ruang. Selanjutnya dilarutkan dengan 20 ul ddH2O.
Plasmid rekombinan yang telah diisolasi selanjutnya dikarakterisasi melalui analisis pemotongan dengan enzim restriksi, serta analisis urutan nukleotida (sekuensing). Analisis pemotongan dilakukan dengan prosedur sebagai berikiut: plasmid rekombinan dimasukkan ke dalam tabung mikro 0,6 ml bersama dengan enzim Xho1 dan Xba1, buffer Tango, dan ddH2O steril (total volume 20 µl).
Campuran reaksi diinkubasi selama 2 jam pada suhu 37°C. Hasil analisis restriksi selanjutnya dielektroforesis pada media agarosa 1% untuk memastikan keberhasilan tahapan reaksi yang telah dilakukan.
Sebelum dianalisis sekuensing plasmid rekombinan (klon 6) dipurifikasi dengan maxiprep kit (Qiagen). Klon 6 yang telah dimurnikan kemudian dihitung konsentrasinya menggunakan Nanofotometer (IMPLEN).
Analisis Sekuensing
Analisis sekuensing plasmid rekombinan pPICZαB-ifnα2a dilakukan di Pusat Bioteknologi BPPT Serpong. Konsentrasi sampel yang disekuens adalah 100 ng/µl. Pembacaan dilakukan dua arah yaitu arah 5’-3’ dengan primer 5’AOX (5’-GACTGGTTCCAATTGACAAGC-3’), dan arah 3’-5’ dengan primer 3’AOX(5’-GCAAATGGCATTCTGACATCC-3’). Konsentrasi masing-masing primer adalah 10 pmol/µl.
Linearisasi Plasmid Rekombinan
Plasmid rekombinan (klon 6) yang telah dicek kebenaran sekuensnya lalu dilinearisasi sebanyak 5-10 ug dengan enzim BstX1. Plasmid yang telah linear kemudian dipurifikasi dengan larutan fenol-kloroform dan diamati pola pitanya dengan elektroforesis agarosa 1%.
Transformasi Plasmid RekombinanLinear ke dalam Sel P. pastoris
Sel elektrokompeten dari yeast (X33) dibuat dengan prosedur EasySelectTM
Pichia Expression Kit Manual Instruction (Invitrogen. 2001). Ditumbuhkan 1 ml galur X33 P. pastoris dalam media YPD cair pada suhu 30°C selama 24 jam.
Selanjutnya diinokulasil 100 ul dari kultur tersebut lalu dipindahkan ke dalam 100 ml media YPD cair baru kemudian ditumbuhkan kembali sampai mencapai OD600= 1,3-1,5. Setelah tercapai kondisi tersebut kultur disentrifugasi pada suhu
4°C selama 5 menit dengan kecepatan 1.100 g. Pelet diresuspen dengan 100 ul ddH2O dingin. Dilakukan kembali sentrifugasi seperti prosedur sebelumnya,
kemudian pelet diresuspensi dengan 50 ml ddH2O dingin. Sel kemudian
Sentrifugasi sel, lalu pelet diresuspen dengan 200 ul sorbitol 1M dingin. Sel disimpan pada suhu dingin dan bisa langsung digunakan.
Sebanyak 80 ul sel elektrokompeten dicampur dengan 5-10 ug klon 6 linear yang telah dipurifikasi. Campuran dipindahkan ke dalam cuvet 0,2 cm yang telah disimpan pada kondisi dingin. Cuvet kemudian diinkubasi pada suhu 4°C selama 5 menit selanjutnya diberi kejutan listrik menggunakan metode elektroporasi. Ditambahkan segera 1 ml sorbitol dingin ke dalam cuvet, kemudian ditransfer seluruh isi cuvet ke dalam tabung steril 15 ml. Tabung selanjutnya diinkubasi tanpa digoyang pada suhu 30°C selama 1-2 jam. Disebar 10, 25, 50, 100 dan 200 ul transforman pada media YPDS padat yang mengandung 100 ug/ml zeocin. Plate kemudian diinkubasi 1-10 hari pada suhu 30°C sampai terbentuk koloni.
Skrining Sel P. pastoris yang membawa Plasmid Rekombinan
Proses skrining dilakukan dengan cara menumbuhkan koloni –koloni tunggal yang tumbuh pada media YPD agar + 100 ug/ml zeocin ke media seleksi YPDS + 2000 ug/ml zeocin. Pemilihan koloni dilakukan secara acak. Sel diinkubasi pada suhu 28-30°C selama 2-5 hari. Transforman yang tumbuh pada media tersebut kemudian diuji ekspresinya.
Ekspresi ke dalam sel P. pastoris
Koloni tunggal dari media YPDS + 2000 ug/ml zeocin ditumbuhkan dalam 2 ml media BMGY. Selanjutnya kultur diinkubasi dalam inkubator shaker pada suhu 28°-30°C (250-300 rpm) sampai kultur mencapai nilai OD600=2-6. Sel
dipanen menggunakan sentrifugasi (1500-3000 x g) selama 5 menit pada temperatur ruang. Supernatan yang diperoleh dibuang sedangkan peletnya diresuspen sampai mencapai nilai OD600=1 dengan menggunakan media ekspresi
BMMY. Kultur ditumbuhkan kembali dalam inkubator bergoyang. Penambahan 100% metanol dengan konsentrasi akhir 0,5% dilakukan untuk interval waktu 24 dan 48 jam. Penambahan metanol dilakukan setiap 24 jam masa inkubasi. Supernatan dan pelet dipisahkan setelah 48 jam jam lalu disimpan di dalam tabung mikropada suhu 4°C. Analisis protein rekombinan terhadap supernatan dilakukan menggunakan teknik Dot blot, SDS-PAGE (Sodium Deodocyl Sulfate-Polyacrylamide Gel) dan Western blot.
Analisis Dot Blot
dengan merendam membran dalam reagen NBT-BCIP yang dimasukkan ke dalam larutan bufer AP pH 7,5 (Ausubel et al. 1992).
Analisis SDS-PAGE (Sodium Dodecyl Sulfate Poly Acrylamide Gel Electrophoresis) dengan Pewarnaan Comassie Brilliant Blue (CBB)
Sampel protein (supernatan) yang akan dianalisis dengan metode SDS- PAGE menggunakan konsentrasi poliakrilamid 12% untuk separating gel dan 3% untuk stacking gel. Sampel protein (15 ul)dan 5 µl marka protein ditambahkan dengan5 µl bufer sampel. Tabung yang berisi supernatan dididihkan selama 5 menit kemudian dimasukkan ke dalam sumur, begitu juga dengan marka protein. Pemisahan protein dilakukan dengan elektroforesis dalam running buffer pada tegangan 90 volt selama 120 menit. Gel hasil elektroforesis diwarnai dengan Comassie brilliant blue (CBB) selama 24 jam yang dilanjutkan dengan penambahan destaining solution.
Analisis Western Blot
4. HASIL DAN PEMBAHASAN
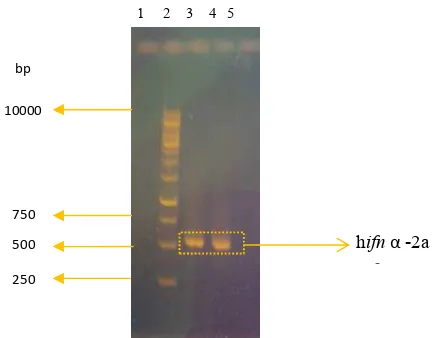
Amplifikasi Kerangka Baca Terbuka human Interferon-alfa2a (hifn-α2a) Amplifikasi kerangka baca terbuka (KBT) hifn-α2a dari plasmid rekombinan pcDNA3.1+IFN-gene yang dilakukan menggunakan sepasang primer (F-IFN dan R-IFN) memperlihatkan pita DNA berukuran sekitar 500 bp (Gambar 3). Pita tebal tersebut merupakan pita DNA gen hifn-α2a dengan ukuran 522 bp, dan sesuai dengan ukuran gen hifn-α2a yang terdapat pada GenBank.
Gambar 3 Produk PCR gen human ifn-α2a. (1): kosong, (2): DNA Ladder 1 kb,(3 & 4): amplikon gen hifn-α2a
Analisis Plasmid Rekombinan
Kontrol negatif (sel XL1 blue tanpa penambahan hasil reaksi ligasi) memberikan hasil yang diharapkan, yaitu tanpa koloni. Hasil transformasi produk ligasi memberikan banyak koloni-koloni tunggal. Koloni yang tumbuh secara teoritis mengandung plasmid dengan sisipan insert hifn-α2a.
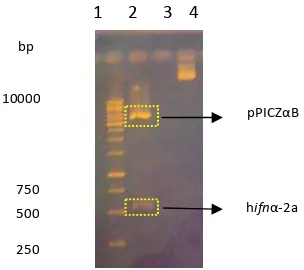
Isolasi plasmid rekombinan dilakukan terhadap 24 transforman. Pemilihan koloni dilakukan secara acak.Visualisasi hasil restriksi plasmid rekombinan (8 transforman) pada gel agarosa 1% menghasilkan dua pola pita DNA dengan ukuran yang berbeda. Pita plasmid pPICZαB berukuran sekitar 3600 bp, sedangkan pita gen hifn-α2a berukuran sekitar 500 bp (Gambar 4). Hasil analisis ini menunjukkan bahwa plasmid rekombinan sudah berhasil disintesis.
1 2 3 4 5
hifnα -2a 2 500
250 bp
Gambar 4 Hasil restriksi plasmid rekombinan (pPICZαB-ifnα2a) dengan enzim Xho1 & Xba1. 1-8: klon 1-8, 9: DNA ladder 1 kb, 10: klon 6 tidak dipotong
Purifikasi Plasmid Rekombinan untuk Analisis Sekuensing
Purifikasi terhadap plasmid rekombinan bertujuan agar DNA plasmid lebih murni. Sebelum dilakukan sekuensing plasmid rekombinan yang telah dihasilkan dipurifikasi dengan Qiagen™ plasmid purification. Delapan klon plasmid rekombinan yang telah direstriksi dengan Xho1 dan Xba1 dipilih satu klon (klon 6) untuk dipurifikasi DNA-nya. Hasil isolasi dari delapan klon tersebut memperlihatkan ada 7 klon yang terestriksi dengan baik (klon 1-7), yang ditunjukkan adanya 2 pita DNA dengan ukuran yang diharapkan. Klon 6 dipilih untuk purifikasi sebagai tahap awal saja, karena metode yang digunakan untuk teknik ini memerlukan jumlah media yang banyak. Hasil purifikasi klon 6 ditampilkan pada Gambar 5.
Gambar 5 Hasil purifikasi plasmid rekombinan klon 6 (Maxiprep) (1): DNA marker 1 Kb, (2): klon 6 dipotong Xho1 & Xba1, (4): klon 6 tidak dipotong
Plasmid rekombinan klon 6 hasil purifikasi dihitung konsentrasinya dengan Nanofotometer dan ditampilkan pada lampiran 4. Hasil purifikasi terhadap klon
ini sudah memuaskan sehingga purifikasi terhadap klon-klon yang lain tidak dilakukan.
Analisis Sekuensing
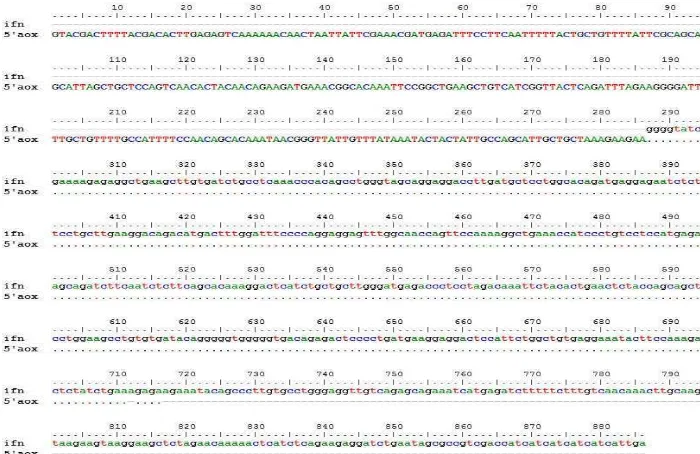
Analisis sekuensing dilakukan untuk mengidentifikasi urutan nukleotida dari plasmid rekombinan yang telah dihasilkan. Urutan nukleotida transforman nomor 6 hasil sekuensing selanjutnya disejajarkan dengan urutan nukleotida kerangka baca terbukan hifn-α2a yang terdapat pada GenBank. Berdasarkan analisis urutan nukleotida menggunakan primer 5’AOX dan 3’AOX diperoleh hasil bahwa gen hifn-α2a telah berhasil disisipkan pada vektor pPICZαB. Plasmid rekombinan selanjutnya dinamakan pPICZαB-ifnα2a. Hasil pensejajaran dapat dilihat pada Gambar 6 dan 7. Electropherogram ditampilkan pada Lampiran 1 dan 2.
Gambar 7 Hasil pensejajaran urutan nukleotida hifn-α2a pada plasmid rekombinan pPICZαB-hifnα2a dengan primer 3’AOX
Linearisasi Plasmid Rekombinan
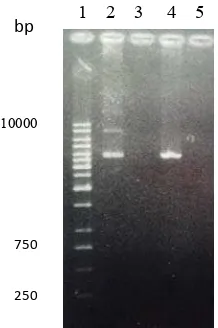
Hasil pemisahan plasmid rekombinan linear dengan elektroforesis agarosa 1% disajikan pada Gambar 8.
Gambar 8 Hasil linearisasi klon 6. (1): DNA marker 1 Kb, (2): plasmid rekombinan pPICZαB-ifnα2a tidak dipotong, (3): kosong, (4): plasmid rekombinan pPICZαB-ifnα2a dipotong BstX1
1 2 3 4 5 bp
10000
Transformasi Rekombinan Plasmid linear ke P. pastoris Galur X33
Transformasi ke dalam genom galur X33 P. pastoris dilakukan dengan
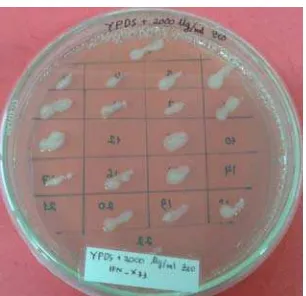
metode elektroporasi menggunakan Gene Pulser Xcell Electroporation Systems BIO-RAD. Koloni-koloni yang ditumbuhkan pada media YPDS + 100µg/ml zeocin muncul setelah diinkubasi 24 jam (1 hari) dan berwarna putih (Gambar 9).
Gambar 9 Koloni-koloni rekombinan P. pastoris pada media YPDS + zeocin 100 ug/ml
Skrining Positif Transforman
Ditumbuhkan sebanyak 22 koloni pada media YPDS yang mengandung 2000 ug/ml zeocin untuk proses skrining pada suhu 30°C. Dihasilkan 18 transforman yang tumbuh pada media YPDS + 2000 ug/ml zeocin (gambar 8). Terdapat 14 koloni (transforman) yang tumbuh setelah 2 hari masa inkubasi, yaitu klon 1, 2, 3, 4, 5, 6, 8, 9, 11, 13, 15, 17, 19 dan 20. Sisa 4 koloni tumbuh setelah diinkubasi selama 4-5 hari, yaitu klon 7, 16, 18 dan 22. Koloni yang tumbuh pada kondisi tersebut secara teori merupakan positif transforman. Koloni yang tumbuh setelah diinkubasi 2 hari selanjutnya dilakukan studi ekspresi.
Analisis Ekspresi metode Dot blot
Sebanyak 14 koloni transforman diuji ekspresinya, yaitu klon 1, 2, 3, 4, 5, 6, 8, 9, 11, 13, 15, 17, 19 dan 20. Analisis ekspresi menggunakan metode Dot blot (14 klon), metode SDS PAGE dan Western blot masing-masing 7 klon ( klon 2, 4, 6, 8, 9, 11 dan 13).
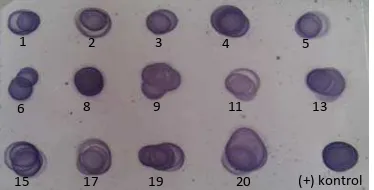
Hasil analisis menggunakan Dot blot ditampilkan pada Gambar 11. Semua klon yang dianalisis memberikan dot-dot berwarna pada membran. Hasil dari metode ini menunjukkan semua sampel yang dianalisis memberikan hasil positif, dengan intensitas ketebalan pita yang berbeda.
Gambar 11 Analisis ekspresi hifn-α2a dengan Dot blot
Analisis SDS-PAGE dengan Pewarnaan CBB
Supernatan yang telah dikumpulkan (7 klon) kemudian dianalisis dengan SDS-PAGE dan divisualisasi dengan pewarnaan Comassie Brilliant Blue (CBB). Hasil analisis dapat dilihat pada Gambar 12. Semua sampel supernatan memberikan pola pita yang ketebalannya berbeda-beda. Bobot molekul (BM) protein hasil karakterisasi dengan metode ini adalah sekitar 24,05 kDa. Hasil analisis protein dengan metode ini menunjukkan bahwa hifn-α2a telah berhasil diekspresikan dalam P. pastoris.
1
6
15
2 3 4 5
8
17
9 11 13
Gambar 12 SDS PAGE protein IFN-α2a dengan pewarnaan CBB. (1): Protein marker, (2-8): supernatan klon 2, 4, 6, 8, 9 ,11 dan 13.
Analisis Western Blot
Hasil analisis dengan Western blot dapat dilihat pada Gambar 9. Pita protein hasil ekspresi berukuran sekitar 24,050 kDa dan memberikan informasi bahwa terjadi interaksi antara antigen (protein IFN) dengan antibodi (Ab anti IFN). BM protein hasil analisis dengan SDS PAGE dan Western blot adalah sama.
Gambar 13 Analisis Western blot IFN-α2a (1):positif kontrol (IFN ekspresi di E. coli), (2): protein marker, (3): klon 2, (4): klon 4, (5): klon 6, (6): klon 8, (7): klon 9, (8): klon 11, (9): klon 13, (10): negatif kontrol (X33 kosong)
Perbandingan ukuran pita-pita protein dari supernatan pada hasil SDS-PAGE dan Western blot menunjukkan adanya perbedaan ketebalan pita dari masing-masing klon yang dianalisis.
Pembahasan
memasukkan DNA asing ke dalam plasmid suatu sel bakteri. Pada penelitian ini DNA yang akan dikloning adalah DNA dari gen human ifn-α2a yang menyandi protein interferon-α2a (IFNα-2a). Gen ini terletak spesifik pada kromosom manusia nomor 9 (Stuart & Sidney, 1993; Guido, 2008). Gen ini secara natural dapat diisolasi dari sel leukosit manusia (Gunther et al. 1991). Dalam melakukan kloning dibutuhkan vektor sebagai wahana atau kendaraan untuk mengangkut gen atau fragmen gen yang akan diklon ke dalam sel, juga memerlukan beberapa persyaratan seperti: enzim restriksi dan ligase, transformasi, kemudian identifikasi sel yang mengandung DNA target (Toha, 2001).
Hasil kloning gen hifn-α2a pada sel XL1 blue telah berhasil dilakukan terbukti dengan diperolehnya fragmen DNA berukuran sekitar 500 bp dari amplifikasi dengan teknik PCR, plasmid rekombinan pPICZαB-hifnα2a juga berhasil disintesis, hasil analisis restriksi terhadap plasmid rekombinan memberikan dua pita DNA yang berbeda, yaitu pita berukuran 3600 bp (vektor) dan pita berukuran sekitar 500 bp (insert).
Plasmid atau vektor merupakan salah satu persyaratan penting yang dibutuhkan jika kita hendak melakukan kloning dan ekspresi suatu gen. Vektor digunakan sebagai wahana, tempat gen DNA disisipkan. Sifat-sifat plasmid yang dapat digunakan sebagai sarana dalam teknologi DNA rekombinan adalah: molekul DNA plasmid harus mampu bereplikasi dalam sel inangnya. Selain itu DNA plasmid harus memiliki paling sedikit satu marker genetik, seperti gen pengkode sifat resistensi terhadap antibiotik tertentu. Sifat penting lain plasmid untuk teknologi DNA rekombinan adalah memiliki urutan nukleotida spesifik yang dikenali dan mampu dipotong oleh enzim restriksi tertentu (Toha, 2001).
Pada penelitian ini vektor yang digunakan adalah pPICZαB (Invitrogen) yang berukuran 3593 bp. Sangat penting mengklon gen in frame dengan signal sekuen faktor α jika menggunakan plasmid ini (Invitrogen, 2001). Plasmid pPICZαB merupakan salah satu vektor ekspresi yang digunakan untuk mengekspresikan protein target pada sel P. pastoris. Plasmid ini merupakan shuttle vektor sehingga dapat digunakan sebagai vektor kloning di E. coli dan vektor ekspresi di sel P. pastoris. Vektor P. pastoris umumnya dirancang sebagai plasmid integrasi untuk mencegah masalah ketidakstabilan plasmid selama pertumbuhan jangka panjang. Vektor pPICZαB membawa marker zeocin sehingga seleksi dapat dilakukan secara langsung dan multi-copy integran dapat diketahui langsung tanpa menggunakan banyak medium. Zeocin juga dapat digunakan untuk E. coli sehingga mengurangi penggunaan antibiotik lain dan pengurangan ukuran vektor.
Dalam melakukan pengklonan suatu DNA asing harus memenuhi hal-hal sebagai berikut, yaitu DNA plasmid (vektor) harus dimurnikan dan dipotong dengan enzim restriksi yang sesuai sehingga terbuka. DNA yang akan disisipkan ke molekul vektor (insert) untuk membentuk rekombinan juga harus dipotong dengan enzim yang sama. Pada penelitian ini enzim restriksi yang digunakan untuk memotong kedua DNA tersebut adalah enzim restriksi endonuklease Xho1 dan Xba1. Tujuan pemotongan rantai DNA sehingga menjadi fragmen ini adalah agar dapat menggabungkan antara fragmen DNA insert (hifn-α2a) dengan fragmen DNA vektor (pPICZαB).
menghubungkan nukleotida insert dengan nukleotida vektor sehingga dihasilkan plasmid rekombinan. Pembentukan ikatan fosfodiester ini terjadi antara ujung fosfat bebas dari polinukleotida dan gugus 3’-OH dari polinukleotida yang lain (Toha, 2001).
Proses masuknya plasmid rekombinan ke sel bakteri disebut transformasi dan proses ini dapat menyebabkan fenotip sel bakteri mengalami perubahan. Plasmid rekombinan ini ditansformasi ke dalam galur XL1 blue (E. coli). Vektor rekombinan yang memasuki sel inang dapat merubah sifat asli sel tersebut sesuai dengan gen yang dibawanya. Sel inang biasanya memiliki sifat sensitif terhadap antibiotik tertentu. Dan sifat ini yang direkayasa untuk digunakan dalam proses kloning. Perubahan sel inang dapat dijadikan indikator untuk mengetahui keberhasilan proses transformasi sel (Toha, 2001).
Proses transformasi mencakup beberapa tahap. Tahap awal adalah merangsang pembengkakan sel sampai terbentuk spheroplast dengan bantuan kalsium klorida (CaCl2). Pada kondisi ini protein periplasmik hilang, sehingga
terbentuk pori-pori pada dinding sel. Kemudian DNA yang ditambahkan membentuk resisten DNAse dengan ion kalsium yang melekat pada permukaan sel. Tahap terakhir diketahui sebagai proses pengambilan kompleks tersebut sewaktu dilakukan Heat shock (Toha, 2001).
Proses seleksi terhadap sel transforman dilakukan untuk mengetahui apakah sel bakteri telah mengandung plasmid rekombinan, dengan cara menumbuhkan sel bakteri yang telah ditransformasi pada media padat LB low salt yang mengandung antibiotik zeocin. Zeocin sangat sensitif terhadap kondisi garam dan pH yang ekstrim, oleh karena itu konsentrasi garam pada media dibuat rendah. pH media dibuat menjadi 7,5. Adanya koloni-koloni tunggal yang tumbuh pada media tersebut dapat dianggap bahwa sel bakteri telah mengandung plasmid rekombinan, selanjutnya diisolasi DNA plasmid rekombinannya. Isolasi DNA bertujuan untuk mendapatkan DNA tanpa debris sel. Prinsip teknik isolasi DNA mencakup berbagai tahap reaksi dengan tujuan yang berbeda-beda setiap tahapnya. Tahap pertama adalah penghancuran dinding sel, tahap kedua adalah lisis sel, sedangkan tahap ketiga adalah membersihkan debris sel.
Analisis hasil isolasi DNA dilakukan dengan metode elektroforesis. elektroforesis adalah teknik yang menggunakan medan listrik untuk memisahkan molekul berdasarkan ukuran. Karena mengandung fosfat yang bermuatan negatif, DNA akan bergerak menuju elektroda positif dalam medan listrik. Pengamatan hasil elektroforesis dilakukan di dawah sinar UV dengan bantuan etidium bromida (EtBr) yang dapat berfluorosensi bila disinari UV. Etidium bromida mempunyai kemampuan membentuk khelat dengan molekul DNA, sehingga jumlah molekul EtBr sebanding dengan ukuran rantai DNA yang diamati dan ukuran DNA yang dianalisis dapat diketahui. Pemberian EtBr dilakukan sebelum atau sesudah proses elektroforesis (Toha, 2001).
Sintesis terhadap plasmid rekombinan pPICZαB-hifnα2a dalam bakteri E. coli telah berhasil dilakukan. Analisis restriksi menggunakan dua macam enzim restriksi Xho1 dan Xba1 menunjukkan adanya dua pita DNA yang ukurannya berbeda. Pita DNA berukuran 3600 bp merupakan DNA vektor (pPICZαB), sedangkan yang berukuran 500 bp adalah pita DNA insert (hifn-α2a).
eukariot lain. Gen ini berukuran kecil (375 bp) dan resisten terhadap zeocin (Cregg et al. 2007). Seleksi transforman menggunakan antibiotik zeocin terjadi melalui mekanisme khusus. Mekanisme kerja dari zeocin dalam menyeleksi koloni-koloni yang mengandung transforman adalah sebagai barikut: zeocin mengandung kelat tembaga (Cu) yang jika tidak digunakan berada dalam bentuk non aktif. Ketika antibiotik masuk ke dalam sel, kation tembaga direduksi dari Cu2+ menjadi Cu1+ dan dipindahkan oleh senyawa sulfhydryl yang terdapat di dalam sel, selama pemindahan tembaga zeocin menjadi aktif dan akan berikatan dengan DNA dan merusaknya, sehingga menyebabkan kematian sel (Invitrogen 2001).
DNA sekuensing merupakan proses identifikasi urutan DNA dari molekul DNA rekombinan hasil kloning. Teknik ini digunakan untuk mengidentifikasi kesalahan pada urutan DNA (Muladno 2002). Hasil analisis sekuensing (klon 6) menggunakan primer 5’AOX dan 3’AOX menunjukkan bahwa urutan basa DNA dari gen human ifnα-2a yang di subklon pada vektor pPICZαB telah sesuai dengan yang diharapkan (in frame). Hasil ini semakin memperkuat bahwa plasmid rekombinan yang diperoleh adalah benar.
Salah satu hal penting dalam mengekspresikan protein menggunakan promotor AOX1 adalah proses linearisasi plasmid rekombinan. Linearisasi dapat menstimulasi rekombinasi ketika plasmid ditransformasikan ke dalam P. pastoris (Invitrogen 2001). Plasmid rekombinan yang telah dianalisis kebenaran sekuensnya (klon 6) dilinearisasi menggunakan enzim BstX1 sebelum ditransformasikan ke sel X33 P. pastoris. DNA vektor linear dapat menghasilkan
transforman yang stabil melalui rekombinasi homolog antara sekuens-sekuens dari vektor dengan sekuens homolog pada genom inang (Cregg et al. 2007).
Transformasi ke dalam sel P. pastoris menggunakan metode elektroporasi. Elektroporasi merupakan metode yang mudah dan cepat untuk transformasi ke P. pastoris (Pingzuo et al. 2007). Prinsip dari metode ini adalah menggunakan kejutan listrik untuk memperbesar pori-pori membran sel sehingga dapat meningkatkan permeabilitas membran. Untuk melakukan metode ini sel P. pastoris (X33) harus terlebih dahulu ditumbuhkan pada media YPD hingga
mencapai masa pertengahan fase log (OD600= 1.3-1.5). Sinyal elektrik akan
menginduksi perbesaran pori-pori membran sehingga molekul yang berukuran seperti DNA dapat masuk ke dalam sel. Elektroporasi dapat menghasilkan 103-104 transforman per mikrogram DNA linear dan tidak menyebabkan kerusakan pada dinding sel Pichia (Invitrogen, 2001).
Ekspresi gen merupakan rangkaian proses penerjemahan informasi genetik (dalam bentuk urutan basa pada DNA dan RNA) menjadi protein, dan lebih jauh lagi fenotipe. Ekspresi gen asing ke dalam P. pastoris harus memenuhi beberapa syarat, yaitu: insersi gen ke dalam vektor ekspresi dan integrasi vektor ekspresi ke dalam genom P. pastoris (Cregg et al. 2007).
Galur sel P. pastoris yang digunakan untuk mengekspresikan hifn-α2a adalah X33. X33 termasuk galur dengan fenotip Mut+ (methanol utilization plus)
dan dapat digunakan untuk seleksi positif transforman menggunakan zeocin. Galur ini dapat tumbuh pada media YPD. Galur Mut+ tumbuh cepat pada media yang mengandung metanol sehingga dapat dengan cepat memproduksi protein asing. X33 banyak digunakan oleh peneliti dalam memproduksi protein
tinggi daripada ekspresi pada galur Muts (methanol utilization slow) (Shi et al. 2007).
Yeast metilotropik menggunakan metanol sebagai sumber karbonnya. Galur X33 sangat responsif dengan metanol, maka ia juga sensitif terhadap metanol pada
konsentrasi tinggi, sehingga perlu dilakukan regulasi dalam penambahan metanol ke dalam media. Metanol dengan konsentrasi tinggi menghambat pertumbuhan sel. Konsentrasi metanol yang baik ditambahkan pada media adalah ≤ 0,4% ( Zhang et al. 2000) atau 0,5% (Invitrogen 2001, Santoso et al. 2012). Pada penelitian ini konsentrasi metanol yang digunakan adalah 0,5%. Terdapat dua gen pada genom P. pastoris yang mengkode alcohol oxidase (AOX), yaitu aox1 dan aox2, namun hanya gen aox1 yang bertanggung jawab untuk sebagian besar aktivitas alcohol oxidase di dalam sel. Ekspresi gen aox1 diregulasi dan diinduksi oleh metanol dan akan terhambat kerjanya dengan keberadaan gliserol atau glukosa (Tschopp et al. 1987). Regulasi gen aox1 adalah sama dengan regulasi gen gal1 pada S. cereviseae, yang terjadi melalui dua mekanisme yaitu: mekanisme represi/de-represi dan mekanisme induksi. Keberadaan metanol sangat penting untuk menginduksi pada level transkripsi (Cregg et al. 2007).
Waktu inkubasi yang dilakukan dalam studi ekspresi adalah 48 jam. Pemilihan lamanya waktu inkubasi ini berdasarkan riset-riset yang telah dipublikasikan yang menyebutkan bahwa 48 jam waktu inkubasi merupakan waktu terbaik dalam produksi protein rekombinan menggunakan inang P. pastoris (Santoso et al. 2012; Gurkan et al. 2003). Waktu inkubasi yang lebih lama dapat menyebabkan protein yang disekresikan terdegradasi oleh protease (Sinha et al. 2004).
Pichia pastoris merupakan kelompok yeast metilotropik yang menggunakan metanol sebagai sumber energi dan sumber karbonnya. Pada saat yeast ditumbuhkan dalam media yang mengandung metanol, maka enzim yang terlibat dalam metabolisme metanol akan terinduksi dengan kuat dan organel-organel yang terikat pada membran seperti peroksisom akan bertambah secara besar-besaran. Enzim penting yang terlibat dalam metabolisme metanol ini, yaitu AOX1 terdapat di dalam peroksisom. Apabila sel ditumbuhkan pada media yang mengandung glukosa, jumlah peroksisom hanya sedikit. Jika sel ditumbuhkan pada media yang mengandung metanol maka jumlah peroksisom mencapai 80% dari total volume sel (Yurimoto et al. 2011). Hidrogen peroksida yang dihasilkan dari oksidasi metanol dapat dirusak dengan bantuan enzim khusus yang terdapat di dalam peroksisom, sehingga tidak ada zat toksik yang dihasilkan selama proses ini.
Tahap kerja produksi protein menggunakan strain Mut+ terjadi melalui dua fase. Fase pertama penggunaan gliserol untuk memperoleh jumlah biomassa tertentu sehingga densitas sel tinggi. Fase kedua adalah reduksi gliserol dan penggunaan metanol untuk biosintesis protein rekombinan (Brierley et al. 1990 dalam Celik et al. 2009).
ini dilakukan metode Dot blot dengan tujuan dapat secara langsung dan cepat melihat adanya interaksi antara antigen dengan antibodi dari 14 transforman yang dihasilkan. Uji ini dilakukan sebagai uji awal untuk pemilihan transforman yang akan dianalisis ekspresinya dengan SDS-PAGE dan Western blot. Dihasilkan dot-dot (noda) berwarna coklat keunguan pada semua sampel protein yang dianalisis, yang menerangkan bahwa semua protein (supernatant yang dianbalisis) dapat berinteraksi dengan antibodi anti IFN.
SDS-PAGE dapat memberikan informasi tentang ukuran (bobot molekul) dari protein IFN dengan cara membandingkan pita yang dihasilkan dengan ukuran marker dalam satuan kilodalton (kDa) (Gambar 12). Analisis dengan metode ini dilakukan terhadap 7 klon, pemilihan klon dilakukan secara acak, karena informasi yang dibutuhkan adalah berapa BM protein IFN yang dihasilkan. Hasilnya diperoleh 7 pita protein yang berukuran sekitar 24,05 kDa.
Western blot mengidentifikasi antibodi spesifik pada protein yang telah dipisahkan antara satu dengan yang lain menurut ukurannya melalui elektroforesis. Blot merupakan sebuah membran biasanya berupa nitrosellulose dan polivinilidine fluoride (PVDV). Pada penelitian ini blot yang digunakan adalah membran nitosellulose (NC).
5. SIMPULAN DAN SARAN
Simpulan
Berdasarkan penelitian yang telah dilakukan diperoleh kesimpulan hasil sebagai berikut:
1. Amplifikasi gen hifnα-2a dengan teknik PCR menggunakan sepasang primer F-IFN dan R-IFN sukses menghasilkan fragmen berukuran 500 bp. Gen hifnα-2a telah berhasil disubklon dalam vektor pPICZαB menghasilkan plasmid rekombinan pPICZαB-hifnα-2a dan ditentukan urutan nukleotidanya. 2. Protein hIFN-α2a hasil ekspresi pada P. pastoris berukuran sekitar 24,05 kDa
termasuk C-myc epitope dan 6x histidin.
Saran
DAFTAR PUSTAKA
Adolf GR, Kalsner I, Ahorn H, Maurer-Fogy I and Cantell K. 1991. Natural Human Interferon-α2 is O-glycosilated. J Biochem 276: 511-518.
Antonelli G. 2008. Biological basis for a proper clinical application of alpha interferons. New microbilogica. 31: 305-318.
Ausubel FM, Brent R, Kingston RE, Moore DD, Seidman JG, Smith JA, Struhl K. 1992. Short Protocols in Molecular Biology. Ed ke-2. New York: J Wiley.
[Biophoenix]. 2007. Biosimilars, Biogenerics and Follow-on Biologics.
www.scripreports.com [ 20 Maret 2012].
Butler.1987. Animal Cell technology : Principles and Products. Taylor & Francis. New York.
Byung-Kwon C, Piotr B, Robert CD, Stephan RH, David HK, Huijuan. L, Robert GM, Juergen HN, Stefan W, Tillman UG. 2003. Use of combinatorial genetic libraries to humanize N- linked glycosylation in the yeast Pichia pastoris. PNAS 100: 5022-5027.
Ceaglio N, Etcheverrigaray M, Conradt HS, Grammel N, Kratje R, Oggero M. 2010. Highly glycosylated Human alpha Interferon : An isight into a New Therapeutic Candidate. J. Biotech 146: 74-83.
Cregg JM, Cereghino L, Shi J, Higgins DR. 2000. Recombinant protein expression in Pichia pastoris. Biotechnol 11:905-910.
Cregg JM, Vedvick TS, Rascchke. 1993. Recent advances in the expression of foreign genes in Pichia pastoris. Bio/Technology 11: 905-910.
Cregg JM. 2007. Editor. Pichia protocol. Second edition. New Jersey
Emanuel SL and Pestka S.1993. Human Interferon-αA, -α2, and –α2 (Arg) Genes in genomic DNA. Biological Chemistry 17: 12565-12569.
Ferenci P. 1993. Historical treatment of Hepatitis B and C. Gut Suppl. S69-S73.
http://www.drugbank.ca/drugs/DB00034. Interferon Alfa-2a, Recombinant. Diakses 13 April 2012.
[Invitrogen]. EasySelectTM Pichia Expression Kit. 2001. A Manual Methods for Expression of recombinant proteins Using pPICZ and pPICZα in Pichia pastoris. Version G
Jonasch E dan Frank GH. 2001. IFN in Oncological Practice : Review of IFN Biology. Clinical Application and Toxicities. The Oncologist 6: 34-55.
Jusuf M. 2001. GENETIKA I. Struktur dan Ekspresi Gen. Jakarta. Sagung Seto.
Klaus W, Gsell B, Labhardt AM, Wipf B and Senn H. 1997. The Three-dimensional High Resolution Structure of Human Interferon α-2a Determined by Heteronuclear NMR Spectroscopy in solution. J. Mol. Biol 274: 661-675.
Kontsek P, Kontsekova E. 2002. Forty years of Interferon. Octa virologica 41: 349-353.
Kuby J. 1994. Immunology. Ed ke-2. New York. W.H. Freeman and Company.
Marilyn SH, Jennifer ML, Aaron DB, Alex L, dan Peter H. 2007. Interferon alpha Therapy for Hepatitis C : Treatment Completion and Response Rates among Patients with Substance use Disorders. BioMed Central 2:4
Meager A, editor. 2006. The Interferons. Characterization and Aplication. Germany:Wiley-VCH.
Morehead H, Johnston PD and Wetzel R. 1984. Roles of the 29-138 disulfide bond of subtype A of human alpha interferon in its antiviral activity and conformational stability.Biochemistry. 23(11)
Muladno. 2002. Seputar Teknologi Rekayasa Genetika. Bogor : Pustaka Wirausaha Muda.
Nur Azhar. 2008. Dasar-dasar Biologi molekuler. Bandung : widya Padjajaran.
Peters M. 1989. Mechanism of Interferons. Sem. Liver dis. 9 (4): 235.
Praseno MS, editor. 1991. Pengantar Kloning Gen. Yogyakarta. Yayasan Essentia Medica.
Rainer F, Jurgen D, Neil E, Ulrich C and Stephan H. 1999. Review Towards Molecular Farming in the Future : Pichia pastoris based production of single-chain antibody fragments. Biotechnol. Appl. Biochem 30: 117-120.
Roy RK, Shreekant MS, and Ranjana AD. 2005. The Effect of Heat Shock on Production of Recombinat Human Interferon Alpha 2a by Eschericia coli. Iranian Biomedical Journal 9 (4): 155-162.
Santoso A, Herawati N , and Rubiyana Y. 2012. The effect of methanol induction and incubation time on expression of human erythropoietin in methylotropic yeast pichia pastoris. MAKARA, Teknologi, 16(1): 7-12.
Sinha J, Plantz AB, Inan M and Meagher MM. 2004. Causes of Proteolytic Degradation of secreted Recombinat Proteins in Methylotrophic Yeast Pichia pastoris: case study with Recombinant ovine Interferon- . Biochemical Engineering. Published online 3 December 2004 in Wiley Interscience.
Sie L, Wang D, Chan W dan Cheng L. 2007. Efficient expression and Purification of human interferon alpha2b in the methylotrophic, Pichia pastoris. Protein Expression & Purification 54: 220-226.
Skoko N, Argamante B, Grujicic NK, Sergio GT, Vladimir G, Garon L. 2003. Expression and characterization of human Interferon- I in the methylotropic yeast Pichia pastoris. Biotechnol. Appl. Biochem 38: 257-265.
Stephe RH, Robert CD, Natarajan S, Juergen HN, Youwei J, Sandra R, Piotr B, Terrance A, Stadheim, Huijuan L, Byung KC, Daniel H, Harry W, Jessica R, Teressa M, Rendall RS, Jack H, Stefan W, Tillman. UG. 2006. Humanization of Yeast to Produce Glycoproteins. Science 313: 1441.
Thomas BR, Deynze AL, Bradford KJ. 2002. Production of Therapeutic Proteins in Plants. Agricultural Biotechnology in California series. Publication 8078. UC Peer Reviewed.
Thomas HC. 1988.Treatment of Hepatitis B viral Infection. Alan R. Liss, Inc. New York
Tschopp JF, Brust PF, Cregg JM, Stillman CA dan Gingeras TR. 1987. Expression of the LacZ gene from two methanol-regulated promoters in Pichia pastoris. Nucl. Acid Res (15) 9: 3859-3876.
Utama A. 2004. Interferon Sebagai Multidrug. Jawa Post, 12 Juni
Yurimoto H, Oku M, dan Sakai Y. 2011. Yeast Methylotrophy: Metabolism, Gene Regulation and Peroxisome Homeostasis. Review article. J microb.
Lampiran 3 Hasil Elektroforesis Vektor pPICZαB pada Gel Agarosa 1%
Gambar 14 Visualisasi vektor pPICZαB, (1 dan 2): pPICZαB tidak dipotong, (3): DNA ladder 1 Kb, (4 dan 5): pPICZαB dipotong Xho1 & Xba1
Lampiran 4 Hasil Pengukuran Konsentrasi Plasmid Rekombinan klon 6 dengan Nanofotometer
Klon 6 (ng/µl) 260/280
536 1,812 1800 1,823
Lampiran 6 Sekuens DNA hifn-α2
GenBank: JN848522.1
RIWAYAT HIDUP