i
MATRIKS TOPENG MASKER WAJAH
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi
Oleh : ELI FELASIH
106102003400
PROGRAM STUDI FARMASI
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
ii
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI BENAR-BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI
ATAU LEMBAGA PENDIDIKAN MANAPUN.
Jakarta, September 2010
Eli Felasih 106102003400
v
IRADIASI (HIDROGEL ) SEBAGAI MATRIKS TOPENG MASKER WAJAH
Salah satu pemanfaatan air kelapa adalah untuk pembuatan nata de coco atau selulosa
bakteri. Dengan modifikasi penambahan polivinil alkohol (PVA) akan diperoleh selulosa bakteri
– polivinil alkohol (PVA) yang dapat digunakan untuk keperluan medis khususnya dalam bidang
kosmetik. Penelitian dilakukan dengan menggunakan vitamin C yang digunakan sebagai model.
Hasil radiasi antara selulosa bakteri – polivinil alkohol (PVA) menghasilkan hidrogel yang
diperoleh dari proses pembentukan ikatan silang (
crosslinking
). Polivinil alkohol (PVA) yang
berupa polimer hidrofilik yang banyak digunakan karena bersifat tidak toksik, kemampuan
menyerap yang tinggi, dan tidak karsinogenik. Hasil uji dari ketebalan selulosa kering 0,028 mm,
absorpsi 238,773 %, kekuatan tarik 1137 kg/cm
2, elongasi 86,666 %, 89,655 % setelah diradiasi
dengan berkas elektron sedangkan selulosa bakteri basah mempunyai ketebalan 0,090 mm. Laju
pelepasan vitamin C ditentukan dengan alat uji difusi dalam medium aquabidest pH 7 pada suhu
37 ± 0,5
0C, kecepatan 50 rpm selama 1 jam. Hasil uji difusi menunjukkan bahwa profil
pelepasan matriks selulosa bakteri – pva + vitamin C mengikuti kinetika orde nol dengan
mekanisme difusi.
vi
ABSTRACT
UTILIZATION OF BACTERIAL CELLULOSE – PVA AFTER IRRADIATION
(HYDROGEL) AS A FACE MASK MATRIX
One of the utilization of coconut water is produce nata de coco or bacterial cellulose.
Modification by addition of polyvinyl alcohol will collected cellulose bacteria - PVA which it
can be used for medical purposes, especially in the cosmetics. Using the vitamin c as a model
was choosen this research. The results collect form of a matrix obtained from the process of
forming crosslinking (crosslinking) between bacterial cellulose and PVA in the form of
hydrophilic polymer that is widely used because harmless, the high ability to absorb, and not
carcinogenic. So it can be applied as a face mask matrix. Pva used with various concentration are
2%, 4%, and 6%. The test results characteristics of hydrogels include thickness of dry cellulose
0.028 mm, strengthent of PVA 6% about 238,773 %, strengthen is 1137 kg/cm
2, elongation
86.666%, gel fraction after irradiated with electron beam is 89.655% while the wet bacterial
cellulose has a thickness of 0.090 mm. Rate of vitamin c release is determined by test equipment
aquabidest diffusion in the medium pH 7 at 37 ± 0.5 0C, at 50 rpm for 1 hour. Diffusion test
results showed that the release profile of bacterial cellulose matrix - PVA + vitamin C followed
zero order kinetics with a diffusion mechanism rule.
vii
limpahan nikmat, rahmat dan ridho-Nya sehingga penyusunan skripsi ini dapat diselesaikan. Skripsi yang berjudul ‘‘Pemanfaatan Selulosa Bakteri – Polivinil alkohol (PVA) Hasil Iradiasi (Hidrogel) Sebagai Matriks Topeng Masker Wajah’’ ini disusun dalam rangka memenuhi persyaratan untuk memperoleh gelar Sarjana Sains pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan, UIN Syarif Hidayatullah Jakarta.
Selama penelitian dan penyusunan skripsi ini tidak terlepas dari bimbingan, bantuan dan dukungan dari berbagai pihak. Oleh karena itu, ucapan terima kasih dengan seikhlas hati dihanturkan kepada Bapak Dr. Darmawan Darwis, M. Sc,. Apt., selaku Pembimbing BATAN dan Ibu Yuni Anggraeni, S. Si, Apt., selaku pembimbing UIN Syarif Hidayatullah yang telah meluangkan waktu, perhatian dan tenaganya untuk memberikan bimbingan dan pengarahan selama penelitian dan penyusunan skripsi. Ucapan terima kasih juga disampaikan kepada:
1. Bapak Prof. Dr. dr. M.K Tadjudin, Sp. And, selaku Dekan Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta. 2. Bapak Drs. Muhammad Yanis Musdja, M. Sc,. Apt, selaku Ketua
Program studi Farmasi FKIK UIN Syarif Hidayatullah Jakarta dan dosen penguji I yang telah meluangkan waktu untuk memberikan arahan dan bimbingannya selama menyusun skripsi ini.
viii
peneliti dan pegawai Laboratorium Sterilisasi Bidang Proses Industri BATAN, Jakarta yang telah memberikan dukungan dan bantuan selama penelitian berlangsung.
5. Untuk kedua orang tua tercinta, ibunda Hj. Muhibah dan ayahanda H. Puryanto, kakak, saudara – saudara ku tersayang atas doa, cinta dan kasih sayang, kesabaran, dan dukungan baik moril maupun materil. Semoga Allah SWT selalu melindungi.
6. Teman-teman farmasi 2006 dan teman terdekat ku (pipit, acit, gita, alfi, hana, icha, yunita, nindi, reni, eka w, syifa) atas dukungan selama kuliah.
7. Teman-teman 11 pejuang (Irma, rico, landing, amal, Sheila, lisna, yayah, tiwi, ardian, hilda).
8. Semua pihak yang tidak dapat disebutkan satu persatu yang turut membantu menyelesaikan skripsi ini.
Akhirnya penulis sebagai manusia biasa menyadari dan merasa bahwa skripsi ini masih jauh dari sempurna, karena itu penulis pun terbuka terhadap kritik dan saran yang sifatnya membangun. Meskipun demikian penulis berharap semoga hasil penelitian ini dapat berguna untuk pihak-pihak lain yang memerlukan.
Jakarta, September 2010
ix
Halaman
COVER...i
LEMBAR PERNYATAAN...ii
LEMBAR PERSETUJUAN...iii
LEMBAR PENGESAHAN SKRIPSI...iv
ABSTRAK...v
ABSTRACT...vi
KATA PENGANTAR...vii
DAFTAR ISI...ix
DAFTAR TABEL...xii
DAFTAR GAMBAR...xiii
DAFTAR LAMPIRAN...xv
BAB I PENDAHULUAN 1.1 Latar Belakang...1
1.2 Perumusan Masalah... 4
1.3 Hipotesis...4
1.4 Tujuan Penelitian...5
1.5 Manfaat Penelitian...5
BAB II TINJAUAN PUSTAKA 2.1 Kelapa...6
2.1.1 Deskripsi Kelapa...6
2.1.2 Penyebaran Kelapa... 7
2.1.3 Kandungan Nutrisi dan Manfaat Kelapa...8
2.2 Sukrosa...12
2.3 Amonium Sulfat ...12
2.4 Selulosa Bakteri... ...13
2.4.1 Struktur Selulosa Bakteri...14
2.4.2 Aplikasi Selulosa Bakteri...15
2.4.3 Sumber Selulosa...20
2.4.4 Pelikel Selulosa Bakteri...21
2.4.5 Pembuatan Pelikel Selulosa...22
2.5 Acetobacter Xylinum... ...24
2.5.1 Deskripsi A.Xylinum...24
2.5.2 Tingkat Bahaya A.Xylinum...25
2.5.3 Pertumbuhan Bakteri A.Xylinum... ...26
2.6 Hidrogel...27
2.6.1 Sintesis Hidrogel...29
2.6.2 Sifat Fisika – Kimia Hidrogel ...32
x
2.9 Polivinil Alkohol...38
3.0 Asam Askorbat...39
3.1 Radiasi...39
3.1.1 Sumber Radiasi...40
3.1.2 Dosis Radiasi... ...43
3.1.3 Efek Radiasi pada Polimer... 44
3.1.4 Keunggulan menggunakan Mesin Berkas Elektron.. ...45
3.2 Radiofarmasi...46
B III KERANGKA KONSEP 3.1 Alur Penelitian... ...51
BAB IV METODOLOGI PENELITIAN 4.1 Tempat dan Waktu Penelitian...52
4.2 Alat dan Bahan Penelitian...52
4.2.1 Alat Penelitian... ... 52
4.2.2 Bahan Penelitian...52
4.3 Prosedur Penelitian... 53
4.3.1 Pengumpulan Tanaman... ...53
4.3.2 Pembuatan Starter... ...53
4.3.3 Pengembangan Starter A.Xylinum...53
4.3.4 Pembuatan Membran Selulosa Bakteri...55
4.3.5 Pembuatan Larutan Polivinil alkohol... ...60
4.3.6 Optimasi Waktu Perendaman Membran Selulosa – PVA.60 4.3.7 Pembuatan Membran Selulosa Bakteri – PVA...61
4.3.8 Pembuatan Membran Selulosa Bakteri – PVA + Vit.C....61
4.3.9 Karakterisasi Membran Selulosa – PVA Sebelum dan Sesudah Radiasi……….61
4.4 Analisa Data………...…67
BAB V HASIL PENELITIAN DAN PEMBAHASAN 5.1 Hasil Penelitian...68
5.1.1 Pengumpulan...68
5.1.2 Hasil Uji Tebal Membran Selulosa Basah dan Kering Sebelum Radiasi ...68
5.1.3 Hasil Optimasi Waktu Perendaman Membran Selulosa Bakteri – PVA... ...68
5.1.4 Hasil Uji Sifat Mekanik Membran Selulosa Bakteri – PVA Sebelum dan Sesudah Radiasi...69
5.1.5 Hasil Uji Gel Fraksi Membran Selulosa Bakteri – PVA Sesudah Radiasi...72
5.1.6 Penentuan Panjang Gelombang Maksimum Vitamin C...73
5.1.7 Pembuatan Kurva Kalibrasi Vitamin C...73
xi
5.2.3 Hasil Uji Daya Absorpsi Membran Selulosa Bakteri –
PVA...78
5.2.4 Hasil Uji Kekuatan Tarik Hidrogel (Selulosa Bakteri – PVA Hasil Iradiasi)... .78
5.2.5 Hasil Uji Gel Fraksi (Selulosa Bakteri – PVA Hasil Iradiasi)... 80
5.2.6 Uji Penetrasi Vitamin C (Selulosa Bakteri – PVA 2 %, 4 %, 6 %)... ...80
5.2.7 Data Hasil ANNOVA... ...82
BAB VI KESIMPULAN DAN SARAN 6.1 Kesimpulan... 84
6.2 Saran...85
DAFTAR PUSTAKA...86
xii
Halaman Tabel 1 Hasil Uji Tebal Membran Selulosa Basah dan Kering Sebelum
Radiasi...11
Tabel 2 Hasil Optimasi Waktu Perendaman Membran Selulosa Bakteri – PVA ...19
Tabel 3 Hasil Uji Sifat Mekanik Membran Selulosa Bakteri – PVA ...44
Tabel 4 Hasil Uji Gel Fraksi Membran Selulosa Bakteri – PVA Sesudah Radiasi...68
Tabel 5 Penentuan Panjang Gelombang Maksimum Vitamin C...69
Tabel 6 Pembuatan Kurva Kalibrasi Vitamin C...70
[image:10.612.114.502.124.541.2]xiii
[image:11.612.115.503.121.547.2]Halaman
Gambar 1 Polivinil alkohol...7
Gambar 2 Air Kelapa...12
Gambar 3 Biakan Acetobacter xylinum...14
Gambar 4 Amonium...15
Gambar 5 Nata de coco...17
Gambar 6 Asam Askorbat...25
Gambar 7 Alat Mikrometer...38
Gambar 8 Alat Pemotong Sampel...39
Gambar 9 Alat Difusi...43
Gambar 10 Alat Tensiometer...45
xiv
Halaman Lampiran 1 Gambar Bahan, alat Penelitian, SEM Selulosa Bakteri…....90 Lampiran 2 Hasil Tebal Membran Selulosa Bakteri ...93 Lampiran 3 Tabel Hasil Optimasi Waktu Perendaman Membran
Selulosa Bakteri dengan PVA 2 %, 4 %, 6 %...95 Lampiran 4 Hasil Elongasi Membran Selulosa Bakteri – PVA 2 % Tanpa Radiasi………... …………..…95 Lampiran 5 Hasil Elongasi Membran Selulosa Bakteri – PVA 4 % Tanpa Radiasi...……... …………..…95 Lampiran 6 Hasil Elongasi Membran Selulosa Bakteri – PVA 6 % Tanpa Radiasi...95 Lampiran 7 Hasil Elongasi Membran Selulosa Bakteri – PVA 2 %
Setelah Radiasi...95 Lampiran 8 Hasil Elongasi Membran Selulosa Bakteri – PVA 4 %
Setelah Radiasi... ...96 Lampiran 9 Hasil Elongasi Membran Selulosa Bakteri – PVA 6 %
Setelah Radiasi... ………...…...96 Lampiran 10 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 2 %
Tanpa Radiasi...96 Lampiran 11 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 4 %
Tanpa Radiasi...96 Lampiran 12 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 6 %
Tanpa Radiasi...97 Lampiran 13 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 2 %
Setelah Radiasi...97 Lampiran 14 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 4 %
Setelah Radiasi...97 Lampiran 15 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 6 %
Setelah Radiasi...97 Lampiran 16 Hasil Elongasi Membran Selulosa Bakteri – PVA 2 % +
Vit.C Tanpa Radiasi...98 Lampiran 17 Hasil Elongasi Membran Selulosa Bakteri – PVA 4 % +
Vit.C Tanpa Radiasi...98 Lampiran 18 Hasil Elongasi Membran Selulosa Bakteri – PVA 6 % +
Vit.C Tanpa Radiasi...98 Lampiran 19 Hasil Elongasi Membran Selulosa Bakteri – PVA 2 % +
Vit.C Setelah Radiasi...98 Lampiran 20 Hasil Elongasi Membran Selulosa Bakteri – PVA 4 % +
Vit.C Setelah Radiasi... ...99 Lampiran 21 Hasil Elongasi Membran Selulosa Bakteri – PVA 6 % +
xv
+ Vit.C Tanpa Radiasi...100
Lampiran 25 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 2 % + Vit.C Setelah Radiasi...100
Lampiran 26 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 4 % + Vit.C Setelah Radiasi...100
Lampiran 27 Hasil Kekuatan Tarik Membran Selulosa Bakteri – PVA 6 % + Vit.C Setelah Radiasi...100
Lampiran 28 Hasil Gel Fraksi Membran Selulosa Bakteri – PVA 2 %, 4 %, 6 %...101
Lampiran 29 Hasil Gel Fraksi Membran Selulosa Bakteri – PVA 2 %, 4 %, 6 % + Vit.C ...101
Lampiran 30 Penentuan Panjang Gelombang Vit.C...102
Lampiran 31 Kurva Kalibrasi Vit.C... ...104
Lampiran 32 Pelepasan Difusi Vit.C... ...105
Lampiran 33 Hasil Statistik Elongasi PVA dan PVA +Vit C Sebelum dan Sesudah Radiasi………..106
Lampiran 34. Hasil Statistik Daya Tarik PVA dan PVA +Vit C Sebelum dan Sesudah Radiasi………...114
1 1.1 LATAR BELAKANG
Selulosa merupakan bahan/materi yang sangat berlimpah di bumi ini. Diperkirakan 1 triliun ton selulosa telah diproduksi tiap tahunnya. Selulosa yang dihasilkan digunakan untuk membuat perabot kayu, tekstil, kertas, kapas serap/bahan penyerap pada popok ataupun pembalut wanita, dan juga dalam berbagai bidang seperti pertambangan, kedokteran, obat-obatan, kosmetik dan lain-lain (Soetrisno T, 1996). Sumber utama selulosa terdapat dalam tumbuh-tumbuhan terutama pada kayu dan kapas. Saat ini selulosa dapat juga dihasilkan dari proses fermentasi Acetobacter xylinum menggunakan media air kelapa sebagai sumber mikronutrien yang disebut selulosa bakteri.
Acetobacter xylinum merupakan bakteri golongan asam asetat yang
berbentuk batang pendek, bersifat non motil, obligat aerobik dan dengan pewarnaan gram menunjukkan gram negatif. Bakteri ini akan membentuk
nata de coco (pelikel selulosa bakteri) jika ditumbuhkan dalam air kelapa
yang kaya akan sumber karbon dan nitrogen melalui proses yang terkontrol. Bakteri tersebut akan menghasilkan enzim ekstraselular yang dapat menyusun zat gula menjadi ribuan rantai serat atau selulosa (Siahaan,dkk, 2003).
alternatif bahan baku yang mudah diperoleh. Selulosa bakteri juga mempunyai potensi yang cukup besar untuk dikembangkan menjadi suatu produk yang berkualitas serta dapat diaplikasikan secara luas, seperti dalam industri pembuatan kertas, biomaterial, bahan penyerap (pembalut dan popok), dan juga membran penyaring (Taufan,dkk, 1996). Penggunaan selulosa bakteri juga dapat memberikan nilai tambah karena memanfaatkan air kelapa yang selama ini menjadi limbah.
Air kelapa merupakan limbah yang biasanya berasal dari industri pengolahan kelapa seperti industri kelapa kopra, pembuatan minyak goreng, santan, ataupun kelapa yang dijual di pasar. Air kelapa yang digunakan dalam pembuatan nata de coco harus berasal dari kelapa yang masak optimal tidak terlalu tua atau terlalu muda (berumur ±6 bulan). Air kelapa mengandung beberapa vitamin seperti vitamin C 0,7 – 1,7 mg/100 mg dan vitamin B kompleks yang terdiri dari asam nikotinat 0,4 g/ml, asam pantotenat 0,52 g/ml, biotin 0,02 g/ml, riboflavin 0,01 g/ml, asam folat 0,03 g/ml, thiamin dan juga piridoksin, yang berperan sebagai sumber mikronutrien yang mendukung proses fermentasi selain dari bahan utama yaitu sukrosa sebagai sumber karbon dan ammonium sulfat sebagai sumber nitrogen (Warisno, 2004).
dari iradiasi EBM (mesin berkas elektron) yaitu terjadinya crosslinking (pembentukan ikatan silang) yang mengakibatkan suatu polimer mempunyai sifat viskositas bertambah, berat molekul bertambah dan sifat mekanik bertambah. Sedangkan kerugian dari iradiasi EBM (mesin berkas elektron) yaitu terjadinya degradasi (pemutusan rantai polimer) yang mengakibatkan suatu polimer mempunyai sifat viskositas berkurang, bobot molekul berkurang, dan sifat mekanik berkurang. Dosis iradiasi untuk sterilisasi biomaterial umumnya 25-50 kGy (Darmawan, 2008). Dalam Farmakope Indonesia Edisi IV disebutkan bahwa dosis sterilisasi yang digunakan untuk produk kesehatan adalah 25 kGy (Darmawan, 2002).
Selama bertahun-tahun pemilihan dosis 25 kGy ini sangatlah aman, sederhana dan mudah. Beberapa peneliti melaporkan bahwa pada bahan-bahan yang sebagian besar mengandung selulosa bila diiradiasi akan terjadi reaksi degradasi atau perubahan ikatan silang. Reaksi degradasi dan ikatan silang saling berkompetisi dan umumnya ikatan silang terjadi pada dosis rendah yaitu 10-30 kGy, sedang degradasi terjadi pada dosis di atas 30 kGy (Erizal,dkk, 2008). Energi radiasi pengion dapat menginduksi reaksi kimia pada bahan yang diiradiasi. Selain terjadi perubahan kimia ternyata reaksi kimia dapat juga menimbulkan perubahan sifat fisika dan biologi (Mirzan,dkk, 1993).
seperti polivinil alkohol (PVA) yang mempunyai sifat fisik yang baik, tidak toksik, dan mempunyai kemampuan menyerap air yang relatif tinggi. Sifat fisik hidrogel yang terpenting adalah kemampuan hidrogel dalam menyerap dan menyimpan air dalam jumlah besar.
Hal inilah yang melatarbelakangi dilakukannya pemanfaatan selulosa bakteri – polivinil alkohol (pva) hasil iradiasi (hidrogel) sebagai matriks topeng masker wajah yang menggunakan model asam askorbat (vitamin C) sebagai antioksidan.
I.2 Perumusan Masalah
1. Bagaimana sifat dan karakteristik dari selulosa bakteri – polivinil alkohol (PVA) hasil iradiasi (hidrogel) yang digunakan sebagai matriks topeng masker wajah?
2. Berapakah konsentrasi polivinil alkohol (PVA) yang optimal untuk memperbaiki karakteristik dan sifat mekanik selulosa bakteri – polivinil alkohol (PVA) hasil iradiasi (hidrogel) sebagai matriks topeng masker wajah?
3. Apakah selulosa bakteri – polivinil alkohol (PVA) hasil iradiasi (hidrogel) dapat digunakan sebagai matriks topeng masker wajah?
I.3 Hipotesis
I.4 Tujuan Penelitian
1. Menghasilkan selulosa bakteri – polivinil alkohol (PVA) hasil iradiasi (hidrogel) yang dapat digunakan sebagai matriks topeng masker wajah dari bahan alam Indonesis yang mudah diperoleh.
2. Menentukan konsentrasi polivinil alkohol (PVA) yang memberikan karakteristik dan sifat mekanik sebagai matriks topeng masker wajah.
I.5 Manfaat Penelitian
6 2.1 Kelapa (Cocos nucifera)
2.1.1 Deskripsi Kelapa
Kelapa lahir dengan batang yang tidak bercabang, dengan lingkar tumbuh tunggal. Tinggi tanaman ini dapat mencapai 20 sampai 22 m pada umur 40 tahun dan pada umur 80 tahun tinggi tanaman dapat mencapai 35-40 m. Bunga dari kelapa merupakan polygamomonoecious, dimana bunga diproduksi secara terus menerus dan bunga ini kemudian memproduksi biji. Daunnya memiliki panjang 4 - 6 m, pada pohon yang tinggi bisa menghasilkan 12 - 18 daun tiap tahunnya, sedangkan pada pohon yang pendek bisa menghasilkan 20 - 22 daun (Chan, et al, 2006).
Buah dari kelapa berserabut, dimana bagian terluar hingga kedalam berturut-turut adalah kulit terluar keras dan tipis disebut dengan eksokarp, bagian tengah yang berserat disebut dengan mesokarp, bagian dalam yang keras disebut endocarp, bagian dalam yang melekat dengan endocarp disebut dengan testa dengan bagian dalam yang putih (daging) disebut dengan endosperm ( Slusarska, et al, 2008). Dan rongga yang dipenuhi dengan cairan (air)(Chan, et al, 2006).
saat yang bersamaan endosperm menjadi tebal dan keras dan air kelapa menjadi agak pahit.
[image:22.612.115.509.113.657.2](a) (b)
Gambar 1. Bagian buah kelapa
Keterangan :
(a) Bagian buah kelapa
(b) Buah kelapa yang sudah matang
2.1.2 Penyebaran kelapa(Chan, et al, 2006)
Pada awalnya penyebaran kelapa diketahui merupakan tanaman asli di daerah pantai asia tenggara (Malaysia, Indonesia dan Filipina) serta Melanesia. Perkembangan saat ini ternyata kelapa banyak ditemukan di daerah tropis dan daerah subtropics (23o lintang utara dan selatan daerah ekuatorial). Manfaatnya yang banyak bagi perekonomian dan kehidupan manusia, sekarang kelapa memiliki penyebaran yang cukup luas dengan varietas yang berbeda-beda. Adapun beberapa daerah penyebarannya adalah sebagai berikut :
- Asia tenggara : Burma, Indonesia, Malaysia, Filipina, Singapura, Thailand, Vietnam.
- Afrika : Kamerun, Ghana, Kenya, Nigeria, Tanzania.
- Amerika : Brazil, Ekuador, Jamaika, Mexico, Trinidad dan Tobago, Venezuela.
tinggi untuk pertumbuhan optimumnya yaitu 70% - 80% sehingga tanaman ini jarang ditemukan pada daerah dengan kelembapan yang rendah seperti daerah mediterania, meskipun memiliki temperatur yang cukup tinggi (umumnya 24oC). Selain itu tanaman ini memiliki toleransi terhadap salinitas yang tinggi.
Berikut adalah klasifikasi dari kelapa : Kingdom : Plantae
Divisi : Magnoliophyta Kelas : Liliopsida Ordo : Arecales Famili : Arecaceae Subfamili : Arecoideae Genus : Cocos
Spesies : Cocos nucifera
2.1.3 Kandungan nutrisi dan manfaat kelapa
atau berbagai bentuk hiasan yang sangat menarik. Cairan manis yang keluar dari tangkai bunga, disebut (air) nira atau legèn (bhs. Jawa), dapat diminum sebagai penyegar atau difermentasi menjadi tuak (Wahyudi, 2003).
Kelapa selain bermanfaat sebagai kuliner dan berbagai kerajinan, juga dapat dimanfaatkan dalam bidang pengobatan. Kelapa dalam pengobatan tradisional telah digunakan untuk mengobati berbagai masalah kesehatan seperti abses, asma, demam, flu, sakit pra menstruasi, konstipasi, luka bakar malnutrisi dan sebagainya. Pada pengobatan modern kelapa juga telah dimanfaatkan diantaranya:
- Memberikan sumber energi
- Membantu mengurangi osteoporosis - Mengurangi inflamasi
- Membantu memberikan perlindungan penyakit periodontal dan kebusukan gigi
- Membantu melindungi kulit dari kerutan wajah
- Diaplikasikan secara topical sebagai kimia barrier pada kulit untuk mencegah infeksi
Salah satu bagian kelapa yaitu air kelapa diketahui memiliki manfaat untuk pengobatan diare dan minuman penambah energi untuk orang yang sakit dan orang tua. Selain itu dalam bidang biomaterial air kelapa dimanfaatkan untuk menghasilkan selulosa bakteri (bacterial cellulose) dengan bantuan bakteri Acetobacter xylinum.
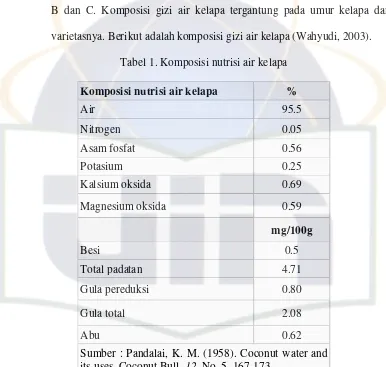
inilah yang menyebabkan air kelapa muda terasa lebih manis dibandingkan air kelapa tua. Kandungan zat gizinya yang kaya dan relatif lengkap, sehingga sesuai untuk pertumbuhan mikroba. Komposisi air kelapa antara lain karbohidrat (sukrosa, glukosa, fruktosa dan sorbitol) mineral (K, Na, Mg, P, Cl, Fe dan Cu), protein (asam–asam amino essencial) dan vitamin B dan C. Komposisi gizi air kelapa tergantung pada umur kelapa dan varietasnya. Berikut adalah komposisi gizi air kelapa(Wahyudi, 2003).
Tabel 1. Komposisi nutrisi air kelapa Komposisi nutrisi air kelapa %
Air 95.5
Nitrogen 0.05
Asam fosfat 0.56
Potasium 0.25
Kalsium oksida 0.69
Magnesium oksida 0.59
mg/100g
Besi 0.5
Total padatan 4.71
Gula pereduksi 0.80
Gula total 2.08
Abu 0.62
Sumber : Pandalai, K. M. (1958). Coconut water and its uses. Coconut Bull. 12, No. 5, 167-173.
2.2 Sukrosa
[image:27.612.115.505.129.524.2]Sukrosa atau sakarosa atau yang dikenal dengan sebutan gula pasir dibuat dari gula tebu atau gula bit melalui proses penyulingan dan kristalisasi. Sukrosa juga terdapat dalam buah, sayuran dan madu (Almaitser, 2001). Struktur kimia dari sukrosa adalah
Gambar 2. Struktur sukrosa
Sukrosa memberikan rasa manis yang baik. Sukrosa merupakan kristal yang tidak berwarna atau berwarna putih, berbentuk kotak-kotak, tidak berbau, dan memiliki rasa yang manis.
Sukrosa pada pembuatan pelikel selulosa bakteri berfungsi sebagai media yang membantu pertumbuhan bakteri Acetobacter xylinum. Penggunaan sukrosa yang berwarna agak gelap menyebabkan warna kocoklatan yang tidak disukai pada pelikel selulosa yang dihasilkan (Collado, 1986). Oleh karena itu, pada pembuatan pelikel selulosa bakteri sebaiknya digunakan sukrosa berwarna putih.
2.3 Amonium Sulfat
akan menyerap air bila kelembaban nisbi 80% pada 300C (Hardjowigono, 1987).
Menurut Considine (1984) ammonium sulfat dapat dihasilkan melalui dua proses reaksi kimia. Pertama adalah mencampur ammonia dengan asam sulfat. Reaksi yang terjadi adalah sebagai berikut :
2NH3 + H2SO4 (NH4)2SO4 ammonia asam sulfat ammonium sulfat
Kedua adalah dengan mencampur ammonium karbonat dengan gypsum (CaSO4) sehingga terjadi reaksi sebagai berikut :
(NH4)2CO3 + CaSO4 (NH4)2SO4 + CaCO3 ammonium karbonat kalsium sulfat ammonium sulfat kalsium karbonat
Ammonium sulfat merupakan sumber nitrogen bagi tanaman yang paling banyak digunakan di Indonesia sebagai pupuk. Amonium sulfat dapat pula digunakan sebagai sumber nitrogen untuk membantu pertumbuhan Acetobacter xylinum pada proses pembuatan pelikel selulosa bakteri (Steinkraus et al, 1983).
2.4 Selulosa Bakteri
Selulosa merupakan biopolimer terbesar, yang diketahui sebagai komponen utama biomassa tanaman, dan juga diwakili oleh polimer ektraseluler mikrobial. Selulosa bakteri termasuk produk spesifik dari metabolisme primer yang sebagian besar sebagai lapisan pelindung sedangkan selulosa tanaman sebagai pembentuk struktur tumbuhan.
banyak menghasilkan selulosa adalah bakteri Gram negatif, bakteri asam asetat dan Acetobacter xylinum. diantara berbagai jenis bakteri tersebut A.
xylinum adalah jenis bakteri yang paling banyak digunakan sebagai model
untuk studi megenai selulosa. Studi biasanya difokuskan pada mekanisme sintesis biopolimer, strukturnya dan karakteristiknya.
Karakteristik penting dari selulosa bakteri adalah kemurniannya. Hal ini yang membedakan dengan selulosa dari tumbuhan, dimana selulosa tumbuhan mengandung hemiselulosa dan lignin yang sangat sulit untuk dihilangkan. Karakteristik dari selulosa bakteri yang unik, banyak diaplikasikan secara luas pada industri kertas, tekstil makanan dan sebagai biomaterial untuk kosmetik dan alat kesehatan.
2.4.1 Struktur selulosa bakteri(Bielecki, et al, 2005)
[image:29.612.111.509.145.583.2]Selulosa bakteri adalah polimer tidak bercabang, yang dihubungkan dengan β-1,4 glukosida. Penelitian selulosa bakteri menunjukkan bahwa secara kimia identik dengan selulosa tanaman, tetapi secara struktur makromolekular karakteristiknya berbeda dengan selulosa tanaman.
Gambar 3. Struktur kimia selulosa
Membentuk suatu bundles dan akhirnya terbentuk seperti pita (ribbon). Berikut adalah gambar struktur dari selulosa bakteri (Bielecki, et al, 2005).
[image:30.612.113.508.131.516.2](a) (b)
Gambar 4. Perbedaan struktur antara selulosa bakteri dengan tumbuhan
Keterangan : (a). selulosa tumbuhan (b). selulosa bakteri
Selulosa bakteri juga berbeda dengan selulosa tumbuhan dari segi index kristalinnya dan derajat polimerisasi. Derajat polimerisasi selulosa baktei dapat mencapai 2000 dan 6000 dan dalam suatu kasus dapat mencapai 16000 atau 20000, sedangkan selulosa tumbuhan memiliki rata-rata derajat polimerisasi 13000 sampai 14000(Bielecki, et al., 2005).
Beberapa kelebihan dari selulosa bakteri adalah memiliki struktur yang teratur, tidak mengandung lignin dan hemiselulosa, memiliki serat yang panjang (lebih kuat), dapat ditumbuhkan pada berbagai wadah. Sedangkan beberapa kelemahan bakteri selulosa untuk pengembangan komersil adalah, biaya cukup tinggi dibandingkan selulosa tumbuhan karena harga yang mahal subtrat yang digunakan (gula), hasil akhir yang sedikit, keterbatasan kapasitas untuk produksi dalam skala besar.
2.4.2 Aplikasi selulosa bakteri
murni, elastik, mampu mempertahankan air, dan memiliki kristalin index yang tinggi. Berikut beberapa aplikasi dari selulosa bakteri adalah :
a. Aplikasi teknik
Dibandingkan dengan selulosa tanaman, selulosa bakteri memiliki kekuatan tarik (Tensile strength) yang lebih tinggi, sehingga selulosa bakteri merupakan komponen yang baik untuk kertas karena memiliki karakteristik mekanik yang baik. Selulosa bakteri untuk diaplikasikan sebagai kertas akan memberikan elastisitas, permeabel terhadap udara, tahan terhadap air dan tekanan berat dan mampu mengikat air (Iguch, 2000).
Selulosa bakteri juga digunakan sebagai pelindung permukaan untuk beberapa kertas. Coating terhadap kertas akan memberikan karakteristik seperti permukaan yang mengkilap, cerah, halus, memiliki porositas, daya penerimaan terhadap tinta dan memiliki kekuatan tarik yang tinggi. Selain itu penambahan selulosa bakteri pada kertas akan meningkatkan masa simpan kertas.
Selulosa bakteri juga merupakan komponen yang berharga pada kertas, karena meningkatkan ketahanan terhadap panas dan tidak mudah terbakar. Penggunaan selulosa bakteri dapat mengurangi bahan tambahan pada pembuatan kertas tanpa menimbulkan efek pada karakteristik kertas.
b. Aplikasi dalam bidang medik
selulosa bakteri terintegrasi dengan baik pada host-nya dan tidak menimbulkan reaksi inflamasi sehingga potensial dikembangkan sebagai
scaffold(Suwannapinunt, 2007).
[image:32.612.111.506.249.510.2]Selulosa bakteri mempunyai sifat-sifat seperti berpori, elastis, mudah untuk disimpan, mampu mengabsorbsi, memiliki kelembapan dapat diaplikasikan untuk pembalut luka. Dengan kelebihannya tersebut dapat mempercepat proses penyembuhan luka dan melindungi luka dari infeksi sekunder. Gambar berikut adalah aplikasi selulosa bakteri sebagai pembalut luka.
Gambar 5. Pelikel bakteri sebagai pembalut luka
BioFill® diperoleh dari produk selulosa mikroba yang telah digunakan
sebagai pengobatan beberapa luka bakar, grafting kulit, dan ulser kulit kronik. Pengobatan dengan menggunakan BioFill® menutupi rasa sakit, dan mempunyai keuntungan adhesi yang baik, barrier yang efektif untuk infeksi, penyembuhan cepat, retensi cairan yang baik (air dan elektrolit), biaya murah, dan waktu penyembuhan pendek dibandingkan secara normal. Produk lainnya yaitu Gengiflex®, diaplikasikan untuk proses penyembuhan dalam kasus periodontal.
bakteri yang elastis, permeabel terhadap udara dan cairan, memiliki kekuatan tarik yang tinggi dapat dimanfaatkan untuk aplikasi tersebut (Bielecki, 2005).
c. Aplikasi dalam bidang makanan
selulosa bakteri memiliki kemurnian secara kimia dan tidak menimbulkan reaksi metabolit sehingga banyak diaplikasikan sebagai stabilizer dalam makanan, emulsifier pada minuman dan sup, dan modifikasi tekstur dan meningkatkan serat makanan. Aplikasi pertama kali dalam bidang makanan adalah dihasilkannya nata de coco komersial. Konsumsi nata diyakini dapat melindungi dari kanker usus, atherosklerosis dan thrombosis pada jantung dan mencegah peningkatan glukosa pada urin.
Salah satu produk makanan popular yang mengandung selulosa bakteri adalah kombucha dari Cina. Makanan ini diperoleh dengan cara menumbuhkan kapang dan bakteri asam asetat pada teh dan ekstrak gula. Pelikel akan terbentuk pada permukaan dimana banyak mengandung selulosa dan enzim yang baik untuk kesehatan. Aktivitas abiotiknya adalah memperluas permukaan usus besar dan saluran pencernaan, selain itu
kombucha diyakini dapat melindungi terhadap kanker(Iguchi, 2000).
d. Aplikasi lainnya(Bielecki, 2005)
Besarnya luas permukaan, daya tahan yang tinggi dan memiliki daya absorpsi yang tinggi dapat digunakan dalam modifikasi proses kimia maupun fisika, seperti selulosa bakteri dapat dimanfaatkan imobilisasi biokatalis. Gel selulosa yang mengandung sel hewan imobilisasi digunakan untuk produksi interferon, interleukin dan antibodi monoklonal. Selulosa bakteri juga dimanfaatkan sebagai absorpsi sel Gluconobacter
oxydans, Acetobacter methanolyticus, Saccharomyces cerevisiae.
[image:34.612.112.520.119.703.2]Imobilisasi strain bakteri ini efektif untuk produksi glukonat, dihidroksi aseton dan etanol. Selulosa bakteri murni dapat dimanfaatkan sebagai bahan mentah sintesis selulosa asetat, nitroselulosa, CM-selulosa, hidroksimetilselulosa, metilselulosa dan hidroksiselulosa. Tabel berikut menunjukkan beberapa aplikasi selulosa bakteri pada beberapa bidang.
Tabel 2. Aplikasi selulosa bakteri pada berbagai bidang
Sektor Aplikasi
Kosmetik Penstabil dan pengemulsi pada krim, tonik dan pelembab kuku, sebagai bahan pengkilap dan sebagai bahan kuku buatan
Industri tekstil Bahan kulit buatan dan tekstil, Bahan pengabsorsi
Olahraga Untuk baju olahraga, tenda, dan
perlengkapan kemah Pertambangan
danpengolahan limbah
Untuk pengambilan batu karang, Absorbsi senyawa toksik, Daur ulang mineral dan minyak
Pemurnian Untuk pemurnian air dan pemurnian udara kota
Broadcasting Produksi diafragma untuk mikrofon dan
headphone
Kehutanan Multilapis untuk plywood
Industri mesin Untuk badan mobil, elemen pesawat, penutup retakan pada pelindung roket, Laboratorium/penelitian Imobilisasi protein, kromatografi dan
komponen media untuk kultur jaringan Kesehatan Kulit buatan sementara untuk terapi
luka bakar, dan penyakit periodontal 2.4.3 Sumber selulosa
1. Kayu
Kayu digunakan secara luas sebagai bahan selulosa. Komponen kimia dari kayu berbeda antar spesies dan juga dengan bagian tanaman, tetapi sebagian besar mengandung 40 - 50% selulosa, 20 - 30% lignin, dan 10 - 30% hemiselulosa dan polisakarida lainnya. Komponen lain juga ditemukan dalam jumlah yang kecil, seperti resin, gums, protein, dan mineral. Sebagai sumber serat selulosa, kayu merupakan bahan baku utama untuk menghasilkan pulp di mana dapat diproses untuk pembuatan kertas dan turunan selulosa seperti rayon, nitroselulosa, CMC, dan lainnya. 2. Serat bibit
Seluruh tanaman kapas juga terdiri dari bahan-bahan selulosa dan dapat dimanfaatkan sebagai pulp. Serat kapuk juga merupakan bahan selulosa yang mengandung 55 - 65% selulosa tetapi tidak digunakan sebagai sumber selulosa untuk pulp. Bahan ini biasanya digunakan untuk bahan pengisi.
3. Serat bast
Serat goni juga mengandung selulosa yang tinggi. Goni biasanya digunakan untuk tali dan karung. Tanaman yang menghasilkan goni antara lain dikenal dengan nama kenaf (Hibiscus cannabinus) dan roselle
(Hibiscus sabdariffa) . Kenaf dan roselle mengandung 70 - 90% selulosa
yang sesuai untuk memproduksi pulp dan kertas untuk kebutuhan khusus. 4. Serat daun
Ada banyak jumlah serat daun tetapi kegunaannya sangat terbatas. Beberapa di antaranya digunakan untuk tali-temali, tekstil, dan kertas. Yang termasuk dalam kelompok ini antara lain rami abaca dan manila, pisang, nanas, dan lainnya.
5. Selulosa non- tanaman
Selulosa juga ditemukan dalam mineral dari sumber tanaman, seperti fossil kayu, dan beberapa tipe batu bara muda.
2.4.4 Pelikel selulosa bakteri
Studi pertama tentang formasi dari selulosa dalam bakteri dilaporkan oleh Adrian Brown pada tahun 1886. Dalam eksperimen diketahui bahwa
Acetobacter xylinum adalah organisme yang bertanggung jawab untuk
membentuk lapisan selulosa.
bakteri yang dibuat dengan kultur statik mengandung 1% selulosa dari bobot kering (Brown, 1961).
Kekuatan mekanik yang baik dari pelikel selulosa bakteri dihasilkan dari ikatan hidrogen intermolekular yang ekstensif. Hal ini diinvestigasi pertama kali oleh Yamanaka (1989). Sumber karbon yang biasa digunakan oleh Acetobacter xylinum untuk memproduksi pelikel selulosa bakteri adalah dekstrosa, glukosa, sukrosa, fruktosa, gula invert (Embuscado, 1994).
Ide untuk memodifikasi selulosa sejak disintesis dideskripsikan oleh Brown, Acetobacter xylinum tidak hanya menjadi faktor penting dalam elusidasi sintesis selulosa tetapi juga dalam fermentasi asam cuka. Produk pelikel selulosa bakteri secara lambat ditegaskan sebagai biopolimer industri yang penting untuk berbagai aplikasi mulai dari makanan sampai material bahan yang mempunyai kekuatan besar (Brown, 1961).
2.4.5 Pembuatan pelikel selulosa bakteri
Terdapat dua faktor utama yang mempengaruhi produksi pelikel selulosa bakteri oleh Acetobacter xylinum yaitu komponen dari fermentasi dan kondisi operasional. Komponen dari fermentasi meliputi strain atau tipe organisme yang digunakan, komposisi media, sumber karbon, dan sumber nitrogen. Kondisi operasional yang mempengaruhi antara lain pH, oksigen, temperatur, konsentrasi relatif dari substrat dan tipe metode kultur yang digunakan.
selulosa. Fermentasi, fermentasi dilakukan pada media cair yang telah diinokulasi dengan starter. Fermentasi berlangsung pada kondisi aerob (membutuhkan oksigen). Mikroba tumbuh terutama pada permukaan media. Fermentasi dilangsungkan sampai pelikel yang terbentuk cukup tebal (1 - 1,5 cm).
2.5 Acetobacter xylinum (A. xylinum) 2.5.1 Deskripsi A. xylinum
A. xylinum adalah bakteri Gram negatif yang dapat memproduksi
selulosa dan asam asetat dengan bantuan udara selama pertumbuhannya dan melepaskannya ke lingkungan. Selulosa yang dihasilkan dikenal dengan selulosa bakteri. Selulosa yang dihasilkan murni dan dihasilkan secara ekstraseluler yang akan membentuk kumpulan fibril dan kemudian dibentuk menjadi satu kesatuan selulosa yang padat yang disebut dengan pelikel atau yang lebih dikenal dengan nata(Suwannapinunt, 2007).
A. xylinum mempunyai aktivitas oksidasi lanjutan atau over oxidizer, yaitu mampu mengoksidasi lebih lanjut asam asetat menjadi CO2 dan H2O. Bakteri pembentuk nata termasuk golongan Acetobacter mempunyai ciri-ciri antara lain : Obligat aerobik, bersifat non motil dan tidak membentuk spora, tidak memproduksi H2S, tidak mereduksi nitrat, termal death point pada suhu 65 - 70 o C.
Berikut adalah klasifikasi dari Acetobacter xylinum: Kingdom : Bakteria
[image:40.612.115.503.180.524.2]Filum : Proteobakteria Kelas : Alphaproteobakteria Order : Rhodospirillales Family : Acetobacteraceae Genus : Acetobacter Subspecies : xylinum
Gambar 6. Acetobacter xylinum 2.5.2Tingkat bahaya A. xylinum
A. xylinum dilaporkan bukan merupakanbakteri patogen bagi manusia.
A.xylinum diketahui tidak dapat menghasilkan toksin dan infeksi yang berbahaya bagi manusia maupun hewan. Bakteri ini tidak menghasilkan enzim atau agen ekstraseluler lainnya yang bersifat virulen. Bakteri ini memiliki plasmid yang berguna untuk menghasilkan enzim untuk produksi asam asetat. Berdasarkan hal tersebut A. xylinum tidak menunjukkan adanya faktor virulensi. Bakteri ini bukan bagian dari flora tubuh manusia dan kulit manusia dan diduga tidak dapat bertahan dalam tubuh manusia sehingga tidak dapat menginfeksi manusia.
2.5.3 Pertumbuhan bakteri Acetobacter xylinum
Bakteri A. xylinum adalah bakteri gram negatif aerobik yang mengalami pertumbuhan sel. Pertumbuhan sel didefinisikan sebagai pertumbuhan secara teratur semua komponen di dalam sel hidup. Berikut adalah fase pertumbuhan sel bakteri Acetobacter xylinum:
1. Fase Adaptasi
Apabila bakteri dipindahkan ke media baru maka bakteri tidak langsung tumbuh melainkan beradaptasi terlebih dahulu. Pada fase ini terjadi aktivitas metabolisme dan pembesaran sel, meskipun belum mengalami pertumbuhan. Adapatasi dicapai pada 0 - 24 jam sejak inokulasi.
2. Fase Pertumbuhan Awal
Fase pertumbuhan awal dimulai dengan pembelahan sel dengan kecepatan rendah. Fase ini berlangsung beberapa jam saja.
Fase eksponensial dicapai antara 1 - 5 hari. Pada fase ini bakteri mengeluarkan enzim ekstraselulerpolimerase sebanyak-banyaknya untuk menyusun polimer glukosa menjadi selulosa (matriks nata).
4. Fase Pertumbuhan Lambat
Fase pertumbuhan lambat terjadi karena nutrisi bakteri telah berkurang, terdapat metabolik yang bersifat racun yang menghambat pertumbuhan bakteri dan umur sel sudah tua. Pada fase ini pertumbuhan tidak stabil, tetapi jumlah sel yang tumbuh masih lebih banyak dibandingkan jumlah sel yang mati.
5. Fase Pertumbuhan Tetap
Pada fase pertumbuhan tetap terjadi keseimbangan antara sel yang tumbuh dan yang mati. Matriks nata lebih banyak diproduksi pada fase ini. 6. Fase Menuju Kematian
Fase menuju kematian terjadi akibat nutrisi di dalam media sudah hampir habis. Setelah nutisi habis, maka bakteri akan mengalami fase kematian.
7. Fase Kematian Sel
Pada fase ini bakteri dengan cepat mengalami kematian. Bakteri hasil fase ini tidak baik untuk strain nata.
2.6 Hidrogel
digunakan air sebagai bahan ˝swelling˝ maka hasilnya disebut hidrogel (Huglin, 1986).
Hidrogel adalah bahan polimer hidrofilik yang mempunyai kemampuan untuk mengembang di air atau cairan biologi dan menunjukkan fraksi air yang berarti pada strukturnya, tetapi matriks tersebut tidak larut dalam air. Ketika mengembang di air, hidrogel tetap mempertahankan bentuk asalnya. Sifat hidrofilik dari hidrogel ini dipengaruhi oleh adanya gugus-gugus –OH, -COOH, -CONH2, dan – SO3H. Sedang sifat ketidaklarutannya dalam air dan kemampuannya mempertahankan bentuk dipengaruhi oleh struktur tiga dimensi dari hidrogel. Kemampuan dari hidrogel untuk mengembang di air adalah kesetimbangan antara kekuatan disperse pada rantai hidrat dengan kekuatan kohesi yang tidak mencegah penetrasi air ke dalam hidrogel. Selain itu, derajat dan sifat ikatan silang serta kekristalan dari polimer turut menentukan sifat mengembang dari hidrogel (Kroschwitz, 1992).
yang tinggi, lunak dan elastis menjadikan hidrogel suatu biomaterial yang baik (Ramarajaj, 1994).
Hidrogel merupakan bahan yang dapat mengabsorbsi dan menahan air dalam jumlah besar, tapi tidak larut dalam air. Umumnya hidrogel dibuat dari polimer hidrofilik baik dalam bentuk tunggal atau kombinasi dengan polimer lainnya dengan teknik kimia atau radiasi sehingga membentuk ikatan silang (crosslinking). Polimer yang digunakan dapat berupa polimer sintetis seperti PVP (polivinil pirolidon) dan PVA (polivinil alkohol) atau polimer alam.
Tujuan utama pengembangan hidrogel sebagai bahan biomaterial adalah untuk perbaikan kesehatan manusia melalui penggunaan biomaterial tersebut sebagai alat kedokteran (Darwis, 1995). Biomaterial adalah material yang digunakan untuk menggantikan/memperbaiki kerusakan jaringan atau sebagai interface dengan lingkungan fisiologis. Biomaterial dapat berupa bahan alam seperti kolagen, serat protein (silk, wool, dan rambut), polisakarida (starch, selulosa dan kitosan) atau bahan sintetis seperti polimer, metal dan keramik(Rosiak, et al., dkk, 1999). 2.6.1 Sintesis hidrogel
menggunakan reaksi organik khusus yang melibatkan gugus fungsi polimer tersebut.
Pada metode radiasi, hidrogel dapat dibuat melalui polimerisasi dan pembentukan ikatan silang dari monomer atau polimer larut dalam air dengan menggunakan sinar gamma atau elektron cepat. Dengan teknik ini tidak diperlukan adanya inisiator kimia atau agensia pengikatan silang, proses lebih mudah dan sekaligus dapat digunakan untuk mensterilkan produk (Chapiro, et al, 1995). Pemakaian radiasi ionisasi untuk membuat hidrogel didasarkan pada reaksi pembentukan ikatan silang. Dua jenis radiasi ionisasi yang banyak digunakan untuk pembuatan hidrogel adalah sinar gamma yang berasal dari sumber radioisotop cobalt-60 dan elektron cepat yang dihasilkan oleh akselerator elektron. Dengan teknik radiasi ini, hidrogel dapat dibuat dengan meradiasi monomer atau polimer baik dalam bentuk larutan dalam air atau dalam bentuk padat. Namun demikian, pembentukan ikatan silang memerlukan dosis yang lebih tinggi pada iradiasi dalam bentuk padat.
antara molekul air dan radiasi gamma (radiolisis) menghasilkan spesies-spesies seperti OH, H3O+ H, H2,H+, H2O2. Diantara spesies ini yang paling realtif adalah radikal hidroksil (OH). Radikal selanjutnya akan bereaksi dengan molekul polimer membentuk radikal polimer. Radikal polimer yang terbentuk akan bereaksi satu dengan yang lainnya membentuk ikatan silang (crosslinking) (Darmawan, 2000).
Secara garis besar, mekanisme terjadinya ikatan silang (crosslinking) pada radiasi polimer dengan adanya air adalah sebagai berikut(Darmawan, 1999).
PH (polimer) PH*, PH+ + e- (exitaded dan ionitated state)
Rekombinasi
PH+ + e- PH* Penguraian (dekomposisi)
PH* Po + H
Radiolisis air
H2O H3O+ aq, OH0, e- aq, H, H2O2, H2 Pemisahan hidrogen
PH + OH0 P0 + H2O Rekombinasi radikal polimer
P0 + P0 P – P (crosslinking polimer)
Secara skematis mekanisme pembentukan ikatan silang suatu larutan polimer
Pembentukan radikal polimer
P P (radikal polimer) Rekombinasi polimer radikal
P + P P – P (ikatan silang) P adalah molekul polimer
b. Ikatan silang tidak langsung (indirect crosslinking) Radiolisis air
H2O H+, OH, e- aq H3O+, H2O2 Abstraksi atom hidrogen
P + OH P + H2O Rekombinasi radikal polimer
P + P P – P (ikatan silang)
2.6.2 Sifat fisika – kimia hidrogel
a. Daya serap air (water absorption)
tekanan osmosis. Keadaan keseimbangan hidrogel disebut sebagai kondisi swelling. Untuk menguji jumlah air yang terserap (daya serap air) pada hidrogel dengan menggunakan rumus sebagai berikut(Erizal, 1999): Daya serap air = (Wa-Wb)/Wb x 100%
Keterangan :
Wa = bobot hidrogel setelah pengembangan Wb = bobot awal hidrogel
b. Sifat biologis hidrogel
Hidrogel dapat dibedakan menjadi hidrogel alami dan hidrogel sintetik. Hidrogel yang terbentuk secara alami umumnya berasal dari proses biologis baik terjadi di dalam tanaman maupun hewan misalnya : agar, gel lidah buaya, dextran, gelatin, dan alginat. Sedangkan hidrogel sintetik terbentuk berdasarkan reaksi kimia atau fisika.
Ditinjau dari sifat biologisnya hidrogel yang diperoleh dari hasil sintetik maupun yang diperoleh dari alam dapat bersifat biodegradable (mudah terdegradasi), non-biodegradable (sukar terdegradasi) dan
bioerodible. Hidrogel biodegradable umumnya berasal dari
senyawa-senyawa alami, misalnya asam amino dan derivatnya yang mudah terdegradasi oleh enzim. Sedangkan hidrogel non-biodegradable terbentuk dari senyawa-senyawa sintetik(Erizal, 1999).
c. Sifat permukaan hidrogel
Sifat permukaan hidrogel dipengaruhi oleh sifat komponen utamanya yang terdiri atas gugus hidrofilik dan hidrofobik.
Jika hidrofilisitas relatif dominan dalam hidrogel, maka hidrogel dengan mudah dibasahi oleh air (sudut kontak=0), sukar dibasahi oleh cairan non polar dan relatif sukar mengabsorpsi protein. Pada hidrogel yang sifat permukaannya relatif hidrofob sukar dibasahi oleh air dan mudah dibasahi oleh minyak. Sedangkan pada hidrogel yang terdiri dari gugus hidrofilik dan hidrofobik yang terdistribusi secara heterogen, maka permukaan hidrogel dapat dibasahi oleh air maupun minyak(Rosiak JM, 1995).
d. Fraksi gel
Fraksi gel merupakan sifat kimia yang terdapat pada hidrogel. Derajat ikatan silang hidrogel dapat diketahui oleh adanya fraksi gel dalam struktur hidrogel tersebut. Semakin besar fraksi gel berarti semakin banyak ikatan silang yang terjadi antar rantai molekul polimer sehingga kekuatan mekanik semakin besar. Fraksi gel ini juga secara tidak langsung mencerminkan besar-kecilnya tingkat kerapatan ikatan silang yang terjadi antar polimer. Fraksi gel dapat diukur dengan cara mengekstraksi hidrogel menggunakan pelarut air pada suhu 90 - 1100C. Fraksi gel dapat dihitung dengan persamaan berikut(Erizal, 1999) :
Fraksi gel (%) = (W1/W0) x 100% Keterangan ;
2.7 Masker (Dwikarya, M, 2002)
Masker adalah salah satu pembersih kulit wajah yang efektif. Selain itu masker juga bermanfaat untuk memperlancar peredaran darah, merangsang kembali kegiatan sel-sel kulit dan mengangkat sel-sel tanduk yang telah mati. Hal ini disebabkan karena pada saat pemakaian masker, kulit muka tertutup secara sempurna oleh masker dan menyebabkan suhu kulit meningkat sehingga peredaran darah menjadi lancar dan penghantaran zat-zat gizi ke lapisan permukaan kulit dipercepat sehingga kulit muka terlihat lebih segar. Adanya peningkatan suhu menyebabkan fungsi kelenjar kulit meningkat sehingga kotoran dan sisa-sisa metabolisme dikeluarkan ke permukaan kulit yang kemudian dapat diserap oleh lapisan masker.
2.7.1 Jenis-jenis masker
1. Masker gel, membentuk lapisan kulit tipis saat mengering. Masker gel sangat ideal untuk kulit wajah usia belasan tahun sampai dua puluh tahun.
2. Masker peel off, langsung membentuk lapisan begitu terpasang di seluruh wajah. Masker ini menambah kelembaban kulit untuk sementara.
4. Masker exfoliate, biasanya berbentuk scrub (mengangkat sel kulit mati, gunanya mengembalikan vitalitas kulit yang pudar dan kusam. 5. Masker sulfur, masker yang berbahan dari belerang ini, ideal untuk
kulit yang banyak noda flek, dan berjerawat.
6. Masker hidrating, masker ini banyak mengandung air dan digunakan untuk mengatasi kulit-kulit yang kering dan halus.
7. Masker topeng (facial mask), dimaksudkan untuk pengelupasan kulit, melembabkan kulit kering, mengisi kulit kusam, menyerap minyak, mengencangkan kulit, menyembuhkan jerawat bekas luka, mencerahkan kulit wajah, menyegarkan.
2.7.2 Mekanisme kerja masker
alami sehingga menyegarkan kulit. Jadi secara singkat dapat diambil kesimpulan bahwa masker kecantikan pada kulit fungsinya ialah menyehatkan, membersihkan, mengencangkan dan menyegarkan kulit.
2.8 Antioksidan
Antioksidan adalah substansi yang diperlukan tubuh menetralisir radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas dengan melengkapi kekurangan elektrolit yang dimiliki radikal bebas dan menghambat terjadinya reaksi berantai dari pembentukan radikal bebas yg dpt menimbulkan stres oksidatif.
Radikal bebas
2.9 PVA (polivinil alkohol)
Gambar 7. Struktur Polivinil alkohol
3.0 Asam Askorbat (vitamin C) (Farmakope Indonesia edisi IV, 1995)
Gambar 8. Struktur Asam Askorbat (Vitamin C)
Mengandung tidak kurang dari 99,0% dan tidak lebih dari 100,5% C6H8O6 Rumus Molekul : C6H8O6. Nama Kimia : L-(+)-asam askorbat, asam 1,3 keto-threo heksuronat lakton, 3-okso L-gulofuranolakton (bentuk enol). Bobot Molekul : 176,13. Pemerian : Hablur/serbuk putih/agak kuning, praktis tidak berbau, rasa asam tajam. Oleh pengaruh cahaya lambat laun menjadi berwarna gelap dalam keadaan kering stabil di udara, dalam larutan cepat teroksidasi. Kelarutan : Mudah larut dalam air (1:3 sampai 1:3,5), larut dalam methanol (1:10) dan dalam aceton, agak sukar larut dalam etanol 95% P (1:25), propilenglikol (1:20), dalam gliserol (1:100), praktis tidak larut dalam kloroform, eter, benzene, eter, minyak, lemak, minyak tanah, pelarut lemak.
3.1 Radiasi
didefinisikan sebagai iradiasi yang mempunyai energi cukup tinggi (lebih dari 50eV) yang dapat melepaskan elektron dari atom atau molekulnya (ionisasi) dan merubahnya menjadi partikel-partikel yang bermuatan listrik yang disebut ion. Reaksi selanjutnya dari ion dan elektron ini yang menyebabkan terbentuknya radikal bebas yang sangat reaktif yang pada akhirnya menyebabkan reaksi kimia. Studi perubahan kimia yang terjadi dalam suatu sistem akibat absorbsi radiasi ionisasi dikenal dengan kimia radiasi.
Secara umum ada dua jenis radiasi ionisasi yang banyak digunakan dalam industri (Darmawan, 2002) :
1). Radiasi elektromagnetik
Radiasi elektromagnetik terdiri dari gelombang radio, gelombang mikro, cahaya tampak, ultraviolet, sinar gamma, dan sinar X. Namun hanya sinar X dan sinar gamma yang mempunyai panjang gelombang rendah dan energi lebih besar dari 50eV yang mampu untuk mengionisasi atom dan molekul.
2). Partikel berenergi tinggi
Partikel ini dihasilkan dari mesin seperti elektron dari akselerator elektron dan H, He, Ar, dan positron dari akselerator ion beam. Namun demikian, partikel ini dapat juga diperoleh dari radioisotop seperti beta partikel dan alfa partikel.
3.1.1 Sumber iradiasi ionisasi
secara komersil adalah Co-60 dan Cs-137. Kedua radioisotop ini merupakan pengemisi gamma. Sumber radiasi ionisasi yang lain adalah akselerator elektron dan mesin sinar-X dan akselerator partikel bermuatan positif atau akselerator ion beam.
a. Radioisotop
Radioisotop yang dikenal juga dengan radioaktif isotop atau radionuklida terjadi secara alami, namun dapat juga diproduksi secara buatan dalam suatu reaktor nuklir. Radioisotop adalah suatu elemen tidak stabil yang mempunyai kelebihan neutron atau proton dalam intinya dan mengemisikan radiasi dapat berupa α, β, γ dan secara spontan akan
meluruh ke keadaan stabil. Di antara sumber iradiasi gamma, Co-60 paling banyak digunakan dalam industri karena mempunyai energi radiasi yang lebih tinggi (2,506 MeV) dibandingkan dengan Cs-137 (0,662 MeV). b. Akselerator elektron
Elektron beam mempunyai daya tembus yang terbatas maka elektron beam hanya dapat digunakan untuk produk-produk yang mempunyai ketebalan tertentu (<5 cm).
Berdasarkan energi yang dihasilkan, akselerator elektron dapat dibagi menjadi tiga bagian :
1). Elektron beam energi rendah (80-500 KeV) 2). Elektron beam energi sedang (500 KeV-5 MeV) 3). Elektron beam energi tinggi (5-10MeV)
Radiasi berkas elektron yang banyak digunakan untuk tujuan sterilisasi adalah yang mempunyai energi 2 hingga 10 MeV (MBE energi sedang hingga tinggi). Mesin berkas elektron (MBE) dengan energi 5 MeV mempunyai kemampuan penetrasi elektron sekitar 2 cm pada produk dengan densitas 1 gr/cm3 pada satu sisi permukaan produk dan 4 cm pada dua sisi permukaan produk. Sedangkan MBE dengan energi 10 MeV dapat meradiasi produk dengan densitas 0,15 g/cm3 setebal 60 cm dengan teknik radiasi dari dua sisi. MBE energi yang tinggi sehingga dapat mensterilkan produk dalam kemasan akhir, fleksibilitas perlakuan produk dan kecepatan dosis yang tinggi (Darmawan, 2006).
Gambar 9. Skema mesin berkas elektron (EBM) 3.1.2 Dosis radiasi
Dosis Radiasi sangat menentukan efektivitas hasil yang diperoleh. Dalam proses iradiasi dikenal dua macam dosis, yaitu dosis terpancar dan dosis serap. Dosis terpancar adalah besarnya energi yang dipancarkan oleh sumber radiasi selama proses berlangsung. Sedangkan dosis serap adalah besarnya energi yang diserap oleh sample selama iradiasi. Biasanya jika hanya disebutkan dosis (radiasi), maka yang dimaksud adalah dosis serap, dengan satuan lamanya adalah rad, dan satuan standarnya adalah Gray (Darmawan, 2002).
Rata-rata dosis yang diserap adalah dosis yang diserap per satuan waktu, contohnya Gy/detik atau Kgy/jam. Satuan dan besaran dosis radiasi dinyatakan melalui energi dan massa bahan, yaitu joule/kg bahan. Satuan dosis menurut S.I dinamakan Gray dan disingkat Gy. Secara numerik 1 Gy = 1 joule/kg bahan. Dulu satuan dosis radiasi menggunakan Rad (Radiation Absorbed Dose).
Tabel 3. Berdasarkan tingkat dosis radiasi, aplikasi teknik radiasi yaitu:
3.1.3 Efek radiasi pada polimer
Apabila suatu radiasi ionisasi mengenai molekul polimer maka akan terjadi reaksi kimia yang pada akhirnya akan menentukan sifat polimer tersebut. Secara garis besar reaksi yang terjadi dapat diklasifikasikan menjadi dua yaitu reaksi pembentukan ikatan silang (crosslinking) dan reaksi pemutusan rantai polimer (degradasi) (Woods, et al, 1994).
Crosslinking suatu polimer terjadi melalui ikatan dua rantai polimer yang berdekatan yang pada akhirnya membentuk suatu network tiga dimensi. Crosslinking dapat mengakibatkan suatu polimer mempunyai sifat viskositas bertambah, berat molekul bertambah, sifat mekanik bertambah (Woods, et al, 1994).
Sebaliknya degradasi merupakan suatu reaksi pemutusan rantai polimer sehingga menyebabkan berkurangnya berat molekul, viskositas, dan menurunnya sifat mekanik.
No. Dosis rendah (0 - 1 kGy)
Dosis sedang (1 - 10 kGy)
Dosis tinggi 1 Mencegah
pertunasan (0,05 - 0,15 kGy)
Menurunkan kandungan mikroba (pasteurisasi) (0,5 - 10 kGy)
Sterilisasi (10 - 50 kGy)
2 Menunda
pematangan buah (0,1 - 1,15 kGy)
Membunuh bakteri patogen
(3 - 10 kGy)
-
3 Membunuh
serangga (0,2 - 1 kGy)
- -
4 Membunuh
parasit daging (0,1 - 0,3 kGy)
Beberapa polimer dalam larutan mengalami reaksi crosslinking dan
degradasi secara simultan jika diradiasi dengan sinar gamma atau elektron
beam. Jika ikatan silang yang terjadi lebih banyak dibandingkan dengan pemutusan ikatan maka polimer disebut sebagai tipe crosslinking, sebaliknya jika degradasi lebih banyak terjadi dibandingkan ikatan silang maka polimer tersebut dikategorikan sebagai polimer bertipe degradasi (Darmawan, 2002). Tergantung dari reaksi mana yang lebih dominan akan menentukan sifat akhir dari polimer tersebut (Darmawan, 2002).
Reaksi ikatan silang
Gambar 10. Reaksi ikatan silang 3.1.4 Keunggulan menggunakan EBM (Woods, et al, 1994)
a. Dalam pelaksanaan iradiasi lebih cepat.
b. Pemilihan bahan pengemas menjadi lebih leluasa karena tidak harus bahan yang tahan panas.
c. Iradiasi merupakan teknologi yang ramah lingkungan karena tidak ada limbah proses yang dibuang ke lingkungan.
d. Teknik ini dapat dilakukan pada bahan/produk yang sudah dikemas (kemasan akhir).
f. Dapat digunakan untuk produk-produk yang tipis karena daya tembusnya yang terbatas.
3.2 Radiofarmasi
Penggunaan radioaktif melalui aliran darah disebut radiofarmasi. Dalam terapi ini, obat dimasukkan ke dalam sirkulasi darah. Obat itu menggunakan molekul atom radioaktif. Atom yang membentuknya adalah radioaktif. Radioaktif gamma dalam teknologi radiofarmasi adalah untuk diagnosis. Ada dua sinar gamma yang digunakan untuk diagnosis. Yakni,
single photon emisien computerized tomography (emisi dari photon
tunggal yang dapat ditelusuri komputer). Yang terbaru disebut
PET-positron emission tomography (radioaktif yang memancarkan positron).
Teknologi ini digunakan agar sinar gamma yang masuk ke dalam aliran darah bisa menembus sasaran. Setelah mencapai sasaran, dalam kurun waktu tertentu bisa ditelusuri dengan kamera gama atau komputer.
digunakan untuk pengobatan beberapa jenis kanker, antara lain pengobatan limfoma, kanker prostat, dan melanoma.
Radio Farmasi atau Farmasi Nuklir adalah penggunaan prinsip dan cara-cara farmasi dan radiokimia untuk membuat obat yang mengandung zat radioaktif (radiofarmaka) bagi keperluan zat radioaktif (radiofarmaka) bagi keperluan diagnosa dan penyembuhan (terapi) penyakit yang diidap pasien. Sediaan farmasi Nuklir adalah sediaan radio isotop yang digunakan reaktor nuklir, telah mengalami suatu pengolahan kimia (destruksi, destilasi, ekstraksi dll)an oleh manusia baik untuk diagnosa maupun terapi serta mnegalami metabolisme di dalam tubuh.
48
KERANGKA KONSEP
3.1 Alur Penelitian
Pengeringan
Pembuatan Membran (Selulosa bakteri – PVA) dan Pembuatan Membran (Selulosa bakteri – PVA) + Vitamin C
Persiapan
Pembuatan Starter
Pembuatan Membran Selulosa Bakteri Pengukuran Tebal Membran Selulosa
Bakteri Basah
1. Uji sifat mekanik 2. Uji fraksi gel
3. Uji pH
4. Uji analisis pelepasan vitamin c dengan spektrofotometer
UV-Vis Karakterisasi Selulosa
Bakteri- PVA + Vitamin C Karakterisasi Selulosa
Bakteri - PVA
1. Uji sifat mekanik 2. Uji fraksi gel
49 4.1 Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Kelompok Bahan Kesehatan Bidang Proses Radiasi, Pusat Aplikasi Teknologi Isotop dan Radiasi, Badan Tenaga Nuklir Nasional (BATAN) Pasar Jumat, Jakarta Selatan selama ±5 bulan dari April sampai dengan Agustus 2010.
4.2 Alat dan Bahan 4.2.1 Alat
Alat-alat yang digunakan pada penelitian ini antara lain erlenmeyer, gelas ukur, gelas piala (Pyrex), alumunium foil, pipet tetes, pH meter, autoklaf (Hirayama HA - 3D, Japan), inkubator (Heraeus), oven (Heraeus), timbangan analitik (Sartorius-West Germany), tangas air, tali rapia, wadah kotak plastik, Mikrometer Thickness Gage (Mitutoyo) Laminar Air Flow (Envair-Australia), tabung reaksi (Pyrex), alat Tensile-Strength (Toyoseiki-Japan), Sealing plastik, spatel, kapas, pembakar spiritus,
Hand-press, cawan petri, pinset, pipet ukur, mesin berkas elektron,
Spektrofotometer UV - Vis (Spectrofotometer UV - Vis Lambda 25 Perkin Elmer).
4.2.2 Bahan
(Merck), asam asetat glasial p.a (Merck), sukrosa (Gulaku), NaOH 4% (Merck), H2O2 0,25% p.a (Merck), air suling, PVA (polivinil alkohol), Vitamin C.
4.3 Prosedur Kerja 4.3.1 Pengumpulan bahan
Bahan yang digunakan untuk penelitian adalah air kelapa (Cocos nucifera) yang diperoleh dari pasar di daerah Pasar Jumat. Kelapa yang digunakan adalah kelapa tua atau tidak lebih dari satu minggu.
4.3.2 Pembuatan starter
Sebanyak lebih kurang 400 ml air kelapa yang telah disaring dengan kain penyaring, ditambahkan dengan 1 gr ammonium sulfat kemudian diaduk sampai homogen. Cek pH, apabila larutan belum mencapai pH 4 maka ditambahkan asam asetat glacial (p.a) sampai pH 4. Larutan media tersebut disterilkan dalam otoklaf pada suhu 1210C selama 10 menit. Sebanyak 80 gr gula pasir ditambahkan ke dalam larutan media steril dan didinginkan. Sebanyak 80 ml biakan Acetobacter xylinum ditambahkan ke dalam larutan media steril yang sudah dingin, aduk sampai homogen. Larutan dipindahkan ke dalam botol steril, ditutup dengan aluminium foil dan disimpan pada suhu 30±20C
4.3.3 Pengembangan stater A. xylinum
penting dilakukan untuk memperoleh kondisi stater yang optimum, karena stok A. xylinum biasanya berada pada kondisi dorman sehingga perlu disegarkan kembali. Hal ini dilakukan agar bakteri A. xylinum tidak membutuhkan waktu yang lama untuk adaptasi ketika dipindahkan pada medium baru. Stater yang baik adalah stater yang berada pada fase pertumbuhan, karena pada fase ini mikroba sedang aktif berkembang sehingga tidak memerlukan waktu adaptasi yang lama ketika dipindahkan ke dalam medium yang baru, jumlah sel meningkat dengan pesat dan kepadatan populasi meningkat beberapa kali lipat.
Berikut adalah gambar perbedaan kondisi stater yang baik dan kurang baik.
[image:68.612.114.506.146.540.2](a) (b)
Gambar 11. Perbedaan kondisi starter
Keterangan : (a). Kondisi stater tidak optimum
(b). Kondisi stater optimum
4.3.4 Pembuatan membran selulosa bakteri
karena pada umur ini kandungan nutrisinya paling maksimum(Piluharto, dkk, 2003). Selain kelapa juga digunakan ammonium sulfat dan gula. Ammonium sulfat digunakan sebagai sumber nitrogen. Nitrogen merupakan senyawa penting karena merupakan komponen dasar penyusun protein. Sedangkan gula adalah sumber karbon/karbohidrat yang akan dimanfaatkan A. xylinum untuk sintesis selulosa ekstraseluler.
Gambar 12. Pemeraman dalam inkubator
Gambar 13. Polimerisasi
Glukosa yang berperan dalam pembentukan selulosa adalah glukosa dalam bentuk β sehingga semua glukosa yang ada dalam bentuk α akan
diubah dalam bentuk β melalui enzim isomerase yang berada pada bakteri
Acetobacter xylinum (Piluharto, dkk, 2003). Tahap berikutnya glukosa
berikatan dengan glukosa yang lain melalui ikatan 1,4 β-glikosida. Tahap terakhir adalah tahap polimerisasi yaitu pembentukan selulosa. Polimerisasi ini terjadi melalui enzim polimerisasi yang ada pada bakteri
Acetobacter xylinum. Secara fisik pembentukan selulosa adalah
terbentuknya pelikel.
[image:71.612.115.506.103.559.2]
Gambar 14. Proses pencucian pelikel yang dihasilkan
Keterangan : A= pelikel setelah fermentasi 8 hari, B = pelikel dicuci dengan air mengalir, C = pelikel dicuci dengan NaOH pada suhu 90oC-95 oC, D = Pelikel yang dicuci dengan H2O2 pada suhu 40oC-45 oC
Pencucian dengan air mengalir bertujuan menghilangkan sisa asam dan gula. Selain itu untuk menghindari reaksi browning ketika dipanaskan dengan NaOH, karena reaksi browning akan menyebabkan warna membran yang dihasilkan berwarna coklat. Pencucian dengan larutan NaOH 4% bertujuan untuk menghilangkan sisa sel-sel bakteri yang terperangkap dalam jaringan pelikel selulosa serta sisa-sisa substrat (Slusarska, 2008). Komponen-komponen non-selulosa ini diduga akan menghalangi ikatan yang terjadi antar rantai molekul selulosa yang mengakibatkan terhadap menurunnya kekuatan sifat mekanis selulosa (Piluharto, 2003). Pelikel selanjutnya dicuci dan direndam dalam air suling untuk menghilangkan sisa NaOH hingga diperoleh pH netral. Proses
C D
k