HUBUNGAN TINGKAT KANDUNGAN PATI DAN ASAM
AMINO TERHADAP PERTUMBUHAN DAN EFISIENSI
PAKAN AYAM PEDAGING
NUGROHO ADI HARTONO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Hubungan Tingkat
Kandungan Pati dan Asam Amino terhadap Pertumbuhan dan Efisiensi Pakan
Ayam Pedaging adalah benar karya saya dengan arahan dari komisi pembimbing
dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun.
Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun
tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan
dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut
Pertanian Bogor.
Bogor, Pebruari 2014
RINGKASAN
NUGROHO ADI HARTONO. Hubungan Tingkat Kandungan Pati dan Asam Amino terhadap Pertumbuhan dan Efisiensi Pakan Ayam Pedaging. Dibimbing oleh NAHROWI dan SUMIATI.
Industri peternakan ayam pedaging di Indonesia merupakan industri yang sangat penting. Efisiensi pakan merupakan hal yang sangat diperlukan untuk mendukung pertumbuhan industri ini. Teknologi nutrisi baru banyak diaplikasikan untuk mencapai perbaikan efisiensi pakan. Salah satu teknik untuk meningkatkan performa pertumbuhan ayam pedaging adalah dengan mempertimbangkan kandungan pati dan rasio terhadap asam amino dalam formulasi pakannya. Pati merupakan bagian utama dari karbohidrat. Pati menyediakan lebih dari 50% kebutuhan energi di dalam ransum ayam pedaging yang berbasis jagung dan bungkil kedelai. Kecernaan pati secara umum diasumsikan sangat tinggi, tetapi laju degradasinya di usus bervariasi (Weurding et al. 2001). Ransum dengan kandungan pati yang dipecah bertahap di usus halus, akan menyediakan glukosa secara kontinyu ke dalam peredaran darah. Glukosa di dalam darah ini akan direspon oleh lepasnya hormon insulin. Insulin memegang peranan penting dalam transpot glukosa dan deposisi protein ke dalam otot selama pertumbuhan (Fox 1996). Tersedianya glukosa yang cukup sampai ke bagian posterior usus halus, bisa mencegah penggunaan asam amino sebagai sumber energi untuk dinding usus (Weurding et al. 2003). Laju kecernaan pati di dalam jejunum lebih cepat dibandingkan dengan protein (Liu et al. 2013). Adanya ketidakselarasan antara laju kecernaan pati dan protein, menyebabkan perbedaan pertumbuhan ayam yang diberikan ransum sorgum dan biji gandum (Blacket al. 2005).
Penelitian ini bertujuan untuk mengetahui penampilan produksi ayam pedaging strain ROSS yang diberi pakan dengan imbangan pati dan asam amino yang berbeda. Penelitian ini menggunakan 240 ekor ayam pedaging strain ROSS yang dipelihara selama lima minggu dalam kandang sekat berukuran 1m x 1m x 1m. Penelitian ini menggunakan rancangan acak lengkap faktorial 2x3 dengan empat ulangan. Ransum yang diberikan pada umur 0-21 hari adalah sebagai berikut : (HSLL) ransum dengan pati 36% dan lisin 1.34%, (HSML) ransum dengan pati 36% dan lisin 1.43%, (HSHL) ransum dengan pati 36% dan lisin 1.48%, (LSLL) ransum dengan pati 32% dan lisin 1.34%, (LSML) ransum dengan pati 32% dan lisin 1.43%, (LSHL) ransum dengan pati 32% dan lisin 1.48%. Ransum yang diberikan pada umur 21-35 hari adalah sebagai berikut : (HSLL) ransum dengan pati 36% dan lisin 1.18%, (HSML) ransum dengan pati 36% dan lisin 1.30%, (HSHL) ransum dengan pati 36% dan lisin 1.35%, (LSLL) ransum dengan pati 32% dan lisin 1.18%, (LSML) ransum dengan pati 32% dan lisin 1.30%, (LSHL) ransum dengan pati 32% dan lisin 1.35%. Parameter yang diamati diantaranya konsumsi ransum, konversi ransum, pertambahan berat badan, kadar glukosa darah, kadaruric aciddarah, kadar insulin, penyerapan pati di dalam usus halus dan penyerapan protein.
fase starter dan 1.3% untuk fase finisher memberikan konversi ransum yang paling baik. Kandungan pati dan asam amino dalam ransum berpengaruh terhadap penyerapan protein, kadar insulin dan uric acid di dalam darah. Rasio pati dan asam amino di dalam ransum mempunyai korelasi yang positif terhadap pertambahan berat badan (r=0.573, P<0.05) dan konsumsi pakan (r=0.55, P<0.01). Penyerapan pati di dalam usus halus mempunyai korelasi yang positif terhadap pertambahan berat badan (r=0.461, P<0.05) dan korelasi negatif terhadap konversi pakan (r= -0.482, P<0.05).
Kesimpulan dari penelitian ini adalah rasio pati 36% dan asam amino berbasis lisin 1.34% untuk fasestarterdan 1.18% untuk fasefinishermemberikan pertambahan berat badan yang paling baik. Rasio pati 36% dan asam amino berbasis lisin 1.43% untuk fase starterdan 1.3% untuk fase finishermemberikan konversi ransum paling baik.
SUMMARY
NUGROHO ADI HARTONO. Relationship between Starch and Amino Acid Levels of Broiler Diets on Growth Performance and Feed Efficiency. Supervised by NAHROWI and SUMIATI.
Broiler chicken industry is a very important in Indonesia. Feed efficiency is very necessary to support it. One technique to improve broiler performance is to consider about starch level and the ratio to amino acid in the feed formulation. In addition, protein is composed of amino acids with a certain ratio of the amino acid lysine (ideal protein concept model). Starch is a part of carbohydrate as important energy source for broiler chickens. The amount of starch is still not taken into account in predicting the energy content of a material. Starch provides a more than 50% of energy requirement in broiler feed which based on corn and soybean meal. Starch generally has very high digestibility, but the rate of degradation in the intestine varies (Weurdinget al. 2001). Feed with the starch content gradually broken down in the small intestine, will provide continuous glucose into the bloodstream. Glucose in the blood will be responded by the release of insulin which plays an important role in the transport of glucose and protein into muscle during growth (Fox 1996). Continuous availability of glucose to the posterior part of the small intestine, could prevent the use of amino acids as an energy source for the intestinal wall (Weurding et al. 2003). The rate of starch digestibility in the jejunum is faster than the protein (Liu et al. 2013). The existence of the unconformity between the rate of starch digestibility and protein, leading to differences in the growth of chickens given feed wheat and sorghum (Blacket al. 2005).
The aims of this study was to determine the feeding effect of diets containing different starch and amino acid levels on growth performance and blood parameters. In this study, 240 day old chicks were distributed to 6 treatments using a completely randomized design (CRD) with four replications. Three treatments were fed with high starch (36%) and three others were fed with low starch (32%). Both type of diets were formulated as isocaloric with three levels of total lysine, varying from 1.34%, 1.43%, 1.48% forstarterperiod (0-21 days) and 1.18%, 1.3%, 1.35% forfinisher period (21-35 days). Parameters were observed among feed intake, feed conversion, weight gain, blood glucose levels, blood uric acid levels, insulin levels, the absorption of starch in the small intestine and absorption of protein.
The conclusion of this study was ratio of 36% starch and amino acid based on 1:34% lysine forstarterperiod and 1.18% lysine gave the highest weight gain. The best feed conversion ratio obtained from the ratio of 36% starch and amino acids based on 1.43% lysine forstarterperiod and 1.3% lysine forfinisherperiod.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Nutrisi dan Pakan
HUBUNGAN TINGKAT KANDUNGAN PATI DAN ASAM
AMINO TERHADAP PERTUMBUHAN DAN EFISIENSI
PAKAN AYAM PEDAGING
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Hubungan Tingkat Kandungan Pati dan Asam Amino terhadap Pertumbuhan dan Efisiensi Pakan Ayam Pedaging
Nama : Nugroho Adi Hartono NIM : D152110011
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Nahrowi, MSc Ketua
Dr Ir Sumiati, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Nutrisi dan Pakan
Dr Ir Dwierra Evvyernie A, MS, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan semesta alam atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan November 2012 sampai Februari 2013 adalah Hubungan Tingkat Kandungan pati dan Asam Amino terhadap Pertumbuhan dan Efisiensi Pakan Ayam Pedaging.
Penulis mengucapkan terima kasih kepada Bapak Prof Dr Ir Nahrowi, MSc dan Ibu Dr Ir Sumiati, MSc selaku pembimbing tugas akhir dan segenap dosen pengajar yang telah memberikan ilmu yang sangat bermanfaat. Penulis menyampaikan ucapan terimakasih kepada Ibu Lanjarsih, SPt dan Pak Ipung yang telah membantu selama penelitian. Terima kasih juga kepada Pak Supri dan Bu Ade serta seluruh staf dan pegawai Pascasarjana Ilmu Nutrisi dan Pakan serta Departemen Ilmu Nutrisi dan Teknologi Pakan atas segala bantuan dan bimbingannya. Penulis mengucapkan terimakasih kepada teman-teman keluarga besar INP 2011 dan istri tercinta atas doa, bantuan dan kebersamaannya selama ini.
Semoga karya ilmiah ini bermanfaat bagi perkembangan ilmu selanjutnya.
Bogor, Pebruari 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Ruang Lingkup Penelitian 2
METODE 3
Waktu dan Tempat 3
Materi 3
Metode 6
Rancangan Percobaan dan Model Matematika 6
Perlakuan 7
Analisis Data 7
Peubah yang diamati 7
HASIL DAN PEMBAHASAN 9
Pengaruh Ransum Perlakuan terhadap Performa Ayam Pedaging 9 Pengaruh Ransum Perlakuan terhadap Penyerapan Protein dan Penyerapan Pati di Usus Halus Ayam Pedaging Umur 0-35 Hari 13 Pengaruh Ransum Perlakuan terhadap Parameter Serum Ayam Pedaging
Umur 0-35 Hari 17
Korelasi Antara Rasio Pati dan Asam Amino terhadap Pertumbuhan dan Parameter Darah Ayam Pedaging Umur 0-35 Hari 20
SIMPULAN DAN SARAN 22
Simpulan 22
Saran 22
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR TABEL
1 Susunan dan kandungan nutrien ransum perlakuan fase starter (0-21
hari) 4
2 Susunan dan kandungan nutrien ransum perlakuan fase finisher (22-35
hari) 5
3 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap konsumsi ransum ayam pedaging umur 0-35 hari (g/ ekor) 9 4 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap
pertambahan berat badan ayam pedaging umur 0-35 hari (g/ ekor) 11 5 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap
konversi ransum ayam pedaging umur 0-35 hari 13 6 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap
penyerapan protein, penyerapan pati dan pola sebaran sisa pati di dalam usus halus ayam pedaging 35 hari (%) 14 7 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap kadar
glukosa serum ayam pedaging umur 21, 28 dan 35 hari (mg/ dL) 17 8 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap kadar
uric acid serum ayam pedaging umur 21, 28 dan 35 hari (mg/ dL) 18 9 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap
kadar insulin serum ayam pedaging umur 21, 28 dan 35 hari
(µIU/mL) 20
10 Korelasi Pearson antara rasio pati dan asam amino terhadap parameter pertumbuhan dan profile darah ayam pedaging 0-35 hari 21
DAFTAR GAMBAR
1 Rataan konsumsi ransum ayam pedaging umur 1-5 minggu dengan level pati 36% (♦) dan pati 32% (■ ) 10 2 Rataan pertambahan berat badan ayam pedaging umur 1-5 minggu
dengan level pati 36% (♦) dan pati 32% (■ ) 12 3 Rataan penyerapan protein ransum ayam pedaging umur 35 hari 15 4 Rataan penyerapan pati ransum di usus halus ayam umur 35 hari 16 5 Rataan kadar glukosa serum (mg/dL) ayam pedaging umur 35 hari 18 6 Rataan kadaruric acidserum (mg/dL) ayam pedaging umur 35 hari 19
7 Biosintesisuric acid 19
DAFTAR LAMPIRAN
1 Metode Koleksi digesta usus halus, Pengukuran performa produksi, Pengukuran profile darah, Pengukuran penyerapan protein dan Pengukuran penyerapan pati di usus halus ayam pedaging 27 2 Hasil analisis statistik performa, profil metabolit serum dan penyerapan
PENDAHULUAN
Latar Belakang
Industri peternakan ayam pedaging di Indonesia merupakan industri yang sangat penting. Efisiensi pakan merupakan hal yang sangat diperlukan, untuk mendukung pertumbuhan industri ini. Efisiensi pakan perlu ditingkatkan dengan tujuan untuk dapat mencapai hasil produksi yang sesuai potensi genetiknya dengan biaya pakan yang murah. Pakan yang efisien dapat mengurangi potensi pencemaran lingkungan akibat nutrien berlebih, khususnya protein yang tidak dicerna oleh ternak. Teknologi nutrisi baru banyak diaplikasikan untuk mencapai perbaikan efisiensi pakan. Salah satu teknik untuk meningkatkan performa pertumbuhan ayam pedaging adalah dengan mempertimbangkan kandungan pati dan rasio terhadap asam amino dalam formulasi pakannya.
Pati merupakan bagian utama dari karbohidrat yang merupakan sumber energi untuk ayam pedaging. Pati menyediakan lebih dari 50% kebutuhan energi di dalam ransum ayam pedaging yang berbasis jagung dan bungkil kedelai. Secara umum, kecernaan pati diasumsikan sangat tinggi, tetapi laju degradasinya di usus bervariasi (Weurdinget al. 2001). Tingkat kecernaan pati pada bahan baku pakan sangat bervariasi, tergantung dari laju kecernaannya (starch digestion rate) dan bagian pati yang tidak bisa dicerna di usus (resistant starch fraction). Ransum dengan kandungan pati yang dipecah bertahap di usus halus, akan menyediakan glukosa secara kontinyu ke dalam peredaran darah. Glukosa di dalam darah ini akan direspon oleh lepasnya hormon insulin. Insulin memegang peranan penting dalam transport glukosa dan deposisi protein ke dalam otot selama pertumbuhan (Fox 1996). Tersedianya glukosa secara kontinyu ke bagian posterior usus halus, bisa mencegah penggunaan asam amino sebagai sumber energi untuk dinding usus (Weurdinget al. 2003).
Ransum yang baik mengandung sejumlah pati dengan laju kecernaan yang bertahap sampai pada usus halus bagian posterior. Usus halus memerlukan glukosa sebagai sumber energi untuk aktifitasnya. Sumber energi lain yang bisa digunakan oleh usus halus adalah dengan pemecahan asam amino. Apabila glukosa tidak tersedia di bagian posterior usus halus, maka kelebihan asam amino akan dioksidasi untuk memenuhi kebutuhan energi aktifitas usus. Laju kecernaan pati di dalam jejunum lebih cepat dibandingkan dengan protein (Liu et al. 2013). Adanya ketidakselarasan antara laju kecernaan pati dan protein, menyebabkan perbedaan pertumbuhan ayam yang diberikan ransum sorgum dan biji gandum (Blacket al. 2005). Hal ini disebabkan oleh karena pati dari sorgum dipecah lebih cepat dibanding protein, sehingga terjadi ketidaksinkronan penyerapannya. Pati dengan laju degradasi yang lambat mampu memberikan suplai glukosa yang terus menerus yang akan mengubah respon insulin (Bjocrket al.2000).
2
dengan terlebih dahulu melewati proses deaminasi atau melepas gugus amino NH2
(Leeson dan Summers 2001). Kelebihan asam amino dari suplementasi asam amino akan didegradasi menghasilkan asetil KoA. Asetil KoA mengalami proses glukoneogenesis sehingga meningkatkan glukosa darah dan juga akan membebaskan amonia sehingga meningkatkan uric acid darah (Bouyeh dan Gevorgyan 2011).
Uric acid yang terdapat di dalam urin akan menyebabkan terjadinya peningkatan degradasi arginin oleh enzim arginase. Arginina merupakan asam amino yang penting untuk unggas, karena unggas tidak mempunyai enzim
carbamyl phosphate synthetaseseperti pada mamalia yang dapat mereaksikan ion ammonium, molekul CO2 dan pospat dari ATP dalam ekskresi nitrogennya.
Proses ini menimbulkan adanya keadaan stres oksidatif pada unggas (Cutler 1984). Kadar uric acid meningkat pada saat nitrogen intake meningkat (Hevia dan Clifford 1977). Uric acid dalam darah dapat digunakan sebagai salah satu indikator hasil akhir dari metabolisme nitrogen (Hartmanet al.2006).
Dengan demikian, diperlukan data yang membuktikan bahwa penerapan konsep keseimbangan energi dengan asam amino yang mempertimbangkan jumlah pati di dalam ransum dapat memberikan pertumbuhan ayam yang baik.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Menganalisis hubungan antara tingkat kandungan pati dan asam amino terhadap pertumbuhan dan efisiensi penggunaan protein pada ayam pedaging yang diberi pakan dengan energi yang sama.
2. Mendapatkan angka kebutuhan pati dan asam amino yang paling efisien untuk pertumbuhan ayam pedaging dengan pakan isokalori berbasis jagung dan bungkil kedelai.
3. Mengetahui hubungan tingkat efisiensi penggunaan protein dikaitkan dengan ketersediaan glukosa hasil pemecahan pati dan kinerja hormon insulin.
Ruang Lingkup Penelitian
3
METODE
Waktu dan Tempat
Penelitian telah dilaksanakan pada bulan November 2012 sampai Pebruari 2013. Penelitian pemeliharaan ayam pedaging dilaksanakan di kandang percobaan Laboratorium Nutrisi Ternak Unggas, Fakultas Peternakan Institut Pertanian Bogor (IPB). Analisis profil darah dilakukan di Laboratorium Ilmu Nutrisi Ternak dan Kerja, Fakultas Peternakan Institut Pertanian Bogor. Analisis kandungan pati dan protein dilakukan di Laboratorium Pusat Penelitian Sumberdaya Hayati dan Biotenologi IPB. Analisa insulin dilakukan di Laboratorium Badan Atom Nasional (BATAN) Lebak Bulus, Jakarta.
Materi
1. Persiapan bahan baku pakan.
Bahan baku pakan yang digunakan adalah jagung, dedak, bungkil kedelai, tepung ikan, minyak sawit, tepung daging tulang, tepung hasil ikutan unggas, pollard, tepung bungkil kopra, CaCO3, NaCl, premik, DL-metionina,
L-treonina, L-lisina, klorida klorin, anti jamur, antioksidan dan antikoksidial. 2. Ternak
Ternak yang digunakan adalah ayam pedaging strain ROSS 308 jantan sebanyak 240 ekor dengan bobot awal rata-rata 40 g/ekor. Ayam dipelihara sampai umur 35 minggu dalam kandang sekat yang berukuran 1m x 1m x 1m, masing-masing sekat berisi 10 ekor ayam.
3. Alat analisa
Kit analisa enzimatik colorimetricAKL 20101803460, IRMA KIT RK -400 CT [125]I, Kit Uricase PAP AKL 10101804028, Spektrofotometer UV–
vis. 4. Ransum
Ada enam jenis formulasi ransum yang digunakan, dengan kombinasi pati dan asam amino yaitu 2 taraf kandungan pati (36% = pati tinggi dan 32% = pati rendah), yang dikombinasikan dengan 3 taraf asam amino yaitu berbasis total lisina 1.34%, 1.43%, 1.48% untuk fasestarter(umur 0-21 hari), dan 1.18%, 1.3%, 1.35% untuk fase finisher (umur 21-35 hari). Asam amino yang lain mengikuti rasio terhadap total lisina menurut nutrient requirement
4
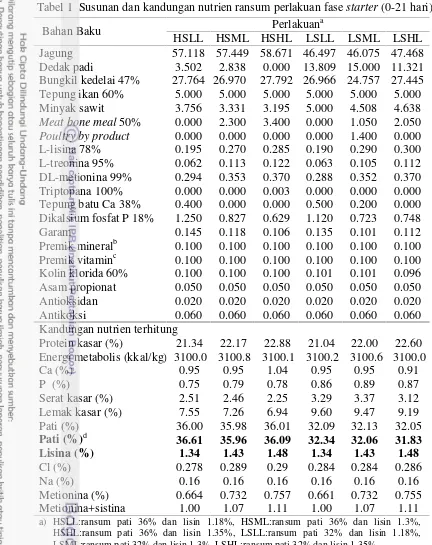
Tabel 1 Susunan dan kandungan nutrien ransum perlakuan fasestarter(0-21 hari)
Bahan Baku Perlakuan
a
HSLL HSML HSHL LSLL LSML LSHL Jagung 57.118 57.449 58.671 46.497 46.075 47.468 Dedak padi 3.502 2.838 0.000 13.809 15.000 11.321 Bungkil kedelai 47% 27.764 26.970 27.792 26.966 24.757 27.445 Tepung ikan 60% 5.000 5.000 5.000 5.000 5.000 5.000 Minyak sawit 3.756 3.331 3.195 5.000 4.508 4.638
Meat bone meal50% 0.000 2.300 3.400 0.000 1.050 2.050
Poultry by product 0.000 0.000 0.000 0.000 1.400 0.000
L-lisina 78% 0.195 0.270 0.285 0.190 0.290 0.300 L-treonina 95% 0.062 0.113 0.122 0.063 0.105 0.112 DL-metionina 99% 0.294 0.353 0.370 0.288 0.352 0.370 Triptopana 100% 0.000 0.000 0.003 0.000 0.000 0.000 Tepung batu Ca 38% 0.400 0.000 0.000 0.500 0.200 0.000 Dikalsium fosfat P 18% 1.250 0.827 0.629 1.120 0.723 0.748 Garam 0.145 0.118 0.106 0.135 0.101 0.112 Premik mineralb 0.100 0.100 0.100 0.100 0.100 0.100 Premik vitaminc 0.100 0.100 0.100 0.100 0.100 0.100 Kolin klorida 60% 0.100 0.100 0.100 0.101 0.101 0.096 Asam propionat 0.050 0.050 0.050 0.050 0.050 0.050 Antioksidan 0.020 0.020 0.020 0.020 0.020 0.020 Antikoksi 0.060 0.060 0.060 0.060 0.060 0.060 Kandungan nutrien terhitung
Protein kasar (%) 21.34 22.17 22.88 21.04 22.00 22.60 Energi metabolis (kkal/kg) 3100.0 3100.8 3100.1 3100.2 3100.6 3100.0 Ca (%) 0.95 0.95 1.04 0.95 0.95 0.91 P (%) 0.75 0.79 0.78 0.86 0.89 0.87 Serat kasar (%) 2.51 2.46 2.25 3.29 3.37 3.12 Lemak kasar (%) 7.55 7.26 6.94 9.60 9.47 9.19 Pati (%) 36.00 35.98 36.01 32.09 32.13 32.05
Pati (%)d 36.61 35.96 36.09 32.34 32.06 31.83
Lisina (%) 1.34 1.43 1.48 1.34 1.43 1.48
Cl (%) 0.278 0.289 0.29 0.284 0.284 0.286 Na (%) 0.16 0.16 0.16 0.16 0.16 0.16 Metionina (%) 0.664 0.732 0.757 0.661 0.732 0.755 Metionina+sistina 1.00 1.07 1.11 1.00 1.07 1.11
a) HSLL:ransum pati 36% dan lisin 1.18%, HSML:ransum pati 36% dan lisin 1.3%, HSHL:ransum pati 36% dan lisin 1.35%, LSLL:ransum pati 32% dan lisin 1.18%, LSML:ransum pati 32% dan lisin 1.3%, LSHL:ransum pati 32% dan lisin 1.35%
b) Tiap 1Kg ransum mengandung: Copper 16 mg, Iodine 1.25 mg, Iron 40 mg, Manganese 120 mg, Selenium 0.3 mg, Zinc 100 mg
c) Tiap 1Kg ransum mengandung Vitamin A 12000 iU, Vitamin D3 5000 iU, Vitamin E 75 iU, Vitamin K 3 mg, Thiamin (B1) 3 mg, Riboflavin (B2) 8 mg, Nicotin Acid 60 mg, Pantothenic acid 15 mg, Pyridoxin (B6) 4 mg, Biotin 0.15 mg, Folic Acid 2 mg, Vitamin B12 0.016 mg, Choline 1600
5
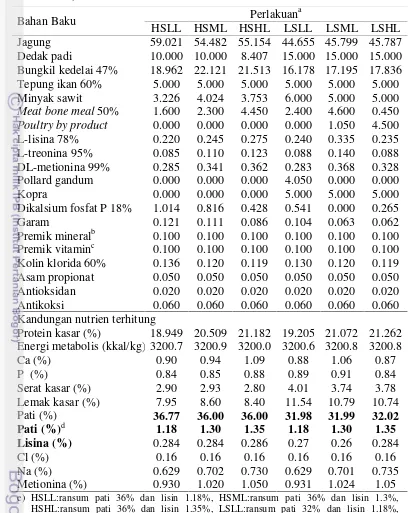
Tabel 2 Susunan dan kandungan nutrien ransum perlakuan fasefinisher(22-35 hari)
Bahan Baku Perlakuan
a
HSLL HSML HSHL LSLL LSML LSHL Jagung 59.021 54.482 55.154 44.655 45.799 45.787 Dedak padi 10.000 10.000 8.407 15.000 15.000 15.000 Bungkil kedelai 47% 18.962 22.121 21.513 16.178 17.195 17.836 Tepung ikan 60% 5.000 5.000 5.000 5.000 5.000 5.000 Minyak sawit 3.226 4.024 3.753 6.000 5.000 5.000
Meat bone meal50% 1.600 2.300 4.450 2.400 4.600 0.450
Poultry by product 0.000 0.000 0.000 0.000 1.050 4.500
L-lisina 78% 0.220 0.245 0.275 0.240 0.335 0.235 L-treonina 95% 0.085 0.110 0.123 0.088 0.140 0.088 DL-metionina 99% 0.285 0.341 0.362 0.283 0.368 0.328 Pollard gandum 0.000 0.000 0.000 4.050 0.000 0.000 Kopra 0.000 0.000 0.000 5.000 5.000 5.000 Dikalsium fosfat P 18% 1.014 0.816 0.428 0.541 0.000 0.265 Garam 0.121 0.111 0.086 0.104 0.063 0.062 Premik mineralb 0.100 0.100 0.100 0.100 0.100 0.100 Premik vitaminc 0.100 0.100 0.100 0.100 0.100 0.100 Kolin klorida 60% 0.136 0.120 0.119 0.130 0.120 0.119 Asam propionat 0.050 0.050 0.050 0.050 0.050 0.050 Antioksidan 0.020 0.020 0.020 0.020 0.020 0.020 Antikoksi 0.060 0.060 0.060 0.060 0.060 0.060 Kandungan nutrien terhitung
Protein kasar (%) 18.949 20.509 21.182 19.205 21.072 21.262 Energi metabolis (kkal/kg) 3200.7 3200.9 3200.0 3200.6 3200.8 3200.8 Ca (%) 0.90 0.94 1.09 0.88 1.06 0.87 P (%) 0.84 0.85 0.88 0.89 0.91 0.84 Serat kasar (%) 2.90 2.93 2.80 4.01 3.74 3.78 Lemak kasar (%) 7.95 8.60 8.40 11.54 10.79 10.74 Pati (%) 36.77 36.00 36.00 31.98 31.99 32.02
Pati (%)d 1.18 1.30 1.35 1.18 1.30 1.35
Lisina (%) 0.284 0.284 0.286 0.27 0.26 0.284
Cl (%) 0.16 0.16 0.16 0.16 0.16 0.16 Na (%) 0.629 0.702 0.730 0.629 0.701 0.735 Metionina (%) 0.930 1.020 1.050 0.931 1.024 1.05
e) HSLL:ransum pati 36% dan lisin 1.18%, HSML:ransum pati 36% dan lisin 1.3%, HSHL:ransum pati 36% dan lisin 1.35%, LSLL:ransum pati 32% dan lisin 1.18%, LSML:ransum pati 32% dan lisin 1.3%, LSHL:ransum pati 32% dan lisin 1.35%
f) Tiap 1Kg ransum mengandung: Copper 16 mg, Iodine 1.25 mg, Iron 40 mg, Manganese 120 mg, Selenium 0.3 mg, Zinc 100 mg
6
Metode
Kandang dan peralatannya disucihamakan menggunakan “Bioseptik” dan
untuk mencegah berkembangnya bibit penyakit menggunakan antiseptik. 240 ekor ayam broiler umur satu hari (DOC) ditempatkan pada 24 unit kandang secara acak. Kandang berukuran 1 m2berisi 10 ekorDOC, dengan alas kandang dilapisi sekam dengan tebal 5 cm. Pada saat brooding DOC diberi lampu neon 60 watt yang berfungsi sebagai penerangan dan penghangat. Ayambroilerumur satu hari (DOC) dipelihara sampai umur 35 hari. Pakan dan air minum diberikan secaraad libitum. Pakan dan sisa pakan ditimbang setiap hari untuk menentukan konsumsi pakan. Penimbangan bobot badan dilakukan setiap minggu untuk mengetahui pertambahan bobot badan.
Pengukuran proses penyerapan pati dan protein dilakukan ketika ayam
broiler berumur 35 hari. Pengukuran penyerapan protein dilakukan dengan menempatkan ayam broiler pada kandang cages individu. Ekskreta dikumpulkan 24 jam setelah selesai pemberian pakan. Ekskreta kemudian dikeringkan dan dianalisis kandungan pati (metode Antrone) dan kandungan protein (AOAC 1990). Hasil analisa tersebut kemudian digunakan untuk menghitung penyerapan pati dan protein. Pada umur 35 hari juga dilakukan pengukuran penyerapan pati di duodenum, jejunum, dan ileum. Pengukuran sebaran sisa pati di dalam bagian-bagian usus halus dilakukan dengan menghitung jumlah konsumsi pakan selama 2 jam, kemudian ayam dipotong. Usus halus ayam dikeluarkan, kemudian duodenum, jejunum dan ileum dipisahkan. Digesta pada masing-masing bagian usus tersebut ditampung dalam plastik untuk selanjutnya dioven pada suhu 60oC sampai beratnya konstan. Sampel yang sudah kering dihaluskan dan selanjutnya dianalisa kandungan patinya. Hasil analisa kandungan pati pada masing-masing bagian usus ini akan dibandingkan dengan kandungan total pati yang dikonsumsi ayam (lihat Lampiran 1).
Pengambilan sampel darah dilakukan pada saat ayam broiler berumur 21, 28 dan 35 hari pada bagian vena jugularis. Pengambilan darah dilakukan dengan mengoleskan alkohol 96%, kemudian sampel darah diambil sebanyak 1 ml menggunakan disposable syringes. Luka bekas pengambilan darah kemudian diolesi alkohol 96% untuk menghindari terjadinya infeksi. Disposable syringes
yang berisi darah diletakkan pada posisi tegak, kemudian serum darah diambil untuk analisis kadar insulin, uric acid dan glukosa. Pengukuran parameter darah dilakukan dengan metode : Kadar glukosa darah (MetodeEnzymatic Colorimetric
AKL 20101803460), kadar hormon insulin (IRMA KIT RK -400 CT [125]I) dan
asam uric acid (Metode Uricase-PAP AKL 10101804028), dibaca dengan
spektrofotometer (lihat Lampiran 1).
Rancangan Percobaan dan Model Matematika
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) faktorial 2x3 dengan 4 ulangan (Steel dan Torrie 1995). Model matematik yang digunakan adalah:
7
Yijkadalah nilai pengamatan pada faktor A (perlakuan tingkat kandungan pati)
taraf ke-i, faktor B (perlakuan tingkat kandungan asam amino) taraf ke-j dan ulangan ke-k. (µ, αi, βj) adalah komponen aditif dari rataan, pengaruh utama
faktor A dan pengaruh utama faktor B. (αβ)ijmerupakan komponen interaksi dari
faktor A dan faktor B dan (εij) adalah pengaruh acak yang menyebar normal (0,σε2).
Perlakuan
Perlakuan ransum fasestarter0-21 hari:
HSLL = Ransum dengan kandungan pati 36% dan lisina 1.34% HSML= Ransum dengan kandungan pati 36% dan lisina 1.43% HSHL= Ransum dengan kandungan pati 36% dan lisina 1.48% LSLL = Ransum dengan kandungan pati 32% dan lisina 1.34% LSML= Ransum dengan kandungan pati 32% dan lisina 1.43% LSHL= Ransum dengan kandungan pati 32% dan lisina 1.48%
Perlakuan ransum fasefinisher21-35 hari:
HSLL = Ransum dengan kandungan pati 36% dan lisina 1.18% HSML= Ransum dengan kandungan pati 36% dan lisina 1.30% HSHL= Ransum dengan kandungan pati 36% dan lisina 1.35% LSLL = Ransum dengan kandungan pati 32% dan lisina 1.18% LSML= Ransum dengan kandungan pati 32% dan lisina 1.30% LSHL= Ransum dengan kandungan pati 32% dan lisina 1.35%
Keterangan:
HSLL =High Starch Low Lysine
HSML=High Starch Medium Lysine
HSHL=High Starch High Lysine
LSLL= Low Starch Low Lysine
LSML=Low Starch Medium Lysine
LSHL =Low Starch High Lysine
Analisis Data
Data yang diperoleh dari penelitian ini dianalisis dengan menggunakan analisa General Linear Model (GLM) univariate dengan kadar pati dan kadar asam amino sebagai faktor tetap. Analisa korelasi menggunakan Bivariate Pearson. Software statistik yang digunakan SPSS 17.
Peubah yang diamati
Peubah yang diamati adalah
8
2. Pertambahan berat badan rata-rata (g/ekor), dihitung dengan menghitung berat badan pada akhir penelitian dikurangi dengan berat badan awal.
3. Konversi ransum, dihitung dengan membandingkan konsumsi pakan dengan pertambahan berat badan.
4. Penyerapan pati di usus halus (%) : dihitung dengan mengurangi total pati yang dikonsumsi dengan jumlah pati tersisa di dalam digesta usus halus, dibagi dengan total pati yang dikonsumsi dikalikan 100%.
5. Penyerapan protein (%) : dihitung dengan mengurangi total protein yang dikonsumsi dengan jumlah protein tersisa di dalam ekskreta, dibagi dengan total protein yang dikonsumsi dikalikan 100%.
9
HASIL DAN PEMBAHASAN
Pengaruh Ransum Perlakuan terhadap Performa Ayam Pedaging Umur 0-35 Hari
Konsumsi Ransum
Kandungan pati di dalam ransum yang mengalami proses pemanasan dan penambahan air pada pembuatan pellet menyebabkan gelatinasi pati. Gelatinasi pati menyebabkan partikel dalam ransum dapat terikat dengan baik, menghasilkan ransum dengan kualitas fisik yang lebih baik (Mommer et al. 1991). Menurut Naber dan Touchburn (1969) kandungan pati dalam ransum dapat mempengaruhi konsumsi ransum ayam pedaging. Konsumsi ransum dipengaruhi oleh kandungan energi dalam ransum, suhu dan kelembaban lingkungan, tingkat pertumbuhan ayam, derajat stress dan aktifitasnya (Northet al.1990). Konsumsi ransum dalam penelitian ini dapat dilihat pada Tabel 3.
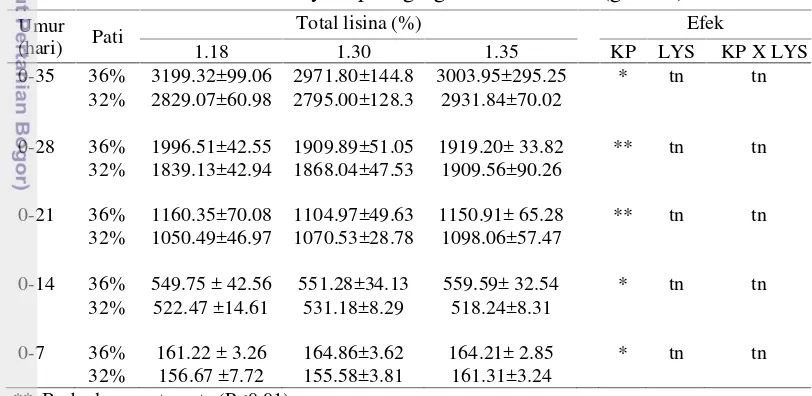
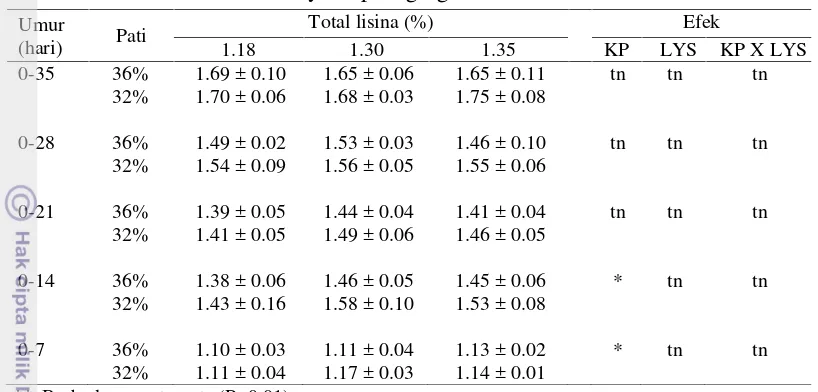
Tabel 3 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap konsumsi ransum ayam pedaging umur 0-35 hari (g/ ekor)
** Berbeda sangat nyata (P<0.01) * Berbeda nyata (P<0.05) tn Tidak berbeda nyata
Berdasarkan Tabel 3, rataan konsumsi ransum ayam/ekor umur 0-35 hari pada semua perlakuan berkisar antara 2795.76 sampai 3199.32 gram/ekor. Potensi genetik ayam broiler modern strain ROSS untuk konsumsi ransum umur 35 hari adalah 3248 gram. Rerata konsumsi pakan pada penelitian ini adalah 90.9% dari potensi genetiknya. Ransum HSLL yang mengandung pati 36% dan asam amino berbasis lisina 1.34% untuk fase starterdan lisina 1.18% menghasilkan konsumsi ransum yang paling tinggi. Ransum LSML yang mengandung pati 32% dan asam amino berbasis lisina 1.43% untuk fase starter dan lisina 1.3% menghasilkan konsumsi ransum yang paling rendah. Kandungan pati dalam ransum yang berbeda antara 36% dan 32% memberikan pengaruh yang nyata terhadap konsumsi pakan ayam 0-35 (P<0.05). Konsumsi pakan tidak dipengaruhi oleh
Umur
(hari) Pati
Total lisina (%) Efek
1.18 1.30 1.35 KP LYS KP X LYS
0-35 36% 3199.32±99.06 2971.80±144.8 3003.95±295.25 * tn tn
32% 2829.07±60.98 2795.00±128.3 2931.84±70.02
0-28 36% 1996.51±42.55 1909.89±51.05 1919.20± 33.82 ** tn tn
32% 1839.13±42.94 1868.04±47.53 1909.56±90.26
0-21 36% 1160.35±70.08 1104.97±49.63 1150.91± 65.28 ** tn tn
32% 1050.49±46.97 1070.53±28.78 1098.06±57.47
0-14 36% 549.75 ± 42.56 551.28±34.13 559.59± 32.54 * tn tn
32% 522.47 ±14.61 531.18±8.29 518.24±8.31
0-7 36% 161.22 ± 3.26 164.86±3.62 164.21± 2.85 * tn tn
10
0 500 1000 1500 2000 2500 3000 3500
1 2 3 4 5
K
o
n
su
m
si
r
a
n
su
m
(
g
/
e
k
o
r
)
11
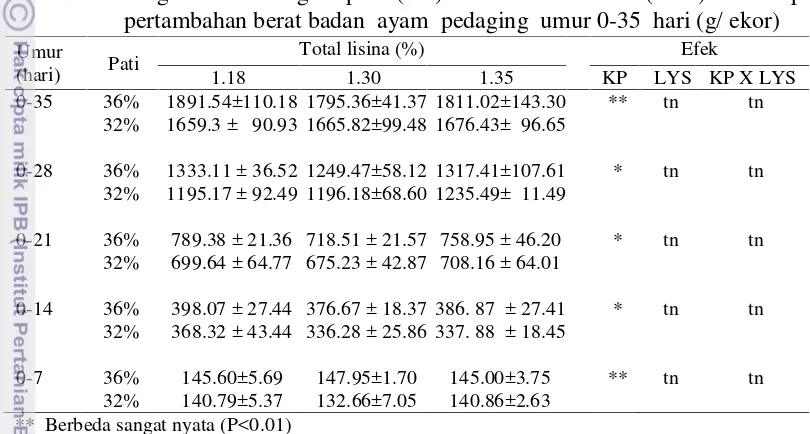
sangat nyata terhadap pertambahan berat badan ayam 0-35 (P<0.01). Pertambahan berat badan tidak dipengaruhi oleh perbedaan tingkat kandungan asam amino di dalam ransum. Hasil penelitian tidak menunjukkan adanya interaksi antara tingkat pati dan asam amino terhadap pertambahan berat badan ayam. Ransum dengan kandungan pati 36% menyebabkan konsumsi ransum yang lebih tinggi dibanding ransum yang mengandung kadar pati 32% (P<0.05). Perbedaan konsumsi ransum ini menyebabkan konsumsi pati yang berbeda juga.
Tabel 4 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap pertambahan berat badan ayam pedaging umur 0-35 hari (g/ ekor)
** Berbeda sangat nyata (P<0.01) * Berbeda nyata (P<0.05) tn Tidak berbeda nyata
Pati dipecah menjadi glukosa di dalam usus halus. Pancreatic α-amylase
disekresikan ke dalam lumen usus halus, terutama di jejunum untuk memecah
ikatan α-1,4 pati (Rogel et al. 1987). Glukosa diserap melalui dinding usus, melalui mekanisme pompa sodium dan potasium. Glukosa diperlukan sebagai prekusor dalam siklus energi asam sitrat (citric acid cycle) (Klasing 2000). Oksidasi glukosa menghasilkan energi yang diperlukan untuk sintesis glikogen, asam amino, asam lemak dan metabolit lainnya (Harper et al. 1987). Ransum yang mengandung pati 36% menghasilkan glukosa yang lebih banyak dibandingkan dengan ransum yang mengandung pati 32%. Glukosa yang dihasilkan dari pati ransum ditentukan oleh jumlah pati yang masuk di usus halus dikalikan dengan tingkat kecernaannya. Ransum dengan kandungan pati yang cukup, akan menyediakan glukosa secara kontinyu ke dalam peredaran darah. Glukosa di dalam darah ini akan direspon oleh lepasnya hormon insulin (Henquin 2000). Insulin memegang peranan penting dalam transpor glukosa dan deposisi protein ke dalam otot selama pertumbuhan (Fox 1996). Black et al. (2005) menyatakan bahwa tidak seimbangnya laju kecernaan pati dan protein mempengaruhi deposisi protein dan performa ayam pedaging.
Ada hubungan yang positif antara peningkatan kandungan amilosa terhadap performa pertumbuhan ayam pedaging (Pirgozliev et al. 2000). Perbedaan kandungan pati di dalam ransum menyebabkan adanya variasi total amilosa yang dikonsumsi. Variasi jumlah amilosa yang dikonsumsi dapat berpengaruh terhadap
Umur
(hari) Pati
Total lisina (%) Efek
1.18 1.30 1.35 KP LYS KP X LYS
0-35 36% 1891.54±110.18 1795.36±41.37 1811.02±143.30 ** tn tn
32% 1659.3 ± 90.93 1665.82±99.48 1676.43± 96.65
0-28 36% 1333.11 ± 36.52 1249.47±58.12 1317.41±107.61 * tn tn
32% 1195.17 ± 92.49 1196.18±68.60 1235.49± 11.49
0-21 36% 789.38 ± 21.36 718.51 ± 21.57 758.95 ± 46.20 * tn tn
32% 699.64 ± 64.77 675.23 ± 42.87 708.16 ± 64.01
0-14 36% 398.07 ± 27.44 376.67 ± 18.37 386. 87 ± 27.41 * tn tn
32% 368.32 ± 43.44 336.28 ± 25.86 337. 88 ± 18.45
0-7 36% 145.60±5.69 147.95±1.70 145.00±3.75 ** tn tn
13
Tabel 5 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap konversi ransum ayam pedaging umur 0-35 hari
** Berbeda sangat nyata (P<0.01) * Berbeda nyata (P<0.05) tn Tidak berbeda nyata
Kandungan pati berpengaruh nyata terhadap konversi ransum pada ayam pedaging fase starter umur 0-7 hari dan 7-14 hari (P<0.05). Kandungan pati dalam ransum sebesar 36% memberikan konversi ransum yang lebih baik dibandingkan ransum yang mengandung pati 32%. Hal ini menunjukkan bahwa pengaruh kandungan pati lebih nyata pada ransum dengan energi yang lebih rendah seperti pada ransum fase starter. Kecernaan lemak pada ayam pedaging umur 0-7 hari masih rendah, karena belum tersedianya enzim lipase secara sempurna (Uni et al. 1995). Hal ini menyebabkan suplai energi dari pati lebih diperlukan dibanding suplai energi dari pemecahan lemak, sehingga pengaruh konversi ransum lebih nyata pada ayam starter, yang diberi ransum dengan kandungan pati 36%. Pada ayam pedaging fase finisher umur lebih dari 21 hari, pengaruh jenis pati dan laju kecernaan di usus halus lebih berpengaruh terhadap konversi ransum dibandingkan dengan jumlah patinya .
Pengaruh Ransum Perlakuan terhadap Penyerapan Protein dan Penyerapan Pati di Usus Halus Ayam Pedaging Umur 0-35 Hari
Penyerapan Protein
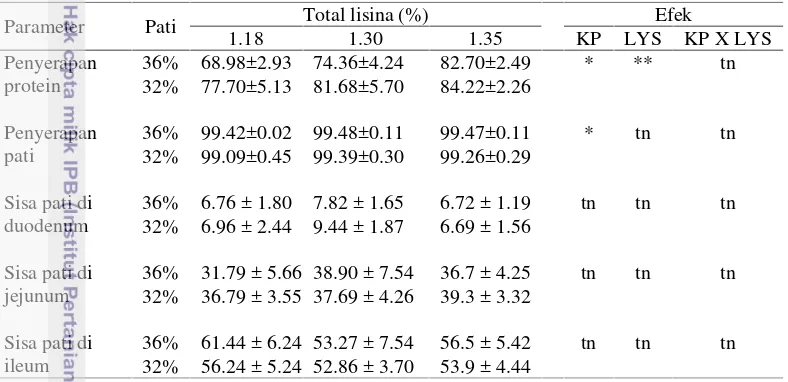
Data penyerapan protein disajikan pada Tabel 6. Rataan penyerapan protein total untuk ransum ayam umur 35 hari pada semua perlakuan berkisar antara 68.98% sampai 84.22%. Kecernaan protein untuk ransum berbasis jagung dan bungkil kedelai yang diberikan pada ayam pedaging adalah berkisar 79.1% sampai 86.5% (Zanella et al. 1999). Kecernaan protein dipengaruhi oleh variasi bahan baku yang digunakan dalam ransum (Moran 1982). Ransum HSLL yang mengandung pati 36% dan asam amino berbasis lisina 1.34% untuk fase starter
14
fasestarterdan lisina 1.35% menghasilkan penyerapan protein yang paling tinggi. Kandungan pati dalam ransum berpengaruh nyata terhadap penyerapan protein ransum ayam 0-35 (P<0.05). Penyerapan protein ransum dipengaruhi oleh perbedaan tingkat kandungan pati dan asam amino di dalam ransum (P<0.05). Hasil penelitian tidak menunjukkan adanya interaksi antara tingkat pati dan asam amino terhadap kecernaan protein ransum ayam.
Tabel 6 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap penyerapan protein, penyerapan pati dan pola sebaran sisa pati di dalam usus halus ayam pedaging 35 hari (%)
** Berbeda sangat nyata (P<0.01) * Berbeda nyata (P<0.05) tn Tidak berbeda nyata
Ransum yang mengandung pati lebih tinggi mempunyai penyerapan protein yang lebih rendah dibandingkan dengan ransum yang mengandung pati lebih rendah yaitu 75.35% dan 84.22%. Hal ini menunjukkan lebih banyak protein yang diserap ayam pada ransum dengan kandungan pati rendah. Hasil penelitian ini menunjukkan bahwa meskipun ransum dengan kadar pati rendah mempunyai penyerapan protein yang lebih tinggi, tetapi tidak memberikan pertambahan berat badan yang lebih baik dibandingkan dengan ransum yang mengandung pati lebih tinggi. Kandungan uric acid darah pada ransum yang mengandung pati rendah dan asam amino tinggi menghasilkan nilai yang paling tinggi. Hal ini menunjukkan bahwa adanya penggunaan protein yang tidak efisien untuk pembentukan daging. Salah satu indikator efisiensi penggunaan protein adalah dengan mengukur kadar konsentrasiuric acid di dalam serum darah (Donsbough
et al. 2000). Selle et al. (2012) menyatakan bahwa laju penyerapan asam amino berhubungan dengan laju kecernaan pati dan penyerapan glukosa. Hal ini yang berpengaruh terhadap pertumbuhan dan deposisi protein. Black et al. (2005) menyatakan bahwa tidak seimbangnya laju kecernaan pati dan protein mempengaruhi deposisi protein dan performa ayam pedaging. Grizard et al. (1999) menyatakan insulin berperan dalam deposisi protein di dalam tubuh.
Koefisien kecernaan zat gizi pada bagian akhir usus halus adalah menggambarkan total jumlah zat gizi yang tersedia di dalam pakan tersebut, tetapi tidak menjelaskan di bagian usus mana terjadinya proses pencernaan terjadi.
Parameter Pati Total lisina (%) Efek
1.18 1.30 1.35 KP LYS KP X LYS
Penyerapan protein
36% 68.98±2.93 74.36±4.24 82.70±2.49 * ** tn
32% 77.70±5.13 81.68±5.70 84.22±2.26
Penyerapan pati
36% 99.42±0.02 99.48±0.11 99.47±0.11 * tn tn
15
0 10 20 30 40 50 60 70 80 90
HSLL HSML HSHL LSLL LSML LSLL
P
e
n
y
e
r
a
p
a
n
p
r
o
te
in
%
16
98.80 98.90 99.00 99.10 99.20 99.30 99.40 99.50 99.60
HSLL HSML HSHL LSLL LSML LSLL
P
e
n
y
e
r
a
p
a
n
p
a
ti
%
17
Pengaruh Ransum Perlakuan terhadap Parameter Serum Ayam Pedaging Umur 0-35 Hari
Glukosa Serum
Data glukosa serum disajikan pada Tabel 7. Kadar glukosa serum penelitian berkisar antara 200.14 sampai 223.68 mg/dL. Hazelwood (2000) menyatakan bahwa kadar glukosa pada ayam pedaging lebih tinggi dibandingkan dengan hewan mamalia, kisarannya 180 sampai 250 mg/dL. Ayam dalam keadaan hipoglikemia bila kadar glukosa darahnya 137 mg/dL dan hiperglikemia pada kadar glukosa darah 363 mg/dL (Goodwin et al. 1994). Hasil penelitian tidak menunjukkan perbedaan yang nyata pada semua perlakuan yang diberikan. Ransum yang mengandung pati yang lebih tinggi cenderung mempunyai kadar glukosa darah yang lebih tinggi dibanding dengan ransum yang mengandung kadar pati rendah (214.97 mg/dL dan 206.21 mg/dL). Glukosa darah selalu diatur dalam kadar yang relatif tetap melalui mekanisme glucoregulation yang dikontrol oleh beberapa hormon metabolic seperti insulin, glukagon,pancreatic polypeptide,
corticosteron dan thyroxin (Hazelwood 2000). Glukosa diserap melalui dinding usus, melalui mekanisme pompa sodium dan potasium. Glukosa diperlukan sebagai prekusor dalam siklus energi asam sitrat (citric acid cycle) (Klasing 2000). Oksidasi glukosa menghasilkan energi yang diperlukan untuk sintesis glikogen, asam amino, asam lemak dan metabolit lainnya (Harperet al. 1987). Nilai glukosa ayam umur 35 hari pada penelitian ini dapat dilihat pada Gambar 5.
Tabel 7 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap kadar glukosa serum ayam pedaging umur 21, 28 dan 35 hari (mg/ dL)
** Berbeda sangat nyata (P<0.01) * Berbeda nyata (P<0.05) tn Tidak berbeda nyata
18
185.00 190.00 195.00 200.00 205.00 210.00 215.00 220.00 225.00 230.00
HSLL HSML HSHL LSLL LSML LSLL
G
lu
k
o
sa
m
g
/d
L
Ransum perlakuan
Umur
(hari) Pati
Total lisina (%) Efek
1.18 1.30 1.35 KP LYS KP X LYS
35 36% 2.34±0.02 2.82±0.26 3.02±0.11 ** ** *
32% 2.92±0.03 2.87±0.18 3.12±0.05
28 36% 2.51±0.08 2.74±0.06 3.06±0.03 ** ** *
32% 3.04±0.15 2.95±0.03 3.10±0.21
21 36% 2.32±0.04 2.47±0.06 2.86±0.07 ** ** **
19
0.00 0.50 1.00 1.50 2.00 2.50 3.00 3.50
HSLL HSML HSHL LSLL LSML LSLL
Ur
ic
a
c
id
(m
g
/d
L
)
20
Insulin
Kadar insulin serum ayam dipengaruhi secara nyata oleh tingkat kandungan pati dan asam amino di dalam ransum (p<0.05). Ransum HSHL yang mengandung pati 36% dan asam amino berbasis lisina 1.48% untuk fase starter
dan lisina 1.35% menghasilkan insulin yang paling tinggi. Ransum LSML yang mengandung pati 32% dan asam amino berbasis lisina 1.43% untuk fase starter
dan lisina 1.3% menghasilkan insulin yang paling rendah. Interaksi antara kandungan pati dan asam amino di dalam ransum tidak mempengaruhi kadar insulin. Hal ini menunjukkan bahwa glukosa hasil pemecahan pati dalam ransum menstimulasi disekresikannya hormon insulin oleh pancreas (Henquin 2000). Perbedaan kandungan pati dalam ransum yang berbeda akan menghasilkan glukosa yang berbeda juga jumlahnya. Kandungan karbohidrat, lemak dan protein yang terkandung dalam pakan yang dikonsumsi, akan menentukan jenis hormon yang berperan (Go 1989). Ransum isokalori yang mengandung pati rendah akan mempunyai kandungan lemak dan protein yang berbeda. Kandungan lemak dan protein ini akan direspon oleh hormon cholecystokinin (CCK). Hormon CCK ini juga akan meningkatkan sekresi hormon insulin, yang akan mempengaruhi respon glisemik (Rushakoff et al. 1993). Grizard et al. (1999) menyatakan insulin berperan dalam deposisi protein di dalam tubuh. Laju kecernaan pati mempunyai efek respon metabolik dari hormon insulin dan sinkronisasi penggunaan energi dan protein tersedia (Weurding et al. 2003). Nilai kadar glukosa darah ransum perlakuan pada ayam umur 35 hari dapat dilihat pada Tabel 9.
Tabel 9 Pengaruh kandungan pati (KP) dan asam amino (LYS) terhadap kadar insulin serum ayam pedaging umur 21, 28 dan 35 hari (µIU/mL)
** Berbeda sangat nyata (P<0.01)
* Berbeda nyata (P<0.05)
tn Tidak berbeda nyata
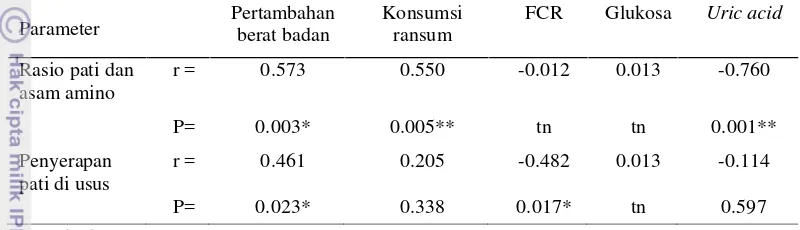
Korelasi Antara Rasio Pati dan Asam Amino terhadap Pertumbuhan dan Parameter Darah Ayam Pedaging Umur 0-35 Hari
Hubungan antara rasio pati dan asam amino pada ransum isokalorik di dalam penelitian ini dijelaskan pada Tabel 10. Hasil penelitian ini menunjukkan bahwa rasio pati dan asam amino mempunyai korelasi yang positif terhadap pertambahan berat badan (r=0.573, P<0.05) dan konsumsi ransum (r=0.573, P<0.05). Penyerapan pati di dalam usus halus mempunyai korelasi yang positif
Umur
(hari) Pati
Total lisina (%) Efek
1.18 1.30 1.35 KP LYS KP X LYS
35 36% 2.52±0.25 2.16±0.18 2.72±0.20 ** ** tn
32% 2.39±0.20 1.73±0.05 2.34±0.20
28 36% 2.48±0.80 2.32±0.17 2.21±0.15 * ** tn
32% 2.37±0.14 2.06±0.29 1.96±0.16
21 36% 2.20±0.21 2.66±0.17 2.32±0.23 * ** tn
21
terhadap pertambahan berat badan (r=0.0461, P<0.05), dan korelasi negatif terhadap konversi pakan (r=-0.0482, P<0.05). Hasil penelitian ini menunjukkan bahwa rasio pati 36% dan asam amino berbasis lisina 1.18% memberikan pertambahan berat badan yang paling tinggi. Konversi ransum paling rendah diperoleh dari ransum dengan rasio pati 36% dan asam amino berbasis lisina 1.3%.
Tabel 10 Korelasi Pearson antara rasio pati dan asam amino terhadap parameter pertumbuhan dan profile darah ayam pedaging 0-35 hari
** Berbeda sangat nyata (P<0.01) * Berbeda nyata (P<0.05) tn Tidak berbeda nyata
Parameter Pertambahanberat badan Konsumsiransum FCR Glukosa Uric acid
Rasio pati dan asam amino
r = 0.573 0.550 -0.012 0.013 -0.760
P= 0.003* 0.005** tn tn 0.001**
Penyerapan pati di usus
r = 0.461 0.205 -0.482 0.013 -0.114
22
SIMPULAN DAN SARAN
Simpulan
Rasio pati 36% dan asam amino berbasis lisina 1.34% untuk fasestarterdan 1.18% untuk fase finisher memberikan pertambahan berat badan yang paling tinggi. Rasio pati 36% dan asam amino berbasis lisina 1.43% untuk fase starter
dan 1.3% untuk fasefinishermemberikan konversi ransum paling baik. Rasio pati dan asam amino di dalam ransum mempunyai korelasi yang positif terhadap pertambahan berat badan (r=0.573, P<0.05) dan konsumsi pakan (r=0.55, P<0.01). Penyerapan pati di dalam usus halus mempunyai korelasi yang positif terhadap pertambahan berat badan (r=0.461, P<0.05) dan korelasi negatif terhadap konversi pakan (r= -0.482, P<0.05).
Saran
23
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 1990. Official Methods of Analysis. Washington DC (US).
Bjorck I, Liljerberg H, Ostman E.2000. Low glycemic-index foods [suppl].Br J Nutr.83:149-S155.
Black JL, Hughes RJ, Nielsen SG, Tredrea AM, Alpine RM, Barneveld RJV. 2005. The energy value of cereal grains, particulary wheat and sorghum for poultry. Di dalam : Proceedings of Australian Poultry Science Symposium16:21-29.
Bouyeh M, Gevorgyan OK. 2011. Influence of excess lysine and methionine on cholesterol, fat and performance of broiler chicks.J Anim Vet Adv. 10 (12): 1546-1550.
Cutler RG. 1984. Urate and ascorbate: Their possible roles as antioxidants in determining longevity of mammalian species Arch. Gerontol. Geriatr.
3:321-348.
Donsbough AL, Powell S, Waguespack A, Binder TD, Southern LL. 2010. Uric acid, urea and ammonia concentrations in serum and uric acid
concentration in excreta as indicators of amino acid utilization in diets for broilers.Poult Sc.89:287-294.
Fox SI. 1996.Human Physiology. Page 588. Wm.C. Brown Pub, Dubugue, IA. Goodwin, Denise, John B, McMurray BL, William IR, Danny LM. 1994.
Blood glucose value and definitions of hypoglicemia and hyperglycemia. Georg Poult Lab (Georgia). The University of Georgia.
Go LW. 1989. Role of Gastrointestinal Hormones in Adaptation. Nutrition and Origin of Disease pp 321-331. New York (US). Academic Pr.
Grizard J, Picard B, Dardevet D, Rochon BMC. 1999. Protein Metabolism and Nutrition, pp 184-187. EAAP Publication no 96. Wageningen Pr.
Hare JM, Johnson RJ. 2003. Uric acid predict clinical outcomes in heart failure: Insights regarding the role of xanthin oxidase and uric acid in desease pathophysiology circulation 107:1951-1953.
Harmeyer J. 2002. The Physiological role of L-carnitine.Lohmann Inf.27:1-8. Harper AE, Miller RH, Block KP. 1984. Branched-chain amino acid metabolism.
Annul Rev Nutr.4:409-454.
Hartman SA, Teorgaleb T, Geng K, Gyenai, Guan X, Smith E. 2006. Comparisson of plasma uric acid levels in five varieties of domestic turkey, Meleagris gallopavo.Poult Sc.85: 1791-1794.
Hazelwood RL. 2000. Pancreatic hormones, insulin, glicagon molar ratios and somatostatin as determinants of avian carbohydrate metabolism. J Exp Zool.232:647-652.
Henquin JC. 2000. Triggering and amplifying pathways of regulation of insulin secretion by glucose.Diab.49:1751-1760.
Hevia P, Clifford AJ. 1977. Protein Intake, uric acid metabolism and protein efficiency ratio in growing chick.J Nutr.107(6):959-964.
Klasing KC. 2000. Anatomy and physiology of the digestive system, In :
24
Leeson S, Summers JD. 2001. Nutrition of The Chicken. 4th ed. Ontario: Univ Books.
Liu SY, Selle PH, Cowieson AJ. 2013. Starch and nitrogen kinetics influence growth performance and nitrogen retention in red sorghum-based diets Di dalam : Proceedings of Australian Poultry Science Symposium 24:115-118.
McNab JM. 1996. Factors affecting the energy value of wheat for poultry.
World’sPoult Sci J. 52:69-73.
Moran ET. 1982. Starch digestion in fowl.Poult Sc.61:1257-1267.
Mommer RP, Ballantyne DK. 1991. Reasons for pelleting. Pages 3-6. in A Guide to Pelleting Technology. Hess and Clark, Inc. Ashland. OH.
Muchtadi D. 2011.Karbohidrat Pangan dan Kesehatan. Hal 68. Bandung (ID). Penerbit Alfabeta.
Naber EC, Touchburn, SP. 1969. Effect of hydration, gelatinization and ball milling of starch on growth and energy utilization by the chick. Poult Sc. 48:1583-1589. New York (US). Van Nostrand Reinhold.
Pirgozliev V, Rose SP, Kettlewell PS, Bedford MR. 2000. Relationship between chemical composition of wheat and broiler chicken growth performance.
Brit Poult Sc.41:697-698.
Pirgozliev V, Rose SP, Kettlewell PS, Bedford MR. 2009. The effect of amylase: amylopectin ratio in dietary on growth performance and gut morphology in broiler chickens.Arch Geflugelk. 74(1):21-29.
Rogel AM, Balnave D, Bryden WL, Annison EF. 1987. The digestion of wheat starch in broiler chickens.Aust J Agric Res.38:639-649.
Rushakoff RA, Goldfine ID, Beucaria LJ, Mathur A. 1993. Reduced postprandial choleystokinin secretion in patients with non insulin depent diabetes mellitus. Evidence for a role for CCK in regulating postprandial hyperglycemia.J Clin Endrocrinol Metab.76:489-493.
Schneeman BO. 1994. Carbohydrates : Significance for energy balance and gastrointestinal function.J Nutr.124:17475-17535.
Selle PH, Liu SY, Cai J, Cowieson AJ. 2012. Animal Production Science. doi:10.1071/AN12026.
Steel RGD, Torrie JH. 1995. Prinsip dan Prosedur Statistika : Suatu Pendekatan Biometrik. Jakarta (ID). Gramedia.
Szabo, Mezes AM, Horn P, Suto Z. 2005. Developmental dynamic of some blood biochemical parameters in the growing turkey. Acta Vet Hung. 53(4):397-409.
25
Wang X, Brown IL, Evans AJ, Conway PL. 1999. The protective effects of high amylase maize (amylomaize) starch granules on the survival of Bifidobacterium spp.in the mouse intestinal tract. J Appl Microbiol. 87:631-639.
Weurding RE, Veldman A, Veen WAG, Van der Aar PJ, Verstegen MWA. 2001. In vitro starch digestion correlates well with rate and extent of starch digestion in broiler chickens. J Nutr.131:2336-2342.
Weurding RE, Enting H, Verstegen MVA. 2003. The relation between starch digestion rate and amino acid level for broiler chickens. Poult Sc. 82:279-284.
Xie M, Hou, Huang S, Zhao W, Yu L, Li JY, Wu Y. 2004. Interrelationship Between methionin and cystein of early Peking duckling.Poult Sc. 83:1703-1708.
Zanella, Sakomura INK, Silversides FG, Fiqueird A, Pack M. 1999. Effect of enzyme supplementations of wheat varieties.Pak J Nutr.1:248-256.
27
LAMPIRAN
Lampiran 1 Metode Koleksi digesta usus halus, Pengukuran performa produksi, Pengukuran profile darah, Pengukuran penyerapan protein dan Pengukuran penyerapan pati di usus halus ayam pedaging
Koleksi Digesta Bagian Usus Halus
Koleksi digesta untuk pengukuran konsentrasi dan sebaran pati didalam bagian usus halus dilakukan hampir sama dengan koleksi excreta untuk penyerapan protein. Ayam pedaging umur 35 hari ditempatkan pada kandang
cages individu. Ayam pedaging kemudian dipuasakan makan selama 24 jam untuk menghilangkan sisa pakan di saluran pencernaan. Ayam pedaging kemudian diberi pakan selama 2 jam (08.00-10.00). Jumlah konsumsi pakan selama 2 jam dicatat. Ayam kemudian dipotong dan dikeluarkan jeroannya. Usus halus ayam kemudian dipisahkan menjadi bagian duodenum, jejunum dan ileum. Digesta pada masing masing bagian tersebut ditampung dalam tabung aluminium untuk selanjutnya dioven pada suhu 60oC sampai beratnya konstan. Sampel yang sudah kering selanjutnya dianalisa kandungan patinya. Hasil analisa kandungan pati pada masing-masing bagian usus ini akan dibandingkan dengan kandungan total pati yang dikonsumsi ayam untuk menghitung konsentrasi dan sebaran padi pada bagian usus halus.
Pengukuran Performa Produksi
Prosedur pengukuran performa ayam pedaging adalah sebagai berikut :
Bobot badan (g), diperoleh dari hasil penimbangan ayam. Penimbangan bobot badan dilakukan setiap minggu selama penelitian untuk mengetahui pertambahan bobot badan. Pertambahan berat badan (g), diperoleh dari hasil pengurangan berat badan akhir dikurangi dengan bobot badan awal. Konsumsi pakan (g/ekor)
diperoleh dari jumlah pakan yang diberikan dikurangi dengan sisa pakan.
Konversi pakan, diperoleh dari hasil pembagian total konsumsi pakan dengan pertambahan berat badan selama periode pengukuran.
Asam urat serum (Metode Uricase-PAP)
Samakan temperatur reagen dan sample dengan suhu ruang sebelum digunakan. Siapkan tabung reaksi untuk menempatkan standar, serum kontrol dan sample. Tempelkan label pada masing-masing tabung. Homogenkan semua reagen dan sample dengan hati-hati untuk menghindari busa. Siapkan larutan asam urat standar dengan konsentrasi 2, 4, 6, dan 8 mg/dl sebanyak 50 µl. Siapkan larutan blanko dengan memipet 50 µl air destilata. Pipet 20 µl larutan asam urat standar, blanko, dan sample kedalam tabung reaksi yang telah disiapkan. Tambahkan 1000 µl reagent kedalam masing-masing tabung reaksi. Vortex selama 10 detik untuk menghomogenkan campuran. Inkubasi selama 5-10 menit pada suhu ruang. Bacalah absorbansi standar dan sample menggunakan spektrofotometer dengan panjang gelombang 520 nm. Hitung konsentrasi asam urat dengan persamaan :
28
Glukosa serum (Metode Enzymatic colorimetric) (AKL 20101803460)
Samakan temperatur reagen dan sample dengan suhu ruang sebelum digunakan. Siapkan tabung reaksi untuk menempatkan standar, serum kontrol dan sample. Tempelkan label pada masing-masing tabung. Homogenkan semua reagen dan sample dengan hati-hati untuk menghindari busa. Siapkan larutan glukosa standar dengan konsentrasi 25, 50, 75, dan 100 mg/dl sebanyak 50 µl. Siapkan larutan blanko dengan memipet 50 µl air destilata. Pipet 10 µl larutan glukosa standar, blanko, dan sample kedalam tabung reaksi yang telah disiapkan. Tambahkan 1000 µl reagent ke dalam masing-masing tabung reaksi. Vortex selama 10 detik untuk menghomogenkan campuran. Inkubasi selama 5-10 menit pada suhu ruang. Bacalah absorbansi standar dan sample menggunakan spektrofotometer dengan panjang gelombang 500 nm. Buatlah kurva regresi absorbansi dan konsentrasi glukosa untuk menentukan konsentrasi glukosa. Hitung konsentrasi glukosa dengan persamaan :
Kadar Glukosa (mg/100 ml) =Absorbansi sample
Absorbansi standar x 100
Analisis insulin [125I] IRMA KIT (RK-400CT)
Samakan temperatur reagen dan sample dengan suhu ruang sebelum digunakan. Tempelkan label pada tabung untuk menempatkan standar, serum kontrol dan sample. Homogenkan semua reagen dan sample dengan hati-hati untuk menghindari busa. Pipet 100 µl standar, kontrol, dan sample ke dalam tabung berlabel yang telah disiapkan. Pipet 200 µl tracer ke dalam masing-masing tabung. Kocok tabung dengan menggunakan shaker. Pastikan rak tabung menempel erat padashaker plate. Nyalakan shaker dan atur kecepatan agar cairan berputar secara konstan. Inkubasi tabung selama 2 jam, kemudian kocok kembali pada temperature ruang. Tambahkan 2 ml larutan pencuci buffer pada masing-masing tabung. Tuangkan supernatan dengan membalikkan rak tabung. Pada posisi rak tabung terbalik, letakkan rak di atas kertas absorben selama 2 menit. Kembalikan posisi rak tabung pada posisi tegak, dan ulangi kembali langkah 8 dua kali lagi. Hitung masing-masing tabung selama minimal 60 detik padagamma counter. Hitung konsentrasi insulin.
Konsentrasi insulin dihitung dengan cara menghitung rataan count per minute (cpm) pada masing-masing tabung yang diuji. Hitung percent binding normal (B/T) pada masing-masing standar, control, dan sample secara berurutan dengan menggunakan persamaan :
B/T(%)=Stadar, Kontrol, Sample (cpm)
Tracer (cpm) x 100
Gambar B/T (%) masing-masing standar yang disesuaikan dengan konsentrasi insulin menggunakan grafik logaritma. Pengukuran konsentrasi insulin pada kontrol dan sample menggunakan interpolasi dari kurva standar.
Pengukuran penyerapan protein
Penyerapan Protein Kasar (PK) dihitung dengan menggunakan rumus :
Penyerapan PK =Konsumsi PK(g)- Eksresi PK (g)
29
Perhitungan penyerapan pati pada bagian usus halus
Pengukuran kadar pati pada pakan dan feses dilakukan melalui tiga tahap yaitu preparasi sample, membuat kurva standar, dan analisa sample. Preparasi sample dilakukan dengan memasukkan 20 gram sample ke dalam gelas piala, kemudian tambahkan 20 ml alkohol 80%. Hancurkan sample dengan waring blender sampai semua gula terekstrak. Pindahkan sampel yang telah hancur ke gelas piala yang lain secara kuantitatif. Saring sample dengan menggunakan kapas, kemudian pindahkan filtrate yang diperoleh ke dalam gelas piala yang lain. Cuci sisa padatan pada kapas dengan alkohol 80% sampai seluruh pati dalam bentuk filtrate. Ukur nilai pH dari filtrate contoh. Bila asam, tambahkan CaCO3 sampai cukup basa dan panaskan pada penangas air 100 oC selama 30 menit. Setelah dingin, saring sample dengan kertas Whatman No. 2. Uapkan alkohol dari sample dengan memanaskan filtrate pada penangas air 85 oC atau dengan bantuan vakum. Jika masih ada endapan, saring kembali sample. Tambahkan 1,5 - 2,5 ml Pb asetat jenuh pada sample (sampai larutan jernih). Pindahkan filtrate pada labu takar 250 ml. Tambahkan destilata sampai volumenya 250 ml. Kocok labu takar, kemudian saring dan ambil filtratnya sebanyak 30 ml. Tambahkan Na-oksalat kering sebanyak 1,5 g pada filtrate untuk mengendapkan Pb, kemudian saring kembali filtrate. Filtrat diambil 5 ml untuk analisis pati total, jika diperlukan filtrate dapat diencerkan terlebih dahulu.
Pembuatan kurva standar dilakukan dengan cara memipet larutan glukosa standar sebanyak 0,2; 0,4; 0,6; 0,8 dan 1,0 ml ke dalam tabung reaksi, kemudian diencerkan sampai total volume masing-masing tabung 1,0 ml. Buat larutan blanko dengan memipet 1 ml air destilata ke dalam tabung reaksi. Tambahkan dengan cepat 5 ml pereaksi anthrone ke dalam masing-masing larutan glukosa standard dan blanko kemudian tutup tabung reaksi. Vortex dan kocok hingga merata. Panaskan tabung reaksi di atas penangas air 100 OC selama 12 menit. Setelah didinginkan, pindahkan larutan ke dalam kuvet dan baca absorbansinya dengan UV-Vis spektrophotometer pada 630 nm. Buat plot kurva standar dan tentukan persamaan regresinya.
Analisis sample analisa pati dilakukan dengan cara memasukkan 5 ml sample (dari preparasi sample) ke dalam labu takar 100 ml dan diencerkan sampai tanda tera dengan air destilata. Masukkan 1 ml sample tersebut ke dalam tabung reaksi bertutup. Tahap analisis selanjutnya sama seperti pembuatan kurva standar. Tentukan konsentrasi pati pada sample dengan menggunakan kurva standar dan faktor pengenceran yang dilakukan dengan menggunakan rumus :
Total pati (%) =Pati(g)x Faktor pengenceran
30
Lampiran 2 Hasil analisis statistik performa, profil metabolit serum dan penyerapan protein dan pati ayam pedaging umur 0-35 hari
Analisis sidik ragam pertambahan berat badan
Sumber Jumlah
Faktor Koreksi 186154.075 5 37230.815 3.609 .020
Intersep 7.3497 1 7.3497 7124.140 .000
Kadar Pati 164252.142 1 164252.142 15.922 .001
Asam Amino 8498.600 2 4249.300 .412 .668
Kadar Pati * Asam Amino 13403.332 2 6701.666 .650 .534
Galat 185688.593 18 10316.033
Faktor Koreksi 416482.556 5 83296.511 3.493 .022
Intersep 2.0968 1 2.0968 8789.227 .000
Kadar Pati 254941.584 1 254941.584 10.690 .004
Asam Amino 69936.987 2 34968.493 1.466 .257
Kadar Pati * Asam Amino 91603.985 2 45801.992 1.921 .175
Galat 429274.405 18 23848.578
Faktor Koreksi 416482.556 5 83296.511 3.493 .022
Intersep 2.0968 1 2.0968 8789.227 .000
Kadar Pati 254941.584 1 254941.584 10.690 .004
Asam Amino 69936.987 2 34968.493 1.466 .257
Kadar Pati * Asam Amino 91603.985 2 45801.992 1.921 .175
Galat 429274.405 18 23848.578
Total 2.1058 24
31
Faktor Koreksi 1155.632 5 231.126 1.122 .384
Intersep 1064435.138 1 1064435.138 5167.876 .000
Kadar Pati 460.051 1 460.051 2.234 .152
Asam Amino 563.662 2 281.831 1.368 .280
Kadar Pati * Asam Amino 131.919 2 65.960 .320 .730
Galat 3707.487 18 205.971
Faktor Koreksi 2.329 5 .466 12.419 .000
Intersep 128.441 1 128.441 3424.772 .000
Kadar Pati .586 1 .586 15.632 .001
Asam Amino 1.638 2 .819 21.842 .000
Kadar Pati * Asam Amino .104 2 .052 1.390 .275
Galat .675 18 .038
Faktor Koreksi 1.481 5 .296 14.201 .000
Intersep 195.335 1 195.335 9364.215 .000
Kadar Pati .345 1 .345 16.538 .001
Asam Amino .789 2 .394 18.903 .000
Kadar Pati * Asam Amino .347 2 .174 8.329 .003
Galat .375 18 .021
Total 197.192 24
32
Faktor Koreksi .424 5 .085 1.736 .177
Intersep 236949.908 1 236949.908 4854673.715 .000
Kadar Pati .235 1 .235 4.814 .042
Asam Amino .129 2 .065 1.326 .290
Kadar Pati * Asam Amino .059 2 .030 .608 .555
Galat .879 18 .049
Total 236951.210 24
Total Terkoreksi 1.302 23
Analisis sidik ragam kecernaan protein kasar
Sumber Jumlah
Faktor Koreksi 673.997 5 134.799 7.668 .001
Intersep 147052.112 1 147052.112 8365.305 .000
Kadar Pati 205.511 1 205.511 11.691 .003
Asam Amino 410.236 2 205.118 11.668 .001
Kadar Pati * Asam Amino 58.251 2 29.125 1.657 .219
Galat 316.419 18 17.579
Total 148042.527 24
Total Terkoreksi 990.415 23
Analisis sidik ragam konsentrasi pati duodenum
Sumber Jumlah
Faktor Koreksi 23.691 5 4.738 1.469 .248
Intersep 1315.690 1 1315.690 407.983 .000
Kadar Pati 2.164 1 2.164 .671 .423
Asam Amino 18.327 2 9.163 2.841 .085
Kadar Pati * Asam Amino 3.200 2 1.600 .496 .617
Galat 58.048 18 3.225
Total 1397.428 24
33
Analisis sidik ragam konsentrasi pati jejenum
Sumber Jumlah
Kuadrat
Derajat Bebas
Kuadrat
Tengah F Hitung Sig.
Faktor Koreksi 146.869 5 29.374 1.183 .356
Intersep 32631.854 1 32631.854 1314.103 .000
Kadar Pati 27.552 1 27.552 1.110 .306
Asam Amino 80.067 2 40.034 1.612 .227
Kadar Pati * Asam Amino 39.249 2 19.625 .790 .469
Galat 446.977 18 24.832
Total 33225.700 24
Total Terkoreksi 593.845 23
Analisis sidik ragam konsentrasi pati ileum
Sumber Jumlah
Kuadrat
Derajat Bebas
Kuadrat
Tengah F Hitung Sig.
Faktor Koreksi 204.037 5 40.807 1.314 .302
Intersep 74519.510 1 74519.510 2399.907 .000
Kadar Pati 45.159 1 45.159 1.454 .243
Asam Amino 135.946 2 67.973 2.189 .141
Kadar Pati * Asam Amino 22.932 2 11.466 .369 .696
Galat 558.918 18 31.051
Total 75282.465 24
34
RIWAYAT HIDUP
Penulis dilahirkan di Bojonegoro Jawa timur pada tanggal 14 Desember 1969 dari ayah Hadi Sugito dan ibu Elyzabeth Carolina Rey. Penulis adalah putra kelima dari lima bersaudara. Pendidikan sarjana ditempuh di Fakultas Peternakan, Universitas Gajah Mada, lulus pada tahun 1993. Pada tahun 2011, penulis diterima di Program Studi Ilmu Nutrisi dan Pakan Program Pascasarjana Institut Pertanian Bogor. Sebagian hasil penelitian ini, ditulis dalam sebuah karya ilmiah yang berjudul Relationship between Starch and Amino Acid Levels of Broiler Diets on Growth Performance and Feed Efficiency yang akan diterbitkan pada jurnalInternational Journal of Poultry Sciencepada tahun 2014.