PEMANFAATAN OLEORESIN CABAI UNTUK FILM
ANTIMIKROBA PENGHAMBAT PERTUMBUHAN
Escherichia coli
UMI MAHARANI
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pemanfaatan Oleoresin Cabai untuk Film Antimikroba Penghambat Pertumbuhan Escherichia coli adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini. Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ii
ABSTRAK
UMI MAHARANI. Pemanfaatan Oleoresin Cabai untuk Film Antimikroba Penghambat Pertumbuhan Escherichia coli. Dibimbing oleh ENDANG WARSIKI.
Oleoresin cabai mengandung senyawa aktif berupa capsaicin yang dapat menghambat pertumbuhan mikroba. Oleoresin ini digunakan sebagai agen antimikroba pada pembuatan film antimikroba (AM). Penelitian ini bertujuan untuk (i) menghasilkan film antimikroba dengan memanfaatkan oleoresin cabai; (ii) mengetahui pengaruh tiga jenis oleoresin cabai terhadap aktifitas penghambatan E. coli; (iii) mengetahui pengaruh konsentrasi oleoresin cabai dalam film AM terhadap aktifitas penghambatan E. coli; dan (iv) mengetahui nilai pH, ketebalan, kekuatan tarik, dan persentase pemanjangan film AM terpilih. Penelitian ini terdiri atas: pembuatan oleoresin cabai, pengujian aktifitas antimikroba oleoresin cabai, pembuatan film AM dengan tiga macam oleoresin cabai, pengujian aktifitas antimikroba film AM, pengujian pH, kekuatan tarik film AM, dan persentase pemanjangan. Hasil uji aktifitas antimikroba oleoresin cabai menunjukan bahwa CapsicumTM memiliki aktifitas penghambatan terhadap E. coli lebih besar dibandingkan dengan PaprikaTM dan Capsicum varietas Bara. Film AM dengan penambahan CapsicumTM juga memiliki aktifitas penghambatan lebih besar dibandingkan dengan PaprikaTM dan Capsicum varietas Bara. Film AM dengan oleoresin 0.6% dan pH rendah juga memiliki aktifitas penghambatan lebih besar dibandingkan film AM konsentrasi 0.2% dan 0.4%. Film AM Capsicum varietas Bara memiliki ketebalan, kekuatan tarik dan persentase pemanjangan lebih besar dibandingkan film AM PaprikaTM.
Kata kunci: capsaicin, film antimikroba, oleoresin cabai
ABSTRACT
UMI MAHARANI. Utilization of Chilli Oleoresin for Growth Inhibitor of Escherichia coli Antimicrobial Film. Supervised by ENDANG WARSIKI.
results showed that CapsicumTM had activity against Escherichia coli greater than PaprikaTM and Capsicum varieties Bara. CapsicumTM films had also the largest inhibition activity compare to PaprikaTM and Capsicum Bara variety. AM films with 0.6% oleoresin and low pH also had inhibition activity greater than AM films with 0.2% and 0.4% concentration. Film with capsicum Bara variety had thickness, tensile strength and elongation percentage greater than PaprikaTM films.
PEMANFAATAN OLEORESIN CABAI UNTUK FILM
ANTIMIKROBA PENGHAMBAT PERTUMBUHAN
Escherichia coli
UMI MAHARANI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Teknologi Industri Pertanian
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul : Pemanfaatan Oleoresin Cabai untuk Film Antimikroba Penghambat Pertumbuhan Escherichia coli
Nama : Umi Maharani NIM : F34100150
Disetujui oleh
Dr. Endang Warsiki, S.TP., M.Si. Pembimbing
Diketahui oleh
Prof. Dr. Ir. Nastiti Siswi Indrasti Ketua Departemen
8
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya, sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2014 sampai Agustus 2014, yaitu
“Pemanfaatan Oleoresin Cabai untuk Film Antimikroba Penghambat Pertumbuhan Escherichia coli”.
Penulis menyampaikan terima kasih kepada Dr. Endang Warsiki, S.TP, M.Si selaku dosen pembimbing atas bimbingan selama penelitian dan penyelesaian skripsi, Dr. Ir. Mulyorini Rahayuningsih, M.Si. dan Dr. Ir. Liesbetini Haditjaroko M.S. atas masukan dan saran yang diberikan. Mamah, papah (alm), kakak, dan adik yang selalu memberikan doa, dukungan, dan semangat kepada penulis. Penulis juga menyampaikan terima kasih kepada Ibu Ega, Bapak Gunawan, Teh Eti, Bapak Edi, Ibu Dyah, Ibu Rini, Ibu Sri, Bapak Sugi, Roseiga Retno, Eka Nurazmi, Elok Pratiwi, Tenti Rahmawati, Lisa Adiyanti, teman satu bimbingan, teman-teman proses, teman kost Windy, dan TIN 47 yang tidak dapat disebutkan satu persatu atas bantuan dan semangat kepada penulis dalam menyelesaikan penelitian. Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Oleoresin Cabai dan Capsaicin 3
Escherichia coli 4
Media Eosin Methylene Blue 5
METODE PENELITIAN 6
Bahan 6
Alat 7
Prosedur 7
Pembuatan Oleoresin Cabai 7
Pengujian Aktifitas Antimikroba Oleoresin Cabai 8
Rancangan Percobaan dan Analisis Data 9
Pembuatan Film AM dengan Tiga Jenis Oleoresin Cabai 10
Pengujian Aktifitas Antimikroba Film AM 12
Pengujian pH Film AM Terpilih 13
Pengujian Ketebalan Film AM Terpilih 13
Pengujian Kekuatan Tarik dan Persentase Pemanjangan Film AM Terpilih 13
HASIL DAN PEMBAHASAN 13
Pembuatan Oleoresin Cabai 13
Aktifitas Antimikroba Oleoresin Cabai 15
Film AM Oleoresin Cabai 16
Aktifitas Antimikroba Film AM 18
Nilai pH Film AM Terpilih 20
Ketebalan Film AM Terpilih 21
Kekuatan Tarik dan Persentase Pemanjangan Film AM Terpilih 22
10
DAFTAR TABEL
Tabel 1 Hasil uji aktifitas antimikroba pada CapsicumTM (A1), PaprikaTM (A2),
dan Capsicum varietas Bara (A3) 15
Tabel 2 Zona bening film kontrol (K), film AM CapsicumTM (A1), film AM PaprikaTM (A2), dan film AM Capsicum varietas Bara (A3) 18
Tabel 3 Hasil uji pH larutan film 20
Tabel 4 Hasil uji ketebalan film 21
Tabel 5 Hasil uji kuat tarik dan elongasi 22
DAFTAR GAMBAR
Gambar 1 Penampang media EMB yang ditumbuhi E. coli (Thrmo Fischer
Scientific 2013) 5
Gambar 2 Diagram alir pembuatan oleoresin cabai (Setyaningrum 2013) 8 Gambar 3 Diagram alir uji aktifitas antimikroba oleoresin cabai 9 Gambar 4 Ilustrasi gambar pembentukan zona bening 9 Gambar 5 Diagram alir pembuatan film antimikroba (AM) (Lestari 2013) 11 Gambar 6 Diagram alir pengujian aktifitas antimikroba film AM (Li et al. 2006)
12 Gambar 7 (a) Cabai segar; (b) Cabai bubuk; (c) Oleoresin cabai 14 Gambar 8 Penampang zona bening yang terbentuk di sekitar oleoresin. DL adalah
diameter luar dan DD adalah diameter dalam 15 Gambar 9 Penampang: (a) Film kontrol; (b) Film CapsicumTM; (c) Film
PaprikaTM; (d) Film Capsicum varietas Bara 17 Gambar 10 Penampang zona bening hasil uji aktifitas antimikroba film AM 18
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Perkembangan inovasi dalam pembuatan kemasan pangan semakin meningkat seiring dengan perkembangan ilmu pengetahuan dan teknologi. Selain itu, maraknya penggunaan bahan kimia berbahaya, seperti boraks, formalin, dan rhodamin B, juga mengkhawatirkan konsumen. Berdasarkan hasil pengawasan Badan Pengawas Obat-obatan dan Makanan (BPOM) sepanjang tahun 2006 sampai 2010 ditemukan sebanyak 40 sampai 44 persen jajanan anak di sekolah mengandung bahan pengawet kimia berbahaya. Dalam mengatasi hal tersebut, muncullah berbagai jenis kemasan pangan berbahan alami yang dibuat untuk meminimalisir penggunaan bahan kimia berbahaya. Salah satu jenis kemasan adalah kemasan antimikroba untuk meminimalkan penggunaan bahan pengawet kimia. Kemasan antimikroba merupakan sistem kemasan yang dapat mengendalikan, menghambat atau memperlambat pertumbuhan mikroorganisme patogen, dan mengurangi kontaminasi pada permukaan makanan. Senyawa antimikroba yang digunakan berasal dari bahan pengawet alami berupa ekstrak tumbuh-tumbuhan yang dicampurkan ke dalam bahan kemasan atau film (Maizura 2008). Salah satu ekstrak tumbuhan yang digunakan, yaitu oleoresin cabai.
Berdasarkan penelitian yang telah dilakukan Setyaningrum (2013), oleoresin cabai terbukti mengandung senyawa antimikroba, tetapi belum diketahui secara pasti keefektifan senyawa antimikroba jika diaplikasikan ke dalam film. Penelitian ini juga merupakan penelitian lanjutan dalam hal aplikasi oleoresin cabai dalam pembuatan film antimikroba. Oleoresin cabai adalah campuran alami yang homogen dari resin-resin dan minyak atsiri yang terkandung dalam cabai. Oleoresin cabai mengandung senyawa aktif yang dikenal dengan capsaicin. Kandungan capsaicin dalam oleoresin cabai digolongkan sebagai salah satu bahan pengawet alami. Senyawa aktif ini berfungsi sebagai agen antimikroba, sehingga dapat mencegah pertumbuhan mikroba.
Mikroba rentan tumbuh pada produk pangan dan seringkali menimbulkan keracunan pangan. Keracunan pangan terutama disebabkan oleh bakteri patogen, seperti: Staphylococcus aureus, Salmonella, dan Escherichia coli. Pada umumnya, air merupakan pembawa E. coli patogen atau yang biasa disebut Enterohaemorragic E. coli (EHEC). E. coli O157:H7 merupakan tipe EHEC yang berbahaya bagi kesehatan manusia (Fardiaz 1989). Keberadaan E. coli O157:H7 dalam pangan kemungkinan karena sanitasi yang rendah. E. coli tipe ini biasanya menyerang produk daging, sayuran, makanan beku, dan makanan mentah, sehingga diperlukan kemasan atau film yang mengandung senyawa antimikroba untuk menghambat pertumbuhan E. coli. Berkaitan dengan hal tersebut, maka dilakukan aplikasi oleoresin cabai ke dalam film untuk mengetahui keefektifan oleoresin cabai menghambat pertumbuhan E. coli.
2
konsentrasi untuk mengetahui pengaruh konsentrasi oleoresin cabai terhadap aktifitas mikroba. Selain itu, pembuatan film AM ini hanya menggunakan agen antimikroba dari oleoresin cabai agar dapat mengetahui pengaruh spesifik oleoresin cabai terhadap aktifitas mikroba. Oleoresin cabai yang digunakan terdiri dari dua jenis, yaitu Capsicum dan Paprika. Capsicum adalah oleoresin yag berasal dari cabai rawit, sedangkan Paprika adalah oleoresin yang berasal dari cabai merah atau cabai besar. Pemilihan jenis oleoresin berdasarkan perbedaan kandungan capsaicin pada Capsicum lebih besar (14%) dibandingkan Paprika (kurang dari 3.9%) (Purseglove et al. 1981).
Tujuan
Penelitian ini bertujuan untuk (i) menghasilkan film antimikroba dengan memanfaatkan oleoresin cabai; (ii) mengetahui pengaruh tiga jenis oleoresin cabai terhadap aktifitas penghambatan Escherichia coli; (iii) mengetahui pengaruh konsentrasi oleoresin cabai dalam film AM terhadap aktifitas penghambatan Escherichia coli; serta (iv) mengetahui nilai pH, ketebalan, kekuatan tarik, dan persentase pemanjangan film AM terpilih.
Ruang Lingkup Penelitian
Pembuatan film antimikroba (AM) dengan menggunakan tiga jenis oleoresin, yaitu CapsicumTM, PaprikaTM, dan Capsicum varietas Bara. Pengujian aktifitas antimikroba film AM hanya dilakukan terhadap bakteri Escherichia coli. Pengujian pH, ketebalan, kekuatan tarik, dan persentase pemanjangan dilakukan terhadap film AM dengan zona bening terbesar dari setiap jenis oleoresin cabai.
TINJAUAN PUSTAKA
Kemasan Antimikroba
3 tersebut efektif untuk dilakukan pada kemasan vakum karena bahan kemasan dapat bersentuhan langsung dengan permukaan pangan. Penggunaan kemasan antimikroba dilakukan secara pelapisan atau lebih dikenal dengan edible coating. Kemasan antimikroba dilapiskan pada permukaan produk. Keunggulan dari kemasan antimikroba adalah penggunaan zat antimikroba dalam kemasan dapat dilakukan seminimal mungkin, memperpanjang umur simpan produk tanpa menggunakan bahan pengawet kimia, dan kemasan aman untuk dikonsumsi (Krochta et al. 1994).
Pelepasan senyawa antimikroba ke dalam kemasan dapat diperoleh dengan beberapa cara, yaitu (i) secara tradisional dengan menambahkan sachet berisi senyawa antimikroba dan bersifat permiabel ke dalam kemasan; (ii) bahan-bahan pengawet dikombinasikan pada bagian permukaan atau ke dalam bahan kemasan polimer dengan pencampuran atau pelapisan; (iii) bahan antimikroba dienkapsulasi atau diletakkan di antara lapisan, sehingga secara perlahan – lahan akan keluar menuju bahan pangan; dan (iv) penggunaan enzim yang diimobilisasi dan bahan yang mempunyai gugus fungsional antimikroba yang terikat secara kimia pada permukaan bahan. Beberapa gugus fungsional yang memiliki aktifitas antimikroba telah ditambahkan dan diimobilasi pada permukaan film polimer dengan modifikasi metode kimia yaitu: (i) peptida yang terikat secara kovalen dengan resin tidak larut air dan mempunyai aktifitas antimikroba; serta (ii) polimer yang permukaanya disinari dengan sinar laser merupakan cara yang efektif untuk memperbaiki sifat-sifat adhesi dari polimer, memodifikasi sifat penghambatan, dan memberikan aktifitas antimikroba pada polimer (Julianti dan Nurminah 2006). Beberapa penelitian kemasan antimikroba telah dikerjakan dengan memanfaatkan ekstrak daun sirih, kunyit, dan bawang putih (Warsiki et al. 2009), aplikasi kemasan antimikroba (AM) untuk bakso (Warsiki et al. 2013), dan kemasan AM dari kitosan (Warsiki et al. 2009).
Oleoresin Cabai dan Capsaicin
4
sintesis protein serta merusak DNA (Pamungkas 2008). DNA akan mengalami kerusakan dan pita DNA akan terpotong melalui mekanisme oksidatif. Sifat capsaicin yang mudah larut dalam lemak dan dinding sel bakteri gram negatif yang terdiri dari 80% lemak akan mempermudah penetrasi capsaicin ke dalam dinding sel bakteri gram negatif, sehingga capsaicin dapat menghambat pertumbuhan sel bakteri negatif.
Escherichia coli
Escherichia coli merupakan bakteri fakultatif anaerob, kemoorganotropik, dan mempunyai tipe metabolisme fermentasi dan respirasi, tetapi pertumbuhannya di bawah keadaan anaerob. E. coli yang anaerob akan memfermentasi laktosa, sehingga menyebabkan perubahan warna laktos broth menjadi kuning akibat terbentuknya senyawa asam hasil fermentasi laktosa yang mengubah warna indikator. Kemampuan E. coli mengubah warna indikator telah dimanfaatkan untuk membuat label cerdas pendeteksi E. coli (Lestari 2013). Pada media Eosin Methylene Blue (EMB), E. coli juga akan memberikan warna khas yaitu koloni berwarna gelap dan metalik (Lestari 2013). Beberapa uji biokimia untuk E. coli yaitu: indol positif, reduksi nitrat positif, fermentasi manitol positif, fermentasi laktosa positif, H2S negatif, sitrat negatif, Voges-Proskauer negatif, memproduksi gas dari glukosa, dan metil merah positif. Bakteri ini juga termasuk dalam kelompok Enterobacteria, bersifat Gram-negatif, oksidase negatif, laktosa dan katalase positif, berbentuk batang pendek, dan tidak membentuk spora. Sel ini biasanya bergerak dengan flagella. E. coli memproduksi macam-macam phili yang berbeda, banyak macamnya pada struktur dan sensitifitas antigen, antara lain filamentus dan proteinaceus (Lay dan Hastowo 1992).
E. coli berbentuk besar (2 sampai 3 µm), circular, konveks, dan koloni tidak berpigmen pada nutrient dan media darah. Mikroorganisme ini tumbuh baik pada suhu optimal 37oC pada media yang mengandung 1% pepton sebagai sumber karbon dan nitrogen serta dapat bertahan hingga suhu 60oC selama 15 menit atau pada 55oC selama 60 menit. Kisaran suhu pertumbuhan E. coli adalah 10 sampai 40oC dengan suhu optimum 30oC dan kisaran pH antara 7 sampai 7.5 dengan nilai Aw (aktivitas air) minimum untuk pertumbuhan adalah 0.96. Bakteri ini sangat sensitif terhadap panas, sehingga inaktivitasi dapat dilakukan pada suhu pasteurisasi (70oC sampai 80oC) (Fardiaz 1989).
5 dan cemaran fekal pada air dan pangan (Sentra Informasi Keracunan Nasional 2014).
Media Eosin Methylene Blue
Media Eosin Methylene Blue Agar adalah hasil modifikasi dari Levine M. (1918-1921) yang digunakan untuk diferensiasi Escherichia coli dan Enterobacteria aerogenes, untuk identifikasi cepat dari Candida albicans, dan untuk identifikasi Staphylococcus koagulase-positif. Media EMB dirumuskan secara spesifik oleh APHA (American Public Health Association) (1970-1992). Media ini dibuat dan dirumuskan dengan tujuan untuk mendeteksi dan membedakan mikroorganisme dari kelompok bakteri coliform. E. coli termasuk bakteri coliform dan memproduksi asam. Dalam suasana asam, pewarna EMB diabsorbsi oleh koloni E. coli, sehingga setelah inkubasi selama 24 jam, koloni E. coli akan berwarna hijau metalik. Lestari (2013) juga telah membuktikan mekanisme EMB ini dalam mengembangkan label cerdas pendeteksi E. coli. Berikut ini penampang media EMB yang telah diinokulasi dengan E. coli.
Gambar 1 Penampang media EMB yang ditumbuhi E. coli (Thrmo Fischer Scientific 2013)
6
Salmonella typhimurium. Laktosa juga berfungsi sebagai sumber karbohidrat untuk pertumbuhan mikroorganisme. Dipotassium hydrogen phosphate merupakan garam yang sangat larut dalam air. Bahan ini berfungsi sebagai pupuk, makanan aditif, dan zat penyangga. Eosin dan methylene blue berfungsi sebagai Indikator warna. Agar (dari rumput laut) berfungsi untuk pemadat media. Agar sulit didegradasi oleh mikroorganisme pada umumnya dan mencair pada suhu 45⁰C (Thrmo Fischer Scientific 2013).
EMB merupakan media selektif dan diferensial. EMB disebut media selektif karena mengandung pewarna methylene blue yang dapat menghambat pertumbuhan bakteri gram positif. Selain itu, EMB juga disebut media diferensial karena memiliki indikator warna untuk membedakan bakteri gram negatif yang dapat memfermentasi laktosa dengan bakteri gram negatif yang tidak dapat memfermentasi laktosa. Bakteri gram negatif yang dapat memfermentasi laktosa akan mengubah suasana EMB menjadi asam, sehingga pewarna eosin akan merespon dengan menghasilkan warna hijau metalik kemudian pewarna ini akan diserap oleh bakteri, sehingga bakteri akan berwarna hijau metalik. Bakteri gram negatif yang tidak dapat memfermentasi laktosa, akan meningkatkan pH media dengan memecah protein, sehingga bakteri tidak dapat menyerap pewarna eosin dan koloni akan tampak tidak berwarna (Thrmo Fischer Scientific 2013).
EMB Agar adalah media yang digunakan untuk mengetahui ada atau tidaknya bakteri coliform di dalam suatu sampel. Media ini sangat baik untuk mengkonfirmasi bahwa kontaminan adalah E. coli karena E. coli termasuk bakteri gram negatif yang dapat memfermentasi laktosa. Pada masa inkubasi, E. coli akan memfermentasi zat untuk kelangsungan hidupnya. E. coli memiliki enzim β -galaktosidase yang akan memecah laktosa dalam EMB menjadi glukosa dan galaktosa (Anonim 2008). Proses fermentasi terjadi saat semua gula terdegradasi dalam bentuk yang lebih sederhana. Fermentasi tersebut akan menghasilkan asam organik berupa asam laktat. Adanya asam laktat akan mengubah pH EMB menjadi asam. Dalam kondisi asam, eosin akan merespon perubahan pH, sehingga menghasilkan warna hijau metalik dan E. coli akan menyerap pewarna eosine tersebut, sehingga pertumbuhan E. coli dapat dideteksi dengan adanya warna hijau metalik. Media ini juga berbentuk padat berguna untuk menjaga sel tidak berpindah tempat, sehingga akan mudah dihitung dan dipisahkan jenisnya ketika tumbuh menjadi koloni. Media padat juga menampakkan difusi hasil metabolit bakteri, sehingga memudahkan dalam pengujian suatu hasil metabolit (Fardiaz 1992).
METODE PENELITIAN
Bahan
7 aktifitas antimikroba adalah akuades, agar bubuk, tapioka, gliserin, oleoresin cabai, kultur bakteri Escherichia coli, Laktose Broth, dan EMB. Oleoresin yang digunakan ada tiga macam, yaitu: CapsicumTM, PaprikaTM, dan Capsicum varietas Bara.
Alat
Alat-alat yang digunakan yaitu: timbangan digital, baskom, blower, alumunium foil, penggiling, saringan 40 mesh, jar, cawan alumunium, termometer, sumbat, labu Erlenmeyer, corong vakum, labu Erlenmeyer vakum, kertas saring, alat Rotary Evaporator, gelas piala, sudip, gelas ukur, hot stirrer, cawan petri, plat kaca, oven, desikator, jarum ose, mikropipet, kertas pH, inkubator, mikrometer skrup, dan alat Tensil Strength and Elongation Tester Industries.
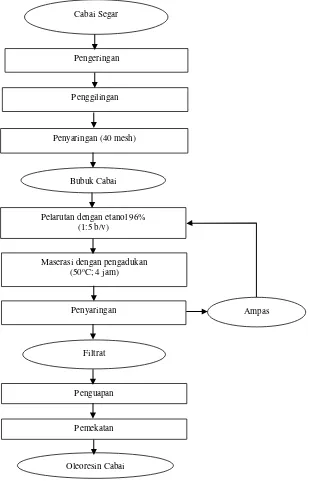
Prosedur Pembuatan Oleoresin Cabai
8
Gambar 2 Diagram alir pembuatan oleoresin cabai (Setyaningrum 2013) Pengujian Aktifitas Antimikroba Oleoresin Cabai
Pada tahap ini, ketiga jenis oleoresin dilakukan pengujian aktifitas antimikroba dengan metode difusi sumur terhadap Escherichia coli. Media agar yang digunakan adalah Eosin Methylene Blue (EMB) sebagai media spesifik untuk pertumbuhan E. coli, yang ditandai dengan warna hijau metalik. Kultur murni E. coli pada agar miring sebanyak satu ose diinokulasikan ke dalam laktos broth dan dilakukan pengocokan sampai homogen, kemudian laktos broth tersebut diinkubasi pada suhu 37oC selama 24 jam. Biakan E. coli dalam laktos broth dipipet sebanyak 0.1 mL dan diinokulasikan pada agar cawan, kemudian bagian
Cabai Segar
Pengeringan
Penggilingan
Penyaringan (40 mesh)
Pelarutan dengan etanol 96% (1:5 b/v)
Penyaringan Maserasi dengan pengadukan
(50oC; 4 jam)
Filtrat
Penguapan
Pemekatan
Oleoresin Cabai
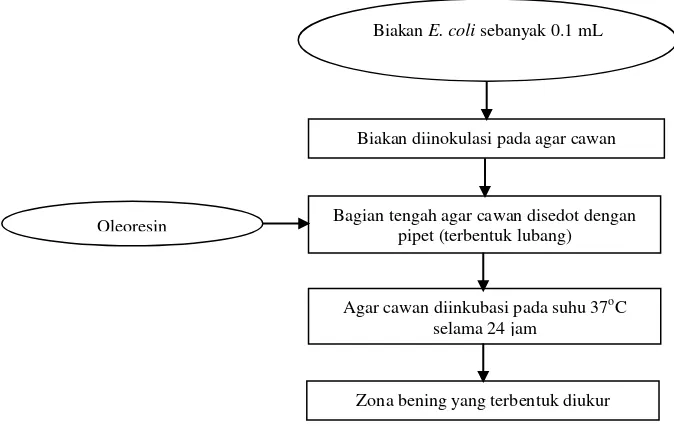
9 tengah agar cawan disedot dengan menggunakan pipet khusus, sehingga membentuk lubang sampai terlihat bagian dasar cawan petri. Pada bagian yang berlubang dimasukkan oleoresin, kemudian cawan diinkubasi pada suhu 37oC selama 24 jam. Pengamatan dilakukan setelah 24 jam dengan melihat dan mengukur zona bening yang terbentuk di sekitar oleoresin. Berikut ini diagram alir pengujian aktifitas antimikroba oleoresin dan ilustrasi gambar pembentukan zona bening.
Gambar 3 Diagram alir uji aktifitas antimikroba oleoresin cabai
Gambar 4 Ilustrasi gambar pembentukan zona bening Rancangan Percobaan dan Analisis Data
Rancangan yang digunakan dalam pembuatan film adalah Rancangan Acak Lengkap (RAL) Faktorial dengan dua faktor dan tiga pengulangan. Faktor pertama adalah jenis oleoresin cabai yang terdiri atas tiga taraf, yaitu CapsicumTM diberi kode A1, PaprikaTM diberi kode A2, dan Capsicum varietas Bara diberi
EMB
Sampel
Zona bening
DL DD
Cawan petri Oleoresin
Biakan diinokulasi pada agar cawan
Agar cawan diinkubasi pada suhu 37oC selama 24 jam
Zona bening yang terbentuk diukur Bagian tengah agar cawan disedot dengan
10
kode A3. Faktor kedua adalah tingkat konsentrasi oleoresin cabai yang terdiri atas tiga taraf, yaitu 0.2% (b/v) diberi kode B1, 0.4% (b/v) diberi kode B2, dan 0.6% (b/v) diberi kode B3. Rancangan percobaan ini akan memperlihatkan pengaruh faktor tersebut terhadap aktifitas antimikroba film AM yang ditunjukan dengan luas zona bening terbentuk. Model matematika RAL Faktorial dirumuskan sebagai berikut:
Yijk = μ + Ai + Bj + (AB)ij + εijk
Yijk adalah nilai pengamatan pada faktor jenis oleoresin cabai taraf ke-i dan konsentrasi oleoresin cabai taraf ke-j pada ulangan ke-k. Nilai μ adalah nilai tengah populasi (rata-rata yang sesungguhnya). Ai adalah pengaruh jenis oleoresin cabai taraf ke-i, Bj adalah pengaruh konsentrasi oleoresin cabai taraf ke-j, (AB)ij adalah pengaruh jenis oleoresin cabai taraf ke-i dan konsentrasi oleoresin cabai taraf ke-j, dan εijk adalah pengaruh acak kombinasi faktor jenis oleoresin cabai taraf ke-i dan konsentrasi oleoresin cabai taraf ke-j pada ulangan ke-k.
Data yang diperoleh dilakukan analisis ragam (ANOVA). Perlakuan memberikan pengaruh nyata jika F hitung lebih besar dari F tabel, kemudian dilakukan uji lanjut Duncan. Software yang digunakan dalam pengolahan data adalah Microsoft Excel dan SPSS 22.
Selanjutnya, pada hasil uji ANOVA akan diketahui film AM dengan zona bening terbesar dari setiap jenis oleoresin cabai. Film AM tersebut dilakukan pengujian pH, ketebalan, kekuatan tarik, dan persentase pemanjangan film. Hasil dari uji ketebalan, kekuatan tarik, dan persentase pemanjangan film AM dilakukan analisis dengan Rancangan Acak Lengkap dengan tiga pengulangan. Pemberian kode sampel yang diberikan sama dengan RAL Faktorial. Model matematika RAL dirumuskan sebagai berikut:
Yij = μ + Ti + εij
Yij adalah nilai pengamatan pada satuan percobaan ke-i (ketebalan/kekuatan tarik/persentase pemanjangan film), ulangan ke-j. μ adalah nilai tengah umum, Ti adalah perlakuan ketebalan/kekuatan tarik/persentase pemanjangan film, dan εij adalah pengaruh acak (kesalahan percobaan) pada perlakuan ketebalan/kekuatan tarik/persentase pemanjangan film dan ulangan ke-j. Data yang diperoleh di analisis ragam (ANOVA). Perlakuan memberikan pengaruh nyata jika F hitung lebih besar dari F tabel, kemudian dilakukan uji lanjut Duncan. Software yang digunakan dalam pengolahan data adalah Microsoft Excel dan SPSS 22.
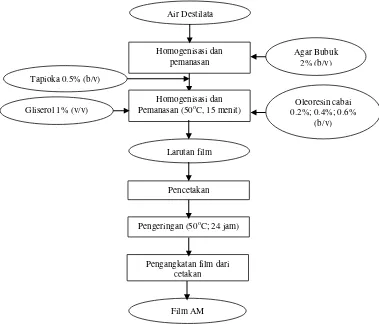
Pembuatan Film AM dengan Tiga Jenis Oleoresin Cabai
11 larutan tersebut sambil tetap dilakukan pemanasan. Pemanas dimatikan setelah larutan homogen, kemudian gliserol sebanyak 1% (v/v) ditambahkan pada kisaran suhu 60 sampai 70oC dan diaduk sampai homogen selama kurang lebih lima sampai sepuluh menit. Pada akhir proses (suhu 50oC), oleoresin cabai ditambahkan ke dalam larutan film dan dilakukan pengadukan selama lima menit. Tiga jenis oleoresin cabai yang digunakan adalah CapsicumTM, PaprikaTM, dan Capsicum varietas Bara. Setiap jenis oleoresin cabai ditambahkan ke dalam larutan film dengan tiga tingkatan konsentrasi sebesar 0.2%, 0.4%, dan 0.6% (b/v).
Selanjutnya, larutan film dicetak pada plat kaca atau cawan petri yang telah disterilkan. Film yang telah dicetak dibiarkan 10 menit pada suhu ruang kemudian dikeringkan pada suhu 50oC di dalam oven selama 24 jam. Film yang telah kering dilepaskan dari cawan petri dan plat kaca. Film yang dicetak dengan cawan petri untuk keperluan uji antimikroba, sedangkan film yang dicetak dengan plat kaca untuk keperluan uji kekuatan tarik dan persentase pemanjangan. Pada tahap ini juga dibuat film kontrol. Film kontrol adalah film tanpa penambahan oleoresin cabai. Proses pembuatan film Antimikroba dapat dilihat pada Gambar 5.
Gambar 5 Diagram alir pembuatan film antimikroba (AM) (Lestari 2013) Oleoresin cabai 0.2%; 0.4%; 0.6%
(b/v) Air Destilata
Homogenisasi dan pemanasan
Gliserol 1% (v/v)
Larutan film
Pencetakan
Pengeringan (50oC; 24 jam)
Pengangkatan film dari cetakan
Film AM Homogenisasi dan Pemanasan (50oC, 15 menit) Tapioka 0.5% (b/v)
12
Pada tahap ini dihasilkan sembilan film AM. Kesembilan film ini dilakukan pengujian aktifitas antimikroba terhadap E. coli dengan tiga pengulangan dan secara triplo.
Pengujian Aktifitas Antimikroba Film AM
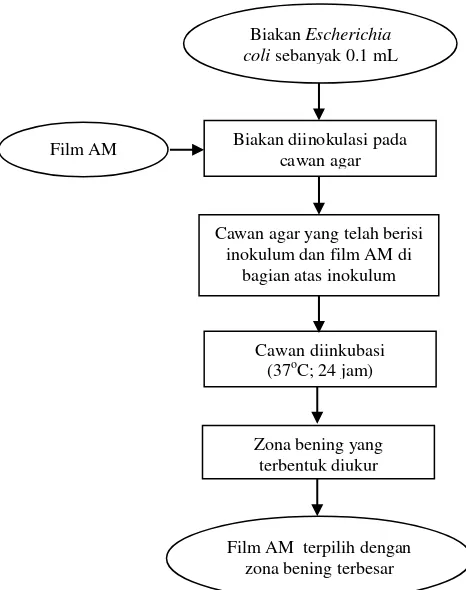
Film yang telah dilepas dari cawan petri dilakukan pengujian aktifitas antimikroba. Pada tahap ini dilakukan pengujian pada film AM dengan metode difusi agar (Li et al. 2006) dengan tiga jenis oleoresin dan konsentrasi yang berbeda. Pengujian aktifitas antimikroba bertujuan melihat zona bening atau zona penghambatan terhadap pertumbuhan Escherichia coli pada ketiga jenis film tersebut. Kultur murni mikroba pada agar miring diinokulasikan sebanyak satu ose ke dalam laktos broth, kemudian dikocok sampai homogen. Inkubasi dilakukan pada suhu 37oC selama 24 jam. Film AM disterilisasi dengan UV selama 2 menit, kemudian diletakkan di atas cawan agar yang telah ditaburi inokulum sebanyak 0.1 mL. Cawan diinkubasi pada suhu 37oC selama 24 jam. Zona bening yang terbentuk di sekitar film diukur. Zona bening tersebut merupakan area penghambatan film AM terhadap E. coli. Berikut ini diagram alir pengujian aktifitas antimikroba film AM.
Gambar 6 Diagram alir pengujian aktifitas antimikroba film AM (Li et al. 2006) Hasil uji aktifitas antimikroba film AM adalah diameter zona bening dari sembilan film AM. Diameter zona bening diperoleh dari selisih diameter luar dengan diameter dalam (Gambar 4). Film AM dengan zona bening terbesar dari setiap jenis oleoresin cabai berdasarkan hasil uji analisis ragam (ANOVA) dipilih
Film AM
Biakan Escherichia coli sebanyak 0.1 mL
Biakan diinokulasi pada cawan agar
Cawan agar yang telah berisi inokulum dan film AM di
bagian atas inokulum
Cawan diinkubasi (37oC; 24 jam)
Zona bening yang terbentuk diukur
13 untuk dilakukan pengujian pH, ketebalan, kekuatan tarik, dan persentase pemanjangan film.
Pengujian pH Film AM Terpilih
Pengujian derajat keasaman (pH) dilakukan pada tiga film AM yang terpilih dari hasil uji aktifitas antimikroba film. Pengujian pH dilakukan dengan menggunakan kertas pH. Kertas pH dicelupkan pada larutan film AM kemudian perubahan warna pada kertas pH dibandingkan dengan indikator pH untuk dilihat nilai pH larutan film. Pengujian ini dilakukan dengan tiga pengulangan untuk setiap jenis film yang diuji.
Pengujian Ketebalan Film AM Terpilih
Ketebalan film AM diukur dengan alat Mikrometer Skrup. Alat ini memiliki ketelitian sebesar 0.01 mm. Pengukuran dilakukan pada lima tempat yang berbeda. Pengukuran ini dilakukan dengan dua pengulangan secara triplo. Nilai ketebalan film AM adalah hasil rata-rata triplo dari kelima tempat yang diukur. Pengujian Kekuatan Tarik dan Persentase Pemanjangan Film AM Terpilih
Pengujian kekuatan tarik film dilakukan dengan menggunakan alat Tensil Strength and Elongation Tester Industries. Sebelum dilakukan pengukuran, film dikondisikan dalam suhu ruang selama 24 jam. Kekuatan tarik ditentukan berdasarkan beban maksimum pada saat film putus atau pecah, sedangkan persentase pemanjangan (elongasi) berdasarkan pemanjangan film saat pecah. Perhitungan kekuatan tarik film dan persentase pemanjangan film dapat dihitung menggunakan rumus di bawah ini:
Kekuatan tarik kg
Nilai beban tarik adalah nilai yang terbaca pada alat saat sampel putus. Nilai N adalah banyaknya contoh setiap kali pengujian dan t adalah tebal contoh uji. Nilai 180 mm adalah jarak antara kedua klem penjepit (atas dan bawah), sehingga contoh uji yang mendapat beban tarik adalah sepanjang 180 mm. Pengujian dilakukan dua pengulangan.
HASIL DAN PEMBAHASAN
Pembuatan Oleoresin Cabai
14
capsaicinoid. Menurut Witt (2007), senyawa capsaicinoid terdiri dari capsaicin (69%), dihydrocapsaicin (22%), dan tiga komponen kecil (9%). Tiga komponen kecil, meliputi: nordihydrocapsaicin (7%), homocapsaicin (1%), dan homodihydrocapsaicin (1%). Capsaicin adalah Capsaicinoid utama di dalam cabai karena mempunyai persentase kandungan paling besar dibandingkan jenis Capsaicinoid yang lain. Capsaicin tidak terpengaruh oleh pemanasan maupun pendinginan. Selain itu, senyawa ini juga tidak berasa, berwarna, dan berbau, serta kurang dapat larut dalam air (bersifat nonpolar) tetapi capsaicin sangat larut di dalam alkohol, lemak, dan minyak.
Cabai yang digunakan untuk pembuatan oleoresin adalah cabai rawit varietas Bara. Pemilihan cabai didasarkan atas kandungan capsaicin yang lebih tinggi dalam Capsicum (14%) dibandingkan dengan Paprika (kurang dari 3.9%) (Purseglove et al. 1981). Berdasarkan Pandji (2013) juga diketahui bahwa kandungan capsaicin dalam Capsicum sebesar 28.80% sedangkan pada Paprika sebesar 6.93%. Tahapan ekstraksi dilakukan sesuai dengan penelitian Setyaningrum (2013). Dalam pembuatan oleoresin cabai, pengeringan merupakan faktor penting untuk menghasilkan mutu oleoresin yang baik. Pengeringan dilakukan untuk menghasilkan cabai dengan kadar air cabai sebesar 6% sesuai dengan ketetapan untuk perdagangan cabai. Pengeringan cabai tersebut juga akan mempermudah proses penggilingan dan penyaringan cabai menjadi cabai bubuk. Pada penelitian ini, pengeringan cabai dilakukan dalam keadaan utuh untuk mencegah penurunan kadar minyak atsiri dalam cabai. Berdasarkan hasil penelitian Yuliana et al. (1991), diketahui bahwa cabai yang dikeringkan dalam kondisi buah dibelah akan menyebabkan penurunan kadar minyak atsiri. Selain itu, pengeringan yang terlalu lama juga dapat menurunkan kadar minyak atsiri dan mempengaruhi warna cabai kering. Oleoresin yang dihasilkan disebut Capsicum varietas Bara. Selain oleoresin yang diekstrak sendiri, pada penelitian ini juga digunakan dua jenis oleoresin yang dijual di pasaran, yaitu: CapsicumTM dan PaprikaTM. CapsicumTM berasal dari cabai rawit atau cabai berukuran kecil, sedangkan PaprikaTM berasal dari cabai merah. Berikut ini gambar cabai segar, cabai bubuk, dan Capsicum varietas Bara.
(a) (b) (c)
15
Aktifitas Antimikroba Oleoresin Cabai
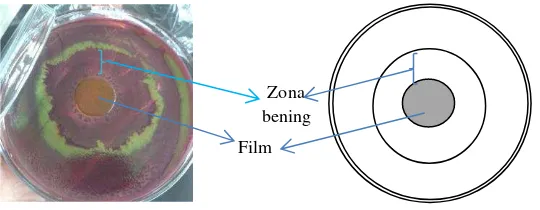
Pada tahap selanjutnya dilakukan pengujian aktifitas antimikroba oleoresin dengan metode difusi sumur. Prinsip metode ini adalah mengetahui ada tidaknya aktifitas antimikroba dari oleoresin cabai. Adanya aktifitas antimikroba dapat diketahui dengan terbentuknya zona bening di sekitar oleoresin cabai, sedangkan tidak terbentuknya zona bening menunjukkan oleoresin cabai tidak mempunyai aktifitas antimikroba. Zona bening merupakan daerah penghambatan oleoresin cabai terhadap mikroba. Mikroba yang digunakan adalah Escherichia coli karena mikroba tersebut merupakan salah satu mikroba patogen yang sering ditemukan pada makanan. Hasil uji aktifitas antimikroba oleoresin cabai yang telah dilakukan adalah terbentuk daerah yang tidak ditumbuhi E. coli dan berwarna bening di sekitar oleoresin. Daerah tersebut adalah zona bening. Zona bening yang terbentuk dapat dilihat pada Gambar 8.
Gambar 8 Penampang zona bening yang terbentuk di sekitar oleoresin. DL adalah diameter luar dan DD adalah diameter dalam
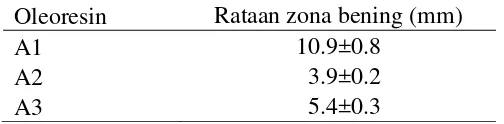
Pengujian aktifitas antimikroba dilakukan pada ketiga jenis oleoresin dengan tiga pengulangan dan secara triplo. Luas zona bening yang terbentuk adalah selisih diameter luar (DL) dengan diameter dalam (DD) zona bening. Berikut ini hasil uji aktifitas antimikroba pada ketiga oleoresin.
Tabel 1 Hasil uji aktifitas antimikroba pada CapsicumTM (A1), PaprikaTM (A2), dan Capsicum varietas Bara (A3)
Oleoresin Rataan zona bening (mm)
A1 10.9±0.8
A2 3.9±0.2
A3 5.4±0.3
Berdasarkan hasil tersebut diketahui bahwa ketiga jenis oleoresin cabai menghasilkan zona bening. Zona bening menunjukkan aktifitas penghambatan terhadap Escherichia coli. Capsicum memiliki zona bening lebih besar
Oleoresin Zona bening DD
DL
16
dibandingkan Paprika. Hal itu sesuai dengan literatur yang menyatakan kandungan capsaicin dalam Capsicum mencapai 14%, sedangkan dalam Paprika mencapai kurang dari 3.9% (Purseglove et al. 1981). CapsicumTM memiliki zona bening lebih besar dibandingkan Capsicum varietas Bara disebabkan oleh penggunaan cabai rawit lebih dari satu varietas, sehingga kandungan capsaicin lebih tinggi. PaprikaTM memiliki zona bening terkecil menunjukkan bahwa kandungan capsaicin rendah (Purseglove et al. 1981).
Pada penelitian Adila (2013), digunakan ekstrak segar rimpang temulawak, kunyit, temu putih, dan temu hitam dengan zona bening hasil uji aktifitas antimikroba terhadap E. coli berurutan sebesar 31.56 mm, 10.16 mm, 10.27 mm, dan 9.92 mm. Ekstrak segar temulawak mempunyai zona bening terbesar dibandingkan ketiga jenis rimpang lainnya dan juga lebih besar dibandingkan CapsicumTM, sehingga diketahui bahwa senyawa antimikroba yang terkandung juga lebih besar. Ekstrak segar kunyit, temu putih, dan temu hitam juga memiliki zona bening yang lebih besar dibandingkan Capsicum varietas Bara dan PaprikaTM. Senyawa antimikroba utama yang terkandung dalam rimpang adalah xhantorrizol.
Kedua hasil penelitian tersebut berdasarkan kategori daya hambat (Davis dan Stout 1971), yang termasuk daya hambat sangat kuat (lebih dari 20 mm) adalah ekstrak segar temulawak. CapsicumTM, ekstrak segar kunyit, dan ekstrak segar temu putih termasuk dalam daya hambat kuat (10 sampai 20 mm), sedangkan Capsicum varietas Bara dan temu hitam termasuk dalam kategori daya hambat sedang (5 sampai 10 mm). PaprikaTM termasuk dalam daya hambat sangat lemah karena memiliki zona bening dibawah 5 mm.
Film AM Oleoresin Cabai
17 zona bening yang terbentuk dapat diamati. Berikut ini gambar film yang dihasilkan.
(a) (b) (c) (d)
Gambar 9 Penampang: (a) Film kontrol; (b) Film CapsicumTM; (c) Film PaprikaTM; (d) Film Capsicum varietas Bara
Berdasarkan gambar film yang dihasilkan, dapat diketahui karakteristik visual setiap film. Film kontrol memiliki warna bening (tidak berwarna), tidak berbau, dan permukaan rata. Film CapsicumTM memiliki warna kuning tua bening, berbau khas cabai rawit, dan permukaan tidak rata. Film PaprikaTM memiliki warna kuning tua pekat, berbau khas paprika, dan permukaan rata, sedangkan film Capsicum varietas Bara memiliki warna kuning pucat, berbau khas cabai rawit, permukaan halus dan rata. CapsicumTM memiliki aroma yang lebih kuat dibandingkan film Capsicum varietas Bara dan PaprikaTM. Hal tersebut dapat disebabkan oleh kandungan minyak atsiri yang lebih besar dalam CapsicumTM.
Film kontrol memiliki kekurangan yaitu film lebih mudah pecah saat pengeringan dan menempel lebih kuat pada plat kaca dibandingkan ketiga film lainnya. Hal tersebut dapat menunjukkan bahwa oleoresin pada umumnya adalah komponen minyak yang berperan sebagai elastiziser, sehingga membuat film tidak mudah pecah dan mudah dilepaskan dari plat kaca. Selain itu, film CapsicumTM juga memiliki kekurangan yaitu warna film menempel pada tangan ketika dilepas dari plat kaca.
Pada penelitian Warsiki et al. (2011), film kitosan dengan ekstrak bawang putih (EBP) berwarna coklat gelap karena EBP berwarna coklat gelap, terlihat adanya serat-serat halus yang berasal dari EBP, dan beraroma khas EBP. Selain itu, pada penelitian Zainab (2009), film kitosan dengan ekstrak sirih berwarna hijau kehitaman, permukaan film tidak rata, dan terlihat ada serat-serat dari partikel-partikel klorofil daun sirih, sedangkan film kitosan dengan kunyit berwarna kuning dan permukaan film tidak rata, serta film kitosan dengan bawang putih berwarna bening, permukaan halus, dan rata. Ketiga film yang dihasilkan Zainab (2009) memiliki aroma khas, terutama film kitosan dengan sirih memiliki aroma yang sangat kuat berasal dari daun sirih dan klorofil.
serat-18
serat. Warna dan aroma dari bahan yang ditambahkan ke dalam film akan mempengaruhi sifat optis dan sensori jika film diaplikasikan pada produk pangan.
Aktifitas Antimikroba Film AM
Pengujian aktifitas antimikroba film dengan metode difusi agar. Metode ini hampir sama dengan metode difusi sumur yang digunakan pada pengujian aktifitas antimikroba oleoresin, perbedaannya adalah media agar yang telah diinokulasi dengan E. coli tidak dilubangi tetapi diberi film di bagian tengah agar. Pengamatan yang dilakukan sama dengan metode difusi sumur, yaitu mengukur luas zona bening yang terbentuk. Zona bening yang terbentuk dapat dilihat pada Gambar 10.
Gambar 10 Penampang zona bening hasil uji aktifitas antimikroba film AM Pengujian ini dilakukan tiga pengulangan dan secara triplo. Luas zona bening yang terbentuk adalah selisih diameter luar (DL) dengan diameter dalam (DD) zona bening (Gambar 4). Pemberian kode film sama dengan pemberian kode oleoresin, sedangkan pemberian kode konsentrasi sesuai dengan tingkatan. Berikut ini zona bening film AM hasil uji aktifitas antimikroba.
Tabel 2 Zona bening film kontrol (K), film AM CapsicumTM (A1), film AM PaprikaTM (A2), dan film AM Capsicum varietas Bara (A3)
Kode film Konsentrasi oleoresin Rataan zona bening (mm)
B1 B2 B3
K - - - -
A1 1.1±0.1 1.8±0.1 6.1±0.5 3.0±0.3
A2 0.3±0 2.3±0.1 3.0±0.2 1.9±0.1
A3 0.5±0 0.9±0 4.3±0.2 1.9±0.2
Rataan zona
bening (mm)a 0.6±0b 1.6±0.1b 4.5±0.2a a
Nilai a menunjukan berbeda nyata dan b menunjukan tidak berbeda nyata pada taraf 5% berdasarkan hasil uji lanjut Duncan
Zona bening
19 Berdasarkan hasil uji ANOVA (Lampiran 1 dan 2) diketahui bahwa jenis oleoresin cabai yang ditambahkan ke dalam film tidak memberikan pengaruh nyata (p>0.05) terhadap luas zona bening (aktifitas penghambatan film AM), sehingga tidak dapat dilakukan uji lanjut, tetapi masih dapat terlihat zona bening film AM dari terbesar sampai terkecil berurutan adalah CapsicumTM, Capsicum varietas Bara, dan PaprikaTM. Hasil tersebut sama dengan hasil uji aktifitas antimikroba pada oleoresin yang menunjukan bahwa Capsicum mempunyai zona bening yang lebih besar dibandingkan Paprika. Zona bening disekitar film AM menunjukkan film AM mempunyai aktifitas penghambatan terhadap E. coli.
Mekanisme penghambatan senyawa antimikroba dapat terjadi dengan cara (i) bereaksi dengan membran sel; (ii) inaktivasi enzim-enzim esensial; dan (iii) destruksi atau inaktivasi fungsi dan materi genetik (Davidson dan Branen 1993). Capsaicin sebagai senyawa antimikroba bercampur dengan materi film. Saat film AM menempel pada media yang telah diinokulasi E. coli, capsaicin akan berdifusi dari film ke dalam dinding sel E. coli karena dinding sel E. coli mengandung 80% lemak dan capsaicin memiliki sifat larut dalam lemak (Jawetz et al. 2005). Peristiwa larutnya capsaicin dalam dinding sel E. coli disebut penetrasi. Penetrasi tersebut akan menghambat sintesis protein dan merusak pita DNA sel bakteri. Kerusakan DNA sel bakteri menyebabkan bakteri tidak dapat berkembang biak, sehingga pada film AM dan daerah sekitar film AM tidak tumbuh E. coli. Daerah yang tidak ditumbuhi E. coli akan tampak berwarna bening atau tidak berwarna hijau metalik karena tidak ada pertumbuhan E. coli, sehingga warna EMB tidak terserap oleh E. coli (Krishna dan Amit 2003).
Selain itu, hasil uji ANOVA juga menunjukkan bahwa konsentrasi oleoresin cabai dalam film berpengaruh nyata (p<0.05) pada taraf 5% terhadap luas zona bening (aktifitas antimikroba) film AM, sehingga dilakukan uji lanjut Duncan. Hasil uji lanjut Duncan menunjukan bahwa film AM dengan konsentrasi oleoresin 0.6% berbeda nyata dengan film AM dengan konsentrasi oleoresin 0.2% dan 0.4%, sedangkan film AM dengan konsentrasi oleoresin 0.2% tidak berbeda nyata dengan konsentrasi oleoresin 0.4%.
Zona bening yang dihasilkan dari oleoresin cabai lebih besar dibandingkan dengan zona bening yang dihasilkan dari ekstrak sirih, kunyit, dan bawang putih. Pada penelitian Parhusip et al. (2005), zona bening ekstrak sirih pada konsentrasi 10% terhadap E. coli sebesar 10 mm, sedangkan pada penelitian Zainab (2009) dengan ekstrak sirih dan kunyit konsentrasi 0.6% menghasilkan zona bening masing-masing sebesar 2.56 mm dan 2.58 mm. Selain itu, pada penelitian Warsiki et al. (2007), zona bening film AM ekstrak sirih antara 1.41 mm sampai 2.22 mm dan zona bening film AM ekstrak bawang putih antara 0.9 sampai 2.6 mm. Zona bening yang dihasilkan oleh ketiga penelitian tersebut lebih kecil dibandingkan zona bening oleoresin cabai karena oleoresin cabai konsentrasi 0.6% dapat menghasilkan zona bening sebesar 4.46 mm. Hal itu menunjukkan oleoresin cabai efektif sebagai antimikroba dan dapat diaplikasikan menjadi film AM.
20
dengan zona bening terbesar dari setiap jenis oleoresin cabai yaitu film AM dengan konsentrasi oleoresin cabai 0.6% dilakukan pengujian pH, ketebalan, kekuatan tarik, dan persentase pemanjangan film.
Nilai pH Film AM Terpilih
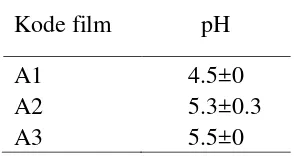
Pengujian pH dilakukan untuk mengetahui pengaruh pH film terhadap daya antimikroba AM. Film AM yang diuji adalah film AM CapsicumTM (A1), PaprikaTM (A2), dan Capsicum varietas Bara (A3) dengan konsentrasi oleoresin cabai 0.6%. Pengujian pH dilakukan pada larutan film AM dan menggunakan kertas pH. Pengujian ini dilakukan dengan tiga pengulangan untuk setiap film AM yang diuji. Berikut ini hasil uji pH.
Tabel 3 Hasil uji pH larutan film Kode film pH
A1 4.5±0
A2 5.3±0.3
A3 5.5±0
Berdasarkan hasil uji derajat keasaman (pH) diketahui bahwa ketiga film AM dengan konsentrasi oleoresin cabai 0.6% mempunyai nilai pH di bawah 7.0, sedangkan pH pertumbuhan E. coli berkisar 7.0 sampai 7.5 (Fardiaz 1989). Hal tersebut menunjukan bahwa adanya daya antimikroba film AM dipengaruhi oleh pH film. Film CapsicumTM mempunyai nilai pH yang paling rendah dibandingkan film PaprikaTM dan Capsicum varietas Bara. Hal itu sesuai dengan hasil uji aktifitas antimikroba yang menunjukan bahwa film CapsicumTM mempunyai daya antimikroba yang paling besar. Derajat keasaman dapat mempengaruhi aktifitas antimikroba pada mikroba tertentu (Jay 1997). Derajat keasaman (pH) yang lebih rendah dari pH pertumbuhan dapat menghambat pertumbuhan E. coli.
21 Mekanisme penghambatan pada pH disebabkan pada kondisi tersebut sel mempertahankan pH konstan dalam sel. Jika pH rendah, proton yang terdapat dalam jumlah tinggi dalam medium akan masuk ke dalam sitoplasma sel (Ray 2001). Hal ini menyebabkan pH sitoplasma menurun. Penurunan tersebut menyebabkan enzim-enzim akan bekerja untuk mengembalikan pH internal sel menjadi pH normal (Booth 1985). Proton ini harus dikeluarkan untuk mencegah terjadinya pengasaman dan denaturasi komponen-komponen sel. Aktifitas mengembalikan pH internal sel menjadi pH normal menggunakan banyak energi, sehingga akan menggangu metabolisme sel dan lama kelamaan sel mengalami kematian (Fardiaz 1992). Pada penelitian Parhusip et al. (2005), ekstrak sirih pada pH 4 paling efektif menghambat E. coli. Hasil tersebut tidak berbeda terhadap hasil pada penelitian ini karena oleoresin cabai dengan pH 4.5 juga mempunyai aktifitas penghambatan E. coli terbesar.
Ketebalan Film AM Terpilih
Pengujian ini dilakukan untuk mengetahui pengaruh jenis oleoresin cabai terhadap ketebalan film. Film CapsicumTM (A1) tidak diuji karena film pecah saat pengeringan, sehingga film AM yang diuji hanya film AM PaprikaTM (A2) dan Capsicum varietas Bara (A3) dengan konsentrasi oleoresin cabai 0.6%. Hasil uji ketebalan film dapat dilihat pada Tabel 4.
Tabel 4 Hasil uji ketebalan film Kode film Ketebalan (mm)
22
besar. Ketebalan film akan berpengaruh pada kekuatan tarik dan persentase pemanjangan film (Park et al. 1996).
Kekuatan Tarik dan Persentase Pemanjangan Film AM Terpilih Pengujian kekuatan tarik film AM dilakukan untuk mengetahui daya elastisitas film AM. Film CapsicumTM (A1) tidak diuji karena film pecah saat pengeringan, sehingga film AM yang diuji hanya film AM PaprikaTM (A2) dan Capsicum varietas Bara (A3) dengan konsentrasi oleoresin cabai 0.6%. Film A1 (film AM CapsicumTM) pecah saat pengeringan, sehingga dapat diketahui bahwa film A1 tidak elastis. Tabel 5 berikut ini data hasil uji yang telah dilakukan.
Tabel 5 Hasil uji kuat tarik dan elongasi
berpengaruh nyata (p<0.05) pada taraf 5% terhadap kekuatan tarik dan persentase pemanjangan film. Penelitian yang dilakukan oleh Zainab (2009) juga menunjukkan hasil yang sama, yaitu penambahan ekstrak sirih, kunyit, dan bawang putih tidak memberikan pengaruh yang berbeda nyata terhadap kekuatan tarik dan persentase pemanjangan film. Nilai kekuatan tarik dan persentase pemanjangan film AM dengan ekstrak sirih, ekstrak kunyit, dan ekstrak bawang putih yang dihasilkan Zainab (2009) berurutan sebesar 180.789 kgf/cm2 dan 27.73%, 159.488 kgf/cm2 dan 27.01%, serta 161.218 kgf/cm2 dan 31.11%. Pada penelitian Warsiki (2007) juga dihasilkan film AM kitosan dengan ekstrak sirih, kunyit, dan bawang putih berurutan sebesar 165.10 sampai 209.07 kgf/cm2, 109.37 sampai 201.60 kgf/cm2, dan 125.87 sampai 202.44 kgf/cm2. Hasil kekuatan tarik film AM pada penelitian Warsiki (2007) dan Zainab (2009) relatif lebih besar dibandingkan pada penelitian ini. Hal tersebut menunjukkan bahwa film AM kitosan dengan ekstrak sirih, kunyit, dan bawang putih lebih elastis dibandingkan film pada penelitian ini.
23 dibandingkan Nofrida et al. (2013). Hal tersebut dapat disebabkan oleh komposisi bahan yang digunakan berbeda. Film kitosan dan film kitosan ditambah ekstrak bawang putih (EBP) yang dihasilkan Warsiki et al. (2011) memiliki kekuatan tarik berurutan sebesar 4.569 N/mm2 dan 3.409 N/mm2 atau setara dengan 46.591 kgf/cm2 dan 34.762 kgf/cm2 dengan elongasi sebesar 107.897% dan 176.530%. Kekuatan tarik film indikator Lestari (2013), film kitosan, dan film kitosan ditambah EBP lebih kecil dibandingkan film Capsicum varietas Bara, sedangkan persentase pemanjangannya lebih besar dibandingkan film oleoresin cabai.
Persentase pemanjangan film dengan sorbitol sebesar 16.6% (Purwanti 2010), film pati ubi jalar 9.00±2.70%, film pati ubi kayu 10.67±2.39%, film pati kentang 4.67±1.55%, film pati garut 4.33±1.555, dan film pati jagung 25.33±6.29% (Ardian 2011). Persentase pemanjangan film pati jagung lebih besar dibandingkan film oleoresin cabai. Berdasarkan literatur standar nilai kekuatan tarik dan persentase pemanjangan edible film, berurutan sebesar 10 sampai 100 kgf/cm2 dan 10 sampai 50% (Krochta dan Johnson 1997), sehingga nilai kekuatan tarik dan persentase pemanjangan yang sudah sesuai standar adalah film AM Capsicum varietas Bara dan film indikator Lestari (2013).
SIMPULAN DAN SARAN
Simpulan
24
Saran
Perlu penelitian lebih lanjut tentang aplikasi film AM dari oleoresin cabai pada pelapisan bahan atau produk pangan, seperti makanan beku, daging, dan sayuran segar, sehingga dapat memperbaiki sifat fisis mekanis film.
DAFTAR PUSTAKA
Adila R. 2013. Uji Antimikroba Curcuma spp. Terhadap Pertumbuhan Candida albicans, Staphylococcus aureus, dan Escherichia coli. J Bio Universitas Andalas. 2(1):1-7. Pemanjangan Plastik Biodegradable dengan metode grafting [Internet]. [diunduh 2014 Agustus 31]. Tersedia pada: http://elibrary.ub.ac.id/handle/123456789/26342.
Bakar A, Mulyono E, Yulianingsih. 2005. Prospek Oleoresin dan Penggunaanya di Indonesia. Bogor: Balai Besar Litbang Pascapanen Pertanian.
Booth IR. 1985. Regulation of Cytoplasmic pH in Bacteria. Microbial rev.
Fardiaz D. 1989. Mikrobiologi Pangan. Bogor: Institut Pertanian Bogor. Fardiaz S. 1992. Mikrobiologi Pangan 1. Jakarta: Gramedia Pustaka Utama. Jawetz E, Melnick JL, Aldenberg EA. 2005. Mikrobiologi Kedokteran. Jakarta:
Salemba Medika.
Jay JM. 1997. Modern Food Microbiology 5thed. New York: Chapman and hall. Julianti E, Nurminah M. 2006. Teknologi Pengemasan. Medan: Universitas
Sumatera Utara.
Kilham C. 2004. Chiles, The Hottest Health Promotor [Internet]. [diunduh 2014 April 11]. Tersedia pada: http://medicinehunter.com/nfm.htm
Krishna De, Amit. 2003. Capsicum, The Genus Capsicum. New York: Tailor & Francis.
Krochta M, Baldwin EA, Nisperos-Carriedo M. 1994. Edible Coating and Film to Improve Food Quality. Lancaster,Basel: Technomic.
25 Lay BW, Hastowo S. 1992. Mikrobiologi Edisi ke-1. Jakarta: Rajawali.
Lestari IA. 2013. Pembuatan Label Cerdas Pendeteksi Escherichia coli [skripsi]. Bogor: Institut Pertanian Bogor.
Li B, Kennedy JF, Peng JL, Yie X, Xie BJ. 2006. Preparation and Performance Evaluation of Glucommannan-Chitin-Nisin Ternary Antimicrobial Blend Film. J of Carbohydrate Polymers. 65(4):488-494.
Maizura M, Fazillah A, Norziah MH, Karim AA. 2008. Antibacterial Ativity of Modified Sago Starch Alginate Based Edible Film Incorporated with Lemongrass (Cymbopogon citrates) boil. International Food Reseach Journal. 15(2):233-236.
Nofrida R, Warsiki E, Yuliasih I. 2013. Pengaruh Suhu Penyimpanan terhadap Perubahan Warna Label Cerdas Indikator Warna dari Daun Erpa (Aerva sanguinolenta). J teknol Indust Pert. 23(3):232-241.
Pandji C, Warsiki E, Purnawati R, Setyaningrum LW. 2013. Tenik Ekstraksi Oleoresin dari Berbagai Jenis Cabai. Prosiding Seminar Hasil-hasil Penelitian dan Pengabdian Kepada Masyarakat IPB 2013. ISBN: 978-602-8853-19-4 Vol 1. hlm 177-187.
Parhusip AJN, Anugrahati NA, Nathalia T. 2005. Aktivitas Antimikroba Ekstrak Sereh (Cymbopogon citrarus DC Stapf) terhadap Bakteri Patogen. Jurnal Ilmu dan Teknologi Pangan. 3(2):27-28.
Purwanti A. 2010. Analisis Kuat Tarik dan Elongasi Plastik Kitosan Terplastisasi Sorbitol. J Teknol Pagan. 3(2):99-106.
Ray B. 2001. Fundamental Food Microbiology Edisi ke-2. New York: CRC Pr. Sentra Informasi Keracunan Nasional. 2014. Keracunan Pangan Akibat Bakteri
Patogen [Internet]. [diunduh 2014 September 12]. Tersedia pada: https://ik.pom.go.id/Keracunan-Pangan-Akibat-Bakteri-Patogen.
Setyaningrum LW. 2013. Ekstraksi Oleoresin Capsaicin dari Cabai Merah, Cabai Keriting, dan Cabai Rawit [skripsi]. Bogor: Institut Pertanian Bogor. Thrmo Fischer Scientific Inc. 2013. Dehydrated Culture Media Eosin Methylene
Blue Agar (Modified) Levin Code: CM0069 [Internet]. [diunduh 2014
Agustus 16]. Tersedia pada:
http://www.oxoid.com/UK/BLUE/prod_detail/prod_detail.asp?pr=CM0069 &c=UK&lang=EN.
Volk &Wheeler. 1993. Mikrobiologi Dasar Jilid 1. Jakarta: Erlangga.
Warsiki E, Sunarti TC, Martua RD. 2009. Pengembangan Kemasan Antimikroba untuk Memperpanjang Umur Simpan Produk Pangan. Prosiding Seminar Hasil-hasil Penelitian IPB. hlm 579-588.
Warsiki E, Sianturi J, Sunarti TC. 2011. Evaluasi Sifat Fisis Mekanis dan Permeabilitas Film Berbahan Kitosan. J Teknol Indust Pert. 21(3):139-145. Warsiki E, Sunarti TC, Nurmala L. 2013. Kemasan Antimikroba untuk
Memperpanjang Umur Simpan Bakso Ikan. JIPI. 18(2):125-131.
26
Yuliana N, Hanum T, Karyono. 1991. Pengaruh Pembelahan Buah Cabai terhadap Rendemen dan Mutu Oleoresin. Jurnal Hortikultura. 1(4):3 −39.
27
Lampiran 1 ANOVA Hasil uji aktifitas antimikroba film AM
Source Type III Sum
Lampiran 2 Uji lanjut Duncan konsentrasi oleoresin cabai Konsentrasi
Nilai dalam subset yang sama menunjukan tidak berbeda nyata, sedangkan pada subset yang berbeda menunjukan berbeda nyata
28
Lampiran 4 ANOVA uji kekuatan tarik film AM terpilih Sum of
Squares df Mean Square F Sig. Between Groups 178.958 1 178.958 0.044 0.854a Within Groups 8221.178 2 4110.589
Total 8400.136 3
a
Nilai Sig (p-value) lebih kecil dari 0.05 menunjukan berpengaruh nyata sedangkan nilai Sig (p-value) lebih besar dari 0.05 menunjukan tidak berpengaruh nyata pada taraf 5%
Lampiran 5 ANOVA uji persentase pemanjangan film AM terpilih Sum of
Squares df Mean Square F Sig. Between Groups 3.430 1 3.430 0.037* 0.865a
Within Groups 184.034 2 92.017
Total 187.464 3
a
29
RIWAYAT HIDUP
Penulis dilahirkan di Cilacap pada tanggal 11 Juli 1992 dari pasangan Sarno (alm) dan Suharni. Penulis adalah putri ketiga dari lima bersaudara. Tahun 2010, penulis lulus dari SMA Negeri 3 Cilacap dan pada tahun yang sama penulis lulus Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) dan diterima di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Selama menjadi mahasiswa, penulis aktif dalam organisasi, yaitu pernah menjadi sekretaris departemen Public Relation Himpunan Mahasiswa Teknologi Industri Pertanian (HIMALOGIN) Teknologi Industri Pertanian IPB tahun 2011-2012. Selain itu, penulis juga aktif menjadi asisten praktikum Bioproses pada tahun ajaran 2014.