OLIVIA MERSYLIA TOMBE
A154100031
PASCASARJANA
BIOTEKNOLOGI TANAH DAN LINGKUNGAN
FAKULTAS PERTANIAN
OLIVIA MERSYLIA TOMBE
A154100031
TESIS
Sebagai salah satu syarat untuk memperoleh gelar
Magister sains pada
Program Studi Bioteknologi Tanah dan Lingkungan
PASCASARJANA
BIOTEKNOLOGI TANAH DAN LINGKUNGAN
FAKULTAS PERTANIAN
Fosfor merupakan unsur hara esensial makro yang dibutuhkan untuk pertumbuhan tanaman dan memegang peranan penting dalam proses metabolisme. Peranan fosfor pada tanaman untuk pertumbuhan sel, pembentukan akar halus dan rambut akar, memperkuat tegakan batang agar tanaman tidak mudah rebah, pembentukan bunga, buah dan biji, serta memperkuat daya tahan terhadap penyakit. Dalam tanah dijumpai fosfor organik dan anorganik, keduanya merupakan sumber penting bagi tanaman. Tanaman menyerap fosfor dalam bentuk H2PO4-, HPO42- dan PO4
3-Hasil penelitian secara in vitro menunjukkan bahwa Burkholderia sp. T9 memiliki nilai Indeks Pelarutan (IP) fosfat dan pelarutan P pada media pikovskaya cair paling besar yaitu sebesar 3,47 dan 4,9 ppm. Hasil yang didapatkan untuk isolat bakteri koleksi menunjukkan bahwa Burkholderia sp. PS4 memiliki nilai IP paling besar diantara isolat bakteri koleksi lainnya yaitu sebesar 1,56 sedangkan
Pseudomonas aeruginosa P2 memiliki kemampuan dalam melarutkan fosfat terlarut paling besar yaitu sebesar 1,3 ppm. Nilai aktivitas enzim paling tinggi dimiliki oleh Burkholderia sp. T9 yaitu sebesar 0,268 ppm sedangkan paling rendah dimiliki oleh Bacillus subtilis J2 yaitu sebesar 0,058 ppm.
. Salah satu alternatif untuk meningkatkan efisiensi pemupukan fosfat dalam tanah adalah dengan memanfaatkan kelompok mikrob pelarut fosfat (BPF). Sawi sendok merupakan tanaman sayuran yang termasuk famili Brassicaceae. Sawi sendok mempunyai nilai ekonomi tinggi. Jenis tanaman ini berkembang pesat di daerah subtropis maupun tropis.
Penelitian ini bertujuan untuk mempelajari kemampuan isolat bakteri koleksi CV.Meori Agro dengan kode P2, J2, PS4 dan satu isolat asal tanah yang diaplikasikan baik secara tunggal maupun kombinasinya sebagai Bakteri Pelarut Fosfat (BPF) , meningkatkan pertumbuhan dan produksi tanaman sawi sendok serta mengurangi dosis penggunaan pupuk fosfat anorganik. Penelitian ini dilaksanakan mulai bulan Januari 2012 sampai Juli 2012 di Laboratorium Bioteknologi Tanah Departemen Ilmu Tanah dan Sumber Daya Lahan serta Lahan milik CV. Meori Agro Jl.Atang Sanjaya KM 4 Pasir Gauk, Bogor. Penelitian ini dilaksanakan dalam dua tahap yaitu secara in vitro dan in vivo (rumah kaca).
Hasil penelitian secara in vivo menunjukkan bahwa kombinasi bakteri
Pseudomonas aeruginosa P2 + Burkholderia sp. PS4 meningkatkan jumlah daun pada tanaman sawi sendok paling besar dibandingkan kontrol yaitu sebesar 17,18%. Pada lebar daun tanaman sawi sendok hasil paling besar diperlihatkan oleh perlakuan Burkholderia sp. PS4 yaitu sebesar 4,83% dibandingkan kontrol. Nilai tertinggi untuk berat basah ditunjukkan oleh Burkholderia sp. PS4 sebesar 0.42% dibandingkan dengan kontrol. Serapan P paling baik ditunjukkan oleh
Plant. Mentored byDwi Andreas Santosa and Rahayu Widyastuti.
Phosphorus is an essential macro nutrient needed for plant growth and has an important function in the metabolic process. The function of phosphorus in plants for cell growth, the formation of fine roots and root hairs, the stems to strengthen the standing crop for not easy to fall, the formation of flowers, fruits and seeds, and strengthen resistance to disease. In soil, organic and inorganic phosphorus, both of which are an important source for plants. Plants absorb phosphorus in the form of H2PO4-, HPO42- dan PO43-. One of the alternative to improving the efficiency of phosphate fertilizer to utilize the phosphate solubilizing microbial groups. Pakchoy is a vegetable crops, including to Brassicaceae family. Pakchoy have a high economic value. These plants thrive in tropical and subtropical regions
This research aims to study about the four isolates of phosphate solubilizing microbes (BPF) applied either single or in combination to enhance the growth and production of pakchoy plant and in reducing the use of inorganic phosphates.This research was started from January 2012 to July 2012 in the Soil Biotechnology Laboratory Departement of Soil Science and Land Resources and Land owned by CV. Agro Meori Jl.Atang Sanjaya KM 4 Sand Gauk, Bogor and implemented in two stages, i.e. in vitro and in vivo (greenhouse).
.
The results of in vitro studied showed that Burkholderia sp. T9 has a high value of Solubilization Index (SI) (3.47) and the solubilizing of phosphate in Pikovskaya liquid medium (4.9 ppm). The results for CV.Meori Agro bacterial isolates collection showed that the Burkholderia sp. PS4 has a high value of Solubilization Index (SI) (1.56) and Pseudomonas aeruginosa P2 has a high value for solubilizing of phosphate in Pikovskaya liquid medium (1.3 ppm). A high value of enzyme activities showed by Burkholderia sp. T9 (0,268 ppm).
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
i
Disetujui Komisi Pembimbing
Dr. Ir. Dwi Andreas Santosa, MS Dr. Rahayu Widyastuti, MSc
Ketua Anggota
Diketahui
Koordinator Mayor Dekan Sekolah Pascasarjana Bioteknologi Tanah dan Lingkungan
Dr. Ir. Dwi Andreas Santosa, MS
Tanggal Ujian : Tanggal Lulus :
merupakan putri kedua dari tiga bersaudara.
Tahun 2006 penulis lulus dari SMA Budi Mulia Bogor dan pada tahun yang sama masuk pada perguruan tinggi Universitas Pakuan Bogor. Penulis memilih jurusan Biologi Fakultas Matematika dan Pengetahuan Alam.
Puji dan syukur ke hadirat Tuhan Yang Maha Kuasa atas segala karuniaNya
sehingga penulis dapat menyelesaikan Tesis yang berjudul : PEMANFAATAN
BAKTERI PELARUT FOSFAT DALAM MENYEDIAKAN FOSFAT BAGI
PERTUMBUHAN DAN PRODUKSI TANAMAN SAWI SENDOK.
Dalam penulisan Tesis ini, penulis banyak mendapatkan bantuan moril serta
bimbingan, baik berupa saran maupun petunjuk dengan cara yang sangat
berharga. Pada kesempatan ini penulis banyak menyampaikan ucapan terima
kasih kepada :
1. Bapak Dr. Ir. Dwi Andreas Santosa, MS selaku Dosen Pembimbing I dan
Ketua Program Studi Bioteknologi Tanah dan Lingkungan yang telah
memberikan bimbingan dan pengarahan yang baik kepada penulis untuk dapat
menyelesaikan Tesis ini.
2. Ibu Dr. Rahayu Widyastuti, MSc selaku Dosen Pembimbing II yang telah
memberikan bimbingan dan pengarahan yang baik kepada penulis untuk dapat
menyelesaikan Tesis ini.
3. Ibu Dr. Sri Djuniwati, MSc selaku dosen penguji yang telah memberikan
masukan dan kritik yang membangun bagi penulisan Tesis ini.
4. Orangtua, kakakku Meisy, Freddy dan adikku Geraldi serta keluarga tercinta
yang selalu memberikan dukungan doa, perhatian serta motivasi kepada
penulis.
5. Ibu Asih, ibu Zul, pak Jito, ibu Lina, seluruh staf Laboratorium Bioteknologi
Tanah dan Lingkungan serta para pegawai CV. MEORI AGRO yang telah
membantu penulis selama ini dalam melaksanakan penelitian.
6. Teman-temanku BTL 2010 chichi, rio, ka delima, abang andreas, dan
sahabatku marwan serta teman-teman Bioteknologi Tanah dan Lingkungan
yang telah membantu dan mendukungku dalam menyelesaikan penelitian dan
kekurangan, oleh sebab itu penulis sangat mengharapkan saran dan petunjuk yang
terus membangun ke arah yang lebih baik. Semoga tulisan dalam Tesis ini
bermanfaat bagi penulis sebagai mahasiswa Pascasarjana pada Program Mayor
Bioteknologi tanah dan Lingkungan maupun bagi para pembaca yang budiman.
Bogor, Desember 2012
Penulis
Halaman
HALAMAN JUDUL ...
HALAMAN PERNYATAAN ...
ABSTRACT ...
RINGKASAN ...
HAK CIPTA ...
HALAMAN JUDUL ...
HALAMAN PENGESAHAN ...
PRAKATA ...
RIWAYAT HIDUP ...
DAFTAR ISI ... xi
DAFTAR GAMBAR ... xiii
DAFTAR TABEL ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan Penelitian... 3
1.3. Hipotesis Penelitian ... 4
1.4. Ruang Lingkup ... 4
1.5. Manfaat Penelitian... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1. Fosfor ... 5
2.2. Bakteri Pelarut Fosfat ... 8
2.3. Pupuk Hayati ... 11
2.4. Sawi Sendok ... 13
BAB III METODE KERJA ... 15
3.1. Lokasi dan Waktu Penelitian ... 15
3.2.1. Alat Penelitian ... 15
3.2.2. Bahan Penelitian ... 15
3.3. Metode Penelitian ... 16
3.3.1. Penelitian Secara In Vitro ... 16
3.3.2. Penelitian Secara In Vivo ... 22
3.4. Rancangan Penelitian ... 25
BAB IV HASIL DAN PEMBAHASAN ... 26
4.1. Penelitian Secara In Vitro ... 26
4.2. Penelitian Secara In Vivo ... 37
BAB V KESIMPULAN DAN SARAN ... 47
5.1. Kesimpulan ... 47
5.2. Saran ... 47
DAFTAR PUSTAKA ... 48
Halaman
1. Siklus Fosfor di Alam ... 5
2. Pelepasan Fosfat dari Al atau Fe ... 10
3. Tanaman Sawi Sendok ... 14
4. Penghitungan Indeks Pelarutan ... 19
5. Metode Uji Antagonis 2 isolat bakteri ... 21
6. Metode Uji Antagonis 3 isolat bakteri ... 21
7. Metode Uji Antagonis 4 isolat bakteri ... 22
8. Koloni Bakteri Pelarut Fosfat Yang Dikelilingi Oleh Zona Bening ... 26
9. Pemurnian Bakteri Pelarut Fosfat Pada Medium Pikovskaya Padat ... 27
10. Pelarutan P Pada Media Pikovskaya Padat Dan Pikovskaya Cair ... 28
11. DNA Genom Bakteri ... 29
12. Hasil Elektroforesis DNA Genom Bakteri ... 30
13. Hasil Amplifikasi Gen 16S rRNA ... 30
14. Pelarutan P Pada Media Pikovskaya Padat Dan Pikovskaya Cair ... 32
15. Kemampuan Sembilan Isolat Bakteri Dalam Menghasilkan Enzim Fosfatase ... 33
16. Hasil Pengujian Enzim Fosfatase ... 34
17. Kurva Standar Empat Isolat Bakteri ... 35
18. Pengujian Antagonis 2,3,dan 4 Isolat Bakteri Pada Cawan Petri ... 37
Halaman
1. Kandungan dan Komposisi Gizi Pakchoy (Brassica rapa L.)
setiap 100 Gram Bahan Segar ... 14
2. Bakteri-Bakteri Yang Digunakan Dalam Uji Antagonis Serta Asalnya ... 22
3. Kombinasi Perlakuan Bakteri Di Rumah Kaca ... 24
4. Kemampuan Bakteri Pelarut Fosfat dalam Melarutkan fosfat pada
medium Pikovskaya Padat dan cair Isolat Asal Tanah ... 27
5. Kemampuan Bakteri Pelarut Fosfat dalam Melarutkan fosfat pada
medium Pikovskaya Padat dan cair Isolat Koleksi ... 31
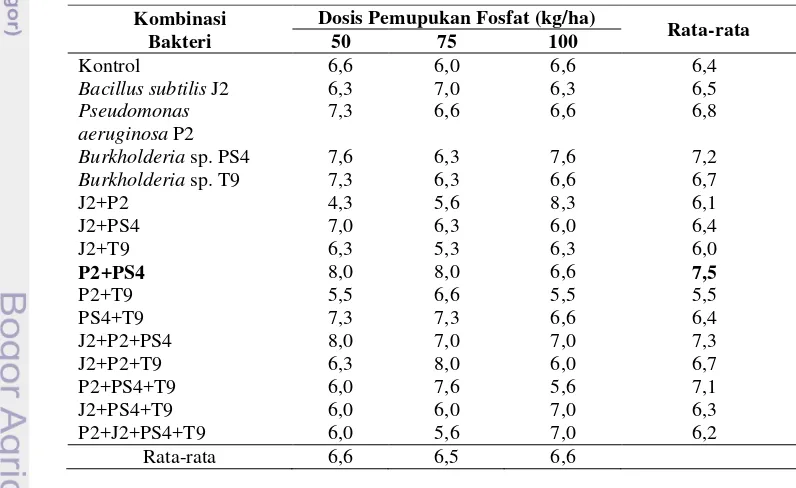
6. Pengaruh Pemberian Isolat Bakteri Dan Variasi Dosis Pupuk Terhadap
Jumlah Daun (helai/tanaman) Pada Minggu Ke-5 Setelah Tanam (MST) ... 38
7. Pengaruh Pemberian Isolat Bakteri dan Variasi Dosis Pupuk Terhadap
Tinggi Tanaman (cm/tanaman) Pada Minggu Ke-5 Setelah Tanam (MST) ... 39
8. Pengaruh Pemberian Isolat Bakteri Dan Variasi Dosis Pupuk Terhadap Lebar Daun (cm/tanaman) Pada Minggu Ke-5 Setelah Tanam (MST) ... 40
9. Pengaruh Pemberian Isolat Bakteri Dan Variasi Dosis Pupuk Terhadap Berat Basah (gram/tanaman) Pada Minggu Ke-5 Setelah Tanam (MST)... 42
10. Pengaruh Pemberian Isolat Bakteri Dan Variasi Dosis Pupuk Terhadap Serapan P (gram/tanaman) Pada Minggu Ke-5 Setelah Tanam (MST) ... 43
11. Pengaruh Pemberian Isolat Bakteri Dan Variasi Dosis Pupuk Terhadap P Dalam Jaringan Tanaman (%) Pada Minggu Ke-5
Setelah Tanam (MST) ... 44
Halaman
1. Kombinasi Perlakuan di Rumah Kaca ... 54
2. Komposisi Media Yang Dipakai ... 55
3. Sidik Ragam Jumlah Daun ... 55
4. Sidik Ragam Tinggi Tanaman ... 55
5. Sidik Ragam Lebar Daun ... 56
6. Sidik Ragam Berat Basah... 56
7. Sidik Ragam Serapan P Tanaman ... 56
8. Sidik Ragam P Dalam Jaringan Tanaman ... 56
9. Sidik Ragam P Dalam Tanah ... 56
BAB I PENDAHULUAN
1.1. LATAR BELAKANG
Fosfor merupakan unsur hara esensial makro yang dibutuhkan untuk
pertumbuhan tanaman dan memegang peranan penting dalam proses metabolisme.
Tanaman menyerap fosfor dalam bentuk H2PO4-, HPO42- dan PO4
3-Pemberian pupuk fosfor pada tanah seringkali menjadi tidak efisien
dikarenakan fosfor yang diberikan pada tanah masam akan bersenyawa dalam
bentuk-bentuk Al-P, Fe-P dan Occluded-P, sedangkan pada tanah bereaksi basa, pada umumnya fosfor bersenyawa sebagai Ca-P sehingga perlu diberikan dalam
takaran yang tinggi. Menurut Jones (1982) tanaman memanfaatkan P hanya
sebesar 10-30% dari pupuk P yang diberikan, berarti 70 - 90% pupuk P tetap
berada di dalam tanah.
. Peranan
fosfor pada tanaman untuk pertumbuhan sel, pembentukan akar halus dan rambut
akar, memperkuat tegakan batang agar tanaman tidak mudah rebah, pembentukan
bunga, buah dan biji, serta memperkuat daya tahan terhadap penyakit.
Kekurangan P pada tanaman akan mengakibatkan berbagai hambatan
metabolisme, diantaranya dalam proses sintesis protein, yang menyebabkan
terjadinya akumulasi karbohidrat dan ikatan-ikatan nitrogen.
Salah satu alternatif untuk meningkatkan efisiensi pemupukan fosfat dalam
mengatasi rendahnya fosfat tersedia dalam tanah adalah dengan memanfaatkan
kelompok mikrob pelarut fosfat, yaitu mikrob yang dapat melarutkan P sukar larut
menjadi larut, baik yang berasal dari dalam tanah maupun dari pupuk, sehingga
dapat diserap oleh tanaman (Saraswati dan Sumarno, 2008). Mikrob pelarut fosfat
terdiri atas bakteri (Taha et al., 1969), fungi (Khan dan Bhatnagar, 1977) dan sedikit aktinomiset (Chen et al., 2002).
Mikrob pelarut fosfat hidup terutama di sekitar perakaran tanaman, yaitu
di daerah permukaan tanah sampai kedalaman 25 cm dari permukaan tanah.
Keberadaan mikrob pelarut fosfat dari suatu tempat ke tempat lainnya sangat
biologisnya. Karena bentuk dan jumlah fosfat dan bahan organik yang terkandung
dalam tanah berbeda-beda, maka keefektifan tiap mikrob pelarut fosfat untuk
melarutkan fosfat berbeda pula.
Mekanisme pelarutan fosfat secara kimia dalam aktivitasnya, mikrob
pelarut P akan menghasilkan asam-asam organik. Pelarutan fosfat secara biologis
terjadi karena mikrob tersebut menghasilkan enzim antara lain enzim fosfatase
(Lynch, 1983). Fosfatase merupakan enzim yang akan dihasilkan apabila
ketersediaan fosfat rendah. Fosfatase dieksresikan oleh akar tanaman dan mikrob,
dan di dalam tanah yang lebih dominan adalah fosfatase yang dihasilkan oleh
mikrob (Joner, et al., 2000). Enzim fosfatase dapat memutuskan fosfat yang terikat oleh senyawa-senyawa organik menjadi bentuk yang tersedia.
Pupuk dapat didefinisikan sebagai zat atau campuran zat yang
ditambahkan pada tanah atau media tanam untuk mencukupi kebutuhan hara
yang diperlukan tanaman agar dapat tumbuh dengan baik. Bahan pembuat pupuk
atau material pupuk dapat berupa bahan organik atau anorganik. Berdasarkan
cara pembuatannya, pupuk dapat digolongkan ke dalam dua kelompok, yaitu
pupuk organik dan pupuk anorganik. Baik pupuk organik maupun pupuk
anorganik atau yang biasa disebut pupuk kimia mengandung berbagai macam
unsur hara yang diperlukan tanaman untuk proses pertumbuhannya. Pupuk kimia
memiliki konsentrasi kandungan unsur hara yang lebih besar daripada
konsentrasi kandungan unsur hara pupuk organik. Oleh karena itu pupuk kimia
lebih banyak dipergunakan oleh petani karena dari segi kualitas dan kuantitas
hasil panen dapat meningkat dengan cepat. Akan tetapi penggunaan pupuk kimia
yang berlebihan dan terus menerus dapat merusak kondisi tanah.
Residu zat kimia dari pupuk yang tidak terserap oleh tanaman dapat
terakumulasi dalam tanah sehingga dapat mempengaruhi kondisi fisika, kimia
dan biologi tanah. Salah satu contohnya adalah perubahan pH tanah dapat
mengakibatkan penyerapan unsur hara oleh tanaman tidak sempurna serta mikrob
yang hidup di tanah dan membantu proses pertumbuhan tanaman tidak dapat
produktif dan kualitas produksi pertanian akan menurun karena tanaman kurang
mendapat nutrisi.
Sawi sendok (Pakchoy, Brassica rapa L) adalah sayuran terna berbentuk roset dengan daun tegak lurus kaku dan lembut, membulat tajam. Sawi sendok
dikenal sebagai kubis putih Cina, karena daun putih khusus, walaupun beberapa
jenis memiliki tangkai daun hijau. Sawi sendok merupakan tanaman sayuran daun
termasuk famili Brassicaceae. Sawi sendok mempunyai nilai ekonomi tinggi. Jenis tanaman ini berkembang pesat di daerah subtropis maupun tropis. Rubatzky
dan Yamaguchi (1998) menyatakan tanaman sawi sendok merupakan salah satu
sayuran penting di Asia, atau khususnya di China. Kualitas produksi tanaman
pertanian seperti jenis sayur-sayuran untuk konsumsi manusia sangat erat
hubungannya dengan kualitas pupuk yang digunakan untuk pertumbuhan
tanaman. Apabila pupuk yang digunakan mempunyai kualitas yang baik dan aman
bagi lingkungan maka hasil produk pertanian akan mempunyai kualitas yang baik
pula.
1.2. TUJUAN PENELITIAN
Penelitian ini dilakukan dengan tujuan :
1. Untuk mempelajari kemampuan isolat bakteri koleksi CV.Meori Agro
dengan kode P2, J2, PS4 dan satu isolat asal tanah sebagai Bakteri Pelarut
Fosfat (BPF)
2. Untuk mempelajari kemampuan isolat bakteri koleksi CV.Meori Agro
dengan kode P2, J2, PS4 dan satu isolat asal tanah yang diaplikasikan baik
secara tunggal maupun kombinasinya dalam meningkatkan pertumbuhan
dan produksi tanaman sawi sendok.
3. Untuk mempelajari kemampuan isolat bakteri koleksi CV.Meori Agro
dengan kode P2, J2, PS4 dan satu isolat asal tanah dalam mengurangi
1.3. HIPOTESIS PENELITIAN
Hipotesis yang diajukan dalam penelitian ini :
1. Isolat bakteri koleksi CV.Meori Agro dengan kode P2, J2, PS4 dan satu
isolat asal tanah merupakan Bakteri Pelarut Fosfat (BPF) dan mampu
melarutkan senyawa fosfat
2. Isolat bakteri koleksi CV.Meori Agro baik tunggal maupun kombinasi
dengan kode P2, J2, PS4dan satu isolat asal tanah mampu meningkatkan
pertumbuhan dan produksi tanaman sawi sendok.
3. Isolat bakteri koleksi CV.Meori Agro baik tunggal maupun kombinasinya
dengan kode P2, J2, PS4 dan satu isolat asal tanah mampu mengurangi
penggunaan pupuk fosfat anorganik
1.4. RUANG LINGKUP
Lingkup penelitian meliputi pengujian terhadap kemampuan isolat dalam
melarutkan fosfat sukar larut beserta uji antagonis antar isolat pada skala in vitro, dan pengaplikasiannya terhadap tanaman sawi sendok dalam skala rumah kaca (in vivo)
1.5. MANFAAT PENELITIAN
Hasil penelitian ini diharapkan dapat memperoleh isolat bakteri sebagai
pupuk hayati yang memiliki fungsi dalam melarutkan fosfat sukar larut dan
meningkatkan pertumbuhan serta produksi tanaman sawi sendok sehingga dapat
BAB II
TINJAUAN PUSTAKA
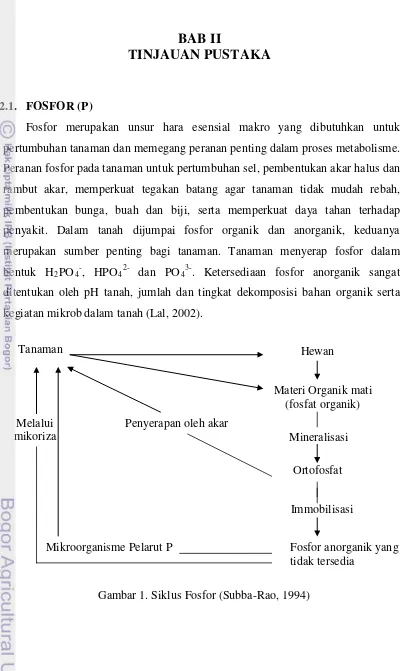
2.1. FOSFOR (P)
Fosfor merupakan unsur hara esensial makro yang dibutuhkan untuk
pertumbuhan tanaman dan memegang peranan penting dalam proses metabolisme.
Peranan fosfor pada tanaman untuk pertumbuhan sel, pembentukan akar halus dan
rambut akar, memperkuat tegakan batang agar tanaman tidak mudah rebah,
pembentukan bunga, buah dan biji, serta memperkuat daya tahan terhadap
penyakit. Dalam tanah dijumpai fosfor organik dan anorganik, keduanya
merupakan sumber penting bagi tanaman. Tanaman menyerap fosfor dalam
bentuk H2PO4-, HPO42- dan PO43-. Ketersediaan fosfor anorganik sangat
ditentukan oleh pH tanah, jumlah dan tingkat dekomposisi bahan organik serta
kegiatan mikrob dalam tanah (Lal, 2002).
Gambar 1. Siklus Fosfor (Subba-Rao, 1994) Melalui
mikoriza
Penyerapan oleh akar
Mikroorganisme Pelarut P
Immobilisasi
Fosfor anorganik yang tidak tersedia
Materi Organik mati (fosfat organik)
Hewan
Mineralisasi
Ketersediaan P dalam tanah pada umumnya rendah. Hal ini disebabkan P
terikat menjadi Fe-fosfat dan Al-fosfat pada tanah masam atau Ca3(PO4)2
Tanaman memperoleh unsur P seluruhnya berasal dari tanah atau dari
pemupukan serta hasil dekomposisi dan mineralisasi bahan organik. Jumlah P
total dalam tanah cukup banyak, namun yang tersedia bagi tanaman jumlahnya
rendah hanya 0,01 – 0,2 mg/kg tanah (Handayanto dan Hairiyah,2007).
pada
tanah basa. Tanaman tidak dapat menyerap P dalam bentuk terikat dan harus
diubah menjadi bentuk tersedia bagi tanaman.
Kekurangan P pada tanaman akan mengakibatkan berbagai hambatan
metabolisme, diantaranya dalam proses sintesis protein, yang menyebabkan
terjadinya akumulasi karbohidrat dan ikatan-ikatan nitrogen. Kekurangan P
tanaman dapat diamati secara visual, yaitu daun-daun yang lebih tua akan
berwarna kekuningan atau kemerahan karena terbentuknya pigmen antisianin.
Pigmen ini terbentuk karena akumulasi gula di dalam daun sebagai akibat
terhambatnya sintesa protein. Gejala lain adalah nekrotis atau kematian jaringan
pada pinggir atau helai daun diikuti melemahnya batang dan akar terhambat
pertumbuhannya.
Buntan (1992) menjelaskan fosfor merupakan bahan makanan utama yang
digunakan oleh semua organisme untuk energi dan pertumbuhan. Secara
geokimia, fosfor merupakan 11 unsur yang sangat melimpah di kerak bumi.
Seperti halnya nitrogen, fosfor merupakan unsur utama di dalam proses
fotosintesis. Fosfor biasanya berasal dari pupuk buatan yang kandungannya
berdasarkan rasio N-P-K. Fosfat merupakan salah satu bahan galian yang sangat
berguna untuk pembuatan pupuk. Sekitar 90% konsumsi fosfat dunia
dipergunakan untuk pembuatan pupuk, sedangkan sisanya dipakai oleh industri
ditergen dan makanan ternak.
Bentuk-bentuk P dalam tanah
Fosfat dalam tanah dibedakan dalam bentuk P-organik dan P-anorganik.
Bentuk organik terdapat dalam bentuk sel-sel mikrob, humus tanah dan bahan
hijauan dan kompos sedangkan P-anorganik adalah mineral yang mengandung P,
misalnya apatit.
P-Organik tanah
P organik tanah berada dalam bentuk senyawa yang sangat komplek.
Kandungan P organik di dalam tanah berkisar lebih kurang 50% dari total P dalam
tanah sedangkan kandungan P dalam bahan organik tanah berkisar antara 1% - 3%
(Tisdale et al., 1993). Kandungan P organik lebih banyak terdapat pada tanah lapisan atas bila dibandingkan dengan tanah lapisan bawah. Kuantitas P-organik
dalam tanah umumnya meningkat dengan meningkatnya C dan/atau N. Banyak
bentuk P-organik yang belum terdeteksi namun sebagian besar bentuk P-organik
tanah adalah inositol fosfat (10-50%), fosfolipida (1-5%) dan asam nukleat
(0,2-2,5%). Sebagian besar inositol fosfat dihasilkan oleh aktivitas mikrob dan
degradasi residu tanaman. Adanya ion H2PO4- dan ion OH- akan menyebabkan
inositol fosfat membentuk kompleks yang sangat kuat dengan protein, dan
membentuk garam tidak larut dengan Fe3+ dan Al3+ pada tanah masam dan dengan
Ca2+
Asam nukleat terdapat pada semua sel hidup dan dihasilkan selama proses
dekomposisi oleh mikrob tanah, dua bentuk asam nukleat adalah RNA (asam
ribonukleat) dan DNA (asam deoksiribonukleat). Asam nukleat merupakan
bentuk yang cepat dirombak. Fosfolipida merupakan senyawa fosfat yang
berkombinasi dengan lipida dan merupakan bentuk tidak larut dalam air tetapi
mudah digunakan dan disintesis oleh mikrob tanah.
pda tanah alkalin (Russel, 1988; Tisdale et al., 1993).
Secara umum immobilisasi dan mineralisasi P sama dengan N, kedua
proses terjadi secara simultan dalam tanah. Sumber utama P-organik tanah adalah
residu tanaman dan hewan yang didegradasi oleh mikrob dan seringkali
berasosiasi dengan asam-asam humik. Inositol fosfat, fosfolipida dan asam
nukleat juga dapat dimineralisasi dalam tanah oleh enzim fosfatase. Enzim
fosfatase berperan utama dalam melepaskan P dari ikatan P-organik. Enzim ini
banyak dihasilkan oleh mikrob tanah, terutama yang bersifat heterotrof. Aktivitas
dipengaruhi oleh pH, kelembaban, temperatur, dan faktor lainnya. Dalam
kebanyakan tanah, total P-organik sangat berkorelasi dengan C-organik tanah,
sehingga mineralisasi P meningkat dengan meningkatnya total C-organik.
Semakin tinggi C-organik dan semakin rendah P-organik, maka semakin
meningkat immobilisasi P (Havlin et al., 1999).
P-anorganik
Menurut Soepardi (1983) ketersediaan P-anorganik sangat ditentukan oleh
beberapa faktor, yaitu pH tanah; besi, aluminium, dan mangan larut; adanya
mineral yang mengandung besi, aluminium, dan mangan; tersedianya kalsium;
jumlah dan tingkat dekomposisi bahan organik; dan kegiatan jasad mikro. Empat
faktor pertama berhubungan satu sama lain, karena semuanya bergantung dari
kemasaman tanah. P-anorganik di dalam tanah pada umumnya berasal dari
mineral flour apatit {Ca10(PO4)6F2
Dalam proses hancuran iklim dihasilkan berbagai mineral P sekunder
seperti hidroksi apatit, karbonat apatit, klor apatit, dan lain-lain sesuai dengan
lingkungannya. Selain itu, ion-ion fosfat dengan mudah dapat bereaksi dengan ion
Fe
}.
3+,
Al3+, Mn2+, Ca2+, ataupun terjerap pada permukaan oksida-oksida hydrat besi,
aluminium, dan liat (Premono, 1994). Pada tanah masam, kelarutan Al dan Fe
menjadi tinggi. Dengan demikian, ion fosfat (H2PO4-, HPO42-, PO43-) akan segera
terikat membentuk senyawa P yang kurang tersedia bagi tanaman. Bila pH tanah
dinaikkan, maka P akan berubah menjadi tersedia kembali. Pada pH di atas netral,
P juga kurang tersedia bagi tanaman karena diikat oleh Ca menjadi senyawa yang
kurang tersedia. Unsur tersebut akan tersedia kembali bila pH diturunkan. Jadi
ketersediaan P sangat dipengaruhi oleh pH tanah (Havlin et al., 1999).
2.2. BAKTERI PELARUT FOSFAT
Salah satu alternatif untuk meningkatkan efisiensi pemupukan fosfat dalam
mengatasi rendahnya fosfat tersedia dalam tanah adalah dengan memanfaatkan
kelompok mikrob pelarut fosfat, yaitu mikrob yang dapat melarutkan fosfat tidak
mikrob pelarut fosfat diharapkan dapat mengatasi masalah P pada tanah masam
(Saleh et al., 1989). Mikrob pelarut fosfat terdiri atas bakteri (Taha et al., 1969), fungi (Khan dan Bhatnagar, 1977) dan sedikit aktinomiset (Chen et al., 2002).
Mikrob pelarut fosfat hidup terutama di sekitar perakaran tanaman, yaitu
di daerah permukaan tanah sampai kedalaman 25 cm dari permukaan tanah.
Keberadaan mikrob ini berkaitan dengan banyaknya jumlah bahan organik yang
secara langsung mempengaruhi jumlah dan aktivitas hidupnya. Akar tanaman
mempengaruhi kehidupan mikrob dan secara fisiologis mikrob yang berada dekat
dengan daerah perakaran akan lebih aktif daripada yang hidup jauh dari daerah
perakaran.
Keberadaan mikrob pelarut fosfat dari suatu tempat ke tempat lainnya
sangat beragam. Salah satu faktor yang menyebabkan keragaman tersebut adalah
sifat biologisnya. Ada yang hidup pada kondisi asam, dan ada pula yang hidup
pada kondisi netral dan basa, ada yang hipofilik, mesofilik, dan termofilik, ada
yang hidup sebagai aerob dan ada yang anaerob, dan beberapa sifat lain yang
bervariasi. Masing-masing mikrob memiliki sifat-sifat khusus dan kondisi
lingkungan optimal yang berbeda-beda yang mempengaruhi efektivitasnya
melarutkan fosfat. Pertumbuhan kelompok bakteri optimum pada pH sekitar netral
dan meningkat seiring dengan meningkatnya pH tanah.
Populasi bakteri pelarut fosfat umumnya lebih rendah pada daerah yang
beriklim kering dibandingkan dengan daerah yang beriklim sedang. Karena
bentuk dan jumlah fosfat dan bahan organik yang terkandung dalam tanah
berbeda-beda, maka keefektifan tiap mikrob pelarut fosfat untuk melarutkan fosfat
berbeda pula. Penggunaan mikrob pelarut fosfat masih menghadapi beberapa
kendala seperti faktor tanah, karena setiap jenis tanah mempunyai bentuk fosfat
yang berbeda-beda antara lain pada lahan masam bentuk fosfat didominasi oleh
Al-P, Fe-P atau occluded- P sedangkan pada lahan basa didominasi oleh bentuk Ca-P. Jadi masing-masing lahan seperti itu memerlukan inokulan pelarut fosfat
Mekanisme Pelarutan P
Mekanisme pelarutan fosfat secara kimia merupakan mekanisme pelarutan
fosfat utama yang dilakukan oleh mikrob. Dalam aktivitasnya, mikroba pelarut P
akan menghasilkan asam-asam organik, diantaranya ialah asam sitrat, glutamate,
suksinat, laktat, oksalat, glioksalat, malat, fumarat, tartat dan α-ketobutirat
(Alexander, 1978). Selain mikrob ternyata akar-akar tanaman dalam eksresinya
juga menghasilkan asam-asam organik antara lain asam sitrat, malat dan oksalat.
(Gerke, 1994). Penurunan pH juga dapat disebabkan karena terbebasnya asam
sulfat dan nitrat pada oksidasi kemoautotrofik sulfur dan amonium, berturut-turut
oleh bakteri Thiobacillus dan Nitrosomonas (Alexander, 1977). Perubahan pH berperanan penting dalam peningkatan kelarutan fosfat (Asea et al., 1988). Selanjutnya asam-asam organik ini akan bereaksi dengan bahan pengikat fosfat
seperti Al3+, Fe3+, Ca2+, atau Mg2+ membentuk khelat organik yang stabil sehingga
mampu membebaskan ion fosfat terikat dan oleh karena itu dapat diserap oleh
tanaman.
Asam-asam organik mampu meningkatkan P tersedia tanah melalui
beberapa mekanisme, diantaranya adalah : (1) anion organik bersaing dengan
ortofosfat pada permukaan tapak jerapan koloid yang bermuatan positif
(Nagarajah et al., 1970); (2) pelepasan ortofosfat dari ikatan logam P melalui pembentukan kompleks logam organik (Earl et al., 1979 ); dan (3) modifikasi muatan permukaan tapak jerapan oleh ligan organik (Tisdale et al., 1993).
Selain menghasilkan asam organik, mikrob Aspergillus, Penicillium, Rhizopus, Cunninghamella, Arthrobacter, Streptomyces, Pseudomonas dan
Bacillus juga menghasilkan enzim-enzim yang dapat melarutkan P-organik dalam tanah (Alexander 1978). Pelarutan fosfat secara biologis terjadi karena mikrob
tersebut menghasilkan enzim antara lain enzim fosfatase (Lynch, 1983) dan enzim
fitase (Alexander, 1977). Fosfatase merupakan enzim yang akan dihasilkan
apabila ketersediaan fosfat rendah. Fosfatase dieksresikan oleh akar tanaman dan
mikrob, dan di dalam tanah yang lebih dominan adalah fosfatase yang dihasilkan
oleh mikrob (Joner, et al., 2000). Pada proses mineralisasi bahan organik, senyawa fosfat organik diuraikan menjadi fosfat anorganik yang tersedia bagi
tanaman dengan bantuan enzim fosfatase (Gaur et al., 1980; Paul dan Clark, 1989). Enzim fosfatase dapat memutuskan fosfat yang terikat oleh
senyawa-senyawa organik menjadi bentuk yang tersedia. Fungi lebih mampu melarutkan P
dalam bentuk AlPO4 (pada tanah masam), sedangkan bakteri lebih efektif
melarutkan fosfat dalam bentuk Ca3PO4
Dari beberapa keberhasilan BPF meningkatkan pertumbuhan tanaman,
sebagian diantaranya terkait dengan peran ganda BPF. Beberapa strain dan jenis
BPF dilaporkan mampu menghasilkan fitohormon yang turut berperan dalam
perkembangan tanaman (De Freitas et al.,1997).
pada tanah basa (Banik dan Dey, 1982).
2.3. PUPUK HAYATI
Istilah pupuk hayati digunakan sebagai nama kolektif untuk semua kelompok
fungsional mikrob tanah yang dapat berfungsi sebagai penyedia hara dalam tanah,
sehingga dapat tersedia bagi tanaman. Pemakaian istilah ini relatif baru
dibandingkan dengan saat penggunaan salah satu jenis pupuk hayati komersial
pertama di dunia yaitu inokulan Rhizobium yang sudah lebih dari 100 tahun yang lalu. Pupuk hayati dapat didefinisikan sebagai inokulan berbahan aktif organisme
hidup yang berfungsi untuk menambat hara tertentu atau memfasilitasi tersedianya
hara dalam tanah bagi tanaman. Memfasilitasi tersedianya hara ini dapat
cendawan mikoriza arbuskuler, pelarutan oleh mikroba pelarut fosfat, maupun
perombakan oleh fungi, aktinomiset atau cacing tanah.
Penyediaan hara ini berlangsung melalui hubungan simbiotis atau
nonsimbiotis. Secara simbiosis berlangsung dengan kelompok tanaman tertentu
atau dengan kebanyakan tanaman, sedangkan nonsimbiotis berlangsung melalui
penyerapan hara hasil pelarutan oleh kelompok mikroba pelarut fosfat, dan hasil
perombakan bahan organik oleh kelompok organisme perombak
Sejumlah bakteri penyedia hara yang hidup pada rhizosfer akar
(rhizobakteri) disebut sebagai rhizobakteri pemacu tanaman (plant growth promoting rhizobacteria = PGPR). Kelompok ini mempunyai peranan ganda di samping (1) menambat N2
FNCA Biofertilizer Project Group (2006) mengusulkan definisi pupuk hayati sebagai bahan yang mengandung mikroorganisme hidup yang
mengkolonisasi rizosfer atau bagian dalam tanaman dan memacu pertumbuhan
dengan jalan meningkatkan pasokan ketersediaan hara primer dan/atau stimulus
pertumbuhan tanaman target, bila dipakai pada benih, permukaan tanaman, atau
tanah. Pengertian pupuk hayati lebih luas daripada istilah yang dikemukakan oleh
Subha Rao (1982) dan FNCA Biofertilizer Project Group (2006).
Mikroorganisme dalam pupuk mikrob yang digunakan dalam bentuk
inokulan dapat mengandung hanya satu strain tertentu atau monostrain tetapi
dapat pula mengandung lebih dari satu strain atau multistrain. Strain-strain pada
inokulan multistrain dapat berasal dari satu kelompok inokulasi silang ( cross-inoculation) atau lebih. Pada mulanya hanya dikenal inokulan yang hanya mengandung satu kelompok mikrob fungsional (pupuk hayati tunggal), tetapi
perkembangan teknologi inokulan telah memungkinkan memproduksi inokulan
yang mengandung lebih dari satu kelompok mikrob fungsional. Inokulan-inokulan
komersial saat ini mengandung lebih dari suatu spesies atau lebih dari satu , juga; (2) menghasilkan hormon tumbuh (seperti IAA,
giberelin, sitokinin, etilen, dan lain-lain); (3) menekan penyakit tanaman asal
tanah dengan memproduksi siderofor glukanase, kitinase, sianida; dan (4)
kelompok mikrob fungsional. Karena itu Simanungkalit dan Saraswati (1993)
memperkenalkan istilah pupuk hayati majemuk untuk pertama kali bagi pupuk
hayati yang mengandung lebih dari satu kelompok fungsional.
2.4. SAWI SENDOK
Sawi sendok adalah sayuran terna berbentuk roset dengan daun tegak lurus
kaku dan lembut, membulat tajam. Sawi sendok dikenal sebagai kubis putih Cina,
karena daun putih khusus, walaupun beberapa jenis memiliki tangkai daun hijau.
Banyak jenis tersedia di Asia Tenggara (Taiwan, Hongkong, Singapura) dan
sayuran ini diusahakan sangat luas di daerah ini. Sayuran sawi sendok cocok di
negara tropis lain, lebih disukai menjadi sayuran popular (Williams et al., 1993). Sawi sendok merupakan tanaman sayuran daun termasuk famili
Brassicaceae. Sawi sendok mempunyai nilai ekonomi tinggi. Jenis tanaman ini berkembang pesat di daerah subtropis maupun tropis. Daerah asal tanaman dari
Tiongkok/Cina (Rukmana, 1994). Sawi sendok atau dalam bahasa Canton adalah
pakcoy berarti sayuran putih, atau disebut juga bokchoy. Konon di daerah Cina,
tanaman ini dibudidayakan sejak 2500 tahun yang lalu, kemudian menyebar luas
ke Filipina dan Taiwan. Sawi sendok masuk ke wilayah Indonesia pada Abad
XIX, bersamaan dengan lintas perdagangan jenis sayuran tropis lain, terutama
kelompok kubis/Brassicaceae (Rubatzky dan Yamaguchi, 1998).
Rubatzky dan Yamaguchi (1998) menyatakan tanaman sawi sendok
merupakan salah satu sayuran penting di Asia, atau khususnya di China. Daun
sawi sendok bertangkai, berbentuk oval, berwarna hijau tua, dan mengkilat, tidak
membentuk kepala, tumbuh agak tegak atau setengah mendatar, tersusun dalam
spiral rapat, melekat pada batang yang tertekan. Tangkai daun, berwarna putih
atau hijau muda, gemuk dan berdaging. Keragaman morfologis dan periode
kematangan cukup besar pada berbagai varietas dalam kelompok ini. Terdapat
bentuk daun berwarna hijau pudar dan ungu yang berbeda. Lebih lanjut
dinyatakan sawi sendok kurang peka terhadap suhu ketimbang sawi putih,
Sawi sendok memiliki umur pascapanen singkat, tetapi kualitas produk
dapat dipertahankan selama 10 hari, pada suhu 00C (Rubatzky dan Yamaguchi,
1998). Produksi utama sawi sendok adalah daun. Sawi sendok dikomsumsi dalam
berbagai bentuk antara lain dilalap, digoreng, disayur lodeh atau ditumis. Oleh
orang Korea, sawi sendok umum diawetkan dalam bentuk asinan disebut
“Kimchee“.
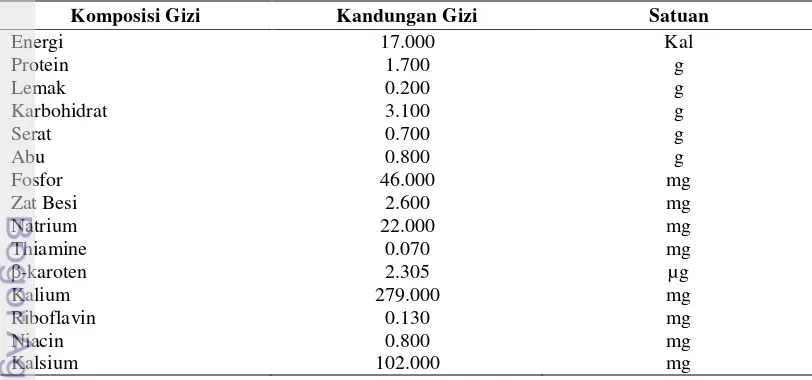
Tabel 1. Kandungan dan Komposisi Gizi Sawi sendok (Brassica rapa L.) setiap 100 Gram Bahan Segar
Sumber : (FAO) Food and Agriculture Organization of The United Nation (1972) Komposisi Gizi Kandungan Gizi Satuan
Energi 17.000 Kal
Protein 1.700 g
Lemak 0.200 g
Karbohidrat 3.100 g
Serat 0.700 g
Abu 0.800 g
Fosfor 46.000 mg
Zat Besi 2.600 mg
Natrium 22.000 mg
Thiamine 0.070 mg
β-karoten 2.305 µg
Kalium 279.000 mg
Riboflavin 0.130 mg
Niacin 0.800 mg
Kalsium 102.000 mg
BAB III
METODE KERJA
3.1. LOKASI DAN WAKTU PENELITIAN
Penelitian dilaksanakan mulai bulan Januari 2012 sampai Juli 2012 di
Laboratorium Bioteknologi Tanah Departemen Ilmu Tanah dan Sumber Daya
Lahan serta Lahan milik CV. Meori Agro Jl.Atang Sanjaya KM 4 Pasir Gauk,
Bogor.
3.2. ALAT DAN BAHAN PENELITIAN
3.2.1. Alat
Alat-alat yang digunakan dalam penelitian ini antara lain : Laminar air
flow, autoclave, oven, Spectrophotometer, refrigerator, perangkat elektroforesis, perangkat PCR, Scope UV, timbangan, cawan petri, batang penyebar, erlenmeyer,
tabung reaksi, pH meter, shaker, mikropipet, tip mikro, magnetik stirer, inkubator, tabung ependoff, jarum ose, gelas ukur, alumunium foil, karet gelang, spidol, polybag.
3.2.2. Bahan
Bahan-bahan yang digunakan pada penelitian ini terbagi menjadi empat
bagian antara lain :
1. Isolasi dan Perbanyakan Mikrob :
Isolat bakteri koleksi CV. Meori Agro dengan kode P2, J2, PS4, Media
Pikovskaya, larutan fisiologis 0.85%, Media NB, Media NA.
2. Pengujian Kualitatif dan Kuantitatif :
Larutan PB, Larutan PC, Modified Universal Buffer (MUB) 1x, 0.5 N NaOH,
0.115 M p-nitro phenyl phosphate (p-NPP), 1 mg/ml p-nitrophenol (p-NP) ,
akuades, alkohol 95%,
3. Identifikasi Molekuler :
Larutan SDS 10%, aquabidest steril, bufer TAE, bufer TE yang mengandung
Kloroform:Isoamil (24:1), isopropanol, etanol 70%, 16F27 (5’-AGA GTT
TGA TCM TGG CTC AG- 3’) dan 16R1492 (5’- TAC GGY TAC CTT GTT
ACG ACT T-3’), 10 mM dNTP (deoxynucleotide triphosphates), 10x bufer
Polymerase Chain Reaction (PCR), 50 mM MgSO4, enzim Taq DNA polimerase, dan Etidium Bromida (EtBr)
4. Penanaman tanaman sawi sendok :
Bibit tanaman sawi sendok berumur 2 minggu, tanah latosol, pupuk kandang,
pupuk anorganik SP-36 dan KCl.
3.3. METODE PENELITIAN
Penelitian dilaksanakan dalam dua tahap yaitu secara in vitro dan in vivo.
3.3.1. Penelitian secara in vitro
Penelitian secara in vitro dilakukan dalam beberapa tahap yaitu :
a. Tahap Persiapan
Tahapan persiapan penelitian ini meliputi persiapan alat-alat, pembuatan
bahan-bahan dan sterilisasi alat serta media yang akan dipakai dalam penelitian.
b. Isolasi Bakteri Pelarut Fosfat dari Tanah
Pengambilan sampel tanah dan pengisolasian bakteri pelarut fosfat asal tanah
latosol dilakukan sebagai pembanding terhadap isolat koleksi CV. Meori Agro.
Tahapan pengambilan tanah dilakukan dengan mengambil tanah di sekitar rizosfer
tanaman jagung kemudian tanah tersebut dikeringudarakan. Kemudian sebanyak
10 gram tanah dari bahan tanah dimasukkan ke dalam tabung erlenmeyer yang
berisi 90 ml larutan fisiologis kemudian dibuat serial pengenceran sampai 10-5.
Sebanyak 1 ml dari pengenceran 10-3,10-4 dan 10-5 dituang di cawan petri
kemudian media pikovskaya dituangkan secara merata secara steril dan diinkubasi
selama 2-3 hari pada suhu ruang. Koloni-koloni bakteri pelarut fosfat yang
diinginkan selanjutnya dimurnikan dan disimpan di dalam medium agar-miring
c. Identifikasi Molekuler
Identifikasi molekuler ini dilakukan dalam beberapa tahapan sebagai berikut,
yaitu isolasi DNA genom bakteri, elektroforesis DNA, Polymerase Chain
Reaction (PCR), dan sekuensing DNA.
Isolasi DNA Genom Bakteri. Sebanyak 2 ml kultur sel BPF yang
ditumbuhkan selama 24 jam pada suhu ruang di dalam medium NB disentrifugasi
(8049,6 x g, 15 menit) untuk memisahkan koloni bakteri dari medium. Supernatan
hasil sentrifugasi dibuang dan pelet dicuci dengan 250 µl bufer TE kemudian pelet
diresuspensi menggunakan mikropipet. Hasil resuspensi diinkubasi pada suhu
370C selama 30 menit kemudian ditambahkan 50 μl larutan SDS 10% dan dibolak
balik. Selanjutnya suspensi kembali diinkubasi pada suhu 370C selama 60 menit
kemudian ditambahkan 65 μl NaCl dan 80 µl CTAB-NaCl dan diinkubasi dalam
waterbath (65ºC, 20 menit). Pada campuran tersebut kemudian ditambahkan 450
μl kloroform: isoamil (24:1), kemudian tabung Eppendoff yang berisi campuran DNA dibolak-balik secara halus. Suspensi yang telah teremulsi disentrifugasi
(6763,9 x g, 15 menit). Supernatan yang mengandung DNA dipindahkan ke dalam
tabung Eppendoff steril dan ditambahkan isopropanol yang dingin (-20ºC). DNA diendapkan dengan sentrifugasi pada suhu 40
Proses Elektroforesis DNA. Larutan 50x bufer TAE diencerkan menjadi
2x bufer TAE. Kemudian dibuat gel agarosa 1%, yaitu 0,2 gram agarosa dalam 20
ml 2x bufer TAE dan ditambahkan 2 µl Et-Br yang selanjutnya dituang ke dalam
cetakan gel agarosa. Setelah gel membeku diletakkan ke dalam tangki
elektroforesis yang telah diisi 1x bufer TAE sehingga gel terendam. Sebanyak 3 μl
dari masing-masing DNA dicampur dengan 1,2 μl loading buffer sebagai
pemberat. Suspensi larutan DNA dengan loading buffer diinjeksikan ke dalam C dengan kecepatan 8049,6 x g
selama 20 menit. Supernatan dibuang kemudian dilakukan pencucian
menggunakan etanol 70% dingin dan disentrifugasi (8049,6 x g, 2 menit).
Supernatan hasil sentrifugasi dibuang dan pelet DNA dikeringudarakan. DNA
yang telah didapatkan siap digunakan untuk elektroforesis atau disimpan sebagai
sumur-sumur pada gel elektroforesis. Setelah semua sumur terisi, power supply
perangkat elektroforesis dinyalakan dengan voltase sebesar 75 V selama ± 45
menit. Selanjutnya DNA dapat dilihat dan difoto menggunakan perangkat UV
Transilluminator.
Proses Polymerase Chain Reaction (PCR). Proses PCR diawali dengan
pembuatan campuran komponen reaksi untuk PCR sebanyak 50 μl dengan
komposisi sebagai berikut : primer 10 μl 16F27 (5’-AGA GTT TGA TCM TGG
CTC AG- 3’), primer 10 μl 16R1492 (5’- TAC GGY TAC CTT GTT ACG ACT
T-3’), 2 μl template DNA, PCR mix 25 µl dan 19 μl aquabidest steril. Running
PCR dilakukan sebanyak 35 siklus dengan kondisi sebagai berikut, denaturasi
siklus awal atau pra-denaturasi 95ºC selama 5 menit, diikuti denaturasi untuk
siklus selanjutnya pada suhu 95ºC selama 1 menit. Penempelan primer
(annealing) dilakukan selama 1 menit pada suhu 55ºC. Polimerisasi dilakukan selama 2 menit pada suhu 72ºC dan pada siklus terakhir, yaitu siklus ke-35
dilakukan perpanjangan waktu polimerisasi selama 10 menit. Produk hasil PCR
divisualisasi dengan menggunakan elektroforesis gel agarosa 1.0% dalam 2x bufer
TAE dengan voltase 75 volt selama ± 30 menit.
Sekuensing DNA. Produk hasil PCR dikirimkan pada PT. Genetika
Science untuk disekuen di Malaysia. Sekuen DNA yang diperoleh dibandingkan
dengan sekuen pada database European Bioinformatics Institute (EBI)
menggunakan piranti FASTA pada situs http://www.ebi.ac.uk.
d. Peremajaan Tiga Isolat Bakteri Koleksi
Ketiga isolat bakteri koleksi CV. Meori Agro yang akan dipergunakan
digoreskan pada media pikovskaya menggunakan jarum ose untuk peremajaan.
Perlakuan ini dilakukan di dalam Laminar Air Flow agar tidak terjadi
e. Pengujian Kualitatif Isolat Bakteri asal Tanah dan Isolat Bakteri
Isolat terpilih dan isolat koleksi yang telah diremajakan kemudian dilakukan
pengujian pelarutan P secara kualitatif. Isolat diujikan pada media pikovskaya
padat kemudian pengamatan dilakukan sampai terbentuknya zona bening di
sekitar bakteri. Koloni yang dikelilingi zona bening menunjukkan adanya
pelarutan fosfat. Pengujian secara kualitatif dilakukan dengan cara menghitung
besarnya zona bening berbanding besarnya koloni bakteri. Perhitungan pelarutan
fosfat pada media menggunakan Indeks pelarutan (IP).
Satu bakteri pelarut fosfat yang unggul selanjutnya disimpan di dalam medium
agar-miring Pikovskaya untuk pengujian selanjutnya.
f. Pengujian Kuantitatif Isolat Bakteri
Pengujian Kemampuan Bakteri Koleksi dan Asal Tanah dalam Pikovskaya cair
Mikrob terpilih diuji kemampuannya dalam melarutkan senyawa P sukar larut
(Ca3(PO4)2) di medium pikovskaya cair. Mikrob yang akan diuji diremajakan
terlebih dahulu kemudian diambil 1 ose mikrob tersebut diinokulasikan pada
pikovskaya cair dan diinkubasi selama 5 hari. Kultur diinkubasi diatas shaker
secara periodik. Pada akhir inkubasi kultur disentrifugasi dengan kecepatan
1048,12 x g selama 20 menit. Filtrat jernih yang diperoleh ditentukaan P larutnya
dengan menggunakan spektrofotometer dengan panjang gelombang (α) 660 nm
dan dibandingkan dengan kontrol. B : Lebar Koloni Bakteri
A
B
Pengujian Bakteri Pelarut Fosfat dalam Menghasilkan Enzim Fosfatase
Sebanyak 50 ml kultur sel BPF yang ditumbuhkan selama 24 jam pada suhu
ruang di dalam medium Pikovskaya cair. Sebanyak 1 ml kultur, kemudian
ditambahkan 1 ml Buffer fosfat, dan 1 ml 0.115 M p-nitro phenyl phosphate
(p-NPP), kemudian diinkubasi selama 2 jam di dalam waterbath pada suhu 38ºC. Setelah diinkubasi selama 2 jam, ditambahkan 1 ml CaCl 0,5 M dan 4 ml 0.5 M
NaOH kemudian dikocok dan disentrifuse. Larutan akan berubah menjadi warna
kuning, hal ini menandakan bahwa bakteri menghasilkan enzim fosfatase.
Semakin pekat warna kuning yang terbentuk, maka semakin tinggi enzim
fosfatase yang dihasilkan. Kemudian dilakukan pengenceran 10x dengan
mengambil 1 ml filtrat ditambahkan dengan 9 ml aquadest. Pengukuran
absorbansi dilakukan pada panjang gelombang (α) = 400 nm menggunakan
Spectrophotometer.
g. Pengukuran Kurva Standar Bakteri
Kurva standar populasi mikrob terpilih ditentukan untuk menyamakan jumlah
sel mikrob dalam percobaan selanjutnya. Kurva ini menyatakan hubungan antara
nilai rapat optis suspensi mikrob dengan satuan pembentuk koloni (SPK) yang
ditentukan dengan metode cawan hitung. Sehingga, inokulasi pada percobaan
selanjutnya dapat menggunakan populasi mikrob yang seragam.
Isolat-isolat yang telah didapatkan diambil menggunakan ose kemudian
ditumbuhkan pada media NB. Setelah 2 hari diinkubasi di atas shaker suspensi
bakteri di dalam medium NB diencerkan berurut 2,3,4,8,dan 10 kali dan diukur
nilai rapat optisnya dengan menggunakan spektrofotometer pada panjang
gelombang (α) 620nm. Pada waktu yang bersamaan setiap tingkat pengenceran
tersebut diatas, populasi mikrob ditentukan dengan metode hitungan cawan.
Populasi mikrob dan nilai rapat optisnya dihubungkan dengan persamaan regresi
linier, yang digunakan sebagai kurva baku populasi mikrob di dalam medium
h.Uji Antagonis Empat Isolat Bakteri
Bakteri-bakteri yang digunakan untuk uji antagonis dapat dilihat pada Tabel 2.
Satu koloni bakteri yang tumbuh terpisah di cawan petri, diambil menggunakan
jarum ose dan digoreskan pada media NA yang telah disiapkan. Pengujian
antagonis empat isolat bakteri tersebut dilakukan pada media agar (Gambar 5,6
dan 7). Pengamatan dilakukan setiap hari terhadap koloni bakteri dengan cara
melihat pertumbuhan empat bakteri bersama-sama.
Gambar 6. Metode Uji Antagonis 3 isolat bakteri Isolat Bakteri 2 Isolat
Bakteri 1
Gambar 5. Metode Uji Antagonis 2 isolat bakteri
Cawan petri Isolat Bakteri 2
Isolat Bakteri 1 Isolat
Bakteri 3
3.3.2. Penelitian secara in vivo
a. Analisis Kandungan Unsur Hara Pada Tanah
Tanah yang akan dipakai untuk menanam tanaman sawi sendok diambil secara
komposit dari lima titik pada kedalaman 0-20 cm dan dicampur hingga merata,
kemudian dianalisis kandungan haranya menggunakan Metoda Bray I. Analisis
kandungan fosfor dilakukan sebelum dan sesudah perlakuan.
b. Analisis Fosfor Pada Tanah menggunakan Metode Bray I
Tanah yang akan dipakai untuk analisis ditimbang sebanyak 3 gram kemudian
ditambahkan pengekstrak Bray dan Kurt I sebanyak 30 ml lalu dikocok selama 5
menit. Kemudian larutan disaring hingga jernih. Dari larutan tersebut dipipet 1 ml
ke tabung reaksi dan ditambahkan pereaksi pewarna fosfat sebanyak 10 ml, Kode Bakteri Asal Isolat
PS4 Rizosfer Tanaman Nilam
P2 Rizosfer Tanaman Kacang Tanah
J2 Rizosfer Tanaman Jagung
T9 Rizosfer Tanaman Jagung
Tabel 2. Bakteri-Bakteri yang Digunakan Dalam Uji Antagonis serta Asalnya Cawan Petri Isolat
Bakteri 1
Isolat Bakteri 2 Isolat
Bakteri 4
Isolat Bakteri 3
dikocok dan dibiarkan selama 10 menit. Diukur absorbansinya dengan
spektrofotometer pada panjang gelombang 693nm.
c. Persiapan Inokulan
Isolat-isolat yang terpilih masing-masing dipindahkan ke dalam 100 ml media
NB dengan jarum ose lalu dibiakkan di atas mesin pengocok selama 3 hari. Pada
hari yang ketiga diukur nilai rapat optis suspensi tersebut dengan spektrofotometer
dengan panjang gelombang (α) 620 nm untuk memperoleh jumlah populasi sel per
milimeter supensi. Penentuan populasi sel ini gunakan untuk menghitung jumlah
isolat yang akan diinukolasikan.
d. Penanaman dan perlakuan bibit tanaman sawi sendok
Benih sawi sendok ditumbuhkan pada media tumbuh berupa tanah dan pupuk
kandang hingga berumur 2 minggu. Kemudian bibit tanaman sawi sendok
dipindahkan ke polybag dengan media yang sama dan diberi perlakuan bakteri
dengan kepadatan bakteri 107
Rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak
Lengkap Faktorial dengan faktor pertama yaitu perlakuan empat isolat bakteri
baik secara tunggal maupun kombinasi sebanyak 16 taraf (Tabel 3) dan faktor
kedua yaitu perlakuan dosis SP-36 sebanyak 3 taraf 50 kg/ha; 75 kg/ha; 100
kg/ha. Percoban dilakukan dengan 3 ulangan sehingga terdapat 144 satuan unit
percobaan.
sel/ml dengan cara menuangkan suspensi dekat
dengan rhizosfer tanaman sawi sendok pada saat tanam kemudian diletakkan di
dalam rumah kaca dan diamati pertumbuhannya. Pupuk SP-36 dan KCl diberikan
1 minggu sebelum penanaman. Penyiraman dilakukan setiap hari dengan
mempertahankan kadar air tanah pada keadaan 80% kapasitas lapang.
Pertumbuhan tanaman sawi sendok di rumah kaca diamati setiap minggu selama ±
Kombinasi perlakuan di rumah kaca :
Tabel 3. Kombinasi Perlakuan Bakteri Di Rumah Kaca
Kombinasi
SP-36 : Pupuk anorganik
Dosis pupuk SP-36 diberikan dalam 3 dosis yaitu 50kg/ha; 75 kg/ha; 100 kg/ha
e. Peubah Yang Diamati
Jumlah daun, tinggi tanaman dan lebar daun diamati setiap minggu selama 5
minggu. Setelah tanaman sawi sendok mencapai masa akhir vegetatif (5 minggu
setelah tanam), tanaman diambil untuk menghitung biomassa segar dan kering
serta kandungan P di dalam jaringan tanaman. Tanah di dalam pot kemudian
dikering anginkan, diaduk merata untuk dianalisis P tersedianya dengan Metode
3.4. RANCANGAN PENELITIAN
Rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak
Lengkap Faktorial dengan faktor pertama yaitu perlakuan empat isolat bakteri
baik secara tunggal maupun kombinasi sebanyak 16 taraf (Tabel 3) dan faktor
kedua yaitu perlakuan dosis SP-36 sebanyak 3 taraf 50 kg/ha; 75 kg/ha; 100
kg/ha. Percoban dilakukan dengan 3 ulangan sehingga terdapat 144 satuan unit
percobaan.
Menurut Gaspersz (1991), model statistik untuk percobaan dengan
menggunakan rancangan acak (RAL) Faktorial adalah sebagai berikut :
Y
ijk= µ +
α
i+
β
j+ (αβ)
ij+ E
ijkDimana : µ : Rata-rata (nilai tengah) respon
αi
β
: Pengaruh dari faktor pertama
j (αβ)
: Pengaruh dari faktor kedua
ij : Interaksi
E
antara faktor pertama dan kedua
ij
pertama taraf ke-i dan faktor kedua taraf ke-j dengan : Pengaruh faktor random yang mendapat perlakuan
ulangan ke-k
Yij
Pengolahan data dilakukan dengan menggunakan pengujian sidik ragam pada
selang kepercayaan 95%. Apabila hasil sidik ragam berpengaruh nyata, maka
dilakukan pengujian beda nilai tengah antar perlakuan dengan menggunakan Uji
Wilayah Berganda Duncan (DMRT) pada taraf 5%.
: Nilai pengamatan pada perlakuan faktor pertama taraf ke-i
BAB IV
HASIL DAN PEMBAHASAN
4.1. Penelitian Secara In Vitro
a. Isolasi Bakteri Pelarut Fosfat Asal Tanah
Penelitian secara in vitro dilakukan dengan mengambil sampel tanah dari sekitar rizosfer tanaman jagung sebagai sumber isolat bakteri pelarut fosfat (BPF)
yang diperoleh dari Lahan milik CV. Meori Agro Jl.Atang Sanjaya KM 4 Pasir
Gauk, Bogor.
Isolasi mikrob dari sampel tanah dilakukan menggunakan larutan fisiologis dan
dilakukan seri pengenceran bertingkat kemudian diukur kemampuannya dalam
melarutkan fosfat pada medium Pikovskaya padat. Tidak semua mikrob tersebut
menghasilkan zona berwarna terang jernih atau zona bening. BPF yang tumbuh
pada medium Pikovskaya padat akan melarutkan fosfat yang ditandai dengan
adanya zona berwarna terang jernih atau zona bening yang mengelilingi koloni
bakteri tersebut (Gambar 8). Hal ini disebabkan adanya pelarutan fosfat dari
Ca3(PO4)2
Sebanyak 6 isolat BPF yang menghasilkan zona bening dimurnikan pada
medium Pikovskaya padat (Gambar 9) dan disimpan dalam medium agar miring
(stockculture) untuk digunakan dalam pengujian selanjutnya. yang terdapat dalam medium.
b. Pengujian Kualitatif dan Kuantitatif Isolat Bakteri Asal Tanah
Pengujian pelarutan fosfat secara kuantitatif dan kualitatif terhadap isolat
bakteri asal tanah dilakukan sebagai pembanding terhadap tiga isolat bakteri
koleksi CV. Meori agro. Sebanyak 6 isolat bakteri pelarut fosfat (BPF) yang telah
diperoleh selanjutnya dilakukan pengujian kemampuan bakteri pelarut fosfat
(BPF) dalam melarutkan fosfat pada medium Pikovskaya padat dan cair serta
pengukuran indeks pelarutan fosfat (IP). Hasil dari pengamatan pada penelitian ini
dapat dilihat dalam Tabel 4 berikut ini :
Tabel 4. Kemampuan Bakteri Pelarut Fosfat dalam Melarutkan Fosfat pada Medium Pikovskaya Padat dan Cair
Dari Tabel 4 tampak bahwa isolat bakteri T9 memiliki nilai Indeks Pelarutan
(IP) fosfat paling besar dari seluruh bakteri yang diukur yaitu sebesar 3,47. Isolat
bakteri T9 pun memiliki hasil pelarutan P pada media pikovskaya cair paling Nama Gambar 9. Pemurnian bakteri pelarut fosfat pada
besar dari seluruh bakteri yang diukur yaitu sebesar 4,9 ppm. Hal ini
menunjukkan bahwa isolat bakteri T9 memiliki kualitas paling baik diantara 5
isolat bakteri lain yang berasal dari tanah yang diuji kemampuannya dalam
melarutkan fosfat. Hasil ini berbeda dengan isolat bakteri T8 yang meskipun
memiliki nilai IP yang tidak berbeda jauh dengan isolat bakteri T9 yaitu 3,27
namun dalam hal melarutkan fosfat pada media pikovskaya cair, isolat bakteri T8
hanya mampu melarutkan fosfat sebesar 2,5 ppm. Sedangkan nilai IP yang paling
kecil terdapat pada isolat bakteri T4 yaitu sebesar 1,64 dan dalam hal pelarutan
fosfat pada media pikovskaya cair juga hanya mampu melarutkan fosfat sebesar
1,5 ppm.
Hal ini menunjukkan bahwa kemampuan isolat bakteri dalam melarutkan
fosfat tidak selalu dilihat berdasarkan lebar dari zona bening. Menurut Rachmiati
(1995) besar kecilnya kemampuan bakteri dalam melarutkan P dari fosfat tak larut
ditunjukkan oleh adanya luas daerah bening di sekitar isolat pada cawan petri.
Tatiek (1991) juga mengemukakan bahwa daerah bening pada media padat tidak
dapat menunjukkan kemampuan setiap bakteri untuk menyumbangkan jumlah
fosfat terlarut, meskipun luas sempitnya daerah bening dapat menunjukkan besar
kecil bakteri melarutkan fosfat sukar larut.
Berdasarkan pengujian secara kualitatif dan kuantitatif di atas maka dipilih satu
mikrob unggul (paling baik) yang berasal dari tanah yaitu isolat bakteri T9.
Pengujian selanjutnya menggunakan empat isolat bakteri yaitu satu isolat bakteri
asal tanah (isolat bakteri T9) dan 3 isolat bakteri koleksi CV. Meori Agro (PS4, J2
dan P2).
Gambar 11. DNA genom bakteri
c. Identifikasi Bakteri
Isolasi DNA
Isolasi DNA bakteri digunakan sebagai awal untuk mendapatkan informasi
genetik 4 isolat bakteri terpilih. Isolat bakteri asal tanah yang diidentifikasi secara
molekuler merupakan isolat terpilih yang memiliki hasil IP, pelarutan fosfat pada
media pikovskaya cair dan kandungan enzim fosfatase yang tinggi yaitu isolat
bakteri T9 sehingga, terdapat empat isolat bakteri yang akan diidentifikasi secara
molekuler. Sel bakteri yang telah ditumbuhkan kemudian disentrifugasi untuk
memisahkan supernatan dan pelet kemudian diresuspensi menggunakan bufer TE.
Bufer TE mengandung lysozyme yang berfungsi sebagai perusak dinding sel. Sodium dodekil sulfat (SDS) 10% yang digunakan dalam isolasi DNA merupakan
sejenis deterjen yang dapat digunakan untuk merusak membran sel, hal ini
mengakibatkan sel mengalami lisis. Kotoran (debris) sel yang disebabkan oleh
pengrusakan sel oleh lysozyme dan SDS dibersihkan dengan cara dibolak-balik sehingga yang tertinggal hanya molekul nukleotida (DNA dan RNA). Untuk
menghilangkan protein dari larutan digunakan larutan isoamil (mengikat protein
dan sebagian kecil RNA) dan kloroform (membersihkan protein dan polisakarida
dari larutan) (Muladno, 2002). Pengambilan fase yang mengandung DNA pada
bagian atas dilakukan dengan sangat hati-hati. Selanjutnya DNA dipresipitasi
menggunakan etanol absolut 70%. DNA akan terlihat berwarna bening dan kental
1
2000 bp
1000 bp
Elektroforesis Gel Agarosa
DNA yang telah berhasil diisolasi kemudian dilakukan pengujian untuk
mendeteksi keberadaan DNA tersebut menggunakan elektroforesis pada gel
agarosa (Gambar 12).
Amplifikasi Gen 16S rRNA
Hasil amplifikasi PCR isolat bakteri menggunakan primer 16S rRNA (Gambar
13) menghasilkan satu amplikon atau produk PCR berukuran sekitar 1500 bp.
Primer yang digunakan dalam proses PCR ini, yaitu 16F27 (5’-AGA GTT TGA
TCM TGG CTC AG- 3’) dan 16R1492 (5’- TAC GGY TAC CTT GTT ACG
ACT T-3’). Selanjutnya amplikon ini disekuen untuk mengetahui urutan
nukleotida pada gen 16S rRNA masing-masing isolat.
Gambar 12. Hasil elektroforesis DNA genom bakteri
Keterangan :
Gambar 13. Hasil amplifikasi gen 16S rRNA
Homologi Isolat Bakteri Dengan Program FASTA
Berdasarkan hasil analisis sekuen gen 16S rRNA pada program FASTA
diketahui homologi spesies dari empat isolat bakteri yang diuji. Isolat bakteri
koleksi CV. Meori Agro dengan kode P2 memiliki kemiripan sebesar 100%
dengan Pseudomonas aeruginosa strain QZX-A , isolat bakteri koleksi CV. Meori Agro dengan kode J2 memiliki kemiripan sebesar 99,3% dengan Bacillus subtilis
strain PARZ2, dan isolat bakteri koleksi CV. Meori Agro dengan kode PS4
memiliki kemiripan sebesar 100% dengan Burkholderia sp. strain AH83.
Sedangkan Isolat asal tanah yaitu isolat bakteri T9 memiliki kemiripan sebesar
99% dengan Burkholderia sp. strain A-3. Hasil analisis sekuen gen 16S rRNA dari tiga isolat BPF pada data GenBank terdapat pada Lampiran 11.
d.Pengujian Kualitatif dan Kuantitatif Isolat Bakteri Koleksi
Sebanyak 3 isolat bakteri koleksi CV. Meori Agro yang sudah diremajakan
dilakukan pengujian dalam melarutkan fosfat pada medium Pikovskaya padat dan
cair serta pengukuran indeks pelarutan fosfat (IP). Hasil dari pengamatan pada
penelitian ini dapat dilihat dalam Tabel 5 berikut ini :
Tabel 5. Kemampuan Bakteri Pelarut Fosfat dalam Melarutkan Fosfat pada Medium Pikovskaya Padat dan Cair
Sama halnya dengan pengujian yang dilakukan pada isolat bakteri asal tanah,
isolat bakteri koleksi pun diukur nilai IP dan kemampuannya dalam melarutkan
fosfat. Hasil yang didapat pada pengukuran tersebut seperti yang terlihat pada
tabel di atas menunjukkan bahwa Burkholderia sp. PS4memiliki nilai IP paling besar diantara isolat bakteri koleksi lainnya yaitu sebesar 1,56. Namun untuk
Burkholderia sp. PS4 memiliki nilai yang paling rendah yaitu sebesar 0,8 ppm.
Lain halnya dengan Pseudomonas aeruginosa P2 yang memiliki kemampuan
dalam melarutkan fosfat terlarut paling besar tetapi nilai IP tidak berbeda jauh
dengan Burkholderia sp. PS4. Setiap spesies bakteri mempunyai kemampuan secara genetik yang berbeda dalam menghasilkan asam-asam organik baik dalam
jumlah maupun jenisnya selama pertumbuhan. Jumlah dan jenis asam-asam
organik inilah yang berperan dalam menentukan tingginya pelarutan P (Tatiek,
1991).
d. Pengujian Bakteri Pelarut Fosfat dalam Menghasilkan Enzim Fosfatase
Setelah dilakukan pengujian kemampuan isolat bakteri dalam melarutkan
fosfat pada medium Pikovskaya padat dan cair, kemudian dilakukan pengujian
kemampuan kesembilan isolat bakteri (6 isolat asal tanah dan 3 isolat koleksi)
dalam menghasilkan enzim fosfatase (Gambar 15). Hasil dari pengamatan pada
penelitian ini dapat dilihat dalam Gambar 15 berikut ini :
Pada Gambar 15 diketahui bahwa nilai aktivitas enzim paling tinggi dari
isolat-isolat asal tanah dimiliki oleh Burkholderia sp. T9 yaitu sebesar 0,268 ppm dan paling kecil dimiliki oleh isolat bakteri T8 yaitu sebesar 0,112 ppm.
Sedangkan untuk isolat koleksi, nilai aktivitas enzim paling tinggi dimiliki oleh
Burkholderia sp. PS4 yaitu sebesar 0,127 ppm dan paling rendah dimiliki oleh
Bacillus subtilis J2 yaitu sebesar 0,058 ppm. Enzim fosfatase berperan utama dalam melepaskan fosfat dari ikatan P-organik. Enzim ini banyak dihasilkan oleh
mikrob tanah, terutama yang bersifat heterotrof (Havlin et al., 1999). Enzim fosfatase merupakan komplek enzim terpenting di dalam tanah yang berfungsi
melarutkan fosfat organik menjadi fosfat tersedia bagi tanaman. Enzim tersebut
akan dihasilkan secara dominan pada kondisi ketersediaan fosfor rendah.
Peningkatan aktivitas enzim fosfatase dapat terinduksi ketika jumlah P terbatas
dalam media tanam, hal ini juga mencirikan akan tingginya kebutuhan P (Salvin et al., 2000). Berdasarkan hal tersebut Burkholderia sp. T9 (asal tanah) dan isolat koleksi Burkholderia sp. PS4 dapat dikatakan memiliki kemampuan paling baik dalam melarutkan P-organik yang terikat sehingga apabila diaplikasikan ke dalam
tanah dapat meningkatkan efisiensi penyerapan fosfat oleh tumbuhan.
0,058
e. Kurva Standar Bakteri
Keempat isolat bakteri yaitu satu isolat bakteri asal tanah (Burkholderia sp. T9) dan 3 isolat bakteri koleksi CV. Meori Agro (Burkholderia sp. PS4, Bacillus subtilis J2 dan Pseudomonas aeruginosa P2) diamati pertumbuhan populasinya (Gambar 17). Hal ini dilakukan untuk memudahkan teknik inokulasi pada
percobaan selanjutnya. Kurva ini menyatakan hubungan antara nilai rapat optis
suspensi mikrob dengan populasi bakteri, yang dinyatakan dengan satuan
pembentuk koloni (SPK) yang ditentukan dengan cawan hitung, sehingga
didapatkan persamaan Y=a+bx, dimana Y= Jumlah populasi dalam cawan petri
dan X= nilai rapat optis suspensi mikrob. Inokulasi mikrob untuk percobaan
selanjutnya dapat menggunakan persamaan tersebut sehingga dapat diperoleh
jumlah sel mikrob yang sama.
Dilihat dari kurva standar diatas, dapat dikatakan bahwa pertumbuhan
Bacillus subtilis J2 memiliki nilai rapat optis (OD) dan nilai populasi terkecil diantara kedua koleksi bakteri lainnya maupun dengan isolat bakteri asal tanah
(Burkholderia sp. T9). Sedangkan pertumbuhan isolat lainnya dapat dikatakan cenderung hampir sama dalam setiap nilai OD berbanding dengan SPK. Namun
hasil ini memiliki makna lain bila dipandang lebih rinci berdasarkan metode
pengukurannya. Metode untuk pengukuran nilai rapat optis menggunakan
spektrofotometer yang bila dicermati hasilnya menunjukkan besaran rapat optis
bakteri yang diukur, namun faktor kehidupan bakteri diabaikan sehingga
spektrofotometer menghitung seluruh jumlah rapat optis bakteri yang muncul.
Berbeda halnya dengan metode pengukuran cawan hitung yang hasilnya dapat
dipastikan hanya menghitung jumlah populasi bakteri yang hidup saja, karena
bakteri yang mati tidak mungkin bisa tumbuh dan ikut terhitung dalam proses Gambar 17. Kurva Standar Empat Isolat Bakteri
pengukuran populasi. Dengan kata lain, masa hidup optimal Bacillus subtilis J2 berlangsung lebih singkat dibandingkan tiga isolat bakteri lainnya, karena setelah
diukur dengan menggunakan spektrofotomer menunjukkan hasil rapat optis yang
tinggi, namun ketika diuji dengan metode cawan hitung hasil populasinya
menunjukkan bahwa Bacillus subtilis J2 tidak serapat hasil perhitungan
spektrofotometer.
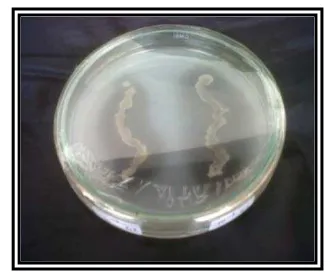
4.6. Uji Antagonis Isolat bakteri
Pengujian antagoniskeempat isolat bakteri yaitu satu isolat bakteri asal tanah
(Burkholderia sp. T9) dan 3 isolat bakteri koleksi CV. Meori Agro (Burkholderia
sp. PS4, Bacillus subtilis J2 dan Pseudomonas aeruginosa P2) dilakukan dengan
metode silang pada cawan petri. Pada Gambar 18 dapat dilihat pengujian
antagonis antara 2 isolat bakteri, 3 isolat bakteri dan 4 isolat bakteri berbeda jenis
yang ditumbuhkan dalam satu cawan petri. Hasil dari pengujian ini menunjukkan
bahwa tidak terjadi aktivitas penghambatan dari pertumbuhan masing-masing
bakteri. Hal ini berarti bahwa jika isolat bakteri ditumbuhkan bersamaan dalam
satu media maka masing-masing isolat bakteri akan tetap tumbuh dan tidak saling
menghambat. Hasil pertumbuhan dari setiap isolat bakteri yang ditumbuhan
bersamaan dalam satu media baik 2, 3, dan 4 isolat bakteri berbeda menunjukkan
hasil pertumbuhan yang sama dengan pertumbuhan setiap bakteri secara tunggal