KUALITAS SPERMATOZOA KAUDA EPIDIDIMIS
DOMBA MASA TUMBUH YANG DIBERI EKSTRAK
ETANOL DAUN KATUK PADA PENYIMPANAN 4ºC
ARUM SAKSONO
DEPARTEMEN KLINIK, REPRODUKSI, DAN PATOLOGI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Kualitas Spermatozoa Kauda Epididimis Domba Masa Tumbuh yang Diberi Ekstrak Kasar Etanol Daun Katuk pada Penyimpanan 4ºC adalah benar karya saya denganarahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ARUM SAKSONO.Kualitas Spermatozoa Kauda Epididimis Domba Masa Tumbuh yang Diberi Ekstrak Etanol Daun Katuk pada Penyimpanan 4ºC. Dibimbing oleh M. AGUS SETIADI dan AGIK SUPRAYOGI.
Katuk merupakan tanaman yang memiliki senyawa aktif yang dapat merangsang hormon reproduksi. Penelitian ini bertujuan untuk mengetahui efek ekstrak etanol daun katuk terhadapkarakteristik spermatozoadi kauda epididimis domba masa tumbuh. Penelitian ini dilakukan pada enam domba jantan lokal usia lima bulan yang terbagi menjadi dua kelompok, yaitu kelompok EtOH dan kontrol.Domba diberi 1500 mg/hari ekstrak etanol daun katuk selama dua bulan, di mana kelompok kontrol hanya diberi plasebo. Epididimis dikumpulkan setelah penyembelihandan spermatozoanya dikoleksi. Koleksi spermatozoa kemudian dianalisis untuk dilihat karakteristiknyaseperti konsentrasi, motilitas,daya hidup, keutuhan membran, dan abnormalitasselama penyimpananlima hari dalamrefrigerator. Konsentrasi dan bobot epididimis diperiksa pada hari pertama. Hasil penelitian menunjukkan bahwa tidak ada perbedaan nyatapada konsentrasi spermatozoapada kedua perlakuan. Motilitas spermatozoa, daya hidup, integritas membran, dan abnormalitas mengalami penurunan dari hari ke hari. Namun demikian, tidak ada perbedaan nyatapada karakteristik spermatozoapadakedua perlakuan selama penyimpanan lima hari. Motilitas sperma tidak terdeteksi pada hari keempat. Hal yang menarik adalahdaya hidup masih tinggi dan terdeteksi hingga akhir.
Kata kunci:ekstrak etanol daun katuk, kauda epididimis, spermatozoa
ABSTRACT
ARUM SAKSONO.The Quality of Growth Ram Cauda Epididymal Sperm That Feed with Extract Katuk Leaves in Ethanol on Storage at 4ºC. Under direction M. AGUS SETIADI and AGIK SUPRAYOGI.
was no detected on the day four. Interestingly, the viabilitywere still high and detected until the end of research.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
KUALITAS SPERMATOZOA KAUDA EPIDIDIMIS
DOMBA MASA TUMBUH YANG DIBERI EKSTRAK
ETANOL DAUN KATUK PADA PENYIMPANAN 4ºC
ARUM SAKSONO
DEPARTEMEN KLINIK, REPRODUKSI, DAN PATOLOGI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi :Kualitas Spermatozoa Kauda Epididimis Domba Masa Tumbuh yang Diberi Ekstrak Etanol Daun Katuk pada Penyimpanan 4ºC Nama : Arum Saksono
NIM : B04070183
Disetujui oleh
Prof. Dr. drh. Mohamad Agus Setiadi Pembimbing I
Prof. Dr. drh. Agik Suprayogi, MSc. AIF Pembimbing II
Diketahui oleh
drh. Agus Setiyono, MS, Ph.D, AP. Vet. Wakil Dekan Fakultas Kedokteran Hewan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini.Bidang penelitian yang menjadi kajian penulis dalam penelitian ini adalah fisiologi reproduksi dengan judul Kualitas Spermatozoa Kauda Epididimis Domba Masa Tumbuh yang Diberi Ekstrak Etanol Daun Katuk pada Penyimpanan 4ºC. Karya ilmah ini dapat terwujud atas dukungan dana DIPA IPB Direktorat Jendral Pendidikan Tinggi, Departemen Pendiddikan Nasional dengan SPK Tahun Anggaran 2010 Nomor 8/ 13.24.4/SPK/PSN/2010, 5 Maret 2010 yang diketuai oleh Prof. Dr. drh. Agik Suprayogi, Msc. AIF.
Pada kesempatan ini penulis ingin menyampaikan terima kasih kepada Bapak Prof. Dr. drh. Mohamad Agus Setiadi dan Bapak Prof. Dr. drh. Agik Suprayogi, MSc, AIF selaku dosen pembimbing yang telah memberikan bimbingan dan arahan selama masa studi penulis hingga selesainya tugas akhir ini. Di samping itu, penghargaan penulis sampaikan kepada Adi Ningrum Kurniasari, Mbak Hidayaturrahmah, dan Bapak Bondan yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ibu, bapak, ketiga kakakku, Uda, dan teman-teman yang selalu memberikan perhatian, didikan, doa, kasih sayang, dan semangat yang tak terhingga.Tak lupa penulis ucapkan terimakasih kepada keluarga besar Fakultas Kedokteran Hewan IPB khususnya rekan-rekan Gianuzzi FKH 44.
Penulis menyadari bahwa skripsi ini jauh mendekati sempurna sehingga penulis menerima segala saran dan kritik dari pembaca. Terlepas dari semua itu, penulis mengharapkan bahwasanya skripsi ini dapat bermanfaat bagi seluruh pihak.Semoga karya ilmiah ini bermanfaat.
Bogor, April 2013
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 1
TINJAUAN PUSTAKA 2
Taksonomi Tanaman Katuk 2
Senyawa Aktif Katuk yang Bermanfaat dalam Reproduksi 2
Ekstraksi 3
Anatomi Reproduksi pada Hewan Jantan 3
Masa Reproduksi pada Hewan Jantan 4
Spermatogenesis dan Pengaruh Beberapa Hormon Reproduksi 4
METODE 6
Waktu dan Tempat Penelitian 6
Alat 6
Bahan 6
Proses Ekstraksi Daun Katuk 6
Prosedur Penelitian 7
Prosedur Pengambilan Sampel 7
Parameter Pengukuran 8
Protokol Penelitian 10
Prosedur Analisis Data 10
HASIL DAN PEMBAHASAN 10
Konsentrasi Spermatozoa 10
Persentase Motilitas Spermatozoa 12
Persentase Daya Hidup dan Keutuhan Membran Spermatozoa 12 Persentase Cytoplasmic Droplet dan Abnormalitas Spermatozoa 14
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 17
DAFTAR PUSTAKA 17
LAMPIRAN 20
DAFTAR TABEL
1 Konsentrasi spermatozoa di kauda epididimis dan bobot epididimis setelah pemberian ekstrak etanol daun katuk 10 2 Persentase motilitas spermatozoa setelah pemberian ekstrak etanol daun
katuk 12
3 Persentase daya hidup spermatozoa setelah pemberian ekstrak etanol
daun katuk 13
4 Persentase keutuhan membran sepermatozoa setelah pemberian ekstrak
etanol daun katuk 13
5 Persentase cytoplasmic droplet spermatozoa setelah pemberian ekstrak
etanol daun katuk 14
6 Persentase abnormalitasspermatozoa setelah pemberian ekstrak etanol
daun katuk 14
DAFTAR GAMBAR
1 Tanaman katuk beserta buah dan bunganya 2
2 Mekanisme hormon-hormon yang mengatur fungsi reproduksi 5
3 Bagan proses ekstraksi daun katuk 7
4 Berbagai macam abnormalitas pada spematozoa 9
5 Protokol penelitian 10
DAFTAR LAMPIRAN
1 Hasil General Linear Model konsentrasi seprmatozoa 20 2 Hasil General Linear Model bobot epididimis 20 3 Hasil General Linear Modelpersentase motilitas spermatozoa 20 4 Hasil General Linear Modelpersentase daya hidup spermatozoa 21 5 Hasil General Linear Model persentase keutuhan membran
spermatozoa 21
6 Hasil General Linear Model persentase cytoplasmic droplet
spermatozoa 21
PENDAHULUAN
Latar Belakang
Katuk (Sauropus androgynus (L.) Merr) merupakan tanaman obat yang telah mendorong para peneliti untuk menemukan senyawa aktif di dalamnya. Suprayogi (2000) melaporkan bahwa pemberian daun katuk kering giling 7.44 g/hari secara oral pada domba laktasi dapat meningkatkan nutrisi di dalam darah yang menuju kelenjar ambing selama 13 hari. Subekti et al. (2008) menyatakan bahwa penggunaan ekstrak dan tepung daun katuk mempengaruhi peningkatan sistem reproduksi pada puyuh. Ekstrak daun katuk juga dapat memacu sekresi air susu pada hewan betina selain domba, yaitu babi (Sidauruk 2008) dan mencit (Suprayogi et al. 2009). Lebih lanjut dikemukakan keberadaan senyawa-senyawa aktif dalam daun katuk yang merupakan prekursor hormon androgen (Suprayogi 2000) dan pengaruhnya pada hewan jantan kemungkinan dapat meningkatkan seksualitas serta fertilitas dengan peningkatan hormon androgen. Hormon androgen akan mempengaruhi spermatogenesis pada hewan jantan sehingga dengan pemberian katuk diharapkan akan memperbaiki spermatogenesis dan meningkatkan kualitas spermatozoa menjadi lebih baik.
Penelitian ini menggunakan hewan percobaan domba jantan yang sedang berada dalam masa tumbuh. Domba jantan sangat memungkinkan dijadikan sumber bibit dan donor semen dengan tujuan memperbaiki performans hasil keturunannya. Meskipun hewan jantan mati, namun spermatozoa dari hewan tersebut masih dapat digunakan untuk aplikasi teknologi reproduksi. Berkaitan dengan informasi bahwa ekstrak daun katuk dapat meningkatkan kemampuan seksualitas dan fertilitas dengan peningkatan hormon androgen, maka penelitian dilakukan untuk mengamati kualitas spermatozoa dari kauda epididimis domba yang diberi ekstrak etanol daun katuk.
Tujuan Penelitian
Penelitianini bertujuan untuk mengkaji kualitas spermatozoa pada domba jantan setelah pemberian ekstrak etanol daun katuk.
Manfaat Penelitian
2
TINJAUAN PUSTAKA
Taksonomi Tanaman Katuk
Katuk merupakan tumbuhan perdu yang memiliki batang, daun, dan bunga.Tumbuhan ini termasuk ke dalam divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledonae, bangsa Euphorbiales, famili Euphorbiaceae, marga Sauropus, dan jenis Sauropus androgynus (L.) Merr.Tumbuhan ini berbatang tegak.Daunnya berbentuk bulat telur dengan ujung meruncing dan pertulangannya menyirip.Bunga katuk berwarna merah keunguan.Putik dan benang sari masing-masing berjumlah tiga.Buahnya bulat dan berwarna hijau muda agak keunguan.Setiap buah berisi tiga biji.Biji buahnya bulat, keras, dan berwarna putih.Akar tumbuhan katuk merupakan akar tunggang (BPOM RI 2008).
Senyawa Aktif Katuk yang Bermanfaat dalam Reproduksi
Katuk mengandung senyawa-senyawayang bermanfaat dalam fungsi reproduksi.Subekti et al. (2008) menyatakan bahwa katuk mengandung kelompok fitosterol yaitu stigmasterol, sitosterol, dan fukosterol dengan menggunakan pelarut etanol.Suprayogi (2000)menemukansenyawa alkaloid dalam daun katuk yaituisoquinoline. Efek akibat isoquinolinemirip dengan efekdari papaverine sehingga senyawa ini juga disebut Papaverine Like Compound.
Agusta et al. (1997) menyatakan bahwa ekstrak daun katuk dengan pelarut etanol memiliki nilai tertinggi dari senyawa 17-ketosteroid yaitu androstan-17-one,3-ethyl-3-hydroxy-5 alpha. Senyawa androstan-17-one,3-ethyl-3-hidroxy-5 alphadalam katuk terlibat langsung sebagai prekursor dalam biosintesis hormon steroid (Suprayogi 2000). Senyawa ini dapat diubah menjadi testosteron dan dehydroepiandrosteron (DHEA) yang dapat disintesis menjadi hormon steroid(Despopoulos dan Silbernagl 2003).
Wang dan Lee (1997)menemukan tiga senyawa flavonol pada ekstrak daun katuk yang menggunakan pelarut etanol,yaitu 3-O-β-D-glucosyl-7-O-α -L-rhamnosyl-kaemferol, 3-O-β-D-glucosyl-(1→6)-β-D-glucosyl-kaemferol, dan 3-O-β-D-glucosyl-(1→6)-β-D-glucosyl-7-O-α-L-rhamnosyl-kaemferol.Katuk juga mengandung fenol (Andarwulan dan Faradilla 2012).Senyawa-senyawa inimampu menghambat oksidasi dari LDL (Low Density Lypoprotein) (Andarwulan dan Faradilla 2012).Tanaman ini juga mengandung fitosterol yang baik untuk fungsi reproduksi, yaitu mempengaruhi daya tetas dan fertilitas pada unggas (Subekti et
3 al. 2008).Senyawa ini dapat dimetabolisme menjadi pregnenolon dan DHEA (dehydropiandrosteron) yang merupakan prekursor hormon steroid (Al Zyood dan Shawakfa 2006).
Katuk mengandung vitamin C dan vitamin E (Subekti et al. 2008).Kedua vitamin ini berfungsi sebagai antioksidan.Vitamin C bersifat mencegah oksidasi molekul.Korelasi positif antara tingkat vitamin C yangtinggi dengan morfologi spermatozoa yang normal menunjukkan bahwa vitamin C memiliki peran penting sebagai antioksidan (Sharma dan Agarwal 1996). Vitamin E berperan sebagai antioksidan yang melindungi PUFA (Polyunsaturated Fatty Acid), komponen sel, dan membran sel dari oksidasi oleh radikal bebas (Hariyatmi 2004) sehingga memungkinkan sel spermatozoa lebih lama bertahan hidup. Hal ini diperkuat dengan penelitian Astuti et al. (2009) yang menyebutkan bahwa tepung kedelai yang mengandung isoflavon, Zn, dan vitamin E pada tikus jantan dapat meningkatkan motilitas dan konsentrasi spermatozoa.
Ekstraksi
Ekstraksi adalah pemisahan campuran beberapa zat menjadi komponen yang terpisah (Winarno et al. 1973). Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi senyawa aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai (Depkes RI 1995). Simplisia adalah bahan alamiah yang belum mengalami perubahan apapun dan biasanya merupakan bahan yang dikeringkan (BPOM RI 2005). Secara umum dikenal beberapa metode dalam ekstraksi, yaitu maserasi, refluksi, digesti, infusi, perkolasi, dan sokletasi (Depkes RI 2000). Metode ekstraksi yang digunakan dalam penelitian ini adalah maserasi. Maserasi adalah menghaluskan bahan yangumumnya dilakukan dengan memotong bahan dan disatukan dengan bahan pengekstraksi (Voigt 1994).
Pelarut adalah cairan yang digunakan dalam proses pemecahan senyawa untuk membentuk larutan dan biasanya terdiri dari beberapa zat yang bersifat dapat tercampur. Kelarutan zat dalam pelarut dapat bersifat polar dan non polar. Senyawa polar larut dalam pelarut polar, sedangkan senyawa non polar larut dalam pelarut non polar (Winarno et al. 1973). Jenis pelarut untuk ekstraksi polar di antaranyaadalah air, etanol, dan metanol, sedangkan pelarut untuk ekstraksi non polar adalah heksan, petroleum eter, dan kloroform (Sarker et al. 2006).
Etanol merupakan cairan volatil yang mudah terbakar, jernih, mudah menguap, aromanya menyegarkan, dan mudah larut dalam air (Depkes RI 1995). Kelebihan pelarut etanol di antaranya adalah tidak menyebabkan pembengkakan membran sel sehingga memperbaiki stabilitas bahan obat terlarut. Etanol juga dapat menghasilkan hasil bahan aktif yang optimal (Voigt 1994).
Anatomi Reproduksi pada Hewan Jantan
4
(Bearden et al. 2004).Testes berjumlah dua buah dan terdiri dari saluran yang disebut tubuli seminiferi yang menghasilkan spermatozoa (Toelihere 1993).
Epididimisterdiri darikaput,korpus, dankauda(Toelihere 1993). Epididimisakan menyalurkan sperma dan bermuara ke duktus deferens yang berakhir sebagai saluran ejakulasi (Turner 1991). Epididimis memiliki fungsi yaitu pengangkutan spermatozoa, pengkonsentrasian spermatozoa, penyimpanan spermatozoa, dan pematangan spermatozoa (Bearden et al. 2004).
Jaringan tubulus seminiferus pada epididimis dipisahkan dari jaringan testis yang lain dengan blood-testis barrier (Despopoulos dan Silbernagl 2003). Istilah blood-testis barrier atau blood-epididymis barrierdigambarkan sebagai pembatas antara sel epitel dan sel Sertoli di epididimis yang membatasi keluar masuknya molekul dan sel dari lumen sehingga tercipta lingkungan untuk perkembangan dan pematangan sel kecambah (Mital et al. 2011).
Masa Reproduksi pada Hewan Jantan
Pubertas merupakan akhir dari proses perubahan endokrin yang dimulaisetelah lahir. Pubertas pada domba terjadi saat usiatujuh hingga delapan bulan (Cunningham dan Klein 2007) yang dapat dipengaruhi oleh umur, bobot badan, faktorgenetik,lingkungan, iklim, dan makanan (Toelihere 1993). Saat hewan mengalami pubertas, terjadi perubahan testosteron di dalam testes (Pineda 2003).
Pubertas terjadi ketika sistem hipotalamus-hipofise padahewan peka terhadaphambatan umpan balik pada gonad.Onset pubertas menyebabkan naiknya sintesis dan pelepasan GnRH dari hipotalamus sehingga menggerakkan sekresi gonadotropin.Sebelum pubertas, pelepasan GnRH dan sekresi gonadotropin disimpan karena hipotalamus sangat sensitif terhadap hambatan umpan balik negatif oleh hormon steroid.Hal ini terlihat saathewan muda mengeluarkan sejumlah kecil FSH dan LH dari hipofise sehingga sekresi gonadotropin menjadi rendah(Cunningham dan Klein 2007).
White et al. (2005) menyatakan bahwa bobot dan volume testis, volume dan diameter tubulus seminiferus, dan bobot epididimis lebih rendah pada umur sebelum pubertas dibandingkan dengan sesudah pubertas pada beruang.Wildeus (1993) menunjukkan bahwa lingkar skrotum pada sapi berkorelasi positif terhadap umur, bobot badan, serta bobot, panjang, dan lebar testis. Total produksi sperma sehari-hari dan jumlah sperma pada epididimis juga lebih besar saat pubertas.
Spermatogenesis dan Pengaruh Beberapa Hormon Reproduksi
5 testosterondi mana spermatid mengalami perubahan bentuk menjadi spermatozoa (Toelihere 1993). Proses tersebut pada domba berlangsung selama 46 sampai 49 hari (Bearden et al. 2004).
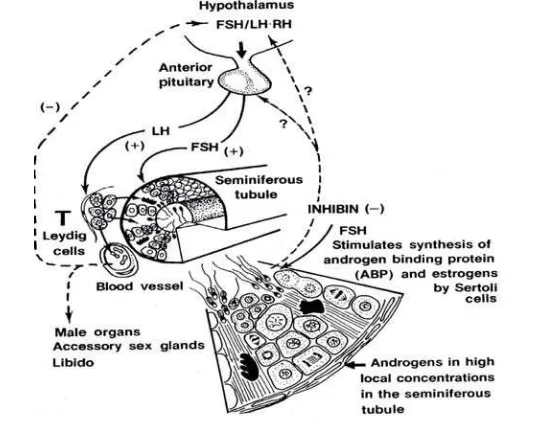
Spermatogenesis membutuhkan interaksi dari berbagai hormon reproduksi. Hormon yang mengatur reproduksi adalah GnRH. GnRH merangsang pelepasan FSH dan LH dari kelenjar hipofise anterior melalui umpan balik positif (Bearden et al. 2004).Fungsi FSH pada hewan jantan adalah menstimuli spermatogenesis di dalam tubuli seminiferi testis,merangsang sekresi inhibin, dan menginduksi ABP (androgen binding protein) dalam sel Sertoli pada testis (Toelihere 1993). LH berperan dalam pematangan spermatozoa dengan merangsang sekresi hormon androgen. Androgen adalah hormon steroid yang terdiri atas testosteron, dihydrotestosterone (DHT), dan 17-ketosteroid seperti dehydroepiandrosterone (DHEA) (Despopoulos dan Silbernagl 2003).
Testosteronberfungsimerangsang spermatogenesis(Bearden et al. 2004),mempertahankan spermiogenesis dalam tubuli seminiferus, dan memperpanjang umur spermatozoa di epididimis (Toelihere 1993). Hormon ini disintesis dalam sel Leydig testis dansekresinya diatur oleh LH (Despopoulos dan Silbernagl 2003). Testosteron akan diikat oleh ABP agar terjadi proses spermatogenesis. ABP disekresi oleh sel Sertoli di bawah pengaruh FSH kemudian diabsorpsi di epididimis (Bearden et al. 2004). ABP juga mengatur transportasi testosteron ke epididimis yang diubah menjadi DHT dan berperan dalam perjalanan serta pematangan spermatozoa (Cunningham dan Klein 2007).
Konsentrasi testosteron yang tinggi akan menghambat sekresi gonadotropin melalui mekanisme umpan balik negatif sedangkan estradiol mengontrol sekresi FSH dan menghambat sekresi androgen melalui sel Leydig. Inhibinbersama testosteron berfungsimengontrol sekresi FSH oleh kelenjar hipofise melalui mekanisme umpan balik negatif (Pineda 2003). Aktivin dalam rete testis bekerja
sebagai umpan balik positif terhadap hipofise (Hafez dan Hafez 2000). Gambar 2 Mekanisme hormon-hormon yang mengatur
6
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai bulan Maret hingga Agustus 2010.Proses ekstraksi dilakukan di Laboratorium Fisiologi Departemen Anatomi, Fisiologi, dan Farmakologi FKH-IPB. Perlakuan hewan coba dilakukandi Karyomendo Farm,Jl. Cibanteng Proyek 100, Cihideung Ilir, Ciampea-Bogor kemudian dilanjutkan di Laboratorium Fertilisasi In Vitro Departemen Klinik, Reproduksi, dan Patologi, FKH-IPB untuk pengamatan karakteristik spermatozoa.
Alat
Penelitian ini menggunakan alat-alat standar untuk proses ekstraksi dan analisis karakteristik spermatozoa. Alat-alat yang digunakan terdiri atas oven, panci Stainless, mesin automatik, rotary-evaporator, gelas erlenmeyer,syringe1 cc, kamar hitung Neubauer, tabungeppendorf, mikroskop, gelas objek, dan cover glass.
Bahan
Bahan yang digunakan dalam penelitian ini terdiri atas enam pasang epididimis domba lokal jantan dan daun katuk segar. Bahan-bahan lain yang digunakan adalah pelarut etanol, maltodekstrin, kapsul, larutan formal saline, eosin negrosin, NaCl fisiologis, reagen HOS test, dan akuades.
Proses Ekstraksi Daun Katuk
7
ProsedurPenelitian
Enam ekor domba jantan dengan usia lima bulan yang diperoleh dari Bogor dikandangkan dalam kandang individu.Domba diberi Albendazole® dan Ivermectin® selama sepuluh hari masa adaptasi.Domba juga dilatih dengan pemberian pakan berupa konsentrat dan rumput selama penelitian.Bahan konsentrat yang digunakan berupa campuran dedak padi, bungkil kelapa, bungkil kedelai, tepung ikan, premiks, dan garam. Tiap domba mendapat formula konsentrat dan komposisi nutrisi yang sama. Domba diberikan konsentrat pada pagi hari dari pukul 07.00 sampai pukul 12.00 dan pukul berikutnya hingga pagi hari domba diberi rumput. Domba juga diberi minum ad libitum.
Domba dibagi menjadi dua perlakuan setelah diadaptasikan selama sepuluh hari, yaitu kontrol (pakan normal domba) dan ekstrak etanol (EtOH). Masing-masing kelompok mendapat perlakuan yaitu kontrol dengan plasebo dan EtOH dengan dosis 1500 mg/hari (empat kapsul EtOH). Dosis itu diberikan sebanyak dua kali sehari pada pagi dan sore hari selama dua bulan (Suprayogi et al. 2010).
Prosedur Pengambilan Sampel
Pengambilan sampel dilakukan pada saat pemotongan domba berusia tujuh bulan. Testisnya dibawa ke laboratorium dalam termos berisi NaCl fisiologis dan icepack. Epididimis diambil dari testis, ditimbang bobotnya, disimpan dalam wadah plastik berisi larutan NaCl fisiologis, dan disimpan dalam refrigerator dengan suhu 4ºC. Koleksi spermatozoa dilakukan dengan menusuk kauda
Gambar 3 Bagan proses ekstraksi daun katuk Daun Katuk Kering
(Sauropus androgynus (L.) Merr)
Penggilingan
Ekstraksi dengan pelarut etanol
Evaporasi dengan rotary-evaporator pada temperatur 40ºC
8
epididimis kiri dan kanan dengan syringe. Spermatozoa yang keluar kemudian dicampur dan diteteskan di atas gelas objek untuk dihomogenkan.
Parameter Pengukuran
Sampel spermatozoa dievaluasi selama lima hari. Pengamatan meliputi konsentrasi spermatozoa, persentase motilitas spermatozoa, persentase spermatozoa yang masih hidup, persentase keutuhan membran plasma spermatozoa, persentase cytoplasmic droplet spermatozoa, dan persentase abnormalitas spermatozoa.
Konsentrasi Spermatozoa
Konsentrasi diukur satu kali pada H-0.Pengenceran 500x dilakukan dengan mencampurkan 1 µL cairan epididimis dengan 499 µL formal saline. Campuran ini diteteskan ke dalam kamar hitung Neubauer dan diamati di bawah mikroskop dengan perbesaran 400x. Jumlah spermatozoa yang terdapat dalam lima kotak haemacytometer yaitu satu kotak pada tiap ujung dan satu kotak di tengah kemudian dihitung. Konsentrasi spermatozoa dihitung dengan menggunakan
rumus berikut :
Persentase Motilitas Spermatozoa
Penilaian motilitas dilakukan dengan meneteskan cairan epididimis di atas gelas objek kemudian ditambahkan tiga tetes NaCl fisiologis.Cairan diaduk dan ditempelkan cover glass.Pergerakan spermatozoa dilihat di bawah mikroskop pada perbesaran 40x dan dinilai dalam %.
Persentase Daya Hidup Spermatozoa
Persentase daya hidup spermatozoa dilakukan dengan meneteskan cairan epididimis ke gelas objek dan ditambahkan dua tetes eosin negrosin.Campuran diaduk dan dibuat preparat ulas yang tipis. Preparat lalu difiksasi dan diamati di bawah mikroskop dengan perbesaran 40x.Spermatozoa yang dihitung minimal 200 spermatozoa denganbeberapalapang pandang.Spermatozoa hidup ditandai dengan kepala berwarna putih sedangkan spermatozoa mati ditandai dengan kepala berwarna merah.
%
Persentase Keutuhan Membran Plasma – HOS Test
Persentase keutuhan membran plasma ditentukan dengan hypoosmotic swelling (HOS) test.Reagen HOS test adalah campuran 0.675 gram fruktosa dan 0.735 gram natrium sitrat dalam 50 ml aquades. Satu tetes cairan epididimis
9 dicampur dengan sembilan tetes reagen HOS testdalam tabung eppendorf dan diinkubasi pada suhu 37ºC selama 30 menit.Campuran diteteskan di atas gelas objek kemudian spermatozoa dengan membran plasma utuh dihitung.Spermatozoa dengan membran plasma utuh ditandai oleh ekor melingkar atau menggembung.Spermatozoa yang dihitung minimal 200 spermatozoa dengan beberapa lapang pandang.
%
Persentase Abnormalitas Spermatozoa
Penghitungan persentase abnormalitas spermatozoa dilakukan dengan memeriksa spermatozoa yang masih memilikicytoplasmic dropletyang ditandai dengan adanya butiran pada ekor spermatozoa dan abnormalitas lain yang ditandai dengan kelainan bentuk seperti kepala terlalu kecil, kepala terlalu besar, ekor patah, ekor melingkar, ekor ganda, dan sebagainya. Penghitungan menggunakan preparat ulas yang telah dibuat pada pemeriksaan spermatozoa yang masih hidup sebelumnya.Spermatozoa yang dihitung minimal 200 spermatozoa dengan beberapa lapang pandang.
%
10
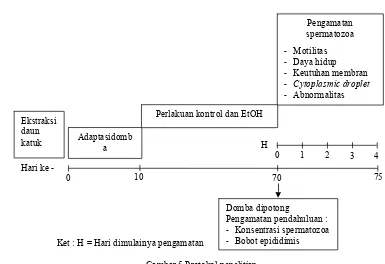
Protokol Penelitian
Prosedur Analisis Data
Rancangan dalam penelitian ini adalah rancangan acak lengkap (RAL) dengan dua macam perlakuan dengan tiga kali ulangan.Data dianalisis dengan General Linear Model(GLM) univariat.
HASIL DAN PEMBAHASAN
Konsentrasi Spermatozoa
Penilaian konsentrasi merupakan salah satu kriteria dalam penilaian kualitas semen (Toelihere 1993).Konsentrasi spermatozoa dan bobot rata-rata epididimis dapat dilihat pada Tabel 1.
Adaptasidomb a
Perlakuan kontrol dan EtOH
Pengamatan
Ket : H = Hari dimulainya pengamatan
75
Gambar 5 Protokol penelitian
Tabel 1Konsentrasi spermatozoa di kauda epididimis dan bobot epididimis setelah pemberian ekstrak etanol daun katuk
Perlakuan Konsentrasi (106 sel/ml) Bobot rata-rata epididimis (g) Kontrol 6323 ± 2928.22 32.26 ± 2.56
11
Konsentrasi dan bobot rata-rata epididimis pada kedua perlakuan tidak menunjukkan perbedaan yang nyata.Hal ini sesuai dengan Toelihere (1993) yang menyatakan bahwa konsentrasi spermatozoa mempunyai kolerasi tinggi dengan bobot testis.Tidak adanya perbedaan yang nyata pada konsentrasi dari kedua perlakuan berhubungan dengan tidak adanya perbedaan yang nyata pada bobot epididimis dalam penelitian ini.
Konsentrasi spermatozoa pada kedua perlakuan lebih rendah dibandingkan penelitian sebelumnya. Rizal dan Herdis (2005) menyatakan bahwa konsentrasi spermatozoa di kauda epididimis domba Garut sebanyak 13 933.33 juta sel/ml (berkisar antara 13 530 dan 14 520 juta sel/ml), sedangkan menurut Surachman et al. (2006) konsentrasi spermatozoa di kauda epididimis domba rata-rata 11 660 juta sel/ml (berkisar antara 10 390 dan 12 420 juta sel/ml).Perbedaan hasil yang diperoleh diduga akibat perbedaan umurdan kondisi reproduksi domba yang digunakan pada penelitian.Domba dalam penelitian sebelumnya adalah domba dewasa sedangkan domba dalam penelitian ini berusia tujuh bulan sehingga kemungkinan baru mengalami masa awal pubertas dan belum dewasa.Secara umum, saat terjadinya pubertas dapat dipengaruhi oleh umur (Wodzicka-Tomaszewska 1991).
Penelitian ini menunjukkan perlakuan yang tidak nyata seperti yang terlihat pada Tabel 1, namun secara kuantitatif perlakuan etanol menunjukkan nilai konsentrasi yang sedikit lebih rendah dibandingkan dengan kontrol. Hal inikemungkinan terjadi mengingat dari hasil pustaka yang ada, ekstrak etanol katuk mengandung senyawa androstan-17-one,3-ethyl-3-hidroxy-5 alpha, fitosterol, alkaloid (Papaverine Like Compound), dan flavonoid yang terdapat dalam katuk.Senyawa androstan-17-one,3-ethyl-3-hidroxy-5 alpha (17-ketosteroid) merupakan prekursor dalam biosintesis hormon steroid (Suprayogi 2000) dan kemungkinan besar diubah menjadi hormon testosteron. Fitosterol dapat diubah menjadi prekursor hormon steroid sehingga meningkatkan kadar hormon steroid (Gilman et al. 2003). Menurut Susetyarini et al. (2011), senyawa alkaloid (Papaverine Like Compound) dan flavonoid dapat mengganggu sintesis dan sekresi hormon dalam poros hipotalamus-hipofise-testis pada tikus putih. Tingginyakadar hormon steroid terutama testosteron akibat senyawa-senyawa ini menyebabkan poros hipotalamus-hipofise-testis terganggu.
12
Persentase Motilitas Spermatozoa
Spermatozoa dalam suatu kelompok mempunyai kecenderungan untuk bergerak bersama-sama ke satu arah (Toelihere 1993). Nilai persentase motilitas disajikan dalam Tabel 2.
Persentase motilitas antarakedua perlakuantidak memperlihatkan perbedaan yang nyata mulai H-0 hingga H-4. Rerata hari pertama pada perlakuan etanol lebih tinggi dibandingkan kontrol.Penurunan mulai terjadi pada kedua perlakuan di hari keduakemudian pada hari ketiga dan hari keempat tidak terlihat adanya motilitas pada spermatozoa.Hal ini kemungkinan akibat adanya akumulasi toksik dari hasil metabolisme terutama ion yang dapat terbentuk melalui peroksidasi lipid seperti ion oksigen dan ion peroksida. Ion-ion ini dapat menjadi radikal bebas dan dapat merusak membran plasma spermatozoa (Salamon dan Maxwell 2000). Permukaan sel spermatozoa dibungkus oleh membran lipoprotein. Apabila sel mati, permeabilitas membran menjadi tinggi dan rusak (Toelihere 1993). Rusaknya membran plasma akan menyebabkan penurunan motilitas. Hal ini sesuai dengan Herdis et al. (2005) yang menyatakan bahwa selama penyimpanan dapat terjadi perubahan fisik dan biokimia dari spermatozoa sehingga motilitas menurun.
Hasil penelitian menunjukkan perlakuan yang tidak nyata, namun secara kuantitatif perlakuan etanol memperlihatkan penurunan motilitas yang lebih cepat terjadi.Hal ini kemungkinan akibat adanya senyawa alkaloid yaitu Papaverine Like Compound yang terkandung dalam katuk. Alkaloid diduga dapatmengganggu aktivitas enzim ATP-ase yang terdapat di membran sel spermatozoa di bagian tengah ekor. Enzim ini berfungsimempertahankan homeosatatis internal untuk ion natrium dan kalium. Terganggunya aktivitas enzim ATP-ase mengakibatkan kadarnatrium dan pengeluaran kaliummenurun.Penurunan kedua ion ini mengakibatkan membransel tidak dapat mengangkut bahan terlarut ke dalam sitoplasma.Transportasi nutrien yang diperlukan oleh spermatozoa untuk pergerakanmenjadi terganggu sehingga motilitas lebih cepat menurun (Susetyarini et al. 2011).
Persentase Daya Hidup dan Keutuhan Membran Spermatozoa
Persentase daya hidup dan keutuhan membran spermatozoa penting dalam menilai kualitas spermatozoa.Data hasil pengamatan dapat dilihat pada Tabel 3 dan Tabel 4.
Tabel 2 Persentase motilitas spermatozoa setelah pemberian ekstrak etanol daun katuk
Perlakuan Waktu Penyimpanan
Hari ke-0 (%) Hari ke-1 (%) Hari ke-2 (%) Hari ke-3 (%) Hari ke-4 (%)
Kontrol 62.0 ± 22.5 40.0 ± 10.0 20.0 ± 5.0 0 ± 0 0 ± 0
13
Persentase daya hidup spermatozoa antar perlakuan tidak menunjukkan perbedaan secara nyata.Secara umum terjadi kecenderungan penurunan persentase daya hidup spermatozoa dan keutuhan membran spermatozoa pada kedua kelompok walaupun persentasenya masih terbilang tinggi.Menurut Nolan dan Hammerstedt (1997), membran plasma sel spermatozoa di kauda epididimis tidak mendapatkan perlindungan berupa glikoprotein yang disintetis oleh kelenjar vesikularis dan disekresikan ke dalam plasma semen.Glikoprotein sangat penting dalam melindungi membran plasma sel spermatozoa dari kerusakan akibat efek pendinginan yang terjadi selama penyimpanan dalam refrigerator dan radikal bebas yang dapat terbentuk akibat kontak dengan oksigen saat spermatozoa dikoleksi.Tidak adanya glikoprotein menyebabkan membran sel spermatozoa mudah rusak sehingga persentase keutuhan membran dan persentase hidup spermatozoa menurun.Namun demikian, Varisli et al. (2009) menyatakan bahwa spermatozoa epididimis pada domba lebih tahan terhadap efek pendinginan dibandingkan dengan spermatozoa hasil ejakulasi.
Persentase daya hidup spermatozoa memiliki nilai rerata lebih tinggi dibandingkan persentase keutuhan membran spermatozoa.Hal ini sesuai dengan penelitian Nur et al. (2005) yang menyatakan bahwa tidak terdapat korelasi antara daya hidup spermatozoa dan keutuhan membran spermatozoa.Meskipun persentase daya hidup spermatozoa dan keutuhan membran antar perlakuan tidak menunjukkan perbedaan secara nyata, namun secara kuantitatif perlakuan etanol memperlihatkan rata-rata persentase spermatozoa yang masih hidup dan memiliki membran utuh yang cenderung lebih banyak dibandingkan kontrol meskipun tidak signifikan. Hal ini terjadi kemungkinan akibat tingginya antioksidan yang terkandung dalam ekstrak etanol daun katuk, yaitu vitamin C dan vitamin E.Vitamin C dapat bereaksi dengan radikal superoksida, peroksida, dan hidroksil dengan mentransfer atom H atau oksigen (Hariyatmi 2004).Antioksidan ini dapat ditemukan dalam plasma darah (Fraga et al. 1991).Konsentrasi vitamin C yang tinggi dalam plasma darah diduga dapat meningkatkan konsentrasi vitamin C dalam plasma epididimis melalui sel epitel testis.Hal ini menyebabkan lingkungan
Tabel 3 Persentase daya hidup spermatozoa setelah pemberian ekstrak etanol daun katuk
Perlakuan Waktu Penyimpanan
Hari ke-0 (%) Hari ke-1 (%) Hari ke-2 (%) Hari ke-3 (%) Hari ke-4 (%)
Kontrol 91.0 ± 5.9 79.9 ± 16.9 75.9 ± 6.1 61.5 ± 11.0 63.3 ± 20.3
EtOH 85.3 ± 2.7 76.5 ± 10.7 77.8 ± 4.4 72.6 ± 5.1 70.6 ± 5.8
Tabel 4 Persentase keutuhan membran spermatozoa setelah pemberian ekstrak etanol daun katuk
Perlakuan Waktu Penyimpanan
Hari ke-0 (%) Hari ke-1 (%) Hari ke-2 (%) Hari ke-3 (%) Hari ke-4 (%)
Kontrol 45.3 ± 20.1 30.1 ± 8.8 47.3 ± 23.7 38.2 ± 17.8 17.0 ± 5.4
14
epididimis menjadi lebih baik dalam mempertahankan spermatozoa.Vitamin E merupakan antioksidan yang berfungsi memutus rantai ikatan sehingga dapat menghambat peroksidasi hidrogen dan peroksidasi lipid. Vitamin E terdapat di dalam membran sel dan melindungi membran dari kerusakan (Agarwal et al. 2007). Antioksidan ini diduga turut serta dalam menyusun struktur membran sel selama proses pembentukan spermatozoa sehingga membran sel menjadi lebih kuat.
Persentase Cytoplasmic Droplet dan Abnormalitas Spermatozoa
Evaluasi terhadap morfologi spermatozoa dibutuhkan dalam menentukan kualitas spermatozoa yang baik.Nilai persentase dari cytoplasmic droplet dan abnormalitas spermatozoa dapat dilihat pada Tabel 5 dan Tabel 6.
Persentase cytoplasmic droplet dan abnormalitas lainnya tidak berbeda nyatapada perlakuan etanol dan kontrol.Meskipun hasil penelitian menunjukkan perlakuan yang tidak berbeda nyata, namun perlakuan etanol memperlihatkan persentase cytoplasmic droplet serta abnormalitas yang tidak jauh berbeda dibandingkan kontrol selama masa penyimpanan.Abnormalitas dan cytoplasmic droplet yang ditemukan pada penelitian ini kemungkinan disebabkan pengaruh senyawa androstan-17-one,3-ethyl-3-hydroxy-5 alpha, flavonoid, fitosterol, dan alkaloid (Papaverine Like Compound) yang terkandung dalam katuk. Senyawa-senyawa ini dapat menyebabkan terhambatnya sekresi FSH dan LH sehingga konsentrasi ABP dan hormon steroid menurun.ABP berfungsi dalam sintesis dan sekresi hormon testosteron ke dalam tubulus seminiferus epididimis. Testosteron yang disekresi akan diubah menjadi DHT (dyhidrotestosterone) yang berperan dalam pematangan dan transportasi spermatozoa di dalam epididimis (Hafez dan Hafez 2000). Konsentrasi ABP yang menurun akan menyebabkan terganggunya Tabel 6 Persentase abnormalitas spermatozoa setelah pemberian ekstrak etanol
daun katuk
Perlakuan Waktu Penyimpanan
Hari ke-0 (%) Hari ke-1 (%) Hari ke-2 (%) Hari ke-3 (%) Hari ke-4 (%)
Kontrol 49.0 ± 6.5 47.3 ± 7.5 45.0 ± 5.3 50.3 ± 3.3 49.8 ± 7.3
EtOH 38.4 ± 10.7 35.3 ± 13.6 41.3 ± 11.1 48.0 ± 6.3 53.8 ± 12.8
Tabel 5 Persentase cytoplasmic droplet spermatozoa setelah pemberian ekstrak etanol daun katuk
Perlakuan Waktu Penyimpanan
Hari ke-0 (%) Hari ke-1 (%) Hari ke-2 (%) Hari ke-3 (%) Hari ke-4 (%)
Kontrol 21.7 ± 13.2 24.8 ± 11.5 22.3 ± 16.0 24.4 ± 15.7 23.5 ± 16.1
15 pematangan spermatozoa sehingga banyak ditemukan cytoplasmic droplet pada saat pengamatan.
Tingginya persentase abnormalitas kemungkinan besar juga dipengaruhi oleh status reproduksi domba.Domba yang digunakan dalam penelitian adalah domba yang berusia tujuh bulan dan berada di awal masa pubertas sehingga masih banyak ditemukan spermatozoa yang belum matang. Domba jantan mengalami pubertas saat usia 6 bulan tetapi dapat tertunda hingga usia 9 sampai dengan 12 bulan (Pineda 2003).Hal ini sesuai dengan penelitian Soderquist et al. (1996) yang menyatakan bahwa abnormalitas spermatozoa (abnormalitas kepala dan akrosom, proximal cytoplasmic droplet, dan total abnormalitas) secara nyata dipengaruhi oleh umur.
Abnormalitas dibagi menjadi dua jenis, yaitu abnormalitas primer dan abnormalitas sekunder.Abnormalitas primer dapat terjadi karena kelainan pada tubuli seminiferi, gangguan testikuler akibat faktor keturunan, penyakit defisiensi makanan, dan pengaruh lingkungan yang jelek.Abnormalitas primer ditandai oleh kepala yang terlalu kecil (microchepalic) atau terlalu besar (macrochepalic), kepala lebar, kepala berganda, kepala yang berbentuk seperti buah pir (pyriformis), ekor berganda, dan pembesaran pada bagian tengah atau ekor (Toelihere 1993).
Abnormalitas sekunder terjadi setelah sel kelamin jantan meninggalkan epitel kecambah pada tubuli seminiferi, selama perjalanannya melalui saluran epididimis, vas deferens, atau uretra, selama ejakulasi, akibat pemanasan berlebihan, pendinginan yang terlalu cepat, kontaminasi dengan air, urin atau antiseptik, serta perlakuan saat pembuatan preparat ulas dan perwarnaan. Abnormalitas sekunder meliputi sperma yang ekornya terputus, kepala tanpa ekor, dan adanya butiran-butiran protoplasma proksimal atau distal serta akrosom yang terlepas (Toelihere 1993).Abnormalitas yang banyak teramati pada penelitian ini adalah abnormalitas sekunder.Hal ini kemungkinan disebabkan perlakuan saat pembuatan preparat ulas dan pewarnaan.Abnormalitas primer tidak banyak terlihat selama pengamatan.
Pembahasan Umum
Spermatozoa di dalam kauda epididimis telah mengalami proses pematangan sehingga dapat digunakan sebagai alternatif sumber spermatozoa dalam penerapan aplikasi teknologi reproduksi. Kauda epididimis mengandung 75% spermatozoa dari total spermatozoa dalam epididimis (Hafez dan Hafez 2000). Pengaruh perlakuan etanol tidak memperlihatkan perbedaan yang nyata terhadap parameter yang diamati dibandingkan dengan kontrol dalam pemeriksaan karakteristik spermatozoa kauda epididimis. Meskipun hasil penelitian menunjukkan pengaruh yang tidak nyata, namun secara kuantitatif perlakuan etanol memperlihatkan penurunan motilitas yang lebih cepat terjadi, persentase spermatozoa yang masih hidup dan masih memiliki membran utuh cenderung lebih banyak, dan persentase cytoplasmic droplet serta abnormalitas yang tidak jauh berbeda dibandingkan kontrol.
16
karakteristik spermatozoa. Meskipun hasil penelitian menunjukkan perlakuan yang tidak berbeda nyata, namun ekstrak etanol katuk diduga mempengaruhi fungsi reproduksi pada domba penelitian yaitu spermatogenesis melalui aksi hormonal. Usia domba yang masih muda dan sedang berada pada awal pubertas juga kemungkinan turut mempengaruhi hasil penelitian. Domba pada masa tumbuh memiliki kesensitifan tinggi terhadap umpan balik negatif dalam sistem hormonal. Hal ini terlihat pada nilai konsentrasi spermatozoa pada perlakuan etanol yang lebih rendah serta persentase motilitas yang lebih cepat menurun dibandingkan dengan kontrol.
Nilai persentase hidup spermatozoa cenderung masih tinggi pada perlakuan etanol dibandingkan kontrol pada hari ketiga hingga hari kelima meskipun persentase motilitas rendah selama masa penyimpanan. Keadaan ini tidak sesuai dengan teori bahwa keutuhan membran plasma berkorelasi dengan motilitas spermatozoa (Yu dan Leibo 2002). Apabila membran plasma spematozoa mengalami kerusakan, maka metabolisme spermatozoa akan terganggu sehingga spermatozoa akan kehilangan motilitasnya dan mengakibatkan kematian. Senyawa yang terdapat dalam ekstrak katuk diduga kuat mempengaruhi komposisi penyusun struktur membran sel sehingga membran sel spermatozoa menjadi lebih kuat.
Spermatozoa di kauda epididimis pada penelitian ini kurang layak digunakan untuk inseminasi buatan karena tidak memenuhi syarat untuk inseminasi di mana persentase motilitas minimal harus 40%, persentase keutuhan membran lebih dari 30% (Hafez dan Hafez 2000), dan abnormalitas kurang dari 20% (Toelihere 1993).Persentase hidup dan keutuhan membran spermatozoa pada perlakuan masih tinggi hingga hari kelima meskipun motilitasnya rendah. Spermatozoa yang masih memiliki membran plasma yang utuh mengindikasikan bahwa kromosom masih terjaga dengan baik sehingga masih dapat digunakan dalam aplikasi teknologi reproduksi lainnya, seperti ICSI (intracytoplasmic sperm injection) yaitu menyuntikkan spermatozoa yang masih hidup ke dalam vitellus oosit (Hafez dan Hafez 2000).
SIMPULAN DAN SARAN
Simpulan
17
Saran
Disarankan untuk dilakukan penelitian terhadap pengaruh ekstrak etanol katuk dengan menggunakan hewan jantan yang telah dewasa.Perlu juga dilakukan penelitian lebih lanjut terhadap karakteristik spermatozoa hasil ejakulat.
DAFTAR PUSTAKA
Agarwal A, Prabhakaran SA, Sikka SC. 2007. Clinical relevance of oxidative stress in patients with male factor infertility: Evidence-based analysis. AUA Update Ser.26: 1–12.
Agusta A, Harapini M, Chairul. 1997. Analisis kandungan kimia ekstrak daun katuk (Sauropus androgynus L. Merr) dengan CGMS. Warta Tumbuhan Obat 3 (3): 31-34.
Andarwulan N, Faradilla RH. 2012. Senyawa Fenolik pada Beberapa Sayuran Indigenous dari Indonesia. Bogor: SEAFAST Center.
Astuti S, Muchtadi D, Astawan M, Purwantara B, Wresdiyati T. 2009. Kualitas spermatozoa tikus yang diberi tepung kedelai kaya isoflavon, seng (Zn), dan vitamin E. Media Peternakan 32 (1): 12-21.
Bearden HJ, Fuquy JW, Willard ST. 2004. Applied Animal Reproduction.Ed ke-6. New Jersey: Pearson Prentice Hall.
[BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia. 2005. Pedoman Cara Pembuatan Obat Tradisional yang Baik. Jakarta: BPOM RI. [BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia. 2008.
Taksonomi Koleksi Tanaman Obat Kebun Tanaman Obat Citeureup. Jakarta: BPOM RI.
Cunningham JG, Klein BG. 2007. Textbook of Veterinary Physiology.Ed ke-4. Missouri: Saunders Elsevier.
[Depkes] Departemen Kesehatan. 1995. Farmakope Indonesia. Ed ke-4. Jakarta: Departemen Kesehatan Republik Indonesia.
[Depkes] Departemen Kesehatan. 2000. Parameter Standar Umum Ekstrak Tumbuhan Obat. Jakarta: Departemen Kesehatan Republik Indonesia.
Despopoulos A, Silbernagl S. 2003. Color Atlas of Physiology. Ed ke-5. New York: Thieme.
Fraga CG, Motchnik PA, Shigenaga MK, Helbock HJ, Jacob RA, Ames BN. 1991. Ascorbic acid protects against endogenous oxidative DNA damage in human sperm. Proceedings of the National Academy of Sciences of the United States of America 88: 11003–11006.
Gilman CL, Leusch FDL, Breckenridge WC, MacLatchy DL. 2003. Effects of a phytosterol mixture on male fish plasma lipoprotein fractions and testis P450scc activity. General and Comparative Endocrinology 130: 172-184. Hafez ESE, Hafez B [editor]. 2000. Reproduction in Farm Animal. Ed ke-7. USA:
Lippincort Williams&Wilkins.
18
Herdis, Toelihere MR, Supriatna I, Purwantara B, Adikara RTS. 2005. Optimalisasi kualitas semen cair domba garut (Ovis aries) melalui penambahan maltose ke dalam pengencer semen tris kuning telur. Media Kedokteran Hewan21 (2): 88-93. Mital P, Hinton BT, Dufour JM. 2011. The blood-testis and blood-epididymis
barriers are more than just their tight junctions. Biol Reprod Papers, in press. Nolan JP, Hammerstedt RH. 1997. Regulation of membrane stability and the
acrosome reaction in mammalian sperm. FASEB J 11:670-682.
Nur Z, Dogan I, Gunay U, Soylu MK. 2005. Relationships between sperm membrane integrity and other semen quality characteristics of the semen of saanen goat bucks. Bull Vet Int Pulawy 48: 183-187.
Pineda MH [editor]. 2003. McDonald’s Veterinary Endocrinology and Reproduction. Ed ke-5. Iowa State: Blackwell Publishing.
Rizal M, Herdis. 2005. Daya hidup spermatozoa epididimis domba garut yang dikriopreservasi menggunakan modifikasi pengencer tris. Hayati 12 (2): 61-66. Salamon S, Maxwell WMC. 2000. Storage of ram semen. Anim Reprod Sci 62:
77-111.
Sarker SD, Latif Z, Gray AI. 2006. Natural Products Isolation. Second Edition. New Jersey: Humana Press.
Sharma RK, Agarwal A. 1996. Role of reactive oxygen species in male infertility.Urology 48 (6): 835-850.
Sidauruk BD. 2008. Produksi air susu induk babi dengan penambahan ekstrak daun katuk (Sauropus androgynus (L.) Merr) dalam ransum pada taraf dan waktu pemberian yang berbeda [skripsi]. Bogor: Program Sarjana, Institut Pertanian Bogor.
Söderquist L, Janson L, Håård M, Einarsson S. 1996. Influence of season, age, breed and some other factors on the variation in sperm morphological abnormalities in Swedish dairy AI bulls. Anim Reprod Sci 44 (2): 91-98.
Subekti S, Sumarti SS, Murdiarti TB. 2008. Pengaruh daun katuk (Sauropus androgynous (L.) Merr) dalam ransum terhadap fungsi reproduksi pada puyuh.JITV 13 (3):167-173.
Suprayogi A. 2000. Studies on the biological effects of Sauropus androgynus (L.)Merr.: effect of milk production and the possibilities of induced pulmonary disorder in lactating sheep [disertasi]. Göttingen: Faculty of Agericultural Sciences, George-August-Universitat Göttingen.
Suprayogi A, Kusumorini N, Setiadi MA, Murti YB. 2009. Produksi fraksi ekstrak daun katuk sebagai bahan baku obat perbaikan gizi, fungsi reproduksi, dan laktasi. Laporan Akhir Penelitian Lembaga Penelitian dan Pengabdian kepada Masyarakat IPB.
Suprayogi A, Kusharto CM, Astuti DA. 2010. Produksi fraksi ekstrak daun katuk (Sauropus androgynus) sebagai bahan feed addictive dalam peningkatan kualitas kesehatan daging domba. Laporan Akhir Penelitian DIKTI.
Surachman M, Herdis, Setiadi MA, Rizal M. 2006.Krioreservasi spermatozoa epididimis domba menggunakan pengencer berbasis lesitin.J Indon Trop Anim Agric 31 (2): 83-89.
Susetyarini E, Corebima D, Susilawati T, Amin M. 2011. Motilitas spermatozoa tikus putih jantan (Ratus norwegicus) yang diberi senyawa aktif daun beluntas dengan berbagai dosis.Berk Penel Hayati Edisi Khusus 6D: 9-13.
19 Turner TT. 1991. Spermatozoa are exposed to a complex microenvironment as
they traverse the epididymis. Ann N Y Sci637: 364-83.
Varisli O, Uguz C, Agca C, Agca Y. 2008. Motility and acrosomal integrity comparisons between electro-ejaculated and epidiymal ram sperm after exposure to a range of anisosmotic solutions, cryoprotective agents and lower temperatures.Animal Reproduction Sciences 110: 256-268.
Voigt R. 1994. Buku Pelajaran Teknologi Farmasi. Edisi kelima. Yogyakarta: Gadjah Mada University Press.
Wang PH, Lee SS. 1997. Active chemical constituens from Sauropus androgynus.J Chin Chem Soc 44(2):145-149.
White Jr don, Berardinelli JG, Aune KE. 2005. Age variation in gross and histological characteristics of the testis and epididymis in grizzly bears. Ursus 16 (2): 190-197.
Wildeus S. 1993. Age-related changes in scrotal circumference, testis size and sperm reserve in bulls of the tropically adapted Senepol breed. Reprod Sci 32 (3): 185-195.
Winarno FG, Fardiaz D, Ansori R, Ketaren S. 1973. Kimia Organik 1. Bogor: Departeman Teknologi Hasil Pertanian IPB.
Wodzicka-Tomaszewska M, Putu GI, Chaniago TD. 2001. Reproduksi, Tingkah Laku, dan Produksi Ternak di Indonesia. Jakarta: Gramedia.
Yu I, Leibo SP. 2002.Recovery motile, membrane-intact spermatozoa from canine epididymides stored for 8 days at 4º C. Theriogenology 57 (3): 1179-1190. Zyood T Al, Shawakfa K. 2006.Phytosterols. Jordan: Jordan University of
20
Lampiran 1 Hasil General Linear Model konsentrasi spermatozoa
Tests of Between-Subjects Effects
Dependent Variable : Konsentrasi Source Perlakuan 3030540.833 1 3030540.833 .848 .365 Error 1.001E8 28 3574085.119
Total 1.185E9 30
Corrected Total 1.031E8 29
a. R Squared = .029 (Adjusted R Squared = -.005)
Lampiran 2 Hasil General Linear Model bobot epididimis
Tests of Between-Subjects Effects
Dependent Variable : Bobot epididimis Source
Lampiran 3 Hasil General Linear Model persentase motilitas spermatozoa
Tests of Between-Subjects Effects
Dependent Variable : Motilitas Source
Corrected Total 21246.667 29
21 Lampiran 4 Hasil General Linear Model persentase daya hidup spermatozoa
Tests of Between-Subjects Effects
Dependent Variable :Daya hidup Source
Intercept 170740.334 1 170740.334 1.096E3 .000
Perlakuan 37.924 1 37.924 .243 .626
Error 4361.283 28 155.760 Total 175139.542 30
Corrected Total 4399.207 29
a. R Squared = .009 (Adjusted R Squared = -.027)
Lampiran 5 Hasil General Linear Model persentase keutuhan membran spermatozoa
Tests of Between-Subjects Effects
Dependent Variable : Keutuhan membran Source Corrected Total 11206.234 29
a. R Squared = .016 (Adjusted R Squared = -.019)
Lampiran 6 Hasil General Linear Model cytoplasmic droplet spermatozoa
Tests of Between-Subjects Effects
Dependent Variable :Cytoplasmic droplet Source
Corrected Total 3607.977 29
22
Lampiran 7 Hasil General Linear Model abnormalitas spermatozoa
Tests of Between-Subjects Effects
Dependent Variable : Abnormalitas Source
Type III Sum
of Squares Df Mean Square F Sig. Corrected
Model 176.758
a
1 176.758 2.094 .159
Intercept 62905.386 1 62905.386 745.204 .000 Perlakuan 176.758 1 176.758 2.094 .159 Error 2363.583 28 84.414
Total 65445.728 30 Corrected Total 2540.341 29
23
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 6 November 1989. Penulis merupakan anak keempat dari empat bersaudara, putri dari pasangan ayah Drs. Ec. Syafi’i Imam Saksono dan ibu Rr. Adiati.