PENGEMBANGAN UJI CEPAT VIGOR BENIH KEDELAI
(
Glycine max
L. Merr.) MENGGUNAKAN METODE
RESPIRASI DENGAN ALAT KOSMOTEKTOR
OKTI SYAH ISYANI PERMATASARI
A24070102
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
RINGKASAN
OKTI SYAH ISYANI PERMATASARI. Pengembangan Uji Cepat Vigor Benih Kedelai (Glycine max L. Merr.) Menggunakan Metode Respirasi dengan Alat Kosmotektor. (Dibimbing oleh M. RAHMAD SUHARTANTO).
Viabilitas benih adalah daya hidup benih atau kemampuan hidup benih. Viabilitas benih dibedakan menjadi dua parameter yaitu viabilitas potensial dan vigor benih. Viabilitas potensial adalah kemampuan benih untuk berkecambah dan tumbuh menjadi tanaman normal pada kondisi lingkungan yang optimum. Vigor benih adalah kemampuan benih untuk berkecambah dan tumbuh menjadi tanaman normal pada kondisi lingkungan yang suboptimum.
Pengujian vigor benih dibedakan menjadi dua, yaitu pengujian secara langsung dan pengujian secara tidak langsung. Pengujian secara langsung dilakukan dengan mengamati gejala pertumbuhan benih. Pengujian secara tidak langsung dilakukan dengan mengamati gejala metabolisme dalam benih. Salah satu pengujian benih secara tidak langsung dilakukan dengan mengamati proses respirasi benih. Penelitian ini dilakukan untuk mempelajari pengujian vigor benih kedelai (Glycine max L. Merr.) dengan metode respirasi, khususnya dengan alat kosmotektor. Tujuan dari pelaksanaan penelitian ini yaitu mempelajari pemanfaatan kosmotektor sebagai alat untuk uji cepat vigor benih. Kosmotektor ini, pada umumnya digunakan untuk mengukur laju respirasi produk-produk hortikultura. Pada penelitian ini, kosmotektor akan digunakan untuk menguji vigor benih dengan mengukur laju respirasi benih. Penelitian ini dilaksanakan di Laboratorium Teknologi Benih dan Laboratorium Pasca Panen, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB pada bulan Februari sampai Mei 2011.
Penelitian ini menguji laju respirasi lot benih dengan berbagai kondisi vigor yang berbeda. Sebelum diukur laju respirasinya, lot benih tersebut diberi perlakuan awal agar respirasinya meningkat karena alat yang digunakan kurang sensitif dalam mengukur laju respirasi benih yang relatif rendah. Perlakuan awal
menit, 5) Inkubasi pada suhu 60 C selama 30 menit, dan 6) Inkubasi pada suhu 600C selama 45 menit. Lot benih yang akan diukur laju respirasinya terdiri dari lima kondisi vigor yang berbeda, yaitu V1, V2, V3, V4, dan V5. V1 diperoleh dengan penyimpanan di ruang ber-AC. V2 diperoleh dengan penyimpanan di ruang suhu kamar. V3, V4, dan V5 berturut-turut diperoleh dengan penderaan pengusangan cepat terkontrol selama 8 jam, 12 jam, dan 16 jam. Benih kedelai yang digunakan dalam penelitian ini adalah varietas Wilis yang berasal dari BPTP Banten. Selain mengukur laju respirasi, pengamatan viabilitas dan vigor benih juga dilakukan untuk dianalisis regresi dan korelasinya dengan laju respirasi benih. Parameter viabilitas potensial dan vigor yang diamati terdiri dari tolok ukur daya berkecambah (DB), tolok ukur potensi tumbuh maksimum (PTM), tolok ukur indeks vigor (IV), tolok ukur keserempakan tumbuh (Kst), tolok ukur kecepatan tumbuh (Kct), dan tolok ukur Bobot Kering Kecambah Normal (BKKN).
Hasil percobaan menunjukkan bahwa saat pembentukan lima tingkat vigor benih, terjadi penurunan secara linier pada parameter viabilitas potensial (tolok
ukur daya berkecambah dan potensi tumbuh maksimum), kecuali tolok ukur bobot kering kecambah normal. Seluruh parameter vigor (tolok ukur indeks vigor, tolok ukur keserempakan tumbuh, dan tolok ukur kecepatan tumbuh) tidak mengalami
The Developing of Rapid Testing Soybean Seed (Glycine max L. MERR.)
Vigor Using Respiration Method with Cosmotector Tools
Abstract
The research was conducted to learn the utilization of tools cosmotector as a tool for rapid testing of soybean (Glycine max L. MERR.) seed vigor. This tool is used to measure the levels of CO2 produced from respiration processes of soybean seeds and then calculated the rate respiration. This research was conducted from February to May 2011 at the Laboratory of Seed Technology and Post Harvest Laboratory, Department of Agronomy and Horticulture, Faculty of Agriculture, IPB. Prior research done by finding the pretreatment so we get the five groups of seeds that have different vigor of a seed same vigor group. Then measured the rate of respiration by several pretreatments, there are moistened for 10 hours, 15 hours, and 20 hours, and incubation at temperatures 600C for 15 minutes, 30 minutes, and 45 minutes. The conclusion of this research is cosmotector tool can be used for rapid testing of soybean seed vigor by measuring the rate respiration. The best pretreatment for measuring respiration rate of soybean seeds with such a device is incubation at temperatures 600C for 45 minutes. This method can determine seed viability and vigor well.
PENGEMBANGAN UJI CEPAT VIGOR BENIH KEDELAI
(
Glycine max
L. Merr.) MENGGUNAKAN METODE
RESPIRASI DENGAN ALAT KOSMOTEKTOR
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
Okti Syah Isyani Permatasari
A24070102
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
Judul :
PENGEMBANGAN UJI CEPAT VIGOR BENIH
KEDELAI (
Glycine max
L. Merr.)
MENGGUNAKAN METODE RESPIRASI DENGAN
ALAT KOSMOTEKTOR
Nama :
OKTI SYAH ISYANI PERMATASARI
NIM :
A24070102
Menyetujui, Dosen Pembimbing
Dr. Ir. M. Rahmad Suhartanto, MSi NIP 19630923 198811 1 001
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, MSc. Agr. NIP 19611101 198703 1 003
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 01 Oktober 1989 di Semarang, Provinsi Jawa Tengah. Penulis merupakan anak pertama dari pasangan Bapak Sjahbuddin Ezzat dan Ibu Sri Dwiana Rusmiwahjani.
Tahun 2001 penulis lulus dari SD Negeri Tirtoyoso No 111 Surakarta. Selanjutnya penulis menyelesaikan studi di SMP Negeri 1 Surakarta pada tahun 2004 dan di SMA Negeri 1 Semarang pada tahun 2007.
Tahun 2007 penulis diterima di IPB melalui jalur USMI. Penulis diterima sebagai mahasiswa Departemen Agronomi dan Hortikultura, Fakultas Pertanian pada tahun 2008. Selama menjalani perkuliahan, penulis mendapat beberapa beasiswa yaitu beasiswa ORBIT pada tahun 2007 hingga 2008, dan beasiswa BBM pada tahun 2009 hingga 2011. Pada kegiatan akademik di kampus, penulis
pernah menjadi asisten praktikum di beberapa mata kuliah, yaitu asisten Mata Kuliah Dasar-Dasar Teknologi Benih, asisten Mata Kuliah Ilmu Tanaman
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang selalu mencurahkan nikmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penulisan skripsi dengan judul ”Pengembangan Uji Cepat Vigor Benih Kedelai
(Glycine max L. Merr.) Menggunakan Metode Respirasi dengan Alat
Kosmotektor”.
Skripsi ini merupakan tugas akhir yang menjadi syarat untuk menyelesaikan program pendidikan S1 Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Pada kesempatan ini penulis menyampaikan terima kasih kepada:
1. Dr. Ir. M. Rahmad Suhartanto, MSi sebagai dosen pembimbing skripsi yang telah banyak memberikan bimbingan serta saran selama pelaksanaan
penelitian dan penulisan skripsi ini.
2. Dr. Ir. Eny Widajati, MS selaku dosen penguji utama yang telah banyak
memberikan saran dan masukkan dalam penyusunan skripsi.
3. Dr. Ir. Yudiwanti Wahyu E. K., MS selaku dosen pembimbing akademik dan dosen penguji yang telah bersedia memberikan saran dan masukan selama penyusunan skripsi.
4. Kedua orang tua dan adik-adik penulis yang selama ini telah banyak memberi dukungan moril dan motivasinya.
5. M. Anggoro W., Evie R., Miftahul Bahrir R., Ita Utami A., dan Istirsyadah H. yang telah memberikan bantuan dan dukungannya.
6. Melly Nurfarida, Nazima, Feni Sintarika, Cutrisni, Rizky, Neneng Siti L. dan semua teman seperjuangan di Laboratorium benih dan seluruh teman-teman AGH 44 yang telah memberikan bantuan dan dukungannya.
7. Teman-teman Arsida 2 yang telah memberi dukungannya.
Penulis mengharapkan semoga hasil penelitian ini dapat memberikan manfaat bagi yang memerlukannya.
Bogor, Agustus 2011
DAFTAR ISI
Halaman
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
Hipothesis ... 3
TINJAUAN PUSTAKA ... 4
Botani Kedelai ... 4
Viabilitas dan Vigor Benih ... 5
Respirasi Benih ... 7
Kosmotektor ... 8
BAHAN DAN METODE ... 10
Waktu dan Tempat Penelitian ... 10
Bahan dan Alat ... 10
Metode Penelitian ... 11
Pelaksanaan Penelitian ... 12
Pengamatan ... 17
HASIL DAN PEMBAHASAN ... 20
Pembuatan Lot Benih ... 20
Laju Respirasi Benih ... 21
Hubungan antara Laju Respirasi dengan Parameter Viabilitas Potensial dan Vigor Benih ... 22
Pemilihan Perlakuan Awal untuk Pengukuran Respirasi ... 29
KESIMPULAN DAN SARAN ... 31
Kesimpulan ... 31
Saran ... 31
DAFTAR PUSTAKA ... 32
DAFTAR TABEL
Nomor Halaman
1. Rata-rata Nilai Viabilitas dan Vigor 5 Lot Benih ... 20 2. Rata-rata Laju Respirasi 5 Lot Benih pada Berbagai
Perlakuan Awal ... 21 3. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju
Respirasi dengan Tolok Ukur Daya Berkecambah 5 Lot
Benih ... 23 4. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju
Respirasi dengan Tolok Ukur Potensi Tumbuh Maksimum 5
Lot Benih ... 24 5. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju
Respirasi dengan Tolok Ukur Indeks Vigor 5 Lot Benih ... 25
6. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju Respirasi dengan Tolok Ukur Keserempakan Tumbuh 5 Lot
Benih ... 26 7. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju
Respirasi dengan Tolok Ukur Kecepatan Tumbuh 5 Lot
Benih ... 26 8. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju
Respirasi dengan Tolok Ukur Bobot Kering Kecambah
Normal 3 Lot Benih ... 27 9. Nilai Tengah dan Standar Deviasi Laju Respirasi 5 Lot Benih
DAFTAR LAMPIRAN
Nomor Halaman
1. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 10 jam dengan Daya Berkecambah 5 Lot Benih ... 36 2. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 15 jam dengan Daya Berkecambah 5 Lot Benih ... 36 3. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 20 jam dengan Daya Berkecambah 5 Lot Benih ... 37 4. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 15 menit dengan Daya
Berkecambah 5 Lot Benih ... 37 5. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 30 menit dengan Daya
Berkecambah 5 Lot Benih ... 38 6. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 45 menit dengan Daya
Berkecambah 5 Lot Benih ... 38
7. Garis Regresi antara Laju Respirasi Perlakuan Awal Pelembaban 10 jam dengan Potensi Tumbuh Maksimum 5
Lot Benih ... 39 8. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 15 jam dengan Potensi Tumbuh Maksimum 5
Lot Benih ... 39 9. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 20 jam dengan Potensi Tumbuh Maksimum 5
Lot Benih ... 40 10. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 15 menit dengan Potensi
Tumbuh Maksimum 5 Lot Benih... 40 11. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 30 menit dengan Potensi
Tumbuh Maksimum 5 Lot Benih... 41 12. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 45 menit dengan Potensi
Tumbuh Maksimum 5 Lot Benih... 41 13. Garis Regresi antara Laju Respirasi Perlakuan Awal
viii
Halaman
14. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 15 jam dengan Indeks Vigor 5 Lot Benih ... 42 15. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 20 jam dengan Indeks Vigor 5 Lot Benih ... 43 16. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 15 menit dengan Indeks
Vigor 5 Lot Benih ... 43 17. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 30 menit dengan Indeks
Vigor 5 Lot Benih ... 44 18. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 45 menit dengan Indeks
Vigor 5 Lot Benih ... 44 19. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 10 jam dengan Keserempakan Tumbuh 5 Lot
Benih ... 45 20. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 15 jam dengan Keserempakan Tumbuh 5 Lot
Benih ... 45 21. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 20 jam dengan Keserempakan Tumbuh 5 Lot
Benih ... 46 22. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 15 menit dengan
Keserempakan Tumbuh 5 Lot Benih ... 46 23. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 30 menit dengan
Keserempakan Tumbuh 5 Lot Benih ... 47 24. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 45 menit dengan
Keserempakan Tumbuh 5 Lot Benih ... 47 25. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 10 jam dengan Kecepatan Tumbuh 5 Lot Benih ... 48 26. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 15 jam dengan Kecepatan Tumbuh 5 Lot Benih ... 48 27. Garis Regresi antara Laju Respirasi Perlakuan Awal
Halaman
28. Garis Regresi antara Laju Respirasi Perlakuan Awal Inkubasi pada suhu 600C selama 15 menit dengan Kecepatan
Tumbuh 5 Lot Benih ... 49 29. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 30 menit dengan Kecepatan
Tumbuh 5 Lot Benih ... 50 30. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 45 menit dengan Kecepatan
Tumbuh 5 Lot Benih ... 50 31. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 10 jam dengan Bobot Kering Kecambah
Normal 5 Lot Benih ... 51 32. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 15 jam dengan Bobot Kering Kecambah
Normal 5 Lot Benih ...51 33. Garis Regresi antara Laju Respirasi Perlakuan Awal
Pelembaban 20 jam dengan Bobot Kering Kecambah
Normal 5 Lot Benih ... 52
34. Garis Regresi antara Laju Respirasi Perlakuan Awal Inkubasi pada suhu 600C selama 15 menit dengan Bobot
Kering Kecambah Normal 5 Lot Benih ... 52 35. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 30 menit dengan Bobot
Kering Kecambah Normal 5 Lot Benih ... 53 36. Garis Regresi antara Laju Respirasi Perlakuan Awal
Inkubasi pada suhu 600C selama 45 menit dengan Bobot
DAFTAR GAMBAR
Nomor Halaman
1. Alat Pengukur Laju Respirasi (Kosmotektor tipe XP-314) ... 10
2. Pemaparan Benih di Ruang Suhu Kamar untuk Penyamaan Kadar Air ... 13
3. Pelembaban Benih dengan Kertas Steinsiel Basah ... 14
4. Pengukuran Respirasi Benih ... 14
PENDAHULUAN
Latar Belakang
Kedelai (Glycine max L. Merr) adalah tanaman yang penting bagi Indonesia karena digunakan baik sebagai pangan maupun sebagai komponen pakan ternak. Kedelai merupakan bahan baku industri tahu, tempe dan kecap yang merupakan pangan tradisional yang tidak terpisahkan dari kehidupan bangsa Indonesia. Kandungan protein yang tinggi dalam kedelai, dimanfaatkan masyarakat Indonesia sebagai sumber protein nabati yang utama. Kandungan protein di dalam kedelai dapat mencapai 35-45% (Suriawinata et al., 1984). Selain mempunyai nilai gizi yang tinggi karena mengandung protein, kedelai juga mengandung lemak, karbohidrat, dan lain-lainya. Sampai saat ini, upaya peningkatan produksi kedelai di Indonesia belum mampu memenuhi kebutuhan industri pangan tersebut. Konsumsi kedelai masyarakat saat ini mencapai 2 juta ton per tahunnya, tetapi rata-rata produksi kedelai dalam negeri tahun 2010 hanya
mencapai 908 111 ton, sehingga dibutuhkan impor kedelai sebesar 1.1 juta ton (BPS, 2010).
Salah satu faktor yang membatasi produksi kedelai di Indonesia adalah ketersediaan benih bermutu. Kemunduran benih yang cepat selama penyimpanan mengurangi penyediaan benih bermutu tinggi. Benih kedelai memerlukan penanganan khusus karena sifatnya yang sangat peka terhadap suhu dan RH. Hal ini disebabkan karena kadar proteinnya yang tinggi. Benih kedelai tidak dapat mempertahankan viabilitasnya dalam kurun waktu tiga bulan, pada suhu 30oC dan kadar air benih 14% (Sadjad, 1980).
2
pertumbuhan dan perkembangan tanaman, meningkatnya kepekaan terhadap lingkungan yang ekstrim yang akhirnya dapat menurunkan produksi tanaman.
Justice dan Bass (2002) menyatakan bahwa metode uji vigor benih yang dikenal terbaik dan banyak digunakan adalah metode uji dingin (cold test) yang dikembangkan untuk pengujian benih jagung, dan tentunya juga dapat digunakan untuk benih beberapa spesies tanaman lainnya. Salah satu masalah pada pengujian tersebut adalah kesulitan untuk menstandarisasi cendawan dan tanahnya yang digunakan untuk membuat pengujian tersebut. Pengujian vigor lainnya yang digunakan untuk penelitian meliputi uji GADA (Glutamic Acid Decarboxylase Activity), berbagai macam uji tekanan, uji laju pertumbuhan kecambah, serta uji tetrazolium.
Menurut Taliroso (2008) pengujian vigor untuk kedelai yang sudah diterima sebagai metode resmi dalam peraturan ISTA (International Seed Testing Association) adalah pengujian viabilitas setelah didera fisik (Accelerated Ageing Test) dan pengujian viabilitas secara biokhemis (uji tetrazolium/TZ). Namun, dalam pelaksanaannya pengujian-pengujian tersebut memiliki beberapa kelemahan. Pada pengujian vigor setelah Accelerated Ageing, waktu yang diperlukan melebihi uji DB, yaitu 11 hari. Kelemahan pada uji tetrazolium adalah sangat tergantung dari analis yang terlatih dan berpengalaman dalam menganalisis hasil pengujian. Menurut Copeland dan McDonald (1995), kendala dalam
evaluasi vigor pada uji TZ adalah standardisasi kemampuan analis untuk menentukan tingkat vigor benih dan ketidakmampuan pengujian TZ untuk mendeteksi fitotoksik.
Pengujian vigor benih juga dapat dilakukan dengan menggunakan metode respirasi. Daya hidup benih dapat dideteksi dari banyaknya CO2 yang terbentuk atau O2 yang diserap melalui proses respirasi. Pengukuran respirasi dapat dilakukan dengan banyak cara. Menurut Winarno dan Amman (1979) beberapa cara yang telah diteliti untuk mengukur proses respirasi yaitu dengan mengukur perubahan kandungan gula, jumlah ATP, jumlah O2 yang digunakan dan jumlah CO2 yang dihasilkan.
Pengukuran jumlah ATP yang terbentuk dibutuhkan waktu yang lama, ketelitian yang tinggi dan alat-alat yang mahal. Jumlah O2 yang digunakan dalam proses
respirasi relatif sangat sedikit, dan dalam pengukurannya sukar dilaksanakan karena dibutuhkan alat yang mempunyai kepekaan tinggi terhadap oksigen. Pengukuran CO2 lebih mudah dilakukan karena menggunakan alat-alat yang sederhana dan jumlah CO2 selama proses respirasi relatif cukup besar, selain itu dibutuhkan waktu yang relatif singkat.
Kosmotektor merupakan alat yang digunakan untuk mengukur besarnya respirasi dengan mendeteksi CO2 yang dihasilkan. Alat ini sering digunakan untuk mengukur respirasi produk-produk hortikultura berupa sayuran dan buah. Sayuran dan buah-buahan yang diukur respirasinya, umumnya memiliki kadar air yang tinggi sehingga dengan mudah dapat diukur dengan alat ini. Pada penelitian ini, kosmotektor akan diteliti untuk mengukur respirasi benih, yang dapat dimanfaatkan untuk uji vigor. Namun, respirasi yang dihasilkan benih terlalu kecil sehingga kosmotektor tidak dapat mengukur respirasinya. Untuk itu, benih perlu diberi perlakuan awal untuk meningkatkan respirasinya.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari pemanfaatan alat kosmotektor untuk uji cepat vigor benih dengan mengukur respirasi benih secara tidak
langsung mendeteksi vigor benih secara cepat.
Hipotesis
1. Alat kosmotektor dapat digunakan untuk mengukur respirasi benih.
2. Alat kosmotektor dapat digunakan untuk uji cepat vigor benih dengan melihat hubungan antara laju respirasi dan peubah fisiologi benih.
TINJAUAN PUSTAKA
Botani Kedelai
Kedelai termasuk tanaman kacang-kacangan dengan klasifikasi lengkap tanaman kedelai adalah sebagai berikut, divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledonae, ordo Rasales, famili Leguminosae, genus Glycine, spesies Glycine max (L.) Merril. Sistem perakaran kedelai terdiri atas dua macam, yaitu akar tunggang dan akar sekunder (serabut) yang tumbuh dari akar tunggang. Selain itu kedelai juga seringkali membentuk akar adventif yang tumbuh dari bagian bawah hipokotil. Pada umumnya, akar adventif terjadi karena cekaman tertentu, misalnya kadar air tanah yang terlalu tinggi (Adisarwanto, 2007).
Biji kedelai berkeping dua yang terbungkus oleh kulit biji. Embrio terletak di antara keping biji. Warna kulit biji bermacam-macam, antara lain kuning, hitam, hijau, dan cokelat. Bentuk biji kedelai umumnya bulat lonjong, bundar atau
bulat agak pipih. Besar biji bervariasi, tergantung varietas. Di Indonesia besar biji bervariasi 6-30 g (Suprapto, 2001).
Adisarwanto (2007) menyatakan bahwa batang berasal dari poros embrio. Selama perkecambahan, hipokotil merupakan bagian batang kedelai, dengan batas mulai dari pangkal akar hingga kotiledon. Plumula dan dua kotiledon yang masih melekat pada hipokotil akan menembus permukaan tanah.
Viabilitas dan Vigor Benih
Kualitas benih dapat dilihat dari viabilitas dan vigor benih tersebut. Sadjad (1975) menyatakan bahwa pengujian viabilitas benih berada dalam konteks agronomi disamping sebagai parameter untuk berbagai pendekatan ilmiah, juga dalam rangka menentukan sehat tidaknya benih. Benih harus memiliki tingkat daya berkecambah tertentu, yang ditetapkan oleh suatu peraturan pemerintah di daerah itu, agar dapat diklasifikasikan sebagai benih. Sebagian besar ahli teknologi benih dan kalangan perdagangan mengartikan viabilitas sebagai kemampuan benih untuk berkecambah dan menghasilkan kecambah secara normal (Copeland dan Mc Donald, 1995). Sadjad (1972) menyatakan bahwa viabilitas benih adalah gejala hidup benih yang dapat ditunjukkan melalui metabolisme benih dengan gejala pertumbuhan.
Menurut Sadjad (1993), tujuan analisis viabilitas benih adalah untuk memperoleh informasi mutu fisiologi benih. Gejala yang dimaksud adalah potensi tumbuh dan daya berkecambah. Mugnisjah et al. (1994) menyatakan bahwa metode pengujian viabilitas benih terdiri dari dua cara, yaitu metode langsung dan
metode tidak langsung. Penilaian pada metode langsung dilakukan terhadap setiap individu benih, sedangkan pada metode tidak langsung penilaian dilakukan terhadap sekelompok benih. Penilaian viabilitas dari gejala pertumbuhannnya
disebut sebagai penilaian dengan indikasi langsung, sedangkan penilaian viabilitas dari gejala metabolismenya disebut dengan penilaian viabilitas dengan indikasi tidak langsung. Oleh karena itu, uji viabilitas benih dapat dilakukan secara tidak langsung, misalnya dengan mengukur gejala metabolisme atau secara langsung dengan mengamati dan membandingkan pertumbuhan unsur-unsur tumbuh yang penting dari benih dalam suatu periode tumbuh tertentu (Sadjad, 1973).
6
Ciri utama dari benih ialah bila benih itu dapat dibedakan dari biji karena mempunyai daya hidup yang disebut viabilitas. Semua insan benih, apapun fungsi yang disandangnya, senantiasa mendambakan benih vigor, tidak sekedar benih hidup (viable) sebab benih yang viabilitasnya tinggi belum tentu memiliki vigor yang tinggi. Benih yang hanya mempunyai potensi hidup normal pun tidak cukup (Sadjad et al., 1999).
Vigor benih sewaktu disimpan merupakan faktor penting yang mempengaruhi umur simpannya. Vigor dan viabilitas benih tidak selalu dapat dibedakan, terutama pada lot-lot yang mengalami kemunduran cepat. Terlepas dari masalah tersebut, beberapa peneliti menunjukkan bahwa lot-lot benih yang mengalami kemunduran cepat, mengandung benih yang bervigor rendah dan benih yang masih vigor. Proses kemunduran benih berlangsung terus dengan semakin lamanya benih disimpan sampai akhirnya semua benih mati. Lot benih yang baru dan vigor mempunyai daya simpan yang lebih lama dibanding dengan lot benih yang lebih tua yang mungkin sedang mengalami proses kemunduran sangat cepat (Justice dan Bass, 2002).
Benih yang ditanam memberikan dua kemungkinan hasil. Pertama, benih tersebut menghasilkan tanaman normal sekiranya kondisi alam tempat tumbuhnya optimum. Kedua, tanaman yang tumbuh abnormal atau mati. Benih mempunyai
daya hidup potensial atau Viabilitas Potensial (Vp), karena hanya akan tumbuh menjadi tanaman normal manakala kondisi alamnya optimum. Benih yang masih mampu menumbuhkan tanaman normal, meski kondisi alam tidak optimum atau suboptimum disebut benih yang memiliki Vigor (Vg). Benih yang vigor akan menghasilkan produk di atas normal kalau ditumbuhkan pada kondisi optimum (Sadjad et al., 1999).
Respirasi Benih
Menurut Winarno dan Amman (1979) respirasi atau pernafasan adalah suatu proses metabolisme dengan cara menggunakan oksigen dalam pembakaran senyawa makromolekul seperti karbohidrat, protein dan lemak yang akan menghasilkan CO2, air, dan sejumlah besar elektron-elektron. Menurut Kamil (1979) respirasi merupakan proses perombakan sebagian cadangan makanan (seperti karbohidrat) menjadi senyawa yang lebih sederhana lagi seperti CO2 dan H2O serta dibebaskan sejumlah tenaga yang disimpan dalam makanan.
Sadjad (1975) menyatakan bahwa respirasi dalam kaitannya dengan perkecambahan benih, respirasi merupakan proses yang menghasilkan energi, sehingga proses perkecambahan tergantung pada respirasi benih itu sendiri. Agrawal (1980) menyatakan bahwa repirasi, terutama saat awal proses imbibisi air ke dalam benih telah menunjukkan keeratan korelasi dengan tingkat pertumbuhan benih buncis, jagung, gandum, kedelai, dan padi.
Faktor yang mempengaruhi respirasi menurut Curtis dan Clark (1950) diantaranya dalah temperatur, kadar air, oksigen, dan karbon dioksida. Menurut
Masyagina et al. (2009) laju respirasi benih pinus gmelin dan siberian meningkat seiring dengan meningkatnya suhu lingkungan selama proses perkecambahan. Tatipata et al. (2004) menyatakan bahwa menurunnya daya berkecambah benih
kedelai yang disimpan berhubungan dengan tingginya kadar air menyebabkan struktur membran mitokondria tidak teratur sehingga permeabilitas membran meningkat. Peningkatan permeabilitas menyebabkan banyak metabolit antara lain gula, asam amino dan lemak yang bocor keluar sel, sehingga substrat untuk respirasi berkurang sehingga energi yang dihasilkan untuk berkecambah berkurang. Oleh karena itu benih yang sudah mengalami kemunduran, laju respirasi akan semakin bekurang.
8
dengan viabilitas total dengan tolok ukur tetrazolium dengan nilai koefisien korelasi yang sangat besar. Disamping itu, kapasitas respirasi juga berkorelasi positif dengan vigor daya simpan, dengan tolok ukur keserempakan tumbuh dan dengan vigor kekuatan tumbuh dengan tolok ukur kecepatan tumbuh. Oleh karena itu, respirasi benih dapat digunakan untuk mendeteksi viabilitas dan vigor benih.
Tatipata et al.(2004) menyatakan bahwa menurunnya aktivitas spesifik suksinat dehidrogenase dan sitokrom oksidase pada benih kedelai menyebabkan laju respirasi menurun, dengan demikian energi yang dihasilkan rendah. Rendahnya energi menyebabkan daya kecambah dan vigor rendah. Sebelumnya Throneberry dan Smith (1955) menyatakan bahwa terlambatnya perkecambahan berkaitan dengan menurunnya aktivitas mitokondria. Aktivitas spesifik suksinat dehidrogenase dan sitokrom oksidase merupakan indikator aktivitas mitokondria.
Kosmotektor
Semua jenis benih masih mengalami proses metabolisme meskipun sudah dipanen dari tanaman induknya. Besarnya kadar metabolisme dari benih
tergantung dari kadar air yang terkandung di dalamnya dan kondisi lingkungan tempat penyimpanan benih. Salah satu proses metabolisme yang dilakukan adalah respirasi benih. Respirasi merupakan proses penguraian karbohidrat sehingga
dihasilkan energi, CO2 dan uap air. Salah satu alat pengukuran kadar respirasi yang dapat digunakan adalah kosmotektor. Alat ini sering digunakan untuk mengukur kadar CO2 yang dihasilkan dari proses respirasi produk-produk hortikultura seperti sayuran dan buah-buahan. Kadar CO2 yang diperoleh, kemudian dimasukkan ke dalam perhitungan untuk didapatkan laju respirasi yang didapatkan (New Cosmos Electric, 1999). Pengukuran respirasi yang dihasilkan dari produk-produk hortikultura digunakan untuk menentukan daya simpan produk. Menurut Purwoko et. al.(2002) daya simpan pada buah pisang dapat diperpanjang dengan menekan laju respirasi dan laju produksi etilena serta menunda terjadi puncak klimakterik buah pisang sehari setelah kontrol.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Februari sampai Mei 2011. Penelitian dilakukan di Laboratorium Teknologi Benih dan Laboratorium Pasca Panen, Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah benih kedelai varietas Wilis yang dipanen pada bulan Desember 2010 yang diperoleh dari BPTP Banten. Bahan-bahan lain yang digunakan yaitu plastik polyethilene, kertas steinsiel, kertas merang, kain strimin, plastik, solatif, plastik wrap, label, kertas amplop, dan air destilata.
Alat utama yang digunakan dalam penelitian ini adalah kosmotektor tipe XP-314 (Gambar 1). Alat-alat lainnya yaitu ruang ber-AC, ruang bersuhu kamar,
timbangan digital, pipet, refrigerator, waterbath, keranjang, toples inkubasi, oven pengering (105oC), oven pemanas (60oC), desikator, sealer, alat pengepres IPB 75-1, germinator IPB 72-1, bak plastik, cawan, dan termohigrometer.
Metode Penelitian
Penelitian ini dilakukan dengan menguji laju respirasi pada lima taraf lot benih dengan kondisi vigor yang berbeda-beda. Sebelum diukur laju respirasinya, masing-masing lot benih diberi perlakuan awal agar aktivitas laju respirasi benih meningkat. Perlakuan awal yang diberikan agar aktivitas respirasi benih dapat meningkat terdiri atas; 1) pelembaban selama 10 jam; 2) pelembaban selama 15 jam; 3) pelembaban selama 20 jam; 4) inkubasi pada suhu 600C selama 15 menit; 5) inkubasi pada suhu 600C selama 30 menit dan; 6) inkubasi pada suhu 600C selama 45 menit. Metode ini dipilih karena alat yang digunakan kurang sensitif dan benih dengan kadar air rendah, respirasi yang dihasilkan sedikit, sehingga diberi perlakuan agar laju respirasi benih meningkat dan dapat terdeteksi oleh alat kosmotektor. Lot benih yang digunakan ada 5 taraf yang terdiri atas lot benih vigor 1, lot benih vigor 2, lot benih vigor 3, lot benih vigor 4, dan lot benih vigor 5. Penelitian ini terdiri dari tiga ulangan, sehingga seluuruhnya terdapat 90 satuan percobaan.
Penelitian ini menggunakan analisis keragaman data tingkat vigor lot
benih dan analisis regresi linier sederhana. Analisis keragaman data tingkat vigor lot benih menggunakan rancangan percobaan RAL (Rancangan Acak Lengkap) dengan dengan satu faktor, yaitu tingkat vigor lot benih. Masing-masing tingkat
vigor lot benih diulang sebanyak tiga kali ulangan. Model percobaan yang digunakan adalah: Yij = µ + αi + εij (i = 1, 2, 3, 4, 5; j = 1, 2, 3) Keterangan:
Yij : Nilai pengamatan tingkat vigor lot benih ke-i pada ulangan ke-j µ : Nilai tengah umum
αi : Pengaruh taraf ke-i faktor tingkat vigor lot benih εij : Galat percobaan
Uji lanjut yang digunakan pada hasil yang berpengaruh nyata pada analisis ini menggunakan Duncans Multiple Range Test (DMRT) pada taraf nyata 5%.
12
viabilitas dan vigor benih. Persamaan regresi yang diperoleh dari analisis tersebut yaitu :
Y = a + bX dengan :
Y : peubah laju respirasi
a : titik potong garis dengan sumbu Y b : kemiringan garis
X : parameter vigor dan viabilitas (peubah bebas)
Hasil analisis regresi ini digunakan dua metode pendekatan. Pendekatan pertama analisis korelasi regresi antara laju respirasi dengan parameter viabilitas dan vigor benih. Parameter viabilitas dan vigor benih dinyatakan sebagai sumbu X dan laju respirasi dinyatakan sebagai sumbu Y. Nilai koefisien korelasi (r) digunakan untuk melihat keeratan hubungan antara peubah laju respirasi dengan peubah viabilitas dan vigor benih. Nilai koefisien korelasi yang mendekati 1 menggambarkan adanya keeratan hubungan atau korelasi antara laju respirasi benih dengan parameter viabilitas dan vigor benih yang sesungguhnya. Laju
respirasi benih dapat dideteksi berdasarkan viabilitas dan vigor benih melalui persamaan regresi apabila koefisien korelasi nyata.
Selain menggunakan analisis keragaman data tingkat vigor lot benih dan
analisis regresi, dilakukan pemilihan perlakuan awal untuk pengukuran laju respirasi yang terbaik dari nilai standar deviasinya. Nilai standar deviasi yang paling kecil menunjukkan data laju respirasi yang diperoleh lebih seragam. Perlakuan awal yang memiliki nilai standar deviasi kecil lebih baik daripada perlakuan awal dengan nilai standar deviasi besar.
Pelaksanaan Penelitian
Terkontrol (PCT) dengan waterbath selama 8 jam. Lot benih vigor 4 diperoleh dari Pengusangan Cepat Terkontrol (PCT) dengan waterbath selama 12 jam. Dan lot benih vigor 5 diperoleh dari Pengusangan Cepat Terkontrol (PCT) dengan waterbath selama 16 jam.
Kelima lot benih tersebut disamakan kadar airnya dengan cara pemaparan diruangan bersuhu kamar selama ±4 hari (Gambar 2). Setelah dipaparkan dari masing-masing lot benih dibagi menjadi tiga bagian, bagian pertama dianalisis viabilitas dan vigornya dengan cara mengecambahkannya menggunakan metode UKDdp (Uji Kertas Digulung Didirikan dalam Plastik). Benih yang dikecambahkan masing-masing gulungannya berisi 25 butir benih.
Gambar 2. Pemaparan Benih di Ruang Suhu Kamar untuk Penyamaan Kadar Air
14
Gambar 3. Pelembaban Benih dengan Kertas Steinsiel Basah
Bagian benih ketiga dilakukan pelembaban sebagai perlakuan awal dengan menggunakan kertas steinsiel basah (Gambar 2). Pelembaban dilakukan dengan
waktu 10 jam, 15 jam, dan 20 jam. Setelah dilembabkan benih dimasukkan ke dalam toples inkubasi dengan masng-masing toples berisi 40 gram benih yang telah dilembabkan, lalu direkatkan tutupnya. Proses inkubasi ini dilakukan di ruangan bersuhu kamar selama ±24 jam. Lalu diukur laju respirasinya (Gambar 4). Bagan alir pelaksanaan penelitian dapat dilihat pada Gambar 5.
Gambar 4. Pengukuran Respirasi Benih
Pelaksanaan Pengusangan Cepat Terkontrol (PCT)
W2 = 100 – A x W1 100 – B
Keterangan :
A = Kadar air benih awal dari benih (%) B = Kadar air benih yang diinginkan (%)
W1 = Berat awal benih yang telah diketahui (gram)
W2 = Berat benih dengan kadar air yang diinginkan (gram)
16
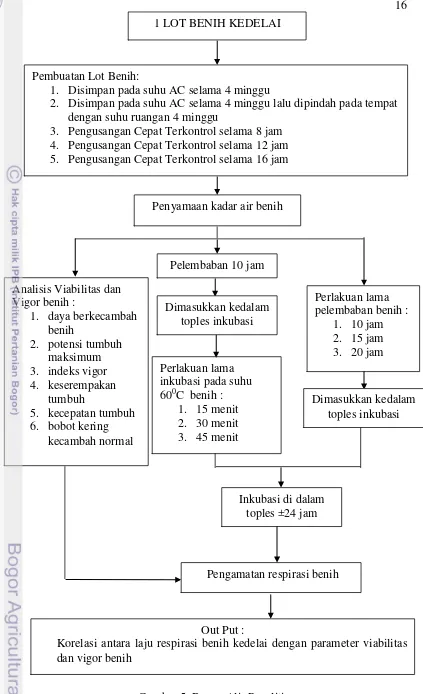
Gambar 5. Bagan Alir Penelitian
Pengamatan respirasi benih
Out Put :
Korelasi antara laju respirasi benih kedelai dengan parameter viabilitas dan vigor benih
Analisis Viabilitas dan Vigor benih :
1. daya berkecambah benih
2. potensi tumbuh maksimum 3. indeks vigor 4. keserempakan
tumbuh
5. kecepatan tumbuh 6. bobot kering
kecambah normal
Perlakuan lama inkubasi pada suhu 600C benih :
1. 15 menit 2. 30 menit 3. 45 menit
Perlakuan lama pelembaban benih :
1. 10 jam 2. 15 jam 3. 20 jam 1 LOT BENIH KEDELAI
Pembuatan Lot Benih:
1. Disimpan pada suhu AC selama 4 minggu
2. Disimpan pada suhu AC selama 4 minggu lalu dipindah pada tempat dengan suhu ruangan 4 minggu
3. Pengusangan Cepat Terkontrol selama 8 jam 4. Pengusangan Cepat Terkontrol selama 12 jam 5. Pengusangan Cepat Terkontrol selama 16 jam
Penyamaan kadar air benih
Pelembaban 10 jam
Dimasukkan kedalam toples inkubasi
Dimasukkan kedalam toples inkubasi
Pengamatan
Pengamatan dilakukan untuk menganalisis mutu benih meliputi analisis berbagai parameter viabilitas dan vigor yang meliputi penetapan kadar air, daya berkecambah, potensi tumbuh maksimum, indeks vigor, kecepatan tumbuh, bobot kering kecambah normal, keserempakan tumbuh, dan laju respirasi.
1. Daya Berkecambah (DB)
Daya berkecambah adalah kemampuan benih untuk tumbuh menjadi kecambah normal dalam lingkungan tumbuh yang optimum. Menurut ISTA dalam Dina et al. (2006) yang dimaksud dengan daya berkecambah dalam pengujian laboratorium adalah muncul dan berkembangnya kecambah sampai suatu tahap dimana struktur esensialnya mengindikasikan dapat tidak berkembang lebih lanjut menjadi tanaman yang memuaskan pada kondisi tanah yang sesuai. Uji daya berkecambah dilakukan dengan metode UKDdp (Uji Kertas Didirikan dalam Plastik). Daya berkecambah dihitung berdasarkan jumlah kecambah normal pada
hari ke-3 dan ke-5.
DB (%) = Σ KN I + KN II × 100% Benih yang ditanam
Keterangan :
KN I : Kecambah Normal pada hitungan I KN II : Kecambah Normal pada hitungan II
2. Potensi Tumbuh Maksimum (PTM)
Potensi Tumbuh Maksimum adalah total benih hidup atau menunjukkan gejala hidup (Sadjad, 1994). Potensi Tumbuh Maksimum merupakan presentase pemunculan kecambah yang dihitung berdasarkan jumlah benih tumbuh terhadap jumlah benih yang ditanam.
18
3. Indeks Vigor (IV)
Presentase kecambah normal pada hitungan pertama pengujian daya berkecambah menunjukkan presentase benih yang cepat berkecambah dan hal ini menunjukkan indeks vigor. Nilai indeks vigor selalu lebih rendah dibandingkan nilai DB tetapi cenderung mendekati
field emergence (Copeland dan McDonald, 1995). Pada penelitian nilai indeks vigor benih kedelai didapat pada hari ke-3 pengamatan daya berkecambah.
4. Keserempakan Tumbuh (KST)
Prosedur pengecambahan untuk pengamatan ini sama seperti pada pengamatan potensi tumbuh maksimum dan daya berkecambah. Pengamatan dilakukan pada hari ke-4 setelah tanam. Nilai keserempakan tumbuh benih dinyatakan sebagai persen kecambah normal kuat.
5. Kecepatan Tumbuh (KCT)
Benih yang lebih cepat tumbuh menunjukkan benih tersebut memiliki vigor yang lebih tinggi. Pengujian kecepatan tumbuh (Kct) dilakukan dengan mengambil dan menghitung kecambah normal setiap
etmal (24 jam) mulai dari hari pertama penanaman hingga hari ke-5. Nilai Kct menunjukkan presentase rata-rata kecambah yang tumbuh setiap hari. Semakin tinggi nilai Kct semakin tinggi pula vigor lot benih tersebut. Kecepatan tumbuh dihitung dengan rumus :
KCT = Σ N/t Keterangan :
N = % KN setiap waktu pengamatan T = waktu pengamatan
6. Bobot Kering Kecambah Normal (BKKN)
ditimbang. Pengujian ini dilakukan di akhir pengamatan ketika pengamatan daya berkecambah telah selesai.
7. Respirasi Benih
Respirasi benih dihitung dengan menggunakan alat yang bernama kosmotektor. Benih yang akan diukur laju respirasinya ditimbang dahulu bobotnya. Kemudian dimasukkan ke dalam toples inkubasi lalu ditutup rapat dan direkatkan dengan isolasi agar tidak terjadi kebocoran. Lalu didiamkan selama 1 hari. Besarnya kadar karbondioksida yang dihasilkan diukur. Kemudian dimasukkan ke dalam perhitungan di bawah untuk dihitung laju respirasinya. Benih yang telah diukur laju respirasinya dihitung volume udara bebasnya yang ada di dalam toples.
L = V × K × 1.76 W × B Keterangan :
L = Laju Respirasi (mg CO2/kg/jam)
V = Volume udara bebas dalam toples (V toples – V bahan) dalam ml K = kadar CO2 sesudah inkubasi – kadar CO2 awal (0.03%)
W = waktu inkubasi (jam)
B = bobot bahan (kg)
HASIL DAN PEMBAHASAN
Pembuatan Lot Benih
Tahap pertama dalam penelitian ini adalah pembuatan lot benih. Tujuan dari pembuatan lot benih ini adalah untuk memperoleh ragam viabilitas potensial dan vigor benih yang kemudian akan diuji respirasinya. Rata-rata daya berkecambah awal benih sebesar 91% dan kadar air awal benih sebesar 9%.
Penyimpanan dalam ruangan ber-AC (vigor 1) dimulai sejak benih didapatkan dan disimpan selama 8 minggu. Rata-rata suhu yang digunakan selama penyimpanan sebesar 18.2oC dan rata-rata RH sebesar 56%. Tingkat vigor 2 dilakukan penyimpanan di ruangan ber-AC selama 4 minggu, kemudian disimpan pada ruangan suhu kamar selama 4 minggu. Rata-rata suhu kamar yang digunakan selama penyimpanan sebesar 28.25oC dan rata-rata RH sebesar 73.5%. Penderaan dengan metode pengusangan cepat terkontrol dilakukan dengan beragam tingkat waktu penderaan yaitu selama 8 jam (vigor 3), 12 jam (vigor 4), dan 16 jam (vigor
5).
Tabel 1. Rata-rata Nilai Viabilitas dan Vigor 5 Lot Benih
Lot Benih DB PTM IV KST KCT BKKN
(%) (%) (%) (%) (%) (gram)
Vigor 1 93.56a 98.67a 74.89a 89.78a 29.09a 0.78a Vigor 2 87.03a 94.14ab 74.62a 84.14a 27.52a 0.73a Vigor 3 63.11b 89.33b 22.00bc 49.33b 16.03b 0.52b Vigor 4 52.00c 83.78c 30.89b 49.33b 16.91b 0.28c Vigor 5 41.33d 66.67d 16.89c 36.44c 11.54c 0.29c
Keterangan : DB : Daya Berkecambah KST : Keserempakan Tumbuh PTM : Potensi Tumbuh Maksimum KCT : Kecepatan Tumbuh
IV : Indeks Vigor BKKN : Bobot Kering Kecambah Normal Angka-angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak
berbeda nyata pada uji DMRT taraf 5%
indeks vigor, keserempakan tumbuh, kecepatan tumbuh, dan bobot kering kecambah normal, penurunan tingkat vigornya tidak menurun secara linier. Hal ini diduga karena waktu penyimpanan dan waktu penderaan yang diberikan untuk pembuatan lot benih kurang lama.
Secara umum, viabilitas dan vigor benih menurun sejalan dengan meningkatnya suhu, dan semakin lamanya benih terkena suhu tinggi serta dengan meningkatnya kandungan kadar air benih (Justice dan Bass. 2002). Tatipata (2004) menambahkan daya berkecambah benih kedelai yang disimpan pada kadar air awal 8% dan 10% pada semua jenis kemasan belum mengalami penurunan secara nyata, tetapi penurunan secara nyata terjadi pada bulan ke-6 dengan kadar air awal 12%. Menurut Wafiroh (2010) yang menyatakan bahwa pada penderaan selama waktu 24 jam dan 48 jam pada kadar air 20% viabilitas benih wijen dapat menurun menjadi 81.3% dan 36.6%.
Laju Respirasi Benih
Sebelum dilakukan pengukuran respirasi benih dari masing-masing lot
benih, diberi perlakuan awal untuk meningkatkan respirasi benih sebab respirasi benih dengan kadar air rendah relatif sedikit, sedangkan kosmotektor kurang sensitif untuk mengukur respirasi dalam jumlah sedikit. Setelah diberi perlakuan
[image:35.595.108.555.574.740.2]awal kadar air benih yang dilembabkan selama 10 jam meningkat hingga 33%, kadar air benih yang dilembabkan selama 15 jam meningkat hingga 45%, dan kadar air benih yang dilembabkan selama 20 jam meningkat hingga 50%.
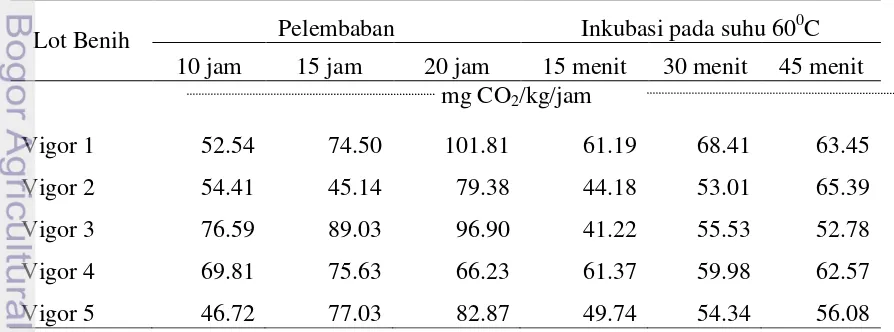
Tabel 2. Rata-rata Laju Respirasi 5 Lot Benih pada Berbagai Perlakuan Awal
Lot Benih Pelembaban Inkubasi pada suhu 60
0 C 10 jam 15 jam 20 jam 15 menit 30 menit 45 menit
mg CO2/kg/jam
Vigor 1 52.54 74.50 101.81 61.19 68.41 63.45
Vigor 2 54.41 45.14 79.38 44.18 53.01 65.39
Vigor 3 76.59 89.03 96.90 41.22 55.53 52.78
Vigor 4 69.81 75.63 66.23 61.37 59.98 62.57
22
Laju respirasi yang dihasilkan pada 5 lot benih (Tabel 2) menunjukkan bahwa terjadi fluktuasi laju respirasi dari vigor 1 hingga vigor 5 baik pada perlakuan awal pelembaban maupun perlakuan awal inkubasi pada suhu 600C. Hasil ini tidak sejalan dengan penelitian Yulinda (2000) yang menyatakan hasil pengukuran respirasi benih jagung, kedelai, dan kacang hijau yang menggunakan metode titrasi menunjukkan semakin tinggi viabilitas benih maka laju respirasi yang dihasilkan juga akan semakin tinggi. Hal ini diduga karena pada saat pemasangan alat kosmotektor ke toples inkubasi terjadi kebocoran, sebab alat tersebut rentan terjadi kebocoran saat pemasangan ke toples inkubasi. Selain itu, jumlah benih yang diukur berbeda masing-masing toplesnya sebab respirasi yang diukur berdasarkan berat 40 gram benih setelah dilembabkan.
Hubungan antara Laju Respirasi dengan Parameter Viabilitas Potensial dan Vigor Benih
Hasil analisis korelasi regresi antara laju respirasi dengan tolok ukur daya berkecambah dari lot benih dapat dilihat pada Tabel 3. Hasilnya menunjukkan
bahwa terjadi korelasi yang positif antara laju respirasi dengan daya berkecambah benih, kecuali pada perlakuan awal pelembaban 10 jam dan 15 jam. Gambar garis regresi antara laju respirasi dengan tolok ukur daya berkecambah 5 lot benih dapat
Tabel 3. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju Respirasi dengan Tolok Ukur Daya Berkecambah 5 Lot Benih
Perlakuan Awal Persamaan Regresi r
Pelembaban 10 jam y = -0.09x + 66.10 -0.16tn
Pelembaban 15 jam y = -0.36x + 96.54 -0.50 tn
Pelembaban 20 jam y = 0.31x + 64.49 0.49 tn
Inkubasi pada suhu 600C selama
15 menit y = 0.024x + 49.95 0.06 tn
Inkubasi pada suhu 600C selama
30 menit y = 0.125x + 49.85 0.45 tn
Inkubasi pada suhu 600C selama
45 menit y = 0.14x + 50.32 0.60 tn
Keterangan : Y : Nilai laju respirasi (mg CO2/kg/jam)
X : Nilai daya berkecambah (%)
tn :
tidak berpengaruh nyata pada taraf uji 5%
Nilai korelasi (r) dari analisis regresi laju respirasi dengan tolok ukur daya berkecambah benih (Tabel 4) menunjukkan bahwa perlakuan awal inkubasi pada suhu 600C selama 45 menit memiliki nilai yang mendekati 1 (≈1). Hal ini menunjukkan bahwa dengan perlakuan awal tersebut lebih memiliki keeratan hubungan antara laju respirasi dengan tolok ukur daya berkecambah daripada perlakuan awal lainnya. Nilai korelasi pada seluruh metode menunjukkan tidak ada yang nyata. Hal ini disebabkan penurunan viabilitas potensial dan vigor dari tingkat vigor yang landai.
24
Tabel 4. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju Respirasi dengan Tolok Ukur Potensi Tumbuh Maksimum 5 Lot Benih
Perlakuan Awal Persamaan Regresi r
Pelembaban 10 jam y = 0.24x + 38.90 0.24tn
Pelembaban 15 jam y = -0.38x + 105.49 -0.29 tn
Pelembaban 20 jam y = 0.47x + 44.86 0.41 tn
Inkubasi pada suhu 600C selama
15 menit y = 0.067x + 45.82 0.09 tn
Inkubasi pada suhu 600C selama
30 menit y = 0.242x + 37.35 0.48 tn
Inkubasi pada suhu 600C selama
45 menit y = 0.22x + 41.3 0.5 tn
Keterangan : Y : Nilai laju respirasi (mg CO2/kg/jam)
X : Nilai potensi tumbuh maksimum (%)
tn :
tidak berpengaruh nyata pada taraf uji 5%
Nilai korelasi (r) dari analisis regresi laju respirasi dengan tolok ukur potensi tumbuh maksimum (Tabel 4) menunjukkan bahwa perlakuan awal inkubasi pada suhu 600C selama 45 menit memiliki nilai yang mendekati 1 (≈1). Hal ini menunjukkan bahwa perlakuan awal tersebut lebih memiliki keeratan hubungan antara laju respirasi dengan tolok ukur potensi tumbuh maksimum daripada perlakuan awal lainnya. Nilai korelasi pada seluruh metode menunjukkan tidak ada yang nyata. Pada tolok ukur potensi tumbuh maksimum ini pengamatan dilakukan pada seluruh kecambah benih yang normal maupun tidak normal sehingga berpengaruh terhadap korelasinya dengan laju respirasi.
Hasil analisis korelasi regresi antara laju respirasi dengan tolok ukur indeks vigor dari 5 lot benih dapat dilihat pada Tabel 5. Hasilnya menunjukkan bahwa terjadi korelasi yang positif antara laju respirasi dengan indeks vigor. kecuali pada perlakuan awal pelembaban 10 jam dan pelembaban 15 jam. Gambar garis regresi antara laju respirasi dengan tolok ukur indeks vigor 5 lot benih dapat dilihat pada Lampiran 13-18. Korelasi yang positif ini menunjukkan bahwa semakin tinggi indeks vigor maka laju respirasinya juga akan semakin tinggi.
Nilai korelasi (r) dari analisis regresi laju respirasi dengan tolok indeks vigor (Tabel 5) menunjukkan bahwa perlakuan awal inkubasi pada suhu 600C
[image:38.595.113.504.118.277.2]respirasi dengan tolok ukur indeks vigor daripada perlakuan awal lainnya. Nilai korelasi pada seluruh metode menunjukkan tidak ada yang nyata.
Tabel 5. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju Respirasi dengan Tolok Ukur Indeks Vigor 5 Lot Benih
Perlakuan Awal Persamaan Regresi R Pelembaban 10 jam y = -0.163x + 67.16 -0.37tn Pelembaban 15 jam y = -0.40x + 89.68 -0.7 tn Pelembaban 20 jam y = 0.119x + 80.23 0.24 tn Inkubasi pada suhu 600C selama
15 menit y = 0.067x + 48.61 0.2 tn
Inkubasi pada suhu 600C selama
30 menit y = 0.09x + 54.29 0.41 tn
Inkubasi pada suhu 600C selama
45 menit y = 0.153x + 53.34 0.82 tn
Keterangan : Y : Nilai laju respirasi (mg CO2/kg/jam)
X : Nilai indeks vigor (%)
tn :
tidak berpengaruh nyata pada taraf uji 5%
Hasil analisis korelasi regresi antara laju respirasi dengan tolok ukur keserempakan tumbuh dari 5 lot benih dapat dilihat pada Tabel 6. Hasilnya menunjukkan bahwa terjadi korelasi yang positif antara laju respirasi dengan keserempakan tumbuh, kecuali pada perlakuan awal pelembaban 10 jam dan pelembaban 15 jam. Gambar garis regresi antara laju respirasi dengan tolok ukur keserempakan tumbuh 5 lot benih dapat dilihat pada Lampiran 19-24. Korelasi yang positif ini menunjukkan bahwa semakin tinggi keserempakan tumbuh maka laju respirasinya juga akan semakin tinggi.
26
Tabel 6. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju Respirasi dengan Tolok Ukur Keserempakan Tumbuh 5 Lot Benih
Perlakuan Awal Persamaan Regresi r
Pelembaban 10 jam y = -0.146x + 69.03 -0.27tn Pelembaban 15 jam y = -0.41x + 97.57 -0.59 tn Pelembaban 20 jam y = 0.217x + 72.05 0.36 tn Inkubasi pada suhu 600C selama
15 menit y = 0.07x + 47.20 0.18 tn
Inkubasi pada suhu 600C selama
30 menit y = 0.125x + 50.55 0.47 tn
Inkubasi pada suhu 600C selama
45 menit y = 0.17x + 49.71 0.74 tn
Keterangan : Y : Nilai laju respirasi (mg CO2/kg/jam)
X : Nilai keserempakan tumbuh (%)
tn :
tidak berpengaruh nyata pada taraf uji 5
Hasil analisis korelasi regresi antara laju respirasi dengan tolok ukur
kecepatan tumbuh dari 5 lot benih dapat dilihat pada Tabel 7. Hasilnya menunjukkan bahwa terjadi korelasi yang positif antara laju respirasi dengan
kecepatan tumbuh, kecuali pada perlakuan awal pelembaban 10 jam dan pelembaban 15 jam. Gambar garis regresi antara laju respirasi dengan tolok ukur kecepatan tumbuh 5 lot benih dapat dilihat pada Lampiran 25-30. Korelasi yang positif ini menunjukkan bahwa semakin tinggi kecepatan tumbuh maka laju respirasinya juga akan semakin tinggi.
Tabel 7. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju Respirasi dengan Tolok Ukur Kecepatan Tumbuh 5 Lot Benih
Perlakuan Awal Persamaan Regresi r Pelembaban 10 jam y = -0.40x + 68.05 -0.24tn Pelembaban 15 jam y = -1.28x + 98.07 -0.6 tn Pelembaban 20 jam y = 0.589x + 73.53 0.32 tn Inkubasi pada suhu 600C selama
15 menit y = 0.246x + 46.57 0.2 tn
Inkubasi pada suhu 600C selama
30 menit y = 0.388x + 50.41 0.48 tn
Inkubasi pada suhu 600C selama
45 menit y = 0.533x + 49.28 0.76 tn
Keterangan : Y : Nilai laju respirasi (mg CO2/kg/jam)
X : Nilai kecepatan tumbuh (%)
tn :
tidak berpengaruh nyata pada taraf uji 5%
[image:40.595.118.493.119.276.2]suhu 600C selama 45 menit memiliki nilai yang mendekati 1 (≈1). Hal ini menunjukkan bahwa perlakuan awal tersebut lebih memiliki keeratan hubungan antara laju respirasi dengan tolok ukur kecepatan tumbuh daripada perlakuan awal lainnya. Nilai korelasi pada seluruh perlakuan awal yang diberikan menunjukkan tidak ada yang nyata.
Tabel 8. Nilai Persamaan Regresi, Nilai Korelasi (r) antara Laju Respirasi dengan Tolok Ukur Bobot Kering Kecambah Normal 5 Lot Benih
Perlakuan Awal Persamaan Regresi r
Pelembaban 10 jam y = -10.69x + 65.59 -0.2tn Pelembaban 15 jam y = -31.05x + 88.45 -0.45 tn Pelembaban 20 jam y = 36.88x + 66.21 0.61 tn Inkubasi pada suhu 600C selama
15 menit y = -4.40x + 53.83 -0.11 tn
Inkubasi pada suhu 600C selama
30 menit y = 9.14x + 53.49 0.35 tn
Inkubasi pada suhu 600C selama
45 menit y = 10.26x + 54.71 0.45 tn
Keterangan : Y : Nilai laju respirasi (mg CO2/kg/jam)
X : Nilai kecepatan tumbuh (%)
tn
: tidak berpengaruh nyata pada taraf uji 5%
Hasil analisis korelasi regresi antara laju respirasi dengan tolok ukur bobot kering kecambah normal dari 5 lot benih dapat dilihat pada Tabel 8. Hasilnya menunjukkan bahwa terjadi korelasi yang positif antara laju respirasi dengan bobot kering kecambah normal, kecuali pada perlakuan awal pelembaban 10 jam, pelembaban 15 jam, dan inkubasi pada suhu 600C selama 15 menit. Gambar garis regresi antara laju respirasi dengan tolok ukur bobot kering kecambah normal 5 lot benih dapat dilihat pada Lampiran 31-36. Korelasi yang positif ini menunjukkan bahwa semakin tinggi bobot kering kecambah normal maka laju
28
Nilai korelasi (r) dari analisis regresi laju respirasi dengan tolok ukur bobot kering kecambah normal (Tabel 8) menunjukkan bahwa perlakuan awal pelembaban 20 jam dan inkubasi pada suhu 600C selama 45 menit memiliki nilai yang mendekati 1 (≈1). Hal ini menunjukkan bahwa perlakuan awal tersebut lebih memiliki keeratan hubungan antara laju respirasi dengan tolok ukur bobot kering kecambah normal daripada perlakuan awal lainnya. Nilai korelasi pada seluruh perlakuan awal yang diberikan menunjukkan tidak ada yang nyata.
Pada seluruh tolok ukur yang diamati menunjukkan bahwa terdapat korelasi positif antara laju respirasi dengan parameter viabilitas potensial dan vigor pada beberapa perlakuan awal benih, tetapi korelasi yang dihasilkan tindak nyata. Hal ini diduga nilai parameter viablitas potensial dan vigor benih yang dihasilkan dari lima tingkat vigor mengalami penurunan yang landai. Meilawati (1999) menyatakan dengan metode titrasi, semakin tinggi viabilitas benih kapas, laju respirasi yang dihasilkan juga semakin tinggi. Aisah (1999) menyatakan bahwa daya hantar listrik semakin rendah dengan semakin lamanya waktu penurunan kadar air benih jeruk besar, yaitu penurunan selama 0, 15, 30, 45, dan
60 jam. Sebaliknya laju respirasi yang diukur dengan metode titrasi semakin meningkat dengan semakin lamanya waktu penurunan kadar air yang berarti juga kelompok benih yang mempunyai daya hantar listrik rendah menunjukkan vigor
yang lebih tinggi dan laju respirasi yang lebih tinggi pula.
Korelasi negatif yang terjadi pada perlakuan awal pelembaban 10 jam dan 15 jam disebabkan karena karena pada saat pemasangan alat kosmotektor ke toples inkubasi terjadi kebocoran, sebab alat tersebut rentan terjadi kebocoran saat pemasangan ke toples inkubasi. Selain itu, jumlah benih yang diukur berbeda masing-masing toplesnya sebab respirasi yang diukur berdasarkan berat 40 gram benih setelah dilembabkan.
Pemilihan Perlakuan Awal untuk Pengukuran Respirasi
Analisis besarnya ragam dilakukan dengan melihat nilai standar deviasi dari rata-rata laju respirasi benih. Besarnya nilai standar deviasi menunjukkan besarnya keragaman data. Semakin besar nilai standar deviasi maka keragaman data yang diperoleh semakin besar dan bervariasi pada masing-masing ulangannya, begitu pula sebaliknya, semakin rendah nilai standar deviasi maka data yang dihasilkan pada masing-masing ulangan lebih seragam (Walpole. 1997).
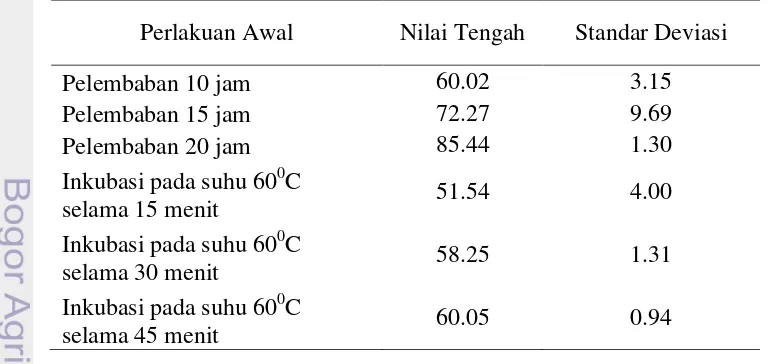
Berdasarkan analisis regresi dan korelasi yang diperoleh menunjukkan bahwa pengukuran respirasi dengan kosmotektor, dengan perlakuan awal inkubasi pada suhu 600C selama 45 menit memiliki hasil yang paling baik berdasarkan tolok ukur daya berkecambah, potensi tumuh maksimum, indeks vigor, keserempakan tumbuh, dan kecepatan tumbuh. Perlakuan awal lain yang memiliki potensi cukup baik adalah perlakuan awal pelembaban selama 20 jam. Hal ini dapat dilihat dari tolok ukur bobot kering kecambah normal, perlakuan awal pelembaban selama 20 jam memiliki hasil yang paling baik. Bila dilakukan analisis besarnya ragam (Standar deviasi) pada masing-masing metode, diperoleh
[image:43.595.109.495.492.674.2]bahwa metode pengovenan tetap paling baik (Tabel 9).
Tabel 9. Nilai Tengah dan Standar Deviasi Laju Respirasi 3 Lot Benih pada Berbagai Perlakuan Awal Pengukuran Laju Respirasi
Perlakuan Awal Nilai Tengah Standar Deviasi
Pelembaban 10 jam 60.02 3.15
Pelembaban 15 jam 72.27 9.69
Pelembaban 20 jam 85.44 1.30
Inkubasi pada suhu 600C
selama 15 menit 51.54 4.00
Inkubasi pada suhu 600C
selama 30 menit 58.25 1.31
Inkubasi pada suhu 600C
selama 45 menit 60.05 0.94
30
KESIMPULAN DAN SARAN
Kesimpulan
Kosmotektor dapat digunakan untuk mengukur respirasi benih yang telah diberi perlakuan awal. Alat tersebut dapat dimanfaatkan untuk uji cepat vigor benih kedelai dengan mendeteksi laju respirasi yang dilakukan oleh benih. Hasil yang didapatkan adalah semakin tinggi vigor benih maka semakin tinggi pula laju respirasinya. Metode yang paling tepat digunakan untuk pengukuran laju respirasi benih kedelai dengan perlakuan awal inkubasi pada suhu 600C selama 45 menit.
Saran
DAFTAR PUSTAKA
Adisarwanto, T. 2007. Kedelai. Cetakan ke-3. Penebar Swadaya. Jakarta. 108 hal.
Agrawal, P.K. 1980. Seed Vigor : Concepts and Measurement. Division of Seed Science and Technology, Indian Agricultural Research Institute. New Delhi, India.
Aisah, S. 1999. Studi Sifat Rekalsitran pada Benih Jeruk Besar (Citrus maxima
Merr). Skripsi. Fakultas Pertanian. Institut Pertanian Bogor. Bogor.
Badan Pusat Statistik. 2010. Data Kedelai 2010. http://www.bps.go.id. [28 Juni 2011].
Cantrell, R.P., H.F. Hodges, W.F. Keim. 1971. Relationship between plant respirastion and seedling vigor in Zea mays L.Crop Science 12(2):214-216.
Copeland, O.L., and M.B McDonald. 1995. Principle of Seed Science and Technology. New York : Chapman & Hall. 408 hal.
Curtis, O.F., and D.G. Clark. 1950. Introduction to Plant Physiology. Mc Graw. Hill Book Company, Inc. New York. Toronto. London.
Dermawan, M. 2007. Studi Pengujian Tetrazolium sebagai Peubah Viabilitas Benih Buncis ( Phaseolus vulgaris L.). Skripsi. Program Studi Pemuliaan Tanaman dan Teknologi Benih, Institut Pertanian Bogor. Bogor. 39 hal.
Dina, M.E. Hartati, Ismiatun, dan Ismanto. 2006. Pengujian vigor benih : telaah prospoek penerapannya di Indonesia. Vigor. Jurnal Informasi Pengembangan Mutu Benih 4( 4):14.
Grzesiiuk, S. and J. Tluczkiewicz. 1983. Respiratory activity of mitochondria of ageing winter wheat grains. Acta Physiol. Plant 5(3):71-77.
ISTA. 1995. Controlled deterioration test, p. 70-78. In: J. G. Hampton, D. M. Tekrony (Eds.), Handbook of Vigour Test Method. International Seed Testing Association. Zurich.
Justice, O.L., dan L.N. Bass. 2002. Prinsip dan Praktek Penyimpanan Benih (diterjemahkan dari: Principles and Practices of Seed Storage, penerjemah: Rennie Roesli). Raja Grafindo Persada. Jakarta. 446 hal.
Kamil, J. 1979. Teknologi Benih. Angkasa Raya. Padang. 262 hal.
Masyagina, O.V., S.G. Prokushkin, M.Yu. Sadilova. 2009. Influence of temperature on fractional composition of proteins and respiration of germinating seeds of gmelin and siberian larch. Sibirskii Ekologicheskii Zhurnal 16 (6):937–948.
Meilawati, L. 1999. Pengaruh Periode Penyimpanan dan Perlakuan Osmoconditioning terhadap Viabilitas Benih Kapas. Skripsi. Fakultas Pertanian. IPB. Bogor.
Mugnisjah, W.Q., A. Setiawan, Suwarto, dan C. Santiwa. 1994. Panduan Praktikum dan Penelitian Bidang Ilmu dan Teknologi Benih. Rajawali Press. Jakarta. 283 hal.
New Cosmos Electric Co. Ltd.. 1999. Cosmos, Portable Gas Detectors Product Guide. http://www.new-cosmos.co.jp/en/index.html. [ 5 Januari 2011].
Pian, Z.A. 1981. Pengaruh Uap Etil Alcohol terhadap Viabilitas Benih Jagung
(Zea mays L.) dan Pemanfaatannya untuk Menduga Daya Simpan.
Disertasi. FPS. IPB. Bogor.
Purwoko, B. S., P. Utoro, Mukhtasar, S. S. Harjadi, dan S. Susanto. 2002. Infiltrasi poliamina menghambat pemasakan buah pisang cavendish. Hayati 9(1):19-23.
Rachmawati, F. 1999. Pengaruh Tingkat Kadar Air Benih dan Invigorasi dengan NAA dan GA3 terhadap Viabilitas Benih Kakao. Skripsi. Fakultas Pertanian. IPB. Bogor.
Sadjad, S., E. Muniarti, dan S. Ilyas. 1999. Parameter Pengujian Vigor Benih dari Komparatif ke Simulatif. Grasindo. Jakarta. 185 hal.
Sadjad, S. 1972. Penyimpanan Benih Tanaman Pangan. Bahan Kuliah Latihan Pola Tanam. LP-3. IRRI. 32 hal.
Sadjad, S. 1973. Pedoman uji daya berkecambah benih tanaman makanan penting di Indonesia. Prasarana Penunjang Intensifikasi Pertanian pada Seminar Pembangunan Pertanian: Potensi Teknologi dan Organisasi Produksi. Fakultas Pertanian IPB dan Badan Pengendali Bimas Departemen Pertanian. 20 hal.
Sadjad, S. 1975. Teknologi Benih dan Masalah Uji Viabilitas Benih. Hal : 127-145. Dalam S. Sadjad (Ed.). Dasar-Dasar Teknologi Benih, Capita Selecta. Departemen Agronomi, Institut Pertanian Bogor, Biro Penataran. Bogor. 216 hal.
Sadjad, S. 1980. Panduan pembinaan mutu benih tanaman kehutanan di Indonesia. Proyek Pusat Pembinaan Kehutanan Direktorat Reboisasi dan Rehabilitasi. Ditjen Kehutanan-IPB.
34
Sadjad, S. 1994. Kuantifikasi Metabolisme Benih. PT Gramedia Widiasarana Indonesia. Jakarta.
Sumarno. 1985. Teknik Pemuliaan kedelai, hal. 263-294. Dalam S. Somaatdja, M. Ismunadji, Sumarno, M. Syam, O. Manurung, dan Yuswadi (Eds.). Kedelai. Badan Penelitian dan Pengembangan Pertanian Tanaman Pangan Bogor. Bogor.
Suprapto, H.S. 2001. Bertanam Kedelai. Cetakan ke-2. Penebar Swadaya. Jakarta. 129 hal.
Suriawinata, R., W. Manalu, dan D. Sastradipradja. 1984. Efek Imunologik dari Konsumsi Protein Kacang-kacangan (Kedelai). Laporan Penelitian. Institut Pertanian Bogor. Bogor. 32 hal.
Taliroso, D. 2008. Deteksi Status Vigor Benih Kedelai (Glycine max L. Merr) melalui Metode Uji Daya Hantar Listrik. Tesis. Sekolah Pascasarjana, Institut Pertanian Bogor. Bogor. 84 hal.
Tatipata, A., P. Yudono, A. Purwantoro, W. Mangoendidjojo. 2004. Kajian aspek fisiologi dan biokimia deteriorasi benih kedelai dalam penyimpanan. Ilmu Pertanian 11 (2):76-87.
Tatipata, A. 2008. Pengaruh kadar air awal, kemasan dan lama simpan terhadap protein membran dalam mitokondria benih kedelai. Bul. Agron. 36(1):8-16.
Throneberry, G.O., and F.G. Smith. 1955. Relation of respirations and enzymic activity to corn seed viability. Plant Physiol. 30:337-343.
Wafiroh, S. 2010. Pengujian Vigor Benih Menggunakan Metode Pengusangan Cepat Terkontrol dan Korelasinya terhadap Daya Tumbuh dan Vigor Bibit Wijen. Skripsi. Departemen Agronomi dan Hortikultura, Institut Pertanian Bogor. Bogor. 49 hal.
Walpole, R.E. 1997. Pengantar Statistik Edisi ke-3. PT Gramedia. Jakarta. 510 hal.
Winarno, F.G., dan M. Amman. 1979. Fisiologi Lepas Panen. Sastra Hudaya. Jakarta. 97 hal.
Woodstock, L.W., and Don F. Grabe. 1967. Relationships between seed respiration during imbibition and subsequent seedling growth in Zea mays
L. Plant Physiol 42:1071-1076.
36
Lampiran 1. Garis Regresi antara laju Respirasi Perlakuan Awal Pelembaban 10 jam dengan Daya Berkecambah 5 Lot Benih
Lampiran 3. Garis Regresi antara Laju Respirasi Perlakuan Awal Pelembaban 20 jam dengan Daya Berkecambah 5 Lot Benih
38
Lampiran 5. Garis Regresi antara Laju Respirasi Perlakuan Awal Inkubasi pada suhu 600C selama 30 menit dengan Daya Berkecambah 5 Lot Benih
Lampiran 7. Garis Regresi antara Laju Respirasi Perlakuan Awal Pelembaban 10 jam dengan Potensi Tumbuh Maksimum 5 Lot Benih
40
Lampiran 9. Garis Regresi antara Laju Respirasi Perlakuan Awal Pelembaban 20 jam dengan Potensi Tumbuh Maksimum 5 Lot Benih
Lampiran 11. Garis Regresi antara Laju Respirasi Perlakuan Awal Inkubasi pada suhu 600C selama 30 menit dengan Potensi Tumbuh Maksimum 5 Lot Benih
42
Lampiran 13. Garis Regresi antara Laju Respirasi Perlakuan Awal Pelembaban 10 jam dengan Indeks Vigor 5 Lot Benih
Lampiran 15. Garis Regresi antara Laju Respirasi Perlakuan Awal Pelembaban 20 jam dengan Indeks Vigor 5 Lot Benih
44
Lampiran 17. Garis Regresi antara Laju Respirasi Perlakuan Awal Inkubasi pada suhu 600C selama 30 menit dengan Indeks Vigor 5 Lot Benih
Lampiran 19. Garis Regresi antara Laju Respirasi Perlakuan Awal Pelembaban 10 jam dengan Keserempakan Tumbuh 5 Lot Benih
46
Lampiran 21. Garis Regresi antara Laju Respirasi Perlakuan Awal Pelembaban 20 jam dengan Keserempakan Tumbuh 5 Lot Benih
Lampiran 23. Garis Regresi antara Laju Respirasi Perlakuan Awal Inkubasi pada suhu 600C selama 30 menit dengan Keserempakan Tumbuh 5 Lot Benih
48
Lampiran 25. Garis Regresi antara Laju Respirasi Perlakuan Awal Pelembaban 10 jam dengan Kecepatan Tumbuh 5 Lot Benih
Lampiran 27 Garis Regresi antara Laju Respirasi Perlakuan Awal Pelembaban 20 jam dengan Kecepatan Tumbuh 5 Lot Benih
50
Lampiran 29. Garis Regresi antara Laju Respirasi Perlakuan Awa