REIZA MAULANA ADITRIAWAN
REIZA MAULANA ADITRIAWAN
DEPARTEMEN MANAJEMEN SUMBER DAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2013
AKUMULASI LOGAM BERAT TEMBAGA (Cu) PADA IKAN
NILA (
Oreochromis niloticus
) YANG DIPELIHARA PADA
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Akumulasi Logam Berat Tembaga (Cu) pada Ikan Nila (Oreochromis niloticus) yang Dipelihara pada Media Berisi Sedimen dari Waduk Cirata adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2013
ABSTRAK
REIZA MAULANA ADITRIAWAN. Akumulasi Logam Berat Tembaga (Cu) pada Ikan Nila (Oreochromis niloticus) yang Dipelihara pada Media Berisi Sedimen dari Waduk Cirata. Dibimbing oleh AGUSTINUS M. SAMOSIR dan YOSMANIAR.
Tembaga di perairan akan berikatan dengan koloid dan partikulat tersuspensidan akhirnya terakumulasi dalam sedimen. Tembaga dalam sedimen akan terdaur ulang kedalam air yang berada di atas sedimen. Tentu saja sangat berbahaya untuk dikonsumsi karena tembaga dapat terbawa oleh ikannila yang ada di Waduk Cirata melalui bioakumulasi.Tujuan penelitian ini adalah mengetahui faktor biokonsentrasi antara sedimen, air, dan ikan serta mengukur efek akumulasi terhadap pertumbuhan ikan. Desain akuarium penelitian di buat mirip dengan keramba jaring apung dengan skala yang diperkecil. Hasil nilai faktor biokonsentrasi (BCF) antara tembaga pada ikan dan tembaga pada sedimen memiliki sifat akumulatif rendah yaitu 0,6069, sedangkan faktor biokonsentrasi antara tembaga pada ikan dan tembaga pada air memiliki sifat akumulatif tinggi yaitu 7467. Konsentrasi tembaga didalam sedimen tidak memberikan pengaruh langsung terhadap akumulasi pada ikan dan konsentasi tembaga didalam air memberikan pengaruh secara langsung terhadap akumulasi pada ikan.Keberadaan tembaga yang tinggi didalam tubuh dan lingkungan memberikan pengaruh terhadap laju pertumbuhan spesifik ikan nila selama penelitian, dimana terjadi penurunan yang signifikan selama 6 minggu pengamatan.
ABSTRACT
REIZA MAULANA ADITRIAWAN. Accumulation of Heavy Metals Copper (Cu) in Tilapia (Oreochromis niloticus) Maintained in Aquarium Containing Reservoir Sediments from Cirata. Supervised by AGUSTINUS A. SAMOSIR dan YOSMANIAR.
REIZA MAULANA ADITRIAWAN
DEPARTEMEN MANAJEMEN SUMBER DAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2013 Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Manajemen Sumber Daya Perairan
AKUMULASI LOGAM BERAT TEMBAGA (Cu) PADA IKAN
NILA (
Oreochromis niloticus
) YANG DIPELIHARA PADA
MEDIA BERISI SEDIMEN DARI WADUK CIRATA
Judul Skripsi : Akumulasi Logam Berat Tembaga (Cu) pada Ikan Nila (Oreochromis niloticus) yang Dipelihara pada Media Berisi Sedimen dari Waduk Cirata
Nama : Reiza Maulana Aditriawan
NIM : C24070070
Disetujui oleh
Ir. Agustinus M Samosir, M.Phil Ir. Yosmaniar, M.Si
Pembimbing I Pembimbing II
Diketahui oleh
Dr. Ir. Yusli Wardiatno, M.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2011 ini ialah akumulasi logam berat pada ikan nila (Oreochromis niloticus).
Terima kasih penulis ucapkan kepada Bapak Ir. Agustinus M. Samosir, M.Phil dan Ibu Ir. Yosmaniar, M.Si selaku pembimbing, serta Bapak Dr. Ir.Isdradjad Setyobudiandi, M.Sc yang telah banyak memberi saran dan masukan kepada penulis, kemudian bapak Prof. Dr. M. F. Rahardjo yang telah memberikan arahan, motivasi, dan nasehat selama perkuliahan, seluruh dosen pengajar departemen Manajemen Sumber Daya Perairan dan Matematika, sahabat-sahabat tercinta serta berbagai pihak (MSP 44, 45, dan 46) yang telah banyak memberikan dukungan sehingga penulis dapat menyusun skripsi ini dengan baik. Penulis menyadari adanya berbagai keterbatasan sehingga dalam tulisan ini masih banyak kekurangan. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Maret 2013
DAFTAR ISI
DAFTAR TABEL v
DAFTAR GAMBAR v
DAFTAR LAMPIRAN v
PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
TINJAUAN PUSTAKA 3
Biologi Ikan Nila 3
Logam Berat 5
Karakteristik logam berat 5
Logam berat dalam sedimen 6
Tembaga 8
Faktor yang Mempengaruhi Biokonsentrasi tembaga 9
METODE PENELITIAN 14
Lokasi dan Waktu 14
Alat, Bahan, dan Kegunaan 14
Rancangan Penelitian 15
Analisis dn Penyajian Data 16
HASIL DAN PEMBAHASAN 18
Gambaran Umum Waduk Cirata 18
Hasil 19
Pembahasan 25
KESIMPULAN DAN SARAN 27
Kesimpulan 27
Saran 27
DAFTAR PUSTAKA 28
LAMPIRAN 31
DAFTAR TABEL
1. Pembagian jenis sedimen berdasarkan ukuran partikel 7 2. Baku mutu konsentrasi logam tembaga (Cu) pada sedimen 7 3. Jenis Industri dengan tembaga sebagai parameter uji wajib 8 4. Hubungan antara pH air dan kehidupan ikan budidaya 11 5. Parameter dan alat yang digunakan untuk analisis kualitas air 15
6. Indeks faktor biokonsentrasi 21
7. Klasifikasi kesadahan 23
DAFTAR GAMBAR
1. Skema rumusan masalah 2
2. Ikan Nila (Oreochromis niloticus) 4
3. Jalur masuk logam kedalam tubuh organisme air 4
4. Hubungan antara pH terhadap spesiasi tembaga (Cu) . 11 5. Hubungan antara kesadahan, pH dengan toksisitas tembaga (Cu) 13
6. Desain akuarium penelitian 16
7. Konsentrasi tembaga (Cu) pada sedimen 19
8. Konsentrasi tembaga (Cu) pada air 20
9. Konsentrasi tembaga (Cu) pada ikan 21
10. Laju pertumbuhan spesifik ikan nila 24
11. Tren pertambahan bobot ikan nila selama 8 minggu pengamatan 25
DAFTAR LAMPIRAN
1. Alat dan bahan yang digunakan 31
2. Desain dan penataan letak akuarium penelitian 32
3. Data konsentrasi logam tembaga (Cu) 32
4. Data parameter lingkungan 32
5. Data bobot ikan nila selama pemeliharaan 33
6. Laju pertumbuhan spesifik ikan nila selama pemeliharaan 33 7. Hasil ANOVA antara perlakuan terhadap konsentrasi tembaga
pada ikan 34
8. Hasil ANOVA antara perlakuan terhadap konsentrasi tembaga
pada sedimen 35
9. Hasil ANOVA antara perlakuan terhadap konsentrasi tembaga
pada air 36
10 Koefesien korelasi antara perlakuan - konsentrasi tembaga ikan 37 11. Koefesien korelasi antara perlakuan - konsentrasi tembaga sedimen 37 12. Koefesien korelasi antara perlakuan - konsentrasi tembaga air 37
PENDAHULUAN
Latar Belakang
Permasalahan lingkungan merupakan permasalahan telah menjadi masalah global karena menyangkut masa depan dari tempat hidup manusia ke depan, yaitu bumi. Kristanto (2004) berpendapat bahwa faktor laju pertumbuhan penduduk merupakan akar dari permasalahan lingkungan, sebab dengan pertambahan penduduk yang tinggi menyebabkan kebutuhan pangan, bahan bakar dan kebutuhan-kebutuhan dasar yang lain juga meningkat yang akhirnya menekan berbagai upaya produksi yang akhirnya juga sejalan dengan meningkatnya limbah. Koeman (1987) menambahkan banyaknya orang yang mendapat tempat di dalam industri, dengan cepat pula resiko terhadap lingkungan, seperti pencemaran. namun dalam periode dahulu adanya anggapan bahwa komponen lingkungan seperti tanah, udara dan air secara bersama-sama dapat memproses limbah. Hingga pada akhirnya terjadi peristiwa pencemaran di Teluk Minamata (Minamata Bay) di Jepang, tahun 1953 yang menimpa sebagian besar masyarakat nelayan, yang mendapatkan sumber makanannya dari laut. Peristiwa ini mengubah anggapan masyarakat dengan pandangan baru masyarakat terhadap lingkungan.
Indonesia sangat rentan terhadap masalah pencemaran, terutama pencemaran perairan. Banyak penelitian yang menunjukan wilayah perairan Indonesia telah mengalami penurunan kualitas air terutama karena pencemaran. Perairan tertutup seperti waduk lebih rentan terhadap bahan pencemar dibandingkan perairan terbuka. Salah satu waduk yang diduga telah mengalami pencemaran adalah Waduk Cirata.
Logam berat merupakan salah satu parameter lingkungan yang sangat penting di Waduk Cirata. Sumber logam berat yang masuk ke dalam lingkungan perairan berasal dari debu kegiatan gunung berapi, erosi dan pelapukan tebing dan tanah, serta kegiatan antropogenik manusia yang terbawa pada jalur-jalur perairan seperti sungai (Effendi 2003). Tembaga adalah salah satu logam berat yang dapat memberikan efek negatif bagi organisme akuatik baik secara fisik maupun hingga tingkat sel. Telah banyak penelitian mengenai efek yang terjadi dari pemaparan tembaga, diantaranya menyebabkan perubahan tingkah laku, melemahkan respon elektrik (Di Gulio and Hinton 2008), merusak lamella sekunder pada insang (Irianto 2005) dan banyak efek lainnya. Tembaga sendiri banyak digunakan dalam industri metalurgi, tekstil, elektronika dan juga pembuatan cat anti karat (anti fouling), bahan pestisida dan pengendalian makro-invertebrata dalam bidang pertanian, selain itu juga digunakan dalam bahan pengawet kayu, pengolahan air.
tembaga akan berikatan dengan partikulat koloid, agregat, dan partikulat tersuspensi yang pada akhirnya akan terakumulasi dalam sedimen. Sedikit demi sedikit, tembaga yang terkandung dalam sedimen akan terdaur ulang kedalam air yang berada di atas sedimen.
Tembaga dapat terbawa oleh organisme akuatik yang ada di Waduk Cirata melalui proses bioakumulasi, ini tentu saja sangat berbahaya bagi seluruh aktivitas budidaya Keramba Jaring Apung (KJA) dengan ikan nila sebagai salah satu komoditasnya, disamping gencarnya program makan ikan karena kandungan protein ikan dipandang sebagai agent of development bagi pembangunan bangsa. Oleh karena itu perlu dilakukannya penelitian untuk mengetahui akulumasi logam berat pada ikan, air dari sedimen yang diambil dari Waduk Cirata.
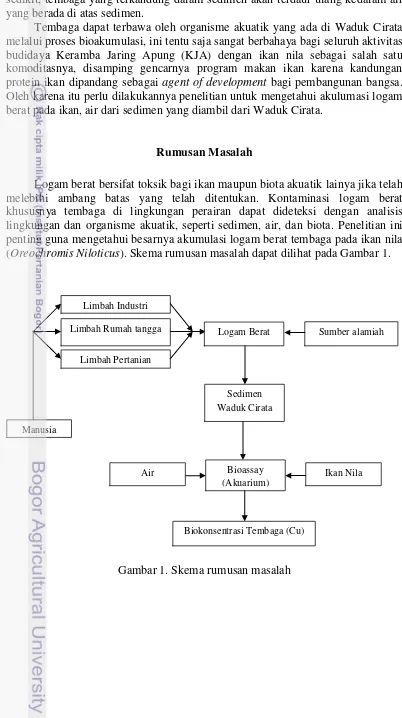
Rumusan Masalah
Logam berat bersifat toksik bagi ikan maupun biota akuatik lainya jika telah melebihi ambang batas yang telah ditentukan. Kontaminasi logam berat khususnya tembaga di lingkungan perairan dapat dideteksi dengan analisis lingkungan dan organisme akuatik, seperti sedimen, air, dan biota. Penelitian ini penting guna mengetahui besarnya akumulasi logam berat tembaga pada ikan nila (Oreochromis Niloticus). Skema rumusan masalah dapat dilihat pada Gambar 1.
Gambar 1. Skema rumusan masalah
Limbah Industri
Limbah Rumah tangga
Limbah Pertanian
Logam Berat
Sedimen Waduk Cirata
Ikan Nila Manusia
Bioassay (Akuarium)
Biokonsentrasi Tembaga (Cu) Air
Tujuan Penelitian
Penelitian ini bertujuan untuk : 1). Mengkaji hubungan biokonsentrasi kandungan logam berat antara sedimen, air dan ikan nila. 2). Mengukur efek akumulasi tembaga terhadap pertumbuhan ikan nila.
Manfaat Penelitian
Penelitian ini dapat memberikan informasi mengenai konsentrasi logam berat tembaga/Copper (Cu) pada air, akumulasinya pada ikan Nila (Oreochromis niloticus) dan sedimen yang diambil dari Waduk Cirata dan diharapkan dapat dijadikan acuan bagi pengelolaan Waduk Cirata.
TINJAUAN PUSTAKA
Biologi Ikan Nila (Oreochromis Niloticus)
Ikan nila (Oreochromis niloticus) berasal dari Sungal Nil dan danau-danau sekitarnya. Sekarang ikan ini telah tersebar ke negara-negara di lima benua yang beriklim tropis dan subtropis. Sedangkan di wilayah yang beriklim dingin, ikan nila tidak dapat hidup dengan baik. Bibit ikan nila sendiri didatangkan ke Indonesia secara resmi oleh Balai Penelitian Perikanan Air Tawar (BPPAT) dari Taiwan pada tahun 1969 (Kordi and Gufron 2010). Setelah melalui masa penelitian dan adaptasi, ikan ini baru disebarluaskan kepada petani di seluruh Indonesia. Nila adalah nama khas Indonesia yang diberikan oleh Pemerintah melalui Direktur Jenderal Perikanan. Secara umum klasifikasi ikan nila :
Domain : Eukaryota Kingdom : Animalia Filum : Chordata Kelas : Actinopterygii Ordo : Perciformes Famili : Cichlidae Genus : Oreochromis
Gambar 2. Ikan Nila (Oreochromis niloticus)
Menurut Amri and Khairuman (2008) ikan nila sengaja diintroduksi untuk menggantikan ikan mujair (Oreochromis mossambicus) yang dinilai kurang menguntungkan karena bobotnya yang relatif kecil, berbeda dengan ikan nila yang mampu memiliki bobot tubuh yang relatif lebih besar. Pertumbuhan ikan nila sangat cepat, hal ini karena ikan nila memiliki sifat omnivora artinya pemakan nabati maupun hewani. Kebiasaan makan ikan nila di perairan alami adalah plankton, tumbuhan air yang lunak serta cacing.
Eneji et al. (2011) mengatakan ikan telah diakui sebagai pengakumulasi polutan organik dan anorganik yang baik. Tingkat bioakumulasi polutan di dalam organisme ikan bergantung pada kemampuan dari ikan mentransformasikan suatu polutan dan bergantung dari konsentrasi polutan di perairan itu sendiri.
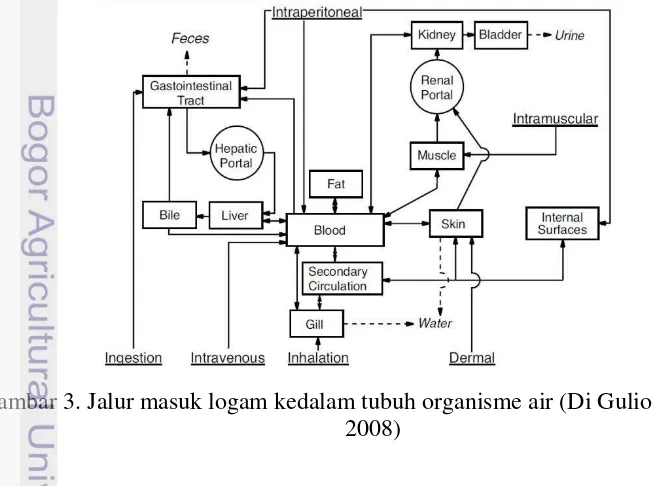
Pencemaran logam berat sangat merugikan ikan secara fisik dan fisiologik, seperti kerusakan vertebral, kerusakan lamella sekunder pada insang (Irianto 2005). Logam juga dapat masuk ke dalam tubuh dan dapat mengumpul di dalam tubuh suatu organisme dan tetap tinggal di dalam tubuh dalam jangka waktu yang lama sebagai racun yang terakumulasi (Kristanto 2004). Gambar 3 menunjukan beberapa jalur pemasukan logam kedalam tubuh organisme.
Logam Berat
Logam berat adalah unsur-unsur dengan bobot jenis lebih besar dari 5 g/cm3, terletak di sudut kanan bawah pada sisitem periodik, mempunyai afinitas yang tinggi terhadap unsur S dan biasanya bernomor atom 22 sampai 92 dari periode 4 hingga 7. Afinitas yang tinggi terhadap unsur S menyebabkan logam ini menyerang ikatan belerang dan enzim, sehingga enzim bersangkutan menjadi tidak aktif (Baird 1995), kadium, timbal, dan tembaga terikat pada sel-sel membran yang menghambat proses transformasi melalui dinding sel.
Logam dalam berbagai bentuk adalah penyusun alamiah dari badan perairan. Logam berasal dari kerak bumi yang berupa bahan-bahan murni, organik dan anorganik, proses alamiah seperti seperti pengikisan batuan dan aktivitas gunung berapi, aliran air permukaan, dan difusi dari atmosfer. Selain itu aktivitas antropogenik menjadikan sumber penting dalam peningkatan logam di lingkungan perairan. Logam diambil melalui kegiatan pertambangan yang kemudian dicairkan dan dimurnikan menjadi logam-logam murni. Dalam proses pemurnian tersebut mulai dari pencairan hingga menjadi logam, sebagian terbuang ke dalam lingkungan. Secara alami siklus perputaran logam berawal dari kerak bumi kemudian ke lapisan tanah, kemudian masuk ke dalam mahluk hidup (Darmono 1995). Harrison (2006) mengatakan secara umum terdapat beberapa alasan yang mendasar penetapan logam sebagai kontaminan di perairan, diantaranya adalah :
1. Bersifat toksik walau pada konsentrasi rendah. 2. Dapat terakumulasi ke dalam organisme.
3. Butuh waktu yang lama untuk terdegradasi dan resisten di lingkungan.
4. Dapat menyebabkan kanker dan mutasi gen; dan 5. Sering digunakan dalam program monitoring.
Air sering tercemar oleh berbagai komponen anorganik, diantaranya berbagai jenis logam berat yang berbahaya, yang beberapa di antaranya banyak digunakan dalam berbagai keperluan sehingga diproduksi secara kontinyu dalam skala industri. Industri-industri tersebut harus mendapat pengawasan yang ketat agar tidak mencemari dan membahayakan lingkungan sekitar.
Karakteristik Logam Berat
Adanya logam berat di perairan, berbahaya baik secara langsung terhadap kehidupan kesehatan organisme, maupun efeknya secara tidak langsung terhadap kesehatan manusia. Hal ini berkaitan dengan sifat-sifat logam berat yaitu diantaranya sulit didegradasi secara alami, dapat terakumulasi dalam organisme, memiliki waktu paruh yang tinggi dalam tubuh biota laut, dan faktor konsentrasi (rasio antara kadar polutan dalam tubuh dan kadar polutan di lingkungan) yang besar dalam tubuh biota laut (Moore and Ramamoorthy 1984).
Logam berat yang masuk ke dalam suatu perairan, proses pertama yang terjadi adalah pengenceran lalu diikuti dispersi oleh karena itu kehadiran logam di dalam perairan biasanya berada dalam kepekatan yang sangat rendah. logam didalama badan perairan akan mengalami beberapa proses yaitu : pengendapan, adsorbsi dan absorbsi oleh organisme perairan. Karena setiap logam yang berbeda tidaklah sama waktu yang dibutuhkan untuk mengendap, beberapa diantaranya akan cenderung untuk tertimbun didekat sumber masukan, sedangkan yang mudah larut akan dapat menyebar pada suatu daerah yang lebih luas (Connell 1995).
Logam Berat Dalam Sedimen
Logam yang berikatan dengan partikulat tersuspensi akan mengendap ke dasar perairan. Jika dibandingkan dengan air yang berada di atasnya, sedimen dapat mengandung konsentrasi logam yang sangat tinggi. Sedikit demi sedikit, logam-logam yang terkandung dalam sedimen akan terdaur ulang kedalam air yang berada di atas sedimen, mula-mula terjadi proses disolasi kedalam fase air interstisi (Bryan 1976 in Connell 1995). Logam yang terkandung dalam sedimen kemungkinan berada dalam kondisi keseimbangan dinamis dengan logam pada air lapisan atas dan air interstisi. Jika air interstisi mempunyai kandungan tinggi organik yang mampu membentuk kompleks yang dapat larut dengan logam, tingkat logam cair interstisi mungkin lebih besar beberapa kali dari tingkat logam air yang berada di atasnya (Connell 1995).
Menurut Sanusi (2006) kandungan logam berat di sedimen tergantung pada komposisi kimia dan mineral sedimen. Ia menambahkan, tekstur atau ukuran partikel sedimen terbentuk terutama disebabkan oleh adanya kekuatan arus, dengan kata lain, faktor arus merupakan energi sortasi sedimen. Perairan yang memiliki kondisi arus yang dinamis (Dynamic waters), memiliki tekstur sedimen yang kasar (kerikil, pasir). Sementara perairan dimana arusnya tenang atau tidak dinamis (sluggish waters) memiliki tekstur yang lebih halus. Perairan yang sering terjadi deposisi material tersuspensi umumnya memiliki tekstur sedimen yang halus.
Tabel 1. Pembagian jenis sedimen berdasarkan ukuran pertikel
Jenis Sedimen Ukuran Partikel (mm)
Batuan (Boulders) > 256
Partikel terlarut (Dissolved Material) < 0,0005
Sumber : Hutabarat and Evans (1985)
Terbentuknya senyawa kimia dalam sedimen disebabkan oleh reaksi oksidasi-eduksi. Selain itu, proses-proses fisika kimia lainnya terjadi dalam sedimen, seperti : adsorpsi-desorpsi, solidifikasi-disolusi akan mempengaruhi komposisi spesiasi kimia sedimen dan lapisan air di permukaan sedimen, melalui interaksi air-sedimen (Bryan 1976 in Connell and Miller 1995).
Makin tinggi kandungan polutan organik dan anorganik dalam kolom air, maka makin tinggi pula akumulasi polutan tersebut dalam sedimen. Oleh karena itu kualitas fisika kimia sedimen suatu perairan dapat dijadikan indikator baik-buruknya kualitas suatu perairan. Dilihat dari aspek kimia, akumulasi bahan organik dalam substrat halus akan menentukan status reduksi-oksidasi, bergantung pada ketersediaan O2 terlarut dalam air dan pH sedimen.
Walau sedimen adalah salah satu kompartemen lingkungan utama, namun jarang menjadi perhatian dalam pemantauan lingkungan sehingga regulasi mengenai sedimen belum banyak diterapkan di banyak negara atau bahkan tidak ada. Indonesia sendiri belum menetapkan baku mutu logam berat didalam sedimen sehingga untuk acuan logam berat didalam sedimen didasarkan pada baku mutu yang dikeluarkan oleh lembaga di beberapa negara, berikut lembaga yang mengeluarkan regulasi mengenai baku mutu sedimen.
Tabel 2. Baku mutu konsentrasi logam tembaga (Cu) pada sedimen.
Logam CCME
*) : Canadian Council of Minister of Environmental (1999). **) : Reseau National d’Observation (1981) in Anggraini (2007).
Tembaga (Cu) Karakteristik Tembaga
Tembaga atau Copper (Cu) mempunyai nomor atom 29, berat atom 63,54, titik cair 1083 ºC, titik didih 2595 ºC dan densitas 8,96. Keberadaan tembaga yang tinggi dapat menyebabkan korosi pada besi dan alumunium. Tembaga (Cu) merupakan logam yang banyak di jumpai pada perairan alami (Boney 1989 in Effendi 2003). Secara umum logam tembaga di lingkungan perairan berada dalam bentuk ion, baik sebagai pasangan ion ataupun dalam bentuk ion tunggal. beberapa terdapat dalam bentuk tidak larut (berikatan dengan partikulat koloid, agregat atau hidroksida logam, ikatan kompleks dengan partikulat tersuspensi). Alkalinitas, kesadahan dan pH adalah beberapa faktor yang menentukan proporsi termbaga larut dan tidak larut (Richey and Roseboom 1978).
Sumber Tembaga
Beberapa sumber tembaga adalah: Chalcopyrite (CuFeS2), Copper Sulfida
(CuS2), malachite [Cu2(CO3)(OH)2], dan Azurite [Cu3(CO3)2(OH)2]. Tembaga
(Cu) merupakan logam berat yang banyak digunakan dalam industri metalurgi, tekstil, elektronika dan juga digunakan dalam pembuatan cat anti karat (anti fouling) (moore 1991 in Effendi 2003). Dalam bidang pertanian tembaga banyak digunakan untuk bahan pestisida seperti algasida dan pengendalian makro-invertebrata, selain itu juga digunakan dalam bahan pengawet kayu, pengolahan air, bakterisidal, industri lem, bangunan dan bahan konstruksi (US-EPA 2008). Berikut jenis kegiatan industri lain yang menghasilkan Tembaga sebagai limbah buangan berdasarkan parameter uji dalam pemantauan limbah buangan.
Tabel 3. Jenis Industri dengan tembaga sebagai parameter uji wajib.
Jenis Industri Parameter uji
Soda/klor pH, TSS, Cl2 tersisa, Cu, Pb, Zn, Cr, Ni, Hg.
Pelapisan Logam pH, TSS, CN, krom total, Cr6+, Cu, Zn, Ni, Cd, Pb
Cat pH, BOD, TSS, Hg, Zn, Pb, Cu, Cr6+,Ti, Cd, fenol, minyak dan lemak
Sumber : Kepmen LH no.51 th 1995
Toksisitas Tembaga
pada dosis akut tembaga terhadap ikan air tawar, mempunyai hubungan terhadap gangguan osmoregulasi pada insang ikan dan memperlihatkan penurunan penyerapan sodium pada insang ikan di ikuti terjadinya kematian karena penurunan kandungan sodium dalam darah, Hasil penelitian ini di dukung oleh pernyataan yang di keluarkan US-EPA (2008) bahwa penyebab utama dari toksisitas tembaga untuk ikan dan invertebrata air adalah melalui pengikatan tembaga pada membran insang, yang menyebabkan kerusakan dan mengganggu proses osmoregulasi. Moore (1991) in Effendi (2003) mengatakan Toksisitas Tembaga (EC50) bagi ikan-ikan air tawar biasanya berkisar antara 0,02-1,0 mg/l
Tembaga diperlukan dalam oksidasi Cytochrome dan pigmen hemocyanin (Hutabarat and Evans 1985). Selain itu Sorensen (1991) pula mengatakan bahwa tembaga adalah elemen esensial dan bagian dari sekitar 30 enzim glicoprotein (co: oksidasi amin, ceruloplasmin, oksidase sitokrom, beta-hidroksilase dopamine, feroksidase, peroksidase, dismutase superoksida, tyrosinase, dll). Pada enzim oksidatif, tembaga terlibat dalam hidrogen peroksida yang berguna sebagai peluruh substansi organik dan produksi energi. Tembaga juga dapat meningkatkan absorption Fe dari jaringan kedalam plasma, selain itu membantu memelihara
mielin dalam sistem syaraf, pembatas α-globulin (seruloplasmin) di dalam darah. Namun ketika level akumulasi tembaga dalam organisme mencapai kepekatan kadar letal maka akan bersifat toksik.
Efek pada pertumbuhan
Pertumbuhan adalah pertambahan ukuran panjang atau berat dalam satu ukuran waktu. Pertumbuhan merupakan proses biologi yang kompleks, dimana banyak faktor yang mempengaruhinya. Faktor yang mempengaruhi pertumbuhan dibagi menjadi dua yaitu faktor dalam dan faktor luar. Faktor dalam adalah faktor yang sukar untuk dikontrol seperti keturunan (genetik), jenis kelamin, parasit/penyakit (Effendie 2002) serta umur kedewasaan (Moyle and Cech 2004) dll. Sedangkan faktor luar seperti ketersediaan makanan, lingkungan (suhu, DO, pH, dll).
Keberadaan tembaga di dalam perairan dalam jumlah yang cukup tinggi mengakibatkan pertumbuhan ikan terganggu seperti yang teramati dalam penelitian Ali et al., (2003) ia juga melaporkan bahwa laju pertumbuhan spesifik (bobot) ikan yang di beri paparan tembaga menurun secara signifikan dibandingkan dengan kontrol, penurunan juga linier berkorelasi dengan peningkatan konsentrasi tembaga dalam air. Hasil yang sama juga di laporkan dalam penelitian Parveen and Javed (2010), Fonseca et al. (2009), dan Nekoubin et al. (2012)
Faktor yang Mempengaruhi Biokonsentrasi Tembaga Suhu
kehidupan biota didalam suatu perairan (Odum 1996). Secara langsung pengaruh suhu menentukan kehadiran spesies akuatik, mempengaruhi pemijahan, penentasan, aktivitas dan pertumbuhan organisme. Pada suhu normal, difusi oksigen berjalan dengan baik sehingga biota yang ada di dalam perairan tersebut dapat melakukan respirasi, metabolisme, makan dan kegiatan fisiologis lainnya dengan baik.
Peningkatan suhu dapat menyebabkan peningkatan kecepatan metabolisme dan respirasi biota air dan selanjutnya meningkatkan konsumsi oksigen, dimana peningkatan suhu perairan 10ºC menyebabkan terjadinya peningkatan konsumsi oksigen oleh organisme akuatik sekitar 2-3 kali lipat dan juga meningkatkan konsumsi oksigen oleh mikroba untuk mendekomposisi bahan organik. Oleh karena itu keberadaan oksigen tidak mencukupi kebutuhan organisme akuatik untuk melakukan metabolisme dan respirasi (Effendi 2003), lebih lanjut Kristanto (2004) menambahkan beberapa akibat jika terjadi naiknya suhu air diantaranya menigkatkan kecepatan reaksi kimia, Menurunnya jumlah oksigen terlarut dalam air, Menganggu kehidupan ikan dan hewan air lainnya, jika batas suhu yang mematikan terlampaui, ikan dan hewan air lainnya mungin akan mati.
Suhu merupakan salah satu parameter untuk mempelajari transformasi dan penyebaran polutan yang masuk ke lingkungan (Mukhtasor 2007). Connell (1995) mengatakan, dalam studi akumulasi, hubungan akumulasi terhadap suhu menunjukan dampak yang signifikan terhadap jumlah logam dalam biota. Sejumlah penelitian menunjukan bahwa secara umum, konsentrasi logam terakumulasi meningkat seiring dengan meningkatnya suhu, hal ini mungkin disebabkan pengaruh peningkatan kecepatan metabolisme mahluk hidup dan juga pengaruh suhu diperkirakan melibatkan mekanisme pengangkutan ion pada permukaan membran. Hasil penelitian Lemus and Chung (1999) mengenai logam berat tembaga, bahwa tembaga lebih beracun dalam suhu yang lebih tinggi. Ini sekaligus membuktikan pernyataan Connell (1995).
Derajat Keasaman (pH)
Nilai pH suatu perairan mencirikan keseimbangan antara asam dan basa dalam air merupakan konsentrasi ion hydrogen dalam larutan. Effendi (2003) menyebutkan pH adalah nilai yang menunjukan aktivitas ion hidrogen dalam air (dalam kadar molar) dan dinyatakan sebagai :
pH = Log [1/H+] atau pH = - Log [H+]
merupakan fungsi dari kandungan CO2 yang terlarut dalam air. Kadar CO2 akan berkurang oleh kegiatan fotosintesis dan akan bertambah karena adanya kegiatan respirasi. Effendi (2003) berpendapat nilai pH ideal untuk perairan adalah 6,5-8,5. Organisme perairan memiliki kemampuan yang berbeda dalam mentolerir pH lingkungan perairannya. Kematian lebih sering diakibakan karena pH yang rendah dibandingkan pH tinggi. Sebagian besar biota akuatik sensitif terhadap perubahan pH serta menyukai pH berkisar antara 7-8,5. Berikut pengaruh pH air terhadap kehidupan ikan budidaya
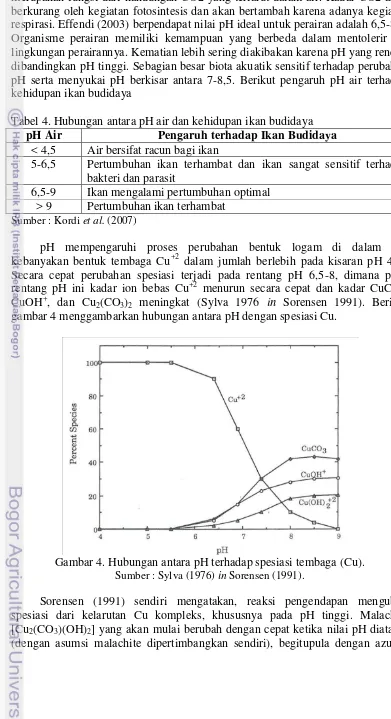
Tabel 4. Hubungan antara pH air dan kehidupan ikan budidaya pH Air Pengaruh terhadap Ikan Budidaya
< 4,5 Air bersifat racun bagi ikan
5-6,5 Pertumbuhan ikan terhambat dan ikan sangat sensitif terhadap bakteri dan parasit
6,5-9 Ikan mengalami pertumbuhan optimal > 9 Pertumbuhan ikan terhambat
Sumber : Kordi et al. (2007)
pH mempengaruhi proses perubahan bentuk logam di dalam air. kebanyakan bentuk tembaga Cu+2 dalam jumlah berlebih pada kisaran pH 4–9. Secara cepat perubahan spesiasi terjadi pada rentang pH 6,5-8, dimana pada rentang pH ini kadar ion bebas Cu+2 menurun secara cepat dan kadar CuCO3,
CuOH+, dan Cu2(CO3)2 meningkat (Sylva 1976 in Sorensen 1991). Berikut
gambar 4 menggambarkan hubungan antara pH dengan spesiasi Cu.
Gambar 4. Hubungan antara pH terhadap spesiasi tembaga (Cu).
Sumber : Sylva (1976) in Sorensen (1991).
Sorensen (1991) sendiri mengatakan, reaksi pengendapan mengubah spesiasi dari kelarutan Cu kompleks, khususnya pada pH tinggi. Malachite [Cu2(CO3)(OH)2] yang akan mulai berubah dengan cepat ketika nilai pH diatas 6
[Cu3(CO3)2(OH)2] yang akan mulai berubah cepat ketika nilai pH berada diantara
6,2 dan 6,8.
pH juga berpengaruh terhadap toksisitas suatu senyawa kimia seperti logam, pernyataan ini didukung oleh Kumar and Hader (1999) yang mengatakan bahwa pH sangat mempengaruhi kandungan logam berat di suatu perairan, diperairan asam konsentrasi logam berat didalam tubuh ikan lebih tinggi dibandingkan di perairan netral dan perairan basa, pernyataan ini didukung oleh hasil penelitian Shaw (1974) in Richey and Roseboom (1978) yang menunjukan perbandingan kandungan tembaga pada pH 6,5 dan 7,4. dia menemukan 8 sampai 29 persen ion tembaga menurun pada pH yang lebih tinggi. Sedangkan penelitian Richey and Roseboom (1978) sendiri yang membuktikan bahwa pH yang tinggi mengurangi jumlah tembaga terlarut. Namun perlu diketahui, Arnold et al. (2005) in Martins and Bianchini (2008) mengingatkan bentuk Tembaga lainnya seperti CuOH+ perlu diperhatikan ketika pH meningkat di atas 7,5.
Oksigen Terlarut (DO)
Oksigen (O2) adalah gas yang sangat dibutuhkan bagi kehidupan di muka
bumi. Kadar oksigen di udara adalah sekitar 20.964 % nomor kedua terbesar setelah N2. Oksigen digunakan mahluk hidup untuk respirasi. Tidak terkecuali
biota akuatik, sumber oksigen didalam air dapat berasal dari kegiatan fotosintesis maupun dari difusi langsung dari udara. Jumlah gas oksigen yang ditemukan terlarut di dalam air disebut oksigen terlarut (DO) yang biasanya dinyatakan dalam satuan mg/l. Jumlah oksigen yang terlarut ini tergantung pada suhu, tekanan atmosfir dan turbulensi air. Kadar oksigen terlarut dapat berfluktuasi secara harian (diurnal) dan musiman tergantung pada pencampuran, pergerakan, massa air, aktivitas fotosintesis, respirasi dan limbah yang masuk ke suatu perairan (Effendi 2003). Selain itu kelarutan oksigen juga dipengaruhi oleh suhu, jika suhu suatu perairan tinggi maka kelarutan oksigen akan rendah. Distribusi vertikal O2 dalam suatu perairan adalah temperatur, tekanan hidrostatik,
fotosintesis dan respirasi, biodegradasi.
Dekomposisi bahan organik dan oksidasi bahan organik dapat mengurangi kadar oksigen di perairan hingga mencapai nol (anaerob), kebutuhan oksigen sangat dipengaruhi oleh suhu. Keberadaan limbah yang masuk kedalam perairan akan menurunkan kadar oksigen terlarut. Keberadaan logam berat yang berlebih diperairan mempengaruhi sistem respirasi organisme akuatik sehingga pada saat kadar oksigen terlarut rendah dan terdapat logam berat dengan konsentrasi tinggi, organisme akuatik lebih menderita (Tebbut 1992 in effendi 2003).
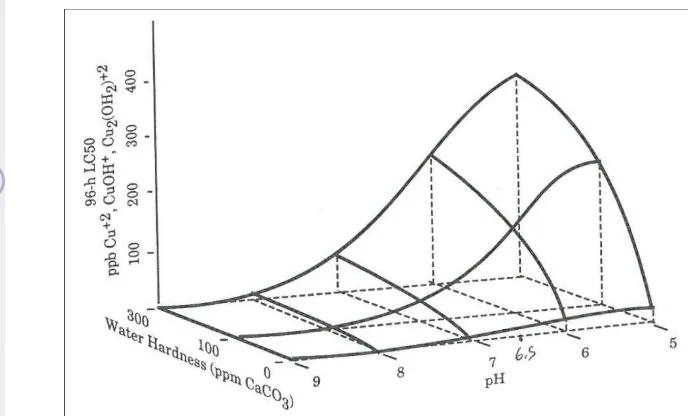
Kesadahan
dengan toksisitas tembaga (Cu). Berikut gambaran mengenai hubungan kesadahan, pH dengan toksisitas tembaga (Cu).
Gambar 5. Hubungan antara kesadahan, pH dengan toksisitas tembaga (Cu).
Sumber : Sorensen 1991.
Kesadahan biasanya dinyatakan dengan satuan yaitu mg/liter CaCO3. Pada
perairan tawar, kation divalen yang paling berlimpah adalah kalsium dan magnesium, sehingga kesadahan pada dasarnya ditentukan oleh jumlah kalsium dan magnesium. Kalsium dan magnesium berikatan dengan anion penyusun alkalinitas, yaitu bikarbonat dan karbonat. Sebenarnya terdapat kation lain yang memberikan kontribusi pada nilai kesadahan total yaitu stronsium, besi valensi dua dan mangan namun peranannya relatif kecil (Effendi 2003).
Pada perairan, sumber kesadahan berasal dari kontak air dengan tanah dan bebatuan. Larutnya ion-ion penyusun kesadahan lebih banyak disebabkan oleh aktivitas bakteri didalam tanah, yang banyak mengeluarkan karbondioksida (CO2). Keberadaan karbon dioksida membentuk kesetimbangan dengan asam
karbonat. Pada kondisi relatif asam, senyawa-senyawa karbonat yang terdapat didalam tanah dan batuan kapur yang sebelumnya tidak larut berubah menjadi senyawa bikarbonat yang bersifat larut. Kesadahan yang tinggi dapat pula menghambat sifat toksik dari logam berat karena kation-kation penyusun kesadahan (kalsium dan magnesium) membentuk senyawa kompleks dengan logam berat tersebut. (Effendi 2003). Lloyd (1975) in Richey and Roseboom (1978) menunjukkan bahwa kesadahan berefek pada toksisitas tembaga.
Alkalinitas
Penyusun alkalinitas perairan adalah anion bikarbonat (HCO3-), karbonat
(CO32-), dan hidroksida (OH-). Borat (H2BO3-), silikat (HSiO3-), fosfat (HPO42-
dan H2PO4-), sulfida (HS-) dan amonia (NH3) juga memberkan kontribusi
terhadap alkalinitas, namun pembentuk alkalinitas yang utama adalah bikarbonat, karbonat, dan hidroksida. Bikarbonat, karbonat dan asam karbonat merupakan sumber utama karbon anorganik di perairan. karbon anorganik di perairan dapat berasal dari beberapa sumber, yaitu atmosfer, batuan karbonat, siklus karbon dan sumber allocthonous (dari luar perairan). selain berasal dari mineral-mineral yang terdapat didalam tanah, karbonat dan bikarbonat dapat berasal dari produk dekomposisi bahan organik oleh mikroba. Diantara ketiga ion tersebut, bikarbonat paling banyak terdapat pada perairan alami. Senyawa kalsium karbonat (CaCO3)
merupakan senyawa yang memberi kontribusi terhadap nilai alkalinitas dan nilai kesadahan diperairan tawar, kelarutan kalsium karbonat menurun dengan meningkatnya suhu dan meningkat dengan keberadaan karbon dioksida (CO2),
karena akan bereaksi membentuk kalsium bikarbonat (Ca(HCO3)2) yang memiliki
daya larut lebih tinggi dibandingkan dengan kalsium karbonat (CaCO3) (Effendi
2003).
Dalam kondisi basa, ion bikarbonat akan membentuk ion karbonat dan melepaskan ion hidrogen yang bersifat asam, sehingga keadaan menjadi netral. Sebaliknya bila keadaan terlalu asam, ion karbonat dalam air akan mengalami hidrolisa menjadi ion bikarbonat dan melepaskan hidrogen oksida yang bersifat basa, sehingga keadaan kembali netral (Kordi et al. 2007)
Alkalinitas dapat dijadikan sebagai parameter yang menentukan sifat dan keberadaan dari logam berat. Dalam perairan alami tembaga dapat berikatan komplek dengan ion karbonat dan hidroksida, hasilnya jumlah ion bebas Cu+2 dalam konsentrasi rendah.
METODELOGI PENELITIAN
Waktu dan Lokasi
Penelitian dilakukan di Laboratorium Instalasi Riset Lingkungan Perikanan Budidaya dan Toksikologi, Balai Penelitian dan Pengembangan Budidaya Air Tawar, Cibalagung, Bogor. Contoh sedimen berasal dari waduk Cirata. Parameter yang diamati meliputi fisika-kimia air, logam berat pada sedimen, air dan ikan Nila. Kegiatan dilaksanakan selama 8 minggu dimulai bulan Mei 2011 hingga Juli 2011. Analisa sampel dilakukan di laboratorium Balai Penelitian Tanah, Bogor.
Alat, Bahan dan Kegunaan
dokumentasi. Alat-alat laboratorium diantaranya lemari pendingin, selang aerasi, batu aerasi, kantong plastik ukuran 8, 7 x 13 cm, waring, paralon, plastik fiber, dan timbangan digital.
Tabel 5.Parameter dan alat yang digunakan untuk analisis kualitas air
Parameter Satuan Alat
Fisika air
Suhu ºC Thermometer
Kimia air
pH - pH-meter
Oksigen terlarut (DO) Mg/l DO-meter
Alkalinitas Mg/l CaCO3
Kesadahan Mg/l CaCO3
Logam
Tembaga (Cu) Mg/l AAS
Rancangan Penelitian Kegiatan Lapang
Kegiatan lapang adalah kegiatan awal (pendahuluan) sebelum penelitian utama dilakukan. Kegiatan lapang dilakukan pada bulan Mei 2011. Kegiatan berupa pengambilan sampel sedimen pada lokasi daerah padat keramba jaring apung (KJA) dengan titik kordinat 06.74056º lintang selatan dan 107.28776º bujur timur.
Kegiatan Laboratorium
Kegiatan Laboratorium dilaksanakan di Laboratorium Instalasi Riset Lingkungan Perikanan Budidaya dan Toksikologi, Balai Penelitian dan Pengembangan Budidaya Air Tawar, Cibalagung, Bogor. kegiatan laboratorium berupa pemeliharaan ikan nila di akuarium berukuran 70 x 40 x 45 Cm yang telah diberi perlakuan berupa perbedaan ketebalan lapisan sedimen 5 cm, 10 cm, dan 15 cm dengan 3 ulangan setiap perlakuanya. Ikan dimasukan kedalam akuarium 3 hari sebelum penelitian dimulai agar dapat beradaptasi dengan lingkungan baru di dalam akuarium. Media pemeliharaan diisikan air sumur dengan volume 50 liter dan dipertahankan tetap dengan melakukan penyiponan dan penambahan air 10% per hari. Padat tebar ikan sebanyak 25 ekor per akuarium yang di tempatkan di dalam waring.
Gambar 6. Desain akuarium penelitian Pengukuran parameter lingkungan
Pengukuran parameter kualitas air (Suhu, DO, pH, Kesadahan, dan alkalinitas) dilakukan sebanyak tiga kali yaitu pada minggu ke-1 (awal), minggu ke-4, dan minggu ke-8 (akhir). Sedangkan pengukuran logam berat Cu dilakukan pada minggu ke-1 (awal) dan minggu ke-8 (akhir).
Analisis dan Penyajian Data Analisis Deskriptif
Analisi deskriptif dilakukan untuk menginterpretasikan hasil data yang di dapat dan untuk membandingkan antara nilai yang didapatkan dari hasil analisis dengan standar baku mutu yang telah ditetapkan. Kriteria baku mutu untuk air tawar menggunakan Peraturan Pemerintah No. 82 Tahun 2001, Tentang Pengelolaan Kualitas Air dan Pengendalian Pencemaran Air. Sedangkan untuk baku mutu sedimen memakai pedoman kualitas sementara sedimen yang dikeluarkan US-EPA (United State-Environmental Protection Agency) region V in Lismana (2006), Reseau National d’Observation (1981) in Anggraini (2007) dan juga baku mutu yang di keluarkan oleh Canadian Council of Minister of Environmental (1999). hal ini dikarenakan di Indonesia sendiri belum ada regulasi mengenai baku mutu untuk sedimen. Baku mutu yang digunakan untuk organisme sendiri menggunakan peraturan yang dikeluarkan WHO (1996) dan SK Dirjen Pengawasan Obat dan Makanan, Departemen Kesehatan Republik Indonesia no : 03725/B/SK/1989.
Analisis Statistik
Perlakuan yang di berikan ialah perbedaan ketebalan lapisan sedimen selama 8 minggu masa percobaan.Bentuk umum dari model aditif adalah :
Yij = µ + τi + εij
keterangan : Yij = data pada perlakuan ke-i dan ulangan ke-j
µ = nilai tengah data (rataan umum) τi = pengaruh perlakuan ke-j
εij= kesalahan percobaan pada perlakuan ke-j dan ulangan ke-i
Koefesien Korelasi
Koefesien Korelasi digunakan untuk mengetahui keeratan hubungan antara pemberian perlakuan dengan kandungan logam berat Cu didalam air, sedimen dan ikan Nila dan nilainya berkisar antara -1 dan 1 (-1 ≤ r ≤ 1) (Mattjik and Sumertajaya, 2002). adapun koefesien korelasinya dihitung berdasarkan rumus sebagai berikut :
– –
–
–
Keterangan :
r : Koefesien Korelasi
Sxy : Sebaran nilai pengamatan x dan y
Sx2 : Keragaman nilai x
Sy2 : Keragaman nilai y
Laju pertumbuhan spesifik
Laju pertumbuhan spesifik menunjukan presentase pertumbuhan harian ikan selama pemeliharaan. Bobot rata-rata awal ditimbang sebelum perlakuan dan diukur pula bobot rata-rata saat sampling dan panen. Model laju pertumbuhan spesifik menurut Ricker (1975) :
SGR = –
keterangan :
Wt = bobot rata-rata ikana pada waktu ke-t (gr)
W0 = bobot rata-rata ikan pada waktu ke-0 (gr) ∆t = Lama pemeliharaan/pengamatan (hari)
Faktor Biokonsentrasi
Biokonsentrasi dapat dilihat sebagai suatu proses kesetimbangan yang melibatkan pengambilan suatu senyawaan antara biota dengan lingkungan disekitarnya. Faktor biokonsentrasi adalah angka banding antara konsentrasi mahluk hidup atau biota (Cb) dengan konsentrasi lingkungan (Cw) (Connell 1995). Untuk melihat perbandingan tingkat biokonsentrasi faktor logam berat pada ikan dengan air dan ikan dengan sedimen, digunakan rumus :
keterangan :
Kb : Faktor Biokonsentrasi Cb : Konsentrasi di dalam biota Cw : Konsentrasi di dalam air/sedimen
HASIL DAN PEMBAHASAN
Gambaran umum Waduk Cirata
Waduk Cirata merupakan salah satu waduk serial di sepanjang aliran sungai Citarum. Berdasarkan posisi dari hulu ke hilir, Waduk Cirata terletak pada posisi kedua setelah Waduk Saguling di bagian hulu dan sebelum Waduk jatiluhur di bagian hilir. Waduk cirata terletak di tiga kabupaten yaitu Cianjur, Bandung dan Purwakarta, Propinsi Jawa Barat. Waduk Cirata selesai dibangun pada tahun 1988 dengan volume air pada waktu normal 2.160.000.000 m3 dan luas 6200 ha, kedalaman rata-rata 34,9 m (Prihadi 2004 in Purnamawati 2009). berdasarkan umurnya merupakan waduk yang paling muda dibandingkan Waduk Jatiluhur yang mulai beroperasi tahun 1967, dan Waduk Saguling beroperasi pada tahun 1985 (Mardiana 2007).
Hasil
Konsentrasi Tembaga (Cu) Pada Sedimen, Air, dan Ikan
Zat kimia yang masuk ke dalam suatu perairan akan berakhir menjadi sedimen. Logam yang berikatan dengan partikulat tersuspensi akan mengendap ke dasar perairan. Dibandingkan dengan air yang berada di atasnya, sedimen dapat mengandung konsentrasi logam yang sangat tinggi. konsentrasi tembaga pada sedimen penelitian dapat dilihat pada Gambar 7.
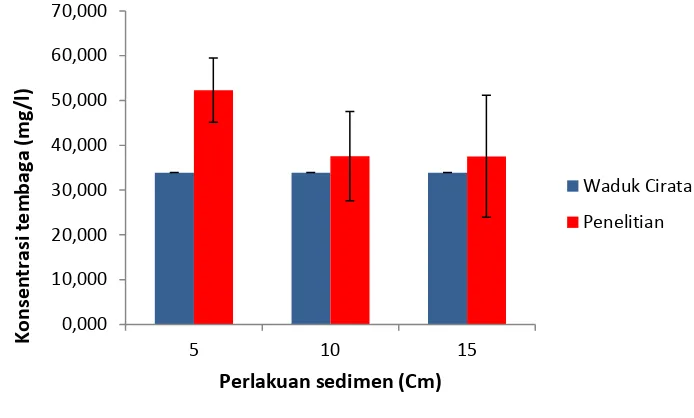
Gambar 7. Konsentrasi Tembaga (Cu) pada Sedimen.
Berdasarkan Gambar 7, diketahui konsentrasi tembaga pada sedimen di Waduk Cirata hasil pengukuran sebesar 33,900 mg/l sedangkan konsentrasi tembaga pada akhir penelitian lebih tinggi daripada konsentrasi tembaga waduk cirata baik ketebalan sedimen 5 cm, 10 cm, dan 15 cm. pada sedimen penelitian konsentrasi tembaga tertinggi pada perlakuan ketebalan sedimen 5 cm yaitu 52,300 mg/l, diikuti perlakuan ketebalan sedimen 10 cm yaitu sebesar 37,567 mg/l, sedangkan peningkatan terendah pada ketebalan sedimen 15 cm sebesar 37,533 mg/l.
Hasil analisis ANOVA pada selang kepercayaan 95%, menunjukan bahwa perlakuan ketebalan sedimen tidak memberikan pengaruh terhadap kandungan logam tembaga di dalam sedimen (Fhit > Ftab). Perlakuan baru memberikan pengaruh pada selang kepercayaan 73%. Hasil uji korelasi didapat nilai koefesien korelasi (r) sebesar 0,8670 (Lampiran 8).
Gambar 8. Konsentrasi tembaga (Cu) pada Air
Konsentrasi tembaga yang terukur dalam air akhir penelitian, baik pada akuarium dengan perlakuan ketebalan sedimen 5 cm, 10 cm, dan 15 cm yaitu sebesar 0,003 mg/l (Gambar 8). Selain itu konsentrasi tembaga pada air penelitian lebih rendah daripada konsentrasi tembaga pada air di Waduk Cirata yaitu sebesar 0,02 mg/l. Perhitungan ANOVA pada selang kepercayaan 95%, diperoleh hasil bahwa perlakuan ketebalan lapisan sedimen tidak memberikan pengaruh terhadap konsentrasi logam berat tembaga pada air (Fhit > Ftab). Nilai koefesien korelasi (r) yang di dapat sebesar 4,5E-08 (Lampiran 9).
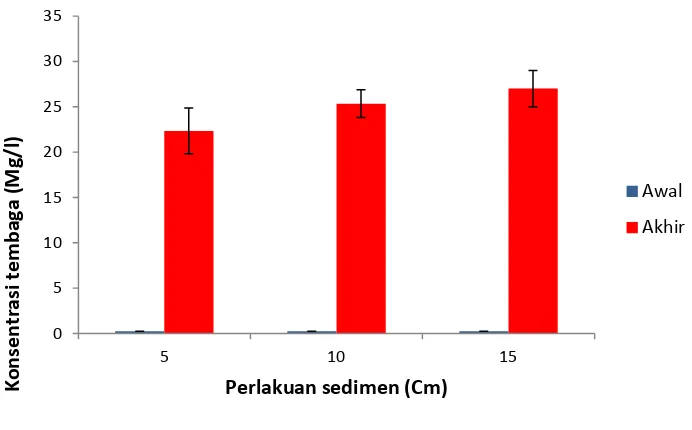
Ikan adalah salah satu organisme akuatik yang dapat mengakumulasi konsentrasi logam yang cukup besar dari dalam massa air, oleh karena itu ikan sering di gunakan sebagai hewan uji dalam penelitian. Konsentrasi tembaga (Cu) pada daging ikan nila setelah penelitian menunjukan peningkatan yang sangat signifikan. Konsentrasi tembaga pada ikan awal penelitian yaitu sebesar 0,25 mg/l sedangkan konsentrasi tembaga rata-rata pada ikan setelah penelitian sebesar 24,889 mg/l. Konsentrasi tembaga tertinggi teramati pada ikan yang dipelihara dengan perlakuan ketebalan lapisan sedimen 15 cm, yaitu sebesar 27 mg/l sedangkan konsentrasitembaga terendah teramati pada ikan yang di pelihara dengan perlakuan ketebalan lapisan sedimen 5 cm, yaitu sebesar 22,333 mg/l. (Gambar 9)
0,000 0,005 0,010 0,015 0,020 0,025
5 10 15
K
onsent
ras
i
tem
baga
(Mg/
l)
Perlakuan sedimen (Cm)
Gambar 9. Konsentrasi Tembaga (Cu) pada ikan.
Dari hasil perhitungan ANOVA pada selang kepercayaan 93%, diperoleh hasil bahwa perlakuan ketebalan lapisan sedimen memberikan pengaruh yang nyata terkait dengan konsentrasi logam berat tembaga pada ikan (Fhit < Ftab). Dari hasil uji korelasi didapat nilai koefesien korelasi (r) = 0,9867 (Lampiran 7).
Faktor Biokonsentrasi
Faktor biokonsentrasi (BCF) dapat mengukur kemampuan suatu biota atau organisme air dalam mengakumulasi bahan pencemar yang berada di sekitar lingkungan biota itu sendiri. Tabel 6 adalah indeks faktor biokonsentrasi menurut Van Esch 1977 in Suprapti 2008.
Tabel 6. Indeks faktor biokonsentrasi
Nilai BCF Keterangan
BCF < 100 Polutan memiliki sifat akumulatif rendah BCF = 100-1000 Polutan memiliki sifat akumulatif sedang BCF > 1000 Polutan memiliki sifat akumulatif Tinggi
Sumber : Van Esch 1977 in Suprapti 2008
Terdapat dua kompartemen lingkungan bagi ikan penelitian yaitu air dan sedimen. Faktor biokonsentrasi tembaga antara sedimen dengan ikan adalah angka banding antara konsentrasi tembaga pada ikan dan konsentrasi tembaga pada sedimen. Nilai faktor biokonsentrasi antara sedimen dengan ikan sebesar 0,607 (Lampiran 13). Sedangkan faktor biokonsentrasi antara air dengan ikan adalah angka banding antara konsentrasi tembaga pada ikan dengan konsentrasi tembaga pada air. Nilai faktor biokonsentrasi antara air dengan ikan sebesar 7467 (Lampiran 13). jika dibandingkan dengan Indeks Faktor Biokonsentrasi menurut Van Esch (1977) in Suprapti (2008) (Tabel 6) maka faktor biokonsentrasi antara sedimen dengan ikan menunjukan sifat akumulatif yang rendah (BCF<100).
sedaangkan faktor biokonsentrasi antara air dengan ikan menunjukan sifat akumulatif yang tinggi (BCF>1000)
Faktor yang mempengaruhi biokonsentrasi tembaga Suhu
Suhu merupakan salah satu faktor fisika yang sangat penting bagi kehidupan organisme perairan. setiap organisme memiliki respon dan toleransi berbeda dengan perubahan suhu. Peningkatan suhu berdampak pada meningkatnya kecepatan metabolisme dan peningkatan konsumsi oksigen. Selain mempengaruhi kehidupan organisme juga berpengaruh terhadap parameter lainya (kimia).
Hasil pengukuran selama penelitian perubahan suhu tidak terlalu jauh dengan rentang suhu paling luas pada perlakuan sedimen 5 cm dengan rentang nilai terendah sebesar 24,7 ºC dan nilai tertinggi sebesar 26,7 ºC. Pada perlakuan sedimen 10 cm memiliki rentang yang paling kecil dengan suhu berkisar antara 25,6 ºC hingga 26,1 ºC. Sedangkan perlakuan sedimen 15 cm memiliki rentang suhu berkisar 25,1ºC hingga 26,4ºC. Nilai suhu yang didapat selama penelitian menunjukan suhu relatif konstan. Menurut Kordi et al. (2007) suhu optimal untuk ikan nila berkisar antara 25-33 ºC, berdasarkan hal tersebut, maka suhu air di dalam akuarium penelitian sangat mendukung kehidupan ikan nila di dalamnya.
Oksigen Terlarut (DO)
Oksigen (O2) adalah gas yang sangat dibutuhkan bagi kehidupan di muka
bumi. Kelarutan oksigen merupakan faktor pembatas, sehingga apabila ketersediaannya di dalam air tidak mencukupi kebutuhan biota maka segala macam aktivitas biota terhambat. Kadar oksigen terlarut dapat berfluktuasi secara harian (diurnal), pergerakan (turbulensi), aktivitas fotosintesis, dan respirasi, selain itu kelarutan oksigen juga dipengaruhi oleh temperatur (suhu). Hasil pengukuran kandungan oksigen terlarut pada perlakuan sedimen 5 cm berkisar antara 1,76 - 4,86 mg/l. tidak berbeda jauh dengan kandungan oksigen terlarut pada perlakuan 10 cm yang berkisar antara 1,82-4,17 mg/l. Dan pada perlakuan sedimen 15 cm kandungan oksigen terlarut sebesar 2,1-6,03 mg/l. Jumlah kandungan oksigen terlarut pada perlakuan 5 cm, 10 cm, dan 15 cm tergolong rendah, hal ini mungkin disebabkan tingginya aktivitas respirasi baik oleh ikan dan juga oleh aktivitas dekomposisi bahan organik. Menurut Peraturan Pemerintah RI no.82 tahun 2001 kadar minimun oksigen terlarut untuk kegiatan perikanan adalah sebesar 3-4 mg/l.
Derajat Keasaman (pH)
kondisi stabil. Ketiga perlakuan mengalami penurunan pH dibawah 6,5. pH terendah terjadi pada akuarium perlakuan sedimen 10 cm dengan nilai pH 6,01. Penurunan pH jg terjadi pada akuarium perlakuan sedimen 5 cm dan 15 cm dengan nilai pH masing-masing 6,13 dan 6,03. nilai pH yang didapat selama penelitian bersifat asam karena pH berada dibawah 7, namun menurut Kordi et al. (2007) ikan-ikan budidaya akan berhasil baik dengan pH 6,5-9
Kesadahan
Nilai kesadahan (hardness) menggambarkan kation logam divalen (valensi dua). kation divalen yang paling berlimpah adalah kalsium dan magnesium, sehingga kesadahan pada dasarnya ditentukan oleh jumlah kalsium dan magnesium. Kalsium dan magnesium berikatan dengan anion penyusun alkalinitas, yaitu bikarbonat dan karbonat. Nilai kesadahan di ketiga perlakuan berbeda-beda. Pada perlakuan 5 cm nilai kesadahan berkisar antara 45,67-76,85 mg/l, perlakuan 10 cm berkisar antara 42,63-84,94 mg/l, dan perlakuan 15 cm berkisar antara 42,63-83,94 mg/l. Tabel 7 adalah klasifikasi tingkat kesadahan menurut Andrew et al. (1988) in Kordi et al. (2007).
Tabel 7. Klasifikasi kesadahan
Istilah Kisaran konsentrasi (Mg/l CaCO3)
Soft (lunak) 0 – 50
Moderately soft (agak lunak) 50 – 100
Slightly hard (sedang) 100 – 200
Moderately hard (agak keras) 200 – 300
Hard (Keras) 300 – 450
Very hard (sangat keras) > 450
Sumber : Andrew et al. (1988) in Kordi et al. (2007)
Jika nilai kesadahan yang diperoleh di klasifikasikan berdasarkan klasifikasi menurut Andrew, et al., (1988), maka nilai kesadahan dari akuarium dengan perlakuan sedimen 5 cm 10 cm, dan 15 cm bersifat lunak-agak lunak (soft-moderately soft). Nilai kesadahan yang rendah disebabkan oleh larutnya ion-ion penyusun kesadahan disebabkan oleh aktivitas bakteri, yang banyak mengeluarkan karbondioksida (CO2). Keberadaan karbon dioksida membentuk
kesetimbangan dengan asam karbonat. Pada kondisi relatif asam, senyawa-senyawa karbonat yang terdapat didalam tanah yang sebelumnya tidak larut berubah menjadi senyawa bikarbonat yang bersifat larut.
Alkalinitas
Alkalinitas adalah kuantitas anion didalam air yang dapat menetralkan kation hidrogen. Alkalinitas juga di artikan sebagai kapasitas penyangga (Buffer capacity). Penyusun alkalinitas perairan adalah anion bikarbonat (HCO3-),
karbonat (CO32-), dan hidroksida (OH-). Diantara ketiga ion tersebut, bikarbonat
ketiga perlakuan ketebalan sedimen memiliki kisaran yang cukup luas, masing-masing perlakuan sedimen 5 cm 80,9 - 162,13 mg/l, perlakuan sedimen 10 cm 64,72 - 153,37 mg/l, dan perlakuan 15 cm 64,72 - 131,46 mg/l. Alkalinitas adalah salah satu dari beberapa faktor yang menentukan proporsi termbaga larut dan tidak larut (Richey and Roseboom 1978) Keberadaan ion karbonat dan hidroksida diperairan dapat beriklatan kompleks dengan logam tembaga, hasilnya jumlah ion bebas Cu+2 dalam konsentrasi rendah.
Laju pertumbuhan spesifik
Pertumbuhan adalah pertambahan ukuran panjang atau berat dalam satu ukuran waktu. lingkungan adalah salah satu faktor yang penting dalam proses pertumbuhan.
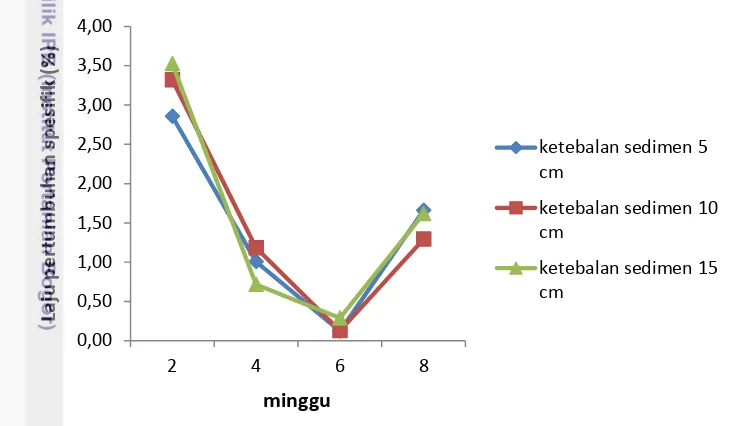
Gambar 10. Laju pertumbuhan ikan nila selama penelitian
Ikan yang digunakan dalam penelitian memiliki bobot awal sebesar 6,69 gr. Laju pertumbuhan spesifik ikan nila pada minggu ke-2 perlakuan ketebalan 5 cm, 10 cm, dan 15 cm berturut-turut sebesar 2,86%, 3,32%, dan 3,53%. Pengamatan pada minggu ke-4 laju pertumbuhan spesifik ketiga perlakuan menurun dan terus menurun hingga pengamatan minggu ke-6 menjadi 0,12%, 0,13%, dan 0,29%. pengamatan pada minggu ke-8 laju pertumbuhan spesifik ikan nila meningkat baik perlakuan ketebalan sedimen 5 cm, 10 cm, dan 15 cm yaitu berturut-turut sebesar 1,66%, 1,29%, dan 1,62%. (Gambar 10).
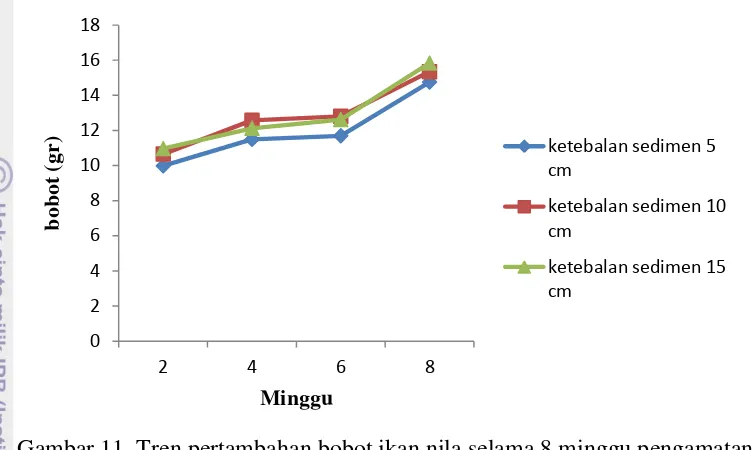
Pertambahan bobot ikan di ketiga perlakuan menunjukan peningkatan seiring dengan lamanya pengamatan. Pada minggu pengamatan ke-4 ikan pada perlakuan ketebalan sedimen 5 cm, 10 cm dan 15 cm, berturut-turut memiliki bobot sebesar 11,49 gr, 12,57 gr, dan 12,12gr, sedangkan pengamatan minggu ke-6 pertambahan bobot tidak terlalu signifikan beruturut-turut sebesar 11,ke-69 gr, 12,8 gr, dan 12,62 gr. Pertambahan bobot ikan penelitian kembali meningkat teramati
pada minggu ke-8. Gambar 11 adalah grafik tren pertambahan bobot ikan nila selama penelitian.
Gambar 11. Tren pertambahan bobot ikan nila selama 8 minggu pengamatan
Pembahasan
Sedimen adalah salah satu kompartemen lingkungan yang sangat penting. Kandungan logam tembaga pada sedimen penelitian memiliki konsentrasi yang tinggi. kandungan tembaga pada sedimen dengan ketebalan 5 cm memiliki konsentrasi tertinggi yaitu sebesar 52,300 mg/l di ikuti ketebalan sedimen 10 cm dan ketebalan sedimen 15 cm. konsentrasi tembaga pada penelitian lebih tinggi daripada konsentrasi tembaga waduk cirata.
Keberadaan tembaga pada sedimen yang tinggi pada Waduk Cirata diduga telah tercemar oleh bungan limbah, baik limbah industri seperti industri metalurgi, tekstil, elektronika dan juga digunakan dalam pembuatan cat anti karat (anti fouling), maupun limbah pertanian yang banyak digunakan untuk bahan pestisida seperti Algasida, Herbisida, molluscisida dan pengendalian makro-invertebrata. Berbagai limbah masuk ke dalam Waduk Cirata melalui sungai-sungai terutama sungai Citarum yang sebelumnya pula diketahui sepanjang DAS Citarum bermukim 11.255 juta penduduk dan sekitar lebih 1000 industri (Wangsaatmaja 2006 in Delinom and Marganingrum 2007), selain itu ia juga menemukan bahwa tutupan lahan di Citarum hulu berkurang 54%, pertanian menurun 55%, permukiman meningkat 23%, dan industri meningkat 86%.
Kandungan tembaga pada air penelitian memiliki konsentrasi yang sangat rendah yaitu sebebsar 0,003 mg/l baik pada perlakuan ketebalan sedimen 5 cm, 10 cm, dan 15 cm. rendahnya konsentrasi tembaga pada air penelitian diduga karena tembaga berikatan dengan partikulat-partikulat yang ada. seperti dikatakan oleh Connell (1995) yang mengatakan tembaga adalah salah satu logam yang paling mudah dihilangkan dari larutan dengan penyerapan pada partikulat tersuspensi dan diperkirakan sekitar 83% tembaga dalam lingkungan diserap ke beberapa bahan. Selain itu rendahnya konsentrasi tembaga di sebabkan karena adanya pergantian air sebanyak 10% perhari.
Berdasarkan Peraturan Pemerintah no.82 tahun 2001 tentang pengelolaan kualitas air dan pengendalian pencemaran air, menetapkan bahwa jumlah maksimum kandungan logam berat tembaga yang diperbolehkan didalam air tawar adalah 0,02 mg/l. Jelas bahwa kandungan logam berat tembaga di dalam air pada akuarium penelitian masih jauh dari nilai ambang batas yang telah ditetapkan.
Eneji et al (2011) mengatakan ikan telah di akui sebagai pengakumulasi polutan organik dan anorganik yang baik. Sehingga organisme ikan telah lama menjadi hewan uji dalam penelitian toksikologi. walau tembaga merupakan salah satu logam esensial yang dibutuhkan oleh manusia untuk metabolisme dalam hemoglobin, akan tetapi karena logam termbaga dapat terakumulasi di dalam jaringan tubuh, maka apabila konsentrasi logam ini besar akan bersifat racun.
konsentrasi tembaga rata-rata pada ikan setelah penelitian sebesar 24,889 mg/l. Konsentrasi tembaga tertinggi teramati sebesar 27 mg/l yaitu pada ikan yang dipelihara dengan perlakuan ketebalan lapisan sedimen 15 cm, sedangkan konsentrasitembaga terendah teramati sebesar 22,33 mg/l yaitu pada ikan yang di pelihara dengan perlakuan ketebalan lapisan sedimen 5 cm. hasil penelitian Nakayama et al. (2010) konsentrasi tembaga didalam daging dan hati ikan Oreochromis niloticus berbanding lurus dengan keberadaan tembaga di dalam sedimen di Danau Itezhi-thezi.
Bagi ikan sendiri keberadaan tembaga yang cukup tinggi di dalam lingkungan sekitar habitatnya dapat menjadi penghambat bagi pertumbuhan ikan yang seharusnya pertumbuhannya optimum menjadi terganggu (stressor). Kandungan rata-rata tembaga dalam ikan adalah 24,889 mg/l jumlah ini melebihi batas kadar maksimum yang di tetapkan SK Dirjen Pengawasan Obat dan Makanan, Departemen Kesehatan Republik Indonesia no : 03725/B/SK/1989 yaitu sebesar 20 mg/l, sedangkan WHO menetapkan batas aman toleransi pemasukan tembaga per-minggu, yaitu 12,5 µg/kg berat tubuh/hari.
and Javed (2010). Kenaikan laju pertumbuhan rata-rata pada minggu ke-8 diduga ikan nila telah beradaptasi dengan lingkungan sekitar.
Nilai faktor biokonsentrasi tembaga antara sedimen dengan ikan menunjukan sifat akumulatif rendah (BCF<100) yaitu sebesar 0,607. Ayling (1974) in Connell (1995) mengatakan sering kali faktor biokonsentrasi yang berasal dari sedimen bernilai kecil, hal ini disebabkan tingginya kandungan logam pada sedimen. Sedangkan nilai faktor biokonsentrasi antara air dengan ikan menunjukan sifat akumulatif tinggi (BCF>100) yaitu sebesar 7467. Connell (1995) mengatakan bahwa proses akumulasi dapat berupa akumulasi langsung terhadap ion tembaga yang larut, penelanan tembaga dengan partikulat kompleks tersuspensi dari lingkungan sekitarnya
Implikasi Pengelolaan
konsentrasi tembaga pada sedimen Waduk Cirata telah melebihi batas baku mutu, yang di duga karena tercemar oleh bungan limbah yang masuk melalui aliran-aliran air, tentu saja ini membuat keberadaan kegiatan budidaya ikan sangat riskan, karena berdasarkan hasil penelitian menunjukan keberadaan tembaga yang cukup tinggi di dalam tubuh ikan menunjukan terjadinya peristiwa akumulasi logam tembaga yang cukup tinggi didalam tubuh dari lingkungannya (sedimen/air). oleh karena itu pengelolaan waduk Cirata pun perlu di perhatikan, pengendalian sebagai upaya pengelolaan terpadu dalam Waduk Cirata maupun DAS Citarum, dimana penataan ruang, penerapan teknologi dan keterlibatan masyarakat memegang peranan penting selain upaya pemerintah dalam upaya manajemen lingkungan khususnya sedimen.
KESIMPULAN DAN SARAN
Kesimpulan
1. faktor biokonsentrasi air terhadap ikan menunjukan sifat akumulatif tinggi, konsentasi tembaga didalam air memberikan pengaruh secara langsung terhadap akumulasi pada organ tubuh ikan nila.
2. Keberadaan tembaga didalam lingkungan dan tubuh ikan nila menyebabkan laju pertumbuhan ikan nila menurun .
Saran
DAFTAR PUSTAKA
Ali A, Al-Ogaily S. M, Al-Asgah N. A, Gropp J. 2003. Effect of Sublethal Concentrations of Copper on the Growth Performance of Oreochromis niloticus. Blackwell Verlag : 0175-8659.
Anggraini D. 2007. Analisis Kadar Logam Berat Pb, Cd, Cu dan Zn pada air laut, sedimen dan Loka (Geloina coaxans) di Perairan Pesisir Dumai, Provinsi Riau. [TerhubungBerkala] [21 desember 2011.]
Amri K & Khairuman. 2008. Budidaya Ikan Nila Secara Intensif. Jakarta. PT Agromedia Pustaka. 102 hlm.
Anonim. 2009. Oreochromis niloticus (tilapia). [Terhubung Berkala] http://zipcodezoo.com/Animals/O/Oreochromis_niloticus/. [26 April 2011].
Baird C. 1995. Environmental Chemistry. W. H. Freeman and Company. New York. 484 hlm.
[BPWC] Lembaga Penelitian dan Pengabdian Masyarakat. 2010. Laporan Hasil Pemantauan Kualitas Air Waduk Cirata Triwulan IV.
[CCME] Canadian Council of Minister of Environmental. 1999. Canadian Sediment Quality Guidelines for the Protection of Aquatic Life.
Connell D. W. 1995. Bioakumulasi senyawaan xenobiotik. Penerjemah; Yanti Koestoer; Pendamping, Sahati. UI-press. Jakarta. 231 hlm.
Connell D. W. & G. J. Miller. 1995. Kimia dan Ekotoksikologi Pencemaran. Penerjemah; Yanti Koestoer; Pendamping, Sahati. UI-press. Jakarta. 520 hlm.
Darmono. 1995. Logam Dalam Sistem Biologi Mahluk Hidup. Jakarta : UI-press 140 hlm.
Delinom R. M & Marganingrum D. 2007. Sumberdaya Air dan Lingkungan. Jakarta. LIPI Press. 262 hlm.
Di Giulio R. T & Hinton D. E. 2008. The toxicology of fishes. Taylor & Francis Group. New York. 1071 hlm.
Effendi H. 2003. Telaah Kualitas Air Bagi Pengelolaan Sumberdaya dan Lingkungan Perairan. Kanisius. Yogyakarta. 258 hlm.
Effendie I. 2002. Biologi perikanan. Jakarta: Yayasan Pustaka Nusantara.109 hlm.
Eisler R. 2006. Mercury Hazard to living Organisms. Taylor & Francis Group, LLC. 312 hlm.
Eneji I, Sha’ato R, Annune P. 2011. Bioaccumulation of Heavy Metals in Fish
(Tilapia zilli and Clarias gariepinus) Organs from River Benue, Nort-Central Nigeria. Pak. J. Anal. Environ. Chem. Vol. 12, no.1 & 2.
Feriningtyas D. 2005. Perubahan Spasial dan Temporal Kualitas Air Waduk Cirata Jawa Barat Selama Periode 2000-2005. Skripsi. Departemen Manajemen Sumberdaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Harrison R. M. 2006. An Introduction to Pollution Science. The royal society of chemistry. 332 hlm.
Hutabarat S & Evans SM. 1985. Pengantar Oseanografi.Cetakan kedua. UI-press. Jakarta. 159 hlm.
Irianto, A. 2005. Patologi Ikan Teleostei. Yogyakarta : UGM-press. 256 hlm. KepMen LH No.51 tahun 1995 tentang Baku Mutu Limbah Cair Bagi Kegiatan
Industri.
Koeman J. H. 1987. Pengantar Umum Toksikologi. [terjemahan dari Algemene Inleiding in de Toxicologie]. Gadjah Mada University. Yogyakarta. 97 hlm.
Kordi M & Gufron H. 2010. Budidaya Ikan Nila di Kolam Terpal. Yogyakarta. Andi Publisher. 112 hlm.
Kordi M, Gufron H & Tancung A. B. 2007. Pengelolaan Kualitas Air Dalam. Jakarta. Rineka Cipta. 210 hlm.
Kristanto P. 2004. Ekologi Industri. Yogyakarta : Andi. 352 hlm
Kumar H, D & Hader D. P. 1999. Global Aquatic and Atmospheric Environment. Springer-Verlag Berlin : Heidelberg. 393 hlm.
Lemus M. J & Chung K. S. 1999. Effect of Temperature on Copper Toxicity, Acummulation and Purification in Tropical Fish Juveniles Petenia Kraussii (Pisces: Cichlidae). Caribbean Journal of Science, vol 35, no. 1-2, 64-69
Lismana I. 2006. Struktur Komunitas Makrozoobenthos dan Kaitannya Dengan Kandungan Logam Berat (Pb, Cu, dan Cd) Pada Air dan Sedimen di Waduk Cirata, Jawa Barat. Skripsi. Depertemen Manajemen Sumberdaya Perairan. Institut Pertanian Bogor.
Mardiana L. 2007. Studi Kandungan Fosfor di Air dan Sedimen Yang Dipengaruhi aktivitas Keramba Jaring Apung di Waduk Cirata, Jawa Barat. Skripsi. Departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Martins S E & Bianchini, A. 2008. Copper Accumulation and Toxicity in the Plata Pompano Trachinotus marginatus Cuvier 1832 (Teleostei, Carangidae) Pan-American Journal of Aquatic Sciences. 3 (3). 384-390. Mattjik AA & Made S. 2002. Perancangan Percobaan dengan Aplikasi SAS dan
Minitab jilid 1. IPB Press. Bogor.
Moore J. W. & S. Ramamoorthy. 1984. Heavy Metals in Neutral Water. Springer Verlag. New York.
Moyle PB & JJ Cech. 2004. Fishes: an introduction to ichthyology. Prentice hall, Upper Saddle River, NJ, USA. 726 hlm.
Mukhtasor. 2007. Pencemaran Pesisir dan Laut. Pradnya Pramita. Jakarta. 322 hlm.
Nakayama S, Ikenaka Y, Muzandu K, Choongo K, Oroszlany B, Teraoka H, Mizuno N, Ishizuka M. 2010. Heavy metal accumulation in lake sediments, fish (Oreochromis niloticus and Serranochromis thumbergi) and crayfish (Cherax quadricarinatus) in Lake Itezhi-tezhi and Lake Kariba, Zambia. Archives of Environmental Contamination and Toxicology, 59(2): 291-300 Nekoubin H, Hatefi S, Gharedaashi E, Sudagar M & Asgharimoghadam A. 2012.
Rate of Grass Carp (Ctenopharynggodon idella). American-Eurasian Journal of Toxicological Sciences 4 (3):138-142, 2012.
Odum, E. P. 1996. Ekologi Sistem. Gajah Mada University Press : Yogyakarta. 657 hlm.
Parveen A & Javed M. 2010. Effect of Water-borne Copper on the Growth Performance of fish Catla catla. International Journal of Agriculture & Biology Vol. 12, no. 6.
PP. No 82. Tahun 2001. Tentang Pengelolaam Kualitas Air dan Pengendalian Pencemaran Air.
Purnamawati. 2009. Tingkat Perombakan Bahan Organik Sedimen Waduk Cirata Pada Kondisi Anaerobik Skala Laboratorium. Tesis. Program Pasca Sarjana. Institut Pertanian Bogor.
Richey, D & Roseboom, D. 1978. Acute Toxicity of Copper to Some Fishes in High Alkalinity Water. Illinois State Water Survey, Urbana. Illinois. Ricker WE. 1975. Computation and Interpretation of Biological Statistic of Fish
Population. UII. Fish. Res. Board Can, no. 119-382 hal.
Sanusi, H. S. 2006. Kimia Laut Proses Fisik Kimia dan Interaksinya dengan Lingkungan. Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
SK Dirjen POM, Departemen Kesehatan RI no : 03725/B/SK/1989. Tentang Batas Maksimum Cemaran Logam dalam Makanan.
Sorensen E. M. 1991. Metal Poisoning In Fish. Florida. CRC Press. 374 hal. Suprapti NH. 2008. Kandungan Chromium pada Perairan, Sedimen dan Kerang
Darah (Anadara granosa) di Wilayah Pantai Sekitar Muara Sungai Sayung, Desa Morosari Kabupaten Demak, Jawa Tengah. [Jurnal]. Laboratorium Ekologi dan Biosistematik, Biologi. FMIPA. Universitas Dipenogoro, Semarang. Vol. 10, No.2. Hal 53-56. [26 Oktober 2012].
Suriawiria U. 2009. Mikrobiologi Air. Bandung. ITB-press. 344 hlm.
[US-EPA] US-Environmental Protection Agency. 2008. Copper Facts. [terhubung berkala] http://www.epa.gov/oppsrrd1/REDs/factsheets/copper_red_fs.pdf. [11 november 2011].
Lampiran 1. Alat dan bahan yang digunakan
GPS Camera Digital Tisu
Akuarium Ekman Grab Sedimen
Lampiran 2. Desain dan penataan letak akuarium penelitian.
Lampiran 3. Data konsentrasi logam tembaga (Cu)
Air Sedimen ikan
Cu Cu Cu
Awal 0,020 33,900 0,250 A1 0,000 60,600 20,000 A2 0,010 48,400 22,000 A3 0,000 47,900 25,000 rataan 0,003 52,300 22,333 B1 0,010 48,000 27,000 B2 0,000 36,600 25,000 B3 0,000 28,100 24,000 rataan 0,003 37,567 25,333 C1 0,000 45,800 25,000 C2 0,000 21,800 29,000 C3 0,010 45,000 27,000 rataan 0,003 37,533 27,000 Lampiran 4. Data parameter lingkungan.
Parameter Awal Perlakuan
A B C
Suhu (°C) 27,1 24,7 - 26,7 25,6 - 26,1 25,1 - 26,4
pH 6,31 6,13 - 6,84 6,01 - 6,79 6,03 - 6,8