BAB I URAIAN MATERI HUKUM / ATURAN DALAM PERHITUNGAN TERKAIT SEL ELEKTROKIMIA
Dalam reaksi redoks terjadi tranfer elektron dari reduktor ke oksidator. Pengetahuan adanya transfer elektron memberikan manfaat dalam upaya
mengembangkan sumber energi listrik alternatif sebab alairan listrik tiada lain adalah aliran elektron. Bidang ilmu yang mempelajari energi listrik dalam reaksi kimia disebut sel elektrokimia. Perangkat atau instrumen untuk membangun energi listrik dari reaksi kimia disebut sel elektrokimia. Untuk mengatahui jumlah energi listrik yang dihasilkan atau dibentuk dalam suatu elektroda dibutuh perhitungan.
Pergitungan dalam sel elektrokimia ada 3 yaitu potensial sel, persamaan nerst, dan hukum faraday.
1.1 Potensial Sel
Arus listrik yang muncul dalam sel gavanik merupakan hasil elektron yang dipaksa bergerak dari elektrode negatif melalui kawat bagian luar ke elektode positif. Kekuatan yang mendorong elektron bergerak melalui kawat gaya elektomotif atau emf, dan diukur dalam volt (V). Sebetulnya, volt adalah ukuran untuk energi yang dihasilkan oleh aliran muatan listrik. Apabila emf sama dengan 1 V, muatannya 1 coulumb untuk mengahasilkan usaha sebesar 1 joule.
1 volt = 1 joule coulomb
1V=1J/C
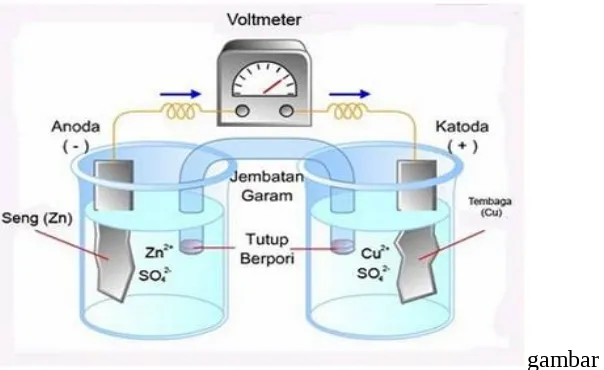
Pada rangkaian sel volta dibawah, elektron mengalir dari elektrode Zn ke elektrode Cu, dan tidak sebaliknya. Kenyataan ini menunjukkan bahwa Zn lebih mudah teroksidasi(lebih mudah melepas elektron) dari pada Cu, sebaliknya ion Cu2+
gambar 1.1
Perbedaan kecendrungan teroksidasi menghasilkan perbedaan rapatan muatan antara elektroda Zn dan elektroda Cu, sehingga menyebabkan beda potensial listrik antara Zn dan Cu yang mendorong elektron mengalir. Selisih potensial itu disebut potensial sel dan diberi lambang Esel. Sedangkan potensial sel yang dihasilkan oleh
elektoda disebut Potensial elektrode standar.
Emf tergantung dari kosentrasi ion dalam sel, suhu, dan tekanan parsial setiap gas yang mungkin terjadi dalm reaksi. Ketika kosentrasi ion sama dengan 1 M, semua tekanan potensial gas sama dengan 1 atm dan suhu 25oC , maka emf disebut
potensial sel standar, yang diberi tanda Eo sel.
Potensial sel yang dihasilkan oleh suatu elektrode (M) dengan elektrode hidrogen disebut potensial elektrode dan dinyatakan dengan E. Apabila pengukuran dilakukan pada kondisi standar, yaitu pada suhu 25oC dengan kosentrasi ion –ion 1 M
dan tekanan 1 atm, disebut potensial elektrode standar dan diberi lambang Eo.
Eo
sel =Eozat yangdireduksi – Eozat yang dioksidasi
Harga potensial elektrode standar ( Eo ) dari berbagai elektrode diberikan pada tabel
1.1.
Reaksi Reduksi E° (volt)
Potensial sel galvanik dapat ditentukan melalui percobaan dengan
dihasilkan bermacam- macam alat yang dapat mengukur emf sel secara cepat dan mudah tanpa mengggambarkan besarnya arus listrik.
Contoh 1.1
1.2 Persamaan Nernst
Pontensial sel volta yang kedua elektrodenya dalam kondisi standar
standar dan dinyatakan dengan lambang Eo. Contoh sel volta dengan kondisi
standarseperti pada gambar1.1, sel tersebut mempunyai potensial sel standar Eo sel=1,1
V. Reaksi sel dari sel volta saperti gambar tersebut adalah: Zn + Cu2+(1M) ⟶ Zn2+ (1 M) + Cu
Kosentrasi dan tekanan(untuk gas) mempengaruhi nilai potensial sel. Jika sel digambar diubah kosentrasi Cu2+ menjadi 2 M mempunyai potensial sel E
sel 1,139 V.
Potensial sel dalam keadaan tidak standar dilambangkan E saja .
Zn + Cu2+(2 M) ⟶ Zn2+ (1 M) + Cu E=1,139 V
Hubungan kosentrasi dengan potensial dikemukakan oleh Walther Nernst pada tahun 1889dan dinyatakan dalam persamaan Nernst
E=Eo – 0,0592 V
n log Q
Contoh soal 1.2
Tentukan potensial sel volta berikut
Al (s) ∣ Al3+(0,36 M)∥ Sn4+→(0,086 M), Sn2+(0,54 M) ∣Pt
Jika diketahui E0 Al ∣∣Al3+= -1,66 V dan Sn4+∣ Sn2+= +0,154 V
Jawab
Reaksi sel yang terjadi dapat dinyatakan sebagai berikut
2Al (s) + 3Sn4+(0,086 M) →, 2Al3+(0,36 M) + 3Sn2+(0,54 M)
=[0,154 V-(-1,66 V)] ⦋– 0,0592 V
Aspek ganda sel elektrokimia ( galvani dan elektrolisis) segera didasari setelah penemuan sel tersebut pada tahun 1800 oleh Alessandro Volta. Volta membuat sebuah “aki” yang terdiri dari sejumlah lembaran perak dan seng yang dipisahkan satu sama lainnya oleh lembaran kertas berpori yang dibasahi oleh larutan garam. Sekitartahun 1807, Sir Humphry Davy telah membuat unsur natrium dan kalium dengan menggunakan sebuah aki untuk mengelektrolisis masing-masing
hidroksidanya . Akan tetapi, dasar ilmiah sel elektrokimia yang digunakan tidak jelas. Pada tahun 1831-1832, jauh sebelum penemuan elektron, Micheal Faraday dari Inggris yang merupakan orang yang pertama yang memperlihatkan hubungan kuantitatif ketika terjadi elektrolisis antara jumlah listrik yang digunakan dengan jumlah senyawa kimia yang terbentuk.
1 mol perak direduksi oleh satu mol elektron yang dihasilkan oleh katoda.
Untuk menggunakan informasi ini kita membutuhkan beberapa cara yang berkatan dengan mol elektron untuk mengukur jumlah listrik. Kita dapat
memperolehnya dengan cara menentukan muatan 1 mol elektron dalam satuan coulomb ( C),yang merupakan satuan internasional (SI) untuk muatan listrik.
e =1,6021773 x 10-19 C
sehingga jumlah muatan yang ditunjukkan 1 mol elektron adalah
Q=(6,022137 x 1023 mol-1)( 1,6021773 x 10-19 C)=96.485,31 C mol-1
jumlah muatan ini disebut tatapan faraday yang dilambangkan
1 F= 96.485,31C mol-1
a. Hukum Faraday I
Massa zat tertentu yang dihasilkan atau dipakai pada suatu elektrode berbanding lurus dengan jumlah muatan listrik yang melalui sel.
Arus listrik adalah jumlah muatan yang mengalir melalui sebuah rangkaian per satuan waktu. Jika Q adalah besarnya muatan dalam coulumb dan t aalah waktu dalam detik yang diperlukan untuk melalui sabuah titik dalam rangkaian, maka arus I adalah :
b. Hukum Faraday II
Massa ekivalen zat yang berbeda dihasilkan atau dipakai pada
elektroda dengan melewatkan sejumlah tertentu muatan listrik melalui
sel.
Jika hukum I dan II digabungkan diperoleh persamaan
I t
95.000C mol−1
= mol elektron
di manasatuan I adalah amper(A) atau coulomb perdetik. Arus I amper
yang lewat salam t detik menyebabkan It coulomb muatan melalui
rangkaian.Dari jumlah mol elektron yang lewat melalui rangkaian,
jumlah mol (dab oleh karena itu jumlah gram) senyawa yang bereakasi
pada elektroda dlam elektrokimia dapat dihitung.
BAB II ANALISIS MISKONSEPSI HUKUM / ATURAN DALAM PERHITUNGAN TERKAIT SEL ELEKTROKIMIA
Menurut Brady(1998:226)E=Eo – 0,0592 V
n log Q sedangkan menurut
Oxtoby(2001:391) , Purba(2006:59) persamaan adalah Esel=
Eselo −¿
0,0592
n log Qc.
Menurut Harnanto(2009:52) penulisan lambang massa atom relatif Ar sedangkan
menurut Hidayati(2009:51) penulisan massa atom relatif adalah Ar.
Menurut Oxtoby(2001:387)penulisan lambang untuk Ampere adalah I sedangkan menurut Harnanto(2009:52) dan Hidayati(2009:51) penulisan lambang ampere i. Menurut Oxtoby(2001:387) 1 Faraday=96,483,31C mol-1 Menurut Harnanto
(2009:52) 1 Faraday= 96.500 coulomb
Menurut Brady(1988:211) rumus untuk potensial sel adalah Eo
sel =Eozat yangdireduksi –
Eo
zat yang dioksidasi ,sedangkan menurut Purba(2006:57) adalah Eo=Eokatode – Eoanode
2.2 Kesalahan Penulisan Huruf/Kata
Menurut Oxtoby(2001:380) Massa zat tertentu yang dihasilkan atau dipakai pada suatu elektrode berbanding lurus dengan jumlah muatan listrik yang melalui sel. Sedangkan menurut Hidayati(2009:51) hukum faraday II adalah
2.3 Kesalahan Penulisan Data
Menurut Chang (2005:202), potensial elektrode standar yang umum di tunjukkan pada tabel
PbSO4(s) + 2e- ⟶ Pb(s) + SO42-(aq) -0,31
Mn2+(aq) + 2e- ⟶ Mn(s) -1,18
Mg2+(aq) + 2e- ⟶ Mg(s) -2,37
Ca2+(aq) + 2e- ⟶ Ca(s) -2,87
Namun ada beberapa data yang berbeda, seperti yang disajikan oleh Harnanto (2009:34) dalam tabel potensial elektrode standar.
Reaksi Reduksi E° (volt)
PbSO4(s) + 2e- ⟶ Pb(s) + SO42-(aq) -0,26
Mn2+(aq) + 2e- ⟶ Mn(s) -1,03
Mg2+(aq) + 2e- ⟶ Mg(s) -2,83
Ca2+(aq) + 2e- ⟶ Ca(s) -2,76
Menurut Oxtoby(2001:380) nilai e=1,6021 x 10-19sedangkan menurut
Harnanto(2009:51) nilai dari e=1,6021 x 10-9.
BAB III KESIMPULAN
DAFTAR PUSTAKA
Brady, James E. John R.Holum.1988. Kimia Universitas. Binapura Aksara:
Tangerang
Chang, Raymond.2005.Kimia Dasar Jilid 2. Jakarta : Erlangga.
Harnanto, Ari dan Ruminten. 2009. Kimia 3 untuk SMA/MA Kelas XII. Jakarta :
Hidayati, Nur dan Anis Wardani. 2009.Kimia SMA/MA Kelas XII. Jakarta : Pusat
Perbukuan, Departemen Pendidikan Nasional..
Oxtoby, David w. 2001. Prinsip-Prinsip Kimia Modern. Jakarta : Erlangga.
Petrucci, Ralph H. 1985. Kimia Dasar. Jakarta : Erlangga.