SINTESIS
1-KLORO-2-METOKSI-6-PROPILNAFTALENA-1,3-DIOKSOLANA (1:1) SEBAGAI PREKURSOR ASAM (
S
)-(+)-(6-METOKSI-2-NAFTIL)PROPANOAT
BETTY ALFIRIZKY KUSTIANA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis 1-Kloro-2-metoksi-6-propilnaftalena-1,3-dioksolana (1:1) sebagai Prekursor Asam (S)-(+)-(6-Metoksi-2-naftil)propanoat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
BETTY ALFIRIZKY KUSTIANA. Sintesis 1-Kloro-2-metoksi-6-propilnaftalena-1,3-dioksolana (1:1) sebagai Prekursor Asam (S)-(+)-(6-Metoksi-2-naftil) propanoat. Dibimbing oleh ZAINAL ALIM MAS’UD dan MUHAMMAD FARID.
Senyawa 1-kloro-2-metoksi-6-propilnaftalena-1,3-dioksolana (1:1) sebagai prekursor asam (S)-(+)-(6-metoksi-2-naftil)propanoat disintesis dari bahan awal 2-metoksinaftalena. Tahapan sintesis diawali dengan klorinasi menggunakan 2 jenis pereaksi klorinasi, yakni isosianurat terklorinasi dan NaOCl. Klorinasi dengan isosianurat terklorinasi berhasil menyintesis 1-kloro-2-metoksinaftalena sebagai produk monoklorinasi melalui pencirian dengan kromatograf gas-spektrometer massa (GC-MS). Nisbah konversi produk paling efisien diperoleh pada laju penambahan 2.5 mmol/jam. Sebaliknya, klorinasi dengan NaOCl menghasilkan produk triklorinasi. 1-Kloro-2-metoksinaftalena selanjutnya diasilasi dengan propanoil klorida, tetapi analisis dengan GC menunjukkan bahwa produk asilasi tidak terbentuk. Sistem bebas-air diperlukan untuk keberhasilan proses asilasi tersebut.
Kata kunci: isosianurat terklorinasi, 1-kloro-2-metoksinaftalena, NaOCl, nisbah konversi
ABSTRACT
BETTY ALFIRIZKY KUSTIANA. Synthesis of 1-Chloro-2-methoxy-6-propyl naphtalene-1,3-dioxolane (1:1) as Precursor of (S)-(+)-(6-Methoxy-2-naphtyl) propanoic Acid. Supervised by ZAINAL ALIM MAS’UD and MUHAMMAD FARID.
Synthesis of 1-chloro-2-methoxy-6-propylnaphthalene-1,3-dioxolane (1:1) as precursor of (S)-(+)-(6-methoxy-2-naphthyl)propanoic acid was carried out from 2-methoxynaphthalene as starting material. The synthesis was started with chlorination using 2 different reagents, i.e. chlorinated isocyanurate and NaOCl. Chlorination by using chlorinated isocyanurate successfully synthesized 1-chloro-2-methoxynaphthalene as monochlorinated product, according to gas chromatograph-mass spectrometer (GC-MS) characterization. The most efficient product conversion ratio was obtained at addition rate of 2.5 mmol/hour. Conversely, chlorination using NaOCl generated trichlorinated product. 1-Chloro-2-methoxynaphthalene was then acylated with propanoyl chloride, but GC analysis showed that the acylation product was not obtained. The reaction needs a water-free system for the success of acylation.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
SINTESIS
1-KLORO-2-METOKSI-6-PROPILNAFTALENA-1,3-DIOKSOLANA (1:1) SEBAGAI PREKURSOR ASAM (
S
)-(+)-(6-METOKSI-2-NAFTIL)PROPANOAT
BETTY ALFIRIZKY KUSTIANA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sintesis 1-Kloro-2-metoksi-6-propilnaftalena-1,3-dioksolana (1:1) sebagai Prekursor Asam
(S)-(+)-(6-Metoksi-2-naftil)propanoat
Nama : Betty Alfirizky Kustiana NIM : G44100004
Disetujui oleh
Dr Zainal Alim Mas’ud, DEA Pembimbing I
Drs Muhammad Farid, MSi Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2014 ini ialah sintesis bahan organik, dengan judul Sintesis 1-Kloro-2-metoksi-6-propilnaftalena-1,3-dioksolana (1:1) sebagai Prekursor Asam (S)-(+)-(6-Metoksi-2-naftil)propanoat.
Terima kasih penulis ucapkan kepada Bapak Zainal Alim Mas’ud dan Bapak Muhammad Farid selaku pembimbing, serta Bapak Mohammad Khotib, Bapak Budi Arifin, dan Bapak Novriyandi Hanif yang telah banyak memberikan saran. Di samping itu, penghargaan penulis sampaikan kepada seluruh analis dan rekan-rekan penelitian di Laboratorium Terpadu IPB Baranangsiang. Ungkapan terima kasih juga disampaikan kepada Ayah (alm.), Ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Karya ilmiah ini penulis dedikasikan untuk Ayahanda tercinta.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
BAHAN DAN METODE 2
Bahan dan Alat 2
Langkah Kerja 2
HASIL DAN PEMBAHASAN 5
Hasil Klorinasi dengan isosianurat terklorinasi 5
Hasil Klorinasi dengan NaOCl 10
Asilasi 14
SIMPULAN DAN SARAN 15
DAFTAR GAMBAR
1 Struktur naproksena 1
2 Analisis retrosintetik
1-kloro-2-metoksi-6-propilnaftalena-1,3-dioksolana (1:1) 2
3 Larutan 2-metoksinaftalena sebelum (a) dan sesudah (b) klorinasi 5 4 Nisbah konversi produk klorinasi pada beberapa laju penambahan
isosianurat terklorinasi 6
5 Pola fragmentasi 2-metoksinaftalena 7
6 Pola fragmentasi 1-kloro-2-metoksinaftalena 7 7 Struktur resonans zat antara untuk substitusi pada C-1 8 8 Struktur resonans zat antara untuk substitusi pada C-3 8 9 Struktur resonans zat antara untuk substitusi pada C-6 8 10 Struktur resonans zat antara untuk substitusi pada C-4 9 11 Struktur resonans zat antara untuk substitusi pada C-5 9 12 Struktur resonans zat antara untuk substitusi pada C-7 9 13 Struktur resonans zat antara untuk substitusi pada C-8 10 14 Klorinasi menggunakan HCl(aq) 3 M (a) dan H2SO4(aq) (b) 11
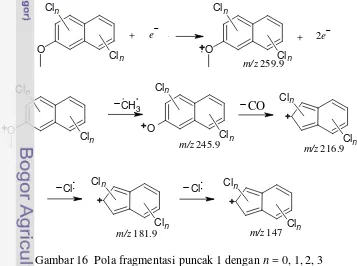
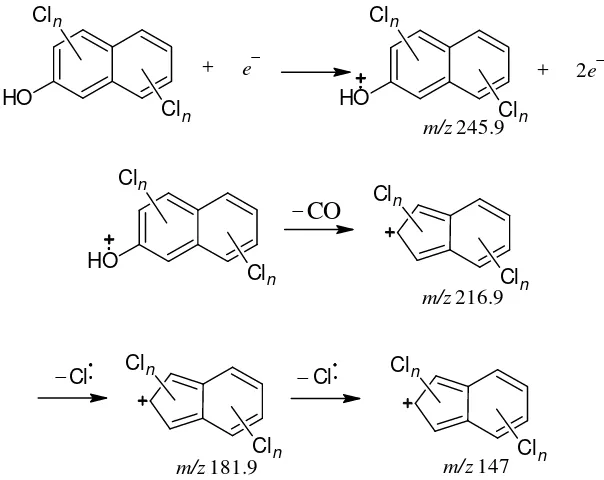
15 Larutan 2-metoksinaftalena sebelum (a) dan setelah (b) klorinasi 11 16 Pola fragmentasi puncak 1 dengan n = 0, 1, 2, 3 12 17 Pola fragmentasi puncak 2 dengan n = 0, 1, 2, 3 13 18 Hiperkonjugasi molekul produk pada puncak 2 dengan n = 0, 1, 2, 3 14
DAFTAR LAMPIRAN
1 Diagram alir penelitian 17
2 Penentuan kadar klorin aktif dalam isosianurat terklorinasi menggunakan metode iodometri tidak langsung 18 3 Penentuan nisbah konversi produk klorinasi dengan isosianurat
terklorinasi 19
4 Kromatogram MS produk klorinasi dengan isosianurat
terklorinasi 20
5 Penentuan kadar klorin dalam NaOCl menggunakan metode
iodometri tidak langsung 21
PENDAHULUAN
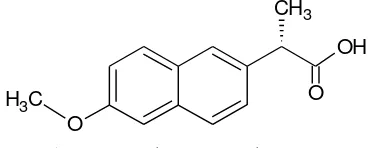
Asam (S)-(+)-(6-metoksi-2-naftil)propanoat, dikenal sebagai naproksena (Gambar 1), merupakan obat untuk meredakan peradangan. Naproksena dikelompokkan ke dalam nonsteroidal anti-inflammatory drug (NSAID) yang bekerja dengan menekan hormon penyebab nyeri (US FDA 2008). Naproksena merupakan salah satu obat analgesik penting di pasaran. ICB Americas (2002) melaporkan bahwa asetaminofen, termasuk aspirin, ibuprofen, dan naproksena memegang peranan penting secara komersial selama 20 tahun terakhir. Rhodia, Inc. melaporkan bahwa asetaminofen telah mendominasi pasar dengan jumlah konsumsi global mencapai 75 000 hingga 80 000 ton per tahun dengan produksi naproksena berkisar antara 2 000 dan 3 000 ton per tahun. Lebih jauh lagi, walaupun adanya berbagai inovasi baru, pemasaran naproksena relatif stabil dan terus berkembang.
O
Gambar 1 Struktur naproksena
Sintesis naproksena telah dilakukan melalui berbagai macam lintas sintesis yang bertujuan meningkatkan efisiensi produksi. James et al. (1994) mengajukan lintas sintesis naproksena melalui sintesis 2-(1-hidroperoksi-1-metiletil)-6-(1-metiletil)naftalena sebagai precursor, dengan rendemen sebesar 1035%. Piccolo et al. (1988) melaporkan berhasil menyintesis suatu prekursor aktif optis dari (S)-2-halo-propionil halida dengan 1-kloro-2-metoksinaftalena (halo = Cl, Br). Lintas sintesis senyawaan asil sebagai prekursor juga digunakan oleh Giordano dan Marco (1989) dengan melibatkan propionil klorida yang tidak aktif optis dengan 1-kloro-2-metoksinaftalena.
Giordano dan Marco (1983) menyintesis senyawaan ketal sebagai prekursor dengan meragamkan gugus pelindung. Gugus pelindung yang digunakan antara lain metanol dengan rendemen ketal sebesar 97.5%, etanol dengan rendemen hampir 100%, etilena glikol dengan rendemen 98%, 1,3-propanadiol dengan rendemen hampir 100%, dan 2,3-butanadiol dengan rendemen mendekati 99%. Giordano dan Marco (1989) juga melaporkan bahwa asam tartarat atau turunannya telah digunakan sebagai gugus pelindung dalam sintesis senyawaan ketal sebagai prekursor naproksena.
2
klorin. Klorinasi dengan isosianurat terklorinasi, atau disebut juga dengan kaporit, digunakan sebagai pembanding karena pereaksi klorinasi tersebut mudah diperoleh dan harganya relatif murah. Selain itu, proses klorinasi dengan isosianurat terklorinasi lebih sederhana (Hazeltine et al. 2003). Laju penambahan isosianurat terklorinasi diragamkan untuk menentukan laju penambahan yang menghasilkan nisbah konversi produk secara efisien. Produk klorinasi selanjutnya diasilasi dengan propanoil klorida sebagai bahan pengasilasi. Propanoil klorida dipilih karena relatif mudah diperoleh dan relatif lebih murah dibandingkan dengan propanoil klorida optis aktif. Etilena glikol digunakan sebagai gugus pelindung pada tahap ketalisasi karena mudah didapat.
Gambar 2 Analisis retrosintetik 1-kloro-2-metoksi-6-propilnaftalena-1,3-dioksolana (1:1)
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan antara lain, KI, Na2S2O3, KIO3,
propanoil klorida (Merck®), NaOH, NaOCl, diklorometana, isosianurat terklorinasi (kaporit), AlCl3•6H2O, n-heksana, etil asetat, H2SO4 98%, asam
asetat glasial, Na2SO4, etilena glikol, dan dietil eter.
Peralatan yang digunakan antara lain buret, penguap putar, radas klorinasi cara NaOCl, radas refluks, kromatografi gas (GC) kolom RTX-5 for Essential Oil, spektrofotometer inframerah transformasi Fourier (FTIR), kromatograf gas-spektrometer massa (GC-MS), pelat kromatografi lapis tipis (KLT) F254, dan alat-alat kaca laboratorium yang umum.
Langkah Kerja
1-(5-3 kloro-6-metoksinaftalen-2-il)propan-1-on dari 1-kloro-2-metoksinaftalena (Giordano dan Marco 1989), dan (3) ketalisasi keton tersebut menggunakan etilena glikol sebagai gugus pelindung (modifikasi Giordano dan Marco 1991). Tahap klorinasi dibagi menjadi 2 cara, yaitu (1) cara isosianurat terklorinasi dan (2) cara NaOCl. Produk klorinasi dan ketalisasi dicirikan dengan teknik GC dan GC-MS, sedangkan produk asilasi dicirikan hanya dengan teknik GC.
Standardisasi Na2S2O3 dengan KIO3 (modifikasi SNI 19-7119.8-2005)
Sebanyak 0.35 g KIO3 dilarutkan ke dalam labu ukur 100 mL dan
ditambahkan air suling sampai tanda tera. Sebanyak 10 mL larutan KIO3
dipipet ke dalam labu Erlenmeyer. Sebanyak 1 g KI dan 10 mL HCl ditambahkan lalu dititrasi dengan Na2S2O3 sampai warna larutan tidak
berwarna. Normalitas Na2S2O3 dihitung dengan rumus sebagai berikut: � = . × × × � × ��
Keterangan:
N1 = konsentrasi larutan Na2S2O3 (N)
b = bobot KIO3 dalam 100 mL air suling (g)
Vb = volume larutan KIO3 yang digunakan dalam titrasi (mL)
V1 = volume larutan Na2S2O3 hasil titrasi (mL)
35.67 = bobot ekuivalen KIO3
100 = volume larutan KIO3 yang dibuat dalam labu ukur 100 mL
1000 = konversi liter ke mililiter
Penentuan Kadar Klorin Aktif dalam larutan NaOCl Menggunakan Metode Iodometri Tidak Langsung (modifikasi Rosyidi 2010)
Larutan NaOCl sebanyak 5 mL ditambahkan 1 g kristal KI dan 2.5 mL asam asetat glasial, lalu dititrasi dengan Na2S2O3 hingga warna cokelat
menghilang. Volume Na2S2O3 yang dibutuhkan dicatat dan kadar klorin
Vcontoh = volume larutan NaOCl (mL)
Penentuan Kadar Klorin Aktif dalam Serbuk Isosianurat Terklorinasi Menggunakan Metode Iodometri Tidak Langsung (modifikasi Rosyidi 2010)
Isosianurat terklorinasi sebanyak 0.1 g dilarutkan ke dalam 10 mL air suling. Larutan diambil sebanyak 10 mL, lalu ditambahkan 1 g kristal KI dan 2.5 mL asam asetat glasial. Setelah itu, larutan isosianurat terklorinasi dititrasi dengan Na2S2O3 hingga warna cokelat menghilang. Volume
Na2S2O3 yang dibutuhkan dicatat dan kadar klorin aktif (ppm) dihitung: [Cl ] ppm = × � S � × � S × BE Cl
4
Keterangan:
V Na2S2O3 = volume larutan Na2S2O3 hasil titrasi (mL)
N Na2S2O3 = konsentrasi larutan Na2S2O3 (N)
Vcontoh = volume larutan isosianurat terklorinasi (mL)
Sintesis 1-Kloro-2-metoksinaftalena dari 2-Metoksinaftalena dengan Isosianurat Terklorinasi (modifikasi Alvarez 1976)
Klorinasi dengan isosianurat terklorinasi dibagi ke dalam 4 erlenmeyer. Sebanyak 32 mmol 2-metoksinaftalena dilarutkan dalam 80 mL asam asetat glasial pada setiap erlenmeyer. Tablet isosianurat terklorinasi ditumbuk sampai halus lalu ditambahkan dengan laju penambahan berturut-turut 0.5, 0.7, 1.25, dan 2.5 mmol/jam. Hasil sintesis dilarutkan dalam diklorometana lalu diekstraksi dengan air suling untuk menghilangkan asam asetat. Hasil sintesis dikonfirmasi dengan GC dan GC-MS.
Sintesis 1-Kloro-2-metoksinaftalena dari 2-Metoksinaftalena dengan NaOCl (Alvarez 1976)
Larutan H2SO4 3 M dalam labu leher 3 ditetesi 50 mL larutan NaOCl
dalam suhu kamar sambal diaduk. Gas Cl2 yang terbentuk dialirkan pada
suhu kamar melalui pipa kaca ke dalam labu lain yang berisi larutan 20 mmol 2-metoksinaftalena dalam 50 mL asam asetat glasial sambil diaduk. Radas diletakkan di dalam lemari asam. Larutan NaOCl ditambahkan secara bertahap. Hasil sintesis dilarutkan dalam diklorometana, lalu diekstraksi dengan air suling untuk menghilangkan asam asetat. Hasil ekstraksi dikonfirmasi dengan GC dan GC-MS.
Sintesis 1-(5-Kloro-6-metoksinaftalen-2-il)propan-1-on (Giordano dan Marco 1989)
Hasil sintesis tahap 1 cara isosianurat terklorinasi ditambahkan setetes demi ke dalam campuran 25 mmol AlCl3•6H2O, 16 mL diklorometana, dan
25 mmol propanoil klorida sambal diaduk, lalu didinginkan sampai 0 °C. Saat reaksi selesai, suhu naik secara spontan ke 20 °C. Proses sintesis dikonfirmasi dengan KLT untuk memastikan bahwa bahan awal telah habis. Eluen yang digunakan ialah n-heksana dan etil asetat dengan nisbah 8:2. Setelah reaksi selesai, campuran reaksi dituang ke dalam campuran 15 mL HCl pekat, 30 g es, dan 20 ml air suling. Terbentuk 2 fase: fase organic diambil dengan 25 ml diklorometana, lalu ditambahkan Na2SO4 anhidrat
untuk menghilangkan air. Pelarut diuapkan dengan penguap putar. Hasil akhir sintesis dikonfirmasi dengan GC.
Sintesis 1-Kloro-2-metoksi-6-propilnaftalena-1,3-dioksolana (1:1) (modifikasi Giordano dan Marco1991)
Hasil sintesis tahap 2 tanpa dimurnikan, direaksikan dengan 15 mmol etilena glikol dan direfluks selama 48 jam pada suhu 60 °C. Setelah proses sintesis selesai, hasil dinetralkan dengan Na2CO3. Penetralan dikonfirmasi
5
HASIL DAN PEMBAHASAN
Hasil Klorinasi dengan Isosianurat Terklorinasi
Reaksi klorinasi ini memanfaatkan prinsip pembentukan in situ Cl2(g).
Reaksi didasarkan pada prinsip substitusi elektrofilik (SEAr) antara Cl2 dan
cincin aromatik dari 2-metoksinaftalena. Pengadukan bertujuan menghindari reaksi terlokalisasi yang dapat menghasilkan campuran produk yang tidak diinginkan. Reaksi klorinasi diamati dari perubahan warna larutan dari tidak berwarna menjadi kuning (Gambar 3).
Gambar 3 Larutan 2-metoksinaftalena sebelum (a) dan sesudah (b) klorinasi Kadar klorin aktif dalam isosianurat terklorinasi diukur menggunakan metode iodometri tidak langsung (Lampiran 2). Metode ini didasarkan pada prinsip titrasi redoks antara I3 dan titran. Metode ini disebut tidak langsung
karena titrat tidak bereaksi secara langsung dengan titran, melainkan terlebih dulu bereaksi dengan I membentuk I3. Dalam larutan berair, isosianurat
terklorinasi akan terurai menjadi Cl2, OCl, dan HOCl.
Komponen-komponen tersebut dikenal sebagai klorin bebas. Jika dalam larutan berair terdapat NH3(g) terlarut, maka senyawa monokloramina akan terbentuk
dengan cepat. Senyawa ini kemudian dikenal sebagai klorin terikat. Klorin bebas dan klorin terikat selanjutnya disebut sebagai klorin aktif (Alaert et al. 1987). Berdasarkan hasil perhitungan, kadar klorin aktif dalam isosianurat terklorinasi diperoleh sebesar 67%. Kadar tersebut cukup tinggi, sehingga penggunaan isosianurat terklorinasi cukup efisien sebagai pereaksi klorinasi dan bermanfaat untuk sintesis skala besar.
Analisis nisbah konversi produk (Lampiran 3) menampilkan kecenderungan peningkatan nisbah konversi seiring dengan meningkatnya laju penambahan isosianurat terklorinasi (Gambar 4). Hal ini menunjukkan bahwa meningkatnya kadar Cl2 disertai dengan meningkatnya jumlah
molekul 2-metoksinaftalena yang terklorinasi. Laju penambahan isosianurat terklorinasi sebesar 0.5 mmol/jam menghasilkan nisbah produk/bahan awal paling rendah. Nisbah konversi meningkat pada laju penambahan 0.7 mmol/jam dan tidak berubah signifikan sampai laju penambahan 1.25 mmol/jam. Nisbah konversi produk paling tinggi dicapai pada laju
6
Laju penambahan kaporit (mmol/jam)
penambahan 2.5 mmol/jam. Dengan demikian, laju penambahan 2.5 mmol/jam menghasilkan konversi produk yang paling efisien di antara keempat laju yang dicobakan.
Hasil analisis GC menunjukkan bahwa puncak 2-metoksinaftalena standar muncul pada menit ke-27.399. Produk klorinasi pada laju penambahan 0.5, 0.7, 1.25, dan 2.5 mmol/jam berturut-turut muncul pada menit ke-33.981, 33.995, 33.965, dan 34.016. Dengan mempertimbangkan galat eksperimental, dapat disimpulkan bahwa keempatnya merupakan produk yang sama. Puncak 2-metoksinaftalena masih muncul dengan intensitas yang tajam meskipun reaksi berlangsung dengan nisbah ekuivalen 1:1. Reaksi yang tidak sempurna disebabkan oleh total mol klorin aktif dalam serbuk isosianurat terklorinasi yang tidak menggambarkan total mol Cl2 sebenarnya.
Kromatogram GC hasil percobaan dengan laju penambahan isosianurat terklorinasi 0.5 mmol/jam menghasilkan 2 puncak. Puncak 1 muncul pada menit ke-26.909, dan diduga merupakan 2-metoksinaftalena berdasarkan kedekatan waktu retensi dengan puncak standar. Dugaan ini diperkuat oleh hasil analisis MS dengan tipe sumber ion tumbukan elektron (EI). Ion molekul ditemukan pada m/z 158, disertai dengan ion-ion fragmen yang berasal dari 2-metoksinaftalena, pada m/z 143 dan 115 (Gambar 5).
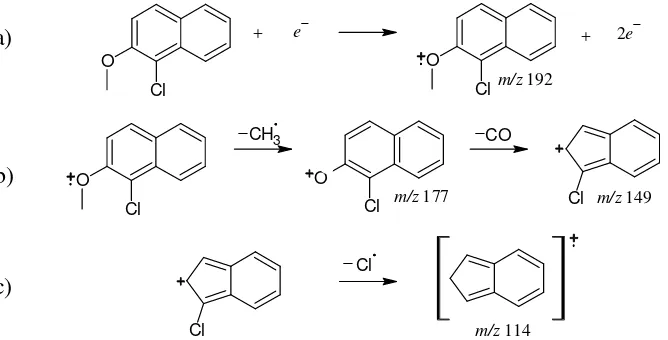
Elektron yang dilepaskan selama ionisasi awal berasal dari orbital molekul dengan energi potensial tertinggi, sebab elektron pada orbital tersebut diikat paling lemah oleh inti atom. Pada 2-metoksinaftalena, elektron dari orbital non-ikatan akan paling mudah dilepaskan dibandingkan dengan elektron dari orbital π. Oleh karena itu, pembelahan diinisiasi dengan pengambilan elektron dari pasangan elektron bebas atom O (Gambar 5a) (Pavia et al. 2009).
7 puncak dengan intensitas puncak tertinggi. Ion fragmen dengan m/z 143 muncul karena terjadi pembelahan ikatan β terhadap cincin (Gambar 5b). Intensitas ion fragmen ini lemah (8.2%) karena tidak stabil dan mudah terdekomposisi lebih lanjut dengan melepaskan molekul CO menghasilkan puncak pada m/z 115 (Gambar 5c). Pelepasan molekul kecil dan netral (CO) dari ion fragmen m/z 143 sangat disukai, sehingga intensitas puncak ini mencapai 83.70% (McLafferty dan Turecek 1993).
a)
b)
c)
Gambar 5 Pola fragmentasi 2-metoksinaftalena
Puncak 2 muncul pada menit ke-33.981. Hasil interpretasi data MS menunjukkan adanya 1 atom Cl terikat pada cincin aromatik dari molekul 2-metoksinaftalena. Hal ini dikonfirmasi oleh munculnya puncak M+ pada m/z 192 disertai puncak [M + 2]+ dengan nisbah kurang lebih 3:1 (Lampiran 4b). Puncak M+ pada m/z 192 melibatkan isotop 35Cl, sedangkan puncak [M + 2]+ melibatkan isotop 37Cl. Nisbah intensitas sebesar 3:1 sesuai dengan kelimpahan kedua isotop tersebut, yaitu masing-masing sebesar 72.8% dan 24.2% (Field et al. 2008). Selain itu, terdapat puncak pada m/z 149 dan 114 sebagai hasil dari fragmentasi yang ditunjukkan pada Gambar 6.
a)
b)
c)
Gambar 6 Pola fragmentasi 1-kloro-2-metoksinaftalena
8
Puncak dengan m/z 192 (Gambar 6a) dihasilkan oleh ionisasi elektron dari atom O yang selanjutnya menginisiasi pembelahan β dan pelepasan CO menghasilkan puncak dengan m/z 149 (Gambar 6b). Seperti terlihat dalam kromatogram MS (Lampiran 4b), puncak dengan m/z 192 dan m/z 149 keduanya memiliki intensitas 100%. Puncak dengan m/z 114 dihasilkan dari pembelahan radikal Cl•(Gambar 6c). Puncak ini memiliki intensitas lebih lemah (30%) dibandingkan dengan intensitas puncak dengan pola fragmentasi yang sama pada 2-metoksinaftalena.
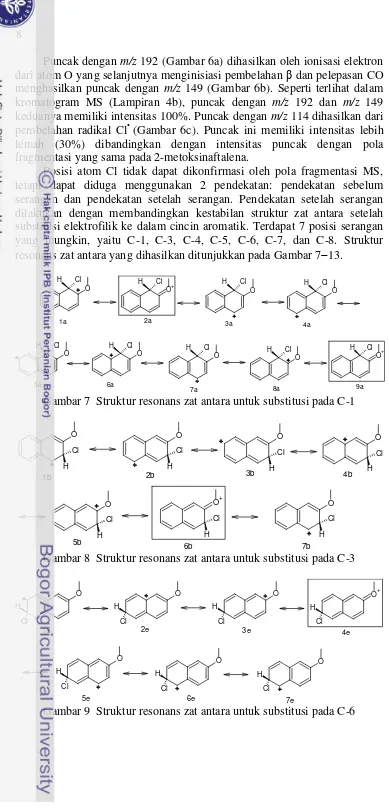
Posisi atom Cl tidak dapat dikonfirmasi oleh pola fragmentasi MS, tetapi dapat diduga menggunakan 2 pendekatan: pendekatan sebelum serangan dan pendekatan setelah serangan. Pendekatan setelah serangan dilakukan dengan membandingkan kestabilan struktur zat antara setelah substitusi elektrofilik ke dalam cincin aromatik. Terdapat 7 posisi serangan yang mungkin, yaitu C-1, C-3, C-4, C-5, C-6, C-7, dan C-8. Struktur resonans zat antara yang dihasilkan ditunjukkan pada Gambar 713.
O Gambar 7 Struktur resonans zat antara untuk substitusi pada C-1
O
Gambar 8 Struktur resonans zat antara untuk substitusi pada C-3
O
9
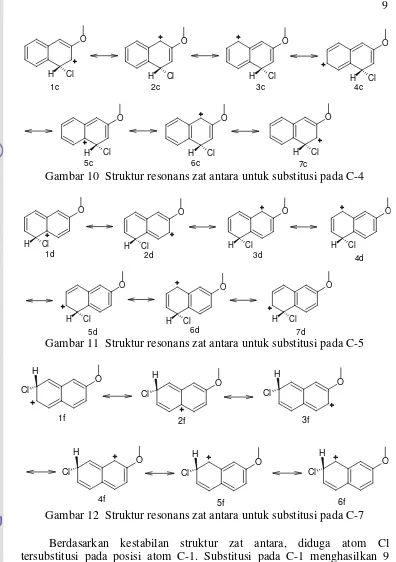
Gambar 10 Struktur resonans zat antara untuk substitusi pada C-4
O
Gambar 11 Struktur resonans zat antara untuk substitusi pada C-5
O
10
yaitu 6, tanpa ada struktur penyumbang utama (Gambar 12). Substitusi pada C-8 menghasilkan 8 struktur resonans, 1 di antaranya adalah penyumbang utama tanpa cincin benzenoid utuh (3g) (Gambar 13). Berdasarkan jumlah struktur penyumbang utama, substitusi pada C-1 akan paling disukai dibandingkan substitusi pada posisi lainnya.
O
Gambar 13 Struktur resonans zat antara untuk substitusi pada C-8 Substitusi tunggal pada produk klorinasi dengan isosianurat terklorinasi diduga disebabkan oleh pembentukan in situ Cl2(g) secara
berkesinambungan melalui penambahan isosianurat terklorinasi yang terkendali. Hasil ini sejalan dengan hasil yang diperoleh Alvarez (1976) dan Giordano dan Marco (1991). Giordano dan Marco (1991) melaporkan bahwa klorinasi 2-metoksinaftalena menggunakan alkali hipoklorit sebagai reagen pengklorinasi menghasilkan produk 1-kloro-2-metoksinaftalena. Sementara Alvares (1976) mendapatkan 1-kloro-2-metoksinaftalena dengan menggunakan gas Cl2 sebagai reagen pengklorinasi.
Hasil Klorinasi dengan NaOCl
Pembentukan Cl2(g) memanfaatkan prinsip reaksi redoks antara
NaOCl(aq) dan larutan asam. H2SO4(aq) dipilih sebagai larutan asam
didasarkan pada hasil percobaan awal untuk membandingkan kekuatan reduksi H2SO4(aq) 3 M dengan HCl(aq) 3 M terhadap NaOCl(aq). Hasil
percobaan tersebut menunjukkan bahwa hanya H2SO4(aq) 3 M yang mampu
mereduksi NaOCl(aq) menjadi Cl2(g). Hal ini dibuktikan oleh terbentuknya
gelembung gas pada campuran H2SO4(aq) 3 M dan NaOCl(aq) serta
munculnya gas berwarna kuning kehijauan, sedangkan HCl(aq) 3 M tidak
menampakkan ciri-ciri fisis tersebut (Gambar 14). Perbedaan kemampuan mereduksi ini dapat disebabkan oleh perbedaan kekuatan asam di antara keduanya.
Seperti pada isosianurat terklorinasi, kadar klorin aktif dalam NaOCl(aq) diukur menggunakan metode iodometri tidak langsung. Data
titrasi dan perhitungan ditunjukkan dalam Lampiran 5. Hasil pengukuran menunjukkan bahwa kadar klorin aktif yang diperoleh sangat tinggi. Meskipun demikian, kadar klorin aktif tersebut tidak menunjukkan kadar Cl2(g) sebenarnya yang dilepaskan selama sintesis berlangsung. Selain itu,
11 dan mulut labu yang tidak rapat, menyebabkan sejumlah Cl2(g) lepas ke
udara (Lampiran 6). Oleh karena itu, klorin aktif yang digunakan dalam tahap ini lebih dari 1 ekuivalen atau berlebih agar 2-metoksinaftalena terklorinasi seluruhnya.
Gambar 14 Klorinasi menggunakan HCl(aq) 3 M (a) dan H2SO4(aq) 3 M (b)
Selama proses klorinasi berlangsung, laju alir Cl2(g) dikendalikan
melalui penambahan NaOCl(aq) setetes demi setetes ke dalam H2SO4(aq) 3 M.
Seperti pada klorinasi dengan isosianurat terklorinasi, pengadukan dilakukan selama klorinasi berlangsung. Pengendalian laju alir dan pengadukan ini bertujuan menurunkan kemungkinan substitusi berulang terhadap 1 molekul 2-metoksinaftalena. Substitusi berulang akan menghasilkan campuran produk yang tidak diinginkan. Reaksi teramati dari perubahan warna larutan 2-metoksinaftalena dari tidak berwarna menjadi kuning (Gambar 15).
Gambar 15 Larutan 2-metoksinaftalena sebelum (a) dan setelah (b) klorinasi
Klorinasi dengan NaOCl juga didasarkan pada prinsip reaksi SEAr
antara Cl2 dan cincin aromatik dari 2-metoksinaftalena. Asam asetat dipilih
a b
12
sebagai pelarut sekaligus katalis dalam klorinasi ini. Pilihan ini didasarkan pada fakta bahwa asam asetat dapat terionisasi melepaskan ion H+ dan berperan dalam pembentukan elektrofili. Prinsip pembentukan elektrofili dengan diinisiasi oleh H+ sama seperti peranan asam-asam Lewis yang lazim digunakan sebagai katalis dalam SEAr, seperti AlCl3 dan FeBr3.
Alvares (1976) menggunakan asam asetat sebagai pelarut dan katalis dalam reaksi klorinasi antara 2-metoksinaftalena dan Cl2(g) dengan produk
klorinasi adalah 1-kloro-2-metoksinaftalena.
Berdasarkan hasil analisis GC (Lampiran 7), puncak-puncak produk klorinasi teramati pada menit ke-42.750 dan 42.868. Hasil analisis MS (Lampiran 8) menunjukkan kedua produk mengandung 3 atom Cl dalam cincin aromatik. Pendugaan ini didasarkan oleh adanya pola [M + 6]+ pada pola fragmentasi keduanya. Pola [M + 6]+ disebabkan oleh adanya 4 menggunakan suatu deret binomial. Nisbah isotop 35Cl dan 37Cl adalah 3:1 maka deret binomial yang digunakan adalah + � , dengan a = kelimpahan isotop 35Cl, b = kelimpahan isotop 37Cl, dan n = jumlah atom Cl dalam 1 molekul senyawa. Dengan demikian, nisbah intensitas keempat kombinasi tersebut adalah 27:27:9:1. Nisbah ini juga teramati pada pola fragmentasi kedua produk klorinasi.
13 intensitas yang lemah (17.65%). Ion fragmen ini masih memiliki pola [M + 6]+ yang mengindikasikan bahwa pembelahan β yang melepaskan radikal CH3• tidak disertai dengan pembelahan ikatan C-Cl (Gambar 16). Namun,
intensitas puncak yang rendah mengindikasikan bahwa ion fragmen ini tidak stabil dan mudah terdekomposisi lebih lanjut melepaskan molekul CO. Ion fragmen yang dihasilkan (m/z 216.9) memiliki intensitas yang kuat (100%). Pembelahan C-Cl mulai terjadi pada m/z 181.9, ditunjukkan dengan adanya pola [M + 4]+. Ion fragmen ini memiliki intensitas lemah dan segera membelah kembali. Pembelahan C-Cl kembali terjadi pada m/z 147 dan memunculkan pola [M + 2]+ dengan intensitas rendah (23.53%).
O menunjukkan pola pembelahan dan intensitas yang sama (23.53%) dengan ion fragmen m/z 147 pada puncak 1 sebelumnya.
Hasil interpretasi MS menunjukkan puncak 2 merupakan 2-hidroksinaftalena yang tersubstitusi oleh 3 atom Cl. Produk ini terbentuk diduga oleh adanya pengaruh substitusi atom Cl pada posisi atom C-1 sehingga memutus ikatan CH3O dan menghasilkan gugus HO. Selain itu,
14
ini mampu menstabilkan molekul produk karena muatan negatif terdelokalisasi.
Hasil yang diharapkan pada klorinasi ini ialah menghasilkan substitusi Cl tunggal pada atom C nomor 1 dari molekul 2-metoksinaftalena. Namun hasil interpretasi MS mengonfirmasi adanya substitusi berulang dari 3 atom Cl terhadap cincin aromatik dari 2-metoksinaftalena (puncak 1) dan 2-hidroksinaftalena (puncak 2). Hasil ini tidak sesuai dengan hasil yang dilaporkan Alvares (1976). Dalam laporannya, klorinasi langsung menggunakan gas Cl2 menghasilkan substitusi selektif pada C-1. Kegagalan
ini disebabkan oleh sulitnya mengontrol laju alir gas Cl2 dari labu berisi
Gambar 18 Hiperkonjugasi molekul produk puncak 2 dengan n = 0, 1, 2, 3 Selain itu, pengaruh suhu mungkin juga berpengaruh terhadap peningkatan terjadinya substitusi berulang. Reddy et al. (2013) melaporkan atom C-1 bersifat lebih aktif dari posisi atom C-6 dan C-8 pada suhu rendah. Dalam kondisi ini, kendali kinetika mendominasi terhadap kendali termodinamika. Kendali termodinamika memegang peranan pada suhu tinggi sehingga substitusi akan terjadi pada posisi atom C yang paling stabil, yaitu C-6.
Asilasi
Metode ini didasarkan pada prinsip asilasi Friedel-Crafts secara langsung. Asilasi Friedel-Crafts merupakan salah satu reaksi yang memanfaatkan prinsip SEAr. Elektrofili dibentuk dengan bantuan katalis
asam-asam Lewis (AlCl3 dan FeBr3) melalui pembentukan kompleks.
15 Fryhle 2011).
1-kloro-2-metoksinaftalena hasil klorinasi dengan isosianurat terklorinasi tanpa pemurnian selanjutnya diasilasi dengan propanoil klorida. Katalis (AlCl3•6H2O) digunakan sebanyak 1 ekivalen bertujuan mengurangi
pengkompleksan antara gugus karbonil dari 1-(5-kloro-6-metoksinaftalen-2-il)propan-1-on dengan AlCl3. Pembentukan kompleks ini akan membuat
cincin aromatik semakin menarik elektron. Selama asilasi dilakukan, suhu dikendalikan pada kisaran 25 °C yang bertujuan mengendalikan laju reaksi asilasi. Pada tahap akhir, produk asilasi dicuci dengan larutan asam untuk memutus kompleks antara 1-(5-kloro-6-metoksinaftalen-2-il)propan-1-on dengan katalis AlCl3 melalui proses hidrolisis. Dengan demikian, produk
asilasi dapat dipisahkan.
Hasil analisis GC tidak menampilkan puncak baru pada kromatogram (Lampiran 9). Hasil interpretasi MS juga gagal menghasilkan kesimpulan bahwa produk asilasi telah terbentuk. Puncak dominan yang teramati pada kromatogram GC adalah 2 puncak, masing-masing untuk puncak 2-metoksi naftalena dan puncak 1-kloro-2-metoksi naftalena. Kegagalan ini tidak sesuai dengan hasil yang didapatkan oleh Giordano dan Marco (1989). Dalam laporannya, 1-(5-kloro-6-metoksinaftalen-2-il)propan-1-on berhasil disintesis dengan rendemen mencapai 96%. Kegagalan ini diduga disebabkan oleh keberadaan air dari AlCl3•6H2O yang digunakan sebagai
katalis sehingga menurunkan reaktifitas propanoil klorida.
SIMPULAN DAN SARAN
1-kloro-2-metoksi-6-propilnaftalena-1,3-dioksolana (1:1) sebagai prekursor gagal disintesis dari bahan dasar 2-metoksinaftalena. Produk klorinasi dengan isosianurat terklorinasi didapatkan sebagai monoklorinasi sedangkan produk klorinasi dengan NaOCl didapatkan sebagai triklorinasi. Nisbah konversi produk klorinasi paling efisien diperoleh pada laju penambahan isosianurat terklorinasi sebesar 2.5 mmol/jam.
Sistem bebas-air air diperlukan keberhasilan proses asilasi. Selain itu, masih diperlukan optimasi efisiensi nisbah konversi produk dengan isosianurat terklorinasi. Elusidasi tiap senyawa yang terbentuk diperlukan agar struktur sebenarnya dapat dibuktikan.
DAFTAR PUSTAKA
Alaert G, Sumestri S, Santika. 1987. Metode Penelitian Air. Surabaya (ID): Usaha Nasional.
16
Field LD, Sternhell S, Kalman JR. 2008. Organic Structures from Spectra. Ed ke-4. Wiltshire (GB): Wiley.
Giordano C, Marco V, penemu; Zambon Group S.p.A. 1991 Okt 1. Process for preparing naproxen. US Patent IT 5053533.
Giordano C, Marco V, penemu; Zambon Group S.p.A. 1989 Feb 1. Process for preparing naproxen. European Patent IT 0301311.
Giordano C, Marco V, penemu; Blaschim S.p.A. 1983 Nov 8. Process for preparing esters of 2-(6’methoxy-2’naphthyl)-propionic acid via rearrangement of new ketals of 2-halo-1-(6’-methoxy-2’ -naphthyl)-propan-1-one and new esters of 2-(5’-bromo-6’-methoxy-2’ -naphthyl)-propionic acid thus prepared. US Patent IT 4414405.
Hazeltine B, Bull C. 2003. Field Guide of Appropriate Technology. San Diego (US): Academic Press.
[ICB] Institute of Certified Bookkeepers. 2002. Acetaminophen leads analgesics [Internet]. [diunduh 2013 Nov 30]. Tersedia pada:
http://www.icis.com/Articles/2002/09/06/acetaminophen-leads-analgesics.html
James DK, Komin AP, Siegman JR, penemu; Koch Industries, Inc. 1994 Feb 15. Process for preparation of 2-(6-methoxy-2-naphthyl)propionic acid and intermediates therefor utilizing 2,6-diisopropylnaphthalene. US Patent US 5286902.
McLafferty FW, Turecek F. 1993. Interpretation of Mass Spectra. Ed ke-4. Sausalito (US): University Science Books.
Pavia DL, Lampman GM, Kriz GS, Vyvyan JR. 2009. Introduction to Spectroscopy. Ed ke-4. Belmont (US): Brooks/Cole.
Piccolo O, Valoti E, Visentin G, penemu; Blaschim S.p.A. 1988 Apr 5. Process for preparing naproxen. US Patent IT 4736061.
Reddy KR, Rajanna KC, Uppalaiah K. 2013. Environmentally benign contemporary Friedel-Crafts acylation of 1-halo-2-methoxynaphthalenes and its related compounds under conventional and nonconventional conditions. Tetrahedron Letters. 54: 3431-3436. Rosyidi MB. 2010. Pengaruh breakpoint chlorination (BPC) terhadap jumlah bakteri koliform dari limbah cair rumah sakit umum daerah Sidoarjo [skripsi]. Surabaya (ID): Institut Teknologi Sepuluh November.
Solomon TWG, Fryhle CB. 2011. Organic Chemistry. Volume ke-10. New York (US): Wiley.
[BSN] Badan Standardisasi Nasional. 2005. SNI 19-7119.8-2005 Udara ambien – Bagian 8: Cara uji kadar oksigen dengan metode neutral buffer kalium iodide (NBKI) menggunakan spektrofotometer [Internet]. [diunduh 2014 Sep 2]. Tersedia pada: http://sisni.bsn.go.id [US FDA] United States Food and Drug Administration. 2008. Vicoproven
17
B1
Lampiran 1 Diagram alir penelitian
O
B1 1-kloro-2-metoksi-naftalena B2 2-metoksinaftalena triklorinasi B3 2-hidroksinaftalena triklorinasi C
1-(5-kloro-6-metoksinaftalen-2-il) propan-1-on
18
Lampiran 2 Penentuan kadar klorin aktif dalam isosianurat terklorinasi menggunakan metode iodometri tidak langsung
Data titrasi Ca(OCl)2 1,006 ppm dengan Na2S2O3 0.0978 N
Volume Ca(OCl)2 (mL)
Volume Na2S2O3 (mL)
[Cl2] (ppm)
blangko 0.00 0.00
5 1.00 693.4020
5 0.90 624.0618
5 1.00 693.4020
rerata 670.2886
Perhitungan
Kadar klorin aktif ulangan 1:
[Cl ] = × � S � × � S × BM Cl h
= × . mL × . mL N × . = . ppm
Rerata kadar klor aktif (ppm):
�̅ = ∑�= �� = . ppm
Standar deviasi:
�� = √ ∑ �� − �̅ −
�= = .
� � � = | − ��
19 Lampiran 3 Penentuan nisbah konversi produk klorinasi dengan isosianurat terklorinasi
Laju penambahan 0.5 mmol/jam:
Nisbah konversi produk = Ar r
Ar h w
= 8686
86
20
Lampiran 4 Kromatogram MS produk klorinasi dengan isosianurat terklorinasi
a) Kromatogram MS puncak menit ke-26.909
b) Kromatogram MS puncak menit ke-33.981 158.0
115.0
21 Lampiran 5 Penentuan kadar klorin dalam NaOCl menggunakan metode
iodometri tidak langsung
rerata 878.3092 35,132.3680
Perhitungan
22
[Cl ] = × � S � × � S × BM Cl
h
= × . mL × . mL N × . = . ppm
Rerata [Cl2] pengenceran (ppm): �̅ = ∑�= �� = . ppm
[Cl ] � = [Cl ] ×
= . × = , .
Rerata [Cl2] sebenarnya (ppm): �̅ = ∑�= �� = , . ppm
Standar deviasi:
�� = √ ∑ �� − �̅ −
�= = .
� � � = | − ��
23 Lampiran 6 Rangkaian radas sintesis 1-kloro-2-metoksinaftalena
NaOCl(aq)
H2SO4(aq) 3 M Cl2(g) 2-metoksinaftalena
24
Lampiran 7 Kromatogram GC produk klorinasi dengan NaOCl
42.750
25 Lampiran 8 Kromatogram MS produk klorinasi dengan NaOCl
a) Kromatogram MS puncak menit ke-42.928
b) Kromatogram MS puncak menit ke-43.058 259.9 216.9
26
Lampiran 9 Kromatogram GC produk asilasi dengan isosianurat terklorinasi
27
RIWAYAT HIDUP
Penulis dilahirkan di Bangkalan pada tanggal 22 Maret 1992 dari ayah Kusnan (alm) dan Ibu Siti Komariyah, Spd. Penulis merupakan putri tunggal. Tahun 2010 penulis lulus dari SMU Negeri 3 Pamekasan dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB dan diterima di Departemen Kimia, Fakultas Matematika dan Ilmu pengetahuan Alam.
Selama mengikuti perkuliahan, penulis aktif sebagai staf Divisi Kajian dan Strategi BEM FMIPA IPB 2012 dan pengurus Rohis Kelas 20102014. Penulis juga pernah menjadi tutor sebaya Asrama Putri TPB 2010, asisten praktikum Kimia Organik Berbasis Kompetensi 2012/2013, asisten responsi Kimia Organik 1 periode Semester Pendek 2012/2013, asisten praktikum Kimia Organik Layanan ITP 2013/2014, asisten praktikum Kimia Fisik Layanan Biokimia 2013/2014, dan asisten responsi Kimia Organik 2 2013/2014. Pada Juli-Agustus 2013 penulis melaksanakan praktik lapangan di Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (PPB-LIPI) Cibinong dengan judul Penapisan Antibakteri Ekstrak Jamur Endofit dari Daun Ginseng Kuning (Rennelia elliptica).