1 PENDAHULUAN
1.1 Latar Belakang
Ikan pari merupakan komoditas hasil perairan dengan jumlahnya cukup banyak di Indonesia. Ikan ini merupakan kelompok ikan bertulang rawan kelas Chondrichthyes (Nelson 1994). Indonesia tercatat sebagai negara dengan pemanfaatan ikan bertulang rawan terbesar di dunia dengan dugaan hasil tangkapan sebesar 118.000 ton pada tahun 2008. Saat itu, total tangkapan pari dunia mencapai 736.491 ton (FAO 2008). Jumlah hasil tangkapan tersebut menempatkan Indonesia sebagai negara ketiga terbesar penangkap ikan pari dunia, menggantikan Amerika Serikat pada tahun 2007.
Ikan pari seringkali bukan merupakan ikan tangkapan utama. Marwoto et al. (2005) menyampaikan bahwa larangan pengoperasian trawl di Indonesia menyebabkan nelayan menggunakan jaring arad untuk menangkap udang di dasar perairan dan seringkali menangkap ikan pari sebagai hasil sampingan (by catch). Lebih lanjut White et al. (2006) menyampaikan bahwa ikan pari hasil tangkapan biasanya dibuang atau dimanfaatkan tidak optimal, misalnya hanya diambil kulitnya saja.
Sebanyak 171 jenis ikan elasmobranchii ditemukan di dunia berasal dari perairan tawar dan muara sungai, yang terdiri dari 68 genus dan 34 famili. Keanekaragaman dan kelimpahan ikan elasmobranchii air tawar dan muara sungai tertinggi ditemukan di negara-negara tropis (Tsuguo 1999). Husnah (2009) menyampaikan bahwa sungai Musi memiliki keanekaragaman ikan yang tinggi, sedikitnya lebih 234 jenis telah ditemukan di bagian hulu hingga hilir dari sungai ini. Sampai saat ini informasi mengenai pemanfaatan ikan pari air tawar belum ada.
2
et al. 2001), tulang ikan sturgeon (Zheng et al. 2008), dan kulit teripang (Chen et al. 2011).
Murado et al. (2010) memaparkan bahwa sebanyak 80% dari tubuh ikan pari tersusun atas tulang rawan. Lignot et al. (2003) lebih lanjut menjelaskan bahwa jaringan tulang rawan ikan pari mengandung molekul glikosaminoglikan terutama kondroitin sulfat. Glikosaminoglikan pada tulang rawan ikan pari ini terikat secara kovalen dengan protein membentuk kompleks proteoglikan yang menempel pada jaringan fibril kolagen.
Pearle et al. (2005) menyatakan bahwa secara teoritis, tulang rawan terdiri dari kondrosit atau sel tulang rawan serta matriks ekstraseluler padat yang tersusun atas air, kolagen, dan proteoglikan. Kadar air tulang rawan berkisar 65-80% dari berat basah. Porter et al. (2006) menyatakan kadar kolagen dan proteoglikan pada tulang rawan pari masing-masing sekitar 17,4% dan 19,6%. Proteoglikan merupakan hasil interaksi antara protein dan glikosaminoglikan. Bentuk yang umum dari glikosaminoglikan adalah heparan sulfat dan kondroitin sulfat. Zhang (2010) juga menambahkan bahwa kedua bentuk tersebut merupakan polimerisasi dan modifikasi enzim yang dikodekan oleh lebih dari 40 gen pada sel-sel tubuh hewan.
3
berkurangnya kadar dan komposisi proteoglikan pada tulang. Simanek et al. (2005) dalam hal ini menjelaskan bahwa osteoartritis muncul karena meningkatnya kadar matriks metalloproteinase yang memiliki aktifitas degradatif terhadap protein jaringan ikat, contohnya kolagen, elastin, proteoglikan, dan laminin. Hal ini menyebabkan ketidakmampuan sel tulang rawan dalam membentuk kembali matriks ekstraseluler yang penting bagi kesehatan sendi, sehingga terjadilah kerusakan sendi yang merupakan awal dari osteoartritis. Penyakit ini telah menjangkit lebih dari 40 juta warga Amerika. Pearle et al. (2005) menambahkan bahwa sekitar 10% orang dewasa berumur lebih dari 50 tahun di Amerika mengalami osteoartritis.
Schneider et al. (2012) menyatakan bahwa sodium kondroitin sulfat dalam bentuk yang dapat dimakan telah diproduksi oleh beberapa perusahaan. Kondroitin sulfat tersebut berasal dari trakea sapi atau tulang rawan unggas. Structum® merupakan contoh produk kondroitin sulfat yang telah diproduksi dan berbahan baku tulang rawan unggas. Produk ini telah diterima secara internasional sejak tahun 1993. Adebowale et al. (2000) menambahkan bahwa lebih dari lima tahun terakhir terdapat peningkatan jumlah suplemen makanan secara signifikan yang telah diperkenalkan ke pasaran. Penjualan glukosamin dan kondroitin sulfat diduga telah lebih dari 500 juta produk yang dijual eceran pada Juli 1998 hingga Mei 1999. Menurut NPS (2003), glikosaminoglikan secara luas telah dimanfaatkan dalam terapi osteoartritis dengan tingkat asupan untuk orang dewasa sebanyak 800-1200 mg per hari.
anion-4
exchange chromatography dan presipitasi konsentrasi etanol yang berbeda. Selain itu dikembangkan juga teknologi solvent-free mechanochemical extraction (SFMCE) (Wang & Tang 2009) dan hidrolisis alkalin hidroalkohol (Murado et al. 2010).
Lignot et al. (2003) melakukan ekstraksi enzimatis dan pemurnian dengan ultrafiltrasi terhadap tulang rawan berbagai jenis pari dan menghasilkan glikosaminoglikan dengan tingkat konsentrasi berkisar 1,3 g/100 mL. Penelitian lain juga dilakukan oleh Garnjanagoonchorn et al. (2007) yaitu dengan mengekstrak glikosaminoglikan dari sirip hiu dan tulang rawan pari (Dasyatis zugei) dengan ekstraksi enzimatis dan pemurnian dengan cetylpyridinium chloride. Glikosaminoglikan yang dihasilkan dari masing-masing sumber tersebut adalah sebesar 1,5 g/100 mL dan 0,749 g/100 mL.
Berdasarkan berbagai kajian tersebut, maka tujuan penelitian ini adalah mempelajari karakteristik hasil ekstraksi glikosaminoglikan dari tulang rawan ikan pari air laut (N. kuhlii) dan pari air tawar (H. signifer).
1.2 Tujuan
Penelitian ini bertujuan:
1) Mempelajari metode ekstraksi glikosaminoglikan dari tulang rawan ikan pari air laut (Neotrygon kuhlii) dan pari air tawar (Himantura signifer) secara enzimatis.
EKSTRAKSI GLIKOSAMINOGLIKAN
DARI TULANG RAWAN IKAN PARI AIR LAUT
(
Neotrygon kuhlii
) DAN PARI AIR TAWAR (
Himantura signifer
)
ANDRI DWI PUJIASTUTI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
RINGKASAN
ANDRI DWI PUJIASTUTI. Ekstraksi Glikosaminoglikan dari Tulang Rawan Ikan Pari Air Laut (Neotrygon kuhlii) dan Pari Air Tawar (Himantura signifer). Dibimbing oleh BAMBANG RIYANTO dan TATI NURHAYATI.
Ikan pari merupakan komoditas hasil perairan yang besar di Indonesia. Berdasarkan jumlah produksinya, telah menempatkan Indonesia sebagai negara ke-3 terbesar penangkap ikan pari dunia. Selain itu, Indonesia juga memiliki keanekaragaman dan kelimpahan ikan pari air tawar dan muara sungai terbesar, akan tetapi sampai saat ini pemanfaatannya belum pernah dilakukan. Berbagai penelitian telah menyampaikan bahwa jaringan tulang rawan ikan pari mengandung molekul glikosaminoglikan, terutama kondroitin sulfat. Potensi tulang rawan ikan pari ini belum banyak dikembangkan. Glikosaminoglikan secara luas telah dimanfaatkan dalam terapi osteoartritis, dengan tingkat asupan untuk orang dewasa sebanyak 800-1200 mg per hari. Teknologi untuk menghasilkan glikosaminoglikan juga telah dikembangkan, antara lain menggunakan ekstraksi alkali dan ekstraksi enzimatis beserta pemurniannya. Berdasarkan hal tersebut, maka tujuan penelitian ini adalah untuk mempelajari karakteristik hasil ekstraksi glikosaminoglikan dari tulang rawan ikan pari air laut (Neotrygon Kuhlii) dan pari air tawar (Himantura Signifer).
EKSTRAKSI GLIKOSAMINOGLIKAN
DARI TULANG RAWAN IKAN PARI AIR LAUT (
Neotrygon
kuhlii
) DAN PARI AIR TAWAR (
Himantura signifer
)
ANDRI DWI PUJIASTUTI C34080003
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Ekstraksi Glikosaminoglikan dari Tulang Rawan Ikan Pari Air Laut (Neotrygon kuhlii) dan Pari Air Tawar (Himantura signifer)
Nama : Andri Dwi Pujiastuti
NRP : C34080003
Program Studi : Teknologi Hasil Perairan
Menyetujui,
Dosen Pembimbing I Dosen Pembimbing II
Bambang Riyanto, S.Pi., M.Si. Dr. Tati Nurhayati, S.Pi., M.Si. NIP. 19690603 199802 1 001 NIP. 19700807 199603 2 002
Mengetahui:
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP. 19580511 1985 03 1 002
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul Ekstraksi Glikosaminoglikan dari Tulang Rawan Ikan Pari Air Laut (Neotrygon kuhlii) dan Pari Air Tawar (Himantura signifer) adalah karya saya dengan arahan dari
komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Pebruari 2013
Andri Dwi Pujiastuti
RIWAYAT HIDUP .
Penulis dilahirkan di Meulaboh, Daerah Istimewa Aceh pada tanggal 17 Desember 1990. Penulis merupakan anak kedua dari pasangan Mastika Andika dan Fitriana.
Penulis memulai jenjang pendidikan formal di SD Inpres Simalingkar, Medan, Sumatera Utara (tahun 1996-1997), kemudian penulis pindah sekolah di SDN 47 Lubuklinggau, Sumatera Selatan (tahun 1997-2002). Penulis melanjutkan pendidikannya di SMPN 4 Lubuklinggau, Sumatera Selatan (tahun 2002-2005). Pendidikan menengah atas ditempuh penulis di SMAN 1 Lubuklinggau, Sumatera Selatan (tahun 2005-2008). Penulis diterima di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) pada tahun 2008.
Selama masa perkuliahan, penulis aktif dalam berbagai organisasi kemahasiswaan, yaitu menjadi anggota Unit Kegiatan Mahasiswa Gentra Kaheman periode 2008-2009, Himpunan Mahasiswa Teknologi Hasil Perikanan (Himasilkan) sebagai sekretaris Divisi Informasi dan Komunikasi periode 2009-2010, dan Badan Eksekutif Mahasiswa (BEM) Fakultas Perikanan dan Ilmu Kelautan sebagai anggota Divisi Pengembangan Sumberdaya Manusia periode 2010-2011. Penulis juga aktif dalam berbagai kepanitiaan di berbagai kegiatan kemahasiswaan di Institut Pertanian Bogor. Penulis juga pernah mengikuti pelatihan HACCP 2012 yang diadakan di Institut Pertanian Bogor. Penulis melakukan penelitian yang berjudul “Ekstraksi Glikosaminoglikan dari Tulang Rawan Ikan Pari Air Laut (Neotrygon Kuhlii) dan Pari Air Tawar (Himantura Signifer)”.
KATA PENGANTAR
Ucapan syukur penulis panjatkan ke hadirat Allah SWT. atas karunia-Nya yang berlimpah, yang membuat penulis dapat menyelesaikan skripsi dengan judul
“Ekstraksi Glikosaminoglikan dari Tulang Rawan Ikan Pari Air Laut (Neotrygon Kuhlii) dan Pari Air Tawar (Himantura Signifer)”.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan skripsi ini, terutama kepada:
1. Bapak Bambang Riyanto S.Pi., M.Si. dan Ibu Dr. Tati Nurhayati, S.Pi., M.Si. selaku dosen pembimbing atas motivasi, nasehat, saran, bimbingan, dan arahan dalam penulisan dan penyempurnaan skripsi.
2. Bapak Dr. Ir. Agoes M. Jacob, Dipl, Biol. selaku ketua program studi S1 Departemen Teknologi Hasil Perairan, Institut Pertanian Bogor.
3. Kedua orang tua, kakak, adik tercinta serta keluarga besar penulis, atas dukungan moral maupun materil yang telah diberikan kepada penulis tanpa batas.
4. Bapak Dr. Adi Pancoro selaku dosen Genetika dan Bioteknologi Molekuler, Sekolah Ilmu Teknologi Hayati (SITH), Institut Teknologi Bandung atas segala bantuan dan dukungannya selama masa penelitian.
5. Ibu Dewi di Laboratorium Bioteknologi Hewan, Pusat Antar Universitas (PAU), Institut Pertanian Bogor atas bantuannya selama masa penelitian. 6. Teman-teman seperjuangan di THP yang bersedia membantu dan selalu
memberikan semangatnya, Steven, Nia, Rivi, Hardi, Hilma, Aksar, Aninta, Riyan, Desi, Dimas, Vini, dan Udoh.
7. Beberapa pihak lain yang telah memberikan bantuan yang sangat bermanfaat, Bang Yoyo, Mbak Dini, Mbak Lastri, Bu Ema, Dinna, Henry, Syukron, Mas Titot, Kak Deksu, Bang Donny, dan Kak Belny.
8. Sahabat-sahabat “Shofura” yang selalu setia menemani di saat suka dan duka serta memberikan semangat dan doanya, Sekar, Tira, Aninta, Wide, dan Anita.
viii
10. Seluruh pihak yang telah membantu yang tidak dapat penulis sebutkan satu persatu atas segala keikhlasannya membantu penulis menyelesaikan skripsi.
Penulis menyadari bahwa penulisan skripsi ini masih belum sempurna, sehingga kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan.
Bogor , Pebruari 2013
DAFTAR ISI
3.3.1 Preparasi dan karakterisasi tulang rawan ... 18
3.3.2 Ekstraksi enzimatis (Lignot et al. 2003) dan dialisis (Garnjanagoonchorn et al. 2007) ... 18
3.4 Prosedur Pengujian ... 19
3.4.1 Analisis kadar air (AOAC 2005) ... 19
3.4.2 Analisis kadar abu (AOAC 2005) ... 20
3.4.3 Analisis asam amino dengan metode High Performance Liquid Chromatography (HPLC) (Millipore Corp. 1993) ... 20
3.4.4 Analisis konsentrasi glikosaminoglikan dengan metode spektrofotometri menggunakan sulfate GAGs assay (Jong et al. (1989) dimodifikasi dengan Zhou et al. (2002)) ... 21
3.4.5 Analisis spektrum gugus fungsi glikosaminoglikan menggunakan Fourier Transform Infra-Red (FTIR) (Garnjanagoonchorn et al. 2007 yang Dimodifikasi) ... 21
4 HASIL DAN PEMBAHASAN ... 23
x
4.1.1 Kadar air dan abu tulang rawan pari ... 23
4.1.2 Komposisi asam amino tulang rawan pari ... 24
4.2 Konsentrasi Glikosaminoglikan Tulang Rawan Ikan Pari Air Laut (Neotrygon kuhlii) dan Tulang Rawan Ikan Pari Air Tawar (Himantura signifer) ... 26
4.3 Spektrum Glikosaminoglikan Tulang Rawan Ikan Pari Air Laut (Neotrygon kuhlii) dan Tulang Rawan Ikan Pari Air Tawar (Himantura signifer) ... 27
4.4 Bentuk Fisik Glikosaminoglikan Pari Air Laut (Neotrygon kuhlii) dan Pari Air Tawar (Himantura signifer)... 31
5 SIMPULAN DAN SARAN ... 33
5.1 Simpulan ... 33
5.2 Saran ... 33
DAFTAR PUSTAKA ... 34
DAFTAR GAMBAR
Nomor Teks Halaman
1 Morfologi ikan pari air tawar (Himantura signifer) (Humphreys 2012) .. 6
2 Morfologi ikan pari air laut (Neotrygon kuhlii) ... 7
3 Penampang struktur tulang rawan (Hamlett 1999) ... 10
4 Proteoglikan (Nakamura 2011) ... 12
5 Struktur kimia kondroitin sulfat (Zhou et al. 2002) ... 14
6 Penampakan jaringan tulang rawan artikular (A) sehat dan (B) mengalami osteoartritis (Pearle et al. 2005) ... 16
7 Spektrum glikosaminoglikan pari air tawar (Himantura signifer) ... 28
8 Spektrum glikosaminoglikan pari air laut (Neotrygon kuhlii) ... 28
9 Spektrum kondroitin-4-sulfat standar ... 29
DAFTAR TABEL
Nomor Teks Halaman
1 Hasil analisis kadar air dan abu tulang rawan ikan pari air laut (Neotrygon kuhlii) dan pari air tawar (Himantura signifer) ... 23 2 Hasil analisis asam amino tulang rawan ikan pari air laut
(Neotrygon kuhlii) dan pari air tawar (Himantura signifer) ... 25 3 Konsentrasi (mg/100 mL) glikosaminoglikan tulang rawan ikan pari
DAFTAR LAMPIRAN
Nomor Halaman
1 Kurva standar pengujian tingkat konsentrasi glikosaminoglikan ... 41 2 Delapan daerah terpenting pada penentuan spektrum inframerah ... 41 3 Spektrum standar kondroitin-4-sulfat (Garnjanagoonchorn et al.
2007) ... 42 4 Spektrum standar kondroitin-6-sulfat (Garnjanagoonchorn et al.
1 PENDAHULUAN
1.1 Latar Belakang
Ikan pari merupakan komoditas hasil perairan dengan jumlahnya cukup banyak di Indonesia. Ikan ini merupakan kelompok ikan bertulang rawan kelas Chondrichthyes (Nelson 1994). Indonesia tercatat sebagai negara dengan pemanfaatan ikan bertulang rawan terbesar di dunia dengan dugaan hasil tangkapan sebesar 118.000 ton pada tahun 2008. Saat itu, total tangkapan pari dunia mencapai 736.491 ton (FAO 2008). Jumlah hasil tangkapan tersebut menempatkan Indonesia sebagai negara ketiga terbesar penangkap ikan pari dunia, menggantikan Amerika Serikat pada tahun 2007.
Ikan pari seringkali bukan merupakan ikan tangkapan utama. Marwoto et al. (2005) menyampaikan bahwa larangan pengoperasian trawl di Indonesia menyebabkan nelayan menggunakan jaring arad untuk menangkap udang di dasar perairan dan seringkali menangkap ikan pari sebagai hasil sampingan (by catch). Lebih lanjut White et al. (2006) menyampaikan bahwa ikan pari hasil tangkapan biasanya dibuang atau dimanfaatkan tidak optimal, misalnya hanya diambil kulitnya saja.
Sebanyak 171 jenis ikan elasmobranchii ditemukan di dunia berasal dari perairan tawar dan muara sungai, yang terdiri dari 68 genus dan 34 famili. Keanekaragaman dan kelimpahan ikan elasmobranchii air tawar dan muara sungai tertinggi ditemukan di negara-negara tropis (Tsuguo 1999). Husnah (2009) menyampaikan bahwa sungai Musi memiliki keanekaragaman ikan yang tinggi, sedikitnya lebih 234 jenis telah ditemukan di bagian hulu hingga hilir dari sungai ini. Sampai saat ini informasi mengenai pemanfaatan ikan pari air tawar belum ada.
2
et al. 2001), tulang ikan sturgeon (Zheng et al. 2008), dan kulit teripang (Chen et al. 2011).
Murado et al. (2010) memaparkan bahwa sebanyak 80% dari tubuh ikan pari tersusun atas tulang rawan. Lignot et al. (2003) lebih lanjut menjelaskan bahwa jaringan tulang rawan ikan pari mengandung molekul glikosaminoglikan terutama kondroitin sulfat. Glikosaminoglikan pada tulang rawan ikan pari ini terikat secara kovalen dengan protein membentuk kompleks proteoglikan yang menempel pada jaringan fibril kolagen.
Pearle et al. (2005) menyatakan bahwa secara teoritis, tulang rawan terdiri dari kondrosit atau sel tulang rawan serta matriks ekstraseluler padat yang tersusun atas air, kolagen, dan proteoglikan. Kadar air tulang rawan berkisar 65-80% dari berat basah. Porter et al. (2006) menyatakan kadar kolagen dan proteoglikan pada tulang rawan pari masing-masing sekitar 17,4% dan 19,6%. Proteoglikan merupakan hasil interaksi antara protein dan glikosaminoglikan. Bentuk yang umum dari glikosaminoglikan adalah heparan sulfat dan kondroitin sulfat. Zhang (2010) juga menambahkan bahwa kedua bentuk tersebut merupakan polimerisasi dan modifikasi enzim yang dikodekan oleh lebih dari 40 gen pada sel-sel tubuh hewan.
3
berkurangnya kadar dan komposisi proteoglikan pada tulang. Simanek et al. (2005) dalam hal ini menjelaskan bahwa osteoartritis muncul karena meningkatnya kadar matriks metalloproteinase yang memiliki aktifitas degradatif terhadap protein jaringan ikat, contohnya kolagen, elastin, proteoglikan, dan laminin. Hal ini menyebabkan ketidakmampuan sel tulang rawan dalam membentuk kembali matriks ekstraseluler yang penting bagi kesehatan sendi, sehingga terjadilah kerusakan sendi yang merupakan awal dari osteoartritis. Penyakit ini telah menjangkit lebih dari 40 juta warga Amerika. Pearle et al. (2005) menambahkan bahwa sekitar 10% orang dewasa berumur lebih dari 50 tahun di Amerika mengalami osteoartritis.
Schneider et al. (2012) menyatakan bahwa sodium kondroitin sulfat dalam bentuk yang dapat dimakan telah diproduksi oleh beberapa perusahaan. Kondroitin sulfat tersebut berasal dari trakea sapi atau tulang rawan unggas. Structum® merupakan contoh produk kondroitin sulfat yang telah diproduksi dan berbahan baku tulang rawan unggas. Produk ini telah diterima secara internasional sejak tahun 1993. Adebowale et al. (2000) menambahkan bahwa lebih dari lima tahun terakhir terdapat peningkatan jumlah suplemen makanan secara signifikan yang telah diperkenalkan ke pasaran. Penjualan glukosamin dan kondroitin sulfat diduga telah lebih dari 500 juta produk yang dijual eceran pada Juli 1998 hingga Mei 1999. Menurut NPS (2003), glikosaminoglikan secara luas telah dimanfaatkan dalam terapi osteoartritis dengan tingkat asupan untuk orang dewasa sebanyak 800-1200 mg per hari.
anion-4
exchange chromatography dan presipitasi konsentrasi etanol yang berbeda. Selain itu dikembangkan juga teknologi solvent-free mechanochemical extraction (SFMCE) (Wang & Tang 2009) dan hidrolisis alkalin hidroalkohol (Murado et al. 2010).
Lignot et al. (2003) melakukan ekstraksi enzimatis dan pemurnian dengan ultrafiltrasi terhadap tulang rawan berbagai jenis pari dan menghasilkan glikosaminoglikan dengan tingkat konsentrasi berkisar 1,3 g/100 mL. Penelitian lain juga dilakukan oleh Garnjanagoonchorn et al. (2007) yaitu dengan mengekstrak glikosaminoglikan dari sirip hiu dan tulang rawan pari (Dasyatis zugei) dengan ekstraksi enzimatis dan pemurnian dengan cetylpyridinium chloride. Glikosaminoglikan yang dihasilkan dari masing-masing sumber tersebut adalah sebesar 1,5 g/100 mL dan 0,749 g/100 mL.
Berdasarkan berbagai kajian tersebut, maka tujuan penelitian ini adalah mempelajari karakteristik hasil ekstraksi glikosaminoglikan dari tulang rawan ikan pari air laut (N. kuhlii) dan pari air tawar (H. signifer).
1.2 Tujuan
Penelitian ini bertujuan:
1) Mempelajari metode ekstraksi glikosaminoglikan dari tulang rawan ikan pari air laut (Neotrygon kuhlii) dan pari air tawar (Himantura signifer) secara enzimatis.
2 TINJAUAN PUSTAKA
2.1 Deskripsi Pari
Ikan pari merupakan ikan bertulang rawan yang termasuk ke dalam kelas Chondrichthyes. Menurut Agustono (2008), habitat yang disenangi ikan pari adalah dasar perairan pantai yang dangkal dengan substrat pasir dan lumpur, dekat
rataan terumbu karang, teluk, muara sungai dan air tawar. Candramila dan Junardi (2006) menjelaskan bahwa elasmobranchii adalah
kelompok ikan bertulang rawan yang penting dan memiliki nilai komersial yang tinggi. Anggota elasmobranchii meliputi pari dan hiu. Ikan ini unik karena termasuk dalam kelompok ikan purba yang masih hidup dengan karakter yang berbeda dengan ikan bertulang sejati. Sifat-sifat biologi elasmobranchii antara lain fekunditas rendah, pertumbuhan lambat, umur yang panjang dan resiko kematian tinggi pada semua tingkat umur. Klasifikasi ikan pari menurut Nelson (1976)
6
makanannya adalah krustasea dan kerang-kerangan. Himantura signifer bersifat ovovivipar dan berkembang biak di perairan tawar. Bagian dorsalnya memiliki duri beracun yang sangat berbahaya (Kottelat et al. 1993). Ip et al. (2009) menjelaskan bahwa kemampuan beradaptasi di perairan tawar disebabkan oleh adanya pengaturan tekanan osmotic pada tubuh ikan pari yang bersifat hiperosmotik. Kondisi tersebut memungkinkan tubuh ikan mudah kehilangan ion-ion dan menyerap air dari lingkungan untuk mengganti ion-ion-ion-ion yang terbuang. Morfologi ikan pari air tawar (Himantura signifer) dapat dilihat pada Gambar 1.
Gambar 1 Morfologi ikan pari air tawar (Himantura signifer) (Humphreys 2012).
Klasifikasi Himantura signifer menurut Nelson (1994) adalah sebagai berikut:
Filum : Chordata Kelas : Elasmobranchii Ordo : Rajiformes Famili : Dasyatidae Genus : Himantura
Spesies : Himantura signifer
7
2.1.2 Ikan pari air laut
Menurut Tam et al. (2003), ikan bertulang rawan yang hidup di laut umumnya ditemukan di perairan tropis. Pengaturan tekanan osmotik dalam tubuhnya bersifat hipoionik dengan tekanan osmotik cairan tubuhnya sama atau lebih tinggi dibandingkan tekanan osmotik lingkungan sekitarnya. Cairan ekstraseluler tubuhnya mengandung garam dengan konsentrasi yang lebih rendah daripada lingkungan sekitarnya sehingga perbedaan tekanan osmotik diseimbangkan dengan adanya senyawa ekstraseluler yang mengandung nitrogen organik. Hal yang membedakan ikan air laut bertulang rawan dengan ikan bertulang sejati adalah ikan bertulang rawan bersifat ureosmotik. Ip et al. (2009) menjelaskan bahwa elasmobranchii air laut beradaptasi terhadap lingkungannya secara hipoosmotik. Cairan ekstraseluler tubuhnya mengandung ion-ion dalam konsentrasi lebih rendah dari lingkungan laut, namun osmolalitas plasma dipertahankan hiperosmotik terhadap medium eksternal dengan disekresikannya urea.
Neotrygon kuhlii merupakan salah satu jenis ikan pari yang hidup di wilayah perairan laut. Neotrygon kuhlii memiliki selaput kulit yang ramping di bagian bawah ekor dan bagian atas ekor setelah duri sengat. Ekornya tidak seperti cambuk dan bagian ujungnya berwarna belang hitam-putih yang lebar. Moncongnya pendek dengan garis lebar berwarna hitam melintang di atas mata. Bagian atas tubuhnya dihiasi oleh bintik-bintik berwarna biru cerah. Bagian ekor sebelum duri sengat tidak dilengkapi dengan duri-duri pendek (White et al. 2006). Morfologi ikan pari air laut (Neotrygon kuhlii) dapat dilihat pada Gambar 2.
8
Klasifikasi Neotrygon kuhlii menurut Nelson (1994) adalah sebagai berikut: Filum : Chordata
Neotrygon kuhlii umumnya memiliki lebar badan sekitar 38 cm. Ikan pari jantan dapat memiliki lebar badan sebesar 22-23 cm. Ikan pari ini umumnya dijumpai di perairan Indo-Pasifik Barat sampai Melanesia, termasuk selatan Jepang dan Australia. Neotrygon kuhlii merupakan ikan demersal di perairan dangkal dan paparan benua pada kedalaman hingga 90 m. Berdasarkan cara reproduksinya, pari jenis ini bersifat vivipar dengan kecenderungan histotrofi, yaitu melahirkan 1-2 ekor anak dengan masa kandungan yang belum diketahui serta waktu musim kawin yang tidak tetap. Makanannya terdiri dari krustasea dan ikan-ikan kecil. Neotrygon kuhlii sering tertangkap dalam jumlah yang banyak oleh pukat dasar, jaring udang, dan perangkap ikan. Bagian tubuh yang dimanfaatkan dari ikan ini adalah dagingnya (White et al. 2006).
2.2 Tulang Rawan
9
Tulang rawan merupakan komposit viskoelastis yang dibentuk oleh sel kondrosit. Sel tersebut mensekresikan matriks ekstraseluler yang banyak mengandung proteoglikan dan kolagen. Proteoglikan memiliki kemampuan untuk menyerap air, sementara kolagen berfungsi sebagai jaringan yang meningkatkan daya regang tulang rawan. Tulang rawan merupakan bahan yang penting dalam kerangka ikan dan pada beberapa taksa tulang rawan merupakan bahan pembentuk kerangka utama sepanjang hidupnya. Tulang rawan pada ikan bertulang sejati merupakan bahan utama pembentuk kerangka selama fase larva. Jenis tulang rawan yang beragam pada ikan bertulang sejati menunjukkan adanya fungsi tulang rawan yang beragam pula. Fungsi-fungsi tulang rawan tersebut diduga sebagai bantalan untuk mengurangi gesekan, sebagai sambungan atau persendian yang fleksibel, serta sebagai pemberi bentuk rigid atau kaku dalam struktur yang tipis (Shadwick dan Lauder 2006). Kittiphattanabawon et al. (2010) menyatakan bahwa tulang rawan merupakan suatu bentuk jaringan penghubung yang secara kimiawi banyak mengandung kolagen, proteoglikan, polisakarida ber-asam, dan air. Hal ini didukung oleh pendapat dari Pearle et al. (2005) yang menyatakan bahwa tulang rawan artikular terdiri dari kondrosit atau sel tulang rawan serta matriks ekstraseluler padat yang tersusun atas air, kolagen, dan proteoglikan.
Porter et al. (2006) menjelaskan dalam penelitiannya bahwa tulang rawan memiliki tingkat kekakuan dan kekuatan yang sama dengan tulang trabekular mamalia. Kandungan kolagen pada tulang rawan dapat digunakan untuk memperkirakan kekakuan dan kekuatan tulang rawan. Fraksi mineral pada tulang rawan sama seperti fraksi mineral pada tulang trabekular mamalia. Menurut Ghosh (2008), jaringan tulang adalah suatu jaringan penghubung yang mengalami mineralisasi. Sel pembentuk tulang disebut osteoblas. Osteoblas menyimpan matriks kolagen dan mengeluarkan ion-ion kalsium, magnesium, dan fosfat. Ion-ion tersebut secara kimiawi berkombinasi dan mengeras di dalam matriks menjadi mineral hidroksiapatit. Kombinasi mineral keras dan kolagen yang fleksibel menyebabkan tulang menjadi lebih keras daripada tulang rawan.
10
dan struktural terbagi atas empat bagian, yaitu bagian superfisial, bagian tengah atau bagian transisi, bagian dalam, dan bagian tulang rawan yang mengalami kalsifikasi atau pengapuran. Bagian superfisial merupakan bagian permukaan yang lembut, halus, dan tidak mudah terpotong. Bagian ini juga disebut sebagai bagian tangensial. Bagian ini menyusun ketebalan tulang rawan sebanyak 10-20%. Bagian superfisial memiliki jumlah kolagen tertinggi. Kondrosit yang terdapat pada lapisan ini secara histologi dicirikan dengan adanya elongasi atau perpanjangan sel. Bagian tengah atau bagian transisi mengisi 40-60% volume tulang rawan. Serat kolagen pada bagian ini lebih tebal dibandingkan serat kolagen pada bagian superfisial. Kondrosit pada lapisan ini berbentuk lebih bulat dibandingkan kondrosit pada lapisan superfisial. Lapisan dalam mengisi 30% dari tulang rawan dan terdiri dari serat kolagen berdiameter lebih besar. Lapisan ini mengandung proteoglikan dalam jumlah yang paling banyak dan air dengan konsentrasi paling sedikit. Dean dan Summers (2006) menjelaskan bahwa tulang rawan ikan pari tersusun dari jaringan yang terkalsifikasi yang morfologinya dipengaruhi oleh umur, spesies, kebiasaan makan, dan lokasi tulang di dalam tubuh. Penampang struktur tulang rawan (Hamlett 1999) dapat dilihat pada Gambar 3.
11
2.3 Proteoglikan
Kuettner dan Kimura (1985) menjelaskan bahwa proteoglikan merupakan kelompok lain dari makromolekul heterogen yang tersebar di seluruh bagian tubuh dan memiliki jumlah terbanyak di dalam matriks ekstraseluler jaringan ikat. Proteoglikan memiliki fungsi yang tidak sama di dalam jaringan yang berbeda dan belum diketahui secara pasti perbedaannya. Perbedaan tersebut didasarkan pada distribusi dan susunannya yang selektif pada situs anatomi yang berbeda serta perbedaan struktur yang sangat besar. Proteoglikan terbentuk sebagai hasil interaksi antara protein dengan salah satu atau lebih rantai samping glikosaminoglikan yang berikatan secara kovalen. Glikosaminoglikan merupakan polisakarida anion linier yang tersusun atas pengulangan unit disakarida. Unit disakarida ini mengandung residu heksosamin dan umumnya residu tersebut berupa asam heksuronat.
Prydz dan Dalen (2000) turut memaparkan bahwa proteoglikan mengandung rantai panjang polisakarida yang tak bercabang. Rantai tersebut memiliki muatan negatif yang besar akibat adanya residu gula yang mengandung asam atau adanya modifikasi oleh gugus sulfat. Gula yang mengandung asam dan gula amino tersusun bergantian dalam unit disakarida yang berulang. Glikosaminoglikan yang terdapat pada proteoglikan memiliki bentuk yang panjang, mampu menarik kation, serta mampu mengikat air.
12
Seluruh sel tubuh mamalia mampu menghasilkan proteoglikan dan mensekresikannya ke dalam matriks ekstraseluler, memasukkannya ke dalam membran plasma, atau menyimpannya dalam granula sekretori. Protein-protein yang terikat dalam proteoglikan tidak hanya berperan sebagai pembawa glikosaminoglikan tetapi juga memiliki fungsi tersendiri. Protein biasanya menentukan jumlah rantai glikosaminoglikan, tipe glikosaminoglikan, serta tujuan akhir dari glikosaminoglikan. Variasi struktur proteoglikan pada berbagai sel atau jaringan disebabkan oleh sejumlah faktor. Beberapa proteoglikan mampu bersubstitusi dengan kondroitin sulfat atau bersubstitusi sekaligus dengan kondroitin sulfat dan heparan sulfat, namun salah satu jenis proteoglikan yang lain, yaitu trombomodulin, mampu berdiri sendiri dengan atau tanpa rantai glikosaminoglikan (Zhang 2010).
Gambar 4 Proteoglikan (Nakamura 2011).
2.4 Glikosaminoglikan
13
glikosaminoglikan, misalnya asam hialuronat, kondroitin sulfat, dan heparan sulfat disintesis pula oleh organisme prokariot.
Selain asam hialuronat, glikosaminoglikan disintesis oleh tubuh dalam bentuk proteoglikan melalui ikatan dengan protein. Glikosaminoglikan berikatan dengan ratusan jenis protein karena memiliki muatan-muatan negatif. Ikatan antara glikosaminoglikan dengan protein merupakan hasil interaksi antara gugus sulfat dan karboksil pada glikosaminoglikan dengan asam amino pada protein. Glikosaminoglikan berperan dalam pengaturan berbagai proses penting dalam sel yang meliputi pertumbuhan dan interaksi antar sel.
Sim et al. (2005) menjelaskan bahwa kondroitin sulfat terdiri dari rangkaian asam D-glukuronat (GLcA) bersulfat atau tanpa gugus sulfat yang tersusun bergantian dengan residu N-asetil-D-galaktosamin (GalNAc) yang terhubung melalui ikatan β-1,3 dan β-1,4. Kondroitin sulfat tergolong ke dalam kelompok glikosaminoglikan yang heterogen. Hal ini disebabkan kondroitin sulfat mengandung disakarida dalam jumlah yang berbeda dengan gugus sulfat yang letaknya bervariasi di dalam rantai polisakarida. Zhou et al. (2002) menjelaskan bahwa kondroitin sulfat terdiri dari 50 hingga 70 pengulangan unit disakarida dan bobot molekulnya berkisar antara 10.000 hingga 30.000 Dalton. Perbandingan komponen disakarida tanpa gugus sulfat, monosulfat, disulfat, atau trisulfat pada kondroitin sulfat tergantung pada spesies dan jaringan asalnya. Kondroitin sulfat merupakan komponen esensial matriks ekstraseluler pada jaringan ikat yang memiliki peranan penting dalam elastisitas serta fungsi tulang rawan artikular. Komponen ini terikat secara kovalen pada protein dalam bentuk proteoglikan. Kondroitin sulfat telah digunakan secara klinis untuk terapi penyakit kronis, contohnya artritis dan penyakit hati.
(CS-14
E) memiliki gugus sulfat yang melekat pada atom karbon nomor empat dan enam. Kondroitin sulfat tipe D (CS-D) memiliki gugus sulfat yang melekat pada atom karbon nomor enam dari N-asetilgalaktosamin sulfat (GalNAc) serta gugus sulfat yang melekat pada atom karbon nomor dua dari asam glukuronat (GlcA). Bentuk paling unik dari kondroitin sulfat yang terdapat pada tulang rawan ikan pari adalah kondroitin sulfat tipe A (CS-A) dan tipe C (CS-C). Kandungan CS-A dan CS-C pada tulang rawan ikan pari masing-masing sebesar 52% dan 48%. Sim et al. (2005) menambahkan bahwa kondroitin sulfat yang bersumber dari tulang rawan hewan darat (seperti sapi dan babi) memiliki jumlah disakarida-4-sulfat yang lebih banyak daripada jumlah disakarida-6-sulfat, sedangkan kondroitin sulfat yang bersumber dari tulang rawan ikan hiu memiliki jumlah disakarida-6-sulfat yang lebih banyak. Struktur kimia kondroitin disakarida-6-sulfat (Zhou et al. 2002) disajikan pada Gambar 5.
Gambar 5 Struktur kimia kondroitin sulfat (Zhou et al. 2002).
15
sekresi berbagai enzim degradatif serta melindungi membran sel dari oksigen reaktif.
2.5 Osteoartritis
Kondroitin sulfat banyak digunakan dalam terapi osteoartritis. Menurut Simanek et al. (2005), osteoartritis adalah penyakit yang menyerang cairan sinovial persendian pada orang-orang dewasa dan tua. Osteoartritis merupakan gangguan yang paling sering muncul pada persendian orang berusia menengah dan tua. Osteoartritis sebagian besar ditandai oleh rusaknya tulang rawan artikular, baik pada bagian inti maupun keseluruhan. Hal lain yang menandai adanya osteoartritis adalah adanya perubahan pada tulang serta ketidakseimbangan antara proses inflamasi dan non-inflamasi, meliputi proteolisis aggrecan dan kolagen yang disertai dengan distorsi oleh kondrosit selama proses
sintesisnya. Hal ini memberikan rasa sakit yang luar biasa serta dapat mengurangi kualitas hidup seseorang yang terkena infeksi. Sebanyak kurang lebih satu per tiga masyarakat berusia di atas 45 tahun menderita gejala osteoartritis. Gejala osteoartritis diawali dengan rasa sakit, pegal, dan penurunan fungsi dari sendi yang terinfeksi. Perkembangan penyakit ini bervariasi mulai dari proses yang lambat hingga proses yang cepat, yaitu dimulai dari sendi yang terkikis dengan kondisi cukup parah selama beberapa bulan. Osteoartritis disebut juga sebagai penyakit kompleks akibat adanya disposisi gen dengan struktur yang rumit.
Simanek et al. (2005) menjelaskan bahwa osteoartritis muncul karena meningkatnya kadar matriks metalloproteinase dalam tubuh. Metalloproteinase merupakan protease yang memiliki aktivitas degradatif terhadap protein jaringan ikat, seperti kolagen, elastin, proteoglikan, dan laminin. Hal ini menyebabkan ketidakmampuan sel tulang rawan dalam membentuk kembali matriks ekstraseluler yang penting bagi kesehatan sendi sehingga terjadi kerusakan sendi yang merupakan awal dari osteoartritis.
16
tidak dapat diperbaiki oleh tubuh dapat berupa keretakan tulang rawan, berkurangnya lapisan-lapisan dalam tulang rawan, dan penggandaan kondrosit. Hal tersebut terjadi ketika osteoartritis pertama kali menginfeksi zona superfisial. Penampakan jaringan tulang rawan artikular yang sehat dan yang mengalami osteoarthritis (Pearle et al. 2005) dapat dilihat pada Gambar 6.
Pearle et al. (2005) juga menjelaskan bahwa proses osteoartritis secara langsung terkait dengan berkurangnya kadar dan komposisi proteoglikan. Konsentrasi proteoglikan yang tinggi pada tulang rawan yang mengalami osteoartritis terdapat dalam bentuk non-aggregat, yaitu tidak terikat dengan hialuronat. Hal tersebut menunjukkan bahwa degradasi proteolitik pada proteoglikan mengurangi panjang rantai proteoglikan sehingga menghambat pembentukan kompleks makromolekul normal. Degradasi proteoglikan ini mengawali terbentuknya matriks padat yang lebih permeabel. Meskipun terjadi peningkatan kadar air pada matriks, peningkatan permeabilitas matriks menyebabkan pengurangan tekanan hidrolik tulang secara signifikan. Hal ini dapat mengakibatkan berkurangnya kekakuan jaringan sehingga secara klinis terjadi pelunakan jaringan tulang rawan yang sering dikenal sebagai kondromalasia.
3 METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret hingga Oktober 2012 di Laboratorium Preservasi dan Pengolahan Hasil Perairan, Laboratorium Biokimia Hasil Perairan, Laboratorium Mikrobiologi Hasil Perairan, Laboratorium Bioteknologi Hasil Perairan, Laboratorium Karakteristik Bahan Baku, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Bioteknologi Hewan, Laboratorium Bilot Plant, Pusat Antar Universitas, Laboratorium Pusat Studi Biofarmaka, Institut Pertanian Bogor, Laboratorium Genetika, Sekolah Ilmu dan Teknologi Hayati, Institut Teknologi Bandung, dan Laboratorium Saraswanti Indo Genetech.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah timbangan dengan tingkat ketelitian 0,001 g, pisau, panci dengan kapasitas ±4 L, oven listrik (merek Yamato tipe DV 41 AC suhu maksimum 290°C), termometer skala 100°C, centrifuge (merek Sorvall Ultra Pro-80 dengan kecepatan maksimum 80.000 rpm, speed control accuracy ±100 rpm), MAG-MIXER magnetic stirrer (tipe MH-61 AC dengan voltase 100 V, daya 250 W dan suhu maksimum 300°C), multiple dialyzer merek Pyrex dengan kapasitas 4 L, spektrofotometer UV-Vis RS Spectrophotometer UV-2500 dengan panjang gelombang 200-1000 nm, Waters Breeze HPLC system (panjang gelombang 190-700 nm, kolom AccQtag (3,9 x 150 mm), suhu kolom 37°C, dan detector fluorescence), Bruker Tensor 37 FT-IR Spectrometer (sumber sinar mid-IR 4000-400 cm-1, beamsplitter KBr, detektor mercury-cadmium-telluride (MCT)).
18
analysis, kondroitin sulfat for analysis dari trakea sapi dengan tingkat kemurnian
≥60% yang dibeli dari Sigma Aldrich dan kertas indikator pH.
3.3 Prosedur Penelitian
Penelitian ini terdiri dari dua tahapan, yaitu preparasi dan karakterisasi tulang rawan ikan pari dan ekstraksi enzimatis serta analisis konsentrasi glikosaminoglikan.
3.3.1 Preparasi dan karakterisasi tulang rawan
Preparasi tulang rawan ikan pari mengacu pada penelitian yang dilakukan oleh Mizuta et al. (2003) yaitu ikan pari yang telah dibekukan lebih dari 24 jam, dipotong pada bagian sirip pektoralnya. Daging selanjutnya dipisahkan dengan cara dikikis menggunakan pisau hingga didapatkan tulang rawan utuh. Aktivitas selanjutnya adalah pembersihan daging pada tulang rawan berdasarkan Murado et al. (2010). Kegiatan yang dilakukan adalah merebus tulang rawan selama 20 menit di dalam panci berisi air dengan suhu 80°C. Sisa daging dibersihkan dengan cara disikat dan dicuci dengan air mengalir. Tulang rawan yang telah bersih dari sisa-sisa lemak dan daging selanjutnya disimpan beku pada suhu ±20oC.
Karakterisasi tulang rawan ikan pari mengacu pada penelitian Kittiphattanabawon et al. (2010). Karakterisasi tulang rawan terdiri dari analisis-analisis yang meliputi analisis-analisis kadar air dan abu (AOAC 2005) serta analisis-analisis komposisi asam amino dengan metode High Performance Liquid Chromatography (HPLC).
3.3.2 Ekstraksi enzimatis (Lignot et al. 2003) dan dialisis (Garnjanagoonchorn et al. 2007)
Ekstraksi tulang rawan dilakukan secara enzimatis diawali dengan pengecilan ukuran dan pengeringan tulang rawan hasil preparasi. Pengeringan tulang rawan mengacu pada penelitian Ndife et al. 2010. Kondisi pencacahan yang dilakukan adalah menggunakan blender pada suhu ruang, sedangkan kondisi pengeringan yang dilakukan adalah dengan menggunakan oven pada suhu 40oC selama 6 jam.
19
0,25 g. Ekstraksi berlangsung pada pH 6,5 dan suhu ±65°C selama 3 jam (kondisi efektif terhadap waktu dan hasil ekstraksi berdasarkan Lignot et al. (2003) yang telah dikembangkan dari Scott (1969) untuk menghasilkan kondroitin sulfat dengan konsentrasi berkisar 1,3 g/100 mL serta berdasarkan Garnjanagoonchorn et al. (2007) pada ekstraksi enzimatis kondroitin sulfat dari sirip hiu dan tulang rawan pari (Dasyatis zugei) dengan konsentrasi kondroitin sulfat yang dihasilkan dari masing-masing sumber sebesar 1,5 g/100 mL dan 0,749 g/100 mL).
Pemisahan protein mengacu pada penelitian Garnjanagoonchorn et al. (2007). Pada hasil ekstraksi selanjutnya ditambahkan asam trikloroasetat (TCA) untuk dipisahkan proteinnya. Asam trikloroasetat ditambahkan ke dalam larutan hasil hidrolisis enzimatis hingga konsentrasinya mencapai 7% (b/v). Campuran tersebut didiamkan selama semalam pada suhu 4°C, kemudian disentrifugasi pada kecepatan 132.000 x g selama 30 menit pada suhu 4°C untuk memisahkan protein yang mengendap. Supernatan yang dihasilkan dari proses ini selanjutnya didialisis dalam akuades dingin selama 24 jam. Proses ini bertujuan untuk memisahkan glikosaminoglikan (GAGs) dari garam-garam yang masih tercampur dalam larutan. Konsentrasi glikosaminoglikan diuji dengan spektrofotometri menggunakan sulfate GAGs assay yang mengacu Jong et al. (1989) dan Zhou et al. (2002) yang dimodifikasi. Larutan hasil dialisis kemudian diberi perlakuan pengeringan dengan evaporator vakum sehingga didapatkan glikosaminoglikan dalam bentuk serpihan halus. Spektrum gugus fungsi glikosaminoglikan selanjutnya dianalisis menggunakan Fourier Transform Infra-Red (FTIR) spektrofotometri (Garnjanagoonchorn et al. 2007).
3.4 Prosedur Pengujian
Analisis sampel yang dilakukan terdiri dari analisis kadar air dan kadar abu tulang rawan, komposisi asam amino tulang rawan, tingkat konsentrasi glikosaminoglikan, dan analisis FTIR glikosaminoglikan.
3.4.1 Analisis kadar air (AOAC 2005)
Analisis kadar air dilakukan dengan penguapan menggunakan oven. Tahap
pertama yang dilakukan adalah mengeringkan cawan porselen pada suhu 102-105oC selama 1 jam. Cawan tersebut diletakkan dalam desikator kurang
20
sebanyak 5 gram kemudian dikeringkan dengan oven pada suhu 102-105oC selama 6 jam. Setelah 6 jam cawan tersebut dimasukkan ke dalam desikator hingga dingin kemudian ditimbang bobotnya. Rumus perhitungan kadar air dapat ditulis sebagai berikut:
% Kadar air =B−C
B−Ax 100%
Keterangan: A = Berat cawan kosong (gram)
B = Berat cawan yang diisi sampel (gram) sebelum dioven C = Berat cawan dengan sampel (gram) setelah dioven 3.4.2 Analisis kadar abu (AOAC 2005)
Analisis kadar abu dilakukan dengan mengabukan sampel di dalam tanur. Tahap pertama cawan abu porselen dikeringkan di dalam oven selama 1 jam pada suhu 105oC, lalu didinginkan dalam desikator kemudian ditimbang. Sampel ditimbang sebanyak 5 gram dan dimasukkan ke dalam cawan pengabuan yang akan dipijarkan di atas nyala api bunsen hingga tidak berasap lagi. Sampel sebanyak 5 gram tersebut dimasukkan ke dalam tanur pengabuan dengan suhu 600oC selama 6 jam, kemudian ditimbang hingga didapatkan berat yang konstan. Proses pengabuan dilakukan sampai abu berwarna putih. Setelah itu cawan didinginkan dalam desikator selam 30 menit, kemudian ditimbang bobotnya. Rumus perhitungan kadar abu dapat ditulis sebagai berikut:
% Kadar abu = C−A
B−Ax 100%
Keterangan: A = Berat cawan kosong (gram)
21
gelombang eksitasi 250 nm dan emisi 395 nm. Derivatisasi asam amino dengan menggunakan 6-aminoquinolyl-N-hydroxysuccinimidyl carbamate (AQC) untuk menghasilkan fluoresens yang stabil (AQC-asam amino) yang siap digunakan untuk analisis pada HPLC. Separasi AQC-asam amino tercapai melalui kombinasi pada perubahan konsentrasi asetonitril dan garam.
3.4.4 Analisis konsentrasi glikosaminoglikan dengan metode spektrofotometri menggunakan sulfate GAGs assay (Jong et al. (1989) dimodifikasi dengan Zhou et al. (2002))
Analisis konsentrasi glikosaminoglikan diukur dengan metode spektrofotometri menggunakan sulfate GAGs assay yang mengacu pada Jong et al. (1989) yang dimodifikasi dengan Zhou et al. (2002). Larutan stok methylene blue dibuat dengan melarutkan 25 mg methylene blue ke dalam 50 mL akua bidestilata. Sebanyak 5 mL larutan stok tersebut diencerkan dengan akua bidestilata hingga mencapai volume 30 mL. Larutan tersebut kemudian digunakan sebagai reagent dalam pengujian konsentrasi glikosaminoglikan.
Larutan sampel dibuat dengan mencampur 0,25 mL larutan glikosaminoglikan ke dalam 0,25 mL akua bidestilata dan ditambahkan 2,5 mL methylene blue. Larutan sampel tersebut didiamkan dalam rentang waktu 5 menit hingga 2 jam dan diukur absorbansinya. Pengukuran absorbansi dilakukan menggunakan spektrofotometer pada panjang gelombang 570 nm.
Kurva standar diperoleh dengan mengukur nilai absorban standar kondroitin sulfat yang dibeli dari Sigma Aldrich. Larutan stok kondroitin sulfat standar dibuat dengan melarutkan sebanyak 0,2 g kondroitin sulfat dalam akuades hingga mencapai volume 100 mL. Larutan uji standar kondroitin sulfat diperoleh melalui pengenceran larutan stok kondroitin sulfat hingga menghasilkan larutan dengan konsentrasi masing-masing 200, 600, 1.000 dan 1.400 ppm. Pengukuran nilai absorban dilakukan pada panjang gelombang 570 nm. Kurva standar pengujian tingkat konsentrasi glikosaminoglikan disajikan pada Lampiran 1. 3.4.5 Analisis spektrum gugus fungsi glikosaminoglikan menggunakan
Fourier Transform Infra-Red (FTIR) (Garnjanagoonchorn et al. 2007 yang Dimodifikasi)
22
Beamsplitter yang digunakan adalah KBr dengan detektor mercury-cadmium-telluride (MCT) dan resolusi 1 cm-1.
4 HASIL DAN PEMBAHASAN
4.1 Karakteristik Kimia Tulang Rawan Ikan Pari Air Laut (Neotrygon kuhlii) dan Pari Air Tawar (Himantura signifer)
Karakterisasi tulang rawan bertujuan untuk mengetahui komposisi kimia tulang rawan dan dilakukan melalui analisis kadar air, kadar abu, dan komposisi asam amino tulang rawan.
4.1.1. Kadar air dan abu tulang rawan pari
Hasil analisis kadar air dan kadar abu tulang rawan ikan pari air laut (Neotrygon kuhlii) dan pari air tawar (Himantura signifer) disajikan pada Tabel 1. Hasil analisis tersebut cenderung sama dengan tulang rawan ikan pari jenis Dasyatis zugei, yaitu kadar air sebesar 65,28% dan kadar abu sebesar 17,12%. Tabel 1 Hasil analisis kadar air dan abu tulang rawan ikan pari air laut (Neotrygon
kuhlii) dan pari air tawar (Himantura signifer)
24
berbeda dengan pengaturan tekanan osmotik pada ikan-ikan air laut, yaitu ikan air laut beradaptasi secara hipoosmotik. Ikan air laut mudah menyerap ion-ion dari lingkungan dan kehilangan banyak air dari tubuhnya. Elasmobranchii laut memiliki sedikit perbedaan pengaturan tekanan osmotik dengan ikan-ikan laut bertulang sejati. Elasmobranchii laut bersifat ureogenik dan memiliki siklus enzim ornitin-urea pada hati dan otot. Cairan ekstraseluler tubuhnya mengandung ion-ion dalam konsentrasi lebih rendah dari lingkungan laut, namun osmolalitas plasma dipertahankan hiperosmotik terhadap medium eksternal dengan disekresikannya urea. Kondisi salinitas lingkungan perairan yang berbeda antara ikan pari air tawar dan pari air laut menyebabkan perbedaan proses mineralisasi pada tulang rawannya.
Dugaan ini juga disampaikan Walker (2005) yang menyampaikan bahwa nilai kadar abu yang lebih tinggi pada tulang rawan ikan pari air laut diduga sebagai akibat tingginya proses mineralisasi pada tulang rawan ikan pari air laut. Sebagian dari struktur kartilago ikan-ikan bertulang rawan diperkuat dan diperkeras oleh proses mineralisasi yaitu berbagai garam didepositkan menjadi tulang rawan.
4.1.2. Komposisi asam amino tulang rawan pari
Hasil analisis tulang rawan ikan pari air tawar dan laut diketahui memiliki komposisi asam amino yang sama, namun kadarnya berbeda. Kadar asam amino pada tulang rawan ikan pari air tawar rata-rata lebih tinggi dibandingkan kadar asam amino tulang rawan ikan pari air laut. Hasil analisis asam amino tulang rawan ikan pari air laut (Neotrygon kuhlii) dan pari air tawar (Himantura signifer) disajikan pada Tabel 2.
25
dalam tipe-tipe yang berbeda, yang diidentifikasi menjadi tipe I hingga XIX. Tipe-tipe tersebut bervariasi dalam hal kompleksitas dan keragaman strukturnya. Perbedaan tipe kolagen juga menunjukkan adanya perbedaan variasi komposisi dan karakteristik fisik asam amino yang berkaitan pula dengan temperatur lingkungan asal hewan.
Tabel 2 Hasil analisis asam amino tulang rawan ikan pari air laut (Neotrygon kuhlii) dan pari air tawar (Himantura signifer)
Parameter (%)
26
bahwa semua jenis kolagen mengandung glisin sebagai asam amino utama serta kaya akan alanin, prolin, dan hidroksiprolin.
Tabel 2 juga memberi informasi mengenai kadar asam amino yang lebih tinggi pada tulang rawan pari Raja kenojei yang diteliti oleh Mizuta et al. (2003) dan tulang rawan hiu Carcharhinus limbatus yang diteliti oleh Kittiphattanabawon et al. (2010) dibandingkan dengan asam amino tulang rawan pari air tawar dan pari air laut pada penelitian ini. Deka et al. (2012) menjelaskan bahwa komposisi kimia ikan, termasuk kandungan protein dan asam amino, sangat bervariasi antara satu individu dengan individu lain tergantung pada umur, jenis kelamin, lingkungan, musim, dan lokasi geografis. Deka et al. (2012) juga menambahkan bahwa asam amino ikan pada musim yang berbeda akan berbeda pula komposisinya. Ikan pari pada penelitian Mizuta et al. (2003) dan Kittiphattanabawon et al. (2010) berasal dari lingkungan subtropis, berbeda dengan ikan pari pada penelitian ini yang berasal dari wilayah tropis. Hal tersebut diduga merupakan salah satu faktor yang menyebabkan perbedaan profil asam amino pada tulang rawan ikan-ikan tersebut.
4.2 Konsentrasi Glikosaminoglikan Tulang Rawan Ikan Pari Air Laut (Neotrygon kuhlii) dan Tulang Rawan Ikan Pari Air Tawar (Himantura signifer)
Konsentrasi glikosaminoglikan dihitung dengan memasukkan nilai absorbansi ke dalam persamaan regresi linear kurva standar kondroitin sulfat. Persamaan regresi yang diperoleh adalah y = 0,0001x + 0,0529 dengan nilai R2 sebesar 0,9878. Konsentrasi (mg/100 mL) glikosaminoglikan tulang rawan ikan pari air laut (Neotrygon kuhlii) adalah sebesar 74,767±6,35 mg/100 mL dan pari air tawar (Himantura signifer) sebesar 66,767±6,11 mg/100 mL. Konsentrasi (mg/100 mL) glikosaminoglikan hasil ekstraksi disajikan pada Tabel 3.
Tabel 3 Konsentrasi (mg/100 mL) glikosaminoglikan tulang rawan ikan pari air laut (Neotrygon kuhlii) dan pari air tawar (Himantura signifer)
Sumber tulang rawan Konsentrasi (mg/100 mL)
Pari air laut 74,767 ± 6,35
27
Berdasarkan Tabel 3, konsentrasi glikosaminoglikan tulang rawan ikan pari air laut diketahui lebih tinggi dibandingkan konsentrasi glikosaminoglikan tulang rawan ikan pari air tawar. Hal ini diduga disebabkan oleh pengaruh perbedaan habitat atau tempat hidup kedua spesies tersebut. Yamada et al. (2011) menjelaskan bahwa perbedaan tingkat salinitas perairan tempat hidup suatu spesies mempengaruhi jumlah dan komposisi glikosaminoglikan bersulfat dari spesies tersebut. Glikosaminoglikan yang berasal dari spesies yang hidup pada perairan dengan konsentrasi garam tinggi memiliki kadar sulfat yang lebih tinggi dibandingkan glikosaminoglikan yang terdapat pada spesies yang hidup di perairan dengan konsentrasi garam rendah. Jumlah glikosaminoglikan bersulfat meningkat sesuai derajat salinitas perairan. Lebih lanjut Qu (2007) menerangkan bahwa enzim tertentu menambahkan gugus ester sulfat ke gugus hidroksil tertentu untuk membentuk kondroitin sulfat. Prydz dan Dalen (2000) menambahkan bahwa sintesis kondroitin berlangsung karena adanya aktivitas enzim galaktosil transferase I (GT I) atau asam glukuronat transferase I (GlcAT I). Hal ini diperkuat oleh Walker (2005) yang menyatakan bahwa proses mineralisasi berperan penting pada pembentukan tulang rawan suatu spesies. Sebagian dari struktur kartilago ikan-ikan bertulang rawan diperkuat dan diperkeras oleh proses mineralisasi. Proses tersebut melibatkan berbagai garam yang didepositkan menjadi tulang rawan.
4.3 Spektrum Glikosaminoglikan Tulang Rawan Ikan Pari Air Laut (Neotrygon kuhlii) dan Tulang Rawan Ikan Pari Air Tawar (Himantura signifer)
28
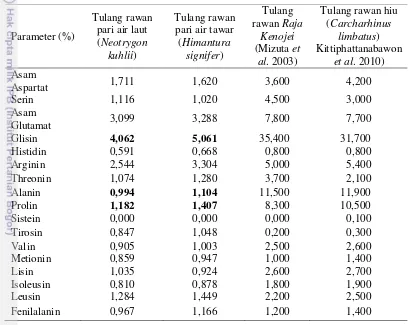
Gambar 7 Spektrum glikosaminoglikan pari air tawar (Himantura signifer).
Gambar 8 Spektrum glikosaminoglikan pari air laut (Neotrygon kuhlii).
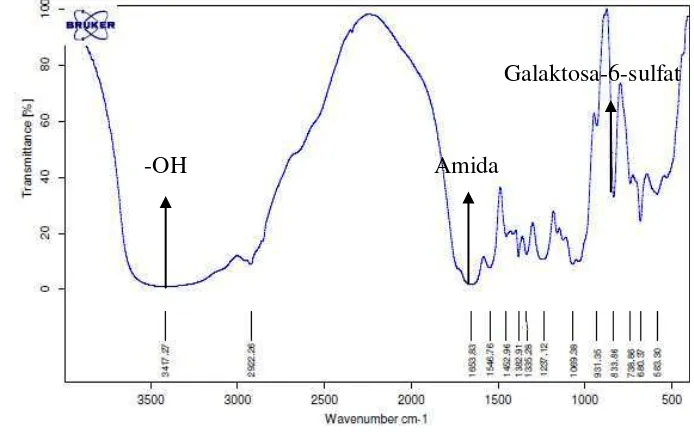
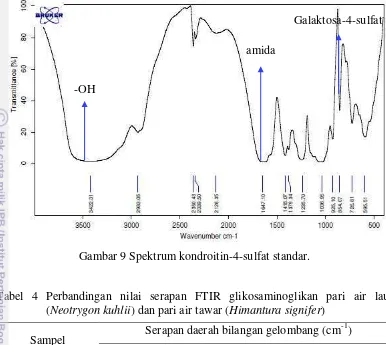
Hasil spektrum glikosaminoglikan pari air tawar (Himantura signifer) dan pari air laut (Neotrygon kuhlii) (Gambar 7 dan 8) menunjukkan bahwa secara keseluruhan kedua spektrum tersebut mirip pada bagian puncak-puncaknya maupun pita serapannya. Spektrum kondroitin-4-sulfat standar disajikan pada Gambar 9 dan perbandingan nilai serapan FTIR glikosaminoglikan pari air tawar dan pari air laut disajikan pada Tabel 4.
-OH Amida
Galaktosa-6-sulfat
-OH
Galaktosa-6-sulfat
29
Gambar 9 Spektrum kondroitin-4-sulfat standar.
Tabel 4 Perbandingan nilai serapan FTIR glikosaminoglikan pari air laut (Neotrygon kuhlii) dan pari air tawar (Himantura signifer)
Sampel Glikosaminoglikan
Serapan daerah bilangan gelombang (cm-1) Regang O-H Regang amida
Galaktosa-6-sulfat
Pari air laut 3430.99 1657.91 833.03
Pari air tawar 3417.27 1653.83 833.86
Identifikasi pita absorpsi khas yang disebabkan oleh berbagai gugus fungsi merupakan dasar penafsiran spektrum inframerah. Delapan daerah terpenting pada penentuan spektrum inframerah (Creswell et al. 2005) dapat dilihat pada Lampiran 2. Frekuensi regang O-H menimbulkan pita absorpsi kuat di daerah 3.350 cm-1. Adanya pita kuat di daerah 3.350 cm-1 pada spektrum inframerah suatu senyawa merupakan petunjuk kuat bahwa molekul itu mengandung gugus fungsi O-H. Rentang bilangan gelombang yang disebabkan oleh frekuensi regang O-H adalah 3.750-3.000 cm-1 (Creswell et al. 2005). Cavalcanti et al. (2005) dalam penelitiannya memaparkan bahwa guguh hidroksil (O-H) membentuk pita serapan pada bilangan gelombang 3.410 cm-1– 3.470 cm-1. Berdasarkan data pada Tabel 4, regang O-H pada glikosaminoglikan pari air tawar dan pari air laut
-OH
amida
30
menimbulkan pita absorpsi yang lebar dan kuat masing-masing pada bilangan gelombang 3.417,27 cm-1 dan 3.430,99 cm-1. Brugnerotto (2001) menjelaskan bahwa gugus O-H akan membentuk pita serapan yang kuat pada bilangan gelombang 3.350 cm-1 sedangkan bila berbentuk polimer, gugus O-H akan semakin mendekati bilangan gelombang 3.450 cm-1.
Gugus amida diidentifikasi dengan adanya pita serapan yang terbentuk oleh gugus C=O. Creswell et al. (2005) menyatakan bahwa regang C=O menandakan adanya gugus asam, aldehida, keton, amida, ester, serta anhidrida dan menimbulkan pita serapan pada bilangan gelombang 1.900 cm-1– 1.650 cm-1. Spektrum yang menunjukkan adanya gugus spesifik amida ditandai dengan pita serapan pada bilangan gelombang 1.700 cm-1 – 1.640 cm-1. Spektrum hasil analisis FTIR glikosaminoglikan pari air tawar dan pari air laut menunjukkan adanya gugus amida masing-masing pada bilangan gelombang 1.653,83 cm-1 dan 1.657,91 cm-1. Hasil tersebut tidak jauh berbeda dengan penelitian yang dilakukan oleh Cavalcanti et al. (2005) yaitu gugus amida kondroitin sulfat ditandai dengan adanya pita serapan pada bilangan gelombang 1.644 cm-1– 1.660 cm-1.
Gugus penting lain yang dapat diidentifikasi adalah galaktosa-6-sulfat yang menandakan adanya kemiripan struktur molekul sampel uji dengan kondroitin-6-sulfat. Pereira et al. (2003) memaparkan bahwa gugus D-galaktosa 4-sulfat diidentifikasi melalui terbentuknya pita serapan yang kuat pada bilangan gelombang 845 cm-1. Adanya pita kuat di daerah 845 cm-1 pada spektrum inframerah suatu senyawa merupakan petunjuk kuat adanya gugus galaktosa 4-sulfat pada senyawa tersebut. Hasil analisis spektrum inframerah glikosaminoglikan pari air tawar dan pari air laut menunjukkan adanya pita serapan pada bilangan gelombang masing-masing 833,86 cm-1 dan 833,03 cm-1. Garnjanagoonchorn et al. (2007) dalam penelitiannya menyatakan bahwa kondroitin-4-sulfat ditandai dengan adanya pita serapan pada bilangan gelombang 857 cm-1 sedangkan kondroitin-6-sulfat ditandai dengan adanya pita serapan pada bilangan gelombang 826 cm-1. Hasil penelitian lain yang dilakukan oleh Uchisawa et al. (2001) menunjukkan hasil yang tidak jauh berbeda dengan penelitian yang
kondroitin-31
6-sulfat ditandai dengan adanya pita serapan pada bilangan gelombang 823,7 cm-1. Spektrum standar kondroitin-4-sulfat dan standar kondroitin-6-sulfat (Garnjanagoonchorn et al. 2007) dapat dilihat pada Lampiran 3 dan 4.
4.4 Bentuk Fisik Glikosaminoglikan Pari Air Laut (Neotrygon kuhlii) dan Pari Air Tawar (Himantura signifer)
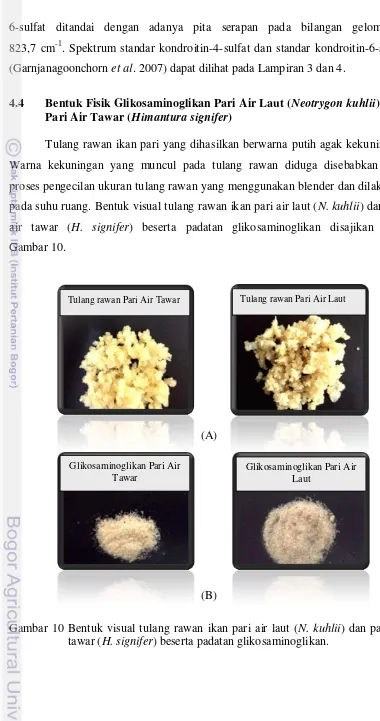
Tulang rawan ikan pari yang dihasilkan berwarna putih agak kekuningan. Warna kekuningan yang muncul pada tulang rawan diduga disebabkan oleh proses pengecilan ukuran tulang rawan yang menggunakan blender dan dilakukan pada suhu ruang. Bentuk visual tulang rawan ikan pari air laut (N. kuhlii) dan pari air tawar (H. signifer) beserta padatan glikosaminoglikan disajikan pada Gambar 10.
Gambar 10 Bentuk visual tulang rawan ikan pari air laut (N. kuhlii) dan pari air tawar (H. signifer) beserta padatan glikosaminoglikan.
Tulang rawan Pari Air Tawar Tulang rawan Pari Air Laut
(A) Glikosaminoglikan Pari Air
Tawar
Glikosaminoglikan Pari Air Laut
32
5. SIMPULAN DAN SARAN
5.1 Simpulan
Glikosaminoglikan berhasil diekstrak dari tulang rawan ikan pari air laut (N. kuhlii) dan tulang rawan ikan pari air tawar (H. signifer) melalui metode ekstraksi enzimatis. Konsentrasi glikosaminoglikan pari air laut (74,767±6,35 mg/100 mL) lebih tinggi dibandingkan dengan konsentrasi glikosaminoglikan pari air tawar (66,767±6,11 mg/100 mL). Spektrum gugus fungsi glikosaminoglikan pari air tawar dan pari air laut menunjukkan pola pita serapan yang hampir mirip dengan spektrum gugus fungsi kondroitin sulfat yang menandakan bahwa jenis glikosaminoglikan pada tulang rawan ikan pari air tawar dan pari air laut adalah kondroitin sulfat.
5.2 Saran
1. Pemurnian kondroitin sulfat untuk mendapatkan tingkat kemurnian yang baik, antara lain berupa kombinasi metode terbaik untuk menghasilkan kondroitin sulfat dengan tingkat konsentrasi yang tinggi,
2. Kajian mengenai karakteristik fisik kondroitin sulfat tulang rawan ikan pari air tawar dan pari air laut,
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical and Chemistry. 2005. Officials Methods of Analysis. 18th Ed. Maryland: Association of Official Analytical and Chemistry Inc.
Adebowale AO, Cox DS, Liang Z, Eddington ND. 2000. Analysis of glucosamine and chondroitin sulfate content in marketed products and the caco-2 permeability of kondroitin sulfate raw materials. Journal of American Nutraceutical Association 3(1): 37-44.
Agustono P. 2008. Jenis-jenis ikan pari dari marga Himantura yang sering ditemukan di pasar atau tempat pelelangan ikan. Warta Oseanografi 22 (4): 20-26.
Almeida PC, Araujo MLG, Almeida MP. 2005. Reproductive aspects of freshwater stingrays (Chondrichthyes: Potamotrygonidae) in the Brazilian Amazon basin. Journal of Northwest Atlantic Fishery Science 35: 165-171. Brugnerotto J. 2001. An infrared investigation inrealtion with chitin and chitosan
characterization. Polymer Journal 42: 3569-3580.
Candramila W, Junardi. 2006. Komposisi, keanekaragaman, dan rasio kelamin ikan elasmobranchii asal sungai kakap Kalimantan Barat. Biospecies 1(2): 41-46.
Cavalcanti OA, Silva CC, Pineda EAG, Hechenleitner AAW. 2005. Synthesis and characterization of phosphate crosslinked chondroitin sulfate: potential ingredient for specific drug delivery. Journal of Acta Farmaceutica Bonaerense 24(2): 234-238.
Chen S, Xue C, Yin L, Tang Q, Yu G, Chai W. 2011. Comparison of structures and anticoagulant activities of fucosylated chondroitin sulfates from different sea cucumbers. Journal of Carbohydrate Polymers 83(2): 688-696.
Creswell CJ, Runquist OA, Campbell MM. 2005. Analisis Spektrum Senyawa Organik. Edisi 3. Diterjemahkan oleh: Padmawinata K, dan Soediro I. Bandung: Penerbit ITB.
Dean MN, Summers AP. 2006. Mineralized cartilage in the skeleton of chondrichthyan fishes. Journal of Zoology 109: 164-168.
35
Einbinder J, Schubert M. 1950. Separation of chondroitin sulfate from cartilage. Journal of Biological Chemistry 725-730.
[FAO] Food and Agriculture Organization. 2008. Fishery and Aquaculture Statistic. Roma: Food and Agriculture Organization of United Nations.
Garnjanagoonchorn W, Wongekalak L, Engkagul A. 2007. Determination of chondroitin sulfate from different sources of cartilage. Chemical Engineering and Processing Journal 46: 465-471.
Ghosh SB. 2008. Bone as a collagen-hydroxyapatite composite and its repair. Journal of Trends Biomater Artificial Organs 22(2): 116-124.
Grossfeld H. 1963. Production of chondroitin sulfate in tissue culture of cartilage. Journal of Biochimica et Biophysica Acta 74: 193-197.
Hamlett WC. 1999. Sharks, Skates, and Rays: The Biology of Elasmobranch Fishes. Maryland: John Hopkins University Press.
Humphreys R. 2012. Fishing in Thailand. http://www.anglersnet.co.uk/overseas-articles/fishing-in-thailand-1009.html (22 November 2012).
Husnah. 2009. Sudahkah Anda Tahu? Jenis dan Sebaran Ikan Elasmobranchii di Perairan Sungai Musi. Jakarta: Badan Riset Kelautan dan Perikanan. Kementrian Kelautan dan Perikanan.
Ip YK, Loong AM, Ching B, Tham GHY, Wong WP, Chew SF. 2009. The freshwater Amazonian stingray, Potamotrygon motoro, up-regulates glutamine synthetase activity and protein abundance, and accumulates
glutamine when exposed to brackish (15 ‰) water. The Journal of Experimental Biology 212: 3828-3836.
Jong JGN, Wevers RA, Laarakkers C, Poorthuls BJHM. 1989. Dimethylmethylene blue-based spectrophotometry of glycosaminoglycans in untreated urine: a rapid screening procedure for mucopolysaccharidoses. Journal of Clinical Chemistry 35(7): 1472-1477.
Kittiphattanabawon P, Benjakul S, Visessanguan W, Shahidi F. 2010. Isolation and characterization of collagen from the cartilages of brownbanded bamboo shark (Chiloscyllium pinctatum) and blacktip shark (Carcharhinus limbatus). Journal of Food Science and Technology 43: 792-800.
Kottelat M, AJ Whitten, SN Kartikasari and S Wirjoatmodjo. 1993. Freshwater Fishes of Western Indonesia and Sulawesi. Periplus Editions, Hong Kong. 344 p.