KINETIKA REAKSI FERMENTASI ALKOHOL DARI
BUAH SALAK
SKRIPSI
Oleh :
FEBRINA LIA GULTOM
080405065
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
KINETIKA REAKSI FERMENTASI ALKOHOL DARI
BUAH SALAK
SKRIPSI
Oleh :
FEBRINA LIA GULTOM
080405065
SKRIPSI INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN
PERSYARATAN MENJADI SATJANA TEKNIK
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
UNIVERSITAS SUMATERA UTARA
PERNYATAAN KEASLIAN SKRIPSI
Saya menyatakan dengan sesungguhnya bahwa skripsi dengan judul:
KINETIKA REAKSI FERMENTASI ALKOHOL DARI BUAH SALAK
dibuat untuk melengkapi sebagian persyaratan menjadi Sarjana Teknik pada Departemen Teknik Kinia Fakultas Teknik Universitas Sumatera Utara.
Skripsi ini adalah hasil karya saya kecuali kutipan-kutipan yang telah saya sebutkan sumbernya.
Demikian pernyataan ini diperbuat, apabila dikemudian hari terbukti bahwa karya ini bukan karya saya atau merupakan hasil jiplakan maka saya bersedia menerima sanksi sesuai dengan aturan yang berlaku.
Medan, Oktober 2013
KINETIKA REAKSI FERMENTASI ALKOHOL DARI
BUAH SALAK
SKRIPSI
OLEH,
FEBRINA LIA GULTOM
080405065
SKRIPSI INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN
PERSYARATAN MENJADI SARJANA TEKNIK
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
PENGESAHAN
Skripsi dengan Judul :KINETIKA REAKSI FERMENTASI ALKOHOL DARI BUAH SALAK
dibuat untuk melengkapi persyaratan menjadi sarjana Teknik pada Departemen Teknik Kimia Fakultas Teknik Universitas Sumatera Utara. Skripsi ini telah diujikan pada sidang ujian skripsi pada 23 Oktober 2013 dan dinyatakan memenuhi syarat/sah sebagai skripsi pada Departemen Teknik Kimia Fakultas Teknik Universitas Sumatera Utara.
Mengetahui, Medan, 2013
Koordinator Skripsi Dosen Pembimbing
A.n Sekretaris
Dr. Ir. Fatimah, MT Dr. Ir. Fatimah, MT
NIP. 19640617 199403 2 001 NIP. 19640617 199403 2 001
Dosen Penguji I Dosen Penguji II
Ir. Bambang Trisakti, MT Dr. Ir. Taslim, MSi
UCAPAN TERIMA KASIH
Penulis Mengucapkan terima kasih kepada :
Dr. Ir. Fatimah, MT
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Kuasa atas segala berkat dan karunia-Nya sehingga skripsi ini dapat diselesaikan. Tulisan ini merupakan skripsi dengan judul “ Kinetika Reaksi Fermentasi Alkohol Dari Buah Salak,” berdasarkan hasil penelitian yang penulis lakukan di Departemen Teknik Kimia Fakultas Teknik Sumatera Utara. Skripsi ini merupakan salah satu syarat untuk mendapatkan gelar sarjana teknik.
Melalui penelitian ini diperoleh data kinetika reaksi fermentasi alkohol. Sehingga hasil yang diperoleh dapat dimanfaatkan, khususnya sebagai sumber referansi. Selain itu, akan menambah nilai ekonomis dari buah salak yang tidak layak jual.
Selama melakukan penelitian sampai penulisan skripsi ini penulis banyak mendapat pengarahan dan bimbingan dari dosen pembimbing penulis, untuk itu secara khusus penulis mengucapkan terima kasih kepada Dr. Ir. Fatimah, MT yang telah banyak membantu hingga peyelesaiannya.
DEDIKASI
RIWAYAT HIDUP PENULIS
Nama : Febrina Lia Gultom NIM : 080405065
Tempat/tgl lahir : Medan, 26 Februari 1991 Nama orang tua : H. Gultom
Alamat orang tua :
Jalan Merica Raya no 58B Perumnas Simalingkar. Medan
Asal Sekolah :
SD Swasta Katholik Budi Murni Tahun 1996-1997
SD Negeri Cikampek Selatan V Tahun 1997-2000
SD Negeri Purwasari IV Tahun 2000-2002
SMP Negeri 2 Cikampek Tahun 2002-2005
SMA Negeri 17 Medan Tahun 2005-2008 Pengalaman Organisasi :
1. Covalen Study Group (CSG) periode 2010/2011 sebagai anggota Bidang Hubungan Masyarakat
2. HIMATEK periode 2011/2012 sebagai anggota Bidang Penelitian Dan Pengembangan
Artikel yang telah dipublikasikan dalam jurnal :
ABSTRAK
Limbah cair industri tahu mengandung banyak senyawa-senyawa organik kompleks berupa protein, lemak, karbohidrat dan minyak.. Berdasarkan hasil studi Balai Perindustrian Medan terhadap karakteristik air buangan industri tahu di Medan, diketahui bahwa limbah cair industri tahu rata-rata mengandung BOD (4583 mg/l), COD (7050 mg/l), TSS (4743 mg/l) dan minyak atau lemak (26 mg/l) dengan pH 6,1. Oleh karena itu, diperlukan pengolahan limbah cair industri tahu yang dapat mengurangi kadar pencemar dalam limbah sehingga dampak buruknya terhadap lingkungan juga dapat dikurangi. Salah satu koagulan alternatif yang dapat digunakan adalah serbuk biji kelor. Penelitian ini menggunakan serbuk biji kelor dengan kadar air 9 %. Variasi dosis koagulan yang digunakan 2000, 3000, 4000, 5000 mg/200 ml limbah cair tahu, lama pengendapan 50, 60,dan 70 menit serta ukuran koagulan 50 dan 70 mesh dengan pH awal adalah 4. Waktu pengendapan optimum yang diperoleh adalah 60 menit dengan penurunan turbiditas 81,71 %, TSS 77,42 %, dan COD 64,10 % pada dosis koagulan 5000 mg/200 ml, dan ukuran partikel koagulan 70 mesh dengan pH akhir adalah 4, karena persentase penurunan turbiditas, TSS dan COD yang diperoleh diatas 50%, maka dapat disimpulkan bahwa serbuk biji kelor dapat digunakan sebagai koagulan yang efektif pada alternatif pengolahan limbah cair industri tahu
ABSTRACT
Liquid waste industrial of wheys contain of many complex organic compounds such as proteins, carbohydrates, fats and oils. Based on the results of field studies on Industry Hall of liquid waste industrial characteristics of whey in Medan, it is known that liquid waste industrial of wheys contain average BOD (4583 mg/l), COD (7050 mg/l), TSS (4743 mg/l ) and oil or fat (26 mg/l ) at pH 6.1. Therefore, the whey waste water must be treated before it is discharged into the environment to reduce the contaminants that accompany the waste. One alternative that can be used as a coagulant is moringa seed powder. This study used of moringa seed powder with a water content of 9 %. Variations of coagulant dosage which are used 2000, 3000, 4000, 5000 mg/200 ml liquid waste industrial of whey, coagulant particle size 50 and 70 mesh with the initial pH about 4. The optimum deposition time is obtained 60 minutes with 81.71 % reduction in turbidity, TSS 77.42 %, and 64.10 % COD in 5000 mg/200 ml dosage of coagulant and coagulant particle size of 70 mesh with the final pH about 4, the reductions of turbidity, TSS and COD were obtained over 50 %.it can be concluded that moringa seeds can be used as an effective coagulant as an whey waste alternative treatment
Keywords : liquid waste industrial of whey, moringa seed powder, turbidity, TSS,
DAFTAR ISI
SAMPUL DALAM ... i
PERNYATAAN KEASLIAN SKRIPSI ... ii
PENGESAHAN ... iii
PRAKATA ... iv
DEDIKASI ... v
RIWAYAT HIDUP ... vi
ABSTRAK ... vii
DAFTAR ISI ... ix
DAFTAR GAMBAR ... xii
DAFTAR TABEL ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Tujuan Penelitian ... 3
1.4 Manfaat Penelitian ... 3
1.5 Ruang Lingkup Penelitian ... 3
BAB II TINJAUAN PUSTAKA ... 5
2.1 Tanaman Salak ... 5
2.2 Potensi Buah Salak ... 5
2.3 Bioetanol dan Potensinya ... 6
2.4 Pembuatan Bioetanol ... 7
2.5 Kinetika Reaksi Enzimatis... 9
2.6 Potensi Ekonomi Bioetanol dari Buah Salak ... 11
BAB III METODOLOGI PENELITIAN ... 12
3.1 Lokasi Penelitian ... 12
3.2 Bahan dan Peralatan ... 12
3.2.1 Bahan-bahan ... 12
3.2.1.1 Bahan Baku ... 12
3.2.1.2 Bahan Kimia ... 12
3.2.2.1 Peralatan Penelitian ... 13
3.2.2.2 Peralatan Analisa ... 13
3.3 Prosedur Penelitian ... 14
3.3.1 Prosedur Fermentasi Buah Salak ... 14
3.3.2 Analisa Kadar Pati ... 14
3.3.3 Analisa Kadar Glukosa ... 15
3.3.4 Analisa Kadar Etanol ... 17
3.3.4.1 Analisa Kadar Etanol dengan Kromatogram GC ... 17
3.3.4.2 Analisa Kadar Etanol dengan Metode Berat Jenis ... 17
3.3.5 Analisa Kadar Volatil Solid ... 19
3.4 Flowchart Penelitian ... 20
3.4.1 Flowchart Fermentasi ... 20
3.4.2 Flowchart Pembuatan Larutan Luff Schoorl ... 21
3.4.3 Flowchart Penentuan Kadar Pati ... 22
3.4.4 Flowchart Penentuan Kadar Glukosa ... 24
3.4.5 Flowchart Penentuan Kadar Etanol dengan Metode Berat Jenis .... 26
3.4.5.1 Preparasi Sampel ... 26
3.4.5.2 Pembuatan Larutan Baku Etanol ... 26
3.4.5.3 Pengukuran Larutan Baku Etanol ... 27
BAB IV HASIL DAN PEMBAHASAN ... 28
4.1 Hasil Penelitian ... 28
4.2 Pembahasan ... 30
4.2.1 Hubungan Antara Kadar Pati terhadap Waktu Fermentasi ... 30
4.2.2 Hubungan Antara Kadar Glukosa terhadap Waktu Fermentasi ... 31
4.2.3 Hubungan Antara Kadar Alkohol terhadap Waktu Fermentasi ... 31
4.2.4 Hubungan Antara Kadar Volatil Solid (VS) terhadap Waktu Fermentasi ... 31
4.3 Penentuan Kinetika Fermentasi ... 31
4.3.1 Penentuan Kinetika Hidrolisis Pati Menjadi Glukosa ... 31
4.2.2 Penentuan Kinetika Fermentasi Glukosa Menjadi Alkohol ... 33
BAB IV KESIMPULAN DAN SARAN ... 35
DAFTAR GAMBAR
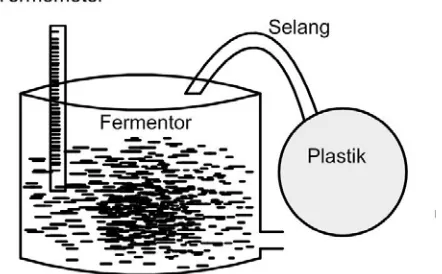
Gambar 3.1 Rangkaian Peralatan Fermentasi ... 13
Gambar 3.2 Flowchart Fermentasi ... 20
Gambar 3.3 Flowchart Pembuatan Larutan Luff Schoorl ... 21
Gambar 3.4 Flowchart Penentuan Kadar Pati ... 22
Gambar 3.5 Flowchart Penentuan Kadar Glukosa ... 24
Gambar 3.6 Flowchart Preparasi Sampel Metode Berat Jenis ... 26
Gambar 3.7 Flowchart Pembuatan Larutan Baku Etanol ... 26
Gambar 3.8 Flowchart Pengukuran Larutan Baku Etanol Metode Berat Jenis ... 27
Gambar 4.1 Grafik Hubungan Antara Kadar (gr/100ml) Pati, Glukosa dan Alkohol terhadap Waktu Fermentasi ... 29
Gambar 4.2 Grafik Hubungan Antara Kadar (%mol) Pati, Glukosa dan Alkohol terhadap Waktu Fermentasi ... 29
Gambar 4.3 Grafik Hubungan Antara Kadar Volatil Solid terhadap Waktu Fermentasi ... 30
Gambar 4.4 Grafik Hubungan Antara 1/[S] vs 1/V ... 32
DAFTAR TABEL
Tabel 2.1 Harga Grosir Buah Di Tingkat Provinsi Per Tanggal 11 Januari 2013 ... 11 Tabel 3.1 Penetapan Kandungan Gula Inversi Menurut Luff Schoorl... 16 Tabel 3.2 Konversi Berat Jenis Kadar Etanol (v/v) ... 18 Tabel 4.1 Hasil Analisa Kadar Pati, Glukosa, Alkohol dan Volatil Solid Selama
14 Hari 28
Tabel 4.2 Kadar Pati Dan Glukosa Disubstitusikan Ke Persamaan Michaelis Menten . 32 Tabel 4.3 Kadar Glukosa Dan Alkohol Disubstitusikan Ke Persamaan
Michaelis Menten ... 33 Tabel A.1 Data Hasil Penelitian
ABSTRAK
Limbah cair industri tahu mengandung banyak senyawa-senyawa organik kompleks berupa protein, lemak, karbohidrat dan minyak.. Berdasarkan hasil studi Balai Perindustrian Medan terhadap karakteristik air buangan industri tahu di Medan, diketahui bahwa limbah cair industri tahu rata-rata mengandung BOD (4583 mg/l), COD (7050 mg/l), TSS (4743 mg/l) dan minyak atau lemak (26 mg/l) dengan pH 6,1. Oleh karena itu, diperlukan pengolahan limbah cair industri tahu yang dapat mengurangi kadar pencemar dalam limbah sehingga dampak buruknya terhadap lingkungan juga dapat dikurangi. Salah satu koagulan alternatif yang dapat digunakan adalah serbuk biji kelor. Penelitian ini menggunakan serbuk biji kelor dengan kadar air 9 %. Variasi dosis koagulan yang digunakan 2000, 3000, 4000, 5000 mg/200 ml limbah cair tahu, lama pengendapan 50, 60,dan 70 menit serta ukuran koagulan 50 dan 70 mesh dengan pH awal adalah 4. Waktu pengendapan optimum yang diperoleh adalah 60 menit dengan penurunan turbiditas 81,71 %, TSS 77,42 %, dan COD 64,10 % pada dosis koagulan 5000 mg/200 ml, dan ukuran partikel koagulan 70 mesh dengan pH akhir adalah 4, karena persentase penurunan turbiditas, TSS dan COD yang diperoleh diatas 50%, maka dapat disimpulkan bahwa serbuk biji kelor dapat digunakan sebagai koagulan yang efektif pada alternatif pengolahan limbah cair industri tahu
ABSTRACT
Liquid waste industrial of wheys contain of many complex organic compounds such as proteins, carbohydrates, fats and oils. Based on the results of field studies on Industry Hall of liquid waste industrial characteristics of whey in Medan, it is known that liquid waste industrial of wheys contain average BOD (4583 mg/l), COD (7050 mg/l), TSS (4743 mg/l ) and oil or fat (26 mg/l ) at pH 6.1. Therefore, the whey waste water must be treated before it is discharged into the environment to reduce the contaminants that accompany the waste. One alternative that can be used as a coagulant is moringa seed powder. This study used of moringa seed powder with a water content of 9 %. Variations of coagulant dosage which are used 2000, 3000, 4000, 5000 mg/200 ml liquid waste industrial of whey, coagulant particle size 50 and 70 mesh with the initial pH about 4. The optimum deposition time is obtained 60 minutes with 81.71 % reduction in turbidity, TSS 77.42 %, and 64.10 % COD in 5000 mg/200 ml dosage of coagulant and coagulant particle size of 70 mesh with the final pH about 4, the reductions of turbidity, TSS and COD were obtained over 50 %.it can be concluded that moringa seeds can be used as an effective coagulant as an whey waste alternative treatment
Keywords : liquid waste industrial of whey, moringa seed powder, turbidity, TSS,
BAB I
PENDAHULUAN
1.1 LATAR BELAKANG
Bahan bakar minyak merupakan kebutuhan yang sangat penting dalam kehidupan. Bahan bakar yang digunakan selama ini berasal dari minyak mentah yang diambil dari dalam bumi, sedangkan minyak bumi merupakan bahan bakar yang tidak dapat diperbaharui. Kebutuhan energi dari bahan bakar minyak bumi (BBM) di berbagai negara di dunia dalam tahun terakhir ini mengalami peningkatan tajam. Tidak hanya pada negara - negara maju, tetapi juga di negara berkembang seperti Indonesia. Sehingga untuk beberapa tahun ke depan diperkirakan masyarakat akan mengalami kekurangan bahan bakar. Keadaan ini tidak dapat lagi dipertahankan pada dasawarsa sembilan puluhan. Bahkan pada abad 21 sekarang ini Indonesia diperkirakan akan menjadi net importer bahan bakar fosil [10].
Melihat kondisi di atas, sudah saatnya Indonesia mengembangkan berbagai energi alternatif yang dapat diperbaharui. Kebutuhan energi fosil yang non-renewableperlu digantikan dengan energi yang renewable. Untuk mengantisipasi terjadinya krisis bahan bakar minyak bumi (BBM) pada masa yang akan datang, saat ini telah dikembangkan pemanfaatan etanol sebagai sumber energi terbarukan, contohnya untuk pembuatan bioetanol.
Bioetanol adalah sebuah bahan bakar alternatif yang diolah dari tumbuhan (biomassa) dengan cara fermentasi, dimana memiliki keunggulan mampu menurunkan emisi CO2 hingga 18 % [17]. Tumbuhan yang potensial untuk menghasilkan bioetanol adalah tanaman yang memiliki kadar karbohidrat tinggi.
tersebut mengandung kadar gula dan air yang tinggi sehingga buah tersebut mudah membusuk jika terluka.
Produksi buah salak Kabupaten Tapanuli Selatan mencapai 100 ton per hari, dan 5 – 10 % dari buah salak yang dipanen merupakan buah salak yang tidak layak jual karena kulitnya terbuka ataupun buahnya terluka [14]. Melihat kondisi ini, buah salak tidak layak jual tersebut berpotensi dijadikan sebagai bahan baku pembuatan bioetanol. Dengan demikian buah salak yang tidak layak jual tersebut tidak terbuang sia-sia.
Dari 100 ton buah salak yang di produksi tiap harinya terdapat 10 % buah yang tidak layak jual dan dapat diolah menjadi bioetanol. Dari 10 ton buah salak yang diolah dapat menghasilkan 3,5 ton bioetanol dan produk lainnya. Harga bioetanol hingga saat ini mencapai Rp. 9.000,00 dan akan meningkat hingga mencapai Rp. 12.000,00 [6]. Oleh karena itu pembuatan bioetanol dari buah salak perlu diteliti lebih lanjut lagi.
Telah banyak penelitian mengenai pembuatan bioetanol dari buah-buahan sebagai energi alternatif. Seperti penelitian yang dilakukan oleh Fifi Nurfiana dkk (2009) menggunakan biji durian untuk pembuatan bioetanol dan menyimpulkan bahwa fermentasi terhenti setelah berlangsung selama 75 jam dengan kadar etanol 8,64 %. Penelitian yang dilakukan oleh Retno (2011) dengan menggunakan kulit pisang sebagai bahan baku memperoleh waktu optimum fermentasi adalah 144 jam dengan kadar etanol 13,5406%.
Pembuatan bioetanol dari buah salak pernah diteliti oleh Yurida Wijayanti (2011) dengan memvariasikan penambahan ragi, yaitu 1%, 1,5%, 3%, 5%, dan 7,5%. Hasil yang diperoleh adalah kadar alkohol tertingi 54,16% dengan penambahan ragi 7,5%.
1.2 RUMUSAN MASALAH
Perolehan alkohol hasil fermentasi buah salak yang telah dilakukan beberapa peneliti berkisar antar 8 – 54 %. Perolehan ini sebenarnya tergantung kepada kinetika reaksi fermentasi yang terjadi. Untuk itu pada penelitian ini akan mengkaji bentuk persamaan kecepatan reaksi fermentasi alkohol dari buah salak dan berapa nilai konstanta kecepatan reaksinya. Sehingga dari data kinetika dapat ditentukan reaksi penentu dalam reaksi fermentasi alkohol dari buah salak.
1.3 TUJUAN PENELITIAN
Adapun tujuan dari penelitian ini adalah untuk mempelajari rangkaian kinetika reaksi fermentasi alkohol yaitu kinetika reaksi hidrolisa pati menjadi glukosa dan fermentasi glukosa menjadi alkohol dari buah salak dengan menggunakan Saccharomyces cereviseae. Serta menentukan reaksi penentu dalam reaksi fermentasi alkohol dari buah salak.
1.4 MANFAAT PENELITIAN
Adapun manfaat dari penelitian ini adalah tersedianya data kinetika reaksi
fermentasi alkohol berupa data kinetika reaksi hidrolisis pati menjadi glukosa dan data
kinetika reaksi fermentasi glukosa menjadi alkohol dari buah salak dengan menggunakan
Saccharomyces cereviseae.
1.5 RUANG LINGKUP PENELITIAN
Adapun ruang lingkup dari penelitian ini adalah :
1. Penelitian ini dilakukan di LaboratoriumMikrobiologi Teknik, Departemen Teknik Kimia, Fakultas Teknik Universitas Sumatera Utara, Medan.
2. Batasan masalah dalam penelitian ini adalah hanya untuk mengetahui kinetika reaksi fermentasi alkohol dari buah salak dengan menggunakan Saccharomyces cereviseae.
3. Bahan baku yang digunakan pada penelitian ini adalah buah salak dan Saccharomyces cereviseae.
4. Variabel yang digunakan dalam penelitian ini meliputi:
- Variabel tetap : suhu (°C) : 30
5. Analisis yang dilakukan adalah :
- Analisis kadar pati dengan menggunakan metode Luff Schoorl.
- Analisis kadar glukosa dengan menggunakan metode Luff Schoorl.
- Analisis kadar etanol dengan menggunakan kromatogram GC (Gas Chromatography) dan metode berat jenis.
BAB II
TINJAUAN PUSTAKA
2.1 TANAMAN SALAK
Tanaman salak termasuk dalam kelompok tanaman Palmae yang tumbuh berumpun dan umumnya tumbuh berkelompok.Banyak varietas salak yang bisa tumbuh di Indonesia. Varietas unggul yang telah dilepas oleh pemerintah untuk dikembangkan ialah: salak pondoh, swaru, nglumut, enrekang, gula batu (Bali), dan lain-lain. Sebenarnya jenis salak yang ada di Indonesia ada 3 perbedaan yang menyolok, yakni: salak Jawa Salacca zalacca (Gaertner) Voss yang berbiji 2-3 butir, salak Bali Slacca amboinensis (Becc) Mogea yang berbiji 1- 2 butir, dan salak Padang Sidempuan Salacca sumatrana (Becc) yang berdaging merah. Jenis salak itu mempunyai nilai komersial yang tinggi. Klasifikasi dari buah salak dapat dilihat berikut [5] :
Tanaman salak termasuk suku pinang-pinangan, ordo Spadiceflorae, famili Palmaceae dengan beberapa spesies sepertiSalacca conferta, Salacca adulis, Salacca affinis, Salacca globoscans, dan Salacca wulliciana [25]. Menurut Suter (1988), panjang buah salak berkisar antara 4,46-6,13 cm, diameter 4,28-5,67 cm, dan berat buah berkisar antara 34,79-83,47 g. Variasi panjang, diameter, dan berat buah salak dipengaruhi oleh kultivar serta letak buah salak pada tandannya. Buah salak banyak disukai orang, selain karena rasanya yang khas buah salak juga mengandung nutrisi yang lengkap, di mana dalam 100 gram salak, terkandung 20,9 gram karbohidrat, 77 kalori, 0,4 gram protein, 28 gram kalsium, 18 gram fosfor, zat besi4,2 mg, 0,04 mg vitamin B, 2 mg vitamin C, dan lain-lain [5].
2.2 POTENSI BUAH SALAK
merpakan buah yang dapat tumbuh baik di Indonesia. Sehingga ketersediaan bahan baku terjamin.
Karbohidrat dalam buah salak dapat difermentasi menjadi bioetanol melalui beberapa tahap, yaitu karbohidrat diurai terlebih dahulu melalui proses hidrolisis sehingga menghasilkan glukosa. Kemudian glukosa difermentasi dengan menggunakan Saccharomycescereviseae menjadi bioetanol.
2.3 BIOETANOL DAN POTENSINYA
Bioetanol (C2H5OH) merupakan cairan dari fermentasi gula dari sumber karbohidrat menggunakan bantuan mikroorganisme. Bioetanol diartikan juga sebagai bahan kimia yang diproduksi dari bahan pangan yang mengandung pati. Bioetanol dapat digunakan sebagai bahan bakar dari minyak nabati yang memiliki sifat menyerupai minyak premium [13].
Bioetanol memiliki satu molekul OH dalam susunan molekulnya.Oksigen yang berikatan di dalam molekul etanol tersebut membantu penyempurnaan pembakaran antara campuran udara dan bahan bakar di dalam silinder. Ditambah dengan rentang keterbakaran (flammability) yang lebar, yakni 4.3 – 19 vol% (dibandingkan dengan gasoline yang memiliki rentang keterbakaran 1.4 – 7.6 vol%), pembakaran campuran udara dan bahan bakar etanol menjadi lebih baik. Hal ini dipercaya sebagai faktor penyebab relatif rendahnya emisi CO dibandingkan dengan pembakaran udara dan bensin, yakni sekitar 4%.Etanol juga memiliki panas penguapan yang tinggi, yakni 842 kJ/kg [10].
Bioetanol dapat diproduksi dari berbagai bahan baku yang banyak terdapat di Indonesia, sehingga sangat potensial untuk diolah dan dikembangkan karena bahan bakunya sangat dikenal masyarakat. Tumbuhan yang potensial untuk menghasilkan bioetanol antara lain tanaman yang memiliki kadar karbohidrat tinggi, seperti tebu, nira, aren, sorgum, ubi kayu, batang pisang, ubi jalar, jagung, bonggol jagung, jerami dan bagas (ampas tebu). Banyaknya variasi tumbuhan menyebabkan pihak pengguna akan lebih leluasa memilih jenis yang sesuai dengan kondisi tanah yang ada.
2.4 PEMBUATAN BIOETANOL
mikroorganisme, sebagai penghasil enzim zimosa yang mengkatalis reaksi biokimia pada perubahan substrat organik. Mikroorganisme yang dapat digunakan untuk fermentasi terdiri dari yeast (ragi), khamir, jamur, dan bakteri. Saccharomyces cereviseae lebih banyak digunakan untuk memproduksi alkohol secara komersial dibandingkan dengan bakteri dan jamur lainnya. Hal ini disebabkan karena Saccharomyces cereviseae dapat memproduksi alkohol dalam jumlah besar dan mempunyai toleransi pada kadar alkohol yang tinggi [22].
Terdapat 2 tahap reaksi pada pembuatan bioetanol, yaitu reaksi hidrolisis dan reaksi fermentasi. Pati yang terdapat pada bahan baku dihidrolisis sehingga menghasilkan gula yang lebih sederhana seperti glukosa. Kemudian glukosa difermentasi dengan bantuan Saccharomyces cereviseae menjadi bioetanol.
Reaksi hidrolisis pati berlangsung menurutpersamaan reaksi sebagai berikut: (C6H10O5)n + nH2O n(C6H12O6)
pati air glukosa [2].
Perubahan glukosa menjadi bioethanol oleh sel-sel Saccharomyces cereviseae:
C6H12O6 Saccharomyces cereviseae 2C2H5OH + 2CO2 glukosa etanol
[12]
Fermentasi bioetanol dipengaruhi oleh faktor-faktor antara lain: a. Substrat
Pada umumnya bahan dasar yang mengandungsenyawa organik terutama glukosa dan pati dapatdigunakan sebagai substrat dalam proses fermentasi bioetanol [16].
b. Suhu
c. Nutrisi
Selain sumber karbon, Saccharomyces cereviseaejuga memerlukan sumber nitrogen, vitamin danmineral dalam pertumbuhannya. Pada umumnya sebagian besar Saccharomyces cereviseae memerlukan vitamin seperti biotin dan thiamin yang diperlukan untuk pertumbuhannya. Beberapa mineral juga harus ada untuk pertumbuhan Saccharomyces cereviseae seperti phospat, kalium, sulfur, dan sejumlah kecil senyawa besi dan tembaga [16].
d. pH
pHpada proses fermentasi merupakansalah satu faktor yang mempengaruhi kehidupan Saccharomyces cereviseae. Saccharomyces cereviseae dapat tumbuh dengan baik pada kondisi pH 4 – 6 [16].
e. Konsentrasi substrat
Konsentrasi substrat yang terlalu sedikit akan mengakibatkan produktivitas menurun karena menjadi lelah dan keadaan ini memperbesar terjadinya kontaminasi. Peningkatan konsentrasi substratakan mempercepat terjadinya fermentasi terutama bila digunakan substrat berkadar tinggi. Tetapi jika konsentrasi substrat berlebihan akan mengakibatkan hilangnya kemampuan bakteri untuk hidup sehingga tingkat kematian bakteri sangat tinggi [9].
f. Waktu fermentasi
Waktu fermentasi yang biasa dilakukan 3-14 hari.Jika waktunya terlalu cepat Saccharomyces cereviseae masih dalam masa pertumbuhan sehingga alkohol yang dihasilkan dalam jumlah sedikit dan jikaterlalu lama Saccharomyces cereviseaeakan mati maka alkohol yang dihasilkan tidak maksimal [18].
2.5 KINETIKA REAKSI ENZIMATIS
Kinetika reaksi enzimatis pertama kalidisusun oleh Leanor Michaelis dan MaudMenthen untuk reaksi enzimatis substrattunggal.Reaksi ini terdiri dari satu jenissubstrat dan enzim. Dalam hal ini termasukreaksi enzimatis fermentasi gula menjadi
k1
k2
1. Jumlah atau konsentrasi substratsangat besar bila dibandingkandengan konsentrasi enzim sehingga,seluruh permukaan aktif enzim akantertutup substrat. Jadi reaksi enzimatis ini dikondisikan mengikuti reaksi orde satu semu.
2. Reaksi antara enzim dan substrat adalah reaksi kesetimbangan(equilibrium). 3. Ikatan kompleks selalu beruraisemuanya menjadi produk.
S+E ES P + E
Bila telah tercapai keadaan seimbang maka kecepatan pembentukan kompleks ES sama dengan kecepatan peruraian kompleks ES;dengan catatan bahwa tetapan laju reaksi pembentukan ES dari produk sangat kecil sehingga dapat diabaikan.
[ES] = [P] ...(1)
Konstanta Disosiasi :
[ES] [E][S]
Km ...(2)
[E], [S], dan [ES] adalah konsentrasi dalamkeadaan kesetimbangan, masing – masing dariE,S dan ES. Jika konsentarsi enzim semulaadalah [E]o, maka konsentrasi enzim bebasyaitu:[E] = [E]o – [ES] ...(3)
[ES] = konsentrasi enzim yang berkaitandengan substrat, yang juga sama dengankonsentrasi produk [P]. Maka bila persamaan (3) dimasukkan ke dalam persamaan (2),didapatkan :
[ES] ES])[S] [ ([E] K 0 m
...(4)
] [ K [S] [E] [ES] [ES][S] [S] [E] [ES] K m 0 0 m S ...(5)
Laju reaksi, V = k3 [ES], sehingga bilapersamaan (5) dimasukkan kedalamnya,diperoleh : [S] K [S] [E] k V m 0 3 atau 1 [S] K [E] k V m 0 3
Bila konsentrasi substrat cukup besar sehinggasemua enzim terikat kepadanya, yaitu dalambentuk kompleks ES, maka akan didapat lajureaksi yang maksimum, Vmaks
Vmaks = k3[E]0 ...(7)
Bila persamaan (6) dibagi dengan persamaan(7), yaitu :
0 3 m
0 3
maks k [E]
[S] K [S] [E] k V
V
Diperoleh harga [S] K [S] V V m maks
...(8)
Persamaan ini adalah persamaan Michaelis-Menten yaitu hubungan kuantitatif antara lajureaksi enzim dan konsentrasi substrat , bilaVmaks atau Km diketahui. Karena sangat sulituntuk mencari harga V secara langsung daripersaamaan (8), maka persamaan tersebutdilinierisasi dengan metode Lineweaver Burk.
[S] 1 V K V 1 V 1 [S] V K [S] V [S] V 1 maks m maks maks m maks
Data untuk menghitung harga Km dan Vmaksadalah dengan membuat grafik hubungan antara 1/V dan 1/[S]. Harga 1/Vmaks adalah intercept dan Km/Vmaks merupakan slope dari persamaan (10) (Suharto, 1995).
2.6 POTENSI EKONOMI BIOETANOL DARI BUAH SALAK
Sebagaimana telah disebutkan, bahwa 5-10% dari 100 ton buah salak yang dipanen setiap harinya merupakan buah salak yang tidak layak jual. Buah salak yang tidak layak jual tersebut pada akhirnya akan terbuang sia-sia.
Melihat kondisi tersebut, maka perlu adanya suatu pengolahan terhadap buah salak yang tidak laayk jual menjadi bioetanol. Sehingga, dapat menambah keuntungan bagi petani salak.
Dari 10 ton buah salak perharinya dapat dihasilkan sekitar 3,5 ton bioetanol. Berdasarkan pada perhitungan seperti dibawah ini :
C6H12O6 Saccharomyces cereviseae 2C2H5OH + 2CO2
...(9)
glukosa etanol
Buah salak mengandung 33 % glukosa. Jadi, dalam 10 ton buah salak mengandung 3.300 kg glukosa yang sama dengan 18,3 kmol. Dan akan menghasilkan 36,7 kmol bioetanol yang setara dengan 3.523,2 kg.
[image:30.595.115.518.271.385.2]Dari data yang bersumber dari pelayanan informasi pasar (ditjen P2HP), harga buah salak bervariasi di setiap provinsi, seperti disajikan dalam tabel 2.1. Sedangkan harga bioetanol hingga saat ini mencapai Rp. 9.000,00 dan akan meningkat hingga mencapai Rp. 12.000,00 [6].
Tabel 2.1 Harga Grosir Buah di Tingkat Provinsi per Tanggal 11 Januari 2013
No. Provinsi Harga
Grosir eceran
1. Ambon, Maluku 10.000 15.000
2. Bengkulu, Bengkulu 6.000 10.000
3. Yogyakarta, DIY 3.000 5.500
4. Pontianak, Kalbar 11.000 13.000
5. Bandung, Jabar 2.500 3.000
BAB III
METODOLOGI PENELITIAN
Kinetika fermentasi alkohol dari buah salak dapat ditentukan dengan memfermentasikan sari buah salak. Terhadap sari buah salak tersebut dilakukan uji kadar gula, uji kadar gula tersebut dilakukan untuk menentukan persentase ragi yang akan digunakan. Fermentasi dilakukan dengan memvariasikan waktu fermentasi. Dilakukan pengujian kadar pati, glukosa dan etanol terhadap hasil fermentasi tiap variasi waktu . dari data yang diperoleh berupa konsentrasi pati, glukosa serta alkohol dapat ditentukan konstanta kinetika reaksinya. Penentuan konstanta kinetika reaksinya mengikuti persamaan Michaelis Menten.
3.1 LOKASI PENELITIAN
Penelitian ini akan dilakukan di Laboratorium Mikrobiologi Teknik, Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara.
3.2 BAHAN DAN PERALATAN
3.2.1 Bahan-Bahan
3.2.1.1 Bahan Baku
Bahan baku dalam penelitian ini adalah buah salak sidempuan yang tidak layak jual. Buah salak ini kemudian difermentasikan dengan bantuan mikroorganisme yaitu Saccharomyces cereviseae.
3.2.1.2 Bahan Kimia
Bahan-bahan kimia yang digunakan dalam penelitian ini adalah bahan-bahan yang digunakan dalam analisa kadar pati dan glukosa, yaitu : Na2CO3 anhidrat, asam sutrat, CuSO4. 5H2O, HCl, NaOH, indikator pp, KI, H2SO4, indikator amilum, (NH4)2HPO4, dan Pb asetat.
3.2.2 Peralatan
1. Termometer 2. Fermentor 3. Shaker
4. Pengaduk kaca 5. Pipa
6. Plastik
7. Labu destilasi 8. Statif
9. Pendingin leibig
3.2.2.2 Peralatan Analisa
1. Kromatogram GC(Gas Chromatography) 2. Buret
3. Statif
[image:32.595.211.432.493.630.2]4. Alat-alat gelas 5. Piknometer
3.3 PROSEDUR PENELITIAN
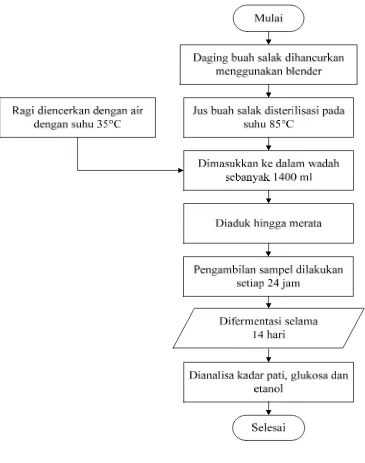
3.3.1 Prosedur Fermentasi Buah Salak
1. Daging buah salak dihancurkan terlebih dahulu dengan menggunakan blender lalu dimasukkan ke dalam wadah sebanyak 21 liter.
2. Jus buah salak disterilisasi pada suhu 85oC selama 30 menit. Lalu didinginkan pada suhu ruang.
3. Ragi dengan jumlah :
Ragi = 0,5% x kadar gula x volume sari buah
Diencerkan dengan air dengan suhu 35oC sebanyak 100 ml, diaduk sampai muncul buihnya.
4. Masukkan ragi ke dalam sari buah dan diaduk sampai tercampur merata.
5. Pengambilan sampel dilakukan setiap hari untuk dianalisa kadar pati, glukosa, etanol, yang terbentuk dan volatil solid.
6. Difermentasikan selama 14 hari.
3.3.2 Analisis Kadar Pati
Analisis kadar pati dilakukan dengan menggunakan metode Luff Schoorl. Adapun prosedur metode ini adalah sebagai berikut (BSN, 2008):
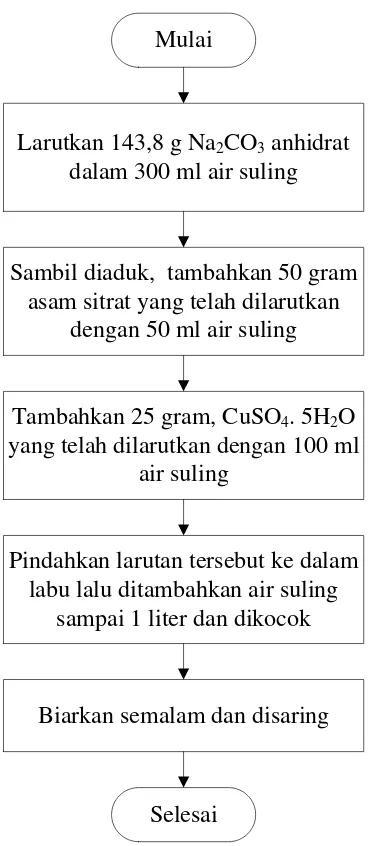
1. Larutan Luff Schoorl dibuat dengan melarutkan 143,8 g Na2CO3 anhidrat dalam 300 ml air suling. Sambil diaduk, tambahkan 50 gram asam sitrat yang telah dilarutkan dengan 50 ml air suling. Tambahkan 25 gram, CuSO4. 5H2O yang telah dilarutkan dengan 100 ml air suling. Pindahkan larutan tersebut ke dalam labu lalu ditambahkan dengan air suling hingga 1 liter dan kocok. Biarkan semalam dan disaring. Larutan ini mempunyai kepekatan Cu2+ 0,2 N dan Na2CO3 2 M.
2. Timbang 5 gram sampel dan dimasukkan ke dalam erlenmeyer 500 ml. 3. Ditambahkan 200 ml HCl 3% dan batu didih.
4. Dipasang pendingin tegak.
5. Dipanaskan selama 3 jam, dinginkan, ditambahkan indikator PP dan netralkan dengan NaOH 40%.
7. Ditambahkan 25 ml larutan luff dan 25 ml aquades, ditambahkan batu didih, dan dipasang pendingin tegak.
8. Dipanaskan selama 10 menit lalu didinginkan. 9. Ditambahkan 15 ml KI 20% dan 25 ml H2SO4 25%.
10.Ditambahkan indikator amilum, teruskan titrasi hingga putih susu. 11.Dilakukan titrasi blanko.
3.3.3 Analisa Kadar Glukosa
Analisis kadar glukosa dilakukan dengan menggunakan metode Luff Schoorl. Adapun prosedur metode ini adalah sebagai berikut (BSN,1992):
1. Ditimbang 2 gram cuplikan dan masukkan ke dalam labu ukur 50 ml. 2. Tambahkan 5 ml Pb asetat setengah basa dan goyangkan.
3. Teteskan 1 tetes larutan (NH4)2HPO4 10% (bila timbul endapan putih maka penambahan Pb asetat setengah basa sudah cukup).
4. Tambahkan larutan (NH4)2HPO4 10% hingga tidak terbentuk endapan.
5. Goyangkan dan tambahkan air suling pada labu ukur sampai 50 ml, dan dikocok 12 kali biarkan dan saring.
6. Pipet 10 ml larutan hasil penyaringan dan masukkan ke dalam Erlenmeyer 500 ml.
7. Tambahkan 15 ml air suling dan 25 larutan Luff serta beberapa butir batu didih.
8. Panaskan selama 10 menit kemudian angkat dan segera dinginkan dalam bak berisi es.
9. Setelah dingin tambahkan 10 ml larutan KI 20% dan 25 ml larutan H2SO4 25%.
10.Titer dengan larutan tio 0,1 N dengan larutan kanji 0,5% sebagai indikator, misalkan dibutuhkan V1 ml tio 0, 1 N.
11. Kerjakan penetapan blanko dengan 25 ml air dan 25 ml larutan Luff, misalkan dibutuhkan V2 ml tio 0, 1 N.
Perhitungan:
% gula sebelum inverse = W
fp x W1
x 100 % Keterangan:
[image:35.595.119.526.232.735.2]Wl = glukosa, mg fp = faktor pengenceran W = bobot contoh (mg)
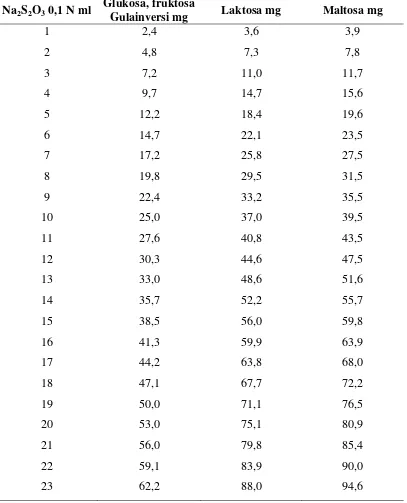
Tabel 3.1 Penetapan kandungan gula inversi menurut Luff Schoorl
Na2S2O3 0,1 N ml Glukosa, fruktosa
Gulainversi mg Laktosa mg Maltosa mg
1 2,4 3,6 3,9 2 4,8 7,3 7,8
3 7,2 11,0 11,7
4 9,7 14,7 15,6
5 12,2 18,4 19,6
6 14,7 22,1 23,5
7 17,2 25,8 27,5
8 19,8 29,5 31,5
9 22,4 33,2 35,5
3.3.4 Analisis Kadar Etanol
3.3.4.1 Analisis Kadar Etanol Dengan Kromatogram GC
Analisis kadar etanol dilakukan dengan analisis GC (Gas Chromatography). Adapun prosedur penggunaan GC adalah sebagai berikut:
1. Senyawa standar disiapkan (butanol)
2. Kondisi kerja ala kromatografi, terutama temperature kolom (db-23), laju alir gas pembawa (N2 dan H2), detector (fid), besar arus yang melalui detector, attenuator, kecepatan kertas recorder, dan posisi pen pada recorder diatur 3. Alat kromatografi gas dipastikan siap untuk dipakai.
4. Tombol zero, enter, sig 1 ditekan pada alat kromatografi gas 5. Senyawa standar diambil
6. Senyawa standar disuntikkan ke dalam alat kromatografi gas sebanyak 1 kali. 7. Tombol start ditekan tepat pada saat penyuntikkan dan alat kromatografi
dibiarkan bekerja.
8. Dengan cara yang sama seperti senyawa standar, sampel campuran disuntikkan.
[24]
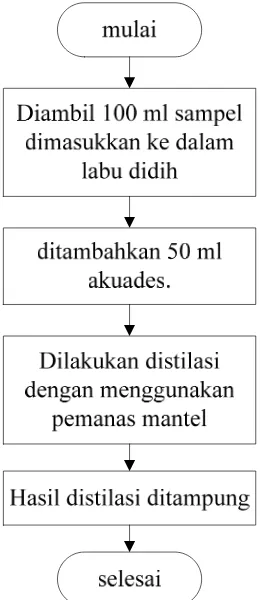
3.3.4.2 Analisis Kadar Etanol Dengan Metode Berat Jenis Adapun prosedur metode ini adalah sebagai berikut: a. Preparasi Sampel
1. Diambil 100 ml sampel dimasukkan ke dalam labu didih kemudian ditambahkan 50 ml akuades.
2. Dilakukan distilasi dengan menggunakan pemanas mantel. 3. Hasil distilasi ditampung.
b. Pembuatan seri larutan baku etanol
1. Etanol hasil distilasi dimasukkan ke dalam labu ukur 100 ml. 2. Ditambahkan akuades hingga volume 100 ml.
c. Pengukuran larutan baku etanol
1. Piknometer dikeringkan dan ditimbang.
3. Piknometer diisi dengan akuades secara hati-hati hingga penuh dan termometer dimasukkan.
4. Suhu akuades dalam piknometer ditunggu hingga mencapai suhu percobaan (20°C), kelebihan akuades pada puncak pipa kapiler dibersihkan.
5. Piknometer yang berisi akuades segera ditimbang dan beratnya dicatat. 6. Cara yang sama dilakukan untuk larutan baku etanol. Berat jenis dihitung
dengan rumus berikut: Berat jenis sampel =
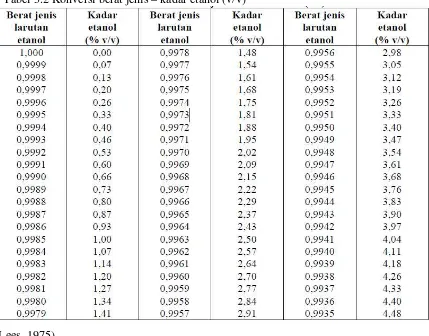
[image:37.595.119.548.330.666.2]Kadar etanol dihitung dengan menggunakan tabel 3.2
Tabel 3.2 Konversi berat jenis – kadar etanol (v/v)
(Lees, 1975)
1. Sampel dikeringkan pada suhu 103-105 ˚C selama 1 jam
2. Dilanjutkan dengan pemanasan pada suhu 550 ˚C selama 15 menit 3. Didinginkan di dalam desikator
(L) sampel volum
(mg) C 550 setelah berat
(mg) C 105 setelah berat
(mg/L)
3.4 Flowchart Penelitian
[image:39.595.115.480.164.627.2]3.4.1 Flowchart Fermentasi
3.4.2 Flowchart Pembuatan Larutan Luff Schoorl
Mulai
Larutkan 143,8 g Na2CO3anhidrat dalam 300 ml air suling
Sambil diaduk, tambahkan 50 gram asam sitrat yang telah dilarutkan
dengan 50 ml air suling
Tambahkan 25 gram, CuSO4. 5H2O yang telah dilarutkan dengan 100 ml
air suling
Pindahkan larutan tersebut ke dalam labu lalu ditambahkan air suling
sampai 1 liter dan dikocok
Biarkan semalam dan disaring
[image:40.595.227.412.128.551.2]Selesai
3.4.5 Flowchart Penentuan Kadar Etanol Dengan Metode Berat Jenis
[image:45.595.254.384.147.447.2]3.4.5.1 Preparasi Sampel
Gambar 3.6 Flowchart Preparasi Sampel Metode Berat Jenis
3.4.5.2Pembuatan larutan baku etanol
[image:45.595.244.392.507.711.2][image:46.595.228.412.127.639.2]
3.4.5.3 Pengukuran larutan baku etanol
BAB IV
HASIL DAN PEMBAHASAN
4.1 HASIL PENELITIAN
Penelitian ini bertujuan untuk mengetahui kinetika fermentasi alkohol dari buah salak oleh Saccaromyces cereviseae.Komposisi kimia buah salak yang digunakan dalam fermentasi ini adalah pati 16,07%, glukosa 32,96%. Pati dapat dihidrolisa menghasilkan glukosa, dan glukosa difermentasi menjadi alkohol.
Glukosa pada buah salak difermentasikan oleh Saccaromyces cereviseae. Saccaromyces cereviseae dalam bentuk ragi ini ditambahkan sebanyak 0,5% dari banyaknya sampel dikalikan dengan banyaknya glukosa awal [10].
[image:47.595.109.532.443.709.2]Parameter analisa fermentasi yang dilakukan adalah analisa kadar pati dan glukosa dengan metode luff schoorl, analisa kadar alkohol dengan metode berat jenis dan Gas Chromatography (GC), serta analisa volatil solid (vs) dengan metode gravimetri. Pada tabel 4.1 dipaparkan hasil analisa yang dilakukan selama 14 hari. Tabel 4.1 Hasil Analisa Kadar Pati, Glukosa, Alkohol dan Volatil Solid Selama 14
Hari hari ke- Pati
(massa) Pati (%mol) Glukosa (%massa) Glukosa (%mol) Alkohol (%massa) Alkohol (%mol) Volatil solid 0 16,07 0,0934 32,96 0,1717 0,00 0,02583 - 1 12,69 0,0738 32,03 0,1668 1,24 0,04021 150 2 12,36 0,0719 31,10 0,1620 1,93 0,06167 140 3 12,10 0,0703 29,09 0,1515 2,96 0,06771 118 4 11,69 0,0680 27,25 0,1420 3,25 0,07104 114 5 11,66 0,0678 25,75 0,1341 3,41 0,08792 100 6 11,31 0,0658 25,15 0,1310 4,22 0,10563 98 7 11,17 0,0649 24,28 0,1264 5,07 0,12271 90 8 10,89 0,0633 23,55 0,1227 5,89 0,13250 70 9 10,76 0,0626 23,26 0,1212 6,36 0,14354 64 10 10,63 0,0618 22,83 0,1189 6,89 0,14833 60 11 10,49 0,0610 22,10 0,1151 7,12 0,14396 58 12 10,29 0,0598 20,94 0,1091 6,91 0,13479 54 13 10,28 0,0598 20,65 0,1076 6,47 0,13063 46 14 10,28 0,0598 19,95 0,1039 6,24 0,02583 42
[image:48.595.167.507.154.362.2]
dan Gambar 4.2 hubungan antara kadar pati, glukosa dan alkohol terhadap waktu fermentasi dan Gambar 4.3 hubungan antara kadar volatil solid terhadap waktu fermentasi.
Gambar 4.1 Grafik Hubungan Antara Kadar(gr/100ml) Pati, Glukosa dan Alkohol terhadap Waktu Fermentasi
[image:48.595.172.494.418.642.2]
G ambar 4.3 Grafik Hubungan Antara Kadar Volatil Solid terhadap Waktu
Fermentasi
4.2 PEMBAHASAN
Dari gambar 4.1dapat dilihat adanya penurunan kadar pati dan juga glukosa terhadap waktu, sedangkan untuk kadar alkohol mengalami peningkatan sampai hari ke-11 dan menurun di hari ke-12. Dari gambar 4.3 menunjukan hubungan antara kadar volatil solid (vs) terhadap waktu fermentasi.
4.2.1 Hubungan Antara Kadar Pati terhadap Waktu Fermentasi
Dari Gambar 4.1dapat dilihat bahwa kadar pati terus mengalami penurunan selama 14 hari waktu fermentasi. Penurunan sangat drastis terjadipada hari pertama fermentasi dimana kadar pati yang pada awalnya adalah 16,07% menjadi 12,69% dan pada hari-hari berikutnya perubahan kadar tidak terlalu besar dan tidak mengalami perubahan pada hari ke-13 dan 14 yaitu sebesar 10,28%.
oleh Omemu et al pada tahun 2005, penurunan kadar pati yang optimum adalah selam 72 jam [18].
4.2.2 Hubungan Antara Kadar Glukosa terhadap Waktu Fermentasi
Dari gambar 4.1 menunjukkan bahwa selama proses fermentasi berlangsung kadar glukosa menurun dari 32,96% menjadi 19,95%. Kadar glukosa selama proses fermentasi dihitung dengan menggunakan metode Luff Schoorl. Penurunan kadar glukosa ini menunjukkan adanya aktivitas fermentasi oleh Saccharomyces cerevisae. Ketersediaan glukosa yang besar pada fermentasi hari ke-0 merupakan sumber nutrisi dan energy bagi S. cerevisae. Konsumsi glukosa oleh S. cerevisae mengakibatkan menurunnya glukosa pada fermentasi hari berikutnya [3].
4.2.3 Hubungan Antara Kadar Alkohol terhadap Waktu Fermentasi
Dari gambar 4.1 dapat dilihat bahwa selama proses fermentasi berlangsung kadar etanol cenderung meningkat. Kadar etanol selama proses fermentasi dihitung dengan menggunakan metode berat jenis. Kadar etanol dipengaruhi oleh waktu fermentasi. Kadar etanol optimum dicapai pada waktu fermentasi jam ke-24, dan mulai menurun pada jam ke-36.
4.2.4 Hubungan Antara Kadar Volatil Solid (VS) terhadap Waktu Fermentasi
Dari gambar 4.2 dapat dilihat bahwa kadar volatil solid cenderung menurun selama proses fermentasi. Kandungan volatile solid merupakan parameter terukur yang dapat menyatakan seberapa besar beban pencernaan yang harus dilakukan mikroorganisme pada proses hidrolisis dan asidogenesis. Penurunan volatil solid menunjukkan bahwa selama proses fermentasi terjadi proses degradasi senyawa organik oleh mikroorganisme [19].
4.3 PENENTUAN KINETIKA FERMENTASI
4.3.1 Penentuan Kinetika Hidrolisis Pati Menjadi Glukosa
Reaksi hidrolisis yang terjadi adalah sebagai berikut :
nH2O + (C6H10O5)n n(C6H12O6)
air pati glukosa
t d[P]
[image:51.595.147.493.147.416.2]V
[image:51.595.127.502.463.691.2]Tabel 4.2 Kadar pati dan glukosa disubstitusikan ke persamaan Michaelis Menten Waktu (jam) Pati [S] (mol) 1/[S] (1/mol) Glukosa [P] (mol) Kecepatan Reaksi (V) (mol/jam) 1/V (jam/mol) 24 0,0934 10,7032 0,17167 0,00715 139,80583 48 0,0738 13,554 0,16682 0,00348 287,73025 72 0,0719 13,9159 0,16198 0,00225 444,50161 96 0,0703 14,2149 0,15151 0,00158 633,6198 120 0,0680 14,7134 0,14193 0,00118 845,50459 144 0,0678 14,7513 0,13411 0,00093 1073,7087 168 0,0658 15,2078 0,13099 0,00078 1282,5447 192 0,0649 15,3984 0,12646 0,00066 1518,2867 216 0,0633 15,7943 0,12266 0,00057 1761,0191 240 0,0626 15,9851 0,12115 0,00050 1981,0834 264 0,0618 16,1806 0,11891 0,00045 2220,2365 288 0,0610 16,3966 0,1151 0,00040 2502,0814 312 0,0598 16,7153 0,10906 0,00035 2860,745 336 0,0598 16,7315 0,10755 0,00032 3124,0678 Dari tabel di atas dapat dibuat hubungan antara 1/[S] dan 1/V sebagai berikut:
[S] 1 V K V 1 V 1 maks m maks
y = b + ax
Sehingga diperoleh: Intercept = b = - 6468 Slope = a = 529,0 1/Vmaks = intercept
Vmaks= -0,00015 mol/jam
-0,0818 K 529 0015 0,0 K slope V K m m maks m
4.3.2 Penentuan Kinetika Fermentasi Glukosa Menjadi Etanol
C6H12O6 Saccharomycescereviseae 2C2H5OH + 2CO2 Glukosa etanol
Kecepatan pembentukan produk dihitung dengan menggunakan persamaan berikut :
t d[P]
[image:52.595.142.497.487.732.2]V
Tabel 4.3 Kadar glukosa dan alcohol disubstitusikan kepersamaan Michaelis Menten Waktu (jam) Glukosa [S] (mol) 1/[S] (1/mol) Alkohol [P] (mol) Kecepatan Reaksi (V) (mol/jam) 1/V (jam/mol)
24 0,1717 5,8252 0,0258 0,0011 929,0323
Gambar 4.5 Hubungan Antara 1/[S] vs 1/V Grafik ini kemudian didekati dengan persamaan linier sebagai berikut :
[S] 1 V K V 1 V 1 maks m maks
y = b + ax
Sehingga diperoleh: Intercept = b = - 1017 Slope = a = 351 1/Vmaks = intercept
Vmaks= -0,00098 mol/jam
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Adapun kesimpulan yang dapat diambil dari penelitian yang telah dilakukan adalah :
1. Kadar patiawaladalah 16,07% danglukosaawal 32,96%.
2. Kadar pati dan glukosa semakin menurun selama proses fermentasi, berbanding terbalik dengan kadar etanol yang cenderung meningkat.
3. Kadar volatil solid (VS) cenderung menurun selama proses fermentasi. 4. Dari penentuan kinetika hidrolisis pati menjadi glukosa diperoleh :
- Kecepatan reaksi maksimum (Vmaks) = - 0.00015 mol/jam - Konstanta Michaelis-Menten (Km) = - 0,0818
5. Dari penentuan kinetika fermentasi glukosa menjadi etanol diperoleh: - Kecepatan reaksi maksimum (Vmaks) = - 0,00098 mol/jam
- Konstanta Michaelis-Menten (Km) = - 0,3451
5.2 SARAN
Adapun saran yang dapat diberikan adalah :
DAFTAR PUSTAKA
[1] Adam MR dan Moss MO. 2000. Food Microbiology. The Royal Society of Chemistry, United Kingdom.
[2]
Agra, I. B., Warnijati, S. 1973. Hidrolisa Pati Ketela Rambat pada Suhu Lebih dari 100°C. Jurnal Forum Teknik. Volume 19. Nomor : 2. Hal : 1-7. Yogyakarta : Universitas Gajah Mada
[3]
Ali, W. M. 2008. Biokonversi Selulosa Menjadi Sumber Energi Mikrobia. Majalah Media Komunikasi Ilmiah Univet Bantara Sukoharjo. No : 1. Hal : 1-8. ISSN : 085-2583
[4] Anarsis, Widji. 2006.
Agribisnis Komoditas Salak. Jakarta : Bumi Aksara [5] Badan Standarisasi Nasional. 1992. SNI 01-2892-1992.
Cara uji gula. Jakarta. [6] Badan Standarisasi Nasional. 2008. SNI 3729:2008. Tepung Sagu. Jakarta.
[7] Desroir, Norman. 1988. Unit Processing Organic Synthesis. Edisi ke-5. New York : McGraw-Hill Book Company.
[8] Giancoli, C Douglas. 1998. Fisika Jilid I. Edisi ke-5. Jakarta : Erlangga. Terjemahan dari : Phisic Principle and Aplication, Fifth Edition.
[9] Kartasamita G. 1992. Sumber Energi yang tersedia untuk Ratusan Tahun. Buletin Pusat Pengembangan Tenaga Perminyakan Gas Bumi. Jakarta.
[10]
Khairani, Rini. 2007. Tanaman Jagung Sebagai Bahan Biofuel. http://www.macklintmip-unpad.net/biofuel/jagung/pati.pdf. (diakses tanggal 23 Desember 2011)
[11]
LAMPIRAN A
[image:56.595.190.449.162.442.2]DATA HASIL PENELITIAN
Tabel A.1 Data Hasil PenelitianHari ke-
Kadar pati
Kadar glukosa
Kadar alkohol
Volatil Solid
(VS)
0 16,07 32,96 0,00 -
1 12,69 32,03 1,24 150
2 12,36 31,10 1,93 140
3 12,10 29,09 2,96 118
4 11,69 27,25 3,25 114
5 11,66 25,75 3,41 100
6 11,31 25,15 4,22 98
7 11,17 24,28 5,07 90
8 10,89 23,55 5,89 70
9 10,76 23,26 6,36 64
10 10,63 22,83 6,89 60
11 10,49 22,10 7,12 58
12 10,29 20,94 6,91 54
13 10,28 20,65 6,47 46
LAMPIRAN B
DOKUMENTASI PENELITIAN
B.1 Dokumentasi Saat Reaksi Fermentasi
[image:57.595.178.458.189.413.2]Berikut gambar rangkaian proses reaksi fermentasi
Gambar B.1 Rangkaian Peralatan Proses Fermentasi
B.2Dokumentasi Analisis Kadar Glukosa
Berikut gambar rangkaian proses analisis kadar glukosa
Gambar B.3 Analisis Glukosa Sebelum Titrasi Gambar B.4 Analisis Glukosa Sesudah Titrasi
B.3Dokumentasi Analisis Kadar Alkohol
[image:59.595.164.460.161.385.2]Berikut gambar rangkaian proses analisis kadar alkohol