PENGEMBANGAN BIO-FLOKULASI SEBAGAI TEKNIK
PEMANENAN MIKROALGA RAMAH LINGKUNGAN
DENI SAPUTRA
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengembangan Bio-flokulasi sebagai Teknik Pemanenan Mikroalga Ramah Lingkungan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2013
ABSTRAK
DENI SAPUTRA. Pengembangan Bio-flokulasi sebagai Teknik Pemanenan Mikroalga Ramah Lingkungan Dibimbing oleh MUJIZAT KAWAROE dan ADRIANI SUNUDDIN.
Pemanenan mikroalga adalah bagian penting dalam sistem kultivasi mikroalga. Teknik pemanenan yang umum digunakan adalah sentrifugasi, filtrasi dan flokulasi, namun memiliki kekurangan yaitu tidak ramah lingkungan dan memerlukan energi serta biaya operasional yang tinggi. Teknik pemanenan bio-flokulasi menggunakan mikroalga tertentu sebagai agen flokulan diharapkan dapat dijadikan alternatif untuk mengatasi masalah tersebut. Penelitian ini telah melakukan pencampuran spesies mikroalga Tetraselmis suecica (flokulan) dengan Chlorella sp. dan Nannochloropsis sp. (non-flokulan) dengan rasio 1:4, 2:4, 3:4 dan 4:4 (v/v) untuk menentukan nilai % pengendapan. Tetraselmis suecica sebagai agen flokulan mampu mempercepat proses pemanenan Chlorella sp. dan Nannochloropsis sp. khususnya pada rasio 4:4 (v/v) yang ditunjukkan dengan peningkatan % pengendapan Chlorella sp. dari 51.14±1.07% menjadi 67.34±0.67% dan Nannochloropsis sp. dari 20.52±1.17% menjadi 42.43±0.40% setelah ditambahkan Tetraselmis suecica. Hasil menunjukkan bahwa bio-flokulasi dapat dijadikan sebagai teknik pemanenan mikroalga.
Kata kunci: Pemanenan Mikroalga, Bio-flokulasi, % Pengendapan, Tetraselmis suecica, Chlorella sp., Nannochloropsis sp.
ABSTRACT
DENI SAPUTRA. Developing A Bio-flocculation As An Environmentally Friendly Microalgae Harvesting Technique. Under Advisory by MUJIZAT KAWAROE and ADRIANI SUNUDDIN.
Microalgae harvesting is an important part in microalgae cultivating system. Microalgae harvesting technique system which commonly used are centrifugation, filtration and flocculation, but those techniques still have some disadvantages, such as not environmentally friendly, and high of energy used and costly. Bio-flocculation harvesting technique using the microalgae as a flocculant agent can be an alternative way to solve those problems. In this research, mixing of Tetraselmis suecica (flocculant) with Chlorella sp., and Nannochloropsis sp. (nonflocculant) in ratio of 1:4, 2:4, 3:4 and 4:4 (v/v) has conducted to obtain % recovery. The results show that Tetraselmis suecica species as a flocculant agent can fasten the harvesting of Chlorella sp. and Nannochloropsis sp. It can be proved with the increase of % recovery value of Chlorella sp. from 51.14±1.07% to 67.34±0.67% and Nannochloropis sp. from 20.52±1.17% to 42.43±0.40% at the first hour. The result shows that bioflocculation can be applied as microalgae harvesting technique.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan
pada
Departemen Ilmu dan Teknologi Kelautan
PENGEMBANGAN BIO-FLOKULASI SEBAGAI TEKNIK
PEMANENAN MIKROALGA RAMAH LINGKUNGAN
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2013
Judul Skripsi : Pengembangan Bio-flokulasi sebagai Teknik Pemanenan Mikroalga Ramah Lingkungan
Nama : Deni Saputra
NIM : C54090012
Disetujui oleh,
Diketahui oleh
Dr Ir I Wayan Nurjaya, MSc Ketua Departemen
Tanggal lulus :
Dr Ir Mujizat Kawaroe, MSi Pembimbing I
PRAKATA
Puji dan syukur penulis panjatkan kepada ALLAH subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 ialah Pengembangan Teknik Bio-flokulasi sebagai Teknik Pemanenan Mikroalga Ramah Lingkungan.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Mujizat Kawaroe, MSi dan Ibu Adriani Sunuddin, SPi MSi yang telah banyak memberikan saran. Selanjutnya penghargaan penulis sampaikan kepada Laboratorium Surfactant and Bioenergy Research Center, Institut Pertanian Bogor dan seluruh staff pegawai yang telah mendukung dan membantu dalam pelaksanaan penelitian ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, seluruh keluarga, serta teman-teman atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2013
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xv
DAFTAR LAMPIRAN xv
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODOLOGI 2
Waktu dan Lokasi Penelitian 2
Rancangan Penelitian 2
Prosedur Penelitian 3
Analisis Data 5
HASIL DAN PEMBAHASAN 6
Spesies Mikroalga Flokulan dan Non-flokulan 6
Waktu Panen Tetraselmis suecica, Chlorella sp., Nannochloropsis sp. 8
Bio-flokulasi Mikroalga 9
Lemak Mikroalga Hasil Pemanenan dengan Teknik Bio-flokulasi 13
Bio-flokulasi Untuk Pemanenan Mikroalga 14
SIMPULAN DAN SARAN 15
Simpulan 16
Saran 16
DAFTAR PUSTAKA 18
LAMPIRAN 19
DAFTAR TABEL
1 Nilai % pengendapan mikroalga flokulan dan non-flokulan sebelum
dilakukan pencampuran pada jam pertama 9
2 Nilai % pengendapan kombinasi mikroalga flokulan dan non-flokulan setelah dilakukan pencampuran pada jam pertama 9 3 Perbandingan kadar lemak hasil panen dengan bio-flokulasi dan
NaOH 13
4 Perbandingan % pengendapan sebelum dan setelah penambahan
spesies flokulan 15
DAFTAR GAMBAR
1 Simulasi perlakuan spesies flokulan dan non-flokulan 3 2 Nilai OD750nm Tetraselmis suecica, Chlorella sp., Nannochloropsis sp. 6 3 Nilai % pengendapan Tetraselmis suecica, Chlorella sp.,
Nannochloropsis sp. 7
4 Kepadatan sel Tetraselmis suecica, Chlorella sp., Nannochloropsis sp. 8 5 Nilai % pengendapan kombinasi Tetraselmis suecica dan Chlorella sp.
dengan rasio 1:4, 2:4, 3:4, dan 4:4 11
6 Nilai % pengendapan kombinasi Tetraselmis suecica dan
Nannochloropsis sp. dengan rasio 1:4, 2:4, 3:4, dan 4:4 11
7 Mikroalga sebelum terflokulasi dan setelah terflokulasi 12
DAFTAR LAMPIRAN
1 Perbanyakan bibit mikroalga untuk stok penelitian 19
2 Data pertumbuhan mikroalga 19
3 Data OD750nm kombinasi masing-masing mikroalga hasil
spektrofotometer 20
4 Hasil % pengendapan kombinasi masing-masing mikroalga hasil
spektrofotometer 21
5 Data OD750nm kombinasi mikroalga flokulan dan non-flokulan dengan rasio 1:4, 2:4, 3:4 dan 4:4 hasil spektrofotometer 22 6 Hasil % pengendapan kombinasi mikroalga flokulan dan non-flokulan
dengan rasio 1:4, 2:4, 3:4 dan 4:4 hasil spektrofotometer 24 7 Data hasil ekstraksi lemak mikroalga yang dipanen dengan tekknik
bio-flokulasi dan bio-flokulasi mengunakan bahan kimia NaOH 25
8 Hasil analisis statistik 26
PENDAHULUAN
Latar Belakang
Pemanenan mikroalga adalah bagian penting dalam sistem kultivasi mikroalga untuk menghasilkan biomassa panen yang lebih tinggi (Sim et al. 1988). Sentrifugasi, filtrasi dan flokulasi merupakan teknik pemanenan yang umum digunakan dalam pemanenan mikroalga (Grima et al. 2003; Thopmson et al. 2010; Chen et al. 2011; Li dan Wan 2011). Sentrifugasi merupakan teknik pemanenan mikroalga dengan penggunaan modal, energi dan biaya operasional yang tinggi (Wijffels dan Barbosa 2010). Pemanenan mikroalga menggunakan teknik filtrasi hanya dapat dilakukan untuk memanen mikroalga yang berukuran lebih besar dari 100 µ m dan memiliki bentuk tubuh filamen atau berkoloni, seperti Spirulina sp. dan Micractinium sp. (Mohn 1988; Gouveia 2011). Pemanenan mikroalga yang berukuran lebih kecil dari 100 µ m dan tidak berkoloni dapat dilakukan dengan menggunakan teknik flokulasi. Teknik flokulasi akan membantu mikroalga membentuk koloni (flok) dengan bantuan bahan kimia (Lee et al. 1998; Papazi et al. 2010), bakteri (Choi et al. 1998; Fujita et al. 2000; Salehizaden et al. 2000; Li dan Yang 2007) dan fungi (Chang et al. 2005).
Pemanenan mikroalga dengan menggunakan flokulan kimia sangat mudah untuk dilakukan, namun tidak cocok untuk pemanenan mikroalga secara berkelanjutan dalam skala besar karena kelebihan flokulan kationik harus dibersihkan dari media kultur agar dapat digunakan kembali (Schenk et al. 2008). Flokulasi menggunakan bahan kimia juga dapat merubah kondisi media kultur seperti perubahan pH yang ekstrim, penurunan nutrisi, perubahan suhu dan O2 terlarut. Penambahan senyawa kimia juga dapat menyebabkan perubahan komposisi sel mikroalga (Benemann dan Oswald 1996). Flokulasi menggunakan makhluk hidup (bio-flokulasi) seperti bakteri dan fungi dapat dijadikan sebagai alternatif untuk menggantikan flokulan kimia, sehingga efek pencemaran bahan kimia terhadap media kultur dapat dikurangi.
Penggunaan fungi dan bakteri sebagai flokulan membutuhkan tambahan media khusus sebagai sumber energi bagi pertumbuhannya. Selain itu bakteri dan fungi dapat menimbulkan kontaminasi terhadap mikroalga (Schenk et al. 2008). Salim et al. (2011) menyatakan bahwa teknik bio-flokulasi menggunakan mikroalga lebih menjanjikan dibandingkan bakteri dan fungi karena tidak memerlukan tambahan biaya operasional untuk media tumbuh dan mencegah terjadinya kontaminasi. Hal yang terpenting bio-flokulasi menggunakan mikroalga lebih ramah lingkungan karena tidak menggunakan bahan kimia.
2
pemilihan spesies tersebut karena untuk spesies Nannochloropsis sp. dan Chlorella sp. relatif mudah dikultur dalam waktu singkat dan spesies tersebut memiliki potensi untuk bio-bahan bakar karena memiliki kadar lemak yang cukup tinggi.
Tujuan Penelitian Penelitian ini bertujuan untuk:
1. Mendapatkan spesies mikroalga flokulan dan non-flokulan dan waktu panen paling optimal.
2. Menentukan rasio antara spesies mikroalga flokulan dan non-flokulan dalam proses bio-flokulasi untuk meningkatkan % pengendapan mikroalga.
3.
Mengukur % kadar lemak mikroalga hasil pemanenan menggunakan teknik bio-flokulasi.METODOLOGI
Waktu dan Lokasi Penelitian
Penelitian dilaksanakan dari tanggal 14 Maret – 5 Juli 2013 terdiri dari 3 tahapan penelitian. Tahap 1 adalah penelitian pendahuluan dari tanggal 14 Maret - 26 April 2013 meliputi kegiatan persiapan alat dan bahan, kultivasi bibit mikroalga untuk stok penelitian dan penentuan waktu panen optimal spesies mikroalga yang digunakan dalam penelitian. Tahap 2 adalah kegiatan penelitian utama yaitu kultivasi mikroalga untuk penelitian bio-flokulasi dan kegiatan penelitian proses bio-flokulasi dari tanggal 1 - 30 Mei 2013. Tahap 3 adalah kegiatan ekstraksi kadar lemak hasil panen mikroalga mengunakan teknik bio-flokulasi pada skala 10 l dari tanggal 5 Juni – 5 Juli 2013. Lokasi penelitian yaitu di Pusat Penelitian Surfaktan dan Bioenergi, LPPM, Kampus IPB Baranangsiang, Kota Bogor.
Rancangan Penelitian
3 tersebut sudah mulai dapat terlihat efek pengendapan akibat penambahan mikroalga flokulan. Batas maksimal sebesar 100% karena penambahan konsentrasi mikroalga flokulan melebihi konsentrasi mikroalga yang dipanen tidak optimal dari segi efesiensi penggunaan mikroalga flokulan. Setidaknya dengan empat rasio yang digunakan akan diperoleh rasio penambahan mikroalga flokulan yang optimal. Kontrol dalam penelitian ini adalah % pengendapan mikroalga non-flokulan sebelum ditambahkan mikroalga flokulan. Rancangan penelitian yang digunakan adalah rancangan acak lengkap (RAL) dengan 2 faktor untuk melihat pengaruh penambahan rasio mikroalga flokulan terhadap mikroalga non-flokulan dalam meningkatkan % pengendapan. Kombinasi dan rasio antara mikroalga flokulan dan non-flokulan dapat dilihat pada Gambar 1. Rasio paling optimal dijadikan patokan untuk memanen mikroalga dalam skala 10 l.
Gambar 1. Simulasi perlakuan spesies flokulan dan non-flokulan
Pelaksanaan Penelitian Penentuan Spesies Mikroalga Flokulan
Penentuan mikroalga flokulan dilakukan dengan cara melihat % pengendapan masing-masing mikroalga yang diperoleh dari nilai OD750nm tiap
4
jam selama 8 jam (Salim et al. 2011). Nilai OD750nm merupakan nilai digital dari kepadatan optik (optical density) mikroalga hasil perhitungan spektrofotometer pada panjang 750 nm (panjang gelombang hijau). Nilai OD750nm berkisar atara 1 dan 0, nilai 1 menyatakan bahwa mikroalga belum terendapakan sedangkan 0 menunjukkan bahwa mikroalga terendapkan secara sempurna. Penurunan nilai OD750nm dari 1 menuju 0 akan dideteksi oleh spektrofotometer sehingga proses pengendapan diketahui secara pasti. Mikroalga dapat dikategorikan sebagai flokulan apabila kemampuan mengendapnya sangat cepat yaitu dalam waktu 1 jam % pengendapan mikroalga lebih besar dari 50 % (Salim et al. 2011).
Penentuan Waktu Panen Mikroalga
Tetraselmis suecica, Nannochloropsis sp., dan Chlorella sp. memiliki waktu panen yang mungkin berbeda sehingga dibutuhkan penelitian awal untuk menentukan waktu panen optimal untuk masing-masing mikroalga. Bibit mikroalga hasil perbanyakan dimasukkan kedalam botol berukuran 500 ml yang sudah disterilisasi menggunakan laminar. Bibit Tetraselmis suecica, Nannochloropsis sp., dan Chlorella sp diambil masing-masing sebanyak 300 ml dan dibagi rata kedalam 3 botol, tiap botol berisi 100 ml bibit mikroalga. Bibit tersebut kemudian ditambahkan air laut yang telah disterilisasi menggunakan autokalaf sebanyak 200 ml untuk masing-masing botol. Selanjutnya dilakukan penambahan pupuk Walne sebanyak 1/3 ml (7 tetes) menggunakan pipet tetes. Proses kultivasi dilakukan selama 20 hari dengan menghubungkan tiap botol dengan aerator. Selama 20 hari kultivasi dilakukan pengambilan data kepadatan sel mikroalga menggunakan haemocytometer tipe Neubeaur yang diamati di bawah mikroskop Olympus CX21LED dengan perbesaran 10x. Hari saat mikroalga dalam jumlah paling banyak akan menjadi acuan untuk hari pemanenan mikroalga dan sekaligus sebagai acuan untuk menentukan awal kultivasi masing-masing spesies mikroalga agar dapat dipanen pada hari yang sama.
Proses Bio-flokulasi
Proses bio-flokulasi dilakukan untuk mengetahui rasio mikroalga flokulan yang paling optimal untuk mengendapkan mikroalga non-flokulan dan mengetahui mekanisme terjadinya bio-flokulasi sehingga mikroalga non-flokulan dapat terendapkan lebih cepat.
5 Pengamatan proses bio-flokulasi dilakukan dengan menggunakan mikroskop Olympus CX21LED. Foto dan video proses bio-flokulasi diambil mengunakan kamera Optilab Microscope Camera yang dipasang pada mikroskop. Proses pengamatan dilakukan beriringan dengan pengamatan nilai OD750nm . Pengambilan foto dilakukan pada saat t0 (jam ke-0), t4 (jam ke-4) dan t8 (jam ke-8) dan pengambilan video dilakukan sampai campuran mikroalga menggendap. Proses Ekstraksi Lemak Mikroalga
Proses ekstraksi lemak membutuhkan sampel mikroalga kering dalam jumlah yang lebih banyak sehingga dibutuhkan proses bio-flokulasi dalam jumlah besar (10 l). Hasil lemak yang diperoleh kemudian dibandingkan dengan lemak hasil pemanenan menggunakan bahan kimia berupa NaOH. Pasta mikroalga hasil pemanenan menggunakan teknik bio-flokulasi dan pemanenan menggunakan bahan kimia dikeringkan menggunakan oven pada suhu 121°C selama ± 24 jam. Mikroalga kering kemudian dipindahkan ke dalam desikator selama ±15 menit. Setelah didinginkan dalam desikator mikroalga kering ditimbang dengan menggunakan neraca digital.
Lemak mikroalga diektraksi dari berat keringnya. Proses ektraksi lemak mikroalga dilakukan dengan metode soxhlet. Pelarut yang digunakan untuk mengekstrak lemak mikroalga adalah n-hexan. Proses ekstraksi berlangsung selama 6 jam kemudian dilanjutkan dengan proses destilasi untuk memisahkan lemak mikroalga dari pelarut n-hexan. Hasil akhir berupa lemak mikroalga ditimbang, kemudian diukur % kadar lemak dari berat kering masing-masing mikroalga yang diekstrak.
Analisis Data Perhitungan % Pengendapan Mikroalga
Nilai % pengendapan diperoleh dari hasil perhitungan data OD750 (Optical Density) menggunakan persamaan 1 (Salim et al. 2011).
OD750(t0) adalah nilai turbiditas pada awal pencampuran dan OD750(tn) nilai turbiditas pada saat pengukuran waktu ke-n.
Pengolahan Data Kepadatan Sel
Kepadatan sel mikroalga dapat dihitung berdasarkan rumus Improved Neubaeur Haemocytometer.
adalah kepadatan sel mikroalga ke-i (jumlah sel /ml) dan adalah jumlah
6
Perhitungan Kadar Lemak Mikroalga
Kadar lemak mikroalga dihitung dari berat kering mikroalga menggunakan persamaan 3.
Analisis Statistik
Analisis statistik untuk menentukan pengaruh rasio mikroalga flokulan dalam meningkatkan % pengendapan mikroalga non-flokulan digunakan rancangan acak lengkap (RAL) dengan 2 faktor. Pengolahan dilakukan secara terpisah untuk masing-masing kombinasi mikroalga dengan rasio 1:4, 2:4, 3:4, 4:4. Selanjutnya untuk menentukan kombinasi mikroalga terbaik antara Tetracelmis suecica dan Chlorella sp. dan Tetracelmis suecica dan Nannochloropsis sp. dalam proses bio-flokulasi dilakukan uji nilai tengah (uji T) (Mattjik dan Sumertajaya 2006).
HASIL DAN PEMBAHASAN
Spesies Mikroalga Flokulan dan Non-flokulan
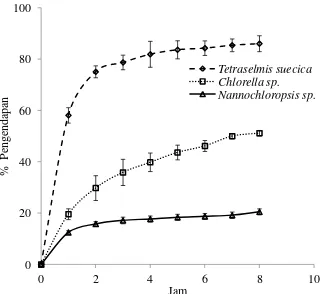
Spesies mikroalga flokulan dan non-flokulan ditentukan dari % pengendapan yang dihitung berdasarkan nilai OD750nm masing-masing mikroalga yang disajikan pada Gambar 2 dan Gambar 3.
Gambar 2. Nilai OD750nm Tetraselmis suecica, Chlorella sp., Nannochloropsis sp. 0
0.15 0.3 0.45 0.6 0.75
0 2 4 6 8 10
OD
750
n
m
Jam
Tetraselmis suecica Chlorella sp.
7
Gambar 3. Nilai % pengendapan Tetraselmis suecica, Chlorella sp. Nannochloropsis sp.
8
Waktu Panen Tetraselmis suecica, Chlorella sp., Nannochloropsis sp. Pengamatan waktu panen Tetraselmis suecica, Chlorella sp., Nannochloropsis sp. dilakukan selama 20 hari mulai dari tanggal 21 Mei - 9 Juni 2013. Data kepadatan masing-masing mikroalga hasil pengamatan tiap hari diolah menggunakan rumus kepadatan sel. Hasil perhitungan kepadatan sel perhari selama 20 hari menunjukkan hari panen terbaik untuk masing-masing mikroalga yang ditunjukkan oleh kepadatan mikroalga terbanyak. Hari tersebut ditetapkan sebagai waktu paling optimal untuk melakukan proses pemanenan mikroalga (Imansetyo dan Kurniastuty 1995). Hasil pengamatan kepadatan masing-masing mikroalga perhari selama 20 hari untuk Tetraselmis suecica, Chlorella sp. dan Nannochloropsis sp. dapat dilihat pada Gambar 4.
Gambar 4. Kepadatan sel Tetraselmis suecica, Chlorella sp., Nannochloropsis sp. Kepadatan sel masing-masing mikroalga tiap hari selama 20 hari mengindikasikan bahwa waktu panen terbaik untuk Tetraselmis suecica terdapat pada hari ke-13. Grafik menunjukkan kenaikan yang sangat tajam pada hari tersebut dengan kepadatan sel 1.98x106±0.49x106 sel/ml. Waktu panen terbaik untuk Chlorella sp. terdapat pada hari ke-12 dengan kepadatan sel 169.17x106±15.93x106 sel/ml. Selanjutnya untuk Nannochloropsis sp. memiliki waktu panen lebih cepat dibanding Tetraselmis suecica dan Chlorella sp. yaitu pada hari ke-11 dengan kepadatan sel 995.42x106±216.89x106 sel/ml.
Menurut penelitian Sen et al. (2005) kepadatan sel tertinggi untuk Tetraselmis suecica terjadi pada hari 11 sampai hari 14 sedangkan hari ke-15 sampai hari selanjutnya mengalami penurunan. Kepadatan sel tertinggi untuk Chlorella sp. terdapat pada hari ke-10 sampai hari ke-12 dan untuk Nannochloropsis sp. kepadatan sel tertinggi terdapat pada hari ke-8 sampai hari
9 ke-12 (Faria et al. 2012). Hasil penelitian yang telah dilakukan diketahui bahwa waktu panen masing-masing mikroalga berada pada rentang hari tersebut.
Waktu panen masing-masing mikroalga yang telah diperoleh dijadikan sebagai dasar dalam melakukan proses kultivasi untuk stok panen menggunakan teknik bio-flokulasi. Hasil penelitian menunjukkan bahwa Tetraselmis suecica merupakan mikroalga yang pertama kali dikultivasi, hari selanjutnya diikuti oleh Chlorella sp. dan yang terakhir dikultivasi adalah Nannochloropsis sp., dengan cara demikian pemanenan mikroalga menggunakan teknik bio-flokulasi dapat dilakukan secara serentak pada hari dan waktu panen yang sama.
Bio-flokulasi Mikroalga
Proses bio-flokulasi dilakukan untuk menentukan rasio paling optimal antara mikroalga flokulan dan mikroalga non-flokulan. Hasil penelitian menunjukkan bahwa rasio 4:4 hasil pengendapan yang lebih cepat dibandingkan 1:4, 2:4 dan 3:4. Pada jam pertama Chlorella sp. terendapkan sebanyak 19.59±2.11% dan Nannochloropsis sp. sebanyak 12.47±0.71% sebelum ditambahkan Tetraselmis suecica. Penambahan Tetraselmis suecica dengan rasio 4:4 (1:1) mampu meningkatkan nilai % pengendapan Chlorella sp. menjadi 33.40±1.17% dan Nannochloropsis sp. menjadi 19.11±0.22% pada jam pertama. Selisih nilai % pengendapan antara sebelum dan sesudah ditambahkan spesies flokulan dengan perbandingan 4:4 pada jam pertama untuk spesies Chlorella sp. adalah sebesar 13.81% dan spesies Nannochloropsis sp. sebesar 6.64%. Hal tersebut menunjukkan Tetraselmis suecica mampu mempercepat proses pengendapan Chlorella sp. dan Nannochloropsis sp. Hasil % pengedapan pada jam pertama untuk sebelum dan setelah dilakukan penambahan spesies flokulan dapat dilihat pada Tabel 1 dan Tabel 2.
Tabel 1. Nilai % pengendapan mikroalga flokulan dan non-flokulan sebelum dilakukan pencampuran pada jam pertama
Mikroalga % Pengendapan Pada Jam Pertama 1. Mikroalga Flokulan
Tetraselmis suecica 50.1±2.30
2. Mikroalga Non-flokulan
Chlorella sp. 19.59±2.11
Nannochloropsis sp. 12.47±0.71
Tabel 2. Nilai % pengendapan mikroalga flokulan dan non-flokulan setelah dilakukan pencampuran pada jam pertama.
dan Chlorella sp. 24.28±4.55 26.83±1.30 27.70±3.98 33.40±1.17 Tetraselmis suecica
dan
10
Salim et al. (2011) menyatakan bahwa penambahan spesies flokulan dengan konsentrasi yang lebih tinggi dalam pemanenan akan meningkatkan % pengendapan. Rasio 4:4 merupakan penambahan spesies flokulan lebih besar dibandingkan dengan rasio yang lain. Hasil uji statistik menggunakan rancangan acak lengkap (RAL) untuk kombinasi Tetraselmis suecica dan Chlorella sp. atau Tetraselmis suecica dan Nannochloropsis sp. (Mattjik dan Sumertajaya 2006) didapatkan nilai p-value < 0.05 (Lampiran 8) yang berarti minimal ada satu rasio dari empat rasio yang digunakan berbeda nyata, sehingga dibutuhkan uji lanjut Tukey untuk menentukan rasio yang berbeda nyata. Hasil uji Tukey diperoleh bahwa semua rasio yang digunakan memberikan pengaruh yang berbeda-beda dalam menggendapkan mikroalga, untuk menentukan rasio mikroalga flokulan dan non-flokulan terbaik maka dilihat dari plot pengaruh utama dari masing-masing rasio (Lampiran 8). Rasio terbaik akan memberikan nilai % pengendapan paling tinggi. Dilihat dari plot pengaruh utama diperoleh 4:4 merupakan rasio yang optimal dibandingkan dengan rasio 1:4, 2:4 dan 3:4. Hal tersebut menunjukkan bahwa penambahan spesies flokulan dalam jumlah yang lebih besar dapat meningkatkan % pengendapan.
Setelah mendapatkan rasio 4:4 sebagai rasio yang optimal selanjutnya dilakukan uji T untuk menentukan kombinasi mikroalga yang optimal dari dua kombinasi yang digunakan. Hasil analisis statistik menggunakan uji T diperoleh kombinasi Teraselmis suecica dan Chlorella sp. merupakan kombinasi yang optimal. Hasil uji T diketahui nilai p-value<0.05 (Lampiran 8) sehingga antara kombinasi Tetraselmis suecica dan Chlorella sp. dan Tetraselmis suecica dan Nannochloropsis sp. berbeda nyata. Hasil nilai rataan Teraselmis suecica dan Chlorella sp. sebesar 48.90 lebih kecil dari rataan Tetraselmis suecica dan Nannochloropsis sp. sebesar 33.50 yang menunjukkan bahwa kombinasi Tetraselmis suecica dan Chlorella sp. lebih cepat mengendap dibandingkan kombinasi Tetraselmis suecica dan Nannochloropsis sp, sehingga kombinasi mikroalga Teraselmis suecica dan Chlorella sp. merupakan kombinasi yang lebih optimal.
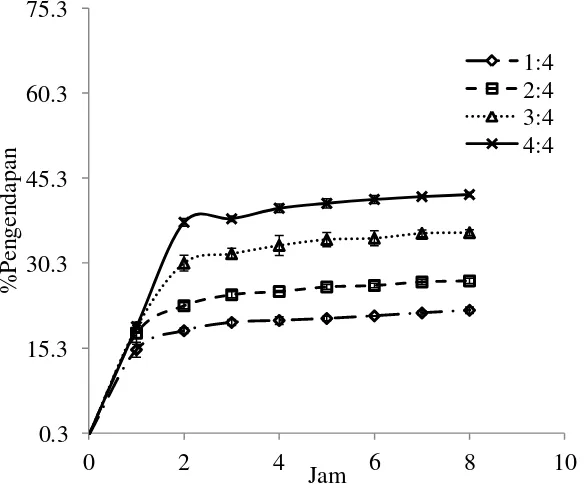
Perbedaan kecepatan % pengendapan antara Chlorella sp. dan Nannochloropsis sp. dipengaruhi oleh ukuran Nannochloropsis sp. lebih kecil dibandingkan Chlorella sp. Chlorella sp. memiliki rentang ukuran diameter sebesar 2.0-10.0 μm dan Nannochloropsis sp. memiliki rentang ukuran diameter sebesar 2.0-4.0 μm (Barsanti dan Gualtieri 2006; Garafalo 2009; Kawaroe et al. 2010). Menurut Pillai (1997) kecepatan pengendapan partikel dipengaruhi oleh ukuran partikel tersebut, semakin besar ukuran suatu partikel maka akan semakin mudah mengendap.
Selain faktor ukuran partikel sel mikroalga, jumlah sel mikroalga yang terlalu banyak juga akan menyebabkan lamanya proses pengendapan. Hasil pengamatan data kepadatan sel menunjukkan jumlah sel Nannochloropsis sp. pada waktu panen 5 kali lebih banyak dibandingkan Chlorella sp., jika dilakukan proses flokulasi menggunakan Tetraselmis suecica maka akan membutuhkan waktu yang lebih lama bagi Tetraselmis suecica untuk membentuk flok dan mengendapkan Nannochloropsis sp. dibandingkan dengan spesies Chlorella sp.
11 Tetraselmis suecica : Nannochloropsis sp. (Gambar 6) dengan rasio 1:4, 2:4, 3:4 dan 4:4 setiap jam selama 8 jam.
Gambar 5. Nilai % pengendapan kombinasi Tetraselmis suecica dan Chlorella sp. dengan rasio1:4, 2:4, 3:4 dan 4:4
Gambar 6. Nilai % pengendapan kombinasi Tetraselmis suecica dan Nannochloropsis sp. dengan rasio 1:4, 2:4, 3:4 dan 4:4
Sathe (2010) menyebutkan bahwa bio-flokulasi merupakan flokulasi spontan dari sel mikroalga yang terjadi akibat adanya sekresi substansi polimer ekstrakseluler (Extracellular Polymeric Substances (EPS)) pada saat mikroalga
12
berada dalam kondisi stres. Kurangnya nutrisi merupakan faktor utama yang menyebabkan sel mikroalga menseksresikan substansi polimer ekstrakseluler (Lee et al. 2009). Substansi polimer ekstrakseluler yang dihasilkan oleh mikroalga akan memicu terbentuknya gumpalan sel, kumpulan sel akan membentuk biomassa yang kemudian terendapkan.
Gambar 7. Mikroalga sebelum terflokulasi dan setelah terflokulasi
Chlorella sp. Nannochloropsis sp.
Tetraselmis suecica
Ditambahkan
Jam ke-0
Jam ke-4
13 Flokulasi yang disebabkan oleh polimer dibagi menjadi dua yaitu patching dan bridging (Salim et al. 2009). Patching merupakan tipe flokulasi yang terjadi apabila polimer mengikat mikroalga sepenuhnya karena ukuran polimer terlalu pendek untuk mengikat mikroalga lain, sehingga polimer terlihat seperti penambalan (patch), sel mikroalga membentuk agregasi (kumpulan) yang terlokalisir. Bridging terjadi apabila polimer memiliki ukuran yang panjang sehingga mikroalga akan terikat disepanjang polimer. Pada kasus bridging polimer menjembatani (bridge) ikatan antar mikroalga sehingga terbentuk flok dalam bentuk jaringan besar.
Hasil pengamatan bio-flokulasi untuk spesies Tetraselmis suecica dan Chlorella sp. atau Tetraselmis suecica dan Nannochloropsis sp. di bawah mikroskop dengan perbesaran 10x dapat dilihat pada Gambar 7. Gambar tersebut memperlihatkan bahwa tipe flok yang terbentuk merupakan tipe patching. Terlihat bahwa sel Chlorella sp. dan Nannochloropsis sp. terikat dalam bentuk lokal pada sel Tetraselmis suecica bukan membentuk jaringan besar yang terhubung satu sama lain (Jam ke-8). Pada awal pencampuran spesies flokulan dan non-flokulan terlihat sel mikroalga flokulan dan non-flokulan masih terpisah dan belum terikat sama sekali (Jam ke-0 ). Secara bertahap proses pengikatan mulai berlangsung karena sel mulai mengalami stres akibat nutrisi semakin berkurang dan memicu mikroalga untuk mengsekresikan polimer ekstrakseluler. Polimer ekstrakseluler yang dihasilkan akan menciptakan ikatan antar sel mikroalga yang berpusat pada sel Tetraselmis suecica. Ikatan antara sel mikroalga flokulan dan non-flokulan pada jam ke-4 sudah mulai terlihat dengan terbentuknya ikatan antara spesies mikroalga. Ikatan mulai terlihat lebih banyak pada jam ke-8, terlihat jelas secara mikroskopis spesies non-flokulan terikat dan membentuk kumpulan biomassa yang lebih besar dengan spesies flokulan sehingga menyebabkan kumpulan sel yang kemudian mengendap.
Lemak Mikroalga Hasil Pemanenan dengan Teknik Bioflokuasi
Bioflukulasi skala 10 l dilakukan untuk mengukur kadar lemak dari mikroalga hasil panen dengan teknik bioflokulasi. Pemanenan dilakukan menggunakan rasio 4:4 antara mikroalga flokulan dan non-flokulan. Sebagai pembanding maka dilakukan pemanenan mikroalga menggunakan flokulan kimia berupa NaOH Hasil ektraksi lemak menggunakan metode soxhlet didapatkan kadar lemak seperti yang terlihat pada Tabel 3.
Tabel 3. Perbandingan kadar lemak hasil panen bio-flokulasi dan NaOH
Mikroalga Pemanen Kadar Lemak (%)
Nannochloropsis sp. NaOH 10.29 ± 3.16
Nannochloropsis sp. Tetraselmis suecica 12.90 ± 2.62
Chlorella sp. NaOH 8.99 ± 1.71
Chlorella sp. Tetraselmis suecica 11.71 ± 0.81
14
mikroalga yang dipanen menggunakan NaOH diperoleh sebesar 10.29±3.16% untuk spesies Nannochloropsis sp. dan 8.99±1.57% untuk spesies Chlorella sp. Chisti (2007) menyatakan bahwa kadar lemak untuk spesies Nannochloropsis sp. berkisar dari 31-68% dan Chlorella sp. berkisar dari 28-32%. Hasil ekstraksi kadar lemak yang diperoleh untuk Nannochloropsis sp. dan Chlorella sp. memiliki nilai yang lebih kecil jika dibandingakan dengan hasil literatur. Hal tersebut kemungkinan disebabkan metode ekstrasi yang berbeda. Metode ekstraksi yang digunakan dalam penelitian ini menggunakan metode soxhlet sehingga tidak semua lemak yang terdapat pada mikroalga dapat terekstraksi dengan baik. Meskipun demikian kadar lemak dari spesies Nannochloropsis sp. lebih tinggi dibandingkan spesies Chlorella sp. baik yang dipanen menggunakan teknik bio-flokulasi ataupun yang dipanen dengan NaOH.
Ekstraksi kadar lemak mikroalga hasil pemanenan dengan bio-flokulasi menghasilkan kadar lemak yang lebih tinggi jika dibandingkan dengan menggunakan flokulasi kimia berupa NaOH. Perbedaaan tersebut terjadi akibat senyawa kimia yang digunakan tidak mengandung lemak, berbeda dengan penggunaan spesies Tetraselmis suecica yang dijadikan sebagai agen flokulan memiliki kadar lemak sebesar 15-23% (Chisti 2007) sehingga pada saat proses ekstraksi berlangsung lemak mikroalga dari spesies Tetraselmis suecica akan ikut terekstrak. Hal tersebut yang menyebabkan kadar lemak hasil pemanenan menggunakan Tetraselmis suecica lebih tinggi jika dibandingkan hasil ekstraksi lemak mikroalga hasil pemanenan dengan menggunakan flokulan kimia berupa NaOH. Pemamfaatan mikroalga sebagai agen flokulan memberikan keuntungan tersendiri karena lemak mikroalga pemanen dapat diekstraksi
Bio-flokulasi untuk Pemanenan Mikroalga
Pemanenan mikroalga dengan teknik bio-flokulasi menggunakan agen flokulasi berupa mikroalga merupakan teknik pemanenan baru yang masih dalam tahap pengembangan. Teknik bio-flokulasi menggunakan mikroalga memiliki banyak keuntungan salah satunya menjanjikan sebagai alternatif pemanenan mikroalga secara ramah lingkungan. Hal itu dikarenakan pemanenan yang tidak menggunakan flokulan kimia yang selama ini digunakan. Penggunaan bahan kimia dapat mencemari air yang digunakan sebagai media kultur mikroalga. Air yang tersisa setelah pemanenan apabila dibuang langsung kelingkungan harus diproses terlebih dahulu agar tidak terjadi pencemaran. Proses tersebut akan membutuhkan biaya dan energi yang tidak sedikit. Bio-flokulasi menggunakan agen flokulan berupa mikroalga menjadi alternatif yang menjanjikan karena air sisa pemanenan dapat digunakan dan dibuang tanpa harus ada pelakukan khusus yang dapat menambah biaya dan energi dalam rantai pengolahan mikroalga menjadi bio bahan bakar.
15 Tabel 4. Perbandingan % pengendapan sebelum dan setelah penambahan spesies flokulan dalam waktu 8 jam
Chlorella sp. 51.14±1.07 67.34±0.67
Nannochloropsis sp. 20.52±1.17 42.43±0.40
*Rasio 4:4
Hasil ini menunjukkan bahwa pemanenan mikroalga menggunakan teknik bio-flokulasi dapat dijadikan sebagai salah satu alternatif pemanenan mikroalga yang ramah lingkungan sebagai pengganti flokulan kimia. Selain ramah lingkungan pemanenan dengan teknik ini juga dapat meningkatkan kadar lemak akibat penambahan spesies mikroalga flokulan walaupun penambahannya masih belum signifikan (Tabel 4). Bio-flokulasi selama 8 jam ternyata belum mampu mengendapkan mikroalga sebesar 100%. Hal tersebut terjadi karena Tetraselmis suecica memiliki kepadatan sel yang jauh lebih rendah dibandingkan Chlorella sp. dan Nannochloropsis sp., sehingga pada saat pencampuran Tetraselmis suecica sebagai pusat berkumpulan Chlorella sp. dan Nannochloropsis sp tidak mampu untuk mengikat Chlorella sp. dan Nannochloropsis sp. secara keseluruhan karena jumlah sel Chlorella sp. dan Nannochloropsis sp yang begitu banyak. Selain itu penggunaan 1 spesies flokulan dalam proses bio-flokulasi juga menyebabkan % pengendapan tidak dapat dilakukan dengan lebih optimal. Penyaringan spesies Tetraselmis suecica akan membantu meningkatkan % pengendapan karena jumlah sel Tetraselmis suecica hasil saringan akan lebih banyak dibandingkan langsung dicampurkan dalam rasio (v/v) kemudian dilakukan pencampuran dalam rasio (m/v). Selain itu juga dapat dilakukan penambahan lebih dari satu spesies flokulan akan membantu proses pengendapan lebih cepat karena penambahan spesies flokulan akan menambah pusat-pusat penempelan sel non-flokulan sehingga pembentukan agregat sel lebih mudah terjadi.
SIMPULAN DAN SARAN
Simpulan
16
mikroalga dapat dijadikan sebagai salah satu alternatif teknik pemanenan mikroalga.
Saran
Pemanenan mikroalga menggunakan teknik bio-flokulasi berpotensi dijadikan sebagai salah satu alternatif pemanenan mikroalga. Perlu dilakukan penelitian lebih lanjut untuk melakukan pemanenan dengan rasio (m/v) bukan dalam bentuk (v/v) dengan menyaring Tetraselmis suecica sebagai agen pemanen sehingga agar % pengendapan meningkat. Selain itu juga dapat dilakukan penambahan lebih dari satu spesies flokulan akan membantu proses pengendapan lebih cepat karena penambahan spesies flokulan akan menambah pusat-pusat penempelan sel non-flokulan sehingga pembentukan agregat sel lebih mudah terjadi. Pengamatan kepadatan sel selain menggunakan haemocytometer disarankan menggunakan spektrofotometer agar tingkat kesalahan perhitungan kepadatan sel dapat diminimalisir.
DAFTAR PUSTAKA
Barsanti L, Gualtieri P. 2006. Algae. Anatomy, Biochemistry, and Biotechnology. Taylor & Francis, Boca Raton.
Benemann JR, Oswald WJ. 1996. System and Economic Analysis of Microalgae Ponds for Conversion of CO2 to Biomass. PETC Final Report. Departement
of Energy Pittsburgh Energy Technology Center.188.
Chang YI, Shih LH, ChenSW.2005. Effects of Glucose And Mannose On The Flocculation Behavior of Saccharomyces cerevisiae at Different Life Stages.
J Colloids and Surfaces Biointerfaces. 44:6–
14.doi:10.1016/j.colsurfb.2005.05.008
Chen CY, Yeh KL, Aisyah R, Jong D, Chang JS. 2011. Cultivation, Photobioreactor Design and Harvesting of Microalgae for Biodiesel Production: A Critical Review. J Bioresource Technology. 102:71–81. doi:10.1016/j.biortech.2010.06.159.
Chisti Y. 2007. Biodiesel From Microalgae. J Biotechnology Advances. 25:294-306. doi: 10.1016/j.biotechadv.2007.02.001.
Choi CW, Yoo SA, Oh IH, Park SH. 1998. Characterization of an Extracellular Flocculating Substance Produced by A Planktonic Cyanobacterium, Anabaena sp. J Biotechnology. 20(7):643–646.
Faria GR, Paes C, Castro D, Tinoco N, Barbarino E, Laourenco SO. 2012. Effects of the Availability of CO2 on Growth, Nutrient Uptake, and Chemical Composition of the Marine Microalgae Chlorella sp. and Nannochloropsis oculata, Two Potentially Useful Strains for Biofuel Production. International Research J of Biotechnology. 3(5):65-67.
17 Garafalo R. 2009. Algae and Aquatic Biomass for a Sustinnable Production of 2nd
Generation Biofuel. Aqua Fuel.258.
Grima EM, Belarbi EH, Fernandez FGA, Medina AR, Chisti Y. 2003. Recovery of Microalgal Biomass and Metabolites: Process Options and Economics. Biotechnology Advances. 20:491–515.PII: S0 7 3 4 - 9 7 5 0 ( 0 2 ) 0 0050-2. Gouveia L. 2011. Microalgae as a Feedstock for Biofuels. New York: Springer
Heidelberg Dordrecht London.68.
Imansetyo A, Kurniaty. 1995. Teknik Kultur Phytoplankton dan Zooplankton. Yogyakarta (ID): Penerbit Kanisius.
Kawaroe M, Prartono T, Sunuddin A, Sari DW, Agustine D. 2010. Mikroalga Potensi dan Pemamfaatan untuk Produksi Bio Bahan Bakar. Bogor (ID): IPB Press.150.
Lee AK, Lewis DM, Ashman PJ. 2009. Microbial Flocculation, A Potentially
Low-Cost Harvesting Technique For Marine Microalgae for The Production
of Biodiesel. J Apply Phycol. 21:559–567.doi 10.1007/s10811-008-9391-8
Lee SJ, Kim SB, Kim JE, Kwon GS, Yoon BD, Oh HM. 1998. Effects of Harvesting Method and Growth Stage on The Flocculation of The Green Alga Botryococcus braunii. Letters in Applied Microbiology. 27:14–18. Li XY, Yang SF. 2007. Influence of Loosely Bound Extracellular Polymeric
Substances (EPS) on The Flocculation, Sedimentation And Dewaterability of Activated Sludge. Water Reserch. 41:1022-10340. doi:10.1016/j.watres.2006.06.037.
Li Y, Wan C. 2011. Algae for Biofuel. Departement of Food, Agricultural and Biological Engineering The Ohio State University.3.
Mattjik AA, Sumertajaya. 2006. Perancangan Percobaan Dengan Aplikasi SAS dan MINITAB. Bogor (ID): IPB Press.
Mohn FH. 1988. Harvesting of Microalga Biomass. Mikroalga Biotechnology. Cambridge University Press.477.
Papazi A, Makridis P, Divanach P. 2010. Harvesting Chlorella minutissima Using Cell Coagulants. J Appl Phycol. 22:349–355.
Pillai J.1997. Flocculants and Coagulants: The Keys to Water and Waste Management in Aggregate Production: Nalco Company.
Salehizaden H, Vossoughi M, Alemzadeh I. 2000. Some Investigations on Bioflocculant Producing Bacteria. J Biochemical Engineering. 5:39-44. Salim S, Bosman R, Vermue MH, Wijffels RH. 2011. Harvesting of microalgae
by bio-flocculation. J Appl Phycol. 23:849-855.doi: 10.1007/s10811-010-9591-x.
Sathe S. 2010. Culturing and Harvesting Microalgae for the Large-scale Production of Biodiesel. Microbial Engineerring Research Group. 97.
Schenk PM, Hall SRT, Stephens E, Marx UC, Mussgnug JH, Posten C, Kruse O, Hankamer B. 2008. Second Generation Biofuels: High-Efficiency Microalgae for Biodiesel Production. Bioenergy. 1(1):20–43.doi 10.1007/s12155-008-9008-8.
18
Sim TS, Goh A, Becker EW. 1988. Comparison of Centrifugation, Dissolved Air Flotation and Filtration Technique for Harvesting Sewage-grown Algae. Biomass 16:51-62.doi:0144-4565/88/$03.50
Shelef G, Sukenik A, Green M. 1984. Microalgae Harvesting and Processing: A Literature Review. Halfa, Israel: Technion Research and Development Foundation Ltd. 66.
Thompson RW, D’Elia L, Keyser A, Young C. 2010. Algae Biodiesel. Faculty Worcester Polytechnic Institute. An Interactive Qualifying Project Report. 47.
19 Lampiran 1 Perbanyakan bibit mikroalga untuk stok penelitian
Bibit mikroalga Tetraselmis suecica, Nannochloropsis sp., dan Chlorella sp. diperoleh dari Laboratorium Pusat Penelitian Surfaktan dan Bioenergi, LPPM, Kampus IPB Baranangsiang, Kota Bogor. Bibit mikroalga awal yang disediakan sebanyak 500 ml untuk masing-masing spesies mikroalga. Jumlah bibit tersebut tidak mencukupi kebutuhan penelitian, sehingga dibutuhkan waktu untuk melakukan proses scale up (perbanyakan bibit). Proses perbanyakan bibit dilakukan dengan cara mengkultivasi mikroalga dari 500 ml menjadi 1.5 L, dari 1.5 L menjadi 4.5 L untuk masing-masing spesies mikroalga. Komposisi bibit mikroalga dan air laut pada saat kultivasi skala laboratorium adalah 1/3 bibit dan 2/3 air laut yang sudah distrerilisasi menggunakan autoklaf. Sedangkan untuk skala out door komposisi bibit mikroalga dan air laut pada saat kultivasi adalah 1/10 bibit mikroalga dan 9/10 air laut steril (Kawaroe et al. 2009). Kultivasi skala laboratorium menggunakan pupuk Walne sebagai sumber nutrisi bagi mikroalga dengan komposisi 1 ml Walne untuk 1 L kultivasi mikroalga. Sedangkan kultivasi skala outdoor menggunakan pupuk TSP, ZA, Urea dengan komposisi berturut-turut 15 ppm, 30 ppm, 30 ppm (Imansetyo dan Kuniastuty 1995). Selanjutnya bibit sebanyak 4.5 L dilakukan perbanyakan bibit hingga 45 L untuk stok bio-flokulasi skala besar yaitu sebesar 10 L
Lampiran 2 Data pertumbuhan mikroalga
Hari
Kepadatan sel 25 kotak ( x 106 Jumlah sel/ml )
Tetraselmis suecica Chlorella sp. Nannochloropsis sp.
20
Hari
Jumlah rata-rata sel 25 kotak ( x 106 sel/ml )
Tetraselmis suecica Chlorella sp. Nannochloropsis sp. Jumlah
Lampiran 3 Data OD750nm masing-masing mikroalga hasil spektrofotometer
21
22
24
Lampiran 6 Persentase pengendapan berdasarkan kombinasi mikroalga
25
26
a: Penambahan NaOH sebanyak 150 ppm, b: Perbandingan 4:4
Lampiran 8 Hasil Analisis Statistik
a. Tetraselmis suecica dan Chlorella sp.
Hasil analisis sidik ragam (ANOVA) dengan model faktorial RAL 2 faktor Keterangan:
Kombinasi alga 1 : T1C4 ( Tetraselmis suecica (1) dan Chlorella sp.(4) ) Kombinasi alga 2 : T2C4 ( Tetraselmis suecica (2) dan Chlorella sp.(4) ) Kombinasi alga 3 : T3C4 ( Tetraselmis suecica (3) dan Chlorella sp.(4) ) Kombinasi alga 4 : T4C4 ( Tetraselmis suecica (4) dan Chlorella sp.(4) ) Faktor Tipe Bayak Taraf Taraf
waktu Tetap 9 0; 1; 2; 3; 4; 5; 6; 7; 8 rasio Tetap 4 1; 2; 3; 4
Analisis sidik ragam menggunakan jumlah kuadrat terkoreksi untuk pengujian Sumber Derajat Jumlah Jumlah Kuadrat Kuadrat Tengah F hit Nilai
Uji Tukey Semua perbandingan pasangan antar taraf rasio = 1 dibandingkan dengan:
Selisih Nilai Standar T hit Nilai Peluang rasio Tengah Error
2 1.307 0.4730 2.764 0.0357 3 2.948 0.4730 6.232 0.0000 4 3.993 0.4730 8.440 0.0000 rasio = 2 dibandingkan dengan:
27 Selisih Nilai Standar T hit Nilai Peluang
rasio Tengah Error
3 1.641 0.4730 3.469 0.0048 4 2.685 0.4730 5.677 0.0000 rasio = 3 dibandingkan dengan:
Selisih Nilai Standar T hit Nilai Peluang rasio Tengah Error
4 1.044 0.4730 2.208 0.1308
b. Tetraselmis suecica dan Nannochloropsis sp.
Hasil analisis (ANOVA) dengan model faktorial RAL 2 faktor Keterangan:
Kombinasi alga 1 : T1N4 ( Tetraselmis suecica (1) dan Nannochloropsis sp.(4) ) Kombinasi alga 2 : T2N4 ( Tetraselmis suecica (2) dan Nannochloropsis sp.(4) ) Kombinasi alga 3 : T3N4 ( Tetraselmis suecica (3) dan Nannochloropsis sp.(4) ) Kombinasi alga 4 : T4N4 ( Tetraselmis suecica (4) dan Nannochloropsis sp.(4) ) Faktor Tipe Bayak Taraf Taraf
waktu tetap 9 0; 1; 2; 3; 4; 5; 6; 7; 8 rasio tetap 4 1; 2; 3; 4
28
Uji Tukey Semua perbandingan pasangan antar taraf rasio = 1 dibandingkan dengan:
Selisih Nilai Standar T hit Nilai Peluang rasio Tengah Error
2 4.330 0.2125 20.38 0.000 3 10.733 0.2125 50.50 0.000 4 15.917 0.2125 74.90 0.000 rasio = 2 dibandingkan dengan:
Selisih Nilai Standar T hit Nilai Peluang rasio Tengah Error
3 6.403 0.21 30.13 0.000 4 11.587 0.21 54.52 0.000 rasio = 3 dibandingkan dengan:
Selisih Nilai Standar T hit Nilai Peluang rasio Tengah Error
4 5.184 0.21 24.39 0.000
Uji T antara kombinasi T4C4 ( Tetraselmis suecica (4) dan Chlorella sp.(4)) dan T4N4 (Tetraselmis suecica (4) dan Nannochloropsis sp.(4))
Dua-contoh T untuk T4C4 vs T4N4
Jumlah Data Rata-rata Standar Deviasi Starandar Error Rata-rata T4C4 27 48.90 20.10 3.90
T4N4 27 33.50 13.90 2.70 Selisih = mu (T4C4) - mu (T4N4)
Estimasi Selisih: 15.36
95% Selang Kepercayaan: (5.88; 24.84) rasio
4 3
2 1
35
30
25
20
Plot Pengaruh Utama
29 Uji T dari selisih = 0 (vs tidak =): T hit = 3.26 Nilai Peluang = 0,002 Derajat Bebas = 46
Lampiran 9 Dokumentasi penelitian
1. Penyaringan air laut 2. Sterilisasi air laut menggunakan autoklaf
3. Sterilisasi alat penelitian di ruang laminar
4. Kultivasi mikroalga
30
7. Sampling mikroalga untuk pengukuran kepadatan
8. Perhitungan kepadatan mikroalga
9. Pemanenan mikroalga untuk stok bio-flokulasi skala 2 ml
10. Penentuan spesies flokulan dan non-flokulan
31
13. Pengamatan proses bio-flokulasi menggunakan mikroskop dan OptiLab
14. Bio-flokulasi dalam medium bervolume 10 l
15. Hasil panen mikroalga
menggunakan teknik bio-flokulasi
16. Pemasukan alga kering ke selongsong untuk proses ekstraksi lemak
17. Ekstraksi lemak mikroalga dengan metode soxhlet
32
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Agam, Sumatera Barat pada tanggal 5 Mei 1990 dari ayah Yakur dan ibu Nurmis. Penulis merupakan anak kedelapan dari delapan bersaudara. Tahun 2009 penulis menyelesaikan pendidikan di SMAN 1 Baso, Kecamatan Baso, Kabupaten Agam, Sumatera Barat. Tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah asisten Biologi Laut pada tahun ajaran 2011/2012 dan 2012/2013, asisten Biologi Tumbuhan Laut 2013/2014 dan asisten Ekologi Laut Tropis 2013/2014. Penulis juga pernah menjadi kontingen IPB untuk kategori PKM-GT pada PIMNAS ke-25 di Universitas Muhammadiyah Yogyakarta tahun 2012 dan tahun berikutnya menjadi anggota kontingen IPB peraih medali perak kategori PKM-P pada PIMNAS ke-26 di Universitas Mataram tahun 2013.