STUDI PEMBERIAN SINBIOTIK DENGAN DOSIS
PROBIOTIK BERBEDA UNTUK PENCEGAHAN PENYAKIT
VIBRIOSIS PADA IKAN KERAPU BEBEK
(
Cromileptes altivelis
)
DWI AGUNG SAPUTRA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa Tesis berjudul Studi Pemberian Sinbiotik Dengan Dosis Probiotik Berbeda Untuk Pencegahan Penyakit Vibriosis Pada Ikan Kerapu Bebek Cromileptes altivelis dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, 12 Juni 2014
RINGKASAN
DWI AGUNG SAPUTRA. Studi pemberian sinbiotik dengan dosis probiotik yang
berbeda untuk pencegahan penyakit vibriosis pada ikan kerapu bebek Cromileptes
altivelis. Dibimbing oleh SUKENDA dan WIDANARNI.
Penyakit Vibriosis yang disebabkan oleh bakteri Vibrio alginolyticus yang merupakan salah satu masalah pada budidaya ikan kerapu bebek. Untuk mereduksi serangan penyakit tersebut maka dilakukan penambahan sinbiotik pada pakan yang bertujuan untuk menstimulasi sistem imun ikan kerapu bebek guna menekan laju pertumbuhan bakteri V. alginolyticus penyebab vibriosis.
Penelitian ini menggunakan rancangan acak lengkap terdiri dari lima perlakuan yaitu kontrol negatif, kontrol positif, (Probiotik 104 cfu/ml 1% + Prebiotik 2 %) sinbiotik P1, (Probiotik 106 cfu/ml 1% + Prebiotik 2 %) sinbiotik P2, dan (Probiotik 108 cfu/ml + Prebiotik 2 %) sinbiotik P3. Probiotik yang digunakan jenis Bacillus sp. (NP5), sedangkan sumber prebiotik berasal dari ubi jalar (Ipomomea batatas L.). Parameter yang diamati adalah berupa penghitungan kelimpahan bakteri usus, peforma pertumbuhan, survival rate, parameter sistem imun. Data dianalisa secara statistik dengan one-way analysis of variance
(ANOVA) menggunakan SPSS 16 pada selang kepercayan 95% (P<0,05). Hasil
yang diperoleh pada perhitungan Total Bacterial Count (TBC), pada perlakuan sinbiotik lebih tinggi dibandingkan kontrol, sedangkan hasil perhitungan bakteri NP5R diketahui bahwa perlakuan sinbiotik dosis P3 menunjukan nilai tertinggi
yaitu sebesar 6,62x103 CFU/g. Sedangkan pada perlakuan perlakuan dosis P1 dan
P2 adalah 7,69x101 CFU/g dan 9,34x102 CFU/g. Sementara itu pada kontrol tidak
ditemukan bakteri NP5R. Perlakuan sinbiotik dengan dosis yang berbeda
meningkatkan laju pertumbuhan harian dan nilai optimal pada rasio konversi pakan (FCR) (P<0,05) bila dibandingkan dengan kontrol (P<0,05). Dari hasil yang diperoleh dari pengamatan jumlah eritrosit dan kadar Hb pada perlakuan sinbiotik setelah 30 hari perlakuan sinbiotik berbeda nyata terhadap kontrol. Setelah diinfeksi kadar eritrosit, Hematokrit, dan Hemoglobin mengalami penurunan dari semua perlakuan. Kemudian jumlah leukosit, Respiratory burst, dan Aktifitas fagositik mengalami peningkatan.
Hasil pengamatan Differential Leukosit (DL) menunjukan bahwa jumlah
limfosit mengalami kenaikan pasca infeksi. Perlakuan sinbiotik dengan dosis probiotik yang berbeda menunjukan bahwa jumlah limfosit berbeda nyata bila dibandingkan dengan kontrol K (+) (P<0,05). Hasil pengamatan monosit, neutrofil, dan trombosit menunjukan terjadinya kenaikan setelah infeksi pada tiap perlakuan sinbiotik, akan tetapi tidak berbeda nyata bila dibandingkan dengan kontrol K (+) (P<0,05). Nilai rasio konversi pakan dan laju pertumbuhan harian perlakuan sinbiotik P2, dan P3 menunjukan perbedaan yang nyata bila dibandingkan dengan kontrol. Respon imun pada parameter total eritrosit, hemoglobin, hematokrit, total leukosit, serta differensial leukosit, menunjukan bahwa perlakuan sinbiotik P2 lebih baik bila dibandingkan perlakuan sinbiotik lainnya maupun kontrol.
SUMMARY
DWI AGUNG SAPUTRA. Study of sinbiotic administration with different probiotic doses to prevent vibriosis diseases in humpback seabass fish
(Cromileptes altivelis). Supervised by SUKENDA and WIDANARNI.
The vibriosis diseases is caused by Vibrio alginolyticus bacteria and this is one of problem in humpback seabass cultivation. To reduce the that disease, sinbiotic administration is conducted to the fish feed with an objective to stimulate
the humpback seabass fish immune system to oppress the growth of V.
Alginolyticus bacterial growth that causes vibriosis.
The research used completely randomized design containing of five treatments; negative control, positive control, (Probiotic 104 cfu/ml 1% + Prebiotic 2 %) sinbiotic P1, (Probiotic 106 cfu/ml 1% + Prebiotic 2%) sinbiotic P2, and (Probiotic 108 cfu/ml 1% + Prebiotic 2%) sinbiotic P3. The prebiotic type
was Bacillus sp. (NP5), and the prebiotic source was sweet cassava (Ipomomea
batatas L.). The observed parameter was the estimination of intestinal bacterial
abudance, growth peformance, survival rate, and immune system parameter. Data
were analyzed statisticallyby using one-way analysis of variance (ANOVA) with
SPSS 16 software with trust interval of 95 % (P<0,05). Total Bacterial Count (TBC) showed higher result in the sinbiotic treatment group compared with control group. The NP5R bacterial count estimation showed the highest value of sinbiotic treatment dose P3 at 6,62 x 103 cfu/g. The NP5R bacterial count estimations in sinbiotic treatment dose P1 and P2 were 7,69 x101 cfu/g and 9,34 x 102 cfu/g respectively. In the control the NP5R bacteria was not found. The sinbiotic treatment with different dose increase daily growth rate and optimal value of feed conversion ratio (P<0,05) compared with control (P<0,05). The erythrocyte amount and Hb level observations results on sinbiotic treatment after 30 days showed significant difference between the sinbiotic treatment group and control group. After being infected, the erythrocyte, Hematokrit (He), Hemoglobin (Hb) levels decreased in all treatment groups. The amount of leucocyte, RB, and AF increased.
The Differential Leucocyte observation results showed that lymphocyte amount increased after infection. Sinbiotic treatment with different prebiotic doses showed significantly different lymphocyte amount compared with control K (+) (P<0,05). The monocyte, neutrophil, and thrombocyte amounts increased after infection in each sinbiotic treatment, but they were signficantly in difference compared with control K (+). (P<0,05). Feed convertion ratio and daily growth rate values on treatment sinbiotic P2, and P3 showed significant differences when compared with controls. Immune response to the parameters total erythrocytes, hemoglobin, hematocrit, total leukocyte and differential leukocytes, showed that treatment sinbiotic P2 better than other sinbiotic treatments and control.
© Hak Cipta milik IPB, tahun 2014
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
STUDI PEMBERIAN SINBIOTIK DENGAN DOSIS
PROBIOTIK BERBEDA UNTUK PENCEGAHAN PENYAKIT
VIBRIOSIS PADA IKAN KERAPU BEBEK
(
Cromileptes altivelis
)
DWI AGUNG SAPUTRA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Studi Pemberian Sinbiotik dengan Dosis Probiotik Berbeda
O untuk Pencegahan Penyakit Vibriosis pada Ikan Kerapu
O Bebeko(Cromileptesoaltivelis)
Nama :uk DwimAgungjSaputra Dwi Agung Saputra
NIM : C151110021
Disetujui oleh
Komisi Pembimbing
Dr Ir Sukenda, MSc Dr Ir Widanarni, MSi
Ketua Anggota
Diketahui oleh
Ketua Program Studi DekanoSekolahoPascasarjana
Ilmu Akuakultur
Dr Ir Widanarni, M.Sc Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penelitian dan penulisan tesis yang berjudul “Studi Pemberian Sinbiotik dengan Dosis Probiotik yang berbeda untuk Pencegahan Penyakit Vibriosis pada Ikan Kerapu Bebek (Cromileptes altivelis)” berhasil diselesaikan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada:
1. Bapak Dr Ir Sukenda, MSc dan Ibu Dr Ir Widanarni MSi Selaku tim komisi pembimbing atas arahan, bimbingan dan masukan-masukannya sejak penyusunan rencana penelitian sampai penyusunan tesis ini.
2. Bapak Dr Dedi Jusadi MSc Selaku wakil program studi Ilmu Akuakultur.
3. Ayah dan Ibu tercinta, adikku Yoga, Octa, Gustalia, Septi yanti atas doa’, semangat serta dukungan yang tak pernah surut selama ini.
4. Bapak Ranta selaku teknisi di Lab Kesehatan ikan Budidaya perairan IPB
serta Dewi, Adni, Fariq atas bantuan serta masukannya selama penelitian.
5. Rekan-rekan yang telah membantu selama penelitian berlangsung : Putra,
Yudha, Epro, Firsty, dll.
6. Semua rekan-rekan mahasiswa Program Mayor Ilmu Akuakultur angkatan
2011 atas kebersamaan dan kerjasamanya yang baik serta bantuannya dalam perkuliahan, penelitian dan penyelesaian karya ilmiah ini.
Bogor, 24 Maret 2014
DAFTAR GAMBAR
1. Mekanisme kerja probiotik di dalam usus (Delgado 2011) 4
2. Laju Pertumbuhan harian kerapu bebek (Cromileptes altivelis) pada perlakuanosinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05) 12
3. FCR pada kerapu bebek (Cromiletes altivelis) pada perlakuan sinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05) 13
4. Sintasan kerapu bebek (Cromileptes altivelis) pada perlakuan sinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05) 14
5. Total Eritrosit Kerapu bebek (Cromileptis altivelis) pada perlakuan sinbiotikodengan dosis probiotik berbeda (Duncan; P<0,05) 14
6. Total Leukosit Kerapu bebek (Cromileptis altivelis) pada perlakuan sinbiotikodengan dosis probiotik berbeda (Duncan; P<0,05) 15
7. Kadar Hemoglobin kerapu bebek (Cromileptis altivelis) pada perlakuan sinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05) 16
8. Kadar Hematokrit kerapu bebek (Cromileptis altivelis) pada perlakuan sinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05) 16
9. Nilai Respiratory Burst kerapu bebek (Cromileptis altivelis) pada perlakuanosinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05) 17
10. Persentase Aktifitas fagositik kerapu bebek (Cromileptis altivelis) pada perlakuan sinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05) 17
11. Persentase Limfosit kerapu bebek (Cromileptis altivelis) pada perlakuan sinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05) 18
12. Persentase Monoait kerapu bebek (Cromileptis altivelis) pada perlakuan sinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05) 18
13. Persentase Neutrofil kerapu bebek (Cromileptis altivelis) pada perlakuan sinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05) 19
14. Persentase Trombosit kerapu bebek (Cromileptis altivelis) pada perlakuan sinbiotik dengan dosis probitik berbeda (Duncan; P<0,05) 20
5. Hasil uji Duncan terhadap total eritrosit (x106 sel/ml) ikan uji pada perlakuanodosis probiotik ysng berbeda 32
6. Hasil uji Duncan terhadap total leukosit (105 sel/ml) ikan uji pada perlakuanodosis yang berbeda 32
7. Hasil uji Duncan terhadap persentase nilai hematokrit (%) ikan uji pada perlakuan dosis probiotik yang berbeda 32
8. Hasil uji Duncan terhadap persentase nilai hematokrit (%) ikan uji pada perlakuan dosis probiotik yang berbeda 32
10. Hasil uji Duncan terhadap nilai persentase aktifitas fogositik (%) ikan uji
pada perlakuan dosis probiotik yang berbeda 33
11. Hasil uji Duncan terhadap persentase limfosit (%) ikan uji pada
perlakuanodosis probiotik yang berbeda 33
12. Hasil uji Duncan terhadap persentase monosit (%) ikan uji pada
perlakuanodosis probiotik yang berbeda 33
13. Hasil uji Duncan terhadap persentase neutrofil (%) ikan uji pada
perlakuanodosis probiotik yang berbeda 34
14. Hasil uji Duncan terhadap persentase trombosit (%) ikan uji pada
perlakuanodosis probiotik yang berbeda 34
15. Kualitas air selama penelitian 34
1. PENDAHULUAN
Latar Belakang
Ikan kerapu bebek (Cromileptes altivelis) merupakan salah satu jenis ikan laut ekonomis penting baik dipasar lokal maupun internasional. Berdasarkan data SIDATIK KKP (2014), produksi selama periode tahun 2008-2011 mengalami peningkatan sebesar 52,68% yaitu dari 4.273 ton pada tahun 2008 menjadi 8.112 ton pada tahun 2011. Pemerintah mengharapkan produksi kerapu pada tahun 2014 mencapai 20.000 ton (KKP 2013).
Salah satu permasalahan dalam budidaya ikan kerapu bebek adalah serangan penyakit vibriosis. Penyebab penyakit vibriosis pada budidaya ikan kerapu bebek diantaranya adalah bakteri Vibrio alginolyticus. Bakteri V. Alginolyticus ini dapat mengakibatkan penyakit pada ikan kerapu bebek dengan gejala klinis berupa
septicemia, tukak, hemoragik (Johnny dan Roza 2002). Penyakit vibriosis ini
dapat menular melalui air atau kontak langsung antar ikan yangsangat cepat
menyebar pada ikan yang dipelihara dengan kepadatan tinggi. Bakteri V.
alginolyticus ini dilaporkan mampu meyebabkan kematian lebih dari 50% pada
ikan air laut (Martins et al. 2010). Kemudian menurut Yanuhar (2009) ikan kerapu bebek merupakan ikan yang rentan terkena penyakit vibriosis dan menyebabkan kematian hingga 100% dari total populasi.
Salah satu cara yang dapat dilakukan pada saat ini untuk menekan penyakit vibriosis pada ikan kerapu adalah dengan menggunakan antibiotik. Akan tetapi, penggunaan bahan antibiotik yang berlebihan telah diketahui dapat menimbulkan masalah serius berupa resistensi pada bakteri patogen (Balcazar et al. 2006). Dengan demikian diperlukan alternatif lain untuk mencegah serangan penyakit vibriosis. Aplikasi sinbiotik merupakan salah satu strategi pengendalian infeksi yang dapat meningkatkan pertumbuhan dan resistensi penyakit organisme akuakultur, karena sinbiotik adalah suplemen yang menggabungkan probiotik dan prebiotik, sehingga dapat meningkatkan efek menguntungkan pada inang (Cerezuela et al. 2011). Pada penelitian Ai et al. (2011) aplikasi sinbiotik antara probiotik bakteri Bacillus subtilis dan prebiotik fructooligosaccharides telah
terbukti mampu meningkatkan respon imun dan resistensi Yellow croaker
terhadap Vibrio harveyi (Ai et al. 2011).
Probiotik merupakan mikroba hidup yang memiliki efek menguntungkan pada organisme inang, karena mampu memodifikasi komunitas mikroba, dan meningkatkan penggunaan pakan atau nilai nutrisi, serta dapat melindungi inang terhadap serangan penyakit patogen (Verschuere et al. 2000).oSedangkan prebiotik merupakan bahan pangan yang tidak dapat dicerna oleh inang akan tetapi memberikan efek menguntungkan bagi inangnya yaitu dengan cara merangsang pertumbuhan dan atau aktifitas dari satu atau beberapa bakteri di dalam kolon sehingga dapat meningkatkan kesehatan inangnya (Ringo et al. 2010).
sistem kekebalan tubuh ikan, juga mampu meningkatkan kualitas lingkungan budidaya perikanan (Wang et al. 2007). Bakteri probiotik NP 5 merupakan hasil isolasi bakteri dari saluran pencernaan ikan nila, dengan menambahankan probiotik NP 5 dalam sinbiotik dapat menghasilkan pertumbuhan, efisiensi pakan, aktivitas enzim, dan retensi nutrien yang lebih baik pada ikan nila (Oreochromis
niloticus) (Putrao2010 ; Tanbiyaskur 2011).
Prebiotik merupakan bahan pangan yang tidak dapat dicerna dan memberikan efek menguntungkan bagi inangnya dengan cara merangsang pertumbuhan dan atau aktivitas dari satu atau beberapa bakteri di dalam kolon usus sehingga dapat meningkatkan kesehatan inangnya (Ringo et al. 2010). Suatu bahan pangan dapat diklasifikasikan sebagai prebiotik apabila memenuhi syarat sebagai berikut: 1) tidak dihidrolisis atau diserap di bagian atas sistem gastrointestinal, 2) dapat menjadi substrat yang selektif untuk satu atau beberapa bakteri potensial yang menguntungkan pada usus besar, 3) mampu meningkatkan jumlah dan aktivitas flora yang mendukung kesehatan dan dapat menekan jenis yang berbahaya dalam usus besar (Ringo et al. 2010). Beberapa penelitian menunjukan bahwa dosis pemberian sinbiotik baik probiotik maupun prebiotik dapat menjadi salah satu faktor pembatas untuk mendapatkan hasil yang optimal pada inang (Cerezuela et al. 2011). Menurut Li et al. (2009) pemberian dosis probiotik yang optimum pada pakan, mampu meningkatkan sintasan dan parameter sistem imun pada udang vaname, dan mampu mereduksi bakteri patogen bakteri vibrio penyebab penyakit vibriosis. Dengan demikian kajian pemberian sinbiotik dengan dosis probiotik berbeda diharapkan dapat menemukan kombinasi optimal yang dapat meningkatkan sistem imun dan resistensi untuk pencegahan penyakit vibriosis pada ikan kerapu bebek (Cromileptes altivelis).
Perumusan masalah
Penggunaan antibiotik untuk pengobatan penyakit pada saat ini secara bertahap mulai ditinggalkan, bahkan dilarang pemakaiannya dikarenakan menyebabkan resistensi bakteri dan keamanan pangan. Sehingga penggunaan probiotik dengan dosis berbeda pada penelitian ini diharapkan dapat ditemukan dosis optimum yang dapat meningkatkan respon imun kerapu bebek terhadap penyakit vibriosis melalui aplikasi sinbiotik.
Tujuan Penelitian
Tujuan penelitian ini adalah mengkaji pemberian sinbiotik dengan dosis probiotik berbeda untuk mencegah penyakit vibriosis pada ikan kerapu bebek
(Cromileptes altivelis).
Manfaat Penelitian
Hipotesis
Hipotesis yang diajukan pada penelitian ini adalah pemberian dengan dosis probiotik berbeda dengan penambahan prebiotik pada pakan, mampu meningkatkan kinerja pertumbuhan, respon imun, dan resistensi ikan kerapu bebek terhadap serangan penyakit vibriosis
2 TINJAUAN PUSTAKA
Penyakit Vibriosis pada Ikan Kerapu
Penyakit vibriosis disebabkan oleh bakteri Vibrio sp. yang pada ikan kerapu bebek disebabkan oleh Vibrio alginolyticus. V. alginolyticus ini merupakan
mikroorganisme patogenik yang tersebar diseluruh dunia. V. alginolyticus
umumnya banyak menginfeksi organisme laut seperti ikan, udang, dan kerang. Spesies Vibrio memproduksi banyak enzim amilase, gelatinase dan kitinase. V.
alginolyticus tumbuh pada kisaran pH 8-8,8 dan suhu pertumbuhan optimum
berada pada suhu 20-37oC (Rebekkah et al. 2010).
Bakteri V. alginolyticus ini adalah bakteri gram negatif, dan merupakan jenis bakteri yang paling patogen pada ikan kerapu bebek dibandingkan jenis bakteri lainnya. NilaiLD 50 adalah sebesar 106 cfu/ml pada ikan kerapu dengan berat antara 5-10 gram. Bakteri ini merupakan jenis bakteri Gram negatif,
berbentuk batang koma, tumbuh optimal pada suhu 15-30oC dan ditemukan pada
air laut (Austin dan Austin 2007). V. alginolyticus dicirikan dengan
pertumbuhannya yang bersifat swarm pada media padat non selektif. V.
alginolyticus terdapat bebas di alam baik di air maupun di lumpur. Vibriosis pada
ikan kerapu bebek ditandai dengan hilangnya selera makan, ikan tidak aktif berenang, kulit menjadi buram (discolored), kemudian mengalami peradangan, nekrosis, dan ulser (Austin et al. 2005).
Probiotik
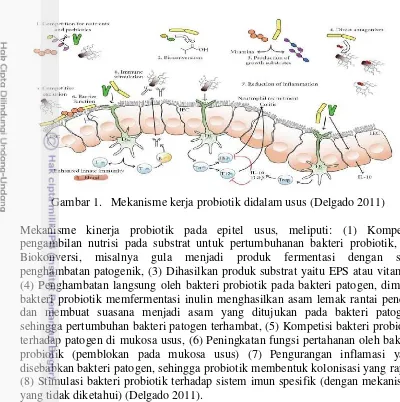
Gambar 1. Mekanisme kerja probiotik didalam usus (Delgado 2011)
Mekanisme kinerja probiotik pada epitel usus, meliputi: (1) Kompetisi pengambilan nutrisi pada substrat untuk pertumbuhanan bakteri probiotik, (2) Biokonversi, misalnya gula menjadi produk fermentasi dengan sifat penghambatan patogenik, (3) Dihasilkan produk substrat yaitu EPS atau vitamin, (4) Penghambatan langsung oleh bakteri probiotik pada bakteri patogen, dimana bakteri probiotik memfermentasi inulin menghasilkan asam lemak rantai pendek dan membuat suasana menjadi asam yang ditujukan pada bakteri patogen, sehingga pertumbuhan bakteri patogen terhambat, (5) Kompetisi bakteri probiotik terhadap patogen di mukosa usus, (6) Peningkatan fungsi pertahanan oleh bakteri probiotik (pemblokan pada mukosa usus) (7) Pengurangan inflamasi yang disebabkan bakteri patogen, sehingga probiotik membentuk kolonisasi yang rapat, (8) Stimulasi bakteri probiotik terhadap sistem imun spesifik (dengan mekanisme yang tidak diketahui) (Delgado 2011).
Probiotik jenis Bacillus sp. merupakan jenis bakteri berbentuk batang, Gram positif dan mampu memproduksi enzim katalase. Di habitatnya Bacillus sp. bersifat aerob sampai anaerob fakultatif, sehingga dapat mentoleransi pH rendah serta mampu membentuk koloni pada mukosa usus (Zheng et al. 2005). Selain itu probiotik jenis Bacillus sp. Ini mampu memfermentasi prebiotik seperti inulin dan menghasilkan produk asam lemak rantai pendek (SCFA) yang dapat menghambat pertumbuhan bakteri patogen (Katarzyna et al. 2010).
Wang et al. (2007) berpendapat bahwa bakteri probiotik jenis Bacillus sp. juga digunakan sebagai bioremediasi dan merupakan jenis bakteri non-patogenik. hasil penelitiannya menunjukan bahwa probiotik ini mampu meningkatkan kualitas lingkungan budidaya perikanan yang kondusif. Dari penelitian Marzouk
et al. (2008), diketahui probiotik jenis Bacillus subtilis dapat memperbaiki FCR
Prebiotik
Prebiotik umumnya merupakan karbohidrat yang tidak dapat dicerna dalam saluran pencernaan inang. Karbohidrat dikelompokkan berdasarkan berat molekul atau tingkat polimerasinya (jumlah unit monosakarida), menjadi monosakarida, oligosakarida dan polisakarida. Oligosakarida tidak dapat dihidrolisis dan diserap usus halus, karena mukosa pada usus tidak memiliki enzim pencerna oligosakarida yaitu α-galaktosidase (Weese 2002).
Oligosakarida merupakan gula dengan 3 hingga 20 unit sakarida. Oligosakarida merupakan rantai pendek polisakarida. Karakteristik senyawa oligosakarida adalah terdiri dari susunan monosakarida antara lain glukosa, galaktosa, xylosa dan fruktosa (Manning et al. 2004).
FAO (2007) juga menegaskan komponen prebiotik bukan organisme atau obat. Prebiotik dapat meningkatkan kesehatan dan tidak diserap oleh epitel usus. Mekanisme penghambatan patogen oleh prebiotik terbagi menjadi dua yaitu secara langsung dan tidak langsung. Penghambatan patogen oleh prebiotik secara
langsung karena prebiotik (oligosakarida) dapat mem „blok‟ sisi reseptor
pelekatan patogen pada mukosa usus. Penghambatan patogen oleh prebiotik secara tidak langsung dikarenakan prebiotik dapat meningkatkan pertumbuhan mikroflora probiotik (Rastall 2005).
Penelitian mengenai prebiotik ini telah dilakukan oleh Javid et al. (2012) dimana rainbow trout (Oncorhynchus mykiss) yang dipelihara didalam wadah pemeliharaan kapasitas 2500 liter yang diberikan perlakuan sebanyak 2 kg/ton tepung prebiotik komersial (A-max USA) dengan bahan dasar utama
Saccharomyces cerevisiae memberikan pengaruh yang signifikan (p<0,05)
terhadap pertumbuhan SGR, FCR, dan nafsu makan bila dibandingkan dengan ikan rainbow yang tidak diberikan prebiotik.
Sinbiotik
Sinbiotik merupakan gabungan antara probiotik dan prebiotik. Keduanya saling berkaitan dimana prebiotik secara selektif memberikan nutrisi pada bakteri probiotik, sehingga akan menstimulasi pertumbuhan bakteri probiotik didalam epitel/mukosa usus (Hamed et al. 2012). Sinbiotik mempengaruhi inang dengan cara meningkatkan kelangsungan hidup dan masuknya mikroba hidup melalui suplemen makanan dalam saluran pencernaan yang secara selektif mampu merangsang pertumbuhan dan mengaktifkan metabolisme bakteri yang dapat meningkatkan kesehatan inang(Cerezuela et al. 2011).
Hamed et al. (2012) juga menjelaskan bahwa sinbiotik dapat memberikan efek positif pada inang target dengan meningkatkan kelangsungan hidup dimana kinerja dari sinbiotik adalah untuk mengimplantasi pertumbuhan mikroba (probiotik) oleh prebiotik dalam saluran pencernaan, sehingga metabolisme dan kesehatan inang selalu terjaga Prebiotik mampu menstimulasi bakteri probiotik, hal ini dapat ditunjukkan oleh bakteri Bifidobacteria yang pertumbuhannya dapat terstimulasi oleh substansi (fructooligosakarida dan Inulin), Transgalactosylated
oligosaccharides, dan Soybean oligosaccharides (Tissier 2001).
Pada larva ikan Texascichlid (Herichthys cyanoguttatus) telah diuji sinbiotik komersial jenis Biomin® IMBO yang terdiri atas probiotik strain Enterococcus
faecium serta prebiotik Fructo-oligosaccharides yang memberikan efek signifikan
yang tidak diberikan sinbiotik (Salaret al. 2012). Selain itu, Salaret al. (2012) juga menjelaskan bahwa semakin besar dosis sinbiotik yang diberikan tingkat pertumbuhan larva ikan texas cichild semakin tinggi.
Sistem Imun pada Ikan
Respon imun ikan terdiri dari respon imun selular dan humoral (Ellis 1989). Aktivitas respon imunitas dapat distimulasi oleh imunostimulator (Anderson dan Siwicki 1993). Respon humoral merupakan respon spesifik, sedangkan respon selular bersifat non-spesifik (Iwama dan Nakanishi 1996). Respon dan faktor humoral antara lain antibodi, transferin, interferon, dan protein C-reaktif, sedangkan respon dan faktor selular meliputi makrofag, sel killer, neutrofil dan hipersensitivitas. Selain itu, penghalang mekanis dan kimiawi, seperti kulit, sisik, dan mukus pada permukaan tubuh dan insang, juga merupakan alat pertahanan tubuh ikan yang bersifat non-spesifik (Anderson 1974).
Respon imun non-spesifik merupakan sistem kekebalan tubuh ikan terhadap mekasnisme fagosit yang berkaitan dengan makrofag dan granular leukosit. Sebagai contoh, neutrofil akan menyerang mikroorganisme yang masuk melalui jaringan kulit atau mukus. Selain itu, terdapat lisosim dan komplemen yang merusak patogen (Iwama dan Nakanishi 1996).
Lisosim bekerja untuk menghancurkan dinding sel (peptidoglikan) sehingga bakteri mengalami lisis, dan juga memberi tanda pada saat tubuh mengalami stres. Lektin bekerja dengan cara memblok karbohidrat sebagai bahan pembentuk dinding sel, serta berperan dalam aktivasi komplemen. Komplemen terdapat dua jalur aktivasi komplemen yaitu klasik serta alternatif, jalur klasik diaktifkan oleh mekanisme antigen dan antibodi. Jalur alternatif biasanya muncul pada saat dibutuhkan dalam waktu yang cepat (Tort et al. 2003).
3 METODE PENELITIAN
Waktu dan Tempat
Penelitian ini telah dilaksanakan di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu kelautan, Institut Pertanian Bogor. Pelaksanaan penelitian telah dilakukan pada bulan Maret – Juni 2013.
Hewan Uji
Penyediaan Bakteri Probiotik
Bakteri probiotik yang digunakan dalam penelitian ini adalah bakteri NP5, yang merupakan bakteri dari genus Bacillus. Penyediaan bakteri probiotik diawali
dengan menumbuhkan bakteri NP5 ke dalam media agar miring SWC (Sea Water
Complete) dengan komposisi 0,5 g bacto peptone, 0,1 g yeast exstract, 0,3 ml
glyserol, 75 ml air laut, akuades 25 ml, bacto agar 1,5-2 g dan diinkubasi selama
24 jam dalam inkubator. Setelah itu dilakukan kultur bakteri NP5 dalam 25 ml media SWC cair steril (tanpa penambahan bacto agar) dan diinkubasi di dalam
water bath shaker dengan kecepatan 140 rpm pada suhu 29o C selama 24 jam.
Selanjutnya dilakukan pemanenan bakteri probiotik dengan memindahkan suspensi bakteri ke dalam tabung eppendorf dan disentrifuse selama 10 menit dengan kecepatan 5000 rpm. Kemudian dilakukan pencucian dengan
menambahkan Phosphate Buffer Saline (PBS) steril sebanyak 10 ml, lalu
dihomogenkan dengan menggunakan vortex dan disentrifuse kembali dengan kecepatan 5000 rpm selama 10 menit. Setelah itu dilakukan tahap pencucian kedua dengan menambahkan 4 ml PBS steril lalu dihomogenkan dengan vortex dan suspensi bakteri probiotik siap dicampurkan ke dalam pakan.
Persiapan Prebiotik
Pembuatan Tepung Ubi Jalar (Marlis, 2008)
Ubi jalar dibersihkan dan dikupas, kemudian diiris dengan menggunakan pisau dengan ketebalan ± 1 mm. Kemudian irisan ubi jalar dikeringkan dalam
oven pengering pada suhu 55oC selama 5 jam hingga irisan ubi dapat dipatahkan
dengan tangan. Irisan ubi jalar kemudian digiling dengan willey mill dan diayak dengan ukuran 60 mesh. Tahapan dalam pembuatan ubi jalar dapat dilihat pada Gambar 2.
Ekstraksi Oligosakarida/Prebiotik dengan Etanol 70% (Muchtadi, 1989)
Sebanyak 10 gram tepung ubi jalar disuspensikan ke dalam 100 ml etanol 70% dan diaduk selama 15 jam menggunakan magnetic stirer pada suhu ruang. Setelah itu dilakukan penyaringan menggunakan kertas saring dan residu dicuci dengan etanol 70%. Filtrat yang diperoleh dipekatkan menggunakan evaporator vakum pada suhu 40oC. Hasil pemekatan disentrifus pada 2000 rpm selama 10 menit untuk mengendapkan kotoran dan padatan sehingga ekstrak mudah disterilisasi dengan membran steril 0,2 µm.
Total Padatan Terlarut (Apriyantono, 1989)
oligosakarida kemudian ditempatkan dalam oven selama sehari semalam. Setelah kering, cawan berisi sampel ekstrak kasar oligosakarida didinginkan dalam desikator selama 10 menit atau hingga berat cawan stabil. Berat cawan yang berisi ekstrak kering kemudian diukur (c gram). Total padatan terlarut dihitung dari hasil perbandingan berat ekstrak setelah dikeringkan dengan berat ekstrak sebelum dikeringkan dan dikalikan 100%.
TPT = x 100%
Persiapan pakan uji
Perlakuan sinbiotik (probiotik 1% + prebiotik 2%) diberikan ke ikan
melalui pakan berupa pakan komersial dengan kandungan protein 45% dan binder
berupa putih telur sebanyak 2% dari bobot pakan. Bakteri probiotik NP5 ditambahkan ke pakan dengan konsentrasi berbeda. Pakan untuk kontrol juga ditambahkan putih telur 2% tanpa pemberian sinbiotik. Pembuatan pakan perlakuan dilakukan setiap hari.
Pengujian Pakan Uji pada Ikan Kerapu Bebek
Ikan kerapu dipelihara selama 30 hari untuk perlakuan pakan sinbiotik, masing-masing akuarium dimasukkan ikan sebanyak 8 ekor/akuarium dengan volume 40 liter. Penelitian ini terdiri dari 4 perlakuan dengan 3 ulangan, yaitu: K (-) : Pemberian pakan tanpa penambahan sinbiotik dan diinjeksi PBS
K (+) : Pemberian pakan tanpa penambahan sinbiotik dan diinfeksi V.alginolyticus P1 : Pemberian pakan dengan penambahan sinbiotik (probiotik (104CFU/ml)1%+ prebiotik 2%)dan diinfeksi V. alginolyticus
P2 : Pemberian pakan dengan penambahan sinbiotik
(probiotik (106 CFU/ml) 1% +prebiotik 2% dan diinfeksi V. alginolyticus P3 : Pemberian pakan dengan penambahan sinbiotik
(probiotik (108CFU/ml)1% +prebiotik 2%)dan diinfeksi V. alginolyticus
Uji TantangP
Uji ini dilakukan untuk mengetahui ketahanan tubuh ikan kerapu terhadap infeksi V. alginolyticus pada hari ke-31. Persiapan bakteri dikultur dimedia SWC
dengan tingkat kepadatan 106 CFU/ml berdasarkan uji LD 50 ikan kerapu bebek
terhadap V. alginolyticus. Kemudian dilakukan proses penyuntikan bakteri patogen secara intramuskular pada tubuh ikan sebanyak 0,1 ml/ekor. Selanjutnya ikan dipelihara selama 6 hari untuk mengetahui kelangsungan hidup dan gejala klinis ikan tersebut. Selama pemeliharaan saat uji tantang ikan kerapu diberikan pakan komersil dengan kadar protein 45 %.
Parameter Pengamatan
Tingkat Kelangsungan Hidup (SR)
Kelangsungan hidup ikan diamati setiap hari dari awal hingga akhir perlakuan. Tingkat kelangsungan hidup ikan dihitung dengan menggunakan rumus:
Keterangan :
SR = Tingkat kelangsungan hidup (%) Nt = Jumlah ikan pada akhir perlakuan No = Jumlah ikan pada awal perlakuan
Laju Pertumbuhan HariLaju Pertumbuhan Harian (LPH)setelah pemberian
nnnnLaju pertumbuhan spesifik ikan dihitung menggunakan rumus berikut
(Huisman, 1987) :
α =
Keterangan :
Wt = Bobot rata-rata ikan pada akhir perlakuan (gram) Wo = Bobot rata-rata ikan pada awal perlakuan (gram) n = Lama perlakuan
Rasio Konversi Pakan (FCR)
Nilai konversi pakan yang digunakan selama perlakuan ini dapat diketahui melalui rumus berikut (Zonneveld et al. 1991):
FCR =
Keterangan :
FCR = Konversi pakan
F = Jumlah pakan yang diberikan (gram)
Bt = Biomassa ikan pada akhir perlakuan (gram)
Kemudian ditambahkan larutan Hayem‟s dengan cara dihisap sampai skala 101,
lalu campuran tersebut dihomogenkan dengan cara pipet digoyang membentuk angka delapan selama 3-5 menit. Setelah itu tetesan pertama dari dalam pipet dibuang, dan tetesan selanjutnya dikeluarkan ke atas hemasitometer yang sudah ditutup dengan kaca penutup, Selanjutnya dilakukan perhitungan sel darah merah pada 5 kotak besar hemasitometer di bawah miroskop. Total sel darah merah didapatkan berdasarkan rumus berikut:
Total sel darah putih
Total sel darah putih dihitung berdasarkan Blaxhall dan Daisley (1973) dengan cara: sampel darah dihisap dengan pipet bulir putih sampai skala 0,5.
Kemudian ditambahkan larutan Turk‟s dengan cara dihisap sampai skala 11, lalu
campuran tersebut dihomogenkan dengan cara pipet digoyang membentuk angka delapan selama 3-5 menit. Setelah itu tetesan pertama dari dalam pipet dibuang, dan tetesan selanjutnya dikeluarkan ke atas hemasitometer yang sudah ditutup dengan kaca penutup, Selanjutnya dilakukan perhitungan sel darah putih pada 5 kotak kecil haemasitometer di bawah miroskop. Total sel darah putih didapatkan berdasarkan rumus berikut:
∑ leukosit = ∑ sel sel darah putih terhitung x (pengencer/volume)
Kadar Hemoglobin (Hb)
Kadar hemoglobin diukur melalui metode Sahli dengan menggunakan Sahlinometer (Wedemeyer dan Yasutake 1977). Prosedur pengukuran kadar hemoglobin dilakukan dengan cara: darah dihisap dengan pipet sahli sampai skala
20 mm3 atau 0,2 ml. Kemudian darah di dalam pipet dimasukkan ke dalam tabung
Hb-meter yang telah diisi HCl 0,1 N sampai skala 10 pada skala yang berwarna merah, lalu diaduk dan didiamkan selama 3-5 menit. Setelah itu, ditambahkan akuades sedikit demi sedikit sampai warna campuran darah dan HCl sama dengan warna larutan standar yang ada di dalam Hb-meter. Selanjutnya kadar hemoglobin dibaca dengan melihat permukaan cairan dan dicocokkan dengan angka pada skala yang berwarna kuning. Kadar hemoglobin yang terbaca memiliki satuan gram% yang berarti banyaknya hemoglobin dalam satuan gram per 100 ml darah.
Kadar Hematokrit (He)
Kadar hematokrit diukur berdasarkan Anderson dan Siwicki (1993) dengan cara: sampel darah dimasukkan kedalam tabung mikrohematokrit sampai ¾ bagian tabung, lalu ujung tabung disumbat dengan crystoseal. Setelah itu tabung disentrifus selama 5 menit dengan kecepatan 3000 rpm. Kemudian dilakukan pengukuran panjang darah yang mengendap (a) dan panjang total volume darah (b) di dalam tabung mikro hematokrit. Kadar hematokrit dinyatakan sebagai % volume padatan sel darah yang dihitung dengan rumus berikut:
He = (a/b) x 100%
Diferensial leukosit
Perhitungan diferensial leukosit ditentukan berdasarkan Amlacher (1970). Perhitungan dilakukan dengan cara mengamati preparat ulas darah. Pembuatan preparat ulas darah ini dilakukan dengan cara: darah diteteskan di atas gelas objek yang telah dibilas alkohol, lalu ujung gelas objek kedua diletakkan di atas gelas
objek yang telah ditetesi darah dengan membentuk sudut sebesar 30˚. Kemudian
dihitung jenis-jenis leukosit dan dihitung pula persentase dari masing-masing jenis leukosit tersebut.
Aktivitas Fagositik
Perhitungan aktivitas fagositosis mengacu pada Anderson dan Siwicki (1993) dilakukan dengan cara: sebanyak 50 µl sampel darah dimasukkan ke dalam
eppendorf dan ditambahkan 50 µl suspensi bakteri Staphylococcus aureus dalam
PBS yang memiliki kepadatan 107 CFU/ml. Campuran tersebut dihomogenkan dan diinkubasi selama 20 menit. Kemudian sebanyak 5 µ l campuran tersebut dibuat preparat ulas dan dikering anginkan, selanjutnya difiksasi dengan metanol dan dikering anginkan. Selanjutnya preparat diwarnai dengan pewarna Giemsa selama 15 menit, lalu dibilas dengan air mengalir dan dikering anginkan Pengamatan aktivitas fagositosis dilakukan di bawah mikroskop dan dihitung persentase dari total 100 sel darah putih yang menunjukkan aktivitas fagositosis.
Aktivitas Respiratory Burst
Respiratory burst dianalisis dengan metode yang dilakukan oleh Liu et al. (2004). Sebanyak 100 µL darah-antikoagulan ditempatkan dalam eppendorf yang sebelumnya sudah ditambahkan 100 µL larutan poly L lysine 0.2 %. Lalu disentrifus pada 700xg selama 20 menit kemudian supernatan dibuang, kemudian ditambahkan 100 µL larutan HBSS dengan nitroblue tetrazolium 0.3 % diamkan selama 2 jam agar bereaksi, kemudian disentrifus pada 700 xg selama 10 menit lalu buang larutan NBTnya, kemudian ditambahkan dengan 100 µL methanol absolute, kemudian disentrifus lagi pada 700 xg selama 10 menit lalu buang supernatannya, kemudian cuci 2 kali dengan 100 µL methanol 70 % kemudian dibiarkan kering udara, kemudian dilarutkan dengan formazan (120 µL 2M KOH dan 140 µL dimethyl sulphoxide (DMSO)), kemudian dipindahkan ke dalam
microplate terakhir dilihat nilai absorbannya pada panjang gelombang 630 nm.
Penghitungan Jumlah Bakteri Di Usus Ikan Uji
Penghitungan jumlah bakteri di usus ikan uji dilakukan diakhir perlakuan dengan metode hitungan cawan (Lampiran 3). Usus ikan diambil kemudian dihomogenkan dalam larutan PBS. Parameter yang diamati adalah Total Viable
Bacterial Count (TBC) dan Total probiotik NP5R Count. Media yang digunakan
berupa media SWC (Sea Water Complete) untuk TBC dan media SWC+
Rifampisin 50 µg/ml untuk NP5R. Kemudian dilakukan perhitungan bakteri dengan metode hitung cawan.
Kualitas Air
Pengukuran kualitas air yang berupa suhu, pH, TAN, dan salinitas dilakukan pada saat awal dan akhir perlakuan, dapat dilihat pada lampiran 15.
Analisis Data
4. HASIL
Kelimpahan Bakteri Usus
Penggunaan sinbiotik dalam meningkatkan populasi bakteri
menguntungkan didalam saluran pencernaan ikan kerapu dapat diketahui dari hasil penghitungan kelimpahan bakteri pada usus. Hasil pengamatan kelimpahan bakteri diusus ikan kerapu selama penelitian disajikan pada Tabel 1.
Tabel Kelimpahan bakteri pada usus kerapu bebek (Cromileptes altivelis)
Hasil perhitungan Total Bacterial Count (TBC), pada perlakuan sinbiotik lebih tinggi dibanding kontrol, kecuali perlakuan P1. Jumlah bakteri tertinggi terdapat pada perlakuan sinbiotik P3 diikuti dengan perlakuan P2, dan terendah
pada perlakuan P1. Sedangkan hasil penghitungan bakteri NP5R, diketahui bahwa
perlakuan sinbiotik dosis P3 menunjukkan nilai tertinggi yaitu sebesar 6,62x103 CFU/g. Sedangkan pada perlakuan dosis P1 dan P2 adalah 7,69x101 CFU/g dan 9,34x102 CFU/g. Sementara itu pada kontrol tidak ditemukan bakteri NP5R. Hal
ini menunjukkan bahwa probiotik NP5R yang diberikan bersama dengan prebiotik
mampu hidup dan memanfaatkan prebiotik pada usus kerapu bebek.
Performa Pertumbuhan
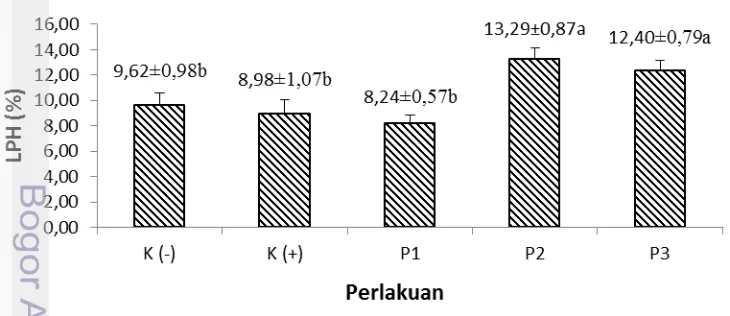
Gambar 2. Laju Pertumbuhan harian kerapu bebek (Cromileptes altivelis) pada o perlakuan sinbiotik dengan dosis probiotik berbeda (Duncan; P<0,05)
Pada Gambar 3 LPH kerapu bebek setelah pemberian perlakuan sinbiotik dengan dosis probiotik berbeda selama 30 hari, menunjukkan bahwa perlakuan P2 (13,29±0,87), dan P3 (12,4±0,79) menghasilkan nilai LPH yang lebih tinggi dan berbeda nyata bila dibandingkan dengan kontrol (9,62±0,98 dan 8,98±1,07). Hal
Perlakuan TBC
(CFU/g)
NP5R
(CFU/g)
K (-) 2,91x106 0
K (+) 2,89x106 0
(P1) 2,31x106 7,69x101
(P2) 5,60 x106 9,34x102
ini membuktikan penggunaan sinbiotik dapat memacu kinerja pertumbuhan ikan kerapu bebek.
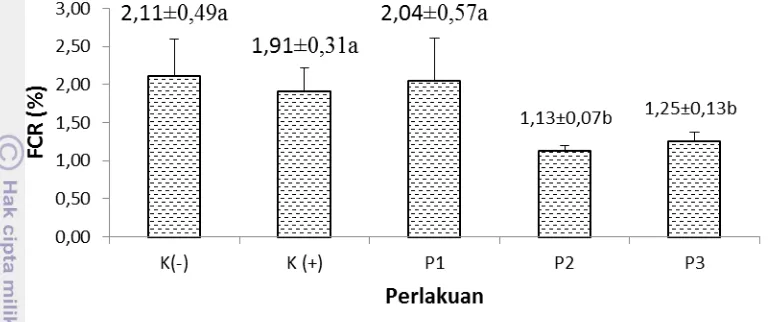
Gambar 3. Rasio konversi pakan (FCR) kerapu bebek (Cromileptes altivelis) O pada perlakuan sinbiotik dengan dosis probiotik berbeda (P<0,05)
Kemudian pada Gambar 4 Nilai FCR pada perlakuan kontrol K (-) sebesar 2,11±0,49 dan kontrol K (+) sebesar 1,91±0,31 lebih tinggi dibandingkan dengan perlakuan sinbiotik P2 (1,13±0,07) dan P3 (1,25±0,13), akan tetapi menunjukkan hasil yang tidak berbeda nyata terhadap perlakuan P1 (2,04±0,57). Hal ini menunjukkan bahwa sebagian dari perlakuan sinbiotik yang diujikan dapat memberikan pengaruh yang menguntungkan terhadap LPH dan FCR pada ikan kerapu.
Sintasan
Gambar 4. Sintasan kerapu bebek (Cromileptes altivelis) pada perlakuan sinbiotik dengan dosis probiotik berbeda (P<0,05)
Respon Imun
Gambaran darah
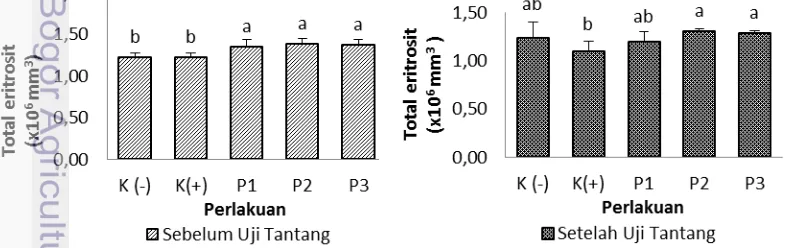
Eritrosit (Total sel darah merah) merupakan salah satu parameter gambaran darah yang diamati dalam penelitian ini hasil pengukuran total eritrosit pada ikan kerapu bebek dilakukan sebelum dan sesudah uji tantang dapat dilihat pada Gambar 6 dan lampiran 5.
Berdasarkan gambar 6 nilai total eritrosit pada ikan kerapu bebek sebelum dilakukan uji tantang menujukan adanya perbedaan yang nyata antar perlakuan sinbiotik terhadap kontrol (P<0,05). setelah dilakukan uji tantang total eritrosit
cenderung mengalami penurunan pada semua perlakuan yang diinjeksikan V.
alginolyticus kecuali pada K (-) sebesar 1,24±0,16(x 106 sel/mm3), hal ini
dikarenakan pada K (-) tidak diinjeksikan V. alginolyticus. sedangkan pada perlakuan sinbiotik P1, P2, P3, dan K (+) masing-masing sebesar 1,20±0,10(x 106 sel/mm3, 1,31±0,02 (x106 sel/mm3, 1,29±0,02 (x 106 sel/mm3), dan 1,10±0,10(x 106 sel/mm3).
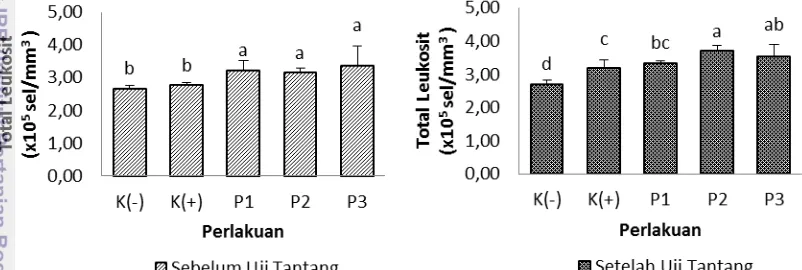
Ikan kerapu memiliki respon imun spesifik dan respon imun non spesifik. Sel darah putih atau leukosit merupakan bagian dari sistem pertahanan tubuh ikan yang bersifat non-spesifik termasuk didalamnya monosit, neutrofil, granulosit, dan sel natural killer (NK) (Sylvia 2002). Hasil pengukuran nilai total leukosit pada ikan kerapu bebek sebelum dan sesudah uji tantang dapat dilihat pada Gambar 7 dan lampiran 6.
Nilai leukosit sebelum dilakukan uji tantang menunjukan bahwa terdapat perbedaan nyata antar perlakuan sinbiotik terhadap kontrol. setelah dilakukan uji tantang total leukosit cenderung meningkat pada semua perlakuan yang diinjeksikan V. alginolyticus pada hari ke-31, dan nilai leukosit tertinggi pada perlakuan sinbiotik P2 (3,69x 105 sel/mm3) dan berbeda nyata bila dibandingkan dengan perlakuan K(+) (3,18 x 105 sel/mm3) (P<0,05) sedangkan pada perlakuan P1, P3, dan K (-) sebesar 3,33x105 sel/mm3, 3,52x105 sel/mm3, dan 2,69x105 sel/mm3).
Gambar 6. Total leukosit kerapu bebek (Cromileptes altivelis) pada o perlakuan sinbiotik dengan dosis berbeda (P<0,05)
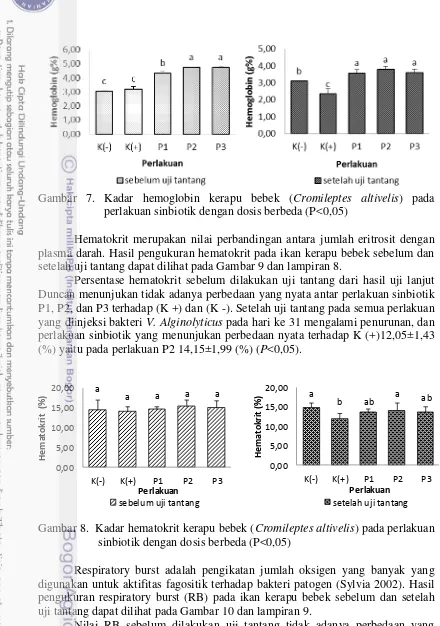
Hemoglobin (Hb) merupakan bagian dari eritrosit yang memiliki kemampuan mengangkut oksigen untuk diedarkan keseluruh tubuh. hasil pengukuran kadar hemoglobin sebelum dan setelah dilakukan uji tantang dapat dilihat pada Gambar 8 dan lampiran 7.
a
Hematokrit merupakan nilai perbandingan antara jumlah eritrosit dengan plasma darah. Hasil pengukuran hematokrit pada ikan kerapu bebek sebelum dan setelah uji tantang dapat dilihat pada Gambar 9 dan lampiran 8.
Persentase hematokrit sebelum dilakukan uji tantang dari hasil uji lanjut Duncan menunjukan tidak adanya perbedaan yang nyata antar perlakuan sinbiotik P1, P2, dan P3 terhadap (K +) dan (K -). Setelah uji tantang pada semua perlakuan yang diinjeksi bakteri V. Alginolyticus pada hari ke 31 mengalami penurunan, dan perlakuan sinbiotik yang menunjukan perbedaan nyata terhadap K (+)12,05±1,43 (%) yaitu pada perlakuan P2 14,15±1,99 (%) (P<0,05).
Gambar 8. Kadar hematokrit kerapu bebek (Cromileptes altivelis) pada perlakuan o sinbiotik dengan dosis berbeda (P<0,05)
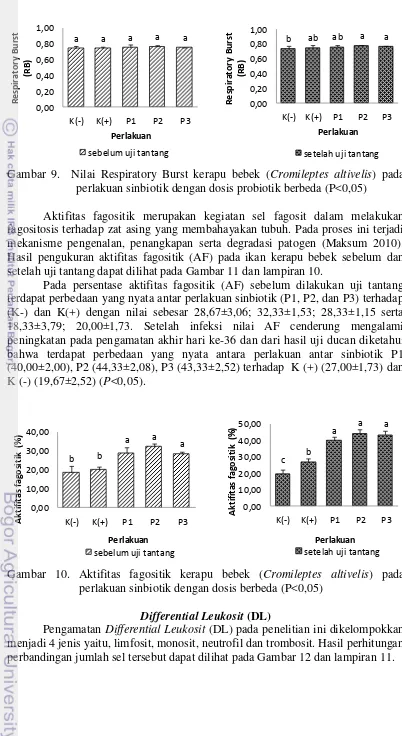
Respiratory burst adalah pengikatan jumlah oksigen yang banyak yang digunakan untuk aktifitas fagositik terhadap bakteri patogen (Sylvia 2002). Hasil pengukuran respiratory burst (RB) pada ikan kerapu bebek sebelum dan setelah uji tantang dapat dilihat pada Gambar 10 dan lampiran 9.
a a a a a
Aktifitas fagositik merupakan kegiatan sel fagosit dalam melakukan fagositosis terhadap zat asing yang membahayakan tubuh. Pada proses ini terjadi mekanisme pengenalan, penangkapan serta degradasi patogen (Maksum 2010). Hasil pengukuran aktifitas fagositik (AF) pada ikan kerapu bebek sebelum dan setelah uji tantang dapat dilihat pada Gambar 11 dan lampiran 10.
Pada persentase aktifitas fagositik (AF) sebelum dilakukan uji tantang terdapat perbedaan yang nyata antar perlakuan sinbiotik (P1, P2, dan P3) terhadap (K-) dan K(+) dengan nilai sebesar 28,67±3,06; 32,33±1,53; 28,33±1,15 serta 18,33±3,79; 20,00±1,73. Setelah infeksi nilai AF cenderung mengalami peningkatan pada pengamatan akhir hari ke-36 dan dari hasil uji ducan diketahui bahwa terdapat perbedaan yang nyata antara perlakuan antar sinbiotik P1 (40,00±2,00), P2 (44,33±2,08), P3 (43,33±2,52) terhadap K (+) (27,00±1,73) dan K (-) (19,67±2,52) (P<0,05).
Gambar 10. Aktifitas fagositik kerapu bebek (Cromileptes altivelis) pada o perlakuan sinbiotik dengan dosis berbeda (P<0,05)
Differential Leukosit (DL)
b b a a a
Limfosit merupakan sel yang berfungsi mengenali berbagai antigen, baik intraseluler maupun ekstraseluler. Nilai limfosit pada pengamatan sebelum uji tantang antar perlakuan sinbiotik (P1, P2, dan P3) menunjukan adanya perbedaan yang nyata terhadap (K-) dan (K+) masing masing sebesar 68,34±1,15; 69,33±1,15; 69,00±1,00; 60,34±1,15; serta 61,00±1,00. Setelah dilakukan uji tantang, nilai limfosit cenderung mengalami peningkatan. Hasil uji lanjut menunjukan nilai antar perlakuan sinbiotik (P1, P2, dan P3) terhadap kontrol berbeda nyata dengan nilai 68,67±1,30; 69,67±1,30; 69,48±1,16; 61,11±1,06; serta 62,33±1,15.
Gambar 11. Persentase limfosit kerapu bebek (Cromileptes altivelis) pada o perlakuan sinbiotik dengan dosis berbeda (Duncan; P<0,05)
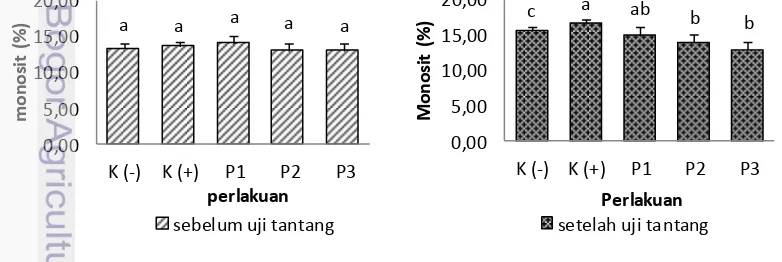
Monosit merupakan parameter mononuklear disamping makrofag yang berhubungan dengan sistem imun non-spesifik pada proses fagositik dan bekerja sama dengan komponen imun lainnya seperti neutrofil, B lymposit, T lymposit, interleuktin (Balasch dan mackenzie 2003).
Hasil persentase monosit pada ikan kerapu bebek sebelum dan setelah uji tantang dapat dilihat pada gambar 13 dan lampiran 12. Hasil pengamatan monosit sebelum uji tantang menunjukan tidak adanya perbedaan yang nyata antar seluruh perlakuan. Setelah dilakukan uji tantang nilai monosit menunjukan terjadinya kenaikan yang cukup signifikan setelah infeksi pada tiap perlakuan sinbiotik (P1 (14,97±1,15), P2 (13,96±1,15), P3 (13,01±1,00)), apabila dibandingkan dengan perlakuan K (+) 16,67±0,58 perlakuan P2, dan P3 menunjukan adanya perbedaan yang nyata (P<0,05).
Gambar 12. Persentase monosit kerapu bebek (Cromileptes altivelis) pada
a a ab ab b
Neutrofil adalah sel fagositik pertama yang tiba dilokasi infeksi dan berperan dalam fagositosis serta degradasi mikroorganisme sebagaimana yang dilakukan dalam penyembuhan luka (Sylvia 2002).
Hasil persentase neutrofil pada ikan kerapu bebek sebelum dan setelah uji tantang dapat dilihat pada gambar 14 dan lampiran 13. Persentase neutrofil sebelum infeksi menunjukan tidak adanya perbedaan nyata antar perlakuan sinbiotik (P1, dan P2) terhadap K (+) dan K(-) sedangkan pada perlakuan sinbiotik P3 tidak berbeda nyata bila dibandingkan dengan perlakuan sinbiotik P1 dan P2. Pasca infkesi setelah perlakuan pakan sinbiotik selama 30 hari menunjukan bahwa setiap perlakuan yang diinjeksikan bakteri V. Alginolyticus cenderung mengalami peningkatan. Peningkatan persentase neutrofil dalam darah ikan kerapu bebek menunjukan tidak adanya perbedaan yang nyata pada
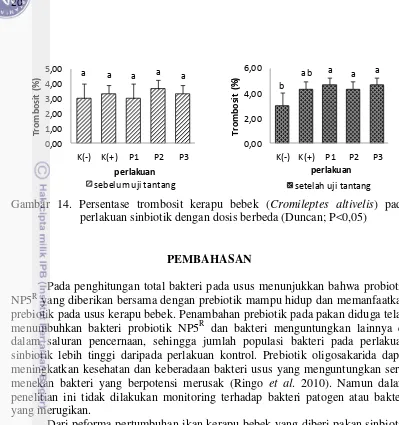
Trombosit merupakan bagian darah yang berperan dalam proses pembekuan darah, sehingga tidak banyak darah yang terbuang percuma pada saat pendarahan. (Maksum 2010).
a a a a a
Pada penghitungan total bakteri pada usus menunjukkan bahwa probiotik
NP5R yang diberikan bersama dengan prebiotik mampu hidup dan memanfaatkan
prebiotik pada usus kerapu bebek. Penambahan prebiotik pada pakan diduga telah menumbuhkan bakteri probiotik NP5R dan bakteri menguntungkan lainnya di dalam saluran pencernaan, sehingga jumlah populasi bakteri pada perlakuan sinbiotik lebih tinggi daripada perlakuan kontrol. Prebiotik oligosakarida dapat meningkatkan kesehatan dan keberadaan bakteri usus yang menguntungkan serta menekan bakteri yang berpotensi merusak (Ringo et al. 2010). Namun dalam penelitian ini tidak dilakukan monitoring terhadap bakteri patogen atau bakteri yang merugikan.
Dari peforma pertumbuhan ikan kerapu bebek yang diberi pakan sinbiotik
Pemberian probiotik NP5R diduga telah meningkatkan aktivitas enzim exogenous
sehingga dapat membantu predigestion pakan ikan kerapu. Peningkatan
pertumbuhan bakteri probiotik NP5R pada perlakuan sinbiotik diduga juga disebabkan oleh pengaruh dari prebiotik yang diberikan. Prebiotik yang diekstrak dari ubi jalar varietas sukuh secara efektif dapat mendukung pertumbuhan bakteri probiotik (Putra 2010). Selain itu, pada penelitian lain juga telah diketahui bahwa
pemberian prebiotik melalui pakan pada Litopenaeus vannamei dapat
meningkatkan panjang mikrovili usus (Zhang et al. 2012). Panjang mikrovili usus dapat membantu meningkatkan penyerapan nutrien sehingga dapat memperbaiki performa pertumbuhan pada inang. Hasil penelitian Putra (2010), menunjukkan bahwa bakteri NP5 dalam aplikasi sinbiotik menghasilkan aktivitas enzim, pertumbuhan, efisiensi pakan, kecernaan, dan retensi nutrien tertinggi pada ikan nila (Oreochromis niloticus).
Dari hasil pengamatan terhadap sintasan ikan kerapu bebek pasca infeksi terlihat bahwa nilai sintasan seluruh perlakuan sinbiotik lebih tinggi bila dibandingkan dengan kontrol K (+) hal ini mengindikasikan bahwa pengaruh pakan sinbiotik untuk meningkatkan resistensi ikan kerapu bebek terhadap infeksi
V. alginolyticus berpengaruh terhadap ketahanan ikan kerapu bebek. Pada
penelitian Yunzhang (2009), bakteri probiotik jenis Bacillus sp. dan
dapat menekan pertumbuhan Vibrio sp. Hal ini menunjukkan bahwa pemberian probiotik dapat meningkatkan ketahanan dan pertumbuhan ikan kerapu yang lebih baik.
Pada pengamatan sistem imun kerapu bebek setelah infeksi kadar eritrosit,
He, dan Hb mengalami penurunan yang disebabkan oleh V. alginolyticus
menginfeksi didalam saluran darah sehingga merusak sel darah merah (Eritrosit), dan menyebabkan septikemia pada ikan kerapu (Johnny dan Roza 2002). Secara fisiologis, hemoglobin menentukan tingkat ketahanan tubuh ikan karena berfungsi untuk mengikat oksigen dalam darah. Kadar hemoglobin bersinergi positif terhadap jumlah eritrosit (Hilman et al. 2005). Pada nilai Respiratory Burst (RB) terhadap Aktifitas fagositik (AF) sangat mempengaruhi persentase nilai (AF) yang
menunjukan pola peningkatan. Menurut Johnny et al. (2005) peningkatan AF dan
RB dipengaruhi oleh pemberian imunostimulan pada ikan. Hal inilah yang menyebabkan nilai AF dan RB perlakuan sinbiotik lebih tinggi dari pada kontrol K (+). Tanbiyaskur (2011) juga menjelaskan pada ikan nila (Oreochromis
niloticus) pemberian probiotik Bacillus NP5R serta prebiotik oligosakarida,
menunjukan adanya korelasi peningkatan hematokrit dengan eritrosit serta hemoglobin. Pola penurunan kadar hematokrit perlakuan yang diinjeksikan
Aeromonas hydrophilla pada ikan patin (Pangasionodon hypophthalmus) ternyata
didukung pula oleh menurunnya kandungan eritrositnya pada waktu pengamatan yang sama. Hal ini diduga terjadi akibat stress akibat infeksi A. hydrophila (Eliyani 2013).
Peningkatan jumlah limfosit setelah uji tantang diduga disebabkan oleh pengaruh pemberian sinbiotik dengan dosis berbeda. Pada penelitian Pirarat et al. (2006), melaporkan bahwa terjadi peningkatan jumlah limfosit pada ikan nila
(Oreochromis niloticus) yang diberi perlakuan pakan yang ditambahkan bakteri
Lactobacillus rhamnosus GG. Kontak antara probiotik dengan sel epitel usus (Gut
Associated Lymphoid Tissue [GALT]) akan mengaktifkan sitokin sehingga
pendarahan / hemoragi (Lampiran 4), sehingga dapat mempengaruhi tingkat respons ikan terhadap stresor yang dipengaruhi oleh gejala klinis yang ditimbulkan oleh ikan tersebut. Selain itu peningkatan jumlah sel darah putih, penurunan kadar hematokrit dan peningkatan neutrofil bergantung pada jenis stres yang dialami (Martin et al. 2004).
Peningkatan jumlah tiap-tiap sel leukosit (Leukositosis) ini terkait dengan kinerja sistem imun ikan dalam mereduksi serangan patogen, dimana hal ini diakibatkan oleh stimulasi leukosit yang diperantarai oleh sitokin dan pelepasan leukosit dari sumsum tulang. Jumlah tiap-tiap jenis leukosit (neutrofil, monosit, limfosit) dalam sirkulasi darah terbatas, akan tetapi dapat meningkat jika terjadi peradangan akibat infeksi (Sylvia 2002). Peningkatan nilai leukosit pada perlakuan sinbiotik pada ikan patin (Pangasionodon hypophthalamus) pasca
infeksi A. hydrophila ditandai dengan peningkatan jumlah leukosit yang
meningkat akibat efek pertahanan tubuh non-spesifiknya yakni leukosit (Eliyani 2013). Rawling et al. (2012) menyatakan bahwa leukosit memegang peranan penting dalam sistem imun bawaan ikan dan tingkat keberadaanya dapat dijadikan sebagai bio-indikator status kesehatan ikan. Sel-sel yang pertama kali diproduksi dan meningkat dalam jumlah besar pada peradangan adalah neutrofil (Sylvia 2002). Neutrofil berperan dalam masalah fagositik sel patogen sebagaimana yang dilakukan monosit (Giri et al. 2012). Menurut Robert (2001) apabila terjadi infeksi oleh bakteri, monosit dapat meningkat dalam waktu yang singkat sekitar 48 jam. Eliyani (2013) juga menjelaskan peningkatan jumlah monosit pasca infeksi A. hydrophila diduga terjadi karena terkait dengan peran monosit sebagai makrofag yaitu sel fagosit utama untuk menghancurkan partikel asing dan
jaringan yang mati. Kemudian Dusan et al. (2006) menyatakan bahwa pemberian
immunomodulator berupa β-Glucan pada ikan fathead minnows (Pimephales
promelas) dapat meningkatkan fungsi neutrofil. Neutrofil merupakan jenis
leukosit yang pertama meninggalkan pembuluh darah karena mengandung vakuola yang berisi enzim dan digunakan untuk menghancurkan bakteri yang difagositnya (Eliyani 2013). Peningkatan trombosit dapat menyebabkan gejala klinis munculnya hemoragi dan tukak (Lampiran 4), karena trombosit diproduksi agar darah membeku guna mencegah pendarahan lebih banyak (Angka et al. 2004).
5. KESIMPULAN
DAFTAR PUSTAKA
Ai Q, Xu H, Mai KS, Xu W, Wang J, Zhang WB. 2011. Effect of dietary supplementation of Bacillus subtilis and fructooligosaccharide on growth performance, survival, non-specific immune response and disease resistance of juvenile large yellow croaker, Larimichthys crocea. Aquaculture 317: 155-161.
Amlacher E. 1970. Fish Disease. DA Conroy, RL Herman, Penerjemah. New York : TFH Publ. Neptune. pp 302 .
Anderson, DP. 1974. Fish Immunology. TFH Publication.Ltd.Hongkong. p.239
Anderson DP, Siwicki AK. 1993. Basic haematology and serology for fish health
programs. Paper presented in second symposium on diseases in Asian
Aquacultureo“AquaticoAnimaloHealthoandotheoEvironment”.oPhuket, Thailand.25-29 th October. 17 hlm.
Angka SL, Priosoeryanto BP, Lay BW, Harris E. 2004. Penyakit Motile
Aeromonad septicemia Pada ikan lele Dumbo. Forum Pascasarjana, 27:
339-350.
Apriyantono, A., Fardiaz, D., Puspitasari, N.L., Sedarnawati, Budiyanto, S. 1989.
Petunjuk Laboratorium Analisis Pangan. IPB Press. Bogor.
Austin B dan Austin D. 2007. Bacterial fish pathogens: diseases of farmed and
wild fish, 4 ed., Chichester: Springer.
Austin B, Austin D, Sutherland R, ThompsonF, and Swings J. 2005. Pathogenicity of vibrios to rainbow trout (Oncorhynchus mykiss, Walbaum) and Artemia nauplii. Environmental Microbiology 1, 1488-1495.
Balcazar JL, Ignacio DB, Imanol RZ, David C, aniel V, and Jose LM. 2006. The role of probiotics in aquaculture. Veterinary Microbiology 114, 173-186. Balasch C, Mackenzie S. 2003. Fish immune system. A cross roads between
innate and adaptive responses. Revisi. Vol. 22 / Núm 3/ Julio-Septiembre. Department of Cell Biology, Physiology and Immunology, Universitat Autónoma de Barcelona, Bellaterra, Spain.
Blaxhall PC, Daisley KW. 1973. Routine haematological methods for use with o o fish blood. J. Fish Biology 5:577-581.
Bratawiddjaja KG. 2006. Imunologi Dasar. Edisi keenam. Balai Penerbitan Fakultas Kedokteran Universitas Indonesia. Jakarta.
Cerezuela R, Meseguer J, Esteban MA. 2011. Current Knowledge in Synbiotic
Use for Fish Aquaculture: A Review. J Aquac Res Development
S1:008.doi:10.4172/2155-9546.S1-008
Delgado GTC, Tamashiro, Wirla M. Silva Cunha, Marostica Junior MR, Moreno YMF, Pastore, Glaucia Maria. 2011. The putative effects of prebiotics as
immunomodulatory agents. Food Research International 44:3167-3173.
Dusan Palic, Claire B. Andreasen, Dawn M. Herolt, Bruce W. Menzel, James A. Roth. 2006. Immunomodulatory effects of β-glucan on neutrophil function
in fathead minnows (Pimephales promelas Rafinesque, 1820). Development
& Comprative Immunology 30 : 817-830.
Ellis, AE. 1989. The Immunology of Teleost. P. 135-152. In: Robert, RJ, (ed). Fish Patology. London. Bailliere Tindall
yang diinfeksi Aeromonas hydrophila. Tesis. Bogor. Sekolah Pascasarjana. InstitutoPertanianoBogor. [FAO] Food Agriculture Organization of the United Nations. 2007. FAO
Technical Meeting on Prebiotics. www.fao.org/ag/agn/agns/index_en.stm. Diakses tanggal [19 April 2007]
Giri SS, Sen SS and Sukumaran V. 2012. Effects of dietary supplementation of o
potential probiotic Pseudomonas aeruginosa VSG-2 on the innate o immunity and disease resistance of tropical freshwater fish, Labeo rohita.
O Fish & Shellfish Immunology 32: 1135-1140.
Huisman EA. 1987. Principles of fish production. Department of Fish Culture and Fisheries,oWaganingenoAgricultureoUniversity.oWaganingen.oNetherland. 170p.
Hamed N., Susan J., Reza I. 2012, Effect of synbiotics (Biomin imbo) on fecundity and Reproductive Factors of Zebrafish (Danio rerio). World
Journal of Fish and Marine Sciences 4 (1): 65-67.
Hilman, Robert S, Ault, Kenneth A, Rinder, Henry M. 2005. Hematologyini prebiotic (Saccharomyces cerevisiae) and acidifier on growth parameters in
grower‟s rainbow trout (Oncorhynchus mykiss). Annals of Biological
Research (5) :2053-2057.
Johnny, F. Dan Roza D. 2002. Kejadian Penyakit pada budidaya ikan kerapu dan
upaya pengendaliannya. Laporan hasil penelitian Balai besar riset perikanan
Budidaya Laut Gondol, Bali. 14 hal.
Katarzyna R, Alina K 2010, Probiotics Properties of Yeast Isolated from Chicken Feces and Kefirs. Polish Journal of Microbiology 59(4): 257-263.
KKP. 2013. KKP: Produk Budidaya Laut Diminati Pasar Ekspor [Internet]. [diunduho2013oJunio11].oTersediaopadao:ohttp://www.kkp.go.id/index.ph
p/arsip/c/9248/KKP-Produk-Budidaya-oLaut-Diminati-Pasar-Ekspor/.
Li JQ, Tan BP, Mai KS. 2009. Dietary probiotic Bacillus OJ and
isomaltooligosaccharides influence the intestine microbial populations, immune responses and resistance to white spot syndrome virus in shrimp
(Litopenaeus vannamei). Aquaculture 291: 35–40.
Liu CH dan Chen CJ. 2004. Effect of ammonia on the immune response of white
o shrimp Litopenaeus vannamei and it‟s susceptibility to Vibrio
ooooooalginolyticus.oFishoandoShellfishoImmunologyo16:321-334. Lv-yun Zhu, Li Nie, Guan Zhu, Li-xin Xiang, Jian-zhong Shao. 2013. Advances
o (Osteichthyes:oSyngnathidae)oinoBrazil,oBraz.oJ.oBiol.o70. Martin ML, Namura DT, Miyazaki DM, Pilarsky F, Ribero K, De castro MP, De
o campos CM. 2004. Physiological and haemotological response of o
Oreochromis niloticus exposed to single and consecutive strees of capture.
O Animaloscienceo449-456.
Manning TS, Rastall R, Gibson G. 2004. Prebiotics and Lactic Acid Bacteria. Di o dalam:oSalminenoS,oWrightoAV,oOuwehandoA,oeditor.oLacticoAcid o
Immunomodulatory Effects of Some Probiotics on Cultured Oreochromis o niloticus. 8th International Symposium on Tilapia in Aquaculture 2008 : o
1054-1056.
Muchtadi, D. 1989. Evaluasi Nilai Gizi Pangan. Depdikbud. Ditjen Dikti-PAU o
IPB.oBogor. Pirarat N, Kobayashi T, Katagiri T, Maita M, Endo M. 2006. Protective effects o
and mechanisms of a probiotic bacterium Lactobacillus rhamnosus against
o experimental Edwardsiella tarda Infection in tilapia (Oreochromis o
niloticus). Veterin Immunol Immunopat 113: 339-347.
Putra AN. 2010. Kajian probiotik, prebiotik dan sinbiotik untuk meningkatkano
kinerja pertumbuhan ikan nila (Oreochromis niloticus) [tesis]. Bogor: o
SekolahoPascasarjana,oInstitutoPertanianoBogor. Rawling MD, Merrifield DL, Snellgrove DL, Kuhlwein H, Adams A and Davies
o SJ. 2012. Haemato-immunological and growth respone of mirror carp
o (Cyprinus carpio) fed a tropical earthworm meal in experimental diets.
O Fisho&oShelloFishoImmunology.o32:o1002-1007.
Rebekkah S, Nagalakshmi R, Ramesh S, 2010. Scaleup and media of protease by
o Vibriooalginolyticus.oJ.oEcobiotechnol.o2(2):o17-25.
Ringo E, Olsen RE, Gifstad TO, Dalmo RA, Amlund H, Hemre GI. 2010. O Prebiotics in aquaculture: a review. Aquaculture Nutrition 16(2), 117-136. Rastall RA. 2005. Mini Review: Modulation of the microbial ecology of the o
human colon by prebiotics, prebiotics and synbiotics to enhance human o
health: An overview of enabling science and potential applications.FEMS
o MicrobiologyoEcologyo52:145-152.
Roberts RJ. 2001. Fish Pathology 3rd ed. Toronto:WB Saunders. hlm 25-30. Salar M, Michael H, Mohammad FV, Azam SHZ, Fakhrie SM, Seyes AH. 2012.
O Effect of Synbiotic (Biomin imbo) on growth Performance and Survival o
Rate of Texas Cichild (Herichthys cyanoguttatus) Larvae. Global o
Veterinariao9o(3):o358-361,o2012.
SIDATIK KKP. 2014. Jumlah Produksi Budidaya Laut menurut jenis ikan dan Provinsi.o10oFebruario2014. Sylvia AP, Lorraine MW. 2002. Patofisiologi : Konsep Klinis Proses-Proses o
Penyakit. Huriawati H, Penerjemah; Brahm U, Huriawati H, Pita W, Dewi
o AM,oeditor.oEGCo:oPenerbitobukuokedokteran.oTerjemahanodari:
Tissier H. 2001 Taxonomy and ecology of bifidobacteria microflora. American o Societyoforocliniconutrition.
Tanbiyaskur. 2011. Efektivitas pemberian probiotik, prebiotik, dan sinbiotik
o melalui pakan untuk pengendalian infeksi Streptococcus agalactiae pada
o ikanonilao(Oreochromisoniloticus)o[tesis].oBogor:oSekolah Pascasarjana, Verschure L, Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotic Bacteria as
o Biological Control Agents in Aquaculture. Microbiological and Molecular
o Biologyo64:655-671.
Wang, Jian-Zhong H. 2007. The role of probiotic cell wall hydrophobicity in o bioremediationoofoaquaculture.oAquacultureo269o:o349-354.
Wedemeyer GA dan WT Yasutake.1977. Clinical Methods For the Assessement o
Of The Effect Environmental Stress On Fish Health. Technical Papers Of
o The U.S. Fish and Wildfield Service. US. Depart. Of the Interior Fish and o
WildlifeoService.o89:1-17. Weese JS 2002. Probiotics, prebiotics, and synbiotics. J. Of Equine Veterinary o
Scienceo22o(8)o:o357-360.
Wlodzimierz G, Anna O, Anna S. 2005. Probiotics, prebiotics and antioxidants as
o functinal foods. Acta Biochimica Polonica (ABP) 52 (3) : 665-671. Yanuhar U. Development of Vaccine based on Receptor Peptide of Grouper
o recognizing Antigen as Transgenic Antibody for Preparing Preeminent
Seed. Research Report. Ministry of Research and Technology. 2009. O Unpublished. Yunzhang S, Hongliang Y, Zechun L, Jianbo C, Jidan Y 2009. Gut microbiota of
o fast and slow growing grouper Epinephelus coioides. African Journal of
o microbiologyoresearcho3(11):o713-720.
Zhang J, Liu Y, Tian L, Yang H, Liang G, Xu D. 2012. Effect of dietary mannan
o oligosaccharide on growth performance, gut morphology and stress tolerance of
o juveniel Pacific white shrimp, Litopenaeus vannamei. Fish and Shellfish o Imunologyo(xxx):o1-6.
Zheng L, Chen H, Han X, Lin W, Yan X. 2005. Antimicrobial screening and
o active compound isolation from marine bacterium NJ6-3-1 associated with
o the sponse Hymeniacidonperleve. World journal of Microbiology &o
BiotechnologyoK21:o201-206.
Lampiran 1 Prosedur pembuatan media kultur bakteri
a.ooMediaoSeaoWateroCompleteo(SWC)
o Media SWC digunakan untuk kultur bakteri air laut. Komposisi bahan
media SWC per 100 ml terdiri dari bacto pepton 0,5 g, bacto agar 1,7 g, yeast
extract 0,1 g, gliserol 0,1 ml, aquades 25 ml, air laut 75 ml. Semua bahan-bahan
tersebut dicampurkan dan dihomogenkan pada penangas air atau water bath bersuhu 100 oC, lalu disterilkan pada suhu 121 oC selama 15 menit, media SWC yang sudah steril dibiarkan hingga tidak terlalu panas (hangat), kemudian dituang
kedalam cawan petri steril. Untuk pembuatan media cair SWC, bacto agar tidak
ditambahkan kedalam media.
b.ooPhosfatoBufferoSalineo(PBS)
o Media PBS dibuat dengan mencampurkan NaCl 0,8 g, KH2PO4 0,2 g,
Na2HPO41,5 g, KCl 0,2 g dan aquades 1000 ml. Bahan- bahan tersebut
dihomogenkan pada penangas air dengan suhu 100 oC, lalu disterilkan pada suhu