PENENTUAN KUALITAS ALUMINIUM INGOT DENGAN
PENGUKURAN KADAR Fe, Si DAN Cu, MENGGUNAKAN
OPTICAL EMISSION SPECTROMETER
SKRIPSI
ANDIKA PUTRA
100822027
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA MEDAN
PENENTUAN KUALITAS ALUMINIUM INGOT DENGAN
PENGUKURAN KADAR Fe, Si DAN Cu, MENGGUNAKAN
OPTICAL EMISSION SPECTROMETER
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ANDIKA PUTRA
100822027
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA MEDAN
PERSETUJUAN
Judul : PENENTUAN KUALITAS ALUMINIUM INGOT DENGAN PENGUKURAN KADAR Fe, Si DAN Cu, MENGGUNAKAN OPTICAL EMISSION SPECTROMETER
Kategori : SKRIPSI
Nama : ANDIKA PUTRA
Nomor Induk Mahasiswa : 100822027
Program Studi : SARJANA (S1)KIMIA Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, Juli 2012
Dosen Pembimbing II Dosen Pembimbing I
Prof.Dr.Harry Agusnar,M. Sc,M.Phill Prof.Dr.Zul Alfian,Msc
NIP. 195308171983031002 NIP. 195504051983031002
Diketahui / Disetujui oleh:
Ketua Departemen Kimia FMIPA USU
PERNYATAAN
PENENTUAN KUALITAS ALUMINIUM INGOT DENGAN PENGUKURAN KADAR Fe, Si DAN Cu, MENGGUNAKAN OPTICAL
EMISSION SPECTROMETER
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2012
PENGHARGAAN
Puji dan syukur ke hadirat Allah SWT, karena berkat rahmat dan karunia-Nya tugas akhir ini telah selesai disusun dalam rangka memenuhi kewajiban penulis sebagai salah satu syarat memperoleh gelar Sarjana Fakultas Matematika dan Ilmu Pengetahuan Alam di Universitas Sumatera Utara. Shalawat beriring salam penulis kirimkan kepada Nabi Muhammad SAW beserta keluarga dan para sahabat beliau.
Dalam penulisan tugas akhir ini penulis ingin mengucapkan rasa hormat dan terima kasih yang tak terhingga kepada ibunda Rosvinawati dan ayahanda tercinta Alm.Suman , dan keuarga yang sangat dukungan baik moril maupun materil, pengorbanan,serta doa tulus tiada hentinya demi kebaikan dan kebahagian penulis.
Selain itu penulis juga ingin megucapkan terima kasih yang sebesar-besarnya kepada:
1. Prof. Dr.Zul Alfian.M.Sc selaku pembimbing 1 yang telah banyak memberikan pengarahan dan bimbingan hingga terselesaikannya skripsi ini.
2. Prof. Dr. Harry Agusnar,M.Sc, M.Phill selaku dosen pembimbing 2 yang telah memberikan saran hingga terselesaikannya penelitian ini.
3. Dr. Rumondang Bulan. MS dan Dr. Darwin Yunus, MS selaku Ketua dan Koordinator Departemen Kimia Ekstensi FMIPA USU.
4. Bapak dan Ibu Dosen yang telah memberikan ilmunya selama masa studi saya di FMIPA USU.
5. Teman-teman seperjuangan saya satu stambuk 2010 yang tidaklah dapat saya sebutkan satu per satu namanya, namun sungguh sangat berkesan. 6. Serta segala pihak yang telah membantu saya menyelesaikan skripsi ini.
Untuk itu semua, semoga Allah membalasnya dengan segala yang terbaik. Amin.
Saya menyadari bahwa skripsi ini masih banyak kekurangan, karena keterbatasan saya baik dalam literatur maupun pengetahuan. Oleh karena itu, saya mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini, dan semoga skripsi ini bermanfaat bagi kita semua.
Medan, Juli 2012
ABSTRAK
Dari hasil penelitian didapati : untuk aluminium yang pertama memiliki kemurnian Al= 99,81% (Fe 0,1445%, Si 0,0473% dan Cu 0,0003%), aluminium yang kedua memiliki kemurnian Al = 99.92 % (Fe 0,0521%, Si 0,0335% dan Cu 0,0002%), aluminium yang ketiga dengan kemurnian Al = 99.81 % (Fe 0,1475%, Si 0,0442% dan Cu 0,0002%), aluminium yang keempat dengan kemurnian Al = 99.91% (Fe 0,0463%, Si 0,0373% dan Cu = 0,0001%), aluminium yang kelima dengan kemurnian Al = 99.82 % (Fe 0,1406%, Si 0,0421% dan Cu 0,0003%), aluminium yang ke enam dengan kemurnian Al = 99.81 % (Fe 0,1511%, Si 0,0504% dan Cu 0,0003%)
DETERMINATION OF ALUMINIUM INGOT QUALITY BY MEASURING LEVELS OF Fe, Si AND Cu USING EMISSION
SPECTROMETRY.
Abstract
DAFTAR ISI
1.6. Lokasi Penelitian dan Pengambilan Sampel 3 1.7. Metodologi Penelitian 3 BAB 2 TINJAUAN PUSTAKA 2.1. Aluminium 43.3. Prosedur Penelitian 17
3.3.1 Preparasi Sampel 18
3.3.2 Pengukuran Sampel Product Metal 20 3.4. Bagan Proses Aluminium Ingot
BAB 4 HASIL DAN PEMBAHASAN
4.1. Perhitungan 21
4.1.1 Pengukuran konsentrasi Fe 21
4.1.2 Pengukuran konsentrasi Si 24
4.1.3 Pengukuran konsentrasi Cu 27
4.1.4 Perhitungan kemurnian aluminium 30
4.2 Pembahasan 31
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 33
5.2. Saran 33
DAFTAR TABEL
Halaman
Tabel 2.1. Standar Kualitas Aluminium Ingot Sesuai JIS 11
Tabel 2.2. Teknik Dasar Spektrometry Atom 14
Tabel 4.1. Data Pengukuran Standar Fe 23
Tabel 4.2. Penurunan persamaan garis regresi Fe 25 Tabel 4.3. Penentuan konsentrasi Fe pada sampel 25
Tabel 4.4. Data Pengukuran Standar Si 26
Tabel 4.5. Penurunan persamaan garis regresi Si 27 Tabel 4.6. Penentuan konsentrasi Si pada sampel 28
Tabel 4.7. Data Pengukuran Standar Cu 29
Tabel 4.8. Penurunan persamaan garis regresi Cu 30 Tabel 4.9. Penentuan konsentrasi Cu pada sampel 31
Tabel 4.10.Penentuan kemurnian aluminium 32
DAFTAR GAMBAR
Halaman
Gambar 3.4. Bagan proses analisa 22
ABSTRAK
Dari hasil penelitian didapati : untuk aluminium yang pertama memiliki kemurnian Al= 99,81% (Fe 0,1445%, Si 0,0473% dan Cu 0,0003%), aluminium yang kedua memiliki kemurnian Al = 99.92 % (Fe 0,0521%, Si 0,0335% dan Cu 0,0002%), aluminium yang ketiga dengan kemurnian Al = 99.81 % (Fe 0,1475%, Si 0,0442% dan Cu 0,0002%), aluminium yang keempat dengan kemurnian Al = 99.91% (Fe 0,0463%, Si 0,0373% dan Cu = 0,0001%), aluminium yang kelima dengan kemurnian Al = 99.82 % (Fe 0,1406%, Si 0,0421% dan Cu 0,0003%), aluminium yang ke enam dengan kemurnian Al = 99.81 % (Fe 0,1511%, Si 0,0504% dan Cu 0,0003%)
DETERMINATION OF ALUMINIUM INGOT QUALITY BY MEASURING LEVELS OF Fe, Si AND Cu USING EMISSION
SPECTROMETRY.
Abstract
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Aluminium adalah unsur kimia dengan lambang Al dan memiliki nomor atom 13, aluminium merupakan logam yang paling berlimpah dan unsur paling melimpah ketiga dalam kerak bumi, setelah oksigen dan silikon, element ini sekitar 8% berat dari permukaan padat bumi, aluminium merupakan konduktor terang dan kuat dan merupakan konduktor yang baik juga buat panas, dapat ditempa menjadi lembaran/lempengan, ditarik menjadi kawat dan d menjadi batangan dengan bermacam-macam penampang, tahan (Wikipedia,2012)
Bahan baku utama pembuatan aluminium adalah alumina dan karbon, alumina diperoleh dari pengolahan biji bauksid melalui proses bayer, reaksi keseluruhan pada industri elektrolisis alumina dengan menggunakan anoda karbon adalah sebagai berikut:
2 Al2O3 (l) + 3 C (s) 4 Al (l) + 3 CO2 (g)
reaksi ini berlangsung pada temperatur sekitar 977°C, beda potensial 1,18 volt.
Pada proses pembuatan aluminium, kualitas aluminium harus sangat di jaga, dalam proses produksi aluminium, logam Fe, Si dan Cu adalah salah satu element terpenting yang harus di kontrol, dikarenakan element ini sangat berpengaruh besar terhadap kemurnian aluminium tersebut, selain faktor bahan baku, peningkatan kadar konsentrasi element ini dapat juga terjadi akibat proses produksi. (Modul pelatihan,2003)
atau pun secara elektrikal mengakibatkan elektron berada pada energi tertinggi (E2) , elektron ini cenderung kembali kekeadaan dasar (E1) ketika elektron kembali ke keadaan dasar (stabil), energi dipancarkan dan energi itu sama dengan perbedaan energi antara keadaan dasar dan keadaan tereksitasi, Pengukuran konsentrasi elemen dapat dilihat dari hubungan linearitas antara intensitas radiasi dengan konsentrasi unsur yang diperoleh dari kurva kalibrasi. (Twyman R.M, 2005)
Berdasarkan latar belakang tersebut peneliti tertarik membuat judul “Penentuan kualitas Aluminium Ingot dengan menghitung kadar Fe, Si dan Cu Menggunakan Spektrometer Emisi”.
1.2. Perumusan Masalah
Berdasarkan pertimbangan tersebut diatas, dapat dirumuskan masalah sebagai berikut:
- dengan pengukuran kadar Fe, Si, dan Cu apakah aluminium Ingot yang dianalisa memiliki kualitas yang baik.
- apakah aluminium ingot sesuai dengan Standar Industri jepang (JIS).
1.3. Pembatasan Masalah
1.4. Tujuan Penelitian
Untuk mengetahui konsentrasi Fe, Si dan Cu dalam aluminium ingot, mengetahui kualitas kemurnian aluminium ingot dan mengetahui kualitas grade aluminium ingot sesuai dengan standar industri jepang (JIS).
1.5. Manfaat Penelitian
Memberikan informasi mengenai kemurnian aluminium ingot yang dihasilkan dengan cara mengetahui kualitas grade aluminium ingot, sesuai dengan standar industri jepang (JIS), dan juga mengetahui konsentrasi Fe, Si dan Cu dalam aluminium ingot.
1.6. Lokasi Penelitian dan Pengambilan Sampel
- Sampel diambil dari pencetakan produksi aluminium ingot yang di lakukan di Smelter Casting PT.Inalum.
- Sampel dianalisa di laboratorium PT.Inalum (SQA).
1.7. Metodologi Penelitian
- Sampel yang digunakan adalah sampel Aluminium Ingot.
- Penentuan kadar ion Besi (Fe), Silika (Si) dan Cuprum (Cu) pada sampel, di ukur menggunakan alat Spektrometer emisi.
BAB 2
TINJAUAN PUSTAKA
2.1 ALUMINIUM
Aluminium ialah unsur kimia dengan lambang Al dan nomor atomnya 13, aluminium adalah logam yang paling berlimpah dan unsur paling melimpah ketiga dalam kerak bumi, setelah oksigen dan silikon sekitar 8% berat dari permukaan padat bumi, aluminium terlalu reaktif secara kimia terjadi secara alami sebagai logam bebas, sebaliknya, ditemukan dikombinasikan dalam lebih dari 270 mineral yang berbeda, bijih utama dari aluminium adalah bauksit, campuran aluminium oksida terhidrasi dan oksida besi terhidrasi.
2.1.1 Karakteristik dan Kegunaannya.
Aluminium adalah logam non besi paling banyak digunakan, aluminium hampir selalu berbentuk paduan, dan dapat meningkatkan sifat mekanik, terutama ketika diperlembut, sebagai contoh, aluminium foil umum dan kaleng minuman adalah paduan dari 92% sampai 99% aluminium, paduan utama tembaga, seng, magnesium, mangan, dan silikon dan tingkat logam lainnya berada dalam kisaran beberapa persen berat, adapun kegunaan logam aluminium adalah : - Transportasi (mobil, pesawat, truk, mobil kereta api, kapal laut, sepeda),
- Listrik jalur transmisi untuk distribusi listrik baja dan magnet super kemurnian aluminium (99,980% sampai 99,999% ), yang digunakan dalam elektronik dan compact disc (CD), heat sink untuk peralatan elektronik seperti transistor dan central processing unit (CPU), media material logam tembaga inti terbungkus laminasi digunakan dalam kecerahan tinggi pencahayaan Ligh Emitting diodes (LED). bubuk aluminium digunakan dalam cat, dan kembang api seperti bahan bakar roket padat dan termit, aluminium dapat direaksikan dengan asam klorida atau dengan sodium hidroksida untuk menghasilkan gas hidrogen.
- Untuk koin berbagai negara, termasuk Perancis, Italia, Polandia, Finlandia, Rumania, Israel, dan bekas Yugoslavia, telah mengeluarkan paduan aluminium atau aluminium-tembaga, beberapa model gitar olahraga aluminium berlian piring pada permukaan instrumen, biasanya baik krom atau hitam, kramer guitars dan travis bean keduanya dikenal karena telah menghasilkan gitar dengan leher yang terbuat dari aluminium, yang memberikan instrumen suara yang sangat berbeda.
(Wikipedia,2012)
2.1.2. Sejarah Aluminium
Pada jaman yunani kuno dan romawi, garam aluminium digunakan sebagai untuk membalut luka, dimana alumina masih digunakan sebagai obat penahan darah, pada 1761, Guyton de Morveau menyarankan untuk menggunakan alumine dasar, pada 1808, Humphry Davy mengidentifikasi adanya logam aluminium, lalu logam ini pertama kali diproduksi pada tahun 1825 dalam bentuk yang tidak murni oleh fisikawan Denmark Hans Christian dan ahli kimia Orsted, reaksinya aluminium klorida anhidrat dengan campuran potasium, menghasilkan gumpalan logam tampak mirip dengan timah.
kalium murni, dia melakukan percobaan serupa pada tahun 1827 dengan aluminium klorida anhidrat, pencampuran dengan kalium dan menghasilkan aluminium. wohler biasanya dibuat dengan mengisolasi aluminium (latin alumen), tetapi juga Orsted dapat terdaftar sebagai penemunya, selanjutnya Pierre Berthier menemukan aluminium dalam bijih bauksit dan berhasil memprosesnya.
Prancis Henri Etienne Sainte-Claire Deville memperbaiki metode Wohler di 1846, dan menggambarkan perbaikan dalam sebuah buku pada tahun 1859, Deville mungkin juga dipahami ide tentang elektrolisis dari aluminium oksida terlarut dalam cryolite, Charles Martin Hall dan Paul Heroult telah mengembangkan proses yang lebih praktis setelah Deville, sebelum proses Hall-Heroult dikembangkan pada akhir 1880-an, aluminium adalah sangat sulit untuk diekstrak dari berbagai bijih alumina, pada masa itu aluminium murni lebih berharga dari pada emas, sebuah bar dari aluminium yang dipamerkan di Exposition Universelle dari 1855 Napoleon III dari Perancis untuk jamuan di mana para tamu yang paling dihormati diberi peralatan aluminium, sedangkan yang lain dibuat dengan emas.
Proses Heroult dikembangkan pada 1889 di Swiss pada Aluminium Industri, sekarang Alcan, dan di Inggris Aluminium, sekarang Luxfer Group dan Alcoa.
Pada 1888 Karl Joseph Bayer, seorang ahli kimia Austria, mengembangkan dan mematenkan metode untuk memisahkan alumina dari boxite, Saat ini, proses Bayer adalah metode dominan di seluruh dunia untuk produksi alumina, pada dasarnya, proses bayer terdiri dari empat tahap :
konsentrasi lain dari bauksit tidak larut dan dengan demikian memicu pada bagian bawah tangki karena lumpur merah.
2. pemisahan dari lumpur : alkali di atas lumpur merah disaring dan dipompa ke tangki dekomposisi.
3. Dekomposisi: alkali yang didinginkan dengan sekitar 60'C dan diaduk terus-menerus, dengan demikian, alumina trihydrate padat presipitat.
4. calsination: kalsinasi dalam fluidized bed pembakaran hidrat alumina tergantung di udara terkompresi, pada sekitar 1300'C air kristalisasi akan dihapus untuk meninggalkan alumina dengan kurang dari 0,1% kotoran dalam bentuk struktural sesuai untuk produksi elektrolitik dari aluminium.
2.2. PEMBUATAN ALUMINIUM
Bahan baku utama pembuatan aluminium adalah alumina dan karbon, alumina diperoleh dari pengolahan biji bauksid melalui proses bayer, reaksi keseluruhan pada industri elektrolisis alumina dengan menggunakan anoda karbon adalah sebagai berikut:
2 Al2O3 (l) + 3 C (s) 4 Al (l) + 3 CO2 (g)
reaksi ini berlangsung pada temperatur sekitar 977°C, beda potensial 1,18 volt. (Module Pelatihan, 2003).
Pembuatan aluminium harus dikontrol, masalah yang sering dihadapi dalam menjaga kualitas aluminium ingot ada pada saat proses produksi, mematikan pot dilakukan bila kondisi pot sudah memburuk dan tidak memungkinkan untuk dioperasikan lagi, tanda-tanda pot reduksi mulai memburuk diantaranya :
- Kadar Fe atau Si dalam metal cair naik dan tidak bisa diturunkan kembali, bila blok katoda retak atau berlubang, baja kolektor bar di bawah block katoda dapat tererosi dan larut di dalam metal cair, menyebabkan kandungan Fe di dalam metal cair naik.
aluminium naik, menyebabkan kualitas metal yang dihasilkan turun, bila erosi dan lubang yang terjadi ini tidak bisa ditanggulangi dengan baik, pot bisa mengalami kebocoran.
Aluminium membentuk ikatan kimia yang kuat dengan oksigen, dibandingkan dengan logam lainnya, sulit untuk mengekstrak dari bijih, seperti bauksit, karena reaktivitas aluminium yang sangat tinggi dan titik leleh tinggi dari sebagian besar bijih tersebut, sebagai contoh, reduksi langsung dengan karbon, seperti yang digunakan untuk menghasilkan besi, bukan kimiawi dimungkinkan karena aluminium adalah bahan pereduksi kuat dari karbon, langsung carbothermic pengurangan dapat dilakukan dengan menggunakan karbon dan Al2O3, ini lebih lanjut dapat menghasilkan logam aluminium pada suhu 1900-2000
° C.
Proses ini masih dalam pengembangan, tetapi membutuhkan lebih sedikit energi dan menghasilkan lebih sedikit CO2 dari proses Hall-Heroult, proses
industri utama untuk ekstraksi aluminium, peleburan alumina elektrolit awalnya biaya terlalu sebagian karena titik lebur tinggi, alumina, atau aluminium oksida, (sekitar 2.000 ° C (3,600 ° F)), banyak mineral, bagaimanapun, akan larut ke dalam mineral sudah cair kedua, bahkan jika suhu mencair secara signifikan lebih rendah dari titik leleh mineral pertama.
Cryolite Molten ditemukan untuk melarutkan alumina pada temperatur spesifik lebih rendah dari titik leleh alumina murni tanpa mengganggu dalam proses peleburan, Dalam proses Hall-Heroult, alumina pertama dilarutkan dalam cryolite cair dengan kalsium fluorida dan kemudian dikurangi menjadi electolytically aluminium pada suhu antara 950 dan 980 ° C (1.740 sampai 1.800 ° F). Cryolite adalah senyawa kimia dari aluminium dan natrium fluorida: (Na3AlF6). Meskipun cryolite ditemukan sebagai mineral di Greenland, bentuk
Jadi dibandingkan dengan semua logam lain, aluminium menunjukkan keuntungan yang signifikan melalui penghematan energi selama proses, aplikasi dan daur ulang, oleh karena itu, aluminium telah menjadi alternatif serius untuk logam struktural klasik untuk aplikasi di bidang bangunan dan konstruksi, transportasi, wadah dan kemasan, karakteristik lain yang menarik dari aluminium adalah konduktivitas yang baik listriknya, dibandingkan berdasarkan berat itu lebih unggul semua logam lainnya, karena tidak dapat magnet, aluminium banyak digunakan dalam konduktivitas, membuatnya dalam bahan yang ideal untuk enginer dan penukar panas. (Shakhashiri,2008)
Bahan baku utama untuk bahan untuk produksi industri aluminium disebut bauksit, dinamai desa Les Baux di selatan Perancis, pada 1822 para Berthier Prancis menemukan ada mineral kemerahan yang mengandung sekitar 50% aluminium oksida (yang disebut sebagai alumina), bauksit dapat ditemukan di setiap benua, terutama di daerah tropis dan dekat dengan permukaan tanah, sumber daya terbesar, yang secara ekonomi menarik, terletak di Guinea dan Australia, pertambangan tahunan saat ini 80-100 juta ton tetap konstan.
2.3 Standar kualitas aluminium
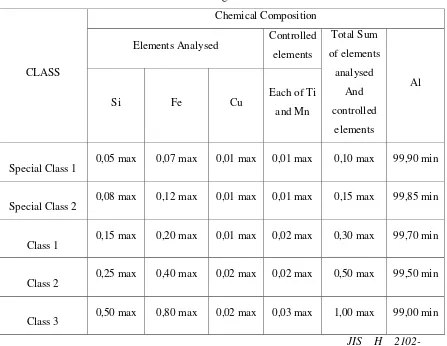
Cakupan : standar ini digunakan untuk kemurnian aluminium Ingot, yang disebut sebagai “Ingot”.
Clasifikasi : ingot dibagi menjadi lima kelas sesuai dengan komposisi kimia, seperti yang ditunjukan pada tabel standar industri jepang.
Kualitas ingot harus seragam, bebas dari pengotor di permukaan dan tidak mengandung kerak yang merugikan atau material pengotor lainnya.
Tabel 2.1 Standar Kualitas Aluminium Ingot Sesuai JIS
CLASS
Chemical Composition
Elements Analysed Controlled elements
Catatan : - nilai analisis dari silikon, besi dan tembaga harus ditunjukkan di setiap pembuatan aluminium ingot.
- control element lain harus dianalisis secara terus menerus dan tidak lebih dari 0,01% dan harus dapat ditunjukkan. (Standar Industri Jepang, 2009)
2.4. Spektroskopi Emisi Atom
merefleksikan panjang gelombang spektral yang diproduksi, sedangkan dalam kasus terakhir, intensitas radiasi yang dipancarkan berkaitan dengan konsentrasi setiap elemen, spektra atom berasal dari transisi elektron dari satu elektron orbital diskrit dalam atom yang lain, spektrum ini dapat dipahami dari segi model Bohr atom.
Dalam model Bohr, atom digambarkan sebagai nukleus dikelilingi oleh orbit elektron diskrit, setiap berhubungan dengan energi, setiap atom memiliki sejumlah orbital elektron, dan masing-masing elektron orbital memiliki tingkat energi tertentu, ketika semua elektron yang hadir dalam orbital, atom dalam bentuk paling stabil (ground state), ketika energi (baik panas, akibat tabrakan, atau radiational, hasil dari penyerapan radiasi elektromagnetik) diterapkan untuk atom dan cukup untuk mengangkat sebuah elektron dari kulit dengan energi Ei satu dengan Ej atom dikatakan dalam tereksitasi keadaan. Keadaan eksitasi tidak stabil dan terurai cepat, waktu tinggal dari tereksitasi stabil keadaan sangat pendek, dengan kisaran 10-8 s, ketika elektron kembali ke keadaan dasar stabil, energi dipancarkan dan energi itu sama dengan perbedaan energi antara keadaan dasar dan keadaan tereksitasi, energi yang dilepaskan dalam bentuk elektromagnetik radiasi dan mendefinisikan panjang gelombang transisi. Hubungan antara energi dan panjang gelombang digambarkan dengan persamaan Planck:
E = Ej – Ei = hv = hc/λ
Dimana Ej – Ei adalah perubahan energy antara kedua level ( Ej > Ei ), h adalah konstanta plank 6.624 x 10- 34 Js-1 , v adalah frekuensi radiasi, c adalah kecepatan cahaya dalam ruang hampa, 2.9979 x 108 ms-1. dan λ adalah panjang gelombang radiasi dalam meter.
yang sama dijelaskan untuk sebuah atom, panjang gelombang untuk radiasi yang dipancarkan karena transisi Ej- Ei adalah
λ = hc/E
dimana E adalah perbedaan energi dan λ adalah panjang gelombang radiasi yang dipancarkan. Spektrum atom tereksitasi netral dinotasikan sebagai I, dan sesuai dengan sebelumnya mereka ke keadaan dasar (garis resonansi) atau dekat dengan keadaan dasar (dekat-resonansi baris), spectra diamati di rendah energi sumber seperti api, spektrum atom terionisasi tunggal dinotasikan sebagai II, dan ini diamati dalam tinggi energi sumber seperti bunga api listrik, induktif dibarengi plasma, dan pembuangan cahaya, setiap unsur memiliki spektrum emisi karakteristik, yang adalah dasar dari analisis spektrokimia.
Spektroskopi emisi nyala (atau fotometri nyala) menyangkut pengukuran energi radiasi yang dipancarkan oleh populasi atom yang tereksitasikan, dalam spektroskopi absorpsi atomik, absorpsi energi radiasi oleh atom dalam keadaan dasar diukur, kedua metode ini untuk kemudahan sering dibahas bersama.
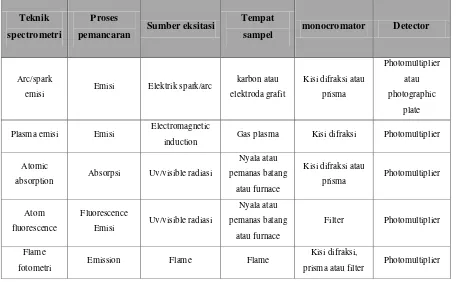
Tabel 2.2. Teknik dasar spectrometry atom
Teknik
spectrometri
Proses
pemancaran Sumber eksitasi
Tempat
sampel monocromator Detector
Arc/spark
emisi Emisi Elektrik spark/arc
karbon atau
Plasma emisi Emisi Electromagnetic
induction Gas plasma Kisi difraksi Photomultiplier
Atomic
absorption Absorpsi Uv/visible radiasi
Nyala atau
Emisi Uv/visible radiasi
Nyala atau
pemanas batang
atau furnace
Filter Photomultiplier
Flame
fotometri Emission Flame Flame
Kisi difraksi,
x-ray
Fotometri nyala merupakan suatu cabang spektroskopi emisi yaitu suatu bidang utama yang merupakan sedikit banyak segi lain dari spektrometri atau spektroskopi absorpsi, pada pelajaran absorpsi, sedikitnya untuk keperluan analisa, nasip dari bahan bahan yang tereksitasi tidaklah penting (kecuali kalau menyangkut proses yang mengganggu pengukuran absorpsi, pada spektroskopi emisi contoh tereksitasi bermacam macam, dan emisi radiasi oleh bahan tereksitasi apabila kembali ke keadaan energi yang lebih rendah diukur, Spektroskopi emisi merupakan spektroskopi atom dengan menggunakan sumber selain nyala api seperti busur listrik dan busur api, belakangan ini sumber eksitasi yang sering digunakan adalah plasma argon, metode ini bersifat spesifik dan peka, mereka memerlukan persiapan sample yang minimum, seperti sampel dapat langsung diletakkan pada sumber eksitasi, gangguan unsur unsur lain pada temperatur eksitasi lebih tinggi tidak berarti, pada saat yang sama dapat diambil spektrum dari dua unsur atau lebih. (Khopkar,2007)
Keterbatasanya adalah perekam yang dilakukan pada kertas fotografi, yang perlu dicetak dan diinterpretasi, intensitas radiasi tidak selalu reprodusible dan kesalahan relatif melebihi 1-2%, sumber eksitasi sangat berpengaruh terhadap bentuk dan intensitas emisi, selain penyediaan energi yang cukup untuk menguapkan sampel, sumber juga menyebabkan eksitasi elektronik partikel partikel dalam gas, garis spektrum kejadian yang terakhir inilah berguna untuk analisis spektroskopi emisi.
Molekul tereksitasi pada fase gas mengemisi spektrum, yaitu akibat transisi dari suatu energi tereksitasi (E2) ketingkat energi yang lebih rendah (E1)
hv = E2 - E1
atom tereksitasi atau ion monoatom pada fase gas mengemisikan spektrum garis, pengukuran dengan spektroskopi emisi dapat memungkinkan karena masing masing atom memiliki tingkat energi tertentu sesuai dengan posisi electron, pada keadaan normal, elektron elektron ini dalam keadaan dasar dengan energi terendah, penambahan energi baik secara termal ataupun elektrikal, menyebabkan satu atau lebih elektron diletakkan pada tingkat energy lebih tinggi, menjauh dari inti, elektron tereksitasi ini ternyata lebih suka kembali ketingkat dasar pada proses ini kelebihan energi dipancarkan dalam bentuk energi radiasi foton.
Oleh karena transisinya telah ditentukan letaknya dalam tingkat energi, maka bilangan gelombangnya terbatas juga, jika energi eksitasinya besar, maka demikian juga energi emisinya, intensitas garis spektrum tergantung pada transisi yang terjadi dalam suatu atom, absorpsi sendiri kadang kala menurunkan intensitas emisi, pemakaian sumber energi tinggi tidak selalu menguntungkan, karena mampu mengioniosasikan gas dan satu atau lebih elektron dapat dikeluarkan dari atom, sedangkan spektrum atom terionisasi jauh berbeda dengan spektrum atom netral. (underwood, 1981)
2.4.1. METODE EKSITASI
api tersebut antara ekeltroda, penguapan selektif dapat saja terjadi, busur api adalah sumber sensitif, terutama untuk deteksi konsentrasi rendah.
Kepekaan busur api DC dapat dinaikkan dengan suatu alat pendukung, busur api AC menggunakan beda potensial 1000 volt atau lebih, elektroda busur api diberi jarak antara 0,5-3 mm, untuk mendapatkan hasil reproduksible, jarak pemisahan antara dua elektroda, tegangan dan arus harus benar benar dikendalikan, busur api AC lebih stabil disbanding busur api DC. (Khopkar,2007)
2.4.2. Sumber Sumber nyala
Dari sumber yang biasa digunakan dengan spektroskopi emisi, maka nyala apilah yang paling sedikit energinya dengan mengeksitasi paling sedikit unsur, yaitu sekitar 50 unsur logam, akan tetapi bila dapat digunakan nyala apilah yang memiliki keuntungan yang paling banyak dibandingkan eksitasi dengan busur api atau bunga api, suatu nyala yang diatur dengan baik merupakan sumber yang jauh lebih stabil dari pada busur api atau bunga api, selanjutnya suatu spectrum emisi suatu unsur dalam nyala relative sederhana, hanya sedikit garis yang terlihat dalam spectrum busur dapat ditemukan dalam emisi nyala, hal ini dapat membuat beban jauh lebih ringan pada daya penguraian dari monokromator terhadap interferensi, berarti akan lebih mudah menemukan garis emisi untuk suatu unsur tertentu yang tidak mempu nyai garis garis dari unsur unsur yang lain sebagai tetangga dekatnya.
grating dengan liputan spectrum 220-780 nm, proses photografi digunakan untuk merekam intensitas garis masih sering dilakukan. (Sudjadi,2007).
2.4.3. TEORI KERJA ALAT
Masing masing atom memiliki tingkat energi tertentu, yang sesuai dan khas, pada keadaan normal, elektron elektron berada pada keadaan dasar, dengan energi terendah (E1). Jika elektron tersebut diberi energi, baik secara termal atau pun secara elektrikal mengakibatkan elektron berada pada energi tertinggi (E2) , elektron ini cenderung kembali kekeadaan dasar (E1) Ketika elektron kembali ke keadaan dasar (stabil), energi dipancarkan dan energi itu sama dengan perbedaan energi antara keadaan dasar dan keadaan tereksitasi. Energi yang dilepaskan dalam bentuk elektromagnetik radiasi dan mendefinisikan panjang gelombang transisi. Hubungan antara energi dan panjang gelombang digambarkan dengan persamaan Planck:
E = E2 – E1 = hv = h c/λ
Dimana E2 – E1 adalah perubahan energy antara kedua level ( E2 > E1 ), h adalah konstanta plank 6.624 x 10- 34 Js-1 , v adalah frekuensi radiasi, c adalah kecepatan cahaya dalam ruang hampa, 2.9979 x 108 ms-1. dan λ adalah panjang gelombang radiasi dalam meter.
BAB 3
METODE PENELITIAN
3.1. Bahan – Bahan.
- Sampel Aluminium Ingot (tiap sekali pencetakan 3 buah sampel)yaitu : - Sampel pertama diambil setelah ± 5 ton pencetakan berlangsung
Sampel kedua diambil setelah pertengahan pencetakan ± 15 ton Sampel ketiga diambil ± 5 ton sebelum pencetakan berakhir. - Alkohol dan Kuas Pembersih
3.2. Alat Alat
- Spektrometer emisi ARL-3460 - Mesin bubut
- Pembersih elektroda - Tisu pembersih
3.3. Prosedur Penelitian
- Sampel diambil dari funace dengan pencetak sampel.
- Sampel dipreparasi (dibubut : Sesuai Instruksi kerja Preparasi Sampel 3.3.1)
- Sampel dianalisa menggunakan Optical Emission Spektrometer (sesuai Instruksi kerja Pengukuran Sampel Produk Metal 3.3.2)
3.3.1. Preparasi Sampel
- Hidupkan power listrik mesin bubut dengan memutar switch ke posisi “ON”.
- Jepit sampel pada spindle dengan identitas sampel berada disebelah dalam spindle dan masukkan kunci socket-T ke lobang spindle, putar ke kanan hingga sampel terjepit dengan kuat dan aman.
- Geser tuas Starting lever ke kiri, maka spindle dan sampel akan berputar. - Putar Handwhell for the carriage ke kiri untuk medekatkan mata pahat
kearah sampel.
- Putar Operating handle for the cross feed ke kanan agar pergerakan mata pahat maju dan berada didaerah sampel yang akan dibubut.
- Lakukan pembubutan dari pinggir sampai ke titik tengah sampel dengan memutar Operating handle for the cross feed ke kanan dan ke kiri (pergerakan mata pahat maju dan mundur). Ulang beberapa kali hingga ketebalan ± 5 mm atau lobang pusat sampel menjadi rata dengan bekas bubutan.
- Buat lobang pada pusat sampel dengan diameter ± 3 mm dan kedalaman
± 1.5 mm.
- Geser mata pahat kepusat sampel dan masukkan kelobang setipis mungkin untuk pembubutan terakhir.
- Tarik Feed start lever keatas, otomatis mata pahat begerak mundur untuk menghaluskan permukaan sampel dan secara bersamaan basahi permukaan sampel dengan alkohol menggunakan kuas.
- Jauhkan mata pahat dari sampel dengan memutar Handwhell for the carriage ke kanan.
- Pindahkan tuas Starting lever ke kanan.
- Tekan Brake pedal dengan kaki untuk menghentikan putaran spindle. - Lepaskan sampel yang telah dibubut dari jepitan spindle, dengan
memasukkan socket T ke lobang spindle lalu putar ke kiri.
3.3.2. Pengukuran sampel Product Metal
- Pada menu utama “WinOE” klik “Production/Analysis”, lalu klik “Concentration Analysis [F2]”, kemudian klik “Change Task”. Pilih/klik “INGOT”, lalu klik “OK”.
- Pada kolom “ Casting Date “ ketik tanggal/bulan/tahun pencetakan Product Metal dengan format “DD/MM/YYYY”, Pada kolom “ Lot No.“ ketik nomor lot.
- Buka pintu chamber spark (Excitation Chamber), letakkan sampel pada meja spark dengan posisi permukaan sampel yang dibubut kearah bawah ( posisi telungkup ) kemudian pasang clamp sampel, tutup pintu chamber spark.
- Klik “Sample Details OK“ atau tekan “Enter“, nilai-nilai hasil pengukuran akan tampil pada layar komputer.
- Lakukan pekerjaan 4 untuk titik spark yang berbeda dari sampel yang sama.
- Klik “Analyse Again” atau tekan “Enter”, nilai-nilai hasil pengukuran selanjutnya akan tampil pada layar komputer. (Pengukuran 2 kali pada titik spark yang berbeda untuk setiap sampel). Bersihkan elektroda maksimal setiap 2 kali spark.
- Ulangi pekerjaan 4 dan 6 diatas untuk sampel yang lain hingga selesai 1 lot (3 buah sampel Product Metal), sehingga diperoleh 6 data hasil pengukuran.
- Setiap selesai melakukan pengukuran 1 lot (3 buah sampel Product Metal), klik “Analyse complete”, klik “Print”, klik “All Runs+Average”, maka hasil pengukuran akan dicetak pada printer dan secara otomatis data akan tersimpan di dalam HardDisk komputer. Selanjutnya klik “Continue”, kemudian klik “OK”.
3.4. Bagan Penelitian
Gambar 3.1. Bagan Proses analisis Fe, Si dan Cu Pada Metal
Flowchart Analisis Fe, Si dan Cu pada metal
Keterangan :
Hasil analisa spektrometer emisi mengukur konsentrasi Fe, Si dan Cu secara bersaan.
Sampel
Sampel diambil dari pencetakan furnace SCA Sampel dipreparasi (dibubut)
Sampel dianalisa dengan optical emission spektrometer
BAB 4
HASIL DAN PEMBAHASAN
4.1. Perhitungan
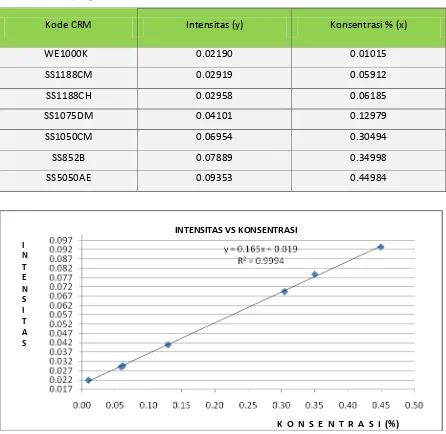
4.1.1. Hasil pengukuran kadar logam Fe Tabel 4.1 Data pengukuran standar Fe
Kode CRM Intensitas (y) Konsentrasi % (x)
WE1000K 0.02190 0.01015
SS1188CM 0.02919 0.05912
SS1188CH 0.02958 0.06185
SS1075DM 0.04101 0.12979
SS1050CM 0.06954 0.30494
SS852B 0.07889 0.34998
SS5050AE 0.09353 0.44984
Gambar4.1 Kurva kalibrasi standar Fe I
N T E N S I T A S
Penurunan Persamaan Garis Regresi dengan Metode Least Square
Hasil pengukuran intensitas standar Besi Fe pada tabel 4.1. diplotkan terhadap konsentrasi sehingga diperoleh kurva kalibrasi berupa garis linier. Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square dengan data pada tabel 4.2.
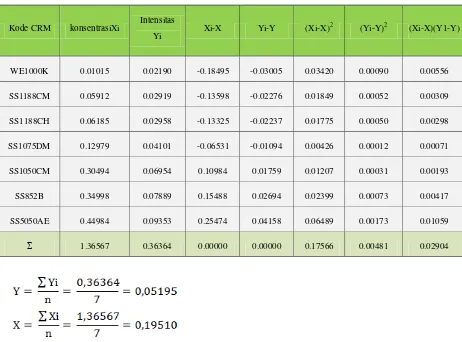
Tabel 4.2. Penurunan persamaan garis regresi untuk penentuan konsentrasi Kadar Fe berdasarkan pengukuran intensitas standar Fe
Kode CRM konsentrasiXi Intensitas
Yi Xi-X Yi-Y (Xi-X)
2
(Yi-Y)2 (Xi-X)(Y1-Y)
WE1000K 0.01015 0.02190 -0.18495 -0.03005 0.03420 0.00090 0.00556
SS1188CM 0.05912 0.02919 -0.13598 -0.02276 0.01849 0.00052 0.00309
SS1188CH 0.06185 0.02958 -0.13325 -0.02237 0.01775 0.00050 0.00298
SS1075DM 0.12979 0.04101 -0.06531 -0.01094 0.00426 0.00012 0.00071
SS1050CM 0.30494 0.06954 0.10984 0.01759 0.01207 0.00031 0.00193
SS852B 0.34998 0.07889 0.15488 0.02694 0.02399 0.00073 0.00417
SS5050AE 0.44984 0.09353 0.25474 0.04158 0.06489 0.00173 0.01059
Σ 1.36567 0.36364 0.00000 0.00000 0.17566 0.00481 0.02904
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis :
dimana :
Dengan mensubstitusikan harga-harga yang tercantum pada tabel 4.2. pada persamaan ini maka diperoleh :
b = – (0,16534 x )
Maka pesamaan garis yang diperoleh adalah :
Penentuan Konsentrasi Fe pada sampel.
Data selengkapnya dapat dilihat pada tabel 4.3.
Tabel 4.3. Penentuan rata-rata konsentrasi Fe pada sampel
NO no. pencetakan Intensitas (y) Konsentrasi % (x)
1 202763 0.0433 0.1445
2 202764 0.0282 0.0521
3 202780 0.0438 0.1475
4 202790 0.0273 0.0463
5 202803 0.0427 0.1406
4.1.2. Hasil pengukuran kadar Si Tabel 4.4. Data pengukuran standar Si
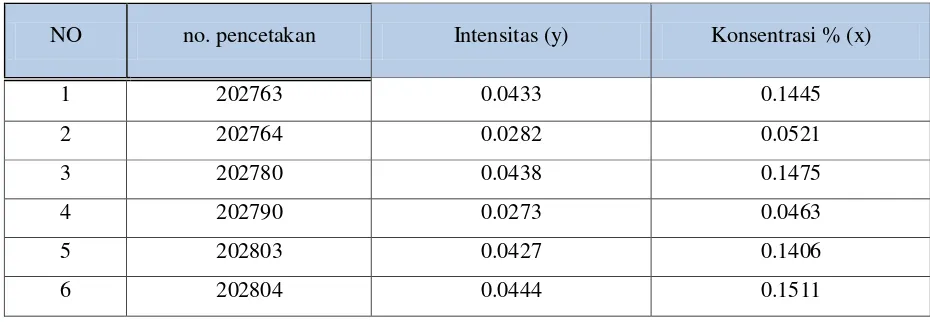
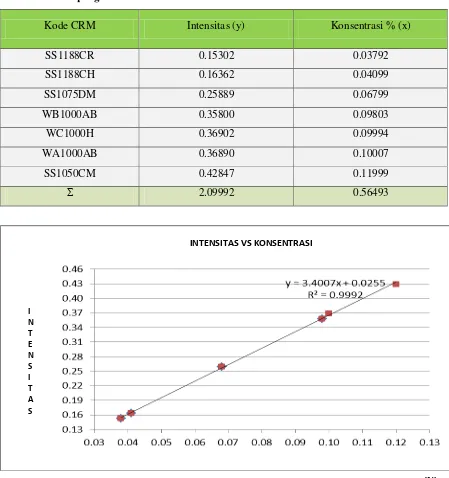
Kode CRM Intensitas (y) Konsentrasi % (x)
SS1188CR 0.15302 0.03792
SS1188CH 0.16362 0.04099
SS1075DM 0.25889 0.06799
WB1000AB 0.35800 0.09803
WC1000H 0.36902 0.09994
WA1000AB 0.36890 0.10007
SS1050CM 0.42847 0.11999
Σ 2.09992 0.56493
Gambar 4.2 Kurva kalibrasi standar Si I
N T E N S I T A S
Penurunan Persamaan Garis Regresi dengan Metode Least Square
Hasil pengukuran intensitas standar Silika (Si) pada tabel 4.4 diplotkan terhadap konsentrasi sehingga diperoleh kurva kalibrasi berupa garis linier. Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square dengan data pada tabel 4.5
Tabel 4.5 Penurunan persamaan garis regresi untuk penentuan konsentrasi Kadar Si berdasarkan pengukuran intensitas standar Si
Kode CRM Konsentrasi Xi
Intensitas
Yi Xi-X Yi-Y (Xi-X)
2
(Yi-Y)2 (Xi-X)(Y1-Y)
SS1188CR 0.03792 0.15302 -0.04278 -0.14697 0.00183 0.02160 0.00629
SS1188CH 0.04099 0.16362 -0.03971 -0.13637 0.00158 0.01860 0.00542
SS1075DM 0.06799 0.25889 -0.01271 -0.04110 0.00016 0.00169 0.00052
WB1000AB 0.09803 0.35800 0.01733 0.05801 0.00030 0.00337 0.00101
WC1000H 0.09994 0.36902 0.01924 0.06903 0.00037 0.00477 0.00133
WA1000AB 0.10007 0.36890 0.01937 0.06891 0.00038 0.00475 0.00133
SS1050CM 0.11999 0.42847 0.03929 0.12848 0.00154 0.01651 0.00505
Σ 0.56493 2.09992 0.00000 0.00000 0.00616 0.07127 0.02094
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis :
Selanjutnya harga slope dapat ditentukan dengan mengunakan metode least square sebagai berikut:
Dengan mensubstitusikan harga-harga yang tercantum pada tabel 4.5. pada persamaan ini maka diperoleh :
b = – (3,4006 x )
=
Makapesamaangaris yang diperolehadalah :
Penentuan konsentrasi Si pada sampel.
Data Selengkapnya dapat dilihat pada tabel 4.6.
Tabel 4.6. Penentuan rata-rata konsentrasi Si pada sampel
NO no. pencetakan Intensitas (y) Konsentrasi % (x)
1 202763 0.1860 0.0473
2 202764 0.1390 0.0335
3 202780 0.1760 0.0442
4 202790 0.1520 0.0373
5 202803 0.1690 0.0421
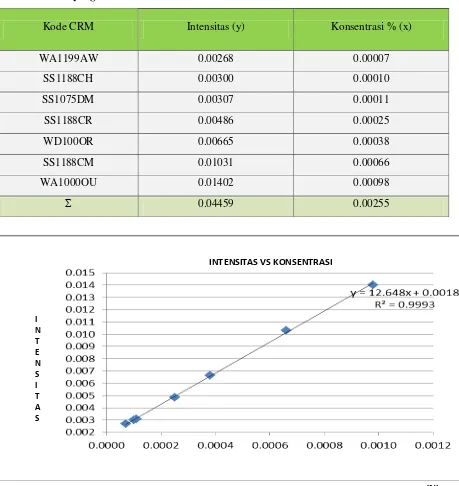
4.1.3. Hasil pengukuran kadar logam Cu Tabel 4.7. Data pengukuran standar Cu
Kode CRM Intensitas (y) Konsentrasi % (x)
WA1199AW 0.00268 0.00007
SS1188CH 0.00300 0.00010
SS1075DM 0.00307 0.00011
SS1188CR 0.00486 0.00025
WD100OR 0.00665 0.00038
SS1188CM 0.01031 0.00066
WA1000OU 0.01402 0.00098
Σ 0.04459 0.00255
Gambar4.3 Kurva kalibrasi standar Cu
Penurunan Persamaan Garis Regresi dengan Metode Least Square I
N T E N S I T A S
Hasil pengukuran intensitas standar Cu pada tabel 4.7 diplotkan terhadap konsentrasi sehingga diperoleh kurva kalibrasi berupa garis linier, persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan metode least square dengan data pada tabel 4.8.
Tabel 4.8. Penurunan persamaan garis regresi untuk penentuan Kadar Cu berdasarkan pengukuran intensitas standar Cu
Kode CRM
Konsentrasi Xi
Intensitas
Yi Xi-X Yi-Y (Xi-X)
2
(Yi-Y)2 (Xi-X)(Y1-Y)
WA1199AW 0.00007 0.00268 -0.00029 -0.00368743 0.00000009 0.00001360 0.00000109
SS1188CH 0.00010 0.00300 -0.00026 -0.00337243 0.00000007 0.00001137 0.00000089
SS1075DM 0.00011 0.00307 -0.00025 -0.00329643 0.00000006 0.00001087 0.00000084
SS1188CR 0.00025 0.00486 -0.00011 -0.00151243 0.00000001 0.00000229 0.00000017
WD100OR 0.00038 0.00665 0.00002 0.00028057 0.00000000 0.00000008 0.00000000
SS1188CM 0.00066 0.01031 0.00030 0.00394157 0.00000009 0.00001554 0.00000117
WA1000OU 0.00098 0.01402 0.00062 0.00764657 0.00000038 0.00005847 0.00000471
Σ 0.00255 0.04459 0.00000 0.00000 0.0000007 0.00011 0.00000887
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan garis :
dimana :
Dengan mensubstitusikan harga-harga yang tercantum pada tabel 4.5 pada persamaan ini maka diperoleh :
b = – (12,6714 x )
Maka pesamaan garis yang diperoleh adalah :
PenentuanKonsentrasi Cu PadaSampel
Data selengkapnya dapat dilihat pada tabel 4.9.
4.9. Penentuan rata-rata konsentrasi Cu pada sampel
NO no. pencetakan Intensitas (y) Konsentrasi % (x)
1 202763 0.0056 0.0003
2 202764 0.0043 0.0002
3 202780 0.0043 0.0002
4 202790 0.0030 0.0001
5 202803 0.0056 0.0003
4.1.4. Perhitungan Kemurnian Aluminium
1. Konsentrasi Al = 100 – (0.1445 + 0.0473 + 0.0003) = 99.81 % Data selengkapnya dapat dilihat pada tabel 4.10
Tabel4.10.Penentuan kemurnian Aluminium
No no.
pencetakan
Konsentrasi (%)
Al (%)
Fe Si Cu
1 202763 0.1445 0.0473 0.0003 99.81
2 202764 0.0521 0.0335 0.0002 99.92
3 202780 0.1475 0.0442 0.0002 99.81
4 202790 0.0463 0.0373 0.0001 99.91
5 202803 0.1406 0.0421 0.0003 99.82
6 202804 0.1511 0.0540 0.0003 99.80
Keterangan :
4.2.Pembahasan
Berdasarkan Hasil pengukuran yang dilakukan, kualitas aluminium ingot menurut standar industri jepang sebagai berikut :
Tabel 4.2. Kualitas Aluminium Ingot Menurut Standar Industri Jepang.
Dari hasil penelitian diatas (tabel 4.2) dimana kemurnian aluminium pada pencetakan lebih kecil dari standar maksimum menurut standar industri jepang (JIS), sehingga aluminium ingot ini memiliki kualitas yang baik.
\ NO. No.
Pencetakan
Hasil Pengukuran Standard JIS
Grade Element Konsentrasi
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Ada enam hasil pemeriksaan pencetakan aluminium ingot, dimana nilai konsentrasi element Fe, Si dan Cu lebih kecil dari standard Maximal yang ditentukan oleh Japanese Industrial Standard (JIS) ini menunjukan kemurnian aluminium ingot semakin tinggi, dan menunjukkan kualitas aluminium ingot yang baik. Keenam pemeriksaan penetakan aluminium ingot ini masuk dalam kategori kualitas special class 1 dan class 1 dalam Japanese Industrial Standart (JIS).
5.2. Saran
DAFTAR PUSTAKA
Applied, Research Labolatorie.1997.Operator’s Manual, Switzerland : ARL-CH Documentation.
Fifield,F,W and Kealey. 1983. Analytical Chemistry, London : 2nd Edition, International textbook Company Limited.
Japanase Industrial Standart H 1305:2005 .2005. Method For Optical Emission Spectrochemical Analysis Of Aluminium And Aluminium Alloys, Tokyo : Aksara.
Japanase Industrial Standart H 2102:1986 .2009. Virgin Aluminium Ingots, Amandments I, Tokyo : Aksara.
Khopkar. S.M. 2007. Konsep Kimia Analitik. Jakarta: Penerbit Universitas Indonesia.
PDA-7000 Series. Optical Emission Specctrometer. Japan: Internasional Division Tokyo.
PT.Inalum Asahan Aluminium.2003. Modul Pelatihan Operasi Tungku Reduksi. Medan.
Shakhashiri, B. Z. 2008.
Sudjadi. 2007. Kimia Farmasi Analisis. Yogyakarta : Pustaka Pelajar.
SQA-WI-10=0. Instruksi Kerja. Pembubutan Aluminium Metal Al.
SQA-WI-06=0. Instruksi Kerja. Analisis Sampel Produk Metal.
Twyman R.M. 2005. Optical Emission Spektrometer. University of York. Elsevier Ltd. All Rights Reserved.
Underwood.A.L. 1981. Analisa Kimia Kuantitatif.Edisi Keempat.Pt.Glora Aksara Pratama. Jakarta: Erlangga.