FERMENTASI KEDELAI HITAM DETAM 2 OLEH
Bacillus
subtilis natto
UNTUK MENINGKATKAN KANDUNGAN
ISOFLAVON AGLIKON
PUJI ASTUTI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Fermentasi Kedelai Hitam Detam 2 oleh Bacillus subtilis natto untuk Meningkatkan Kandungan Isoflavon Aglikon adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Puji Astuti
ABSTRAK
PUJI ASTUTI. Fermentasi Kedelai Hitam Detam 2 oleh Bacillus subtilis natto
untuk Meningkatkan Kandungan Isoflavon Aglikon. Dibimbing oleh HASIM dan SYAMSUL FALAH.
Fermentasi merupakan proses yang paling banyak dilakukan manusia untuk meningkatkan nilai tambah suatu bahan alam. Fermentasi Bacillus subtilis natto
(B.natto) diharapkan mampu meningkatkan konsentrasi isoflavon aglikon yang
bermanfaat bagi kesehatan. Penelitian ini bertujuan untuk mengukur jumlah isoflavon aglikon daidzein dan genistein pada kedelai hitam detam 2 yang difermentasi oleh B.natto strain IFO 3335. Konsentrasi aglikon dianalisis secara kuantitatif dengan High Performance Liquid Chromatography (HPLC). Aglikon yang dikandung kedelai mentah defatted dan undefatted setiap 100 g berat kering sampel masing-masing sebesar 1.29 mg dan 1.19 mg untuk genistein serta 1.16 mg dan 1.07 mg untuk daidzein. Setelah difermentasi, konsentrasi genistein dan daidzein kedelai meningkat hingga 8 kali lipat dibandingkan kedelai mentah. Konsentrasi genistein meningkat hingga 10.43 mg untuk defatted dan 9.43 mg sampel undefatted serta konsentrasi daidzein juga meningkat hingga 9.60 mg untuk defatted dan 8.68 mg untuk sampel undefatted. Nilai ini lebih tinggi daripada kedelai non fermentasi yang mengandung genistein dan daidzein masing-masing 1.07 mg dan 1.09 mg untuk sampel defatted dan 0.97 mg dan 0.98 mg untuk sampel undefatted. Fermentasi dengan B.natto ini terbukti mampu meningkatkan konsentrasi genistein dan daidzein kedelai hitam varietas detam 2. Kata kunci: daidzein, fermentasi, genistein, kedelai
ABSTRACT
PUJI ASTUTI. Fermented Black Soybeans Detam 2 by Bacillus subtilis natto to Improve Content aglycone isoflavones. Supervised by HASIM and SYAMSUL FALAH.
Fermentation is a process that most humans do to improve value of nature material. Bacillus subtilis natto (B.natto) fermentation was expected to increase the content of aglycone isoflavones that beneficial for health. The aim of this study was to measure the amount of isoflavone aglycone daidzein and genistein in fermented black soybeans varieties detam 2 with B.natto strain IFO 3335. HPLC analysis of aglycone showed defatted and undefatted of raw soybeans sample for 100 g dry weight are 1.29 mg and 1.19 mg for genistein and 1.16 mg and 1.07 for daidzein. After fermentation both genistein dan daidzein concentration increased up to 8 times higher than raw soybeans. Genistein concentration increase until 10.43 mg for defatted and 9.43 mg undefatted sample and daidzein concentration is 9.60 mg for deffated and 8.68 mg for undefatted sample. This values were higher than non-fermented soy that only contain genistein and daidzein, respectively 1.07 mg and 1.09 mg for defatted sample and also 0.97 mg and 0.98 mg for undefatted sample. Fermentation with B.natto was proven to improve the consentration of genistein and daidzein in black soybeans varieties detam 2.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Biokimia
FERMENTASI KEDELAI HITAM DETAM 2 OLEH
Bacillus
subtilis natto
UNTUK MENINGKATKAN KANDUNGAN
ISOFLAVON AGLIKON
PUJI ASTUTI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Fermentasi Kedelai Hitam Detam 2 oleh Bacillus subtilis natto
untuk Meningkatkan Kandungan Isoflavon Aglikon Nama : Puji Astuti
NIM : G84080052
Disetujui oleh
Dr drh Hasim DEA Pembimbing I
Dr Syamsul Falah, S.Hut, MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, M.App.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah yang berjudul Fermentasi Kedelai Hitam Detam 2 oleh
Bacillus subtilis natto untuk Meningkatkan Kandungan Isoflavon Aglikon
berhasil diselesaikan. Karya ilmiah ini memberikan deskripsi mengenai topik penelitian yang telah dilakukan penulis sejak bulan April sampai September 2013 di Laboratorium Penelitian Biokimia, Departemen Biokimia, Institut Pertanian Bogor.
Penulis menyampaikan terima kasih kepada Dr. drh. Hasim DEA selaku pembimbing utama dan Dr. Syamsul Falah, S.Hut, M.Si selaku pembimbing kedua yang telah membimbing dan memberikan arahan serta motivasi selama penulisan karya tulis ini. Terima kasih juga penulis ucapkan kepada ibu Didah atas ilmu dan bimbingannya selama proses penulisan, Bu Popi dan Bu Suryani atas jawaban dari pertanyaan-pertanyaan saya, Bu Ami, Pak Edi, dan Pak Zainal atas perbaikan dan sarannya, seluruh staf laboratorium Biokimia dan rekan-rekan Biokimia angkatan 45 dan 46 terutama rekan kerja penelitian (Arya, Adul, Wali, Neng Yulia, Yayuk, Suhe) atas bantuan dan saran yang diberikan selama pelaksanaan penelitian, sahabat-sahabat di SQ khususnya sahabat seperjuangan (Upil, Ceret, Ewi) dan Mega yang selalu memberikan dukungan dari awal hingga akhir penelitian, serta rekan-rekan lainnya: Putu, Distya, Taku, Masato, dan Ahmad Rois yang tanpa lelah memberikan berbagai bantuan moril dan materil sehingga dapat memperlancar pelaksanaan penelitian ini. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Karya ilmiah ini masih jauh dari kesempurnaan. Saran dan kritik dari pembaca diharapkan dapat menyempurnakan tulisan ini. Penulis juga berharap skripsi ini dapat bermanfaat dan memberikan inspirasi positif kepada pembaca.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur Penelitian 2
HASIL 5
Fermentasi Kedelai Hitam Detam 2 dengan B.natto IFO 3335 5
Hasil Kromatogram Sampel Kedelai 5
Kandungan Isoflavon Aglikon dalam Kedelai 7
Analisis Kuantitatif Aglikon 8
PEMBAHASAN 8
Fermentasi Kedelai Hitam Detam 2 dengan B.natto IFO 3335 8 Kromatogram dan Kandungan Isoflavon Aglikon dalam Kedelai 10
Analisis Kuantitatif Aglikon 11
SIMPULAN 14
SARAN 15
DAFTAR PUSTAKA 15
LAMPIRAN 17
DAFTAR TABEL
1 Hasil analisis kromatogram HPLC pada sampel kedelai mentah,
non fermentasi, dan fermentasi 7
2 Jumlah dua senyawa isoflavon aglikon dominan dari 100 g
sampel kedelai dan produk turunannya 13
DAFTAR GAMBAR
1 Kedelai detam 2 hasil fermentasi B.natto strain IFO 3335 dengan metode 1 (1a), metode 2 (1b), dan metode fermentasi modifikasi
(1c). 5
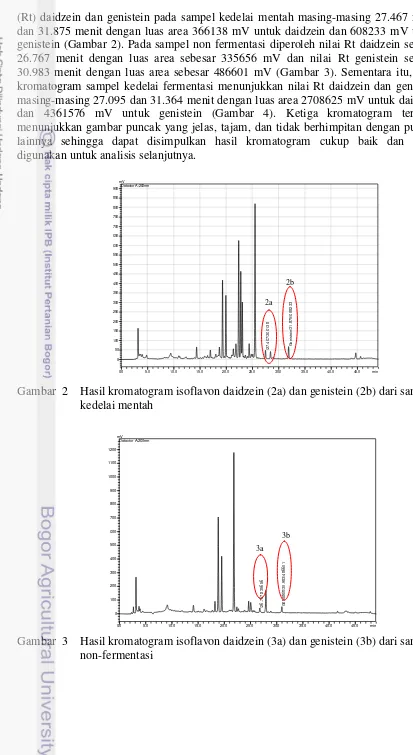
2 Hasil kromatogram isoflavon daidzein (2a) dan genistein (2b) dari
sampel kedelai mentah 6
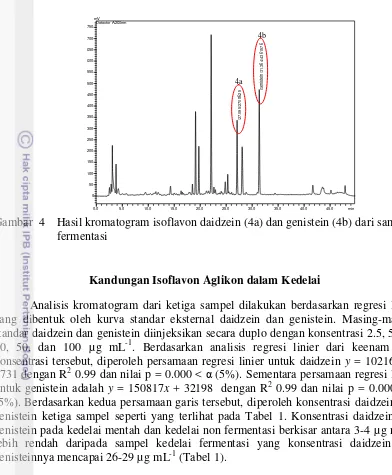
3 Hasil kromatogram isoflavon daidzein (3a) dan genistein (3b) dari
sampel non-fermentasi 6
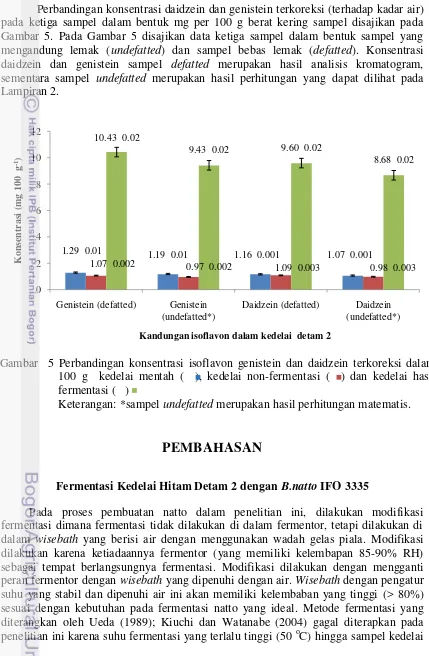
4 Hasil kromatogram isoflavon daidzein (4a) dan genistein (4b) dari
sampel fermentasi 7
5 Perbandingan konsentrasi isoflavon genistein dan daidzein terkoreksi dalam 100 g kedelai mentah ( ), kedelai non-fermentasi
( ) dan kedelai hasil fermentasi ( ) 8
6 Struktur kimia isoflavon glikosida (6a) dan aglikon (6b) pada kedelai 11
DAFTAR LAMPIRAN
1 Alur Penelitian 18
PENDAHULUAN
Ketertarikan dunia terhadap kedelai dan produk olahannya semakin meningkat beberapa tahun belakangan ini terutama manfaatnya bagi kesehatan manusia. Kedelai
(Glycine max L.merr) salah satunya kedelai hitam telah lama dikonsumsi masyarakat
Asia sejak ratusan tahun yang lalu dan telah mengalami sejumlah pengolahan menjadi beragam produk pangan. Kedelai mengandung banyak nutrisi seperti protein dan berbagai komponen fungsional seperti isoflavon yang dilaporkan dapat meningkatkan aktivitas enzim antioksidan dan daya tahan limfosit tikus terhadap hidrogen peroksida (Nurrahman et al. 2012), mengurangi kerusakan DNA akibat siklofosfamid (Ribeiro et al. 2003), menekan oksidasi lipoprotein (Takahashi et al. 2005), menurunkan level LDL pada tikus dislipidemia (Utaminingrum dan Murwani 2011) dan mengurangi resiko penyakit kardiovaskular (Rimbach et al. 2008).
Kedelai mengandung 12 jenis isoflavon yakni tiga jenis isoflavon aglikon dan 9 lainnya merupakan isoflavon glikosida (glikosida, malonil glikosida, asetil glikosida). Isoflavon glikosida merupakan isoflavon terbanyak yang dikandung kedelai mentah (Izumi et al. 2000). Namun, glikosida, malonil glikosida, dan asetil glikosida merupakan jenis glikosida yang sulit diserap tubuh (bioavailabilitas rendah), sementara isoflavon aglikon merupakan jenis dengan bioavailabilitas yang tinggi (Fereira et al.
2011). Peningkatan jumlah aglikon yang memiliki bioavailabilitas yang tinggi merupakan harapan dari modifikasi produk olahan kedelai sehingga diperoleh lebih banyak manfaat dari isoflavon terutama aglikon bagi kesehatan manusia.
Salah satu metode yang dapat digunakan untuk meningkatkan kandungan aglikon kedelai adalah fermentasi dan reaksi dengan asam. Pada proses fermentasi, terjadi hidrolisis isoflavon glikosida dengan enzim -glukosidase yang dihasilkan oleh sejumlah mikroorganisme (Haron et al. 2009). Salah satu mikroorganisme tersebut adalah Bacillus subtilis natto (B.natto). B.natto merupakan bakteri Gram positif yang umum digunakan pada pembuatan natto, produk pangan terfermentasi khas Jepang yang dibuat dari kacang kedelai (Sulistyo 1999). Melalui proses fermentasi, isoflavon glikosida yang sulit diserap tubuh dapat dihidrolisis menjadi isoflavon aglikon yang lebih mudah diserap tubuh.
Beberapa jenis produk hasil fermentasi kedelai seperti chuungkookjang,
kochujang, dan meju (makanan tradisional Korea) dilaporkan memiliki efek
antidiabetes yang lebih baik dibandingkan dengan produk kedelai yang tidak difermentasi pada hewan coba dan manusia yang mengalami diabetes (Kwon et al.
2009, 2011; Taniguchi et al. 2008). Kedelai yang difermentasi memiliki kemampuan yang lebih baik dalam mengobati diabetes karena mengandung isoflavon berbentuk aglikon yang lebih banyak dibandingkan dengan kedelai non-fermentasi. Aglikon ini sangat penting, karena lebih efisien diserap tubuh bila dibandingkan bentuk isoflavon glikosida yang banyak ditemukan pada kedelai non-fermentasi (Ferreira et al. 2011).
2
METODE
Pada penelitian ini dilakukan pemilihan metode fermentasi yang paling tepat untuk strain bakteri B.natto IFO 3335. Setelah terpilih metode fermentasi yang paling baik, kedelai hitam varietas detam 2 difermentasikan dan dilanjutkan dengan tahap analisis hasil fermentasi. Analisis hasil fermentasi dilakukan dengan menggunakan HPLC (High Performance Liquid Chromatography) untuk mengetahui konsentrasi isoflavon aglikon yang terkandung di dalamnya dan hasil dibandingkan dengan kedelai yang tidak difermentasi dan kedelai mentah. Diagram alir penelitian yang lebih jelas terlihat pada Lampiran 1. Hasil analisis dengan HPLC diolah sehingga diperoleh data kuantitatif yang model perhitungan terlihat pada Lampiran 2.
Bahan dan Alat
Bahan-bahan yang digunakan adalah kedelai hitam varietas detam 2 yang diperoleh dari Unit Pengelolaan Benih Sumber (UPBS), Balai Penelitian Kacang-kacangan dan Umbi-umbian (Balitkabi), Malang, Jawa Timur. Sementara bakteri B.
natto dengan nomor kode IFO 3335 diperoleh dari Laboratorium Mikrobiologi PAU,
Universitas Gajah Mada. Selain itu bahan-bahan lain yang digunakan antara lain: standar eksternal HPLC genistein dan daidzein, aquades, kertas aluminium foil, kapas, etanol 70%, medium Nutrient Broth (NB) dan Nutrient Agar (NA), metanol 80%, n-heksan, kertas saring Whattman No. 40, HPLC, bufer butterfield fosfat, NaCl, NaOH, dan H2SO4.
Alat yang digunakan dalam penelitian ini adalah alat gelas, wisebath, inkubator, HPLC Shimadzu LC SOLUTION 1.2 tipe ODS-2 Column (150 x 4.6 mm, 5 µ L), laminar air flow cabinet, autoklaf, pH meter, sentifus, spektrofotometer, neraca analitik, mikropipet, jarum ose, kaca sebar, dan soxhlet.
Prosedur Penelitian
Preparasi Inokulum Bakteri B.natto
Metode preparasi inokulum bakteri B.natto dilakukan menurut penjelasan dari
Wei et al. (2001) yang mengalami sedikit modifikasi. Modifikasi dilakukan pada tahap
pengkulturan bakteri dimana bakteri dikulturkan sebanyak dua kali, yakni selama 24 jam dan 16 jam. Selain itu, metode ini juga berbeda dibandingkan metode preparasi B.
natto lainnya karena secara khusus B.natto dibiakkan pada bufer butterfield fosfat
sehingga dihasilkan kultur yang lebih baik. Bufer butterfield fosfat merupakan pelarut untuk mikroorganisme yang umum digunakan oleh American Public Health
Association (APHA). Bufer ini murah dan mudah disiapkan serta memiliki nilai pH
yang tetap, yakni pH 7.2 sehingga lebih spesifik dan lebih terukur dibandingkan dengan pelarut non-bufer yang memiliki beragam variasi pH (Entis 2002).
3 kecepatan 200 rpm selama 16 jam. Nilai OD660 kultur diukur dengan spektofotometer. Setelah 16 jam inkubasi, nilai OD660 adalah 1.5 dengan populasi bakteri berkisar antara 107-108 cfu mL-1. Kultur bakteri ini siap digunakan untuk preparasi inokulum.
Pembuatan Inokulum B.natto untuk Proses Fermentasi. Sebanyak 7.5 g kedelai yang digunakan sebagai media fermentasi ditambahkan ke dalam 150 mL kultur bakteri B.natto yang telah siap panen dan dibiarkan selama ± 30 menit. Kultur tersebut disentrifugasi dengan kecepatan 12.000 rpm selama 25 menit pada suhu 4 oC. Pelet yang diperoleh kemudian dilarutkan dengan bufer butterfield fosfat steril sebanyak 15 mL. Kultur bakteri di dalam buffer tersebut merupakan inokulum B.natto yang siap digunakan pada proses fermentasi.
Pemilihan Metode Fermentasi
Terdapat beragam metode fermentasi kedelai untuk pembuatan natto skala laboratorium. Prinsip dasar semua metode fermentasi sama, namun terdapat sedikit perbedaan pada setiap metode. Untuk itu perlu dilakukan pemilihan metode fermentasi terbaik yang paling cocok untuk B.natto IFO 3335.
Fermentasi kedelai hitam dengan B.natto menurut Ueda 1989; Kiuchi dan
Watanabe 2004 (Metode fermentasi 1). Kedelai dipilih, dicuci dan direndam di dalam air pada suhu 10 oC selama 18 jam. Kedelai kemudian dikukus dalam rotary cooker
selama 1-1.5 jam pada tekanan 2 kg atau direbus untuk pembuatan home made natto. Sebanyak 60 kg kedelai masak diinokulasikan dengan 108 cfu spora B.natto. Kedelai yang telah tercampur rata dengan spora bakteri ditempatkan di dalam styrofoam dan ditutup dengan plastik film. Kedelai diinkubasi pada suhu 50 oC selama 16-18 jam dan kemudian didinginkan pada suhu 3-10 oC selama 8 jam untuk proses pematangan fermentasi.
Fermentasi kedelai hitam dengan B.natto menurut Juan dan Chou 2010
(Metode fermentasi 2). Kedelai hitam dicuci dan direndam dalam air destilasi (bobot air destilasi adalah tiga kali bobot kedelai) pada suhu ruang (21-23 oC) selama 16 jam. Setelah air ditiriskan, kedelai hitam dikukus dalam autoklaf pada suhu 121 oC selama 110 menit. Setelah dingin, 100 g kedelai diinokulasikan dengan 5 mL B.natto. Setelah diaduk rata, kedelai tersebut diinokulasikan dalam round screen (60 mesh) selama 18 jam pada suhu 40 oC dengan Relative Humidity (RH) sebesar 95%.
Fermentasi kedelai hitam dengan B.natto menurut Wei et al. 2001 (Metode
fermentasi 3). Kedelai yang telah dibersihkan dan direndam dalam air destilasi pada suhu ruang (21-23 oC) selama 16 jam hingga rasio bobot sebelum dan setelah perendaman berkisar 2.1-2.3, kemudian ditiriskan. Kedelai yang telah direndam dikukus dalam autoklaf pada suhu 121 oC selama 20, 25, 30, 35, dan 40 menit. Tekanan pada autoklaf dikurangi setiap 5 menit setelah proses pengukusan terjadi. Sebanyak 120 g kedelai yang telah dikukus diinokulasikan dengan 5 mL inokulum B.natto, ditutup dengan perforated plastic film dan ditempatkan di dalam kotak styrofoam (90 x 90 x 35 mm). Fermentasi dilakukan dengan menggunakan inkubator bakteriologi pada suhu 40-42 oC selama 10, 12, 14, 18, dan 20 jam dengan 85-90% RH.
Fermentasi Kedelai Hitam dengan B.natto (Metode fermentasi modifikasi)
4
tahap tambahan yakni proses pematangan hasil fermentasi dengan cara penyimpanan hasil fermentasi pada lemari pendingin selama 8 jam. Pertama, biji kedelai dicuci bersih lalu direndam di dalam air destilasi (jumlah air destilasi 3x bobot kedelai) pada suhu ruang (21-23 oC) selama 16 jam hingga rasio bobot kedelai setelah perendaman dengan bobot kedelai sebelum perendaman mencapai 2.1-2.3. Kedelai kemudian ditiriskan dan dikukus di dalam autoklaf pada suhu 121 oC selama 40 menit, dinginkan hingga mencapai suhu 50 oC. Ditempatkan sebanyak 60 g kedelai bersuhu 50 oC ke dalam gelas piala 600 mL lalu segera diinokulasikan dengan 5 mL inokulum B.natto, aduk rata, lapisi permukaan dengan plastik dan tutup gelas piala dengan alumunium foil steril. Beri lubang pada permukaan alumunium foil untuk sirkulasi udara. Sampel diinkubasi di dalam wisebath selama 24 jam pada suhu 42 oC. Setelah fermentasi, sampel disimpan dalam lemari pendingin pada suhu 3-10 oC selama 8 jam. Sampel kemudian di oven selama 24 jam pada suhu 42 oC hingga kering sempurna.
Preparasi Sampel dan Ekstraksi Isoflavon
Preparasi sampel dan ekstraksi isoflavon dilakukan berdasarkan metode yang diterangkan oleh Iskandar dan Priatni (2006) serta Shao et al. (2009) dengan sedikit modifikasi. Kedelai kering dihaluskan dengan cara diblender selama 3-4 menit. Sebanyak 5 g serbuk kedelai dibungkus dengan kertas saring dan dihilangkan lemaknya dengan menggunakan soxhlet yang berisi 75 mL n-heksan selama 3-4 jam hingga seluruh lemak hilang. Serbuk kedelai tersebut didiamkan dalam lemari asam semalaman untuk menghilangkan sisa pelarut. Sebanyak 1 g serbuk kedelai bebas lemak diekstraksi dengan 10 mL metanol 80% (v/v) selama 2 jam pada suhu ruang. Ekstrak kedelai disentrifus pada kecepatan 5.000 rpm selama 10 menit pada suhu 4 oC. Supernatan disaring dengan kertas saring Whatmann no. 40 hingga diperoleh filtrat bening berwarna kuning yang dianalisis kadar isoflavonnya. Perlakukan serupa dilakukan terhadap kedelai non-fermentasi dan kedelai mentah.
Analisis Isoflavon dengan HPLC
5
HASIL
Fermentasi Kedelai Hitam Detam 2 dengan B.natto IFO 3335
Sebelum dilakukan fermentasi terhadap kedelai hitam detam 2, terlebih dahulu dilakukan proses pemilihan metode fermentasi terbaik diantara beberapa metode fermentasi yang tersedia. Berdasarkan percobaan yang dilakukan pada penelitian ini, metode fermentasi 1 dan metode fermentasi 2 tidak berhasil dilakukan. Hal ini terlihat pada Gambar 1a dan 1b yang menunjukkan penampakan kedelai yang kering dan tidak berlendir. Sementara itu, hasil modifikasi metode Wei et al. (2001) (metode fermentasi modifikasi) berhasil dilakukan dengan hasil seperti yang terlihat pada Gambar 1c. Metode inilah yang digunakan sebagai metode fermentasi pada penelitian ini.
Gambar 1 Kedelai detam 2 hasil fermentasi B.natto strain IFO 3335 dengan metode 1 (1a), metode 2 (1b), dan metode fermentasi modifikasi (1c).
Hasil Kromatogram Sampel Kedelai
Hasil analisis dengan menggunakan HPLC diperoleh konsentrasi daidzein dan genistein dari kedelai mentah, kedelai non fermentasi dan kedelai fermentasi dalam bentuk luas area kromatogram (kuantitatif). Kromatogram menunjukkan waktu retensi
(1a) (1b)
6
(Rt) daidzein dan genistein pada sampel kedelai mentah masing-masing 27.467 menit dan 31.875 menit dengan luas area 366138 mV untuk daidzein dan 608233 mV untuk genistein (Gambar 2). Pada sampel non fermentasi diperoleh nilai Rt daidzein sebesar 26.767 menit dengan luas area sebesar 335656 mV dan nilai Rt genistein sebesar 30.983 menit dengan luas area sebesar 486601 mV (Gambar 3). Sementara itu, hasil kromatogram sampel kedelai fermentasi menunjukkan nilai Rt daidzein dan genistein masing-masing 27.095 dan 31.364 menit dengan luas area 2708625 mV untuk daidzein dan 4361576 mV untuk genistein (Gambar 4). Ketiga kromatogram tersebut menunjukkan gambar puncak yang jelas, tajam, dan tidak berhimpitan dengan puncak lainnya sehingga dapat disimpulkan hasil kromatogram cukup baik dan dapat digunakan untuk analisis selanjutnya.
Gambar 3 Hasil kromatogram isoflavon daidzein (3a) dan genistein (3b) dari sampel non-fermentasi
7
Analisis kromatogram dari ketiga sampel dilakukan berdasarkan regresi linier yang dibentuk oleh kurva standar eksternal daidzein dan genistein. Masing-masing standar daidzein dan genistein diinjeksikan secara duplo dengan konsentrasi 2.5, 5, 10, 20, 50, dan 100 µg mL-1. Berdasarkan analisis regresi linier dari keenam titik konsentrasi tersebut, diperoleh persamaan regresi linier untuk daidzein y = 102167x –
6731 dengan R2 0.99 dan nilai p = 0.000 < α (5%). Sementara persamaan regresi linier untuk genistein adalah y = 150817x + 32198 dengan R2 0.99 dan nilai p = 0.000 < α (5%). Berdasarkan kedua persamaan garis tersebut, diperoleh konsentrasi daidzein dan genistein ketiga sampel seperti yang terlihat pada Tabel 1. Konsentrasi daidzein dan genistein pada kedelai mentah dan kedelai non fermentasi berkisar antara 3-4 µg mL-1, lebih rendah daripada sampel kedelai fermentasi yang konsentrasi daidzein dan genisteinnya mencapai 26-29 µg mL-1 (Tabel 1).
Kedelai mentah Daidzein 27.59 366397 3.59
Genistein 32.02 604659 3.99
Kedelai non-fermentasi Daidzein 26.77 334858 3.28
Genistein 30.98 487289 3.22
Kedelai fermentasi Daidzein 27.12 2703849 26.49
Genistein 31.39 4356383 28.79
4a 4b
8
Analisis Kuantitatif Aglikon
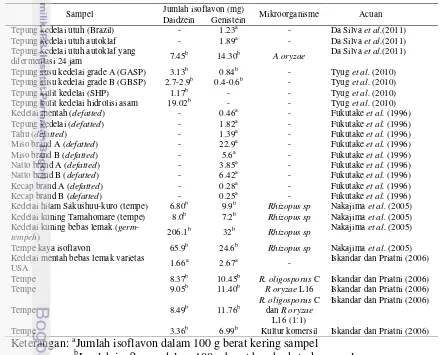
Perbandingan konsentrasi daidzein dan genistein terkoreksi (terhadap kadar air) pada ketiga sampel dalam bentuk mg per 100 g berat kering sampel disajikan pada Gambar 5. Pada Gambar 5 disajikan data ketiga sampel dalam bentuk sampel yang mengandung lemak (undefatted) dan sampel bebas lemak (defatted). Konsentrasi daidzein dan genistein sampel defatted merupakan hasil analisis kromatogram, sementara sampel undefatted merupakan hasil perhitungan yang dapat dilihat pada Lampiran 2.
PEMBAHASAN
Fermentasi Kedelai Hitam Detam 2 dengan B.natto IFO 3335
Pada proses pembuatan natto dalam penelitian ini, dilakukan modifikasi fermentasi dimana fermentasi tidak dilakukan di dalam fermentor, tetapi dilakukan di dalam wisebath yang berisi air dengan menggunakan wadah gelas piala. Modifikasi dilakukan karena ketiadaannya fermentor (yang memiliki kelembapan 85-90% RH) sebagai tempat berlangsungnya fermentasi. Modifikasi dilakukan dengan mengganti peran fermentor dengan wisebath yang dipenuhi dengan air. Wisebath dengan pengatur suhu yang stabil dan dipenuhi air ini akan memiliki kelembaban yang tinggi (> 80%) sesuai dengan kebutuhan pada fermentasi natto yang ideal. Metode fermentasi yang diterangkan oleh Ueda (1989); Kiuchi dan Watanabe (2004) gagal diterapkan pada penelitian ini karena suhu fermentasi yang terlalu tinggi (50 oC) hingga sampel kedelai
1.29 0.01 1.19 0.01 1.16 0.001 1.07 0.001
1.07 0.002 0.97 0.002 1.09 0.003 0.98 0.003
10.43 0.02
Gambar 5 Perbandingan konsentrasi isoflavon genistein dan daidzein terkoreksi dalam 100 g kedelai mentah ( ), kedelai non-fermentasi ( ) dan kedelai hasil fermentasi ( )
9 kering dan tidak memiliki tekstur yang lembut selayaknya natto yang berhasil difermentasi. Sementara metode yang diterangkan oleh Wei et al. (2001) juga mengalami kegagalan, meskipun suhu yang digunakan berkisar 40-42 oC. Hal ini terjadi karena fermentasi dilakukan di dalam inkubator biasa yang tidak memiliki pengaturan kelembaban ruang (RH) sehingga kedelai menjadi kering.
Fermentasi dengan metode modifikasi yang berhasil dilakukan pada penelitian ini menghasilkan natto dengan ciri utama berlendir dan berbau khas natto. Natto ini memiliki tekstur yang lembut, beraroma natto, berwarna kecoklatan dan diselubungi oleh lendir berwarna putih yang lengket (Gambar 1c). Ciri-ciri khas natto inilah yang digunakan sebagai parameter kualitatif untuk menentukan waktu optimum fermentasi pada penelitian ini. Menurut Wei et al. (2001) tidak ada literatur yang dapat memberikan waktu optimum fermentasi skala industri yang paling tepat. Waktu fermentasi rata-rata B.natto berkisar antara 16-20 jam (Maruo dan Yoshkawa 1989). Waktu optimum fermentasi natto terutama dipengaruhi oleh strain B.natto yang digunakan sehingga waktu optimum untuk setiap strain yang digunakan pada percobaan dengan kondisi (variabel) lain dibuat sama akan berbeda-beda (Wei et al. 2001).
Pengamatan secara kualitatif yang dilakukan pada penelitian ini menunjukkan hasil yang tidak berbeda dengan pengamatan kuantitatif pada penelitian yang dilakukan
Wei et al. (2001). Pada fermentasi kedelai hitam detam 2 dengan B.natto strain IFO
3335, lendir putih yang tampak pada jam 18 lebih sedikit dibandingkan pada jam ke-20 dan jam ke-24. Tetapi, pada jam ke-30 lendir putih yang tampak lebih sedikit dibandingkan pada jam ke-24. Berkurangnya lendir putih ini juga diikuti dengan semakin keringnya sampel natto. Lendir putih ini merupakan asam poliglutamat atau -PGA dan polisakarida (Hongo dan Yoshimoto 1968). Menurut Wei et al. (2001) banyaknya lendir putih di permukaan natto dapat diukur secara kuantitatif dengan pengukuran viskositas (viscosity). Semakin tinggi nilai viskositas sampel maka semakin banyak pula lendir putih yang dihasilkan dan berarti semakin baik pula kualitas natto. Pada penelitian Wei et al. (2001) kedelai yang difermentasi oleh B.natto strain itobiki dan NRRL B-3383 menunjukkan kenaikan nilai viskositas yang signifikan dari jam ke-10 hingga jam ke-18 waktu fermentasi. Nilai viskositas mulai menurun setelah melewati jam ke-18. Hal ini menunjukkan bahwa lendir putih akan terus meningkat hingga fermentasi mencapai waktu optimum (jam ke-18) dan akan menurun setelah melewati waktu fermentasi optimum tersebut. Hal inilah yang menyebabkan lendir putih pada fermentasi kedelai hitam detam 2 berkurang pada jam ke-30 karena pada jam ini fermentasi kedelai hitam detam 2 telah melewati waktu fermentasi optimumnya, yakni jam ke-24.
10
sama secara visual dan masih digolongkan sebagai natto dengan kualitas yang baik (Wei et al. 2001).
Selain itu, pada fermentasi IFO 3335 juga digunakan aroma natto sebagai salah satu parameter kualitatif. Pada saat pengamatan, aroma natto yang muncul semakin kuat seiring semakin lamanya waktu fermentasi (jam ke-18 hingga ke-24). Tetapi pada jam ke-30 aroma natto mulai berkurang dan mulai muncul aroma lain yang busuk yang biasa muncul pada tempe busuk. Hal ini menandakan bahwa natto telah mengalami fermentasi berlebih pada jam ke-30 dan berakibat pada menurunnya kualitas natto.
Pada penelitian ini, jumlah inokulum bakteri IFO 3335 yang digunakan untuk fermentasi adalah 1.2 x 107 cfu mL-1 dengan nilai OD660 (absorban) sebesar 1.6. Jumlah inokulum ini dihitung tepat sebelum inokulum digunakan untuk fermentasi dengan menggunakan metode Total Plate Count (TPC). Jumlah inokulum ini hampir sama dengan jumlah inokulum 9 strain bakteri B. natto yang digunakan pada percobaan Wei
et al. (2001). Pada percobaan Wei, inokulum bakteri yang digunakan berkisar antara
107 hingga 108 cfu mL-1 dengan nilai absorban sebesar 1.5. Jumlah inokulum yang digunakan pada fermentasi perlu diketahui jumlahnya karena inokulum yang terlalu sedikit akan berakibat gagalnya fermentasi.
Bakteri B.natto IFO 3335 yang digunakan sebagai agen fermentasi kedelai hitam detam 2 pertama kali diisolasi oleh M. Yamazaki pada tahun 1954 (IFO 2000). Strain IFO 3335 ini dapat memproduksi -glukosidase seperti jenis B.natto lainnya dan banyak diteliti karena kemampuannya memproduksi -PGA dalam jumlah yang besar (9.6 g L-1) tanpa adanya produk sampingan seperti polisakarida dalam media yang mengandung asam L-glutamat (30 g L-1), asam sitrat (20 g L-1) dan ammonium sulfat (5 g L-1) (Goto dan Kunioka 1992). Kedelai hitam detam 2 yang digunakan pada penelitian ini merupakan kedelai lokal unggulan hasil persilangan kedelai Wilis dengan galur introduksi 9837 yang dikembangkan oleh BALITKABI. Kedelai ini mengandung protein sebanyak 45.58% berat kering lebih tinggi daripada kedelai lain yang umumnya mengandung protein sebesar 35% (Balitkabi 2012).
Kromatogram dan Kandungan Isoflavon Aglikon dalam Kedelai
Analisis kandungan isoflavon kedelai diukur dengan High Performance Liquid
Chromatography (HPLC). HPLC merupakan jenis kromatografi yang menggabungkan
koefisien kolom dengan kecepatan analisis, memiliki kecepatan dan sensitivitas yang lebih baik serta dapat digunakan untuk menguji hampir semua jenis molekul biologi, baik makro maupun mikro (Bintang 2010). Hasil kromatogram ketiga sampel hanya menunjukkan luas area daidzein dan genistein masing-masing sampel, namun tidak menunjukkan konsentrasi daidzein dan genisteinnya. Perhitungan konsentrasi daidzein dan genistein ketiga sampel diperoleh dari regresi linier yang dibentuk oleh kurva standar eksternal daidzein dan genistein dengan menggunakan program LC SOLUTION 1.2.
11
(6a) (6b)
berdasarkan kedua persamaan, diketahui nilai p keduanya < 5% sehingga disimpulkan bahwa fermentasi berpengaruh terhadap kandungan isoflavon atau tolak H0.
Pada penelitian ini, dilakukan konversi isoflavon glikosida (genistin dan daidzin) menjadi aglikon (genistein dan daidzein) akibat aktivitas enzim -glukosidase yang dihasilkan oleh B.natto. Konversi ini dilakukan karena produk pangan yang mengandung aglikon dalam jumlah besar akan lebih banyak memberikan manfaat bagi manusia karena aglikon lebih mudah diserap usus daripada bentuk glikosidanya (Izumi
et al. 2000). Hingga saat ini, dilaporkan terdapat 12 jenis isoflavon yang terkandung di
dalam kedelai, antara lain: tiga jenis isoflavon aglikon (genistein, daidzein, dan glisitein), isoflavon 7-O- -D-glukosida atau dikenal dengan glikosida (genistin, daidzin, dan glisitin), isoflavon 6”-O-malonil-7-O- -D-glukosida (malonilgenistin, malonildaidzin, dan malonilglisitin), dan isoflavon 6”-O-asetil-7-O- -D-glukosida (asetilgenistin, asetildaidzin, dan asetilglisitin) (Shao et al. 2009). Diantara semua jenis isoflavon tersebut, isoflavon 7-O- -D-glukosida atau glikosida paling banyak ditemukan pada kedelai mentah. Namun, beragam proses pengolahan kedelai seperti pemanasan, pemasakan, hidrolisis enzimatik, dan fermentasi dapat mengubah bentuk glikosida menjadi bentuk aglikon sehingga jumlah aglikon pada produk olahan kedelai lebih tinggi daripada mentahnya (Wang et al. 1998).
Analisis Kuantitatif Aglikon
Konsentrasi sampel hasil kromatografi muncul sebagai konsentrasi sampel
defatted atau sampel bebas lemak. Pada sampel defatted, lemak yang berhasil
dihilangkan dari ketiga sampel berkisar 8-10% (total lemak kedelai hitam detam 2 sebesar 14.83%, lebih rendah daripada kedelai biasa yang mencapai 18-20%) sehingga dapat disimpulkan proses penghilangan lemak pada ketiga sampel cukup baik. Proses
12
penghilangan lemak ini merupakan proses yang penting pada analisis konsentrasi aglikon dengan HPLC karena kandungan lemak yang tinggi pada sampel akan menghasilkan kromatogram yang tidak bersih dan puncak-puncak yang saling berhimpitan. Selain itu, proses penghilangan lemak dengan soklet tidak akan mengakibatkan kehilangan isoflavon yang signifikan (Iskandar dan Priatni 2006).
Konsentrasi genistein dan daidzein (terkoreksi) tertinggi dihasilkan oleh kedelai yang difermentasi dengan peningkatan hingga 8 kali lipat dibandingkan sampel kedelai mentah yakni genistein sebesar 10.43 mg dan daidzein sebesar 9.6 mg dalam 100 g berat kering kedelai. Kandungan daidzein dan genistein terendah dihasilkan oleh kedelai non fermentasi dengan konsentrasi genistein sebesar 1.07 mg dan daidzein 1.09 mg, diikuti dengan konsentrasi genistein dan daidzein kedelai mentah yang tidak jauh berbeda, masing-masing 1.29 mg dan 1.16 mg.
Namun, kedelai dan produk turunannya yang dikonsumsi manusia sebagian besar tidak dalam bentuk kedelai bebas lemak (defatted), tetapi dalam bentuk kedelai yang mengandung lemak (undefatted). Oleh karena itu, dilakukan konversi konsentrasi aglikon pada sampel defatted menjadi konsentrasi sampel undefatted. Sampel
undefatted secara keseluruhan mengandung daidzein dan genistein (terkoreksi) lebih
rendah daripada sampel bebas lemaknya. Berdasarkan Gambar 5 terlihat bahwa fermentasi mampu meningkatkan kandungan genistein dan daidzein hingga 8 kali lipat dari sampel mentahnya. Genistein dan daidzein yang terkandung di dalam sampel fermentasi masing-masing mencapai 9.43 mg dan 8.68 mg untuk setiap 100 g berat sampel kering, jauh lebih tinggi dari kedelai mentah yang hanya mengandung 1.19 mg genistein dan 1.07 mg daidzein. Sementara itu kedelai non fermentasi hanya mengandung genistein sebesar 0.97 mg dan daidzein sebesar 0.98 mg.
Bila dibandingkan dengan kedelai varietas lain, kedelai hitam detam 2 mengandung daidzein dan genistein yang lebih rendah. Detam 2 mengandung daidzein dan genistein masing-masing 1.162 mg dan 1.294 mg dalam 100 g sampel kering lebih rendah daripada varietas amerika yang mengandung 1.66 mg daidzein dan 2.67 mg genistein (Iskandar dan Priatni 2006). Selain itu, daidzein dan genistein kedelai non fermentasi pada penelitian ini lebih rendah daripada kedelai mentahnya. Hal ini terjadi karena sebagian isoflavon ikut terlarut bersama air selama proses perendaman kedelai (± 16 jam perendaman). Selain itu, proses pengukusan pada suhu 121 oC selama 40 menit juga dapat menjadi penyebab hilangnya sebagian isoflavon aglikon tersebut (Grun et al. 2001).
Merujuk pada berbagai penelitian terdahulu mengenai fermentasi kedelai, terlihat bahwa kedelai yang difermentasi atau mengalami hidrolisis asam akan mengandung daidzein dan genistein lebih tinggi (Nakajima et al. 2005; Iskandar dan Priatni 2006; Tyug et al. 2010; Da Silva et al. 2011). Fermentasi yang berhasil meningkatkan konsentrasi aglikon terlihat pada penelitian Da Silva et al. (2011) yang berhasil menambah konsentrasi genistein dari 1.23 mg menjadi 14.30 mg melalui fermentasi A. oryzae. Selain itu, kedelai kuning bebas lemak yang difermentasi dengan
Rhizopus sp. menjadi germ tempeh pada penelitian yang dilakukan oleh Nakajima et al.
(2006) juga berhasil meningkatkan konsentrasi aglikonnya hingga 206.1 mg untuk daidzein dan 32 mg untuk genistein. Konsentrasi ini merupakan konsentrasi tertinggi dari semua jenis kedelai dan produk olahannya yang disajikan pada Tabel 2.
Pada penelitian ini, fermentasi kedelai hitam detam 2 dengan B. natto IFO 3335 menghasilkan daidzein sebesar 8.68 mg dan genistein sebesar 9.43 mg (sampel
13 turunannya (natto, kecap, tempe) pada Tabel 2. Produk turunan kedelai hitam seperti natto dan kecap bahkan mengandung sangat sedikit daidzein sehingga tidak dapat terdeteksi (tidak terukur). Produk kedelai hitam lain seperti tempe juga mengandung daidzein lebih kecil (6.80 mg) dibandingkan dengan hasil penelitian ini, yaitu 8.68 mg daidzein (tertinggi diantara sampel kedelai hitam jenis lain dan turunannya). Sementara itu, kandungan genistein kedelai hitam dan turunannya pada Tabel 2 cukup bervariasi dengan konsentrasi terendah sebesar 0.25 mg pada sampel kecap brand B dan tertinggi pada tempe kedelai hitam Sakushuu-kuro sebesar 9.9 mg. Sedangkan hasil dari penelitian ini menunjukkan kandungan genistein sampel sebesar 9.43 mg yang merupakan kadar tertinggi kedua untuk sampel kedelai hitam.
Tabel 2 Jumlah dua senyawa isoflavon aglikon dominan dari 100 g sampel kedelai dan produk turunannya
Sampel Jumlah isoflavon (mg) Mikroorganisme Acuan
Daidzein Genistein Kedelai kuning Tamahomare (tempe) 8.0b 7.2b Rhizopus sp Nakajima et al. (2005) Kedelai kuning bebas lemak (
germ-Tempe 3.36b 6.99b Kultur komersil Iskandar dan Priatni (2006)
Keterangan: aJumlah isoflavon dalam 100 g berat kering sampel b
Jumlah isoflavon dalam 100 g berat basah ekstrak sampel
14
akan terputus dan posisi glukosa ini akan digantikan oleh atom hidrogen sehingga membentuk isoflavon aglikon. Selain itu menurut Hart (1983) reaksi hidrolisis ini juga membutuhkan katalis asam, seperti yang terjadi di dalam lambung manusia. Kedelai yang dikonsumsi secara alami akan mengalami hidrolisis akibat aktivitas -glukosidase dari mikroflora di dalam usus manusia (Behloul dan Wu 2013) atau akibat aktivitas enzim laktase (asam) di usus kecil (Raimondi et al. 2009).
Enzim -glukosidase atau -D-glukosida-o-glukohidrolase dengan nomor E.C. 3.2.1.21 merupakan kelompok enzim hidrolase dengan NAD dan NADH sebagai akseptor hidrogen. Seperti enzim pada umumnya, enzim -glukosidase akan bekerja dengan cara menurunkan energi aktivasi reaksi pengubahan glikosida menjadi aglikon. Energi aktivasi suatu reaksi adalah jumlah energi dalam kalori yang diperlukan untuk membawa semua molekul pada 1 mol senyawa pada suhu tertentu menuju tingkat transisi pada puncak batas energi. Akibat turunnya energi aktivasi ini, maka fraksi molekul substrat yang bereakasi menjadi produk per satuan waktu akan lebih cepat dibandingkan dengan keadaan tanpa enzim (Lehninger 1982).
Aktivitas enzim -glukosidase dalam menghidrolisis isoflavon kedelai pertama kali dilaporkan oleh Matsuura et al pada tahun 1989. Matsuura melaporkan -glukosidase berperan dalam meningkatkan daidzein dan genistein selama proses perendaman kedelai pada proses pembuatan susu kedelai. Selain itu, -glukosidase juga berperan dalam menghidrolisis glikosida menjadi aglikon pada pembuatan tepung kedelai terfermentasi (da Silva et al. 2011). Jumlah aglikon yang tinggi dalam produk pangan akan meningkatkan jumlah zat aktif isoflavon (aglikon) yang dapat diserap tubuh manusia yang berperan sebagai antidiabetes.
Berdasarkan studi yang dilakukan oleh Kwon et al. pada tahun 2011 menunjukkan bahwa meju, makanan tradisional korea yang difermentasi oleh Bacillus
dan Aspergillus tanpa garam selama 20-60 hari dan chungkookjang (fermentasi kedelai
dengan B.subtilis tanpa garam selama 2-3 hari) terbukti mampu bekerja sebagai antidiabetes dengan cara meningkatkan sensitivitas insulin. Genistein sendiri bermanfaat dalam memperbaiki metabolisme glukosa dan lipid serta melindungi sel -pankreas (Choi et al. 2008). Penelitian Rahadiyanti (2011) juga menunjukkan bahwa pemberian tempe kedelai pada 18 orang prediabetes selama 14 hari mampu menurunkan kadar glukosa darah puasa sebesar 8.69%. Hal ini dapat terjadi karena selama proses fermentasi, konsentrasi isoflavon aglikon (daidzein dan genistein) yang memiliki bioavailabilitas yang tinggi (mudah diserap tubuh) meningkat sehingga mampu memberikan dampak yang lebih signifikan dalam menstimulasi insulin untuk menyerap glukosa.
SIMPULAN
15 konsentrasi aglikon, yakni sebesar 1.07 mg untuk genistein dan 1.09 mg untuk daidzein (0.97 mg dan 0.98 mg pada sampel undefatted).
SARAN
Pemanfaatan daidzein dan genistein yang cukup tinggi pada kedelai yang difermentasikan oleh B.natto IFO 3335 membutuhkan penelitian lebih lanjut, terutama penelitian untuk mengetahui aktivitas dan cara kerja kedua isoflavon aglikon tersebut. Selain itu, mekanisme kerja enzim -gluksidase yang masih belum jelas pada penelitian ini membutuhkan penelitian lebih lanjut terutama mengenai mekanisme kerja, aktivitas dan kinetika enzimnya.
DAFTAR PUSTAKA
[Balitkabi] Balai Penelitian Kacang-kacangan dan Umbi-umbian. 2012. Kedelai hitam detam 2. Balitkabi [internet]. [diunduh 2013 Januari 19]. Tersedia pada: http://balitkabi.litbang.deptan.go.id/varietas-unggul/vu-kedelai/108-varietas-unggul-kedelai-detam-2.html.
Behloul N, Wu G. 2013. Genitein: A promising therapeutic agent for obecity and diabetes treatment. Europ J Pharm. 698: 31-38.
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta (ID): Penerbit Erlangga.
Choi MS, Jung UJ, Yeo J, Kim MJ, Lee MK. 2008. Genistein and daidzein prevent diabetes onset by elevating insulin level and altering hepatic gluco- neogenic and lipogenic enzyme activities in non-obese diabetic (NOD) mice. Diabet Metab. 24: 74–81.
Fukutake M, Takahashi M, Ishida K, Kawamura H, Sugimura T, Wakabayashi K. 1996. Quantification of genistein and genistin in soybean and soybean products. J Food
Chem Toxicol. 34: 457-461.
Goto A, Kunioka M. 1992. Biosynthesis and hydrolysis of polyglutamic acid from
Bacillus subtilis IFO 3335. J Biosci. 56: 1031-1035.
16
Haron H, Ismail A, Azlan A, Shahar S, Peng LS. 2009. Daidzein and genestein contents in tempeh and selected soy products. J Food Chem. 115: 1350-1356.
Hart H. 1983. Kimia Organik: Suatu Kuliah Singkat. Jakarta (ID): Penerbit Erlangga. Hlm130.
Hongo M, Yoshimoto A. 1968. Formation of phage-induced -polyglutamic acid depolymerase in lysogenic strain of Bacillus natto. JAgr Bio Chem. 32: 525-527. [IFO] Institute for Fermentation Osaka. 2000. List of Cultures: Microorganism 11th
Edition. Osaka (JP): IFO Pr. p180.
Iskandar YM, Priatni S. 2006. Isoflavone aglicone produce from fermented soybean. Di dalam: Prosiding Seminar Nasional Iptek Solusi Kemandirian Bangsa; 2006 Agust 2-3; Yogyakarta, Indonesia.
Izumi T, Piskula MK, Osawa S, Obata A, Tobe K, Saito M. 2000. Soy isoflavone aglycones are absorbed faster and in higher amounts than their glucosides in humans. J Nutr. 130: 1695–1699.
Juan MY, Chou CC. 2010. Enhancement of antioxidant activity, total phenolic and flavonoid content of black soybeans by solid state fermentation with Bacillus
subtilis BCRC 14715. J Food Microbiol. 27: 586-591.
Kiuchi K, Watanabe S. 2004. Industrialization of Japanese Natto, In : Industrialization of Indigenous Fermented Foods. New York (US): Marcel Dekker. p193-246. Kwon DY, Hong SM, Ahn S, Kim MJ, Yang HJY, Park, S. 2009. Kochujang, a korean
fermented red pepper plus soybean paste, improves glucose homeostatis in 90% pancreatectomized diabetic rats. J Nutr. 25: 790-799.
Kwon DY, Hong SM, Ahn S, Kim MJ, Yang HJY, Park, S. 2011. Isoflavonoids and peptides from meju, long-term fermented soybeans, increase insulin sensivity and exert insulinotropic effect in vitro. JNutr. 27: 244-252.
Lehninger AL. 1982. Dasar-Dasar Biokimia. Jilid ke-1. Thenawidjaja M, penerjemah. Bogor (ID): IPB Pr. Terjemahan dari: Principles of Biochemistry.
Maruo B, Yoshkawa H. 1989. Industrial application of B.subtilis-Ch 8 in Topics in Secondary Metabolism I Bacillus subtilis: Molecular Biology and Industrial Application. J Food Sci.143–161.
Matsuura M, Obata A, Fukushima D. 1989. Objectionable flavor of soy milk developed during the soaking of soybeans and its control. J Food Sci. 54:602–605.
Nakajima N, Nozaki N, Ishihara K, Ishikawa A, Tsuji H. 2005. Analysis of isoflavone content in tempeh, a fermented soybean and preparation of a new isoflavone enriched tempeh. J Biosci Bioeng. 100(6):685-687.
Nurrahman, Astuti M, Suparmo, Soesatyo MHNE. 2012 Mei. Peran tempe kedelai hitam dalam meningkatkan aktivitas enzim antioksidan dan daya tahan limfosit tikus terhadap hydrogen peroksida in vivo. LPPM UNIMUS, siap terbit.
17 Raimondi S, Roncaglia L, De Lucia M, Amaretti A, Leonardi A, Pagnoni UM, Rossi M.
2009. Bioconversion of soy isoflavones daidzin and daidzein by Bifidobacterium
strains. Appl. Microbiol. Biotechnol. 81: 943–950.
Ribeiro MLL, Mandarino JMG, Panizzi MCC, de Oliveira MCN, Campo CBH, Nepomuceno AL, Ida EI. 2007. Isoflavone content and -glucosidase activity in soybean cultivars of different maturity groups. J Food Compst Analys. 20: 19-24. Rimbach G, Boesch-Saadatmandi C, Frank J, Fuchs D, Wenzel U, Daniel H, Hall W L,
Weinberg P D. 2008. Dietaryisoflavones in the prevention of cardiovascular disease – Amolecular perspective. Food Chem Tox. 46:1308–1319.
Shao S, Duncan AM, Yang R, Marcone MF, Rajcan I, Tsao R. 2009. Tracking isoflavones: from soybean to soy flour, soy protein isolates to functional soy bread. J Funct Food. 1: 119-127.
Sulistyo. 1999. Profil kandungan asam organic pada proses fermentasi natto. J Mikrob
Trop. 2: 9 17.
Takahashi R, Ohmori R, Kiyose C, Momiyama Y, Ohsuzu F, Kondo K. 2005. Antioxidant activities of black and yellow soybeans against low density lipo- protein oxidation. J.Agric Food Chem 53: 4578-4582.
Taniguchi A, Yamanaka-Okumura H, Nishida Y, Yamamoto H, Taketani Y, Takeda E. 2008. Natto and viscous vegetables in a Japanese style meal supress postprandial glucose and insulin responses. Asia Pac J Clin Nutr. 7: 663-668.
Tyug TS, Prasad KN, Ismail A. 2010. Antioxidant capacity, phenolics and isoflavones in soybean by products. J Food Chem. 123: 583-589.
Ueda S. 1989. Industrial Application of B. subtilis, In : Bacillus subtilis : Molecular
Biology and Industrial Application. Tokyo (JP): Kodansha. p143-161.
Utaminingrum F, Murwani HR. 2011. Pengaruh pemberian yogurt kedelai hitam (black soyghurt) terhadap kadar kolesterol LDL serum pada tikus dislipidemia[skripsi]. Semarang (ID): Universitas Diponegoro.
Wang C, Ma Q, Pagadala S, Sherrard MS, Krishnan PG.1998. Changes of isoflavones during processing of soy protein isolates. J Amer Oil Chem Soc. 75: 337–341. Wei Q, Hall W, Chang KC. 2001. Natto characteristics as affected by steaming time,
18
Lampiran 1 Alur Penelitian
Preparasi Inokulum Bacillus
subtilis natto (B. natto)
Fermentasi kedelai hitam detam 2 dengan B. natto
Pembuatan serbuk kedelai fermentasi dan non fermentasi Kedelai mentah
Penghilangan lemak (defatted) dengan n-heksan
Ekstraksi isoflavon dengan methanol 80% Optimasi fermentasi kedelai
detam 2 dengan B. natto
Analisis konsentrasi isoflavon dengan HPLC
19 Lampiran 2 Hasil Analisis HPLC sampel kedelai
Sampel Jenis
isoflavon
Waktu Retensi (min)
Area Konsentrasi (µg mL-1)
Konsentrasi
defatted (mg 100 g-1)
Konsentrasi
undefatted (mg 100 g-1)
Kedelai mentah Daidzein 27.59 366397 3.59 1.16 1.07
Genistein 32.02 604659 3.99 1.29 1.19
Kedelai non-fermentasi Daidzein 26.77 334858 3.28 1.09 0.98
Genistein 30.98 487289 3.22 1.07 0.96
Kedelai fermentasi Daidzein 27.12 2703849 26.49 9.59 8.68
Genistein 31.39 4356383 28.79 10.43 9.43
Rumus :
a.
Contoh perhitungan sampel kedelai mentah defatted daidzein:bobot kering sampel
b. Contoh perhitungan sampel kedelai mentah undefatted daidzein:
20
RIWAYAT HIDUP
Penulis merupakan putri dari bapak Samusi dan ibu Sadjiati yang lahir pada tanggal 21 April 1990 di Pontianak, Kalimantan Barat. Penulis adalah putri kedua dari tiga bersaudara. Penulis memulai pendidikannya di SD N 04 Pontianak dan lulus pada tahun 2002, dilanjutkan dengan pendidikan menengah di SMP N 03 Pontianak hingga tahun 2005 dan pada tahun 2008 penulis lulus dari SMA Negeri 1 Pontianak dan berhasil diterima untuk melanjutkan pendidikan tinggi di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan, penulis aktif di berbagai organisasi dan kepanitiaan. Penulis aktif sebagai staf Kementrian Sosial Kemasyarakatan (Soskemas) BEM KM periode 2008-2009 dan 2009-2010. Penulis juga bergabung dalam IPB
Debating Community (IDC), Organisasi Mahasiswa (OMDA) Kalimantan Barat, serta
menjadi kepala bidang kewirausahaan Himpunan Keprofesian Mahasiswa Biokimia (CREBs) periode 2010-2011. Selain aktif di berbagai organisasi, penulis juga berhasil mengukir sejumlah prestasi selama masa perkuliahannya, yakni menjadi penerima full
scholarship dari Yayasan Sime Darby (YSD) tahun 2009, menjadi juara 1 Century’s
Partner (Business Simulation) tahun 2008, juara 1 paper pada National Debating
Competition (NDC) UNPAD tahun 2010, penerima Program Kreativitas Mahasiswa