SINTESIS HIDROGEL POLI(ASAM AKRILAT)-ko-KITOSAN
DENGAN TEKNIK IRADIASI GAMMA SEBAGAI
ADSORBEN ION LOGAM TEMBAGA
DESY TRIASTUTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis Hidrogel Poli(Asam Akrilat)-ko-Kitosan dengan Teknik Iradiasi Gamma sebagai Adsorben Ion Logam Tembaga adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Desy Triastuti
ABSTRAK
DESY TRIASTUTI. Sintesis Hidrogel Poli(AsamAkrilat)-ko-Kitosan dengan Teknik Iradiasi Gamma sebagai Adsorben Ion Logam Tembaga. Dibimbing oleh SRI MULIJANI dan ERIZAL.
Hidrogel merupakan suatu jaringan rantai polimer hidrofilik yang tertaut silang dan mampu mengabsorbsi air yang tinggi hingga lebih dari 99.99 %, tetapi tidak larut dalam air disebabkan oleh struktur 3 dimensi pada jaringan polimernya. Tujuan penelitian ini adalah menyintesis hidrogel poli(asam akrilat)-ko-kitosan dengan teknik iradiasi gamma, mencirikan, dan menguji kapasitas adsorpsi terhadap ion Cu(II). Hidrogel hasil sintesis dengan ragam dosis iradiasi dicirikan dengan analisis fraksi gel, equilibrium degree of swelling (EDS), spektrofotometer inframerah transformasi fourier, differential scanning calorimetry, dan
thermogravimetric analysis. Pengujian kapasitas adsorpsi dilakukan terhadap ragam konsentrasi larutan awal ion Cu(II), waktu kontak dan bobot hidrogel. Nilai fraksi gel, EDS, dan kapasitas adsorpsi terbesar ialah berturu-turut 95 %, 2.16 g/g dan 850.36 mg/g ditunjukkan oleh dosis 10 kGy dan mengikuti model isotermal adsorpsi Freundlich. Perubahan warna bening kekuningan menjadi biru dan penurunan puncak serapan FTIR pada bilangan gelombang 3285 cm-1 dan 3400 cm-1 ditunjukkan oleh hidrogel yang telah mengadsorpsi ion Cu(II).
Kata kunci: adsorpsi, asam akrilat, hidrogel, iradiasi, kitosan
ABSTRACT
DESY TRIASTUTI. Synthesis Poly(Acrylic Acid)-co-Chitosan Hydrogel by Gamma Irradiation as Adsorbent Metal Copper Ion. Supervised by SRI MULIJANI and ERIZAL.
Hydrogel is a crosslinked hydrophilic polymer chain network and can highly absorb water more than 99.99 %, but insoluble in water due to the three-dimensional structure of the polymer network. The objectives of this research are to synthesize poly(acrylic acid)-co-chitosan hydrogel by gamma irradiation, to characterize it, and to analysis adsorption capacity of Cu(II) ion. The synthesized hydrogels by various irradiation doses were then characterized by analyzing gel fraction, equilibrium degree of swelling (EDS), fourier transform infrared spectrophotometer, differential scanning calorimetry, and thermogravimetric analysis. Adsorption capacity analysis was performed with various initial concentrations of Cu(II) ion, contact time, and mass adsorbent. The largest gel fraction, EDS, and adsorption capacity value was 95 %, 2.16 g/g and 850.36 mg/g, respectively as shown by 10 kGy irradiation dose and proven to be fit to Freundlich isothermal adsorption. Change from clear yellow to blue and decreasing absorption peak of FTIR at wavenumber 3285 cm-1 and 3400 cm-1 was observed when the hydrogel adsorbed Cu(II) ion.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
SINTESIS HIDROGEL POLI(ASAM AKRILAT)-ko-KITOSAN
DENGAN TEKNIK IRADIASI GAMMA SEBAGAI
ADSORBEN ION LOGAM TEMBAGA
DESY TRIASTUTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Sintesis Hidrogel Poli(Asam Akrilat)-ko-Kitosan dengan Teknik Iradiasi Gamma sebagai Adsorben Ion Logam Tembaga
Nama : Desy Triastuti NIM : G44124020
Disetujui oleh
Dr Sri Mulijani, MS Pembimbing I
Drs Erizal, APU Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini yang berjudul “Sintesis Hidrogel Poli(Asam Akrilat)-ko-Kitosan dengan Teknik Iradiasi Gamma sebagai Adsorben Ion Logam Tembaga” sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Januari hingga Juni 2015 di Pusat Aplikasi Teknologi Isotop dan Radiasi-BATAN, Jalan Cinere Pasar Jumat, Jakarta Selatan.
Ucapan terima kasih penulis sampaikan kepada Ibu Dr Sri Mulijani, MS dan Bapak Drs Erizal, APU selaku pembimbing yang telah banyak memberikan arahan, saran, dan motivasi. Di samping itu, penulis mengucapkan terima kasih kepada Pusat Aplikasi Teknologi Isotop dan Radiasi-BATAN, Jalan Cinere Pasar Jumat, Jakarta Selatan dan staf yang telah membantu selama penelitian.
Ungkapan terima kasih juga disampaikan kepada keluarga dan kerabat atas segala doa dan kasih sayangnya. Tak lupa juga terima kasih kepada keluarga besar IPB, dosen, staff, laboran dan mahasiswa kimia. Semoga Allah SWT memberikan balasan atas segala amal yang diperbuat dan senantiasa menyertai hamba-Nya dengan kasih dan sayang-Nya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Alat dan Bahan 2
Waktu dan Tempat Penelitian 2
Metode Penelitian 2
HASIL DAN PEMBAHASAN 4
Hidrogel Poli(Asam Akrilat)-ko-Kitosan 4
Spektrum FTIR 5
Termogram DSC 6
Termogram TGA 7
Derajat Kesetimbangan Penggembungan 8
Fraksi Gel 9
Kapasitas Adsorpsi pada Ragam Konsentrasi Ion Cu(II) 9
Kapasitas Adsorpsi pada Ragam Waktu Kontak 11
Kapasitas Adsorpsi pada Ragam Bobot Hidrogel 12
Isotermal Adsorpsi 13
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 14
DAFTAR GAMBAR
1 Spektrum IR asam akrilat (a), kitosan (b), poli(asam akrilat)-ko-kitosan dengan dosis iradiasi 10 (-), 20 (-), 30 kGy (-) dan yang telah
mengadsorpsi ion Cu(II) (-) (c) 6
2 Termogram DSC hidrogel poli(asam akrilat)-ko-kitosan pada dosis
iradiasi 10 (-), 20 (-), 30 (-) kGy 7
3 Termogram TGA hidrogel poli(asam akrilat)-ko-kitosan pada dosis
iradiasi 10 (-), 20 (-), 30 (-) kGy 7
4 Nilai EDS pada dosis iradiasi 10, 20, 30 kGy 8
5 Skema kondisi penggembungan hidrogel 8
6 Pengaruh ragam dosis iradiasi terhadap fraksi gel 9 7 Kenaikan kapasitas adsorpsi hidrogel dengan dosis iradiasi 10 ( ), 20
( ), dan 30 kGy ( ) pada tingkat ragam konsentrasi awal ion Cu(II) 10 8 Efisiensi adsorpsi hidrogel dengan dosis iradiasi 10 ( ), 20 ( ), dan 30
kGy ( ) pada ragam tingkat konsentrasi awal ion Cu(II) 10 9 Pengaruh waktu kontak terhadap kapasitas adsorpsi hidrogel 11 10 Efisiensi adsorpsi ion Cu(II) hidrogel pada ragam waktu kontak 12 11 Penurunan kapasitas adsorpsi pada berbagai kenaikan bobot hidrogel 12 12 Kenaikan efisiensi adsorpsi pada ragam bobot hidrogel 13
13 Kurva isotermal adsorpsi Langmuir 13
14 Kurva isotermal adsorpsi Freundlich 14
DAFTAR LAMPIRAN
1 Diagram alir penelitian 17
2 Penampilan fisik hidrogel 18
3 Tahapan reaksi sintesis hidrogel larutan asam akrilat 18
4 Data hasil pengujian EDS 19
5 Data hasil pengujian fraksi gel poli(asam akrilat)-ko-kitosan 19
6 Pembuatan larutan ion Cu(II) 1 mg/mL 20
7 Pembuatan larutan EDTA 5.6 mg/mL 20
8 Tabel absorbans larutan standar ion Cu(II) 20
9 Kapasitas adsorpsi hidrogel poli(asam akrilat)-ko-kitosan pada ragam
konsentrasi ion Cu(II) 21
10 Kapasitas adsorpsi hidrogel poli(asam akrilat)-ko-kitosan 10 kGy pada
ragam waktu kontak 23
11 Kapasitas adsorpsi hidrogel poli(asam akrilat)-ko-kitosan 10 kGy pada
ragam bobot hidrogel 24
1
PENDAHULUAN
Hidrogel merupakan jaringan polimer hidrofilik yang dapat menyerap sejumlah besar air sehingga dapat menyebabkan peningkatan volume secara drastis. Polimer ini berbentuk mirip air disebabkan oleh hampir seluruh bagiannya terdiri atas air. Namun, hidrogel juga menunjukkan sifat padatan disebabkan oleh adanya jaringan yang terbentuk akibat reaksi ikatan silang (Erizal 2010). Hidrogel secara intensif dalam skala besar telah dimanfaatkan dalam produk perawatan kepribadian. Pemanfaatan lainnya adalah sebagai immobilisasi enzim dan obat, preparatif pada kromatografi, bahan penyimpan air di bidang pertanian dan mengatasi masalah pencemar air. Namun, pemanfaatan untuk mengatasi masalah pencemaran air khususnya ion-ion logam bobot masih sangat sedikit yang dilaporkan. Hidrogel bila ditinjau dari struktur kimia khususnya yang disintesis dari monomer/polimer yang mengandung gugus-gugus amina (‒NH2), karboksilat (‒COOH), dan hidroksi (‒OH) seperti asam akrilat yang dapat berikatan dengan ion logam bobot berpotensi untuk mengatasi masalah pencemaran air (Erizal et al. 2011).
Penelitian yang telah dilakukan diantaranya adalah sintesis hidrogel linear densitas rendah polietilen-g-poli(asam akrilat)-ko-pati/organo monmorilonit sebagai adsorben untuk penghilangan Pb(II) dari larutan (Irani et al. 2014), adsorpsi ion Mn(II) oleh pencampuran kering polivinil alkohol/kitosan dari larutan (Abdeen et al. 2014) dan sifat flokulasi dan adsorpsi hidrogel terbiodegradasi getah karet tergrafting poli(akrilamid-ko-asam metakrilat) (Mittal
et al. 2015). Asam akrilat secara umum dipelajari karena murah dan mudah dipolimerisasi dengan bobot molekul yang lebih besar. Namun, asam akrilat kurang baik sebagai persyaratan keamanan lingkungan sehingga memunculkan ide dicampurkan dengan polimer alam yang mudah dibiodegradasi. Salah satu polimer alam tersebut adalah kitosan (Ge &Wang 2014). Kitosan banyak mengandung gugus ‒NH2 dan ‒OH yang dapat mengkelat ion logam berat, memberikan kapasitas dan selektivitas adsorpsi yang tinggi (Nadia et al. 2009). Kitosan tidak larut dalam beberapa jenis asam mineral dan air sehingga sangat menguntungkan apabila difungsikan sebagai adsorben (Haryani et al. 2007). Selain karena karakteristik kitosan yang istimewa, pemanfaatan kitosan juga didukung oleh bahan baku berupa cangkang kepiting yang berlimpah sehingga termasuk bahan agen penyerap yang murah (Kandile & Nasr 2009).
2
spektrofotometer inframerah transformasi fourier (FTIR), differential scanning calorimetry (DSC), dan thermogravimetric analysis (TGA). Pengujian kapasitas adsorpsi dilakukan terhadap ragam konsentrasi ion Cu(II), waktu kontak dan bobot hidrogel. Oleh sebab itu, penelitian ini bertujuan menyintesis hidrogel poli(asam akrilat)-ko-kitosan berikatan silang dengan ragam dosis iradiasi gamma, penciriannya dan analisis kapasitas adsorpsi terhadap ragam konsentrasi ion Cu(II), ragam waktu kontak dan ragam bobot hidrogel.
METODE
Alat dan Bahan
Bahan-bahan yang digunakan adalah asam akrilat (Merck), kitosan (Biotech Surindo), dan CuSO4 (Merck), dan Na2H2EDTA.2H2O (Merck).
Alat-alat yang digunakan adalah peralatan kaca, oven, neraca analitik, pengaduk magnetik, shaker incubator, saringan, kertas saring, alat Iradiator Panorama Serbaguna Irka, pH meter, spektrofotometer FTIR Prestige‒21, DSC‒ 60 Shimadzu, TGA‒60 Shimadzu, dan spektrofotometer UV‒Vis.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Januari–Juni 2015 di Pusat Aplikasi Teknologi Isotop dan Radiasi BATAN, Jalan Cinere Pasar Jumat, Jakarta Selatan.
Metode Penelitian
Tahapan penelitian meliputi sintesis hidrogel berbahan asam akrilat dan kitosan dengan teknik iradiasi gamma, dilakukan dengan ragam dosis iradiasi, penciriannya dan uji kapasitas adsorpsi terhadap ragam konsentrasi ion Cu(II), ragam waktu kontak, dan bobot hidrogel. Tahap pencirian meliputi penentuan fraksi gel, EDS, FTIR, DSC, dan TGA. Penentuan konsentrasi ion Cu(II) menggunakan spektrofotometer UV‒Vis melalui tahap pembentukan kompleks Cu‒EDTA. Diagram penelitian ini dapat dilihat pada Lampiran 1.
Sintesis Hidrogel dengan Ragam Dosis Iradiasi (modifikasi Erizal et al. 2011) Larutan asam akrilat 15% (v/v) ditambahkan kitosan sebanyak 3 g dan diaduk. Pengadukan dilanjutkan hingga homogen ±2 jam menggunakan pengaduk magnet. Dimasukkan ke dalam wadah plastik lalu disegel dan diiradiasi dengan ragam dosis 10, 20, dan 30 kGy. Hidrogel hasil iradiasi dipotong kecil-kecil lalu dikeringkan dalam oven pada suhu 60.0 °C ±72 jam hingga diperoleh bobot konstan. Hidrogel kering dihaluskan hingga berukuran 60-80 mesh.
Penentuan EDS (Gulrez et al. 2011)
3 S (g g) WWs
0
Keterangan :
WS = bobot hidrogel dalam keadaan pembengkakan optimum (g) W0 = bobot hidrogel awal (g)
Penentuan Fraksi Gel
Hidrogel berbentuk serbuk dimasukkan ke kantong kertas dan ditimbang (W0). Direndam dalam 100 mL akuades selama 24 jam, lalu dikeringkan di oven pada suhu 60.0 °C selama ±48 jam hingga bobot konstan. Selanjutnya ditimbang (W1), pengujian dilakukan sebanyak 3 kali ulangan. Fraksi gel dihitung menggunakan persamaan berikut:
raksi gel ( ) WW1
0 100
Keterangan :
W0 = Bobot awal berisi hidrogel kering (g)
W1 = Bobot akhir berisi hidrogel setelah perendaman (g)
Analisis Gugus Fungsi menggunakan Spektrofotometer FTIR
Hidrogel sebelum dan sesudah diuji kapasitas adsorpsi terhadap ion Cu(II) dikeringkan di oven pada suhu 60.0 °C hingga diperoleh bobot konstan. Hidrogel digerus halus dan dicampur dengan serbuk KBr (1:200), lalu dimasukkan ke wadah stainless steel. Analisis pemayaran dilakukan pada kisaran bilangan gelombang 4000‒400 cm-1 dengan kecepatan 20 cm-1 s-1.
Analisis Termal menggunakan DSC
Hidrogel dikeringkan di oven pada suhu 60.0 °C hingga diperoleh bobot konstan. Sebanyak ±10 mg diletakkan di atas wadah sampel dari alumunium lalu ditekan dan dimasukkan ke instrumen DSC. Pemanasan dilakukan dari suhu kamar hingga 500.0 °C dengan laju pemanasan 10 °C mnt-1.
Analisis Termal menggunakan TGA
Hidrogel dikeringkan di oven pada suhu 60.0 °C hingga diperoleh bobot konstan. Sebanyak ±10 mg diletakkan di atas wadah sampel dari alumunium lalu ditekan dan dimasukkan ke instrumen TGA. Pemanasan dilakukan dari suhu kamar hingga 500.0 °C dengan laju pemanasan 10 °C mnt-1.
Analisis Kapasitas Adsorpsi terhadap Ragam Konsentrasi Ion Cu(II) (modifikasi Tetala & Stamatialis 2013)
Analisis dilakukan dengan teknik kesetimbangan tumpak dan ragam konsentrasi ion Cu(II). Hidrogel dengan dosis iradiasi 10, 20, 30 kGy masing-masing sebanyak 50 mg ditambahkan ke larutan Cu(II) sebanyak 25 mL dengan ragam konsentrasi 1, 2, 3, 4, 5 mg/mL. Diaduk menggunakan shaker incubator
4
konsentrasi 1 mg/mL ditambahkan 1 mL larutan EDTA konsentrasi 5.6 mg/mL). Konsentrasi ion Cu(II) dalam filtrat diukur menggunakan spektrofotometer UV‒ Vis pada panjang gelombang 740 nm. Hidrogel dicirikan dengan FTIR.
Analisis Kapasitas Adsorpsi terhadap Ragam Waktu Kontak (modifikasi Tetala & Stamatialis 2013)
Analisis dilakukan dengan teknik kesetimbangan tumpak dan ragam waktu kontak. Hidrogel dengan dosis iradiasi 10 kGy sebanyak 50 mg ditambahkan ke larutan Cu(II) 1 mg/mL sebanyak 25 mL. Diaduk menggunakan shaker incubator
dengan kecepatan 120 rpm pada suhu ruang masing-masing selama 1, 2, 3, 4, 5 jam. Sampel disaring dan filtrat ditambahakan agen pengompleks EDTA. Konsentrasi ion Cu(II) dalam filtrat diukur menggunakan spektrofotometer UV‒ Vis pada panjang gelombang 740 nm. Hidrogel dicirikan dengan FTIR.
Analisis Kapasitas Adsorpsi terhadap Ragam Bobot Hidrogel
Analisis dilakukan dengan teknik kesetimbangan tumpak dan ragam bobot hidrogel. Hidrogel dengan dosis iradiasi 10 kGy sebanyak 10, 25, 50, 75, 100 mg masing-masing ditambahkan ke 25 mL larutan Cu(II) 1 mg/mL. Diaduk menggunakan shaker incubator dengan kecepatan 120 rpm pada suhu ruang selama 2 jam. Sampel disaring dan filtrat ditambahakan agen pengompleks EDTA. Konsentrasi ion Cu(II) dalam filtrat diukur menggunakan spektrofotometer UV‒ Vis pada panjang gelombang 740 nm. Hidrogel dicirikan dengan FTIR.
HASIL DAN PEMBAHASAN
Hidrogel Poli(Asam Akrilat)-ko-Kitosan
Sintesis hidrogel poli(asam akrilat)-ko-kitosan dilakukan dengan teknik iradiasi gamma pada ragam dosis iradiasi. Reaksi pembentukan kopolimer asam akrilat-kitosan diperkirakan mengikuti reaksi polimerisasi adisi sehingga akan terbentuk ikatan silang antara asam akrilat dan kitosan membentuk poli(asam akrilat)-ko-kitosan. Tahapan-tahapan reaksi yang terjadi terdiri atas tahap inisiasi, propagasi, dan terminasi (Lampiran 3). Larutan yang terdiri atas komponen asam akrilat, air dan kitosan jika dipapari iradiasi gamma, maka terjadi reaksi berantai yang dimulai dari tahap inisiasi. Pada tahap tersebut, air mengalami reaksi radiolisis membentuk radikal OH dan H yang akan bergabung membentuk gas H2 dan O2. Radikal H dapat menumbuk asam akrilat dan membentuk radikal asam akrilat. Selanjutnya adalah tahap kedua yaitu tahap propagasi. Pada tahap ini radikal asam akrilat bereaksi membentuk ikatan silang radikal-radikal homopolimer yaitu poli(asam akrilat). Reaksi ini berlangsung terus menerus dan radikal-radikal polimer (P·) bereaksi satu dengan yang lainnya membentuk molekul polimer (PP) berikatan silang dengan bobot molekul yang lebih besar pada tahap terminasi.
5 mekanik yang baik. Kitosan merupakan polimer yang bersifat hidrofobik yang tidak larut air. Gejala tersebut dapat diamati ketika pencampuran kitosan dalam larutan membutuhkan waktu ±3 jam dengan menggunakan pengaduk magnetik. Walau demikian, dengan adanya kandungan gugus ‒NH2 dan ‒OH dalam struktur molekulnya, kitosan mampu berinteraksi dengan molekul air membentuk ikatan hidrogen.
Penampilan fisik hidrogel poli(asam akrilat)-ko-kitosan dari hasil sintesis dengan ragam dosis iradiasi sebelum dan sesudah mengadsorpsi ion Cu(II) ditunjukan pada Lampiran 2. Hasilnya menunjukkan bahwa dengan meningkatnya dosis iradiasi pembentukan gel, maka hidrogel yang diperoleh semakin kenyal dan keras setelah dikeringkan. Hidrogel mengalami perubahan warna sebelum dan sesudah mengadsorpsi ion Cu(II) yaitu dari bening kekuningan menjadi biru. Perubahan warna ini sebagai tanda awal telah berhasilnya sintesis hidrogel dan proses adsorpsi ion Cu(II) oleh hidrogel tersebut. Di samping itu, dengan meningkatnya dosis iradiasi dihasilkan gelembung yang semakin banyak. Hal ini kemungkinan disebabkan oleh pengaruh proses iradiasi sehingga terjadi reaksi pengikatan silang yang mengakibatkan pembentukan gas di dalam hidrogel. Semakin tinggi dosis iradiasi, ikatan silang yang terbentuk semakin banyak sehingga gas yang terbentuk semakin terjebak dan sulit keluar dari hidrogel. Oleh sebab itu, hidrogel dengan dosis tertinggi yaitu 30 kGy menghasilkan gelembung yang paling banyak.
Spektrum FTIR
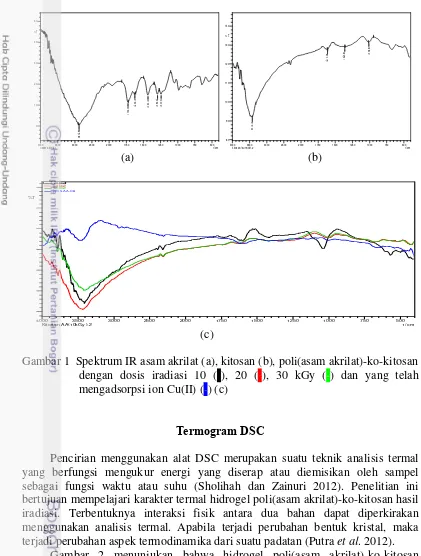
Gugus fungsi asam akrilat, kitosan, dan hidrogel poli(asam akrilat)-ko-kitosan dianalisis berdasarkan hasil spektrum FTIR pada Gambar 1 untuk menentukan keberhasilan proses taut silang. FTIR merupakan suatu metode yang dapat mengamati interaksi molekul dengan radiasi elektromagnetik yang berada pada daerah panjang gelombang 0.75‒1000 µm atau pada bilangan gelombang 13000‒10 cm-1 (Stuart 2004). Spekrum FTIR kitosan menunjukkan puncak serapan pada bilangan gelombang 3100.65 cm-1(gugus –NH dan –OH), 2819.85 cm-1 (gugus –CH), 1640 cm-1 (gugus C=O), dan 1512.05 cm-1 (gugus H2C=CH2). Spektrum kitosan yang telah mengalami proses taut silang dengan asam akrilat menunjukkan puncak serapan pada bilangan gelombang 3436.91 cm-1 (gugus – NH dan –OH), 1645 cm-1 (gugus C=O) sedangkan puncak serapan pada bilangan 1562 cm-1 (gugus H2C=CH2) tidak tampak pada spektrum poli(asam akrilat)-ko-kitosan hasil sintesis ini. Hal ini membuktikan bahwa proses taut silang antara asam akrilat dan kitosan terjadi pada karbon rangkap dua.
6
(a) (b)
(c)
Gambar 1 Spektrum IR asam akrilat (a), kitosan (b), poli(asam akrilat)-ko-kitosan dengan dosis iradiasi 10 (-), 20 (-), 30 kGy (-) dan yang telah mengadsorpsi ion Cu(II) (-) (c)
Termogram DSC
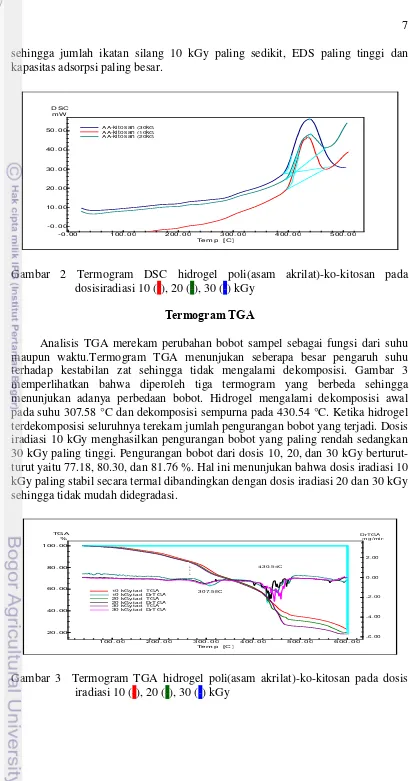
Pencirian menggunakan alat DSC merupakan suatu teknik analisis termal yang berfungsi mengukur energi yang diserap atau diemisikan oleh sampel sebagai fungsi waktu atau suhu (Sholihah dan Zainuri 2012). Penelitian ini bertujuan mempelajari karakter termal hidrogel poli(asam akrilat)-ko-kitosan hasil iradiasi. Terbentuknya interaksi fisik antara dua bahan dapat diperkirakan menggunakan analisis termal. Apabila terjadi perubahan bentuk kristal, maka terjadi perubahan aspek termodinamika dari suatu padatan (Putra et al. 2012).
Gambar 2 menunjukan bahwa hidrogel poli(asam akrilat)-ko-kitosan membentuk satu puncak termogram pada semua dosis iradiasi sehingga membuktikan proses taut silang antara asam akrilat dan kitosan telah berhasil. Disamping itu, dengan adanya ragam dosis iradiasi menghasilkan ragam nilai suhu leleh. Nilai tersebut berhubungan dengan jumlah ikatan silang yang terbentuk. Suhu leleh yang tinggi menunjukan jumlah ikatan silang yang semakin banyak sehingga menyebabkan nilai EDS menurun dan kemungkinan nilai kapasitas adsorpsi akan menurun. Hidrogel dengan dosis iradiasi 10 kGy menghasilkan nilai suhu leleh yang paling rendah sedangkan 30 kGy paling tinggi
7 sehingga jumlah ikatan silang 10 kGy paling sedikit, EDS paling tinggi dan kapasitas adsorpsi paling besar.
-0.00 100. 00 200. 00 300. 00 400. 00 500. 00
Gambar 2 Termogram DSC hidrogel poli(asam akrilat)-ko-kitosan pada dosisiradiasi 10 (-), 20 (-), 30 (-) kGy
Termogram TGA
Analisis TGA merekam perubahan bobot sampel sebagai fungsi dari suhu maupun waktu.Termogram TGA menunjukan seberapa besar pengaruh suhu terhadap kestabilan zat sehingga tidak mengalami dekomposisi. Gambar 3 memperlihatkan bahwa diperoleh tiga termogram yang berbeda sehingga menunjukan adanya perbedaan bobot. Hidrogel mengalami dekomposisi awal pada suhu 307.58 °C dan dekomposisi sempurna pada 430.54 °C. Ketika hidrogel terdekomposisi seluruhnya terekam jumlah pengurangan bobot yang terjadi. Dosis iradiasi 10 kGy menghasilkan pengurangan bobot yang paling rendah sedangkan 30 kGy paling tinggi. Pengurangan bobot dari dosis 10, 20, dan 30 kGy berturut-turut yaitu 77.18, 80.30, dan 81.76 %. Hal ini menunjukan bahwa dosis iradiasi 10 kGy paling stabil secara termal dibandingkan dengan dosis iradiasi 20 dan 30 kGy sehingga tidak mudah didegradasi.
100. 00 200. 00 300. 00 400. 00 500. 00 600. 00
8
Derajat Kesetimbangan Penggembungan
Pengujian derajat kesetimbangan penggembungan atau EDS dilakukan dengan ragam dosis iradiasi untuk penentuan dosis iradiasi optimum selama 24 jam. EDS suatu hidrogel merupakan salah satu parameter penting yang menunjukkan nisbah pengembung pada kondisi pengembungan maksimum dalam jangka waktu tertentu. Kondisi ini terjadi akibat adanya tarik-menarik gugus hidrofilik yang berikatan hidrogen dengan air untuk mengembung dan kecenderungan tarik-menarik antar gugus hidrofilik pada keadaan kesetimbangan (Erizal 2010). Hasil pengujian diperoleh bahwa semakin besar dosis iradiasi yang digunakan, maka nilai EDS semakin menurun (Gambar 4).
Gambar 4 Nilai EDS pada dosis iradiasi 10, 20, 30 kGy
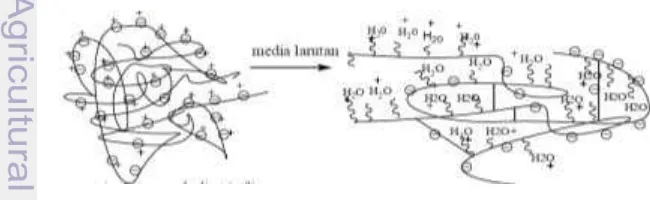
Dosis iradiasi 10 kGy menghasilkan nilai EDS terbesar yaitu 2.1656 g/g sedangkan nilai EDS dari dosis iradiasi 20 dan 30 kGy berturut-turut yaitu 2.1085 dan 2.0305 g/g. Kecenderungan ini dapat disebabkan oleh semakin besar dosis iradiasi yang digunakan, maka semakin meningkat kerapatan ikat silang yang terbentuk dalam struktur jaringan hidrogel sehingga difusi air ke dalam matriks relatif rendah. Mekanisme absorpsi air oleh hidrogel poli(asam akrilat)-ko-kitosan dapat dijelaskan dari bentuk awalnya dalam kondisi kering dan setelah berada dalam media larutan. Struktur hidrogel dalam bentuk keringnya seperti gulungan yang melipat (Gambar 5) yang disepanjang rantai utamanya terdiri atas gugus hidrofilik berupa gugus ‒COOH dari asam akrilat yang terdisosiasi dalam air membentuk ion karboksil dengan muatan negatif. Ion-ion tersebut saling tolak menolak sepanjang rantai polimer yang kontak dengan lebih banyak gugus ‒OH. Hal ini akan mengakibatkan terekspansinya ukuran hidrogel dan menyebabkan peningkatan jumlah air yang diserap.
Gambar 5 Skema kondisi penggembungan hidrogel (Erizal et al. 2011) 2.00
2.05 2.10 2.15 2.20
0 10 20 30 40
EDS (g
/g
)
9 Adanya gugus ‒NH2 dan ‒OH dari kitosan yang membentuk ikatan hidrogen dengan molekul air juga menyumbangkan peningkatan jumlah air yang diserap oleh hidrogel. Proses masuknya air berlangsung secara terus-menerus sebagai fungsi waktu dan akan berakhir setelah tercapai kondisi kesetimbangan (jenuh). Kondisi kesetimbangan ini yang dikenal sebagai EDS. Laju EDS dipengaruhi oleh jenis senyawa pembentuk dan porositasnya. Semakin hidrofilik hidrogel yang disertai porositas yang tinggi, maka kondisi EDS semakin cepat tercapai (Prilian 2002). Pada penelitian ini pengaruh jenis senyawa pembentuk tidak berpengaruh karena jenis senyawa pembentuk dan jumlahnya sama.
Fraksi Gel
Hasil Pengujian fraksi gel (Gambar 6) menunjukan bahwa dengan naiknya dosis iradiasi, maka fraksi gel yang terbentuk semakin kecil. Fraksi gel tertinggi dihasilkan oleh dosis iradiasi 10 kGy. Nilai ini mencerminkan fraksi jumlah bahan awal baik monomer atau polimer yang diubah menjadi hidrogel. Parameter ini juga menunjukkan nilai efisiensi dari proses dalam sintesis hidrogel yang bergantung pada kepekaan dari bahan terhadap iradiasi yang dipaparkan. Semakin peka bahan terhadap iradiasi, maka semakin tinggi efiensi proses tersebut (Erizal
et al. 2011). Oleh sebab itu, dapat disimpulkan bahwa dosis iradiasi 10 kGy merupakan dosis optimum.
Gambar 6 Pengaruh ragam dosis iradiasi terhadap fraksi gel
Kapasitas Adsorpsi pada Ragam Konsentrasi Ion Cu(II)
10
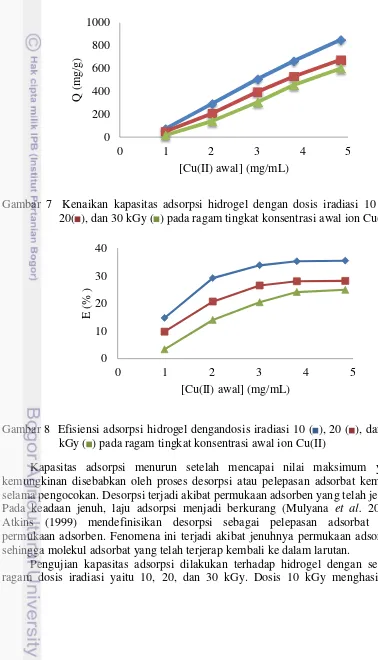
meningkatnya kekuatan pergerakan dari hasil gradien konsentrasi. Hal ini sesuai dengan hasil penelitian dari Barros et al. (2003) yang menyatakan bahwa konsentrasi yang tinggi akan menyebabkan jumlah molekul dalam larutan bertambah sehingga meningkatkan interaksi molekul adsorbat dengan adsorben. Interaksi yang tinggi akan meningkatkan laju reaksi sehingga adsorbat yang terjerap semakin besar.
Gambar 7 Kenaikan kapasitas adsorpsi hidrogel dengan dosis iradiasi 10 ( ), 20( ), dan 30 kGy ( ) pada ragam tingkat konsentrasi awal ion Cu(II)
Gambar 8 Efisiensi adsorpsi hidrogel dengandosis iradiasi 10 ( ), 20 ( ), dan 30 kGy ( ) pada ragam tingkat konsentrasi awal ion Cu(II)
Kapasitas adsorpsi menurun setelah mencapai nilai maksimum yang kemungkinan disebabkan oleh proses desorpsi atau pelepasan adsorbat kembali selama pengocokan. Desorpsi terjadi akibat permukaan adsorben yang telah jenuh. Pada keadaan jenuh, laju adsorpsi menjadi berkurang (Mulyana et al. 2003). Atkins (1999) mendefinisikan desorpsi sebagai pelepasan adsorbat dari permukaan adsorben. Fenomena ini terjadi akibat jenuhnya permukaan adsorben sehingga molekul adsorbat yang telah terjerap kembali ke dalam larutan.
Pengujian kapasitas adsorpsi dilakukan terhadap hidrogel dengan semua ragam dosis iradiasi yaitu 10, 20, dan 30 kGy. Dosis 10 kGy menghasilkan
0 200 400 600 800 1000
0 1 2 3 4 5
Q (
mg
/g
)
[Cu(II) awal] (mg/mL)
0 10 20 30 40
0 1 2 3 4 5
E (
%
)
11 kapasitas adsorpsi terbesar pada berbagai konsentrasi awal ion Cu(II). Hal ini kemungkinan disebabkan oleh kandungan gugus aktif yang lebih banyak dan pori-pori hidrogel yang kurang rapat sehingga memudahkan proses adsorpsi. Semakin besar ukuran pori-pori adsorben, maka adsorbat akan semakin mudah terjerap (Suzuki 1990). Nilai ini berkorelasi dengan nilai EDS yaitu pada dosis tersebut menghasilkan nilai tertinggi sehingga dosis iradiasi terbaik adalah 10 kGy. Di samping itu, Gambar 7 menunjukan bahwa konsentrasi awal ion Cu(II) tertinggi yaitu 5 mg/mL bukan merupakan konsentrasi optimum karena kapasitas adsorpsi yang lebih besar masih mungkin diperoleh pada konsentrasi yang lebih tinggi walaupun perubahannya tidak terlalu besar. Hal ini diperkuat dari hasil efisiensi pada Gambar 8, nilainya terus meningkat dan setelah konsentrasi 3 mg/mL perubahannya mulai kecil yaitu dari 33.80‒35.47 (efisiensi dari dosis iradiasi 10 kGy).
Kapasitas Adsorpsi pada Ragam Waktu Kontak
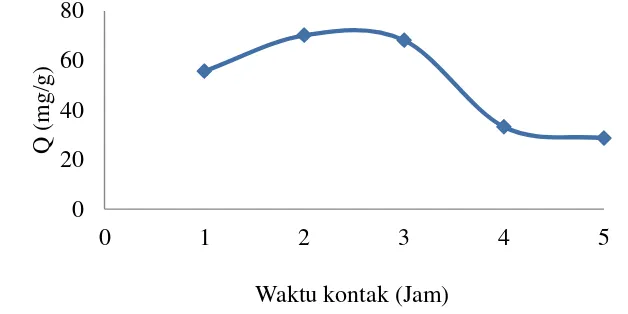
Pengaruh waktu kontak terhadap kapasitas adsorpsi dipelajari pada konsentrasi awal 1 mg/mL dengan dosis iradiasi hidrogel optimum yaitu 10 kGy. Hasil analisis dijelaskan pada Gambar 9 dan 10 yang menunjukan bahwa kapasitas adsorpsi terus mengalami kenaikan hingga 70.14 mg/g pada jam ke-2 (Lampiran 12), selanjutnya menurun pada jam ke-3 hingga 68.11 mg/g. Oleh sebab itu, dapat disimpulkan bahwa kapasitas dan efisiensi adsorpsi meningkat seiring dengan bertambahnya waktu adsorpsi, selanjutnya cenderung stabil dan turun setelah melewati waktu optimum. Penurunan kapasitas adsorpsi kemungkinan disebabkan oleh proses desorpsi ikatan dan sisi aktif antara adsorben dan ion Cu(II) pada adsorben yang telah mengalami penjenuhan oleh adsorbat. Hasil yang diperoleh sesuai dengan penelitian Notodarmojo (2004) yang menyatakan bahwa waktu kontak antara adsorbat dan adsorben yang melebihi waktu optimum dapat menyebabkan desorpsi. Waktu optimum atau waktu setimbang adalah waktu ketika adsorben telah jenuh dengan adsorbat. Kapasitas adsorpsi 70.14 mg/g artinya setiap 1 gram adsorben hidrogel poli(asam akrilat)-ko-kitosan mampu mengadsorpsi 70.14 mg ion Cu(II).
Gambar 9 Pengaruh waktu kontak terhadap kapasitas adsorpsi hidrogel 0
20 40 60 80
0 1 2 3 4 5
Q (
mg
/g
)
12
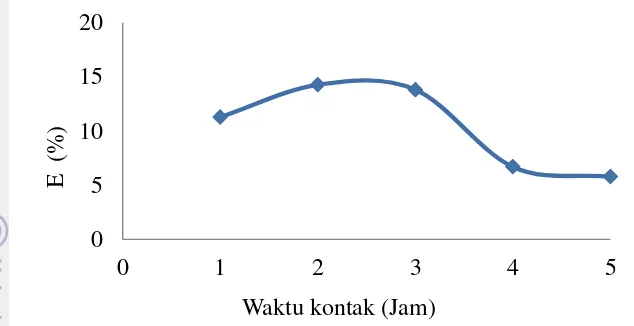
Gambar 10 Efisiensi adsorpsiion Cu(II) pada ragammwaktu kontak
Kapasitas Adsorpsi pada Ragam Bobot Hidrogel
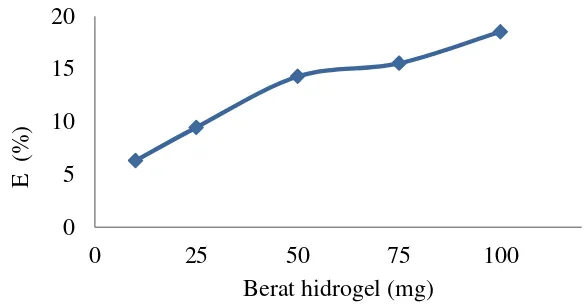
Faktor lain yang mempengaruhi kapasitas dan efisiensi adsorpsi adalah bobot adsorben. Semakin banyak bobot adsorben, diharapkan luas permukaan akan lebih besar sehingga mampu mengadsorpsi adsorbat lebih banyak. Hasil penelitian ini menunjukkan bahwa pada peningkatan bobot adsorben, nilai kapasitas adsorpsi berbanding terbalik dengan efisiensi (Gambar 11 dan 12). Hal ini disebabkan oleh kenaikan bobot adsorben dengan waktu proses adsorpsi dan konsentrasi adsorbat yang tetap, maka menyebabkan peningkatan jumlah tapak aktif yang akan meningkatkan penyebaran adsorbat sehingga waktu yang dibutuhkan untuk mencapai kesetimbangan adsorpsi akan lebih lama. Hasil ini sesuai dengan penelitian Demirbas et al. (2004) yang menyimpulkan bahwa kapasitas adsorpsi akan semakin rendah dengan meningkatnya bobot adsorben dikarenakan tapak aktif dalam jumlah besar membutuhkan waktu kesetimbangan yang lebih lama. Walau demikian, pada bobot 50 mg terlihat perubahan nilai yang tidak signifikan yaitu dari 14.27‒15.52 sehingga dapat digunakan dalam pengujian.
Gambar 11 Penurunan kapasitas adsorpsi pada berbagai kenaikan bobot hidrogel 0
5 10 15 20
0 1 2 3 4 5
E (
%
)
Waktu kontak (Jam)
0 50 100 150 200
0 25 50 75 100
Q (
mg
/g
)
13
Gambar 12 Kenaikan efisiensi adsorpsi pada ragam bobot hidrogel
Isotermal Adsorpsi
Hasil analisis nilai kapasitas adsorpsi dapat ditentukan fenomena isotermal adsorpsi yang terjadi. Fenomena tersebut digambarkan melalui suatu hubungan antara jumlah adsorbat yang terjerap per satuan bobot adsorben dan konsentrasi kesetimbangan. Hubungan ini disebut sebagai isotermal adsorpsi. Tipe isotermal adsorpsi dapat digunakan untuk mengetahui proses terbentuknya lapisan adsorbat pada permukaan adsorben. Isotermal Freundlich dan Langmuir pada umumnya dianut oleh adsorpsi padat‒cair (Atkins 1999). Analisis model Langmuir dan Freundlich dilakukan dengan membuat persamaan garis linear antara Ce terhadap Ce/Q untuk model isotermal Langmuir dan Log Ce terhadap Log Q untuk model Freundlich.
Gambar 13 dan 14 menunjukan bahwa proses adsorpsi adsorben hidrogel poli(asam akrilat)-ko-kitosan pada semua ragam dosis iradiasi mengikuti tipe isotermal Freundlich. Hal ini disebabkan oleh tipe isotermal Freundlich memiliki linearitas 96.40‒97.47 % yang lebih tinggi dibandingkan tipe isotermal Langmuir. Pendekatan tersebut mengasumsikan bahwa adsorbat yang teradsorpsi membentuk
multilayer, permukaan adsorbat berbeda daya ikatnya, terdapat antaraksi lateral antarmolekul adsorbat, dan molekul adsorbat yang teradsorpsi tidak terlokalisasi sehingga molekul-molekul tersebut bergerak pada permukaan.
Gambar 13 Kurva isotermal adsorpsi Langmuir ( y = −0.0031x + 0.0117, R2 = 0.6264), ( y = −0.0047x + 0.0188, R2 = 0.6697),
( y = −0.0177x + 0.0593, R2 = 0.6445) 0
5 10 15 20
0 25 50 75 100
E (
%
)
Berat hidrogel (mg)
0.00 0.02 0.04 0.06
0 1 2 3 4
C
e/Q
14
Gambar 14 Kurva isotermal adsorpsi Freundlich ( y = 1.8962x + 2.0750, R2 = 0.9640), ( y = 1.9873x + 1.8408, R2 = 0.9747),
( y = 2.7638x + 1.3591, R2 = 0.9696)
SIMPULAN DAN SARAN
Simpulan
Hidrogel poli(asam akrilat)-ko-kitosan dapat disintesis dari asam akrilat dan kitosan menggunakan teknik iradiasi gamma. Dosis iradiasi yang menghasilkan nilai fraksi gel dan EDS terbaik adalah 10 kGy, fraksi gel sebesar 95.01 %, dan EDS sebesar 2.1656 g/g. Kapasitas adsorpsi pada dosis iradiasi 10 kGy menghasilkan nilai terbesar dibandingkan dosis iradiasi 20 dan 30 kGy. Ragam waktu kontak dan bobot hidrogel terbaik adalah pada jam ke-2 dan bobot 50 mg.
Saran
Pengaruh suhu dan pH terhadap proses adsorpsi dari hidrogel poli(asam akrilat)-ko-kitosan perlu dilakukan untuk mengetahui pengaruh termodinamika dan pH optimum sehingga hidrogel dapat bekerja secara maksimum dan meningkatkan % efisiensi.
DAFTAR PUSTAKA
Abdeen Z, Mohammad SG, Mahmoud MS. 2014. Adsorption of Mn(II) ion on polyvinyl alcohol/chitosan dry blending from aqueous solution. J ENMM. 2215-1532. doi.org/10.1016/j.enmm.2014.10.001.
Atkins PW. 1999. Kimia Fisik Jilid 1. Irma I Kartohadiprojo, penerjemah; Rohhadyan T, Hadiyana K, editor. Jakarta: Erlangga. Terjemahan dari:
Physical Chemistry.
0.0 1.0 2.0 3.0 4.0
-0.1 0.0 0.1 0.2 0.3 0.4 0.5
L
og
Q
15 Barros JLM, Macedo GR, Duarte MML, Silva EP, Lobato AKCL. 2003. Biosorption of cadmium using the fungus Aspergillusniger. Braz J Chem Eng.20:1-17.doi.org/10.1590/S0104-66322003000300003.
Demirbas E, Kobya M, Senturk E, Ozkan T. 2004. Adsorption kinetics for the adsorbent of chromium(VI) from aqueous solutions on the activated carbons prepared from agricultural wastes. Water SA. 30:533-540. doi. org/10.4314/ wsa.v30i4.5106
Erizal. 2010. Sintesis hidrogel superabsorben poli(akrilamida-ko-kalium akrilat) dengan teknik radiasi dan penciriannya. JIlm Aplik Isot Rad.6(2):105-116. Erizal, Abidin Z, Deswita, Sudirman. 2011. Superabsorben
Poli(akrilamida-ko-asam akrilat)-kitosan hasil iradiasi gamma untuk adsorpsi ion logam Cu2+ dan Fe3+. Indones J Mater Scien. 12(3):168-174.
Ge H, Wang S. 2014. Thermal of chitosan-acrylic acid superabsorbent: optimization, characteristic and water absorbency. J carbohyd
Polym.113:296-303.doi:10.1016/j.carbpol.2014.06.078.
Gulrez SKH, Al-Assaf S, Phillips GO. 2011. Hydrogel: Methods of Preparation, Characterisation, and Applications, Progress in Molecular and Enviromental Bioengineering-From Analysis and Modeling to Technology Applications. Carpi A, editor. Rijeka(HR): InTech.
Haryani K, Hargono, Budiyati CS. 2007. Pembuatan kitosan dari kulit udang untuk mengadsorpsi logam krom (Cr6+) dan Cu (Cu). 11(2):86-90. Semarang : Teknik Kimia. Fakultas Teknik. Universitas Diponegoro. Irani M, Ismail H, Ahmad Z, Fan M. 2014. Synthesis of linear low-density
polyethylene-g-poly (acrylic acid)–co–strach/organo-montmorillonite hydrogel composite as an adsorbent for removal of pb (II) from aqueous solutions. J Enviro Scien. 27:9-20.doi:10.1016/j.jes.2014.05.049.
Mittal H, Jindal R, Kaith BS, Maity A, Ray SS. 2015. Flocculation and adsorption properties of biodegradable gum-ghatti-grafted poly(acrylamide-co methacrylic acid) hydrogels. J Carbohyd Polym.115:617628.doi:10.1016/j. carbpol.2014.09.026.
Mulyana L, Pradiko H, Nasution K. 2003. Pemilihan persamaan adsorbsi isoterm pada penentuan kapasitas adsorbsi kulit kacang tanah terhadap zat warna golden yellow. Infomatek Teknik Lingkukngan. Universitas Pasundan. Nadia G, Kandile, Nasr AS. 2009. Environment friendly modified chitosan
hydrogels as a matrix for adsorption of metal ions, synthesis and characterization.J Carbohyd. Polym.78:753759.doi:10.1016/j.carpol.2009. 06.008.
Notodarmojo S. 2004. Pencemaran Tanah dan Air Tanah. Bandung: ITB Pr. Prilian SM. 2002. Sintesis Polimer Superabsorben dari Hidrogel Kitosan Terikat
Silang. [Skripsi]. Depok: Departemen Kimia, Fakultas MIPA, Universitas Indonesia.
Stuart B. 2004. Infrared Spectroscopy: Fundamentals and Applications.NewYork (US): John Wiley & Sons.
Suzuki M. 1990. Adsorption Engineering. Tokyo : Kodansha.
16
17 Lampiran 1 Diagram alir penelitian
FTIR DSC TGA Fraksi EDS
gel Larutan asam akrilat 15 % (v/v) dengan penambahan 3 g kitosan
Iradiasi pada dosis 10, 20, 30 kGy
Hidrogel
poli(asam akrilat)-ko-kitosan
Kapasitas adsorpsi Karakterisasi
FTIR
Hidrogel
poli(asam akrilat)-ko-kitosan pada dosis iradiasi optimum Variasi konsentrasi
ion Cu(II)
Variasi waktu kontak adsorpsi
18
Lampiran 2 Penampilan fisik hidrogel
Hidrogel Dosis
kGy Bentuk Penampilan
Warna Sebelum
adsorpsi
Sesudah adsorpsi Poli
(asam akrilat) -ko-kitosan
10 Gel
(+) *
Bening
kekuningan Biru
20 Gel
(++) **
Bening
kekuningan Biru
30 Gel
(+++) ***
Bening
kekuningan Biru Keterangan:
+ = tekstur kenyal * = terdapat gelembung
Lampiran 3 Tahapan reaksi sintesis hidrogel larutan asam akrilat Tahap inisiasi
Tahap propagasi
19 Lampiran 4 Data hasil pengujian EDS
Dosis iradiasi
hidrogel pada keadaan s elling (g) hidrogel pada keadaan kering (g)
EDS = 0.27300.1264 2.1598 g g
20
Lampiran 6 Pembuatan larutan ion Cu(II) 1 mg/mL
Larutan 1 mg/mL = mg
Lampiran 7 Pembuatan larutan EDTA 5.6 mg/mL Larutan 5.6 mg/mL = mg Lampiran 8 Tabel absorbans larutan standar ion Cu(II)
Larutan [Cu
Kurva standar ion Cu(II)
21
Lampiran 9 Kapasitas adsorpsi hidrogel poli(asam akrilat)-ko-kitosan pada ragam konsentrasi ion Cu(II)
23
24
25
Contoh perhitungan
Persamaan garis y = 0.1331x + 0.0142 Dosis iradiasi 10 kGy pengaruh konsentrasi ion Cu(II) A = 0.3201 0.3201 = 0.1331 x + 0.0142
x = 2.2983 mg/mL [CuEDTA] akhir = x x FP
= 2.2983 mg/mL x 1 = 2.2983 mg/mL
Mol CuEDTA akhir = [CuEDTA] akhir x V : Mr CuEDTA = 2.2983 mg/mL x 10 mL : 353.5866 g/mol = 6.4999 x 10−5 mol
Mol CuEDTA akhir ≈ mol Cu(II) akhir 6.4999 x 10−5 mol
[Cu(II)] akhir = mol Cu(II) akhir x Ar Cu(II) g/mol : V = 6.4999 x 10−5 mol x 65.37 g/mol : 5 mL = 0.8498 mg/mL
[Cu(II)] teradsorpsi = [Cu(II)] awal terukur - [Cu(II)] akhir = 0.9968 mg/mL - 0.8498 mg/mL = 0.1470 mg/mL
Efisiensi (E) = Cu(II) teradsorpsi
Cu(II) a al terukur x 100% = 0.1470 mg m
0.9968 mg m x 100%
= 14.74%
Kapasitas adsorpsi (Q) = Cu(II) teradsorpsi hidrogel x V = 0.1470 mg m
0.0503 g x 25 mL
1
Lampiran 12 Isotermal adsorpsi
Dosis iradiasi
(kGy)
[Cu (II)] akhir (Ce)
(mg/mL)
Rerata daya serap (Q) (mg/g)
Langmuir
R²
Freundlich
R²
Ce Ce/Q Log Ce Log Q
10
0.8500 72.7557 0.8500 0.0117
0.6264
-0.0706 1.8619
0.9640
1.4313 292.2318 1.4313 0.0049 0.1557 2.4657
1.9963 507.6033 1.9963 0.0039 0.3002 2.7055
2.4641 665.0966 2.4641 0.0037 0.3917 2.8229
3.1216 850.3636 3.1216 0.0037 0.4944 2.9296
20
0.8996 48.4370 0.8996 0.0186
0.6697
-0.0459 1.6852
0.9747
1.6033 206.8046 1.6033 0.0078 0.2050 2.3156
2.2173 396.7000 2.2173 0.0056 0.3458 2.5985
2.7400 529.5821 2.7400 0.0052 0.4378 2.7239
3.4758 675.0612 3.4758 0.0051 0.5410 2.8293
30
0.9635 16.4919 0.9635 0.0584
0.6445
-0.0161 1.2173
0.9696
1.7376 140.2927 1.7376 0.0124 0.2400 2.1470
2.4002 305.8406 2.4002 0.0078 0.3802 2.4855
2.8882 455.0562 2.8882 0.0063 0.4606 2.6581
3.6304 599.8198 3.6304 0.0061 0.5600 2.7780
RIWAYAT HIDUP
Penulis dilahirkan di Indramayu pada tanggal 16 Desember 1990. Penulis lulus dari SMA Negeri 1 Sindang Indramayu pada tahun 2008 dan pada tahun yang sama diterima di Program Diploma Jurusan Analis Kimia Universitas Padjadjaran (UNPAD) Bandung melalui jalur beasiswa Talent-scouting (kerjasama pemerintah Indramayu dan UNPAD). Penulis lulus dari Diploma UNPAD pada tahun 2011 dan melanjutkan pendidikan S1 melalui Program Alih Jenis Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam IPB pada tahun 2013.