KARAKTERISASI PROTEIN ANTIGENIK LARVA 3
Gnathostoma spinigerum PADA IKAN BELUT RAWA
(Monopterus alba) MENGGUNAKAN TEKNIK
IMMUNOBLOTTING
KHUMAIRA PUSPASARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Protein Antigenik Larva 3 Gnathostoma spinigerum pada Ikan Belut Rawa (Monopterus alba) Menggunakan Teknik Immunoblotting adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2013
RINGKASAN
KHUMAIRA PUSPASARI. Karakterisasi Protein Antigenik Larva 3 Gnathostoma spinigerum pada Ikan Belut Rawa (Monopterus alba) Menggunakan Teknik Immunoblotting. Dibimbing oleh RISA TIURIA dan ELOK BUDI RETNANI.
Gnathostoma spinigerum merupakannematoda usus pada karnivora yang dapat menyebabkan gnathostomiasis pada manusia. Manusia dapat terinfeksi karena memakan inang antara, seperti ikan air tawar, katak, burung dan ular mentah/kurang matang yang mengandung kista larva tahap 3 (L3) Gnathostoma spp. Larva 3 G. spinigerum paling sering ditemukan pada hati dan daging ikan belut rawa (Monopterus alba). Tujuan penelitian ini adalah untuk mengkarakterisasi protein produk Ekskretori-Sekretori (ES) larva 3 G. spinigerum (ES-L3-Gs) melalui reaksi antara antigen ES-L3-Gs dengan antibodi poliklonal immunoglobulin G (IgG) kelinci anti ES-L3-Gs menggunakan teknik Western blotting. Hasil penelitian ini diharapkan dapat menjadi dasar pencarian antigen spesifik untuk pengembangan metode immunodiagnostik maupun molekuler dalam mendiagnosis gnathostomiasis.
Isolasi protein kasar ekskretori dan sekretori L3 G. spinigerum diperoleh dengan cara menginkubasi larva tiga G. spinigerumdalammedia RPMI 1640 yang mengandung antibiotik 100 unit/ml penicillin G dan 100 µg/ml streptomycin selama empat hari pada inkubator CO2 5% dengan suhu 37°C. Protein antigen
ES-L3-Gskasar yang diperoleh tidak dilakukan purifikasi. Immunoglobulin G anti ES-L3-Gs diperoleh dengan mengimunisasi kelinci putih strain New Zealand dengan ES-L3-Gs. Hasil immunoblotting antara L3-Gs dengan IgG anti ES-L3-Gs menunjukkan lima pita blot, dengan berat molekulyaitu12.6, 18.6, 37.9, 41.7 dan 49.5 kDa. Pita blot dengan berat molekul 12.6, 18.6 dan 37.9 kDa juga terlihat pada reaksi antara ES larva nematoda lain dengan IgG anti ES-L3-Gs. Protein spesifik dengan berat molekul 41.7 dan 49.5 kDa merupakan antigen potensial untuk dikembangkan dalam immunodiagnostik dan diagnostik molekuler gnathostomiasis pada belut rawa dan gnathostomiasis manusia di Indonesia.
SUMMARY
KHUMAIRA PUSPASARI. Analysis of Protein Patterns of Gnathostoma spinigerum Larvae in Swamp Eeels (Monopterus alba) by Immunoblotting. Supervised by RISA TIURIA and ELOK BUDI RETNANI.
Gnathostoma spinigerum is an intestine nematode in carnivore but can cause human gnathostomiasis. Man is a paratenic host and can acquires the infection by eating non cooked or inadequately processed intermediate hosts, e.g. freshwater fishes, frogs, birds and snakeswhich contain encapsulated third stage larvae. Third stage larvaes (L3s) of G. spinigerum were most found in liver and muscle of swamp eels (Monopterus alba). The objective of this research was to analyze the specific antigens of excretory-secretory (ES) products of G. spinigerum L3s (ES-Ag Gs L3) against rabbit immunoglobulin G (IgG) polyclonal antibody-anti ES-Ag Gs L3s using Western blotting technique. The result of this research was hoped to be a basic for the development of immunodiagnostic and molecular diagnostic of gnathostomias.
Excretory-secratory proteins isolation of G. spinigerum L3 were obtained by incubating L3 in RPMI 1640 medium which contains 100 units/ml penicillin G and 100 µg/ml streptomycin for four days at 37°C under 5% CO2 in air. The crude
antigen protein of ES-L3-Gs were not purificated. Immunoglobulin G anti ES-Ag Gs L3s were obtained by immunize New Zealand strain white rabbits with ES-Ag Gs L3s. Bands with apparent molecular weights of 12.6, 18.6, 37.9, 41.7 and 49.5 kDa were identified from immunoblotting reactions between IgG-anti ES-Ag Gs L3s and ES-Ag Gs L3s. The proteins of ES from other nematode larvae with apparent molecular weights of 12.6, 18.6, and 37.9 were also recognized by IgG-anti ES-Ag Gs L3s. The specific proteins with molecular weights of 41.7 and 49.5 kDa were potential antigens for immunodiagnostic and molecular diagnostic of gnathostomiasis in swamp eels and human gnathostomiasis in Indonesia.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Parasitologi dan Entomologi Kesehatan
KARAKTERISASI PROTEIN ANTIGENIK LARVA 3
Gnathostoma spinigerum PADA IKAN BELUT RAWA
(Monopterus alba) MENGGUNAKAN TEKNIK
IMMUNOBLOTTING
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Nopember 2011 ini ialah Gnathostoma spinigerum, dengan judul Karakterisasi Protein Antigenik Larva 3 Gnathostoma spinigerum pada Ikan Belut Rawa (Monopterus alba) Menggunakan Teknik Immunoblotting.
Terima kasih penulis ucapkan kepada Ibudrh.Risa Tiuria, M.S, Ph.Ddan Ibu Dr.drh.Elok Budi Retnani, M.S selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada Ibu Dr. drh. Sri Murtini, M.Si yang telah banyak membantu dalam penelitian ini, Ibu Emei Widiyastuti, S.Pi, Tatik Sumirah, A.Md, Tina Yunia Asri,A.Md dan Chusnul Chotimah dari laboratorium Parasitologi dan Fredy Riatmono, A.Md dan Ade Nurdin S.St.Pi dari laboratorium sekuensing Balai Uji Standar Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan (BUSKIPM) yang telah membantu selama pengumpulan data. Rasa terima kasih juga penulis ucapkan pada Bapak Ir. Asep Dadang Koswara, M.Si dan Ibu Nurlaila S.Pi, M.Si beserta staf teknis BUSKIPM atas bantuan dan dorongannya dalam penelitian ini, juga kepada para dosen dan staf program studi Parasitologi dan Entomologi Kesehatan (PEK) atas bimbingannya selama perkuliahan. Ungkapan terima kasih juga disampaikan kepada suami tercinta Riki Frihatand Pasariboe, ananda M. Nouval Farraz P. dan M. Jaffan Waldan P., ayahanda H. Arman Tefuri (Alm), ibunda Hj. Saadiyah, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Tahap 1 Isolasi dan Identifikasi Morfologi dan Molekuler Larva Tiga
(L3) Gnathostoma spinigerum 16
Tahap 2 Produksi dan Karakterisasi Protein Antigen ES-L3-Gs 16
Tahap 3 Produksi Poliklonal Antibodi 17
Tahap 4 Immunoblotting 18
Analisis Data 19
4 HASIL DAN PEMBAHASAN 20
Hasil 21
Isolasi dan Identifikasi Morfologi dan Molekuler Larva Tiga (L3)
Gnathostoma spinigerum 21
Produksi dan Karakterisasi Protein Antigen ES-L3-Gs 23
Produksi Poliklonal Antibodi 24
Immunoblotting 25
Pembahasan 27
Isolasi dan Identifikasi Morfologi dan Molekuler Larva Tiga (L3)
Gnathostoma spinigerum 27
Produksi dan Karakterisasi Protein Antigen ES-L3-Gs 29
Produksi Poliklonal Antibodi 31
5 SIMPULAN DAN SARAN 367
Simpulan 37
Saran 37
DAFTAR PUSTAKA 38
LAMPIRAN 43
RIWAYAT HIDUP 55
DAFTAR TABEL
Prevalensi dan intensitas L3 Gnathostoma pada belut rawa (November 2011 – Juli
2012) dari Palembang 22
DAFTAR GAMBAR
1 Larva Gnathostoma 52 Gnathostoma spinigerum dewasa 6
3 Siklus hidup G. spinigerum 7
4 Gejala klinis gnathostomiasis manusia 8
5 Struktur IgG mamalia 14
6 Kista L3 Gnathostoma pada belut rawa 21
7 Morfologi L3 Gnathostoma pada belut rawa 22
8 Hasil elektroforesis PCR L3 Gnathostoma 23
9 Profil protein antigen ES L3 Gnathostoma 24
10 Hasi AGPT IgG serum kelinci 25
11 Hasil immunoblotting 26
12 Hasil immunoblotting IgG anti ES-L3-Gs dengan ES-Ag Spiroksis 27
13 Hipotetikal hasil SDS-PAGE dan immunoblotting 32
DAFTAR LAMPIRAN
1 Metode Bradford (1976) 432 Metode SDS-PAGE (Laemmli 1970) 45
3 Komposisi reagen SDS-PAGE 46
4 Data elektrogram sekuensing Gnathostoma 47
5 Hasil analisis BLAST sekuensing 51
1
PENDAHULUAN
Latar Belakang
Gnathostomaspp. merupakan nematoda usus pada karnivora yang dapat menyebabkan gnathostomiasis pada manusia. Manusia merupakan inang paratenik dan dapat terinfeksi karena memakan inang antara yang mengandung kista larva tahap 3 (L3) dari Gnathostoma sp., dan tidak dimasak dengan baik(Saksirisampant et al.2001).Jenis-jenis hewan yang berpotensi sebagai inang antara tersebut antara lain ikan air tawar, katak, unggas dan ular(Saksirisampant et al.2001).Spesies dominan penyebab gnathostomiasis pada manusia adalah Gnathostoma spinigerum, dengan inang antaranya antara lain belut rawa (Monopterus alba). Hal ini terbukti dari hasil identifikasi bahwa hampir semua Gnathostoma yang ditemukan pada Gnathostomiasis pada manusia umumnya adalah G. Spinigerum. Parasit inimemiliki penyebaran di wilayah beriklim tropis basah, khususnya Asia Tenggara seperti Thailand dan Vietnam yang memiliki tingkat prevalensi gnathostomiasis pada manusia tertinggi, karena kebiasaan mereka dalam mengkonsumsi ikan secara mentah.
Parasit ini telah menyebabkan kerugian ekonomis yang cukup besar pada usaha ekspor ikan belut Indonesia ke Cina. Kantor berita Xin Hua melaporkan bahwa pada tanggal 17 Mei 2011 Jawatan Pemeriksaan dan Karantina Barang Ekspor dan Impor Shanghai Tiongkok mengumumkan keberadaan Gnathostoma dalam belut yang diimpor dari Indonesia dan Filipina. Hasil analisis laboratoriummenunjukkan semua Gnathostoma yang ditemukan adalah patogenik terhadap manusia. Bandar Shanghai kini mengusulkan untukmenghentikan impor belut dari Indonesia.Ditemukannya Gnathostomasp. pada belut Indonesia tidak hanya membuat kerugian ekonomis, tetapi juga menimbulkan potensi adanya penyakit gnathostomiasispada manusia di Indonesia.
Kerugian ekonomis dan potensi timbulnya gnathostomiasis dapat ditekan melalui program pengendalian parasit baik pada inang antara maupun inang definitif. Oleh karenanya, keberhasilan program pengendalian harus ditunjang oleh metode diagnosis yang akurat. Metode diagnosis yang dilakukan sampai saat ini terhadap inang definitif, inang antara terutama belut dan ikan air tawar lainnya, dan manusia sebagai inang paratenik umumnya menggunakan cara konvensional.Diagnosis konvensional dilakukan dengan menemukan telur cacing pada feses inang definitif, dan penemuan kista L3 Gnathostomasp.pada jaringan tubuh, seperti organ dalam, daging, dan lain-lain dari inang antara khususnya ikan dan inang paratenik. Proses pembedahan diperlukan untuk menemukan bentukan kista berisi L3 maupun L3 yang bermigrasi dari cacing ini. Metode ini mempunyai sensitifitas yang rendah karena sulit untuk menemukan bentukan dari cacing ini. Diagnosis klinis gnathostomiasis pada manusia jarang dilakukan, dan keakuratan diagnosis ini sangat rendah, karena gambaran gnathostomiasis sangat sulit dibedakan dengan parasitosis lainnya seperti Angiostrongyliasis, trichinellosis dan larva migran kutaneus yang disebabkan oleh parasit lain(Chaicumpa 2010).
2
diagnosa dini maupun konfirmatori. Pengujian berbasis antigen untuk diagnosis gnathostomiasis pada inang definitif, inang antara maupun manusia menggunakan antibodi spesifik terhadap parasit ini sebagai reagen penangkap antigen belum banyak dikembangkan di dunia dan bahkan belum dilakukan di Indonesia. Hal ini disebabkan kurangnya konsentrasi protein antigen G. spinigerum pada inang, karena umumnya jumlah spesimen L3 G. spinigerum yang masuk ke dalam tubuh inang sangat sedikit. Beberapa pengujian imunologis berdasarkan deteksi antibodi telah dikembangkan di Thailand untuk diagnosis diferensial gnathostomiasis pada manusia dengan penyakit parasitik lainnya. Deteksi antibodi ini merupakan diagnosis gnathostomiasis presumtif yang sensitif, tetapi kebanyakan pengujian memberikan hasil spesifitas yang rendah terhadap komponen antigenik umum yang dimiliki oleh Gnathostoma spp. dengan parasit lain, atau sering mengalami reaksi silang dengan antigen yang dimiliki oleh parasitik lain. Untuk itu, protein antigen spesifik dari Gnathostoma perlu dicari. Antigen dalam bentuk murni atau protein rekombinan parasit dari antigenisitas yang sama dengan bagian antigen alami dapat meningkatkan spesifisitas diagnosis gnathostomiasis berbasiskan pengujian antibodi.
Sumber antigen untuk imunodiagnostik nematoda yang paling banyak digunakan adalah ekstrak jaringan cacing (somatik). Produk Ekskretori-Sekretrori (ES) mulai banyak digunakan semenjak dua dekade terakhir (Saksirisampant et al. 2001). Protein antigen ES mempunyai sifat yang lebih dapat dikenali oleh sistem tanggap kebal daripada antigen somatik dan antigen permukaan (Chaicumpa 2010).
Perumusan Masalah
Karakterisasi protein antigen produk ES L3 G. spinigerum yang spesifik, yang berasal dari produk Ekskretori-Sekretori (ES) larva diperlukan untuk pengembangan metode diagnosis G. spinigerum. Kandidat protein antigen ES yang ditemukan diharapkan dapat dikembangkan sebagai metode diagnosis yang lebih cepat dan akurat pada inang antara dan manusia.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkarakterisasi protein antigen spesifik produk ekskretori sekretori Larva 3 Gnathostoma spinigerum (ES-L3-Gs) melalui reaksi antara antigen L3-Gs dengan antibodi poliklonal IgG kelinci anti ES-L3-Gsmenggunakann teknik immunoblotting.
Manfaat Penelitian
4
5
2
TINJAUAN PUSTAKA
Gnathostoma spinigerum
Gnathostoma spp. merupakan nematoda parasitik intestinal pada hewan karnivora dan gnathostomiasis jaringan pada manusia.Salah satu spesies yang biasa ditemukan pada lingkungan tropis basah, khususnya Asia Tenggara, adalah Gnathostoma spinigerum.Berdasarkan taksonomi G. spinigerum dapat diklasifikasikan sebagai berikut:
Telur Gnathostoma berbentuk oval dan memiliki sumbat lendir atau kutub pada salah satu ujung cangkang dan tidak terembrionisasi. Ukuran telur 65-70 µm x 38-40 µm. Telur diproduksi oleh cacing dewasa dalam saluran pencernaan inang definitif, dan dikeluarkan bersama feses inang (Maleewong et al. 1995).
Larva 3 G. spinigerum berwarna transparan dan berukuran 2-16 mm. Bentuk kepala seperti bola lampu, dikelilingi oleh empat barisan kait melintang yang berfungsi untuk membantu masuk ke dalam jaringan inang dan memiliki sepasang bibir di ujungnya. Empat baris kait sudah jelas terlihat dalam tahap larva kedua. Duri kutikula kecil terdapat di seluruh tubuh. Bagian dalam L3 memiliki dua jenis papilla – sebuah papilla serviks pada bagian tubuh utama dan dua papilla labial pada bola sefalik. Pada bola sefalik juga terdapat empat organ seperti kantung yang berfungsi untuk bergerak dan berkontraksi, serta membuang cairan ke sekitarnya. Saluran pencernaan Gnathostoma tidak lengkap, hanya terdiri dari sebuah esophagus, usus dan anus (Maleewong et al. 1995).
Gnathostoma spinigerum dewasa berbentuk silinder, berwarna merah kecoklatan.Kepala berbentuk bulat seperti bola lampu, dan terdapat sepasang bibir diujungnya. Daerah sefalik dikelilingi 4 - 8 barisan kait melintang. Seluruh tubuh ditutupi duri halus, semakin mendekati posterior jarak antara duri semakin
6
renggang. Duri kecil banyak ditemukan pada ujung posterior. Lapisan kutikula terdiri dari tiga lapisan luar yang terbuat dari kolagen dan senyawa lainnya. Lapisan kutikula melindungi nematoda sehingga mereka mampu menginvasi saluran pencernaan hewan. Pada bagian posterior kepala terdapat empat kantung kelenjar servikal (glandural cervical) yang menempel dekat esophagus, masing-masing kantung servikal terhubung melalui saluran pusat. Nematoda ini memiliki otot longitudinal sepanjang dinding tubuh. Tali syaraf dorsal, ventral dan longitudinal terhubung ke otot utama tubuh. Sistem ekskretori tubular terdiri dari tiga saluran yang tersusun membentuk huruf “H” (Maleewong et al. 1995).
Ukuran cacing jantan lebih pendek dari cacing betina. Panjang cacing jantan 11–25 mm dan panjang cacing betina 25–54 mm dengan lebar 0.43–2.13 mm. Cacing jantan memiliki delapan papilla kaudal pada ujung posterior, dan terdapat spikula tumpul berukuran panjang ±1.1 mm dengan lebar ±0.4 mm. Cacing betina hanya memiliki dua papilla besar di ujung posterior yang berbentuk bulat (Robert et al. 2000).
Siklus Hidup
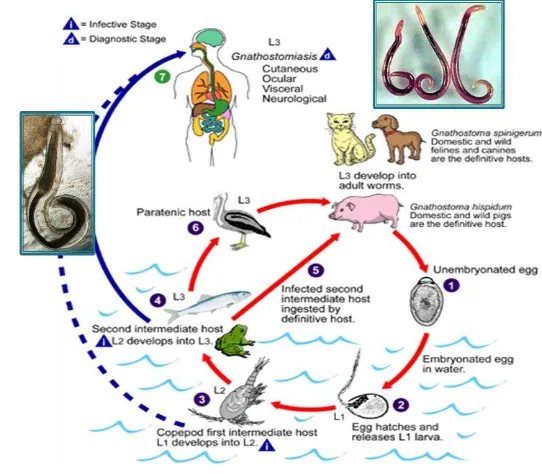
Gnathostoma spinigerum memiliki siklus hidup multi-inang. Cacing dewasa membentuk tumor pada dinding lambung inang definitif dan melepaskan telur yang tidak terembrionasi ke dalam saluran pencernaan inang. Telur yang dikeluarkan bersama tinja inang akan terembrionasi dan menetas seminggu kemudian dalam air dan berkembang menjadi larva tahap pertama (L1). L1 yang termakan inang antara pertama yaitu krustasea genus Cyclops, seperti Mesocyclops leuckarti, Eucyclops agilis, Cyclops varicans, dan Thermocyclops sp. (Daengsvang 1980), akan menembus dinding lambung Cyclops dan berkembang menjadi larva tahap kedua (L2) dan bahkan L3 awal. L2 pada kopepoda, apabila tertelan oleh inang antara keduamaka akan menembus dinding lambung, kemudian bermigrasi ke jaringan dan berkembang menjadi L3. Larva ini kemudian mengkista dalam jaringan hati, ginjal dan otot daging inang.Ikan air tawar, unggas, katak, ular dan mamalia merupakan inang antara kedua.
7 sebagai cacing dewasa. Cacing akan membentuk tumor dan terus tumbuh menjadi dewasa selama 6–8 bulan dan akan berkopulasi. Cacing betina mulai mengeluarkan telur yang telah dibuahi melalui kotoran inang 8–12 bulan setelah kista tertelan. Telur terbawa dalam kotoran inang. Kucing, anjing, harimau, macan tutul, singa, musang, dan berang-berang merupakan inang definitif cacing ini (Rusnak and Lucey 1993). Manusia bukan inang definitif dari cacing ini, maka larva tahap ketiga yang tertelan oleh manusia tidak dapat berkembang lebih lanjut, tetapi dapat menyebabkan berbagai kerusakan pada jaringan, tergantung di mana larva mengembara dalam tubuh. Skema penularan pada manusia dan hewan secara rinci diuraikan pada Gambar 3.
Gnathostomiasis
Gnatostomiasis adalah suatu penyakit yang disebabkan oleh cacing Gnathostoma spp. Gnathostomiasis pada inang definitif bisa berakibat serius, bahkan fatal hingga menyebabkan kematian. Penyakit Gnathostomiasis pertama pada hewan dideskripsikan oleh Sir Richard Owen di London ketika memeriksa perut harimau muda yang mati di Kebun Binatang London dengan aorta pecah (Rusnak dan Lucey 1993).
Larva tahap tiga cacing ini lebih sering diteliti, karena bersifat patogen yang menyebabkan gnathostomiasis pada manusia atau sering dikenal dengan berbagai nama lain seperti creeping eruption, larva migrans profundus, dan larva migrans spiruroid (Rusnak dan Lucey 1993). Larva 3 (L3) Gnathostoma spinigerum yang tertelan oleh manusia akan bermigrasi ke dalam jaringan tubuh dan menyebabkan penyakit gnathostomiasis kutaneus dan visceral. Gnathostomiasis kutaneus atau sering disebut sebagai larva migran kutaneus dapat berlangsung selama
8
tahun. Gnathostomiasis visceral, antara lain migrasi parasit pada sistem syaraf pusat atau mata, dapat mengakibatkan hemoragi intrakranial, meningo-ensepalitis eosinofilik, atau bahkan kebutaan (Miyazaki, 1960; Chitanondh, 1967; Daengsvang, 1986).Kasus infestasi L3 Gnathostoma pada manusia ditemukan pertama kali oleh Levinson pada wanita Thailand tahun 1889.Infeksi gnathostomiasis pada manusia terjadi setelah manusia menelan inang antara kedua, yaitu ikan, unggas, katak atau babi mentah atau kurang dimasak yang terinfeksi larva tahap ketiga.
Larva tiga G. spinigerum bermigrasi dan masuk ke jaringan lain tanpa mampu berkembang menjadi dewasa. Larva yang bermigrasi dapat membentuk kista pada berbagai jaringan. Pada inang antara kedua, terutama ikan, umumnya kista L3 ditemukan pada hati, daging, limpa, empedu dan ginjal. Gejala klinis Gnathostomiasis pada inang antara kedua, terutama belut, yang terkena L3 Gnathostoma sangat sulit dibedakan dengan inang yang sehat. Umumnya ikan yang terinfeksi oleh parasit cacing akan menampakkan gejala klinis berupa tubuh yang kurus dan intensitas warna daging yang berubah kuning, seperti halnya ikan lele yang terinfeksi cacing cestoda Lytocestus sp. (Ahmad and Sanaullah 1977). Pada ikan belut yang terinfeksi Gnathostoma, gejala klinis tersebut tidak dapat teramati (Sugaroon and Wiwanitkit 2003). Hal inilah yang menyebabkan potensi tinggi gnathostomiasis pada manusia yang sering mengkonsumsi belut mentah.
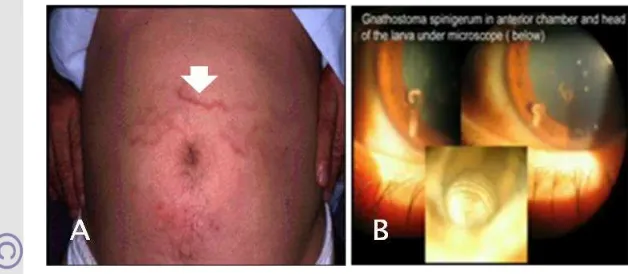
Beberapa ahli membedakan gnathostomiasis pada manusia sebagai gnathostomiasis kutaneus dan visceral. Migrasi dalam jaringan subkutan atau sering disebut gnathostomiasis kutaneus menyebabkan intermiten, migran, kesakitan, pembengkakan pruritus. Gnathostomiasis kutaneus sering disebut sebagai larva migrans cutaneus karena efek yang disebabkannya (Crowley and Kim 1995).
Migrasi ke jaringan lain (larva migrans visceral), atau sering disebut sebagai gnathostomiasis visceral dapat terjadi pada organ pencernaan (gastrointestinal), organ pernafasan (paru-paru), saluran genitourinari, telinga, hidung, tenggorokan, mata (intraokuler), dan sistem saraf pusat (Rusnak and Lucey 1993). Transmisi gnathostomiasis prenatal juga mungkin terjadi dan dapat
Gambar 4 Gejala klinis gnathostomiasis manusia
9 menyebabkan cacat lahir. Masa inkubasi gnathostomiasisselama 3-4 minggu sejak larva mulai bermigrasi melalui jaringan subkutan tubuh. Pasien dapat mengalami masalah yang serius jika tidak diobati.
Epidemiologi Gnathostomiasis
Terdapat 13 spesies Gnathostoma yang telah diidentifikasi dengan baik. Empat Gnathostoma yaitu G. spinigerum,G. hispidium, G. nipponicum, dan G. doloresi telah terbukti mampu menyebabkan gnathostomiasis pada manusia (Nawa et al. 1989; Akahane et al. 1994 dan Ando et al. 1988). Spesies yang paling dominan sebagai penyebab gnathostomiasis manusia pada daerah endemik adalah G. spinigerum.
Penyakit ini umumnya terjadi di Thailand dan telah dilaporkan di berbagai Negara lain seperti Jepang, Cina, Malaysia, Indonesia, Filipina, Laos, Kamboja, Vietnam, Burma, India, Sri Lanka, Israel, Australia, Meksiko, Ekuador dan pulau Pasifik lainnya (Rojekittikum et al. 1989; Ando et al. 1988, Akahane et al. 1994). Penyakit Gnathostomiasis di Indonesia pertama kali dilaporkan tahun 1979 di Jakarta pada rahim seorang perempuan (Hadidjaya et al. 1979). Prevalensi gnathostomiasis pada manusia sampai saat ini belum diketahui secara pasti, tetapi dari tahun 1961 – 2003 telah di laporkan lebih dari 1965 kasus gnathostomiasis pada manusia di Thailand (Lertanekawattana et al. 2004). Kebanyakan penyakit gnathostomiasis pada manusia meningkat disebabkan karena pola konsumsi berbagai jenis ikan yang tidak dimasak dengan baik.
Diagnosis Gnathostomiasis
Diagnosis kecacingan karena gnathostomiasis pada inang antara maupun inang definitif dapat dilakukan post mortem maupun pada inang hidup. Pemeriksaan post mortem dapat dilakukan dengan melakukan nekropsi atau pembedahan inang antara maupun inang definitif untuk mencari keberadaan larva maupun cacing dewasa dan kemudian mengidentifikasinya di bawah mikroskop. Sedangkan diagnosis pada inang hidup dapat dilakukan dengan melihat gambaran klinis dan patoklinis inang maupun dengan pemeriksaan secara laboratoris.
1) Pemeriksaan secara klinis
10
Diagnosis secara klinis tidak dapat dilakukan dengan pasti pada inang antara kedua. Umumnya inang antara kedua, terutama, ikan tidak memperlihatkan gejala klinis yang spesifik. Peningkatan eosinofil pada sel darah putih total tidak mampu membedakan dengan penyakit yang disebabkan oleh penyakit cacing lainnya.
Gejala klinis gnathostomiasis pada manusia dapat berkembang secepatnya dalam 24 jam setelah L3 cacing tertelan. Manifestasi klinis gnathostomiasis pada manusia disebabkan oleh migrasi dari L3 cacing. Eosinofilia sering berkembang pada awal penetrasi larva dari dinding lambung atau usus, tetapi tidak memberikan hasil spesifik mengenai penyebab infeksi. Meningitis eosinofilik karena gnathostomiasis sangat sulit dibedakan dari parasitosis lainnya seperti Angiostrongyliasis. Adanya migratory edema atau creeping eruption merupakan tanda-tanda visual keberadaan parasit. Keakuratan diagnosis klinis sangat bergantung dari ketelitian dan pengalaman analis, karena gambaran gnathostomiasis sangat sulit dibedakan dengan parasitosis lainnya seperti Angiostrongyliasis, trichinellosis dan larva migran kutaneus yang disebabkan oleh parasit lain seperti cacing jangkar atau infeksi cacing paru-paru, Paragonimus heterotremus (Intapan et al. 1999). Sejarah perjalanan atau kebiasaan makan dapat memberikan informasi penting sebagai pemanjang diagnosis. Teknik pemeriksaan seperti magnetic resonance imaging (MRI) dapat digunakan untuk mendukung diagnosis klinis (Chaicumpa 2010).
2) Pemeriksaan secara laboratorium
Pemeriksaan laboratorium dapat dibedakan dalam beberapa metode, antara lain pemeriksaan mikroskopis, molekuler dan berdasarkan reaksi antigen-antibodi.
A Pemeriksaan secara mikroskopis
Diagnosis definitif G. spinigerum secara konvensional didasarkan pada penemuan telur cacing yang dikeluarkan di dalam feses inang. Teknik konvensional dengan pulasan sederhana atau metode konsentrasi antara lain pengendapan (sedimentasi), pengapungan (floating) dan saringan bertingkat dapat dilakukan untuk menemukan telur cacing dengan perhitungan jumlah telur dalam tiap gram feses pada pemeriksaan feses, cairan duodenum dan cairan empedu.
Isolasi dan identifikasi L3 maupun dewasa dari cacing dalam jaringan inang merupakan diagnosa definitif parasit G. spinigerum.Pada inang antara kedua, khususnya ikan, isolasi dan identifikasi L3 cacing ini harus dilakukan melalui pembedahan dan pengamatan kista di bawah mikroskop (Chaicumpa 2010). Diagnosis definitif gnathostomiasis pada manusia dilakukan dengan mengisolasi larva, seperti jika parasit muncul melalui kulit, bola mata atau setelah operasi pembedahan dari jaringan seperti otak (Chaicumpa 2010).
B Pemeriksaan secara molekuler
11 ditemukan. Pemeriksaan secara molekuler untuk diagnosis penyakit ini tidak pernah dilakukan, karena tidak terdapat spesimen yang mengandung parasit atau DNA parasit dalam jumlah yang memadai. Gnathostomiasis pada manusia biasanya disebabkan oleh infeksi larva tunggal dan sulit untuk memastikan daerah anatomikal partikular dalam inangnya (Chaicumpa 2010).
C Pemeriksaan berdasarkan reaksi antigen-antibodi
Pengujian berbasis antigen untuk diagnosis gnathostomiasis baik pada inang definitif, inang antara maupun manusia dengan menggunakan antibodi spesifik terhadap parasit sebagai reagen penangkap antigen jarang dilakukan karena kurangnya spesimen yang secara klinis mengandung jumlah antigen parasit yang memadai. Beberapa penelitian yang melaporkan diagnosis berbasis antigen untuk pemeriksaan gnathostomiasis. Manusia yang terinfeksi Gnathostoma spp. akan mengembangkan antibodi dalam serum untuk merespon antigen parasit. Deteksi antibodi ini merupakan diagnosis gnathostomiasis presumtif yang sensitif. Beberapa pengujian secara imunologi telah dikembangkanuntuk diagnosis diferensial gnathostomiasis seperti uji presipitasi, radioimmunoassay, ouchterlony gel diffusion, IFAT, indirect hemaglutinasi, reaksi microprecipitation, immunoblots, dan ELISA (Anantaphruti 2002). Sampai saat ini, belum tersedia pengujian secara imunologis maupun molekuler berupa kit komersial, baik untuk gnathostomiasis pada manusia maupun pada inang antara dan inang definitif. Kebanyakan metode serologis menggunakan ekstrak somatik cacing dewasa maupun larva G. spinigerum atau G. doloresi sebagai antigen untuk mendiagnosis. Beberapa studi melaporkan sentitifitas diagnostik tinggi, 80 – 100%, dibandingkan dengan diagnosis klinis dan/atau diagnosis konfirmatori parasit. Kebanyakan pengujian ini memberikan hasil spesifitas rendah terhadap komponen antigenik umum yang dimiliki oleh Gnathostoma spp. dengan parasit lain, yaitu hanya mencapai 37%. Respon imun dalam serum individu (terutama pada daerah endemik), dihasilkan dari paparan sebelumnya dari beberapa parasit lain, berikatan dengan satu atau lebih komponen dalam ekstrak Gnathostoma somatik sehingga menghasilkan positif palsu pada pengujian berbasis antibodi (Chaicumpa 2010). Antigen dalam bentuk murni (atau cukup murni untuk mengeliminasi komponen reaksi silang) atau protein rekombinan parasit dari antigenisitas yang sama dengan bagian antigen alami dapat meningkatkan spesifisitas diagnosis gnathostimiasis berbasiskan pengujian antibodi.
Antigen Ekskretori dan Sekretori (ES)
12
adalah bagian antigen yang berkombinasi dengan produk atau hasil respon imun spesifik.
Antigen banyak digunakan sebagai reagen penangkap antibodi pada reaksi antigen – antibodi untuk teknik imunodiagnostik pemeriksaan penyakit kecacingan. Antigen juga digunakan sebagai reagen untuk merangsangtimbulnya antibodi pada berbagai hewan coba, sehingga antibodi yang diperoleh dapat digunakan untuk menangkap keberadaan antigen yang bersirkulasi pada spesimen yang terinfeksi penyakit kecacingan pada teknik pemeriksaan imunodiagnostik. Sumber yang banyak digunakan sebagai antigen untuk imunodiagnostik nematoda adalah ekstrak kasar jaringan cacing atau larva cacing yang dikenal dengan antigen somatik dan antigen permukaan. Antigen somatik hanya dapat dikenali oleh inangnya jika cacing tersebut telah mati atau dihancurkan, sedangkan antigen permukaan selalu berubah sejalan dengan perkembangan cacing yang mengalami moulting sepanjang hidupnya sehingga menyulitkan inang dalam memberikan respon tanggap kebal. Antigen somatik memiliki komponen antigenik yang sangat kompleks, dan beberapa komponen antigenik yang dihasilkan oleh ekstrak somatik dari spesies tertentu juga dapat dihasilkan oleh beberapa spesies lain, sehingga sering memberikan hasil positif palsu ketika digunakan dalam pemeriksaan secara imunodiagnostik.
Teknik imunodiagnostik menggunakan antigen somatik untuk pemeriksaan Gnathostomiasis pada manusia juga mulai digunakan. Beberapa studi melaporkan sentitifitas diagnostik tinggi dihasilkan dari immunodiagnostik terhadap antibodi inang yang terinfeksi Gnathostoma menggunakan antigen somatik dibandingkan dengan diagnosis klinis dan/atau diagnosis konfirmatori parasit, tetapi kebanyakan pengujian memberikan hasil spesifitas yang rendah. Pencarian terhadap antigen yang lebih spesifik sangatlah diperlukan untuk diagnosis akurat.
Antigen ekskretori dan sekretori (ES) mempunyai sifat yang lebih dapat dikenali oleh sistem tanggap kebal daripada antigen somatik dan antigen permukaan, sehingga diduga lebih protektif untuk memicu respon tanggap kebal (Chaicumpa 2010). Antigen ES mengandung glikoprotein yang menutupi kulit cacing, juga mengandung sebagian kecil enzim metabolisme yang dilepaskan secara konstan sehingga mempermudah migrasi ke jaringan dalam inang (Bird 1991). L3 Gnathostoma melepaskan produk ES pada media kultur hari ke 2 sampai 14, dengan puncak tertinggi pada hari ke empat (Anantaphruti et al.2005). Jumlah komponen protein produk Ekskretori-Sekretori lebih sedikit dibandingkan dengan jumlah komponen antigen somatikdan proteinantigen ES mempunyai sifat yang lebih dapat dikenali oleh sistem tanggap kebal daripada antigen somatik dan antigen permukaan (Chaicumpa 2010). Sehingga karakterisasi protein produk ES perlu dilakukan untuk pengembangan metode imunodiagnostik Gnathostomiasis pada inang antara mapun inang definitif.
13 spesifik dengan berat molekul 24 kDa memberikan reaksi konsisten dengan antisera IgE dari infeksi ini. Literatur yang ada juga menunjukkan bahwa di antara komponen yang dilepaskan cacing, imunogen utama hadir dalam material ES (Saksirisampant et al. 2001).
Analisis kombinasi gel elektroforesis dua dimensi dipadukan dengan LC/MS-MS mengindikasikan bahwa G. spinigerum memiliki beberapa protein di antaranya cyclophilin, hypothetical protein, actin, matrix metalloproteinase-like protein dan intermediate filament protein B. Matrix metalloproteinase-like protein menempati jumlah yang paling banyak ditemukan baik dalam antigen somatik maupun produk ES G. spinigerum (Laummaunwai et al. 2008).
Antibodi Poliklonal
Antibodi (Ab) adalah molekul protein kompleks yang dihasilkan oleh semua spesies hewan dari sebuah imunogen dan merupakan bagian dari sistem tanggap kebal yang akan bereaksi terhadap substansi asing atau antigen. Sistem imun normal dapat membedakan antara dirinya sendiri dengan molekul asing sehingga hanya molekul asinglah yang imunogenik. Imunogenitas dari suatu imunogen bergantung dari antigennya sendiri, faktor biologis hewan atau manusia yang menerima antigen tersebut dan cara masuk serta kepekaan dari metode yang digunakan untuk mendeteksi respon imunnya. Secara umum semakin besar molekul maka akan semakin imunogenik, sehingga akan mampu menggertak sel limfosit. Sel limfosit T sitotoksik berperan dalam menghancurkan antigen intraseluler, sedangkan sel limfosit T helper berperan untuk membantu sel limfosit B. Antigen akan mengaktifasi sel limfosit T helper sehingga berdiferensasi menjadi limfokin. Limfokin berinteraksi dengan sel limfosit B, dan berdiferensiasi menjadi sel plasma dan sel memori. Selanjutnya sel plasma tersebut akan menghasilkan antibodi (Mayer 2009).
Molekul antibodi berada dalam darah, interestial atau cairan tubuh lainnya dan akan berikatan dengan antigen spesifik atau epitop melalui antigen binding sites. Molekul antibodi dapat mengenali sebagian kecil antigen partikular atau yang disebut epitop (antigen determinan), melalui interaksi ikatan non-kovalen antara antigen binding sites dengan epitop tersebut. Aktivitas antibodi dalam menangkap antigen tertentu dari suatu patogen dikenal sebagai netralisasi (Mayer 2009), sehingga antibodi sering digunakan sebagai reagensia untuk mengukur, mendeteksi dan memurnikan molekul biologis bahkan untuk pengobatan.
Antibodi poliklonal dihasilkan melalui imunisasi secara sengaja terhadap hewan dengan suatu immunogen spesifik. Antibodi poliklonal memiliki reaktivitas multipel yaitu dapat menangkap sejumlah epitop yang berbeda, sehingga dapat menimbulkan reaksi silang. Reaksi silang dapat terjadi karena epitop yang sama dimiliki oleh antigen yang berbeda atau epitop yang secara struktur mirip atau memiliki keserupaan dengan epitop pembuat peka (priming epitop) yang dikenali oleh antibodi (Smith 1995).
14
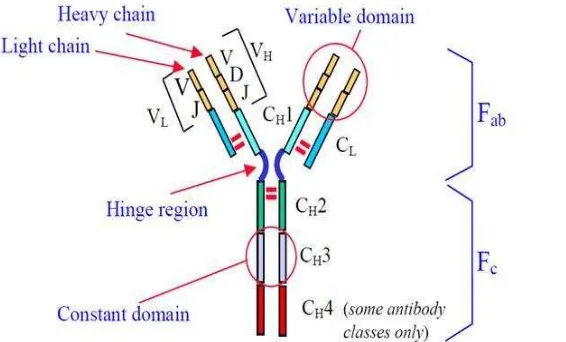
IgG, IgM, IgE, IgA and IgD IgG merupakan immunoglobulin yang paling dominan dalam serum mamalia. Serum mengandung sekitar 20 mg/ml immunoglobulin total, meskipun konsentrasi ini dapat bervariasi di antara individual. IgG memiliki presentasi sekitar 80% dari antibodi dalam serum dibandingkan dengan IgM (antibodi pertama yang muncul dalam respon primer), IgA, IgE dan IgD. IgG diproduksi selama respon sekunder terhadap antigen, ukurannya yang kecil membuat IgG terdistribusi luas dalam kompartemen ekstra vaskular. Fungsi utama dari IgG adalah untuk mengikat antigen tertentu dari suatu patogen dan menetralisasi efek patogen tersebut. Sifat dan fungsi IgG tersebut membuat IgG umum digunakan dalam immunodiagnostik.
Struktur IgG memiliki empat rantai polipeptida yang terbagi atas dua rantai ringan dan dua rantai berat yang semuanya dihubungkan oleh ikatan disulfida pada bagian engsel (hinge region). Rantai ringan memiliki satu bagian yang dapat berubah (VL) dan satu bagian yang konstan (CL). Rantai berat memiliki satu
bagian yang dapat berubah atau variabel (VH) dan 3 atau 4 bagian yang konstan
(CH1, CH2, CH3 dan CH4). Bagian variable (VH dan VL) berfungsi khusus untuk
melekatkan antigen, sedangkan bagian konstan menentukan sifat biologis IgG seperti penyebaran IgG dalam jaringan, pelekatan IgG pada struktur jaringan spesifik, pelekatan pada kompleks komplemen, serta kemudahan dalam melewati membran (Guyton and Hall 2007).
15
3
METODE
Penelitian ini merupakan penelitian laboratorium yang bersifat deskriptif komparatif. Penelitian dilaksanakan dari bulan November 2011 sampai dengan November 2012. Penelitian dilaksanakan di Laboratorium Helmintologi, Bagian Parasitologi dan Entomologi Kesehatan (PEK) FKH IPB dan di Laboratorium Parasitologi, Balai Uji Standar Karantina Ikan dan Pengendalian Mutu dan Keamanan Hasil Perikanan (BUSKIPM) Jakarta. Penelitian dilakukan melalui empat tahapan yaitu: 1) Isolasi dan identifikasi morfologi dan molekuler L3 G. spinigerum, 2) Produksi dan karakterisasi antigen ekskretori-sekretori (ES) L3 G. spinigerum, 3) Produksi poliklonal antibodi, dan 4) Uji immunoblotting.
Bahan
Ikan belut rawa (Monopterus alba), kelinci ras white New Zealand, obat cacing, Ivomex®, NaCl fisiologis, phosphate buffer saline (PBS), DNEasy® blood and tissue kit extraction (Qiagen, Singapura), etanol, primerpada daerah ribosomal ITS1, yaituLim1657 (f), 5’-CTGCCCTTTGTACACACCG-3’ (Almeyda-Artigas et al. 2000) dan 58S2 (r), 5’ -TCTTTATGCTCAATGTCTT-CGC-3’ (Ando et al. 2006),GoTaq®Green Master Mix 2X (Promega, USA), agarose, Sybr safe, TAE buffer, DNA ladder, BigDye®Terminator Cycle Sequencing (ABI, USA),EDTA, natrium asetat, RPMI 1640 (GIBCO, USA), penicillin G,streptomycin, leupeptin-antipain,membran nitroselulosa (0.45 µm, protran Schleicher & Schuell Bioscience GmbH, Jerman),ammonium sulfat, Montage® Antibody Purification Kit and Spin Column with PROSEP®-A Media (Merck, Jerman), Amicon® 30.000, steriflip-GP filter, Freud adjuvant complete, Freud adjuvant incomplete, akrilamid, Tris-HCl, SDS, APS, TEMED, β -mercaptoethanol, gliserol, bromphenol blue, glisin, perak nitrat, methanol, asam asetat, marker protein, larutan Bradford, bovine serum albumin (BSA), membran nitroselulosa, larutan Ponceau S (Sigma), natrium azide (NaN3), susu skim, PBS
tween, enzim peroksidase (anti rabbit IgG alkaline phosphatase conjugate), substrat BCIP-NBT dengan hydrogen peroksida.
Alat
Alat-alat bedah, alat-alat gelas, mikroskop cahaya Nikon E50i dengan digital kamera dan perangkat lunak NIS Element D,pipet mikro berbagai ukuran, tabung mikro berbagai ukuran, tissue grinder, inkubator, sentrifugasi, vortex, Thermal cycler, Mesin sequencer Applied Biosystems 3130 DNA Analyser, inkubator CO2, penangas air dengan pengaduk magnet, waterbath sonicator,
16
Prosedur Penelitian
Tahap 1 Isolasi dan Identifikasi Morfologi dan Molekuler Larva Tiga (L3) Gnathostoma spinigerum
Gnathostoma spinigerum dikoleksi dari sampel ikan belut (Monopterus alba) BUSKIPM yang dikirim oleh eksportir ikan belut. Ikan dinekropsi, kista yang terdapat pada hati, ginjal dan daging diambil secara aseptis dan diamati dengan mikroskop stereo. Kista yang berisi L3 Gnathostoma dipecahkan dan L3 yang masih hidup dan utuh dikumpulkan dalam wadah berisi NaCl fisiologis, kemudian L3 tersebut dipindahkan ke dalam tabung 50 ml berisi larutan phosphate buffer saline (PBS) dan diinkubasi pada suhu 25°C selama 15 – 20 menit. Pengamatan morfologi dan morfometri L3 dilakukan menggunakan mikroskop cahaya dengan perbesaran 4 – 40X (objektif).
Sepuluh ekor L3 Gnathostoma yang telah diisolasi dan diidentifikasi secara morfologi kemudian difiksasi menggunakan alkohol 70% untuk identifkasi sampai tingkat spesies secara molekuler dengan metode polymerase chain reaction (PCR) dan sequencing. Ekstraksi DNA dilakukan dengan menggunakan kit komersial DNEasy® blood and tissue kit extraction (Qiagen, Singapura) sesuai dengan protokol pemakaian. Uji polymerase chain reaction (PCR) dan sequencing menggunakan primerpada daerah ribosomal ITS1, yaituLim1657 (f), 5’ -CTGCCCTTTGTACACACCG-3’ (Almeyda-Artigas et al. 2000) dan 58S2 (r), 5’-TCTTTATGCTCAATGTCTTCGC-3’ (Ando et al. 2006). Amplifikasi PCR dilakukan dengan menggunakan 2 µL DNA total Gnathostoma, 12.5 µL GoTaq®Green Master Mix 2X (Promega, USA), 20 pmol masing-masing primer dan air bebas nuklease sampai volume akhir reaksi 25 µl. Kondisi PCR untuk analisis rDNA adalah sebagai berikut: 94 °C selama 1 menit, 52 °C selama 1 menit and 72 °C selama 3 menit untuk 30 siklus (Ando et al. 2006). Cycle sequencing dilakukan sesuai metode Sanger menggunakan 2 µL DNA hasil amplifikasi, 2 µl BigDye®Terminator Cycle Sequencing(ABI, USA), 3 µl buffer sequencing 5x, 20 pmol primer tunggal dan air bebas nuclease sampai volume akhir reaksi 25 µL. Kondisi cycle sequencing adalah sebagai berikut 96 °C selama 10 detik, 50 °C selama 5 detik and 60 °C selama 4 menit untuk 25 siklus. Purifikasi produk cycle sequencing menggunakan presipitasi etanol/EDTA. Denaturasi dilakukan pada suhu 95 °C selama 5 menit dengan menambahkan Hi-Di formamide 1:1 ke dalam produk purifikasi. Capillary electrophoresis dilakukan dengan mesin sequencer Applied Biosystems 3130 DNA Analyser.
Larva tiga nematoda lain yang membentuk kista dan berada pada organ yang sama di ikan belut (Monopterus alba) yaitu Spiroksis, diisolasi dan diidentifikasi dengan cara yang sama dengan L3 Gnathostoma. Spiroksis merupakan nematoda yang masih satu famili dengan Gnathostoma, dan juga merupakan parasit dalam bentuk L3 pada ikan belut (BUSKIPM 2011).
Tahap 2 Produksi dan Karakterisasi Protein Antigen ES-L3-Gs Preparasi Antigen Ekskretori-Sekretori (ES) L3 G. spinigerum
(masing-17 masing lima ekor cacing dalam satu mL RPMI). Hal ini sesuai hasil riset dari Saksirisampant et al. (2001), yang menyatakan bahwa metabolisme hasil ES-L3-Gs optimum didapatkan setelah masa inkubasi empat hari pada suhu 37°C. Cacing dipindahkan dan larutan media RPMI yang mengandung antigen ES diambil dan disentrifugasi pada 10,000 rpm selama 30 menit pada suhu 4°C. Supernatan diambil dan kemudian dipekatkan dengan menambahkan Ammonium sulfat 20% (w/v) sambil diaduk dengan batang pengaduk magnet selama 24 jam pada suhu 4 °C. Antigen yang telah dipekatkan didialisis menggunakan membran sellulosa dalam larutan PBS selama empat jam, volume PBS yang digunakan sebanyak 100 kali volume larutan yang didialisis. Buffer pendialisis diganti setiap satu jam. Hasil dialisis merupakan antigen ES yang telah dimurnikan, selanjutnya antigen tersebut disimpan dalam freezer -20°C sampai saat akan digunakan (Samarang 2011).
Produksi antigen ES L3 Spiroksis juga dilakukan sama seperti produksi antigen ES-L3-Gs, tetapi waktu inkubasi yang dilakukan berbeda dari G. spinigerum, yaitu satu hari. Hal tersebut dikarenakan masa hidup Spiroksis pada media buatan tidak sekuat Gnathostoma. Antigen ES L3 Spiroksis ini akan digunakan untuk melihat adanya reaksi silang pada pengujian immunoblotting.
Produksi antigen somatik juga dilakukan dengan cara larva tahap tiga G. spinigerum yang telah dicuci menggunakan PBS dihomogenkan dalam 0.1 M PBS pH 7.4, yang berisi inhibitor protease (0.05 mg/ml leupeptin-antipain, 10 mM EDTA) dengan tissue grinder dan kemudian disonifikasi menggunakan waterbath sonicator selama 2 x 10 menit dan kemudian disentrifugasi pada 10,000 rpm selama 30 menit pada suhu 4 °C. Supernatan diambil dan supernatan ini merupakan hasil antigen ekstrak somatik kasar, yang selanjutnya antigen tersebut disimpan dalam freezer -20 °C sampai saat akan digunakan. Antigen somatik ini diproduksi sebagai pembanding dalam reaksi immunoblotting sehingga diharapkan pita protein spesifik dari ES-L3-Gs dapat terkarakterisasi.
Pengukuran Konsentrasi dan Karakterisasi Protein Antigen
Konsentrasi protein antigen ES yang diperoleh diukur menggunakan metode Bradford (1976) menggunakan bovine serum albumin (BSA) sebagai standar. Komponen protein antigen ES-L3-Gs dipisahkan berdasarkan berat molekulnya dengan menjalankan protein tersebut menggunakan metode Sodium Deodecil Sulphate-Poly Acrylamide Gel Electrophoresis (SDS-PAGE), yang terdiri dari gel pemisah 7.5%, 12.5% dan 17.5% serta gel pengumpul (stacking gel) 4% (Laemmli 1970). Standar berat molekul protein hingga 58 kDa digunakan untuk menentukan berat molekul antigen sampel.40 µL antigen diletakkan dalam setiap sumur gel-tunggal.Sampel antigen dijalankan menggunakan gel elektroforesis pada voltase konstan 150 V. Pita antigen yang muncul pada elektroforesis SDS-PAGE dideteksi dengan menggunakan pewarnaan perak nitrat (AgNO3).
Tahap 3 Produksi Poliklonal Antibodi
18
cacing dan ivomex® agar tidak terkena infeksi penyakit parasit.Dosis imunisasi protein antigen ES-L3-Gs pada masing-masing kelinci adalah 600 µL/ekor.Imunisasi pertama dilakukan dengan rute intra vena (i.v). Imunisasi kedua dilakukan seminggu setelah imunisasi pertama dengan rute subcutan (s.c) menggunakan Freud adjuvant komplit dengan perbandingan antara antigen dan adjuvant sama banyak. Penyuntikan ketiga sampai kelima dengan interval dua minggu melalui rute s.c menggunakan Freud adjuvant inkomplit dengan perbandingan yang sama.
Koleksi antibodi poliklonal dilakukan dengan mengambil serum darah kelinci dari vena auricularis pada telinga, setiap seminggu setelah penyuntikan kedua hingga minggu ke 16. Darah kelinci yang telah membentuk antibodi IgG anti ES-L3-Gs dimasukkan ke dalam incubator suhu 37°C dengan posisi miring selama 30 menit, kemudian disimpan dalam refrigerator semalam pada suhu 4°C dan disentrifus dengan kecepatan 2000 x g selama 15 menit. Serum yang terpisah di bagian atas dikumpulkan menggunakan mikropipet.Keberadaan antibodi anti ES-L3-Gs dari kelinci diperiksa secara kualitatif menggunakan metode Agar Gel Precipitation Test (AGPT) menurut Eisen (1973).
Serum yang diperoleh dimurnikan untuk mendapatkan IgG menggunakan Montage® Antibody Purification Kit and Spin Column with PROSEP®-A Media(Merck, Jerman). Media PROSEP®-A yang digunakan dipre-ekuilibrasi menggunakan 10 mL Binding Buffer A dengan mensentrifus spin column kecepatan 500 x g selama 30 menit pada suhu 4°C. sampel berupa serum kelinci anti ES-L3-Gs disaring menggunakan 0.2 µm Steriflip-GP filter. Sepuluh ml serum yang telah difiltrasi ditambahkan dengan 10 mLBinding Buffer A (perbandingan 1:1 v/v) disentrifus kecepatan 500 x g selama 30 menit pada suhu 4°C. Supernatant di dasar tabung setelah 30 menit dibuang, kemudian spin column dibilas menggunakan 20 mLBinding Buffer A dan disentrifus kecepatan 500 x g selama 30 menit pada suhu 4°C untuk menghilangkan kontaminan yang tidak terikat. Sebanyak 10 mL Elution Buffer B2 ditambahkan langsung ke dalam spin column dalam tabung steril baru yang telah diisi 1.3 mL Neutralization Buffer C dan disentrifus kecepatan 4500 x g selama 40 menit pada suhu 4°C.Supernatant di dasar tabung yang mengandung IgG diambil, kemudian difiltrasi menggunakan Amicon® 30.000 yang disentrifus dengan kecepatan 4500 x g selama 25 menit pada suhu 4°C. Supernatant berisi IgG dialiquot dalam tabung-tabung mikro 1.5 mL dan disimpan pada suhu -20°C. Konsentrasi IgG yang telah dipurifikasi diukur menggunakan spektrofotometer pada panjang gelombang 595 nm dengan metode Bradford.
Produksi dan deteksi antibodi poliklonal anti antigen somatik Gnathostoma juga dilakukan sama dengan produksi dan deteksi antibodi poliklonal anti ES-L3-Gs. Antibodi poliklonal anti antigen somatik Gnatostoma ini diproduksi untuk dilakukan reaksi immunoblotting sebagai pembanding reaksi immunoblotting antara antibodi poliklonal anti ES-L3-Gs dengan antigen ES-L3-Gs, sehingga diharapkan pita protein spesifik dapat terdeteksi.
Tahap 4 Immunoblotting
19 mA selama satu jam. Standar protein berat molekul yang terpisah pada membran nitroselulosa diwarnai dengan larutan Ponceau S (Sigma) dan dicuci dengan air suling untuk menghilangkan kelebihan warna (overstaining). Membran nitroselulosa yang terblotting direndam dalam susu skim (blotto) 2% dalam PBS-0.02% NaN3 selama satu jam pada platform goyang untuk memblokir situs
pengikatan non-spesifik pada membran. Membran dicuci dengan alir mengalir untuk membersihkan kelebihan susu skim. Membran secara individual direaksikan dengan serum kelinci yang diencerkan 1:5000 dengan susu skim 5% pada suhu kamar semalam pada platform goyang. Membran dicuci tiga kali dengan PBST (PBS tween 0.1%) masing-masing lima menit untuk menghapus antibodi yang tidak terikat, kemudian membran direaksikan dengan antibodi sekunder yaitu IgG anti rabbit yang telah dikonjugasi dengan enzim peroksidase (anti rabbit IgG alkaline phosphatase conjugate) yang diencerkan 1:2500 dengan susu skim 5% selama satu jam di suhu kamar pada platform goyang. Membran kemudian dicuci tiga kali dengan PBST masing-masing lima menit, dan aktivitas enzim dibiarkan untuk berkembang dengan menambahkan substrat BCIP-NBT yang mengandung hidrogen peroksida pada platform goyang. Reaksi selesai ketika pita berwarna coklat gelap muncul pada garis nitroselulosa reaktif.Reaksi dihentikan dengan mencuci garis menggunakan air suling untuk menghapus pewarna latar belakang, dan garis kemudian dikeringkan di udara (Anantaphruti et al. 2005; Wongkham et al. 2000). Reaksi antara antibodi kelinci anti ES-L3-Gs dengan antigen parasit nematoda lain (ES L3 Spiroksis) juga dilakukan untuk melihat adanya reaksi silang. Reaksi yang sama juga dilakukan antara anti ES-L3-Gs dengan serum negatif sebagai kontrol negatif. Reaksi immunoblotting juga dilakukan antara antibodi poliklonal anti antigen somatik Gnathostoma dengan antigen somatik Gnathostoma sebagai pembanding pita-pita protein yang muncul.
Analisis Data
20
21
4
HASIL DAN PEMBAHASAN
Hasil
Isolasi dan Identifikasi Morfologi dan Molekuler Larva Tiga (L3)
Gnathostoma spinigerum
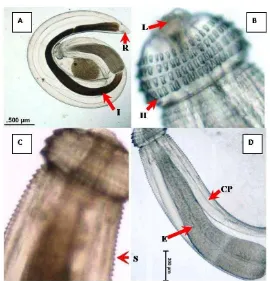
Lebih dari 1000 kista diisolasi dari 985 sampel ikan belut rawa (Monopterus alba) hidup dari Palembang yang dikirim oleh perusahan pengumpul dan eksportir selama bulan November 2011 sampai Juli 2012. Kista yang diambil terkonsentrasi pada jaringan otot dan hati ikan belut rawa. Lebih dari 400 kista yang diamati menunjukkan terdapat larva tiga (L3) Gnathostoma (Gambar 6) dengan ciri-ciri adanya kepala berbentuk bohlam (head bulb) dengan deretan kait di sekelilingnya. Sejumlah total 316 ekor larva tiga (L3) yang menunjukkan ciri-ciri Gnathostoma dikeluarkan dari kista dan diamati. Hasil pengamatan morfologi (n = 316) menunjukkan karakteristik yang spesifik yaitu adanya kepala berbentuk bohlam (head bulb) dengan empat deretan kait (H) (Gambar 7B). Sepasang bibir (L) berada pada ujung anterior tubuh dan dikelilingi oleh empat ballonet. Duri-duri (S) terletak secara merata pada permukaan tubuh dari bagian anterior dan semakin menurun jumlahnya secara bertingkat sampai ujung posterior (Gambar 7C). Esofagus (E) besar dengan panjang hampir sepertiga dari panjang tubuh, dan terhubung dengan intestine (I). Dua pasang kantung servikal (CP) teramati di sekitar esofagus (Gambar 7D). Pengamatan morfometri menunjukkan bahwa ukuran tubuh larva Gnathostoma (Gambar 7A) pendek, tebal dan melengkung, dengan panjang 2.06 – 3.81 mm (rata-rata 2.87 ± 0.42 mm) dan lebar 0.26 – 0.56 mm (rata-rata 0.43 ± 0.05 mm). Larva mempunyai Jumlah kait pada deret pertama, kedua, ketiga dan keempat berturut-turut adalah 32 – 46 buah (rata-rata 37.26 ± 4.18 buah), 36 – 48 buah (rata-rata 42.17 ± 3.30 buah), 40 – 50 buah (rata-rata 44.96 ± 2.48 buah), dan 44 – 52 buah (rata-rata 48.70 ± 2.53 buah).
Prevalensi Gnathostomiasis pada ikan belut rawa mencapai 53.33 % dengan intensitas berkisar 1 – 20 ekor larva per belut. Prevalensi L3 Gnathostoma di ikan belut rawa dapat dilihat pada tabel 1. Prevalensi dan intensitas infeksi larva Gnathostoma pada belut tinggi terjadi pada bulan Nopember sampai Februari, sedangkan infeksi rendah pada bulan Mei – Juni.
22
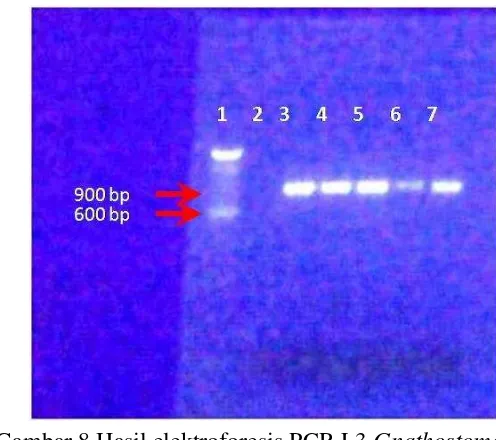
Identifikasi molekuler dilakukan untuk peneguhan terhadap identifikasi morfologi. Pengujian PCR menggunakan primer daerah daerah ribosomal ITS1, yaitu Lim1657 F (Almeyda-Artigas et al., 2000) dan 58S2 R (Ando et al., 2006) terhadap delapan belas ekor L3 Gnathostoma yang masing-masing diambil 2 ekor dari setiap bulan menunjukkan posisi profil molekuler yang sama untuk setiap isolate pada 900-an bp (Gambar 8). Hasil produk PCR dilanjutkan untuk proses
Tabel 1 Prevalensi dan intensitas L3 Gnathostoma pada belut rawa (November 2011 – Juli 2012) dari Palembang
Bulan Jumlah (Ekor) Prevalensi Gambar 7 Morfologi L3 Gnathostoma pada belut rawa
23
sekuensing menggunakan primer yang sama. Identitas hasil sekuens dianalisis dan dibandingkan dengan gen ribosomal DNA dari Gnathostoma yang terdapat pada GeneBank menggunakan Basic Local Alignment Search Tool (BLAST) (www.ncbi.nih.gov/BLAST/). Hasil analisa blastdelapan belas ekor L3 Gnathostoma yang disekuensing memiliki kemiripan basa nukleotida (maximal identity) tertinggi 98% dengan G. spinigerum (AB181155.1) yang terdapat di GeneBank (NCBI) dengan nilai maksimal (max score) 1411, query coverage 100% dan tingkat kesalahan (error value) 0.0 (Lampiran 5 dan 6). Total sekuens dengan primer Lim 1657 F dan 58S2 R untuk G. spinigerum (AB181155.1) adalah 917 base pair (bp). Sedangkan kemiripan dengan G. Bineculatum (AB181159.1) hanya 92%, nilai maksimal 597, query coverage 79% dan tingkat kesalahan 4 x 10-167. Kemiripan dengan G. hispidum (AB181158.1) adalah 100%, tetapi nilai maksimal yang diperoleh hanya 564, query coverage 79% dan tingkat kesalahan 4 x 10-157, total sekuens G. Hispidum 867 bp. Kemiripan dengan G. nipponicum (AB181157.1) adalah 96%, nilai maksimal yang diperoleh hanya 556, query coverage 80% dan tingkat kesalahan 7 x 10-1557, total sekuens G. nipponicum 1127 bp. Kemiripan dengan G. doloresi (AB181156.1) adalah 100%, tetapi nilai maksimal yang diperoleh hanya 508, query coverage 75% dan tingkat kesalahan 2 x 10-140, total sekuens 904 bp.
Produksi dan Karakterisasi Protein Antigen ES-L3-Gs
Produksi protein antigen ES-L3-Gs diperoleh dengan menginkubasi lima ekor larva per satu ml media RPMI pada inkubator CO2 5% pada suhu 37 °C
selama empat hari, hal ini sesuai dengan hasil penelitian Saksirisampant et al. (2001), yang menyatakan bahwa metabolisme hasil ES-L3-Gs optimum didapatkan setelah masa inkubasi empat hari pada suhu 37°C. Konsentrasi antigen ES-L3-Gs yang diperoleh sebelum purifikasi pada penelitian ini sangat kecil yaitu
24
rata-rata 13.5 ± 2.8 µg/ml. Kecilnya konsentrasi disebabkan kemungkinan antigen ini diperoleh dari bentuk larva tiga, serta ukuran dan jumlah larva per ml media. Setelah proses purifikasi menggunakan membran dialisis ternyata konsentrasi protein hilang, Sehingga ketika dilakukan proses elektroforesis menggunakan SDS-PAGE tidak terdapat satu pita protein yang terbentuk.
Profil protein ES-L3-Gs sebelum purifikasi hasil elektroforesis menggunakan SDS-PAGE menghasilkan 11 pita protein yaitu 61.8, 57.4, 54.6, 49.5, 44.9, 41.7, 37.85, 31.9, 18.6, 12.6 dan 5 kDa (Gambar 9) menggunakan marker 40 kDa. Hasil ini berbeda dengan hasil penelitian yang telah dilakukan oleh Sugaron et al. (2003) terhadap protein antigen ES-L3-Gs, yang hanya menemukan 6 pita polipeptida dengan berat molekul 43, 41, 24, 22, 21 dan 19.5 kDa.
Produksi Poliklonal Antibodi
Keberadaan antibodi poliklonal anti antigen ES-L3-Gs(IgG anti ES-L3-Gs) pada serum kelinci dari minggu pertama sampai minggu ke enam belas tidak dapat terdeteksi melalui reaksi AGPT. Keberadaan antibodi dalam serum ditandai dengan terbentuknya garis presipitasi antara antigen ES-L3-Gs dengan serum darah kelinci (Gambar 10).
Garis presipitasi yang tidak tampak pada pengujian AGPT serum kelinci minggu pertama hingga minggu ke enam belas menunjukkan konsentrasi antibodi dalam serum kelinci belum dapat terdeteksi melalui reaksi AGPT. Pembentukan antibodi dapat bervariasi dan tergantung pada banyak faktor, seperti imunogenitas, bentuk, stabilitas stimulant, spesies hewan, rute injeksi, dan konsentrasi antigen yang diinjeksikan, serta sensitivitas uji yang digunakan untuk mendeteksi antibodi (Mayer, 2009). Konsentrasi antigen yang dihasilkan dalam penelitian ini sangat rendah, yaitu rata-rata 13.5 ± 2.8 µg/ml, sehingga membutuhkan jumlah yang banyak dan waktu yang cukup lama untuk merangsang timbulnya antibodi.
25
Pengukuran spektrofotometer terhadap konsentrasi antibodi yang dihasilkan pada serum kelinci sebelum purifikasi adalah 41.17 µg/ml. Setelah proses pemurnian didapatkan konsentrasi antibodi berupa IgG adalah 28.3 µg/ml. Konsentrasi antibodi terendah yang mampu dideteksi menggunakan uji AGPT adalah 30 µg/ml (Tizzard, 2004).
Immunoblotting
Pada penelitian ini, protein ES yang diekstraksi dari L3 G.spinigerum
dipisahkan menggunakan SDS-PAGE dan dianalisis menggunakan
immunoblotting. Hasil immunoblotting dapat dilihat pada Gambar 11. Analisa
immunoblotting antara antigen ES-L3-Gs dengan serum kelinci negatif tidak memperlihatkan adanya blot pita hasil reaksi. Analisis immunoblotting dari antigen ES-L3-Gs dengan antibodi poliklonal IgG kelinci yang dihasilkan dari imunisasi kelinci dengan antigen tersebut memperlihatkan adanya lima blot pita protein, yaitu pada 12.6, 18.6, 37.9, 41.7 dan 49.5 kDa. Terlihatnya blot hasil reaksi antara antigen ES-L3-Gs dengan antibodi poliklonal IgG kelinci menunjukkan bahwa antigen ES-L3-Gs memiliki sifat imunogenik yang cukup tinggi. Satu pita protein yang menghasilkan warna blot paling tebal adalah pada 18.6 kDa.
Hasil immunoblotting antara antigen somatik L3 G. spinigerum dengan antibodi kelinci anti antigen somatik L3 G. spinigerum yang dilakukan oleh peneliti (tidak dipublikasikan), memperlihatkan adanya lebih dari 20 pita protein yang berada di antara 7.7 kDa sampai 204 kDa. Hasil immunoblotting antara antigen somatik L3 G. spinigerum dengan antibodi kelinci anti antigen somatik L3 G. spinigerum ini kemudian dibandingkan dengan hasil immunoblotting antara antigen ES-L3-Gs dengan antibodi poliklonal IgG kelinci pada penelitian ini menunjukkan bahwa terdapat empat blot pita protein ES-L3-Gsyang terdapat juga pada antigen somatik G. spinigerum, yaitu 18.6, 37.9, 41.7 dan 49.5 kDa. Chaicumpa (2010) mengatakan bahwa protein yang dihasilkan dari proses metabolisme cacing (hasil ekskretori sekretori) menempati 0.23% dari
Gambar 10 Hasil AGPT IgG serum kelinci
Ab: antibodi anti ES-Ag L3 Gs; Ag: Antigen ES-Ag L3 Gs; Gp: Garis presipitasi.
26
keseluruhan protein yang dihasilkan oleh cacing, tetapi antigen ES memiliki tingkat spesifitas yang lebih tinggi dibandingkan protein cacing lainnya. Pita protein yang secara konsisten paling dikenali baik pada antigen somatik maupun antigen ES L3 Gs ada pada berat molekul 18.6 kDa.
Blot juga terlihat pada reaksi antara antibodi poliklonal dari serum kelinci yang disuntikan antigen ES L3 G.spinigerum dengan antigen ES L3 Spiroksis yang juga terdapat pada belut (Gambar 12). Terdapat beberapa pita blot yang sama antara antigen ES L3 G.spinigerum dan ES L3 Spiroksis, yaitu pada sekitar 37, 18 dan 12 kDa. Hal ini kemungkinan disebabkan karena Spiroksis dan
Gnathostoma merupakan cacing nematoda yang berasal dari famili yang sama.
Spiroksis dan Gnathostoma juga merupakan L3 nematoda yang ada di belut, sama-sama membentuk kista dan mempunyai habitat mikro yang sama yaitu pada hati dan daging. Pita blot spesifik yang hanya terdapat pada antigen ES L3 G.spinigerum adalah 41.7 dan 49.5 kDa
Gambar 11 Hasil immunoblotting
A: IgG anti Ag somatik G. sipinigerum dengan Ag somatik G. sinigerum;
B: IgG anti ES-Ag G. sipinigerum dengan ES-Ag G. sinigerum;
27
Pembahasan
Isolasi dan Identifikasi Morfologi dan Molekuler Larva Tiga (L3)
Gnathostoma spinigerum
Hasil identifikasi dan karakterisasi morfologi dan morfometri sebanyak larva tiga Gnathostoma yang terdapat pada belut rawa di Palembang Indonesia menunjukkan bahwa semuanya mengarah pada Gnathostoma spinigerum. Ciri spesifik dari tiap spesies Gnathostoma dapat dibedakan dari bagian kepala yang berbentuk bohlam. Larva G. nipponicum mempunyai kepala dengan tiga deretan kait, sedangkan G. spinigerum memliki empat deretan kait.G. hispidum juga memiliki empat deretan kait pada kepalanya, hanya saja jumlah kait pada setiap deretnya lebih sedikit dibandingkan dengan G. spinigerum. Jumlah kait pada deret 1, 2, 3, dan 4 berturut-turut adalah ± 45 buah, ± 48 buah, ± 50 buah dan ± 52 buah (Bong-Kwang et al. 2008; Daengsvang 1980). Ukuran G. spinigerum yang ditemukan di Myanmar dan Thailand adalah panjang 2.65 mm dan lebar 0.32 mm. Empat deretan kait terdapat dibagian kepala. Ukuran dan jumlah kait pada tiap deret tersebut tidak berbeda jauh dengan G. Spinigerum yang ditemukan pada penelitian ini.
Hasil identifikasi morfologi dan morfometri perlu diteguhkan dengan teknik molekuler untuk memastikan spesies Gnathostoma yang ditemukan pada belut rawa. Pengujian PCR menggunakan primer daerah ribosomal mencakup sebagian 18S, ITS1 komplit dan sebagian 5.8S terhadap delapan belas ekor L3 Gnathostoma menunjukkan posisi profil molekuler yang sama untuk setiap isolat pada 900-an base pair (bp), sama dengan G. spinigerum (AB181155.1) yaitu 917 bp.Daerah ITS1 G. spinigerum komplit mempunyai ukuran 633 bp, sedangkan produk PCR yang dihasilkan mempunyai ukuran sekitar 900-an bp, hal tersebut disebabkan karena primer Lim 1657 F dan 58S2 R daerah ribosomal sebagian 18S, ITS1 komplit dan sebagian 5.8S. Kemiripan basa nukleotida (maximal identity)
28
98% dengan max score 1411 (tertinggi), query coverage 100% dan tingkat kesalahan (error value) 0.0 menunjukkan bahwa Gnathostoma yang menginfeksi ikan belut rawa dari Palembang adalah G. spinigerum.
Perbedaan prevalensi dan intensitas infeksi larva Gnathostoma setiap bulan pada belut rawa dan keberadaan belut rawa di alam dipengaruhi oleh keberadaan dari cyclop sebagai makanan ikan belut rawa. Keberadaan cyclop sebagai inang antara pertama larva Gnathostomadi Thailand, yaitu Mesocyclops leuckarti, Eucyclops agilis, Cyclops varicans, dan Thermocyclops sp. meningkat selama musim hujan (Janwan et al. 2011). Rojekittikhun et al. (1998, 2004) mengatakan bahwa infeksi larva Gnathostoma tertinggi di Thailand terjadi pada bulan Oktober sampai Desember. Rojekittikhun et al. (1998) menyebutkan bahwa perbedaan tingkat infeksi ini disebabkan karena perbedaan curah hujan. Tingkat infeksi meningkat ketika musim hujan tiba dan infeksi tertinggi akan terjadi pada bulan dengan curah hujan tertinggi. Ketika musim hujan berakhir maka infeksi L3 Gnathostoma menurun sampai dengan nol. Hal ini dikarenakan jumlah cyclop meningkat ketika curah hujan tinggi dan berkurang ketika curah hujan rendah. Di Indonesia sendiri khususnya Palembang dengan klimatologi yang hampir sama dengan Thailand, belum diketahui jenis-jenis cyclop sebagai inang antara pertama Gnathostoma, sehingga belum diketahui juga mengenai pengaruh curah hujan terhadap keberadaan cyclop.
Prevalensi dan intensitas infeksi tentu juga dipengaruhi keberadaan dari telur Gnathostoma yang dikeluarkan oleh inang definitif. Keberadaan dan jumlah populasi inang definitif di sekitar habitat belut dan cyclop di Palembang belum diketahui secara pasti. Perkembangan telur untuk terembrionisasi dan menetas di air membutuhkan waktu 1 – 2 minggu, dan sekurangnya tujuh hari untuk berkembang menjadi L3 awal pada cyclop.Jika tidak terdapat hujan maka sangat tidak memungkinkan telur mencapai reservoir air dimana cyclop, sebagai inang antara pertama, berada. Periode perkembangan Gnathostoma dari telur pada feses kucing atau anjing sampai membentuk kista L3 pada hati dan daging belut membutuhkan waktu sekitar 1 – 2 bulan. L3 dapat ditemukan pada hati dan daging belut dua minggu setelah cyclop yang terinfeksi tertelan, dan membentuk kista dalam waktu 4 – 5 minggu setelah tertelan (Daengsvang, 1980). Kurun waktu tersebut menurut Rojekittikhun et al. (1998) terjadi pada sikus hidup Gnathostoma di Thailand dan negara beriklim tropis basah lainnya seperti Mexico (Rusnak and Lucey 1993)
Tingginya intensitas infeksi larva juga tidak mempengaruhi ukuran belut, karena semakin besar ukuran belut terdapat kecenderungan semakin besar jumlah larva yang ditemukan. Hal ini kemungkinan disebabkan karena larva membentuk kista yang membuat tubuh belut mampu bertoleransi terhadap kista dorman ini.