ZEOLIT CIKALONG DAN LAMPUNG TERMODIFIKASI
ASAM FOSFAT SEBAGAI ADSORBEN LOGAM Cd(II)
NOPRIYANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Zeolit Cikalong dan Lampung Termodifikasi Asam Fosfat sebagai Adsorben Logam Cd(II) adalah karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
ABSTRACT
NOPRIYANI. Zeolit Cikalong and Lampung modified Phosphoric Acid as a metal adsorbent Cd(II). Supervised by ETI ROHAETI and SRI SUGIARTI.
Direct utilization of natural zeolites can not be done because many contain a mixture of (impurities) that it needs treatment first, one to increase the usability of zeolite as an adsorbent is through an increase in its reactivity, which can be done by modifying the surface with a suitable chemical solvent. This study aims to determine the ability of phosporic acid-modified natural zeolite as an absorbent solution of Cd (II) by comparing two different types of zeolite origin. Analysis of samples is conducted by cation exchange capacity (CEC) test, surface area, and characteristics with XRD, SEM-EDS. Tests conducted on the second adsorption zeolite modified by varying the concentration of adsorbate, pH, weight of adsorbent, contact time, and temperature using a shaker speed 150 rpm which was analyzed by AAS. Adsorption of metal ions Cd (II) by two samples of zeolite followed Langmuir isotherm model and tend to follow the pseudo second-order kinetics, spontaneous, and exothermic.
RINGKASAN
NOPRIYANI. Zeolit Cikalong dan Lampung Termodifikasi Asam Fosfat sebagai Adsorben Logam Cd(II). Dibimbing oleh ETI ROHAETI dan SRI SUGIARTI.
Logam berat merupakan salah satu zat pencemar bagi manusia dan lingkungan. Oleh karena itu sebagai suatu zat pencemar perlu suatu perlakuan sebelum dibuang ke perairan, sehingga tidak mengakibatkan pengaruh buruk bagi makhluk hidup dan lingkungan sekitarnya. Logam berat yang memiliki potensi bahaya bagi manusia dan lingkungan diantaranya adalah Cd(II) selain Pb(II) dan Hg(II). Cd(II) banyak dihasilkan dari industri-industri, diantaranya seperti pelapisan logam, industri penambangan dan peleburan, pabrik cat dan zat warna, dan sebagainya. Batas maksimal kandungan kadmium yang diperbolehkan di perairan menurut Peraturan Pemerintah No. 82 tahun 2001 sebesar 0,01 ppm. Menurut Keputusan Menteri Kesehatan RI No. 907 Tahun 2002 persyaratan kesehatan air minum terhadap bahan kimia yang memiliki pengaruh langsung pada kesehatan khususnya kadmium, kadar maksimum yang diperbolehkan adalah 0,003 mg/L.
Perlakuan terhadap zat pencemar berbahaya dapat dilakukan melalui proses kimia, salah satunya adalah dengan proses adsorpsi, yaitu proses penjerapan suatu zat oleh zat lainnya. Zat yang diserap disebut adsorbat dan yang menjerap disebut adsorben. Adsorben yang digunakan dalam penelitian ini adalah zeolit, karena zeolit memiliki pori dan luas permukaan yang besar, memiliki ruang kosong yang ditempati oleh kation, air, dan molekul lain sehingga memiliki kemampuan dalam memisahkan spesi target melalui prinsip penukar ion, selain itu bahan baku zeolit banyak terdapat di alam.
Pemanfaatan zeolit alam untuk penggunaan secara langsung belum dapat dilakukan karena masih banyak mengandung pengotor (impurities) sehingga perlu pengolahan terlebih dahulu untuk menghilangkan atau memisahkan kotoran-kotorannya, untuk hasil optimal dan memiliki nilai guna yang lebih baik. Tujuan penelitian ini adalah untuk mengetahui kemampuan zeolit alam yang dimodifikasi dengan asam fosfat dalam jerapannya terhadap logam Cd(II).
Sampel zeolit dalam penelitian ini yaitu menggunakan zeolit yang berasal dari Cikalong, Jawa Barat (mordenit) dan zeolit Lampung (klinoptilolit). Sebelum digunakan dalam uji adsorpsi terlebih dahulu dilakukan tahap-tahap preparasi, aktivasi dan modifikasi. Dalam tahap tersebut sampel dianalisis kandungannya, nilai kapasitas tukar kation (KTK), dan dikarakterisasi dengan XRD, SEM, yang berguna untuk mengamati terjadinya perubahan struktur pada sampel.
zeolit dengan asam fosfat berhasil dilakukan. Hal ini diketahui dari data EDS bahwa zeolit termodifikasi mengandung fosfat sebesar 133,6 ppm untuk zeolit Cikalong sedangkan zeolit Lampung mengandung 158,65 ppm fosfat. Modifikasi ini juga meningkatkan nilai KTK.
Adsorpsi terhadap ion logam Cd(II) oleh zeolit Cikalong dan zeolit Lampung mengikuti model isotermal Langmuir dan cenderung mengikuti kinetika reaksi orde kedua semu, spontan, dan eksotermis.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh kaya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
ZEOLIT CIKALONG DAN LAMPUNG TERMODIFIKASI
ASAM FOSFAT SEBAGAI ADSORBEN LOGAM Cd(II)
NOPRIYANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul Tesis : Zeolit Cikalong dan Lampung Termodifikasi Asam Fosfat sebagai Adsorben Logam Cd(II)
Nama : Nopriyani
NRP : G451090251
Disetujui Komisi Pembimbing
Dr. Eti Rohaeti, MS Sri Sugiarti, Ph.D
Ketua Anggota
Diketahui
Ketua Program Studi Kimia Dekan Sekolah Pascasarjana
Prof. Dr. Dra. Purwantiningsih Sugita, MS. Dr. Ir. Dahrul Syah, M.Sc.Agr
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT, karena dengan segala rahmat dan hidayah-Nya sehingga karya ilmiah ini dapat diselesaikan sesuai dengan waktu yang direncanakan. Penelitian yang dilakukan sejak bulan Januari 2011 ini berjudul “Zeolit Cikalong dan Lampung Termodifikasi Asam Fosfat sebagai Adsorben Logam Cd(II), semoga memiliki dan menambah nilai guna dalam khasanah ilmu pengetahuan.
Ucapan terima kasih disampaikan kepada komisi pembimbing Dr. Eti Rohaeti, MS dan Sri Sugiarti, Ph.D yang telah meluangkan waktunya dalam membimbing penulis dalam menyelesaikan penelitian ini. Disamping itu, penulis mengucapkan terimakasih kepada Bapak Drs. Sulistiyoso, GMT dan Ibu Deswita dari PTBIN BATAN Serpong, yang membantu dalam karekteristik sampel dengan XRD maupun SEM, serta seluruh staf Laboratorium Kimia Analitik, Anorganik, Kimia-Fisik dan Organik serta Laboratorium Bersama Departemen Kimia, yang telah memberikan bantuan dalam penelitian penulis terutama dalam penggunaan alat. Tak lupa pula terimakasih yang sebesar-besarnya kepada keluarga tercinta Ibu, Bang Ikrom serta ananda Meyna Cahyani Syahda dan M. Radhiy Pasha, yang memberikan semangat dan dorongan serta do’a nya kepada penulis dalam menyelesaikan studi.
Semoga karya ini dapat memberikan manfaat bagi kita semua, khususnya pihak akademisi dan masyarakat umumnya, amin.
Bogor, Agustus 2011
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 3 April 1970 sebagai anak kelima dari pasangan Ayahanda (Alm) Subli Yusuf dan Ibunda Hj. Aminah Romaniah. Pendidikan Sarjana ditempuh di Program Studi Pendidikan MIPA/ Kimia Universitas Jambi, lulus pada tahun 1993.
DAFTAR ISI
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN Latar Belakang ... 1
Perumusan Masalah ... 3
Tujuan Penelitian ... 4
Manfaat Penelitian ... 4
Hipotesa Penelitian ... 4
TINJAUAN PUSTAKA Kadmium ... 5
Struktur Kimia Zeolit ... 5
Sifat-Sifat Zeolit ... 8
Sifat Adsorpsi Zeolit ... 9
Aktivasi Zeolit ... 10
Isoterm Adsorpsi ... 11
Kinetika Adsorpsi ... 12
Parameter Termodinamika ... 13
BAHAN DAN METODE Waktu dan Tempat ... 14
Alat dan Bahan ... 14
Metode Penelitian ... 14
HASIL DAN PEMBAHASAN Hasil Analisis Proses Preparasi, Aktivasi, dan Modifikasi ... 18
Hasil Analisis Kandungan Unsur ... 20
Hasil Analisis Karakteristik ... 22
Optimasi Parameter Adsorpsi ... 26
Isotermal Adsorpsi ... 29
Kinetika Adsorpsi ... 32
Termodinamika Adsorpsi ... 35
KESIMPULAN ... 39
DAFTAR PUSTAKA ... 40
DAFTAR TABEL
Halaman
1 Kapasitas Tukar Kation (KTK) ... 20
2 Unsur-unsur yang terkandung pada karakterisasi sampel zeolit ... 21
3 Parameter isotermal adsorpsi Langmuir dan Freundlich ... 31
4 Kinetika adsorpsi Cd(II) ... 37
DAFTAR GAMBAR
Halaman
1 Struktur kerangka zeolit mordenit dan klinoptilolit ... 6
2 Tertrahedral alumina dan silika pada zeolit ... 7
3 Unit bangun sekunder struktur zeolit ... 8
4 Skema reaksi modifikasi zeolit PNa2 ... 19
5 Difraktogram XRD zeolit Cikalong ... 22
6 Difraktogram XRD zeolit Lampung ... 24
7 SEM zeolit Cikalong dan Lampung ... 25
8 Kapasitas adsorpsi optimasi variasi konsentrasi ... 27
9 Kapasitas adsorpsi optimasi variasi pH ... 27
10 Kapasitas adsorpsi optimasi waktu kontak ... 28
11 Kapasitas adsorpsi optimasi bobot adsorben ... 29
12 Isotermal adsorpsi Cd(II) oleh zeolit Cikalong dan Lampung ... 29
13 Adsorpsi isotermal Langmuir ... 30
14 Adsorpsi isotermal Freundlich ... 31
15 Pengaruh waktu kontak pada adsorpsi Cd(II) ... 33
16 Plot kinetika orde pertama semu zeolit Cikalong ... 33
17 Plot kinetika orde pertama semu zeolit Lampung ... 34
18 Plot kinetika orde kedua semu zeolit Cikalong ... 34
19 Plot kinetika orde kedua semu zeolit Lampung ... 35
20 Pengaruh suhu pada kinetika adsorpsi Cd(II) ... 36
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 42
2 Komposisi unsur zeolit Cikalong karakteristik EDS ... 43
3 Komposisi unsur zeolit Lampung karakteristik EDS ... 44
4 Kapasitas adsorpsi zeolit Lampung pada variasi konsentrasi ... 45
5 Optimasi waktu kontak zeolit Cikalong ... 46
6 Optimasi waktu kontak zeolit Lampung ... 47
7 Isotermal adsorpsi zeolit ... 48
8 Data hasil analisis isotermal Langmuir dan Freundlich ... 49
9 Pesamaan regresi linier laju adsorpsi Cd(II) ... 50
10 Perbandingan konstanta laju orde pertama dan orde kedua ... 51
11 Kinetika orde kedua ... 52
PENDAHULUAN
Latar Belakang
Pencemaran lingkungan salah satunya dapat disebabkan oleh adanya logam berat dalam jumlah diatas ambang batas. Logam berat merupakan salah satu pencemar yang sangat berbahaya bagi manusia dan lingkungan, sehingga perlu adanya perlakuan terhadap limbah sebelum dibuang ke perairan.
Cd (Kadmium) merupakan logam berat dengan potensi bahaya terbesar bagi manusia dan lingkungan, selain Pb(Timbal) dan Hg(Raksa). Berdasarkan persyaratan kesehatan air minum terhadap bahan kimia yang memiliki pengaruh langsung pada kesehatan yang diatur oleh Keputusan Menteri Kesehatan RI tahun 2002, kadar maksimum yang diperbolehkan untuk kadmium adalah 0,003 mg/L.
Di antara beberapa metode yang tersedia untuk pengolahan limbah logam berat, penyerapan oleh pertukaran ion merupakan aplikasi yang relatif sederhana, murah dan aman, karena hanya membutuhkan kondisi operasi ringan, pertukaran ion antara fase cair dan padat berpori, baik sintetis maupun alami (Panneerselvam et al. 2008). Menurut Malekpour et al. (2009) zeolit alam digunakan secara intensif karena kemampuannya dalam memisahkan spesi target melalui prinsip penukar ion. Penggunaan zeolit alam sebagai adsorben dikarenakan metodenya yang sederhana, bahan baku yang banyak terdapat di alam, kemampuan adsorpsinya yang cukup baik sehingga dapat mengontrol polusi dan pencemaran logam berat.
Di Indonesia, zeolit alam ditemukan melimpah dan tersebar di beberapa daerah di pulau Jawa dan Sumatera. Dalam dasawarsa ini zeolit oleh para peneliti dijadikan sebagai mineral serbaguna. Sifat-sifat unik tersebut meliputi dehidrasi, adsorben dan penyaring molekul, katalisator, dan penukar ion.
dilakukan sehingga dapat memberikan hasil yang nyata secara ekonomi (Pusat Penelitian & Pengembangan Teknologi Mineral 1994).
Adsorben yang digunakan dalam proses adsorpsi harus memenuhi kriteria yang dibutuhkan, di antaranya mempunyai daya serap yang besar terhadap larutan, zat padat yang mempunyai luas permukaan yang besar, tidak larut dalam zat cair yang akan diadsorpsi, tidak beracun dan mudah didapat serta, memiliki harga yang relatif murah. Karbon aktif, mineral lempung, zeolit, biomaterial, dan beberapa limbah padat industri telah banyak digunakan sebagai adsorben untuk adsorpsi ion dan nonionik dalam pengolahan air limbah (Wang & Peng 2010).
Aktivasi merupakan proses untuk menaikkan kapasitas adsorpsi sehingga diperoleh sifat yang diinginkan sesuai dengan penggunaannya. Aktivasi secara kimia dapat dilakukan dengan penambahan larutan asam ataupun basa. Pada umumnya asam yang digunakan adalah asam sulfat dan asam klorida, sedangkan basa yang digunakan adalah NaOH. Berbagai penelitian terhadap zeolit banyak dilakukan dalam modifikasinya yaitu dengan mengubah atau mempertukarkan ion yang dapat dipertukarkan, mengubah rasio perbandingan Si/Al, dealuminasi (penghilangan Al) melalui perlakuan asam mineral, dan sebagainya dengan tujuan meningkatkan mutu zeolit.
Panuccio et al. (2009) melakukan percobaan untuk aktivitas ion, pH, dan waktu kontak pada serapan kadmium dalam tiga mineral berbeda antara lain vermiculite, zeolit, dan batu apung. Dari parameter Langmuir dan Freundlich yang diperoleh, disimpulkan bahwa tingkat penyerapan kadmium mengikuti deret vermiculit>zeolit>batu apung. Hamidpour et al. (2010) membandingkan penyerapan Pb (II) dan Cd (II) oleh zeolit, dan menemukan bahwa zeolit lebih efektif dibandingkan bentonit sehingga dapat digunakan sebagai penyerap air dan pengolahan limbah.
asam fosfat, hasil analisa ternyata tidak mengubah struktur, dan pengujian terhadap penyerapan ion Cu2+ dari larutan air menunjukkan kapasitas yang tinggi, dua kali lipat dibandingkan keadaan zeolit sebelum termodifikasi.
Gupta & Bhattacharyya (2008) menyelidiki imobilisasi Pb(II), Cd(II) dan Ni(II) pada lempung (kaolinit dan montmorilonit) dalam medium air melalui proses adsorpsi dalam berbagai variabel adsorpsi, kinetika, dan termodinamika yang diantaranya menunjukkan bahwa adsorpsi Cd(II) menunjukkan peningkatan bertahap pada pH 1,0-10,0 dengan tidak ada indikasi pengendapan Cd(II)-hidroksida. Termodinamika proses imobilisasi bersifat eksotermik pada Pb(II) dan Ni(II), tetapi endotermik untuk Cd(II). Interaksi dengan Pb(II) dan Ni(II) disertai dengan penurunan entropi dan energi Gibbs, sedangkan imobilisasi endotermik pada Cd(II) didukung oleh peningkatan entropi dan penurunan berarti dalam energi Gibbs.
Berdasarkan beberapa hasil penelitian selain pada zeolit alam, zeolit sintetis termodifikasi asam sulfat juga telah memberikan pengaruh yang berarti pada sifatnya sebagai adsorben. Kadmium merupakan salah satu adsorbat yang dalam proses kinetika dan termodinamika adsorpsinya oleh zeolit sintetik memberikan hasil yang berbeda bila dibandingkan dengan Ni(II) dan Pb(II) (Gupta & Bhattacharyya 2008).
Peranan zeolit sebagai salah satu penjerap senyawa organik sampai saat ini masih terus dilakukan, sehingga pengubahan terhadap struktur zeolit perlu dilakukan untuk memperoleh hasil guna yang lebih baik dari zeolit asal. Penelitian ini mengamati pengaruh modifikasi zeolit alam dengan menggunakan asam fosfat terhadap penjerapan kadmium. Proses penjerapan dilakukan dengan menggunakan sampel zeolit yang berasal dari Lampung (klinoptilolit) dan Cikalong, Tasikmalaya (mordenit) yang dimodifikasi dengan asam fosfat sebagai adsorben terhadap kadmium.
Perumusan Masalah
pemanasan dan aktivasi permukaan zeolit dengan pelarut kimia yang sesuai, yaitu menggunakan larutan HCl 4 M serta memodifikasinya dengan asam fosfat.
Zeolit hasil modifikasi menggunakan asam fosfat selanjutnya diamati kapasitas adsorpsinya terhadap ion logam Cd(II). Penerapan berbagai variabel adsorpsi memberikan informasi mengenai potensi dua sumber zeolit alam yang berbeda, yaitu jenis mordenit dan klinoptilolit, sebagai adsorben terhadap ion logam Cd(II).
Tujuan Penelitian
Tujuan penelitian ini adalah mengetahui kemampuan zeolit alam yang berasal dari Cikalong dan Lampung oleh modifikasi asam fosfat dalam adsorpsinya sebagai penjerap ion logam kadmium.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai peran zeolit alam yang dimodifikasi asam fosfat sebagai penjerap Cd(II).
Hipotesa Penelitian
TINJAUAN PUSTAKA
Kadmium (Cd)
Unsur kadmium dengan nomor atom 48, bobot atom 112,4 g/mol, dan densitas 8.65 g/cm3 merupakan salah satu jenis logam berat yang berbahaya, karena dalam jangka waktu panjang dapat terakumulasi pada tubuh manusia khususnya pada hati dan ginjal. Kadmium yang terdapat dalam tubuh manusia sebagian besar diperoleh melalui makanan dan tembakau, hanya sejumlah kecil berasal dari air minum dan pencemaran udara. Pada konsentrasi rendah kadmium dapat memberikan efek terhadap gangguan paru-paru, emphysema, dan penyakit renal tubular yang kronis (Suhendrayatna 2001).
Kadmium dalam perairan terion dari garamnya dalam bentuk Cd2+. Sumber kadmium dalam lingkungan berasal dari pelapisan logam, industri penambangan dan peleburan, pabrik baterai kadmium-nikel, pupuk fosfat, pabrik cat dan zat warna, serta industri alloy (Gupta & Bhattacharyya, 2008). Ion kadmium mempunyai sedikit kecenderungan terhidrolisis pada pH di bawah 8, tetapi di atas pH 11 seluruh kadmium berada sebagai komplek hidrokso. Dalam air segar pada pH 6-8 dominan sebagai Cd(II), CdOH+, Cd(OH)2, Cd(OH)3-, Cd(OH)42- yang tergantung pada pH larutan. Kompleks kloro CdCl+, CdCl2, dan CdCl3- lebih dominan pada air laut, sementara Cd(II) berada dalam jumlah yang sangat kecil. Kadmium karbonat dapat digunakan sebagai kontrol kelarutan (Mohan et al. 2006)
Jumlah normal kadmium di tanah berada di bawah 1 ppm, tetapi angka tertinggi 1700 ppm dijumpai pada sampel tanah yang diambil di dekat pertambangan bijih seng. Kadmium lebih mudah diakumulasi oleh tanaman dibandingkan dengan ion logam berat lain seperti timbal (Barchan et al. 1998).
Stuktur Kimia Zeolit
air laut, sedangkan zeolit sintesik direkayasa oleh manusia secara proses kimia atau di laboratorium.
Zeolit Indonesia umumnya mengandung jenis mordenit, dan klinoptilolit, serta kadang-kadang gabungan jenis keduanya (Suyartono 1991). Umumnya zeolit tersusun oleh satuan unit pembangun primer yang merupakan satuan unit terkecil tetrahedral SiO4 dan AlO4. Dalam struktur zeolit, atom Si dan O tidak memiliki muatan, sedangkan atom Al bermuatan negatif sehingga struktur rantai aluminosilikat akan dinetralkan oleh kation (contoh Na , Ca dan K ).
Zeolit merupakan kristalin dari aluminosilikat alkali atau alkali tanah terhidrasi, yang memiliki struktur kerangka tiga dimensi terbuka yang dibangun oleh tetrahedral-tetrahedral SiO44- dan AlO45- dengan atom O sebagai penghubung antara atom Si dengan atom Al membentuk rongga-rongga dan saluran-saluran yang teratur. Dibawah ini ditunjukkan gambar struktur dan rumus dari jenis zeolit mordenit dan klinoptilolit (Gambar 1).
Struktur kristal modernit Struktur kristal klinoptilolit
Na8[Al8Si40O96]24 H2O Na6[Al6Si30O72]24 H2O
Gambar 1 Struktur kerangka zeolit mordenit dan klinoptilolit (http://www.iza-online.org/natural/index.htm 2010)
Formula umum penyusun zeolit adalah (Mx+, My2+)(Al(x+2y) Sin-(x+2y) O2n). mH2O, dengan simbol M+ dan M2+ yaitu berturut-turut kation monovalen atau divalen. Kation yang terdapat dalam tanda kurung pertama adalah kation yang dapat tukar (exchangeable cations), sedangkan yang kedua adalah kation struktural (penyusun dasar) karena bersama-sama dengan atom O menyusun zeolit, sementara m adalah jumlah mol air.
Unit-unit pembentuk struktur mineral zeolit secara garis besar digolongkan ke dalam dua bagian utama yaitu (a) unit pembangun primer (primary building unit), yaitu SiO44- dan AlO45- yang berbentuk tetrahedral, dan (b) unit pembangun sekunder (secondary building unit/ SBU), yaitu gabungan dari pembentuk primer yang dapat membentuk cincin. Beberapa cincin ini akan bergabung saling menghubungkan diri membentuk bangunan polihedral seperti ditunjukkan oleh Gambar 2 dan 3. Struktur zeolit membentuk rongga diantara ion-ion yang terikat satu dengan yang lainnya yang terisi oleh molekul air. Jika molekul air didehidrasi, maka rongga dapat terisi oleh molekul yang ukurannya lebih kecil dari rongga tersebut, peristiwa ini disebut adsorpsi.
Gambar 2 Tetrahedral alumina dan silika (TO4) pada struktur zeolit (Las 2005).
Mineral zeolit bukan mineral tunggal, melainkan sekelompok mineral yang terdiri dari beberapa spesies, antara lain analsit, klinoptilolit, kabalsit, mordenit, natrolit dan sebagainya. Spesies berbeda satu sama lain dengan adanya variasi dalam perbandingan jumlah Si dan Al. Selain itu jenis dan jumlah kation dalam tiap spesies berbeda. Kabasit kaya akan Ca, klinoptilolit kaya akan Na atau K, mordenit kaya akan Ca dan Na dan seterusnya.
Al
juga berperan dalam proses pertukaran ion. Semakin besar konsentrasinya semakin besar pula kemungkinan tejadinya pertukaran ion, demikian pula halnya dengan temperatur, semakin tinggi temperatur, maka tumbukan antar ion semakin besar sehingga proses pertukaran ion akan lebih mudah terjadi. Kapasitas pertukaran kation tergantung kepada ukuran, muatan ion, dan jenis zeolit
Sifat Adsorpsi dari Zeolit
Adsorpsi adalah proses penjerapan suatu zat oleh zat lainnya yang hanya terjadi pada permukaan. Zat yang diserap disebut fase terjerap (adsorbat) dan zat yang menjerap disebut adsorben. Adsorben pada umumya adalah zat padat yang berongga, contohnya adalah zeolit. Pada umumya untuk dapat mengadsorpsi, zeolit harus didehidrasi terlebih dahulu dengan pemanasan.
Adsorpsi yang terjadi pada permukaan padatan atau cairan dapat melibatkan satu atau banyak lapisan molekul. Hal ini tergantung pada permukaan serta jenis gaya yang terlibat. Selain itu adsorpsi tergantung pada luas permukaan. Semakin besar luas permukaan maka adsorpsi juga semakin besar. Adsorben yang baik adalah padatan yang sangat porous dan butiran yang sangat halus. Banyaknya zat yang teradsorpsi sebagian besar tergantung pada zat padatnya dan molekul yang teradsopsi (Husaini 2003).
Beberapa mekanisme yang terlibat dalam proses adsorpsi terutama adalah adsorpsi fisik atau gaya Vander Waals, adsorpsi kimia atau daya tarik elektrostatik, ikatan hidrogen dan kompleks koordinasi. Sedangkan faktor-faktor yang memengaruhi proses adsorpsi antara lain luas permukaan, ukuran partikel, dan komposisi kimia. Adapun sifat adsorbat antara lain ukuran molekul dan komposisi kimia serta konsentrasi adsorbat dalam fase cairan. Semakin kecil ukuran partikel, maka semakin besar luas permukaan padatan persatuan volume tertentu, sehingga semakin banyak zat yang diadsorpsi (Atkins 1995).
Penjerapan adsorben sangat dipengaruhi oleh luas permukaan, sehingga adsorben harus mempunyai pori yang maksimum. Penyediaan reaktan pada permukaan adsorben dipengaruhi oleh kecepatan difusi reaktan tersebut kedalam pori. Jika beberapa molekul memasuki sistem pori zeolit, salah satu molekul tersebut akan tertahan yang berdasarkan pada kepolaran atau efek interaksi molekul tersebut dengan zeolit.
Aktivasi Zeolit
Aktivasi merupakan proses untuk menaikkan kapasitas adsorpsi sehingga diperoleh sifat yang diinginkan sesuai dengan penggunaannya. Tujuan aktivasi zeolit adalah untuk menghasilkan luas permukaan yang lebih luas melalui pembentukan struktur berpori dan juga untuk menghilangkan senyawa-senyawa pengotor. Aktivasi zeolit dilakukan dengan pemanasan, penambahan asam, dan penambahan basa. Pada penelitian ini dilakukan aktivasi dengan penambahan asam dan pemanasan. Pada umumnya asam yang digunakan adalah asam sulfat dan asam klorida, sedangkan basa yang digunakan adalah NaOH.
Proses aktivasi dilakukan melalui dua cara antara lain proses fisis dilakukan dengan pemanasan pada suhu 300⁰-375⁰C selama 3-4 jam (Suwardi, 2000) Pemberian larutan HCl pada dasarnya dapat meningkatkan KTK zeolit, akan tetapi jumlah senyawa pengotor yang berbeda memberikan hasil peningkatan yang berbeda pula. Ini menunjukkan bahwa zeolit yang berasal dari lokasi berbeda memiliki respon yang berbeda terhadap perlakuan asam. (Sastiono 1993). Peningkatan KTK zeolit hasil pemanasan lebih rendah daripada hasil pengasaman atau penambahan basa, karena pada pemanasan hanya molekul-molekul air dalam rongga yang dapat dihilangkan.
rendah, tetapi justru sebaliknya dengan meningkatnya konsentrasi HCl akan mengakibatkan kenaikan persentase SiO2.
Isoterm Adsorpsi
Isoterm adsorpsi merupakan hubungan yang menunjukkan distribusi fasa teradsorpsi pada permukaan adsorben dengan fasa ruah saat kesetimbangan pada temperatur tertentu. Isoterm yang umum digunakan antara lain isoterm Langmuir dan Freundlich. Isoterm Langmuir dipelajari untuk menggambarkan pembatasan sisi aktif adsorpsi dengan asumsi bahwa sisi aktif adsorben bersifat homogen dan memiliki energi yang sama dalam mengadsorbsi adsorbat. Isoterm adsorpsi Langmuir didasarkan atas asumsi, (1) adsorpsi hanya terjadi pada lapisan tunggal (monolayer), (2) panas adsorpsi tidak tergantung pada penutupan permukaan, (3) semua bagian dan permukaannya bersifat homogen, dan (4) sejumlah tertentu tapak aktif adsorben membentuk ikatan kovalen atau ion. Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoritis dengan menganggap terjadinya kesetimbangan antara molekul-molekul yang diadsorpsi pada permukaan adsorben dengan molekul-molekul yang tidak teradsorpsi. Persamaan isoterm adsorpsi Langmuir dapat dituliskan sebagai berikut:
= (1)
dengan qe= jumlah adsorbat yang teradsorpsi per unit bobot adsorben pada kesetimbangan (mg/g), qm= kapasitas adsorpsi maksimum (mg/g), Ce = konsentrasi kesetimbangan adsorbat dalam larutan (mg/L), b = konstanta yang berhubungan dengan energi bebas adsorpsi (L/mg).
Persamaan isoterm adsorpsi Freundlich didasarkan pada asumsi, (1) terbentuknya adsorpsi beberapa lapisan (multilayer) dari molekul-molekul adsorbat pada adsorben, (2) bagian tapak aktif pada permukaan adsorben bersifat heterogen, dan (3) hanya melibatkan gaya Van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lain dari adsorben. Persamaan isoterm adsorpsi Freundlich dapat dituliskan sebagai berikut:
dengan KF = konstanta, yang menggambarkan kapasitas adsorpsi relatif dari adsorben ((mgg-1)(mgl-1)n), n= konstanta yang menggambarkan intensitas adsorpsi.
Gambar persamaan linear Langmuir dan Freundlich diperoleh dengan memplot berturut-turut Ce/qe vs Ce dan log qe vs log Ce, dan dengan persamaan tersebut koefisien dapat dicari.
Persamaan Langmuir juga digunakan untuk memperoleh nilai RL, yang menggambarkan dimensi parameter kesetimbangan atau faktor pemisahan dengan persamaan (Ghassabzadeh et al. 2010)
= (3)
berdasarkan nilai R, bentuk isoterm dapat ditafsirkan sebagai R>1 menggambarkan adsorpsi yang kurang baik, R = 1 adsorpsi linear, 0<R<1 adsorpsi yang baik, R = 0 adsorpsi irreversible. Dalam persamaan Freudlich, nilai n dalam rentang 1-10 menggambarkan adsorpsi yang baik (Fan et al. 2008)
Kinetika Adsorpsi
Untuk menentukan orde kinetika adsorpsi biasanya digunakan persamaan model kinetika orde pertama semu dan orde kedua semu. Persamaan Lagergren, pertama diterapkan dengan asumsi kinetika orde pertama semu, di mana jumlah ion logam melebihi jumlah tempat adsorpsi di permukaan adsorben. Nilai konstanta rata-rata orde pertama, k1, diperoleh dari persamaan berikut (Mohan et al. 2006; Fan et al. 2008; Gupta & Bhattacharyya 2008) :
= − ) (4)
Integrasi persamaan (4) dari qt = 0 pada t = 0 adalah:
= − (5)
atau − ) = −
. (bentuk linear) (6)
= − ) (8) dimana k2 adalah konstanta rata-rata orde kedua. Bentuk integrasi dari persamaan adalah:
= + (9)
nilai k2 dapat ditentukan dengan memplot grafik t/qt versus t.
Parameter termodinamika
Dalam praktek teknik faktor entropi dan energi bebas Gibbs harus dipertimbangkan untuk menentukan apakah proses akan terjadi secara spontan. Parameter termodinamika seperti perubahan entalpi (ΔH°), energi bebas Gibbs (ΔG°) dan perubahan entropi (ΔS°) dapat diperkirakan dengan menggunakan konstanta kesetimbangan dengan perubahan suhu. Nilai-nilai perubahan energi bebas Gibbs standar untuk proses adsorpsi dievaluasi dengan menggunakan nilai yang diperoleh dari Kc model Langmuir pada suhu yang berbeda. Konstanta kesetimbangan dapat diekspresikan dalam perubahan entalpi adsorpsi dan suhu sebagai berikut (Fan et al. 2008; Gupta & Bhattacharyya 2008; Ghassabzadeh et al. 2010):
∆ ° = − ln (10)
∆ ° = ∆ ° − ∆ ° (11)
= .∆ ° − .∆ ° (12)
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari 2011 sampai dengan Mei 2011 bertempat di Laboratorium Kimia Analitik dan Laboratorium Bersama Departemen Kimia FMIPA IPB, Laboratorium Departemen Ilmu Tanah Fakultas Pertanian IPB, PTBIN BATAN Serpong dan Lemigas.
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah spektrofotometer serapan atom (AAS Shimadzu 7000), XRD (Shimadzu XRD 610), dan SEM (Analytical Scanning Electron Microscope JSM-6510LA). Bahan yang digunakan adalah: zeolit alam asal Lampung dan Cikalong, HCl 4 M, larutan stok 1000 mg Cd(II) per liter (dibuat dengan melarutkan CdCl2 dalam 1 L air bebas ion dan digunakan sebagai larutan adsorbat), H3PO4, NaHCO3, NaOH 0,01 N.
Metode Penelitian
Penelitian ini dilakukan dalam beberapa tahap mulai dari preparasi, aktivasi, dan modifikasi zeolit, juga dilakukan karakterisasi dan identifikasi terhadap sampel menggunakan XRD, SEM-EDS, KTK, dan uji adsorpsi, yang diurutkan dalam diagram alir penelitian (Lampiran 1).
Preparasi
Zeolit alam (asal Lampung dan Cikalong) masing-masing dihaluskan lalu diayak sehingga diperoleh zeolit dengan ukuran butir lolos ayakan 60 mesh, kemudian dilakukan pemanasan dalam tanur bersuhu 300 °C selama 3 jam.
Aktivasi zeolit
menunjukkan bebas Cl (tidak ada endapan jika ditetesi dengan Ag), selanjutnya zeolit dipanaskan pada suhu 300 ˚C selama 3 jam.
Modifikasi zeolit
Sebanyak 100 g zeolit alam teraktivasi dicampur dengan 13.1 g asam fosfat (H3PO4 85% 7,8 mL) dalam 2 L aquabides. Campuran diaduk dengan magnet
stirer pada suhu 60 °C selama 3 jam kemudian disaring dengan vakum dan dipanaskan pada suhu 300 °C selama 1 jam. Kemudian campuran ditambah dengan 1500 mL larutan NaHCO3 jenuh, dan diaduk dengan magnet stirer pada suhu 60 °C selama 3 jam untuk mendapatkan bentuk natrium, lalu disaring, residu dicuci dengan air sampai pH netral dan dikeringkan dalam oven pada suhu 300 °C selama 1 jam. Zeolit hasil modifikasi selanjutnya disebut zeolit-PNa2 (Panneerselvam et al. 2008)
Penentuan KTK dan karekterisasi zeolit
Prosedur penentuan KTK dan identifikasi terhadap kandungan beberapa unsur yang terdapat pada kedua jenis zeolit dilakukan di Laboratorium Departemen Ilmu Tanah Fakultas Pertanian IPB dengan menggunakan metode Ammonium Asetat yang merujuk literatur Methods of Soil Analysis (Page A.L et al. 1982). Selain itu, penciriannya dianalisa menggunakan XRD dan SEM yang dilakukan di BATAN. Sedangkan untuk luas permukaan pori dilakukan dengan menggunakan metode BET di Lemigas.
Penentuan parameter optimum adsorpsi
Penentuan parameter optimum dilakukan untuk melihat kondisi kesetimbangan dari sifat adsorbat maupun adsorben yang akan digunakan dalam penentuan adsorpsi isotermal dan kinetika adsorpsi. Adapun parameter dalam optimasi dimulai dari kesetimbangan konsentrasi, pH, waktu kontak, dan bobot adsorben.
150 rpm, suhu dijaga agar konstan selama interval waktu yang ditentukan. Setelah tercapai kesetimbangan campuran disentrifugasi dan ion logam yang tertinggal dalam filtrat dianalisis dengan SSA. Percobaan diulang dengan konsentrasi adsorbat (10, 20, 30, 40, dan 50 mg/L), pH larutan ( 3, 5, 7, 9, 11), waktu kontak (10, 30, 60, 90, 120, 150,180, 210, dan 240 menit), variasi bobot adsorben (0.1, 0.2, 0.3, 0.4 dan 0.5 g), dan suhu (303, 308, dan 313 K). Untuk menjaga pH larutan, ditambahkan NaOH 0,01 N atau HCl 0,01 N sebelum adsorpsi, dan pH dikontrol sebelum dan sesudah adsorpsi.
Isotermal adsorpsi
Adsorben zeolit ditambahkan kedalam 50 ml larutan Cd(II) dengan konsentrasi 10, 20, 30, 40 mg/L, digojog pada kondisi optimal dan suhu kamar. Selanjutnya adsorben zeolit disaring dengan kertas saring dan kadar Cd dalam filtrat dianalisis dengan spektrofotometer serapan atom pada panjang gelombang 228.8 nm.
Kinetika adsorpsi
Adsorben zeolit masing-masing ditambahkan kedalam 50 ml larutan Cd(II) dengan konsentrasi 10, 20, 30, 40 mg/L digojog pada kondisi optimal pada suhu kamar. Pada selang waktu 30, 60, 120, 180 dan 240 menit diambil filtratnya dan dianalisis oleh spektrofotometer serapan atom pada panjang gelombang 228.8 nm.
Percobaan pengaruh suhu terhadap kinetika adsorpsi dilakukan sebagai berikut: adsorben zeolit ditambahkan kedalam 50 ml larutan Cd(II) dengan konsentrasi 10 mg/L, kemudian digojog pada kondisi optimal suhu 30, 40, dan 50 ˚C. Pada selang waktu 30, 60, 120, 180, dan 240 menit diambil filtratnya untuk dianalisis oleh spektrofotometer pada panjang gelombang 228.8 nm.
Kapasitas adsorpsi dihitung dengan cara:
Q =
m C) V(Co−
(13)
Efisiensi adsorpsi dapat dihitung dengan menggunakan persamaan :
Keterangan:
Q = kapasitas adsorpsi/ion logam yang teradsorpsi (mg/g) V = volume larutan (L)
Co = konsentrasi awal ion logam dalam larutan (mg/L)
HASIL DAN PEMBAHASAN
Hasil analisis proses preparasi, aktivasi dan modifikasi terhadap zeolit Penelitian ini menggunakan zeolit alam yang berasal dari Lampung dan Cikalong, Jawa Barat. Zeolit alam Lampung merupakan jenis klinoptilolit, sementara zeolit alam Cikalong merupakan jenis mordenit. Pemilihan kedua jenis zeolit alam tersebut bertujuan untuk melihat pengaruh aktivasi dan modifikasi terhadap dua jenis zeolit yang berbeda. Zeolit tersebut dihaluskan sampai ukuran 60 mesh dengan tujuan untuk menghomogenkan ukuran permukaan serta memperbesar permukaan pori zeolit, sehingga kemampuan adsorpsi dapat lebih optimal. Pemanasan yang dilakukan ditahap preparasi pada suhu 300 °C adalah untuk menguapkan air yang terkandung dalam kristal zeolit sehingga dapat mempertinggi keaktifan zeolit disebabkan oleh terbukanya pori-pori zeolit.
Proses aktivasi bertujuan untuk menghilangkan unsur-unsur pengotor (pengganggu) yang terdapat didalam zeolit, yaitu dengan cara pemanasan dan cara penambahan zat kimia. Aktivasi dilakukan dengan perendaman dan pengadukan zeolit dengan HCl 4 M selama 1 jam dengan harapan tidak terjadinya dealuminasi.
Modifikasi pada zeolit bertujuan untuk meningkatkan kualitas dari zeolit melalui proses tukar kation pada inti aktif zeolit sehingga terjadi peningkatan KTK (kapasitas tukar kation), yang dapat meningkatkan kapasitas adsorpsi terhadap penjerapan larutan Cd(II). Menurut Pannerselvam et al. 2008 modifikasi asam fosfat yang dikonversi dengan Na+ pada zeolit alam untuk penyerapan Cu2+ memiliki kapasitas adsorpsi lebih tinggi pada zeolit dibanding adsorben lain.
Gambar 4 Skema reaksi modifikasi zeolit PNa2 (Panneerselvam et al. 2008)
Hasil analisis kandungan unsur pada modifikasi zeolit
Pengukuran nilai KTK mulai tahap preparasi, aktivasi, dan modifikasi dengan pemanasan pada 300 ˚C menunjukkan kenaikan secara teratur baik pada zeolit Lampung maupun zeolit Cikalong (Tabel 1).
Tabel 1 Kapasitas Tukar Kation (KTK) dari tahap perlakuan zeolit
Perlakuan Modifikasi H3PO4
50.41
KTK zeolit Cikalong lebih besar dibandingkan dengan zeolit Lampung, hal ini dapat disebabkan karena pengaruh ikatan fosfat dan tukar kation. Pengaruh suhu tinggi dapat mengakibatkan terjadi penurunan nilai KTK, hal ini terlihat pada Tabel 1 jika dilakukan pemanasan pada suhu lebih dari 400 ˚C pada preparasi dan aktivasi zeolit ternyata dapat mengalami penurunan nilai KTK. Hal ini sesuai dengan penelitian Sastiono (1993), pemanasan zeolit pada suhu 400-600 °C dapat mengakibatkan kondensasi dari gugus hidroksil (dehidroksilasi) yang mengakibatkan kerusakan struktural, sehingga menghasilkan bahan yang lebih amorf.
dan hilangnya unsur-unsur pengotor karena adanya perubahan kandungan pada setiap tahap.
Tabel 2 Unsur-unsur yang terkandung pada karekteristik sampel zeolit dalam berbagai kondisi
Zeolit Perlakuan Ca Mg K Na P (ppm) (ppm) (me/100g) (me/100g) (ppm)
Cikalong Preparasi 10.3152 0.4429 0.3125 0.7635 -
Aktifasi 8.8005 0.3717 0.3317 0.4984 -
Modifikasi 7.7941 0.2612 0.2169 1.7285 133.60
Lampung Preparasi 5.5305 0.7484 0.5358 0.5938 -
Aktifasi 4.9494 0.6052 0.3828 0.2227 -
Modifikasi 5.1188 0.5710 0.3572 1.3362 158.65
Dari analisis EDS diketahui bahwa untuk tahap preparasi dan modifikasi dengan mengambil rata-rata 3 titik sampel sebagai perwakilan masing-masing zeolit, menunjukkan kandungan utama zeolit Si mengalami kenaikan. Untuk zeolit Cikalong kadar Si naik dari 20.42 ppm menjadi 22.18 ppm sedangkan zeolit Lampung dari 18.11 ppm menjadi 21.56 ppm walaupun terjadi sedikit pergeseran Al, untuk zeolit Cikalong dari 3.59 ppm menjadi 3.50 ppm sedangkan zeolit Lampung dari 4.0 ppm menjadi 3.32 ppm. Analisis Na tetap menunjukkan kenaikan pada kedua zeolit (Lampiran 2 dan 3).
bahwa penggunaan HCL 5 M ternyata tidak menurunkan kandungan SiO2 dan Al2O3 kecuali jika dipanaskan pada suhu >75 ˚C.
Hasil analisis karakterisasi zeolit
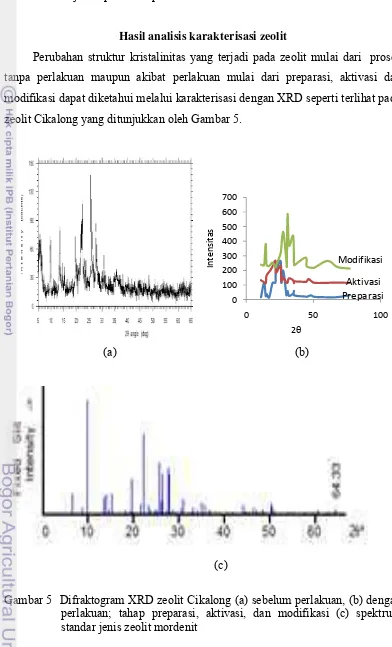
Perubahan struktur kristalinitas yang terjadi pada zeolit mulai dari proses tanpa perlakuan maupun akibat perlakuan mulai dari preparasi, aktivasi dan modifikasi dapat diketahui melalui karakterisasi dengan XRD seperti terlihat pada zeolit Cikalong yang ditunjukkan oleh Gambar 5.
(a) (b)
(c)
Gambar 5 Difraktogram XRD zeolit Cikalong (a) sebelum perlakuan, (b) dengan perlakuan; tahap preparasi, aktivasi, dan modifikasi (c) spektrum standar jenis zeolit mordenit
0 100 200 300 400 500 600 700
0 50 100
Intensitas
2θ
Preparasi Modifikasi
Gambar 5(a) menunjukkan difraktogram XRD zeolit Cikalong sebelum dilakukan tahap preparasi. Diketahui berbagai puncak yang muncul pada rentang sudut difraksi (2θ) antara 5-65˚. Intensitas tertinggi muncul pada beberapa sudut 2θ di antaranya 25.669, 22.337, 27.673, dan 13.506. Apabila dibandingkan posisi puncak yang didapat dari data pengukuran dengan standar difraksi sinar-X atau kartu JCPDS (Joint Committee Powder Diffraction Standard) jenis mineral mordenit (c), posisi puncak-puncaknya berada pada rentang sudut difraksi (2θ), di antaranya 9.754, 22.206, 25.576, dan 27.681. Pada gambar terlihat banyak puncak karena masih banyaknya pengotor. Sedangkan pada gambar zeolit Cikalong hasil preparasi (a) menunjukkan beberapa intensitas di antaranya 25.568, 27.595, 22.121, dan 26.131. Bila dibandingkan dengan zeolit Cikalong aktivasi, hasil difraktogram menunjukkan terjadi pergeseran yang tidak signifikan dimana intensitas puncak muncul pada beberapa sudut di antaranya 25.999, 27.973, 22.523, dan 22.317 serta beberapa puncak pada preparasi sudah tidak nampak lagi di antaranya puncak pada sudut 22.121 dan 77.002 yang menunjukkan hilangnya pengotor-pengotor.
Karakterisasi zeolit Cikalong modifikasi menunjukkan beberapa puncak dengan sudut difraksi 2θ, di antaranya 25.558, 22.117, 27.602, dan 26.139 yang mendekati standar yaitu 25.955. Beberapa pengotor sudah hilang ditandai dengan hilangnya beberapa puncak dibandingkan dari hasil aktivasi sebelumnya, diantaranya puncak pada sudut 39.661, namun muncul puncak baru pada sudut 13.294. Jadi berdasarkan hasil difraktogram sinar-X dari sebelum perlakuan, kemudian dilakukan preparasi dan aktivasi tidak merubah struktur zeolit akibat pemanasan maupun aktivasi dengan penambahan HCl.
0 100 200 300 400 500 600
0 20 40 60
In
ten
sitas
2θ
Modifikasi
Aktivasi
Preparasi
(a) (b)
(c)
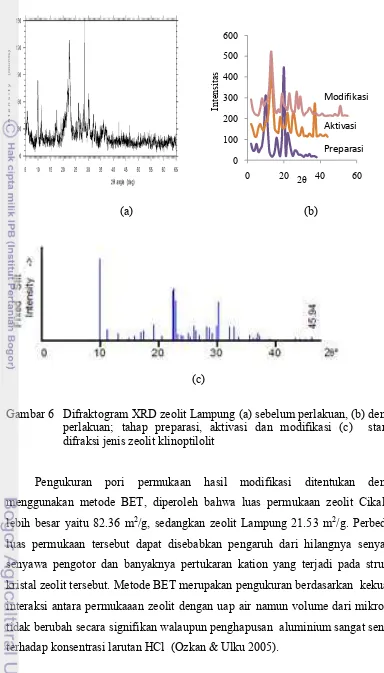
Gambar 6 Difraktogram XRD zeolit Lampung (a) sebelum perlakuan, (b) dengan perlakuan; tahap preparasi, aktivasi dan modifikasi (c) standar difraksi jenis zeolit klinoptilolit
(a)
(b)
Gambar 7 Hasil SEM zeolit Cikalong (a) dan Lampung (b)
Hasil SEM (Scanning Electron Microscope) pada Gambar 7 dengan perbesaran 2000x dengan skala perbandingan pada gambar 10μm, menunjukkan morfologi permukaan kedua zeolit mengalami perubahan bentuk permukaan. Pada gambar zeolit Cikalong preparasi menunjukkan permukaan masih belum teratur menyatakan masih banyaknya senyawa pengotor, setelah diaktivasi permukaan terlihat lebih teratur dan seragam, dan setelah dimodifikasi permukaan lebih bersih dengan bentuk partikel yang lebih kecil, begitu pula pada zeolit Lampung pada hasil modifikasi menunjukkan permukaan menjadi lebih halus. Hal ini menunjukkan bahwa dari tahap proses preparasi, aktivasi, dan modifikasi pada kedua zeolit mampu mengubah permukaan zeolit menjadi lebih kecil dan teratur.
preparasi aktivasi modifikas
Optimasi Parameter Adsorpsi
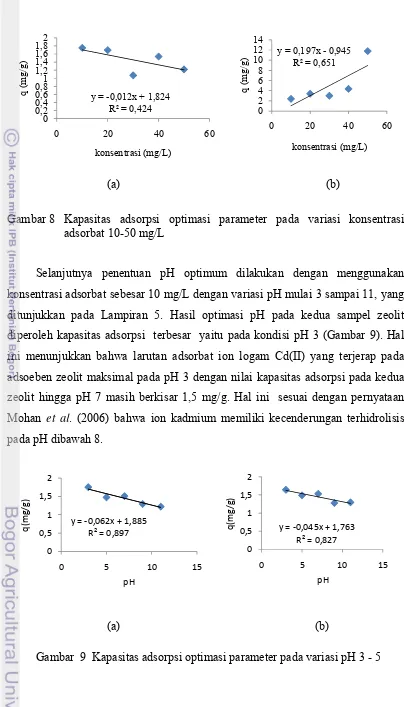
Parameter adsorpsi pada uji pendahuluan dilakukan guna memperoleh kapasitas jerapan yang maksimal dalam adsorpsi larutan ion Cd(II) oleh kedua jenis sampel zeolit yang akan digunakan pada proses isotermal adsorpsi, kinetika, dan termodinamika. Penentuan kapasitas adsorpsi pada variasi konsentrasi adsorbat 10, 20, 30, 40, dan 50 mg/L menggunakan volume 50 mL dengan waktu kontak 60 menit dan 0.1 g adsorben. Hasil percobaan menunjukkan bahwa kapasitas adsorpsi tertinggi pada zeolit Cikalong berada pada konsentrasi adsorbat 10 mg/L, sedangkan pada zeolit Lampung sebaliknya yaitu pada konsentrasi adsorbat 50 mg/L. Hal ini menunjukkan bahwa interaksi antara larutan ion logam Cd(II) dengan adsorben zeolit Lampung cukup tinggi, karena seiring dengan naiknya konsentrasi adsorbat hingga 50 mg/L masih belum mencapai titik jenuh.
Tingginya kapasitas adsorpsi salah satunya dapat disebabkan karena banyaknya kation tukar yang terjadi dalam proses jerapan larutan adsorbat terhadap adsorben yang akan dipengaruhi oleh ikatan yang terjadi antara muatan negatif dengan kation tukar yang masuk kedalam rongga zeolit, oleh kestabilan ikatan. Adanya gugus fosfat dapat mempengaruhi ikatan yang terjadi pada interaksi jerapan, dimana kandungan fosfat pada zeolit Lampung lebih besar dibandingkan zeolit Cikalong, sehingga kestabilan ikatan yang terjadi pada zeolit Lampung lebih kuat dibandingkan zeolit Cikalong, hal ini salah satu penyebab tingginya kapasitas adsorpsi pada zeolit Lampung.
y = 0,197x - 0,945
Gambar 8 Kapasitas adsorpsi optimasi parameter pada variasi konsentrasi adsorbat 10-50 mg/L
Selanjutnya penentuan pH optimum dilakukan dengan menggunakan konsentrasi adsorbat sebesar 10 mg/L dengan variasi pH mulai 3 sampai 11, yang ditunjukkan pada Lampiran 5. Hasil optimasi pH pada kedua sampel zeolit diperoleh kapasitas adsorpsi terbesar yaitu pada kondisi pH 3 (Gambar 9). Hal ini menunjukkan bahwa larutan adsorbat ion logam Cd(II) yang terjerap pada adsoeben zeolit maksimal pada pH 3 dengan nilai kapasitas adsorpsi pada kedua zeolit hingga pH 7 masih berkisar 1,5 mg/g. Hal ini sesuai dengan pernyataan Mohan et al. (2006) bahwa ion kadmium memiliki kecenderungan terhidrolisis pada pH dibawah 8.
(a) (b)
Dari hasil optimasi yang diperoleh sebelumnya, yaitu konsentrasi adsorbat 10 mg/L dan pH 3, jerapan zeolit terhadap Cd(II) dilakukan pada variasi waktu kontak 30, 60, 90, 120, 180, dan 240 menit. Hasil jerapan ternyata memberikan kapasitas adsorpsi yang tidak terlalu berbeda, maka pengamatan dilakukan pada waktu 10 dan 20 menit. Kapasitas adsorpsi terbesar dicapai pada waktu 10 menit untuk zeolit Cikalong yang tidak jauh berbeda dengan kapasitas adsorpsi pada zeolit Lampung namun pada waktu yang lebih lama yaitu 180 menit (Lampiran 5 dan 6).
(a) (b)
Gambar 10 Kapasitas adsorpsi optimasi parameter variasi kontak waktu (10, 20, 30, 60, 90, 120, 180, dan 240 menit)
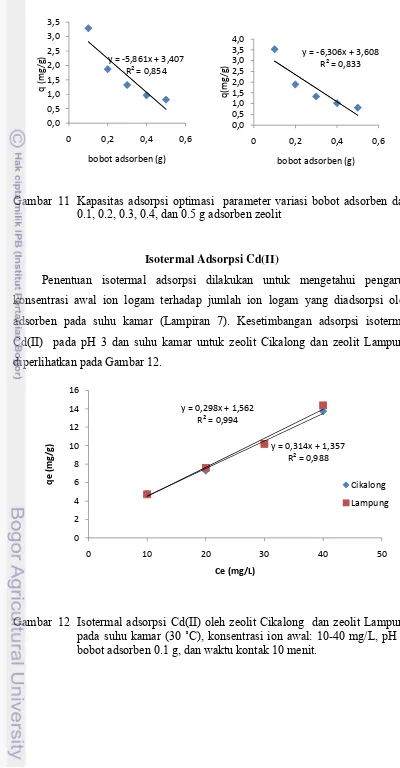
Hasil optimasi berikutnya dilakukan pula terhadap pengaruh bobot adsorben pada larutan adsorbat Cd(II), yaitu pada variasi bobot mulai dari 0.1 sampai 0.5 g. Kapasitas adsorpsi pada kedua zeolit menunjukkan kondisi optimal berada pada bobot adsorben 0.1 g. Hal ini menunjukkan jerapan yang terbesar dari interaksi larutan adsorbat dengan adsorben terjadi pada kondisi maksimal pada bobot 0,1 g dalam konsentrasi larutan 10 mg/L (Gambar 11).
Gambar 11 Kapasitas adsorpsi optimasi parameter variasi bobot adsorben dari 0.1, 0.2, 0.3, 0.4, dan 0.5 g adsorben zeolit
Isotermal Adsorpsi Cd(II)
Penentuan isotermal adsorpsi dilakukan untuk mengetahui pengaruh konsentrasi awal ion logam terhadap jumlah ion logam yang diadsorpsi oleh adsorben pada suhu kamar (Lampiran 7). Kesetimbangan adsorpsi isotermal Cd(II) pada pH 3 dan suhu kamar untuk zeolit Cikalong dan zeolit Lampung diperlihatkan pada Gambar 12.
Gambar 12 Isotermal adsorpsi Cd(II) oleh zeolit Cikalong dan zeolit Lampung pada suhu kamar (30 ˚C), konsentrasi ion awal: 10-40 mg/L, pH 3, bobot adsorben 0.1 g, dan waktu kontak 10 menit.
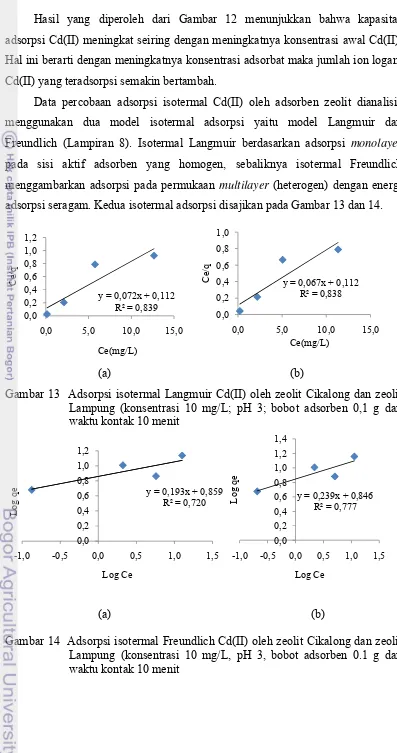
Hasil yang diperoleh dari Gambar 12 menunjukkan bahwa kapasitas adsorpsi Cd(II) meningkat seiring dengan meningkatnya konsentrasi awal Cd(II). Hal ini berarti dengan meningkatnya konsentrasi adsorbat maka jumlah ion logam Cd(II) yang teradsorpsi semakin bertambah.
Data percobaan adsorpsi isotermal Cd(II) oleh adsorben zeolit dianalisis menggunakan dua model isotermal adsorpsi yaitu model Langmuir dan Freundlich (Lampiran 8). Isotermal Langmuir berdasarkan adsorpsi monolayer pada sisi aktif adsorben yang homogen, sebaliknya isotermal Freundlich menggambarkan adsorpsi pada permukaan multilayer (heterogen) dengan energi adsorpsi seragam. Kedua isotermal adsorpsi disajikan pada Gambar 13 dan 14.
(a) (b)
Gambar 13 Adsorpsi isotermal Langmuir Cd(II) oleh zeolit Cikalong dan zeolit Lampung (konsentrasi 10 mg/L; pH 3; bobot adsorben 0,1 g dan waktu kontak 10 menit
(a) (b)
Gambar 14 Adsorpsi isotermal Freundlich Cd(II) oleh zeolit Cikalong dan zeolit Lampung (konsentrasi 10 mg/L, pH 3, bobot adsorben 0.1 g dan waktu kontak 10 menit
Berdasarkan persamaan isotermal Langmuir dan Freundlich maka nilai parameter isotermal qm, Kf, n, dan R2 dapat ditentukan dari kemiringan dan intersep (Gambar 13 dan 14). Hasil perhitungan nilai parameter isotermal disajikan pada Tabel 3.
Tabel 3 Parameter isotermal adsorpsi Langmuir dan Freundlich Cd(II) oleh adsorben zeolit Cikalong dan zeolit Lampung
Zeolit
Langmuir Freundlich
qm : b : R2 : RL Kf : R2 : 1/n
Cikalong Lampung
13.88 : 0.64 : 0.839 : 0.135 14.93 : 0.60 : 0.838 : 0.143
7.23 : 0.720 : 0.193 7.02 : 0.777 : 0.239
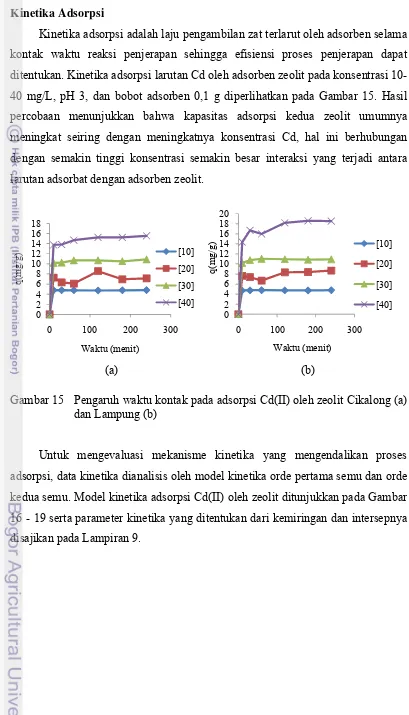
Pada adsorpsi Cd(II) oleh zeolit Cikalong maupun Lampung, nilai korelasi model isotermal Langmuir lebih besar dibandingkan model Freundlich. Hal ini menunjukkan bahwa proses adsorpsi Cd(II) oleh adsorben zeolit didominasi oleh proses adsorpsi monolayer dimana sisi aktif adsorben memiliki energi yang sama dalam mengadsorpsi adsorbat dan bersifat homogen, sejumlah tapak aktif adsorben membentuk ikatan kovalen atau ion, dan terjadi keseimbangan antara molekul yang diadsorpsi pada permukaan adsorben dengan molekul-molekul yang tidak teradsorpsi.
Kinetika Adsorpsi
Kinetika adsorpsi adalah laju pengambilan zat terlarut oleh adsorben selama kontak waktu reaksi penjerapan sehingga efisiensi proses penjerapan dapat ditentukan. Kinetika adsorpsi larutan Cd oleh adsorben zeolit pada konsentrasi 10-40 mg/L, pH 3, dan bobot adsorben 0,1 g diperlihatkan pada Gambar 15. Hasil percobaan menunjukkan bahwa kapasitas adsorpsi kedua zeolit umumnya meningkat seiring dengan meningkatnya konsentrasi Cd, hal ini berhubungan dengan semakin tinggi konsentrasi semakin besar interaksi yang terjadi antara larutan adsorbat dengan adsorben zeolit.
(a) (b)
Gambar 15 Pengaruh waktu kontak pada adsorpsi Cd(II) oleh zeolit Cikalong (a) dan Lampung (b)
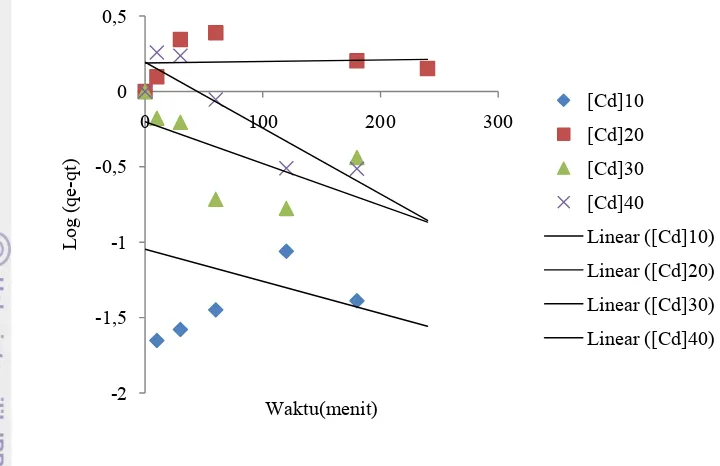
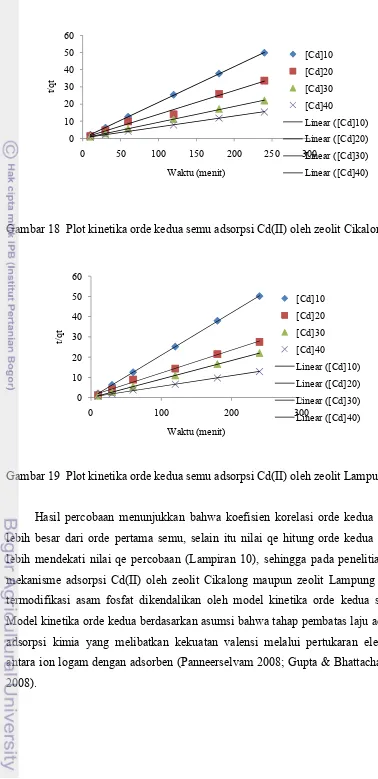
Untuk mengevaluasi mekanisme kinetika yang mengendalikan proses adsorpsi, data kinetika dianalisis oleh model kinetika orde pertama semu dan orde kedua semu. Model kinetika adsorpsi Cd(II) oleh zeolit ditunjukkan pada Gambar 16 - 19 serta parameter kinetika yang ditentukan dari kemiringan dan intersepnya disajikan pada Lampiran 9.
Gambar 16 Plot kinetika orde pertama semu adsorpsi Cd(II) oleh zeolit Cikalong
(b)
Gambar 17 Plot kinetika orde pertama semu adsorpsi Cd(II) oleh zeolit Lampung -2
-1,5 -1 -0,5 0 0,5
0 100 200 300
Log
(qe-qt)
Waktu(menit)
[Cd]10
[Cd]20
[Cd]30
[Cd]40
Linear ([Cd]10)
Linear ([Cd]20)
Linear ([Cd]30)
Linear ([Cd]40)
-2,5 -2 -1,5 -1 -0,5 0 0,5 1
0 50 100 150 200 250 300
Log (qe-qt
)
Waktu (menit)
[Cd]10
[Cd]20
[Cd]30
Gambar 18 Plot kinetika orde kedua semu adsorpsi Cd(II) oleh zeolit Cikalong
Gambar 19 Plot kinetika orde kedua semu adsorpsi Cd(II) oleh zeolit Lampung
Hasil Analisis Termodinamika Adsorpsi
Pengaruh suhu pada kinetika adsorpsi Cd(II) oleh zeolit Cikalong dan zeolit Lampung menggunakan konsentrasi 10 mg/L, pH 3, bobot adsorben 0,1 g pada suhu 30, 40, dan 50 °C ditunjukkan oleh Gambar 20. Hasilnya menunjukkan bahwa kapasitas adsorpsi pada kedua zeolit rata-rata menurun seiring dengan naiknya suhu, hal ini menunjukkan proses adsorpsi berlangsung secara eksotermis.
(a)
(b)
Gambar 20 Pengaruh suhu pada kinetika adsorpsi Cd(II) oleh zeolit Cikalong (a) dan zeolit Lampung (b)
Berdasarkan percobaan, adsorpsi Cd(II) oleh zeolit Cikalong dan zeolit Lampung mengikuti model kinetika orde kedua semu. Hasil interpretasi data kinetika adsorpsi ditunjukkan pada Tabel 4 (Lampiran 11). Kinetika orde kedua ternyata masih menunjukkan proses adsorpsi yang sangat baik, terlihat dari nilai koefisien korelasi (R2) = 1 dan nilai qe hitung hampir sama dengan nilai qe percobaan.
Tabel 4 Kinetika adsorpsi Cd(II) oleh zeolit Cikalong dan zeolit Lampung pada konsentrasi 10 mg/L dengan variasi suhu
Zeolit Suhu qe percobaan k2 qe R2 (⁰C) (mg/g) (g/mgmenit) hitung(mg/g)
Cikalong 30 4.6289 1,2610 4,6296
40 4.6565 2,4331 4,6512 1
50 4.7270 1,0354 4,7393
Lampung 30 4.6372 2,2217 4,6296
40 4.6901 1,4178 4,6948 1
50 4.7426 1,9175 4,7619
Gambar 21 Plot Van’t Hoff adsorpsi Cd(II) oleh zeolit Cikalong dan Lampung
Tabel 5 Termodinamika adsorpsi Cd(II) oleh zeolit Cikalong dan zeolit Lampung Zeolit Suhu Parameter termodinamika
T(⁰C) ΔG˚(Kj/mol) ΔH˚(Kj/mol) ΔS(J/molK)
Cikalong 30 - 5,3954
40 - 4,6240 -20,528 -92,5 50 - 4,8580
Lampung 30 - 4,1064
40 - 3,4099 -21,026 -94,5 50 - 2,4574
Tabel 5 menunjukkan bahwa proses adsorpsi Cd(II) oleh zeolit Cikalong dan zeolit Lampung memberikan nilai ΔG˚ negatif, yang menunjukkan bahwa
y = 1072x - 4,828 R² = 0,869
y = 1098,x - 4,937 R² = 0,977
-1,6 -1,55 -1,5 -1,45 -1,4 -1,35 -1,3 -1,25
0,00305 0,0031 0,00315 0,0032 0,00325 0,0033 0,00335
Log Kc
1/T
Cikalong
Lampung
Linear (Cikalong)
SIMPULAN
DAFTAR PUSTAKA
Atkins PW. 1995. Kimia Fisik, Irma IK, penerjemah, Jakarta: Erlangga, terjemahan dari Physical Chemistry.
Barchan VSH, Kovnatsky EF, Smetannikova. 1998. Studi on removal of cadmium and plumbum from environment. Water Air Soil Pollut 103:173-195.
Fan T et al. 2008. Biosorption of cadmium (II), zinc(II), and lead(II) by penicillium simplicissimum: Isotherm, kinetics and thermodynamics. Journal of Hazardous Materials 160:655-661.
Gupta SS, Bhattachachartta KG. 2009. Immobilization of Pb(II) and Ni(II) ions on kaolinite and montmorillonite surfaces from aqueous medium. Journal Environmental Management 87:46-58.
Hamidpour M, Kalbasi M, Afyuni M, Shariatmadari H, Holm PE, Hansen HCB. 2010. Sorption hysteresis of Cd(II) and Pb(II) on natural zeolite and bentonite. Journal of Hazardous Materials 181:686-691.
Husaini, Soenara T. 2003. Modifikasi zeolit asal Cikalong Jawa Barat dengan heksadesiltrimetilamonium dan uji daya serapnya terhadap ion sulfat dan kromat. Jurnal Zeolit Indonesia 2:15-23.
Iza. 2010. Commision on natural zeolites index of natural zeolit dataset, [terhubung berkala] http://www.iza.online.org/natural/index.htm.2010.
Keputusan Menteri Kesehatan RI Nomor 907/MENKES/SK/VII/2002/Tanggal 29 Juli 2002 Tentang syarat-syarat dan pengawasan kualitas air minum.
Las T. 2005. Potensi zeolit untuk mengolah limbah industri dan radioaktif, [terhubung berkala] http://www.batan.go.id/ptlr/artikel/zeolit.html.18 Maret 2010.
Malekpour A, Hajialigol S, Taheh MA. 2009. Study on solid phase extraction and flame atomis absorption spectrophotometry for the selective determination of cadmium in water and plant sample with modified clinoptilolite. Journal of Hazardous Material 177:229-233.
Mohan D, Pittman Jr CU, Steele PH. 2006. Single, binary and multi-component adsorption of copper and cadmium from aqueous solutions on Kraft lignin-abiosorbent. Journal of Colloid and Interface Science 297:489-504.
Mungitmaturrohmah, Gunawan, Khabibi. 2009, Aplikasi zeolit alam terdealuminasi dan termodifikasi HDTMA sebagai adsorben fenol [laporan], Semarang: Universitas Diponegoro Semarang.
Ozkan-Cakicioglu & Ulku. 2005. The effect of HCl treatment on water vapor adsorption characteristics of clinoptilolite rich natural zeolite. Microporous and Mesoporous Materials 77:45-53.
Page AL, editor. 1982. Methods of soil analysis Part 2 (Chemical and Microbiological Properties Second Edition). Madison-Wiconsin USA.
Panneerselvam P, Thinakaran N, Thiruvenkararavi KV, Palanichamy, Sivanesan S. 2008. Phosphoric acid modified-Y zeolites: A novel, efficient and ion exchanger. Journal of Hazardous Materials 159:427-434.
Panuccio MR, Sorgona A, Rizzo M, Cacco G. 2009. Cadmium adsorption on vermiculite, zeolite and pumice: Bath experimental studies. Journal of Environmental Management 90:364-374.
[P3TM] Pusat Penelitian & Pengembangan Teknologi Mineral. 1994. Cara uji pengukuran luas permukaan spesifik mineral zeolit. Bandung: Pusat Penelitian & Pengembangan Teknologi Mineral.
Sastiono A. 1993. Perilaku mineral zeolit dari pengaruhnya terhadap perkembangan tanah [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Suyartono, Husaini. 1991. Tinjauan terhadap kegiatan penelitian karakterisasi dan pemanfaatan zeolit Indonesia yang dilakukan PPTM Bandung periode 1090-1991. Bandung: Buletin PPTM. JPPSH.
Lampiran 1 Diagram Alir Penelitian
Zeolit Lampung dan Cikalong
Preparasi
Aktivasi
Modifikasi Penentuan KTK,
Karekteristik, XRD, SEM.
Isoterm Adsorpsi
Pada pH 3-11
Bobot adsorben 0,1 g – 0,5 g
Konsentrasi
adsorbat 10-50 mg/l Adsorpsi logam Cd
Isoterm adsorpsi Kinetika
Termodinamika
Waktu Kontak 30-240 menit
Preparasi
Penggilingan lolos ayakan 60 mesh,
pengeringan 300⁰C 3 jam
Aktivasi dengan HCl 4 M,
Pengeringan pada suhu 300⁰C, 3
jam
Modifikasi dengan asam fospat, NaHCO3 jenuh, dipanaskan pada
suhu 300⁰C, 3 jam
Lampiran 2 Komposisi unsur zeolit Cikalong pada perlakuan preparasi dan modifikasi
Zeolit Unsur % massa Rata-rata
Titik 1 Titik 2 Titik 3
Cikalong preparasi
C 20,62 19,62 26,97 22,403
O 49,16 49,21 45,81 48,06
Na 0,53 0,61 0,47 0,54
Mg 0,46 0,52 0,36 0,45
Al 3,67 3,92 3,17 3,59
Si 21,00 21,52 18,74 20,42
K 0,51 0,54 0,51 0,52
Ca 1,06 1,31 1,01 1,13
Fe 1,40 1,28 1,43 1,37
Cu 1,59 1,45 1,53 1,52
Zeolit Unsur % massa Rata-rata
Titik 1 Titik 2 Titik 3
Cikalong modifikasi
C 19,75 16,88 17,88 18,17
O 51,16 51,99 52,57 51,91
Na 1,31 1,36 1,16 1,28
Mg 0,21 0,16 0,34 0,24
Al 3,53 3,02 3,95 3,50
Si 21,47 23,66 21,41 22,18
K 0,36 0,25 0,36 0,32
Ca 0,93 1,05 1,30 1,09
Fe 0,49 0,17 0,22 0,29
Lampiran 3 Komposisi unsur zeolit Lampung pada perlakuan preparasi dan modifikasi
Zeolit Unsur % massa Rata-rata
Titik 1 Titik 2 Titik 3
Lampung preparasi
C 24,91 26,12 24,55 25,19
O 50,02 49,82 50,85 50,23
Na 0,25 0,13 0,27 0,22
Mg 0,19 0,24 0,38 0,27
Al 3,78 4,36 3,87 4,00
Si 18,76 17,82 17,74 18,11
K 0,86 0,65 1,49 1
Ca 0,51 0,40 0,77 0,56
Fe 0,72 0,40 0,10 0,41
Zeolit Unsur % massa Rata-rata
Titik 1 Titik 2 Titik 3
Lampung modifikasi
C 22,36 19,68 21,34 21,13
O 49,82 52,35 49,81 50,66
Na 1,21 1,10 1,06 1,12
Mg 0,16 0,12 0,11 0,13
Al 3,52 3,32 3,12 3,32
Si 21,06 22,05 23,32 22,14
K 0,78 0,61 0,56 0,65
Ca 0,68 0,53 0,42 0,54
Lampiran 4 Kapasitas adsorpsi zeolit Lampung pada variasi konsentrasi (0,5-10 mg/L) dalam volume 0,05 L
Zeolit
[adsorbat] (mg/L)
adsorben (g)
Co (mg/L)
Ce (mg/L)
q (mg/g)
Lampung 0,5 1 5 10
0,1004 0,1005 0,1004 0,1008
0,4232 0,8193 3,6295 6,6529
0,0231 0,0300 0,0855 0,3365
Lampiran 5 Optimasi waktu kontak (konsentrasi adsorbat 10 mg/L, bobot
Volume pH adsorben Co
Lampiran 6 Optimasi waktu kontak (konsentrasi adsorbat 10 mg/L, bobot adsorben)
Zeolit [adsorbat] [kontrol]
wkt
kontak Volume pH adsorben Co Ce Q
(mg/L) (mg/L) (menit) (L) (g) (mg/L) (mg/L) (mg/g)
Lampung 10 9,7546 10 0,05 3 0,2007 8,6482 0,2179 2,1002
0,05 0,2007 8,6482 0,2204 2,0996
0,05 0,2007 8,6482 0,2279 2,0977
R a t a - r a t a 0,2221 2,0992
10 9,7546 20 0,05 3 0,2002 8,6482 0,3290 2,0777
0,05 0,2002 8,6482 0,3309 2,0772
0,05 0,2002 8,6482 0,3334 2,0766
R a t a - r a t a 0,3311 2,0772
10 9,754 30 0,05 3 0,2005 8,6482 0,5153 2,0282
0,05 0,2005 8,6482 0,5176 2,0276
0,05 0,2005 8,6482 0,5182 2,0274
R a t a - r a t a 0,5170 2,0277
10 9,7546 60 0,05 3 0,2005 8,6482 0,3594 2,0670
0,05 0,2005 8,6482 0,3621 2,0664
0,05 0,2005 8,6482 0,3598 2,0669
R a t a - r a t a 0,3604 2,0668
10 9,7546 120 0,05 3 0,2001 8,6482 0,1565 2,1219
0,05 0,2001 8,6482 0,1552 2,1222
0,05 0,2001 8,6482 0,1544 2,1224
R a t a - r a t a 0,1554 2,1221
10 9,7546 180 0,05 3 0,2003 8,6482 0,1008 2,1336
0,05 0,2007 8,6482 0,1029 2,1289
0,05 0,2007 8,6482 0,1025 2,1290
R a t a - r a t a 0,1021 2,1305
10 9,7546 240 0,05 3 0,2006 8,6482 0,2256 2,0994
0,05 0,2006 8,6482 0,2169 2,1015
0,05 0,2006 8,6482 0,215 2,1020
Lampiran 7 Data hasil percobaan isotermal adsorpsi zeolit terhadap Cd(II)
Zeolit Massa [adsorbat] Co Ce q
(g) (mg/L) (mg/L) (mg/L) (mg/g)
Cikalong
0,1003 10 9,7546 0,1365 4,7947
0,1006 10 9,7546 0,1312 4,7830
Rata-rata 9,7546 0,1339 4,7888
0,1003 20 20,4064 5,7148 7,3238
0,1006 20 20,4064 5,784 7,2676
Rata-rata 20,4064 5,7494 7,2957
0,1009 30 22,6874 2,0857 10,2090
0,1006 30 22,6874 2,1334 10,2157
Rata-rata 22,6874 2,1096 10,2123
0,1004 40 40,2112 12,5930 13,7541
0,1000 40 40,2112 12,7229 13,7442
Rata-rata 40,2112 12,6580 13,7491
Zeolit Massa [adsorbat] Co Ce qe
(g) (mg/L) (mg/L) (mg/L) (mg/g)
Lampung
0,1008 10 9,7546 0,2068 4,7360
0,1009 10 9,7546 0,2045 4,7325
Rata-rata 9,7546 0,2057 4,7342
0,1008 20 20,4064 5,0682 7,6082
0,1007 20 20,4064 5,0634 7,6182
Rata-rata 20,4064 5,0658 7,6132
0,1006 30 22,6874 2,1454 10,2097
0,1003 30 22,6874 2,2360 10,1951
Rata-rata 22,6874 2,1907 10,2024
0,1004 40 40,2112 11,3208 14,3876
0,1005 40 40,2112 11,3727 14,3475
Lampiran 8 Data hasil analisis isotermal Langmuir dan perhitungan parameter 5,7494 7,2957 5,7494 0,7881 0,7596 0,8631 2,1096 10,2123 2,1096 0,2066 0,3242 1,0091 12,658 13,7491 12,658 0,9206 1,1024 1,1383
Lampung 0,2057 4,7342 0,2057 0,0434 -0,6868 0,6752 5,0658 7,6132 5,0658 0,6654 0,7046 0,8816 2,1907 10,2024 2,1907 0,2147 0,3406 1,0087 11,3468 14,3676 11,3468 0,7897 1,0549 1,1574
Adsorpsi isotermal menurut persamaan
Langmuir
Adsorpsi isotermal menurut persamaan
Lampiran 9 Persamaan regresi linier laju adsorpsi Cd(II) oleh zeolit Zeolit [Cd]₀
Orde pertama semu [Cd]o Orde kedua semu
(mg/L) (mg/L)
Cikalong 10 Log (qe-qt) = -1,045-0,002t 10 t/qt = 0,066 + 0,208t 20 Log (qe-qt) = 0,189+1E-04t 20 t/qt = 0,656 + 0,114t 30 Log (qe-qt) = 0,199-0,002t 30 t/qt = 0,010 + 0,091t 40 Log (qe-qt) = 0,195-0,004t 40 t/qt = 0,206 + 0,053t
Lampung 10 Log (qe-qt) = -1,867-0,004t 10 t/qt = 0,008 + 0,209t 20 Log (qe-qt) = 0,158-0,003t 20 t/qt = 1,939 + 0,342t 30 Log (qe-qt) = -0,003-0,227t 30 t/qt = 0,048 + 0,274t 40 Log (qe-qt) = 0,466-0,006t 40 t/qt = 0,621 + 0,158t
Perhitungan parameter kinetika
Kinetika orde satu semu
Log(qe-qt)=Logqe - k1/2.303 x t
Slope = -k1/2.303 → k1 = -2.303 x (-0,002) = 0,0046 menit-1 Intersep = Log qe → qe = inv log -1,045 = 0,0902
Kinetika orde dua semu t/qt = 1/k2qe2 + 1/qe x t
Slope = 1/qe → qe = 1/0,208 = 4,8077
Lampiran 10 Perbandingan konstanta laju orde pertama dan orde kedua serta nilai qe hasil perhitungan dan percobaan
Zeolit [Cd] qe Percoba
an (mg/g)
Lampiran 11 Analisis kinetika orde kedua
Zeolit Suhu °C
qe percobaan
(mg/g)
1/T kinetika orde dua
R2 1/K k2(g/mg menit) qe(hitung)mg/g)
Cikalong
30 0,9035 0,0033 8,5124 0,9001 1
40 0,9122 0,0032 5,9104 0,9107 1
50 0,9313 0,0031 6,1030 0,9311 1
Zeolit Suhu °C
qe percobaan
(mg/g)
1/T kinetika orde dua
R2 1/K k2(g/mg menit) qe(hitung)mg/g)
Lampung
30 0,9095 0,0033 5,1034 0,9017 1
40 0,9228 0,0032 3,7069 0,9225 1
Slope =
Intersep =
ΔH 2.303R
ΔS
2.303R
ΔH =
ΔS = -4,937 x 2
= -1098 x 2.303 x 8
2.303 x 8,3149.10-3
8,3149.10-3 = -21
3 = -0,0945
PENDAHULUAN
Latar Belakang
Pencemaran lingkungan salah satunya dapat disebabkan oleh adanya logam berat dalam jumlah diatas ambang batas. Logam berat merupakan salah satu pencemar yang sangat berbahaya bagi manusia dan lingkungan, sehingga perlu adanya perlakuan terhadap limbah sebelum dibuang ke perairan.
Cd (Kadmium) merupakan logam berat dengan potensi bahaya terbesar bagi manusia dan lingkungan, selain Pb(Timbal) dan Hg(Raksa). Berdasarkan persyaratan kesehatan air minum terhadap bahan kimia yang memiliki pengaruh langsung pada kesehatan yang diatur oleh Keputusan Menteri Kesehatan RI tahun 2002, kadar maksimum yang diperbolehkan untuk kadmium adalah 0,003 mg/L.
Di antara beberapa metode yang tersedia untuk pengolahan limbah logam berat, penyerapan oleh pertukaran ion merupakan aplikasi yang relatif sederhana, murah dan aman, karena hanya membutuhkan kondisi operasi ringan, pertukaran ion antara fase cair dan padat berpori, baik sintetis maupun alami (Panneerselvam et al. 2008). Menurut Malekpour et al. (2009) zeolit alam digunakan secara intensif karena kemampuannya dalam memisahkan spesi target melalui prinsip penukar ion. Penggunaan zeolit alam sebagai adsorben dikarenakan metodenya yang sederhana, bahan baku yang banyak terdapat di alam, kemampuan adsorpsinya yang cukup baik sehingga dapat mengontrol polusi dan pencemaran logam berat.
Di Indonesia, zeolit alam ditemukan melimpah dan tersebar di beberapa daerah di pulau Jawa dan Sumatera. Dalam dasawarsa ini zeolit oleh para peneliti dijadikan sebagai mineral serbaguna. Sifat-sifat unik tersebut meliputi dehidrasi, adsorben dan penyaring molekul, katalisator, dan penukar ion.
dilakukan sehingga dapat memberikan hasil yang nyata secara ekonomi (Pusat Penelitian & Pengembangan Teknologi Mineral 1994).
Adsorben yang digunakan dalam proses adsorpsi harus memenuhi kriteria yang dibutuhkan, di antaranya mempunyai daya serap yang besar terhadap larutan, zat padat yang mempunyai luas permukaan yang besar, tidak larut dalam zat cair yang akan diadsorpsi, tidak beracun dan mudah didapat serta, memiliki harga yang relatif murah. Karbon aktif, mineral lempung, zeolit, biomaterial, dan beberapa limbah padat industri telah banyak digunakan sebagai adsorben untuk adsorpsi ion dan nonionik dalam pengolahan air limbah (Wang & Peng 2010).
Aktivasi merupakan proses untuk menaikkan kapasitas adsorpsi sehingga diperoleh sifat yang diinginkan sesuai dengan penggunaannya. Aktivasi secara kimia dapat dilakukan dengan penambahan larutan asam ataupun basa. Pada umumnya asam yang digunakan adalah asam sulfat dan asam klorida, sedangkan basa yang digunakan adalah NaOH. Berbagai penelitian terhadap zeolit banyak dilakukan dalam modifikasinya yaitu dengan mengubah atau mempertukarkan ion yang dapat dipertukarkan, mengubah rasio perbandingan Si/Al, dealuminasi (penghilangan Al) melalui perlakuan asam mineral, dan sebagainya dengan tujuan meningkatkan mutu zeolit.
Panuccio et al. (2009) melakukan percobaan untuk aktivitas ion, pH, dan waktu kontak pada serapan kadmium dalam tiga mineral berbeda antara lain vermiculite, zeolit, dan batu apung. Dari parameter Langmuir dan Freundlich yang diperoleh, disimpulkan bahwa tingkat penyerapan kadmium mengikuti deret vermiculit>zeolit>batu apung. Hamidpour et al. (2010) membandingkan penyerapan Pb (II) dan Cd (II) oleh zeolit, dan menemukan bahwa zeolit lebih efektif dibandingkan bentonit sehingga dapat digunakan sebagai penyerap air dan pengolahan limbah.