LAMPIRAN 1
DATA PENELITIAN
1.1 BILANGAN IODIN ADSORBEN BIJI ASAM JAWA
Dari modifikasi adsorben biji asam jawa yang dilakukan dengan memvariasikan rasio adsorben : asam nitrat (b/v) sebesar 1:1, 1:2, dan 1:3, serta suhu pemanasan di dalam oven sebesar 110, 120, 130, dan 140 oC, diperoleh bilangan iodin masing-masing adsorben seperti pada Tabel L1.1 di bawah ini. Bilangan iodin adsorben biji asam jawa sebelum dimodifikasi adalah 379,812 mg/g.
Tabel L1.1. Bilangan Iodin Adsorben Biji Asam Jawa untuk Setiap Variasi (mg/g) Suhu (oC) Rasio Adsorben : Asam Nitrat (b:v)
1:1 1:2 1:3 1:4
110 372,364 405,217 408,870 404,055
120 387,563 448,565 448,565 444,595
130 417,920 511,773 475,029 471,622
140 456,028 506,839 504,220 501,493
1.2 KARAKTERISASI GUGUS FUNGSI PADA ADSORBEN BIJI ASAM JAWA DENGAN SPEKTROFOTOMETRI IR
Adsorben yang terbentuk dan memiliki bilangan iodin paling besar selanjutnya dikarakterisasi gugus-gugus fungsinya dengan spektofotometri FTIR. Begitu pula dengan adsorben yang telah terpakai (spent adsorbent) untuk mengadsorpsi CPO. Adapun hasil yang diperoleh diberikan pada Gambar L1.1 - L1.3 berikut.
Gambar L1.1 Hasil Spektrofotometri FTIR untuk Adsorben Biji Asam Jawa Sebelum Diaktivasi
Gambar L1.2 Hasil Spektrofotometri FTIR untuk Adsorben Biji Asam Jawa Setelah Diaktivasi
763,81 cm-1 : gugus C-H (alkena aromatik) 2360,87 cm-1 : gugus C=O 1060,85 cm-1 : gugus C-O (asam karboksilat) (karbondioksida) 1246,02 cm-1 : gugus C-N (amina) 3290,56 cm-1 : gugus O-H (alkohol
1431,90 cm-1 : gugus C-H (alkana) 1519,91 cm-1 : gugus NO2 (senyawa nitro)
Gambar L1.3 Hasil Spektrofotometri FTIR untuk Adsorben Biji Asam Jawa yang Telah Terpakai untuk Adsorpsi
1.3 KADAR ASAM LEMAK BEBAS PADA MINYAK KELAPA SAWIT Kadar asam lemak bebas sebelum dilakukan proses adsorpsi dengan adsorben adalah sebesar 4,936 %, sedangkan kadar asam lemak bebas setelah dilakukan proses adsorpsi diberikan pada Tabel L1.2 berikut.
Tabel L1.2. Hasil Kadar Asam Lemak Bebas pada Minyak Kelapa Sawit (%)
Dosis Adsorben (%) FFA (%)
t = 25 menit t = 35 menit t = 45 menit
0,5 4,65 4,2 4,34
1,0 4,493 3,928 4,063
1,5 4,618 4,047 4,089
1.4 BILANGAN PEROKSIDA PADA MINYAK KELAPA SAWIT
Kandungan bilangan peroksida sebelum dilakukan proses adsorpsi dengan adsorben adalah sebesar 0,0144 meq/kg minyak, sedangkan bilangan peroksida setelah dilakukan proses adsorpsi diberikan pada Tabel L1.3 berikut.
Tabel L1.3. Hasil Adsorpsi Bilangan Peroksida pada Minyak Kelapa Sawit (meq/kg minyak)
Dosis Adsorben (%) Bilangan Peroksida (meq/kg) t = 25 menit t = 35 menit t = 45 menit
0,5 0,02315 0,0864 0,3415
1,0 0,02307 0,00868 0,4613
LAMPIRAN 2
CONTOH PERHITUNGAN
2.1 PERHITUNGAN BILANGAN IODIN ADSORBEN
Bilangan Iodin mg g =
10-VxN1
N2
W2
x W1xFp (3.1) Dimana,
V = volume natrium tiosulfat yang diperlukan (ml) N1 = normalitas natrium tiosulfat (N)
N2 = normalitas iodin (0,1 N)
W1 = jumlah iodin untuk setiap 1 ml larutan natrium tiosulfat 0,1 N (12,69 mg/ml)
W2 = massa sampel (g) Fp = faktor pengenceran (5)
Misalnya untuk adsorben hasil modifikasi pada suhu 130 oC dan rasio adsorben : asam nitrat (b/v) sebesar 1:2, diketahui :
V = 6,0 ml N1 = 0,1001 N W2 = 0,52 g Maka :
Bilangan Iodin mg
g =
10-6x 0,1001 0,1
0,52 x 12,69 x 5 = 511,773 mg/g
2.2 PERHITUNGAN KADAR ASAM LEMAK BEBAS
% Asam Lemak Bebas = N x V x M
gr sampel
(L2.2)
Ket : N = normalitas larutan NaOH (mol/l) V = volume larutan NaOH terpakai (ml)
Misalnya perhitungan untuk kadar asam lemak bebas minyak kelapa sawit yang diadsorpsi pada waktu 35 menit dengan dosis adsorben 1 % diketahui:
N = 0,1 N V = 7,8 ml
M = 25,6 gram/mol (asam palmitat) Berat sampel = 5,09 gram
Maka,
% Asam Lemak Bebas = 0,1 x 7,8 x 25,6
5,09 (3.3)
LAMPIRAN 3
FOTO HASIL PENELITIAN
3.1 FOTO PERCOBAAN PEMBUATAN ADSORBEN BIJI ASAM JAWA
Gambar 3.1 Sampel Biji Asam Jawa
Gambar 3.3 Sampel Diayak dengan Ayakan 140 mesh
Gambar 3.5 Sampel Biji Asam Jawa Diaktivasi dengan Asam Nitrat (HNO3) 4 N sambil Dipanaskan
Gambar 3.7 Tempat Pengeringan Adsorben yang Telah Dicuci dan Disaring
Gambar 3.8 Adsorben Hasil Pengeringan di Dalam Oven
Gambar 3.9 Adsorben Dikeringkan di Dalam Oven
Gambar 3.10 Adsorben Dicampur dengan Larutan Iodin dan Dikocok
Gambar 3.12 Hasil Titrasi Filtrat dengan Natrium Tiosulfat (Na2S2O3) 0,1 N
3.3 FOTO PERCOBAAN ADSORPSI KADAR ASAM LEMAK BEBAS DAN BILANGAN PEROKSIDA PADA MINYAK KELAPA SAWIT
Gambar 3.14 Rangkaian Alat Percobaan Utama
Gambar 3.16 Adsorben Sisa Reaksi atau Spent Adsorbent
Gambar 3.18 Rangakaian Peralatan Analisa Kadar Asam Lemak Bebas
Gambar 3.20 Adsorben dengan Bilangan Iodin Tertinggi (kiri) Adsorben dengan Hasil Adsorpsi Terbaik (kanan)
DAFTAR PUSTAKA
[1] Departemen Perindustrian, Roadmap Industri Pengolahan CPO, Direktorat Jenderal Industri Agro Dan Kimia Departemen Perindustrian, 2009.
[2] J. Erna, Produksi CPO AALI 2013 Tumbuh 4,2%, Diakses 15 Januari 2014, dari SindoNews.
http://ekbis.sindonews.com/read/826700/32/produksi-cpo-aali-2013-tumbuh-4-2
[3] C.W. Puah, Y. M. Choo, A. N. Ma, C. Chuah, “Deguming and Bleaching: Effect on Selected Constituents of Palm Oil”, Journal of Oil Palm Research, Vol., 16, No.2, 2004 : hal. 57 – 63.
[4] S. H. Goh, Y. M. Choo, S. H. Ong, “Mineral Constituents of Palm Oils”, J. Am. Oil Chem. Soc., Vol. 62, 1985 : hal. 237 – 240.
[5] Noor Azian Morad, Mustafa Kamal Abd Aziz, Rohani binti Mohd Zin, “Process Design in Degumming and Bleaching of Palm Oil”, Research, Centre of Lipids Engineering and Applied Research (CLEAR), Universiti Teknologi Malaysia, Vote No. 74198, 2006.
[6] F. M. Ogwu, M. Odo, O. Osborne, “The Quality of Locally Processed Palm Oil from Ebonyi and Enugu States”, Proceedings of the 26th Annual NIFST Conference, 4th-8th (November 2012), hal. 47 – 48.
[7] S. Lin, C. C. Akoh, A. E. Reynolds, “The Recovery of Used Frying Oil with Various Adsorbent”, Journal Food Lipids, Vol. 5, 1998 : hal. 1 – 16.
[9] Wei Puah Chiew, Choo Yuen May, Ma Ah Ngan, Chuah Cheng Hock, “Degumming and Bleaching: Effect on Selected Constituents of Palm Oil”, Journal of Oil Palm Research, 16(2) 2004 : hal. 57 – 63.
[10] Fereidoon Shahidi, Bailey’s Industrial Oil and Fat Products, Sixth Edition, Volome 2 Edible Oil and Fat Products : Edible Oils, (New Jersey : John Wiley & Sons, Inc., 2005), hal. 372.
[11] Deny Sumarna, “Kajian Proses Degumming CPO (Crude Palm Oil) dengan Menggunakan Membran Ultrafiltrasi”, Sekolah Pasca Sarjana, Institut Pertanian Bogor, Bogor, 2006.
[12] O. Idoko, Bwai M. D, Emmanuel S. A, Thomas S. A, “Effect of Bleaching and Degumming on The Physicochemical Properties and Antioxidant Activity of Palm Oil”, Research Journal in Engineering and Applied Sciences, 2(5) 2013 : hal. 343 – 345.
[13] D. Cowan, H. C. Holm, H. S. Yee, “Reduction in Free Fatty Acid in Crude Palm Oil by Enzymatic Remediation”, Journal of Oil Palm Research, Vol. 24, 2012.
[14] Ramdani Ritonga, “Penentuan Bilangan Peroksida pada Minyak Inti Kelapa Sawit (CPKO) di PT. Ecogreen Oleochemicals”, Karya Ilmiah, Universitas Sumatera Utara, 2010.
[15] Audy D. Wuntu, Vanda S. Kamu., “Adsorpsi Aseton pada Arang Aktif Biji Asam Jawa”, Jurnal Ilmiah Sains, 11(2) 2012 : hal. 174 – 177.
[17] Bernard Enrico, ”Pemanfaatan Biji Asam Jawa (Tamarindus indica) sebagai Koagulan Alternatif dalam Proses Penjernihan Limbah Cair Industri Tahu”, Tesis, Sekolah Pascasarjana Universitas Sumatera Utara, Medan, 2008.
[18] Enggar Pawening, ”Pemanfaatan Arang Aktif dari Biji Buah Asam Jawa (Tamarindus indica) sebagai Adsorben Logam Berat Kromium (III)”, Program Studi Kimia Fakultas Sains dan Teknologi Universitas Airlangga, Surabaya, 2009
[19] Kumar, P. Senthil, R. Sivaranjanee, U. Vinothini, M. Raghavi, K. Rajasekar, K. Ramakrishnan, “Adsorption of Dye onto Raw and Surface Modified Tamarind Seeds: Isotherms, Process Design, Kinetics, and Mechanism”, Balaban Desalination Publications, 1944-3994/1944-3986, 2013.
[20] Suresh Gupta, B. V. Babu, “Adsorption of Chromium (VI) by a Low-Cost Adsorbent Prepared from Tamarind Seeds”, (Rajasthan: Chemical Engineering Group, Birla Institute of Technology and Science, 2007).
[21] K. Munusamy, Rajesh S. Somani, Hari C. Bajaj, “Tamarind Seeds Carbon : Preparation and Methane Uptake”, Bioresources Peer Reviewed Article. 6(1) 2011 : hal. 537 – 551.
[22] S. Shanti, T. Mahalakshmi, “Studies on the Removal of Malachite Green and Methylene Blue Dyes from Aqueous Solutions of Their Binary Mixyure by Adsorption Over Commercial Activated Carbon and Tamarind Kernel Powder”, International Journal of Research in Pharmacy and Chemistry, ISSN: 2231-2781,
2(2) 2012 : hal. 289 – 298.
[24] R. Rajeshkannan, M. Rajasimman, N. Rajamohan, “Decolourization of Malachite Green Using Tamarind Seed: Optimazation, Isotherm, and Kinetic Studies”, Chemical Industry & Chemical Engineering Quarterly, 17(1) 2011 : hal. 67 – 79.
[25] R. Gayathri, M. Thirumarimurugan, T. Kannadasan, “Removal of Chromium (VI) ions from Aqueous Solutionusing Tamarind Seeds as an Adsorbent”, International Journal of Pharmaceutical and Chemical Sciences, 2(2) 2013.
[26] Abdullah, Yudhistira Abdi Atmanegara, Radna Nurmasari, “Optimasi Pemucatan CPO Menggunakan Arang Aktif dan Bentonit”, Jurnal Ilmu Dasar, 11(2) 2010 : hal. 124 – 128.
[27] Siti Aisyah, Eny Yulianti, Ghanaim Fasya, “Penurunan Angka Peroksida dan Asam Lemak Bebas (FFA) pada Proses Bleaching Minyak Goreng Bekas oleh Karbon Aktif Polong Buah Kelor (Moringa Oliefera. Lamk) dengan Aktivasi NaCl”, ALCHEMY, 1(2) 2010 : hal. 93 – 103.
[28] R. Wannahari, M. F. N. Nordin, “Reduction of Peroxide Value in Used Palm Cooking Oil Using Bagasse Adsorbent”, American International Journal of Contemporary Research, 2(1) 2012 : hal. 185 – 191.
[29] Widayat, Suherman, dan K. Haryani., “Optimasi Proses Adsorbsi Minyak Goreng Bekas dengan Adsorbent Zeolit Alam: Studi Pengurangan Bilangan Asam”, Jurnal Penelitian Teknik Kimia, 17(1) 2006.
[30] Ailen Tanjaya, Sudono, Nani Indraswati, Suryadi Ismadji, “Pembuatan Bleaching Earth dari Bentonit Pacitan dengan Aktivasi Asam : Karakterisasi dan
[31] J. C. Igwe, A. A. Abia, “A Bioseparation Process for Removing Heavy Metals from Waste Water Using Biosorbents”, African Journal of Biotechnology, 5(12) 2006 : hal. 1167-1179.
[32] M. A. Ashraf, M. J. Maah, I. Yusoff, “Study of Banana Peel (Musa sapientum) as a Cationic Biosorben”, American-Eurasian J. Agric & Environ. Sci, 8(1) 2010 : hal. 7 – 17.
[33] T. Tsuda, Watanabe, K. Oshima, A. Yamamoto, S. Kawakishi, T. Osawa, “Antioxidative Componen Isolated from The Seed of Tamarind (Tamarindus indica L.)”, Agricultural Food Chemical, 1994.
[34] K. El-Siddig, H.P.M. Gunasena, B.A. Prasad, D.K.N.G. Pushpakumara, K.V.R. Ramana, K.V.R. Ramana, P.Vijayanand, J. T. Williams., Tamarid Tamarindicus indica L., (Southampton: Southampton Centre for Underutilised
Crops, 2006).
[35] H. D. Gunasena, A. Hughes, Tamarind : Tamarindus indica, (Southampton: International Centre for Underutilised Crops, 2000).
[36] M. M. Morad, S. B. El Magoli, K. A. Sedky, “Physico-Chemical Properties of Egyptian Tamarind Seed Oil”, Fette Seifen Anstrichmittel, Vol. 80, 1978 : hal. 357 – 359.
[37] M. M. Ishola, E. B. Agbaji, A. S. Agbaji, “A Chemical Study of Tamarindus indica (Tsamiya) Fruits Grown in Nigeria”, Journal of Science, Food and Agriculture, Vol. 51, 1990 : hal. 141 – 143.
[39] Nilanjana Rao (2005), “Use of Plant Material as Natural Coagulants for Treatment of Watewater”, Diakses 1 Maret 2014 dari Visionriviewpoint
http://www.visionriviewpoint.com/article.asp?articleid=48
[40] E. S. Imbabi, K. E. Ibrahim, I. M. Abulfutah, P. Hulbert, “Chemical Characterization of Tamarind Bitter Principle”, Fitoterapia, 63(6) 1992 : hal. 537 – 538.
[41] A. Mishra, M. Bajpai, “Flocculation Behaviour of Model Textile Wastewater Treated with Food Grade Polysaccharide”, Journal Hazard, Mat, B118, 2005 : hal. 213 – 217.
[42] T. Khrisna Murthy, Minor Forest Products of India (New Delhi: Oxford and IBH, 1993), hal. 234 – 335.
[43] G. Vazquez, G. Antorrena, J Gonzalez, M. D. Doval. “Bioresource Technol”, 1994 : hal. 251 – 255.
[44] Puspita, Yohanna Vinia Dewi, Mohammad Shodiq Ibnu, Surjani Wonorahardjo, “Karakterisasi dan Uji Kemampuan Serbuk Ampas Kelapa Asetat sebagai Adsorben Belerang Dioksida (SO2)”, Jurusan Kimia, FMIPA, Universitas Negeri Malang, Malang, 2013.
[45] M. Bockish, Fats and Oils Handbook, (USA: AOCS Press, 1998)
[46] Frank D. Gunstone, The Chemistry of Oils and Fats, (UK: Blackwel Publishing Ltd., 2004).
[48] Abdul A. Azis, “The Effect of CPO Quality Parameters (FFA, M&I, IV, PV, AV , DOBI and Colour) on the Refinery Production Efficiency”, Proceedings of the 2000 National Seminar on Palm Oil Milling, Refining Technology, Quality
and Environment, 2000 : hal. 79 – 88.
[49] S. Ketaren, Minyak dan Lemak Pangan, (Jakarta: Universitas Indonesia Press, 2005).
[50] B. Jacobsberg, “Palm Oil Characteristics and Quality”, Proceedings of First MARDI Workshop on Oil Palm Technology, Kuala Lumpur, 1974.
[51] M. W. Formo, E. Jungermann, F. A. Norris, N. O. Sonntag, Bailey’s Industrial Oil and Fat Products, (New York: John Wiley & Sons Inc., 1979).
[52] R. Sambanthamurthi, K. Sundram, Y. A. Tan, “Chemistry and Biochemistry of Palm Oil”, Progress in Lipid Research, Vol. 39, 2000 : hal. 507 – 558.
[53] W. L. Leong, “The Refining and Fractionation of Palm Oil”, Palm Oil Mill Engineers-Executives Training Course 14th Semester 1, PORIM, 1992.
[54] G. Borner, J. Hollien, M. Schneider, “Practical Experiences with Countercurrent Bleaching Process”, Proceedings of the 1999 PORIM International Palm Oil Congress (Chemistry and Technology), 1999 : hal. 52 –
59.
[55] M. S. A. Yusoff, T. Thiagarajan, “Refining and Downstreaming Processing of Palm and Palm Kernel Oil”, Selected Readings on Palm Oil and Its Uses, 1993 : hal. 150 – 174.
[57] Badan Standardisasi Nasional, “Minyak Kelapa Sawit Mentah (Crude Palm Oil)”, SNI 01-2901-2006, 2006.
[58] Badan Standardisasi Nasional, “Minyak Goreng Sawit”, SNI 7709:2012, 2012.
[59] K. L. Er, “Quality Control Laboratories in Refineries”, Proceedings of Workshop on Quality in the Palm Oil Industry, (Agustus, 1985) hal. 203 – 208.
[60] Djoehana, Budidaya Kelapa Sawit, (Ungaran: Kanisius, Ungaran, 1992).
[61] A. J. Dijkstra, M. V. Opstal, “Process for Producing Degummed Vegetable Oils and Gums of High Phospholipidic Acid Content, U.S. Patent 4.698.185, 1987.
[62] T. Thiagarajan, T. S. Tang, “Refinery Practices and Oil Quality”, PORIM International Palm Oil Conference (Chemistry and Technology), Vol 1, 1991 :
hal. 254 – 266.
[63] Dece Elisabeth Sahertian, Haryono Semangun, “Pemucatan Warna (Bleaching) pada Minyak Sawit Mentah”, Mikoriza: Bios-Majalah Ilmiah Semipopuler, 5(2) 2011 : hal. 41 – 43.
[64] Emma Zaidar Nasution, “Manfaat dari Beberapa Jenis Bleaching Earth Terhadap Warna CPO (Crude Palm Oil)”, Jurnal Sains Kimia, 7(2) 2003 : hal. 31 – 35.
[66] David W. Martin, Biokimia, (Jakarta: EGC Penerbit Buku Kedokteran, 1992).
[67] H. W. Lawson, Standard For Fat and Oil, Volume 5, (United State America: Avi Publishing Company, Inc. Connenticut, 1985).
[68] Lahuddin Rangkuti, “Analisa Kadar Asam Lemak Bebas (ALB), Kadar Air, dan Kadar Kotoran pada Minyak Kelapa Sawit (CPO) Hasil Olahan PT. Mopoli Raya Aceh Tamiang”, Karya Ilmiah, Universitas Sumatera Utara, Medan, 2007.
[69] J. Weiss Theodore, Food Oils and Their Uses, Second Edition, (United State America: The AVI Publishing Company, 1983).
[70] S. Ketaren, Pengantar Teknologi Minyak dan Lemak Pangan, Edisi I, (Jakarta: UI-Press, 1986).
[71] S. Sudarmadji, Analisa Bahan Makanan dan Pertanian, (Yogyakarta: Liberty Yogyakarta Bekerja Sama dengan Pusat Antara Universitas Pangan dan Gizi Universitas Gadjah Mada, 1989).
[72] H. Egan, Ronald S. Kirk, R. Sawyer, Pearson’s Chemical Analysis of Foods, Eighth Edition, (New York: Churchill Livingstone, 1981).
[73] M. Suguna, N. Siva Kumar, M. Venkata Subbaiah, A. Krishnaiah, “Removal of Diavalent Manganese from Aqueous Solution Using Tamarindus indica Fruit Nut Shell”, J. Chem. Pharm. Res., 2(1) 2010 : hal. 7 – 20.
[74] Yustinah, Hartini “Adsorbsi Minyak Goreng Bekas Menggunakan Arang Aktif dari Sabut Kelapa”, Prosiding Seminar Nasional Teknik Kimia “Kejuangan” Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam
[75] Julius Fernando Pakpahan, Tomas Tambunan, Agnes Harimby, M. Yusuf Ritonga., “Pengurangan FFA dan Warna dari Minyak Jelantah dengan Adsorben Serabut Kelapa dan Jerami”, Jurnal Teknik Kimia USU, 2(1) 2013 : hal. 31 – 36.
[76] AOCS, Official Methods and Recommended Practices of the AOCS, 4th Edition, (USA: American Oil Chemists Society, Champaign, 1993).
[77] ASTM D 4607-94, Standard Test Method for Determination of Iodine Number of Activated Carbon, (Philadelphia: Annual Book of ASTM Standard,
1999), hal. 15.
[78] Sandra Hermanto, Anna Muawanah, dan Rizkina Harahap, “Profil dan Karakteristik Lemak Hewani (Ayam, Sapi dan Babi) Hasil Analisa FTIR dan GCMS”, Program Studi Kimia, Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah, Jakarta, 2013
[79] Mohammad Abedi, Zaker Bahreini, “Preparation of Carbonaceous Adsorbent from plant of Calotropis Gigantea by Thermo-Chemical Activation Process and its Adsorption Behavior for Removal of Methylene Blue”, World Applied Sciences Journal, 11(3) 2010 : hal. 263 – 268.
[80] H. Xin, J. Liu, F. Fan, Z. Feng, G. Jia, Q. Yang, C. Li. “Mesoporous Ferrosilicates with High Content of Isolated Iron Species Synthesized in Mild Buffer Solution and Their Catalytic Application. Microporous and Mesoporous Materials, Vol. 113 2008 : hal. 231 – 239.
[81] W. M. Johnson, J. A. Maxwell, Rock and Mineral Analysis. Edisi Kedua, (New York: John Wiley & Sons Inc., 1981).
[83] L. G. Hargis, Analytical Chemistry, (New Jersey: Printice Hall, 1988).
[84] D. A. Skoog, F. J. Holler, T. A. Nieman, Principles of Instrumental Analysis, Edisi ke 5, (Orlando: Hourcourt Brace, 1998).
[85] Harry Budiman, Fransiska Sri H.K, Achmad H Setiawan, “Preparation of Silica Modified 2-Mercaptoimidazole and its Sorption Properties of Chromium (III)”, E-Journal of Chemistry, 6(1) 2009 : hal. 141 – 150.
[86] Ralph T. Yang, Adsorbents: Fundamentals and Applications, (New Jersey: John Wiley & Sons Inc, 2003), hal. 92.
BAB III
METODOLOGI PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Penelitian dilakukan di Laboratorium Penelitian dan Laboratorium Proses Industri Kimia, Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara. Penelitian ini dilaksanakan selama lebih kurang 4 bulan.
3.2 BAHAN DAN PERALATAN 3.2.1 Bahan
Pada penelitian ini bahan-bahan yang digunakan antara lain: 1. Minyak kelapa sawit (CPO)
2. Biji Asam Jawa
3. Asam Nitrat (HNO3) 4 N dan 6 N 4. Aquadest
5. Indikator Fenolftalein 6. Asam Asetat (CH3COOH) 7. Kloroform (CHCl3)
8. Iodin (I2)
9. Larutan Iodium 0,1 N
10. Natrium Tiosulfat (Na2S2O3) 0,01 N 11. Natrium Hidroksida (NaOH) 0,1 N 12. Kalium Iodida (KI)
13. Kalium Hidrogen Ftalat 14. Isopropanol (C3H8O)
3.2.2 Peralatan
Pada penelitian ini peralatan yang digunakan anatara lain: 1. Vacuum erlenmeyer
2. Pompa vakum
4. Spektrofotometer FTIR 5. Termometer
6. Hot plate dan magnetic stirrer 7. Kertas Whatman No.1
8. Beaker glass 9. Tabung reaksi 10. Erlenmeyer 11. Corong gelas 12. Gabus 13. Oven 14. Desikator 15. Gelas ukur
16. Satu set alat titrasi 17. Ayakan 140 mesh 18. Ball mill
19. Lumpang dan alu 20. Stopwatch
21. Timbangan digital 22. Batang pengaduk 23. Penjepit tabung 24. Cawan porselen
3.3 PROSEDUR PERCOBAAN
3.3.1 Pembuatan Adsorben Biji Asam Jawa
1. Biji asam jawa dicuci dengan air lalu dikeringkan di bawah sinar matahari. 2. Biji asam jawa dihaluskan hingga berbentuk serbuk berukuran 140 mesh. 3. Adsorben diaktifkan dengan larutan asam nitrat (HNO3) 4 N rasio 1:1 dan
dipanaskan selama dua jam pada suhu 80 oC, lalu didinginkan.
4. Setelah dingin, dilanjutkan dengan pencucian beberapa kali menggunakan air untuk menghilangkan pengotor terlarut.
6. Prosedur diulangi untuk rasio adsorben : asam nitrat 1:2, 1:3, dan 1:4 serta suhu oven 120, 130, dan 140 oC.
[22]
3.3.2 Proses Degumming dan Bleaching
1. Timbang 100 gram sampel CPO dan masukkan ke dalam beaker glass. 2. CPO dipanaskan di atas hot plate hingga suhu 90 oC sambil diaduk dengan
menggunakan magnetic stirrer hingga homogen.
3. Tambahkan adsorben asam jawa dengan dosis 0,5% (b/b) dari CPO yang digunakan dan pertahankan temperatur hingga suhu 100 – 110 oC selama 25 menit.
4. Saring dengan segera minyak tersebut dengan corong buchner dan kertas saring Whatman No.1 dalam kondisi vakum.
5. Amati residu yang terdapat pada kertas saring.
6. Amati warna bleach oil yang diperoleh dan bandingkan dengan warna pada CPO yang digunakan.
7. Ulangi percobaan untuk variasi waktu reaksi 35 menit dan 45 menit, variasi dosis penambahan asam jawa 1% dan 1,5% (b/b) dari CPO yang digunakan. [76]
3.4 PROSEDUR ANALISA
3.4.1 Analisa Bilangan Iodin pada Adsorben
1. Timbang 1 gram adsorben dan keringkan pada suhu 110 oC selama 3 jam. 2. Lakukan pendinginan dalam desikator.
3. Selanjutnya tambahkan 50 ml larutan iod 0,1 N dan diaduk dengan magnetic stirer selama 15 menit.
4. Saring dan diambil sebanyak 10 ml filtrat. Titrasi dengan larutan Na2S2O3 0,1 N sampai warna kuning berkurang.
5. Selanjutnya tambahkan beberapa tetes indikator amilum 1% dan dititrasi kembali sampai larutan tidak berwarna
Bilangan Iodin mg g =
10-VxN1
N2
W2
x W1xFp (3.1) Dimana,
V = volume natrium tiosulfat yang diperlukan (ml) N1 = normalitas natrium tiosulfat (N)
N2 = normalitas iodin (0,1 N)
W1 = jumlah iodin untuk setiap 1 ml larutan natrium tiosulfat 0,1 N (12,69 mg/ml)
W2 = massa sampel (g) Fp = faktor pengenceran (5) [77]
3.4.2 Analisa Karakteristik Gugus Fungsi dengan Spektrofotometri FTIR 1. Siapkan sampel yang akan diuji dan 200 mg KBr.
2. Ambil ±1 mg sampel haluskan bersama KBr dengan mortar hingga halus. 3. Buat pellet dari campuran bahan tersebut menggunakan alat tekan dan di pre
vakum selama 2 – 3 menit.
4. Tekan pellet dengan pompa hidrolik dan atur tekanannya menjadi 80 KN selama 5 menit.
5. Hentikan proses vakum dan pengepresan, lalu ambil sampel pellet dengan cara mendorongnya dengan pompa hidrolik.
6. Letakkan pellet yang sudah jadi pada sampel holder dan tempatkan pada lintasan sinar alat FTIR.
7. Lakukan pengukuran dengan alat FTIR dan amati grafik yang terbentuk. 8. Simpan data yang dihasilkan dan lakukan pembahasan terhadap
puncak-puncak yang terbentuk [78]
3.4.3 Analisa Kadar Asam Lemak Bebas (%FFA) pada Minyak 3.4.3.1 Bahan Kimia
1. Larutan titar terdiri dari:
Larutkan 40 gram natrium hidroksida dalam 1 liter aquadest. Standardisasi.
b. Larutan kalium hidroksida (KOH) 0,1 N
Larutkan 56 gram natrium hidroksida dalam 1 liter aquadest. Standardisasi.
c. Larutan natrium hidroksida (NaOH) 0,25 N
Larutkan 100 gram natrium hidroksida dalam 1 liter aquadest. Standardisasi.
Standarisasi larutan titar NaOH 0,1 N / NaOH 0,25 N / KOH 0,1 N dilakukan dengan menggunakan Kalium Hidrogen Ftalat sebagai berikut: a. Keringkan Kalium Hidrogen Ftalat dalam oven pada suhu sekitar 120 oC
selama 2 jam, kemudian masukkan dalam desikator, diamkan sampai dingin.
b. Timbang 0,4 gram ± 0,02 gram untuk 0,1 N NaOH dan 0,1 N KOH atau 1,0 gram untuk 0,25 N NaOH ke dalam erlenmeyer 250 ml, tambah 50 ml aquadest dan beberapa tetes larutan indikator fenolftalein.
c. Panaskan di atas penangas air sambil digoyang-goyang hingga larut semua. Titrasi dengan larutan titar hingga timbul warna merah muda (merah jambu) yang stabil.
d. Perhitungan:
Normalitas larutan NaOH/KOH = W x 1000 V x 204,2 (3.2) Dimana :
W = berat kalium hidrogen ftalat (gram)
V = berat volume larutan titar yang digunakan (ml) 204,2 = berat equivalen kalium hidrogen ftalat
2. Pelarut: Isopropanol atau etanol 95% yang dinetralkan
Isopropanol atau etanol 95% dipanaskan di atas pemanas (hot plate) hingga mendidih. Tambahkan kira-kira 0,5 ml indikator fenolftalein, kemudian titrasi dengan larutan NaOH 0,1 N hingga timbul warna merah muda (merah jambu) yang stabil.
4. Aquadest. 3.4.3.2 Cara Kerja
1. Panaskan minyak pada suhu 60 oC hingga 70 oC, aduk hingga homogen. 2. Timbang minyak sesuai tabel di bawah ini ke dalam erlenmeyer.
% Asam Lemak Bebas Berat Contoh ± 10% (g)
< 1,8 10 ± 0,02
1,8 – 6,9 5 ± 0,01
< 6,9 2,5 ± 0,01
3. Tambahkan 50 ml pelarut isopropanol yang sudah dinetralkan.
4. Panaskan di atas penangas air atau pemanas dan atur suhunya pada 40 oC hingga sampel larut semua.
5. Tambahkan larutan indikator fenolftalein sebanyak 1 – 2 tetes.
6. Titrasi dengan larutan titar sambil digoyang-goyang hingga mencapai titik akhir yang ditandai dengan perubahan warna menjadi merah muda (merah jambu) yang stabil selama 30 detik.
7. Catat volume larutan titar yang digunakan.
8. Lakukan analisa duplo, perbedaan antara kedua hasil uji tidak boleh melebihi 0,05%.
9. Kadar asam lemak bebas sampel dapat dihitung berdasarkan persamaan berikut:
% Asam Lemak Bebas = N x V x M
gr sampel (3.3)
Ket : N = normalitas larutan NaOH (mol/l) V = volume larutan NaOH terpakai (ml)
M = berat molekul FFA (gr/mol) = 25,6 sebagai asam palmitat [57].
3.4.4 Analisa Bilangan Peroksida pada Minyak
1. Timbang 5 gram minyak ke dalam erlenmeyer 250 ml dan tambahkan 30 ml lautan asam asetat – kloroform 3 : 2.
3. Didiamkan selama 1 menit sambil digoyang dan tambahkan 30 ml aquadest secepat.
4. Tambahkan 0,5 ml larutan kanji dan titrasi dengan larutan Na2S2O3 0,01 N secara perlahan dan dengan pengocokan yang kuat. Titrasi hingga warna kuning hampir hilang dan lanjutkan titrasi warna biru tepat hilang.
5. Untuk setiap jenis sampel, dilakukan titrasi blanko dengan cara dan perlakuan yang sama seperti sampel, titrasi blanko harus tidak lebih dari 0,1 ml larutan natrium tiosulfat 0,01 N.
6. Nilai bilangan peroksida dapat dihitung berdasarkan persamaan berikut: Bilangan Peroksida, meq/kg = (S – B) x N x 1000
W (3.4)
Dimana : N = normalitas Na2S2O3
B = volume Na2S2O3 0,01 N yang terpakai dalam titrasi blanko S = volume Na2S2O3 0,01 N yang terpakai dalam titrasi sampel W = berat sampel dalam gram
3.5 FLOWCHART PENELITIAN
3.5.1 Pembuatan Adsorben Biji Asam Jawa
[image:35.595.143.483.175.717.2]Alur proses pembuatan adsorben biji asam jawa dapat digambarkan melalui flowchart pada Gambar 3.1.
Gambar 3.1 Flowchart Pembuatan Adsorben Asam Jawa Mulai
Biji asam jawa dicuci dengan air
Dikeringkan dengan cara dijemur di bawah sinar matahari
Didinginkan pada suhu ruangan
Dicuci dengan aquadest
Selesai
Diaktifkan dengan larutan asam nitrat (HNO3) 4 N rasio 1:2
Dipanaskan selama 2 jam pada suhu 80 oC
Dipanaskan di dalam oven selama 2 jam pada suhu 120 oC
Ulangi percobaan untuk rasio adsorben dan suhu oven yang lain Dilakukan analisa bilangan iodin dan gugus
3.5.2 Proses Degumming dan Bleaching
[image:36.595.149.483.151.696.2]Alur proses adsorpsi CPO atau yang disebut proses degumming dan bleaching dapat digambarkan melalui flowchart pada Gambar 3.2.
Gambar 3.2 Flowchart Prosedur Utama Mulai
Timbang 100 gram sampel CPO dan masukkan ke dalam beaker
Dipanaskan di atas hot plate hingga suhu 90 oC sambil diaduk dengan menggunakan magnetic stirrer hingga homogen
Tambahkan adsorben asam Jawa dengan dosis 0,5% (b/b) dari CPO yang digunakan
Naikkan temperatur hingga suhu 105 oC selama 25 menit
Saring dengan segera minyak tersebut dengan corong buncher dan kertas saring Whatman No.1 dalam kondisi vakum
Ulangi percobaan untuk variasi yang lain
Selesai
3.5.3 Analisa Bilangan Iodin pada Adsorben
Alur proses analisa bilangan iodin adsorben dapat digambarkan melalui flowchart pada Gambar 3.3.
Ya
Tidak Mulai
Keirngkan 1 gram adsorben pada suhu 110 o
C selama 3 jam
Didinginkan di dalam desikator
Tambahkan 50 ml larutan iod 0,1 N dan aduk dengan magnetic stirer selama 15 menit
Titrasi dengan larutan Na2S2O3 0,1 N
Apakah warna kuning pada larutan berkurang?
Catat volume Na2S2O3 0,1 N yang terpakai dan lakukan titrasi blanko Saring dan ambil sebanyak 10 ml filtrat
Tambahkan beberapa tetes indikator amilum 1%
Apakah larutan menjadi tidak berwarna?
Tidak Titrasi dengan larutan Na2S2O3 0,1 N
Gambar 3.3 Flowchart Analisa Bilangan Iodin pada Adsorben
3.5.4 Analisa Karakteristik Gugus Fungsi pada Adsorben
Alur proses analisa karakteristik gugus fungsi pada adsorben dapat digambarkan melalui flowchart pada Gambar 3.4.
Selesai
Haluskan ±1 mg sampel bersama 200 mg KBr
Buat pellet dari campuran bahan tersebut menggunakan alat tekan
Pre vakum selama 2 – 3 menit
Tekan pellet dengan pompa hidrolik 80 KN selama 5 menit
Ambil sampel pellet dengan dengan pompa hidrolik
Letakkan pellet pada sampel holder dan tempatkan pada lintasan sinar alat FTIR
Lakukan pengukuran dengan alat FTIR
Mulai A
Hitung bilangan iodin pada adsorben
Gambar 3.4 Flowchart Analisa Karakteristik Gugus Fungsi pada Adsorben
3.5.5 Analisa Kadar Asam Lemak Bebas pada Minyak
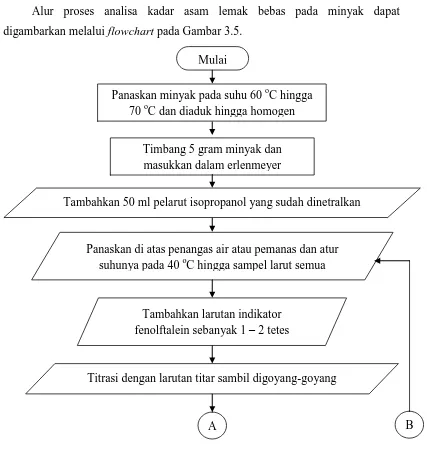
Alur proses analisa kadar asam lemak bebas pada minyak dapat digambarkan melalui flowchart pada Gambar 3.5.
Mulai
Panaskan minyak pada suhu 60 oC hingga 70 oC dan diaduk hingga homogen
Timbang 5 gram minyak dan masukkan dalam erlenmeyer
Tambahkan 50 ml pelarut isopropanol yang sudah dinetralkan
Panaskan di atas penangas air atau pemanas dan atur suhunya pada 40 oC hingga sampel larut semua
Tambahkan larutan indikator fenolftalein sebanyak 1 – 2 tetes
Titrasi dengan larutan titar sambil digoyang-goyang Selesai
A
Amati puncak grafik yang terbentuk dan bandingkan dengan tabel gugus fungsi FTIR untuk melihat gugus
fungsi yang terdapat pada adosrben
Gambar 3.5 Flowchart Analisa Kadar Asam Lemak Bebas pada Minyak
3.5.6 Analisa Bilangan Peroksida pada Minyak
Alur proses analisa bilangan peroksida pada minyak dapat digambarkan melalui flowchart pada Gambar 3.6.
Ya
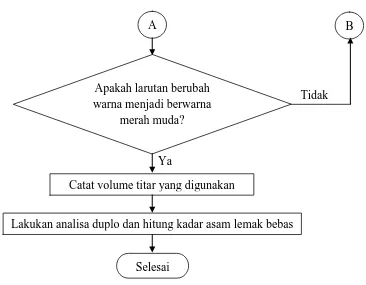
Tidak Apakah larutan berubah
warna menjadi berwarna merah muda?
Catat volume titar yang digunakan
Lakukan analisa duplo dan hitung kadar asam lemak bebas
Selesai
Mulai
Timbang 5 gram minyak ke dalam Erlenmeyer 250 ml
Aduk minyak dan tambahkan 0,5 ml larutan jenuh KI
Didiamkan selama 1 menit sambil digoyang dan tambahkan 30 ml aquadest secepatnya
Tambahkan 0,5 ml larutan kanji
Tambahkan 30 ml larutan asam asetat – kloroform 3 : 2
A B
Gambar 3.6 Flowchart Analisa Bilangan Peroksida pada Minyak Ya
Ya Tidak
Tidak Titrasi dengan larutan Na2S2O3 0,01 N
secara perlahan dan kocok dengan kuat
Apakah warna kuning pada larutan hilang?
Catat volume titar yang digunakan dan lakukan analisa duplo serta hitung bilangan peroksida pada minyak
A B
Apakah warna kuning pada larutan hilang?
BAB IV
HASIL DAN PEMBAHASAN
4.1 PEMBUATAN ADSORBEN DARI BIJI ASAM JAWA
[image:42.595.134.486.415.625.2]Pada penelitian ini, adsorben dari bahan baku biji asam jawa diaktivasi secara kimia dengan aktivator asam nitrat (HNO3) 4N pada suhu 80 oC dan dioptimasi dengan memvariasikan rasio adsorben : asam nitrat (b:v) sebesar 1:1, 1:2, 1:3, dan 1:4, serta suhu pemanasan di dalam oven sebesar 110, 120, 130, dan 140 oC. Sebelum dan setelah diaktivasi, dilakukan analisa bilangan iodin terhadap adsorben. Bilangan iodin sebelum diaktivasi adalah 379,812 mg/g. Dari hasil penelitian diperoleh adsorben dengan kapasitas adsorpsi yang paling baik dari berbagai variasi suhu pemanasan dengan oven dan rasio adsorben : aktivator (b:v) tertentu yang dinyatakan sebagai bilangan iodin (mg/g), yaitu jumlah mg iodin yang dapat diserap oleh setiap 1 gram adsorben, sebagaimana digambarkan melalui grafik pada Gambar 4.1 di bawah ini.
Gambar 4.1 Pengaruh Suhu Pemanasan terhadap Bilangan Iodin Adsorben pada Rasio Adsorben : Asam Nitrat (b:v) Tertentu
Dari grafik pada Gambar 4.1 di atas dapat dilihat bahwa bilangan iodin cenderung meningkat seiring dengan semakin tingginya suhu pemanasan untuk rasio adsorben : asam nitrat (b:v) dan dengan semakin kecilnya rasio adsorben :
360 380 400 420 440 460 480 500 520
105 110 115 120 125 130 135 140 145 150
B il an gan Iodin (mg/ g)
Suhu Pemanasan (°C)
asam nitrat (b:v) pada suhu pemanasan yang sama, dan pada titik tertentu mengalami penurunan. Bilangan iodin paling besar diperoleh yaitu pada suhu pemanasan 130 oC untuk rasio 1:2, sebesar 511,773 mg/g. Standar bilangan iodin dari arang aktif adalah > 750 mg/g [31], sedangkan standar bilangan iodin dari adsorben yang dibuat dari biomassa tanpa proses pengarangan tidak tersedia.
Berdasarkan teori, keunggulan dari aktivasi kimiawi dibandingkan aktivasi fisik yaitu waktu perlakuan yang lebih singkat dan suhu yang lebih rendah diperoleh luas permukaan adsorpsi yang lebih besar dan penambahan mikropori [79]. Suhu modifikasi adsorben yang semakin tinggi akan meningkatkan laju reaksi pengurangan pengotor dan senyawa volatil yang mengisi pori-pori adsorben sehingga mengoptimalkan pembentukan pori aktif, namun pemanasan berlebihan dapat berakibat pada pengurangan mesopori dan mikropori [80]. Volume aktivator yang terlalu besar akan menyebabkan rusaknya struktur adsorben [81] dan dapat menghilangkan sifat aktif adsorben karena kerusakan yang diakibatkan oleh pelarutan dan pecahnya pori adsorben [82].
Pada rasio 1:1, 1:3, dan 1:4, bilangan iodin terus meningkat seiring dengan bertambahnya suhu oven. Pada rasio 1:2, bilangan iodin terus meningkat seiring bertambahnya suhu dari 110, 120, sampai 130 oC, namun kembali menurun pada suhu 140 oC. Pada suhu oven 110 oC, bilangan iodin mengalami pengingkatan seiring dengan semakin kecilnya rasio adsorben : asam nitrat dari 1:1 sampai 1:3, namun terjadi penurunan pada rasio 1:4. Pada suhu 120 oC, bilangan iodin meningkat pada penurunan rasio dari 1:1 ke 1:2, tetap sama pada rasio 1:3, dan kembali menurun pada rasio 1:4. Pada suhu 130 dan 140 oC, bilangan iodin meningkat pada penurunan rasio dari 1:1 ke 1:2, namun kembali menurun saat penurunan rasio berikutnya, yaitu dari 1:2, 1:3, dan 1:4.
rasio yang lebih rendah dari 1:2, adsorben telah rusak akibat adanya pelarutan pada strukturnya. Kondisi yang paling baik untuk menghasilkan adsorben dari biji asam jawa dengan bilangan iodin yang paling tinggi adalah pada rasio adsorben : asam nitrat 1:2 dan suhu pemanasan 130 oC.
4.2 KARAKTERISTIK GUGUS FUNGSI PADA ADSORBEN DARI BIJI ASAM JAWA DENGAN SPEKTROFOTOMETRI FTIR
[image:44.595.113.511.375.633.2]Adsorben sebelum dan setelah diaktivasi, serta adsorben yang telah terpakai (spent adsorbent) untuk adsorpsi kandungan pengotor pada CPO selanjutnya dikarakterisasi gugus-gugus fungsinya dengan spektofotometri FTIR. Gugus-gugus yang terdapat pada adsorben dapat disimpulkan dengan membandingkan puncak gelombang yang terbentuk dengan literatur, yaitu dari tabel korelasi IR [83, 84]. Adapun hasil yang diperoleh diberikan pada Gambar 4.2, 4.3, dan 4.4 berikut.
Gambar 4.1 Hasil Spektrofotometri FTIR untuk Adsorben Biji Asam Jawa Sebelum Diaktivasi
Gambar 4.2 Hasil Spektrofotometri FTIR untuk Adsorben Biji Asam Jawa Sebelum Diaktivasi
763,81 cm-1 : gugus C-H (alkena aromatik) 2360,87 cm-1 : gugus C=O 1060,85 cm-1 : gugus C-O (asam karboksilat) (karbondioksida) 1246,02 cm-1 : gugus C-N (amina) 3290,56 cm-1 : gugus O-H (alkohol 1431,90 cm-1 : gugus C-H (alkana)
Gambar 4.2 Hasil Spektrofotometri FTIR untuk Adsorben Biji Asam Jawa Setelah Diaktivasi
Gambar 4.3 Hasil Spektrofotometri FTIR untuk Adsorben Biji Asam Jawa Setelah Diaktivasi
Gambar 4.3 Hasil Spektrofotometri FTIR untuk Adsorben Biji Asam Jawa Setelah Diaktivasi
Gambar 4.4 Hasil Spektrofotometri FTIR untuk Adsorben Biji Asam Jawa yang Telah Terpakai untuk Adsorpsi
898,83 cm-1 : gugus C-H (alkena aromatik) 2881,65 cm-1 : gugus N=H (amina) 2943,37 cm-1 : gugus O-H (alkohol) 3741,90 cm-1 : gugus –OH (alkohol 2345,44 cm-1 : gugus C=O (karbondioksida) ikatan hidrogen) 2943,37 cm-1 : gugus C-H (alkana, alkanol) 1531,48 cm-1 : gugus NO2 (nitro)
Dari Gambar 4.2 dan 4.3 dapat dibandingkan gugus fungsi yang terdapat pada adsorben, sebelum dan setelah diaktivasi. Dari kedua grafik pada Gambar 4.2 dan 4.3 dapat dilihat bahwa proses pengaktivasian tidak memberikan perubahan yang berarti terhadap gugus-gugus fungsi yang terkandung pada kedua adsorben.
Adsorben sebelum diaktivasi mengandung gugus alkena, senyawa karbon cincin aromatik, karbondioksida, gugus –OH dari alkohol, senyawa nitro, alkana dan amina. Setelah diaktivasi tidak terdapat lagi asam karboksilat pada adsorben. Titik didih asam karboksilat hanya sedikit di atas titik didih air [67]. Maka dapat terjadi kemungkinan menguapnya asam karboksilat saat proses aktivasi adsorben. Kandungan gugus –OH hidroksil pada biji asam jawa memiliki kecenderungan berinteraksi dengan adsorbat [39]. Gugus alkanol mempengaruhi daya pemucatan adsorben, asam lemak bebas, peroksida, dan zat-zat organik yang bersifat polar [69]. Pada aktivasi menggunakan asam terjadi pertukaran kation dari mineral dengan ion H- dari asam yang menyebabkan adsorben menjadi bermuatan negatif, sehingga kemampuan penyerapannya meningkat. Selain itu, pertukaran ion ini yang akan meningkatkan luas permukaan adsorben [70].
Pada adsorben yang telah dikontakkan dengan CPO, ada beberapa gugus fungsi yang terikat oleh adsorben setelah pengontakkan. Pada bilangan gelombang 1161,15 cm-1 terdapat gugus C-O asam karboksilat yang merupakan indikasi adanya senyawa asam lemak bebas. Pada bilangan gelombang 1238,30 cm-1 terdapat gugus –OH yang merupakan indikasi melekatnya senyawa polar peroksida HOOH. Keton dan aldehid merupakan senyawa yang menyebabkan kekeruhan dan bau tengik atau rancid pada minyak. Pada bilangan gelombang 1103,28 cm-1 terdapat gugus ester, dan pada bilangan gelombang 1631,78 cm-1 terdapat gugus hidrokarbon metil. Gugus alkanol yang berperan menyerap kandungan pengotor spesifik pada CPO tidak ditemukan lagi pada adsorben setelah diaktivasi, yang berarti keseluruhannya telah terpakai untuk proses adsorpsi pada permukaan adsorben.
Asam lemak adalah asam karboksilat yang diperoleh dari hidrolisis ester terutama gliserol, sebagian asam lemak tidak bergabung dengan molekul gliserol pada minyak atau lemak yang dikenal dengan asam lemak bebas (FFA) [66]. Kerusakan lemak atau minyak yang utama adalah karena peristiwa oksidasi dan hidrolitik, baik enzimatik maupun nonenzimatik. Kerusakan pada minyak kelapa sawit menyebabkan bau tengik atau rancid terutama disebabkan oleh aldehid dan keton [10]. Dari hasil spektrofotmetri IR ini dapat disimpulkan bahwa adsorben dari biji asam jawa dapat mengadsorpsi kandungan asam karboksilat berupa asam lemak bebas, senyawa peroksida, aldehid, dan keton dari minyak kelapa sawit.
[image:47.595.147.501.426.605.2]4.3 ADSORPSI KADAR ASAM LEMAK BEBAS (FFA) PADA CPO Dari penelitian ini dapat dilihat penurunan kadar asam lemak bebas (FFA) pada CPO yang optimum dari berbagai variasi waktu kontak dan dosis adsorben. Pada waktu 35 menit dengan penambahan dosis adsorben 1% menghasilkan penurunan kadar FFA paling besar. Hasil tersebut dapat dilihat melalui grafik pada Gambar 4.5 berikut.
Gambar 4.5 Grafik Penurunan Kadar Asam Lemak Bebas (FFA) Minyak Kelapa Sawit pada Waktu Tertentu
Kadar asam lemak bebas mula-mula pada minyak kelapa sawit adalah 4,936 %. Untuk penambahan dosis adsorben asam jawa sebesar 0,5 % dalam minyak pada waktu 25 menit, kadar asam lemak bebas dalam minyak turun menjadi 4,65 %. Pada waktu 35 menit kadar asam lemak bebas dalam minyak turun menjadi 4,2
3 3.5 4 4.5 5
20 25 30 35 40 45 50
%. Dan pada waktu 45 menit kadar asam lemak bebas dalam minyak mengalami peningkatan menjadi 4,34 %. Selanjutnya untuk penambahan dosis adsorben biji asam jawa sebesar 1,0 % dalam minyak pada waktu 25 menit, kadar asam lemak bebas dalam minyak turun menjadi 4,493 %. Pada waktu 35 menit kadar asam lemak bebas dalam minyak turun menjadi 3,923%. Dan pada waktu 45 menit kadar asam lemak bebas dalam minyak mengalami peningkatan menjadi 4,063 %. Kemudian untuk penambahan dosis adsorben biji asam Jawa sebesar 1,5 % dalam minyak pada waktu 25 menit, kadar asam lemak bebas dalam minyak turun menjadi 4,618 %. Pada waktu 35 menit kadar asam lemak bebas dalam minyak turun menjadi 4,047%. Dan pada waktu 45 menit kadar asam lemak bebas dalam minyak mengalami peningkatan menjadi 4,089 %.
Menurut teori, penurunan kadar asam lemak bebas pada CPO akan meningkat seiring semakin besar dosis adsorben yang digunakan disertai pengadukan kontinu pada waktu kontak 30 menit [5]. Menurut Wei et al. [9], dosis adsorben yang diaktivasi dengan asam yang paling baik untuk menghilangkan kandungan yang tidak diinginkan dari CPO adalah > 0,5%. Standar kadar asam lemak pada CPO hasil adsorpsi menggunakan degumming agent dan bleaching earth adalah sebesar 3 – 5 % [59]. Pada industri pemurnian minyak kelapa sawit dengan menggunakan degumming agent konvensional (asam fosfat 85%) dengan dosis 1% dari berat minyak, kadar asam lemak bebas mengalami peningkatan dari 5% menjadi 5,05%.
Dari hasil penelitian yang telah dilakukan, maka pemanfaatan adsorben biji asam jawa yang diaktivasi dengan asam nitrat 4 N dengan rasio (b:v) 1:2 dengan dosis penambahan adsorben ke dalam minyak sebanyak 1 % dari berat minyak dengan waktu kontak selama 35 menit menghasilkan penurunan kadar asam lemak bebas paling besar dari 4,936 % menjadi 3,923 %, dimana tidak memberikan perbedaan yang besar dengan hasil pada waktu 45 menit yaitu 4,063 % dan dosis 1,5 % yaitu 4,047. Oleh karena itu, dengan pertimbangan ekonomi terhadap jumlah penggunaan adsorben, dosis 1,0 % dipilih sebagai dosis terbaik untuk adsorpsi kandungan asam lemak bebas dalam minyak kelapa sawit dan telah memenuhi standar kandungan asam lemak bebas pada minyak kelapa sawit setelah proses adsorpsi. Persentase penurunan kadar FFA adalah sebesar 20,52 %.
4.4 ADORPSI KANDUNGANPEROKSIDA PADA CPO
[image:49.595.148.498.501.696.2]Kandungan peroksida pada minyak kelapa sawit sebelum dilakukan proses adsorpsi dengan adsorben adalah 0,0144 meq/kg minyak. Dari penelitian ini dapat dilihat bahwa bilangan peroksida mengalami penurunan yang optimum untuk setiap variasi waktu kontak dan dosis adsorben. Adsorpsi pada waktu 35 menit dengan penambahan dosis adsorben 1,0 % menghasilkan penurunan bilangan peroksida paling besar. Hasil adsorpsi penurunan bilangan peroksida dapat digambarkan melalui grafik pada Gambar 4.6 di bawah ini.
Gambar 4.6 Grafik Penurunan Bilangan Peroksida Minyak Kelapa Sawit pada Beberapa Kondisi Operasi
0 0.1 0.2 0.3 0.4 0.5
20 25 30 35 40 45 50
Untuk penambahan dosis adsorben sebesar 0,5 % pada waktu 25 menit, bilangan peroksida dalam minyak meningkat menjadi 0,02315 meq/kg. Pada waktu 35 menit bilangan peroksida meningkat menjadi 0,0864 meq/kg. Dan pada waktu 45 menit bilangan peroksidamengalami peningkatan menjadi 0,3415 meq/kg. Untuk penambahan dosis adsorben sebesar 1,0 % dalam minyak pada waktu 25 menit, bilangan peroksida meningkat menjadi 0,02307 meq/kg. Pada waktu 35 menit bilangan peroksida dalam minyak turun menjadi 0,00868 meq/kg. Pada waktu 45 menit bilangan peroksida mengalami peningkatan menjadi 0,4613 meq/kg. Untuk penambahan dosis adsorben sebesar 1,5 % pada waktu 25 menit, bilangan peroksida meningkat menjadi 0,01722 meq/kg. Pada waktu 35 menit bilangan peroksida dalam minyak meningkat menjadi 0,0258 meq/kg. Pada waktu 45 menit bilangan Peroksida dalam minyak mengalami peningkatan menjadi 0,4599 meq/kg.
Secara teori, bilangan peroksida adalah banyaknya miliekuivalen peroksida dalam 1000 gram lemak. Bilangan peroksida adalah nilai terpenting untuk menentukan derajat kerusakan pada minyak atau lemak. Asam lemak tidak jenuh dapat mengikat oksigen pada ikatan rangkapnya sehingga membentuk peroksida [70]. Berdasarkan data penelitian yang diperoleh, diketahui bahwa semakin lama waktu kontak adsorpsi tidak meningkatkan kemampuan daya jerap adsorben biji asam jawa dan terjadi proses desorpsi. Desorpsi terjadi akibat permukaan adsorben yang telah jenuh, pada keadaan jenuh laju adsorpsi menjadi berkurang. Adsorpsi kandungan peroksida biasanya terjadi dengan mekanisme adsorpsi fisika [87]. Proses adsorpsi ini disebabkan oleh adanya perbedaan energi potensial antara permukaan adsorben dan zat yang terserap, baik itu melibatkan gaya fisika atau kimia. Adsorpsi fisika melibatkan gaya antar molekul (gaya Van der Waals atau melalui ikatan hidrogen). Molekul yang terbentuk dari adsorpsi fisika sangat lemah dan energi yang dilepaskan pada adsorpsi fisika relatif rendah sekitar 20 kJ/mol, karena itu sifat adsorpsinya adalah reversible, yaitu dapat balik atau dilepaskan kembali dengan adanya penurunan konsentrasi larutan [27].
Pada permunian minyak kelapa sawit konvensional dengan menggunakan asam fosfat dengan dosis 1 % penurunan bilangan peroksida dari 2,9 meq/kg menjadi 2,83 meq/kg [5].
Dari grafik pada Gambar 4.6 dapat dilihat bahwa penurunan bilangan peroksida yang dihasilkan berfluktuasi. Hal ini dapat disebabkan oleh beberapa faktor. Pertama, penggunaan dosis adsorben yang rendah tidak efektif dalam menyerap peroksida lebih banyak karena permukaan porinya telah tertutup dengan pengotor yang lain. Kedua, pemanasan dan waktu reaksi yang lama rentan mengakibatkan naiknya bilangan peroksida.
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Adapun kesimpulan yang dapat diambil dari penelitian ini adalah:
1. Bilangan iodin adsorben biji asam jawa yang paling besar adalah 511,773 mg/g yang diperoleh pada aktivasi dengan suhu 130 oC dan rasio adsorben : asam nitrat (b:v) 1:2.
2. Dari hasil spektofotometri FTIR sebelum dan sesudah adsorben dikontakkan dengan CPO, dapat disimpulkan bahwa adsorben menyerap gugus ester, asam karboksilat, aldehid, dan keton yang dapat menyebabkan kerusakan CPO.
3. Kondisi terbaik untuk adsorpsi kandungan asam lemak bebas dan bilangan peroksida pada CPO adalah pada waktu kontak 35 menit dan dosis adsorben 1,5 %.
4. Kadar asam lemak bebas minimum yang diperoleh adalah 3,923 % dengan persentase penurunan sebesar 20,52 %.
5. Bilangan peroksida minimum yang diperoleh adalah 0,00868 meq/kg minyak dengan persen penurunan sebesar 39,72 %.
5.2 SARAN
Adapun saran yang dapat diberikan kepada peneliti selanjutnya, yaitu: 1. Dilakukan analisa Moisture and Impurities dan analisa logam pada minyak
untuk mengetahui kemampuannya mengadsorb pengotor dalam minyak. 2. Perlu dilakukan penelitian lebih lanjut untuk mengetahui karakteristik
adsorben seperti diameter pori dan porositas untuk menambah informasi tentang karakteristik adsorben dan kesesuaian standar adsorben komersial dan SNI.
BAB II
TINJAUAN PUSTAKA
2.1 BIJI ASAM JAWA SEBAGAI ADSORBEN
Proses adsorpsi menunjukkan kemampuan adsorbat untuk menempel pada bahan penjerap. Proses ini dapat diterapkan pada pemisahan polutan terlarut atau untuk mengambil kembali bahan yang bernilai tinggi tapi berjumlah sedikit pada suatu campuran [31]. Berdasarkan gaya yang bekerja, proses adsorpsi dibagi menjadi dua, yaitu adsorpsi fisika dan adsorpsi kimia. Pada adsorpsi fisika, gaya utama bekerja adalah gaya gaya Van der Waals. Gaya ini relatif lemah dengan energi yang terlibat sekitar 5 kkal/mol. Sementara pada adsorpsi kimia, terdapat proses perpindahan elektron yang sama dengan pembentukan ikatan kimia antara permukaan padatan dengan zat terjerap. Adsorpsi kimia biasanya terjadi pada proses-proses katalitik heterogen. Aktivasi kimia pada adsorben pada umumnya digunakan industri yang umumnya lebih efisien dalam penghilangan impurities (kotoran) [16].
Penggunaan bahan-bahan biologis sebagai adsorben disebut sebagai biosorpsi. Biosorpsi menunjukkan kemampuan biomassa untuk mengikat logam berat dari dalam larutan melalui langkah-langkah metabolisme atau kimia-fisika [32], dan termasuk penghilangan racun dari bahan-bahan yang berbahaya [31]. Proses pengolahan ini dapat dilakukan di tempat, sehingga tidak diperlukan proses pemindahan bahan yang akan diolah. Keuntungan lain dalam pemakaian biosorben adalah bahan baku yang melimpah, murah, proses pengolahan yang efisien, minimalisasi lumpur yang terbentuk, serta tidak adanya nutrisi tambahan dan proses regenerasi [32].
kekuatan muatan kedua bahan. Interaksi kolombik dapat diamati dari adsorpsi bahan kationik dan anionik adsorben.
Lebih lanjut Igwe dan Abia [31] menyebutkan bahwa pada biosorben umumnya mengandung β-D-glukosa berulang sebagai komponen utama dinding sel. Gugus hidroksil polar selulosa inilah yang berperan dalam reaksi kimia dan mengikat adsorbat dari larutan. Modifikasi gugus fungsional dapat mengubah sifat-sifat permukaan yang pada akhirnya akan mempengaruh kemampuan adsorpsi bahan. Untuk meningkatkan kemampuan adsorpsinya, biosorben dapat diaktivasi dengan metode aktivasi kimia (menggunakan asam atau basa) atau aktivasi termal (dengan pemanasan) [24]. Faktor-faktor yang mempengaruhi adsorpsi adalah distribusi ukuran partikel, sifat adsorben dan adsorbat, luas permukaan adsorben, pH, suhu, konsentrasi awal, waktu kontak, dosis adsorben, dan lain-lain [22].
Parameter yang dapat menunjukkan kualitas adsorben adalah daya adsorpsi adsorben terhadap larutan Iodin. Daya adsorpsi adsorben terhadap iodin memiliki korelasi dengan luas permukaan adsorben. Dimana semakin besar angka iodin maka semakin besar kemampuan dalam mengadsorpsi adsorbat atau zat terlarut. Salah satu metode yang digunakan dalam analisis daya adsorpsi adsorben terhadap iodin adalah dengan metode titrasi iodometri. Kereaktifan dari arang aktif dapat dilihat dari kemampuannya mengadsorpsi substrat. Daya adsorpsi tersebut dapat ditunjukkan dengan besarnya angka iodin (iodine number) yaitu angka yang menunjukkan seberapa besar adsorben dapat mengadsorpsi iodin. Semakin besar nilai angka iodin maka semakin besar pula daya adsorpsi dari adsorben. Daya serap adsorben terbagi 2 yaitu :
a. Daya serap fisika (adsorbsi fisika)
Biasanya melibatkan perubahan energi yang lebih kecil (ikatan lemah) Contoh : adsorbsi N2 pada karbon melepas ± 5000 kal/mol
b. Daya serap kimia (adsorbsi kimia)
pangan dan medis. Daging buah asam jawa digunakan sebagai bahan baku pembuatan obat-obatan herbal, sedangkan bunga dan daun asam jawa biasa dikonsumsi sebagai sayuran [33].
[image:56.595.218.406.247.401.2]Adsorben atau biosorben juga dapat dibuat dari biji-bijian tanaman tertentu seperti asam jawa. Bagian biji asam jawa biasanya tidak dimanfaatkan dan dibuang sebagai limbah. Pemanfaatan biji asam jawa telah diteliti untuk digunakan sebagai koagulan dalam pengolahan limbah cair [15] dan sebagai adsorben untuk zat warna serta logam berat.
Gambar 2.1 Biji Asam Jawa [34]
[image:56.595.114.536.471.707.2]Adapun komposisi kimia dari biji asam jawa diberikan pada Tabel 2.1 berikut.
Tabel 2.1 Komposisi Biji Asam Jawa, Kernel, dan Testa (%) [35, 36, 37, 38]
Konstituen Whole Seed
Seed Kernel (Kotiledo
n)
Testa (Seed Coat)
Moisture 9,4-11,3 11,4-22,7 11,0
Protein 13,3-26,9 15,0-20,9
Lemak/Minyak 4,5-16,2 3,9-16,2
Crude Fibre 7,4-8,8 2,5-8,2 21,6
Karbohidrat 50,0-57,0 65,1-72,2
Total Ash 1,60-4,20 2,4-4,2 7,4
Ekstrak Bebas Nitrogen
59,0
Yield TKP 50,0-60,0
Kalori/100 g 340,3
Total Gula 11,3-25,3
Gula Tereduksi 7,4
Starch 33,1
Dari Tabel 2.1 dapat dilihat bahwa biji asam jawa memiliki kandungan tannin sebesar 20,2% yang terdapat pada kulit biji (seed coat) dan kandungan pati (starch) dalam daging biji cukup besar sekitar 33,1% [35]. Berdasarkan pengamatan Nilanjana [39] tannin yang dikandung dalam tanaman merupakan zat aktif yang menyebabkan proses koagulasi, sedangkan polimer alami seperti pati berfungsi sebagai flokulan. Imbabi et al. [40] mempelajari bahwa ekstrak biji asam jawa mempunyai kemampuan dalam melawan bakteri E.coli yang dihasilkan oleh zat tamarindineal (5-hydroxy-2-oxo-hexa-3,5-dineal).
[image:57.595.146.473.475.551.2]Ekstrak biji asam Jawa mengandung polisakarida alami yang tersusun atas D-galaktosa, D-glukosa dan D-xylosa yang merupakan flokulan alami. Flokulan alami terutama polisakarida, lebih ramah lingkungan bila dibandingkan dengan koagulan organik dan anorganik [41]. Bagian testa pada biji mengandung 40% karbohidrat dan pektin yang larut dalam air serta 60% tannin dan bahan pewarna [42]. Struktur testa dianggap sama dengan flavonoid dan proantosianidin yang terkondensasi, sehingga testa mudah teroksidasi dan mengalami polimerisasi yang progresif pada kondisi asam. Menurut Vazquez et al [43], beberapa kelompok tannin yang berada pada testa adalah zat aktif untuk proses adsorpsi. Sifat fisika-kimia dari biji asam jawa diberikan pada Tabel 2.2 berikut.
Tabel 2.2 Sifat Fisika dan Kimia Biji Asam Jawa [24]
Parameter Nilai
Luas permukaan, m2/g (metode adsorpsi nitrogen BET)
0,99 Kandungan air mekanis, % (b/b) 10,00 Kapasitas pertukaran ion, meq/g 2,76
berdampingan. Berdasarkan struktur, biji asam jawa yang mengandung selulosa mempunyai potensi yang cukup besar untuk dijadikan sebagai adsorben karena mengandung gugus hidroksil (–OH) yang dapat berinteraksi dengan komponen adsorbat [44].
2.2 MINYAK KELAPA SAWIT (CRUDE PALM OIL)
Pada tahun 1434, seorang pelaut dari Portugis, Gil Eannes pertama kali memberitahukan mengenai tanaman kelapa sawit (Elaeis guineensis) [45]. Saat ini, tanaman kelapa sawit telah berkembang kebanyakan di bagian barat benua Afrika, Indonesia, Malaysia, dan akhir-akhir ini berkembang di Brazil dan Kolombia. Pohon kelapa sawit dapat tumbuh hingga 20 meter tingginya dan temperatur yang baik untuk pertumbuhan kelapa sawit adalah 24-27oC. Pohon kelapa sawit membutuhkan iklim yang lembab dan minyaknya dapat diolah dari buahnya pada saat pohon berumur 4 tahun dan dapat dipanen selama 40-50 tahun [5].
[image:58.595.218.403.561.715.2]Kelapa sawit (Elaeis guineensis) dapat menghasilkan dua jenis minyak, yaitu minyak kelapa sawit yang berasal dari daging buah (mesocarp) dan minyak biji kelapa sawit (kernel palm oil) dari biji buah kelapa sawit. Minyak kelapa sawit memiliki titik leleh pada suhu 21-27oC yang dapat dikristalisasi menjadi fraksi padat (palm stearin, 25-35%, mencair pada suhu antara 48 dan 50oC) dan fraksi cair (palm olein, 65-70%, mencair pada suhu antara 18 dan 20oC), dengan demikian dapat memperluas jangkauan yang bermanfaat dari minyak kelapa sawit [46].
CPO (crude palm oil) merupakan minyak kasar yang diperoleh dengan cara ekstraksi daging buah sawit dan biasanya masih mengandung kotoran terlarut dan tidak terlarut dalam minyak. Pengotor yang dikenal dengan sebutan gum atau getah ini terdiri dari fosfatida, protein, hidrokarbon, karbohidrat, air, logam berat, resin, asam lemak bebas (FFA), tokoferol, pigmen dan senyawa lainnya [47]. Komposisi umum dari CPO diberikan pada Tabel 2.3 di bawah ini.
Tabel 2.3 Komposisi Umum Minyak Sawit Kasar (CPO) [48]
Kelompok Komponen dalam Kelompok
Minyak -Trigliserida, Digliserida, Monogliserida -Fosfolipida, Glikolipida, Lipoprotein -Asam Lemak Bebas
Produk Teroksidasi - Peroksida, Aldehida, Keton, Furfural (dari gula)
Non-Minyak (namun larut dalam minyak)
-Karoten -Tokoferol -Squalane -Sterol
Pengotor -Partikel Logam
-Ion Logam -Kompleks Logam Bahan yang Larut dalam Air -Air (moisture)
-Gliserol
-Pigmen Klorofil -Fenol
-Gula (karbohidrat yang dapat larut)
Adanya pengotor pada minyak akan menurunkan kualitas dan mempengaruhi penampilan fisik, rasa, bau dan waktu simpan dari minyak, sehingga harus dihilangkan melalui proses pemisahan secara fisika maupun secara kimia [47]. Sementara komposisi dari konstituen utama minyak sawit kasar diberikan pada Tabel 2.4 di bawah ini.
Tabel 2.4 Komposisi dari Konstituen Utama Minyak Sawit Kasar (CPO) [5]
Konstituen Crude Palm Oil
Trigliserida, % 95
Asam Lemak Bebas (FFA), % 2-5
Red Color (5 ¼ “ Lovibond Cell) Orange Red Moisture & Impurities, % 0,15-3,0 Bilangan Peroksida, (meq/kg) 1-5,0
[image:59.595.117.539.643.745.2]β – karoten, ppm 500-700
Fosfor, ppm 10-20
Besi, ppm 4-10
Tokoferol, ppm 600-1000
Digliserida, % 2-6
CPO berbentuk semi padat pada suhu ruang. CPO berwarna jingga karena mengandung sekitar 500 – 700 ppm β - karoten dan merupakan bahan pangan dengan sumber karoten alami terbesar. CPO juga mengandung sedikit air serta serat halus yang berwarna kuning sampai merah yang menyebabkan CPO tidak dapat dikonsumsi langsung sebagai bahan pangan maupun non pangan.
CPO terdiri atas berbagai trigliserida dengan rantai asam lemak yang berbeda-beda, antara 14 – 20 atom karbon. Dalam proses pembentukannya, trigliserida merupakan hasil proses kondensasi satu molekul gliserol dengan tiga molekul asam-asam lemak yang membentuk satu molekul trigliserida dan tiga molekul air [49].
O
||
H2C – OH HOOCR1 H2C – O – C – R1 | | | O
HC – OH + HOOCR2 ↔ HC – O – C – R2 + 3H2O | | | O
H2C – OH HOOCR3 H2C – O – C – R1
Gliserol Asam Lemak Trigliserida Air
1. Asam Lemak Jenuh
Asam lemak jenuh adalah asam lemak yang tidak mengandung ikatan rangkap antara atom – atom karbon pada rantainya, dan pada umumnya mempunyai titik lebur yang tinggi.
2. Asam Lemak Tak Jenuh
Asam lemak tak jenuh adalah asam lemak yang memiliki satu atau lebih ikatan rangkap di antara atom – atom karbonnya, dan pada umumnya mempunyai titik lebur yang rendah.
Komposisi asam lemak jenuh dan asam lemak tidak jenuh pada CPO diberikan pada Tabel 2.5 dan 2.6 di bawah ini.
Tabel 2.5 Asam – Asam Lemak Jenuh pada Minyak Kelapa Sawit [49] Asam Lemak Jenuh Jumlah Atom Karbon Rumus Struktur Titik Lebur
(oC)
Jumlah (%)
Asam Miristat 14 CH3(CH2)12COOH 54,4 1,1 – 2,5 Asam Palmitat 16 CH3(CH2)14COOH 62,9 40 – 46
[image:61.595.108.532.453.545.2]Asam Stearat 18 CH3(CH2)16COOH 69,6 3,6 – 4,7
Tabel 2.6 Asam – Asam Lemak Tak Jenuh pada Minyak Kelapa Sawit [49] Asam Lemak Tak Jenuh Jumlah Atom Karbon Rumus Struktur Titik Lebur
(oC)
Jumla h (%) Asam Oleat 18 CH3(CH2)7CH=(CH2)7COOH 14 42,7
Asam
Linoleat 18
CH3(CH2)7CH=CHCHCH2=(CH)2CO
OH -5 10,3
Asam lemak bebas diperoleh dari proses hidrolisa, yaitu dari penguraian lemak atau trigliserida oleh molekul air yang menghasilkan gliserol dan asam lemak bebas. Kerusakan minyak atau lemak dapat juga diakibatkan oleh proses oksidasi, yaitu terjadinya kontak antara sejumlah oksigen dengan minyak atau lemak, yang biasanya dimulai dengan pembentukan peroksida dan hidroperoksida. Selanjutnya terurailah asam lemak disertai dengan hidroperoksida menjadi aldehid dan keton serta asam-asam lemak bebas [49].
karbohidrat, turunan karbohidrat, protein, dan bahan-bahan berlendir atau getah (gum) serta zat-zat berwarna yang memberikan warna serta rasa dan bau yang tidak diinginkan. Dalam proses pemurnian dengan penambahan alkali (biasanya disebut dengan proses penyabunan) beberapa senyawa non trigliserida ini dapat dihilangkan, kecuali beberapa senyawa yang disebut dengan senyawa yang tak tersabunkan [50]. Menurut Formo et al. [51], tingginya kandungan air pada minyak kelapa sawit disebabkan oleh aktivitas enzim, oleh karena itu kandungan air harus diturunkan untuk menjaga kandungan asam lemak bebas tetap minimum. Kandungan minor dalam minyak sawit berjumlah kurang lebih 1 %, antara lain terdiri dari karoten, tokoferol, sterol, alkohol, triterpen, dan fosfolipida. Meskipun berada dalam jumlah kecil, kandungan minor ini dapat mempengaruhi kemampuan pemucatan, stabilitas, dan nilai nutrisi minyak sawit. Fosfolipida, yang merupakan ester kompleks yang sebagian besar terdiri dari fosfor, dan sebagian kecil nitrogen, gula, dan asam lemak rantai panjang, merupakan konstituen utama yang harus dihilangkan selama degumming dengan cara koagulasi kandungan fosfatida menggunakan asam fosfat atau asam sitrat. Fosfolipida dalam minyak kelapa sawit berada pada jumlah yang relatif kecil, yaitu sekitar 5 – 130 ppm dibandingkan dengan minyak nabati lainnya [5]. Sambanthamurthi et al. [52] menyebutkan bahwa minyak mesokarp yang diekstraksi dengan pelarut biasanya mengandung 100 – 200 ppm fosfolipida, namun pada minyak kelapa sawit biasanya hanya sekitar 20 – 80 ppm.
2.3 PEMURNIAN CPO
Proses pemurnian merupakan tahap yang diperlukan dalam produksi minyak dan lemak nabati. Tujuan dari proses ini adalah untuk menghilangkan pengotor serta komponen lain yang dapat mempengaruhi kualitas akhir produk. Kualitas akhir produk yang perlu dipantau adalah rasa, stabilitas penyimpanan, dan warna [53].
efisien. Kehilangan (loss) komponen yang diinginkan dijaga seminimum mungkin dengan biaya produksi yang efektif [54].
Sangat penting memilih proses pemurnian yang sesuai untuk memproduksi produk akhir dengan kualitas tinggi dan sesuai dengan kebutuhan konsumen. Ada dua jenis proses pemurnian yang umum dalam teknologi pengolahan minyak kelapa sawit, yaitu pemurnian secara kimia (alkali) dan pemurnian secara fisika. Perbedaan dasar keduanya adalah pada bahan kimia yang digunakan serta cara penghilangan FFA (Free Fatty Acid).
Pemurnian secara fisika muncul pertama kali untuk menggantikan penggunaan bahan kimia (alkali) dalam pemurnian minyak yang disebabkan oleh tingginya kandungan FFA pada minyak yang dimurnikan secara kimia. Tahap proses deasidifikasi (deodorisasi) pada pemurnian secara fisika dapat mengatasi masalah tersebut. Selain itu, menurut literatur, metode pemurnian secara fisika lebih disukai karena dianggap lebih cocok untuk minyak nabati dengan kandungan fosfatida rendah, seperti minyak kelapa sawit. Dengan demikian, pemurnian secara fisika terbukti memiliki efisiensi yang lebih tinggi, kerugian yang lebih sedikit (faktor pemurnian (RF) < 1,3), dan biaya operasi yang lebih rendah [55]. Faktor pemurnian (RF) adalah parameter yang digunakan untuk menilai efisiensi dari setiap tahap proses pemurnian. Faktor ini tergantung pada yield produk dan kualitas bahan yang digunakan [53]. Faktor ini dihitung sebagai
berikut :
RF = % oil loss
% FFA (2.1)
Adapun kualitas yang hendak dicapai dari pemurnian CPO menjadi RBDP Olein (Refined Bleached Deodorized Palm Olein) atau minyak goreng sawit menurut Standar Nasional Indonesia diberikan pada Tabel 2.7 berikut.
Tabel 2.7 Standar Mutu CPO dan RBDP Olein menurut SNI [57, 58]
Parameter CPO RBDP Olein
Warna (Lovibond 5 ¼ “ cell) Jingga kemerah - merahan Maks. 5,0/50 Kadar Air dan Kotoran (M&I), % Maks. 0,5 Maks. 0,1 Asam Lemak Bebas (sebagai
asam palmitat), %
Maks 0,5 Maks. 0,3
Sedangkan standar mutu yang umum digunakan pada skala internasional untuk minyak kelapa sawit mentah atau CPO (Crude Palm Oil), yang telah dihilangkan getah dan warnanya atau DBPO (Degummed Bleached Palm Oil), serta yang telah dimurnikan seluruhnya atau RBDPO (Refined Bleached Deodorized Palm Oil) diberikan pada Tabel 2.8 di bawah ini.
Tabel 2.8 Standar Mutu Umum dari CPO, DBPO, dan RBDPO [59]
Parameter CPO DBPO RBDPO
FFA (sebagai palmitat), % 2 – 5 3 – 5 ~ 0,05
M&I, % 0,15 – 3,0 ~ 0,2 ~ 0,02
Warna