UJI TETRAZOLIUM UNTUK KRITERIA
VIGOR BENIH CABAI (
Capsicum annum
)
USI EVILIANI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Uji Tetrazolium untuk Kriteria Vigor Benih Cabai (Capsicum annum) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Usi Eviliani
ABSTRAK
USI EVILIANI. Uji Tetrazolium untuk Kriteria Vigor Benih Cabai (Capsicum annum). Dibimbing oleh ENY WIDAJATI.
Ketersediaan benih cabai (Capsicum annum) unggul bermutu secara kontinyu sangat penting untuk mendapatkan produksi tinggi dengan kualitas prima. Kriteria mutu benih serta evaluasi yang tepat merupakan salah satu kunci utama. Penelitian ini dilakukan untuk memperoleh informasi pola pewarnaan pada pengujian tetrazolium untuk kriteria vigor benih cabai (Capsicum annum) secara cepat untuk menunjang ketersediaan benih. Rancangan yang digunakan adalah rancangan kelompok lengkap teracak dengan 3 ulangan. Konsentrasi tetrazolium yang digunakan 1%. Pengujian pola pewarnaan tetrazolium pada benih cabai (Capsicum annum) menghasilkan 16 pola pewarnaan, kemudian dikelompokkan menjadi 4 kelompok. Keempat kelompok ini dijadikan standar pewarnaan untuk membedakan benih yang berpotensi tumbuh menjadi kecambah normal kuat, kecambah normal kurang kuat, abnormal, dan mati. Tolok ukur daya berkecambah dan berat kering kecambah normal memiliki nilai korelasi tinggi dengan uji tetrazolium. Pola pewarnaan belum dapat digunakan untuk pendugaan vigor benih cabai.
Kata kunci: pola, produksi, tolok ukur.
ABSTRACT
USI EVILIANI. Tetrazolium test for chili’s (Capsicum annum) vigour criteria. Supervised by ENY WIDAJATI.
The continuous availability of superior quality chili seed (Capsicum annum) is very important to get high productions with excellent quality. Criteria for seed quality and proper evaluations are ones of the main keys. This research was conducted to obtain informations on tetrazolium test’s staining pattern for chili (Capsicum annum) seed’s vigor criteria quickly to support the availability of seed.
The design used was a complete group randomized design with 3 replications. Tetrazolium concentration was used 1%. Tetrazolium test’s staining pattern on the chili (Capsicum annum) seed produced 16 staining pattern, which then was grouped into 4 groups. The four group was used as the standard coloring to distinguish the seeds that have the potential to grow into a strong normal seedling, less strong normal seedling, abnormal, and dead. Parameters germination potency and dry weight of normal seedling have a high correlation value with tetrazolium test.
Staining patterns cannot be used yet to estimate chili seed’s vigor.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
UJI TETRAZOLIUM UNTUK KRITERIA
VIGOR BENIH CABAI (
Capsicum annum
)
USI EVILIANI
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
//&3%,!+-3 "3.,2*&/(3/)./%3 , ., 3 *,3 )3 3 (3 3 - 3 0')3
3 3
-./#/3 *&3
,3 ,3 3
*-)3(()3
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT yang memberi kesehatan, hidayah dan kekuatan sehingga karya ilmiah ini dapat diselesaikan dengan baik. Karya ilmiah ini dibuat sebagai salah satu syarat untuk mendapatkan gelar sarjana. Karya ilmiah dengan judul Uji Tetrazolium untuk Kriteria Vigor Benih Cabai (Capsicum annum) secara khusus dilaksanakan memperoleh pola pewarnaan pada uji tetrazolium untuk kriteria vigor benih cabai (Capsicum annum). Kegiatan penelitian dilaksanakan mulai bulan Februari sampai bulan Juni 2015 di laboratorium Ilmu dan Teknologi Benih Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Penulis menyampaikan terima kasih kepada Dr. Ir. Eny Widajati, MS selaku dosen pembimbing yang telah memberikan bimbingan dan pengarahan selama kegiatan penyusunan skripsi. Penulis juga menyampaikan terima kasih kepada Dr. Ir. Faiza C. Suwarno dan Prof. Dr. Ir. Sobir MSi sebagai dosen penguji ujian sidang tugas akhir yang telah memberikan saran terhadap karya ilmiah ini. Penulis juga menyampaikan terima kasih kepada kedua orang tua dan teman-teman yang telah memberikan doa, semangat, motivasi, kasih sayang yang tulus. Semoga karya ilmiah ini bermanfaat dan menambah dunia ilmu pengetahuan.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
TINJAUAN PUSTAKA 2
METODE PENELITIAN 5
Lokasi dan Waktu Penelitian 5
Bahan dan Alat 5
Analisis Data 5
Pelaksanaan Penelitian 6
Pengamatan 7
HASIL DAN PEMBAHASAN 8
Kondisi Umum Benih Cabai (Capsicum annum) 8
Pengujian tetrazolium 9
Pendugaan vigor benih melaui pola pewarnaan tetrazolium 14
Simpulan dan Saran 17
Simpulan 17
Saran 17
DAFTAR PUSTAKA 20
DAFTAR TABEL
1 Rekapitulasi sidik ragam pengaruh lot benih terhadap
parameter viabilitas benih 2
2 Rekapitulasi uji lanjut DMRT pada parameter viabilitas
benih cabai (Capsicum annum) 2
3 Rata-rata pola pewarnaan tetrazolium dengan konsentrasi 1% pada tingkatan viabilitas yang berbeda pada benih cabai
(Capsicum annum) 10
4 Pola pewarnaan tetrazolium pada benih cabai (Capsicum
annum) pada mikroskop dengan perbesaran 4 x 10 11 5 Pola pewarnaan dapat memperlihatkan keadaan embrio
benih cabai (Capsicum annum) dengan perbesaran 4 x 10 14 6 Nilai persamaan regresi, nilai korelasi (r) antara pengujian
langsung dan pengujian tetrazolium 15
7 Nilai persamaan regresi, nilai korelasi (r) antara pengujian langsung dan pola kecambah normal kuat pengujian
tetrazolium 16
DAFTAR GAMBAR
1 Bagian benih cabai 6
2 Struktur benih cabai dengan perbesaran 4 x 10 9
DAFTAR LAMPIRAN
1 Struktur benih tomat (Lycopersicon esculentum) menurut
Bradford (2014) 20
2 Rekapitulasi sidik ragam regresi antara parameter viabilitas
dan uji tetrazolium 20
PENDAHULUAN
Latar Belakang
Cabai (Capsicum annum) merupakan salah satu komoditi hortikultura yang penting untuk dibudidayakan oleh petani Indonesia. Permintaan cabai di pasar semakin meningkat seiring pertumbuhan penduduk Indonesia sehingga produktivitas cabai harus ditingkatkan. Peningkatan produktivitas harus seimbang antara peningkatan kualitas dan kuantitas dari cabai tersebut. Program pemerintah tentang pengadaan benih yang bermutu diperlukan untuk menunjang peningkatan kualitas dan kuantitas komoditas cabai di Indonesia.
Menurut data Badan Pusat Statistik (2014) produksi cabai rawit dengan tangkai tahun 2014 sebesar 0.800 juta ton. Dibandingkan tahun 2013, terjadi kenaikan produksi sebesar 86.98 ribu ton (12.19%). Kenaikan ini disebabkan oleh kenaikan produktivitas sebesar 0.23 ton per hektar (4,04%) dan peningkatan luas panen sebesar 9.76 ribu hektar (7.80%) dibandingkan tahun 2013.
Penggunaan benih bermutu merupakan salah satu faktor penting untuk menunjang produksi yang dihasilkan tanaman cabai. Ketersediaan benih cabai (Capsicum annum) unggul bermutu secara kontinyu sangat penting untuk mendapatkan produksi tinggi dengan kualitas prima. Kriteria mutu benih serta evaluasi yang tepat merupakan salah satu kunci utama. Mutu benih mencakup mutu fisik, mutu genetik dan mutu fisiologis yang informasinya didapatkan melalui pengujian.
Mutu fisiologis benih menggambarkan viabilitas benih. Viabilitas benih merupakan kemampuan hidup benih untuk tumbuh menjadi kecambah normal pada kondisi tertentu. Viabilitas benih dibedakan menjadi viabilitas pada kondisi optimum dan sub optimum (vigor). Parameter viabilitas benih pada kondisi optimum mencakup kemampuan daya berkecambah benih, berat kering kecambah normal, potensi tumbuh maksimum. Viabilitas pada kondisi sub optimum (vigor) mencakup kecepatan tumbuh benih, keserempakan tumbuh benih dan indeks vigor benih.
Pengujian viabilitas benih dapat melalui uji fisiologi dan uji biokemis. Uji fisiologi salah satunya dapat melalui uji daya berkecambah, namun metode tersebut hanya menentukan presentase kecambah normal pada kondisi lingkungan media perkecambahan yang optimum. Metode perkecambahan tersebut relatif memerlukan waktu lama sehingga dapat menunda keputusan hasil pengujian benih. Pengujian viabilitas benih secara biokemis dilakukan dengan menggunakan larutan 2.3.5 trifenil tetrazolium klorida.
2
diharapkan menjadi alternatif pengujian untuk mendapatkan informasi viabilitas benih cabai secara cepat.
Berdasarkan penelitian Dermawan (2007) uji tetrazolium pada benih buncis (Phaseolus vulgaris L.) menghasilkan 40 kemungkinan warna dan dikategorikan menjadi 4 kelompok yang menggambarkan kecambah normal kuat, normal lemah, abnormal, dan mati. Konsentrasi larutan tetrazolium yang digunakan sebesar 1%. Hasil analisis pengujian pola pewarnaan tetrazolium pada benih buncis yang digunakan untuk mengindikasikan vigor benih (Vg) adalah pola 4, dan untuk mengindikasikan viabilitas benih (Vp) adalah pola 2, serta viabilitas total adalah pola 1.
Berdasarkan Dina et al. (2007) uji tetrazolium pada benih kedelai (Glycine max) menghasilkan 10 pola pewarnaan dan pola topografi. Pola yang diperoleh digunakan untuk pendugaan pertumbuhan benih di lapangan. Pola 1,2,3,4 dan pola 1,2,3 pada pengujian tetrazolium mempunyai korelasi yang tinggi dengan pertumbuhan tanaman dan hasil produksi. Pola 1,2,3,4 yaitu seluruh bagian benih berwarna merah atau bergradasi merah muda sampai merah dengan ujung poros embrio merah atau merah tua, menunjukkan benih viabel, sedangkan pola yang lebih spesifik yaitu 1,2,3 dimana pewarnaan pada kotiledon terbentuk merata dan poros embrio berwarna merah dengan atau tanpa merah tua di ujung radikula dikategorikan sebagai pola vigor. Pola 1,2,3,4 dan pola 1,2,3 dapat digunakan untuk mengestimasi pertumbuhan tanaman, tetapi pola 1,2,3 sebagai pola vigor dapat mengestimasi ukuran pertumbuhan tanaman.
Tujuan
Penelitian ini bertujuan untuk memperoleh pola pewarnaan pada uji tetrazolium untuk kriteria vigor benih cabai (Capsicum annum).
TINJAUAN PUSTAKA
Viabilitas benih adalah kemampuan benih untuk dapat tumbuh normal pada keadaan lingkungan tumbuh yang optimal. Viabilitas benih dibagi menjadi viabilitas potensial dan vigor. Viabilitas potensial adalah kemampuan benih untuk tumbuh normal dan berproduksi normal pada kondisi optimum. Vigor merupakan kemampuan benih untuk tumbuh dan berproduksi normal pada kondisi sub optimum. Vigor benih dibagi menjadi vigor kekuatan tumbuh benih yang mencerminkan vigor benih apabila ditanam di lapang dan vigor daya simpan benih yang menunjukkan kemampuan benih untuk berapa lama dapat disimpan. Kecepatan tumbuh benih dan keserempakan tumbuh benih menjadi tolok ukur vigor kekuatan tumbuh benih (Widajati et al. 2012).
Tinggi rendahnya viabilitas potensial bisa diukur dengan daya berkecambah benih dan berat kering kecambah normal. Viabilitas dan vigor benih secara alami akan menurun sejalan dengan meningkatnya suhu dan kadar air benih. Peningkatan kandungan air berhubungan dengan aktivitas metabolik di dalam benih yang melibatkan enzim untuk mengkatalisis cadangan energi di dalam benih (Sadjad 1993).
3 benih. Pengujian fisiologis benih dengan mengamati proses pertumbuhan dan metabolisme benih menjadi kecambah normal di dalam laboratorium dan di lapang dengan keadaan lingkungan yang terkendali. Pengujian selanjutnya menggunakan pengujian biokimiawi dengan mengamati reaksi kimia dengan larutan kimia tertentu untuk mengetahui metabolit dalam benih, sel hidup dan sel mati. Pengamatan anatomi dengan alat bantu mikroskop dengan perbesaran tertentu untuk mengetahui struktur sel dan inti sel pada benih. Pengamatan sitologi dengan mengamati pada organel sel normal kromosom tidak mengalami aberasi. Pengamatan menggunakan pendekatan matematika benih yang ditentukan oleh dimensi waktu periode viabilitas benih yang menunjukkan kecenderungan garis viabilitas dengan fungsi persamaan diferensial (Sadjad 1990).
Faktor yang dapat mempengaruhi viabilitas benih adalah faktor genetik, kerusakan mekanik pada bagian benih, kerusakan yang disebabkan mikroorganisme selama masa penyimpanan benih, kondisi lingkungan seperti suhu, kelembapan, air yang dapat mempengaruhi proses pertumbuhan benih menjadi kecambah. Faktor-faktor tersebut menjadi penentu tingkat keberhasilan pertanaman di lahan sehingga resiko kegagalan pertanaman dapat diminimalkan (Copeland 1976).
Pengujian vigor benih menggunakan tetrazolium yang dilakukan terhadap struktur penting embrio benih dapat memberikan informasi yang lebih lengkap. Vigor benih yang didapat melalui pewarnaan tetrazolium menunjukkan kriteria benih bervigor tinggi, benih bervigor sedang, serta benih bervigor dengan indikator merata atau tidaknya pola pewarnaan endapan formazan. Pengujian tetrazolium dilakukan untuk mengetahui potensi tumbuh maksimum, vigor benih, dan viabilitas benih dari benih yang diuji. Pengujian tetrazolium untuk mengetahui informasi vigor dilakukan dengan berdasarkan kriteria pengamatan viabilitas benih yang lebih ketat dan menunjukkan struktur penting embrio benih (Mugnisjah et al. 1994).
Berdasarkan Dina et al. (2007) kriteria pola dan topografi pewarnaan yang dihasilkan dari pewarnaan tetrazolium yang mengindikasikan viabilitas benih kedelai adalah pola 1 merah cerah pada poros embrio dan merah cerah pada kotiledon, pola 2 merah dengan ujung merah tua pada embrio dan merah pada kotiledon, pola 3 merah cerah dengan ujung merah tua pada embrio dan merah cerah pada kotiledon, pola 4 merah cerah gradasi merah pada embrio merah muda pada kotiledon. Penentuan pola topografi pewarnaan yang menunjukkan vigor benih kedelai menggunakan penghitungan nilai Root Mean Square (RMS) antara pengujian vigor benih di laboratorium meliputi accelerated aging test (AA), indeks vigor (IV), kecepatan tumbuh relatif (KCT) dengan penghitungan laju pertumbuhan kecambah (LPK) dengan hasil uji tetrazolium.
4
viabilitas benih secara cepat dapat dilakukan dengan menggunakan tetrazolium. Pengujian dengan tetrazolium ini belum banyak dikembangkan untuk pendugaan vigor benih. Pola pewarnaan dan intensitas warna merah dari endapan formazan pada bagian embrio benih menjadi acuan untuk menentukan viabilitas dan vigor benih. Benih yang mempunyai viabilitas dan vigor tinggi akan menunjukkan pola pewarnaan yang jelas pada embrio atau struktur penting pada benih yang menentukan pertumbuhan. Benih yang memiliki vigor dan viabilitas rendah ditunjukkan dengan pola pewarnaan yang tidak jelas pada struktur penting embrio benih. Larutan tetrazolium dalam jaringan hidup dengan enzim dehidrogenase akan direduksi oleh ion H+ yang berasal dari aktivitas respirasi menjadi triphenil formazan yang berwarna merah dan tidak larut dalam air. Warna endapan formazan semakin merah menunjukkan semakin banyak H2 yang terlibat dalam reaksi kimia.
Uji tetrazolium untuk beberapa jenis benih seperti benih dengan testa keras perlu perlakuan pendahuluan dengan merendam benih dalam akuades dan dilakukan skarifikasi. Pengujian tetrazolium tidak boleh terkena sinar matahari langsung karena dapat terjadi reduksi pada larutan tetrazolium sehingga akan mengurangi efektivitas dari garam tetrazolium. Temperatur pewarnaan dalam uji tetrazolium 20–40 0C, jika temperature optimum 30 0C tidak digunakan sebagai acuan, maka penyesuaian lama waktu pewarnaan harus dibuat. Penambahan atau pengurangan suhu 50 0C dari suhu optimum (30 0C) dapat mengurangi atau menambah waktu menjadi satu setengah jam. Konsentrasi larutan tetrazolium yang digunakan harus sesuai yang dianjurkan. Pewarnaan dengan garam tetrazolium yang terlalu tinggi konsentrasinya dapat menyembunyikan perbedaan pola pewarnaan seperti benih yang lemah dan kerusakan spesifik seperti embun beku pada benih. Konsentrasi yang dianjurkan untuk benih cabai sebesar 1%. Periode pewarnaan tidak bisa dinyatakan secara mutlak, karena bisa berbeda berdasarkan kondisi benih yang diuji. Periode pewarnaan dapat berkelanjutan jika benih belum selesai proses pewarnaannya. Hal tersebut dilakukan agar dapat memeriksa kembali kekurangan pewarnaan karena pengambilan benih yang lambat dari larutan garam tetrazolium akibat adanya indikasi kerusakan dalam benih (ISTA 2014).
5 METODE PENELITIAN
Lokasi dan Waktu Penelitian
Percobaan ini dilakukan di Laboratorium Ilmu dan Teknologi Benih Departemen Agronomi dan Hortikultura Fakultas Pertanian Institut Pertanian Bogor, mulai bulan Februari sampai dengan Juni 2015.
Bahan dan Alat
Bahan yang digunakan untuk penelitian meliputi benih cabai varietas Taruna. Benih cabai dengan tingkat viabilitas V1 = 71.33%, V2 = 64%, V3 = 58%, V4 = 46.67% yang di dapatkan melalui penurunan viabilitas secara alami dengan penyimpanan yang diuji per bulan selama 4 bulan. Bahan kimia yang digunakan yaitu larutan tetrazolium 1%. Bahan penunjang lainnya yaitu akuades, plastik PE, alumunium foil.
Alat-alat yang digunakan adalah gelas ukur, gunting kuku, label, selotip, cawan petri, gunting, sprayer, alat pengecambah benih APB tipe IPB 73-2A, silet, oven, mikroskop, kamera, dan peralatan ATK.
Analisis Data
Rancangan percobaan yang digunakan dalam penelitian adalah menggunakan rancangan kelompok lengkap teracak (RKLT) dengan satu faktor yaitu tingkat viabilitas (V1, V2, V3, V4). Menurut Walpole (1992) model
αi : Pengaruh tingkat viabilitas benih ke-i
βj : Pengaruh kelompok (lot) benih ke-j
Εij : Pengaruh galat tingkat viabilitas benih pada taraf ke-i dan kelompok (lot) benih pada taraf ke-j
Selain itu menggunakan analisis regresi linier sederhana untuk mengetahui hubungan antara pengukuran vigor yang diamati dengan hasil uji tetrazolium. Berdasarkan Walpole (1992) rancangan regresi menggunakan persamaan:
Y = a + b X Keterangan: Y: nilai vigor yang diduga
a: titik potong garis dengan sumbu Y b: kemiringan garis
X: nilai vigor yang diukur dengan tetrazolium
6
sumbu Y adalah nilai vigor yang diduga. Nilai koefisien korelasi (r) digunakan untuk melihat keeratan hubungan antara nilai vigor yang diduga dengan nilai vigor yang diukur dengan tetrazolium. Nilai koefisien mendekati 1 (r 1) menggambarkan adanya keeratan hubungan atau korelasi antara pola pada nilai vigor yang diduga dengan nilai vigor yang diukur dengan tetrazolium.
Pelaksanaan Penelitian
Pembuatan larutan tetrazolium
Tetrazolium 1% diperoleh dengan mencampur 1 gram tetrazolium dengan 100 ml akuades dalam gelas ukur kemudian gelas ukur ditutup disimpan ke dalam lemari pendingin dan dilapisi alumunium foil untuk menghindari terkena cahaya langsung.
Pengujian tetrazolium
Pengujian tetrazolium ini dilakukan pada setiap lot benih dengan perlakuan pendahuluan pelembaban. Pelembaban dilakukan dengan cara merendam benih selama 18 jam dalam air dengan suhu 20 0C. Benih yang telah direndam kemudian ditiriskan dan dikering anginkan di atas kertas. Proses selanjutnya dilakukan
skarifikasi yaitu dengan pelukaan benih dengan memotong bagian testa benih antara radikula dan kotiledon (Gambar 1).
Benih yang telah diskarifikasi direndam dengan menggunakan larutan tetrazolium 1% pada suhu 30 0C selama kurang lebih 6 jam. Benih dibelah secara membujur menjadi dua dan dilakukan pengamatan struktur pewarnaan tetrazolium pada embrio benih dengan menggunakan mikroskop stereo dengan perbesaran 4 x 10.
Pengujian viabilitas dan vigor benih dengan indikasi langsung.
Tolok ukur yang diamati meliputi daya berkecambah (DB), berat kering kecambah normal (BKKN), indeks vigor (IV), kecepatan tumbuh (KCT). Pengamatan presentase benih berkecambah pertama pada hari ke-7 dan pengamatan kedua pada hari ke-14 sesuai dengan ketentuan yang telah ditetapkan ISTA. Pengecambahan benih dilakukan dengan menggunakan metode uji di atas kertas (UDK) setiap bulan selama 4 bulan dengan menggunakan alat
Radikula
Kotiledon Bagian yang
dipotong
7 pengecambah benih IPB 73-2A. Jumlah benih yang ditanam sebanyak 50 butir dengan 3 ulangan.
Pengamatan
Daya Berkecambah (DB)
Daya berkecambah adalah kemampuan benih untuk tumbuh menjadi kecambah normal dalam lingkungan tumbuh yang optimum. Daya berkecambah dihitung berdasarkan jumlah kecambah normal pada hitungan pertama yaitu hari ke-7 dan hitungan kedua yaitu hari ke-14 setelah penanaman (ISTA 2014)
Keterangan :
KN 1 : Kecambah Normal pada hitungan I KN 2 : Kecambah Normal pada hitungan II Bobot Kering Kecambah Normal (BKKN)
Seluruh kecambah normal dibungkus dengan menggunakan kertas kemudian di oven pada suhu 60 0C selama 3 x 24 jam. Selanjutnya kecambah dimasukkan ke dalam desikator ± 30 menit dan ditimbang. Pengujian ini dilakukan dua kali pengovenan kecambah normal pada pengamatan kecambah normal umur 7 hari dan 14 hari.
Kecepatan Tumbuh (KCT)
Benih yang lebih cepat tumbuh menunjukkan benih tersebut memiliki vigor yang lebih tinggi. Pengujian kecepatan tumbuh (KCT) dilakukan dengan mengambil dan menghitung kecambah normal setiap etmal (24 jam) mulai dari hari pertama penanaman hingga hari ke-14. Nilai KCT menunjukkan presentase rata-rata kecambah yang tumbuh setiap hari. Semakin tinggi nilai KCT semakin tinggi juga vigor lot benih tersebut. Menurut Sadjad (1999) rumus penghitungan kecepatan tumbuh adalah
Keterangan:
KCT : kecepatan tumbuh (%KN/etmal)
N : presentase kecambah normal setiap waktu pengamatan t : waktu pengamatan
tn : waktu akhir pengamatan Indeks Vigor (IV)
8
Pola pewarnaan tetrazolium
Pengamatan dilakukan berdasarkan intensitas dan lokasi pewarnaan yang terbentuk pada benih cabai yang dihubungkan dengan struktur anatomi benih cabai untuk mengetahui benih viabel dan non viabel. Topografi pewarnaan dilihat dengan menggunakan mikroskop kemudian pengambilan gambar pola pewarnaan dengan menggunakan kamera. Standar pewarnaan dibuat untuk membedakan antara benih yang berpotensi tumbuh menjadi kecambah normal kuat, kecambah normal kurang kuat, abnormal, dan mati.
HASIL DAN PEMBAHASAN
Kondisi Umum Benih Cabai (Capsicum annum)
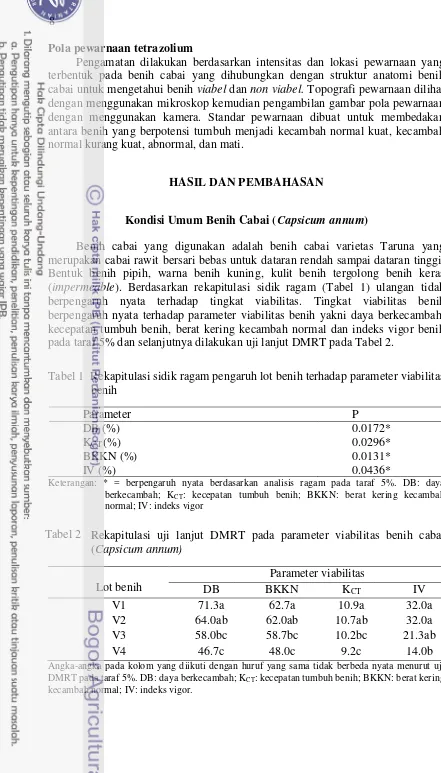
Benih cabai yang digunakan adalah benih cabai varietas Taruna yang merupakan cabai rawit bersari bebas untuk dataran rendah sampai dataran tinggi. Bentuk benih pipih, warna benih kuning, kulit benih tergolong benih keras (impermeable). Berdasarkan rekapitulasi sidik ragam (Tabel 1) ulangan tidak berpengaruh nyata terhadap tingkat viabilitas. Tingkat viabilitas benih berpengaruh nyata terhadap parameter viabilitas benih yakni daya berkecambah, kecepatan tumbuh benih, berat kering kecambah normal dan indeks vigor benih pada taraf 5% dan selanjutnya dilakukan uji lanjut DMRT pada Tabel 2.
Tabel 1 Rekapitulasi sidik ragam pengaruh lot benih terhadap parameter viabilitas benih DMRT pada taraf 5%. DB: daya berkecambah; KCT: kecepatan tumbuh benih; BKKN: berat kering
kecambah normal; IV: indeks vigor.
9 Berdasarkan rekapitulasi uji lanjut DMRT menunjukkan bahwa lot benih V1 merupakan hasil tertinggi, namun tidak berbeda dengan V2 tetapi berbeda dengan V3 dan V4. Lot benih V4 merupakan lot yang terendah. Uji lanjut DMRT pada parameter viabilitas daya berkecambah, kecepatan tumbuh benih, dan indeks vigor benih menunjukkan hasil yang sama. Hasil uji lanjut DMRT parameter daya berkecambah benih yang paling sensitif menunjukkan beda yang signifikan antar lot benih pada tingkat viabilitas yang berbeda. Hasil uji lanjut DMRT pada parameter daya berkecambah dapat menduga pertumbuhan benih di lapang jika kondisi lapang optimum. Menurut pendapat Kulik dan Yaklich (1982) pendugaan perkecambahan di lapangan dibedakan menjadi estimating potential field emergence (E) dan predicting field emergence (P). Pada E ≥ 80% diperkirakan (Lycopersicon esculentum) Bradford (2004) (Lampiran 1) meliputi testa, kotiledon dan embrio yang menjadi satu dengan endosperm benih. Bagian terpenting pada embrio benih adalah radikula yang menentukan tumbuh atau tidaknya benih. Jaringan keras terdapat pada kulit benih yang dapat menghalangi munculnya radikula. Munculnya radikula pada proses perkecambahan benih ditentukan oleh keseimbangan antara potensi pertumbuhan embrio dan ketahanan mekanik dari endosperma. Endosperma juga merupakan bagian penting benih dalam menentukan jumlah nutrisi yang masuk pada benih saat pertumbuhan embrio setelah perkecambahan (Martinez et al. 2012)
Pola pewarnaan yang terbentuk pada jaringan hidup benih cabai saat pengujian merupakan aktivitas ion H+ mereduksi larutan tetrazolium menjadi triphenyl formazan yang berwarna merah dan tidak larut dalam air. Pembentukan pola pewarnaan pada benih didahului dengan proses imbibisi larutan tetrazolium pada bagian benih. Waktu yang diperlukan imbibisi larutan pada benih tergantung pada jenis benih yang diuji. Waktu perendaman benih cabai (Capsicum annum) untuk imbibisi larutan tetrazolium mengacu pada Widajati et al. (2013). Menurut Budiarti (2002) jika pola endapan formazan semakin jelas menunjukkan semakin banyak H2 yang terlibat dalam reaksi kimia saat proses pewarnaan.
Gambar 2 Struktur benih cabai dengan perbesaran 4 x 10 Testa
Endosperma Kotiledon
10
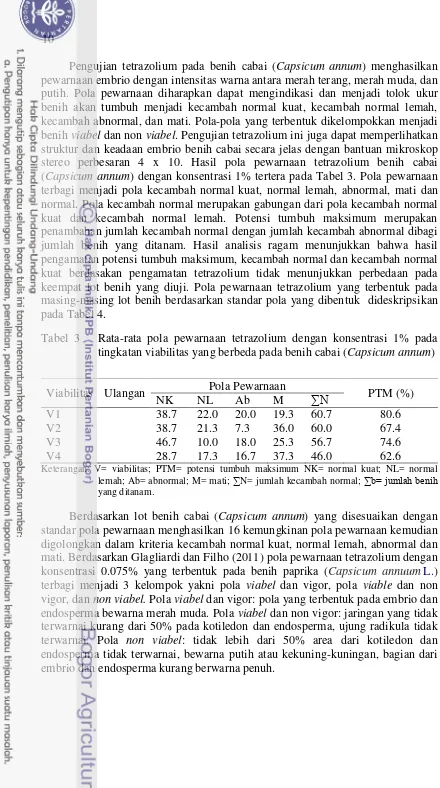
Pengujian tetrazolium pada benih cabai (Capsicum annum) menghasilkan pewarnaan embrio dengan intensitas warna antara merah terang, merah muda, dan putih. Pola pewarnaan diharapkan dapat mengindikasi dan menjadi tolok ukur benih akan tumbuh menjadi kecambah normal kuat, kecambah normal lemah, kecambah abnormal, dan mati. Pola-pola yang terbentuk dikelompokkan menjadi benih viabel dan non viabel. Pengujian tetrazolium ini juga dapat memperlihatkan struktur dan keadaan embrio benih cabai secara jelas dengan bantuan mikroskop stereo perbesaran 4 x 10. Hasil pola pewarnaan tetrazolium benih cabai (Capsicum annum) dengan konsentrasi 1% tertera pada Tabel 3. Pola pewarnaan terbagi menjadi pola kecambah normal kuat, normal lemah, abnormal, mati dan normal. Pola kecambah normal merupakan gabungan dari pola kecambah normal kuat dan kecambah normal lemah. Potensi tumbuh maksimum merupakan penambahan jumlah kecambah normal dengan jumlah kecambah abnormal dibagi jumlah benih yang ditanam. Hasil analisis ragam menunjukkan bahwa hasil pengamatan potensi tumbuh maksimum, kecambah normal dan kecambah normal kuat berdasakan pengamatan tetrazolium tidak menunjukkan perbedaan pada keempat lot benih yang diuji. Pola pewarnaan tetrazolium yang terbentuk pada masing-masing lot benih berdasarkan standar pola yang dibentuk dideskripsikan pada Tabel 4.
Tabel 3 Rata-rata pola pewarnaan tetrazolium dengan konsentrasi 1% pada tingkatan viabilitas yang berbeda pada benih cabai (Capsicum annum)
Viabilitas Ulangan Pola Pewarnaan PTM (%)
NK NL Ab M ∑N lemah; Ab= abnormal; M= mati; ∑N= jumlah kecambah normal; ∑b= jumlah benih yang ditanam.
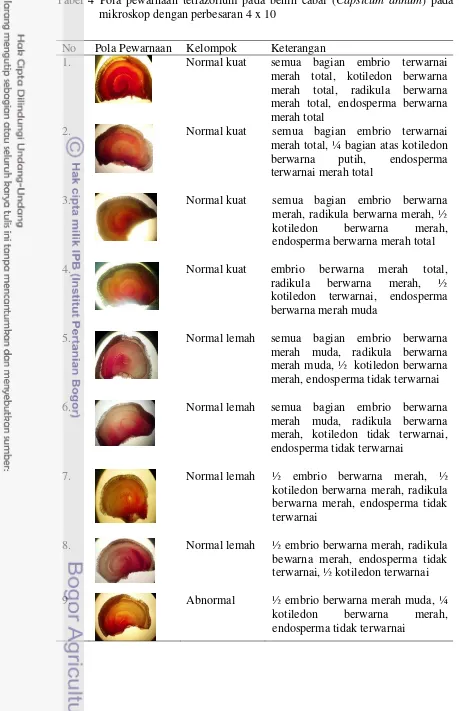
11 Tabel 4 Pola pewarnaan tetrazolium pada benih cabai (Capsicum annum) pada
mikroskop dengan perbesaran 4 x 10
No Pola Pewarnaan Kelompok Keterangan
1. Normal kuat semua bagian embrio terwarnai
merah total, kotiledon berwarna merah total, radikula berwarna merah total, endosperma berwarna merah total
2. Normal kuat semua bagian embrio terwarnai
merah total, ¼ bagian atas kotiledon berwarna putih, endosperma terwarnai merah total
3. Normal kuat semua bagian embrio berwarna
merah, radikula berwarna merah, ½ kotiledon berwarna merah, endosperma berwarna merah total
4. Normal kuat embrio berwarna merah total,
radikula berwarna merah, ½ kotiledon terwarnai, endosperma berwarna merah muda
5. Normal lemah semua bagian embrio berwarna
merah muda, radikula berwarna merah muda, ½ kotiledon berwarna merah, endosperma tidak terwarnai
6. Normal lemah semua bagian embrio berwarna
merah muda, radikula berwarna merah, kotiledon tidak terwarnai, endosperma tidak terwarnai
7. Normal lemah ½ embrio berwarna merah, ½
kotiledon berwarna merah, radikula berwarna merah, endosperma tidak terwarnai
8. Normal lemah ½ embrio berwarna merah, radikula bewarna merah, endosperma tidak terwarnai, ½ kotiledon terwarnai
9. Abnormal ½ embrio berwarna merah muda, ¼
12
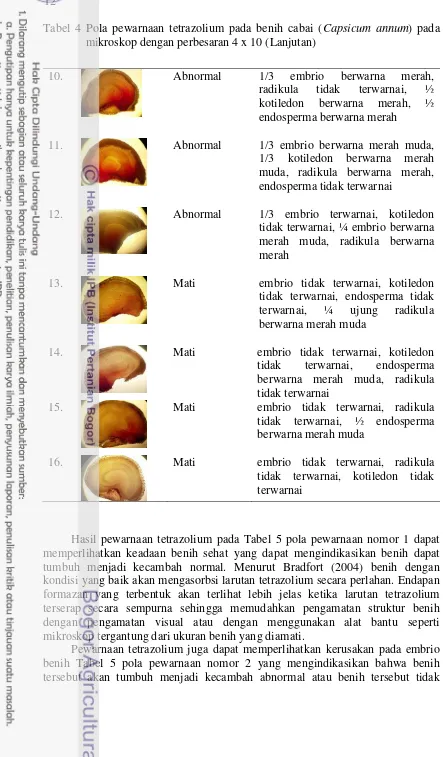
Tabel 4 Pola pewarnaan tetrazolium pada benih cabai (Capsicum annum) pada mikroskop dengan perbesaran 4 x 10 (Lanjutan)
10. Abnormal 1/3 embrio berwarna merah,
radikula tidak terwarnai, ½ kotiledon berwarna merah, ½ endosperma berwarna merah
11. Abnormal 1/3 embrio berwarna merah muda,
1/3 kotiledon berwarna merah muda, radikula berwarna merah, endosperma tidak terwarnai
12. Abnormal 1/3 embrio terwarnai, kotiledon
tidak terwarnai, ¼ embrio berwarna merah muda, radikula berwarna merah
13. Mati embrio tidak terwarnai, kotiledon
tidak terwarnai, endosperma tidak terwarnai, ¼ ujung radikula berwarna merah muda
14. Mati embrio tidak terwarnai, kotiledon
tidak terwarnai, endosperma berwarna merah muda, radikula tidak terwarnai
15. Mati embrio tidak terwarnai, radikula
tidak terwarnai, ½ endosperma berwarna merah muda
16. Mati embrio tidak terwarnai, radikula
tidak terwarnai, kotiledon tidak terwarnai
Hasil pewarnaan tetrazolium pada Tabel 5 pola pewarnaan nomor 1 dapat memperlihatkan keadaan benih sehat yang dapat mengindikasikan benih dapat tumbuh menjadi kecambah normal. Menurut Bradfort (2004) benih dengan kondisi yang baik akan mengasorbsi larutan tetrazolium secara perlahan. Endapan formazan yang terbentuk akan terlihat lebih jelas ketika larutan tetrazolium terserap secara sempurna sehingga memudahkan pengamatan struktur benih dengan pengamatan visual atau dengan menggunakan alat bantu seperti mikroskop tergantung dari ukuran benih yang diamati.
13 tumbuh. Kerusakan yang terjadi pada bagian embrio benih tersebut dapat disebabkan oleh serangan cendawan dikarenakan pada saat penyimpanan tidak ada bahan pelapis kimia yang melindungi benih dari serangan cendawan atau hama. Menurut Leist (2004) bagian kotiledon benih yang berdekatan dengan bagian radikula merupakan bagian penting benih setelah embrio benih. Jika area tersebut tidak terwarnai saat pengujian menggunakan tetrazolium mengindikasikan bahwa benih yang diuji tersebut mengalami kerusakan dan diasumsikan bahwa benih tersebut tidak akan tumbuh menjadi kecambah normal. Pada saat pengamatan dapat diketahui kondisi benih sehat dan benih tidak sehat melalui pewarnaan embrio benih dengan menggunakan tetrazolium.
Benih yang tidak terwarnai pada Tabel 5 pola pewarnaan nomor 3 mengindikasikan bahwa benih tidak dapat tumbuh menjadi kecambah atau mati. Menurut Copeland (2001) larutan garam tetrazolium klorida tidak bereaksi dengan enzim dehidrogenase pada jaringan yang mati sehingga pada saat benih yang mati direndam dalam larutan tetrazolium tidak akan terjadi reaksi sehingga benih tetap bewarna putih.
Pengujian tetrazolium dengan tiga ulangan juga menghasilkan pola dan intensitas pewarnaan yang berbeda antar ulangan. Hal ini disebabkan oleh kemampuan imbibisi larutan tetrazolium antar benih yang berbeda. Kemampuan imbibisi ini dipengaruhi oleh testa benih yang keras dan pemotongan bagian benih antara radikula dan kotiledon yang tidak seragam. Terlihat pada Tabel 5 pola pewarnaan nomor 4 memperlihatkan pewarnaan tidak terjadi pada seluruh bagian benih, pewarnaan formazan terdapat pada bagian penting benih seperti radikula sehingga dapat mengindikasikan benih tersebut dapat tumbuh menjadi kecambah.
Menurut Widajati et al. (2013) luas dari bagian merah merupakan jaringan hidup dan luas dari bagian benih yang tidak terwarnai merupakan jaringan mati atau jaringan nekrotik serta daerah di mana jaringan nekrotik berada memberikan informasi yang sangat menentukan untuk mengkategorikan apakah benih tersebut hidup atau mati. Evaluasi yang dilakukan untuk penentuan daerah maksimum yang tidak terwarnai tidak diberlakukan dalam uji tetrazolium pada famili Solanaceae yaitu tomat (Lycopersicon esculentum), cabai (Capsicum annum), terong (Solanum melongena).
14
Tabel 5 Pola pewarnaan dapat memperlihatkan keadaan embrio benih cabai (Capsicum annum) dengan perbesaran 4 x 10
No Pola pewarnaan Keterangan
1. benih mengalami kerusakan pada bagian embrio dengan tidak terwarnai seluruh bagian embrio sehingga dapat diduga bahwa benih tidak akan tumbuh menjadi kecambah normal bahkan menunjukkan benih tersebut mati
2. kondisi benih sehat dengan terwarnai seluruhnya bagian benih mencakup embrio, kotiledon, radikula, dan endosperma sehingga dapat diduga bahwa benih tersebut akan tumbuh menjadi kecambah normal
3. benih yang tidak terwarnai setelah benih direndam kedalam larutan tetrazolium yang mengindikasikan bahwa benih tersebut mati
4. bagian benih terwarnai sebagian namun benih dapat diindikasikan dapat tumbuh menjadi kecambah normal lemah karena bagian terpenting benih yakni radikula dan bagian benih yang berdekatan dengan radikula terwarnai
Pendugaan Vigor Benih melalui Pola Pewarnaan Tetrazolium
Pendekatan analisis korelasi regresi antara nilai vigor yang diduga dengan nilai vigor yang diukur dengan tetrazolium. Sebagai sumbu X adalah nilai vigor yang di ukur dengan tetrazolium sedangkan sumbu Y adalah nilai vigor yang diduga. Nilai koefisien korelasi (r) digunakan untuk melihat keeratan hubungan antara nilai vigor yang diduga dengan nilai vigor yang diukur dengan tetrazolium. Nilai koefisien mendekati 1 (r 1) menggambarkan adanya keeratan hubungan atau korelasi antara pola pada nilai vigor yang diduga dengan nilai vigor yang diukur dengan tetrazolium (Mattjik 2002).
Analisis korelasi yang dilakukan pada masing-masing lot benih yang dibagi berdasarkan vigor benih. Nilai koefisien korelasi yang mendekati 1 (r→1.00) pada masing-masing lot vigor dianggap paling sesuai digunakan sebagai standar pola pewarnaan. Nilai tersebut memiliki nilai kedekatan antara pengujian langsung dan pengujian tidak langsung (tetrazolium). Nilai korelasi dan regresi yang didapatkan antara parameter viabilitas benih dan pengujian tetrazolium tertera pada Tabel 6. Rekapitulasi sidik ragam uji regresi telampir pada Lampiran 2.
15 IV mempunyai hubungan positif dengan pengujian tetrazolium. Parameter viabilitas yang memiliki keeratan hubungan dengan pengujian tetrazolium terdapat pada parameter daya berkecambah dan berat kering kecambah normal. Nilai korelasi antara masing-masing parameter viabilitas benih dan pengujian tetrazolium diperoleh nilai koefisien tertinggi untuk peubah vigor benih cabai (Capsicum annum) terdapat pada parameter BKKN dengan nilai sebesar 0.699. Nilai tersebut mendekati 1 sehingga menunjukkan hubungan positif dan p-value
menunjukkan nilai 0.01 ini berarti menunjukkan hubungan yang erat antara berat kering kecambah normal pengujian langsung dan pengujian tetrazolium. Berdasarkan Akbudak dan Bolkan (2010) nilai koefisien korelasi antara standar perkecambahan untuk prediksi perkecambahan lot benih tomat dengan uji tetrazolium sebesar 0.631. Uji tetrazolium dapat dijadikan standar perkecambahan untuk memprediksi munculnya kecambah normal.
Tabel 6 Nilai persamaan regresi, nilai korelasi (r) antara pengujian langsung dan pengujian tetrazolium
Parameter viabilitas Persamaan regresi r P
DB DB = 15.8 + 0.405 ttz 0.601 0.039*
BKKN BKKN = 22.6 + 167.9 ttz 0.699 0.011*
KCT KCT = 13.7 + 0.377 ttz 0.423 0.171tn
IV IV = 22.7 + 0.418 ttz 0.518 0.085tn
Keterangan: r= koefisien korelasi, *= berpengaruh nyata, tn = tidak berpengaruh nyata pada taraf
5%, angka pada kolom yang sama diperbandingkan secara vertikal. DB: daya berkecambah; KCT: kecepatan tumbuh benih; BKKN: berat kering kecambah normal;
IV: indeks vigor.
Hasil uji korelasi antara pengujian langsung dan pola kecambah normal kuat pengujian tetrazolium pada Tabel 7 menunjukkan tidak ada parameter yang memiliki nilai korelasi tinggi. Nilai p-value > 0.05 dari semua parameter viabilitas menunjukkan tidak adanya hubungan dari parameter viabilitas dengan uji tetrazolium. Hal ini menunjukkan bahwa pada penelitian pola pewarnaan yang dihasilkan dari uji tetrazolium belum dapat digunakan untuk pendugaan vigor benih cabai (Capsicum annum). Menurut Dina et al. (2007) rendahnya hubungan korelasi antara hasil uji tetrazolium benih kedelai dan accelerated aging test
diduga karena adanya benih keras. Menurut ISTA (2003) pengujian tertrazolium menggunakan benih keras harus dilakukan pelukaan pada bagian kotiledon benih dan dilakukan perendaman kembali pada larutan tetrazolium.
16
Menurut Patin dan Dadladi (2014) temperatur perendaman benih dalam larutan tetrazolium pada suhu 20 0C sampai 40 0C tidak memiliki efek akurat uji tetrazolium tetapi proses pewarnaan uji tetrazolium yang cepat pada temperatur tinggi. Perbedaan pewarnaan antara benih normal dan abnormal sulit dibedakan.
Menurut Grancharova et al. (2011) famili Solanaceae mempunyai ukuran embrio yang kecil. Terdapat placenta pada embrio benih sehingga larutan tetrazolium tidak dapat terimbibisi secara optimal ke dalam embrio benih.
Pola kecambah normal kuat dapat menduga vigor benih. Hal ini berhubungan dengan proses respirasi yang terdapat pada benih. Menurut Budiarti (2002) respirasi benih dapat menggambarkan tingkat viabilitas dan vigor benih, semakin tinggi tingkat respirasi benih maka semakin tinggi viabitas benih. Viabilitas benih dapat diduga dari keadaan benih yang memiliki embrio sehat. Benih yang sehat dapat mengimbibisi larutan tetrazolium secara sempurna yang terlihat pada pola pewarnaan tetrazolium yang penuh pada bagian terpenting benih. Pola pewarnaan kecambah normal kuat dengan warna formazan merah total mendeskripsikan jaringan pada benih hidup.
Tabel 7 Nilai persamaan regresi, nilai korelasi (r) antara pengujian langsung dan pola kecambah normal kuat pengujian tetrazolium
Parameter viabilitas Persamaan regresi r P
DB DB = 14.4 + 0.157 ttz 0.182 0.571tn
Pada jaringan hidup terdapat energi yang dihasilkan dari proses respirasi. Proses respirasi melibatkan sel hidup untuk mengambil oksigen dari udara atau air dan mempergunakannya dalam proses oksidasi sehingga energi yang dihasilkan dalam bentuk panas. Proses respirasi benih menghasilkan ion H+, semakin banyak ion H+ yang terlibat dalam proses pewarnaan tetrazolium semakin jelas pola pewarnaan yang terbentuk. Benih yang sedang berkecambah menggunakan karbohidrat untuk proses oksidasi dalam menghasilkan energi (Byrd 1986). Energi yang dihasilkan tergantung dari cadangan makanan dalam kotiledon benih. Energi tersebut digunakan benih untuk berkecambah sehingga benih yang memiliki kotiledon, radikula, embrio, endosperma yang baik dapat tumbuh menjadi kecambah normal. Keadaan benih tersebut dapat terlihat dari proses pewarnaan benih menggunakan tetrazolium. Berdasarkan Black dan Blewle (2006) benih menyerap oksigen reaktif yang dihasilkan dari molekul oksigen yang sangat reaktif dan biasanya bersifat elektrofilik.
17 koefisien korelasi (r) dari persamaan antara tolok ukur pengujian tetrazolium dengan tolok ukur pengujian langsung yang sama. Tolok ukur pengujian tetrazolium sebagai sumbu X dan tolok ukur pengujian langsung menjadi sumbu Y. Keeratan hubungan antara tolok ukur pengujian tetrazolium dengan tolok ukur pengujian langsung diketahui dari nilai koefisien korelasi. Nilai koefisien korelasi berkisar antara -1 dan +1. Signifikansi hubungan antara kedua peubah dinyatakan dengan nilai p-value. Nilai p-value < 0.05 menunjukkan adanya hubungan yang erat antar kedua peubah tersebut, yang arahnya ditunjukkan oleh tanda koefisien korelasinya (positif: hubungan searah; negatif: hubungan berlawanan).
SIMPULAN DAN SARAN
Simpulan
Pengujian pola pewarnaan menggunakan tetrazolium dengan konsentrasi 1% pada benih cabai (Capsicum annum) menghasilkan 16 pola pewarnaan, kemudian dikelompokkan menjadi 4 kelompok yang dijadikan standar pewarnaan untuk membedakan benih yang berpotensi tumbuh menjadi kecambah normal kuat, kecambah normal kurang kuat, abnormal, dan mati. Parameter yang memiliki nilai korelasi tinggi dengan uji tetrazolium adalah daya berkecambah dan berat kering kecambah normal. Pola pewarnaan belum dapat digunakan untuk pendugaan vigor benih cabai.
Saran
Perlu dilakukan pelukaan benih secara tepat untuk mengoptimalkan proses imbibisi larutan tetrazolium pada benih. Penelitian lanjutan disarankan menggunakan larutan penyangga (buffer) dan pola yang lebih banyak terhadap beragam varietas benih cabai yang ada.
DAFTAR PUSTAKA
Akbudak N, Bolkan H. 2010. Diagnostic method for predicting tomato seedling emergence. Journal of Food, Agriculture and Environtment. 8(1): 170-174. Black M, Bewley JD, Halmer P. 2006. The Encyclopedia of Seeds. Science,
Tehcnology and Uses. Wallington (UK): CAB International Pr. 828 hlm. [BPS] Badan Pusat Statistik. 2014. Produksi Cabai Besar, Cabai Rawit dan
Bawang Merah Tahun 2014. [Internet]. [diakses pada tanggal 2 Desember 2015]. Tersedia pada: bps.go.id.
Bradford KJ. 2004. Seed Production an Quality. California (USA): University of California Pr. 126 hlm.
18
Byrd HW. 1986. Pedoman Teknologi Benih. Hamidin A, penerjemah. Jakarta (ID): PT Pembimbing Masa. Terjemahan dari: Seed Technology Handbook. 26 hlm.
Copeland LO, McDonald MB. 2001. Principles of seed science and technology. Fourth edition. London (Eng): Kluwer Academic Pr. 401 hlm.
Dermawan M. 2007. Studi pengujian tetrazolium sebagai peubah viabilitas benih buncis (Phaseolus vulgaris L.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Dina, Widajati E, Wirawan B, Ilyas S. 2007. Pola topografi pewarnaan tetrazolium sebagai tolok ukur viabilitas dan vigor benih kedelai (Glycine max L. Merr) Bul. Agron. (35) (2) 88-95.
Glagliardi B, Filho JM. 2011. Assesment of the physiological potential of bell pepper seeds and relationship with seedling emergence. Revista Brasileira de Sementes. 33(1): 162-170.
Grancharova PY, Tsvetkova EY, Baldjiev G, Barragan MC. 2011. Reproductive biology of Atropa belladonna: embryological features, pollen and seed viability. Phytologia Balcanica. 17 (1): 101 –112.
[ISTA] International Seed Testing Association. 2004. Seed Science and Technology. International Rules for Seed Testing. Zurich: International Seed Testing Association.
[ISTA] International Seed Testing Association. 2014. ISTA Working Sheets on Tetrazolium Testing. Seed Science and Technology. Zurich : International Seed Testing Association.
Kulik MM, Yaklich RW. 1982. Evaluation of vigor tests in soybean seeds: relationship of accelerated aging, cold, sand bench, and speed of germination tests to field performance. Crop Sci. 22: 766-770.
Leist N. 2004. Seed Vigour Determination by Means of the Topographical Tetrazolium Test. Makalah dalam ISTA Seed Quality Assesment Training Organised by APSA, Hanoi, Vietnam.
Martinez AC, Pluskota WE, Bassel GW, Asahina M, Pupel P, Nguyen TT, Takeda KN, Toubiana D, Bai B, Gorecki RJ , Fait A, Yamaguchi S, Nonogaki H. 2012. The mechanisms of hormonal regulation of endosperm cap-specific gene expression in tomato seeds. Seed biology in the 21st century: perspectives and new directions. The Plant Journal. 71, 575-586. Mattjik AA, Sumertajaya IM. 2002. Perancangan Percobaan dengan Aplikasi SAS
dan Minitab Jilid I. Bogor (ID): IPB Pr. 350 hlm.
Mugnisjah WQ, Setiawan A, Suwarto, Santiwa C. 1994. Panduan Praktikum dan Penelitian Bidang Ilmu dan Teknologi Benih. Jakarta (ID): RajaGrafindo Persada. 201 hlm.
Patin VN, Dadladi M. 2014. Tetrazolium Test for Seed Viability and Vigour. [Internet]. [diakses pada tanggal 7 November 2015]. Tersedia pada: http//seednet. gov. In/Chapter%252014.pdf.
Sadjad S. 1993. Dari benih kepada benih. Jakarta (ID): Grasindo. 143 hlm.
Sadjad S, Murniati E, Ilyas S. 1990. Parameter pengujian vigor benih. Jakarta (ID) Grasindo. 35 hlm.
19 Widajati E, Murniati E, Palupi ER, Kartika T, Suhartanto MR, Qadir A. 2013.
20
LAMPIRAN
Lampiran 1 Struktur benih tomat (Lycopersicon esculentum) menurut Bradford (2014)
Lampiran 2 Rekapitulasi sidik ragam regresi antara parameter viabilitas dan uji tetrazolium
Parameter Viabilitas Sumber db KT F P
DB regresi 1 66.1 5.7 0.03
galat 10 11.7
KCT regresi 1 32.7 2.9 0.17
galat 10 15.0
BKKN regresi 1 89.3 9.5 0.01
galat 10 9.4
IV regresi 1 49.1 3.7 0.08
galat 10 13.4
Keterangan: DB= daya berkecambah; KCT= kecepatan tumbuh; BKKN= berat kering
21
Riwayat Hidup
Penulis dilahirkan di Kediri pada tanggal 8 Juni 1993 dari ayah Kuswari dan ibu Djiati. Penulis adalah putri kedua dari lima bersaudara. Tahun 2011 penulis lulus dari SMA Negeri 5 Kediri dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor dan diterima di Departemen Agronomi dan Hortikultura, Fakultas Pertanian.