Lampiran 1. Bagan Percobaan
Lampiran 2. Bagan tanaman per plot
Lampiran 3. Deskripsi Varietas Kedelai Grobogan
Nama Varietas : Grobogan
SK : 238/Kpts/SR.120/3/2008
Tahun : 2008
Tetua : Pemurnian populasi lokal Malabar Grobogan Potensi Hasil (t/ha) : 2,77 t/ha
Rataan Hasil : 3.40 t/ha
Karakter : polong masak tidak mudah pecah, dan pada saat panen daun luruh 95-100% saat panen >95% daunnya telah luruh
Pemulia : Suhartina, M. Muchlish Adie, T. Adisarwanto, Sumarsono, Sunardi, Tjandramukti, Ali Muchtar, Sihono, SB. Purwanto, Siti Khawariyah, Murbantoro, Alrodi, Tino Vihara, Farid Mufhti, dan Suharno Tipe Pertumbuhan : Determinate Umur Berbunga (hari) : 30-32 hari
Daerah Sebaran : beradaptasi baik pada beberapa kondisi lingkungan tumbuh yang berbeda cukup besar, pada musim hujan dan daerah beririgasi baik
Lampiran 4. Jadwal Kegiatan
Penyiraman Disesuaikan dengan kondisi lapangan
Penjarangan X
Penyulaman X
Lampiran 5 : Gambar Tanaman
3 MST
berbunga
A0 A1
1.daun dihaluskan 0.10 gr
2. aceton diambil menggunakan pipet
3. aceton diberi pada daun yg sudah halus 4.campuran aceton dengan
daun yang halus
5.ekstrak daun dimasukkan kedalam botol
7.ekstrak dalam botol yang telah siap utk diukur klorofilya
8.spektrofotometri
9. ekstrak dimasukkan kedalam
cuffet 10. cuffet yang berisi estrak
dimasukkan kedalam
spektrofotometri
11. pembacaan angka pada spektrofotometri
12. cuffet dikeluarkan dan dituang kembali kedalam botol utk diukur lagi
Lampiran 7 : Komposisi Asam Askorbat
Komposisi :
1. Assay (Iodometri) min. 99.7 % 2. Identitiy (IR-Spectrum) Passes Test 3. H2O 10 % + 20.5-21.5
4. Insoluble In water max. 0.005% 5. pH (5%.H2O) 2.2-2.5 %
6. Chlorides (Cl) max 0.005% 7. Sulfates (SO4) max 0.002% 8. Copper (Cu) max 0.00003%
9. Heavey metals (as pb) max 0.0002% 10. Iron (Fe) max 0.001%
11. Lead (Pb) max 0.001% 12. Nickel (Ni) max 0.05% 13. Sulfated ash max 0.1%
Loss on drying (105oC)
Lampiran 8. Bagan Alir Penelitian
Tanggal tanam 28 April 2012 DHL 6,7
9 HST (07 Mei 2012) DHL 7,3 (Banjir I)
21 HST (19 Mei 2012) DHL 8,6 (Banjir II)
36 HST (03 Juni 2012) DHL 10
Lampiran 9 :Data Pengamatan Tinggi Tanaman 3 MST (cm)
Lampiran 10 : Sidik Ragam Tinggi Tanaman 3 MST
Sumber db JK KT Fhit Ket F.05
Lampiran 11 : Data Pengamatan Tinggi Tanaman 4 MST (cm)
Perlakuan Blok Total Rataan
Lampiran 12 : Sidik Ragam Tinggi Tanaman 4 MST
Lampiran 13 : Data Pengamatan Jumlah Cabang 3 MST (cabang)
Lampiran 14: Sidik Ragam Jumlah Cabang 3 MST Sidik Ragam
Lampiran 15 : Data Pengamatan Jumlah Cabang 4 MST (cabang)
Lampiran 16 : Sidik Ragam Jumlah Cabang 4 MST (cabang)
Lampiran 17 : Data Pengamatan Jumlah Cabang 5 MST (cabang)
Perlakuan Blok Total Rataan
Lampiran 18 : Sidik Ragam Jumlah Cabang 5 MST
Lampiran 19 : Data Pengamatan Umur Berbunga (HST)
Lampiran 20 : Sidik Ragam Umur Berbunga
Sumber db JK KT Fhit Ket F.05
Lampiran 21 : Data Pengamatan Umur Panen (HST)
Perlakuan Blok Total Rataan
Lampiran 22 : Sidik Ragam Umur Panen
Lampiran 23: Data Pengamatan Jumlah Polong Berisi Pertanaman (polong)
Lampiran 24 : Sidik Ragam Jumlah Polong Berisi Pertanaman
Sumber db JK KT Fhit Ket F.05
Lampiran 25 : Data Pengamatan Jumlah Polong Hampa Pertanaman (polong)
Perlakuan Blok Total Rataan
Lampiran 26 : Sidik Ragam Jumlah Polong Hampa Pertanaman
Lampiran 27 : Data Pengamatan Jumlah Biji Pertanaman (biji)
Lampiran 28 : Sidik Ragam Jumlah Biji Pertanaman
Sumber db JK KT Fhit Ket F.05
Lampiran 29: Data Pengamatan Bobot Biji Pertanaman (g)
Perlakuan Blok Total Rataan Lampiran 30 : Sidik Ragam Bobot Biji Pertanaman
Lampiran 31: Data Pengamatan Bobot 100 Biji (g) Lampiran 32 : Sidik Ragam Bobot 100 Biji
Sumber db JK KT Fhit Ket F.05
Lampiran 33 : Data Pengamatan Jumlah Klorofil a (mg/l)
Perlakuan BLOK Total Rataan
I II III IV V VI VII VIII
Lampiran 34 : Sidik Ragam Jumlah Klorofil a
Lampiran 35: Data Pengamatan Jumlah Klorofil b (mg/l)
Perlakuan BLOK Total Rataan
I II III IV V VI VII VIII
Lampiran 36 : Sidik Ragam Jumlah Klorofil b
Sumber db JK KT Fhit Ket F.05
Lampiran 37: Data Pengamatan Jumlah Klorofil Total (mg/l)
Perlakuan BLOK Total Rataan
I II III IV V VI VII VIII
Lampiran 38 : Sidik Ragam Jumlah Klorofil Total
DAFTAR PUSTAKA
Afzal, I., S.M.A. Basra, N. Ahmad, and M. Farooq. 2005. Optimization of hormonal priming techniques for alleviation of salinity stress in wheat (Triticum aestivum L.). Cardeno de Pesquisa Sėr. Bio., Santa Cruz do sul. 17(1):95-109.
Afzal, I., N. Islam, F. Mahmood, A. Hameed, S. Irfan, and G. Ahmad. 2004. Enhancement of germination and emergence of canola seeds by different
priming techniques. Cardeno de Pesquisa Sėr. Bio., Santa Cruz do sul.
16(1):19-34.
Agung, T dan A. Y. Rahayu. 2004. Analisis Efisiensi Serapan N, Pertumbuhan, dan Hasil Beberapa Kultivar Kedelai Unggul Baru dengan Cekaman Kekeringan dan Pemberian Pupuk Hayati. Agrosains 6(2): 70-74, Semarang.
Amor NB, Hamed KB, Ahmed D, Grigon C, Chedly-Abdelly (2005). Physiological and antioxidant responses of the potential halophyte Chrithmum maritimum to salinity. Plant Sci. 168(4): 889-899.
Andarwulan, N., dan S. Koswara. 1992. Kimia Vitamin. Rajawali, Jakarta.
Andrianto, T. T., dan N. Indarto, 2004. Budidaya dan Analisis Usaha Tani Kedelai, Kacang Hijau dan Kacang Panjang. Absolut, Yogyakarta.
Arora, A., R.K. Sairam and G.C. Srivastava. 2002. Oxidative Stress And Antioxidative System In Plants. Current Science. 82(10):1227-1238. Atman, 2009. Strategi Peningkatan Produksi Kedelai di Indonesia. Jurnal Ilmiah
Tambua. Vol VIII No. 1 : 39-45
Basra, S.M.A., M. Farooq, A. Wahid and M.B. Khan. 2006. Rice seed invigoration by hormonal and vitamin priming. Seed Sci. & Technol., 34:753-758.
Beltagi, M. S., 2008. Exogenous Ascorbic Acid (Vitamin C) Induced Anabolic Changes For Salt Tolerance In Chick Pea (Cicer Arietinum L.) Plants. African Journal of Plant Science Vol. 2 (10), pp. 118-123, October 2008. Bonhert, H. J., Nelson D. E., Jensen RG. 1995. Adaptations to Environmental
Stresses. The plant Cell 7: 1099-111.
Chen, Z., and Gallie, D. R. 2004. The Absorbic Acid Redox State Controls Guard Cell Signaling an Stomata Movement. The Plant Cell 16: 1143-1162. Conklin, P.L., and C. Barth. 2004. Ascorbic acid, a familiar small molecule
interwined in the response of plants to ozone, pathogenes, and the onset of senescence. Plant Cell and Environment. 27:656-970.
Damardjati, D. S., Marwoto, D. K. S.Swastika, D. M. Arsyad, dan Y. Hilman. 2005. Prospek dan Arah Pengembangan Agribisnis Kedelai. Badan Litbang Pertanian, Departemen Pertanian, Jakarta
Departemen Pertanian. 1990. Upaya Peningkatan Produksi Kedelai. Departemen Pertanian, Balai Informasi Pertanian, Sumatera Utara, Medan.
Departemen Pertanian.1996. Direktorat Jenderal Tanaman Pangan dan Hortikultura. Budidaya Tanaman Palawijaya Pendukung Program Makanan Tambahan Anak Sekolah (PMT-AS). Jakarta.
Dolatabadian, A., and S. A. M. Modarressanavy. 2008. Effect of the ascorbic acid, pyridoxine and hydrogen peroxide treatments on germination, catalase activity, protein and malondialdehyde content of three oil seeds. Not. Bot. Hort. Agrobot. Cluj. 36(2):61-66.
Drevan, 2011. http://drevan.blogspot.com/2011/06/makalah-vitamin-c-asam-askorbat.html. Diakses tanggal 20 Februari 2012.
El-Zawahry, A.M. and A.M. Hamada. 1994. The Effect of Soaking Seeds in ascorbic acid, pyridoxine or thiamine solutions on nematode (Meloidogyne javanica) infection and on some metabolic processes in egg plant. Assiut journal of Agricultural Science. 25(3):233-247.
Farooq, M., S.M.A. Basra, R.Tabassum and I. Afzal. 2006b. Enhancing the performance of direct seeded fine rice by seed priming. Plant Prod Sci. 9(4):446-445.
Farooq, M., S.M.A. Basra, and N. Ahmad. 2007. Improving the performance of transplanted rice by seed priming. Plant Growth Regul. 51:129-137. Gill, S. S., and Tuteja, N., 2010. Reactive Oxygen Species And Antioxidant
Machinery In Abiotic Stress Tolerance In Crop Plants. Plant Physiology and Biochemistry 48 (2010) 909-930.
Greenway, H., and Munns, R. 1980. Mechanisms of Salt Tolerance in Non Halophytes. Ann. Rev. Plant Physiol 31:149-160.
Hanafiah, K.A. 2005. Dasar-dasar Ilmu Tanah. Raja Grafindo persada, Jakarta. hlm: 338-341
Hidayat, O. O., 1985 dalam Somaatmadja S., M. Ismunadji, Sumarno, M. Syam, S. O. Manurung dan Yuswadi. 1985. Kedelai : Morfologi Tanaman Kedelai. Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor. http://warintek.ristek.go.idpertanian/kedelai.pdf, 2008. Diakses tanggal 03
Februari 2011.
Kong-ngern K, Daduang S, Wongkham C, Bunnag S, Kosittrakun M, Theerakulpisut P (2005). Protein profile in response to salt stress in leaf sheaths of rice seedlings. Sci. Asia 31: 403-408.
Kusnawidjaja, K., 1987. Biokimia. Alumni, Bandung.
Malau, S., 1995. Biometrika Genetik Dalam Pemuliaan Tanaman. Universitas HKBP Nomensen, Medan.
Mangoendidjojo, 2003. Dasar-dasar Pemuliaan Tanaman. Kanisius, Yogyakarta. Miyake C, Asada K (1992). Thylakoid Bound Ascorbate Peroxidase In Spinach
Mursito. D., 2003. heritabilitas dan sidik lintas karakter fenotipik beberapa galur kedelai (Glycine max (L) Merrill). Fakultas Pertanian, Universitas Sebelas Maret. Surakarta.
Nahed, G. A, S. Taha Lobna and M. M. Ibrahim Soad. Some Studies on the Effect of Putrescine, Ascorbic Acid and Thiamine on Growth, Flowering and Some Chemical Constituents of Gladiolus Plants at Nubaria. Ozean Journal of Applied Sciences 2(2), 2009 Dalam Smirnoff, N., 1996. The Function and Metabolism of Ascorbic Acid in Plants. http://jxb.oupjournals.org/egi/content/full.
Noor, M. 2004. Lahan Rawa, Sifat dan Pengolahan Tanah Bermasalah Sulfat Masam. Raja Grafindo Persada, Jakarta. hlm: 144-145.
Phang, T.H., G. Shao and H.M. Lam. 2008. Salt tolerance in Soybean. Journal of Integrative Plant Biology 50 (10) : 1196-1212.
Poehlman, J. M., and D. A., Sleper. 1995. Beerding Field Crops. Pamina Publishing Coorporation, New Delhi.
Poedjiadi, A., 1994. Dasar-Dasar Biokimia. UI Press, Jakarta.
Rosmarkam, A dan N.W Yuwono. 2002. Ilmu Kesuburan Tanah. Kanisius, Yogyakarta.hlm: 198-202.
Rubatzky, V. E., dan M. Yamaguchi. 1998. Sayuran Dunia, Prinsip, Produksi, dan Gizi. Edisi Kedua. Penerjemah C. Herison. ITB Press, Bandung.
Rukmana, R. & Y. Yuniarsih, 2004. Kedelai Budidaya dan Pasca Panen. Kanisius. Yogyakarta.
Sipayung, R., 2003. Stress Garam dan Mekanisme Toleransi Tanaman. Fakultas Pertanian Jurusan Budidaya Pertanian, Universitas Sumatera Utara, Medan.
Shaddad, M. A., A.F. radi., A.M., Abdel-Rahman., and M.M. Azooz. 1989. Response of seeds of Lupinus termis and Vicia faba to the interactive effect of salinity and ascorbic acid or pyridoxine. Plant and Soil. 177-183. Shalata, A. and P. M. Neuman, 2001. Exogenous Ascorbic Acid (Vitamin C)
Sharma, O. P., 1993. Plant Taxonomy. Tata Mc Graw Hill Publishing Company Limited, New Delhi.
Slinger, D. and Tenison, K. 2005. Salinity Glove Box Guide - NSW Murray and Murrumbidgee Catchments. An initiative of the Southern Salt Action Team, NSW Department of Primary Industries.
Smirnoff, N., 1996. The Function and Metabolism of Ascorbic Acid in Plants. http://jxb.oupjournals.org/egi/content/full.
Suherman, V.E. 2005. Penggunaan antioksidan pada beberapa lot benih yang berbeda vigornya untuk meningkatkan viabilitas benih bunga matahari. Skripsi. Dept. AGH. IPB. Bogor. 36hal.
Winarno, F. G., 1992. Kimia Pangan dan Gizi. Gramedia, Jakarta.
Wolucka, B. A., Goossens, A., and Inze, D., 2005. Methyl Jasmonate Stimulates the de novo Biosynthesis of Vitamin C in Plant Cell Suspensions, J. Exp. Botany, 56: 2527-2538.
BAB III
BAHAN DAN METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Lahan Percobaan Desa Paluh 80 Kecamatan Percut Sei Tuan Kabupaten Deli Serdang dengan ketinggian tempat ±1.5 m dpl, yang dilakukan pada bulan Maret 2012 sampai dengan Juni 2012.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah benih kedelai varietas Grobogan generasi F3 hasil seleksi terhadap salinitas, asam askorbat, pupuk (Urea, TSP, KCl), kompos sebagai penutup lubang tanam, Insektisida Decis 2,5 EC 0,5cc/L air, Fungisida Dithane M-45 1cc/L air, air untuk menyiram tanaman serta bahan lain yang mendukung penelitian ini.
Alat yang digunakan adalah cangkul untuk membersihkan lahan dari gulma dan sampah, meteran untuk mengukur luas lahan dan tinggi tanaman, handsprayer sebagai alat aplikasi insektisida dan fungisida, gembor, pacak sampel, timbangan analitik, oven, alat tulis dan kertas label serta alat lain yang mendukung penelitian ini.
Metode Penelitian
Rancangan percobaan yang digunakan adalah Rancangan Acak Kelompok (RAK) Non Faktorial yang terdiri dari 4 taraf perlakuan asam askorbat yaitu :
A0 : 0 ppm (Kontrol) A1 : 200 ppm
Jumlah ulangan =8
Jumlah plot = 32
Jarak antar blok = 50 cm Jarak antar plot = 30 cm
Jarak tanam = 20 x 30 cm
Jumlah tanaman/ plot = 20 tanaman Jumlah sampel/ plot = 4 tanaman Jumlah sampel seluruhnya = 128 tanaman Jumlah tanaman seluruhnya = 640 tanaman
Ukuran plot = 1,1 m x 1 m
Data hasil penelitian dianalisis dengan sidik ragam berdasarkan model linier sebagai berikut :
Yij = µ + ρi + σj + εij
i = 1,2,3,4,5,6,7,8 j=1,2,3,4 Dimana :
Yij = Hasil pengamatan pada blok ke-I dalam perlakuan ke-j
µ
= Nilai tengah umum
ρi = pengaruh blok ke-i
σj = pengaruh perlakuan ke-j
εij = pengaruh galat terhadap blok ke-i pada perlakuan ke-j
BAB IV
PELAKSANAAN PENELITIAN
Persiapan Lahan
Areal pertanaman yang akan digunakan, dibersihkan dari gulma yang tumbuh pada areal tersebut. Tanah diolah kemudian dibuat plot dengan ukuran 1.1 m x 1 m. Dibuat parit drainase dengan jarak antar plot 30 cm dan jarak antar blok 50 cm untuk mengurangi masuknya air kelahan penelitian. Kemudian tanah plot digemburkan menggunakan cangkul.
Penanaman Benih
Penanaman dilakukan dengan membuat lubang tanam diplot yang telah dibuat dengan kedalaman ± 2cm, kemudian dimasukkan 1 benih per lubang tanam dan ditutup dengan kompos. Jarak tanam yang digunakan adalah 20 cm x 30 cm. Pemupukan
Pemupukan dilakukan sesuai dengan dosis anjuran kebutuhan pupuk kedelai yaitu 100 kg Urea/ha (0,6 g/lubang tanam), 200 kg TSP/ha (1,2 g/lubang tanam), dan 100 kg KCl/ha (0,6 g/lubang tanam). Pemupukan TSP dan KCL dilakukan 1 minggu sebelum tanam dan pupuk Urea dilakukan 2 minggu setelah tanam.
Aplikasi Asam Askorbat
Asam askorbat diaplikasikan sebanyak 3 kali yaitu pada saat tanaman berumur 2 MST, 4 MST dan 6 MST dengan menyemprotkan pada daun tanaman. Pemeliharaan Tanaman
Penyiraman dilakukan dua kali sehari yaitu pada pagi dan sore hari, apabila terjadi hujan tidak dilakukan penyiraman dan diperkirakan telah mencukupi kebutuhan tanaman atau disesuaikan dengan kondisi di lapangan. Penyiraman dilakukan dengan menggunakan gembor.
Penyulaman
Penyulaman dilakukan apabila dalam satu lubang tanam tidak ada benih yang tumbuh atau pertumbuhannya abnormal. Penyulaman dilakukan paling lama 2 MST.
Penyiangan
Penyiangan dilakukan 3 minggu setelah tanam dan seterusnya dilakukan setiap 1 minggu sekali atau disesuaikan dengan perkembangan gulma yang ada di areal penelitian secara manual dengan mencabut gulma atau dengan menggunakan garu. Penyiangan dilakukan sesuai dengan kondisi di lapangan.
Pembumbunan
Agar tanaman tidak mudah rebah dan berdiri tegak serta kokoh, pembumbunan dilakukan dengan cara membuat gundukan tanah di sekeliling tanaman.
Pengendalian Hama dan Penyakit
Pengendalian hama dan penyakit dilakukan dengan penyemprotan insektisida dengan dosis 0,5 cc/liter air, sedangkan pengendalian penyakit dilakukan dengan menyemprot fungisida dengan dosis 1 cc/liter air. Penyemprotan dilakukan pada saat 3 minggu setelah tanam dan selanjutnya tergantung dari intensitas serangan hama dan penyakit.
Panen dilakukan dengan cara dipetik satu persatu dengan menggunakan tangan. Adapun kriteria panen yaitu adalah ditandai dengan kulit polong sudah berwarna kuning kecoklatan sebanyak 95% dan daun sudah berguguran tetapi bukan karena adanya serangan hama dan penyakit.
Pengamatan Parameter
Tinggi Tanaman (cm)
Pengukuran tinggi tanaman dilakukan dari pangkal batang sampai titik tumbuh dengan menggunakan meteran. Pengukuran tinggi tanaman dilakukan sejak tanaman berumur 2 MST hingga 4 MST.
Jumlah Cabang (cabang)
Penghitungan jumlah cabang dilakukan dengan menghitung jumlah cabang yang muncul di sekitar batang utama. Penghitungan jumlah cabang dilakukan sejak tanaman berumur 3 MST hingga 5 MST.
Umur Berbunga (hari)
Pengamatan umur berbunga dilakukan dengan menghitung umur tanaman pada saat tanaman sudah berbunga.
Umur Panen (hari)
Pengamatan umur panen dilakukan dengan menghitung umur panen pada saat tanaman telah memiliki polong yang telah mencapai warna polong matang ± 95% yang ditandai warna kecoklatan pada polong.
Jumlah Polong Berisi Pertanaman (polong)
Jumlah polong berisi dihitung pada setiap tanaman yaitu polong yang menghasilkan biji. Perhitungan dilakukan pada saat tanaman telah dipanen.
Dihitung jumlah polong hampa pada setiap tanaman, yaitu polong yang tidak berisi biji. Perhitungan dilakukan pada saat tanaman telah dipanen.
Jumlah Biji Pertanaman (biji)
Penghitungan dilakukan saat stadia R8 (matang penuh / 95 % dari polong
telah mencapai warna polong matang) atau saat panen dilakukan. Untuk mengetahui jumlah biji pada tiap polong tanaman dilakukan dengan membuka / mengupas tiap polong, lalu dihitung semua biji yang ada pada polong tersebut. Bobot Biji Pertanaman (g)
Diambil seluruh biji dari masing-masing perlakuan pada tanaman sampel dengan menggunakan timbangan analitik. Penimbangan dilakukan dengan kondisi biji kering.
Bobot 100 biji (g)
Diambil 100 biji dari masing-masing perlakuan pada tanaman sampel. Untuk memperoleh 100 biji kedelai dilakukan pengambilan biji secara acak. Jumlah Klorofil Daun (g/ml)
Metode yang digunakan dalam menghitung jumlah klorofil a dan b adalah metode Henry dan Grime (1993), dengan langkah sebagai berikut :
- Digerus daun segar sebanyak 0.1 gram dengan mortal, dan menggunakan aceton 80% sebanyak 10 ml.
- Ekstrak disaring dengan kertas saring dan dipindahkan ke dalam botol.
- Absorbansi diukur pada panjang gelombang 645 nm dan panjang gelombang 663 nm.
- Total klorofil, klorofil a, dan klorofil b dihitung dengan menggunakan rumus
Klorofil a = (12.7 x A663) – (2.69 x A645) 10
BAB V
HASIL DAN PEMBAHASAN
Hasil
Dari hasil penelitian dan pengujian sidik ragam ternyata perlakuan berpengaruh nyata terhadap tinggi tanaman, jumlah cabang, jumlah polong berisi pertanaman, jumlah biji pertanaman, bobot biji pertanaman, bobot 100 biji, dan jumlah klorofil daun. Tetapi tidak berpengaruh nyata terhadap umur berbunga, umur panen, dan jumlah polong hampa pertanaman.
Tinggi Tanaman (cm)
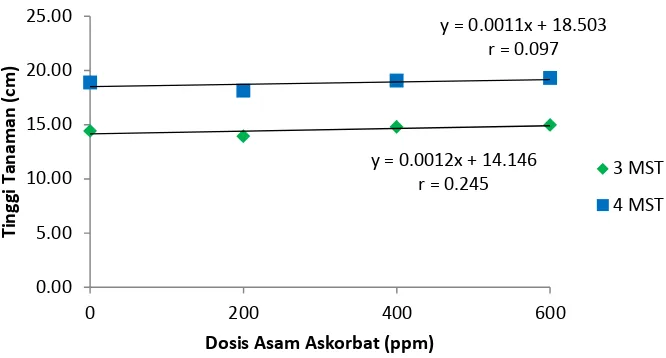
Data pengamatan tinggi tanaman 3 MST dan 4 MST dan daftar sidik ragam tinggi tanaman dapat dilihat pada lampiran 9 sampai 12. diketahui bahwa perlakuan berbeda nyata terhadap tinggi tanaman pada 3 MST dan 4 MST. Rataan tinggi tanaman dapat dilihat pada Tabel 1.
Tabel 1. Rataan Tinggi Tanaman Pada 3 MST dan 4 MST
Perlakuan Tinggi Tanaman (cm) menunjukkan tidak berbeda nyata pada Uji Duncan (Duncan’s Multiple Range Test/DMRT) pada taraf 5 %
Pada pengamatan 4 MST perlakuan A1 berbeda nyata terhadap semua perlakuan. Dari tabel 1 dapat dilihat bahwa rataan tinggi tanaman tertinggi pada perlakuan A3 yaitu : 14.96 cm, dan 19.29 cm. Sedangkan rataan tinggi tanaman terendah pada perlakuan A1 yaitu : 13.93 cm, dan 18.12 cm.
Gambar 3. Grafik Pertambahan Tinggi Tanaman 3 MST dan 4 MST
Pada Gambar 3 dapat dilihat bahwa pengaruh perlakuan asam askorbat terhadap tinggi tanaman menunjukkan hubungan linier positif, yang artinya dengan menambahkan dosis asam askorbat cenderung meningkatkan tinggi tanaman pada 3 dan 4 MST.
Jumlah Cabang (cabang)
Dari data penelitian dan analisis sidik ragam yang dapat dilihat pada lampiran 13 sampai 18, diketahui bahwa perlakuan berbeda nyata terhadap jumlah cabang pada 5 MST tetapi tidak berbeda nyata terhadap 3 dan 4 MST. Rataan jumlah cabang tanaman dapat dilihat pada tabel 2.
Tabel 2. Rataan Jumlah Cabang Pada 3, 4 dan 5 MST (cabang)
Perlakuan Jumlah Cabang (cabang) menunjukkan tidak berbeda nyata pada Uji Duncan (Duncan’s Multiple Range Test/DMRT) pada taraf 5 %
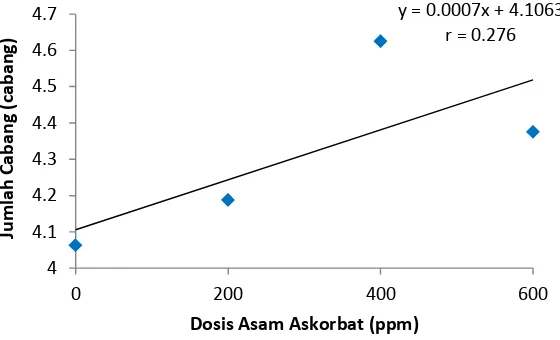
Pada pengamatan jumlah cabang 5 MST, perlakuan A2 berbeda nyata terhadap A0 dan A1, dan tidak berbeda nyata terhadap A3. Dari tabel 2 diketahui bahwa rataan jumlah cabang terbanyak terdapat pada perlakuan A2 (4.63 cabang) dan terendah pada perlakuan A0 (4.06 cabang).
Grafik jumlah cabang 5 MST dapat dilihat pada gambar dibawah ini
Gambar 4. Grafik Jumlah Cabang 5 MST
Pada Gambar 4 dapat dilihat bahwa pengaruh perlakuan asam askorbat terhadap jumlah cabang menunjukkan hubungan linier positif, artinya dengan menambahkan dosis asam askorbat cenderung meningkatkan jumlah cabang pada 5 MST.
Umur Berbunga (hari setelah tanam/ HST)
Dari data penelitian dan analisis sidik ragam dapat dilihat pada lampiran 19 dan 20, diketahui bahwa perlakuan berpengaruh tidak nyata terhadap parameter umur berbunga. Rataan umur berbunga dapat dilihat pada tabel 3.
Tabel 3. Rataan Umur Berbunga (HST) 21 dan 22, diketahui bahwa perlakuan berpengaruh tidak nyata terhadap parameter umur panen. Rataan umur panen dapat dilihat pada tabel 4.
Tabel 4. Rataan Umur Panen (HST)
Perlakuan Umur Panen (HST) 23 dan 24, diketahui bahwa perlakuan berpengaruh nyata terhadap jumlah polong berisi pertanaman. Rataan jumlah polong berisi pertanaman dapat dilihat pada tabel 5.
Tabel 5. Rataan Jumlah Polong Berisi Pertanaman (polong)
Perlakuan Jumlah Polong Berisi Pertanaman
A0 4.06c
A1 5.06c
A2 8.63a
A3 6.81b
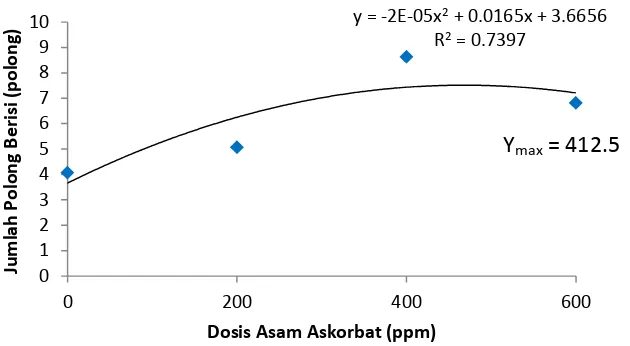
Dari data diatas diketahui bahwa A2 berbeda nyata terhadap semua perlakuan. Rataan jumlah polong berisi pertanaman paling banyak pada perlakuan A2 yaitu 8.63 polong dan paling sedikit pada perlakuan A0 yaitu 4.06 polong.
Grafik jumlah polong berisi pertanaman dapat dilihat pada gambar dibawah ini
Gambar 5. Grafik Jumlah Polong Berisi Pertanaman
Pada Gambar 5 dapat dilihat bahwa pengaruh perlakuan asam askorbat terhadap jumlah polong berisi pertanaman menunjukkan kurva kuadratik dimana pengaruh dosis asam askorbat mencapai jumlah polong berisi maksimum pada dosis 412.5 ppm.
Jumlah Polong Hampa Pertanaman (polong)
Tabel 6. Rataan Jumlah Polong Hampa Pertanaman (polong)
Perlakuan Jumlah Polong Hampa Pertanaman
A0 0.13
A1 0.44
A2 0.44
A3 0.38
Jumlah Biji Pertanaman (biji)
Dari data penelitian dan analisis sidik ragam dapat dilihat pada lampiran 27 dan 28, diketahui bahwa perlakuan berpengaruh nyata terhadap jumlah biji pertanaman. Rataan jumlah biji pertanaman dapat dilihat pada tabel 7.
Tabel 7. Rataan Jumlah Biji Pertanaman (biji)
Perlakuan Rataan
A0 7.69c
A1 9.75c
A2 18.75a
A3 13.69b
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Duncan (Duncan’s Multiple Range Test/DMRT) pada taraf 5 %
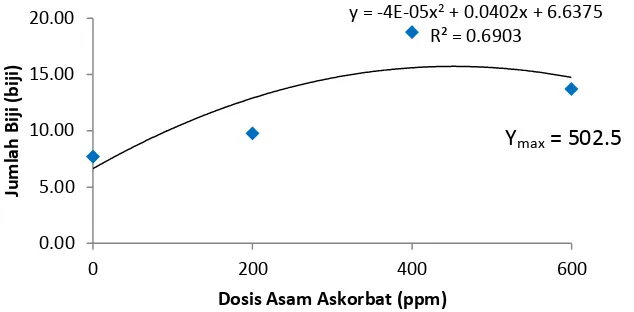
Dari data diatas diketahui bahwa A2 berbeda nyata terhadap semua perlakuan. Rataan jumlah biji pertanaman paling banyak pada perlakuan A2 yaitu 18.75 biji dan paling sedikit pada perlakuan A0 yaitu 7.69 biji.
Gambar 6. Grafik Jumlah Biji Pertanaman
Pada Gambar 6 dapat dilihat bahwa pengaruh perlakuan asam askorbat terhadap jumlah biji menunjukkan kurva dimana pengaruh dosis asam askorbat mencapai jumlah biji maksimum pada dosis 502.5 ppm.
Bobot Biji Pertanaman (g)
Dari data penelitian dan analisis sidik ragam dapat dilihat pada lampiran 29 dan 30, diketahui bahwa perlakuan berpengaruh nyata terhadap bobot biji pertanaman. Rataan bobot biji pertanaman dapat dilihat pada tabel 8.
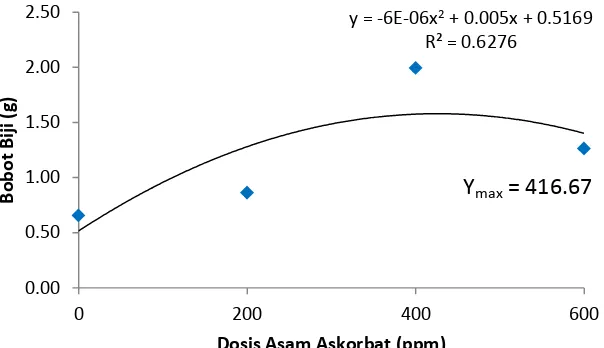
Tabel 8. Rataan Bobot Biji Pertanaman (g)
Perlakuan Bobot Biji Pertanaman (g)
A0 0.66c
A1 0.86c
A2 1.99a
A3 1.26b
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Duncan (Duncan’s Multiple Range Test/DMRT) pada taraf 5 %
Dari data diatas diketahui bahwa A2 berbeda nyata terhadap semua perlakuan. Rataan bobot biji pertanaman paling banyak pada perlakuan A2 yaitu 1.99 g dan paling sedikit pada perlakuan A0 yaitu 0.66 g.
Gambar 7. Grafik Bobot Biji Pertanaman
Pada Gambar 7 dapat dilihat bahwa pengaruh perlakuan asam askorbat terhadap bobot biji menunjukkan kurva kuadratik dimana pengaruh dosis asam askorbat mencapai bobot biji maksimum pada dosis 416.67 ppm.
Bobot 100 biji (g)
Dari data penelitian dan analisis sidik ragam dapat dilihat pada lampiran 31 dan 32, diketahui bahwa perlakuan berpengaruh nyata terhadap bobot 100 biji. Rataan bobot 100 biji dapat dilihat pada tabel 9.
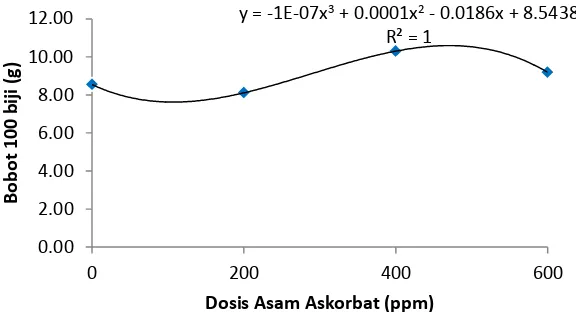
Tabel 9. Rataan Bobot 100 Biji (g)
Perlakuan Rataan Bobot 100 Biji (g)
A0 8.54b
A1 8.11b
A2 10.30a
A3 9.19ab
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Duncan (Duncan’s Multiple Range Test/DMRT) pada taraf 5 %
Dari data diatas diketahui bahwa A2 berbeda nyata terhadap A0 dan A1dan tidak berbeda nyata terhadap A3. Rataan bobot 100 biji paling banyak pada perlakuan A2 yaitu 10.30 g dan paling sedikit pada perlakuan A1 yaitu 8.11g.
Grafik bobot 100 biji dapat dilihat pada gambar dibawah ini
Gambar 8. Grafik Bobot 100 Biji
Pada Gambar 8 dapat dilihat bahwa pengaruh dosis asam askorbat belum dapat dijelaskan oleh kurva apakah dengan menambah atau mengurangi dosis asam askorbat berpengaruh terhadap bobot 100 biji.
Jumlah Klorofil Daun (g/ml)
Dari data penelitian dan analisis sidik ragam dapat dilihat pada lampiran 33 sampai 38, diketahui bahwa perlakuan berpengaruh nyata terhadap jumlah klorofil a, klorofil b dan klorofil total. Rataan klorofil a, klorofil b dan klorofil total dapat dilihat pada tabel 10.
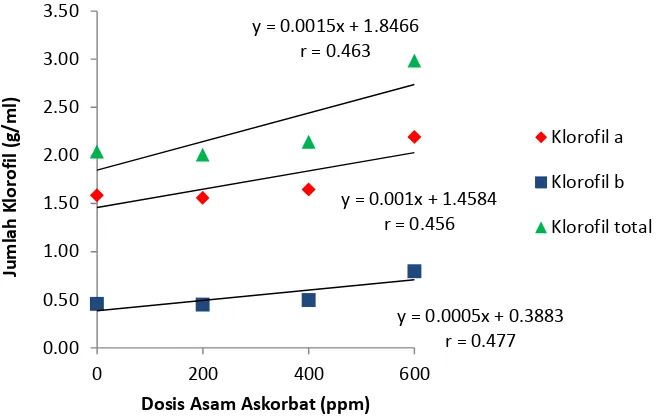
Tabel 10. Rataan Klorofil a, Klorofil b dan Klorofil Total (g/ml)
Keterangan : Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Duncan (Duncan’s Multiple Range Test/DMRT) pada taraf 5 %
Pada pengamatan parameter jumlah klorofil a, klorofil b dan klorofil total, perlakuan A3 berbeda nyata terhadap semua perlakuan. Dengan jumlah klorofil paling banyak terdapat pada perlakuan A3 yaitu 2.19 g/ml, 0.79 g/ml dan 2.98 g/ml.
Grafik jumlah klorofil a, klorofil b dan klorofil total dapat dilihat pada gambar dibawah ini
Gambar 9. Grafik Jumlah Klorofil a, Klorofil b dan Klorofil Total
Pada Gambar 9 dapat dilihat bahwa pengaruh perlakuan asam askorbat terhadap jumlah klorofil menunjukkan hubungan yg linier positif dimana dengan menambahkan dosis asam askorbat cenderung meningkatkan jumlah klorofil. Pembahasan
Pengaruh Asam Askorbat Terhadap Parameter Pertumbuhan Vegetatif Kedelai di Tanah Salin
Berdasarkan analisis sidik ragam diperoleh hasil bahwa perlakuan asam askorbat berpengaruh nyata pada parameter tinggi tanaman pada saat 3 MST dan
4 MST. Hal ini menunjukkan bahwa asam askorbat dapat mengurangi dampak negatif dari tanah salin dengan cara menurunkan konsentrasi ROS (senyawa oksigen reaktif) yang dapat dilihat dari jumlah klorofil yang lebih banyak dibandingkan dengan perlakuan tanpa pemberian asam askorbat sehingga aktivitas metabolisme pembentukan sel tidak terganggu. Hal ini sesuai dengan literatur Nahed, et al. 2009 Dalam Smirnoff (1996) menyatakan bahwa asam askorbat membantu dalam proses pembelahan sel tanaman. Literatur lain yang mendukung adalah Conklin dan Barth (2004) yang menyatakan bahwa Asam askorbat merupakan salah satu senyawa yang penting dalam proses selular termasuk pembelahan dan pembesaran sel serta dalam mengaktifkan aktivitas metabolisme ketika proses perkecambahan dimulai. Menetralisir racun, melindungi sel dari senyawa oksigen reaktif dan radikal bebas serta mencegah kematian sel.
Asam askorbat tidak berpengaruh nyata terhadap parameter jumlah cabang 3 MST dan 4 MST, hal ini diduga karena intensitas aplikasi yang kurang tepat, sehingga asam askorbat yang diberikan pada 2 MST belum tercukupi untuk pembentukan jumlah cabang 3 MST dan 4 MST. Namun aplikasi asam askorbat pada 4 MST menyebabkan perlakuan asam askorbat berpengaruh nyata terhadap jumlah cabang 5 MST dan hal ini mungkin disebabkan karena pada saat 5 MST tidak ada lagi penambahan tinggi tanaman sehingga asam askorbat yang diaplikasikan lebih diarahkan untuk pembentukan cabang dari pada tinggi tanaman.
Pengaruh Asam Askorbat Terhadap Parameter Produksi Kedelai di Tanah Salin
Tingginya produksi pada konsentrasi ini disebabkan karena didukung oleh meningkatnya komponen-komponen produksi, yaitu jumlah jumlah polong berisi pertanaman, jumlah biji pertanaman, bobot biji pertanaman, bobot 100 biji, dan jumlah klorofil. Hal ini disebabkan karena asam askorbat melindungi sel dari senyawa oksigen reaktif dan radikal bebas yang mengganggu fungsi kloroplas, sehingga tanaman dapat berfotosintesis dengan baik yang mendukung meningkatnya produksi. Hal ini sesuai literatur Afzal et al. (2005) yang menyatakan bahwa perlakuan asam askorbat dapat mengurangi dampak negatif dari konsentrasi garam yang tinggi yaitu melindungi fungsi kloroplas sehingga menurunkan konsentrasi ROS. Literatur lain yang mendukung adalah Farooq et al (2006) yang menyatakan bahwa priming dengan asam askorbat mampu meningkatkan kinerja, pertumbuhan dan produksi benih padi Super Basmati yang ditanam dengan system tebar langsung.
Pemberian asam askorbat dengan konsentrasi 600 ppm menurunkan produksi karena pada konsentrasi 400 ppm sudah cukup bagi tanaman untuk mengatasi masalah stress garam.
askorbat dapat mengurangi dampak negatif yang ditimbulkan dari konsentrasi garam yang tinggi.
Dari hasil pengamatan dan analisis sidik ragam dapat diketahui bahwa perlakuan A2 mempunyai rataan tertinggi pada jumlah polong berisi pertanaman, jumlah biji pertanaman, dan bobot biji pertanaman. Hal ini diduga karena tanaman telah mampu untuk menurunkan jumlah senyawa oksigen reaktif akibat stress garam, sehingga tanaman dapat melakukan fotosintesis yang memicu pembentukan dan pengisian polong. Hal ini sesuai dengan literatur Shalata and Neumann (2001) yang menyatakan bahwa efek penambahan asam askorbat pada tanaman dapat mendukung tanaman tersebut untuk bertahan hidup dengan menghambat beberapa partikel merugikan yang ditimbulkan akibat senyawa oksigen reaktif.
Dari data penelitian dan analisis sidik ragam dapat diketahui bahwa perlakuan asam askorbat berpengaruh nyata terhadap bobot 100 biji. Ukuran biji yang dihasilkan ditentukan secara genetik, namun faktor lingkungan selama fase pengisian biji juga berpengaruh. Salah satu faktor lingkungan yang merugikan pada saat penelitian ini adalah meningkatnya DHL tanah dari 6.7 mmhos hingga 10 mm/hos akibat adanya luapan air laut yang masuk ke lokasi penanaman. Mursito (2003) menjelaskan bahwa ukuran biji suatu varietas ditentukan secara genetik, namun ukuran biji yang terbentuk juga ditentukan oleh lingkungan semasa pengisian biji.
BAB VI
KESIMPULAN DAN SARAN
Kesimpulan
1. Perlakuan asam askorbat berpengaruh nyata terhadap pertumbuhan vegetatif tanaman yaitu pada parameter tinggi tanaman 3 MST ,4 MST, dan jumlah cabang 5 MST.
2. Pemberian asam askorbat akan meningkatkan produksi. Produksi maksimum akan dicapai pada pemberian asam askorbat pada konsentrasi 416.67 ppm. Penambahan dosis diatas dosis maksimum akan menurunkan produksi.
3. Meningkatnya produksi pada konsentrasi 400 ppm disebabkan karena didukung oleh meningkatnya komponen-komponen produksi, yaitu jumlah jumlah polong berisi pertanaman, jumlah biji pertanaman, bobot biji pertanaman, bobot 100 biji, dan jumlah klorofil.
Saran
BAB II
TINJAUAN PUSTAKA
Botani Tanaman
Menurut Sharma (1993) tanaman kedelai diklasifikasikan sebagai berikut: Kingdom : Plantae
Divisio : Spermatophyta Subdivisio : Angiospermae Class : Dicotyledoneae Ordo : Polypetales Famili : Papilionaceae Genus : Glycine
Spesies : Glycine max (L.) Merill
Susunan akar kedelai pada umumnya sangat baik. Pertumbuhan akar tunggang lurus masuk kedalam tanah dan mempunyai banyak akar cabang. Pada akar cabang banyak terdapat bintil akar berisi bakteri Rhizobium japonicum, yang mempunyai kemampuan mengikat zat lemas bebas (N2) dari udara yang kemudian
dipergunakan untuk menyuburkan tanah (Andrianto dan Indarto, 2004).
Terdapat empat tipe daun yang berbeda yaitu kotiledon atau daun biji, daun primer sederhana, daun bertiga, dan daun profila. Daun primer sederhana berbentuk telur (oval) berupa daun tunggal (unifoliat) dan bertangkai sepanjang 1-2 cm, terletak berseberangan pada buku pertama di atas kotiledon. Daun-daun berikutnya daun bertiga (trifollit), namun adakalanya terbentuk daun berempat atau daun berlima (Hidayat dalam Somaatmadja dkk, 1985).
Kultivar kedelai memiliki bunga bergerombol terdiri atas 3-15 bunga yang tersusun pada ketiak daun. Karakteristik bunganya seperti famili Papilionaceae lainnya, yaitu corolla (mahkota bunga) terdiri atas 5 petal yang menutupi sebuah pistil dan 10 stamen (benang sari). 9 stamen berkembang membentuk seludang yang mengelilingi putik, sedangkan stamen yang kesepuluh terpisah bebas (Poehlman and Sleper, 1995).
Banyaknya polong tergantung pada jenisnya. Ada jenis kedelai yang menghasilkan banyak polong, ada pula yang sedikit. Berat masing-masing biji pun berbeda-beda, ada yang bisa mencapai berat 50-500 gram per 100 butir biji. Selain itu, warna biji juga berbeda-beda. Perbedaan warna biji dapat dilihat pada belahan biji ataupun pada selaput biji, biasanya kuning atau hijau transparan (tembus cahaya). Ada pula biji yang berwarna gelap kecoklat-coklatan sampai hitam atau berbintik-bintik (Andrianto dan Indarto, 2004).
Syarat Tumbuh
Iklim
Tanaman kedelai sebagian besar tumbuh di daerah yang beriklim tropis dan subtropis. Sebagai barometer iklim yang cocok bagi kedelai adalah bila cocok bagi tanaman jagung. Bahkan daya tahan kedelai lebih baik daripada jagung. Tanaman kedelai dapat tumbuh baik di daerah yang memiliki curah hujan sekitar 100-400 mm/bulan (Sugeno, 2008).
Tanaman kedelai sebagian besar tumbuh di daerah beriklim tropis dan subtropis. Bahkan daya tahan kedelai lebih baik daripada jagung. Iklim kering lebih disukai tanaman kedelai dibandingkan dengan iklim lembab. Tanaman kedelai dapat tumbuh baik di daerah yang memiliki curah hujan 100-400 mm/bulan. Sedangkan untuk mendapatkan hasil yang opimal, tanaman kedelai membutuhkan curah hujan antara 100-200 mm/bulan. Suhu yang dikehendaki tanaman kedelai antara 21-340C, akan tetapi suhu optimum bagi pertumbuhan tanaman kedelai adalah 23-270C. Pada proses perkecambahan benih kedelai, diperlukan suhu yang cocok (http://warintek.ristek.go.idpertanian/kedelai.pdf, 2008).
terjadi pada saat pertumbuhan generatif, misalnya saat pengisian polong, akan menurunkan produksi. Kekeringan dapat juga menurunkan bobot biji, sebab bobot biji sangat dipengaruhi oleh jumlah air yang diberikan dalam musim tanam. Balittan Malang (1990) melaporkan bahwa pemberian air yang intensif akan berpengaruh terhadap hasil biji kedelai. Pemberian air setiap 10 hari selama musim tanam dapat meningkatkan hasil menjadi 2 ton/ha diban dibandingkan pemberian 3 kali selama musim tanam (1.71 ton/ha) dan tanpa irigasi teratur hanya 1.47 ton/ha (Agung dan Rahayu, 2004).
Tanah
Kedelai termasuk tanaman yang mampu beradaptasi terhadap berbagai agroklimat, menghendaki tanah yang cukup gembur, tekstur lempung berpasir dan liat. Tanaman kedelai dapat tumbuh dengan baik pada tanah yang mengandung bahan organik dan pH antara 5,5-7 (optimal 6,7). Tanah hendaknya mengandung cukup air tapi tidak sampai tergenang (Departemen Pertanian, 1996).
Kedelai dapat tumbuh baik pada berbagai jenis tanah asal darinase dan aerase tanah cukup baik. Tanah-tanah yang cocok yaitu alluvial, regosol, grumosol, latosol dan andosol. Pada tanah-tanah podsolik merah kuning dan tanah yang mengandung banyak pasir kwarsa, pertumbuhan kedelai kurang bagus. Kecuali kalau diberi tambahan pupuk organik atau kompos dalam jumlah yang cukup (Andrianto dan Indarto, 2004).
dan pemberian kapur sebanyak 2-3 ton/Ha pada tanah yang ber-pH 5,5 pada umumnya dapat menaikkan hasil (Departemen Pertanian, 1990).
Salinitas
Salinitas, proses ini terjadi di daerah kering dan panas merupakan gerakan garam dari profil tanah bawah (sub soil) ke bagian atas (top soil). Pada bagian atas terjadi penguapan yang intensif (suasana panas dan kering), sehingga menyebabkan larutan garam bergerak secara kapilaritas ke atas, menguap, dan meninggalkan endapan garam dipermukaan tanah. Apabila proses ini berlangsung terus menerus sepanjang tahun, maka terbentuk tanah garam (saline soil). Di Indonesia proses ini tidak berlangsung sepanjang tahun, hanya terdapat di daerah panas dan kering. Pada musim kemarau terjadi salinisasi, sebaliknya pada musim hujan terjadi desilinisasi. Pengurangan kadar garam dipermukaan tanah terjadi karena curah hujan yang turun kemudian melindi ke bawah. Proses salinisasi hanya terjadi pada tanah yang mempunyai tekstur halus sampai sangat halus (Rosmarkam dan Yuwono, 2002).
Toleransi terhadap salinitas adalah beragam dengan spektrum yang luas diantara spesies tanaman mulai dari yang peka hingga yang cukup toleran. Lima tingkat pengaruh salinitas tanah terhadap tanaman, mulai dari tingkat non-salin hingga tingkat salinitas yang sangat tinggi.
Suatu tanah disebut tanah alkali atau tanah salin jika kapasitas tukar kation (KTK) atau muatan negative koloid-koloidnya dijenuhi oleh > 15% Na, yang mencerminkan unsur ini merupakan komponen dominan dari garam-garam larut yang ada. Pada tanah-tanah ini, mineral sumber utamanya adalah halit (NaCl) (Hanafiah, 2005).
Tanah-tanah salin dan sodik, yang kini disebut Aridisol, adalah tanah-tanah daerah iklim kering dengan curah hujan rata-rata kurang dari 500 mm (20 in.) per tahun. Jumlah H2O yang berasal dari presipitasi tidak cukup untuk
menetralkan jumlah H2O yang hilang oleh evaporasi dan evapotranspirasi.
Sewaktu air luapan ke atmosfer, garam-garam tertinggal dalam tanah. Proses penimbunan garam mudah larut dalam tanah ini disebut salinisasi. Garam-garam tersebut terutama adalah NaCl, Na2SO4, CaCO3, dan/atau MgCO3. Dulu
tanah-tanah yang terbentuk disebut tanah-tanah salin, tanah-tanah alkali putih, atau solonchak. Mereka termasuk tipe tanah zonal. Salinisasi dapat juga terjadi secara setempat dan membentuk tanah salin tipe intrazonal, seperti misalnya tanah-tanah yang direklamasi dari dasar laut dan tanah-tanah didaerah pantai yang dipengaruhi oleh pasang surut (Tan, 2004).
Pengaruh Salinitas Terhadap Tanah dan Tanaman
seperti daun mongering dibagian ujung dan gejala khlorosis. Gejala ini timbul karena konsentrasi garam terlarut yang tinggi menyebabkan menurunnya potensial larutan tanah sehingga tanaman kekurangan air (Sipayung, 2003).
Garam-garam yang menimbulkan stress tanaman antara lain NaCl, NaSO4,
CaCl2, MgSO4, MgCl2 yang larut dalam air. Dalam larutan tanah garam-garam ini
mempengaruhi pH dan daya hantar listrik. Menurut Sipayung (2003) tanah salin memiliki pH < 8,5 dengan daya hantar listrik >4mmhos/cm. Nilai daya hantar listrik (DHL) mencerminkan kadar garam yang terlarut. Peningkatan konsentrasi garam yang terlarut akan menaikkan nilai DHL larutan yang diukur dengan menggunakan elektroda platina.
Garam-garam atau Na+ yang apat dipertukarkan akan mempengaruhi sifat-sifat tanah jika terdapat dalam keadaan yang berlebihan dalam tanah. Kekurangan unsur Na+ dan Cl- dapat menekan pertumbuhan dan mengurangi produksi. Peningkatan konsentrasi garam terlarut di dalam tanah akan meningkatkan tekanan osmotik sehingga menghambat penyerapan air dan unsur-unsur hara yan berlangsung melalui proses osmosis. Jumlah air yang masuk ke akar berkurang sehingga mengakibatkan menipisnya jumlah persediaan air dalam tanaman (Sipayung 2003).
Menurut Sipayung (2003), salinitas akan mempengaruhi sifat fisik dan kimia tanah yaitu : 1) tekanan osmotik yang meningkat, 2) peningkatan potensi ionisasi, 3) infiltrasi tanah menjadi buruk, 4) kerusakan dan terganggunya struktur tanah, 5) permeabilitas tanah yang buruk, 6) penurunan konduktivitas. Salinitas atau konsentrasi garam-garam terlarut yang cukup tinggi akan menimbulkan stress dan memberikan tekanan terhadap pertumbuhan tanaman. Salinitas dapat menghambat pertumbuhan tanaman dengan dua cara yaitu :
a. Dengan merusak sel-sel yang sedang tumbuh sehingga pertumbuhan tanaman terganggu.
b. Dengan membatasi jumlah suplai hasil-hasil metabolisme esensial bagi pertumbuhan sel melalui pembentukan tyloses.
Kelarutan garam yang tinggi dapat menghambat penyerapan (up take) air dan hara oleh tanaman seiring dengan terjadinya peningkatan tekanan osmotic. Secara khusus, kegaraman yang tinggi menimbulkan keracunan tanaman, terutama oleh ion Na+ dan Cl-. Beberapa tanaman peka terhadap kegaraman (<4 dS.m-1) seperti apel, jeruk, dan kacang-kacangan, tanaman lain nisbi tahan kegaraman (4-10 dS.m-1) seperti padi, kentang, mentimun, sorgum dan jagung dan tanaman yang lainnya lebih tahan kegaraman (>10 dS.m-1) seperti kapas, bayam, dan kurma (Noor,2004).
tanaman pada tanah dengan tingkat salinitas yang cukup tinggi adalah pertumbuhan yang tidak normal seperti daun mengering di bagian ujung dan gejala khlorosis. Gejala ini timbul karena konsentrasi garam terlarut yang tinggi menyebabkan menurunnya potensi larutan tanah sehingga tanaman kekurangan air (Sipayung, 2003).
Menurut Phang, et al (2008), tingginya konsentrasi garam menyebabkan gangguan pada seluruh siklus hidup kedelai. Tingkat toleransi kedelai pada berbagai varietas kedelai bervariasi menurut tingkat pertumbuhan. Perkecambahan biji kedelai akan terhambat pada konsentrasi garam rendah. Konsentrasi garam yang lebih tinggi secara nyata akan menurunkan persentase perkecambahan. Pengaruh garam pada tahap awal dan penurunan persentase perkecambahan lebih menonjol pada varietas yang sensitive dibandingkan varietas toleran. Sifat-sifat agronomi kedelai sangat dipengaruhi oleh salinitas yang tinggi, diantaranya :
1. Pengurangan tinggi tanaman, ukuran daun, biomassa, jumlah ruas, jumlah cabang, jumlah polong, bobot tanaman dan bobot 100 biji
2. Penurunan kualitas biji
3. Penurunan kandungan protein biji
4. Menurunkan kandungan minyak pada biji kedelai 5. Nodulasi kedelai
Mekanisme toleransi tanaman terhadap salinitas dapat dilihat dalam dua bentuk adaptasi yaitu dengan mekanisme morfologi dan fisiologi. Mekanisme toleransi yang paling jelas adalah dengan adaptasi morfologi (Sipayung, 2003).
Respon perubahan struktural dapat beragam pada berbagai jenis tanaman dan tipe salinitas. Salinitas klorida umumnya menambah sukulensi pada banyak spesies tanaman. Sukulensi terjadi dengan meningkatnya konsentrasi SO4. Dengan
adaptasi struktural ini kondisi air akan berkurang dan mungkin akan menurunkan kehilangan air pada transpirasi. Namun pertumbuhan akar yang terekspos pada lingkungan salin biasanya kurang terpengaruh dibandingkan dengan pertumbuhan tajuk atau buah. Hal ini diduga terjadi akibat perbaikan keseimbangan dengan mempertahankan kemampuan menyerap air (Sipayung, 2003).
Berbagai cekaman abiotik menyebabkan kelebihan spesies oksigen reakif (ROS) pada tanaman yang sangat reaktif dan beracun yang menyebabkan kerusakan protein, lipid, karbohidrat dan DNA yang akhirnya mengakibatkan stress oksidatif. ROS terdiri dari radikal bebas (O2), radikal superoksida (OH),
radikal hidroksil (HO2), radikal perhydroxy dan non radikal (H2O2). ROS juga
mempengaruhi ekspresi sejumlah gen, oleh karena itu ROS mengontrol banyak proses seperti pertumbuhan, siklus sel, penuaan sel, respon stress abiotik, pertahanan pathogen, dan pertumbuhan (Gill and Tuteja, 2010).
Asam Askorbat (Vitamin C)
Vitamin adalah senyawa-senyawa organic tertentu yang diperlukan dalam jumlah kecil dalam tubuh tetapi esensial untuk reaksi metabolism dalam sel, penting untuk melangsungkan pertumbuhan normal, serta memelihara kesehatan. Vitamin C (asam askorbat) merupakan vitamin yang dapat disintesis oleh tumbuhan tetapi tidak dapat disintesis oleh manusia, kera, dan sebagian mamalia lainnya (Poedjiadi, 1994).
Vitamin C mempunyai rumus empiris C6H8O6 dalam bentuk murni
merupakan Kristal putih, tidak berbau dan mencair pada suhu 190-1920C. Vitamin C merupakan senyawa yang sangat mudah larut dalam air, mempunyai sifat asam dan sifat pereduksi yang kuat. Sifat-sifat tersebut terutama disebabkan karena adanya struktur enediol yang berkonjugasi dengan gugus karbonil dalam cincin lakton. Bentuk vitamin C yang ada di alam terutama adalah L-asam askorbat. D-asam askorbat jarang terdapat di alam dan hanya memiliki 10 persen aktivitas vitamin C. Biasanya D-asam askorbat ditambahkan ke dalam bahan pangan sebagai antioksidan, bukan sebagai sumber vitamin C (Andarwulan dan Koswara, 1992).
lembab akan menyebabkan terdegradasi menjadi zat lainnya sehingga hilang potensi vitamin C-nya (Kusnawidjaja, 1987).
Winarno (1992), vitamin C merupakan vitamin yang paling mudah rusak, sangat larut dalam air, serta mudah teroksidasi. Proses oksidasi tersebut dipercepat oleh panas, sinar, alkali, enzim, oksidator, serta oleh katalisis tembaga dan besi. Oksidasi akan terhambat bila vitamin C dibiarkan dalam keadaan asam atau pada suhu rendah. Asam askorbat merupakan salah satu senyawa yang penting dalam proses selular termasuk pembelahan dan pembesaran sel serta dalam mengaktifkan aktivitas metabolisme ketika proses perkecambahan dimulai. Menetralisir racun, melindungi sel dari senyawa oksigen reaktif dan radikal bebas serta mencegah kematian sel (Conklin dan Barth, 2004).
Metabolisme Vitamin C pada Tanaman
Vitamin C (asam askorbat) pada tumbuhan banyak terdapat di kloroplas, karena asam ini berfungsi sebagai senyawa antara dalam metabolisme karbohidrat. Bioseintesis asam askorbat membutuhkan D_glukosa. Biosintesis asam askorbat dalam tumbuhan menurut Smirnoff (1996) adalah sebagai berikut :
Asam askorbat bersifat sangat sensitif terhadap pengaruh-pengaruh dari luar yang menyebabkan kerusakan seperti suhu, konsentrasi gula dan garam, pH, oksigen, enzim, katalisator logam, konsentrasi awal asam askorbat baik dalam larutan, serta perbandingan asam askorbat dan asam dehidroaskorbat (Muchtadi dkk, 1993).
Asam askorbat sangat mudah teroksidasi menjadi asam dehidroaskorbat dimana reaksi yang terjadi bersifat reversible (bolak-balik). Asam L-askorbat dan asam L-dehidroaskorbat mempunyai 100% aktivitas vitamin C, sedangkan 2,3 asam diketogulonat sudah tidak mempunyai aktivitas vitamin C lagi.
Peranan Asam Askorbat Pada Tanaman
Askorbat memilki sifat antioksidan yang baik dalam mendeteksi spesies
oksigen reaktif (ROS) dan spesies nitrogen reaktif, serta mendaur ulang α
-tokoferol yang teroksidasi. Singkatnya, sistem in vitro telah menunjukkan
askorbat sebagai pendeteksi superoksida, hidroksil, hidrofilik peroksil, thiyl, dan
radikal nitroksida sebaik asam hipoklorit dan hidrogen peroksida. Hal ini telah
dikemukakan secara rinci sebelumnya. Fungsi lain askorbat adalah dalam
metabolisme besi dengan mempertahankan besi pada tingkat reduksi askorbat
sehingga memicu penyerapan besi. Selain itu askorbat juga memobilisasi besi dari
deposit feritin (Drevan, 2011).
Hasil penelitian Basra et al. (2006) menunjukkan bahwa priming mampu meningkatkan vigor benih padi, priming dengan asam askorbat dan asam salsilat mampu meningkatkan keseragaman perkecambahan, mempercepat waktu terjadinya perkecambahan, menurunkan T50, meningkatkan panjang radikula dan
plumula serta meningkatkan bobot basah dan bobot kering bibit.
Hasil penelitian Shaddad et al. (1989) menunjukkan bahwa perendaman benih Lupinus termis dan Vicia faba dalam larutan asam askorbat 50 ppm selama 4 jam sebelum tanam mampu meningkatkan persentase perkecambahan, panjang kecambah, bobot kering kecambah, kandungan karbohidrat, protein, dan asam amino serta mengurangi efek merugikan yang ditimbulkan oleh kondisi cekaman garam.
El-Zawahry dan Hamada (1994) menggunakan tiga senyawa yaitu asam askorbat, pyridoxine dan thiamin dengan konsentrasi masing-masing 50 dan 100 ppm selama 5 jam sebagai perakuan pra tanam pada benih terong (Solanum melongena) kultivar Black Balady, hasilnya menunjukkan bahwa perlakuan
yang sehat, thiamin dan pyridoxin mampu mengurangi jumlah nematode tetapi tidak dengan asam askorbat.
Hasil penelitian Basra et al. (2006) menunjukkan bahwa priming benih padi kultivar KS-282 dan Super Basmati dengan asam askorbat dan asam salsilat 10 dan 20 ppm selama 48 jam mampu meningkatkan vigor bibit, keseragaman dan keserempakan tumbuh, menurunkan waktu untuk memulai perkecambahan dan T50, meningkatkan panjang plumula dan radikula serta meningkatkan bobot segar dan bobot kering bibit. Priming dengan asam askorbat 10 ppm selama 24 jam juga mampu meningkatkan kinerja, pertumbuhan dan produksi benih padi Super Basmati yang ditanam dengan system tebar langsung (Farooq et al, 2006) dan yang ditanam melalui persemaian (Farooq et al., 2007).
Hasil penelitian Dolatabadian dan Modarressanavy (2008) menunjukkan bahwa perlakuan pra tanam dengan asam askorbat dan pyridoxine terhadap benih Helianthus annus L., dan Brassica napus L., mampu meningkatkan daya
berkecambah, mencegah kerusakan protein dan peroksidasi lemak.
Perlakuan asam askorbat dan α-tokoferol mampu meningkatkan vigor benih bunga matahari (suherman, 2005). Perlakuan asam salsilat 50 ppm dan asam askorbat 50 ppm sebagai perlakuan pra tanam pada benih gandum (Triticum aestivum L.) cv. Ugab-2000 mampu meningkatkan vigor kecambah, bobot segar
BAB I
PENDAHULUAN
Latar Belakang
Kedelai merupakan komoditas pangan penghasil protein nabati yang sangat penting, baik karena gizinya, aman dikonsumsi, maupun harganya yang relatif murah dibandingkan dengan sumber protein hewani. Di Indonesia, kedelai umumnya dikonsumsi dalam bentuk pangan olahan seperti tahu, tempe, susu kedelai dan berbagai bentuk makanan ringan (Damardjati dkk, 2005).
Proyeksi konsumsi kedelai menunjukkan bahwa total kebutuhan terus mengalami peningkatan yaitu 2,71 juta ton pada tahun 2015 dan 3,35 juta ton pada tahun 2025. Jika sasaran produktivitas rata-rata nasional 1,5 t/ha bisa dicapai, maka kebutuhan areal tanam diperkirakan sebesar 1,81 juta ha pada tahun 2015 dan 2,24 juta ha pada tahun 2025 (Simatupang, dkk, 2005). Tantangannya adalah bagaimana mencapai areal tanam tersebut sementara lahan yang tersedia terbatas dan digunakan untuk berbagai tanaman palawija lainnya yang lebih kompetitif (Atman, 2009). Penurunan produksi, menurut pendataan BPS, utamanya terjadi karena luas panen tanaman kedelai yang pada 2010 tercatat 660.823 hektar berkurang menjadi 631.425 hektar pada 2011.
disebabkan adanya efek toksik dan peningkatan tekanan osmotik akar yang mengakibatkan terganggunya pertumbuhan tanaman (Slinger and Tenison, 2005).
Pada kondisi salin, pertumbuhan dan perkembangan tanaman terhambat karena akumulasi berlebihan Na dan Cl dalam sitoplasma, menyebabkan perubahan metabolisme di dalam sel. Aktivitas enzim terhambat oleh garam. Kondisi tersebut juga mengakibatkan dehidrasi parsial sel dan hilangnya turgor sel karena berkurangnya potensial air di dalam sel (Yuniati, 2004). Stomata berperan penting sebagai alat untuk adaptasi tanaman terhadap cekaman kekeringan. Pada kondisi cekaman kekeringan maka stomata akan menutup sebagai upaya untuk menahan laju transpirasi.
Stres lingkungan memicu berbagai macam respon tanaman, mulai dari mengubah ekspresi dan metabolisme seluler untuk mempercepat penuaan daun dan layu permanen, semuanya mengarah pada perubahan tingkat pertumbuhan dan produksi tanaman. Stress garam memberikan pengaruh buruk terhadap pertumbuhan dan produktivitas tanaman (Reddy et al., 2004; Baek et al., 2005; Amor et al., 2005). Melalui peningkatan Reactive Spesies Oxygen (ROS) yang dapat menyebabkan stress oksidatif mengakibatkan kerusakan sel oleh oksidasi lipid, protein dan asam nukleat (McKersie and Leshem, 1994; Pastori and Foyer, 2002; Apel and Hirt, 2004). Untuk meminimalkan efek stres garam oksidatif, sel-sel tumbuhan telah berevolusi membentuk system antioksidan kompleks yang akan menurunkan konsentrasi ROS (Beltagi, 2008).
sebagai antioksidan, kofaktor enzim dan sebagai modulator sel sinyal dalam beragam proses fisiologis penting, termasuk biosintesis dinding sel, metabolit sekunder dan phytohormones, toleransi stress, photoprotection, pembelahan dan pertumbuhan sel (Wolucka et al, 2005).
Tanaman yang tercekam salinitas juga mengalami stres oksidatif yang mengakibatkan terhambatnya proses fotosintesis seperti transport elektron (Greenway dan Munns, 1980). Stres oksidatif menginduksi konsentrasi ROS (Reactive Oxygen Spesies) yang lebih tinggi/menengah seperti superoksida (O2),
H2O2 dan radikal hidroksi, karena proses transportasi electron terganggu di
kloroplas, mitokondria, dan jalur fotorespirasi. Keadaan ini mengakibatkan terjadinya ketidakseimbangan antara Source dan Sink dalam metabolisme tanaman. Aplikasi asam askorbat, diharapkan dapat mencegah/mengurangi aktifitas ROS yang terjadi akibat stres garam sehingga tanaman lebih toleran dan sebagai indikator adalah meningkatnya aktifitas SOD (superoksida dimustase) (Bohnert dan Jensen, 1995) yang berperan melindungi fungsi kloroplas (Orcutt dan Nilsen, 2000).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh perlakuan asam askorbat terhadap pertumbuhan dan produksi kedelai (Glycine max (L.) Merril) varietas Grobogan pada tanah salin.
Hipotesis Penelitian
Kegunaan Penelitian
1. Sebagai salah satu syarat untuk dapat melakukan penelitian di Fakultas Pertanian Universitas Sumatera Utara, Medan.
ABSTRACT
ELPRIN NIWITA SITINJAK : Response on Growth and Yield of Soybean (Glycine max L.) Varieties Grobogan to Ascorbate Acid in the Land of Salinity , supervised by LUTHFI A. M. SIREGAR and ROSMAYATI.
To increasing the production of plant can be done by utilizing marginal lands such as saline soil due to the limited agricultural land through the use of salt-tolerant soybean and crop nutrient management. One of them by giving ascorbic acid as an antioxidant to minimize the effects of salt stress. The study was conducted in the village of Tanjung Rejo Experiment Land District Percut Sei Tuan Deli Serdang regency with ± 1.5 m altitude above sea level, which was held in April 2012 to July 2012. Experimental was conducted using by Randomize Block Design Non Factor consist of four degrees, were 0 ppm (control), 200 ppm, 400 ppm, and 600 ppm, eight replications was used to the treatments. Data were analyzed with ANOVA and continued with Duncan Multiple Range Test (DMRT).
The results showed that treatment were significantly to parameters plant high 3 and 4 weeks after planted, branches number 5 weeks after planted, number of pods contents per plant sample, the number of branch at 3 weeks after planted, seeds production per plant, weight of seeds per sample, weight of 100 seeds, number of chlorophyll a, chlorophyll b and total chlorophyll. The treatment were not significantly to parameters number branch 3 and 4 weeks after planted, age of flowering, harvesting age, number of empty pods,
ABSTRAK
ELPRIN NIWITA SITINJAK : Respons Pertumbuhan dan Produksi Kedelai (Glycine max ( L.) Merril) Varietas Grobogan Dengan Pemberian Asam Askorbat Pada Tanah Salin, dibimbing oleh LUTHFI A. M. SIREGAR dan ROSMAYATI.
Peningkatan produksi kedelai dapat dilakukan dengan memanfaatkan tanah-tanah marginal seperti tanah salin akibat semakin sempitnya lahan pertanian melalui pemanfaatan kedelai toleran garam dan pengelolaan nutrisi tanaman. Salah satunya dengan pemberian asam askorbat sebagai antioksidan bagi tanaman untuk meminimalkan efek stress garam. Penelitian dilakukan di Lahan Percobaan Desa Tanjung Rejo Kecamatan Percut Sei Tuan Kabupaten Deli Serdang dengan ketinggian tempat ± 1.5 m dpl, yang dilaksanakan pada bulan April 2012 hingga bulan Juli 2012. Penelitian ini menggunakan Rancangan Acak Kelompok Non Faktorial yang terdiri dari 4 taraf perlakuan asam askorbat yaitu 0 ppm (kontrol), 200 ppm, 400 ppm dan 600 ppm, perlakuan diulang delapan kali. Data yang diperoleh dianalisis dengan menggunakan sidik ragam dan dilanjutkan dengan Uji Jarak Berganda Duncan (DMRT) pada taraf 5%.
Hasil analisis data menunjukkan bahwa perlakuan asam askorbat berbeda nyata terhadap parameter tinggi tanaman 3 MST, 4 MST, jumlah cabang 5 MST, jumlah polong berisi pertanaman, jumlah biji pertanaman, bobot biji pertanaman, bobot 100 biji, jumlah klorofil a, klorofil b dan total klorofil. Perlakuan yang tidak berpengaruh nyata adalah jumlah cabang 3 MST, 4 MST, umur berbunga, umur panen dan jumlah polong hampa pertanaman.
RESPONS PERTUMBUHAN DAN PRODUKSI KEDELAI (Glycine max (L.) Merril) VARIETAS GROBOGAN DENGAN PEMBERIAN ASAM
ASKORBAT PADA TANAH SALIN
SKRIPSI
OLEH :
ELPRIN NIWITA SITINJAK 080307029/PEMULIAAN TANAMAN
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
RESPONS PERTUMBUHAN DAN PRODUKSI KEDELAI (Glycine max (L.) Merril) VARIETAS GROBOGAN DENGAN PEMBERIAN ASAM
ASKORBAT PADA TANAH SALIN
SKRIPSI
OLEH :
ELPRIN NIWITA SITINJAK 080307029/PEMULIAAN TANAMAN
Skripsi Sebagai Salah Satu Syarat Untuk Mendapatkan Gelar Sarjana di Fakultas Pertanian Universitas
Sumatera Utara, Medan
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
Judul Skripsi : Respons Pertumbuhan Dan Produksi Kedelai (Glycine max (L.) Merril) Varietas Grobogan Dengan Pemberian Asam Askorbat Pada Tanah Salin
Nama : Elprin Niwita Sitinjak NIM : 080307029
Program Studi : Agroekoteknologi
Disetujui oleh, Komisi Pembimbing :
Mengetahui,
Ir. T. Sabrina, M.Agr.Sc, Ph.D Ketua Departemen Agroekoteknologi Ketua Komisi Pembimbing
Luthfi Aziz Mahmud Siregar, SP. MSc. Ph.D NIP : 197307122005021006
Anggota Komisi Pembimbing
ABSTRACT
ELPRIN NIWITA SITINJAK : Response on Growth and Yield of Soybean (Glycine max L.) Varieties Grobogan to Ascorbate Acid in the Land of Salinity , supervised by LUTHFI A. M. SIREGAR and ROSMAYATI.
To increasing the production of plant can be done by utilizing marginal lands such as saline soil due to the limited agricultural land through the use of salt-tolerant soybean and crop nutrient management. One of them by giving ascorbic acid as an antioxidant to minimize the effects of salt stress. The study was conducted in the village of Tanjung Rejo Experiment Land District Percut Sei Tuan Deli Serdang regency with ± 1.5 m altitude above sea level, which was held in April 2012 to July 2012. Experimental was conducted using by Randomize Block Design Non Factor consist of four degrees, were 0 ppm (control), 200 ppm, 400 ppm, and 600 ppm, eight replications was used to the treatments. Data were analyzed with ANOVA and continued with Duncan Multiple Range Test (DMRT).
The results showed that treatment were significantly to parameters plant high 3 and 4 weeks after planted, branches number 5 weeks after planted, number of pods contents per plant sample, the number of branch at 3 weeks after planted, seeds production per plant, weight of seeds per sample, weight of 100 seeds, number of chlorophyll a, chlorophyll b and total chlorophyll. The treatment were not significantly to parameters number branch 3 and 4 weeks after planted, age of flowering, harvesting age, number of empty pods,
ABSTRAK
ELPRIN NIWITA SITINJAK : Respons Pertumbuhan dan Produksi Kedelai (Glycine max ( L.) Merril) Varietas Grobogan Dengan Pemberian Asam Askorbat Pada Tanah Salin, dibimbing oleh LUTHFI A. M. SIREGAR dan ROSMAYATI.
Peningkatan produksi kedelai dapat dilakukan dengan memanfaatkan tanah-tanah marginal seperti tanah salin akibat semakin sempitnya lahan pertanian melalui pemanfaatan kedelai toleran garam dan pengelolaan nutrisi tanaman. Salah satunya dengan pemberian asam askorbat sebagai antioksidan bagi tanaman untuk meminimalkan efek stress garam. Penelitian dilakukan di Lahan Percobaan Desa Tanjung Rejo Kecamatan Percut Sei Tuan Kabupaten Deli Serdang dengan ketinggian tempat ± 1.5 m dpl, yang dilaksanakan pada bulan April 2012 hingga bulan Juli 2012. Penelitian ini menggunakan Rancangan Acak Kelompok Non Faktorial yang terdiri dari 4 taraf perlakuan asam askorbat yaitu 0 ppm (kontrol), 200 ppm, 400 ppm dan 600 ppm, perlakuan diulang delapan kali. Data yang diperoleh dianalisis dengan menggunakan sidik ragam dan dilanjutkan dengan Uji Jarak Berganda Duncan (DMRT) pada taraf 5%.
Hasil analisis data menunjukkan bahwa perlakuan asam askorbat berbeda nyata terhadap parameter tinggi tanaman 3 MST, 4 MST, jumlah cabang 5 MST, jumlah polong berisi pertanaman, jumlah biji pertanaman, bobot biji pertanaman, bobot 100 biji, jumlah klorofil a, klorofil b dan total klorofil. Perlakuan yang tidak berpengaruh nyata adalah jumlah cabang 3 MST, 4 MST, umur berbunga, umur panen dan jumlah polong hampa pertanaman.
RIWAYAT HIDUP
Elprin Niwita Sitinjak, lahir di Bah Raja II, 25 April 1990. Anak dari S. Sitinjak (Alm) dan S. br Napitupulu yang beralamat di Panetongah, P. Siantar. Anak ke-6 dari 6 bersaudara.
Adapun riwayat pendidikan dari penulis adalah sebagai berikut: SD Negeri No 095149 di Panetongah tamat tahun 2002, SMP Negeri 1 di Panetongah tamat tahun 2005, SMA Negeri 1 di P. Siantar tamat tahun 2008.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa, karena berkat rahmat dan hidayahNya penulis dapat menyelesaikan usulan penelitian ini.
Adapun judul dari skripsi ini adalah “Respons Pertumbuhan Dan Produksi Kedelai (Glycine max (L.) Merril) Varietas Grobogan Dengan
Pemberian Asam Askorbat Pada Tanah Salin” yang merupakan salah satu
syarat untuk mendapatkan gelar sarjana di Fakultas Pertanian, Universitas Sumatera Utara.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Luthfi Aziz Mahmud Siregar, SP. MSc. Ph.D selaku ketua komisi pembimbing
dan Prof. Dr. Ir. Rosmayati, MS selaku anggota komisi pembimbing yang telah memberikan bantuan dalam penyelesaian skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, penulis mengharapkan saran dan kritik demi penyempurnaan skripsi ini.
Akhir kata, penulis mengucapkan terima kasih dan semoga skripsi ini bermanfaat bagi kita semua.
Medan, Agustus 2012
DAFTAR ISI
Pengaruh Salinitas Terhadap Tanah dan Tanaman ... 10
Pemeliharaan Tanaman ... 22
Jumlah Polong Berisi Pertanaman (polong) ... 24