PENAPISAN BAKTERI PENGHASIL SENYAWA ANTIMIKROB
YANG BERASOSIASI DENGAN SPONS
sp. DAN
DETEKSI GEN PENYANDI POLIKETIDA SINTASE
DAN PEPTIDA SINTASE NONRIBOSOM
MEGASARI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PENAPISAN BAKTERI PENGHASIL SENYAWA ANTIMIKROB
YANG BERASOSIASI DENGAN SPONS
sp. DAN
DETEKSI GEN PENYANDI POLIKETIDA SINTASE
DAN PEPTIDA SINTASE NONRIBOSOM
MEGASARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MEGASARI. Penapisan Bakteri Penghasil Senyawa Antimikrob yang Berasosiasi dengan Spons sp. dan Deteksi Gen Penyandi Poliketida Sintase dan Peptida Sintase Nonribosom. Dibimbing oleh ARIS TRI WAHYUDI dan NISA RACHMANIA MUBARIK.
Spons tergolong dalam Filum Porifera memiliki kemampuan bersimbiosis dengan mikroorganisme. Simbiosis tersebut menghasilkan produk alami yang menguntungkan seperti poliketida dan peptida nonribosom yang memiliki aktivitas antimikrob. Poliketida dan peptida nonribosom masing-masing dibentuk oleh gen (PKS) dan
(NRPS). Keduanya merupakan enzim multifungsional yang terlibat dalam biosintesis senyawa bioaktif yang penting dalam bidang farmasi dan industri. Penelitian ini bertujuan menapis bakteri asal spons penghasil senyawa antimikrob dan mendeteksi gen yang berperan dalam biosintesis senyawa bioaktif tersebut. Sebanyak 18 isolat bakteri yang diisolasi dari spons sp. dan diuji aktivitas antimikrobnya, didapatkan 12 isolat bakteri yang
menghambat pertumbuhan empat bakteri patogen, yaitu ,
(EPEC), , , dua bakteri nonpatogen, yaitu
, , dan dua cendawan patogen, yaitu , dan
Deteksi gen penyandi PKS dan NRPS dilakukan dengan teknik
(PCR) menggunakan primer spesifik yang masing-masing menghasilkan amplikon berukuran 700 pb dan 1000 pb. Satu isolat yang memiliki aktivitas antimikrob terbaik dan memiliki kedua gen penyandi PKS dan NRPS yaitu Iso 10 dipilih untuk analisis homologinya. Fragmen DNA dari genom Iso 10 KS (700 pb) yang telah berhasil diklon ke dalam plasmid pGEMT dan disekuen, menyatakan homologinya dengan domain KS sekitar 49-51%.
Keyword: senyawa bioaktif, antimikrobial, PKS, NRPS, spons
ABSTRACT
MEGASARI. Screening of Bacteria Producing Antimicrobial Compounds which is Associated with sp. Sponge and Detection Its Encoding Peptide Synthase and Non-ribosomal Polyketide Synthase Gene. Supervised by ARIS TRI WAHYUDI and NISA RACHMANIA MUBARIK.
Sponges are classified in the Porifera phylum have the ability to symbiosis with microorganisms. The symbiont produced useful natural products such as polyketides and non-ribosomal peptides that possessed antimicrobial activities. Each polyketide and non-non-ribosomal peptide are synthesized by the (PKS) dan
(NRPS) gene. Both of them are multifunctional enzymes that involved in the biosynthesis bioactive compounds that are important in pharmaceutical and other industries.The aims of study was to screened the bacteria producing antimicrobial compounds which is associated with sponge and detect the genes that play a role in the biosynthesis of bioactive compounds. A total of 18 isolates bacteria that associated with sp. was tested their antimicrobial activity and finally 12 isolates bacteria that inhibited four pathogenic bacteria growth that consist of
, (EPEC), ,
, and two non-pathogenic bacteria that consist of , ,
and the two pathogenic fungus and . Detection of PKS and
NRPS encoding gene performed by (PCR) using specific primers,
producing 700 bp and 1000 bp amplicon. One isolate that possessed the best antimicrobial activities and both of PKS and NRPS gene which is Iso 10 are selected for homology test. DNA fragment from Iso 10 KS genome (700 bp) that have been successfully cloned into plasmid pGEMT and sequenced and its homology with other KS domain sequences of about 49-51%.
Judul : Penapisan Bakteri Penghasil Senyawa Antimikrob yang Berasosiasi dengan
Spons
sp. dan Deteksi Gen Penyandi Poliketida Sintase dan
Peptida Sintase Nonribosom
Nama : Megasari
NIM
: G34061194
Disetujui:
Pembimbing I,
Pembimbing II,
(Dr. Aris Tri Wahyudi, M.Si.) (Dr.Nisa Rachmania Mubarik, M.Si.)
NIP 19630705 199103 1 005
NIP 19671127 199302 2 001
Diketahui:
Ketua Departemen Biologi
Institut Pertanian Bogor
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus karena dengan berkat, kuasa, dan roh kudus-Nya penulis dapat menyelesaikan penelitian dan menyusun skripsi ini. Tema penelitian ini yaitu Penapisan Bakteri Penghasil Senyawa Antimikrob yang Berasosiasi dengan Spons sp. dan Deteksi Gen Penyandi Poliketida Sintase dan Peptida Sintase Nonribosom. Penelitian ini dilaksanakan mulai bulan Februari sampai Oktober 2010 di Laboratorium Mikrobiologi Departemen Biologi, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Bapak Dr. Aris Tri Wahyudi, M.Si. dan Ibu Dr. Nisa Rachmania Mubarik, M.Si. selaku pembimbing atas saran dan bimbingannya dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Terima kasih disampaikan kepada Ibu Dr. Ir. Raden Roro Dyah Perwitasari, M.Sc. sebagai wakil komisi pendidikan atas saran dan diskusi yang diberikan. Terima kasih juga kepada Bang Yonathan Banoet, Mbak Rika Astuti, Mbak Ari untuk saran dan bantuannya selama penelitian di laboratorium. Selain itu, ucapan terima kasih penulis sampaikan kepada teman-teman terdekat, keluarga besar laboratorium mikrobiologi FMIPA IPB, keluarga perwira 52, Komisi Literatur PMK IPB, serta teman-teman seperjuangan di Biologi 43 yang tidak dapat disebutkan satu per satu, atas segala bantuan dan semangat yang telah diberikan. Ucapan terima kasih juga penulis sampaikan kepada Mama, Papa, Robby Sutady, Angela Meliana, atas do`a, dukungan, semangat, dan segala cinta yang diberikan.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, November 2010
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 4 Mei 1988 dari Bapak Wijaya Sutady dan Ibu Lenny. Penulis merupakan anak ketiga dari tiga bersaudara. Tahun 2006 penulis lulus dari SMU TARAKANITA 1 JAKARTA dan lolos seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ……… vii
DAFTAR GAMBAR……...……….… vii
DAFTAR LAMPIRAN…..………..… vii
PENDAHULUAN Latar Belakang………. 1
Tujuan…... 1
Waktu dan Tempat Penelitian……….. 2
BAHAN DAN METODE Bahan dan Alat………...…… 2
Metode………. 2
Penapisan Bakteri Penghasil Senyawa Antibakteri………...……….. 2
Pengujian Bakteri Penghasil Senyawa Antifungi………...…………. 2
Isolasi DNA Genom……… 2
Amplifikasi Domain KS dan Domain A………. 2
Kloning Domain KS dan Domain A ke dalam Sel DH5α...……….. 3
Analisis Bioinformatika………...………...…… 3
HASIL Penapisan Bakteri Penghasil Senyawa Antibakteri…...……… 3
Penapisan Bakteri Penghasil Senyawa Antifungi………...………. 4
Amplifikasi Domain KS dan Domain A……….... 5
Kloning Domain KS dan Domain A dalam Sel DH5α……….. 6
Verifikasi Hasil Kloning Domain KS dan Domain A……… 6
Analisis Bioinformatika………. 6
PEMBAHASAN……… 7
SIMPULAN……… 8
DAFTAR PUSTAKA……… 8
DAFTAR TABEL
Halaman 1 Hasil penapisan bakteri yang berasosiasi dengan spons yang memiliki aktivitas antibakteri
dan antifungi……….………..……….…... 5
2 Analisis homologi sekuen Iso 10 KS terhadap sekuen domain KSasal " ... 7
DAFTAR GAMBAR
Halaman 1 Zona bening di sekitar koloni terhadap (a) , (b) #( c) # (d) EPEC………. 42 Zona bening di sekitar koloni terhadap (a) dan (b) (b) ………..………. 4
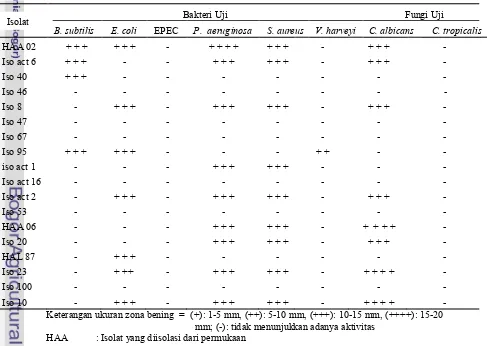
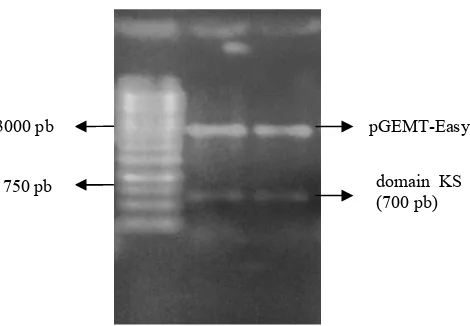
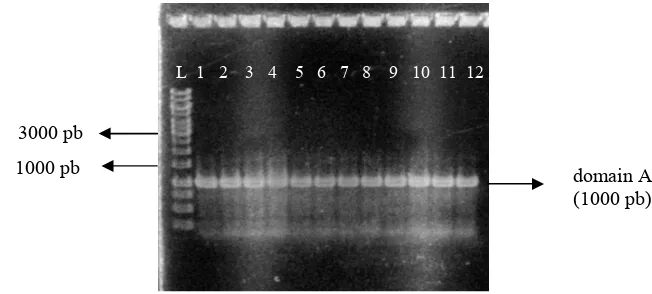
3 Elektroforesis gel agarosa 1% (b/v) hasil amplifikasi domain KS untuk 12 isolat yang berasosiasi dengan spons sp. Ket: (L) 1 Kb $ , (1) HAA 02, (2) Iso act 6, (3) Iso 8, (4) Iso act 2, (5) Iso 95, (6) Iso act 1, (7) Iso 40, (8) HAA 06, (9) HAL 87, (10) Iso 23, (11) Iso 20, (12) Iso 10…. 5 4 Elektroforesis gel agarosa 1% (b/v) hasil amplifikasi domain A untuk 12 isolat yang berasosiasi dengan spons sp. Ket: (L) 1 Kb $ , (1) HAA 02, (2) Iso act 6, (3) Iso 8, (4) Iso act 2, (5) Iso 95, (6) Iso act 1, (7) Iso 40, (8) HAA 06, (9) HAL 87, (10) Iso 23, (11) Iso 20, (12) Iso 10… 5 5 Koloni putih DH5α pada isolat Iso 10 yang diduga membawa plasmid rekombinan………… 6
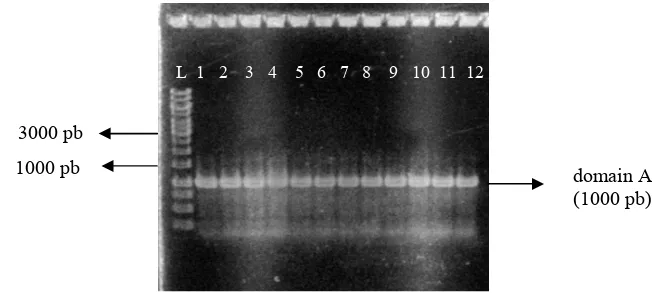
6 Elektroforesis agarosa 1% dari pGEMT-Easy-10-KS dipotong dengan RI……… 6
DAFTAR LAMPIRAN
Halaman 1 Komposisi macam-macam media yang digunakan dalam proses penapisan bakteri yang berasosiasi dengan spons sp………..……….…... 112 Bahan-bahan dan media yang digunakan dalam proses transformasi………... 11
3 Sekuen dari Iso 10 KS (dalam bentuk FASTA)………...………... 11
PENDAHULUAN
Latar Belakang
Mikrob dapat berinteraksi dengan organisme laut, seperti spons, dan menghasilkan berbagai produk alami. Produk alami yang berasal dari metabolit sekunder mikrob berperan penting dalam penelitian medis dan pengembangan obat. Produk alami tersebut dapat secara lansung menjadi obat atau menjadi struktur dasar sintesis obat kimia baru (Bahkuni . 2005). Sejak tahun 1981, dilaporkan bahwa sekitar 40% produk kimia berasal dari turunan produk alami mikrob (Lanen & Shen 2006). Keuntungan dari produk alami sebagai senyawa bioaktif karena dapat memiliki aktivitas antimikrob, antiviral, antimalaria, antikanker, antitumor, bahkan memiliki aktivitas % .
Spons yang sudah diteliti dan menghasilkan senyawa bioaktif antara lain
& sp., #
# ' #
# dan Kennedy
(2008, 2009) melaporkan, pada ditemukan sekitar delapan filum bakteri. Filum yang paling
banyak ditemukan ialah filum
# #
( # dan ) . Metabolit
yang diisolasi dari bakteri yang berasosiasi
dengan spons sp., misalnya:
sterol, steroid, alkaloid, avarol, nukleosida, peptida, dan poliketida (Blunt . 2007). Peptida nonribosom sebagai salah satu senyawa bioaktif memiliki kemampuan untuk menjadi antibiotik hingga racun. Oleh karena itu, investigasi biosintesis peptida sangat menarik untuk pembentukan obat baru dalam bidang farmasi modern. Selain peptida nonribosom, poliketida juga memiliki peran penting dalam industri agrokimia, farmasi, dan bioteknologi (Schwarger . 2003, Kennedy 2008).
Peptida nonribosom atau poliketida masing-masing dibentuk oleh enzim besar yang multifungsional dengan kelompok situs katalitik yang terkoordinasi, yaitu
(PKS) dan
(NRPS) (Zhao 2007). NRPS terdiri atas organisasi modular, yaitu serangkaian situs aktif terkoordinasi yang dapat dideteksi untuk analisis genetik bakteri yang berasosiasi dengan spons. Setiap modul terdiri atas domain minimal dan domain opsional. Domain minimal adalah
domain dengan jumlah minimum yang diperlukan untuk seluruh proses sintesis peptida nonribosomal, terdiri atas domain
(A), domain
(PCP), domain (C),
dan domain (TE). Sedangkan
domain opsional terdiri atas domain
* (Cy), domain +
(MT), dan domain * (Er) (Shen 2004). Seperti halnya NRPS, PKS juga
merupakan enzim besar yang
multifungsional dengan organisasi modular. Persyaratan minimal yang dibutuhkan oleh PKS ialah tiga domain, yaitu domain
+ (AT), domain
(KS), dan domain (ACP)
(Otsuka 2004, Xiao 2006, Zucko 2007).
Domain KS dan domain A masing-masing memiliki peran penting dalam sintesis poliketida dan peptida nonribosomal. Domain A berperan dalam tugas inti yaitu mengaktifkan dan memilih asam amino yang sama asal dari kelompok substrat bebas dalam pembentukan non-ribosomal peptida (Schwarger 2003,
Shen 2004, Zhao 2007).
Sedangkan Domain KS bertanggung jawab untuk kondensasi unit luar yang ditambahkan pada rantai poliketida selama biosintesis poliketida (Xiao 2006, Zucko 2007). Menurut Shen (2004), modifikasi NRPS dengan pengubahan substrat pada domain A akan menjadi rekayasa sintesis peptida baru. Seperti halnya domain A, keragaman struktur poliketida dapat dilakukan dengan pengubahan starter, perluasan unit, dan jumlah kondensasi pada modifikasi domain KS (Otsuka 2004). Selain itu, persamaan domain KS dan domain A yaitu keduanya lebih sesuai dalam analisis filogenetik keanekaragaman PKS dan NRPS (Zhang 2008, 2009). Oleh karena itu, analisis domain KS dan domain A memudahkan penelitian untuk mendeteksi gen yang berperan dalam pembentukan senyawa bioaktif yang berperan penting dalam bidang farmasi dan industri.
Tujuan
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Maret hingga Oktober 2010 di Laboratorium Bagian Mikrobiologi, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini ialah 16 bakteri endofit (HAL 87, Iso act 6, Iso 40, Iso 46, Iso 8, Iso 47, Iso 67, Iso 95, Iso act 1, Iso act 16, Iso act 2, Iso 53, Iso 20, Iso 23, Iso 100, dan Iso 10), dan 2 bakteri permukaan (HAA 02, HAA 06) yang berasosiasi dengan spons sp. asal Pulau Wigeo, wilayah Raja Ampat, Provinsi Papua Barat (Tokasaya 2010), dua
bakteri uji nonpatogen ( ,
), empat bakteri uji patogen
( , #
,
[EPEC]), dan dua fungi uji
patogen ( ,
).
Metode
Penapisan Bakteri Penghasil Senyawa Antibakteri. Teknik lapis ganda
( ) digunakan dalam pengujian
aktivitas antibakteri. Teknik ini dilakukan dengan cara mengkulturkan bakteri uji, baik
yang patogen ( , ,
, EPEC) maupun nonpatogen (
dan ) pada media ,
(SWC) cair (Lampiran 1), kemudian diinkubasi selama 18 jam. Kultur cair bakteri uji diambil sebanyak 1 ml kemudian dimasukkan ke dalam 100 ml media agar-agar SWC steril. Campuran antara kultur bakteri dan media SWC dijadikan sebagai lapisan kedua. Selanjutnya, sebanyak 15 ml campuran dituangkan ke dalam cawan petri yang telah berisi dengan media agar-agar SWC yang telah padat (lapisan pertama). Setelah padat, 18 isolat bakteri asal spons masing-masing digoreskan pada permukaan media SWC yang telah mengandung kultur bakteri uji, kemudian diinkubasi selama 3 hari pada suhu 37 0C. Senyawa bioaktif antibakteri diindikasikan dengan terbentuknya zona jernih di sekitar koloni.
Penapisan Bakteri Penghasil
Senyawa Antifungi. Metode yang
dilakukan sama dengan pengujian
antibakteri yaitu dengan teknik lapis ganda. Kultur cair yang telah diinkubasi selama 24 jam dalam %
(PDB), diambil sebanyak 1ml kemudian dimasukkan ke dalam 100 ml media
% (PDA) steril (Lampiran 1). Campuran antara kultur fungi dan media PDA dijadikan sebagai lapisan kedua. Selanjutnya, sebanyak 15 ml campuran dituangkan ke dalam cawan petri yang telah berisi dengan media PDA yang telah padat (lapisan pertama). Setelah padat, 18 isolat bakteri asal spons masing-masing digoreskan pada permukaan media PDA yang telah mengandung kultur fungi, lalu diinkubasi selama 3 hari pada suhu 37 0C. Senyawa bioaktif antifungi diindikasikan dengan terbentuknya zona jernih di sekitar koloni.
Isolasi DNA Genom. DNA genom dari bakteri yang berasosiasi dengan spons sp. diisolasi dengan menggunakan metode
(CTAB) yang diacu dari Sambrook dan Russel (2001).
Amplifikasi Domain KS dan Domain A. Domain KS (700 pb) dan domain A (1000 pb) diamplifikasi dengan PCR. PCR diawali dengan pembuatan larutan campuran PCR. Larutan campuran PCR dibuat dengan mencampurkan berturut-turut 12,5 µl bufer GC II, 4 µl dNTPs (2,5 mM), 0,25 µl (5 unit/µl) enzim $ - DNA , 1 µl (50 pmol) primer spesifik (+ , dan ) untuk masing-masing PKS dan NRPS, 3,25 µl ddH2O, 3 µl sampel DNA genom. Sekuen primer spesifik untuk
domain KS yaitu + , :
5’-GCSATGGAYCCSCARCARCGSVT-3’ ; : 5’-GTSCCSG-TSCCRTGS-SCYT-CSAC-3’. Sedangkan sekuen primer spesifik untuk domain A yaitu + , :
5’-AARD-SIGGIGSIGSITAYBICC-3’ ; :
5’-CKRWAICCICKIAIYTTIAYYTG-3’. Sekuen primer yang digunakan adalah primer yang dirancang khusus untuk gen PKS dan NRPS. Primer tersebut diacu dari Schirmer (2005).
selama 1 menit, dan pada suhu 72 0
C selama 1 menit. Tahap terakhir dilakukan pada suhu 72 0C selama 10 menit.
Produk PCR dielektroforesis pada gel agarosa 1 % (b/v) menggunakan tegangan 70 volt selama ±30-40 menit. Proses selanjutnya ialah purifikasi produk PCR dari gel menggunakan Gel/PCR DNA )
% . (Geneaid Biotech. Ltd., Taiwan).
Kloning Domain KS dan Domain A ke dalam Sel E. coli DH5α. Amplikon diligasi ke dalam vektor kloning pGEMT-Easy. Ligasi fragmen pengkode DNA domain KS dan domain A ke plasmid
pGEMT-Easy dilakukan dengan
mencampurkan berturut-turut 5 µl 2x
$ ++ (Promega), 2 µl (60 ng domain KS dan 72 ng domain A) DNA sisipan, 1µl (3 Weiss units/µl) enzim T4 DNA ligase (Promega), 1 µl (50 ng) vektor kloning pGEMT-Easy. Campuran kemudian dilarutkan dengan ddH2O hingga volume reaksi 10 µl dan diinkubasi semalam (±24 jam) dengan suhu 4 OC. Proses transformasi hasil ligasi dilakukan ke dalam
DH5α, yang terlebih dahulu disiapkan menjadi sel kompeten.
Pembuatan sel kompeten dilakukan dengan mengkulturkan satu koloni ke media LB selama 16 jam. Kemudian kultur diambil 500 µl dan dikulturkan kembali ke dalam media LB baru selama 2 jam. Hasil kultur diambil sebanyak 1,5 ml dan diinkubasi di dalam es selama 10 menit. Setelah itu disentrifugasi dengan kecepatan 3000 rpm (372,29 g) selama 10 menit, kemudian pelet sel diresuspensi
dengan / + ++ (TFB)
sebanyak 250 µl (Lampiran 2). Hasil resuspensi diinkubasi ke dalam es selama 20 menit. Proses resuspensi dengan TFB diulang kembali dan diinkubasi kembali ke dalam es selama 10 menit.
Plasmid DNA rekombinan
sebanyak 10 µl dicampur dengan dan diinkubasi kembali ke dalam es selama 45 menit. Campuran diberi perlakuan renjatan panas ( 0. Proses renjatan panas dilakukan dengan memasukan campuran ke dalam penangas air yang bersuhu 42 0C selama 45 detik dan segera dimasukkan ke dalam es selama 5 menit. Kemudian campuran ditambahkan TFB sebanyak 100 µl dan diinkubasi dalam penangas air dengan suhu 37 0C selama 45-60 menit. Setelah itu campuran disebar dalam media
(LA) yang di dalamnya terkandung ampisilin, X-gal, dan IPTG kemudian diinkubasi dengan suhu 37 OC selama 16 jam (Lampiran 2). Koloni putih yang tumbuh dikulturkan dalam media LA yang mengandung ampisilin sebagai simpanan dan dikulturkan juga ke media LB.
Kultur dalam media (LB)
diisolasi plasmid rekombinannya.
Plasmid rekombinan (pGEMT-Easy-KS dan pGEMT-Easy-A) yang telah diisolasi selanjutnya dipotong dengan menggunakan enzim restriksi RI. Visualisasi hasil restriksi dilakukan dengan elektroforesis menggunakan gel agarosa 1 % (b/v). Plasmid rekombinan selanjutnya disekuen dan dilakukan analisis bioinformatika.
Analisis Bioinformatika. Sekuen dari domain KS dan domain A pada plasmid rekombinan dianalisis dengan menggunakan program dan BLAST dari
+ 1 +
(NCBI). Sekuen dicari homologinya dengan sekuen domain KS yang sudah dipublikasi
dengan menggunakan CLUSTAL W
(ncbi.nlm.nih.gov).
HASIL
Penapisan Bakteri Penghasil Senyawa Antibakteri
Sebanyak 18 isolat bakteri yang berasosiasi dengan spons diuji aktivitas antibakterinya terhadap bakteri uji, baik
yang patogen ( , #
, dan EPEC K-11) maupun non-patogen ( dan ). Hasil dari penapisan bakteri didapatkan beberapa isolat
bakteri yang dapat menghambat
pertumbuhan bakteri uji. Hal ini ditandai dengan zona bening di sekitar goresan bakteri pada permukaan media yang mengandung bakteri uji (Tabel 1). Bakteri endofit dapat menghambat sekitar 2-4 bakteri uji. Bakteri uji yang dapat dihambat
bakteri endofit ialah , #
, dan . Bakteri
permukaan dapat menghambat sekitar 2-5 bakteri uji. Bakteri uji yang dapat dihambat
bakteri permukaan ialah , #
, , dan .
EPEC merupakan bakteri uji yang tidak dapat dihambat pertumbuhannya, sedangkan bakteri uji hanya dapat dihambat oleh satu bakteri permukaan.
(a) (b)
c) (d)
Gambar 1 Zona hambatan di sekitar koloni bakteri pada pengujian dengan
(a) # (b) #(c)
#dan (d) EPEC.
Penapisan Bakteri Penghasil Senyawa Antifungi
Hasil penapisan bakteri yang dapat menghambat pertumbuhan
yaitu bakteri endofit (HAL 87, Iso act 6, Iso
40, Iso 46, Iso 8, Iso 47, Iso 67, Iso 95,Iso act 1, Iso act 16, Iso act 2, Iso 53, Iso 20, Iso 23, Iso 100, dan Iso 10). Demikian pula bakteri permukaan HAA 02 dan HAA 06 hanya dapat menghambat pertumbuhan
. Baik bakteri endofit ataupun bakteri permukaan tidak ada yang dapat menghambat pertumbuhan
(Gambar 2, Tabel 1).
(a) (b)
Gambar 2 Zona hambatan di sekitar koloni bakteri pada pengujian dengan
(a) # dan (b)
Berdasarkan uji aktivitas antimikrob didapatkan 12 isolat bakteri yang mampu menghambat pertumbuhan bakteri
Keterangan ukuran zona bening = (+): 1-5 mm, (++): 5-10 mm, (+++): 10-15 mm, (++++): 15-20 mm; (-): tidak menunjukkan adanya aktivitas
HAA : Isolat yang diisolasi dari permukaan Iso, HAL : Isolat yang diisolasi dari endofit
Bakteri Uji Fungi Uji
EPEC
HAA 02 + + + + + + - + + + + + + + - + + + -
Iso act 6 + + + - - + + + + + + - + + + -
Iso 40 + + + - - - -
Iso 46 - - - -
Iso 8 - + + + - + + + + + + - + + + -
Iso 47 - - - - - -
Iso 67 - - - -
Iso 95 + + + + + + - - - + + - -
iso act 1 - - - + + + + + + - - -
Iso act 16 - - - -
Iso act 2 - + + + - + + + + + + - + + + -
Iso 53 - - - - - - - -
HAA 06 - - - + + + + + + - + + + + -
Iso 20 - - - + + + + + + - + + + -
HAL 87 - + + + - - - -
Iso 23 - + ++ - + + + + + + - + + + + -
Iso 100 - - - - - - - -
Iso 10 - + + + - + + + + + + - + + + + -
Tabel 1 Hasil penapisan bakteri yang berasosiasi dengan spons yang memiliki aktivitas antibakteri dan antifungi Iso 8
Iso 10 HAA 06 Iso 10
Iso 23
Iso 95
Iso 8
uji dan fungi uji yang lebih baik. Isolat-isolat bakteri tersebut ialah HAA 02, Iso act 6, Iso 8, Iso act 2, Iso 95, Iso act 1, Iso 40, HAA 06, HAL 87, Iso 23, Iso 20, dan Iso 10.
Amplifikasi Domain KS dan Domain A DNA genom dari 12 isolat bakteri diamplifikasi dengan proses
(PCR). Hasil amplifikasi domain KS dan domain A pada gel agarosa
1% (b/v) menunjukkan pita berukuran sekitar 700 pb untuk domain KS (Gambar 3) dan sekitar 1000 pb untuk domain A (Gambar 4). Hasil amplifikasi domain KS dan domain A dari 12 isolat bakteri yang berasosiasi dengan spons tersebut menunjukkan bahwa ke-12 isolat tersebut memiliki domain KS dan domain A.
Gambar 3 Elektroforesis gel agarosa 1% (b/v) hasil amplifikasi domain KS untuk 12 isolat yang berasosiasi dengan spons sp. Ket: (L) 1 Kb$ , (1) HAA 02, (2) Iso act 6, (3) Iso 8, (4) Iso act 2, (5) Iso 95, (6) Iso act 1, (7) Iso 40, (8) HAA 06, (9) HAL 87, (10) Iso 23, (11) Iso 20, (12) Iso 10.
Gambar 4 Elektroforesis gel agarosa 1% (b/v) hasil amplifikasi domain A untuk 12 isolat yang berasosiasi dengan spons sp. Ket: (L) 1 Kb $ , (1) HAA 02, (2) Iso act 6, (3) Iso 8, (4) Iso act 2, (5) Iso 95, (6) Iso act 1, (7) Iso 40, (8) HAA 06, (9) HAL 87, (10) Iso 23, (11) Iso 20, (12) Iso 10.
L 1 2 3 4 5 6 7 8 9 10 11 12
1000 pb 3000 pb
750 pb
domain KS (700 pb)
1000 pb domain A
(1000 pb) 3000 pb
Kloning Domain KS dan Domain A
Dalam Sel DH5α
Dua isolat dipilih untuk proses pengklonan domain KS dan domain A ke dalam sel DH5α, yaitu isolat Iso 10 dan HAA 02. Iso 10 menjadi contoh dari bakteri endofit dan HAA 02 menjadi contoh dari bakteri permukaan. Keduanya memiliki aktivitas antimikrob. Selain itu Iso 10 dan HAA 02 juga memiliki domain KS dan domain A berdasarkan hasil verifikasi dengan elektroforesis. Hasil klon domain KS dari Iso 10 menunjukkan adanya koloni putih dan koloni biru (Gambar 5), sedangkan hasil klon dari domain A dari isolat Iso 10 tidak terdapat koloni putih dan biru. Hasil klon domain KS dan domain A dari isolat HAA 02 tidak menunjukkan adanya koloni putih. Hal ini menandakan proses pengklonan domain KS dan domain A dari isolat HAA 02 tidak berhasil.
Gambar 5 Koloni putih DH5α pada isolat Iso 10 yang diduga membawa plasmid rekombinan.
Verifikasi Hasil Kloning Domain KS dan Domain A
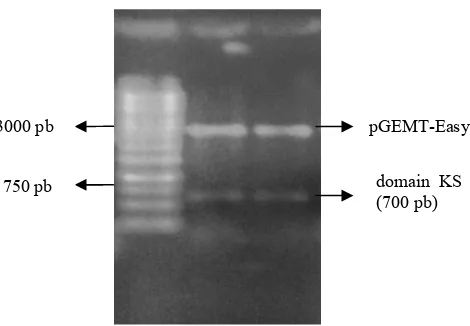
Koloni putih dari Iso 10 untuk domain KS dipilih untuk proses isolasi plasmid. Plasmid rekombinan hasil isolasi plasmid dari beberapa koloni putih DH5α diduga ialah pGEMT-Easy-10-KS. Plasmid yang diduga rekombinan dipotong dengan enzim RI dan menghasilkan dua pita dengan ukuran yang berbeda. Pita pertama berukuran 3000 pb yang
menunjukkan ukuran pGEMT-Easy,
sedangkan pita kedua berukuran 700 pb yang sesuai dengan ukuran domain KS berdasarkan Schirmer (2005) (Gambar 6). Hal ini menunjukkan bahwa pengklonan domain KS Iso 10 berhasil disisipkan pada DH5α. Selain itu, plasmid rekombinan yang membawa domain KS tersebut telah terpotong oleh enzim RI.
Gambar 6 Elektroforesis gel agarosa 1% dari
pGEMT-Easy-10-KS yang
dipotong dengan RI.
Analisis Bioinformatika
Palsmid rekombinan dari isolat Iso 10 yang diduga membawa domain KS selanjutnya dilakukan sekuensi (Lampiran 3). Hasil analisis didapatkan sekuen Iso 10 KS tidak sesuai dengan domain KS. Berdasarkan hasil dari amplifikasi PCR dan verifikasi hasil restriksi Iso 10 sesuai dengan domain KS, sehingga sekuen Iso KS dihomologikan dengan sekuen dari yang telah dipublikasikan dan dinyatakan telah memiliki domain KS (Lampiran 4).
( dari sekuen-sekuen
tersebut, yaitu AAW84215, AAW84218, AAW84193, dan AAW84190. Proses ini digunakan untuk mendapatkan homologi antara sekuen Iso KS dengan sekuen domain KS lainnya. Hasil analisis didapatkan bahwa 49-51% dengan sekuen-sekuen domain KS lainnya (Tabel 2). Koloni putih Koloni biru pGEMT-Easy
domain KS (700 pb) 3000 pb
PEMBAHASAN
Proses penapisan bakteri yang berasosiasi dengan sp. dilakukan dengan menguji adanya aktivitas antibakteri dan antifungi. Penapisan dilakukan terhadap bakteri yang terdapat pada bagian endofit
dan permukaan dari spons sp.
yang berasal dari Pulau Waigeo, wilayah Raja Ampat, Provinsi Papua Barat (Tokasaya 2010). Sebanyak dua isolat bakteri permukaan dan 16 isolat bakteri endofit yang digunakan dalam proses penapisan bakteri. Isolat bakteri endofit adalah bakteri yang berasal dari bagian , yaitu lapisan yang luas dari jaringan ikat spons bagian dalam. Umumnya bakteri yang berasal dari terdapat dalam jumlah yang berlimpah. Hal ini karena aliran air yang mengandung partikel makanan dialirkan ke dalam oleh
sel yang berflagella ( ).
Berlimpahnya nutrisi menjadikan
sebagai tempat tinggal komunitas bakteri yang padat (Taylor 2007).
Isolat bakteri endofit berbeda dengan bakteri yang terdapat pada bagian permukaan spons. Bakteri permukaan terdapat dalam jumlah yang lebih sedikit dibandingkan bakteri Ketersediaan nutrisi yang lebih sedikit pada bagian permukaan dibandingkan dengan bagian dapat menjadi penyebabnya (Taylor 2007).
Bakteri uji yang digunakan dalam penelitian ini, yaitu adalah bakteri aerob, berbentuk batang, dan termasuk bakteri Gram negatif. Isolat ini termasuk dalam bakteri patogen oportunistik, yaitu bakteri yang dapat mengeksploitasi inang saat pertahanan inangnya melemah. Bakteri patogen yang lain yaitu , adalah bakteri Gram positif yang sering ditemukan dalam bagian pernapasan manusia. Hal ini menjadikan
sebagai penyebab beberapa infeksi serius pada manusia seperti, pneumonia dan meningitis. Bakteri merupakan bakteri patogen terhadap udang dan ikan, sedangkan EPEC merupakan bakteri yang
patogen terhadap manusia. EPEC dapat menyebabkan diare dan banyak ditemukan pada negara berkembang (Madigan 2006).
Fungi uji yang digunakan ialah
dan , keduanya
merupakan khamir patogen pada manusia. menyerang bagian mulut, organ pencernaan, dan organ kelamin, sedangkan menyerang kulit, bagian pencernaan, organ kelamin wanita, dan kerongkongan (Calderone & Fonzi 2001).
Hasil uji aktivitas antibakteri, menunjukkan isolat-isolat bakteri dapat menghambat pertumbuhan bakteri uji
bakteri patogen (P. , ,
dan ) dan nonpatogen (
dan ). Zona bening di sekitar koloni yang merupakan zona hambatan berukuran rata-rata 10-15 mm (Gambar 1). Bakteri uji yang dapat dihambat bakteri endofit ialah
, # , , dan
. Bakteri uji yang dapat dihambat
bakteri permukaan ialah , #
, dan . Bakteri uji
yang tidak dapat dihambat pertumbuhannya ialah EPEC, sedangkan bakteri uji
hanya dapat dihambat oleh satu bakteri permukaan. Zona bening yang terdapat pada berukuran rata-rata 5-10 mm (Gambar 2). Seperti dilaporkan pada penelitian Abubakar (2009), isolat bakteri endofit yang berasosiasi dengan
& sp. dapat menghambat pertumbuhan bakteri uji lebih baik dibanding isolat bakteri permukaan.
Hasil uji aktivitas antifungi menunjukkan, bakteri endofit hanya dapat
menghambat pertumbuhan . Baik
bakteri endofit ataupun bakteri permukaan tidak ada yang dapat menghambat
pertumbuhan (Gambar 2)
Seperti yang dilaporkan Tokasaya (2010), dalam penelitiannya menguji aktivitas antifungi, sebanyak 6 isolat dari 31 isolat bakteri endofit yang mampu menghambat
pertumbuhan . Selain itu, hanya
5 isolat dari 8 isolat bakteri permukaan yang mampu menghambat pertumbuhan
. HAL 87 merupakan isolat bakteri
( Organisme Homologi (%)
AAW84215 2 51 %
AAW84218 2 50 %
AAW84193 2 49 %
AAW84190 2 49 %
endofit yang sama digunakan dalam penelitian ini dan dalam penelitian Tokasaya (2010). Hasilnya didapatkan bahwa HAL 87
memang tidak dapat menghambat
pertumbuhan . Selain itu, isolat bakteri permukaan yang digunakan dalam penelitian ini sama dengan penelitian Tokasaya (2010) ialah HAA 02 dan HAA 06. Namun hasil penelitian Tokasaya HAA 02 dan HAA 06 dapat menghambat
pertumbuhan , sedangkan dalam
penelitian ini tidak. Diduga bahwa khamir yang digunakan berasal dari galur yang berbeda.
Hasil penapisan 18 isolat bakteri didapatkan 12 isolat (66,67%) yang memiliki potensi sebagai penghasil senyawa antimikrob (Tabel 1). Isolat-isolat bakteri tersebut memiliki aktivitas antibakteri dan antifungi dengan spektrum luas. Salah satu contoh isolat bakteri yang memiliki aktivitas antimikrob dengan spektrum luas ialah HAA
02. HAA 02 dapat menghambat
pertumbuhan tiga bakteri uji dan satu fungi uji. Selain HAA 02, terdapat lima isolat bakteri lain yang dapat menghambat pertumbuhan tiga bakteri uji dan satu fungi uji. Isolat-isolat bakteri tersebut ialah Iso act 6, Iso 8, Iso act 2, Iso 23, dan Iso 10. Isolat bakteri lainnya hanya dapat menghambat pertumbuhan sekitar dua sampai tiga bakteri uji. Radjasa (2007) menyatakan bahwa, bakteri yang berasosiasi dengan
sp. memiliki spektrum aktivitas antimikrob yang luas. Sehingga bakteri asosiasi dengan sp. dapat dimungkinkan sebagai sumber senyawa antimikrob untuk mengendalikan bakteri patogen.
Senyawa bioaktif dari bakteri yang berasosiasi dengan spons laut mungkin memiliki gen biosintesis metabolit sekunder yaitu PKS dan NRPS. Proses PCR dapat dilakukan untuk melihat ada atau tidaknya gen PKS dan NRPS pada suatu bakteri. Metode PCR dapat menjadi suatu cara untuk memperkirakan kekayaan produsen metabolit sekunder hasil asosiasi dengan
spons sp. dan mempelajari
keragaman gen bakteri pada spons lain (Radjasa 2007).
Sebanyak 12 genom dari isolat bakteri diuji dengan PCR. Primer PCR dirancang secara khusus untuk domain KS dan domain A. Primer degeneratif tersebut diacu berdasarkan Schirmer (2005). Hasil amplifikasi domain KS dan domain A pada gel agarosa 1% (b/v) menunjukkan pita berukuran sekitar 700 pb untuk domain KS
(Gambar 3) dan sekitar 1000 pb untuk domain A (Gambar 4). Hal ini menunjukkan bahwa 12 isolat tersebut memiliki domain KS dan domain A. Hal ini memungkinkan 12 isolat memiliki gen hibrid PKS-NRPS (Gambar 3 & 4). Hibrid PKS-NRPS dapat terjadi dengan kombinasi domain pada modul NRPS dengan domain pada modul
PKS dalam satu + . Gen
hibrid PKS-NRPS dapat menghasilkan senyawa bioaktif dengan struktur hibrid (Ansari 2004, Zhu 2009)
Sebanyak dua isolat dipilih dari 12 isolat untuk pengklonan domain KS dan domain A ke dalam sel DH5α yaitu HAA 02 dan Iso 10. Isolat Iso 10 untuk domain KS menghasilkan koloni putih dan biru (Gambar 5). Isolat Iso 10 memiliki domain KS. Hal tersebut didukung dengan verifikasi hasil isolasi plasmid dan proses pemotongan plasmid (restriksi) dengan RI. Hasil verifikasi mendapatkan dua pita dengan ukuran yang berbeda berukuran 3000 pb dan 700 pb (Gambar 6). Pengklonan domain A untuk Isolat Iso 10 dan HAA 02 tidak menghasilkan koloni putih dan biru. Hal ini diduga proses pengklonan domain A pada Iso 10 dan HAA 02 tidak berhasil.
Hasil analisis dengan BLAST diidentifikasikan Iso 10 tidak memiliki domain KS. Iso 10 memiliki %
sebesar 92% sebagai
( ). Berdasarkan
hasil amplifikasi PCR dan verifikasi hasil pemotongan plasmid (restriksi) didapatkan ukuran pita dari plasmid Iso 10 sesuai dengan domain KS. Hasil analisis didapatkan bahwa Iso 10 memiliki kemiripan sekitar 49-51% dengan sekuen-sekuen domain KS. Sekuen domain KS yang mirip merupakan organisme
SIMPULAN
Dua belas isolat bakteri dari 18 isolat asal spons sp. (66,67%) menghasilkan senyawa bioaktif dengan aktivitas antibakteri dan antifungi.
Sepuluh isolat termasuk bakteri endofit dan dua isolat berasal dari bagian permukaan spons. Kedua belas isolat diduga
mengandung domain . (KS) dari
(PKS) dan domain
( (A) dari
(NRPS). Homologi antara isolat Iso 10 KS dengan sekuen domain KS lainnya sekitar 49-51%.
DAFTAR PUSTAKA
Abubakar E. 2009. Bakteri yang berasosiasi dengan spons & sp. : analisis penghasil senyawa antimikrob dan keragaman genetiknya [tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Ansari MZ, Yadav G, Gokhale RS, Mohanty D. 2004. NRPS-PKS: a knowledge-based resource for analysis of NRPS/PKS megasynthases.
( 32:405-413.
Bahkuni DS, Rawat DS. 2005.
! . New Delhi:
Anamaya Publishers.
Blunt JW, Copp BR, Hu WP, Munro MH, Prinsep MR. 2007. Marine natural
products. 24 :31-86.
Calderone RA, Fonzi WA. 2001. Virulence
factors of . /
! 9:327-325.
Kennedy J, Codling CE, Jones BV, Dobson ADW, Marchesi JR. 2008. Diversity of microbes associated with the
marine sponge, ,
isolated from Irish water and identification of polyketide synthase genes from the sponge metagenome.
( !
10:1888-1902.
Kennedy J, Baker P, Piper C, Cotter PD, Walsh M. . 2009. Isolation and analysis of bacteria with antimicrobial activities from the marine sponge ans collected from
Irish waters. !
11:384-396.
Lanen SGV, Shen B. 2006. Microbial genomics for the improvement of atural product discovery. '
9:252-260.
Madigan MT, Martinko JM, Dunlap PV,
Clark DP. 2006. +
! Ed ke-12. San
Fransisco: Pearson Education. Otsuka M, Ichinose K, Fujii I, Ebizuka Y.
2004. Cloning, sequencing, and functional analysis of an iterative type I polyketide synthase gene cluster for biosynthesis of the antitumor chlorinated polyenone neocarzilin in
* . (
( 9:3468-3476.
Pangan ACG, Uy FA, Oclarit JM. 2007. Antimicrobial properties of some marine sponges (porifera) from Mactan, Cebu, Philiphines.
44: 35-45.
Piel J. 2003. Metabolites from symbiotic
bacteria 21: 519-538.
Radjasa OK, Kencana DS, Sabdono A, Hutagalung RA, Lestari ES. 2007. Antibacterial activity of marine bacteria associated with sponge Aaptos sp. against Multi Drugs Resistant (MDR) strains. & !
12: 148-152.
Sambrook J, Russel DW. 2001. !
( $ ! Vol
1. Ed-3. New York: Cold Spring Harbor Laboratory Press.
Schirmer 2005. Metagenomisc analysis reveals diverse polyketide synthase gene clusters in microorganisms associated with the marine sponge
' . (
! 8:4840-4849.
Shen QT, Chen XL, Sun CY, Zhang YZ. 2004. Dissecting and exploiting non-ribosomal peptide synthase. (
36:243–249. Schwarger D, Finking R, Marahiel MA.
2003. Nonribosomal peptides: from genes to products.
20:275-287.
Thomas TRA, Kavlekar DP, Lokabharathi PA. 2010. Marine drugs from sponge-microbe association. ! '
Tokasaya P. 2010. Sponge-associated bacteria producing antimicrobial compounds and their genetic diversity analysis [tesis]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Zhang W, Li Z, Miao X, Zhang F. 2008.The
screening of antimicrobial bacteria with diverse novel non-ribosomal peptide synthase (NRPS) genes from South China Sea sponges !
11 :346-355.
Zhang W, Zhang F, Li Z, Miao X, Zhang X. 2009. Investigation of bacteria with polyketide synthase genes and antimicrobial activity isolated from South China Sea sponges. & (
! 107 :567-575.
Zhao J, Yang N, Zeng R. 2007. Phylogenetic analysis of tipe I polyketide synthase and nonribosomal peptide synthase genes in antartic sediment.
% 12 :97-10
Zhu, Peng, Zheng Y, Yan X, Shao J. 2009. Molecular phylogeny and modular structure of hybrid NRPS/PKS gene
fragmet og sp.
NJ6-3-2 isolated from marine sponge . & !
19 :229-237.
Zucko J, Skunca N, Curk, Zupans B, Long PF. 2007. Polyketide synthase genes and the natural products
potential of '
. + 23
:2543-2549.
Xiao HC, Vater J, Piel J, Franke P, Scholz R. . 2006. Structural and functional characterization of three polyketide synthase genes clusters in
- + FZB 42. &
Lampiran 1 Komposisi macam-macam media yang digunakan dalam proses penapisan bakteri yang berasosiasi dengan spons sp.
Media 3 (SWC)
Media ' % ( (PDA)
Media ' % (PDB)
Lampiran 2 Bahan-bahan dan media yang digunakan dalam proses transformasi
/ + ++ (TFB)
Media $ ( (LA)
Komposisi Jumlah
5 g
4 % 1 g
( 15 g
Air laut
Aquades
750 ml 1000 ml
Komposisi Jumlah
Agar-agar 20 g
Dekstrosa 20 g
Kentang 300 g
Aquades 1000 ml
Komposisi Jumlah
' % 24 g
Aquades 1000 ml
Komposisi Jumlah
CaCl2 MgCl2 Tris-Cl (pH 7) NaCl
0,1 M 5 mM 5 mM 10 g
Komposisi Jumlah
4 % 5 g
/ 10 g
NaCl 10 g
Lampiran 3 Sekuen dari Iso 10 KS (dalam bentuk FASTA)
GCATGCTCCC GGCCGCCATG GCGGCCGCGG GAATTCGATT GCCATGGACC
CCCAGCAGCG GCTGGAAGGG GTGCGGGCCG CCGGCAAGGC GCGTGGCCGC
CTGCGCCAGC TGAGCGTGGT GCCGGGCGAT TTCTCGGTGG AATCCGGGCA
TGCCGCGGCC GTGGCGCTGC TGGCCGATGC GTCGGCGCCG ACCGCAGTCT
TCTGCTTCAG CGACCAGATG GCGCTGGGTG CGCTGGCGGC CTGCCGCGAT
CTGGGCATCC GCGTGCCGGA CGAGTTGTCC ATCGTCGGTT TCGATGACCT
GGCGTCTTCG CGTTACCTCA CGCCGCCGCT GACGACCATC CGGCAGCCGA
TGCGGGAGAT CGGCGCGCGC GCGGTCAACC TGCTGCTCGC CATCGTTGAA
CAGGTGGATG TTCCGCTTCA ACAGACGCTG GATTTCAGCC TGATGGTGCG
GGGGTCGACG GCGGCACCTG GGCCCAGGTG AGGCCAGGGA CGCTGCAGGT TCGAGTCCTT GATCCCGAAT TGACGTAAAG CTGTCAGACT CACGACAGGC AGCCCGGCAG GGGCCGGGGT GGAACGTGCG ATCGCGCAAG GGGGTCGGCA ATGCCGTTCT TGACTGACTC GACGGAGGTC GCGGTCGAGG GCCACGGCAC GGGGACAATC ACTAGTGAAT TCGCGGCCGC CTGCAGGTCG ACCAT
Keterangan: nukleotida Iso 10 yang dengan sekuen-sekuen domain KS ditampilkan
ABSTRAK
MEGASARI. Penapisan Bakteri Penghasil Senyawa Antimikrob yang Berasosiasi dengan Spons sp. dan Deteksi Gen Penyandi Poliketida Sintase dan Peptida Sintase Nonribosom. Dibimbing oleh ARIS TRI WAHYUDI dan NISA RACHMANIA MUBARIK.
Spons tergolong dalam Filum Porifera memiliki kemampuan bersimbiosis dengan mikroorganisme. Simbiosis tersebut menghasilkan produk alami yang menguntungkan seperti poliketida dan peptida nonribosom yang memiliki aktivitas antimikrob. Poliketida dan peptida nonribosom masing-masing dibentuk oleh gen (PKS) dan
(NRPS). Keduanya merupakan enzim multifungsional yang terlibat dalam biosintesis senyawa bioaktif yang penting dalam bidang farmasi dan industri. Penelitian ini bertujuan menapis bakteri asal spons penghasil senyawa antimikrob dan mendeteksi gen yang berperan dalam biosintesis senyawa bioaktif tersebut. Sebanyak 18 isolat bakteri yang diisolasi dari spons sp. dan diuji aktivitas antimikrobnya, didapatkan 12 isolat bakteri yang
menghambat pertumbuhan empat bakteri patogen, yaitu ,
(EPEC), , , dua bakteri nonpatogen, yaitu
, , dan dua cendawan patogen, yaitu , dan
Deteksi gen penyandi PKS dan NRPS dilakukan dengan teknik
(PCR) menggunakan primer spesifik yang masing-masing menghasilkan amplikon berukuran 700 pb dan 1000 pb. Satu isolat yang memiliki aktivitas antimikrob terbaik dan memiliki kedua gen penyandi PKS dan NRPS yaitu Iso 10 dipilih untuk analisis homologinya. Fragmen DNA dari genom Iso 10 KS (700 pb) yang telah berhasil diklon ke dalam plasmid pGEMT dan disekuen, menyatakan homologinya dengan domain KS sekitar 49-51%.
Keyword: senyawa bioaktif, antimikrobial, PKS, NRPS, spons
ABSTRACT
MEGASARI. Screening of Bacteria Producing Antimicrobial Compounds which is Associated with sp. Sponge and Detection Its Encoding Peptide Synthase and Non-ribosomal Polyketide Synthase Gene. Supervised by ARIS TRI WAHYUDI and NISA RACHMANIA MUBARIK.
Sponges are classified in the Porifera phylum have the ability to symbiosis with microorganisms. The symbiont produced useful natural products such as polyketides and non-ribosomal peptides that possessed antimicrobial activities. Each polyketide and non-non-ribosomal peptide are synthesized by the (PKS) dan
(NRPS) gene. Both of them are multifunctional enzymes that involved in the biosynthesis bioactive compounds that are important in pharmaceutical and other industries.The aims of study was to screened the bacteria producing antimicrobial compounds which is associated with sponge and detect the genes that play a role in the biosynthesis of bioactive compounds. A total of 18 isolates bacteria that associated with sp. was tested their antimicrobial activity and finally 12 isolates bacteria that inhibited four pathogenic bacteria growth that consist of
, (EPEC), ,
, and two non-pathogenic bacteria that consist of , ,
and the two pathogenic fungus and . Detection of PKS and
NRPS encoding gene performed by (PCR) using specific primers,
producing 700 bp and 1000 bp amplicon. One isolate that possessed the best antimicrobial activities and both of PKS and NRPS gene which is Iso 10 are selected for homology test. DNA fragment from Iso 10 KS genome (700 bp) that have been successfully cloned into plasmid pGEMT and sequenced and its homology with other KS domain sequences of about 49-51%.
PENDAHULUAN
Latar Belakang
Mikrob dapat berinteraksi dengan organisme laut, seperti spons, dan menghasilkan berbagai produk alami. Produk alami yang berasal dari metabolit sekunder mikrob berperan penting dalam penelitian medis dan pengembangan obat. Produk alami tersebut dapat secara lansung menjadi obat atau menjadi struktur dasar sintesis obat kimia baru (Bahkuni . 2005). Sejak tahun 1981, dilaporkan bahwa sekitar 40% produk kimia berasal dari turunan produk alami mikrob (Lanen & Shen 2006). Keuntungan dari produk alami sebagai senyawa bioaktif karena dapat memiliki aktivitas antimikrob, antiviral, antimalaria, antikanker, antitumor, bahkan memiliki aktivitas % .
Spons yang sudah diteliti dan menghasilkan senyawa bioaktif antara lain
& sp., #
# ' #
# dan Kennedy
(2008, 2009) melaporkan, pada ditemukan sekitar delapan filum bakteri. Filum yang paling
banyak ditemukan ialah filum
# #
( # dan ) . Metabolit
yang diisolasi dari bakteri yang berasosiasi
dengan spons sp., misalnya:
sterol, steroid, alkaloid, avarol, nukleosida, peptida, dan poliketida (Blunt . 2007). Peptida nonribosom sebagai salah satu senyawa bioaktif memiliki kemampuan untuk menjadi antibiotik hingga racun. Oleh karena itu, investigasi biosintesis peptida sangat menarik untuk pembentukan obat baru dalam bidang farmasi modern. Selain peptida nonribosom, poliketida juga memiliki peran penting dalam industri agrokimia, farmasi, dan bioteknologi (Schwarger . 2003, Kennedy 2008).
Peptida nonribosom atau poliketida masing-masing dibentuk oleh enzim besar yang multifungsional dengan kelompok situs katalitik yang terkoordinasi, yaitu
(PKS) dan
(NRPS) (Zhao 2007). NRPS terdiri atas organisasi modular, yaitu serangkaian situs aktif terkoordinasi yang dapat dideteksi untuk analisis genetik bakteri yang berasosiasi dengan spons. Setiap modul terdiri atas domain minimal dan domain opsional. Domain minimal adalah
domain dengan jumlah minimum yang diperlukan untuk seluruh proses sintesis peptida nonribosomal, terdiri atas domain
(A), domain
(PCP), domain (C),
dan domain (TE). Sedangkan
domain opsional terdiri atas domain
* (Cy), domain +
(MT), dan domain * (Er) (Shen 2004). Seperti halnya NRPS, PKS juga
merupakan enzim besar yang
multifungsional dengan organisasi modular. Persyaratan minimal yang dibutuhkan oleh PKS ialah tiga domain, yaitu domain
+ (AT), domain
(KS), dan domain (ACP)
(Otsuka 2004, Xiao 2006, Zucko 2007).
Domain KS dan domain A masing-masing memiliki peran penting dalam sintesis poliketida dan peptida nonribosomal. Domain A berperan dalam tugas inti yaitu mengaktifkan dan memilih asam amino yang sama asal dari kelompok substrat bebas dalam pembentukan non-ribosomal peptida (Schwarger 2003,
Shen 2004, Zhao 2007).
Sedangkan Domain KS bertanggung jawab untuk kondensasi unit luar yang ditambahkan pada rantai poliketida selama biosintesis poliketida (Xiao 2006, Zucko 2007). Menurut Shen (2004), modifikasi NRPS dengan pengubahan substrat pada domain A akan menjadi rekayasa sintesis peptida baru. Seperti halnya domain A, keragaman struktur poliketida dapat dilakukan dengan pengubahan starter, perluasan unit, dan jumlah kondensasi pada modifikasi domain KS (Otsuka 2004). Selain itu, persamaan domain KS dan domain A yaitu keduanya lebih sesuai dalam analisis filogenetik keanekaragaman PKS dan NRPS (Zhang 2008, 2009). Oleh karena itu, analisis domain KS dan domain A memudahkan penelitian untuk mendeteksi gen yang berperan dalam pembentukan senyawa bioaktif yang berperan penting dalam bidang farmasi dan industri.
Tujuan
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Maret hingga Oktober 2010 di Laboratorium Bagian Mikrobiologi, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Bahan
Bahan yang digunakan dalam penelitian ini ialah 16 bakteri endofit (HAL 87, Iso act 6, Iso 40, Iso 46, Iso 8, Iso 47, Iso 67, Iso 95, Iso act 1, Iso act 16, Iso act 2, Iso 53, Iso 20, Iso 23, Iso 100, dan Iso 10), dan 2 bakteri permukaan (HAA 02, HAA 06) yang berasosiasi dengan spons sp. asal Pulau Wigeo, wilayah Raja Ampat, Provinsi Papua Barat (Tokasaya 2010), dua
bakteri uji nonpatogen ( ,
), empat bakteri uji patogen
( , #
,
[EPEC]), dan dua fungi uji
patogen ( ,
).
Metode
Penapisan Bakteri Penghasil Senyawa Antibakteri. Teknik lapis ganda
( ) digunakan dalam pengujian
aktivitas antibakteri. Teknik ini dilakukan dengan cara mengkulturkan bakteri uji, baik
yang patogen ( , ,
, EPEC) maupun nonpatogen (
dan ) pada media ,
(SWC) cair (Lampiran 1), kemudian diinkubasi selama 18 jam. Kultur cair bakteri uji diambil sebanyak 1 ml kemudian dimasukkan ke dalam 100 ml media agar-agar SWC steril. Campuran antara kultur bakteri dan media SWC dijadikan sebagai lapisan kedua. Selanjutnya, sebanyak 15 ml campuran dituangkan ke dalam cawan petri yang telah berisi dengan media agar-agar SWC yang telah padat (lapisan pertama). Setelah padat, 18 isolat bakteri asal spons masing-masing digoreskan pada permukaan media SWC yang telah mengandung kultur bakteri uji, kemudian diinkubasi selama 3 hari pada suhu 37 0C. Senyawa bioaktif antibakteri diindikasikan dengan terbentuknya zona jernih di sekitar koloni.
Penapisan Bakteri Penghasil
Senyawa Antifungi. Metode yang
dilakukan sama dengan pengujian
antibakteri yaitu dengan teknik lapis ganda. Kultur cair yang telah diinkubasi selama 24 jam dalam %
(PDB), diambil sebanyak 1ml kemudian dimasukkan ke dalam 100 ml media
% (PDA) steril (Lampiran 1). Campuran antara kultur fungi dan media PDA dijadikan sebagai lapisan kedua. Selanjutnya, sebanyak 15 ml campuran dituangkan ke dalam cawan petri yang telah berisi dengan media PDA yang telah padat (lapisan pertama). Setelah padat, 18 isolat bakteri asal spons masing-masing digoreskan pada permukaan media PDA yang telah mengandung kultur fungi, lalu diinkubasi selama 3 hari pada suhu 37 0C. Senyawa bioaktif antifungi diindikasikan dengan terbentuknya zona jernih di sekitar koloni.
Isolasi DNA Genom. DNA genom dari bakteri yang berasosiasi dengan spons sp. diisolasi dengan menggunakan metode
(CTAB) yang diacu dari Sambrook dan Russel (2001).
Amplifikasi Domain KS dan Domain A. Domain KS (700 pb) dan domain A (1000 pb) diamplifikasi dengan PCR. PCR diawali dengan pembuatan larutan campuran PCR. Larutan campuran PCR dibuat dengan mencampurkan berturut-turut 12,5 µl bufer GC II, 4 µl dNTPs (2,5 mM), 0,25 µl (5 unit/µl) enzim $ - DNA , 1 µl (50 pmol) primer spesifik (+ , dan ) untuk masing-masing PKS dan NRPS, 3,25 µl ddH2O, 3 µl sampel DNA genom. Sekuen primer spesifik untuk
domain KS yaitu + , :
5’-GCSATGGAYCCSCARCARCGSVT-3’ ; : 5’-GTSCCSG-TSCCRTGS-SCYT-CSAC-3’. Sedangkan sekuen primer spesifik untuk domain A yaitu + , :
5’-AARD-SIGGIGSIGSITAYBICC-3’ ; :
5’-CKRWAICCICKIAIYTTIAYYTG-3’. Sekuen primer yang digunakan adalah primer yang dirancang khusus untuk gen PKS dan NRPS. Primer tersebut diacu dari Schirmer (2005).
selama 1 menit, dan pada suhu 72 0
C selama 1 menit. Tahap terakhir dilakukan pada suhu 72 0C selama 10 menit.
Produk PCR dielektroforesis pada gel agarosa 1 % (b/v) menggunakan tegangan 70 volt selama ±30-40 menit. Proses selanjutnya ialah purifikasi produk PCR dari gel menggunakan Gel/PCR DNA )
% . (Geneaid Biotech. Ltd., Taiwan).
Kloning Domain KS dan Domain A ke dalam Sel E. coli DH5α. Amplikon diligasi ke dalam vektor kloning pGEMT-Easy. Ligasi fragmen pengkode DNA domain KS dan domain A ke plasmid
pGEMT-Easy dilakukan dengan
mencampurkan berturut-turut 5 µl 2x
$ ++ (Promega), 2 µl (60 ng domain KS dan 72 ng domain A) DNA sisipan, 1µl (3 Weiss units/µl) enzim T4 DNA ligase (Promega), 1 µl (50 ng) vektor kloning pGEMT-Easy. Campuran kemudian dilarutkan dengan ddH2O hingga volume reaksi 10 µl dan diinkubasi semalam (±24 jam) dengan suhu 4 OC. Proses transformasi hasil ligasi dilakukan ke dalam
DH5α, yang terlebih dahulu disiapkan menjadi sel kompeten.
Pembuatan sel kompeten dilakukan dengan mengkulturkan satu koloni ke media LB selama 16 jam. Kemudian kultur diambil 500 µl dan dikulturkan kembali ke dalam media LB baru selama 2 jam. Hasil kultur diambil sebanyak 1,5 ml dan diinkubasi di dalam es selama 10 menit. Setelah itu disentrifugasi dengan kecepatan 3000 rpm (372,29 g) selama 10 menit, kemudian pelet sel diresuspensi
dengan / + ++ (TFB)
sebanyak 250 µl (Lampiran 2). Hasil resuspensi diinkubasi ke dalam es selama 20 menit. Proses resuspensi dengan TFB diulang kembali dan diinkubasi kembali ke dalam es selama 10 menit.
Plasmid DNA rekombinan
sebanyak 10 µl dicampur dengan dan diinkubasi kembali ke dalam es selama 45 menit. Campuran diberi perlakuan renjatan panas ( 0. Proses renjatan panas dilakukan dengan memasukan campuran ke dalam penangas air yang bersuhu 42 0C selama 45 detik dan segera dimasukkan ke dalam es selama 5 menit. Kemudian campuran ditambahkan TFB sebanyak 100 µl dan diinkubasi dalam penangas air dengan suhu 37 0C selama 45-60 menit. Setelah itu campuran disebar dalam media
(LA) yang di dalamnya terkandung ampisilin, X-gal, dan IPTG kemudian diinkubasi dengan suhu 37 OC selama 16 jam (Lampiran 2). Koloni putih yang tumbuh dikulturkan dalam media LA yang mengandung ampisilin sebagai simpanan dan dikulturkan juga ke media LB.
Kultur dalam media (LB)
diisolasi plasmid rekombinannya.
Plasmid rekombinan (pGEMT-Easy-KS dan pGEMT-Easy-A) yang telah diisolasi selanjutnya dipotong dengan menggunakan enzim restriksi RI. Visualisasi hasil restriksi dilakukan dengan elektroforesis menggunakan gel agarosa 1 % (b/v). Plasmid rekombinan selanjutnya disekuen dan dilakukan analisis bioinformatika.
Analisis Bioinformatika. Sekuen dari domain KS dan domain A pada plasmid rekombinan dianalisis dengan menggunakan program dan BLAST dari
+ 1 +
(NCBI). Sekuen dicari homologinya dengan sekuen domain KS yang sudah dipublikasi
dengan menggunakan CLUSTAL W
(ncbi.nlm.nih.gov).
HASIL
Penapisan Bakteri Penghasil Senyawa Antibakteri
Sebanyak 18 isolat bakteri yang berasosiasi dengan spons diuji aktivitas antibakterinya terhadap bakteri uji, baik
yang patogen ( , #
, dan EPEC K-11) maupun non-patogen ( dan ). Hasil dari penapisan bakteri didapatkan beberapa isolat
bakteri yang dapat menghambat
pertumbuhan bakteri uji. Hal ini ditandai dengan zona bening di sekitar goresan bakteri pada permukaan media yang mengandung bakteri uji (Tabel 1). Bakteri endofit dapat menghambat sekitar 2-4 bakteri uji. Bakteri uji yang dapat dihambat
bakteri endofit ialah , #
, dan . Bakteri
permukaan dapat menghambat sekitar 2-5 bakteri uji. Bakteri uji yang dapat dihambat
bakteri permukaan ialah , #
, , dan .
EPEC merupakan bakteri uji yang tidak dapat dihambat pertumbuhannya, sedangkan bakteri uji hanya dapat dihambat oleh satu bakteri permukaan.
selama 1 menit, dan pada suhu 72 0
C selama 1 menit. Tahap terakhir dilakukan pada suhu 72 0C selama 10 menit.
Produk PCR dielektroforesis pada gel agarosa 1 % (b/v) menggunakan tegangan 70 volt selama ±30-40 menit. Proses selanjutnya ialah purifikasi produk PCR dari gel menggunakan Gel/PCR DNA )
% . (Geneaid Biotech. Ltd., Taiwan).
Kloning Domain KS dan Domain A ke dalam Sel E. coli DH5α. Amplikon diligasi ke dalam vektor kloning pGEMT-Easy. Ligasi fragmen pengkode DNA domain KS dan domain A ke plasmid
pGEMT-Easy dilakukan dengan
mencampurkan berturut-turut 5 µl 2x
$ ++ (Promega), 2 µl (60 ng domain KS dan 72 ng domain A) DNA sisipan, 1µl (3 Weiss units/µl) enzim T4 DNA ligase (Promega), 1 µl (50 ng) vektor kloning pGEMT-Easy. Campuran kemudian dilarutkan dengan ddH2O hingga volume reaksi 10 µl dan diinkubasi semalam (±24 jam) dengan suhu 4 OC. Proses transformasi hasil ligasi dilakukan ke dalam
DH5α, yang terlebih dahulu disiapkan menjadi sel kompeten.
Pembuatan sel kompeten dilakukan dengan mengkulturkan satu koloni ke media LB selama 16 jam. Kemudian kultur diambil 500 µl dan dikulturkan kembali ke dalam media LB baru selama 2 jam. Hasil kultur diambil sebanyak 1,5 ml dan diinkubasi di dalam es selama 10 menit. Setelah itu disentrifugasi dengan kecepatan 3000 rpm (372,29 g) selama 10 menit, kemudian pelet sel diresuspensi
dengan / + ++ (TFB)
sebanyak 250 µl (Lampiran 2). Hasil resuspensi diinkubasi ke dalam es selama 20 menit. Proses resuspensi dengan TFB diulang kembali dan diinkubasi kembali ke dalam es selama 10 menit.
Plasmid DNA rekombinan
sebanyak 10 µl dicampur dengan dan diinkubasi kembali ke dalam es selama 45 menit. Campuran diberi perlakuan renjatan panas ( 0. Proses renjatan panas dilakukan dengan memasukan campuran ke dalam penangas air yang bersuhu 42 0C selama 45 detik dan segera dimasukkan ke dalam es selama 5 menit. Kemudian campuran ditambahkan TFB sebanyak 100 µl dan diinkubasi dalam penangas air dengan suhu 37 0C selama 45-60 menit. Setelah itu campuran disebar dalam media
(LA) yang di dalamnya terkandung ampisilin, X-gal, dan IPTG kemudian diinkubasi dengan suhu 37 OC selama 16 jam (Lampiran 2). Koloni putih yang tumbuh dikulturkan dalam media LA yang mengandung ampisilin sebagai simpanan dan dikulturkan juga ke media LB.
Kultur dalam media (LB)
diisolasi plasmid rekombinannya.
Plasmid rekombinan (pGEMT-Easy-KS dan pGEMT-Easy-A) yang telah diisolasi selanjutnya dipotong dengan menggunakan enzim restriksi RI. Visualisasi hasil restriksi dilakukan dengan elektroforesis menggunakan gel agarosa 1 % (b/v). Plasmid rekombinan selanjutnya disekuen dan dilakukan analisis bioinformatika.
Analisis Bioinformatika. Sekuen dari domain KS dan domain A pada plasmid rekombinan dianalisis dengan menggunakan program dan BLAST dari
+ 1 +
(NCBI). Sekuen dicari homologinya dengan sekuen domain KS yang sudah dipublikasi
dengan menggunakan CLUSTAL W
(ncbi.nlm.nih.gov).
HASIL
Penapisan Bakteri Penghasil Senyawa Antibakteri
Sebanyak 18 isolat bakteri yang berasosiasi dengan spons diuji aktivitas antibakterinya terhadap bakteri uji, baik
yang patogen ( , #
, dan EPEC K-11) maupun non-patogen ( dan ). Hasil dari penapisan bakteri didapatkan beberapa isolat
bakteri yang dapat menghambat
pertumbuhan bakteri uji. Hal ini ditandai dengan zona bening di sekitar goresan bakteri pada permukaan media yang mengandung bakteri uji (Tabel 1). Bakteri endofit dapat menghambat sekitar 2-4 bakteri uji. Bakteri uji yang dapat dihambat
bakteri endofit ialah , #
, dan . Bakteri
permukaan dapat menghambat sekitar 2-5 bakteri uji. Bakteri uji yang dapat dihambat
bakteri permukaan ialah , #
, , dan .
EPEC merupakan bakteri uji yang tidak dapat dihambat pertumbuhannya, sedangkan bakteri uji hanya dapat dihambat oleh satu bakteri permukaan.
(a) (b)
c) (d)
Gambar 1 Zona hambatan di sekitar koloni bakteri pada pengujian dengan
(a) # (b) #(c)
#dan (d) EPEC.
Penapisan Bakteri Penghasil Senyawa Antifungi
Hasil penapisan bakteri yang dapat menghambat pertumbuhan
yaitu bakteri endofit (HAL 87, Iso act 6, Iso
40, Iso 46, Iso 8, Iso 47, Iso 67, Iso 95,Iso act 1, Iso act 16, Iso act 2, Iso 53, Iso 20, Iso 23, Iso 100, dan Iso 10). Demikian pula bakteri permukaan HAA 02 dan HAA 06 hanya dapat menghambat pertumbuhan
. Baik bakteri endofit ataupun bakteri permukaan tidak ada yang dapat menghambat pertumbuhan
(Gambar 2, Tabel 1).
(a) (b)
Gambar 2 Zona hambatan di sekitar koloni bakteri pada pengujian dengan
(a) # dan (b)
Berdasarkan uji aktivitas antimikrob didapatkan 12 isolat bakteri yang mampu menghambat pertumbuhan bakteri
Keterangan ukuran zona bening = (+): 1-5 mm, (++): 5-10 mm, (+++): 10-15 mm, (++++): 15-20 mm; (-): tidak menunjukkan adanya aktivitas
HAA : Isolat yang diisolasi dari permukaan Iso, HAL : Isolat yang diisolasi dari endofit
Bakteri Uji Fungi Uji
EPEC
HAA 02 + + + + + + - + + + + + + + - + + + -
Iso act 6 + + + - - + + + + + + - + + + -
Iso 40 + + + - - - -
Iso 46 - - - -
Iso 8 - + + + - + + + + + + - + + + -
Iso 47 - - - - - -
Iso 67 - - - -
Iso 95 + + + + + + - - - + + - -
iso act 1 - - - + + + + + + - - -
Iso act 16 - - - -
Iso act 2 - + + + - + + + + + + - + + + -
Iso 53 - - - - - - - -
HAA 06 - - - + + + + + + - + + + + -
Iso 20 - - - + + + + + + - + + + -
HAL 87 - + + + - - - -
Iso 23 - + ++ - + + + + + + - + + + + -
Iso 100 - - - - - - - -
[image:32.595.113.296.85.241.2] [image:32.595.331.511.169.369.2]Iso 10 - + + + - + + + + + + - + + + + -
Tabel 1 Hasil penapisan bakteri yang berasosiasi dengan spons yang memiliki aktivitas antibakteri dan antifungi Iso 8
Iso 10 HAA 06 Iso 10
Iso 23
Iso 95
Iso 8
[image:32.595.334.508.201.270.2] [image:32.595.67.554.395.741.2]uji dan fungi uji yang lebih baik. Isolat-isolat bakteri tersebut ialah HAA 02, Iso act 6, Iso 8, Iso act 2, Iso 95, Iso act 1, Iso 40, HAA 06, HAL 87, Iso 23, Iso 20, dan Iso 10.
Amplifikasi Domain KS dan Domain A DNA genom dari 12 isolat bakteri diamplifikasi dengan proses
(PCR). Hasil amplifikasi domain KS dan domain A pada gel agarosa
[image:33.595.161.473.237.373.2]1% (b/v) menunjukkan pita berukuran sekitar 700 pb untuk domain KS (Gambar 3) dan sekitar 1000 pb untuk domain A (Gambar 4). Hasil amplifikasi domain KS dan domain A dari 12 isolat bakteri yang berasosiasi dengan spons tersebut menunjukkan bahwa ke-12 isolat tersebut memiliki domain KS dan domain A.
Gambar 3 Elektroforesis gel agarosa 1% (b/v) hasil amplifikasi domain KS untuk 12 isolat yang berasosiasi dengan spons sp. Ket: (L) 1 Kb$ , (1) HAA 02, (2) Iso act 6, (3) Iso 8, (4) Iso act 2, (5) Iso 95, (6) Iso act 1, (7) Iso 40, (8) HAA 06, (9) HAL 87, (10) Iso 23, (11) Iso 20, (12) Iso 10.
Gambar 4 Elektroforesis gel agarosa 1% (b/v) hasil amplifikasi domain A untuk 12 isolat yang berasosiasi dengan spons sp. Ket: (L) 1 Kb $ , (1) HAA 02, (2) Iso act 6, (3) Iso 8, (4) Iso act 2, (5) Iso 95, (6) Iso act 1, (7) Iso 40, (8) HAA 06, (9) HAL 87, (10) Iso 23, (11) Iso 20, (12) Iso 10.
L 1 2 3 4 5 6 7 8 9 10 11 12
1000 pb 3000 pb
750 pb
domain KS (700 pb)
1000 pb domain A
(1000 pb) 3000 pb
[image:33.595.151.477.442.589.2]Kloning Domain KS dan Domain A
Dalam Sel DH5α
Dua isolat dipilih untuk proses pengklonan domain KS dan domain A ke dalam sel DH5α, yaitu isolat Iso 10 dan HAA 02. Iso 10 menjadi contoh dari bakteri endofit dan HAA 02 menjadi contoh dari bakteri permukaan. Keduanya memiliki aktivitas antimikrob. Selain itu Iso 10 dan HAA 02 juga memiliki domain KS dan domain A berdasarkan hasil verifikasi dengan elektroforesis. Hasil klon domain KS dari Iso 10 menunjukkan adanya koloni putih dan koloni biru (Gambar 5), sedangkan hasil klon dari domain A dari isolat Iso 10 tidak terdapat koloni putih dan biru. Hasil klon domain KS dan domain A dari isolat HAA 02 tidak menunjukkan adanya koloni putih. Hal ini menandakan proses pengklonan domain KS dan domain A dari isolat HAA 02 tidak berhasil.
Gambar 5 Koloni putih DH5α pada isolat Iso 10 yang diduga membawa plasmid rekombinan.
Verifikasi Hasil Kloning Domain KS dan Domain A
Koloni putih dari Iso 10 untuk domain KS dipilih untuk proses isolasi plasmid. Plasmid rekombinan hasil isolasi plasmid dari beberapa koloni putih DH5α diduga ialah pGEMT-Easy-10-KS. Plasmid yang diduga rekombinan dipotong dengan enzim RI dan menghasilkan dua pita dengan ukuran yang berbeda. Pita pertama berukuran 3000 pb yang
menunjukkan ukuran pGEMT-Easy,
[image:34.595.313.548.92.255.2]sedangkan pita kedua berukuran 700 pb yang sesuai dengan ukuran domain KS berdasarkan Schirmer (2005) (Gambar 6). Hal ini menunjukkan bahwa pengklonan domain KS Iso 10 berhasil disisipkan pada DH5α. Selain itu, plasmid rekombinan yang membawa domain KS tersebut telah terpotong oleh enzim RI.
Gambar 6 Elektroforesis gel agarosa 1% dari
pGEMT-Easy-10-KS yang
dipotong dengan RI.
Analisis Bioinformatika
Palsmid rekombinan dari isolat Iso 10 yang diduga membawa domain KS selanjutnya dilakukan sekuensi (Lampiran 3). Hasil analisis didapatkan sekuen Iso 10 KS tidak sesuai dengan domain KS. Berdasarkan hasil dari amplifikasi PCR dan verifikasi hasil restriksi Iso 10 sesuai dengan domain KS, sehingga sekuen Iso KS dihomologikan dengan sekuen dari yang telah dipublikasikan dan dinyatakan telah memiliki domain KS (Lampiran 4).
( dari sekuen-sekuen
tersebut, yaitu AAW84215, AAW84218, AAW84193, dan AAW84190. Proses ini digunakan untuk mendapatkan homologi antara sekuen Iso KS dengan sekuen domain KS lainnya. Hasil analisis didapatkan bahwa 49-51% dengan sekuen-sekuen domain KS lainnya (Tabel 2). Koloni putih Koloni biru pGEMT-Easy
dom