Tanaman Padi (Oryza sativa L.) melalui Aktivitas Asam Indol Asetat. Dibimbing oleh YULIN LESTARI dan HAMIM.
Aktinomiset endofit hidup di jaringan tanaman dan kemungkinan dapat menghasilkan senyawa bioaktif potensial. Senyawa bioaktif yang dihasilkan aktinomiset endofit dapat berfungsi sebagai pemacu tumbuh tanaman melalui hormon tumbuh yang dihasilkannya, seperti Asam Indol Asetat (IAA). Hasil seleksi in vitro produksi IAA dari kesepuluh isolat yang ditumbuhkan dalam medium ISP 2 cair dengan penambahan 0.2 ml L-triptofan 0.2% menunjukkan seluruh isolat mampu menghasilkan IAA dengan kisaran konsentrasi 11-99 ppm. Isolat yang menghasilkan IAA tinggi yaitu AB131-1 (99.2 ppm), AB131-2 (99.2 ppm), dan PS4-16 (93.4 ppm). Ketiga isolat terpilih kemudian digunakan untuk uji in planta dengan cara diberi perlakuan supernatan pada kecambah tanaman padi (Oryza sativaL.) yang kemudian ditumbuhkan dalam pouches. Perlakuan dibedakan menjadi 20 perlakuan: kontrol negatif, kontrol positif (IAA 0.01, 0.1 dan 1 ppm), kontrol media ISP 2 cair dan supernatan ketiga isolat dalam berbagai pengenceran konsentrasi. Aplikasi perlakuan yang menunjukkan respon terbaik adalah AB131-1 (1.05 ppm IAA) karena mampu meningkatkan tinggi tanaman (26%), panjang akar (33.4%) dan bobot kering total tanaman (206%) melebihi pengaruh perlakuan IAA sintetik 0.1 ppm. Hasil pengamatan mikroskopis pada isolat AB131-1 dan PS4-16 dengan metode pewarnaan dan Scanning Electron Micrographs(SEM) menunjukkan bahwa kedua isolat merupakan isolat aktinomiset endofit yang mampu melakukan penetrasi pada akar padi. Data-data tersebut menunjukkan bahwa aplikasi aktinomiset endofit dapat meningkatkan pertumbuhan tanaman padi.
Kata Kunci: Aktinomiset endofit, Asam Indol Asetat (IAA), Oryza sativaL.
ABSTRACT
TERA TRI YUSEPI. The Capability of Actinomycetes Endophytic in Increasing the Growth of Rice Plant (Oryza sativa L.) through the Activity of Indole Acetic Acid. Under the Guidance of YULIN LESTARI and HAMIM.
Actinomycetes endophyte lives in plant tissue and may be able to produce various bioactive compounds. The bioactive compound produced by Actinomycetes endophyte can be useful to enhance the growth of plant through the activity of phytohormones substances produced, i.e. indole Acetic Acid (IAA). In vitro production of IAA from the ten isolates that were grown in ISP 2 liquid medium with the addition of 0.2 ml L-tryptophan 0.2% showed various concentration ranging about 11-99 ppm. Isolates producing high IAA were AB131-1 (99.2 ppm), AB131-2 (99,2 ppm), and PS4-16 (93.4 ppm). Those three superior isolates were then inoculated into rice seedlings which were then grown in pouches. Inoculation were designed in 20 different treatments, i.e. negative control, positive control (IAA 0.01, 0.1 dan 1 ppm), media control of ISP 2 liquid medium and supernatant of the three isolates in various concentrations. AB131-1 (1.05 ppm IAA) was considered as the most potential isolate based on its capability to increase plant height (26%), root length (33.4%) and dry weight (206%) more than the influence of IAA sintetic of 0.1 ppm addition. Microscopic observation of AB131-1 and PS4-16 of rice treatment using root coloring and Scanning Electron Micrographs (SEM) method showed that both of isolate were able to penetrate to the root of rice. The data showed that the application of Actinomycetes endophytic can increase the growth of rice plant.
1
PENDAHULUAN Latar Belakang
Padi (Oryza sativa L.) merupakan komoditas pangan utama di Indonesia. Peningkatan produksi padi selama ini masih menggunakan bahan-bahan kimia seperti pupuk anorganik. Penggunaan pupuk anorganik dapat meningkatkan produktivitas tanaman padi, namun dapat berdampak negatif terhadap lingkungan. Salah satu cara untuk mengurangi dampak negatif penggunaan pupuk anorganik yaitu menggunakan produk mikrobiologi dengan memanfaatkan mikroba endofit. Mikroba endofit merupakan mikroba yang hidup di dalam jaringan tanaman tanpa membahayakan inangnya. Mikroba endofit memperoleh nutrisi dari hasil metabolisme tanaman dan mampu melindungi tanaman dari serangan patogen, sedangkan tanaman memperoleh nutrisi dan senyawa bioaktif yang diperlukan selama hidupnya (Strobel & Daisy 2003; Hallman et al. 2007).
Senyawa bioaktif yang dihasilkan mikroba endofit dapat berfungsi untuk meningkatkan pertumbuhan tanaman. Salah satunya dengan menghasilkan hormon pertumbuhan Asam Indol Asetat (IAA). IAA adalah hormon auksin endogen yang disintesis dalam berbagai bagian tubuh tanaman dan umumnya berasosiasi dengan bagian tanaman yang sedang aktif tumbuh dan berkembang seperti pada semua jenis meristem ujung tunas, ujung akar dan kambium. Fungsi IAA bagi tanaman yaitu menstimulasi perpanjangan sel, meregulasi dominansi apikal, dan merangsang pembentukan akar-akar lateral dan adventif (Salisbury & Ross 1995). IAA secara struktural berkaitan dengan asam amino triptofan, dan terdapat 3 lintasan biosintesis IAA dari triptofan yaitu melalui Indol-3-Asetonitril (IAN), Indol-3-Asetamida (IAM), atau asam indol-3-piruvat (IpyA). Lintasan yang umum terdapat dalam jaringan tanaman adalah lintasan IAM dan IpyA, sedangkan pada sel bakteri biosintesis IAA dapat melalui ketiga jalur (Zakharova et al. 1999).
Bakteri penghasil IAA mempunyai potensi untuk bergabung dengan beberapa proses fisiologis tanaman dengan memasukkan IAA yang dihasilkannya ke tanaman. Pengaruhnya bagi tanaman itu sendiri adalah tanaman tersebut lebih sensitif dalam mengubah konsentrasi IAA yang dimilikinya (Berg 2009). Beberapa bakteri non aktinomiset dilaporkan mampu memproduksi IAA antara lain Pseudomonas putida (Patten & Glick
2002), Rhizobium strain dari Indigofera (Kumari et al. 2008), Azotobacter(Isminarni et al. 2007) dan Arthrobacter (Forni et al. 1992). Susilowati (2003) melaporkan bahwa beberapa bakteri endofit non aktinomiset asal tanaman padi mampu menambat N2 dan menghasilkan asam indol asetat, serta dapat meningkatkan pertumbuhan tanaman padi (Adhikari et al. 2001).
Aktinomiset merupakan bakteri Gram positif bersifat anaerobik atau fakultatif yang memiliki struktur berupa filamen lembut yang disebut hifa atau miselia. Pada lempeng agar aktinomiset dapat dibedakan dengan mudah dari bakteri non aktinomiset seperti koloni bakteri non aktinomiset yang berlendir dan tumbuh dengan cepat, sedangkan koloni aktinomiset muncul perlahan, menunjukkan konsistensi berbubuk dan melekat erat pada permukaan agar (Rao 1994, diacu dalam Puryantiningsih 2009). Beberapa aktinomiset merupakan penghasil beragam senyawa bioaktif yang dapat berfungsi antara lain sebagai antimikroba dan pemacu tumbuh tanaman (Lestari 2006; Aryantha et al. 2006). Igarashi et al. (2002) melaporkan Streptomyces hygroscopicus dapat memacu pertumbuhan tanaman kacang-kacangan melalui dihasilkannya asam pteridic A dan B. Meguro et al. (2006) melaporkan strain dari Streptomyces sp. MBR-52 mampu mempercepat pemunculan dan pemanjangan akar adventif tanaman. Khamna et al. (2010) melaporkan Streptomyces viridis mampu meningkatkan perkecambahan dan panjang akar tanaman jagung dan kacang polong melalui dihasilkannya IAA. Namun demikian, kajian mengenai kemampuan aktinomiset endofit dalam meningkatkan pertumbuhan tanaman padi melalui dihasilkannya hormon pemacu tumbuh seperti IAA belum dilakukan. Oleh karena itu, tujuan penelitian ini yaitu mengkaji peran aktinomiset endofit dalam menghasilkan IAA dan meningkatkan pertumbuhan tanaman padi perlu dilakukan. Luaran dari penelitian ini adalah informasi mengenai peran biologi aktinomiset endofit asal tanaman padi.
BAHAN DAN METODE Waktu dan Tempat Penelitian
PENDAHULUAN Latar Belakang
Padi (Oryza sativa L.) merupakan komoditas pangan utama di Indonesia. Peningkatan produksi padi selama ini masih menggunakan bahan-bahan kimia seperti pupuk anorganik. Penggunaan pupuk anorganik dapat meningkatkan produktivitas tanaman padi, namun dapat berdampak negatif terhadap lingkungan. Salah satu cara untuk mengurangi dampak negatif penggunaan pupuk anorganik yaitu menggunakan produk mikrobiologi dengan memanfaatkan mikroba endofit. Mikroba endofit merupakan mikroba yang hidup di dalam jaringan tanaman tanpa membahayakan inangnya. Mikroba endofit memperoleh nutrisi dari hasil metabolisme tanaman dan mampu melindungi tanaman dari serangan patogen, sedangkan tanaman memperoleh nutrisi dan senyawa bioaktif yang diperlukan selama hidupnya (Strobel & Daisy 2003; Hallman et al. 2007).
Senyawa bioaktif yang dihasilkan mikroba endofit dapat berfungsi untuk meningkatkan pertumbuhan tanaman. Salah satunya dengan menghasilkan hormon pertumbuhan Asam Indol Asetat (IAA). IAA adalah hormon auksin endogen yang disintesis dalam berbagai bagian tubuh tanaman dan umumnya berasosiasi dengan bagian tanaman yang sedang aktif tumbuh dan berkembang seperti pada semua jenis meristem ujung tunas, ujung akar dan kambium. Fungsi IAA bagi tanaman yaitu menstimulasi perpanjangan sel, meregulasi dominansi apikal, dan merangsang pembentukan akar-akar lateral dan adventif (Salisbury & Ross 1995). IAA secara struktural berkaitan dengan asam amino triptofan, dan terdapat 3 lintasan biosintesis IAA dari triptofan yaitu melalui Indol-3-Asetonitril (IAN), Indol-3-Asetamida (IAM), atau asam indol-3-piruvat (IpyA). Lintasan yang umum terdapat dalam jaringan tanaman adalah lintasan IAM dan IpyA, sedangkan pada sel bakteri biosintesis IAA dapat melalui ketiga jalur (Zakharova et al. 1999).
Bakteri penghasil IAA mempunyai potensi untuk bergabung dengan beberapa proses fisiologis tanaman dengan memasukkan IAA yang dihasilkannya ke tanaman. Pengaruhnya bagi tanaman itu sendiri adalah tanaman tersebut lebih sensitif dalam mengubah konsentrasi IAA yang dimilikinya (Berg 2009). Beberapa bakteri non aktinomiset dilaporkan mampu memproduksi IAA antara lain Pseudomonas putida (Patten & Glick
2002), Rhizobium strain dari Indigofera (Kumari et al. 2008), Azotobacter(Isminarni et al. 2007) dan Arthrobacter (Forni et al. 1992). Susilowati (2003) melaporkan bahwa beberapa bakteri endofit non aktinomiset asal tanaman padi mampu menambat N2 dan menghasilkan asam indol asetat, serta dapat meningkatkan pertumbuhan tanaman padi (Adhikari et al. 2001).
Aktinomiset merupakan bakteri Gram positif bersifat anaerobik atau fakultatif yang memiliki struktur berupa filamen lembut yang disebut hifa atau miselia. Pada lempeng agar aktinomiset dapat dibedakan dengan mudah dari bakteri non aktinomiset seperti koloni bakteri non aktinomiset yang berlendir dan tumbuh dengan cepat, sedangkan koloni aktinomiset muncul perlahan, menunjukkan konsistensi berbubuk dan melekat erat pada permukaan agar (Rao 1994, diacu dalam Puryantiningsih 2009). Beberapa aktinomiset merupakan penghasil beragam senyawa bioaktif yang dapat berfungsi antara lain sebagai antimikroba dan pemacu tumbuh tanaman (Lestari 2006; Aryantha et al. 2006). Igarashi et al. (2002) melaporkan Streptomyces hygroscopicus dapat memacu pertumbuhan tanaman kacang-kacangan melalui dihasilkannya asam pteridic A dan B. Meguro et al. (2006) melaporkan strain dari Streptomyces sp. MBR-52 mampu mempercepat pemunculan dan pemanjangan akar adventif tanaman. Khamna et al. (2010) melaporkan Streptomyces viridis mampu meningkatkan perkecambahan dan panjang akar tanaman jagung dan kacang polong melalui dihasilkannya IAA. Namun demikian, kajian mengenai kemampuan aktinomiset endofit dalam meningkatkan pertumbuhan tanaman padi melalui dihasilkannya hormon pemacu tumbuh seperti IAA belum dilakukan. Oleh karena itu, tujuan penelitian ini yaitu mengkaji peran aktinomiset endofit dalam menghasilkan IAA dan meningkatkan pertumbuhan tanaman padi perlu dilakukan. Luaran dari penelitian ini adalah informasi mengenai peran biologi aktinomiset endofit asal tanaman padi.
BAHAN DAN METODE Waktu dan Tempat Penelitian
2
Metode
Peremajaan Aktinomiset Endofit. Isolat aktinomiset endofit AB131-2, PS4-16 dan Impara 6A diremajakan pada media agar-agar Oat Meal (media OM), isolat AB131-1, AB131-3, A-Fat, Membramo A, LSW-05, LBR-02, dan SSW-02 diremajakan pada mediaInternational Streptomyces Project no. 2 (ISP 2), lalu diinkubasi pada suhu ruang selama 14 hari. Kedua jenis media selektif tersebut digunakan berdasarkan kemampuan tumbuh isolat aktinomiset.
Bioesei IAA Aktinomiset Endofit. Produksi IAA diukur secara spektrofotometri dengan metode Salkowski (Patten & Glick 2002). Isolat ditumbuhkan pada media ISP 2 (Lampiran 1a) pada suhu ruang selama 5 hari, kemudian sebanyak 2 disc isolat (5 mm per disc) dipindahkan pada 19.8 ml media International Streptomyces Projectno. 2 (ISP 2) cair (Lampiran 1b) yang telah ditambah 0.2 ml L-triptofan 0.2%, dan diinkubasi pada inkubator bergoyang dengan kecepatan 125 rpm pada suhu ruang selama 10 hari. Kultur yang diperoleh kemudian disentrifugasi dengan kecepatan 11000 rpm pada suhu 4°C selama 15 menit. Sebanyak 1 ml supernatan diambil kemudian dicampurkan dengan 4 ml pereaksi Salkowski (Lampiran 2), lalu disimpan di ruang gelap selama 30 menit. Pembentukan IAA ditunjukkan jika terjadi perubahan warna menjadi merah muda. Absorbansi diukur pada panjang gelombang 530 nm dengan menggunakan Spectronic 20 Baush and Lomb (Khamna et al. 2010). Absorbansi IAA dibaca dengan mengurangi nilai absorbansi sampel yang ditambah pereaksi Salkowski dengan nilai Optical Density (OD). Absorbans terkoreksi lalu dimasukkan ke dalam persamaan kurva standar IAA (Lampiran 3 & 5). Pengujian dilakukan sebanyak 2 kali ulangan.
Penentuan Waktu Optimum Produksi IAA dan Pengukuran Biomassa Sel. Kurva produksi IAA aktinomiset endofit terpilih diukur dengan metode bioesei IAA pada hari ke-5, 10, 15 dan 20. Isolat ditumbuhkan pada media ISP 2 (Lampiran 1a) pada suhu ruang selama 5 hari, kemudian sebanyak 4 disc isolat (5 mm per disc) dipindahkan pada 39.6 ml media ISP 2 cair (Lampiran 1b) yang telah ditambah 0.4 ml L-triptofan 0.2% dan diinkubasi pada inkubator bergoyang dengan kecepatan 125 rpm pada suhu ruang. Kultur yang diperoleh kemudian disentrifugasi dengan kecepatan 4500 rpm pada suhu 4°C
selama 30 menit. Sebanyak 1 ml supernatan diambil kemudian dicampurkan dengan 4 ml pereaksi Salkowski (Lampiran 2), lalu disimpan di ruang gelap selama 30 menit. Absorbansi diukur pada panjang gelombang 530 nm. Pengukuran IAA dilakukan bersamaan dengan pengukuran biomassa sel aktinomiset. Kultur hasil sentifugasi disaring dengan menggunakan kertas saring. Pelet selanjutnya dikeringkan di dalam oven selama 6 jam pada suhu 70°C, lalu ditimbang. Pengujian dilakukan sebanyak 2 kali ulangan.
Penyiapan Inokulum Aktinomiset Endofit. Isolat diremajakan pada media ISP 2 atau media M sesuai dengan kemampuan tumbuhnya. Inkubasi dilakukan pada suhu ruang selama 5 hari, kemudian sebanyak 4 discisolat (5 mm per disc) dipindahkan pada 40 ml media ISP 2 cair dan diinkubasi pada suhu ruang selama 15 hari. Kultur yang diperoleh lalu disentrifugasi dengan kecepatan 4500 rpm, pada suhu 4°C selama 30 menit.
Penyiapan Tanaman Uji. Benih padi disterilisasi permukaannya dengan alkohol 95% selama satu menit, dibilas air steril sebanyak tiga kali, dan digoyang pada inkubator bergoyang selama 10 menit. Benih kemudian direndam pada larutan HgCl20.2% selama delapan menit, dibilas air steril sebanyak enam kali, dan direndam selama satu malam. Benih kemudian disebar pada media Triptone Yeast(TY) (Lampiran 4a) dan diinkubasi selama empat hari pada suhu ruang dalam kondisi gelap.
h
j c
i a
g
f e
d b tinggi tanaman, panjang dan jumlah akar,
serta bobot kering akar dan tajuk.
Pengamatan Mikroskopis Akar Tanaman Padi.
Metode Pewarnaan. Pengamatan dilakukan pada hari ke-15 setelah inokulasi dengan metode reducing tetrazolium (Patriquin & Doberainer 1978). Akar padi dibersihkan dengan aquades steril, direndam dalam chloramine T 1% selama satu jam sambil dikocok, dibilas air steril, dan direndam kembali dalam tetrazolium bufer fosfat selama satu malam. Irisan melintang akar selanjutnya diletakkan pada gelas objek yang telah ditetesi gliserin 50% dan diamati dibawah mikroskop dengan perbesaran 40x10.
Metode SEM. Akar padi direndam dalam bufer caccodylate selama 2 jam, diagitasi dalam Ultrasonic cleanerselama 5 menit, lalu dipisahkan untuk setiap bagian akar. Setelah itu sampel direndam dalam larutan glutaraldehyde 2.5% sampai 2 hari. Sampel selanjutnya difiksasi dengan asam tannat 2% selama 6 jam dan dicuci dengan caccodylate sebanyak 4 kali selama 5 menit. Sampel yang telah difiksasi kemudian didehidrasi dalam alkohol 50% selama 5 menit sebanyak 4 kali, direndam dalam alkohol 70, 80, dan 95% selama 20 menit, dan direndam dalam alkohol absolut selama 10 menit sebanyak 2 kali. Proses pengeringan sampel dilakukan dengan perendaman sampel dalam tert butanol selama 10 menit sebanyak 2 kali, dibekukan dalam freezer, lalu dimasukkan ke dalam freeze dryer untuk proses pengeringan dan diamati dengan Scanning Electron Micrographs (SEM) JSM-5000.
Perancangan Percobaan. Percobaan menggunakan Rancangan Acak Lengkap (RAL) dengan satu faktor yaitu aplikasi IAA (dalam bentuk supernatan aktinomiset), dibandingkan dengan kontrol terhadap tanaman sebanyak enam ulangan, dan diuji dengan uji Duncan.
HASIL
Peremajaan Isolat Aktinomiset Endofit. Kesepuluh isolat aktinomiset endofit yang telah diremajakan, enam diantaranya yaitu AB131-1, AB131-2, AB131-3, A Fat, Impara 6-A, dan Membramo-A merupakan aktinomiset endofit asal tanaman padi, sedangkan empat lainnya yaitu SSW 02, LBR 02, LSW 05 dan PS4-16 merupakan isolat aktinomiset asal tanah. Isolat AB131-2, PS4-16 dan Impara 6A diremajakan dalam media
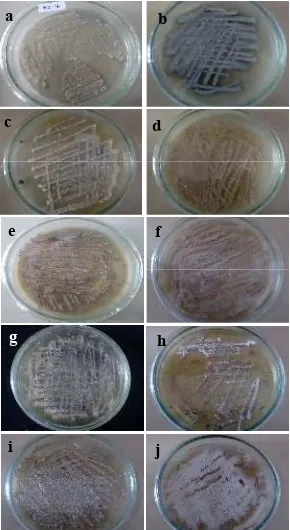
OM sedangkan isolat AB131-1, AB131-3, A-Fat, Membramo A, LSW-05, LBR-02, dan SSW-02 diremajakan dalam media ISP2. Isolat rata-rata membentuk miselia yang berwarna putih. Namun terdapat beberapa isolat yang memiliki warna miselia yang berbeda setelah koloni isolat mencapai dewasa, seperti AB131-1 dan SSW-02 dengan miselia berwarna agak keabuan, AB131-2 dengan miselia berwarna hijau tua, serta AB131-3 dan LBR-02 dengan miselia berwarna coklat muda (Gambar 1). Warna yang terbentuk pada koloni tersebut merupakan hasil pigmentasi dari miselium aerial isolat dan menjadi warna karateristik dari aktinomiset dewasa (Nurkanto 2007).
Gambar 1 Pertumbuhan isolat aktinomiset umur 14 hari pada suhu ruang dalam medium ISP 2; (a) PS4-16, (b) AB131-2, (c) Impara-6A. Dalam medium OM; (d) AB131-3, (e) LBR 02, (f) SSW 02, (g) Membramo A, (h) AB131-1, (i) A fat, (j) LSW 05.
3
h
j c
i a
g
f e
d b tinggi tanaman, panjang dan jumlah akar,
serta bobot kering akar dan tajuk.
Pengamatan Mikroskopis Akar Tanaman Padi.
Metode Pewarnaan. Pengamatan dilakukan pada hari ke-15 setelah inokulasi dengan metode reducing tetrazolium (Patriquin & Doberainer 1978). Akar padi dibersihkan dengan aquades steril, direndam dalam chloramine T 1% selama satu jam sambil dikocok, dibilas air steril, dan direndam kembali dalam tetrazolium bufer fosfat selama satu malam. Irisan melintang akar selanjutnya diletakkan pada gelas objek yang telah ditetesi gliserin 50% dan diamati dibawah mikroskop dengan perbesaran 40x10.
Metode SEM. Akar padi direndam dalam bufer caccodylate selama 2 jam, diagitasi dalam Ultrasonic cleanerselama 5 menit, lalu dipisahkan untuk setiap bagian akar. Setelah itu sampel direndam dalam larutan glutaraldehyde 2.5% sampai 2 hari. Sampel selanjutnya difiksasi dengan asam tannat 2% selama 6 jam dan dicuci dengan caccodylate sebanyak 4 kali selama 5 menit. Sampel yang telah difiksasi kemudian didehidrasi dalam alkohol 50% selama 5 menit sebanyak 4 kali, direndam dalam alkohol 70, 80, dan 95% selama 20 menit, dan direndam dalam alkohol absolut selama 10 menit sebanyak 2 kali. Proses pengeringan sampel dilakukan dengan perendaman sampel dalam tert butanol selama 10 menit sebanyak 2 kali, dibekukan dalam freezer, lalu dimasukkan ke dalam freeze dryer untuk proses pengeringan dan diamati dengan Scanning Electron Micrographs (SEM) JSM-5000.
Perancangan Percobaan. Percobaan menggunakan Rancangan Acak Lengkap (RAL) dengan satu faktor yaitu aplikasi IAA (dalam bentuk supernatan aktinomiset), dibandingkan dengan kontrol terhadap tanaman sebanyak enam ulangan, dan diuji dengan uji Duncan.
HASIL
Peremajaan Isolat Aktinomiset Endofit. Kesepuluh isolat aktinomiset endofit yang telah diremajakan, enam diantaranya yaitu AB131-1, AB131-2, AB131-3, A Fat, Impara 6-A, dan Membramo-A merupakan aktinomiset endofit asal tanaman padi, sedangkan empat lainnya yaitu SSW 02, LBR 02, LSW 05 dan PS4-16 merupakan isolat aktinomiset asal tanah. Isolat AB131-2, PS4-16 dan Impara 6A diremajakan dalam media
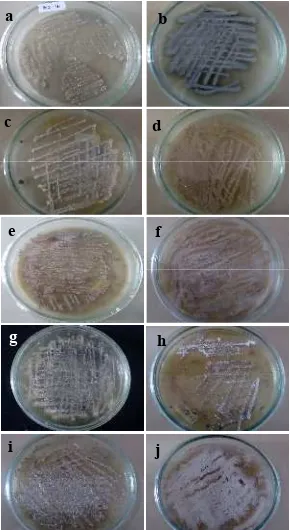
OM sedangkan isolat AB131-1, AB131-3, A-Fat, Membramo A, LSW-05, LBR-02, dan SSW-02 diremajakan dalam media ISP2. Isolat rata-rata membentuk miselia yang berwarna putih. Namun terdapat beberapa isolat yang memiliki warna miselia yang berbeda setelah koloni isolat mencapai dewasa, seperti AB131-1 dan SSW-02 dengan miselia berwarna agak keabuan, AB131-2 dengan miselia berwarna hijau tua, serta AB131-3 dan LBR-02 dengan miselia berwarna coklat muda (Gambar 1). Warna yang terbentuk pada koloni tersebut merupakan hasil pigmentasi dari miselium aerial isolat dan menjadi warna karateristik dari aktinomiset dewasa (Nurkanto 2007).
Gambar 1 Pertumbuhan isolat aktinomiset umur 14 hari pada suhu ruang dalam medium ISP 2; (a) PS4-16, (b) AB131-2, (c) Impara-6A. Dalam medium OM; (d) AB131-3, (e) LBR 02, (f) SSW 02, (g) Membramo A, (h) AB131-1, (i) A fat, (j) LSW 05.
11-99 ppm (Gambar 2). Berdasarkan hasil analisis supernatan diperoleh tiga isolat yang menghasilkan IAA tinggi, yaitu AB131-1 (99.2 ppm), AB131-2 (99.2 ppm), dan PS4-16 (93.4 ppm).
Gambar 2 Produksi IAA oleh aktinomiset endofit umur 10 hari dalam media ISP 2 cair.
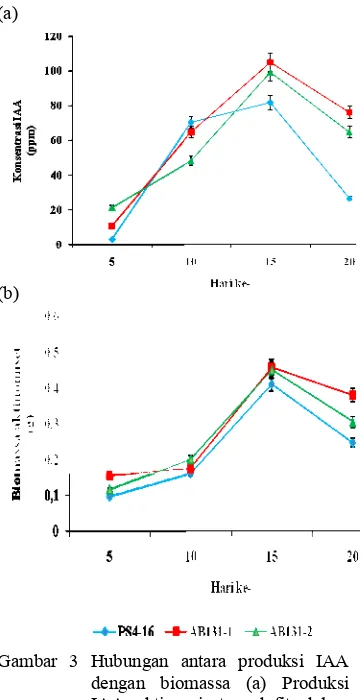
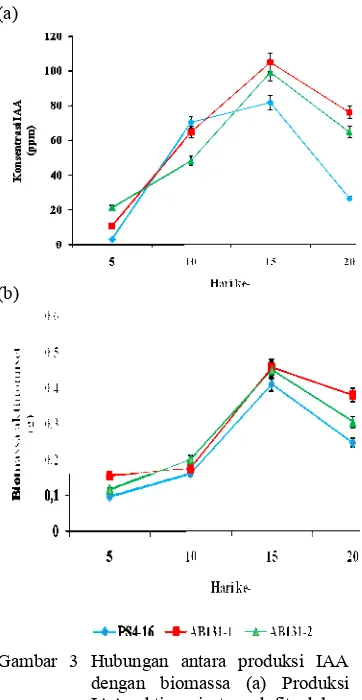
Penentuan Waktu Optimum Produksi IAA dan Pengukuran Biomassa Aktinomiset. Pengukuran produksi IAA ketiga isolat terpilih AB131-1, AB131-2, dan PS4-16 yang ditumbuhkan dalam media ISP 2 cair dengan penambahan 0.4 ml L-triptofan 0.2%, menunjukkan konsentrasi IAA tertinggi umumnya diproduksi pada usia kultur mencapai 15 hari yaitu masing-masing sebesar 105 ppm, 99 ppm dan 82 ppm (Lampiran 6a). Pada hari inkubasi ke-5 IAA yang dihasilkan ketiga isolat masih rendah kemudian meningkat dihari 10 sampai pada hari ke-15 lalu mengalami penurunan pada hari ke-20 (Gambar 3a).
Hasil pengukuran biomassa ketiga isolat menunjukkan biomassa tertinggi untuk ketiga isolat dihasilkan pada hari ke-15 yaitu AB131-1 sebesar 0.46 g, AB131-2 sebesar 0.45 g dan PS4-16 sebesar 0.41 g (Lampiran 6b). Biomassa ketiga isolat kemudian menurun pada hari ke-20 (Gambar 3b). Penurunan biomassa yang terjadi diduga karena isolat sudah mencapai fase kematian. Jika dihubungkan dengan kurva produksi IAA maka biomassa yang dihasilkan sebanding dengan IAA yang dihasilkan ketiga isolat. Hal ini menunjukkan bahwa biomassa yang tinggi dari masing-masing isolat mempengaruhi produksi IAA yang dihasilkan.
(a)
(b)
Gambar 3 Hubungan antara produksi IAA dengan biomassa (a) Produksi IAA aktinomiset endofit dalam medium ISP2 cair, (b) Biomassa aktinomiset endofit
.
Uji Potensi Aktinomiset Endofit secara in planta pada Tanaman Padi. Uji efektivitas ketiga isolat aktinomiset endofit secara in planta menunjukkan bahwa ketiga isolat mampu meningkatkan pertumbuhan tanaman padi. Perlakuan IAA sintetik sebagai kontrol positif dilakukan untuk mengetahui konsentrasi IAA sintetik yang sesuai bagi pertumbuhan tanaman padi. Perlakuan ketiga konsentrasi IAA sintetik (1, 0.1 dan 0.01 ppm) menunjukkan bahwa perlakuan 0.1 ppm merupakan perlakuan yang paling berpengaruh nyata lebih besar terhadap pertumbuhan tanaman padi jika dibandingkan dengan perlakuan konsentrasi IAA sintetik 1 dan 0.01 ppm (Tabel 1; Gambar 4a). Berdasarkan hasil tersebut maka IAA sintetik konsentrasi 0.1 ppm dapat dijadikan kontrol positif yang selanjutnya dibandingkan dengan hasil perlakuan ketiga isolat terpilih.
5
supernatan ketiga isolat mampu meningkatkan tinggi tanaman jika dibandingkan dengan perlakuan kontrol. Seluruh perlakuan supernatan pada isolat AB131-1 mampu mempengaruhi tinggi tanaman. Akan tetapi perlakuan supernatan konsentrasi 1.05 ppm memberikan pengaruh yang nyata lebih besar terhadap tinggi tanaman sebesar 26% (19.75 cm) jika dibandingkan dengan kontrol negatif. Hasil tersebut lebih besar dari pengaruh perlakuan IAA sintetik 0.1 ppm yang berpengaruh terhadap tinggi tanaman padi sebesar 24.2% (19.47 cm) (Tabel 1 & 2; Gambar 4b). Perlakuan supernatan AB131-2 konsentrasi 0.99 ppm mampu berpengaruh nyata lebih besar terhadap tinggi tanaman sebesar 18.5% (18.58 cm) jika dibandingkan dengan perlakuan kontrol negatif. Sedangkan pada isolat PS4-14 perlakuan supernatan konsentrasi 82 ppm yang berpengaruh nyata lebih besar terhadap tinggi tanaman sebesar 11.8% (17.53 cm) jika dibandingkan kontrol negatif (Tabel 1 & 2).
Perlakuan pemberian supernatan isolat rata-rata mampu meningkatkan panjang akar dan jumlah akar tanaman padi dengan respon yang berbeda-beda jika dibandingkan dengan kontrol. Perlakuan supernatan AB131-1 konsentrasi 1.05 ppm berpengaruh nyata lebih besar terhadap panjang akar sebesar 33.4% (17.07 cm) dan jumlah akar sebesar 4.8% (6.50), sedangkan perlakuan supernatan AB131-2 konsentrasi 0.99 ppm berpengaruh nyata terhadap panjang akar sebesar 23.7% (15.83 cm) dan tidak memiliki pengaruh yang nyata terhadap jumlah akar jika dibandingkan kontrol. Sama halnya dengan PS4-16 konsentrasi 82 ppm yang berpengaruh nyata terhadap panjang akar sebesar 22.5% (15.68 cm) namun tidak berpengaruh nyata terhadap jumlah akar (Tabel 1& 2).
Bobot kering tajuk dan akar tanaman menunjukkan beda nyata pada setiap perlakuan. Perlakuan supernatan AB131-1 konsentrasi 1.05 ppm berpengaruh paling nyata lebih besar terhadap bobot kering tajuk sebesar 109.3% (162 mg) dan akar sebesar 96.7% (77.3 mg) jika dibandingkan dengan perlakuan kontrol negatif dan IAA sintetik 0.1 ppm. Sedangkan perlakuan supernatan AB131-2 konsentrasi 0.99 ppm berpengaruh nyata lebih besar terhadap berat kering tajuk sebesar 49.9% (115.8 mg) dan akar sebesar 69.75 (66.7 mg) jika dibandingkan dengan kontrol negatif. Perlakuan supernatan PS4-16 konsentrasi 82 ppm berpengaruh nyata lebih
besar terhadap bobot kering tajuk sebesar 28.8% (99.7 mg) dan akar sebesar 87.8% (73.8 mg) jika dibandingkan dengan kontrol negatif (Tabel 1 & 2).
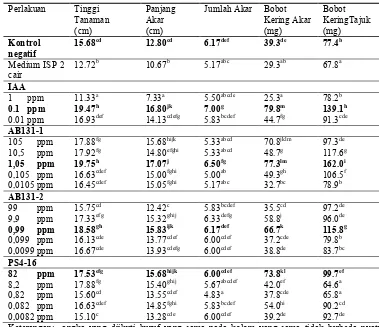
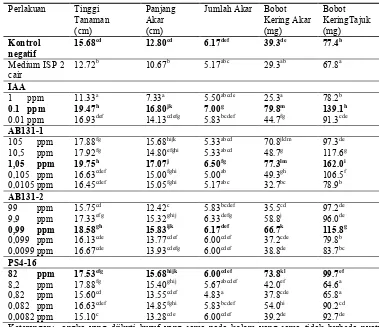
Tabel 1 Pengaruh aplikasi aktinomiset endofit terhadap pertumbuhan tanaman padi umur 20 hari
Keterangan: angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji Duncan (=0.05).
(a) (b)
Gambar 4 Respon pertumbuhan tanaman padi terhadap perlakuan aktinomiset jika dibandingkan dengan perlakuan IAA sintetik, tanaman 20 hari; (a) Perlakuan supernatan AB131-1 (105 ppm IAA) dengan berbagai pengenceran (100, 10-1, 10-2, 10-3, dan 10-4), (b) Perlakuan IAA sintetik dibandingkan dengan kontrol negatif dan kontrol media.
Perlakuan Tinggi Tanaman (cm) Panjang Akar (cm)
Jumlah Akar Bobot Kering Akar (mg) Bobot KeringTajuk (mg) Kontrol negatif
15.68cd 12.80cd 6.17def 39.3de 77.4b
Medium ISP 2 cair
12.72b 10.67b 5.17abc 29.3ab 67.8a
IAA 1 ppm 0.1 ppm 0.01 ppm 11.33a 19.47h 16.93def 7.33a 16.80jk 14.13cdefg 5.50abcde 7.00g 5.83bcdef 25.3a 79.8m 44.7fg 78.2b 139.1h 91.3cde AB131-1
105 ppm 10,5 ppm 1,05 ppm 0,105 ppm 0,0105 ppm 17.88fg 17.92fg 19.75h 16.63cdef 16.45cdef 15.68hijk 14.80efghi 17.07j 15.00fghi 15.05fghi 5.33abcd 5.33abcd 6.50fg 5.00ab 5.17abc 70.8jklm 48.7g 77.3lm 49.3gh 32.7bc 97.3de 117.6g 162.0i 106.5f 78.9b AB131-2
99 ppm 9,9 ppm 0,99 ppm 0,099 ppm 0,0099 ppm 15.75cd 17.33efg 18.58gh 16.13cde 16.67cde 12.42c 15.32ghij 15.83ijk 13.77cdef 13.93cdefg 5.83bcdef 6.33defg 6.17def 6.00cdef 6.00cdef 35.5cd 58.8j 66.7k 37.2cde 38.8de 97.2de 96.0de 115.8g 79.8b 83.7bc PS4-16
7
Tabel 2 Persentase peningkatan pertumbuhan tanaman padi umur 20 hari setelah diberi perlakuan aktinomiset endofit dibandingkan dengan kontrol
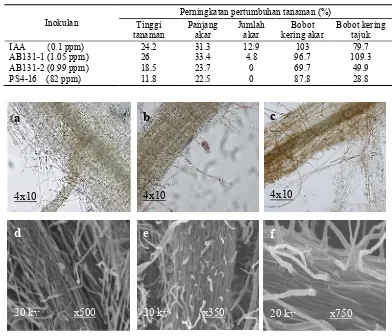
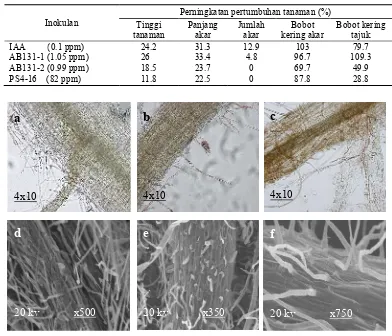
Gambar 5 Penetrasi aktinomiset endofit pada akar padi. Metode pewarnaan; (a) tanpa perlakuan, (b) AB131-1 (c) PS4-16, Metode SEM; (d) tanpa perlakuan (e) AB131-1, (f) PS4-16.
PEMBAHASAN
Sebanyak 10 isolat aktinomiset endofit yang diuji dalam percobaan ini terbukti mampu memproduksi IAA dalam media ISP 2 cair dengan penambahan 0.2 ml L-triptofan 0.2% dengan masa inkubasi 10 hari. Hasil pengujian menunjukkan bahwa seluruh isolat mampu menghasilkan IAA dengan kisaran konsentrasi 11-99 ppm. Isolat yang menghasilkan IAA tinggi yaitu AB131-1 (99.2 ppm), AB131-2 (99.2 ppm) dan PS4-16 (93.4 ppm). Hasil ini masih jauh lebih besar dari penelitian Susilowati et al. (2003) yang melaporkan bahwa isolat bakteri endofit dari batang padi yang ditumbuhkan dalam media menghasilkan IAA tertinggi sebesar 8.29 ppm selama 5-7 hari inkubasi dengan penambahan 1 mg L-triptofan 5 Mml. Khamna et al. (2010) melaporkan S. viridis asal tanah rizosfer
tanaman obat menghasilkan IAA tertinggi sebesar 144 ppm, sedangkan Shrivastava et al. (2008) melaporkan Kitasatospora sp. menghasilkan IAA pada kisaran 0.8-1.8 ppm selama 4-6 hari inkubasi dengan penambahan L-triptofan sebanyak 0.5 g. Perbedaan produksi IAA dari berbagai bakteri ini dapat dipengaruhi oleh jenis isolat serta kemampuannya dalam mengkonversi L-triptofan yang terkandung dalam media menjadi IAA (Patten & Glick 2002). L-triptofan merupakan asam amino yang berperan sebagai prekursor dalam pembentukan IAA. Ketersedian prekursor yang cocok adalah salah satu faktor primer sekresi metabolit sekunder dari mikroba. Mannulis et al. (1994) melaporkan beberapa spesies dari Streptomyces diantaranya S. violaceus, S. scabies, S. griseus, S. exfoliates, Inokulan
Perningkatan pertumbuhan tanaman (%) Tinggi
tanaman
Panjang akar
Jumlah akar
Bobot kering akar
Bobot kering tajuk IAA (0.1 ppm)
AB131-1 (1.05 ppm) AB131-2 (0.99 ppm) PS4-16 (82 ppm)
24.2 26
18.5 11.8
31.3 33.4 23.7 22.5
12.9 4.8
0 0
103 96.7 69.7 87.8
79.7 109.3
49.9 28.8
a
4x10
d
20 kv x500
c
4x10
e
20 kv x350
f
20 kv x750
b
S. coelicolor dan S. lividans mampu memproduksi IAA ketika diberikan L-triptofan.
Penentuan waktu produksi IAA dilakukan untuk mengetahui waktu optimum isolat aktinomiset endofit dalam memproduksi IAA. Kurva produksi IAA ketiga isolat menunjukkan produksi IAA pada hari ke 5, masih rendah lalu meningkat pada hari ke 10 hingga hari ke 15 kemudian menurun kembali pada hari ke 20. Produksi IAA optimum dari ketiga isolat dihasilkan pada waktu umur isolat 15 hari yaitu AB131-1 sebesar (105 ppm), AB131-2 (99 ppm), dan PS4-16 (82 ppm). Jika dihubungkan dengan kurva biomassa aktinomiset maka diperoleh hasil sebanding dengan produksi IAA aktinomiset. Hasil tersebut menunjukkan bahwa biomassa yang tinggi dapat mempengaruhi produksi IAA yang tinggi. Menurut Lestari et al. (2007) bahwa pada awal inkubasi, sumber nutrisi tinggi sehingga produksi IAA tinggi dan terus meningkat secara signifikan sampai akhir inkubasi. Waktu produksi IAA maksimun ini selanjutnya akan digunakan dalam pengujian aplikasi IAA aktinomiset endofit terpilih pada tanaman padi di lapangan.
IAA merupakan hormon kunci bagi peningkatan pertumbuhan tanaman sehingga sintesisnya oleh jenis mikroba tertentu merupakan salah satu alasan terjadinya peningkatan pertumbuhan tanaman yang di uji (Aryantha et al. 2006). IAA dapat disintesis oleh mikroba melalui asosiasinya dengan tanaman. Asosiasi tanaman dengan mikroba dapat berpengaruh terhadap keseimbangan hormon didalam tanaman (Berg 2009). Kemampuan produksi IAA dari ketiga isolat aktinomiset endofit yang terpilih merupakan dasar pengkajian potensi aktinomiset endofit dalam peningkatan pertumbuhan tanaman padi.
Penentuan konsentrasi IAA yang sesuai bagi tanaman padi dilakukan untuk mengetahui konsentrasi IAA yang dapat mempengaruhi pertumbuhan tanaman padi. Berdasarkan hasil pengamatan, IAA konsentrasi 0.1 ppm berpengaruh nyata lebih besar jika dibandingkan dengan konsentrasi IAA 1 ppm dan 0.01 ppm. Perlakuan IAA dengan konsentrasi 1 ppm justru menghambat pertumbuhan tanaman padi (Gambar 4a). Efek pemberian IAA yang tinggi dapat memicu terbentuknya hormon lain seperti etilen yang akan menghambat pertumbuhan tanaman (Salisbury & Ross 1995).
Berdasarkan uji in planta terbukti bahwa IAA yang dihasilkan aktinomiset endofit
mampu meningkatkan pertumbuhan tanaman padi yang ditumbuhkan dalam pouches. Aplikasi supernatan AB131-2 konsentrasi 0.99 ppm dan PS4-16 konsentrasi 82 ppm masing-masing berpengaruh nyata lebih besar terhadap tinggi tanaman, panjang akar, bobot kering akar dan tajuk jika dibandingkan dengan kontrol negatif (Tabel 1 & 2). Aplikasi supernatan AB131-1 konsentrasi 1.05 ppm merupakan aplikasi yang berpengaruh paling besar terhadap pertumbuhan tanaman padi karena mampu meningkatkan tinggi tanaman sebesar 26% (19.75 cm), panjang akar 33.4% (17.07 cm), dan bobot kering tajuk 109.3% (162 mg) jika dibandingkan dengan kontrol serta lebih tinggi dari respon kontrol positif IAA sintetik 0.1 ppm (Tabel 1 & 2; Gambar 4b).
Adhikari et al. (2001) melaporkan strain S20 dan S21 bakteri endofit yang diisolasi dari akar padi mampu meningkatkan tinggi tanaman padi yang ditumbuhkan dalam pouches sebesar 4-10%. Penelitian Khamna et al. (2010) melaporkan bahwa perlakuan S. vidis mampu meningkatkan panjang akar tanaman jagung sebesar 18.5 cm dan kacang polong sebesar 4.7 cm. Aryantha et al. (2004) melaporkan bahwa produk cair aktinomiset galur LC mampu meningkatkan jumlah cabang akar tanaman kacang hijau. Pertumbuhan yang pesat dari akar baik dengan pemanjangan akar utama maupun penambahan jumlah percabangan akar lateral dan akar adventif memberikan keuntungan bagi tanaman dalam pelekatan diri pada tanah dan penyerapan air serta nutrisi dari lingkungan, dan akhirnya akan meningkatkan peluang kelangsungan hidup tanaman (Patten & Glick 2002).
9
nyata lebih kecil terhadap bobot kering akar tanaman padi jika dibandingkan dengan perlakuan kontrol IAA sintetik 0.1 ppm. Namun jika dilihat dari bobot kering total tanaman, perlakuan AB131-1 konsentrasi 1.05 ppm (206%) berpengaruh nyata lebih besar dibandingkan IAA 0.1 ppm (182.7%). Adhikari et al. (2001) melaporkan bahwa perlakuan bakteri endofit strain S20 dan S21 dengan metode pencelupan benih padi mampu meningkatkan bobot kering total tanaman padi sebesar 12%-50%.
Pengamatan mikroskopis akar padi yang diberi perlakuan AB131-1 dan PS4-16 dengan metode pewarnaan tetrazolium masing-masing menunjukkan adanya penetrasi pada akar padi. Koloni berwana merah yang terdapat di permukaan akar padi diduga merupakan aktinomiset endofit yang sedang melakukan penetrasi (Gambar 5b). Larutan tetrazolium digunakan sebagai indikator untuk menunjukkan proses biologi yang terjadi di dalam sel hidup. Senyawa tersebut diimbibisi oleh sel, dan di dalam jaringan sel hidup akan bereaksi dengan proses reduksi dalam respirasi. Aktivitas enzim dehidrogenase akan melepas H+ dan bereaksi dengan tetrazolium membentuk endapan formazan yang berwarna merah, stabil dan tidak larut air (Dina et al. 2006). Pengamatan penetrasi aktinomiset endofit isolat AB131-1 dan PS4-16 dengan metode SEM ditunjukkan dengan koloni yang berbentuk seperti kait, panjang agak spiral, berbuku-buku dan menggembung. Sardi et al. (1992) mengamati hifa Streptomyces sp. pada bagian kortikal jaringan akar tomat. Coombs dan Franco (2003) mengamati hifa aerial Streptomyces yang berbentuk panjang agak spiral dan menggembung pada permukaan akar tanaman gandum yang steril.
Berdasarkan data-data diatas terbukti bahwa isolat aktinomiset endofit mampu menghasilkan IAA yang dapat meningkatkan pertumbuhan tanaman padi. Aplikasi AB131-1 konsentrasi AB131-1.05 ppm merupakan aplikasi yang paling besar berpengaruh nyata terhadap pertumbuhan tanaman padi.
SIMPULAN
Sebanyak 10 isolat aktinomiset endofit yang diuji secara in vitro menunjukkan kemampuan dalam menghasilkan hormon IAA dengan konsentrasi yang beragam yaitu dengan kisaran 11-99 ppm pada saat kultur berumur 10 hari. Isolat yang menghasilkan IAA tinggi yaitu, AB131-1 (99.2 ppm), AB131-2 (99.2 ppm) dan PS4-16 (93.4 ppm). Aplikasi in plantayang paling berperngaruh
besar terhadap pertumbuhan tanaman padi yaitu supernatan AB131-1 dengan konsentrasi 1.05 ppm karena dapat meningkatkan persentase pertumbuhan tinggi tanaman sebesar 26%, panjang akar 33.4% dan bobot kering total tanaman 206% melebihi pengaruh penambahan IAA sintetik 0.1 ppm. Hasil pengamatan secara mikroskopis pada isolat AB131-1 dan PS4-16 mengindikasikan bahwa kedua isolat merupakan isolat aktinomiset endofit yang mampu melakukan penetrasi pada akar padi. Data-data tersebut menunjukkan bahwa aplikasi aktinomiset endofit dapat meningkatkan pertumbuhan tanaman padi.
DAFTAR PUSTAKA
Adhikari TB, Joseph CM, Yang G, Donal AP, Nelsom LM. 2001. Evaluation of bacteria isolated from rice for plant growth promotion and biological rice. Can J Microbiol 47916-924.
Aryantha INP, Lestari DP, Pangesti NPD. 2004. Potensi isolat bakteri penghasil IAA dalam peningkatan pertumbuhan kecambah kacang hijau pada kondisi hidroponik. J Mikrobiol Indones 9 (2) 43-46.
Berg G. 2009. Plant microbe interactions promoting plant growth and health: perpectives for controlled use of microorganisms in agriculture. Appl Microbiol Biotechnol 84: 11-18. Coombs JT, Franco CM. 2003. Isolation and
identification of Actinobacteria from surface sterilized wheat roots. Appl Environ Microbiol69(9): 5603-5608. Dina, Widyati E, Wirawan B, Ilyas S. 2007.
Pola Topografi Pewarnaan Tetrazolium Sebagai Tolak ukur Viabilitas dan Vigor Benih Kedelai (Gycine max L. Merr.) untuk Pendugaan Pertumbuhan Tanaman di Lapangan. Bul Agron 35 (2): 88-95.
Forni C, Riov J, Caiola G, Tel-Or E. 1992. Indole-3-Acetid-Acid (IAA) production by Arthrobacter species isolated from Azolla. J Gen Microbiol 138: 377-381.
Hallmann J, Quadt-Hallmann, Mahaffee WF, Kloepper JW. 1997. Bacterial endophytes in agricultural crops. Can J Microbiol 43: 895-914.
nyata lebih kecil terhadap bobot kering akar tanaman padi jika dibandingkan dengan perlakuan kontrol IAA sintetik 0.1 ppm. Namun jika dilihat dari bobot kering total tanaman, perlakuan AB131-1 konsentrasi 1.05 ppm (206%) berpengaruh nyata lebih besar dibandingkan IAA 0.1 ppm (182.7%). Adhikari et al. (2001) melaporkan bahwa perlakuan bakteri endofit strain S20 dan S21 dengan metode pencelupan benih padi mampu meningkatkan bobot kering total tanaman padi sebesar 12%-50%.
Pengamatan mikroskopis akar padi yang diberi perlakuan AB131-1 dan PS4-16 dengan metode pewarnaan tetrazolium masing-masing menunjukkan adanya penetrasi pada akar padi. Koloni berwana merah yang terdapat di permukaan akar padi diduga merupakan aktinomiset endofit yang sedang melakukan penetrasi (Gambar 5b). Larutan tetrazolium digunakan sebagai indikator untuk menunjukkan proses biologi yang terjadi di dalam sel hidup. Senyawa tersebut diimbibisi oleh sel, dan di dalam jaringan sel hidup akan bereaksi dengan proses reduksi dalam respirasi. Aktivitas enzim dehidrogenase akan melepas H+ dan bereaksi dengan tetrazolium membentuk endapan formazan yang berwarna merah, stabil dan tidak larut air (Dina et al. 2006). Pengamatan penetrasi aktinomiset endofit isolat AB131-1 dan PS4-16 dengan metode SEM ditunjukkan dengan koloni yang berbentuk seperti kait, panjang agak spiral, berbuku-buku dan menggembung. Sardi et al. (1992) mengamati hifa Streptomyces sp. pada bagian kortikal jaringan akar tomat. Coombs dan Franco (2003) mengamati hifa aerial Streptomyces yang berbentuk panjang agak spiral dan menggembung pada permukaan akar tanaman gandum yang steril.
Berdasarkan data-data diatas terbukti bahwa isolat aktinomiset endofit mampu menghasilkan IAA yang dapat meningkatkan pertumbuhan tanaman padi. Aplikasi AB131-1 konsentrasi AB131-1.05 ppm merupakan aplikasi yang paling besar berpengaruh nyata terhadap pertumbuhan tanaman padi.
SIMPULAN
Sebanyak 10 isolat aktinomiset endofit yang diuji secara in vitro menunjukkan kemampuan dalam menghasilkan hormon IAA dengan konsentrasi yang beragam yaitu dengan kisaran 11-99 ppm pada saat kultur berumur 10 hari. Isolat yang menghasilkan IAA tinggi yaitu, AB131-1 (99.2 ppm), AB131-2 (99.2 ppm) dan PS4-16 (93.4 ppm). Aplikasi in plantayang paling berperngaruh
besar terhadap pertumbuhan tanaman padi yaitu supernatan AB131-1 dengan konsentrasi 1.05 ppm karena dapat meningkatkan persentase pertumbuhan tinggi tanaman sebesar 26%, panjang akar 33.4% dan bobot kering total tanaman 206% melebihi pengaruh penambahan IAA sintetik 0.1 ppm. Hasil pengamatan secara mikroskopis pada isolat AB131-1 dan PS4-16 mengindikasikan bahwa kedua isolat merupakan isolat aktinomiset endofit yang mampu melakukan penetrasi pada akar padi. Data-data tersebut menunjukkan bahwa aplikasi aktinomiset endofit dapat meningkatkan pertumbuhan tanaman padi.
DAFTAR PUSTAKA
Adhikari TB, Joseph CM, Yang G, Donal AP, Nelsom LM. 2001. Evaluation of bacteria isolated from rice for plant growth promotion and biological rice. Can J Microbiol 47916-924.
Aryantha INP, Lestari DP, Pangesti NPD. 2004. Potensi isolat bakteri penghasil IAA dalam peningkatan pertumbuhan kecambah kacang hijau pada kondisi hidroponik. J Mikrobiol Indones 9 (2) 43-46.
Berg G. 2009. Plant microbe interactions promoting plant growth and health: perpectives for controlled use of microorganisms in agriculture. Appl Microbiol Biotechnol 84: 11-18. Coombs JT, Franco CM. 2003. Isolation and
identification of Actinobacteria from surface sterilized wheat roots. Appl Environ Microbiol69(9): 5603-5608. Dina, Widyati E, Wirawan B, Ilyas S. 2007.
Pola Topografi Pewarnaan Tetrazolium Sebagai Tolak ukur Viabilitas dan Vigor Benih Kedelai (Gycine max L. Merr.) untuk Pendugaan Pertumbuhan Tanaman di Lapangan. Bul Agron 35 (2): 88-95.
Forni C, Riov J, Caiola G, Tel-Or E. 1992. Indole-3-Acetid-Acid (IAA) production by Arthrobacter species isolated from Azolla. J Gen Microbiol 138: 377-381.
Hallmann J, Quadt-Hallmann, Mahaffee WF, Kloepper JW. 1997. Bacterial endophytes in agricultural crops. Can J Microbiol 43: 895-914.
KEMAMPUAN AKTINOMISET ENDOFIT DALAM MENINGKATKAN
PERTUMBUHAN TANAMAN PADI (Oryza sativa L.) MELALUI
AKTIVITAS ASAM INDOL ASETAT
TERA TRI YUSEPI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
nyata lebih kecil terhadap bobot kering akar tanaman padi jika dibandingkan dengan perlakuan kontrol IAA sintetik 0.1 ppm. Namun jika dilihat dari bobot kering total tanaman, perlakuan AB131-1 konsentrasi 1.05 ppm (206%) berpengaruh nyata lebih besar dibandingkan IAA 0.1 ppm (182.7%). Adhikari et al. (2001) melaporkan bahwa perlakuan bakteri endofit strain S20 dan S21 dengan metode pencelupan benih padi mampu meningkatkan bobot kering total tanaman padi sebesar 12%-50%.
Pengamatan mikroskopis akar padi yang diberi perlakuan AB131-1 dan PS4-16 dengan metode pewarnaan tetrazolium masing-masing menunjukkan adanya penetrasi pada akar padi. Koloni berwana merah yang terdapat di permukaan akar padi diduga merupakan aktinomiset endofit yang sedang melakukan penetrasi (Gambar 5b). Larutan tetrazolium digunakan sebagai indikator untuk menunjukkan proses biologi yang terjadi di dalam sel hidup. Senyawa tersebut diimbibisi oleh sel, dan di dalam jaringan sel hidup akan bereaksi dengan proses reduksi dalam respirasi. Aktivitas enzim dehidrogenase akan melepas H+ dan bereaksi dengan tetrazolium membentuk endapan formazan yang berwarna merah, stabil dan tidak larut air (Dina et al. 2006). Pengamatan penetrasi aktinomiset endofit isolat AB131-1 dan PS4-16 dengan metode SEM ditunjukkan dengan koloni yang berbentuk seperti kait, panjang agak spiral, berbuku-buku dan menggembung. Sardi et al. (1992) mengamati hifa Streptomyces sp. pada bagian kortikal jaringan akar tomat. Coombs dan Franco (2003) mengamati hifa aerial Streptomyces yang berbentuk panjang agak spiral dan menggembung pada permukaan akar tanaman gandum yang steril.
Berdasarkan data-data diatas terbukti bahwa isolat aktinomiset endofit mampu menghasilkan IAA yang dapat meningkatkan pertumbuhan tanaman padi. Aplikasi AB131-1 konsentrasi AB131-1.05 ppm merupakan aplikasi yang paling besar berpengaruh nyata terhadap pertumbuhan tanaman padi.
SIMPULAN
Sebanyak 10 isolat aktinomiset endofit yang diuji secara in vitro menunjukkan kemampuan dalam menghasilkan hormon IAA dengan konsentrasi yang beragam yaitu dengan kisaran 11-99 ppm pada saat kultur berumur 10 hari. Isolat yang menghasilkan IAA tinggi yaitu, AB131-1 (99.2 ppm), AB131-2 (99.2 ppm) dan PS4-16 (93.4 ppm). Aplikasi in plantayang paling berperngaruh
besar terhadap pertumbuhan tanaman padi yaitu supernatan AB131-1 dengan konsentrasi 1.05 ppm karena dapat meningkatkan persentase pertumbuhan tinggi tanaman sebesar 26%, panjang akar 33.4% dan bobot kering total tanaman 206% melebihi pengaruh penambahan IAA sintetik 0.1 ppm. Hasil pengamatan secara mikroskopis pada isolat AB131-1 dan PS4-16 mengindikasikan bahwa kedua isolat merupakan isolat aktinomiset endofit yang mampu melakukan penetrasi pada akar padi. Data-data tersebut menunjukkan bahwa aplikasi aktinomiset endofit dapat meningkatkan pertumbuhan tanaman padi.
DAFTAR PUSTAKA
Adhikari TB, Joseph CM, Yang G, Donal AP, Nelsom LM. 2001. Evaluation of bacteria isolated from rice for plant growth promotion and biological rice. Can J Microbiol 47916-924.
Aryantha INP, Lestari DP, Pangesti NPD. 2004. Potensi isolat bakteri penghasil IAA dalam peningkatan pertumbuhan kecambah kacang hijau pada kondisi hidroponik. J Mikrobiol Indones 9 (2) 43-46.
Berg G. 2009. Plant microbe interactions promoting plant growth and health: perpectives for controlled use of microorganisms in agriculture. Appl Microbiol Biotechnol 84: 11-18. Coombs JT, Franco CM. 2003. Isolation and
identification of Actinobacteria from surface sterilized wheat roots. Appl Environ Microbiol69(9): 5603-5608. Dina, Widyati E, Wirawan B, Ilyas S. 2007.
Pola Topografi Pewarnaan Tetrazolium Sebagai Tolak ukur Viabilitas dan Vigor Benih Kedelai (Gycine max L. Merr.) untuk Pendugaan Pertumbuhan Tanaman di Lapangan. Bul Agron 35 (2): 88-95.
Forni C, Riov J, Caiola G, Tel-Or E. 1992. Indole-3-Acetid-Acid (IAA) production by Arthrobacter species isolated from Azolla. J Gen Microbiol 138: 377-381.
Hallmann J, Quadt-Hallmann, Mahaffee WF, Kloepper JW. 1997. Bacterial endophytes in agricultural crops. Can J Microbiol 43: 895-914.
10
interactions with host plants. Actinomycetologica 20(2): 72-81. Igarashi Y, Lida T, Yoshida R, Furumai T.
2002. Pteridic acids A and B, novel plant growth promoters with auxin-like activity from Streptomyces hygroscopicus TP-A0451. J Antibiot 55: 764-767.
Isminarni F, Wedhasti S, Wedada J, Purwanto BH. 2007. Penambatan nitrogen dan penghasilan indol asam asetat oleh isolat-isolat Azotobacter pada pH rendah dan alumunium tinggi. J Ilmu Tanah dan Lingkungan7(1): 23-30. Khamna S, Yokota A, Peberdy JF, Lumyong
S. 2010. Indole-3-acetic acid production by Streptomyces sp. isolated from some Thai medicinal plant rhizosphere soils. EurAsia J Bio Sci 4:23-32.
Kumari SB, Ram RM, Mallailah KV. 2008. Studies of exopolysaccharide and indol acetid acid production by Rhizobium strain from Indigofera. Afric J Microbiol3(1): 10-14.
Lestari P, Susilowati NDN, Riyanti EI. 2007. Pengaruh hormon asam indol asetat yang dihasilkan oleh Azospirillum sp. terhadap perkembangan akar padi. J Agro Biogen3(2): 66-71.
Lestari Y. 2006. Identification of indigenous Streptomyces spp. producing antibacterial compounds. J Mikrobiol Indones11 (2): 99-101.
Manulis S, Shafrir H, Epetein E, Lichter A, Barash I. 1994. Biosynthesis of indole-3-acetic acid via indole-3-acetamide pathway in Streptomyces spp. Microbiology140: 1045-1050.
Meguro A et al. 2006. An Endophytic Actinomycete, Streptomyces sp. MBR-52, That Accelerates Emergence and Elongation of Plant Adventitious Roots.Actinomycetologica 20: 1-9. Nurkanto A. 2007. Identifikasi aktinomiset
tanah hutan pasca kebakaran Bukit Bangkirai Kalimantan Timur dan potensinya sebagai pendegradasi selulosa dan pelarut fosfat. Biodiversitas8(4): 314-319.
Patriquin DG, Dobereiner JB. 1978. Light microscopy observation of tetrazolium reducing bacteria in the endorhizosphere of maize and other
grasses in Brazil. Can J Microbiol24: 734-742.
Patten CL, Glick BR. 2002. Role of Pseudomonas putidaindole acetic acid in development of the host plant root system. Appl Environ Microbiol68 (3) 3795-3801.
Puryantiningsih RA. 2009. Isolasi Streptomyces dari rizosfer familia poaceae yang berpotensi menghasilkan antibiotik terhadap Escherichia coli [skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhammadiyah Surakarta. Rao, N.S.S. 1994. Soil Microorganisms and
Plant Growth. London: Oxford and IBM Publishing Co.
Rina DN, Iswandi A. 2004. Tanggap tanaman kedelai terhadap inokulasi rhizobium dan Asam Indol Asetat (IAA) pada U1tisol Darmaga. Bul Agron32(2): 25-32.
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan. Bandung: Institut Teknologi Bandung Press.
Sardi P et al. 1992. Isolation of endophytic Streptomyces strains from surface-sterilized roots. Appl Environ Microbiol 58 (8): 2691-2693.
Susilowati DN, Saraswati R, Yuniarti E. 2003. Isolasi dan seleksi mikroba diazotrof endofitik dan penghasil zat pemacu tumbuh pada tanaman padi dan jagung. Prosiding Seminar Hasil Penelitian Rintisan dan Bioteknologi Tanaman; Bogor, 23-24 Sep 2003. BogorBalai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian. Shrivastava S, Dsouza SF, Desai PD. 2008.
Production of indole-3acetic acid by immobilized Actinomycete (Kitasatospora sp.) for soil applications. Curr Science 94(2): 1595-1604.
Strobel GA, Daisy B. 2003. Bioprospecting for microbial endophytes and their natural product. Microbiol and Mol Biol 67 (4): 63-68.
AKTIVITAS ASAM INDOL ASETAT
TERA TRI YUSEPI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
TERA TRI YUSEPI. Kemampuan Aktinomiset Endofit dalam Meningkatkan Pertumbuhan Tanaman Padi (Oryza sativa L.) melalui Aktivitas Asam Indol Asetat. Dibimbing oleh YULIN LESTARI dan HAMIM.
Aktinomiset endofit hidup di jaringan tanaman dan kemungkinan dapat menghasilkan senyawa bioaktif potensial. Senyawa bioaktif yang dihasilkan aktinomiset endofit dapat berfungsi sebagai pemacu tumbuh tanaman melalui hormon tumbuh yang dihasilkannya, seperti Asam Indol Asetat (IAA). Hasil seleksi in vitro produksi IAA dari kesepuluh isolat yang ditumbuhkan dalam medium ISP 2 cair dengan penambahan 0.2 ml L-triptofan 0.2% menunjukkan seluruh isolat mampu menghasilkan IAA dengan kisaran konsentrasi 11-99 ppm. Isolat yang menghasilkan IAA tinggi yaitu AB131-1 (99.2 ppm), AB131-2 (99.2 ppm), dan PS4-16 (93.4 ppm). Ketiga isolat terpilih kemudian digunakan untuk uji in planta dengan cara diberi perlakuan supernatan pada kecambah tanaman padi (Oryza sativaL.) yang kemudian ditumbuhkan dalam pouches. Perlakuan dibedakan menjadi 20 perlakuan: kontrol negatif, kontrol positif (IAA 0.01, 0.1 dan 1 ppm), kontrol media ISP 2 cair dan supernatan ketiga isolat dalam berbagai pengenceran konsentrasi. Aplikasi perlakuan yang menunjukkan respon terbaik adalah AB131-1 (1.05 ppm IAA) karena mampu meningkatkan tinggi tanaman (26%), panjang akar (33.4%) dan bobot kering total tanaman (206%) melebihi pengaruh perlakuan IAA sintetik 0.1 ppm. Hasil pengamatan mikroskopis pada isolat AB131-1 dan PS4-16 dengan metode pewarnaan dan Scanning Electron Micrographs(SEM) menunjukkan bahwa kedua isolat merupakan isolat aktinomiset endofit yang mampu melakukan penetrasi pada akar padi. Data-data tersebut menunjukkan bahwa aplikasi aktinomiset endofit dapat meningkatkan pertumbuhan tanaman padi.
Kata Kunci: Aktinomiset endofit, Asam Indol Asetat (IAA), Oryza sativaL.
ABSTRACT
TERA TRI YUSEPI. The Capability of Actinomycetes Endophytic in Increasing the Growth of Rice Plant (Oryza sativa L.) through the Activity of Indole Acetic Acid. Under the Guidance of YULIN LESTARI and HAMIM.
Actinomycetes endophyte lives in plant tissue and may be able to produce various bioactive compounds. The bioactive compound produced by Actinomycetes endophyte can be useful to enhance the growth of plant through the activity of phytohormones substances produced, i.e. indole Acetic Acid (IAA). In vitro production of IAA from the ten isolates that were grown in ISP 2 liquid medium with the addition of 0.2 ml L-tryptophan 0.2% showed various concentration ranging about 11-99 ppm. Isolates producing high IAA were AB131-1 (99.2 ppm), AB131-2 (99,2 ppm), and PS4-16 (93.4 ppm). Those three superior isolates were then inoculated into rice seedlings which were then grown in pouches. Inoculation were designed in 20 different treatments, i.e. negative control, positive control (IAA 0.01, 0.1 dan 1 ppm), media control of ISP 2 liquid medium and supernatant of the three isolates in various concentrations. AB131-1 (1.05 ppm IAA) was considered as the most potential isolate based on its capability to increase plant height (26%), root length (33.4%) and dry weight (206%) more than the influence of IAA sintetic of 0.1 ppm addition. Microscopic observation of AB131-1 and PS4-16 of rice treatment using root coloring and Scanning Electron Micrographs (SEM) method showed that both of isolate were able to penetrate to the root of rice. The data showed that the application of Actinomycetes endophytic can increase the growth of rice plant.
AKTIVITAS ASAM INDOL ASETAT
TERA TRI YUSEPI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kemampuan Aktinomiset Endofit dalam Meningkatkan
PertumbuhanTanaman Padi (
Oryza sativa
L.) melalui
Aktivitas Asam Indol Asetat
Nama
: Tera Tri Yusepi
NIM
: G34062938
Disetujui
Pembimbing I
Pembimbing II
Diketahui
Kepala Departemen Biologi
Dr. Ir. Ence Darmo Jaya Supena, MS.
NIP. 19641002 198903 1 002
Tanggal Lulus:
Dr. Ir. Yulin Lestari
Alhamdulillahirabbil’alamin, segala puji bagi Allah SWT atas segala
limpahan rizki dan rahmat-Nya sehingga karya ilmiah ini berhasil diselesaikan.
Penelitian yang berjudul Kemampuan Aktinomiset Endofit dalam Meningkatkan
PertumbuhanTanaman Padi (
Oryza sativa
L.) melalui Aktivitas Asam Indol
Asetat ini dilaksanakan sejak bulan Januari 2010 hingga Oktober 2010 di
laboratorium Mikrobiologi Departemen Biologi Fakultas Matematika dan Ilmu
Pengetahuan Alam (FMIPA) Institut Pertanian Bogor (IPB) dan laboratorium
Mikrobiologi Tanah BB-BIOGEN.
Ucapan terima kasih penulis haturkan kepada Dr. Ir. Yulin Lestari dan Dr.
Ir. Hamim, M.Si., atas bimbingan, motivasi, dan dana yang diberikan kepada
penulis selama pelaksanaan penelitian ini. Terima kasih juga penulis ucapkan
kepada Dr. Rita Megia selaku dosen penguji atas koreksi dan sumbang sarannya
dan kepada Ir. Ratih D. Hastuti, M.Sc., atas bimbingan dan sumbang sarannya.
Terimakasih penulis sampaikan kepada laboran laboratorium Mikrobiologi dan
laboratorium Kultur jaringan: Mbak Heni, Pak Jaka, Mbak Feby, dan Pak
Kusmayadi atas bantuannya,
teman-teman seperjuangan di laboratorium
Mikrobiologi: Pak Puji, Mba Irni, Novita, Kartika, Sonya, Diania, Sheila, Resti,
Kak Ason atas bantuan, pengertian dan sarannya. Kepada seluruh pegawai
laboratorium Mikrobiologi Tanah BB-Biogen terima kasih atas bantuannya,
kepada sahabat-sahabatku Sari, Mita, Upik, Anggi, Mba Fina, Chika, Tami, Piki,
Gugun, Dadan, Gilang dan teman-teman biologi 43 terima kasih atas cinta,
persahabatan, dan kerjasamanya. Penghargaan dan terima kasih tertinggi penulis
persembahkan untuk Bapak, Mamah, kakakku Anwar dan Epi, adikku tersayang
Aditya, dan seluruh keluarga atas dukungan, do’a, dan kasih sayangnya selama
ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 6 Oktober 1988 dari ayah Usep
Karnedi dan ibu Cicih Nursilawati. Penulis merupakan anak ketiga dari empat
bersaudara. Penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui
jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2006 dan diterima di
Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR TABEL ...viii
DAFTAR GAMBAR ...viii
DAFTAR LAMPIRAN ...viii
PENDAHULUAN... 1
BAHAN DAN METODE ... 1
Waktu dan Tempat Penelitian ...1
Metode ...2
Peremajaan Aktinomiset Endofit...2
Bioesei IAA Aktinomiset Endofit ... 2
Penentuan Waktu Optimum Produksi IAA dan Pengukuran Biomassa Sel ...2
Penyiapan Inokulum Aktinomiset Endofit ...2
Penyiapan Tanaman Uji. ...2
Uji Potensi Aktinomiset Endofit secara in planta pada Tanaman Padi...2
Pengamatan Mikroskopis Akar Tanaman Padi...3
Perancangan Percobaan ...3
HASIL ...3
Peremajaan Isolat Aktinomiset Endofit ...3
Bioesei IAA Aktinomiset Endofit ...3
Penentuan Waktu Optimum Produksi IAA dan Pengukuran Biomassa Aktinomiset... 4
Uji Potensi Aktinomiset Endofit secara in planta pada Tanaman Padi...4
Pengamatan Mikroskopis Akar Tanaman Padi...5
PEMBAHASAN ...7
SIMPULAN ...9
DAFTAR PUSTAKA ...9
DAFTAR TABEL
Halaman
1 Pengaruh aplikasi aktinomiset endofit terhadap pertumbuhan tanaman padi umur 20 hari ...6
2 Persentase peningkatan pertumbuhan tanaman padi umur 20 hari setelah diinokulasikan dengan aktinomiset dibandingkan dengan kontrol ...7
DAFTAR GAMBAR Halaman 1 Pertumbuhan Isolat umur 14 hari dalam media ISP2 dan OM ...3
2 Produksi IAA oleh Aktinomiset endofit umur 10 hari dalam media ISP2 cair...4
3 Hubungan antara produksi IAA dengan biomassa aktinomiset ...4
4 Respon pertumbuhan tanaman padi terhadap perlakuan aktinomiset endofit dibandingkan dengan perlakuan IAA sintetik ... 6
5 Penetrasi aktinomiset endofit pada akar padi ...7
DAFTAR LAMPIRAN Halaman 1 Komposisi media peremajaan dan produksi ...12
2 Komposisi pereaksi Salkowski ... 12
3 Kurva standar IAA ... 12
4 Komposisi media perkecambahan dan media tumbuh tanaman padi ... 13
5 Perhitungan konsetrasi IAA isolat ...13
PENDAHULUAN Latar Belakang
Padi (Oryza sativa L.) merupakan komoditas pangan utama di Indonesia. Peningkatan produksi padi selama ini masih menggunakan bahan-bahan kimia seperti pupuk anorganik. Penggunaan pupuk anorganik dapat meningkatkan produktivitas tanaman padi, namun dapat berdampak negatif terhadap lingkungan. Salah satu cara untuk mengurangi dampak negatif penggunaan pupuk anorganik yaitu menggunakan produk mikrobiologi dengan memanfaatkan mikroba endofit. Mikroba endofit merupakan mikroba yang hidup di dalam jaringan tanaman tanpa membahayakan inangnya. Mikroba endofit memperoleh nutrisi dari hasil metabolisme tanaman dan mampu melindungi tanaman dari serangan patogen, sedangkan tanaman memperoleh nutrisi dan senyawa bioaktif yang diperlukan selama hidupnya (Strobel & Daisy 2003; Hallman et al. 2007).
Senyawa bioaktif yang dihasilkan mikroba endofit dapat berfungsi untuk meningkatkan pertumbuhan tanaman. Salah satunya dengan menghasilkan hormon pertumbuhan Asam Indol Asetat (IAA). IAA adalah hormon auksin endogen yang disintesis dalam berbagai bagian tubuh tanaman dan umumnya berasosiasi dengan bagian tanaman yang sedang aktif tumbuh dan berkembang seperti pada semua jenis meristem ujung tunas, ujung akar dan kambium. Fungsi IAA bagi tanaman yaitu menstimulasi perpanjangan sel, meregulasi dominansi apikal, dan merangsang pembentukan akar-akar lateral dan adventif (Salisbury & Ross 1995). IAA secara struktural berkaitan dengan asam amino triptofan, dan terdapat 3 lintasan biosintesis IAA dari triptofan yaitu melalui Indol-3-Asetonitril (IAN), Indol-3-Asetamida (IAM), atau asam indol-3-piruvat (IpyA). Lintasan yang umum terdapat dalam jaringan tanaman adalah lintasan IAM dan IpyA, sedangkan pada sel bakteri biosintesis IAA dapat melalui ketiga jalur (Zakharova et al. 1999).
Bakteri penghasil IAA mempunyai potensi untuk bergabung dengan beberapa proses fisiologis tanaman dengan memasukkan IAA yang dihasilkannya ke tanaman. Pengaruhnya bagi tanaman itu sendiri adalah tanaman tersebut lebih sensitif dalam mengubah konsentrasi IAA yang dimilikinya (Berg 2009). Beberapa bakteri non aktinomiset dilaporkan mampu memproduksi IAA antara lain Pseudomonas putida (Patten & Glick
2002), Rhizobium strain dari Indigofera (Kumari et al. 2008), Azotobacter(Isminarni et al. 2007) dan Arthrobacter (Forni et al. 1992). Susilowati (2003) melaporkan bahwa beberapa bakteri endofit non aktinomiset asal tanaman padi mampu menambat N2 dan menghasilkan asam indol asetat, serta dapat meningkatkan pertumbuhan tanaman padi (Adhikari et al. 2001).
Aktinomiset merupakan bakteri Gram positif bersifat anaerobik atau fakultatif yang memiliki struktur berupa filamen lembut yang disebut hifa atau miselia. Pada lempeng agar aktinomiset dapat dibedakan dengan mudah dari bakteri non aktinomiset seperti koloni bakteri non aktinomiset yang berlendir dan tumbuh dengan cepat, sedangkan koloni aktinomiset muncul perlahan, menunjukkan konsistensi berbubuk dan melekat erat pada permukaan agar (Rao 1994, diacu dalam Puryantiningsih 2009). Beberapa aktinomiset merupakan penghasil beragam senyawa bioaktif yang dapat berfungsi antara lain sebagai antimikroba dan pemacu tumbuh tanaman (Lestari 2006; Aryantha et al. 2006). Igarashi et al. (2002) melaporkan Streptomyces hygroscopicus dapat memacu pertumbuhan tanaman kacang-kacangan melalui dihasilkannya asam pteridic A dan B. Meguro et al. (2006) melaporkan strain dari Streptomyces sp. MBR-52 mampu mempercepat pemunculan dan pemanjangan akar adventif tanaman. Khamna et al. (2010) melaporkan Streptomyces viridis mampu meningkatkan perkecambahan dan panjang akar tanaman jagung dan kacang polong melalui dihasilkannya IAA. Namun demikian, kajian mengenai kemampuan aktinomiset endofit dalam meningkatkan pertumbuhan tanaman padi melalui dihasilkannya hormon pemacu tumbuh seperti IAA belum dilakukan. Oleh karena itu, tujuan penelitian ini yaitu mengkaji peran aktinomiset endofit dalam menghasilkan IAA dan meningkatkan pertumbuhan tanaman padi perlu dilakukan. Luaran dari penelitian ini adalah informasi mengenai peran biologi aktinomiset endofit asal tanaman padi.
BAHAN DAN METODE Waktu dan Tempat Penelitian
2
Metode
Peremajaan Aktinomiset Endofit. Isolat aktinomiset endofit AB131-2, PS4-16 dan Impara 6A diremajakan pada media agar-agar Oat Meal (media OM), isolat AB131-1, AB131-3, A-Fat, Membramo A, LSW-05, LBR-02, dan SSW-02 diremajakan pada mediaInternational Streptomyces Project no. 2 (ISP 2), lalu diinkubasi pada suhu ruang selama 14 hari. Kedua jenis media selektif tersebut digunakan berdasarkan kemampuan tumbuh isolat aktinomiset.
Bioesei IAA Aktinomiset Endofit. Produksi IAA diukur secara spektrofotometri dengan metode Salkowski (Patten & Glick 2002). Isolat ditumbuhkan pada media ISP 2 (Lampiran 1a) pada suhu ruang selama 5 hari, kemudian sebanyak 2 disc isolat (5 mm per disc) dipindahkan pada 19.8 ml media International Streptomyces Projectno. 2 (ISP 2) cair (Lampiran 1b) yang telah ditambah 0.2 ml L-triptofan 0.2%, dan diinkubasi pada inkubator bergoyang dengan kecepatan 125 rpm pada suhu ruang selama 10 hari. Kultur yang diperoleh kemudian disentrifugasi dengan kecepatan 11000 rpm pada suhu 4°C selama 15 menit. Sebanyak 1 ml supernatan diambil kemudian dicampurkan dengan 4 ml pereaksi Salkowski (Lampiran 2), lalu disimpan di ruang gelap selama 30 menit. Pembentukan IAA ditunjukkan jika terjadi perubahan warna menjadi merah muda. Absorbansi diukur pada panjang gelombang 530 nm dengan menggunakan Spectronic 20 Baush and Lomb (Khamna et al. 2010). Absorbansi IAA dibaca dengan mengurangi nilai absorbansi sampel yang ditambah pereaksi Salkowski dengan nilai Optical Density (OD). Absorbans terkoreksi lalu dimasukkan ke dalam persamaan kurva standar IAA (Lampiran 3 & 5). Pengujian dilakukan sebanyak 2 kali ulangan.
Penentuan Waktu Optimum Produksi IAA dan Pengukuran Biomassa Sel. Kurva produksi IAA aktinomiset endofit terpilih diukur dengan metode bioesei IAA pada hari ke-5, 10, 15 dan 20. Isolat ditumbuhkan pada media ISP 2 (Lampiran 1a) pada suhu ruang selama 5 hari, kemudian sebanyak 4 disc isolat (5 mm per disc) dipindahkan pada 39.6 ml media ISP 2 cair (Lampiran 1b) yang telah ditambah 0.4 ml L-triptofan 0.2% dan diinkubasi pada inkubator bergoyang dengan kecepatan 125 rpm pada suhu ruang. Kultur yang diperoleh kemudian disentrifugasi dengan kecepatan 4500 rpm pada suhu 4°C
selama 30 menit. Sebanyak 1 ml supernatan diambil kemudian dicampurkan dengan 4 ml pereaksi Salkowski (Lampiran 2), lalu disimpan di ruang gelap selama 30 menit. Absorbansi diukur pada panjang gelombang 530 nm. Pengukuran IAA dilakukan bersamaan dengan pengukuran biomassa sel aktinomiset. Kultur hasil sentifugasi disaring dengan menggunakan kertas saring. Pelet selanjutnya dikeringkan di dalam oven selama 6 jam pada suhu 70°C, lalu ditimbang. Pengujian dilakukan sebanyak 2 kali ulangan.
Penyiapan Inokulum Aktinomiset Endofit. Isolat diremajakan pada media ISP 2 atau media M sesuai dengan kemampuan tumbuhnya. Inkubasi dilakukan pada suhu ruang selama 5 hari, kemudian sebanyak 4 discisolat (5 mm per disc) dipindahkan pada 40 ml media ISP 2 cair dan diinkubasi pada suhu ruang selama 15 hari. Kultur yang diperoleh lalu disentrifugasi dengan kecepatan 4500 rpm, pada suhu 4°C selama 30 menit.
Penyiapan Tanaman Uji. Benih padi disterilisasi permukaannya dengan alkohol 95% selama satu menit, dibilas air steril sebanyak tiga kali, dan digoyang pada inkubator bergoyang selama 10 menit. Benih kemudian direndam pada larutan HgCl20.2% selama delapan menit, dibilas air steril sebanyak enam kali, dan direndam selama satu malam. Benih kemudian disebar pada media Triptone Yeast(TY) (Lampiran 4a) dan diinkubasi selama empat hari pada suhu ruang dalam kondisi gelap.
h
j c
i a
g
f e
d b tinggi tanaman, panjang dan jumlah akar,
serta bobot kering akar dan tajuk.
Pengamatan Mikroskopis Akar Tanaman Padi.
Metode Pewarnaan. Pengamatan dilakukan pada hari ke-15 setelah ino