MODIFIKASI FERMENTASI HIDROLISAT ASAM ENCER
Euchema cottonii MENJADI BIOETANOL MENGGUNAKAN
Saccharomyces cerevisiae DAN Pachysolen tannophilus
MUHAMMAD SYUKUR SARFAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Modifikasi Fermentasi Hidrolisat Asam Encer Euchema cottonii Menjadi Bioetanol Menggunakan
Saccharomyces cerevisiae dan Pachysolen tannophilus adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
RINGKASAN
MUHAMMAD SYUKUR SARFAT. Modifikasi Fermentasi Hidrolisat Asam Encer Euchema cottonii Menjadi Bioetanol Menggunakan Saccharomyces cerevisiae dan Pachysolen tannophilus. Dibimbing oleh MULYORINI RAHAYUNINGSIH, ANI SURYANI, dan DWI SETYANINGSIH.
Euchema cottonii adalah alga merah yang terdiri dari polisakarida linear yang biasa disebut “karagenan”. Karagenan merupakan galaktan (polisakarida sulfat) tersulfatasi linear hidrofilik yang merupakan polimer dari galaktosa. Tujuan dari penelitian ini adalah adalah modifikasi fermentasi secara curah bioetanol dari rumput laut (Euchema cottonii) sebagai substrat sehingga dihasilkan rendemen produk bioetanol yang tinggi.
Penelitian dilakukan dalam dua tahap. Tahap pertama merupakan tahap pendahuluan yang meliputi pengecilan ukuran, pengeringan, karakterisasi E. cottonii dengan parameter yang diuji adalah kadar karbohidrat (selulosa dan hemiselulosa), protein, serat kasar, abu, dan kadar air. Tahap pendahuluan yang terakhir adalah hidrolisis E. cottonii menggunakan asam sulfat sehingga komponen selulosa dan hemiselulosa dari E. cottonii dapat terhidrolisis menjadi gula-gula penyusunnya (galaktosa) dan kemudian hasil hidrolisis disaring sehingga diperoleh padatan dan hidrolisat yang mengandung galaktosa. Tahap kedua merupakan tahap penelitian utama yang dibagi menjadi dua tahap, yaitu tahap adaptasi dan tahap fermentasi. Pada tahap adaptasi, khamir diadaptasi pada media yang mengandung galaktosa untuk mengkondisikan khamir tersebut pada media yang mengandung galaktosa. Tahap kedua adalah fermentasi hidrolisat asam encer E. cottonii yang mengandung galaktosa menjadi bioetanol dengan menggunakan dua jenis khamir yang telah teradaptasi (Saccharomyces cerevisiae
IPBCC AL IX dan Pachysolen tannophilus IPBCC AC IX). Untuk proses fermentasi, pada media hidrolisat asam encer E. cottonii ditambahkan vitamin, nitrogen, dan mineral-mineral (trace element) untuk memacu aktivitas pertumbuhan khamir dalam mengkonsumsi galaktosa menjadi bioetanol.
Euchema cottonii memiliki kandungan polisakarida yang tinggi dan dapat dikonversi menjadi gula yang dapat difermentasi setelah dihidrolisis menggunakan enzim atau asam. Polisakarida Euchema cottonii terdiri dari 29.45% (bk) karbohidrat, 3.21% (bk) hemiselulosa, dan 11.30% (bk) selulosa. Jenis gula yang terdapat pada hidrolisat asam Euchema cottonii terdiri dari 4.95% galaktosa, 0.25% glukosa, 0.04% xilosa, dan 0.02% maltoheptaosa. Produksi etanol tertinggi dari Saccharomyces cerevisiae IPBCC AL IX teradaptasi adalah 2.38% (v/v etanol pada fermentasi cair), dengan 79.09% efisiensi penggunaan substrat, dan 56.30% efisiensi fermentasi yang difermentasi selama 6 hari. Produksi etanol tertinggi dari Pachysolen tannophilus IPBCC AC IX teradaptasi adalah 0.11% (v/v etanol pada fermentasi cair), dengan 15.39% efisiensi penggunaan substrat, dan 2.60% efisiensi fermentasi yang difermentasi selama 4 hari. Produksi etanol tertinggi dengan perlakuan refreshed culture menggunakan
iii
dan 19.79% efisiensi fermentasi yang difermentasi selama 6 hari. Produksi etanol tertinggi dengan perlakuan refreshed culture menggunakan Saccharomyces cerevisiae IPBCCA teradaptasi setelah fermentasi berlangsung 24 jam oleh
Saccharomyces cerevisiae IPBCC AL IX teradaptasi adalah 1.76% (v/v etanol pada fermentasi cair), dengan 53.06% efisiensi penggunaan substrat, dan 43.53% efisiensi fermentasi yang difermentasi selama 6 hari. Produksi etanol tertinggi dengan perlakuan perbedaan konsentrasi gula pereduksi pada media fermentasi setelah fermentasi selama 6 hari adalah 2.13% (v/v etanol pada fermentasi cair), dengan 76.31% efisiensi penggunaan substrat, dan 50.97% efisiensi fermentasi dengan konsentrasi gula pereduksi pada media diawal fermentasi sebesar 6.57% (b/v).
SUMMARY
MUHAMMAD SYUKUR SARFAT. Fermentation Modification of Acid Hydrolisates of Euchema cottonii to Produce Bioethanol Using Saccharomyces cerevisiae and Pachysolen tannophilus. Supervised By MULYORINI RAHAYUNINGSIH, ANI SURYANI, dan DWI SETYANINGSIH.
Euchema cottonii is a red algae that is formed from linear polysaccharide commonly called "carrageenan". Carrageenan is galactan (polysaccharide sulfate linear hydrophilic) which is a polymer consists of galactose. The research objective is to modify bioethanol fermentation by batch condition from seaweed (Euchema cottonii) acid hydrolisates to produce a high yield of bioethanol.
The study was conducted in two stages. The first stage is a preliminary phase which consists of size reduction, drying, characterization of E. cottonii with parameters tested were carbohydrates (cellulose and hemicellulose), protein, crude fiber, ash, and water content. The last stage is the preliminary were hydrolysis of
E. cottonii using sulfuric acid so that the cellulose and hemicellulose components of E. cottonii can be hydrolyzed into constituent sugars (galactose) and then filtered the results so obtained solids hydrolysis and hydrolyzate containing galactose. The second stage is the stage of primary research which is divided into two stages, adaptation stages and fermentation stages. In the adaptation phase, yeast was adapted in media containing galactose to condition the yeast in media containing galactose. The second stage is the fermentation of acid hydrolisates of
E. cottonii to produce bioethanol using two kinds of yeast that has been adapted (Saccharomyces cerevisiae IPBCC AL IX and Pachysolen tannophilus IPBCC AC IX). For the fermentation process, the medium of acid hydrolisates of E. cottonii added vitamins, nitrogen, and minerals (trace elements) to spur the growth of activity in the yeast consumes galactose to produce bioethanol.
Euchema cottonii has high polysaccharides content and those can be converted into fermentable sugar through acid or enzymatic hydrolysis. Polysaccarides of red algae Euchema cottonii consists of 29.45% (db) carbohydrates, 3.21% (db) hemicelluloses, and 11.30% (db) celluloses. Type of sugar was obtained in acid hydrolisates of Euchema cottonii consists of 4.95% galactose, 0.25% glucose, 0.04% xylose, and 0.02% maltoheptaosa. The highest ethanol production from adapted Saccharomyces cerevisiae IPBCC AL IX was 2.38% (v/v ethanol in fermentation broth), with 79.09% substrate efficiency and 56.30% fermentation efficiency for 6 days incubation. The highest ethanol production from adapted Pachysolen tannophilus IPBCC AC IX was 0.11% (v/v ethanol in fermentation broth), with 15.39% substrate efficiency and 2.60% fermentation efficiency for 4 days incubation. The highest ethanol production with refreshed culture treatment using adapted Pachysolen tannophilus IPBCC AC IX after fermentation lasts 24 hours by adapted Saccharomyces cerevisiae
IPBCC AL IX was 0.81% (v/v ethanol in fermentation broth), with 82.42% substrate efficiency and 19.79% fermentation efficiency for 6 days incubation. The highest ethanol production with refreshed culture treatment using adapted
v
fermentation broth), with 53.06% substrate efficiency and 43.53% fermentation efficiency which fermented for 6 days. The highest ethanol production with different of reducing sugar concentration treatment on media of fermentation after 6 days incubation was 2.13% (v/v ethanol in fermentation broth), with 76.31% substrate efficiency and 50.97% fermentation efficiency with reducing sugar consentration on media in the start of fermentation was 6.57% (w/v).
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
MODIFIKASI FERMENTASI HIDROLISAT ASAM ENCER
Euchema cottonii MENJADI BIOETANOL MENGGUNAKAN
Saccharomyces cerevisiae DAN Pachysolen tannophilus
MUHAMMAD SYUKUR SARFAT
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
viii
Judul Penelitian : Modifikasi Fermentasi Hidrolisat Asam Encer Euchema cottonii menjadi Bioetanol menggunakan Saccharomyces cerevisiae dan Pachysolen tannophilus.
Nama : Muhammad Syukur Sarfat
NRP : F351110121
Disetujui
Komisi Pembimbing
Dr Ir Mulyorini Rahayuningsih, MSi Ketua
Prof Dr Ir Ani Suryani, DEA Dr Dwi Setyaningsih, STP MSi
Anggota Anggota
Diketahui oleh
Ketua Program Studi Dekan sekolah Pascasarjana
Teknologi Industri Pertanian
Dr Ir Machfud, MS Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 ini ialah bioetanol, dengan judul Modifikasi Fermentasi Hidrolisat Asam Encer Euchema cottonii Menjadi Bioetanol Menggunakan Saccharomyces cerevisiae dan
Pachysolen tannophilus.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Mulyorini Rahayungingsih, MSi, Ibu Prof Dr Ir Ani Suryani, DEA, dan Ibu Dr Dwi Setyaningsih, STP, MSi selaku pembimbing, serta Dr Ir Liesbetini Haditjaroko, MS yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Saudari Nely Muna dan Saudari Indah Khayati dari Pusat Penelitian Surfaktan dan Bioenergi yang telah membantu selama penelitian dan pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Oktober 2013
i
DAFTAR ISI
DAFTAR TABEL ii
DAFTAR GAMBAR iii
DAFTAR LAMPIRAN iv
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan 4
Ruang Lingkup 4
2 TINJAUAN PUSTAKA 5
Rumput Laut (E. cottonii) 5
Hidrolisis Asam 6
Fermentasi Etanol 7
Karakteristik Mikroba yang Mengkonversi Galaktosa Menjadi
Bioetanol 8
3 METODOLOGI 11
Tempat Pelaksanaan 11
Alat dan Bahan 11
Prosedur Kerja 11
4 HASIL DAN PEMBAHASAN 19
Karakteristik E. cottonii dan Hidrolisat Asam Encer E. cottonii 19
Adaptasi Khamir Dalam Media Galaktosa 20
Fermentasi Khamir Teradaptasi Pada Hidrolisat Asam Encer E.
cottonii 25
Fermentasi Hidrolisat Asam Encer E. cottonii Dengan Perlakuan
Refreshed Culture Berbeda Setelah Fermentasi Berlangsung 24 Jam 31 Fermentasi Hidrolisat Asam Encer E. cottonii Dengan Perlakuan
Refreshed Culture Yang Sama Setelah Fermentasi Berlangsung 24 Jam 35 Fermentasi Hidrolisat Asam Encer E. cottonii Dengan Perlakuan
Perbedaan Konsentrasi Gula Pereduksi Pada Media 38
5 KESIMPULAN DAN SARAN 42
Kesimpulan 42
Saran 42
ii
DAFTAR TABEL
1. Komposisi kimia beberapa jenis rumput laut 2
2. Karakteristik hidrolisat untuk fermentasi 7
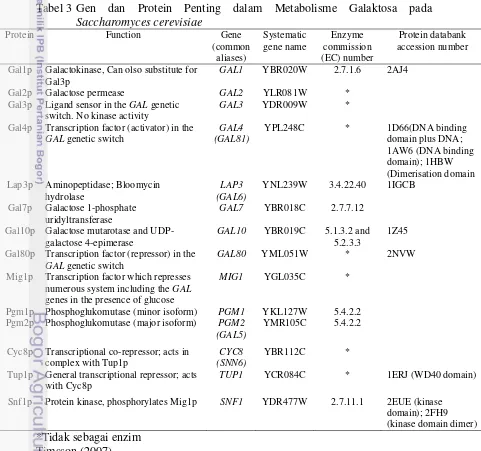
3. Gen dan Protein Penting dalam Metabolisme Galaktosa pada
Saccharomyces cerevisiae 9
4. Klasifikasi dari Saccharomyces cerevisiae dan Pachysolen tannophilus 10 5. Hasil analisis komposisi kimia E. cottonii kering 19 6. Karakterisasi komponen gula yang terdapat pada hidrolisat asam encer
E. cottonii menggunakan HPLC 20 7. Hasil perhitungan viabilitas sel pada tiap tahapan adaptasi cepat P.
tannophilus 23
8. Hasil perhitungan efisiensi penggunaan substrat, efisiensi fermentasi, dan konsentrasi etanol yang dihasilkan dari fermentasi hidrolisat asam encer E. cottonii menggunakan khamir teradaptasi 26 9. Hasil perhitungan jumlah etanol dan sel yang dihasilkan dari total gula
yang terkonsumsi selama fermentasi hidrolisat asam encer E. cottonii
menggunakan khamir teradaptasi 27
10.Hasil perhitungan presentase etanol dan sel yang dihasilkan dari total gula yang terkonsumsi selama fermentasi hidrolisat asam encer E. cottonii menggunakan khamir teradaptasi 27 11.Konsentrasi etanol maksimum hasil fermentasi dari beberapa jenis gula
menggunakan P. tannophilus dari beberapa jenis strain 31 12.Hasil Perhitungan efisiensi penggunaan substrat, efisiensi fermentasi,
dan konsentrasi etanol yang dihasilkan dari fermentasi hidrolisat asam encer E. cottonii dengan perlakuan refreshed culture berbeda setelah
fermentasi berlangsung 24 jam 33
13.Hasil perhitungan jumlah etanol dan sel yang dihasilkan dari total gula yang terkonsumsi selama fermentasi dengan perlakuan refreshed culture
berbeda setelah fermentasi 24 jam 34
14.Hasil perhitungan efisiensi penggunaan substrat, efisiensi fermentasi, dan konsentrasi etanol yang dihasilkan dari fermentasi hidrolisat asam encer E. cottonii dengan perlakuan refreshed culture berbeda setelah
fermentasi berlangsung 24 jam 36
15.Hasil perhitungan jumlah etanol dan sel yang dihasilkan dari total gula yang terkonsumsi selama fermentasi dengan perlakuan refreshed culture
yang sama setelah fermentasi 24 jam 37
16.Hasil perhitungan efisiensi penggunaan substrat, efisiensi fermentasi, dan konsentrasi etanol yang dihasilkan dari fermentasi hidrolisat asam encer E. cottonii dengan perlakuan perbedaan konsentrasi gula pereduksi
iii
17.Hasil perhitungan jumlah etanol dan sel yang dihasilkan dari total gula yang terkonsumsi selama fermentasi dengan perlakuan perbedaan konsentrasi gula pereduksi pada media hidrolisat asam E. cottonii 40
DAFTAR GAMBAR
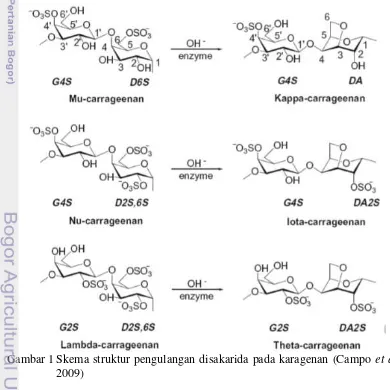
1. Skema struktur pengulangan disakarida pada karagenan 5
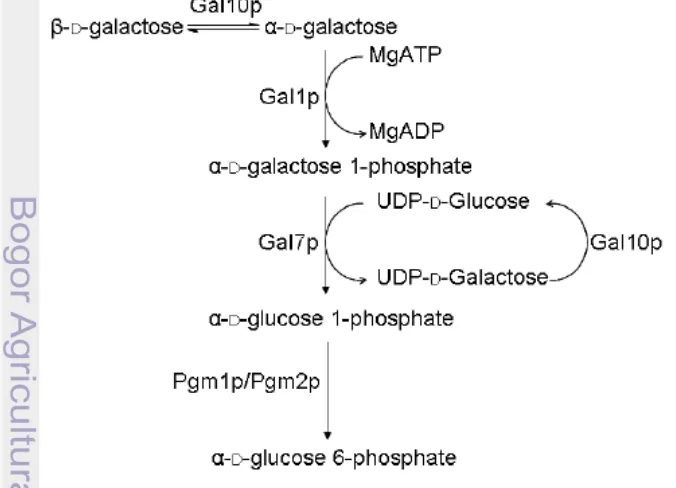
2. Jalur Leloir 8
3. Diagram alir penelitian modifikasi fermentasi hidrolisat asam encer E. cottonii menjadi bioetanol menggunakan Saccharomyces cerevisiae dan
Pachysolen tannophilus 12
4. Proses hidrolisis E. cottonii dengan menggunakan H2SO4 13
5. Proses penyiapan inokulum 13
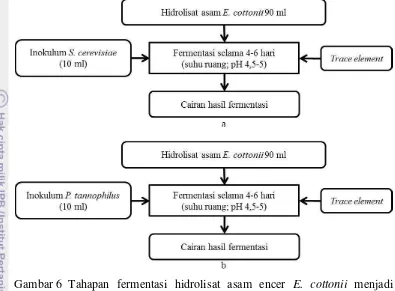
6. Tahapan fermentasi hidrolisat asam encer E. cottonii menjadi bioetanol
menggunakan khamir teradaptasi 15
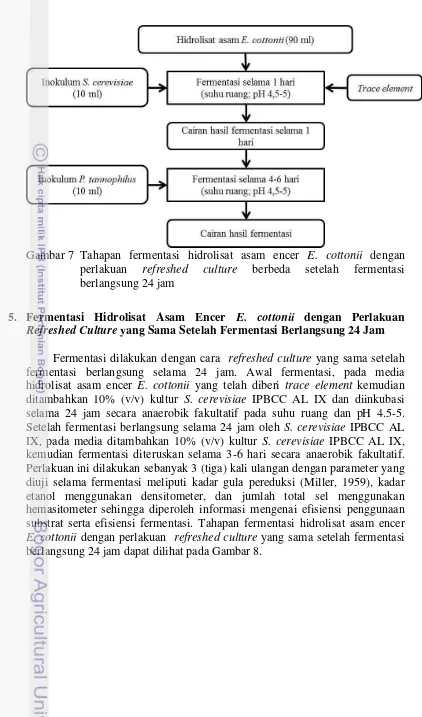
7. Tahapan fermentasi hidrolisat asam encer E. cottonii dengan perlakuan
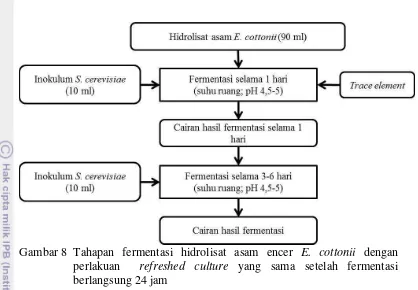
refreshed culture berbeda setelah fermentasi berlangsung 24 jam 16 8. Tahapan fermentasi hidrolisat asam encer E. cottonii dengan perlakuan
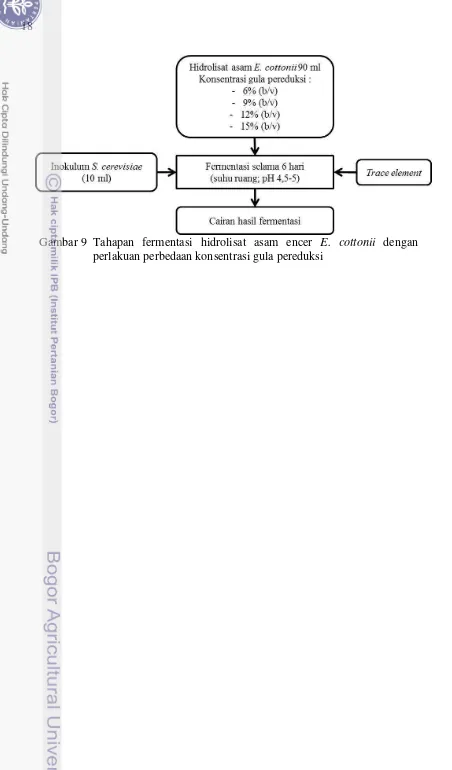
refreshed culture yang sama setelah fermentasi berlangsung 24 jam 17 9. Tahapan fermentasi hidrolisat asam encer E. cottonii dengan perlakuan
perbedaan konsentrasi gula pereduksi 18
10.Hubungan antara tahapan adaptasi lambat S. cerevisiae pada media 100% hidrolisat asam encer E. cottonii dengan log jumlah total sel, log
jumlah sel hidup, dan gula pereduksi 21
11.Hubungan antara tahapan adaptasi cepat P. tannophilus pada media campuran antara YMP Galaktosa dengan hidrolisat asam encer E. cottonii (1:1) dengan log jumlah total sel, log jumlah sel hidup, dan gula
pereduksi 22
12.Hasil pengamatan morfologi sel khamir yang telah teradaptasi 24 13.Hasil pengamatan gelembung udara yang terbentuk pada saat adaptasi 25 14.Hubungan antara waktu fermentasi hidrolisat asam encer E. cottonii
menggunakan khamir teradaptasi dengan log jumlah total sel, gula
pereduksi, dan konsentrasi etanol 26
15.JalurMetabolisme galaktosa menjadi bioetanol 30 16.Hasil pengamatan kondisi permukaan media pada tahap fermentasi
menggunakan khamir teradaptasi 31
17.Hubungan antara waktu fermentasi hidrolisat asam encer E. cottonii
dengan perlakuan refreshed culture berbeda setelah fermentasi berlangsung 24 jam terhadap log jumlah total sel, gula pereduksi, dan
iv
18.Hasil pengamatan kondisi permukaan media yang dipenuhi oleh lapisan putih pada tahap fermentasi dengan perlakuan refreshed culture berbeda
setelah fermentasi berlangsung 24 jam 35
19.Hubungan antara waktu fermentasi hidrolisat asam encer E. cottonii
dengan perlakuan refreshed culture yang sama setelah fermentasi berlangsung 24 jam terhadap log jumlah total sel, gula pereduksi, dan
konsentrasi etanol 36
20.Hubungan antara perbedaan konsentrasi gula pereduksi pada media hidrolisat asam encer E. cottonii terhadap log jumlah total sel, gula pereduksi, dan konsentrasi etanol yang dihasilkan selama fermentasi. 39
DAFTAR LAMPIRAN
1. Prosedur Pengamatan 47
2. Perbandingan Beberapa Hasil Penelitian Sejenis Yang Telah Dilakukan 50
1
1 PENDAHULUAN
Latar Belakang
Sebagian besar bahan bakar yang digunakan di Indonesia berasal dari bahan bakar fosil yang merupakan energi tidak terbarukan. Sebagai negara agraris, Indonesia memiliki beragam sumber daya alam hayati yang sangat potensial ketika digunakan sebagai bahan baku pembuatan energi terbarukan, khususnya bioetanol. Namun demikian, pengembangan bioetanol dianggap dapat membahayakan pasokan pangan pokok karena kebanyakan bahan baku yang digunakan berasal dari bahan-bahan pangan pokok yang merupakan bahan yang umum digunakan sebagai sumber energi bagi mahluk hidup yang ketersediaanya masih dianggap kurang karena disebabkan semakin berkurangnya ketersediaan lahan pertanian akibat alih fungsi. Oleh karena itu dicari alternatif dari beberapa sumber daya alam hayati yang dapat digunakan sebagai bahan baku pembuatan bioetanol yang dianggap sangat potensial karena ketersediaannya yang melimpah serta terdapat lahan potensial yang dapat digunakan sebagai lahan budidaya. Salah satu sumber daya alam hayati tersebut yang dapat digunakan sebagai bahan baku pembuatan bioetanol adalah rumput laut. Produksi rumput laut di Indonesia terus meningkat. Tercatat dari tahun 2009 sampai dengan 2012, produksi rumput laut Indonesia meningkat 90% dengan peningkatan disetiap tahunnya berturut-turut adalah 2.9, 3.9, 4.3, dan 5.2 juta ton. Pemerintah menargetkan produksi rumput laut tahun 2013 naik 30% menjadi 7.5 juta ton dibandingkan dengan tahun lalu 5.2 juta ton. Sedangkan ketersediaan lahan budidaya rumput laut masih sangat luas. Pada daerah pasang surut terdapat 1.1 juta hektar lahan yang dapat digunakan sebagai lahan budidaya dengan produkstivitas rata-rata 16 ton rumput laut kering/hektar/tahun dan yang baru termanfaatkan sebesar 380 ribu hektar. Rumput laut dapat dipanen 3-5 kali dalam setahun, tidak mengandung lignin, dan dapat menyerap CO2 sebanyak 36.7 ton/ha, atau 5-7 kali tanaman darat.
Keunggulan lain dari rumput laut adalah tidak berkompetisi dengan lahan pertanian dan tidak membutuhkan pupuk kimia atau irigasi (Sakti, 2013).
E. cottonii merupakan salah satu jenis rumput laut yang dibudidayakan dan dapat menghasilkan karaginan (Distantina et al., 2010). E. cottonii merupakan alga merah yang terbentuk dari polisakarida linear yang biasa disebut “karagenan”. Karagenan adalah galaktan tersulfatasi linear hidrofilik yang memiliki berat molekul berkisar 400.000 sampai 600.000 Da. Polimer ini merupakan pengulangan unit disakarida. Penyusun utama karagenan adalah galaktan (polisakarida sulfat) yang merupakan polimer dari galaktosa. Selain galaktosa dan sulfat, beberapa karbohidrat juga ditemui, seperti xilosa, glukosa, asam uronik dan substituen seperti metil ester dan grup piruvat. Galaktan tersulfatasi ini diklasifikasi menurut adanya unit 3.6-anhidro galaktosa(DA) dan posisi gugus sulfat (Van De Velde, 2002).
2
Sedangkan menurut Devis (2008) E. cottonii memiliki kandungan karbohidrat sebesar 41.43% (basis basah).
Tabel 1 Komposisi kimia beberapa jenis rumput laut
Komposisi Kimia
Selain itu, berdasarkan hasil hidrolisis menggunakan asam sulfat, dengan otoklaf pada suhu 121oC, tekanan 1,5 bar yang dilakukan oleh Setyaningsih et al.
(2012) E.cottonii dipilih sebagai bahan baku bioetanol untuk proses selanjutnya karena perolehan gula pereduksi yang tertinggi dan total padatan (ampas) sisa proses hidrolisis yang rendah. Perolehan gula pereduksi tertinggi adalah 3.28% (b/v) untuk hidrolisat asam E.cottoni, 3.22 (b/v) untuk hidrolisat asam Sargassum sp., dan 0.52% (b/v) untuk hidrolisat asam limbah agar. Sedangkan total padatan menunjukkan secara keseluruhan total padatan hasil hidrolisis E. cottonii lebih rendah (18-37%) dibandingkan Sargassum sp. (47.5-55.3%) dan limbah agar (64.5-76.5%). Hal ini dapat disebabkan karena padatan E. cottonii lebih mudah dan lebih banyak terhidrolisis dibandingkan Sargassum sp. danlimbah agar.
Khamir yang umum digunakan untuk memproduksi bioetanol seperti
Saccharomyces cerevisiae adalah khamir yang hanya optimal jika mengkonsumsi gula dalam bentuk glukosa, sedangkan untuk memproduksi bioetanol dari gula galaktosa mendapatkan kendala karena khamir ini belum dapat mengkonsumsi gula galaktosa secara optimal hingga menjadi bioetanol.
Adam dan Gallagher (2008) melakukan penelitian mengenai produksi bioetanol menggunakan rumput laut jenis Laminarin sp. 0.1 U sebagai bahan baku dan mikroba yang digunakan adalah Saccharina latissima 0.5% (v/v) diperoleh bahwa pada kondisi pH 6 dan suhu 230C merupakan kondisi optimum proses produksi bioetanol dengan rendemen bioetanol yang dihasilkan sebesar 0.45% (v/v). Devis (2008) melakukan penelitian mengenai produksi bioetanol berbahan dasar ampas rumput laut (Kappaphycus alvarezii) yang telah dihidrolisis sebanyak 200 ml dan 10% (v/v) starter Saccharomyces cerevisiae diperoleh rendemen bioetanol sebesar 4.5% (v/v) pada kondisi pH 4.5-5,0 dan suhu kamar (25-300C). Selain itu, Candra et al. (2011) mempelajari produksi bioetanol menggunakan rumpul laut (E. cottonii) dari Laut Bontang dan Saccharomyces cerevisiae 10% (v/v) diperoleh rendemen bioetanol sebesar 4.6% setelah difermentasi 5-6 hari pada suhu ruang. Rumput laut (E. cottonii) dihidrolisis dengan H2SO4 5% selama
3
bioetanol dari E. cottonii menggunakan Saccharomyces cerevisiae teradaptasi dengan waktu fermentasi 72-144 jam pada suhu ruang (300C) menghasilkan 2.20% (v/v) etanol pada fermentasi cair dengan efisiensi penggunaan substrat sebesar 80.3% dan efisiensi fermentasi sebesar 48.9%.
Kedua jenis khamir di atas masih menghasilkan bioetanol dengan rendemen yang sangat sedikit pada kondisi yang sudah dianggap optimum. Hasil identifikasi dari beberapa jenis khamir liar yang dilakukan oleh Inggit (2013), diperoleh hasil bahwasanya Pachysolen tannophilus dan Saccharomyces cerevisiae merupakan khamir yang dapat mengkonversi galaktosa yang terdapat pada hidrolisat asam encer E. cottonii menjadi bioetanol. Oleh karena itu, perlu dilakukan penelitian mengenai modifikasi proses produksi bioetanol dari galaktosa oleh
Saccharomyces cerevisiae dan Pachysolen tannophilus yang merupakan khamir yang dianggap dapat mengkonversi galaktosa menjadi bioetanol.
Penelitian mengenai modifikasi fermentasi hidrolisat asam encer E. cottonii
menjadi bioetanol menggunakan perpaduan antara dua jenis khamir yang berbeda yaitu Saccharomyces cerevisiae IPBCC AL IX dan Pachysolen tannophilus
IPBCC AC IX diawali dengan pengeringan dan pengecilan ukuran dari bahan baku E. cottonii. Kemudian dilakukan karakterisasi dari E. cottonii. Tahap selanjutnya merupakan tahap hidrolisis dari E. cottonii sehingga komponen galaktan (polisakarida sulfat) dapat diubah menjadi galaktosa yang tidak lain merupakan gula penyusun polimer galaktan tersebut. Hidrolisis dilakukan dengan menggunakan asam. Menurut Tahezadeh dan Karimi (2007), hidrolisis asam dapat digunakan untuk memecah komponen polisakarida menjadi monomer-monomernya. Proses hidrolisis yang sempurna akan memecah selulosa dan pati menjadi glukosa, sedangkan hemiselulosa akan terpecah menjadi pentosa dan heksosa. Asam sulfat (H2SO4) dan asam klorida (HCl) merupakan asam yang
digunakan sebagai katalis dalam proses hidrolisis. Hidrolisis menggunakan H2SO4
menghasilkan total gula sedikit lebih tinggi dibandingkan dengan HCl pada konsentrasi, waktu, dan suhu yang sama karena sifat HCl lebih kuat dengan reaktivitas yang lebih tinggi daripada H2SO4. Hidrolisis asam dikelompokkan
menjadi dua yaitu hidrolisis dengan konsentrasi tinggi dan hidrolisis dengan konsentrasi rendah. Penentuan konsentrasi asam tergantung pada ukuran, bentuk, dan kadar air pada partikel lignoselulosa. Asam sulfat biasanya digunakan pada larutan terlarut dengan konsentrasi tidak melebihi 10% berat (asam sulfat umum digunakan tidak lebih dari 5%). Penggunaan asam dengan konsentrasi rendah selalu terjadi penambahan air yang banyak pada bahan lignoselulosa dan hal itu membutuhkan energi panas yang lebih banyak selama proses pemanasan.
Tahap terakhir adalah tahap fermentasi yaitu hidrolisat asam encer E. cottonii yang dihasilkan dari proses hidrolisis menggunakan asam sulfat akan digunakan sebagai sumber karbon dalam memproduksi bioetanol. Proses fermentasi menggunakan dua jenis khamir, yaitu Saccharomyces cerevisiae
IPBCC AL IX dan Pachysolen tannophilus IPBCC AC IX. Saccharomyces cerevisiae IPBCC AL IX merupakan khamir teradaptasi dengan metode adaptasi lambat pada media hidrolisat asam E. cottonii. Menurut Timsson (2007),
Saccharomyces cerevisiae dapat memetabolisme galaktosa menjadi glukosa 6-phosphate dengan menggunakan 5 (lima) enzim pada jalur metabolisme galaktosa.
4
laboratorium yang dilakukan oleh tim peneliti dari Pusat Penelitian Surfaktan dan Bioenergi tahun 2012, menjelaskan bahwa Pachysolen tannophilus IPBCC y 11.1149 yang diperoleh dari IPB Culture Collection (IPBCC) yang merupakan khamir yang belum teradaptasi pada media yang mengandung galaktosa dapat memproduksi bioetanol dari hidrolisat asam encer E. cottonii dengan rendemen yang masih sangat kecil yaitu sekitar 1,3% (v/v) dengan waktu fermentasi selama 5 hari. Oleh karena itu, dengan proses adaptasi yang dilakukan terhadap
Pachysolen tannophilus IPBCC pada media yang mengandung galaktosa, diharapkan akan menghasilkan bioethanol dengan rendemen yang lebih tinggi dari yang dihasilkan oleh Pachysolen tannophilus IPBCC y 11.1149 yang belum teradaptasi ketika digunakan sebagai inokulum pada proses fermentasi dengan menggunakan hidrolisat asam encer E. cottonii sebagai sumber karbon.
Tahap fermentasi diawali dengan adaptasi kedua jenis khamir tersebut pada media yang mengandung galaktosa. Selanjutnya kedua jenis khamir yang telah teradaptasi masing-masing akan ditumbuhkan pada media hidrolisat asam
E.cottonii untuk mengetahui kemampuan khamir tersebut dalam mengkonversi galaktosa menjadi bioetanol.
Tujuan
Tujuan umum dari penelitian ini adalah mengetahui modifikasi fermentasi secara curah bioetanol dari rumput laut (E. cottonii) sebagai substrat sehingga dihasilkan rendemen produk bioetanol yang tinggi.
Adapun tujuan khusus dari penelitian ini adalah
1. Mendapatkan informasi kemampuan fermentatif khamir teradaptasi terhadap kadar bioetanol yang dihasilkan
2. Mendapatkan informasi pengaruh penambahan kultur berbeda setelah fermentasi 24 jam terhadap kadar bioetanol yang dihasilkan
3. Mendapatkan informasi pengaruh penambahan kultur yang sama setelah fermentasi 24 jam terhadap kadar bioetanol yang dihasilkan
4. Mendapatkan informasi pengaruh konsentrasi gula pereduksi pada media terhadap kadar bioetanol yang dihasilkan
Ruang Lingkup
5
2
TINJAUAN PUSTAKA
Rumput Laut (E. cottonii)
E. cottonii merupakan alga merah yang terbentuk dari polisakarida linear yang biasa disebut “karagenan”. Karagenan adalah polisakarida yang diekstraksi dari beberapa spesies rumput laut atau alga merah (rhodophyceae) (Gambar 1). Karagenan adalah galaktan tersulfatasi linear hidrofilik. Polimer ini merupakan pengulangan unit disakarida. Galaktan tersulfatasi ini diklasifikasi menurut adanya unit 3.6-anhydro galactose (DA) dan posisi gugus sulfat (Campo et al., 2009). Selain galaktosa dan sulfat, beberapa karbohidrat juga ditemui, seperti xilosa, glukosa, uronic acids, dan substituen seperti metil ester dan grup pyruvate. Tiga jenis karagenan komersial yang paling penting adalah karagenan iota, kappa dan lambda. Sedangkan karagenan mu adalah prekursor karagenan kappa, karagenan nu adalah prekursor iota. Jenis karagenan yang berbeda ini diperoleh dari spesies rhodophyta yang berbeda. Secara alami, jenis iota dan kappa dibentuk secara enzimatis dari prekursornya oleh sulfohydrolase. Sedangkan secara komersial, jenis ini diproduksi menggunakan perlakuan alkali atau ekstraksi dengan alkali (Van De Velde et al., 2002).
6
Saat ini jenis karagenan kappa didominasi dipungut dari rumput laut tropis
Kappaphycus alvarezii, yang di dunia perdagangan dikenal sebagai Euchema cottonii. Euchema denticulatum (dengan nama dagang Euchema spinosum) adalah spesies utama untuk menghasilkan jenis karagenan iota. Karagenan lamda diproduksi dari spesies Gigartina dan Condrus (Van de Velde et al., 2002).
Menurut Doty (1985) Eucheuma cottonii sp. merupakan salah satu jenis rumput laut merah (Rhodophyceae) dan dikenal dalam dunia perdagangan nasional maupun internasional sesuai dengan nama daerahnya yaitu „cottonii’ padahal nama ilmiah sebenarnya adalah Kappaphycus alvarezii karena karaginan yang dihasilkan termasuk fraksi kappa-karaginan. Klasifikasi Eucheuma cottonii sp. adalah sebagai berikut :
Kingdom : Plantae
Hidrolisis asam dapat digunakan untuk memecah komponen polisakarida menjadi monomer-monomernya. Proses hidrolisis yang sempurna akan memecah selulosa dan pati menjadi glukosa, sedangkan hemiselulosa akan terpecah menjadi pentosa dan heksosa. Asam sulfat (H2SO4) dan asam klorida (HCl) merupakan
asam yang digunakan sebagai katalis dalam proses hidrolisis. Hidrolisis asam dikelompokkan menjadi dua yaitu hidrolisis dengan konsentrasi tinggi dan hidrolisis dengan konsentrasi rendah (Tahezadeh dan Karimin, 2007).
Keuntungan hidrolisis dengan konsentrasi tinggi adalah proses hidrolisis dapat dilakukan pada suhu yang rendah. Namun penggunaan asam konsentrasi tinggi mempunyai kelemahan antara lain jumlah asam yang digunakan sangat banyak, potensi korosi pada peralatan produksi, penggunaan energi yang cukup tinggi untuk proses daur ulang asam, dan terbentuk produk samping yang tidak diharapkan seperti furfural dan hidroksimetil furfural (HMF). Hindrolisis menggunakan asam dengan konsentrasi rendah mempunyai keuntungan yaitu jumlah asam yang digunakan sedikit. Namun kerugian dalam penggunaan asam dengan konsentrasi rendah antara lain membutuhkan suhu tinggi dalam proses operasinya, potensi korosi pada peralatan produksi terutama alat yang dibuat dari besi, dan terbentuk produk samping yang tidak diharapkan seperti furfural dan hidroksimetil furfural (HMF). Komponen furfural dan hidroksimetil furfural merupakan produk yang nantinya dapat menghambat proses fermentasi (Tahezadeh dan Karimin, 2007).
Hidrolisis asam dengan konsentrasi rendah dapat dilakukan dalam dua tahap yaitu tahap pertama menggunakan asam dengan konsentrasi rendah untuk menghidrolisis gula dari golongan pentosa yang umumnya terdapat dalam fraksi hemiselulosa. Tahap ini biasanya menggunakan H2SO4 1 M pada suhu 80-1200C
7
tinggi untuk menghidrolisis gula yang berasal dari golongan heksosa seperti selulosa, biasanya dilakukan dengan konsentrasi asam H2SO4 5-20 M dengan
suhu 180 0C. Proses hidrolisis bertahap ini dapat memaksimalkan glukosa yang dihasilkan dan meminimumkan hasil samping yang tidak diinginkan (Purwadi, 2006).
Penentuan konsentrasi asam tergantung pada ukuran, bentuk, dan kadar air pada partikel lignoselulosa. Asam sulfat biasanya digunakan pada larutan terlarut dengan konsentrasi tidak melebihi 10% berat (asam sulfat umum digunakan tidak lebih dari 5%). Penggunaan asam dengan konsentrasi rendah selalu terjadi penambahan air yang banyak pada bahan lignoselulosa dan hal itu membutuhkan energi panas yang lebih banyak selama proses pemanasan (Tahezadeh dan Karimin, 2007).
Hidrolisis asam pada bahan lignoselulosa dan hemiselulosa merupakan komponen yang paling gampang terhidrolisis menjadi xilosa, manosa, asam asetat, galaktosa, dan sejumlah kecil ramnosa. Selulosa akan terdegradasi menjadi glukosa. Pada suhu dan tekanan yang tinggi, komponen glukosa, galaktosa, dan manosa terdegradasi menjadi hidroksimetil furfural (HMF) dan xilosa menjadi furfural. Komponen fenol terbentuk dari lignin yang terpecah sebahagian dan juga selama proses degradasi karbohidrat. Lignin merupakan komponen komplek yang tersusun oleh fenilpropane yang terikat di dalam struktur tiga dimensi. Ikatan kimia terjadi diantara lignin dan hemiselulosa bahkan terkadang juga dengan selulosa. Lignin sangat tahan terhadap reaksi kimia dan enzimatik (Palmqvist dan Hagerdal, 2000). Karakteristik hidrolisat untuk fermentasi dapat dilihat pada Tabel 2
Tabel 2 Karakteristik hidrolisat untuk fermentasi
No Senyawa Konsentrasi Sumber
1
Bioetanol merupakan senyawa alkohol yang diperoleh melalui proses fermentasi biomassa dengan bantuan mikroorganisme. Mikroorganisme yang biasa digunakan dalam fermentasi glukosa menjadi etanol, adalah khamir dari spesies Saccharomyces cerevisiae. Pada umumnya fermentasi etanol dilakukan pada kondisi anaerob, karena adanya cukup oksigen (aerob) akan menjadikan
Saccharomyces cerevisiae berkembang bagus tetapi pembentukan etanol sebagai salah satu produk metabolismenya hanya sedikit (Prescott dan Dunn, 1981).
Menurut Oura (1983), secara sederhana proses fermentasi alkohol dari bahan baku yangg mengandung gula (glukosa) terlihat pada reaksi berikut :
Glukosa 2 C2H5OH + 2 CO2 + 2 ATP + 2 Kkal
8
Fermentasi dapat dilakukan dengan menggunakan media padat atau media cair. Menurut Rahman (1992), fermentai menggunakan media padat dan media cair mempunyai kelebihan dan kekurangan masing-masing. Media padat mempunyai kelebihan karena cara pengoperasiannya yang sederhana, kontaminasi bukan merupakan masalah penting, bahan untuk media atau substrat mudah diperoleh, dan relatif murah harganya. Kekurangannya adalah memerlukan ruang yang luas, membutuhkan banyak tenaga kerja, sulit mengatur komposisi komponen-komponen media dan meniadakan komponen yang berpengaruh negatif terhadap proses fermentasi, dan sulit mengatir kondisi lingkungan fermentasi. Media cair mempunya kelebihan karena jenis dan konsentrasi media dapat diatur sesuai dengan yang diinginkan, dapat memberi kondisi yang optimum bagi pertumbuhan, dan pemakaian medium lebih efisien. Untuk media fermentasi dapat digunakan bioreaktor yaitu setiap jenis wadah seperti tabung labu, labu erlenmeyer, dan fermentor yang digunakan untuk melangsungkan proses fermentasi yang dilakukan.
Menurut Paturau (1981), fermentasi etanol membutuhkan waktu 30-72 jam. Menurut Prescott dan Dunn (1981), waktu fermentasi etanol yang diperlukan adalah 3 sampai 7 hari.
Karakteristik Mikroba yang Mengkonversi Galaktosa Menjadi Bioetanol Kandungan gula dalam bentuk gula galaktosa pada E. cottonii membuat mikroba yang selama ini digunakan dalam memproduksi bioetanol kesulitan dalam mengkonversi gula galaktosa tersebut menjadi bioetanol karena gula yang selama ini dikonversi merupakan gula glukosa. Oleh karena itu dibutuhkan teknologi yang dapat mengubah gula galaktosa menjadi gula glukosa. Menurut Timsson (2007) khamir dapat memetabolisme galaktosa menjadi α-D-glukosa-6-fosfat melalui jalur Leloir (Gambar 2).
9
Gen dan protein penting yang dibutuhkan oleh Saccharomyces cerevisiae
dalam metabolisme galaktosa dapat dilihat pada Tabel 3. Enzim yang dihasilkan oleh Saccharomyces cerevisiae selama pertumbuhannya dalam memetabolisme galaktosa menjadi glukosa 6-phosphate adalah :
1. Galaktosa mutarotase dan UDP-galaktosa-4-epimerase (Gal10p) yang dapat mengubah (fosforilasi) β-D-galaktosa menjadi α-D-galaktosa
2. Galaktokinase (Gal1p) yang berfungsi mengubah α-D-galaktosa menjadi α -D-galaktosa-1-fosfat.
3. Galaktosa-1-fosfat uridiltransferase (Gal7p) yang berfungsi mengubah α -D-galaktosa-1-fosfat menjadi α-D-glukosa-1-fosfat.
4. Fosfoglukomutase (Pgm1p/Pgm2p) yang merupakan enzim terakhir yang digunakan dalam jalur Leloirsebagai katalis yang mengisomerisasi α -D-glukosa-1-fosfat menjadi α-D-glukosa-6-fosfat.
Tabel 3 Gen dan Protein Penting dalam Metabolisme Galaktosa pada
Saccharomyces cerevisiae
Gal1p Galactokinase, Can olso substitute for Gal3p
GAL1 YBR020W 2.7.1.6 2AJ4
Gal2p Galactose permease GAL2 YLR081W *
Gal3p Ligand sensor in the GAL genetic switch. No kinase activity
GAL3 YDR009W *
Gal4p Transcription factor (activator) in the
GAL genetic switch
GAL4 (GAL81)
YPL248C * 1D66(DNA binding
domain plus DNA;
Gal80p Transcription factor (repressor) in the
GAL genetic switch
GAL80 YML051W * 2NVW
Mig1p Transcription factor which represses numerous system including the GAL
genes in the presence of glucose
MIG1 YGL035C *
Pgm1p Phosphoglukomutase (minor isoform) PGM1 YKL127W 5.4.2.2 Pgm2p Phosphoglukomutase (major isoform) PGM2
(GAL5)
YMR105C 5.4.2.2
Cyc8p Transcriptional co-repressor; acts in complex with Tup1p
CYC8 (SNN6)
YBR112C *
Tup1p General transcriptional repressor; acts with Cyc8p
TUP1 YCR084C * 1ERJ (WD40 domain)
Snf1p Protein kinase, phosphorylates Mig1p SNF1 YDR477W 2.7.11.1 2EUE (kinase domain); 2FH9 (kinase domain dimer)
10
Berdasarkan laporan dari GB-Analyst report dikatakan bahwa mikroba yang efektif dalam memfermentasi glukosa akan bisa melakukan fermentasi terhadap galaktosa, contohnya adalah S.cerevisiae (Goh dan Lee, 2010). Hal ini didukung dengan hasil identifikasi dari beberapa jenis khamir liar yang dilakukan oleh Inggit (2013), diperoleh hasil bahwasanya Pachysolen tannophilus dan
Saccharomyces cerevisiae merupakan khamir yang dapat mengkonversi galaktosa yang terdapat pada hidrolisat asam E. cottonii menjadi bioetanol. Oleh karena itu, perlu dilakukan penelitian mengenai modifikasi proses produksi bioetanol dari galaktosa oleh Saccharomyces cerevisiae dan Pachysolen tannophilus yang merupakan khamir yang dianggap dapat mengkonversi galaktosa menjadi bioetanol. Klasifikasi dari Saccharomyces cerevisiae dan Pachysolen tannophilus
dapat dilihat pada Tabel 4.
Tabel 4 Klasifikasi dari Saccharomyces cerevisiae dan Pachysolen tannophilus
Klasifikasi Spesifik Saccharomyces cerevisiae Pachysolen tannophilus
Gambar
Kingdom Khamir Khamir
Filum Ascomycota
Subfilum Saccharomycotina Ascomycota
Kelas Saccharomycetes Saccharomycetes
Ordo Saccharomycetales Saccharomycetales
Famili Saccharomycetaceae Saccharomycetaceae
Genus Saccharomyces Pachysolen
Spesies S. cerevisiae P. tannophilus
11
3
METODOLOGI
Tempat Pelaksanaan
Penelitian ini dilaksanakan di Pusat Penelitian Surfaktan dan Bioenergi (SBRC).
Alat dan Bahan
Bahan yang digunakan dalam penelitian ini adalah rumput laut (E. cottonii) yang diperoleh dari Banten, kultur khamir (Saccharomyces cerevisiae
IPBCC05.548 dan Pachysolen tannophilus IPBCC y 11.1149), asam sulfat, pepton, PDA (Potato Dextrose Agar), PDB (Potato Dextrose Broth), pupuk urea, pupuk NPK (Nitrogen, Posfor, Kalium), fenol, DNS, NaOH, HCl, etanol,
aquadest, spiritus, heksana, desinsektan, kapur tohor, urea, NPK, vitamin B, mineral (MgSO4.7H2O, FeSO4.7H2O, ZnSO4.7H2O, MnSO4.6H2O, CuSO4.5H2O
dan CaCl).
Alat yang digunakan dalam penelitian ini meliputi autoclave, pH-meter, oven, lemari es, inkubator, neraca analitik, hemasitometer, spektrofotometer,
freezer, alat destilasi, termometer, saringan, sarung tangan, tanur, kompor listrik, alat pengaduk, pemanas, plastik, piknometer, loop inokulasi, dan alat-alat gelas lainnya seperti labu erlenmeyer, tabung reaksi, pipet, bunsen, cawan petri, gelas piala, tabung Kjeldahl, tabung Soxhlet, buret, dan lain-lain.
Prosedur Kerja
Penelitian modifikasi fermentasi hidrolisat asam encer E. cottonii menjadi bioetanol menggunakan Saccharomyces cerevisiae IPBCC AL IX dan Pachysolen tannophilus IPBCC AC IX dilaksanakan dalam dua tahap. Diagram penelitian dapat dilihat pada Gambar 3.
Tahap pertama merupakan tahap pendahuluan yang meliputi pengecilan ukuran, pengeringan, karakterisasi E. cottonii dengan parameter yang diuji adalah kadar karbohidrat (selulosa dan hemiselulosa), protein, serat kasar, abu, dan kadar air. Tahap pendahuluan yang terakhir adalah hidrolisis E. cottonii menggunakan asam sulfat sehingga komponen selulosa dan hemiselulosa dari E. cottonii dapat terhidrolisis menjadi gula-gula penyusunnya (galaktosa) dan kemudian hasil hidrolisis disaring sehingga diperoleh padatan dan hidrolisat yang mengandung galaktosa. Tahap kedua merupakan tahap penelitian utama yang dibagi menjadi dua tahap, yaitu tahap adaptasi dan tahap fermentasi. Pada tahap adaptasi, khamir diadaptasi pada media yang mengandung galaktosa untuk mengkondisikan khamir tersebut pada media yang mengandung galaktosa. Tahap kedua adalah fermentasi hidrolisat asam encer E. cottonii yang mengandung galaktosa menjadi bioetanol dengan menggunakan dua jenis khamir yang telah teradaptasi (Saccharomyces cerevisiae IPBCC AL IX dan Pachysolen tannophilus IPBCC AC IX). Untuk proses fermentasi, pada media hidrolisat asam encer E. cottonii ditambahkan trace element (Kofli et al., 2006) yaitu MgSO4.7H2O (2.4 g/L), FeSO4.7H2O (0.01 g/L),
12
CaCl (0.12 g/L) serta Vitamin B (1 g/L), Urea (0.5% dari 0Brix), dan NPK (0.06% dari 0Brix) untuk memacu aktivitas pertumbuhan khamir dalam mengkonsumsi galaktosa menjadi bioetanol.
Gambar 3 Diagram alir penelitian modifikasi fermentasi hidrolisat asam encer E. cottonii menjadi bioetanol menggunakan Saccharomyces cerevisiae
dan Pachysolen tannophilus
Tahap Pendahuluan 1. Pengecilan ukuran E. cottonii
Pengecilan ukuran E. cottonii dilakukan dengan menggunakan mesin pemotong hingga diperoleh E. cottonii dengan ukuran kecil berkisar ± 1 cm.
2. Pengeringan E. cottonii
Pengeringan E. cottonii dilakukan dengan menggunakan sinar matahari dan oven (suhu ± 500C).
3. Karakterisasi E. cottonii
Karakterisasi E. cottonii meliputi analisis terhadap kadar karbohidrat (SNI 01-2891-1992), protein (AOAC, 1995), serat kasar (AOAC, 1995), abu (AOAC, 1995), dan kadar air (AOAC, 1995) (Lampiran 1).
4. Hidrolisis E. cottonii dengan Menggunakan H2SO4
Hidrolisis E. cottonii menggunakan H2SO4 mengacu pada hasil
penelitian yang dilakukan oleh Setyaningsih et al. (2012). E. cottonii yang menggandung Total Dissolved Solid (TDS) berada pada kisaran 14-17.5 0Brix dari 10-15% (b/v) konsentrasi padatan dalam bentuk serbuk rumput laut kering dihidrolisis dengan H2SO4 3% selama dua kali 30 menit pada suhu
13
hidrolisis E. cottonii dengan menggunakan H2SO4 dapat dilihat pada Gambar
4.
Gambar 4 Proses hidrolisis E. cottonii dengan menggunakan H2SO4
Hidrolisat yang diperoleh kemudian dianalisis kadar gula pereduksi (Miller, 1959) dan total padatan terlarut menggunakan brixmeter serta komponen gula sederhana (monosakarida) menggunakan High Performance Liquid Chromatogtaphy (HPLC) dengan Spesifikasi pengukuran : Fase gerak: H2SO40.008 N; Kolom: Aminex®HPX-87H; 300 mm x 7.8 mm; Detector:
Reactive Index; Flow rate: 1 ml/min; Volume injeksi: 20 µl; Suhu kolom: 350C; Back Pressure: 1247 psi.
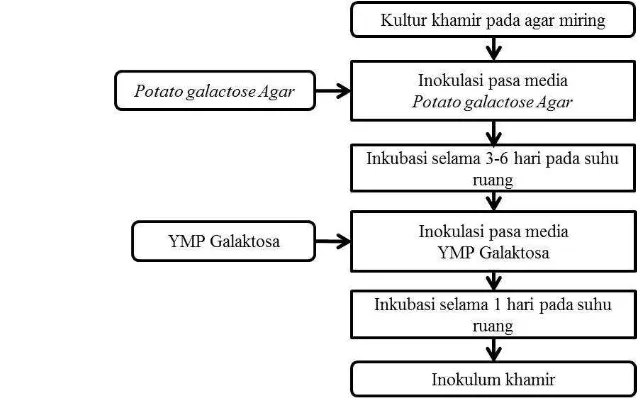
Penelitian Utama 1. Penyiapan Inokulum
Sel khamir yang berasal dari agar miring disegarkan pada media Potato Galactose Agar (PGA). Khamir yang telah disegarkan kemudian diinokulasikan pada media YMP Galaktosa untuk penyiapan inokulum yang akan digunakan pada tahap fermentasi hidrolisat asam encer E. cottonii menjadi bioethanol (Gambar 5).
14
2. Adaptasi Khamir dalam Media Galaktosa
Khamir diadaptasikan dalam media yang mengandung galaktosa baik melalui cara adaptasi cepat maupun adaptasi lambat. Pada adaptasi cepat, sebanyak 10% (v/v) atau 1 ml kultur khamir dimasukkan ke dalam media yang mengandung galaktosa (YMP Galaktosa dan hidrolisat asam encer E. cottonii
dengan perbandingan 1:1) sebanyak 9 ml, yang kemudian diinkubasi selama 3 hari. Kultur kemudian dipanen dan dilakukan perhitungan jumlah total sel menggunakan hemasitometer, jumlah koloni sel yang tumbuh dengan metode plating, dan gula pereduksi. Pada waktu yang sama, sebanyak 10% cairan hasil fermentasi dimasukkan ke dalam media fermentasi baru, kemudian diinkubasi kembali pada media baru yang mengandung galaktosa, dan dilakukan pemanenan. Kegiatan ini akan diulang-ulang minimal 9 kali. Adapun pada adaptasi lambat, sebanyak 10% (v/v) atau 1 ml kultur khamir dimasukkan ke dalam media yang mengandung galaktosa (100% hidrolisat asam E. cottonii) sebanyak 9 ml, yang kemudian diinkubasi selama 3 hari. Kultur kemudian dipanen dan dilakukan perhitungan jumlah total sel menggunakan hemasitometer, jumlah koloni sel yang tumbuh dengan metode plating, dan gula pereduksi. Pada waktu yang bersamaan kultur khamir yang telah diinkubasi selama 3 hari disegarkan kembali pada media standar dan diinkubasi untuk penyegaran. Biakan segar kemudian diinokulasikan sebanyak 10% (v/v) pada media baru yang mengandung galaktosa dan diinkubasi kembali selama 3 hari. Kegiatan ini juga diulang hingga 9 kali.
Penetapan waktu adaptasi selama 3 hari untuk tiap tahapan adaptasi didasarkan pada hasil penelitian yang dilakukan oleh Setyaningsih, et al.
(2012) bahwasanya pertumbuhan optimal S. cerevisiae pada media galaktosa terjadi pada jam ke-48. Pada hidrolisat asam E. cottonii, selain mengandung galaktosa juga mengandung xilosa dan glukosa (Van De Velde, 2002). Oleh karena itu, pada tahapan adaptasi menggunakan hidrolisat asam E. cottonii, khamir dihadapkan pada kondisi pertumbuhan diauxic, yaitu terdapat lebih dari satu sumber karbon pada media hidrolisat asam encer E. cottonii sehingga khamir tersebut terlebihdahulu mengkonsumsi sumber karbon yang umum digunakan oleh khamir tersebut (glukosa dan xilosa) hingga berkurang dan kemudian mengkonsumsi sumber karbon yang belum umum digunakan oleh khamir tersebut (galaktosa).
3. Fermentasi Khamir Teradaptasi pada Hidrolisat Asam Encer E. cottonii
15
asam encer E. cottonii menjadi bioetanol menggunakan S. cerevisiae dan P. tannophylus dapat dilihat pada Gambar 6.
Gambar 6 Tahapan fermentasi hidrolisat asam encer E. cottonii menjadi bioetanol menggunakan khamir teradaptasi. a)S. cerevisiae; b)P. tannophylus
4. Fermentasi Hidrolisat Asam Encer E. cottonii dengan Perlakuan
Refreshed Culture Berbeda Setelah Fermentasi Berlangsung 24 Jam
16
Gambar 7 Tahapan fermentasi hidrolisat asam encer E. cottonii dengan perlakuan refreshed culture berbeda setelah fermentasi berlangsung 24 jam
5. Fermentasi Hidrolisat Asam Encer E. cottonii dengan Perlakuan
Refreshed Culture yang Sama Setelah Fermentasi Berlangsung 24 Jam
Fermentasi dilakukan dengan cara refreshed culture yang sama setelah fermentasi berlangsung selama 24 jam. Awal fermentasi, pada media hidrolisat asam encer E. cottonii yang telah diberi trace element kemudian ditambahkan 10% (v/v) kultur S. cerevisiae IPBCC AL IX dan diinkubasi selama 24 jam secara anaerobik fakultatif pada suhu ruang dan pH 4.5-5. Setelah fermentasi berlangsung selama 24 jam oleh S. cerevisiae IPBCC AL IX, pada media ditambahkan 10% (v/v) kultur S. cerevisiae IPBCC AL IX, kemudian fermentasi diteruskan selama 3-6 hari secara anaerobik fakultatif. Perlakuan ini dilakukan sebanyak 3 (tiga) kali ulangan dengan parameter yang diuji selama fermentasi meliputi kadar gula pereduksi (Miller, 1959), kadar etanol menggunakan densitometer, dan jumlah total sel menggunakan hemasitometer sehingga diperoleh informasi mengenai efisiensi penggunaan substrat serta efisiensi fermentasi. Tahapan fermentasi hidrolisat asam encer
17
Gambar 8 Tahapan fermentasi hidrolisat asam encer E. cottonii dengan perlakuan refreshed culture yang sama setelah fermentasi berlangsung 24 jam
6. Fermentasi Hidrolisat Asam Encer E. cottonii dengan Perlakuan Perbedaan Konsentrasi Gula Pereduksi
Berbeda dengan perlakukan pada fermentasi bioetanol tahap I, II, dan III, pada tahap IV, fermentasi dilakukan selama 6 hari dengan perlakuan perbedaan konsentrasi gula pereduksi di awal fermentasi, yaitu 6% (b/v), 9% (b/v), 12% (b/v), dan 15% (b/v). Penambahan inokulum S. cerevisiae IPBCC AL IX dilakukan diawal fermentasi sebanyak 10 % (v/v). Pengamatan dilakukan terhadap kadar gula pereduksi (Miller, 1959), kadar etanol menggunakan densitometer, dan jumlah total sel menggunakan hemasitometer yang dilakukan pada awal dan akhir fermentasi sehingga diperoleh informasi efisiensi penggunaan substrat dan efisiensi fermentasi. Perlakuan ini dilakukan sebanyak 3 (tiga) kali ulangan. Fermentasi dilakukan secara anaerobik fakultatif pada suhu ruang dengan pH cairan 4.5-5. Pengaturan pH dilakukan dengan menambahkan H2SO4 hingga mencapai pH yang diinginkan. Nutrient
18
19
4
HASIL DAN PEMBAHASAN
Karakteristik E. cottonii dan Hidrolisat Asam Encer E. cottonii
E. cottonii kering yang akan digunakan sebagai bahan baku untuk memproduksi bioetanol dengan menggunakan dua jenis khamir (S. cerevisiae
IPBCC AL IX dan P. tannophilus IPBCC AC IX) terlebih dahulu dikarakterisasi untuk mengetahui komposisi kimia yang terdapat pada E. cottonii. E. cottonii
yang dianalisis merupakan E. cottonii yang telah dikeringkan hingga kadar airnya di bawah 10%.
Hasil analisis komposisi kimia E. cottonii (Tabel 5) memberikan informasi bahwa E. cottonii yang telah dikeringkan mengandung air sebesar 8.75% basis basah atau terdapat 0.0959 g air per g E. cottonii yang telah dikeringkan. Menurut Karunakara dan Gurusamy (2011) berat kering dari Euchema sp. sebesar 13.9 g yang diperoleh dari 20 g Euchema sp. dalam kondisi segar.
Kadar abu yang terdapat pada E. cottonii sebesar 18.66% basis kering, nilai yang sama dengan hasil penelitian yang dilakukan oleh Yunizal (2004) yaitu sebesar 18.87% basis kering. Mineral yang terkandung dalam E. cottonii meliputi Na, K, Ca, Mg, Fe, Zn, Cu, dan iodium. Kadar protein yang terdapat pada E. cottonii sebesar 5.50% basis kering, nilai yang sedikit lebih besar jika dibandingkan dengan hasil pengujian yang dilakukan oleh Yunizal (2004) yaitu sebesar 4.07% basis kering.
Kadar karbohidrat yang terdapat pada E. cottonii yang telah dikeringkan adalah sebesar 29.45% basis kering yang terdiri dari 3.21% basis kering hemiselulosa dan 11.30% basis kering selulosa. Kadar karbohidrat pada E. cottonii yang digunakan sebagai bahan baku pada penelitian ini lebih sedikit jika dibandingkan dengan hasil pengujian yang dilakukan oleh Yunizal (2004) yaitu sebesar 67.64% basis kering.
Tabel 5 Hasil analisis komposisi kimia E. cottonii kering
Komposisi kimia E. cottonii kering (% basis kering)
Hemiselulosa adalah rantai polimer bercabang dari berbagai jenis monomer (monosakarida) yang berbeda atau sering disebut heteropolimer. Monomer hemiselulosa terdiri atas D-glukosa, D-manosa, D-galaktosa, D-xilosa, L-arabinosa, dan sedikit L-ramnosa. Selama hidrolisis berlangsung, hemiselulosa akan terdegradasi menjadi monomer-monomer penyusunnya. Selulosa merupakan senyawa organik dengan rumus (C6H10O5)n, sebuah polisakarida yang terdiri dari
20
terdegradasi menjadi monomer-monomer penyusunnya yaitu golongan monosakarida dan oligosakarida.
Menurut Tong et al. (2007) Euchema mengandung karbohidrat yang merupakan komponen utamanya sebesar 70% basis kering. Rumput laut jenis ini digunakan sebagai bahan baku pembuatan karagenan yang merupakan polisakarida linear yang sekitar 55% dari berat keringnya adalah D-galaktosa dan 3-6-anhidro-galaktosa. Menurut Lin et al. (2000) pada karagenan mengandung sebanyak 56.2% D-galaktosa dan 43.8% 3-6-anhidro-galaktosa.
Hidrolisat asam encer E. cottonii diperoleh dengan cara dihidrolisis menggunakan asam H2SO4 3% yang dilakukan sebanyak 2 tahap. Hidrolisis
dengan cara ini menghasilkan hidrolisat asam encer E. cottonii dengan rendemen ± 57.31% dengan total padatan terlarut sebesar ± 12.5 0Brix dan gula pereduksi sebesar ± 100 g/L atau ± 10% (b/v). Total gula pereduksi bisa lebih besar atau lebih kecil dari 10% (b/v) tergantung pada kesempurnaan proses hidrolisis.
Hasil pengukuran komponen gula yang terdapat pada hidrolisat asam encer
E. cottonii menggunakan High Performance Liquid Chromatogtaphy (HPLC) memberikan informasi bahwasanya komponen gula tertinggi yang terdapat pada hidrolisat asam encer E. cottonii yang diperoleh dari hasil hidrolisis 30 gram E. cottonii kering pada 100 ml larutan asam sulfat 3% (30 g/100 ml) adalah galaktosa yaitu 4.95% (Tabel 6). Selain galaktosa, pada hidrolisat asam encer E. cottonii juga terdapat glukosa, xilosa, dan maltoheptaosa dengan konsentrasi masing-masing secara berurutan adalah 0.25%, 0.04%, dan 0.02% (Tabel 6).
Tabel 6 Karakterisasi komponen gula yang terdapat pada hidrolisat asam encer
E. cottonii menggunakan HPLC
Menurut hasi penelitian yang dilakukan oleh Karunakara dan Gurusamy (2011) pada Euchema sp terdapat beberapa jenis gula setelah dianalisis menggunakan High Performance Liquid Chromatogtaphy (HPLC), yaitu D-Galaktosa 3.6-anhidro-D-galaktosa, sulfat, D-galaktosa, dan glukosa. Dari keempat jenis gula yang terdapat pada Euchema sp, komponen gula tertinggi adalah D-galaktosa, sedangkan komponen gula terendah adalah glukosa.
Adaptasi Khamir Dalam Media Galaktosa
Adaptasi diperlukan untuk mengkondisikan khamir pada media yang mengandung galaktosa yang merupakan komponen terbesar dalam hidrolisat asam encer E. cottonii. Menurut Eddy (1954), adaptasi khamir diploid seperti
Saccharomyces cerevisiae pada media galaktosa sebagai sumber karbon memberikan bukti bahwasanya terlibatnya pertumbuhan selektif dari beberapa sel yang telah bermutasi ke kondisi yang memungkinkan galaktosa mudah dimanfaatkan. Menurut Sheffner dan McClary (1954), percobaan adaptasi
21
konsumsi oksigen dengan asumsi dasar bahwasanya kedua parameter tersebut dapat menjadi indikator adanya kegiatan galaktokinase dan fosfogalaktoisomerase yang merupakan enzim yang dapat memetabolisme galaktosa.
Metabolisme galaktosa membutuhkan energi intensif, proses induktif oleh
Saccharomyces cerevisiae, serta membutuhkan berbagai enzim yang harus disintesis, diantaranya galaktosa permease (GAL2), galaktokinase, heksosa-1-fosfat uridiltransferase, dan UDP-glukosa-4-epimerase (Nevado et al., 1993; Lohr
et al., 1995; Ostergaard et al., 2001).
Hasil pengamatan jumlah total sel pada adaptasi lambat (AL) yang dilakukan pada S. cerevisiae IPBCC05.548 sehingga diperoleh strain yang diberi nama S. cerevisiae IPBCC AL terlihat bahwa jumlah total sel dan total sel hidup yang diperoleh cenderung memberikan data yang fluktuatif dari masing-masing tahapan adaptasi (Gambar 10). Hal ini dapat disebabkan karena kondisi lingkungan yang berbeda pada tiap tahapan adaptasi seperti konsentrasi gula pereduksi (Wignyanto et al., 2001 ; Gaur, 2006), ketersediaan oksigen (Barnett et al., 2000 ; Trust, 2008), pH (Sassner et al., 2008), serta konsentrasi dan kondisi kultur yang digunakan (Wignyanto et al., 2001).
Gambar 10 Hubungan antara tahapan adaptasi lambat S. cerevisiae pada media 100% hidrolisat asam encer E. cottonii dengan log jumlah total sel, log jumlah sel hidup, dan gula pereduksi. (♦) jumlah total sel; (■) jumlah sel hidup; (▲) gula pereduksi. (Setyaningsih et al., 2012)
22
bahwasanya konsentrasi etanol tertinggi dihasilkan oleh S. cerevisiae IPBCC yang telah teradaptasi pada media hidrolisat asam encer E. cottonii sebanyak 9 kali, yaitu sebesar 0.268 % (v/v) (Setyaningsih et al., 2012). Hal ini yang mendasari pada tahap fermentasi hidrolisat asam encer E. cottonii menjadi etanol menggunakan S. cerevisiae IPBCC AL IX yang merupakan khamir yang telah teradaptasi pada hidrolisat asam encer E. cottonii sebanyak 9 kali.
Hasil pengamatan jumlah total sel pada adaptasi cepat (AC) yang dilakukan pada P. tannophilus IPBCC y 11.1149 sehingga diperoleh strain yang diberi nama
P. tannophilus IPBCC AC terlihat bahwa jumlah total sel dan total sel hidup yang diperoleh semakin meningkat diakhir inkubasi untuk tiap tahapan adaptasi dengan data peningkatan yang begitu fluktuatif dari tiap tahapan adaptasi (Gambar 11). Hal ini dapat disebabkan karena kondisi lingkungan yang berbeda pada tiap tahapan adaptasi seperti konsentrasi gula pereduksi (Wignyanto et al., 2001 ; Gaur, 2006), ketersediaan oksigen (Barnett et al., 2000 ; Trust, 2008), pH (Sassner
et al., 2008), serta konsentrasi dan kondisi kultur yang digunakan (Wignyanto et al., 2001).
23
Hasil perhitungan viabilitas sel pada tiap tahapan adaptasi P. tannophilus
IPBCC y 11.1149, diperoleh bahwasanya viabilitas sel tertinggi terdapat pada P. tannophilus IPBCC AC yang telah teradaptasi sebanyak 9 kali, yaitu sebesar 61.97% (Tabel 7). Hal ini memberikan informasi bahwasanya diakhir waktu untuk tiap tahapan adaptasi masih terdapat sel hidup dalam jumlah yang masih banyak. Semakin banyak jumlah sel yang hidup diakhir waktu inkubasi untuk tiap tahapan adaptasi, menandakan bahwasanya sel tersebut semakin teradaptasi dengan tingkat kejenuhan yang tidak begitu cepat. Tingginya viabilitas sel pada akhir adaptasi cepat P. tannophilus IPBCC yang telah teradaptasi pada media yang mengandung galaktosasebanyak 9 kali, menjadi dasar penggunaan P. tannophilus
IPBCC AC IX untuk digunakan pada tahap fermentasi hidrolisat asam encer E. cottonii menjadi etanol.
Tabel 7 Hasil perhitungan viabilitas sel pada tiap tahapan adaptasi cepat P. tannophilus
Jumlah Adaptasi
Jumlah total sel dan Jumlah Sel Hidup
P. tannophilus IPBCC AC* Viabilitas Sel (%)
* Adaptasi cepat pada campuran hidrolisat asam encer E. cottonii dengan YMP Galaktosa (1 : 1)
Ditinjau dari sisa gula pereduksi (Gambar 10 dan Gambar 11) yang terdapat dalam media di akhir waktu inkubasi untuk tiap tahapan adaptasi, sisa gula pereduksi cenderung menurun yang menunjukkan kemampuan S. cerevisiae
IPBCC AL dan P. tannophilus IPBCC AC untuk mengkonsumsi gula yang ada selama adaptasi. Semakin tinggi sisa gula pereduksi, maka kemampuan S. cerevisiae IPBCC AL dan P. tannophilus IPBCC AC untuk melakukan metabolisme semakin rendah dan semakin rendah sisa gula pereduksi, maka kemampuan S. cerevisiae IPBCC AL dan P. tannophilus IPBCC AC untuk melakukan metabolisme semakin tinggi. Aktivitas S. cerevisiae IPBCC AL dan P. tannophilus IPBCC AC dalam mensintesis galaktokinase dan fosfogalaktoisomerase yang merupakan enzim yang dapat memetabolisme galaktosa terlihat dari adanya gelembung CO2 pada tabung durham yang
24
fosfogalaktoisomerase. Terbentuknya karbon dioksida pada tabung durham yang diletakkan pada tabung adaptasi dapat juga mengindikasikan terbentuknya etanol selama adaptasi. hal ini mengacu pada persamaan Gay Lussac yang menyatakan bahwa secara teoritis, konversi 1 molekul gula dapat menjadi 2 molekul etanol dan 2 molekul karbon dioksida.
Hasil pengamatan morfologi sel S. cerevisiae IPBCC AL IX dan sel P. tannophilus IPBCC AC IX menggunakan mikroskop dengan perbesaran 400 kali dapat dilihat bahwasanya ukuran sel S. cerevisiae IPBCC AL IX berkisar antara 4.64-7.50 µm (Gambar 12-a) sedangkan ukuran sel P. tannophilus IPBCC AC IX berkisar antara 3.80-4.88 µm (Gambar 12-b). Data yang diperoleh memberikan informasi bahwasanya ukuran sel S. cerevisiae IPBCC AL IX lebih besar jika dibandingkan dengan ukuran sel P. tannophilus IPBCC AC IX.
Gambar 12 Hasil pengamatan morfologi sel khamir yang telah teradaptasi.
a)
Morfologi S. cerevisiae IPBCC AL IX pada perbesaran 400x ;
b)
Morfologi P. tannophilus IPBCC AC IX pada perbesaran 400x
25
Gambar 13 Hasil pengamatan gelembung udara yang terbentuk pada saat adaptasi. a)Adaptasi lambat S. cerevisiae IPBCC05.548; b)Adaptasi cepat P. tannophilus IPBCC y 11.1149
Fermentasi Khamir Teradaptasi Pada Hidrolisat Asam Encer E. cottonii
Hasil pengamatan jumlah total sel selama fermentasi diperoleh hasil bahwasanya semakin lama waktu fermentasi maka jumlah total sel semakin meningkat (Gambar 14-A). Hal ini menandakan bahwasanya selama fermentasi berlangsung, sel khamir mengkonsumsi gula untuk tumbuh dan memperbanyak sel. Jumlah total sel S. cerevisiae IPBCC AL IX lebih sedikit jika dibandingkan dengan jumlah total sel P. tannophilus IPBCC AC IX pada akhir fermentasi selama 6 hari. Namun, peningkatan jumlah total sel pada fermentasi yang berlangsung selama 6 hari untuk kedua jenis khamir relatif sama yaitu 13.67 kali lipat untuk sel S. cerevisiae IPBCC AL IX dan 13.37 kali lipat untuk P. tannophilus IPBCC AC IX. Rendahnya jumlah total sel S. cerevisiae IPBCC AL IX di akhir masa fermentasi didukung juga dengan jumlah penambahan total sel diawal fermentasi yang lebih sedikit jika bandingkan dengan jumlah total sel P. tannophilus IPBCC AC IX. Demikian halnya dengan tingginya jumlah total sel P. tannophilus IPBCC AC IX diakhir masa fermentasi didukung dengan jumlah penambahan total sel yang lebih banyak jika dibandingkan dengan total sel S. cerevisiae IPBCC AL IX. Semakin tinggi peningkatan jumlah total sel selama fermentasi sampai pada konsentrasi optimum, maka pertumbuhan sel semakin baik selama fermentasi.
Hasil pengamatan sisa gula pereduksi selama fermentasi (Gambar 14-B) diperoleh hasil bahwasanya semakin lama waktu fermentasi menggunakan S. cerevisiae IPBCC AL IX, sisa gula pereduksi semakin sedikit. Hal ini berbanding terbalik jika dibandingkan dengan fermentasi menggunakan P. tannophilus
IPBCC AC IX yang semakin lama waktu fermentasi, sisa gula pereduksi semakin tinggi. S. cerevisiae IPBCC AL IX mengkonsumsi galaktosa lebih baik jika dibandingkan dengan P. tannophilus IPBCC AC IX dengan efisiensi penggunaan substrat tertinggi sebesar 79.09% setelah fermentasi berlangsung selama 6 hari (Tabel 8). Efisiensi penggunaan substrat tertinggi pada fermentasi menggunakan
26
Gambar 14 Hubungan antara waktu fermentasi hidrolisat asam encer E. cottonii
menggunakan khamir teradaptasi dengan log jumlah total sel, gula pereduksi, dan konsentrasi etanol. ALog jumlah total sel; Bgula pereduksi dan konsentrasi etanol. (◊) log jumlah total sel S. cerevisiae
IPBCC AL IX; (□) log jumlah total sel P. tannophilus IPBCC AC IX; (▲) gula pereduksi S. cerevisiae IPBCC AL IX; (x) gula pereduksi P. tannophilus IPBCC AC IX; (♦) konsentrasi etanol S. cerevisiae
IPBCC AL IX; (■) konsentrasi etanol P. tannophilus IPBCC AC IX.
Hasil perhitungan yield etanol yang dihasilkan per substrat yang terkonsumsi (Yp/s) selama fermentasi (Tabel 8) diperoleh hasil bahwasanya
semakin lama waktu fermentasi menggunakan S. cerevisiae IPBCC AL IX, yield
etanol yang dihasilkan per substrat yang terkonsumsi (Yp/s) semakin tinggi.
Sedangkan yield etanol yang dihasilkan per substrat yang terkonsumsi (Yp/s)
selama fermentasi menggunakan P. tannophilus IPBCC AC IX diperoleh hasil bahwasanya semakin lama waktu fermentasi, yield etanol yang dihasilkan per substrat yang terkonsumsi (Yp/s) semakin tinggi, kecuali fermentasi hari ke-5 yang
menurun sehingga lebih rendah jika dibandingkan dengan fermentasi hari ke-4.
Tabel 8 Hasil perhitungan efisiensi penggunaan substrat, efisiensi fermentasi, dan konsentrasi etanol yang dihasilkan dari fermentasi hidrolisat asam encer
E. cottonii menggunakan khamir teradaptasi
Waktu Fermentasi Efisiensi
Hari ke-4 53.62±4.448 31.02±1.853 1.32±0.085 0.37±0.034 Hari ke-5 75.33±7.264 46.70±2.961 2.01±0.132 0.39±0.083 Hari ke-6 79.09±1.791 56.30±5.177 2.38±0.182 0.45±0.053
P. tannophilus IPBCC AC IX
Hari ke-4 15.39±7.698 2.60±0.293 0.11±0.014 0.11±0.082 Hari ke-5 11.60±0.940 1.23±0.895 0.05±0.038 0.07±0.045 Hari ke-6 7.05±7.745 1.44±0.836 0.06±0.035 0.13±1.155