IDENTIFIKASI
Beauveria
sp. ASAL SITU GEDE DENGAN
ANALISIS SEKUEN
INTERNAL TRANSCRIBED SPACER
DAN
VIRULENSINYA TERHADAP
Nilaparvata lugens
Stal
CYNTIA NIRMALASARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Identifikasi Beauveria sp. Asal Situ Gede dengan Analisis Sekuen Internal Transcribed Spacer dan Virulensinya terhadap Nilaparvata lugens Stal adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
CYNTIA NIRMALASARI. Identifikasi Beauveria sp. Asal Situ Gede dengan Analisis Sekuen Internal Transcribed Spacer dan Virulensinya Terhadap Nilaparvata lugens Stal. Dibimbing oleh SURYANI dan YADI SURYADI
Beauveria sp. atau dikenal sebagai penyebab penyakit “white muscardine” merupakan salah satu fungi entomopatogen yang dapat digunakan sebagai agen biokontrol terhadap berbagai hama serangga. Tujuan penelitian ini adalah melakukan identifikasi isolat Beauveria sp. asal Situ Gede dengan analisis sekuen internal transcribed spacer (ITS) dan mempelajari patogenitasnya terhadap Nilaparvata lugens Stal untuk mendapatkan isolat yang memiliki daya virulensi yang tinggi. Primer ITS 1 dan 4 telah berhasil mengamplifikasi daerah internal transcribed spacer (600 bp) dari ketigabelas isolat fungi Beauveria sp. Berdasarkan analisis homologi isolat Stgd 5(14)1 identik dengan Beauveria bassiana no 1572, dan isolat Stgd 7(14)2 identik dengan B. bassiana Bb 9005. Kedua isolat ini memiliki hubungan kekerabatan yang dekat berdasarkan analisis pohon filogenetik. Isolat Stgd 8(4)2 dan Stgd 7(14)2 merupakan isolat yang virulen terhadap N. lugens (S.) dengan tingkat mortalitas sebesar 100%. Isolat yang
CYNTIA NIRMALASARI. Identification of Beauveria sp. From Situ Gede Origin with Internal Transcribed Spacer Sequence Analysis and Their Virulence Against Nilaparvata lugens Stal. Under Supervision SURYANI dan YADI SURYADI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
IDENTIFIKASI
Beauveria
sp. ASAL SITU GEDE DENGAN
ANALISIS SEKUEN
INTERNAL TRANSCRIBED SPACER
DAN
VIRULENSINYA TERHADAP
Nilaparvata lugens
Stal
CYNTIA NIRMALASARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Bismillahirrahmanirrahim
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini dilaksanakan sejak bulan Januari hingga bulan April 2015, dengan judul Identifikasi Beauveria sp. Asal Situ Gede dengan Analisis Sekuen Internal Trancribed Spacer dan Virulensinya terhadap Nilaparvata lugens Stal.
Terima kasih penulis ucapkan kepada Dr Suryani, SPMSc dan Ir Yadi Suryadi, MSc selaku pembimbing yang telah banyak memberikan pengarahan dan saran selama pelaksanaan penelitian dan penyusunan karya ilmiah ini. Di samping itu, penghargaan penulis sampaikan kepada Ibu Puji Lestari, Bapak Wartono, Bapak Jajang dan Ibu Aminah beserta seluruh staf Laboratorium Mikrobiologi Konservasi Mikroorganisme BB-Biogen yang telah membantu selama pengumpulan data penelitian. Ucapan terimakasih juga disampaikan kepada Ayah, Ibu, Kakak, Adik, sahabat dekat (Mustika, Whyranti, Galuh, Arisya, Dea, dan Mei), serta teman-teman Biokimia angkatan 48 untuk segala doa, dukungan, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Alat dan Bahan 2
Prosedur Penelitian 2
HASIL 6
Morfologi Isolat Fungi Beauveria sp. 6
Kuantitas dan kualitas DNA Hasil Isolasi 6
Hasil Amplifikasi Sekuen Internal Transcribed Spacer (ITS) 7
Sekuens DNA 8
Patogenitas Fungi Beauveria sp. terhadap N. lugens (S.) 9
PEMBAHASAN 10
Morfologi Isolat Fungi Beauveria sp. 10
Kuantitas dan Kualitas DNA Hasil Isolasi 10
Hasil Amplifikasi Sekuen Internal Transcribed Spacer (ITS) 11
Sekuens DNA 12
Patogenitas Fungi Beauveria sp. terhadap N. lugens (S.) 13
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
LAMPIRAN 14
DAFTAR TABEL
1. Kemurnian DNA hasil isolasi dengan spektrofotometer nanodrop 7 2. Hasil identifikasi isolat Stgd 5(14)1 dan 7(14)2 8 3. Rerata persentase mortalitas dan LT50 hama N. lugens (S.) 9
DAFTAR GAMBAR
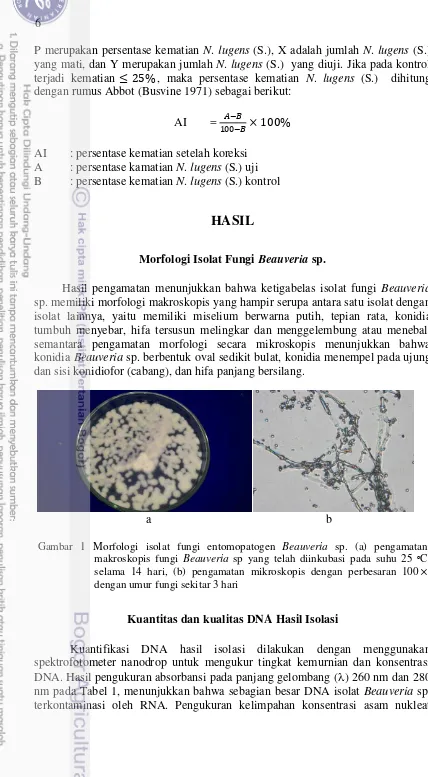
1. Morfologi isolat fungi entomopatogen Beauveria sp. 6
2. Elektroforegram DNA hasil isolasi 7
3. Amplikon DNA isolat fungi Beauveria sp. 8
4. Grafik mortalitas N. lugens (S.) 9
5. Diagram skematik gen rDNA 12
6. N. lugens (S.)yang mati akibat fungi Beauveria sp. 14
DAFTAR LAMPIRAN
1. Diagram alir penelitian 18
2. Hasil pembacaan urutan basa-basa nukleotida 19
3. Pohon filogenetik Beauveria sp. 20
4. Kerapatan larutan dari 9 isolat Beauveria sp. 21
5. Mortalitas hama N. lugens (S.) 22
6. Hasil uji mortalitas N. lugens (S.) 23
PENDAHULUAN
Serangan hama wereng batang cokelat atau Nilaparvata lugens Stal telah menyebabkan kerusakan areal persawahan lebih dari 100 hektar, dan terdapat persawahan yang mengalami puso seluas 3030 hektar (Litbang Pertanian 2005). Selama ini hama wereng batang cokelat dibasmi dengan menggunakan pestisida kimia. Menurut Djunaedy (2009), kebutuhan pestisida di Indonesia tiap tahunnya mencapai 6.33%, namun fakta di lapangan diperkirakan dapat mencapai lebih dari 10-20%. Dampak penggunaan pestisida kimia secara intensif yaitu dapat menyebabkan terjadinya resistensi hama target dan resurgensi (peristiwa meningkatnya populasi hama target yang lebih tinggi daripada tingkat populasi sebelumnya). Selain itu, pestisida kimia yang memiliki spektrum luas dapat membunuh hama non target seperti cacing, serangga bangkai, dan lebah yang merupakan organisme yang memiliki manfaat terhadap tanaman tersebut (Laba 2010). Bishnu et al. (2008) melaporkan bahwa tanah perkebunan teh di India yang menggunakan pestisida kimia mengalami penurunan yang signifikan terhadap jumlah mikroba tanah dibandingkan dengan tanah tanpa pestisida. Organisasi kesehatan dunia (WHO) memperkirakan setiap tahun terjadi sekitar 25 juta kasus keracunan pestisida atau sekitar 68.493 kasus setiap hari (Raini 2007).
Indonesia merupakan negeri yang kaya akan keanekaragaman hayatinya. Arinafril (2002) menyatakan bahwa terdapat 37.000 spesies flora asli Indonesia yang telah diidentifikasi, dan baru sekitar satu persen yang telah dimanfaatkan sebagai agen biopestisida. Biopestisida atau pestisida hayati merupakan pestisida yang menggunakan formulasi mikroba tertentu seperti fungi, bakteri, maupun virus yang bersifat antagonis terhadap serangga. Biopestisida ini memiliki kegunaan sebagai agen yang dapat mematikan, menghalau, serta menghambat perkembangan larva dan serangga hama tanaman tanpa mengakibatkan kerusakan lingkungan (Djunaedy 2009). Salah satu mikroorganisme yang dapat dijadikan sebagai agen pengendali serangan hama, yaitu fungi Beauveria sp.
Beauveria sp. merupakan salah satu jenis fungi entomopatogen, yaitu fungi yang dapat menyebabkan penyakit pada serangga serta tidak menimbulkan gangguan terhadap hewan maupun tumbuhan (Djunaedy 2009). Fungi Beauveria sp. telah dilaporkan dapat digunakan sebagai agen pengendali hama oleh Sheeba et al. (2001); Townsend et al. (2003); Bednarek et al. (2004); Thungrabeab dan Tongma (2007). Beauveria sp. memiliki jenis inang terbanyak di antara fungi entomopatogen lainnya, meliputi serangga dari ordo Lepidoptera, Coleoptera, Hemiptera, Diptera, dan Hymenoptera (Tanada dan Kaya 1993). Beauveria sp. dapat digunakan sebagai agen pengendali hama serangga karena memiliki aktivitas kitinase yang tinggi yang dapat menghidrolisis ikatan β -1,4-asetomido-2-deoksi-D-glikosida pada kitin dan oligomer kitin hama serangga (Bielka et al. 1984).
2
patogenitas terhadap N. lugens (S.) untuk mendapatkan isolat yang memiliki daya virulensi yang tinggi yaitu memiliki daya mortalitas yang tinggi dan memiliki lethal time (LT50) tercepat.
Penelitian ini diharapkan mampu memberikan kontribusi bagi upaya peningkatan hasil pertanian dalam mengatasi serangan hama N. lugens (S.) dengan memanfaatkan potensi isolat Beauveria sp. melalui formulasi dan optimasi produk biopestisida yang dapat digunakan sebagai pengganti pestisida kimia.
METODE
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini meliputi cawan Petri, jarum ose, labu Erlenmeyer 100, 500 dan 1000 mL, neraca analitik OHAUS GA 200, sudip, oven, laminar cabinet (laminar air flow), penangas Bunsen, rotary shaker, water bath, pengaduk magnet, pipet mikro 10, 100, dan 1000 μL, tip biru, tip kuning, tip putih, mesin PCR Esco, seperangkat alat elektroforesis (tray, comb, chamber, dan sumber arus listrik), tabung Eppendorf, microfuse 22R Beckman Coulter, mikroskop, lemari pendingin, komputer dengan program ChemDoc, dan haemocytometer.
Bahan-bahan yang digunakan adalah isolat-isolat Beauveria sp. asal Situ Gede yang sebelumnya telah dilakukan uji patogenitas dengan walang sangit yaitu Stgd 0113, Stgd 0213, Stgd 2(14)1, Stgd 2(14)2, Stgd 2(14)3, Stgd 4(14)1, Stgd 5(14)1, Stgd 5(14)2, Stgd 6(14)1, Stgd 6(14)2, Stgd 7(14)2, Stgd 8(4)2, Stgd 8(14)2, media potato dextrose agar (PDA), media sabouraud dextrose broth (SDB), akuades, akuabides, bufer CTAB: 2% CTAB; 20 mM EDTA; 0.1 M Tris-HCl; 1.4 M NaCl, 2-merkaptoetanol, kloroform:isoamil alkohol (24:1), kloroform:isopropanol (24:1), fenol: kloroform:isopropanol (25:24:1), etil alkohol 70%, parafilm, serbuk agarosa, bufer TAE 0.5×, loading dye, larutan etidium bromida (EtBr), primer ITS 1 (5’-TCC GTA GGT GAA CCT GCGGA-3’) dan ITS 4 (5’-TCC TCC GCT TAT TGA TATGC-3’), Kappa 2G Fast Ready Mix, dan marker 100 bp DNA ladder (Vivantis).
Prosedur Penelitian
Pembuatan media PDA (potato dextrose agar)
3 Peremajaan Isolat Beauveria sp.
Ketigabelas isolat Beauveria sp. diremajakan dengan cara memindahkan sebanyak 1-2 ose miselium ke dalam media PDA yang telah dibuat sebelumnya. Peremajaan ini dilakukan secara steril dalam ruang laminar. Isolat yang telah dipindahkan kemudian dibiarkan tumbuh selama kurang lebih 2-7 hari pada suhu ruang yaitu 25 0C sampai tumbuh miselia.
Pengamatan morfologi Beauveria sp.
Pengamatan secara makroskopis mengacu pada pedoman Bessey (1979) dan Samson et al. (1995), yang meliputi pengamatan warna koloni, bentuk koloni, tekstur koloni, dan bentuk tepian koloni, sedangkan pengamatan secara mikroskopis dilakukan dengan membuat preparat fungi. Biakan murni sel fungi dioleskan secara aseptis menggunakan jarum ose ke atas permukaan kaca preparat yang telah ditetesi akuades steril. Setelah itu, preparat ditutup dengan gelas penutup (cover glass) dan diamati dengan perbesaran rendah hingga tinggi (4 -100) menggunakan mikroskop (Pohan 2012). Pengamatan secara mikroskopis meliputi bentuk spora, konidia, dan hifa.
Perbanyakan Miselium untuk Ekstraksi DNA (Trizelia et al. 2012)
Konidia dipanen dari biakan fungi yang telah berumur 15 hari dan dipindahkan sebanyak 2 ose miselium ke dalam labu Erlenmeyer yang telah berisi 100 mL media cair sabouraud dextrose broth (SDB) (1L: 20 g dekstrosa, 10 g pepton, dan 2 g ekstrak khamir) (Goettel dan Inglish 1997), dan diinkubasi selama 4 hari pada rotary shaker dengan kecepatan 130 rpm pada suhu 25 ᵒC. Miselia dipanen dengan menggunakan kertas saring Whatman No. 2 dan dicuci dua kali dengan air suling, kemudian dikeringkan dengan oven dengan suhu 50 ᵒC selama semalam.
Ekstraksi DNA Fungi Beauveria sp. (Rogers & Benedich 1994)
Miselia fungi Beauveria sp. yang telah dikeringkan kemudian digerus dalam nitrogen cair dengan menggunakan mortar. Serbuk miselium dipindahkan ke dalam tabung Eppendorf dan ditambahkan 700 μL bufer ekstraksi (2% CTAB: 20 mM EDTA; 0.1 M Tris-HCl; 1.4 M NaCl pH 8.2; 2-merkaptoetanol = 100:1 (1%) yang telah diinkubasi selama 5 menit pada suhu 65 ᵒC, lalu divortek dan diinkubasi kembali selama 30 menit pada suhu 65 ᵒC sambil sesekali digoyang. Larutan kloroform:isoamil alkohol (24:1) ditambahkan sebanyak 400 μL dan divortek hingga lapisan air dan organik tercampur. Campuran tersebut disentrifugasi selama 10 menit dengan kecepatan 12.000 rpm, dan lapisan atas yang terbentuk dipindahkan sebanyak 500 μL dalam tabung Eppendorf baru dan ditambahkan 400 μL kloroform:isoamil alkohol (24:1).
4
Larutan fenol:kloroform:isoamil alkohol (25:24:1) ditambahkan sebanyak 300 μL dan divortek, lalu disentrifugasi selama 10 menit dengan kecepatan 13.000 rpm.
Lapisan atas dipindahkan sebanyak 500 μL kedalam tabung Eppendorf baru dan ditambahkan 500 μL iso-propanol dingin, kemudian dikocok dan diinkubasi selama 1 jam. Campuran tersebut disentrifugasi dengan kecepatan 10.000 rpm selama 5 menit, dan lapisan atas yang terbentuk dibuang dan pelet yang terbentuk dikering udarakan selama 1 jam. Pelet yang ada dicuci dengan etil alkohol 70% dingin sebanyak 1 mL dan disentrifugasi kembali selama 5 menit dengan kecepatan 12.000 rpm. Lapisan atas dibuang dan dikering udarakan selama 1 jam pada suhu ruang. Pelet yang terbentuk ditambahkan 30 μL bufer TE dan diresuspensi dengan tangan dan disimpan pada suhu 4 ᵒC.
Uji Kuantitatif DNA Hasil Isolasi dengan Spektrofotometer Nanodrop (Thermo Fisher Scientific 2008)
DNA Beauveria sp. yang telah diisolasi selanjutnya dilakukan kuantifikasi untuk mengukur konsentrasi dan kemurniaannya terhadap kontaminan (protein) menggunakan spektrofotometer nanodrop pada panjang gelombang 260 nm dan 280 nm. Langkah awal adalah mengatur program Spektrofotometer pada komputer, selanjutnya lubang optik dibersihkan terlebih dahulu dengan tissue, kemudian bufer TE diambil sebanyak 2 μL dan dimasukkan ke dalam lubang optik sebagai blanko. Setelah itu lubang optik dibersihkan kembali sebelum sampel dimasukkan. Sebanyak 1 μL sampel DNA dimasukkan ke dalam lubang optik dan dilakukan pembacaan pada panjang gelombang 260 nm dan 280 nm. Uji Kualitatif DNA Hasil Isolasi dengan Elektroforesis Gel Agarosa (Sambrook & Russel 2001)
Gel agarosa yang digunakan adalah 1% (1 gram serbuk agarosa dilarutkan dalam 100 mL bufer TAE 0.5×). Gel agarosa yang telah padat dipindahkan kedalam reservoir yang berisi bufer TAE 0.5×. Loading Dye dipipet sebanyak 1 μL dan diletakkan di atas kertas parafilm dan diresuspensi dengan DNA hasil isolasi sebanyak 2 μL. Campuran tersebut dimasukkan kedalam sumur gel agarosa. Proses elektroforesis dilakukan selama 30 menit dengan menggunakan arus 50 mA dan voltase 60 V. Gel agarosa diangkat dan direndam kedalam larutan Etidium Bromida (EtBr) selama 10 menit, dan direndam kembali dalam akuades selama 5 menit. Proses visualisasi dilakukan dengan menggunakan program ChemDoc.
5 untuk denaturasi pada suhu 95 oC dan dilanjutkan dengan 30 siklus untuk 1 menit denaturasi pada suhu 95 oC; 35 detik annealing (penempelan) pada suhu 55 oC; dan 30 detik elongasi pada suhu 72 oC. Selanjutnya DNA hasil amplifikasi divisualisasi dengan teknik elektroforesis pada gel agarosa konsentrasi 1.4%. Sekuensing DNA
Sekuensing DNA Beauveria sp. dilakukan di PT Bioneer Corporation Korea. Analisis sekuen internal transcribed spacer dilakukan dengan menggunakan program BlastN pada situs NCBI (www.ncbi.nlm.nih.gov/BLAST/). Dua sampel isolat fungi entomopatogen Beauveria sp. yang telah dipilih selanjutnya dianalisis tingkat homologinya dengan isolat Beauveris sp. lain yang terdapat di dalam database Gene Bank. Pembuatan pohon filogenetik dilakukan melalui program MEGA 5.1 untuk melihat kekerabatan kedua isolat tersebut. Uji Virulensi terhadap N. lugens (S.)
Penyiapan N. lugens (S.)
Hama N. lugens (S.) dikumpulkan dari kultur koleksi BB-BIOGEN. Hama tersebut dipelihara seperti pada habitat awalnya yaitu pada tanaman padi yang telah diberi sekat silinder plastik untuk mencegah kemungkinan lepasnya hama tersebut. Jumlah hama wereng batang cokelat yang dimasukkan kedalam 1 tanaman padi adalah sekitar 15 ekor, dengan ulangan perlakuan isolat sebanyak dua kali.
Penyiapan Suspensi Konidium (Budi et al. 2013)
Seluruh isolat fungi diperbanyak pada medium potato dextrose agar (PDA) dalam cawan Petri pada suhu 25 ᵒC selama 15 hari. Konidium fungi dipanen dengan cara menambahkan 10 mL akuades steril dan 0.1% Triton X100 sebagai bahan perata ke dalam cawan Petri dan konidia dilepas dari medium padat dengan kuas halus. Perhitungan kerapatan konidium digunakan alat haemocytometer. Suspensi konidia Beauveria sp. diambil sebanyak 1 mL dan dilakukan pengenceran hingga 10-2 lalu diteteskan pada bagian kotak perhitungan dan ditutup dengan gelas penutup.
Aplikasi Konidium Beauveria sp. terhadap N. lugens (S.)
Metode yang digunakan untuk menginfeksi N. lugens (S.) adalah dengan metode semprot yang mengacu pada metode Burgerjon (1956), sebagai perlakuan kontrol digunakan akuades dengan 0.1% Triton X100. Pengamatan kematian N. lugens (S.) akibat terinfeksi Beauveria sp. dilakukan setiap 24 jam sekali setelah perlakuan. Persentase kematian N. lugens (S.) dicatat.
Analisis Data
Data hasil percobaan diolah dan dianalisis dengan program Sirichai pada taraf nyata 5%. Penentuan nilai lethal time (LT50) dari perlakuan konidium isolat fungi Beauveria sp. dilakukan dengan menggunakan aplikasi analisis probit (Hsin 1997). Persentase kematian dihitung dengan menggunakan rumus sebagai berikut:
6
P merupakan persentase kematian N. lugens (S.), X adalah jumlah N. lugens (S.) yang mati, dan Y merupakan jumlah N. lugens (S.) yang diuji. Jika pada kontrol terjadi kematian , maka persentase kematian N. lugens (S.) dihitung dengan rumus Abbot (Busvine 1971) sebagai berikut:
AI =
AI : persentase kematian setelah koreksi A : persentase kamatian N. lugens (S.) uji B : persentase kematian N. lugens (S.) kontrol
HASIL
Morfologi Isolat Fungi Beauveria sp.
Hasil pengamatan menunjukkan bahwa ketigabelas isolat fungi Beauveria sp. memiliki morfologi makroskopis yang hampir serupa antara satu isolat dengan isolat lainnya, yaitu memiliki miselium berwarna putih, tepian rata, konidia tumbuh menyebar, hifa tersusun melingkar dan menggelembung atau menebal, semantara pengamatan morfologi secara mikroskopis menunjukkan bahwa konidia Beauveria sp. berbentuk oval sedikit bulat, konidia menempel pada ujung dan sisi konidiofor (cabang), dan hifa panjang bersilang.
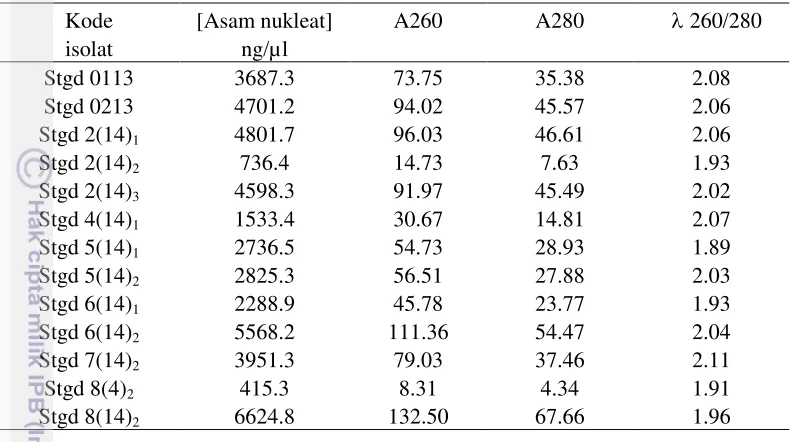
Kuantitas dan kualitas DNA Hasil Isolasi
Kuantifikasi DNA hasil isolasi dilakukan dengan menggunakan spektrofotometer nanodrop untuk mengukur tingkat kemurnian dan konsentrasi DNA. Hasil pengukuran absorbansi pada panjang gelombang () 260 nm dan 280 nm pada Tabel 1, menunjukkan bahwa sebagian besar DNA isolat Beauveria sp. terkontaminasi oleh RNA. Pengukuran kelimpahan konsentrasi asam nukleat
a b
7 setiap isolat menunjukkan nilai yang berbeda, dengan nilai konsentrasi terbesar dimiliki oleh isolat Stgd 8(14)2 yaitu sebesar 6624.8 ng/μL dan konsentrasi asam nukleat terendah pada isolat Stgd 8(4)2 sebesar 415.3 ng/μL.
Tabel 1 Kemurnian DNA hasil isolasi dengan spektrofotometer nanodrop Kode [Asam nukleat] A260 A280 260/280 isolat ng/µl
Stgd 0113 3687.3 73.75 35.38 2.08 Stgd 0213 4701.2 94.02 45.57 2.06 Stgd 2(14)1 4801.7 96.03 46.61 2.06 Stgd 2(14)2 736.4 14.73 7.63 1.93 Stgd 2(14)3 4598.3 91.97 45.49 2.02 Stgd 4(14)1 1533.4 30.67 14.81 2.07 Stgd 5(14)1 2736.5 54.73 28.93 1.89 Stgd 5(14)2 2825.3 56.51 27.88 2.03 Stgd 6(14)1 2288.9 45.78 23.77 1.93 Stgd 6(14)2 5568.2 111.36 54.47 2.04 Stgd 7(14)2 3951.3 79.03 37.46 2.11 Stgd 8(4)2 415.3 8.31 4.34 1.91 Stgd 8(14)2 6624.8 132.50 67.66 1.96
Pengujian DNA secara kualitatif dilakukan dengan menggunakan metode elektroforesis gel agarosa dengan konsentrasi gel sebesar 1%. Analisis elektroforesis ini bertujuan untuk menentukan keberhasilan isolasi DNA. Berdasarkan elektroforegram Gambar 2, seluruh isolat masih terkontaminasi oleh RNA. Isolat-isolat dengan kode Stgd 0113, Stgd 2(14)1, Stgd 2(14)2, dan Stgd 6(14)2 tampak memiliki pita DNA lebih dari satu.
Gambar 2 Elektroforegram DNA hasil isolasi. 1) isolat Stgd 0113; 2) isolat Stgd 0213; 3) isolat Stgd 2(14)1; 4) isolat Stgd 2(14)2; 5) isolat Stgd 2(14)3; 6) Stgd 4(14)1; 7) isolat Stgd 5(14)1; 8) isolat Stgd 5(14)2; 9) isolat Stgd 6(14)1; 10) isolat Stgd 6(14)2; 11) isolat Stgd 7(14)2; 12) isolat Stgd 8(4)2: 13) isolat Stgd 8(14)2.
Hasil Amplifikasi Sekuen Internal Transcribed Spacer (ITS)
8
dilihat dengan menggunakan teknik elektroforesis dengan konsentrasi gel agarosa sebesar 1.4%. Hasil amplifikasi pada Gambar 3 menunjukkan bahwa seluruh isolat menghasilkan pita DNA tunggal. Ukuran amplikon yang terbentuk berada pada sekitar 600 bp (base pairs), dengan tingkat ketebalan pita amplikon yang bervariasi.
Gambar 3 Amplikon DNA isolat fungi Beauveria sp. 1) isolat Stgd 0113; 2) isolat Stgd 0213; 3) isolat Stgd 2(14)1; 4) isolat Stgd 2(14)2; 5) isolat Stgd 2(14)3; 6) Stgd 4(14)1; 7) isolat Stgd 5(14)1; 8) isolat Stgd 5(14)2; 9) isolat Stgd 6(14)1; 10) isolat Stgd 6(14)2; 11) isolat Stgd 7(14)2; 12) isolat Stgd 8(4)2: 13) isolat Stgd 8(14)2.
Sekuens DNA
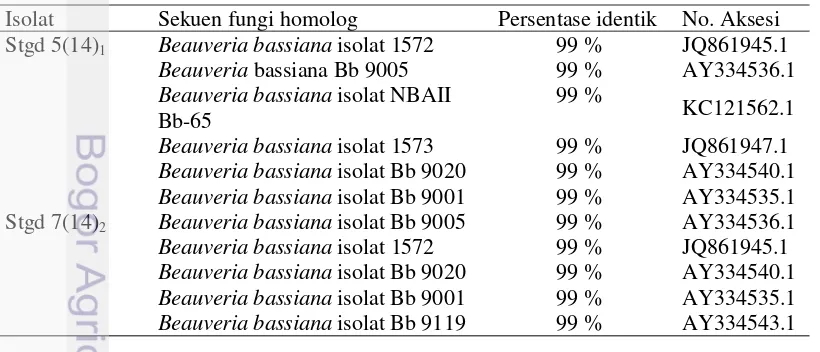
Hasil sekuensing DNA yang berupa urutan basa-basa nukleotida, kemudian dianalisis tingkat homologinya dengan menggunakan program BLAST nucleotide pada situs National Center for Biotechnology Information (NCBI). Analisis dengan program BLASTN bertujuan untuk membandingkan atau mensejajarkan dua sekuen atau lebih dengan database dalam gene bank. Hasil analisis pensejajaran isolat Stgd 5(14)1 dengan database menunjukkan bahwa isolat tersebut memiliki tingkat kemiripan sebesar 99% dengan Beauveria bassiana isolat no 1572 (JQ861945.1), sedangkan isolat Stgd 7(14)2 memiliki kemiripan sebesar 99% dengan Beauveria bassiana isolat Bb 9005 (AY334536.1).
Tabel 2 lanjutan Hasil identifikasi isolat STGD 7(14)2 600 bp
Tabel 2 Hasil identifikasi isolat Stgd 5(14)1 dan 7(14)2
Isolat Sekuen fungi homolog Persentase identik No. Aksesi Stgd 5(14)1 Beauveria bassiana isolat 1572 99 % JQ861945.1
Beauveria bassiana Bb 9005 99 % AY334536.1
Beauveria bassiana isolat NBAII Bb-65
99 %
KC121562.1
Beauveria bassiana isolat 1573 99 % JQ861947.1
Beauveria bassiana isolat Bb 9020 99 % AY334540.1
Beauveria bassiana isolat Bb 9001 99 % AY334535.1
Stgd 7(14)2 Beauveria bassiana isolat Bb 9005 99 % AY334536.1
Beauveria bassiana isolat 1572 99 % JQ861945.1
Beauveria bassiana isolat Bb 9020 99 % AY334540.1
Beauveria bassiana isolat Bb 9001 99 % AY334535.1
Beauveria bassiana isolat Bb 9119 99 % AY334543.1
9 Patogenitas Fungi Beauveria sp. terhadap N. lugens (S.)
Uji patogenitas isolat fungi Beauveria sp. terhadap N. lugens (S.) bertujuan untuk menentukan keefektifan isolat-isolat Beauveria sp. terhadap mortalitas hama N. lugens (S). Analisis statistik menunjukkan bahwa masing-masing isolat memiliki nilai mortalitas terhadap hama N. lugens (S.) yang berbeda nyata. Rerata persentase mortalitas pada Tabel 3 menunjukkan bahwa isolat Stgd 7(14)2 dan Stgd 8(4)2 merupakan isolat yang sangat virulen, dengan tingkat rerata mortalitas sebesar 100% pada hari keenam setelah aplikasi suspensi konidium. Isolat Stgd 0213 merupakan isolat yang memiliki daya virulensi yang terendah dengan rerata persentase mortalitas sebesar 67.50%. Isolat yang memiliki kemampuan untuk mematikan populasi N. lugens (S.) sebesar 50% dengan waktu yang cepat adalah isolat Stgd 5(14)2 dan Stgd 7(14)2. Tabel 3 Rerata persentase mortalitas dan LT50 N. lugens (S.)
No Isolat Rerata mortalitas
10
Kecepatan mortalitas N. lugens (S.) pada Gambar 4, menunjukkan bahwa rerata waktu yang dibutuhkan untuk dapat mematikan populasi 50% yaitu pada hari ke-3, sedangkan waktu yang dibutuhkan untuk dapat mematikan 90% populasi N. lugens (S.) yaitu pada hari ke-5 dan ke-6.
PEMBAHASAN
Morfologi Isolat Fungi Beauveria sp.
Morfologi makroskopis yang diamati menunjukkan bahwa isolat Beauveria sp. memiliki kemiripan antara satu isolat dengan isolat lainnya, yaitu memiliki miselium yang berwarna putih pada awal pertumbuhannya dan akan berangsur-angsur berwarna putih gading (sedikit kekuningan) pada bagian tepi pada fungi tua, dengan penampakan seperti tepung dan membentuk gelembung pada pangkalnya serta berkelompok. Pertumbuhan fungi ini sangat cepat.
Karakteristik morfologi secara mikroskopis yang diamati dibawah mikroskop dengan perbesaran 100×, menunjukkan kemiripan karakter dengan fungi Beauveria sp. yang diungkapkan oleh Steinhaus (1963) dan Tanada (1987) yaitu memiliki spora hialin berukuran 2-3 μm dengan bentuk bundar dan lebih kecil dari fusarium. Konidiofor berbentuk zig-zag dan pada ujungnya membentuk konidia. Konidia hialin berbentuk oval yang terdiri atas satu sel kering dan kecil menonjol. Konidia berukuran 2.0-2.5 mm sampai 2.0-3.0 μm. Konidia dihasilkan dalam bentuk simpodial dari sel-sel induk yang terhenti pada ujung konidiofor, dengan hifa yang berukuran 1-2 μm.
Kuantitas dan Kualitas DNA Hasil Isolasi
Isolasi DNA fungi Beauveria sp. dilakukan dengan menggunakan metode Cethyl Trimethyl Ammonium Bromide (CTAB) yang dikembangkan oleh Rogers dan Benedich (1994). CTAB berfungsi sebagai detergen yang dapat melisiskan membran sel dan mendenaturasi protein. Selain itu, bufer CTAB dapat memisahkan polisakarida dari asam nukleat yang disebabkan oleh perbedaan kelarutan kedua senyawa tersebut terhadap CTAB. Ketika CTAB ditambahkan ke dalam ekstrak tersebut, komplek asam nukleat-CTAB akan mengendap sedangkan karbohidrat, protein, dan komponen lainnya berada dalam supernatan (Bintang 2010).
11 DNA isolat dengan kode Stgd 2(14)2, Stgd 5(14)1, Stgd 6(14)1, Stgd 8(4)2, dan Stgd 8(14)2 dapat dinyatakan murni, karena masuk kedalam rentang nilai 1.8-2.0 (Tabel 1). Nilai kemurnian ini diperoleh karena metode yang digunakan bertujuan untuk mendapatkan DNA yang terbebas dari protein dengan memaksimalkan presipitasi DNA dengan menggunakan kloroform:isoamil alkohol secara berulang yakni dua kali (Mulyani et al. 2012).
DNA dengan kode isolat Stgd 0113, Stgd 0213, Stgd 2(14)1, Stgd 2(14)3, Stgd 4(14)1, Stgd 5(14)2, Stgd 6(14)2, dan Stgd 7(14)2 memiliki rasio absorbansi lebih dari 2, yang menunjukkan bahwa DNA terkontaminasi oleh RNA. Hal ini disebabkan oleh tidak diberikan penambahan enzim ribonuklease (RNAse) dalam isolasi DNA. Pengujian DNA secara kualitatif dilakukan dengan menggunakan teknik elektroforesis. Analisis elektroforesis digunakan untuk mengukur tingkat keberhasilan isolasi DNA. Konsentrasi gel agarosa yang digunakan yaitu 1%. Bintang (2010) mengungkapkan bahwa gel agarosa konsentrasi 1% memiliki struktur serat yang baik, ukuran pori yang besar, dan tahan terhadap gesekan. Elektroforegram yang ditunjukkan pada Gambar 2 menunjukkan bahwa DNA seluruh isolat terkontaminasi oleh RNA. Hal ini sesuai dengan hasil kuantitatif yang menunjukkan bahwa sebagian besar isolat terkontaminasi RNA, yang ditunjukkan oleh terbentuknya pita diskrit putih pada ujung gel.
Berdasarkan elektroforegram Gambar 2, isolat dengan kode Stgd 0113, Stgd 2(14)1, Stgd 2(14)2, dan Stgd 6(14)2 terlihat memiliki pita DNA lebih dari 1. Munculnya pita DNA lebih dari 1 ini diduga bahwa isolat tersebut tidaklah murni atau tercampur dengan isolat Beauveria sp. lainnya. Pemurnian isolat ini tidak dapat dilakukan karena penampakan morfologis makroskopis dari Beauveria sp. tidak dapat dibedakan antara satu isolat dengan isolat lainnya.
Hasil Amplifikasi Sekuen Internal Transcribed Spacer (ITS)
12
Hasil Amplifikasi subunit kecil DNA ribosomal sekuen ITS pada Gambar 3, menunjukkan bahwa seluruh isolat Beauveria sp. menghasilkan pita DNA tunggal yang berukuran sekitar 600 bp. Hal ini sesuai dengan penelitian Brasileiro et al. (2004) yang menyatakan bahwa primer universal ITS yang digunakan untuk mengamplifikasi DNA ribosomal dari segala spesies fungi akan menghasilkan fragmen spesifik yang berukuran diantara 400 hingga 900 bp, sedangkan Beeck et al. (2014) menyatakan bahwa lebar daerah ITS pada fungi biasanya berkisar pada panjang 500 dan 600 pasang basa (pb) untuk ascomycetes dan basidiomycetes. Ketebalan pita DNA hasil amplifikasi masing-masing isolat bervariasi, hal ini dikarenakan konsentrasi DNA yang digunakan juga berbeda yaitu sekitar 50-100 ng/μL. Innis et al. (1990) menyatakan bahwa konsentrasi DNA yang baik untuk PCR bekisar pada 10-100 ng/μL.
DNA hasil isolasi digunakan sebagai cetakan (template) untuk proses amplifikasi. DNA isolasi yang masih terkontaminasi RNA tidak akan mengganggu proses amplifikasi, karena RNA tidak dapat digunakan secara langsung sebagai cetakan untuk PCR dan membutuhkan tahapan transkripsi balik untuk membuat mRNA menjadi DNA komplementer (Hewajuli dan Dharmayanti 2014). Isolat-isolat yang memiliki pita DNA lebih dari 1, yaitu Stgd 0113, Stgd 2(14)1, Stgd 4(14)1, dan Stgd 6(14)2 menghasilkan 1 pola amplikon yang seukuran. Hal ini dimungkinkan isolat-isolat tersebut merupakan satu spesies namun memiliki strain yang berbeda
Sekuens DNA
Sekuensing DNA menggunakan metode berbasis PCR. Sekuensing sekuen internal transcribed spacer isolat Beauveria sp. dilakukan untuk mengetahui informasi taksonomi sampel berdasarkan basis data pada situs National Center of Biotechnology Information (NCBI). Hasil sekuensing yang berupa data urutan basa-basa nukleotida seperti yang terlampir pada Lampiran 2 selanjutnya dianalisis homologinya dengan program BLASTN. Fungsi dari pensejajaran basa nukleotida ini adalah membandingkan sekuen query dengan data pada gene bank. Isolat-isolat yang akan dilakukan sekuensing yaitu isolat Stgd 5(14)1 dan Stgd 7(14)2, dengan dasar pertimbangan bahwa isolat tersebut merupakan isolat dengan DNA yang murni atau hanya terdapat DNA tunggal saat isolasi DNA dan saat diamplifikasi menghasilkan pita DNA dengan kriteria yang baik yaitu ketebalan yang diperoleh cukup baik.
13 Berdasarkan hasil analisis homologi pada Tabel 2, isolat fungi dengan kode Stgd 5(14)1 dan Stgd 7(14)2 identik dengan fungi Beauveria bassiana dengan tingkat homologi sebesar 99% namun memiliki nomor kode isolat yang berbeda, yaitu isolat Stgd 5(14)1 identik dengan Beauveria bassiana isolat 1572 (JQ861945.1) dan Isolat Stgd 7(14)2 identik dengan Beauveria bassiana Bb 9005 (AY334536.1).
Hasil sekuen kedua isolat B. bassiana asal Situ Gede selanjutnya dianalisis kekerabatannya dengan data sekuen B.bassiana asal India (KC121562.1), Cina
( JQ861946.1), Colombia (AY334540.1), Palestina (JN713137.1), Argentina
(KF500409.1) serta dengan sepuluh spesies fungi lain dari data base NCBI. Hasil
analisis kekerabatan menggunakan pohon filogenetik dengan program MEGA 5.1 dapat dilihat pada Lampiran 3. B. bassiana isolat 1572 memiliki hubungan kekerabatan yang dekat dengan B. bassiana asal Colombia (AY334540.1),
sedangkan B. bassiana Bb 9005 memiliki hubungan kekerabatan yang dekat
dengan B. bassiana asal India (KC121562.1). Hubungan kekerabatan antara B.
bassiana isolat 1572 dan B. bassiana Bb 9005 menunjukkan bahwa kedua isolat
memiliki hubungan kekerabatan yang dekat, karena berada pada anak cabang yang sama. Dekatnya hubungan kekerabatan kedua isolat tersebut diduga karena berasal dari daerah yang sama. Selain itu, Trizelia et al. (2012) melaporkan bahwa keragaman genetik fungi Beauveria sp. dapat dipengaruhi oleh kisaran inang dan kondisi ekologis.
Patogenitas Fungi Beauveria sp. terhadap N. lugens (S.)
Patogenitas Beauveria sp terhadap N. lugens (S.) merupakan proses infeksi oleh fungi Beauveria sp. yang dapat menyebabkan penyakit hingga kematian pada hama N. lugens (S.). Tujuan dilakukannya uji patogenitas ini yaitu untuk menentukan isolat-isolat Beauveria sp. yang virulen terhadap hama N. lugens (S.). Berdasarkan hasil uji patogenitas pada Tabel 3, seluruh isolat memiliki rerata mortalitas yang berbeda nyata terhadap hama N. lugens (S.) berdasarkan analisis statistika. Isolat dengan kode Stgd 7(14)2 dan Stgd 8(4)2merupakan isolat yang sangat virulen karena dapat meyebabkan tingkat kematian sebesar 100% pada hari keenam setelah aplikasi konidium, sedangkan isolat dengan kode Stgd 0213 merupakan isolat dengan daya virulensi terendah. Isolat-isolat yang memiliki kemampuan untuk mematikan populasi sebesar 50% dengan waktu yang cepat adalah isolat Stgd 5(14)2 dan Stgd 7(14)2 dengan waktu 2.77 hari dan 2.86 hari.
Hasil pengamatan di lapangan menunjukkan bahwa tanda awal kematian N. lugens (S.) adalah tubuh yang kaku serta warna tubuhnya menjadi pucat (warna awal cokelat), sehingga data mortalitas N. lugens (S.) sudah dapat teramati sejak hari ke-1 setelah aplikasi suspensi konidium. Data kematian N. lugens (S.) dapat dilihat pada Lampiran 5. Proses mortalitas N. lugens (S.) berlangsung relatif singkat yaitu sejak hari ke-1 hingga hari ke-6. Hal yang sama diungkapkan oleh Indriyati (2009), yaitu setelah aplikasi konidium proses mortalitas serangga berlangsung dalam jangka waktu yang pendek (hari ke-3 hingga hari ke-5).
14
suspensi yang digunakan mengandung konidia sebesar . Selain itu, kemampuan patogen dalam menginfeksi serangga inang ditentukan oleh tiga faktor yaitu patogen, inang atau serangga dan lingkungan (Inglis et al. 2001). Trizelia et al. (2007) menyatakan bahwa cara aplikasi dan dosis patogen yang diberikan juga dapat mempengaruhi mortalitas serangga tersebut. Faktor fisiologi dan morfologi inang juga berpengaruh terhadap kerentanan serangga terhadap jamur entomopatogen.
Mekanisme infeksi serangga hama yaitu, fungi Beauveria bassiana ini memproduksi senyawa beauvericin dan senyawa bioaktif lain berupa mikotoksin yang dapat merusak fungsi hemolimfa dan inti sel serangga inang melalui kontak fisik, yaitu dengan penempelan konidia pada integumen. Konidia yang menempel ini akan berkecambah selama 1-2 hari dan akan tumbuh miselia didalam tubuh inang. Serangga yang terinfeksi akan berhenti makan sehingga imunitas akan menurun, dalam kurun waktu 3-5 hari serangga akan mati dan terlihat pertumbuhan konidia pada integumen (Deciyanto dan Indrayani 2008).
Gambar 6 N. lugens (S.)yang mati akibat fungi Beauveria sp.
SIMPULAN DAN SARAN
Simpulan
Identifikasi isolat Beauveria sp. dengan analisis sekuen internal transcribed spacer membuktikan bahwa isolat tersebut memiliki tingkat homologi sebesar 99% dengan Beauveria bassiana. Isolat dengan kode Stgd 5(14)1 identik dengan Beauveria bassiana no 1572 dan isolat Stgd 7(14)2 identik dengan B. bassiana isolat Bb 9005. Hasil analisis kekerabatan membuktikan bahwa kedua isolat tersebut memiliki hubungan kekerabatan yang cukup dekat. Isolat dengan kode Stgd 8(4)2 dan Stgd 7(14)2 merupakan isolat yang virulen terhadap hama N. lugens (S.) dengan tingkat mortalitas sebesar 100%. Nilai lethal time (LT50) yang cepat dimiliki oleh isolat B. bassiana Bb 9005 dan isolat Stgd 5(14)2.
Saran
Perlu dilakukan analisis kandungan senyawa bioaktif pada fungi Beauveria bassiana yang menyebabkan patogenitas terhadap hama target. Serta perlu dilakukannya pengujian patogenitas terhadap serangga dari ordo lain dengan memakai variasi konsentrasi konidium.
15
DAFTAR PUSTAKA
Arinafril. 2002. Ekstrak tanaman untuk atasi hama [Ulasan]. Palembang (ID): Unsri Press.
Bednarek AE, Popowska N, Pezowicz E, Kamionek M. 2004. Integrated methods in pest control: effect of insecticides on entomopathogenic fungi Beauveria bassiana (Bals.) Vuill., B. brongniartii (Sacc.), and nematodes (Heterorhabditis megidis Poinar, Jackson, Klein, Steinernema feltiae Filipjev, S. glaseri Steiner). Polish J Ecol. 52(2): 223-228.
Beeck MOD, Lievens B, Busschaert P, Declerk S, Vanronsveld J, Colpaert JV. 2014. Comparison and validation of some ITS primer pairs for fungal metabarcoding studies. J Pone. 9(6): e97629.
Bessey EA. 1979. Morphology and Taxonomy of Fungi. Edisi ke-3. New Delhi: Vikas Publishing House PVT LTD.
Bielka H, Dixon HB, Karlson P, Liebeeg C, Sharon N, Van Lenten FJ, Velix SF, Vligenhart JFG, DAN Webb EC. 1984. Enzyme Nomenclature. Ney York (US): Academic Press.
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta (ID): Erlangga.
Bhisnu A, Chakrabarti K, Chakraborty A, Saha T. 2008. Pesticide residue level in tea ecosystems of hills and dooars region of west Bengal, India. Envron Monit Ass. 149: 64-457.
Budi AS, Afandhi A, Puspitarini RD. 2013. Patogenitas jamur entomopatogen Beauveria bassiana (Deuteromycetes : moniliales) pada larva Spedoptera litura Fabricus (Lepidoptera: Noctuidae). JHPT. 1(1):57-65.
Burgerjon A. 1956. Pulverisation et poudrage au laboratoire par des preparations pathogenes insecticides. Ann Epiphyties. 4: 677-686.
Busvine JR. 1971. Techniques for Testing Insecticides. The Commonwealth Institute of entomology 56 Queens. Gate, London S. W. 7. 334 hlm.
Brasileiro BT, Coimbra MR, Morais MA, Oliveira NT. 2004. Genetic variability within fusarium solani specie as revealed by pcr-fingerprinting based on pcr markers. Brazilian J Microbiol. 35:205-210 ISSN 1517-8382.
Deciyanto S, Indrayani IGA. 2008. Jamur entomopatogen Beauveria bassiana: potensi dan prospeknya dalam pengendalian hama tungau. Perspektif. 8(2): 65-73.
Djunaedy A. 2009. Biopestisida sebagai agen pengendali organisme pengganggu tanaman (OPT) yang ramah lingkungan. Embryo. 6(1):88-95.
Ekasari TWD, Retnoningsih A, Widianti T. 2012. Analisis keanekaragaman kultivar pisang menggunakan penanda PCR-RFLP pada internal transcribed spacer (ITS) DNA ribosom. JMIPA. 35(1): 21-29.
Griffin MR. 2007. Beauveria bassiana, a cotton endophyte with biocontrol activity against seeding disease. [Disertasi Ph. D]. Knoxville: The University of Tennesse.
Hendra W, Pohan HG. 2009. Kajian teknis standar minyak buah merah (Pondanus conoideus Lam.). Prosiding PPI Standardisasi. Jakarta. 19 November 2009. Hewajuli DA, Dharmayanti NLP. 2014. Perkembangan teknologi reverse
16
influenza dan newcastle disease [ulasan]. Balai Besar Penelitian Veteriner, siap terbit.
Hsin C. 1997. Probit Analysis. Taiwan: National Chung Hsing University.
Indriyati. 2009. Virulensi jamur entomopatogen Beauveria bassiana (Balsamo) Vuillemin (Deuteromycotina : Hyphmocetes) terhadap kutu daun (Aphis spp.) dan kepik hijau (Neazaraviridula). JHPT. 9(2): 92-98. ISSN 1411-7525.
Inglis GD, Goettel MS, Butt TM, Strasser H. 2001. Use of hypomycetous fungi for managing insect pest. In: Butt TM, Jackson CW, dan Magan N. (Eds). Fungi as Biocontrol Agents, Progress, Problems, and Potential. London (UK): CABI Publishing.
Innis M, Gelfand D, Sninsky D, White T. 1990. PCR-protocols. London (UK): Academy Press.
Khosravinia H, Murthy HNN, Prasad DT, Pirany N. 2007. Optimizing factors influencing DNA extraction from fresh whole avian blood. African J Biotech. 6(4): 481-486.
Laba IW. 2010. Analisis empiris penggunaan insektisida menuju pertanian berkelanjutan. Naskah disarikan dari bahan Orasi Profesor Riset Bogor. Pengembangan Inovasi Pertanian. 3: 120-137.
[Litbang Pertanian] Badan Penelitian dan Pengembangan Pertanian. 2005. Serangan hama wereng batang cokelat (WBC) di Jawa Tengah [Internet]. 16
Murray RK, Granner DK, Mayes PA, Rodwell VW. 2003. Biokimia Harper. Edisi 25. Jakarta: EGC.
Raini M. 2007. Toksikologi pestisida dan penanganan akibat keracunan pestisida [Ulasan]. Media Litbang Kesehatan. 17(3): 10-18.
Pohan A. 2012. Mikologi. Surabaya (ID) : Unair Pr.
Rakhmana S, Saryono, Titania T, Nugroho. 2015. Ekstraksi DNA dan amplifikasi rDNA isolat fungi endofit LBKURCC67 umbi tanaman dahlia (Dahlia variabilis). JOM FMIPA. 2(1): 2015.
Rogers SO, Benedich AJ. 1994. Extraction of total cellular DNA from plants, alga, and fungi. Plant Mol. Manual, D1, 1-8.
Sambrook, Russell. 2001. Molecular Cloning 3th edition. New York: Cold Spring Harbor Laboratory Press.
Samson RA, Hoekstra ES, Frisvad JC, Filtenborg O. 1995. Introduction to Food Borne Fungi. Ed 4. Netherlands : Ponsen &Looyen.
Sheeba GS, Seshadri N, Raja S, Janarthanan, Ignacimutu S. 2001. Efficacy of Beauveria bassiana for control of the rice weevil Sitophilus oryzae (L.) (Coleoptera:Curculionidae). Appl Entomol Zool. 36(1): 117-120.
Steinhaus EA. 1963. Insect Pathology. New York (US): Academic Press.
Tanada Y, Kaya HK. 1993. Insect Pathology. New York: San Diego Academic Press, INC. Harcourt Brace Jovanovich, Publisher.
Tanada Y. 1987. Insect Pathology. New York (US): Academic Press.
17 Thungrabeab M, Tongma S. 2007. Effect of enthomopatogenic fungi, Beauveria bassiana (Balsamo) and Metarhizium anisopliae (Metschnikoff) on non target insect. J Tech. 7(1): 8-12.
Townsend RJ, O’Callaghan VW, Johnson, Jackson. 2003. Compatibility of microbial control agents Serratia entomophilia and Beuaveria bassiana with selected fertilizers. New Zealand Plant Protection. 56: 118-122.
Trizelia, Santosos T, Sosromarsono S, Rauf A, Sudirman AI. 2007. Patogentitas jamur entomopatogen Beauveria bassiana (Deuteromycotina:Hypomycetes) dan virulensinya terhadap Crocidolomia pavonana. JPIP. 11(1): 52-59.
Trizelia, Santoso T, Sosromarsono S, Rauf A, Sudirman AI. 2012. Keragaman genetik berbagai isolat Beauveria bassiana (Bals.) Vuill. (Deuteromycotina: Hypomycetes) dan virulensinya terhadap Crocidolomia pavonana. J Natur Indones. 14(3): 176-183.
18
Peremajaan isolat Beauveria sp,
Pengamatan morfologi Beauveria sp.
Uji Kuantitas dan Kualitatif DNA genomik : Spektrofotometer nanodrop
dan Elektroforesis gel agarosa
Amplifikasi DNA dengan PCR
Elektroforesis Hasil Amplifikasi PCR
Sekuensing DNA
Analisis homologi dengan program BLASTN
Penyiapan suspensi konidium Penghitungan jumlah spora per mL
Aplikasi suspensi konidium terhadap N. lugens (S.)
Analisis statistik Lampiran 1 Diagram alir penelitian
Isolasi DNA genom
19 Lampiran 2 Hasil pembacaan urutan basa-basa nukleotida
a. Isolat 5(14)1 dengan primer ITS 1 dan ITS 4
GGGGGGGGGGGACGGACCGGATATCTCCCTGATTCGGGTCACGTTCAG AAGTTGGGTGTTTTACGGCGTGGCCGCGTCGGGGTTCCGGTGCGAGCT GTATTACTACGCAGAGGTCGCCGCGGACGGGCCGCCACTCCATTTCAG GGCCGGCGGTGTGCTGCCGGTCCCCAACGCCGACCTCCCCCAGGGGAG GTCGAGGGTTGAAATGACGCTCGAACAGGCATGCCCGCCAGAATGCT GGCGGGCGCAATGTGCGTTCAAAGATTCGATGATTCACTGGATTCTGC AATTCACATTACTTATCGCATTTCGCTGCGTTCTTCATCGATGCCAGAG CCAAGAGATCCGTTGTTGAAAGTTTTGATTCATTTGTTTTGCCTTGCGG CGTATTCAGAAGATGCTGGAATACAAGAGTTTGAGGTCCCCGGCGGGC CGCTGGTCCAGTCCGCGTCCGGGCTGGGGCGAGTCCGCCGAAGCAACG ATAGGTAGGTTCACAGAAGGGTTAGGGAGTTGAAAACTCGGTAATGA TCCCTCCGCAGGTTCACCTACGGAAGT
b. Isolat 7(14)2 dengan primer ITS 1 dan ITS 4
20
21 Lampiran 4 Kerapatan larutan dari 9 isolat Beauveria sp.
Sampel Kerapatan konidia per mL larutan
Stgd 0113
Stgd 0213
Stgd 2(14)1
Stgd 2(14)2
Stgd 5(14)2
Stgd 6(14)1
Stgd 7(14)2
Stgd 8(4)2
Stgd 8(14)2
Contoh perhitnugan: Luas kotak kecil
L = V = = =
= 0.0025 mm2 = 0.00025 mm3
1 mL = 1 cm3 = 0.0025 mm3 = 0.00000025 cm3
Jumlah sel per mL dalam 1 kotak kecil =
isolat 0113 ulangan1
= = jumlah sel
22
Lampiran 5 Mortalitas hama N. lugens (S.)
23 Lampiran 6 Hasil uji mortalitas N. lugens (S.)
Perlakuan Persentase mortalitas Persentase mortalitas terkoreski Ulangan 1 Ulangan 2 Rataan Ulangan 1 Ulangan 2 Rataan Kontrol 26.67 26.67 26.67 0.00 0.00 0.00 Stgd 0113 100.00 86.67 93.33 100.00 81.00 90.50 Stgd 0213 93.33 60.00 76.66 90.00 45.00 67.50 Stgd 2(14)1 100.00 93.33 96.66 100.00 90.00 95.00 Stgd 2(14)2 86.67 93.33 90.00 81.00 90.00 85.00 Stgd 5(14)2 86.67 100.00 93.33 81.00 100.00 90.50 Stgd 6(14)1 86.67 100.00 93.33 81.00 100.00 90.50 Stgd 7(14)2 100.00 100.00 100.00 100.00 100.00 100.00
Stgd 8(4)2 100.00 100.00 100.00 100.00 100.00 100.00 Stgd 8(14)2 100.00 80.00 90.00 100.00 72.00 86.00
Contoh isolat Stgd 0213 ulangan 1:
% mortalitas =
=
Koreksi data ( bila pada kontrol terjadi kematian jumlah N. lugens (S.) ) AI =
AI : persentase kematian setelah koreksi A : persentase kamatian N. lugens (S.) uji B : persentase kematian N. lugens (S.) kontrol % mortalitas terkoreksi =
24
Sirichai Statistics Version 6.00 :
Problem Identification: Procedure : Analysis of Variance I --- Table.... Analysis of Variance
Source df SS MS F F.05 F.01 F-Prob Treatment 9 15950.4500 1772.2722 8.70 3.02 4.94 0.0015 Ex.Error 10 2036.5000 203.6500
Total 19 17986.9500 946.6816 GRAND MEAN = 80.55
CV = 17,7164 % LSD .05 = 31.7948948983952 LSD .01 = 45.2235286952489
DUNCAN'S MULTIPLE-RANGE TEST PROBLEM IDENTIFICATION NUMBER OF MEANS= 10 ERROR DEGREE OF FREEDOM= 10 ERROR MEAN SQUARE= 203.65 STANDARD ERROR OF MEAN= 10.090837428083
Treatment Mean ranked at probability level .05 Stgd 7(14)2 100.0000 a
Stgd 8(4)2 100.0000 a Stgd 2(14)1 95.0000 a
Stgd 0113 90.5000 a Stgd 6(14)1 90.5000 a Stgd 5(14)2 90.5000 a Stgd 8(14)2 86.0000 a Stgd 2(14)2 85.5000 a Stgd 0213 67.5000 a
Kontrol 0.0000 b
26
Lanjutan Analisis probit lethal time N. lugens (S.)
Isolat Hari Log hari Populasi Respon Resp/pop
Stgd 8(4)2 4.00000 0.602060 30 20 0.667
5.00000 0.698970 30 29 0.967
6.00000 0.778151 30 30 1.000
Stgd 8(14)2 1.00000 0.000000 30 0 0.000
2.00000 0.301030 30 7 0.233
3.00000 0.477121 30 13 0.433
4.00000 0.602060 30 24 0.800
5.00000 0.698970 30 27 0.900
6.00000 0.778151 30 27 0.900
Intercepts and slopes unconstrained. Preparation isolat ( Stgd 0113) Not estimating natural response
Maximum log-likelihood -84.753169
parameter standard error t ratio
is1 -1.9919821 0.31299603 -6.3642407 SLOPE 4.0636787 0.55699224 7.2957547 Variance-Covariance matrix
Isolat Stgd 0113 SLOPE Isolat Stgd 0113 0.9796651E-01 -0.1631441 SLOPE - 0.1631441 0.3102404 Chi-squared goodness of fit test
Isolat Populasi Respon Nilai harapan Deviasi Probabilitas
Stgd 0113 30 1.000 0.696 0.304 0.023187
30 7.000 6.631 0.369 0.221038
30 13.000 14.365 - 1.365 0.478820
30 20.000 20.259 - 0.259 0.675300
30 23.000 24.057 - 1.057 0.801894
30 28.000 26.371 1.629 0.879035
chi-square 1.4878 degrees of freedom 4 heterogeneity .37 Index of significance for potency estimation:
g(.90)= 0.05083 g(.95) = 0.07217 g(.99)= 0.12465
Lethal Time Waktu Batas 0.90 0.95 0.99
LT50 3.09166 Bawah 2.76479 2.69905 2.56440
Atas 3.42689 3.49642 3.64115
LT90 6.39086 Bawah 5.49314 5.36143 5.12928
27
RIWAYAT HIDUP
Penulis dilahirkan di Madiun, Jawa Timur pada tanggal 06 April 1993 dari ayah bernama Didik Indarto dan Ibu bernama Tri Rahayu Ningtyas. Penulis merupakan anak kedua dari tiga bersaudara. Tahun 2011 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMAN 03 Kab. Tangerang, Provinsi Banten dan di tahun yang sama penulis lolos seleksi masuk PTN Institut Pertanian Bogor (IPB) melalui jalur SNMPTN undangan dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama di bangku perkuliahan, penulis menjadi asisten praktikum Mikrobiologi Dasar pada tahun ajaran 2014/2015 dan asisten praktikum Biokimia Umum di tahun yang sama. Penulis juga pernah aktif dalam kegiatan organisasi diantaranya sebagai sekretaris divisi Company UKM FORCES periode 2013/2014 kemudian sebagai staff Departemen Sains dan Teknologi (SAINSTEK) Badan Eksekutif Mahasiswa (BEM) FMIPA periode 2013/2014.