KEMUNDURAN MUTU UDANG PUTIH: ORGANOLEPTIK,
BLACKSPOT, HISTOLOGIS, DAN ENZIMATIS
SONYA AYU UTARI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul “Kemunduran Mutu Udang Putih: Organoleptik, Blackspot, Histologis, dan Enzimatis” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
SONYA AYU UTARI. Kemunduran Mutu Udang Putih: Organoleptik, Blackspot, Histologis, dan Enzimatis. Dibimbing oleh TATI NURHAYATI dan AGOES MARDIONO JACOEB.
Udang putih (Litopenaeus vannamei) memiliki proses kemunduran mutu yang sangat cepat, karena luas permukaan tubuh udang yang lebih kecil dibandingkan dengan ikan. Tujuan penelitian ini adalah untuk menentukan kemunduran mutu secara organoleptik, blackspot, histologi, dan aktivitas enzim katepsin. Hasil organoleptik fase pre rigor udang terjadi pada penyimpanan hari 0 sampai hari 2, rigor mortis terjadi pada penyimpanan hari 3 sampai hari ke-11, post rigor terjadi pada penyimpanan hari ke-12 sampai hari ke-17, dan deteriorasi terjadi pada penyimpanan lebih dari hari ke-18. Kenampakan awal munculnya blackspot terdapat pada cephalothorax dan pereiopod. Hasil histologi menunjukkan serabut otot pre rigor terlihat kompak dan padat, serabut otot pada rigor mortis mulai mengalami pengerutan, dan serabut otot pada post rigor mengalami pengerutan sehingga membentuk ruang kosong. Nilai aktivitas enzim katepsin paling besar terjadi pada fase rigor mortis.
Kata kunci: Blackspot, enzim katepsin, histologi, kemunduran mutu Litopenaeus vannamei.
ABSTRACT
SONYA AYU UTARI. Degradation on White Shrimp: Organoleptic, Blackspot, Histologic, and Enzymatic. Supervised by TATI NURHAYATI and AGOES MARDIONO JACOEB.
White shrimp (Litopenaeus vannamei) has a short term degradation because its surface area is tinier than fish. The aim of this research to determine the degradation process by organoleptic, blackspot, histologic, and enzymatic activities of catepsine. The result of organoleptic that pre rigor phase in shrimp happened for 0-2 days, rigor mortis happened for 3-11 days, post rigor happened for 12-17 days, and deterioration happened more than 18 days after incubation. The blackspot had started to cephalothorax and pereiopod. The result of histology shows that the muscle fibers in pre rigor still looked compact and dense, the muscle fibers in rigor mortis began shrinkage, the muscle fibers in rigor mortis shrinkage caused empty space. The biggest value of enzymatic activities for catepsin happened at rigor mortis phase.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
KEMUNDURAN MUTU UDANG PUTIH: ORGANOLEPTIK,
BLACKSPOT, HISTOLOGIS, DAN ENZIMATIS
SONYA AYU UTARI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul : Kemunduran Mutu Udang Putih: Organoleptik, Blackspot, Histologis, dan Enzimatis
Nama : Sonya Ayu Utari
NIM : C34100025
Progam Studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Tati Nurhayati, SPi MSi Pembimbing I
Dr Ir Agoes M Jacoeb, Dipl-Biol Pembimbing II
Diketahui oleh
Dr Ir Joko Santoso, MSi Ketua Departemen
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada kehadirat Allah SWT yang telah memberikan rahmat, berkat, dan hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Kemunduran Mutu Udang Putih: Organoleptik, Blackspot, Histologis, dan Enzimatis”, sebagai salah satu syarat untuk menyelesaikan pendidikan Sarjana Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penelitian ini di danai melalui hibah penelitian unggulan perguruan tinggi tahun 2013 dengan judul “Isolasi, Pemurnian, dan Karakterisasi Inhibitor Polyphenoloxidase Alami sebagai Penghambat Pembentukan Blackspot pada Udang” melalui Dr Tati Nurhayati, SPi MSi.
Penulis ucapkan terima kasih kepada Dr Tati Nurhayati, SPi MSi dan Dr Ir Agoes Mardiono Jacoeb, Dipl-Biol selaku pembimbing yang telah banyak memberikan pengarahan, serta Prof Dr Ir Nurjanah, MS selaku dosen penguji sidang akhir skripsi. Penghargaan penulis sampaikan kepada Bapak Ranta dari Laboratorium Kesehatan Ikan (Departemen Budidaya Perairan), Bapak Saeful dari Laboratorium Karakterisasi Bahan Baku Hasil Perairan (Departemen Teknologi Hasil Perairan), Ibu Ria dari Laboratorium Terpadu (Fakultas Kedokteran Hewan), dan Pusat Studi Biofarmaka. Ungkapan terimakasih juga disampaikan kepada ayah, ibu, adik, serta keluarga besar THP 47.
Semoga tulisan ini bermanfaat bagi semua pihak.
DAFTAR ISI
Pengukuran Aktivitas Enzim Katepsin ... 6
HASIL DAN PEMBAHASAN ... 7
Kemunduran Mutu Udang : Organoleptik ... 7
Kemunduran Mutu Udang : Blackspot ... 10
Kemunduran Mutu Udang : Histologi ... 13
Kemunduran Mutu Udang : Enzimatik ... 16
DAFTAR TABEL
1 Prosedur pengukuran aktivitas enzim katepsin ... 7
2 Hasil organoleptik kemunduran mutu udang ... 8
DAFTAR GAMBAR
1 Diagram alir prosedur penelitian ... 4
2 Kemunduran mutu udang secara organoleptik ... 8
3 Udang pada masing-masing fase kemunduran mutu ... 10
4 Mata udang jam ke-0 ... 12
10 Cephalothorax udang jam ke-72 ... 12
11 Abdomen udang jam ke-0 ... 13
18 Kondisi histologi daging udang putih pada fase pre rigor (4x10) ... 15
19 Kondisi histologi daging udang putih pada fase pre rigor (10x10) ... 15
20 Karapas pada fase pre rigor (10x10) ... 15
21 Kondisi histologi daging udang putih pada fase rigor mortis (4x10) ... 16
22 Kondisi histologi daging udang putih pada fase rigor mortis (10x10) ... 16
23 Kondisi histologi daging udang putih pada fase post rigor (10x10) ... 16
24 Kondisi histologi daging udang putih pada fase post rigor (40x10) ... 16
25 Karapas pada fase post rigor (10x10)... 16
26 Hasil pengukuran aktivitas enzim katepsin udang selama kemunduran mutu ... 17
DAFTAR LAMPIRAN
1 Lembar penilaian organoleptik udang segar ... 222 Diagram alir pengujian histologi daging dan karapas udang ... 23
3 Diagram alir ekstraksi enzim katepsin ... 24
PENDAHULUAN
Latar Belakang
Potensi perikanan di Indonesia sangat besar. Hal ini dipengaruhi oleh wilayah Indonesia yang sebagian besar adalah lautan. Kegiatan penangkapan tidak mampu memenuhi kebutuhan akan produksi perikanan sehingga dibutuhkan adanya kegiatan budidaya. Produksi perikanan budidaya pada tahun 2006 didominasi oleh udang sebesar 327.260 ton, rumput laut sebesar 1.079.850 ton, ikan mas sebesar 285.250 ton, ikan bandeng sebesar 269.530 ton, dan ikan nila sebesar 227.000 ton (BRKP 2007). Salah satu hasil budidaya yang banyak diminati adalah udang putih (Litopenaeus vannamei). Hal ini dapat ditunjukkan dengan produksi udang tahun 2012 sebesar 529 ribu ton yang menjadi 608 ribu ton pada tahun 2013 (KKP 2013).
Udang memiliki proses kemunduran mutu yang lebih cepat jika dibandingkan dengan ikan, karena luas permukaan tubuh udang yang lebih kecil dibandingkan dengan ikan. Ciri khusus yang dimiliki udang saat kemunduraan mutu yaitu adanya blackspot. Laju penyebaran blackspot pada udang akan bertambah seiring dengan waktu penyimpanan. Penyebaran blackspot ini dapat dijadikan parameter dalam kemunduran mutu udang. Proses kemunduran mutu juga dapat disebabkan oleh proses autolisis (enzimatis dan kimiawi), proses oksidasi, proses bakteriologis, dan akibat proses dehidrasi (Nurjanah et al. 2011). Proses kemunduran mutu secara kimiawi dapat dilihat melalui nilai pH dan total volatile base (TVB). Proses kemunduran mutu secara bakteriologis dapat dilihat dengan metode total plate count (TPC).
Pengamatan kemunduran mutu dilakukan dengan mengamati perubahan kondisi fisik udang pada setiap fase. Fase yang diamati antara lain fase pre rigor, rigor mortis, dan post rigor. Fase kemunduran mutu tersebut ditentukan melalui organoleptik. Tumbuhnya blackspot pada udang merupakan ciri khusus ketika udang mengalami kemunduran mutu. Hal ini dapat diamati melalui pengamatan menggunakan Stereoskop. Kerusakan pada jaringan tubuh udang dapat diamati secara mikroskopis yaitu melalui histologi. Histologi adalah ilmu yang mempelajari struktur dari hewan dan hubungan antara pengorganisasian sel dan jaringan serta fungsi-fungsi yang dilakukannya (Hartono 1989).
Proses kemunduran mutu secara enzimatis terjadi dengan menguraikan senyawa-senyawa kimia yang terdapat pada jaringan tubuh udang. Enzim dapat dikatakan memicu kebusukan udang secara alami di dalam badan udang. wSalah satu enzim tersebut yaitu enzim katepsin. Enzim katepsin merupakan enzim yang banyak terdapat pada lisosom sel dan mendegradasi protein miofibril (Jiang 2000).
Penelitian mengenai kemunduran mutu udang telah banyak dilakukan. Pornrat et al. (2007) mengamati perubahan tekstur dan struktur udang galah (Macrobrachium rosenbergii) pada suhu 5 oC selama 14 hari penyimpanan dan hasil dari pengamatan tersebut menunjukkan terjadi perubahan struktur mikroskopik pada miofibril selama waktu penyimpanan. Zamorano et al. (2009) mengamati penyebaran melanosis pada pink shrimp (Parapenaeus longirostris) pada suhu 4 oC selama waktu penyimpanan dan hasil dari pengamatan tersebut
vannamei) secara organoleptik, blackspot, histologi, dan enzimatik masih sedikit sehingga diperlukan penelitian ini untuk memudahkan saat proses penanganan udang.
Perumusan Masalah
Udang putih mendominasi hasil produksi perikanan budidaya namun informasi mengenai blackspot sebagai salah satu pemicu kemunduran mutu udang masih sangat sedikit. Penyebaran blackspot dapat menyebabkan kerusakan jaringan. Kerusakan membran lisosom pada otot udang disebabkan oleh penurunan pH, hal ini yang dapat mengaktifkan enzim katepsin. Penelitian mengenai kemunduran mutu udang putih secara organoleptik, blackspot, histologi, dan enzimatik diperlukan untuk memudahkan saat proses penanganan udang. Penelitian ini juga dapat dijadikan data untuk penelitian lebih lanjut.
Tujuan Penelitian
Tujuan penelitian ini yaitu untuk menentukan kemunduran mutu udang secara organoleptik, menentukan perkembangan blackspot udang, menentukan kemunduran mutu udang secara histologi, dan mengukur aktivitas enzim katepsin berdasarkan kemunduran mutu udang.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai kemunduran mutu udang secara organoleptik, blackspot, histologi, dan enzimatik untuk memudahkan saat proses penanganan udang.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah pengambilan udang putih, preparasi udang putih, organoleptik, pengamatan blackspot, pengujian histologi udang putih, dan pengujian aktivitas enzim katepsin.
METODE PENELITIAN
Bahan
Bahan utama yang digunakan pada penelitian ini yaitu udang putih
(Litopenaeus vannamei) size 50 (10-13 gram/ekor) yang diperoleh dari supplier di Muara Karang, Jakarta. Udang putih disimpan pada suhu chilling (4 oC). Bahan
yang digunakan untuk uji histologi yaitu larutan buffer normal formalin (BNF) 10% (Merck p.a.), alkohol p.a. 50-100% (Merck), xylol p.a. (Merck), paraffin p.a. (Merck), hematoksilin p.a. (Merck), eosin p.a. (Merck), dan mounting agent p.a. (Merck). Bahan yang digunakan untuk ekstraksi enzim katepsin antara lain akuades dan buffer tris HCl 0,1 M, sedangkan bahan yang digunakan untuk aktivitas katepsin antara lain enzim katepsin, buffer tris HCl 0,1 M, tirosin, akuades, hemoglobin 2%, TCA 5%, dan folin.
Alat
Alat yang digunakan untuk organoleptik yaitu scoresheet organoleptik udang berdasarkan SNI 01-2346-2006. Alat yang digunakan untuk pengamatan blackspot yaitu Stereoskop digital (SDA-1). Alat yang digunakan untuk uji histologi antara lain pisau scalpel, botol film, kasa, benang, gunting, botol film, pipet volumetrik, oven (Yamato DV 40), cetakan yang terbuat dari kalender, mikrotom putar (Yamato Kohki LR-85), dan Mikroskop Cahaya Olympus CX41 beserta Kamera DP21. Alat yang digunakan untuk ekstraksi enzim katepsin yaitu Centrifuge (HIMAC CR 21G). Pengujian aktivitas enzim katepsin menggunakan Spektrofotometer (UV. VIS & IR U-2800), inkubator (Memmert), pipet volumetrik, tabung reaksi, dan kertas saring.
Prosedur Penelitian
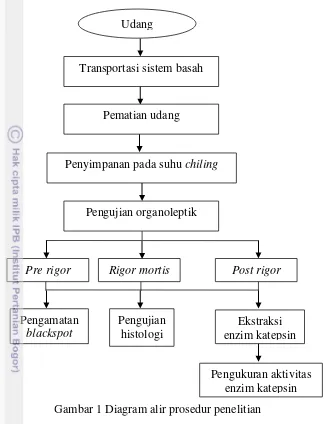
Udang putih (L. vannamei) disimpan pada suhu chilling (4oC) selama 23 hari. Pengamatan udang dilakukan untuk menentukan fase kemunduran mutu (pre rigor, rigor mortis, dan post rigor). Bersamaan dengan organoleptik dilakukan pula pengamatan blackspot setiap 6 jam. Pengamatan selanjutnya adalah histologi dan pengukuran aktivitas enzim katepsin pada masing-masing fase kemunduran mutu. Diagram alir penelitian disajikan pada Gambar 1.
Preparasi Sampel Udang Putih
Uji Organoleptik (BSN 2006)
Pengujian organoleptik merupakan cara pengujian yang bersifat subjektif menggunakan indera yang ditujukan pada sampel. Pengujian organoleptik dilakukan untuk mengetahui waktu kemunduran mutu udang yang meliputi pre rigor, rigor mortis, post rigor, dan deteriorasi. Udang disimpan pada suhu chilling (4oC) dengan waktu pengamatan setiap 24 jam. Pengamatan dilakukan secara organoleptik menggunakan scoresheet berdasarkan SNI 01-2346-2006 yang terdapat pada Lampiran 1 (BSN 2006).
Pengamatan Blackspot
Pengamatan blackspot udang dilakukan setiap 6 jam menggunakan Stereoskop digital (SDA-1) yang telah dihubungkan dengan komputer. Pengamatan dilakukan setiap 6 jam sejak kemunculan pertama blackspot. Hasil pengamatan blackspot berupa foto per ruas dari udang tersebut yang kemudian dianalisis secara deskriptif.
Gambar 1 Diagram alir prosedur penelitian Ekstraksi enzim katepsin Penyimpanan pada suhu chiling
Udang
Pematian udang
Pre rigor Rigor mortis Post rigor
Pengamatan blackspot
Pengujian histologi
Pengujian organoleptik Transportasi sistem basah
Analisis Histologi (Angka et al. 1990)
Pengamatan jaringan daging diawali dengan pembuatan preparat udang. Tahapan pembuatan preparat terdiri atas pemotongan daging dan karapas udang, fiksasi, dehidrasi, clearing, impregnasi, embedding, blocking, trimming, pemotongan jaringan, pewarnaan, dan perekatan jaringan menggunakan mounting agent. Fiksasi dilakukan dalam larutan BNF selama 24-48 jam. Larutan fiksasi dibuang, kemudian didehidrasi melalui perendaman jaringan dalam alkohol pada suhu ruang dengan alkohol secara berurutan yaitu alkohol 70% selama 24 jam, alkohol 80% selama 2 jam, alkohol 90% selama 2 jam, alkohol 95% selama 2 jam, alkohol 95% selama 2 jam, alkohol 95% selama 2 jam, dan alkohol 100% selama 12 jam.
Proses clearing dimulai dari perendaman sampel dalam clearing agent. Jaringan direndam dalam alkohol-xylol (1:1) selama 30 menit pada suhu ruang yang dilanjutkan dengan perendaman jaringan dengan xylol I, xylol II, dan xylol III yang masing-masing selama 30 menit. Proses selanjutnya adalah impregnasi dan embedding. Impregnasi adalah perendaman jaringan ke dalam xilol:parafin (1:1) dalam gelas piala selama 45 menit pada suhu 60oC. Embedding adalah perendaman jaringan di dalam parafin cair, yakni parafin I, parafin II, parafin III masing-masing selama 45 menit pada suhu 60oC.
Jaringan yang telah dibenamkan dalam parafin cair lalu dibentuk menyerupai blok/kotak (dicetak agar mudah dipotong) dengan parafin cair yang kemudian dibekukan. Proses ini membutuhkan cetakan yang dapat dibuat dari kertas yang kaku, misal kertas kalender, dengan ukuran 2x2x2 cm3. Parafin cair dituangkan ke dalam cetakan hingga memenuhi sekitar 1/8 bagian cetakan dan dibiarkan hingga sedikit membeku. Jaringan disusun dalam cetakan dengan bagian sayatan yang diperlukan menghadap ke dasar cetakan dan dituangi parafin cair hingga material jaringan terendam. Jaringan dibiarkan membeku pada suhu ruang selama 24 jam. Blok parafin yang dikeluarkan dari cetakan lalu ditrimming menggunakan silet. Pemotongan jaringan dilakukan menggunakan mikrotom setebal 4 µm. Pemotongan jaringan membujur. Pita-pita parafin yang terbentuk diambil dengan jarum kemudian diletakkan di permukaan air hangat (45-50oC) waterbath. Pita-pita
parafin kemudian ditempelkan pada gelas objek yang telah diberi zat perekat misal albumin dengan cara memasukkan kaca objek tersebut ke dalam waterbath dan menggerakkannya ke arah paraffin, kemudian dibiarkan kering.
Tahapan selanjutnya adalah dewaxing yang dimulai dengan meletakkan gelas objek yang berisi jaringan ke keranjang preparat. Keranjang tersebut berisi 10 gelas objek. Keranjang yang telah berisi gelas objek direndam dengan xylol I dan xylol II masing-masing selama 2 menit, dilanjutkan perendaman dalam alkohol absolut (100%, 95%, 90%, 80%, 70%, dan 50%) masing-masing selama 2 menit. Objek dibilas dengan akuades selama 2 menit.
kemudian dikeringkan dalam oven pada suhu 40oC selama 24 jam dan sampel
diamati di bawah mikroskop dengan perbesaran 40x hingga 1000x lalu didokumentasikan untuk dijadikan bahan analisis deskriptif. Diagram alir pembuatan preparat daging dan karapas udang dapat dilihat pada Lampiran 2. Ekstraksi Enzim Katepsin (Dinu et al. 2002)
Ekstraksi dilakukan dengan preparasi sampel untuk memperoleh ekstrak kasar katepsin. Proses ekstraksi menggunakan udang pada fase pre rigor, rigor mortis, dan post rigor. Daging udang diambil dan disuspensikan dalam akuades dengan perbandingan daging udang dan akuades sebsar 1:1, lalu dihomogenisasi pada suhu 0-4oC. Skema ekstraksi enzim katepsin dari udang dapat dilihat pada
Lampiran 3.
Ekstrak daging hasil homogenisasi disentrifugasi pada 600 xg selama 10 menit dan supernatan yang diperoleh kemudian disentrifugasi lagi pada 10000 xg selama 10 menit. Pelet yang dihasilkan dari hasil sentrifugasi kemudian dilarutkan dalam 0,1 M buffer tris HCL pH 7,4 dengan jumlah yang sama seperti jumlah akuades dan disentrifugasi pada 4000 xg selama 10 menit. Hasil supernatan (ekstrak kasar enzim) yang diperoleh merupakan protein utama dari mitokondria dan lisosom yang akan diukur aktivitasnya.
Pengukuran Aktivitas Enzim Katepsin (Dinu et al. 2002)
Aktivitas proteolitik dari katepsin diuji menggunakan hemoglobin terdenaturasi asam sebagai substratnya. Hemoglobin sebanyak 8% (w/v) dilarutkan dalam akuades dengan perbandingan 1:3. Nilai pH dibuat menjadi 2 dengan HCl 1 N dan konsentrasi akhir hemoglobin dibuat menjadi 2% (w/v) dengan akuades. Prosedur pengukuran aktivitas enzim katepsin disajikan pada Tabel 1.
Tabel 1 Prosedur pengukuran aktivitas enzim katepsin
Pereaksi Sample (mL) Standar (mL) Blanko (mL)
Buffer tris 0,1 M pH 7,4 0,1 0,1 0,1
Katepsin 0,1 - -
Tirosin - 0,1 -
Akuades - - 0,1
Hemoglobin 2% 0,5 0,5 0,5
Diinkubasi 37 oC, 10 menit
TCA 5% 2 2 2
Disaring dengan kertas saring
Filtrat 1 1 1
Folin 1 1 1
Didiamkan pada 37oC, 20 menit
Diukur pada spektrofotometer dengan panjang gelombang 750 nm Aktivitas enzim katepsin dapat dihitung dengan rumus berikut:
� = abs. standar − abs. blanko × � × �. � � − �. 1
Keterangan :
UA = jumlah tirosin yang dihasilkan per mL enzim per menit P = faktor pengenceran
T = waktu inkubasi (10 menit)
HASIL DAN PEMBAHASAN
Kemunduran Mutu Udang : Organoleptik
Gambar 2 Kemunduran mutu udang secara organoleptik,
keterangan : : kenampakan, : bau, : tekstur Tabel 2 Hasil organoleptik kemunduran mutu udang putih
Kenampakan Bau Tekstur
Pre rigor
Kemunduran mutu udang putih ditentukan dengan pengamatan organoleptik sehingga diketahui fase kemunduran mutu. Nilai organoleptik udang putih mengalami penurunan seiring dengan lama waktu penyimpanan. Pengamatan kemunduran mutu udang putih dilakukan selama 23 hari. Parameter yang diamati yaitu kenampakan, bau, dan tekstur. Pengamatan organoleptik udang dilakukan pada suhu chilling (4oC). Hal ini dilakukan untuk mengurangi laju kemunduran mutu udang sehingga menghambat pertumbuhan bakteri dan aktivitas enzim.
Deteriorasi Pre
rigor Rigor mortis
Udang pada fase pre rigor menunjukkan nilai organoleptik 9-8 yang terjadi pada hari ke-0 sampai hari ke-2 yang menggambarkan bahwa udang dalam kondisi sangat segar. Kenampakan utuh pada fase ini disebabkan udang belum mengalami perubahan secara fisik, biokimia, maupun mikrobiologi. Blackspot pada fase ini belum ada sehingga warna udang masih terlihat putih. Bau udang pada fase ini sama seperti udang hidup. Tekstur udang sangat kenyal, terlihat jika daging tersebut ditekan oleh jari maka akan kembali lagi. Fase ini ditandai dengan penurunan ATP melalui proses glikolisis anerob. Proses ini akan mengubah glikogen menjadi asam laktat yang akan menyebabkan penurunan pH (Eskin 1990). Menurut Huidobro et al. (2003); Olafsdottir et al. (1997) tidak terjadi pelunakan pada tekstur daging selama penyimpanan hari ke-0 hingga ke-3.
Udang pada fase rigor mortis memiliki nilai organoleptik 7-5 yang merupakan batas aman kondisi udang. Fase rigor mortis udang terjadi pada hari ke-3 sampai hari ke-11. Kenampakan udang pada fase ini sama seperti udang pada fase pre rigor, hanya pada fase rigor mortis kebeningan pada tubuh udang mulai memudar jika dibandingkan dengan fase pre rigor. Hal ini disebabkan bertambahnya waktu penyimpanan. Kesegaran udang pada fase ini sudah mulai berkurang jika dibandingkan pada fase pre rigor, hal ini dapat dilihat pada hasil organoleptik yaitu pada parameter bau. Blackspot pada fase ini mulai bermunculan yaitu pada cephalothorax, pereiopod, pleopod, telson, dan abdomen. Daging udang pada fase ini mengalami kekakuan sehingga teksturnya kurang elastis. Kekakuan pada daging akibat dari tidak berkontraksinya aktin dan miosin pada otot daging. Fase rigor mortis juga terjadi penurunan pH akibat akumulasi asam laktat yang akan mengaktifkan enzim proteolitik contohnya enzim katepsin. Fase ini ditandai dengan habisnya ATP sehingga kontraksi antara aktin dan miosin terhenti (Morkore et al. 2006). Menurut Pornrat et al. (2007) menyatakan bahwa pada penyimpanan hari ke-7 hingga hari ke-9 tekstur udang kurang elastis jika dibandingkan dengan tekstur udang pada awal penyimpanan.
Udang pada fase post rigor memiliki nilai organoleptik berkisar 5-3. Fase post rigor ini terjadi pada hari ke-12 sampai hari ke-17. Daging pada fase ini sudah mulai mengalami pelunakan jika dibandingkan pada fase rigor mortis. Pelunakan tekstur tersebut akibat dari aktivitas bakteri. Blackspot pada fase ini semakin banyak sehingga warna tubuh udang menjadi hitam. Akumulasi blackspot terbanyak terdapat pada cephalothorax. Fase ini merupakan awal dari kebusukan udang. Nilai pH pada fase ini meningkat atau pada kisaran pH basa akibat dari penguraian protein yang akan memicu terbentuknya senyawa basa-basa volatil, contohnya amoniak. Lingkungan pH basa tersebut akan menjadi tempat pertumbuhan bakteri (Eskin 1990). Udang putih pada fase ini sudah tidak dapat diterima oleh konsumen (Pornrat et al. 2007).
Gambar 3 Udang pada masing-masing fase kemunduran mutu, keterangan : (a) pre rigor, (b) rigor mortis, (c) post rigor, (d) deteriorasi
Kemunduran Mutu Udang: Blackspot
Pengamatan blackspot dilakukan setiap 6 jam selama 84 jam yang dilakukan pada suhu chilling. Pengamatan dilakukan pada mata, cephalothorax, abdomen, dan pereiopod. Bagian-bagian tersebut mewakili pengamatan untuk penyebaran blackspot. Gambar perkembangan penyebaran blackspot selama 84 jam dapai dilihat pada Lampiran 4.
Kemunduran mutu udang dapat dilihat pada bagian mata udang. Mata udang pada jam ke-0 terlihat dalam keadaan segar dengan bola mata menonjol (Gambar 4). Hal ini berbeda pada jam ke-48 (Gambar 5) dan jam ke-66 (Gambar 6), mata udang cekung akibat waktu penyimpanan. Cekungnya mata udang ini menunjukkan udang sudah tidak segar. Cephalothorax udang pada jam ke-0 (Gambar 7) belum terdapat blackspot, hal ini menyebabkan cephalothorax udang masih berwarna putih bening. Hasil pengamatan penyebaran blackspot pada jam ke-0 ini jika dikaitkan dengan hasil organoleptik termasuk ke dalam fase pre rigor. Awal kemunculan blackspot terjadi pada jam ke-48 (Gambar 8), jika dikaitkan dengan hasil organoleptik munculnya blackspot terjadi pada peralihan fase pre rigor ke rigor mortis. Blackspot muncul pada bagian tengah cephalothorax yang merupakan tempat organ pencernaan udang. Penyebaran blackspot pada cephalothorax lebih cepat dibanding bagian tubuh lainnya. Organ pencernaan pada cephalothorax ini menyebabkan pembusukan lebih cepat sehingga laju penyebaran blackspot semakin cepat. Penyebaran blackspot semakin meningkat pada jam ke-54 (Gambar 9) dan
jam ke-72 (Gambar 10). Penyebaran blackspot ini menyebabkan seluruh permukaan cephalothorax berwarna hitam.
Abdomen udang pada ruas 1 sampai ruas 6 memiliki pertumbuhan blackspot yang lambat jika dibandingkan dengan cephalothorax dan pereiopod. Hal ini disebabkan paparan blackspot untuk masuk ke dalam abdomen lebih lama akibat adanya daging pada abdomen udang. Titik-titik hitam pada abdomen udang merupakan pemicu tumbuhnya blackspot, namun tidak semua titik hitam tersebut dapat menjadi blackspot. Satu titik hitam pada abdomen merupakan blackspot, hal ini dapat dilihat bahwa titik tersebut membesar seiring berjalannya waktu penyimpanan. Titik blackspot yang awalnya kecil pada jam ke-0 (Gambar 11) kemudian membesar pada jam ke-84 (Gambar 12).
Pereiopod udang memiliki penyebaran blackspot yang sama cepatnya dengan cephalothorax, hal ini disebabkan pereiopod terletak tepat dibawah cephaalothorax. Pereiopod pada jam ke-0 (Gambar 13) berwarna putih bening dan belum ditutupi oleh blackspot. Awal muncul adanya blackspot terjadi pada jam ke-48 (Gambar 14), penyebaran blackspot semakin cepat pada jam ke-66 (Gambar 15) dan jam ke-84 (Gambar 16). Hasil pengamatan penyebaran blackspot sesuai dengan Nirman dan Benjakul (2011) yang menyatakan bahwa selama penyimpanan pada suhu 4 oC
terjadi peningkatan nilai melanosis.
Menurut Montero et al. (2001), udang yang disimpan dalam suhu chilling memiliki reaksi melanosis yang dimulai dari cephalothorax hingga ekor dengan tingkat pertumbuhan blackspot berbeda-beda setiap spesies. Kenampakan awal munculnya blackspot berada pada bagian tubuh udang yang tidak memiliki daging, yaitu cephalothorax, pereiopod, ekor, dan pleopod. Udang pada bagian cephalothorax, ekor, pereiopod, dan pleopod mengalami blackspot terlebih dahulu, kemudian dilanjutkan pada tubuh udang dari ruas pertama hingga ruas keenam.
Gambar 4 Mata udang jam ke-0
Gambar 7 Cephalothorax udang jam ke-0
Gambar 9 Cephalothorax udang jam ke-54
Gambar 10 Cephalothorax udang jam ke-72
Gambar 8 Cephalothorax udang jam ke-48
Gambar 13 Pereiopod udang jam ke-0
Gambar 15 Pereiopod udang jam ke-66
Gambar 16 Pereiopod udang jam ke-84
Gambar 11 Abdomen udang jam ke-0
Keterangan : : belum terjadi penyebaran blackspot, : awal munculnya blackspot, : penyebaran blackspot semakin cepat
Kemunduran Mutu Udang: Histologi
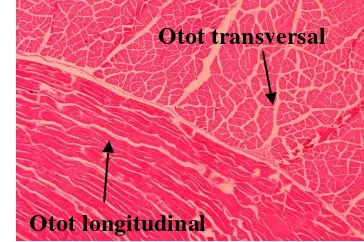
Kemunduran mutu udang dapat diamati melalui pengamatan histologis. Pengamatan histologis dilakukan setiap fase kemunduran mutu udang yaitu pre rigor, rigor mortis, dan post rigor. Pengamatan dilakukan menggunakan bagian abdomen udang berupa daging dan karapas udang yang dipotong secara membujur. Serabut otot pada udang terbagi menjadi dua yaitu otot longitudinal dan otot transversal (Gambar 17).
Gambar 14 Pereiopod udang jam ke-48
Gambar 17 Serabut otot udang
Serabut otot pada fase pre rigor terlihat kompak (Gambar 18). Perbesaran gambar serabut otot fase ini dapat dilihat pada Gambar 19 yang menunjukkan serabut otot tersebut menyatu dengan septum yang belum mengalami kerusakan. Hal ini sesuai dengan hasil organoleptik yang memiliki tekstur udang sangat elastis, kompak dan padat. Menurut Pornrat et al. (2007), pada waktu penyimpanan 2 hari dengan suhu 5oC tidak terjadi pergeseran pada jaringan otot udang. Jaringan otot kompak dan menyatu dengan erat. Awal kemunduran mutu udang terjadi pada bagian tubuh udang yaitu karapas (kulit udang). Karapas pada udang merupakan tempat terbentuknya blackspot yang diakibatkan oleh waktu penyimpanan. Infeksi awal munculnya blackspot yaitu pada karapas yang kemudian terjadi pelepasan partikel blackspot menuju jaringan otot. Blackspot yang terjadi pada jaringan otot termasuk infeksi terberat. Kemunduran mutu karapas udang saat fase pre rigor (Gambar 20) terlihat bahwa karapas masih kompak. Hal ini sesuai dengan hasil pengamatan penyebaran blackspot pada jam ke-0 yang menunjukkan belum berkembangnya blackspot. Hematoksilin bekerja sebagai pewarna basa artinya zat ini mewarnai unsur basofilik pada jaringan menjadi ungu-kebiruan. Eosin bersifat asam dan mewarnai komponen asidofilik menjadi merah muda. Sel bersifat asidofilik sehingga dapat menyerap pewarna eosin (Angka et al. 1990).
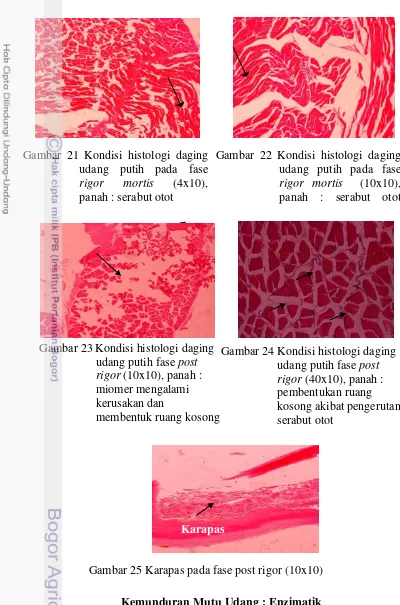
Antar serabut otot pada fase rigor mortis mulai mengalami pengerutan (Gambar 21 dan 22) sehingga mulai terbentuk ruang kosong. Miomer yang mulai mengalami kerusakan pada fase ini disebabkan oleh pengerutan pada serabut otot sehingga menyebabkan mulai adanya ruang kosong yang berwarna putih. Pengerutan pada serabut otot disebabkan oleh kekakuan pada daging udang akibat dari tidak berkontraksinya aktin dan miosin (Morkore et al. 2006). Warna putih pada ruang kosong tersebut di isi oleh parafin saat proses pembuatan preparat histologi. Hal ini sesuai dengan hasil organoleptik yang memiliki tekstur kurang elastis, kompak, dan padat atau daging udang menjadi kaku. Nilai pH udang putih pada fase rigor mortis sebesar 6,98 (Azizah 2013). Penurunan pH pada fase ini menyebabkan membran lisosom pada serabut otot menjadi rusak. Penurunan pH merupakan akibat akumulasi asam laktat (Morkore et al. 2006). Kolagen pada fase ini terpecah sehingga mioseptum menjadi rusak. Menurut Pornrat et al. (2007), setelah penyimpanan selama 6 hari pada suhu 5 oC terjadi degradasi dan perubahan
mikroskopik struktur miofibril akibat dari tekstur udang yang kaku.
Fase post rigor terjadi perenggangan yang jelas pada serabut otot. Gambar 23 menunjukkan terjadinya kerusakan miomer yang menyebabkan terbentuknya ruang kosong. Kehilangan serat kolagen di miocomata yang menyebabkan pemisahan miomer. Materi padat dalam mitokondria mengalami perluasan akibat lama penyimpanan (Caballero et al. 2009). Menurut Pornrat et al. (2007), disrupsi
Otot longitudinal
Gambar 18 Kondisi histologi daging udang putih pada fase pre rigor (4x10), panah : a) serabut otot, b) perimisium
(perubahan struktur morfologi) pada mitokondria menyebabkan pelepasan enzim ke dalam sarkoplasma. Disrupsi mitokondria terjadi ketika struktur miofibril mengalami degradasi. Serabut otot pada fase ini sudah terpotong-potong atau mengalami kerusakan (Gambar 24). Karapas pada fase post rigor (Gambar 25) terjadi kerusakan akibat waktu penyimpanan. Waktu penyimpanan ini akan berdampak pada aktivitas penyebaran blackspot yang tinggi sehingga menyebabkan terdapat rongga-rongga pada karapas. Hal ini sesuai dengan hasil oganoleptik, blackspot pada fase post rigor menutupi hampir seluruh tubuh udang.
b
a
Gambar 19 Kondisi histologi daging udang putih pada fase pre rigor (10x10), panah : serabut otot
Karapas
Kemunduran Mutu Udang : Enzimatik
Penyebab lain dari penurunan kesegaran mutu daging udang yaitu adanya aktivitas enzim proteolitik setelah udang mati. Aktivitas enzim tersebuat menyebabkan penguraian protein menjadi senyawa-senyawa yang lebih kecil sehingga senyawa tersebut mudah menguap. Salah satu enzim tersebut adalah
Gambar 24 Kondisi histologi daging udang putih fase post rigor (40x10), panah : pembentukan ruang kosong akibat pengerutan serabut otot
Kutikula epidermis Gambar 23 Kondisi histologi daging
udang putih fase post rigor (10x10), panah : miomer mengalami kerusakan dan
membentuk ruang kosong
Gambar 25 Karapas pada fase post rigor (10x10) Karapas
Gambar 21 Kondisi histologi daging udang putih pada fase rigor mortis (4x10), panah : serabut otot
enzim katepsin yang dapat mendegradasi protein miofibril (Jiang 2000). Hasil pengukuran aktivitas enzim katepsin pada daging udang disajikan pada Gambar 26. Gambar 26 menunjukkan nilai aktivitas enzim daging udang pada fase pre rigor (0,064 U/mL), rigor mortis (0,452 U/mL), dan post rigor (0,314 U/mL). Nilai aktivitas enzim katepsin tertinggi yaitu pada fase rigor mortis dan nilai aktivitasnya menurun setelah fase rigor mortis. Perbedaan nilai aktivitas enzim katepsin disebabkan oleh perbedaan pH udang pada masing-masing fase. Enzim katepsin aktif bekerja pada pH optimum yaitu pada kisaran pH asam (Shahidi & Kamil 2001). Menurut Qiu et al. (2013), enzim katepsin B pada krustasea optimal pada pH 6,0 dan suhu 45oC. Ketika udang mati, pH udang akan turun dari kisaran netral (pH 7) ke kisaran pH 6,5 yang kemudian pH naik kembali (Chereta et al. 2007). Nilai pH udang putih pada fase rigor mortis sebesar 6,98 (Azizah 2013). Penurunan pH menyebabkan membran lisosom pada serabut otot menjadi rusak dan mengaktifkan enzim katepsin. Enzim katepsin termasuk ke dalam enzim proteolitik atau pengurai protein menjadi pepton, asam amino, dan polipeptida (Kim et al. 2002). Katepsin dan enzim penghidrolisis lainnya pada udang terdapat dalam organel sub selluler atau disebut lisosom. Lisosom sel terdapat di dua tempat yaitu serabut otot dan membran sel (Hu dan Leung 2006). Proses penguraian protein terjadi akibat penurunan pH pada jaringan otot karena terbentuknya asam laktat. Asam laktat ini merupakan hasil reaksi pemecahan glikogen anaerob (Eskin 1990).
Enzim katepin B paling banyak terkandung di daging udang (Li et al. 2013). Enzim tersebut juga terdapat pada Pandalus borealis yaitu pada kelenjar getah bening dan enzim ini terdeteksi ketika pH asam (Aoki et al. 2003). Menurut Stephens et al. (2012), pada Litopenaeus vannamei kandungan katepsin B rendah pada kulit (karapas) dan tinggi pada insang, sedangkan menurut Ren et al. (2010), katepsin L banyak terdapat hepatopankreas Fenneropenaeus chinensis. Katepsin D tidak terdapat pada udang, namun terdapat pada krustasea lainnya, contohnya lobster (Rojo et al. 2010).
KESIMPULAN DAN SARAN
Kesimpulan
Hasil penelitian menunjukkan bahwa fase pre rigor udang terjadi sesaat setelah udang mati (penyimpanan hari ke-0 sampai hari ke-2), rigor mortis terjadi pada penyimpanan hari ke-3 sampai hari ke-11, post rigor terjadi pada penyimpanan hari ke-12 sampai hari ke-17, dan deteriorasi (kebusukan) terjadi pada penyimpanan hari ke-18 sampai hari ke-23. Kenampakan awal munculnya blackspot terdapat pada cephalothorax yang kemudian berlanjut seiring berjalannya waktu. Serabut otot pada fase pre rigor belum mengalami kerusakan. Serabut otot masih terlihat kompak dan padat. Serabut otot pada fase rigor mortis mulai mengalami pengerutan. Serabut otot pada fase post rigor sudah terpotong-potong. Nilai aktivitas enzim katepsin paling besar terjadi pada fase rigor mortis.
Saran
Saran untuk penelitian selanjutnya yakni (1) penggunaan teknik pewarnaan lainnya yang dapat dijadikan pembanding dalam pembuatan preparat, (2) penentuan perubahan jaringan daging dan karapas melalui pengamatan struktur ultra dari sel dengan menggunakan TEM (Transmision Electron Microscope), (3) analisis pembentukan blackspot pada cephalothorax melalui irisan tipis (thin section), (4) isolasi dan karakteristik enzim polyphenol oxidase.
DAFTAR PUSTAKA
Angka SL, Mokoginta I, Hamid H. 1990. Anatomi dan Histologi Banding Beberapa Ikan Air Tawar yang Dibudidayakan di Indonesia. Bogor (ID): Departemen Pendidikan dan Kebudayaan, Direktorat Jendral Pendidikan Tinggi, Institut Pertanian Bogor.
Aoki H, Ahsan MN, Watabe S. 2003. Molecular cloning and characterization of cathepsin B from the hepatopancreas of northern shrimp Pandalus borealis. Comparative Biochemistry and Physiology 134: 681–694.
Azizah LH. 2013. Analisis Kemunduran Mutu Udang Putih secara Biokimia dan Mikrobiologi. Bogor (ID): Inpres.
[BRKP] Badan Riset Kelautan Perikanan. 2007. Dukungan teknologi penyediaan produk perikanan. www.litbang.deptan.go.id. [3 Januari 2014].
[BSN] Badan Standardisasi Nasional. Standar Nasional Indonesia 01-2345-2006. Uji Organoleptik Ikan Segar. Jakarta (ID): Badan Standardisasi Indonesia. Caballero MJ, Betancor M, Escring JC, Montero D, Monteros AE, Castro P, Gines
Chereta R, Ladrat CD, Anton ML, Bagnis VV. 2007. Calpain and chatepsin activities in post mortem fish and meat muscles. Food Chemistry 101(4): 1474-1479.doi:10.1016/j.foodchem.2006.04.023.
Dinu D, Dumitru IF, Nichifor MT. 2002. Isolation and charaterization of two cathepsins from muscle of Carassius auratus gibelio. Roum Biotechnology 7: 753-758.
Eskin NAM. 1990. Biochemistry of Foods. Second Edition. San Diego (US): Academic Press.
Hartono. 1989. Histologi Veteriner. Bogor (ID): Pusat Antar Universitas Ilmu Hayat IPB.
Huidobro FR, Miguel E, Onega E, Blazquez B. 2003. Changes in meat quality characteristics of bovine meat during the first six days post mortem. Meat Science 65: 1439-1446.
Hu KJ, Leung PC. 2006. Food digestion by cathepsin L and digestion-related rapid cell differentiation in shirmp hepatopankreas. Comparative Biochemistry and Physiology 146:69-80.
Ilyas S. 1993. Teknik Refrigerasi Hasil Perikanan Jilid II. Jakarta (ID): Paripurna. Jiang ST. 2000. Enzymes and their effects on seafood texture. Di dalam: Haard NF
dan Simpson BK, editor. Seafood Enzymes Utilization and Influence on Postharvest Seafood Quality. New York (US): Marcel Dekker Inc.
[JICA] Japan International Cooperation Agency. 2008. Bantuan Teknis untuk Industri Ikan dan Udang Skala Kecil dan Menengah di Indonesia. Jakarta (ID): Kementrian Kelautan dan Perikanan.
Kim SK, Park PJ, Kim JB, Shahidi F. 2002. Purification and Characterization of the collagenase from the tissue of filefish Novoden modestrus. Journal of Biochemistry and Molecular Biology 35 (2) : 165-171.
[KKP] Kementrian Kelautan dan Perikanan. 2013. Data produksi udang.
www.kkp.go.id. [3 Januari 2014].
Li X, Meng X, Kong J, Luo K, Luan S, Cao B, Liu N, Pang J, Shi X. 2013. Molecular cloning and characterization of a cathepsin B gene from the Chinese shrimp Fenneropenaeus Chinensis. Fish and Shellfish Immunology 35: 1604-1612.doi:10.1016/j.fsi.2013.09.004.
Montero P, Avalos A, Miriam PM. 2001. Characterization of polyphenoloxidase of prawns (Penaeus japonicus) alternatives to inhibition: additivies and high-pressure treatment. Food Chemistry 75:317-324.
Morkore T. 2006. Relevance of dietary oil source for contraction and quality of pre rigor filleted atlantic cod Gadus Morhua. Aquaculture 25:56-65.
Nirmal NP, Benjakul S. 2011. Use of tea extracts for inhibition of polyphenoloxidase and retardation of quality loss of Pacific white shrimp iced storage. LWT-Food Science and Technology 44: 924-932.
Nurjanah, Abdullah A, Kustiariyah. 2011. Pengetahuan dan Karakteristik Bahan Baku Hasil Perairan. Bogor (ID): IPB Press.
Olafsdottir G, Martinsdottir E, Oehlenschlager J, Dalgaard P, Jensen B, Undeland I. 1997. Methods to evaluate fish freshness in research and industry. Trends in Food Science and Technology 8(8): 258-265.
during cold storage. LWT-Food Science and Technology 40:1747-1754.doi: 10.1016/j.lwt.2007.01.006.
Qiu R, Liu X, Hu Y, Sun B. 2013. Expression characterization and activity of a chatepsin B from Pacific abalone Haliotis discus hannai. Fish Shellfish Immunology 34:1376-1382.
Ren Q, Zhang XW, Sun YD, Sun SS, Zhou J, Wang ZH. 2010. Two cysteine proteinases respond to bacterial and WSSV challenge in Chinese white shrimp Fenneropenaeus chinensis. Fish Shellfish Immunology 29:551-556. Ridwansyah. 2002. Pengaruh konsentrasi hidrogen peroksida dan lama perendaman
terhadap mutu ikan kembung yang di pindang. Medan : Universitas Sumatra Utara.
Rojo L, Muhlia AA, Saborowski R, Garcia CF. 2010. Aspartic cathepsin D endopeptidase contributes to extracellular digestion in clawed lobsters Homarus americanus and Homarus gammarus. Marine Biotechnology 12:696–707.
Shahidi F, Kamil YVAJ. 2001. Enzymes from fish and aquatic invertebrates and their application in food industry. Trends in Food Science & Technology 12: 435-464.
Stephens A, Rojo L, Araujo-Bernal S, Garcia-Carreño F, Muhlia-Almazan A. 2012. Cathepsin B from the white shrimp Litopenaeus vannamei: cDNA sequence analysis, tissues-specific expression and biological activity. Comparative Biochemistry and Physiology 161:32-40.
Lampiran 2 Diagram alir pengujian histologi daging dan karapas udang Pemotongan daging dan karapas
udang
Fiksasi dengan larutan BNF 10%
Dehidrasi dengan alkohol berseri
Penjernihan (clearing) dengan alkohol-xylol (1:1)
Trimming
Penanaman (embedding) dalam parafin
Impregnasi dengan menggunakan xylol-parafin (1:1)
Pemotongan dengan mikrotom
Pelekatan pita parafin pada gelas obyek
Pewarnaan Hematoksilin dan Eosin
Perekatan jaringan dengan mounting agent
Preparat awetan
Pengamatan dengan mikroskop
Lampiran 3 Diagram alir ekstraksi enzim katepsin
Daging udang + akuades 1:1
Homogenisasi
Sentrifugasi 600 x g, 10 menit, 4oC
Pelet Supernatan
Buffer tris HCl 0,1 M pH 7,4 + Pelet Supernatan Sentrifugasi 10.000 x g, 10 menit, 4oC
Sentrifugasi 4.000 x g, 10 menit, 4oC
Lampiran 4 Dokumentasi penyebaran blackspot udang putih selama 84 jam
Jam ke- Mata Cephalothorax Abdomen Pereiopod
0
6
12
18
24
30
36
Jam ke- Mata Cephalothorax Abdomen Pereiopod
48
54
60
66
72
84
Keterangan : : belum terjadi penyebaran blackspot : awal munculnya blackspot
RIWAYAT HIDUP
Penulis dilahirkan di Denpasar pada tanggal 15 September 1992. Penulis merupakan anak pertama dari dua bersaudara dari pasangan ayah bernama Anwar Bestari dan ibu bernama Magfirah Rahayu. Pendidikan formal yang ditempuh penulis dimulai di SDN 1 Paciran, Jawa Timur pada tahun 1998 hingga tahun 2004. Penulis melanjutkan pendidikan pada tahun yang sama di SMPN 1 Anyer, Banten. Penulis lulus SMP pada tahun 2007. Pendidikan formal selanjutnya ditempuh di SMAN 1 Kramatwatu, Banten pada tahun 2007 dan lulus pada tahun 2010.
Penulis diterima sebagai Mahasiswa pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB). Selama perkuliahan, penulis aktif berorganisasi dalam Divisi Kesekretariatan, Himpunan Mahasiswa Teknologi Hasil Perairan (HIMASILKAN), Fakultas Perikanan dan Ilmu Kelautan tahun kepengurusan 2011-2012.