PENINGKATAN MUTU NUTRITIF HIJAUAN FERMENTASI
(Hi-
fer
)
MELALUI INOKULASI
Lactobacillus plantarum
DAN ASAM FORMIAT
SAPRILIAN STYA HAPSARI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Peningkatan Mutu Nutritif Hijauan Fermentasi (Hi-fer) melalui Inokulasi Lactobacillus plantarum dan Asam Formiat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SAPRILIAN STYA HAPSARI. Peningkatan Mutu Nutritif Hijauan Fermentasi (Hi-fer) melalui Inokulasi Lactobacillus plantarum dan Asam Formiat. Dibimbing oleh SURYAHADI dan HERI AHMAD SUKRIA.
Solusi tepat guna diperlukan dalam rangka menunjang ketersediaan dan kualitas hijauan di Indonesia, yaitu melalui teknologi pengawetan, penyimpanan, transportasi dan distribusi. Teknologi pengawetan yang banyak digunakan adalah silase atau hay, namun aplikasi teknologi ini belum optimal di kalangan peternak. Teknologi ini perlu dimodifikasi namun dengan pendekatan yang berbeda.
Penggunaan aditif berupa sumber energi dan asam maupun garam organik yang dibutuhkan bagi bakteri dapat mempercepat proses fermentasi. Campuran ini disebut cairan aditif fermentasi (AF). Teknologi pengawetan hijauan menggunakan AF dikenal sebagai hijauan awet fermentasi (Hi-fer). Level penggunaan AF yang belum optimal menyebabkan terjadinya penurunan kualitas nutrisi Hi-fer selama penyimpanan. Oleh karena itu kualitas nutrisi Hi-fer dapat ditingkatkan dengan penambahan aditif lainnya, yaitu bakteri Lactobacillus plantarum dan asam formiat. Tujuan penelitian diantaranya adalah memperoleh level AF terbaik, mengetahui pengaruh penambahan kedua bahan aditif terhadap kualitas nutrisi Hi-fer serta menentukan perlakuan terbaik yang memberikan peningkatan mutu Hi-fer dan palatabilitas pada ternak.
Rangkaian penelitian terdiri atas 2 percobaan utama. Percobaan pertama terdiri dari 2 tahap. Tahap ke-1 menguji kualitas fisik dan fermentatif hasil akhir Hi-fer. Pengukuran kualitas fermentatif menggunakan rancangan acak lengkap pola faktorial 3x2x2 dengan 3 ulangan. Faktor pertama adalah level AF (5%, 7.5%, dan 10%), faktor kedua adalah L.plantarum (tanpa dan dengan menggunakan L.plantarum) dan faktor ketiga adalah asam formiat (tanpa dan dengan menggunakan asam formiat 0.15%). Tahap ke-2 menguji kualitas kimia, mikrobiologi dan kecernaan in vitro Hi-fer terpilih berdasarkan level AF. Rancangan percobaan pada analisa in vitro adalah rancangan acak kelompok dengan 4 jenis Hi-fer (P0= Hi-fer kontrol, P1= P0 + asam formiat, P2= P0 + L.plantarum, P3= P0 + asam formiat + L.plantarum) dan 3 kelompok cairan rumen serta 3 bag (kemasan) sebagai sub ulangan. Percobaan kedua menguji palatabilitas Hi-fer pada ternak. Rancangan percobaan menggunakan bujur sangkar latin dengan 4 jenis Hi-fer sebagai perlakuan dan 4 ekor ternak domba ekor tipis (jantan) selama 4 hari.
dikombinasikan dengan L. plantarum. Hasil percobaan kedua menunjukkan penambahan asam formiat mampu meningkatkan palatabilitas Hi-fer pada ternak domba. Simpulan hasil penelitian adalah baik penambahan L. plantarum maupun asam formiat dapat menekan penggunaan AF dan berkontribusi dalam meningkatkan kualitas nutrisi Hi-fer dengan kelebihan masing-masing. Perlakuan penambahan asam formiat terpilih mampu memberikan peningkatan kualitas nutrisi dan palatabilitas pada Hi-fer.
SUMMARY
SAPRILIAN STYA HAPSARI. Improvement on the Nutritive Quality of Fermented Forage (Hi-fer) through Inoculation of Lactobacillus plantarum and Formic Acid. Supervised by SURYAHADI and HERI AHMAD SUKRIA.
Appropriate technology solutions is needed to support the availability and quality of forage in Indonesia, with preservation, storage, transportation and distribution technology. Preservation technology which widely used are silage or hay, but the application of its technology is not optimal among farmers. This can be modified with different approaches.
The used of additives such as energy source, various acids and organic salt mineral is needed by bacteria to accelerate fermentation process. This combination called as liquid fermentation additive (FA). Preservation technology with the used of those AF is called as fermented forage (Hi-fer). Unoptimal level used of AF led to a decline in nutritional quality of Hi-fer during storage. Therefore nutritive quality of Hi-fer can be improved by the addition of other additives, namely Lactobacillus plantarum and formic acid. The research objective is to obtain the best level used of FA, determine the effect of the additives on the nutrititive quality of Hi-fer and determine the best treatment that provides improved quality of Hi-fer and palatability to livestock.
Series of research consisted of 2 main experiment. The first experiment consisted of 2 sub trial. First sub trial was a test of physical and fermentative quality. Fermentative quality used factorial randomized design 3x2x2 with 3 replication. First factor was level of liquid FA (5%, 7.5%, 10%), and second factor was inoculation of L.plantarum (without and with inoculation of L.plantarum) and third factor was addition of formic acid (without and with adition of 0.15% formic acid). The second sub trial tested the chemical, microbiological and in vitro digestibility of selected Hi-fer. In vitro analysis used block randomized design with 4 type of Hi-fer (P0= control Hi-fer, P1= P0 + formic acid, P2= P0 + L.plantarum, P3= P0 + formic acid + L.plantarum), 3 blocks based on different rumen fluid and 3 bag as sub replication. The second experiment was pallatablity test of Hi-fer on sheep. It used latin square design with 4 type of Hi-fer as treatment and 4 Javanesse thin-tailed sheep (male) for 4 days.
treatment selected as the best treatment that could improved nutrititive quality and palatability of Hi-fer.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Nutrisi dan Pakan
PENINGKATAN MUTU NUTRITIF HIJAUAN FERMENTASI
(Hi-
fer
) MELALUI INOKULASI
Lactobacillus plantarum
DAN ASAM FORMIAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Peningkatan Mutu Nutritif Hijauan Fermentasi (Hi-fer) melalui Inokulasi Lactobacillus plantarum dan Asam Formiat
Nama : Saprilian Stya Hapsari NIM : D251130051
Disetujui oleh Komisi Pembimbing
Dr Ir Suryahadi, DEA Ketua
Dr Ir Heri Ahmad Sukria, MScAgr Anggota
Diketahui oleh
Ketua Program Studi Ilmu Nutrisi Pakan
Dr Ir Dwierra Evvyernie, MS MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan baik. Tema yang dipilih dalam penelitian ini ialah pengawetan hijauan, dengan judul Peningkatan Mutu Nutritif Hijauan Fermentasi (Hi-fer) melalui Inokulasi Lactobacillus plantarum dan Asam Formiat. Penelitian dilaksanakan sejak bulan November hingga Mei 2015, dan penulis menyelesaikan penulisan karya ilmiah pada Desember 2015. Sebagian hasil penelitian ini akan dipublikasikan pada jurnal nasional terakreditasi dengan judul Improvement on the nutritive quality of fermented forage through inoculation of Lactobacillus plantarum and formic acid. Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Suryahadi, DEA dan Dr. Ir. Heri Ahmad Sukria, MScAgr selaku pembimbing dalam tugas akhir penulis. Terima kasih kepada Prof. Dr. Ir. Yuli Retnani, MSc selaku dosen penguji dan Dr. Ir. Rita Mutia, MSc selaku panitia perwakilan dari Pasca INP yang telah memberikan banyak masukan dan saran dalam rangka perbaikan tulisan pada sidang akhir tesis. Penulis juga menghaturkan terima kasih kepada Ir. Anita S. Tjakradidjaja, MRurSc dan Dr. Ir. Dwierra Evvyernie, MS, MSc atas kesediaannya memberikan perbaikan dan saran pada tesis penulis.
Ungkapan terima kasih penulis sampaikan kepada laboran Lab. Nutrisi Ternak Perah (Ibu Dian), Industri Pakan, Ilmu dan Teknologi Pakan serta Lab. Biokimia, Fisiologi dan Mikrobiologi Nutrisi (Ibu Yani), yang telah memfasilitasi dan memberi masukan teknis selama penelitian. Tak lupa penulis juga haturkan terima kasih kepada Sadeli Tim, yaitu Lilis Riyanti dan Dea Justia yang senantiasa hadir dan memberi dukungan baik pikiran maupun tenaga kepada penulis. Kepada seluruh keluarga CENTRAS (Centre for Tropical Animal Studies) LPPM IPB dan Pasca INP 2013 yang juga telah mendukung berlangsungnya penelitian hingga akhir. Selain itu terima kasih penulis ucapkan kepada keluarga sekretariat Pasca INP (Mas Supri dan Bu Ade) yang membantu segala kegiatan perihal kesekretariatan dan administratif penulis selama studi. Tak lupa penulis ucapkan terima kasih pada Lembaga Riset dan Teknologi Kementerian Pendidikan dan Perguruan Tinggi (RISTEK-DIKTI) atas Beasiswa BPPDN-DIKTI yang diberikan, sehingga penulis berkesempatan melanjutkan studi program pascasarjana (magister) di program studi INP IPB.
Penghargaan tertinggi penulis persembahkan kepada Almh. Mama, Bapak, Suami dan seluruh keluarga, atas segala doa, motivasi dan kasih sayangnya. Semoga karya ilmiah ini dapat bermanfaat bagi semua dan turut serta mendukung kemajuan ilmu pengetahuan umumnya dan peternakan khususnya. Aamiin.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
2 METODE 4
Waktu dan Tempat Pelaksanaan 4
Materi 4
Metode 4
3 HASIL DAN PEMBAHASAN 13
Percobaan 1: Kombinasi Level penggunaan Cairan Aditif Fermentasi, inokulasi L. plantarum dan penambahan asam formiat terhadap Kualitas
dan Kecernaan in vitro Hi-fer 13
Percobaan 2. Penggunaan inokulan L. plantarum dan asam formiat
terhadap palatabilitas Hi-fer pada domba 25
4 SIMPULAN DAN SARAN 28
DAFTAR PUSTAKA 29
LAMPIRAN 33
RIWAYAT HIDUP 45
DAFTAR TABEL
1 Skema pengacakan rancangan BSL 12
2 Kualitas fisik Hi-fer perlakuan 13
3 pH Hi-fer perlakuan 15
4 Kandungan bahan kering (%) Hi-fer 16
5 Kandungan N-NH3 (g/100g) Hi-fer 18
6 Penyusutan berat segar Hi-fer (%) 19
7 Nilai Fleigh Hi-fer 19
8 Kandungan nutrient Hi-fer setelah ensilase 21 hari (100% BK) 20 9 Fermentabilitas dan koefisien cerna in vitro Hi-fer 23 10 Palatabilitas bahan kering Hi-fer dalam 4 jam (g/ekor) 25 11 Palatabilitas segar dan bahan kering Hi-fer perlakuan dalam 4 jam 26
DAFTAR GAMBAR
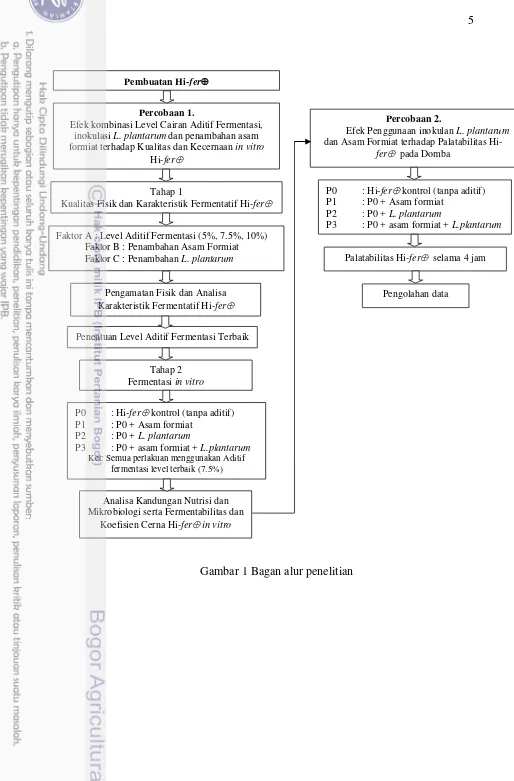
1 Bagan alur penelitian 5
2 Tampilan fisik Hi-fer setelah 21 hari inkubasi 14
3 Diagram populasi BAL dan asam laktat Hi-fer 21
DAFTAR LAMPIRAN
1 Hasil analisa dan uji lanjut duncan interaksi perlakuan terhadap
pH Hi-fer 33
2 Hasil analisa dan uji lanjut duncan interaksi perlakuan terhadap
bahan kering (BK) Hi-fer 33
3 Hasil analisa dan uji lanjut duncan interaksi perlakuan terhadap
konsentrasi N-NH3 Hi-fer 34
4 Hasil analisa dan uji lanjut duncan interaksi perlakuan terhadap
penyusutan berat segar (%) Hi-fer 35
5 Hasil analisa dan uji lanjut duncan interaksi perlakuan terhadap
nilai fleigh Hi-fer 36
6 Hasil analisa dan uji lanjut duncan pengaruh perlakuan terhadap
konsentrasi asam laktat Hi-fer 37
7 Hasil analisa pengaruh perlakuan terhadap populasi BAL Hi-fer 38 8 Hasil analisa dan uji lanjut duncan pengaruh perlakuan terhadap
konsentrasi N-NH3 rumen in vitro 38
9 Hasil analisa dan uji lanjut duncan pengaruh perlakuan terhadap
konsentrasi VFA rumen in vitro 39
10 Hasil analisa dan uji lanjut duncan pengaruh perlakuan terhadap
koefisien cerna bahan kering (KCBK) rumen in vitro 39 11 Hasil analisa dan uji lanjut duncan pengaruh perlakuan terhadap
13 Hasil analisa pengaruh perlakuan terhadap proporsi propionat 41 14 Hasil analisa pengaruh perlakuan terhadap proporsi butirat 41 15 Hasil analisa pengaruh perlakuan terhadap proporsi isobutirat 41 16 Hasil analisa dan uji lanjut duncan pengaruh perlakuan terhadap proporsi
isovalerat 42
1
PENDAHULUAN
Latar Belakang
Usaha peternakan khususnya ruminansia bergantung pada ketersediaan hijauan. Hijauan merupakan bahan pakan utama bagi ternak ruminansia, namun ketersediaan dan kualitas hijauan di Indonesia masih tergolong rendah. Ketersediaan pakan yang belum memadai mengakibatkan terjadinya kesulitan dalam peningkatan populasi ternak sapi (Suryahadi et al. 2009). Hal ini disebabkan oleh beberapa permasalahan dalam pakan, diantaranya adalah: (1) Mutu nutrisi pakan lokal rendah. Umumnya peternak menggunakan rumput lapang atau limbah pertanian yang rendah kandungan energi dan protein. Sehingga dibutuhkan adanya teknologi pengolahan untuk meningkatkan mutu nutrisi pakan, (2) produksi bersifat musiman, dimana berlimpah ketika musim hujan namun terjadi kelangkaan ketika musim kemarau. Hal ini memerlukan solusi pengawetan, sehingga pakan dapat disimpan dan tersedia dalam jangka waktu yang lama, dan (3) lokasi produksi pakan tidak setumpu dengan lokasi produksi ternak. Ketiadaan pakan dan sistem pengangkutan pakan yang sulit menyebabkan peningkatan biaya pakan ternak. Secara ringkas teknologi yang dibutuhkan adalah pengawetan, penyimpanan, kemudahan transportasi dan distribusi. Teknologi yang mudah, murah dan mampu menjawab semua permasalahan diatas dapat menjadi solusi terlebih ketika teringkas dalam suatu sisem yang terintegrasi. Sebagai contoh teknologi pengawetan yang telah dikenal adalah silase atau hay. Namun hingga saat ini teknologi ini belum optimal dan belum teraplikasikan dengan baik pada peternakan rakyat, hanya terbatas pada perusahaan atau peternakan skala besar. Beberapa kendala yang ditemui di peternak antara lain adalah tingkat kegagalan dalam pembuatan yang masih cukup tinggi dan sulit diaplikasikan secara meluas. Hal ini terkait dengan kelembapan udara yang tinggi sehingga menyulitkan dalam proses pembuatan terutama pemadatan. Adapun penyimpanan hijauan secara konvensional dan sederhana dalam bentuk kering meningkatkan resiko mudah terbakar.
Hal ini yang selanjutnya mendasari penelitian berupa pengembangan silase namun dengan pendekatan yang berbeda. Pendekatan yang dimaksud adalah melalui beberapa modifikasi sehingga lebih mudah untuk diaplikasikan, murah dan dengan mutu nutrisi yang baik. Agar teknologi lebih mudah dibuat, maka perlu dilakukan penambahan bahan aditif. Tujuan utama yang hendak dicapai adalah mempercepat proses fermentasi sehingga mudah dalam pembuatan dan mampu menghasilkan produk akhir yang berkualitas. Aditif yang dikembangkan merupakan campuran dari berbagai komponen seperti sumber energi (molasses), asam-asam serta garam-garam organik yang dibutuhkan oleh bakteri selama fermentasi. Lebih lanjut campuran ini disebut sebagai cairan aditif fermentasi (AF). Cairan aditif ini mampu: (1) meningkatkan palatabilitas pakan fermentasi, (2) meningkatkan daya simpan pakan dan (3) mempercepat proses fermentasi (Suryahadi, 2013). Cairan AF tersebut dibutuhkan untuk mempercepat penurunan pH, mengoptimalkan pertumbuhan BAL sehingga mempercepat proses fermentasi secara anaerob.
2
tingkat kekeringan yang tinggi dapat dimanfaatkan dalam bentuk pakan atau hijauan fermentasi. Teknologi fermentasi ini disebut sebagai hijauan awet fermentasi (Hi-fer). Teknologi yang tepat guna dan terintegrasi akan lebih mudah untuk diaplikasikan di masyarakat. Sehingga produk Hi-fer dikemas dalam kemasan komersial (plastik) agar praktis dan mudah untuk diaplikasikan oleh masyarakat secara luas. Hal ini tentunya akan memudahkan dalam proses pendistribusian, transportasi dan pengangkutan (Centras 2013). Kelebihan dari Hi-fer, diantaranya adalah: 1) dapat diproduksi oleh masyarakat (petani/peternak) secara masal, 2) mudah (secara manual dengan peralatan dan bahan tersedia di lokasi setempat) baik secara produksi/pembuatan maupun transportasi dan 3) biaya produksi murah. Hi-fer telah terbukti bermanfaat diaplikasikan pada masyarakat maupun ternak (Suryahadi 2014). Namun jumlah penggunaan cairan AF yang selama ini hanya didasarkan pada kondisi faktual di lapang, dirasa perlu dilakukan pengevaluasian kembali. Fermentasi pada intensitas yang lebih tinggi dan berkelanjutan menyebabkan terjadinya penurunan kualitas Hi-fer, terutama jika disimpan dalam jangka waktu lama (Suryahadi 2014). Penurunan kualitas Hi-fer dikhawatirkan akan berdampak pada palatabilitas Hi-fer terutama pada ternak ruminansia kecil. Hal ini yang kemudian mendasari penelitian lanjutan untuk memperoleh takaran/jumlah penggunaan AF yang tepat dan diharapkan mampu meningkatkan kualitas nutrisi Hi-fer.
Poin penting dalam proses fermentasi adalah mempercepat produksi asam sehingga kehilangan nutrient dapat ditekan. Oleh karena itu diperlukan penambahan aditif lainnya yang bertujuan untuk meningkatkan proses fermentasi secara lebih efisien sehingga mampu meningkatkan kualitas nutrisi Hi-fer. Berbagai jenis aditif baik biologis maupun kimiawi telah banyak digunakan dan dikembangkan untuk meningkatkan kualitas fermentasi. Inokulan yang mengandung strain bakteri asam laktat (BAL) telah dikembangkan dan digunakan untuk menstimulasi proses frementasi (McDonald et al. 1991). Pada proses ensilase hijauan, BAL digunakan sebagai aditif untuk meningkatkan nilai nutrisi tanaman melalui aksi minimalisasi respirasi tanaman dan aktivitas enzim serta dengan menghambat populasi mikroba merugikan. Penambahan inokulan BAL menghasilkan kualitas yang lebih baik pada silase hijauan dibandingkan dengan penggunaan inokulan komersil (Bureenok et al. 2006 dan Santoso et al. 2011). BAL homofermentatif seperti Lactobacillus plantarum, Enterococcus faecium dan Pediococcus spp. mampu menurunkan pH dengan cepat dan menghasilkan rasio laktat:asetat yang lebih tinggi. Fungsi inokulan tersebut adalah untuk menjadikan proses fermentasi berjalan dengan cepat dan efisien dengan perombakan karbohidrat terlarut (Water Soluble Carbohydrate/ WSC) menjadi asam laktat dan mampu meningkatkan masa simpan silase dengan kehilangan nutrient seminimal mungkin. Lactobacillus plantarum (L. plantarum) merupakan spesies BAL homolaktat yang mampu menghasilkan penurunan pH dengan cepat, peningkatan jumlah BAL dan penghambatan mikroorganisme perusak (Adesoji et al. 2010). L. plantarum meningkatkan fermentasi silase dengan dominasi fermentasi oleh bakteri homolaktat dan menghasilkan banyak asam laktat (Filya dan Sucu 2007). Asam laktat berperan dalam menurunkan pH silase (Ennahar et al. 2003) dan pengawet, sehingga dapat menghindarkan adanya pertumbuhan mikroorganisme pembusuk.
3 secara utama bertujuan untuk menurunkan konsentrasi asam hasil fermentasi, mengurangi kehilangan dan mempertahankan sebanyak mungkin kandungan nutrisi pada hijauan yang diensilase. Aditif yang berperan sebagai penghambat fermentasi umumnya adalah asam. Pemberian dosis asam yang tepat, akan menurunkan pH silase secara cepat dan membatasi terjadinya kehilangan protein dan karbohidrat selama proses fermentasi (Luckstadt 2009). Asam formiat (HCOOH) termasuk bahan aditif kimia yang telah lama dikenal dalam proses ensilase. Terutama banyak digunakan pada hijauan yang sulit diawetkan melalui potensinya dalam menekan aktifitas bakteri yang tidak diinginkan, dan memungkinkan bakteri asam laktat untuk mendominasi selama proses fermentasi (McDonald et al.1991). Dominasi aktivitas BAL akan menurunkan kehilangan CO2 dan menghasilkan lebih banyak
BK yang tersedia pada produk fermentasi (Lorenzo dan O’Kiely 2008). Pembatasan fermentasi pada perlakuan asam formiat diketahui menghasilkan konsentrasi gula residu yang tinggi, peningkatan sintesis protein mikroba rumen dan penurunan proporsi pada VFA rumen dibandingkan silase tanpa perlakuan (Jaakola et al. 1991). Asam formiat sebagai pembatas fermentasi berkorelasi positif dengan sintesis protein mikroba di rumen dan menghasilkan lebih banyak proporsi VFA lipogenik (Jaakola et al. 2006).
Tujuan Penelitian
1. Memperoleh level optimal penggunaan cairan AF sehingga mampu memberikan peningkatan mutu nutrisi Hi-fer
2. Mengetahui pengaruh penambahan L.plantarum dan aditif asam formiat pada kualitas nutritive Hi-fer
4
2
METODE
Waktu dan Tempat Pelaksanaan
Penelitian dilaksanakan pada bulan November 2014 hingga Mei 2015. Produksi Hi-fer dilakukan di Laboratorium Industri Pakan Fapet IPB. Pengujian palatabilitas pada ternak dilaksanakan di peternakan rakyat CV Anugerah Farm, Ciampea-Jasinga Bogor. Analisa laboratorium di Laboratorium Ternak Perah Fakultas Peternakan IPB, Laboratorium Biokimia, Fisiologi dan Mikrobiologi Nutrisi Fakultas Peternakan IPB, dan Laboratorium Ilmu dan Teknologi Pakan Fakultas Peternakan IPB.
Materi
Bahan
Bahan-bahan yang digunakan dalam pembuatah Hi-fer adalah rumput gajah (Pennisetum purpureum) yang berasal dari kebun Fapet IPB, kultur murni L. plantarum 1A-2 dari Pusat Penelitian Bioteknologi LIPI Cibinong Bogor, asam formiat 55%, cairan Aditif Fermentasi (AF) dari CENTRAS LPPM IPB dan sweetener. Bahan untuk perbanyakan bakteri adalah media MRS-B (deMann Rogose Sharpe Broth), bacto agar dan NaCl. Adapun bahan yang digunakan dalam analisa in vitro antara lain cairan rumen sapi Peranakan Ongol berfistula (fistulated cattle) berasal dari LIPI Cibinong Bogor, larutan McDougall, larutan pepsin-HCl, HgCl2 jenuh, dan bahan-bahan penunjang laboratorium lainnya.
Alat
Alat-alat yang digunakan dalam penelitian ini antara lain laminar air flow, shaker waterbath, Gas Chromatograph (Shimadzu GC-8A, colom no 80/100 Chromosorb W), spektrofotometer, pH meter HACH Spain, shaker model VRN-360 dan seperangkat glassware seperti gelas ukur, tabung reaksi, cawan petri dan erlenmeyer.
Ternak yang digunakan adalah domba Ekor Tipis jantan dengan bobot badan rataan 20 kg sebanyak 4 ekor. Ternak ditempatkan pada kandang individu.
Metode
5
Gambar 1 Bagan alur penelitian Percobaan 1.
Efek kombinasi Level Cairan Aditif Fermentasi, inokulasi L. plantarum dan penambahan asam formiatterhadap Kualitas dan Kecernaan in vitro
Hi-fer
Faktor A : Level Aditif Fermentasi (5%, 7.5%, 10%) Faktor B : Penambahan Asam Formiat Faktor C : Penambahan L. plantarum
Tahap 1
Kualitas Fisik dan Karakteristik Fermentatif Hi-fer
Pengamatan Fisik dan Analisa Karakteristik Fermentatif Hi-fer
Penentuan Level Aditif Fermentasi Terbaik
Tahap 2 Fermentasi in vitro
P0 : Hi-ferkontrol (tanpa aditif) P1 : P0 + Asam formiat
P2 : P0 + L. plantarum
P3 : P0 + asam formiat + L.plantarum Ket: Semua perlakuan menggunakan Aditif
fermentasi level terbaik (7.5%)
Analisa Kandungan Nutrisi dan Mikrobiologi serta Fermentabilitas dan
Koefisien Cerna Hi-fer in vitro
Percobaan 2.
Efek Penggunaan inokulan L. plantarum dan Asam Formiat terhadap Palatabilitas
Hi-fer pada Domba
P0 : Hi-ferkontrol (tanpa aditif) P1 : P0 + Asam formiat
P2 : P0 + L. plantarum
P3 : P0 + asam formiat + L.plantarum
Palatabilitas Hi-fer selama 4 jam
Pengolahan data
6
Peremajaan Isolat dan Pembuatan Inokulum Hi-fer
Isolat L. plantarum 1A2 yang digunakan sebagai inokulum Hi-fer ditumbuhkan pada media spesifik BAL, yaitu deMan Rogosa Sharpe (MRS). Pertama-tama kultur starter diperbanyak dengan media MRS Agar pada cawan petri atau agar miring di tabung reaksi. Inkubasi dilakukan selama 18 jam pada suhu ruang (28-30C). Setelah kultur tumbuh dan tidak nampak adanya kontaminasi, maka dapat disimpan di kulkas dan digunakan sebagai stok dalam pembuatan inokulum Hi-fer. Inokulum dibuat dengan menginokulasikan 3 ose dari stok L. plantarum ke dalam 10 ml media MRS broth (cair) sebagai prekultur, ditransfer 1% (v/v) prekultur ke dalam media MRS cair selanjutnya. Keberhasilan ditandai dari adanya endapan berwarna putih dan tidak tampak adanya hifa atau serat yang mengambang dan mengapung (media jernih seperti awal pembuatan). Penghitungan koloni BAL menggunakan metode total plate count (TPC) dan diperoleh populasi akhir L. plantarum sebanyak 1,6 x 109 CFU/ml.
Prosedur Pembuatan Hi-fer
Rumput gajah di panen pada umur potong 30 hari. Selanjutnya dilayukan terlebih dahulu selama dua malam. Pelayuan dilakukan dengan cara mengangin-anginkan rumput pada suhu ruang di bawah naungan. Hal ini bertujuan untuk mengurangi kadar air yang terdapat pada rumput. Kemudian rumput dichop/dicacah hingga berukuran 3-5 cm. Cairan aditif fermentasi dicampurkan sejumlah level perlakuan, yaitu 5%, 7.5% dan 10% (Suryahadi 2014) pada rumput gajah hingga rata. Pada tahapan ini dilakukan penerapan perlakuan penambahan L.plantarum sebanyak 0.0625 ml/kg rumput (kepadatan populasi 109 cfu/ml) dan asam formiat sebanyak 0,15% per kg rumput (Sariri et al. 2011). Setelah tercampur merata, selanjutnya rumput dimasukkan kedalam kantong plastik transparan LDPE (bag) berukuran 50x85cm. Rumput dimampatkan dan diupayakan tidak ada udara dalam kantong. Lapisan kantong dibuat sebanyak 2 lapis (double layer) untuk mencegah kebocoran. Tiap kantong berisi 15 kg, dan selama masa simpan Hi-fer disimpan pada ruangan tertutup (terhindar dari hujan) dan kondisi suhu ruang selama 3 minggu hingga siap dianalisa.
Percobaan 1. Efek kombinasi Level penggunaan Cairan Aditif Fermentasi, inokulasi L. plantarum dan penambahan asam formiatterhadap Kualitas dan Kecernaan in vitro Hi-fer
Tujuan percobaan ini adalah memperoleh Hi-fer kualitas terbaik melalui kombinasi antara faktor level cairan AF, inokulasi L. plantarum dan penambahan asam formiat. Percobaan dibagi menjadi dua tahap, yaitu tahap pertama dengan mengukur karakteristik fisik dan fermentative Hi-fer dan tahap kedua menguji mutu kimia, mikrobiologis dan kecernaan in vitro Hi-fer.
Tahap 1. Karakteristik fisik dan fermentative Hi-fer
Peubah awal yang diukur pada tahap pertama penelitian adalah mutu fisik Hi-fer. Selain itu juga dilakukan pengukuran beberapa peubah karakteristik fermentasi Hi-fer, yaitu: pH, kadar N-NH3 Hi-fer (mikrodifusi conway),
7
Pengukuran Kualitas Fisik Hi-fer. Pengamatan fisik terdiri atas: warna, bau, tekstur dan keberadaaan jamur dalam Hi-fer. Pengamatan dilakukan secara organoleptik setelah tiga minggu proses ensilase. Sampling dilakukan dengan membuka tiap kantong dan mengamati seluruh bagian, yaitu bagian atas, tengah dan bawah kantong. Pengamatan dilakukan secara organoleptik deskriptif oleh peneliti. Sebagai penunjang observasi, digunakan bantuan media gambar (photo). Aroma atau bau dapat diklasifikasikan sebagai bau busuk, harum (asam), harum alkohol.
Pengukuran pH. Hi-fer yang baru dibuka ditimbang sebanyak 10 gram dan dicampur dengan 100 ml aquadest dengan cara dishaker pada kecepatan 600 rpm selama 10 menit. pH cairan diukur menggunakan Pocket pH meter yang telah dikalibrasi. Pembacaan pH dilakukan setelah screen stabil atau ±30 detik.
Pengukuran N-NH3 Hi-fer. Pengukuran N-NH3 dengan metode
mikrodifusi Conway (1957). Sebanyak 1 ml sampel yang sama dengan sampel pengukuran pH ditempatkan pada salah satu ujung jalur cawan Conway yang telah diolesi vaselin kemudian 1 ml larutan Na2CO3 ditempatkan pada sisi yang
bersebelahan dengan sampel. Asam borat berindikator sebanyak 1 ml ditempatkan didalam cawan kecil yang ada dibagian tengah cawan Conway kemudian tutup rapat cawan Conway. Supernatan dan larutan Na2CO3 dicampur
hingga rata dengan cara cawan Conway dimiringkan. Diamkan selama 24 jam pada suhu kamar dan setelah 24 jam asam borat berindikator dititrasi menggunakan H2SO4 sampai terjadi perubahan warna dari biru menjadi merah.
Kemudian kadar NH3 dihitung dengan rumus:
N NH mM = � � � � � � �
Perhitungan nilai Fleigh. Nilai fleigh dihitung menggunakan rumus Kilic (1984):
NF = 220 + (2 x BK (%) – 15) – (40 x pH)
Penghitungan berdasarkan rumus fleigh digunakan untuk mempermudah mengestimasi kualitas suatu produk fermentasi, berdasarkan karakteristik fermentative yaitu nilai pH dan BK.
Perlakuan dan rancangan percobaan tahap 1
8
dengan ANOVA dan apabila terdapat perbedaan diuji lanjut dengan Duncan. Secara umum model matematis rancangan adalah sebagai berikut:
RAL Faktorial : Yjkl = + j + k + l + jkl + jkl
Keterangan :
Yjkl = Nilai pengamatan faktor A ke-j, faktor B ke-k dan faktor C ke-l
= Rataan umum pengamatan
j = Pengaruh faktor A ke-j / perlakuan ke-j
k = Pengaruh faktor B ke-k
l = Pengaruh faktor C ke-l
jkl = Pengaruh interaksi faktor A ke-i, faktor B ke-j dan faktor C ke-k
jkl = Galat percobaan untuk faktor A ke-j, faktor B ke-k dan faktor C
ke-l
Tahap 2. Mutu kimia, mikrobiologis dan kecernaan in vitro Hi-fer
Perlakuan Hi-fer terpilih dari tahap pertama berdasarkan level cairan AF selanjutnya dilakukan pengujian dengan peubah kualitas kimia, mikrobiologis dan kecernaan in vitro. Kualitas kimia Hi-fer dengan menganalisa kandungan nutrient Hi-fer menggunakan prosedur standar proksimat (AOAC 2005) dan VanSoest (VanSoest et al. 1991) yang meliputi BK, Abu, PK, SK, LK, NDF, ADF dan lignin. Pengukuran menggunakan sampel Hi-fer yang telah dikeringkan dalam oven 105C dan digiling hingga berbentuk tepung. Selain itu juga diukur kadar asam laktat Hi-fer dengan Spektrofotometer (Baker dan Summerson 1941). Secara mikrobiologis dianalisa jumlah koloni BAL dalam Hi-fer dengan Total Plate Count(Fardiaz 1992).
Fermentabilitas Hi-fer diukur secara in vitro (Tilley dan Terry 1963). Peubah yang diamati adalah Produksi VFA total (steam destillation), VFA parsial dengan Gas Chromatography (General Laboratory Procedures 1966) dan konsentrasi NH3 (mikrodifusi Conway). Dilanjutkan dengan pengukuran
kecernaan yang meliputi Koefisien Cerna Bahan Kering (KCBK) dan Bahan Organik (KCBO) (Tilley dan Terry 1963).
Pengukuran Kadar Asam Laktat (Baker and Summerson 1941).
Pengukuran asam laktat dengan menggunakan spektrofotometer. Sebanyak 1 gram sampel Hi-fer digrinder hingga lumat dan dengan ditambah TCA 10% sedikit demi sedikit sambil disaring dan ditampung dalam tabung sentrifuse sampai mendapatkan filtrat 5 ml. Selanjutnya disentrifuse dengan kecepatan 3000 rpm selama 15 menit. Supernatan dituang dan ditambahkan kembali TCA 10% sampai 5 ml (A).
Tabung sentrifuse diisi 1 ml aquades sebagai blanko. Tabung kedua diisi dengan 1 ml larutan standar asam laktat yang mengandung 0,01 mg/ml. Tabung ketiga diisi dengan 1 ml filtrat bebas protein (A). Pada semua tabung sentrifuse ditambahkan 0,5 ml larutan CuSO4 20% dan diencerkan hingga 5 ml dengan
9 dengan stopper atau parafilm dan dikocok dengan vortex hingga padat hancur
dan homogen, kemudian didiamkan. Lakukan berulang selama ≥ ½ jam.Setelah semua tabung disetarakan beratnya, selanjutnya disentrifuse dengan kecepatan 3000 rpm selama 15 menit. Kemudian diambil 0,5 ml supernatan, dimasukkan dalam tabung reaksi yang kering dan bersih. Pada tiap tabung reaksi ditambahkan 0,025 ml CuSO4 4%, ditambahkan setetes demi setetes dengan
buret 3 ml H2SO4 pekat. Isi tabung akan menjadi panas, dan selanjutnya
dimasukkan dalam air mendidih ± 5 menit. Tabung didinginkan dengan air
mengalir/ es dengan suhu ≤ 20C dan ditambahkan 0,05 ml reagent p-hidrosiphenil setetes demi setetes hingga menjadi putih. Campuran dihomogenkan dan dimasukkan kedalam water bath 30C selama ≥ 30 menit. Kemudian dimasukkan ke dalam air mendidih selama 90 detik dan didinginkan. Isi tabung akan berubah warna menjadi violet. Isi tabung terakhir dipindahkan pada kuvet dan dimasukkan dalam spektrofotometer dengan spektonik 20 panjang gelombang 560 nm (vis). Penghitungan absorbansi dengan regresi linier.
Y= a + bx
Penghitungan Jumlah Koloni Bakteri Asam Laktat (Fardiaz 1992).
Jumlah koloni bakteri asam laktat dihitung dengan menggunakan Metode Total Plate Count (TPC). Sampel Hi-fer ditambah aquades dengan perbandingan 1:2. Sebanyak 1 ml cairan Hi-fer dimasukkan ke dalam 9 ml aquades, lalu diencerkan dengan mengambil 1 ml dimasukkan ke 9 ml aquades sampai pengenceran 7 kali. Lalu sebanyak 0.1 ml dari pengenceran 6 dan 7 kali ditanam pada cawan petri berisi media MRS agar. Media agar yang ditanam dengan sampel silase diinkubasi pada suhu ruang selama 3 hari. Koloni yang tumbuh berbentuk bulat miring bewarna agak kekuningan. Jumlah koloni yang diperoleh ditranformasi dalam log.
Populasi BAL (cfu/g) = jumlah koloni x pengenceran
Inkubasi in vitro (Tilley dan Terry 1963). Sebanyak 0.5 gram sampel Hi-fer dimasukkan ke tabung fermentor dan ditambahkan 10 ml larutan buffer McDougall dan 40 ml cairan rumen. Pengambilan cairan rumen dilakukan 2-3 jam setelah pemberian pakan pagi. Cairan rumen diperas dan disaring menggunakan dua lapis kain kasa steril kemudian dipindahkan ke tabung fermentor dan secara kontinyu dialiri CO2 didalam shaker water bath pada suhu
39C. Keduanya diaduk dengan gas CO2 selama 30 detik dan ditutup rapat
dengan karet berventilasi. Tabung fermentor ditempatkan pada shaker water bath dengan suhu 39C dan fermentasi dilakukan selama 4 jam untuk sampel pH rumen, NH3, VFA total dan parsial, dan fermentasi 48 jam untuk sampel
KCBK/KCBO. Setelah inkubasi kedalam tabung fermentor ditambahkan 2-3 tetes HgCl2 jenuh untuk menghentikan aktivitas mikroba.
Pengukuran N-NH3 rumen. Pengukuran N-NH3 menggunakan metode
Mikrodifusi Conway (General Laboratory Procedure 1966). Setelah inkubasi selama 4 jam di dalam shaker water bath ditambahkan 2-3 tetes HgCl2 jenuh ke
10
Sebanyak 1 ml supernatan sampel ditempatkan pada salah satu ujung alur cawan Conway, disisi yang bersebelahan ditambahkan 1 ml larutan Na2CO3, dan pada
bagian tengah ditambahkan 1 ml Asam borat berindikator. Kemudian cawan ditutup rapat dan perlahan-lahan supernatan dan larutan Na2CO3 dicampur
dengan cara cawan dimiringkan. Cawan didiamkan selama 24 jam dan dititrasi menggunakan H2SO4 sampai terjadi perubahan warna dari biru menjadi merah.
Kadar NH3 dihitung dengan rumus:
N − NH mM = � � � � � � � � �
Pengukuran VFA Total. Supernatan yang telah disiapkan menggunakan prosedur yang sama denganpenggukuran NH3 rumen sebanyak 5 ml dimasukkan
ke dalam tabung destilasi, lalu segera ditambahkan dengan 1 ml H2SO4 15 %
dan ditutup dengan tutup karet yang mempunyai lubang dan dapat dihubungkan dengan labu pendingin. Tabung destilasi dimasukkan ke dalam labu penyulingan yang berisi air mendidih (dipanaskan terus selama destilasi). Uap air panas akan mendesak campuran supernatan dan H2SO4 dan akan terkondensasi dalam labu
pendingin. Air yang terbentuk ditampung dalam labu erlenmeyer yang berisi 5 ml NaOH 0,5 N hingga 300 ml. Kemudian ditambahkan indikator PP (Phenolpthaline) sebanyak 2 - 3 tetes dan dititrasi dengan HCl 0,5 N sampai berubah warna dari merah jambu menjadi merah seulas (tidak berwarna). Produksi VFA total dapat dihitung dengan rumus sebagai berikut:
VFA total mM = � − � � � � � /
Keterangan:
a = volume titran blanko (ml) b = volume titran contoh (ml)
Pengukuran VFA Parsial. Pengukuran produksi VFA parsial (asetat, propinat, butirat, isobutirat, valerat, isovalerat) dilakukan dengan alat Gas Chromatography (General Laboratory Procedures 1966). Sampel VFA parsial yang digunakan merupakan supernatant yang sama untuk pengukuran NH3 dan VFA total. Sebanyak 1.5 ml supernatant dimasukkan ke dalam tabung ependorf dan disimpan dalam kondisi dingin (freezer). Sebelum diinjeksikan, sampel ditambahkan asam agar pH turun dan sampel lebih stabil. Sampel diinjekkan sebanyak 0.4 l pada GC. Dengan membaca kromatogram standar yang konsentrasinya sudah diketahui maka konsentrasi VFA yang akan diukur dapat dilihat pada kromatogram. Konsentraso VFA sampe dihitung dengan rumus: mM sampel VFA = A a h x M
A a a a
11 disentrifuge 3500 rpm selama 15 menit. Supernatan yang dihasilkan dibuang dan ditambahkan 50 ml larutan pepsin HCl 0,2% dalam endapan. Pencernaan enzimatis berlangsung aerob selama 48 jam. Residu disaring menggunakan kertas Whatman no.41 yang dibantu dengan pompa vakum. Kemudian hasil saringan dimasukkan kedalam cawan porselen dan dipanaskan didalam oven suhu 105C selama 24 jam untuk menentukan BK residu. Selanjutnya residu BK dimasukkan kedalam tanur 600C selama 6 jam untuk mendapatkan residu bahan organik. Sebagai blanko digunakan residu asal fermentasi tanpa sampel. KCBK dan KCBO dhitung berdasarkan rumus:
% KCBK = � − � � � � − � � %
% KCBO = − � � − � %
Perlakuan dan rancangan percobaan tahap 2
Tahap kedua terdiri atas dua jenis rancangan percobaan. Peubah mutu kimia dan mikrobiologis dengan menggunakan Rancangan Acak Lengkap (RAL) dengan 4 perlakuan dan 3 ulangan. Rancangan kedua digunakan untuk pengujian in vitro Hi-fer, yaitu Rancangan Acak Kelompok (RAK) dengan 4 perlakuan dan 3 kelompok cairan rumen dan 3 bag Hi-fersebagai sub ulangan. Perlakuan terdiri atas 4 jenis Hi-fer yang berbeda sebagai hasil dari percobaan tahap 1.
P0 = Hi-fer kontrol (tanpa aditif) P1 = P0 + Asam formiat
P2 = P0 + Inokulan L. plantarum P3 = P0 + asam formiat + L. plantarum
Data dianalisis dengan ANOVA dan apabila terdapat perbedaan diuji lanjut dengan Duncan. Secara umum model matematis rancangan adalah sebagai berikut:
RAL : Yij = + i + ij
RAK : Yijk = + i + k + ijk
Keterangan :
Yij = Nilai pengaruh perlakuan
Yijk = Nilai pengamatan perlakuan ke-i, ulangan ke-j dan
kelompok ke-k
= Rataan umum pengamatan i = Pengaruh perlakuan ke-i
k = Pengaruh kelompok (cairan rumen) ke-k
ij = Galat percobaan untuk perlakuan ke-i dan ulangan ke-j
ijk = Galat percobaan untuk perlakuan ke-i, ulangan ke-j dan
12
Percobaan 2. Efek Penggunaan inokulan L. plantarum dan Asam Formiat terhadap Palatabilitas Hi-fer pada Domba
Sebagai tindak lanjut dari percobaan pertama, Hi-fer selanjutnya diukur tingkat palatabilitasnya langsung pada ternak domba. Setiap perlakuan diuji dengan diberikan pada ternak secara adlibitum. Hi-fer ditempatkan didalam wadah pakan dan diletakkan pada setiap kandang individu. Penelitian menggunakan empat ekor domba jantan didalam kandang individu. Pakan diberikan selama empat jam, yaitu dimulai pukul 07.00 hingga pukul 11.00 WIB.
Hi-fer perlakuan dipindahkan dan digilir ke setiap kandang lainnya secara acak sehingga semua domba mendapat giliran pakan yang berbeda. Palatabilitas bahan kering setiap Hi-fer perlakuan yang dikonsumsi diukur setiap pukul 11.00 WIB atau empat jam setelah pemberian pakan berdasarkan modifikasi metode Rogosic et al. (2006). Pengukuran palatabilitas dengan menimbang jumlah pakan segar yang diberikan dan menghitung pakan yang tersisa. Palatabilitas Hi-fer ditetapkan pada basis g kg-1 berat badan metabolik (g kg-1 BB0.75).
Perlakuan dan rancangan percobaan
Pengamatan palatabilitas dengan menerapkan rancangan percobaan Bujur Sangkar Latin (BSL) 4x4 menggunakan empat ekor domba jantan dengan empat perlakuan berbeda selama empat hari. Skema pengacakan diperlihatkan pada tabel 1 berikut. Perlakuan terdiri atas:
P0 = Hi-fer (kontrol)
P1 = Hi-fer + Asam Formiat P2 = Hi-fer + L. plantarum
P3 = Hi-fer + Asam Formiat + L. plantarum
Data dianalisis dengan ANOVA dan apabila terdapat perbedaan diuji lanjut dengan uji Duncan. Secara umum model matematis rancangan adalah sebagai berikut:
Yijk = µ + i + j + k + ijk
Yij = nilai pengamatan pada baris ke-i, kolom ke-j dan perlakuan ke-k
µ = rataan umum
i = pengaruh ternak ke-i
j = pengaruh hari ke-j
k = pengaruh perlakuan ke-k
ij = pengaruh galat ke-i, kolom ke-j, perlakuan ke-k.
13
3
HASIL DAN PEMBAHASAN
Percobaan 1: Kombinasi Level penggunaan Cairan Aditif Fermentasi, inokulasi L. plantarum dan penambahan asam formiatterhadap Kualitas dan
Kecernaan in vitro Hi-fer
Kualitas Fisik Hi-fer
Secara keseluruhan hasil ensilase Hi-fer memperlihatkan kualitas fisik yang baik. Kualitas fisik merupakan tolok ukur awal dalam menentukan kualitas suatu produk ensilase. Beberapa peubah fisik diantaranya adalah warna, bau, tekstur dan keberadaan jamur di Hi-fer ditampilkan pada tabel 2 berikut. Karakteristik fisik yang dihasilkan pada produk hasil fermentasi secara umum mampu menggambarkan kualitas silase tersebut (Ferreira dan Merten 2005).
Tabel 2 Kualitas fisik Hi-fer perlakuan
Level
5 Hijau kecoklatan Hijau kecoklatan Hijau kecoklatan Hijau kecoklatan
7.5 Hijau kecoklatan Hijau kecoklatan Hijau kecoklatan Hijau kecoklatan
10 Hijau kecoklatan Hijau kecoklatan Hijau kecoklatan Hijau kecoklatan
Bau
5 Harum Harum Harum Harum
7.5 Harum Harum Harum Harum
10 Harum Harum Harum Harum
Tekstur
5 Utuh, kering Utuh, agak basah Utuh, agak basah Utuh, agak basah
7.5 Utuh, agak basah Utuh, agak basah Utuh, agak basah Utuh, agak basah
10 Utuh, agak basah Utuh, agak basah Utuh, agak basah Utuh, agak basah
Jamur
5 Tidak ada Tidak ada Tidak ada Tidak ada
7.5 Tidak ada Tidak ada Tidak ada Tidak ada
10 Tidak ada Tidak ada Tidak ada Tidak ada
Keterangan: AF= Aditif Fermentasi; P0 = Hi-ferkontrol (tanpa aditif), P1 = P0 + Asam Formiat, P2 = P0 + L. plantarum, P3 = P0 + asam formiat + L. plantarum.
14
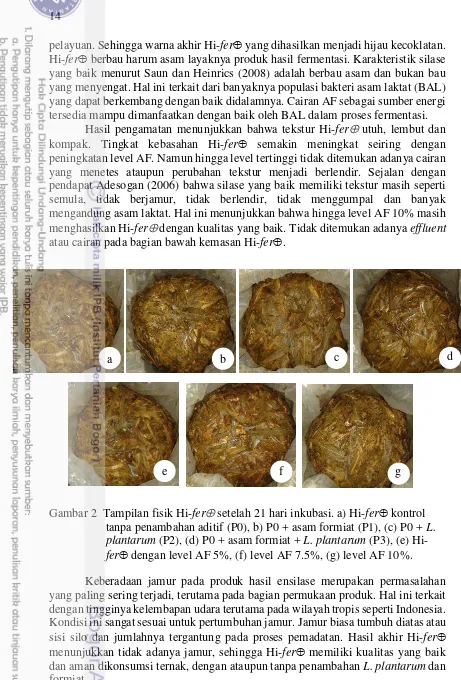
pelayuan. Sehingga warna akhir Hi-fer yang dihasilkan menjadi hijau kecoklatan. Hi-fer berbau harum asam layaknya produk hasil fermentasi. Karakteristik silase yang baik menurut Saun dan Heinrics (2008) adalah berbau asam dan bukan bau yang menyengat. Hal ini terkait dari banyaknya populasi bakteri asam laktat (BAL) yang dapat berkembang dengan baik didalamnya. Cairan AF sebagai sumber energi tersedia mampu dimanfaatkan dengan baik oleh BAL dalam proses fermentasi.
Hasil pengamatan menunjukkan bahwa tekstur Hi-fer utuh, lembut dan kompak. Tingkat kebasahan Hi-fer semakin meningkat seiring dengan peningkatan level AF. Namun hingga level tertinggi tidak ditemukan adanya cairan yang menetes ataupun perubahan tekstur menjadi berlendir. Sejalan dengan pendapat Adesogan (2006) bahwa silase yang baik memiliki tekstur masih seperti semula, tidak berjamur, tidak berlendir, tidak menggumpal dan banyak mengandung asam laktat. Hal ini menunjukkan bahwa hingga level AF 10% masih menghasilkan Hi-fer dengan kualitas yang baik. Tidak ditemukan adanya effluent atau cairan pada bagian bawah kemasan Hi-fer.
Gambar 2 Tampilan fisik Hi-fer setelah 21 hari inkubasi. a) Hi-fer kontrol tanpa penambahan aditif (P0), b) P0 + asam formiat (P1), (c) P0 + L. plantarum (P2), (d) P0 + asam formiat + L. plantarum (P3), (e) Hi-fer dengan level AF 5%, (f) level AF 7.5%, (g) level AF 10%. Keberadaan jamur pada produk hasil ensilase merupakan permasalahan yang paling sering terjadi, terutama pada bagian permukaan produk. Hal ini terkait dengan tingginya kelembapan udara terutama pada wilayah tropis seperti Indonesia. Kondisi ini sangat sesuai untuk pertumbuhan jamur. Jamur biasa tumbuh diatas atau sisi silo dan jumlahnya tergantung pada proses pemadatan. Hasil akhir Hi-fer menunjukkan tidak adanya jamur, sehingga Hi-fer memiliki kualitas yang baik dan aman dikonsumsi ternak, dengan ataupun tanpa penambahan L. plantarum dan formiat.
a b c d
g f
15
Karakteristik Fermentatif Hi-fer
Beberapa karakteristik fermentasi sebagai parameter kualitas suatu produk fermentasi diantaranya adalah pH, BK dan N-NH3 Hi-fer. Secara keseluruhan pH berkisar antara 3.02-4.00 (tabel 3). McDonald et al. (1991) menggambarkan karakteristik kualitas silase yang baik yaitu memiliki pH dibawah 4.2, kandungan N-NH3 kurang dari 100 g/kg BK dan tingginya kandungan asam laktat. Pada
penelitian ini, keseluruhan Hi-fer yang dibuat memiliki kualitas yang baik. Tabel 3 pH Hi-fer perlakuan
Keterangan: AF= Aditif fermentasi; angka yang diikuti oleh huruf berbeda menunjukkan ada perbedaan nyata (P<0.01)
Ensilase Hi-fer selama 3 minggu pada parameter pH secara statistik memberi hasil yang saling berinteraksi dari ketiga faktor. Perlakuan kontrol menunjukkan pengaruh yang hampir sama pada pH dengan peningkatan AF. Meskipun terlihat terdapat kenaikan (AF 7.5%) dan menurun kembali pada level AF 10%. AF menyediakan sejumlah substrat tersedia yang dibutuhkan bagi pertumbuhan bakteri. Cairan AF diketahui mengandung asam dan garam organik, serta sejumlah molasses sebagai sumber energi bagi bakteri. Hasil penelitian Hernaman et al. (2005) menunjukkan penurunan pH dengan peningkatan level molasses (2%,4%,6%) sebagai suplemen pada silase campuran ampas tahu dan pucuk tebu kering. Kandungan gula dalam molasses oleh bakteri selama proses ensilase akan dirombak menjadi asam organik seperti asam laktat dan sebagian kecil asam asetat dan butirat.
Penambahan L. plantarum dan asam formiat dalam menghasilkan pH dapat mengurangi penggunaan AF. Penambahan BAL menunjukkan adanya interaksi yang baik antara cairan AF dengan L.plantarum didalam proses fermentasi, sejak level AF terendah. Molases dapat menstimulasi fermentasi, namun tidak cukup mencegah proteolysis karena penurunan pH yang lebih lambat (Baytok dan Aksu 2005). L.plantarum berperan membantu mempercepat penurunan pH melalui akumulasi asam laktat yang dihasilkan. Penambahan molasses pada proses ensilase mampu memberikan kondisi yang layak bagi perkembangan bakteri pembentuk asam laktat, sehingga pH menjadi cepat turun. Hasil penelitian Jasin (2014) menunjukkan nilai pH semakin rendah dengan meningkatnya penambahan molasses pada silase rumput gajah dengan inokulasi BAL.
16
(4.51). pH hasil penelitian ini lebih rendah dibandingkan hasil penelitian Ratnakomala et al. (2006) dengan penggunaan strain inokulan yang sama pada konsentrasi 0%-1% yaitu 3.67-4.18. Rendahnya pH pada penggunaan inokulan ini menimbulkan kekhawatiran akan menyebabkan penurunan palatabilitas Hi-fer. L. plantarum merupakan bakteri fakultatif heterofermenter yang dapat menggunakan heksosa dan sedikit pentosa menjadi produk akhir utama berupa asam laktat (McDonald et al. 1991). Asam laktat yang menyebabkan penurunan pH dengan cepat, melalui pembatasan respirasi tanaman dan aktivitas enzim, sehingga menghambat bakteri lainnya (Adesoji et al. 2012). Hal ini didukung pula oleh hasil penelitian Filya (2003) yang menghasilkan penurunan pH yang cepat sehingga stabil sehingga dapat disimpan lebih lama dengan kehilangan BK yang rendah pada inokulasi bakteri L.plantarum dan L.buchneri.
Penambahan asam formiat mampu membatasi fermentasi. Meskipun demikian, pH akhir yang dihasilkan masih dalam kisaran kualitas silase yang baik (4.0). Hal ini membuktikan bahwa penggunaan asam formiat mampu menahan proses fermentasi dan sekaligus mengurangi penggunaan AF dalam Hi-fer. Sebagai pembatas fermentasi, asam formiat menurunkan pH seketika ketika pemberian dan bekerja dengan mengurangi aktifitas Enterobacteri dan bakteri Saccharolytic Clostridia (Lorenzo dan O’Kiely 2008). Pada kondisi suhu dan tekanan yang sesuai carbon monoxide dan sodium hydroxide dari asam formiat akan menghasilkan sodium formiat dan asam sulfur yang akan menurunkan pH secara cepat dan berfungsi sebagai antimikroba (Luckstadt 2009).
Kombinasi antara BAL dengan formiat menunjukkan nilai yang lebih besar dibandingkan perlakuan formiat tunggal. Hal ini mengindikasikan adanya dominasi pengaruh dari L.plantarum terhadap pH Hi-fer. Asam laktat yang dihasilkan oleh L.plantarum lebih berperan dalam menurunkan pH dibandingkan asam formiat. Kombinasi L.plantarum dan asam formiat mampu menghasilkan pH Hi-fer yang baik, dan keduanya mampu menurunkan penggunaan AF. Belum banyak penelitian yang menggabungkan kedua aditif ini dalam satu perlakuan. Hasil penelitian ini menunjukkan bahwa L. plantarum dan asam formiat dapat bersinergi dengan baik dalam menghasilkan pH silase yang berkualitas.
Tabel 4 Kandungan bahan kering (%) Hi-fer
Inokulasi
Keterangan: AF= Aditif fermentasi; angka yang diikuti oleh huruf berbeda menunjukkan ada perbedaan nyata (P<0.05)
17 BK awal hijauan setelah pelayuan selama 2 malam adalah 16.58%. Nilai BK ini tergolong masih rendah dari yang direkomendasikan oleh McDonald et al. (1991) yaitu minimum 25%. Kondisi rumput yang lebih kering akan menghasilkan kandungan bahan kering silase yang lebih tinggi. Rumput gajah dipanen pada umur 30 hari, sehingga BK rumput masih sangat rendah (11.61%). Sebagai pembanding, BK rumput gajah yang digunakan oleh Santoso et al. (2009) pada umur panen 50 hari adalah 16.80% dan Rukmana (2005) sebesar 19.9%. Selain itu, kondisi cuaca (musim hujan) menyebabkan proses pelayuan tidak dapat berjalan secara optimal. Sehingga selama penjemuran BK rumput hanya meningkat sebanyak 35.94%. Banyak faktor lainnya yang mempengaruhi kandungan bahan kering pada suatu tanaman, diantaranya adalah kandungan unsur hara tanah, sinar matahari dan lain-lain.
Semakin tinggi pemberian cairan AF, memberikan pengaruh yang berbeda antar perlakuan. AF digunakan oleh bakteri sebagai sumber karbohidrat telarut yang tersedia. Kehilangan BK dapat ditekan dengan cara mempercepat kondisi anaerob dan penurunan pH sehingga proses fermentasi optimal oleh BAL dapat tercapai. Penambahan L. plantarum dan asam formiat dapat mengurangi penggunaan AF pada BK akhir Hi-fer. Peningkatan cairan AF pada level lebih tinggi (7.5% dan 10%) menurunkan kandungan BK akhir pada perlakuan Hi-fer kontrol, sedangkan perlakuan asam formiat menunjukkan peningkatan BK pada level 7.5% dan menurun kembali ketika peningkatan level AF (10%). Penggunaan asam formiat mampu menghasilkan BK Hi-fer lebih baik dibanding perlakuan kontrol, terutama pada level AF lebih tinggi (7.5%). Level pemberian AF yang lebih tinggi mengurangi pengaruh dari asam formiat. Asam formiat memiliki kemampuan dalam membatasi fermentasi (Jaakola et al. 2006). Pembatasan proses fermentasi akan berakibat pada lebih tingginya kandungan nutrient akhir produk fermentasi.
Inokulasi L. plantarum dalam Hi-fer mampu menghasilkan BK tertinggi terutama pada level AF 7.5% dan 10%. Inokulasi BAL mampu memberikan hasil terbaik pada kadar BK Hi-fer, yaitu 24.80-26.93%. Kadar BK yang tinggi diakibatkan karena dominasi bakteri L. plantarum didalam Hi-fer. L. plantarum mampu memfermentasi gula menjadi asam laktat sebagai produk utama. Hal ini terlihat dari pH (tabel 3) dan produksi asam laktat yang dihasilkan (gambar 3). Sehingga penggunaan WSC akan lebih efisien dan menghasilkan lebih banyak nutrient yang tersisa. Sejalan dengan hasil penelitian Filya (2003) yang menggunakan L. plantarum dan L. buchneri pada silase sorgum dan jagung dengan BK awal rendah. Cairan AF mampu bersinergi baik dengan L. plantarum dalam mengoptimalkan proses fermentasi.
18
Kandungan N-ammonia (N-NH3) Hi-fer secara statistik nyata dipengaruhi
oleh interaksi dari ketiga faktor (P<0.01). Produksi N-NH3 dipengaruhi oleh proses
perombakan protein didalam Hi-fer. Produk utama pemecahan protein adalah asam amino dan amonia, dan proporsi keduanya bergantung pada berlanjutnya pemecahan asam amino tersebut. Beberapa faktor yang mempengaruhi proses proteolysis adalah bahan kering, temperatur, pH dan spesies tanaman (McDonald et al. 1991). Kandungan N-NH3 Hi-fer yang dihasilkan ditampilkan pada tabel 5
berikut.
0.15% 2.57±0.22abc 1.38±0.60a 1.94±0.28abc 1.96 ± 0.63
+ 0 2.65±0.10abc 1.74±0.36ab 2.64±0.10abc 2.34 ± 0.56
0.15% 2.12±0.60abc 2.80±0.41bc 1.99±0.50abc 2.31 ± 0.58
Rataan 2.63 ± 0.52 2.61 ± 1.36 2.18 ± 0.51 2.47 ± 0.89
Keterangan: AF = Aditif fermentasi; angka yang diikuti oleh huruf berbeda menunjukkan ada perbedaan nyata (P<0.01)
Semakin tinggi jumlah pemberian cairan AF menunjukkan pengaruh yang berbeda pada tiap perlakuan. Secara umum tidak banyak pengaruh peningkatan level AF terhadap kadar N-NH3 Hi-fer. Perlakuan kontrol dan kombinasi
menghasilkan kadar N-NH3 tertinggi pada level cairan AF 7.5% dan menurun pada
level AF 10%. Sebaliknya pada perlakuan L.plantarum maupun asam formiat secara tunggal menunjukkan penurunan pada level 7.5%, dan meningkat kembali ketika level AF 10%. Rataan kandungan N-NH3 Hi-fer rumput gajah berkisar
antara 1.38-4.51 g/kg BK. Umumnya penambahan molasses menghasilkan lebih sedikit ammonia, seperti pada hasil penelitian Abarghoei et al. (2011), disebabkan karena lebih banyak gula tersedia sehingga mempercepat penurunan pH untuk selanjutnya menghambat deaminasi dan dekarboksilasi asam amino.
Baik asam formiat maupun inokulan L. plantarum mampu menurunkan kandungan ammonia didalam Hi-fer dibandingkan perlakuan Hi-fer tanpa aditif, terutama pada level AF 7.5%. Keduanya secara tunggal berpengaruh dalam menekan proteolysis didalam hijauan. Asam formiat maupun inokulasi bakteri keduanya dapat membatasi pemecahan protein didalam silase melalui penurunan pH dan penghambatan aktivitas enzim serta dengan menekan pertumbuhan bakteri pendegradasi protein, sejalan dengan hasil penelitian Winters et al. (2001) dan Saarisalo et al. (2006). Meskipun dalam hal ini asam formiat terlihat lebih berpengaruh dalam menekan ammonia di Hi-fer.
19 Tabel 6 Penyusutan berat segar Hi-fer (%)
Inokulasi
Keterangan: AF = Aditif fermentasi; angka yang diikuti oleh huruf berbeda menunjukkan ada perbedaan nyata (P<0.05)
Peningkatan level AF secara umum tidak banyak mempengaruhi penyusutan berat segar Hi-fer baik dengan ataupun tanpa penambahan L. plantarum dan asam formiat. Meskipun demikian, kecenderungan penyusutan berat segar lebih kecil pada level AF lebih rendah. Penambahan asam formiat baik secara tunggal maupun kombinasi dengan L. plantarum, meningkatkan penyusutan berat segar Hi-fer selama ensilase. Hal tersebut tidak dipengaruhi oleh banyak atau sedikitnya level cairan AF. Peran asam formiat dalam menekan proses fermentasi dirasa kurang nampak ketika dalam menekan penyusutan berat segar. Hal ini dimungkinkan terkait dosis pemberian asam formiat yang belum optimal ketika diberikan pada hijauan dengan BK rendah. Penggunaan asam formiat sebanyak 1.5 liter per ton dikategorikan dalam dosis yang rendah. Dosis asam formiat yang umum digunakan di UK sebanyak 2 liter per ton (McDonald et al. 1991).
Nilai fleigh merupakan salah satu parameter dalam mengukur karakteristik fermentasi silase. Secara statistik ketiga faktor berinteraksi nyata (P<0.01) dan diperlihatkan pada tabel 7 berikut. Pengelompokan kualitas berdasarkan nilai fleigh adalah 80-100 yaitu menyatakan silase berkualitas baik sekali, 60-80 berkualitas baik, 40-60 berkualitas cukup baik, 20-40 berkualitas sedang dan <20 berkualitas kurang baik (Idikut et al. 2009).
Tabel 7 Nilai Fleigh Hi-fer
- 0 111.26±6.58abc 103.43±9.64ab 120.23±1.73bcd 111.64 ± 9.37
0.15% 91.01±6.83a 122.53±2.90bcd 103.49±14.74ab 105.68 ± 16.03
+ 0 118.47±5.05bcd 134.99±3.90d 138.19±3.90d 130.55 ± 10.02
0.15% 108.95±16.99abc 122.29±4.46bcd 128.80±6.18cd 120.01 ± 12.79
Rataan 107.42 ± 13.59 120.81 ± 12.78 122.68 ± 15.14 116.97 ± 15.13
Keterangan: AF = Aditif fermentasi; angka yang diikuti oleh huruf berbeda menunjukkan ada perbedaan nyata (P<0.01)
20
Keseluruhan perlakuan Hi-fer berdasarkan penilaian parameter fisik dan fermentatif, menunjukkan kualitas hasil yang baik. Adapun penggunaan cairan AF memberikan pengaruh yang terkait erat dengan perlakuan penambahan aditif/inokulan. Secara umum, pemberian cairan AF 7.5% mampu menghasilkan Hi-fer yang berkualitas, baik dari kualitas fisik dan fermentative, yaitu BK dan N-NH3. Sehingga keseluruhan perlakuan dengan level pemberian cairan AF 7.5%
dipilih untuk dilakukan pengujian lebih lanjut pada tahap kedua.
Karakteristik Nutritif - Mikrobiologis Hi-fer
Pada percobaan kedua pengujian lebih lanjut dilakukan dengan parameter nutritif-mikrobiologis. Hasil analisa nutritif Hi-fer ditampilkan pada tabel 8 berikut. Perlakuan memperlihatkan pengaruh yang bervariasi pada masing-masing nutrient.
Tabel 8 Kandungan nutrient Hi-fer setelah ensilase 21 hari (100% BK)
Komposisi Hi-fer P0 + asam formiat + L. plantarum; *Perhitungan rumus Sutardi (2001):TDN = 2.79 + 1.17 PK + 1.74 LK – 0.295 SK + 0.810 BETN.
21 secara alami berasal dari tanaman awal, bakteri pencerna serat (selulolitik) dan hidrolisis oleh asam organik selama fermentasi (McDonald et al. 1991).
Kombinasi L. plantarum dan asam formiat berdampak pada kandungan serat kasar dan lemak kasar yang lebih tinggi dibandingkan perlakuan lainnya. Pada analisa serat, kandungan hemiselulosa dan NDF perlakuan penambahan aditif lebih tinggi dibandingkan perlakuan kontrol. Pada perlakuan kontrol menunjukkan lebih banyaknya perombakan komponen serat terutama hemiselulosa yang terjadi selama proses fermentasi dibandingkan dengan perlakuan penambaan aditif. Sebaliknya dengan penambahan L. plantarum maupun asam formiat tidak banyak merombak hemiselulosa yang terdapat dalam hijauan. Hal ini mencerminakan bahwa aktifitas perombakan nutrient terutama hemiselulosa dan NDF selama proses fermentasi dapat ditekan oleh penambahan kedua aditif tersebut. Perombakan nutrient terjadi akibat aktifitas enzim yang terdapat secara alami pada tanaman dan mendegradasi dinding sel selama ensilase berlangsung. Selanjutnya karbohidrat yang telah tersedia digunakan sebagai substrat bagi mikroorganisme (McDonald et al. 1991). Kedua aditif terlihat lebih berpengaruh dalam menurunkan fraksi serat lainnya yaitu selulosa dan lignin dibandingkan dengan perlakuan kontrol.
Karakteristik mikrobiologis diukur melalui jumlah populasi BAL dalam Hi-fer dan asam laktat yang dihasilkan. Populasi BAL dan asam laktat pada Hi-fer terpilih ditampilkan pada gambar 3 berikut.
Gambar 3 Diagram populasi BAL dan asam laktat Hi-fer.
Keterangan : P0= Hi-fer kontrol, P1 = P0 +asam formiat, P2 = P0 + L. plantarum, P3 = P0 + asam formiat + L. plantarum
Secara statistik populasi BAL tidak berbeda antar perlakuan, namun asam laktat yang dihasilkan berbeda nyata (P<0.05). Populasi BAL menunjukkan bahwa penambahan L.plantarum tidak memberikan pengaruh terhadap populasi BAL dibandingkan dengan perlakuan lainnya. Pada perlakuan kontrol menghasilkan produksi asam laktat tertinggi diikuti oleh perlakuan L. plantarum dan terendah adalah asam formiat dan kombinasinya dengan L. plantarum. Selama 21 hari
22
Populasi BAL tertinggi pada perlakuan kontrol, yaitu merupakan BAL yang secara alami terdapat pada rumput gajah. Populasi awal BAL pada rumput gajah yang dilaporkan oleh Pereira et al. (2007) adalah 4.92 log cfu g-1 atau 3.6 x 105 cfu g-1 menurut Yahaya et al. (2004). Pemberian L. plantarum sebanyak 0.0625 ml kg -1 rumput dengan kepadatan populasi inokulum sebesar 1.6 x 109 cfu ml-1 (9.20 log
cfu ml-1) dimaksudkan untuk menjamin pertumbuhan BAL agar mencapai 105-106 cfu g-1 hijauan (Weinberg et al. 2003). Pertumbuhan BAL ditunjang oleh ketersediaan karbohidrat terlarut air didalam Hi-fer yang banyak disediakan oleh cairan AF. Meskipun populasi BAL tidak nyata berbeda, namun keseluruhan Hi-fer telah memperlihatkan hasil yang optimal dari jumlah populasi BAL didalamnya.
Penurunan populasi BAL pada perlakuan L. plantarum disebabkan karena produksi asam yang dihasilkan L. plantarum lebih banyak, sehingga pada akhirnya menekan perkembangan BAL tersebut sendiri. Sesuai pendapat Ratnakomala (2006), bahwa penurunan populasi BAL terbesar pada L. plantarum 1A-2 dibandingkan dengan inokulum lainnya (1BL-2 dan kombinasinya), yaitu sebesar 4-5 digit pada rumput gajah. Hal ini disebabkan karena produksi asam dari inokulum L. plantarum 1A-2 lebih banyak. Saarisalo et al. (2007) menunjukkan hasil serupa, dimana jumlah BAL pada produk akhir silase lebih kecil dibandingkan dengan silase yang diberi perlakuan pembatas fermentasi maupun silase kontrol. Hal ini dimungkinan disebabkan karena rendahnya pH dan autolysis yang terjadi. Meskipun penambahan L. plantarum tidak menunjukkan perbedaan nyata pada populasi BAL, namun asam laktat yang dihasilkan cukup banyak. Asam laktat merupakan produk utama hasil fermentasi karbohidrat, terutama oleh bakteri homofermentatif. Sebagai BAL, L. plantarum mampu meningkatkan fermentasi melalui produksi asam laktat dan sedikit sekali produksi asam lemah seperti asam asetat (McDonald et al. 1991; Kung et al. 2003). Hi-fer dengan inokulasi L. plantarum lebih efisien dalam proses fermentasi, dibuktikan pula oleh persentase BK akhir perlakuan yang tinggi (tabel 4).
Asam formiat mampu membatasi proses fermentasi secara tidak langsung melalui pembatasan aktifitas BAL dalam memproduksi asam laktat. Hal ini dibuktikan dari rendahnya konsentrasi asam laktat yang dihasilkan (gambar 3). Penambahan asam formiat menghasilkan asam laktat terendah, yaitu 2.64 g kg-1 BK. Jumlah asam laktat ini tidak jauh berbeda dengan yang dihasilkan pada penelitian Kozelov et al. (2008) dengan perlakuan asam formiat pada alfalfa yaitu 2.20 g kg-1
BK. Penurunan asam laktat juga ditunjukkan pada hasil penelitian Saarisalo et al. (2006) dan Nowak et al. (2004) namun tidak berpengaruh pada asam butirat. Kung et al. (2003) melaporkan asam formiat bekerja dengan menurunkan pH secara cepat dan mengurangi fermentasi yang dibutuhkan hingga mencapai pH rendah yang stabil.
Asam formiat tidak berpengaruh nyata (P>0.05) terhadap populasi BAL dalam Hi-fer. Hal ini mengindikasikan bahwa asam formiat pada level 0.15% hanya menghambat proses fermentasi asam laktat oleh BAL, namun tidak mengganggu perkembangan BAL didalam Hi-fer. Meskipun beberapa penelitian menyebutkan bahwa asam formiat memiliki kemampuan sebagai antibakteri pada beberapa spesies bakteri termasuk BAL (Rowghani dan Zamiri 2009). Hasil
23 berpengaruh dalam menekan aktivitas Enterobacteria dan Clostridia dibandingkan BAL.
Fermentabilitas dan Koefisien Cerna in vitro Hi-fer
Kedua jenis aditif memiliki kemampuan yang berbeda dalam mempengaruhi proses fermentasi dalam Hi-fer. Penambahan asam formiat membatasi fermentasi dengan menekan produksi asam laktat dengan pH akhir yang lebih tinggi 0.51 poin dibandingkan perlakuan L. plantarum. Adapun L. plantarum meningkatkan produksi asam laktat dan menghasilkan pH terendah diantara perlakuan lainnya. Kemampuan suatu produk pakan dalam menunjang proses fermentasi dalam rumen, diantaranya dicerminkan melalui produk fermentasi yang dihasilkan (N-NH3 dan VFA). Fermentabilitas dan koefisien cerna Hi-fer in vitro
ditampilkan pada tabel 9 berikut.
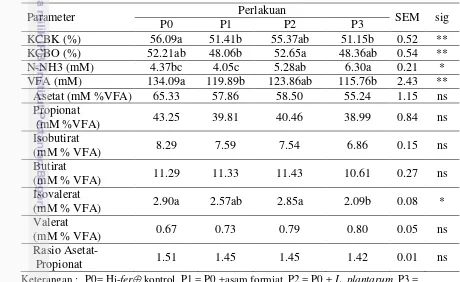
Tabel 9 Fermentabilitas dan koefisien cerna in vitro Hi-fer
Parameter Perlakuan SEM sig
P0 P1 P2 P3 P0 + asam formiat + L. plantarum; KCBK : Koefisien Cerna Bahan Kering; KCBK : Koefisien Cerna Bahan Organik; VFA : Vollatile Fatty Acid; huruf yang berbeda pada baris yang sama menunjukkan berbeda nyata * : p<0.05; ** : p<0.01
Secara statistik ammonia yang dihasilkan signifikan berbeda (P<0.01) antar perlakuan. Baik asam formiat maupun L. plantarum mampu mengurangi proteolysis dalam Hi-fer, namun keduanya memberikan respon yang berbeda ketika di dalam rumen. Rataan konsentrasi N-NH3 yang dihasilkan adalah 4-6.3
24
Boucher et al. (2007) yaitu 5-13 mg dL-1 atau 2.94-7.65 mM dalam mendukung
pertumbuhan bakteri rumen.
Perlakuan kombinasi formiat dan L. plantarum menghasilkan ammonia tertinggi dibandingkan perlakuan lainnya (6.30 mM). Meskipun dalam Hi-fer baik penambahan formiat maupun L. plantarum mampu menekan perombakan protein, namun keduanya menghasilkan pengaruh yang berbeda dalam cairan rumen. Ketika dikombinasikan keduanya menghasilkan produksi ammonia terbesar dibandingkan ketika penggunaan asam formiat secara tunggal. Hal tersebut mencerminkan kombinasi asam formiat dan L. plantarum mampu menyediakan lebih banyak protein yang mudah didegradasi menjadi ammonia selama fermentasi dalam rumen. Meskipun secara statistik penggunaan L.plantarum dan asam formiat tunggal tidak banyak berbeda dengan kontrol. Asam formiat sebagai pembatas fermentasi belum terlihat menghambat degradasi protein didalam rumen, meskipun secara numerik cenderung menurun dibandingkan perlakuan kontrol dan L. plantarum.
Pembentukan sintesis protein mikroba tidak hanya membutuhkan NH3
sebagai sumber N, tetapi juga ketersediaan energi. Sintesis protein mikroba membutuhkan keseimbangan ketersediaan baik sumber nitrogen maupun energi (Pathak 2008). VFA merupakan produk hasil fermentasi karbohidrat oleh mikroba didalam rumen. Total VFA signifikan (P<0.01) dipengaruhi oleh perlakuan yang diperlihatkan pada tabel 9 diatas. Rataan total VFA perlakuan Hi-ferberkisar 115-134 mM. Total VFA rumen tertinggi terdapat pada perlakuan kontrol, diikuti dengan L. plantarum dan terakhir asam formiat baik secara tunggal maupun kombinasinya dengan L. plantarum. Penambahan asam formiat ataupun L. plantarum tidak meningkatkan konsentrasi VFA rumen dibandingkan kontrol. Meskipun demikian, kisaran VFA yang dihasilkan telah memenuhi kisaran VFA normal menurut McDonald et al. (2002) yaitu 70-150 mM.