APLIKASI TEKNOLOGI MEMBRAN UNTUK PEMEKATAN
ALGINAT DARI BAKTERI Pseudomonas aeruginosa
Oleh :
AGNUR RAHMATIA
C34050852
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
RINGKASAN
AGNUR RAHMATIA. C34050852. Aplikasi Teknologi Membran untuk Pemekatan Alginat dari Bakteri Pseudomonas aeruginosa. Dibimbing oleh UJU dan DESNIAR.
Alternatif penggunaan bakteri pada produksi alginat telah banyak dilakukan, namun pada proses pemanenannya masih menggunakan metode sentrifuge, kemudian dilakukan penambahan etanol 96% dengan perbandingan 2-3 kali. Penggunaan etanol dalam perbandingan yang tinggi akan menyebabkan biaya produksi yang tinggi. Untuk itu pemanfaatan teknologi membran pada proses pemekatan alginat diharapkan mampu mengurangi penggunaan etanol 96%.
Tujuan dari penelitian ini, yaitu untuk menerapkan teknologi filtrasi membran dalam proses pemekatan alginat yang dihasilkan oleh bakteri Pseudomonas aeruginosa dan dapat mengurangi penggunaan etanol 96%, serta mengetahui kinerja membran yang digunakan.
Penelitian ini dilakukan dalam dua tahap. Tahap pertama produksi alginat dari bakteri P. aeruginosa dengan menentukan kurva pertumbuhan dan pengukuran konsentrasi alginat skala besar. Tahap kedua pemekatan alginat menggunakan teknologi membran dengan menentukan permeabilitas membran, penentuan waktu tunak, pengaruh tekanan transmembran dan suhu terhadap nilai fluks dan rejeksi serta proses pengkonsentrasian alginat.
Massa kering sel bakteri yang didapatkan 1,5 g/l, konsentrasi alginat 4,04 g/l dan viskositas 1,376 cp. Selama proses filtrasi dengan membran reverse osmosis (RO) diketahui tekanan transmembran dan suhu umpan mempengaruhi besarnya fluks permeat yang dihasilkan. Fluks pada penelitian ini meningkat sebesar 0,3 l.m-2.h-1 untuk setiap kenaikan tekanan transmembran sebesar 1 kPa, dan 0,12 l.m-2.h-1 untuk setiap kenaikan suhu sebesar 1 oC. Tekanan transmembran dan suhu umpan tidak berpengaruh signifikan terhadap perubahan nilai rejeksi alginat. Alginat yang dapat direjeksi membran RO pada penelitian ini berkisar antara 92,767–97,548%. Alginat yang dihasilkan berwarna merah kekuningan, memiliki niali viskositas akhir sebesar 1,08 cP, dengan tingkat kecerahan 54,07
APLIKASI TEKNOLOGI MEMBRAN UNTUK PEMEKATAN
ALGINAT DARI BAKTERI Pseudomonas aeruginosa
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh :
AGNUR RAHMATIA
C34050852
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul : APLIKASI TEKNOLOGI MEMBRAN UNTUK PEMEKATAN ALGINAT DARI BAKTERI
Pseudomonas aeruginosa
Nama : Agnur Rahmatia NRP : C34050852
Menyetujui,
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Tanggal Lulus :
Pembimbing I
Uju, S. Pi, M. Si NIP. 19730612 200012 1 001
Pembimbing II
Desniar, S. Pi, M. Si NIP. 19701224 199702 2 001
Mengetahui, Ketua Departemen
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul “Aplikasi Teknologi Membran untuk Pemekatan Alginat dari Bakteri
Pseudomonas aeruginosa” adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Desember 2009
KATA PENGANTAR
Syukur Alhamdulillah penulis panjatkan kehadirat Allah S.W.T yang telah memberikan taufik dan hidayah-Nya serta kesabaran sehingga penulis dapat menyelesaikan skripsi ini dengan baik.
Penelitian dengan judul “Aplikasi Teknologi Membran untuk Pemekatan Alginat dari Bakteri Pseudomonas aeruginosa” merupakan salah satu syarat untuk memperoleh gelar Sarjana Perikanan, pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu dalam penulisan skripsi ini,
terutama kepada :
1. Bapak Uju S.Pi, M.Si dan keluarga, selaku dosen pembimbing atas dorongan dan saran yang diberikan mulai dari persiapan penelitian hingga selesainya skripsi ini.
2. Ibu Desniar, S.Pi, M.Si dan keluarga, selaku dosen pembimbing akademik dan pembimbing skripsi atas dorongan dan saran yang diberikan mulai dari persiapan penelitian hingga selesainya skripsi ini.
3. Ibu Ir. Winarti Zahiruddin, M. S dan Bapak Dr. Ir. Bustami Ibrahim, M. Sc selaku dosen penguji yang telah memberikan saran dan kritikan yang membangun bagi penulis.
4. DIKTI melalui Program Kreativitas Mahasiswa atas pendanaan penelitian. 5. Bapak Dr. Ir. Agoes M Jacoeb, Dipl. Biol, selaku komisi pendidikan yang
telah banyak membantu penulis dalam kelancaran akademik.
6. Ayah dan Ibu tercinta atas semua dukungan, kasih sayang, dan kesabaran yang diberikan, baik moril maupun materil serta doa yang selalu mengalir tanpa henti kepada penulis.
7. Kakak-kakakku serta adik tersayang (Romi Ekananda, Ade Gustiawan, Yarki Agrian, Deni Anggraini dan Agnur Radhia Aini) atas support dan semangat yang telah diberikan kepada penulis.
8. Team “Membran” Marglory Siburian, Jamaludin dan Sofia Halimi atas
9. Oktafil Ulya, Gina Ginanjarsari, Yuli Tri Yulianty serta teman-teman kostan zulfa lainnya atas kebersamaan, canda tawa, dan support kepada penulis. 10.Rizki “aNt” Andriyanti, S. Pi, Mudzakir “nCrut”, S. Pi, Permana “kOBe”
Turangga, Aditya “nDut” Dadik Putra Mahardika, Bondan “duDul” Wiseso, Agy Maulana dan Puput Rachmawati, S. Pi, yang telah memberikan motivasi, semangat dan menjadi teman terbaik bagi penulis selama ini.
11.Bapak Agus Soemantri, mbak Selin FKH IPB, Ibu Ema, Rita, Mas Ipul, Mas Zaki, Bang Mail, Pak Ade, Pak Tatang, Bu Etang, dan Umi atas bantuannya selama ini.
12.Rodi, Seno, Niken, Ari, Zen, Mica, Dan, Uli, Indri, Fathu, Yayan, serta
teman-teman THP 42 yang belum disebutkan, terima kasih atas suka dan duka yang dilalui bersama penulis
13.Teman-teman THP 43 dan 44 serta kakak kelas THP 41 dan 40 atas kebersamaan dan bantuannya.
14.Seluruh pihak yang telah membantu penulis yang tidak dapat penulis sebutkan satu persatu.
Penulis menyadari bahwa di dalam skripsi ini masih terdapat banyak kekurangan. Semoga skripsi ini dapat bermanfaat bagi semua pihak yang memerlukan.
Bogor, Desember 2009
tahun 200 02. Penulis
n yang sam
8. Selain itu n ajaran 20 dan menyu Perikanan p i Teknolog
onas aeru
S.Pi, M.Si.
R
Penu sebagai an Arnen Suati
ma penulis di s diterima d Kelautan, In ikuti perkul hasiswa Fak swa Tekno u penulis ju 007-2008,
iterima di IP di Departem nstitut Pertan liahan, penu kultas Perik ologi Hasi uga aktif se 2008-2009 sebagai sal tas Perikan i pada tahu tahun 1999 SLTPN SLTP Ang kan di SMU
PB melalui men Teknolo
nian Bogor. ulis aktif seb kanan (BEM
il Perikan ebagai Asis
dan 2009 lah satu sya an dan Ilm un 1993 dan 9. Pada tah 1 Buki gkasa Jaka UN 60 Jaka
jalur SPMB ogi Hasil P . arat untuk m mu Kelautan arta Timur arta (2002-2
B dan pada erairan, Fak
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
1. PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Tujuan ... 2
2. TINJAUAN PUSTAKA ... 3
2.1. Alginat ... 3
2.2. Bakteri Pseudomonas aeruginosa sebagai Penghasil Alginat ... 4
2.3. Penggunaan Alginat dalam Industri ... 6
2.4. Teknologi Membran ... 6
2.4.1. Sistem membran ... 10
2.4.2. Proses pemisahan membran ... 11
2.4.3. Membran reverse osmosis ... 13
2.4.4. Faktor-faktor yang mempengaruhi kinerja membran ... 14
3. METODOLOGI PENELITIAN ... 17
3.1. Waktu dan Tempat ... 17
3.2. Alat dan Bahan ... 17
3.3. Metode Penelitian ... 17
3.3.1. Produksi alginat dari Pseudomonas aeruginosa ... 17
3.3.2. Proses pemisahan alginat dengan teknologi membran ... 20
3.4. Analisis Data ... 23
3.5. Prosedur Analisis ... 24
4. HASIL DAN PEMBAHASAN ... 26
4.1. Produksi Alginat dari Pseudomonas aeruginosa ... 26
4.1.1. Biomassa kering P. aeruginosa... 26
4.1.2. Konsentrasi alginat ... 28
4.1.3. Viskositas ... 28
4.2.1. Permeabilitas membran ... 30
4.2.2. Pengaruh tekanan terhadap nilai fluks ... 31
4.2.3. Penentuan waktu tunak (steady state) ... 32
4.3. Pengaruh Variabel Operasi ... 32
4.3.1. Pengaruh tekanan transmembran dan suhu terhadap nilai fluks ... 32
4.3.2. Pengaruh tekanan transmembran dan suhu terhadap nilai rejeksi ... 34
4.4. Proses Pengkonsentrasian Alginat ... 34
4.4.1. Respon fluks ... 34
4.4.2. Respon rejeksi ... 35
4.4.3. Viskositas dan warna alginat akhir ... 37
5. KESIMPULAN DAN SARAN ... 38
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Nomor Teks Halaman
1. Pengelompokkan proses membran berdasarkan kisaran ukuran partikel yang direjeksi ... 9
DAFTAR GAMBAR
Nomor Teks Halaman
1. Bakteri Pseudomonas aeruginosa ... 5
2. Prinsip kerja sistem membran secara umum ... 7
3. Membran modul spiral wound ... 8
4. Skema prinsip kerja modul hollow fiber ... 8
5. Sistem desain operasi (a) dead-end (b) cross-flow ... 11
6. Prinsip kerja membran reverse osmosis (RO) ... 13
7. Lokasi terjadinya fouling pada membran ... 16
8. Penentuan kurva pertumbuhan dan pengukuran konsentrasi alginat ... 19
9. Proses produksi alginat skala besar ... 20
10. Diagram alir proses pemisahan alginat dengan teknologi membran ... 21
11. Grafik hubungan waktu inkubasi dengan biomassa kering bakteri ... 26
12. Grafik hubungan waktu inkubasi dengan konsentrasi alginat yang dihasilkan ... 28
13. Grafik hubungan waktu inkubasi dengan viskositas ... 29
14. Pengaruh tekanan transmembran terhadap nilai fluks ... 30
15. Pengaruh tekanan transmembran terhadap nilai fluks permeat .... 31
16. Pola perubahan nilai fluks permeat yang disebabkan oleh perubahan tekanan transmembran ... 32
17. Pengaruh tekanan transmembran dan suhu umpan terhadap nilai fluks ... 33
18. Pengaruh tekanan transmembran dan suhu umpan terhadap niali rejeksi ... 34
19. Pengaruh lamanya waktu filtrasi terhadap fluks ... 35
20. Pengaruh lamanya waktu filtrasi terhadap rejeksi ... 36
DAFTAR LAMPIRAN
Nomor Halaman
1. Membran Reverse osmosis (CSM Model No:
RE75-1812-50GPD) ... 44
2. Data pengaruh waktu inkubasi dengan biomassa kering
Pseudomonas aeruginosa ... 44
3. Data pengaruh waktu inkubasi dengan konsentrasi alginat yang
dihasilkan ... 45
4. Data pengaruh waktu inkubasi dengan viskositas ... 45 5. Data dan hasil analisis statistik pengaruh tekanan transmembran
terhadap nilai fluks ... 46
6. Data dan hasil analisis statistik pengaruh tekanan transmembran
dan suhu terhadap nilai fluks ... 46
7. Data dan hasil analisis statistik pengaruh tekanan transmembran
dan suhu terhadap nilai rejeksi ... 47
1. PENDAHULUAN
1.1. Latar Belakang
Alginat merupakan salah satu produk yang dihasilkan dari ekstraksi rumput laut kelas Phaeophyceae dan mempunyai nilai ekonomis yang tinggi. Anggadireja et al. (2006) melaporkan kebutuhan alginat di pasar dunia pada tahun 2001 mencapai 30.000 ton dengan penggunaan bahan baku sekitar 126.500 ton. Yulianto (2006) melaporkan bahwa kebutuhan alginat bagi industri di Indonesia rata-rata per tahun sebesar 2.000 ton yang hampir seluruhnya diimpor. Permintaan alginat dimasa yang akan datang akan semakin meningkat, terutama dengan semakin berkembangnya industri makanan di negara-negara
berkembang yang menggunakan alginat hampir 50% dari total produksi alginat. Berdasarkan hal tersebut, maka perlu diusahakan suatu alternatif untuk memproduksi alginat secara komersial yang dapat menjamin kontinuitas produksi.
Secara komersial sebagian besar alginat diproduksi dari spesies Macrocystis pyrifera, Laminaria digitata, L. hyperborea, L. japonica dan Ascophillum nodosum. Jenis rumput laut tersebut tumbuh dengan baik di daerah substropis, dan telah diolah secara komersial. Indonesia sendiri telah mulai membudidayakan Sargassum dan Turbinaria sebagai rumput laut penghasil alginat yang mampu tumbuh baik di daerah tropis. Namun kandungan alginat kedua jenis rumput laut tersebut masih rendah sehingga secara ekonomis kurang menguntungkan (Departemen Kelautan dan Perikanan 2005).
Selama ini, proses pemanenan alginat dari bakteri umumnya menggunakan metode sentrifuge, kemudian dilakukan penambahan etanol 96% dengan perbandingan 2-3 kali, kemudian di sentrifuge kembali dan dikeringkan. Penggunaan etanol dalam perbandingan yang besar akan menyebabkan biaya produksi yang tinggi.
Berdasarkan kondisi dan permasalahan tersebut, maka perlu dicari sumber lain penghasil alginat yang potensial dalam hal kelimpahan, berkualitas baik dan kesinambungan bahan baku terjamin. Selain itu perlu dicari teknologi produksi yang lebih efisien dan ramah lingkungan, salah satunya yaitu teknologi proses membran. Teknologi ini telah banyak diaplikasikan untuk pemurnian beberapa polimer seperti protein, polisakarida, oligosakkarida, nukleotida dan gula
(DeFrees 2003; Yeh dan Dong 2003 diacu dalam Uju 2005). Pemurnian karagenan dengan teknologi membran mikrofiltrasi 0,1 µm menunjukkan bahwa pada beberapa parameter seperti kadar sulfat, kadar selulosa dan viskositas karaginan pada proses membran lebih rendah dibandingkan dengan proses konvensional. Selain itu kekuatan gel dan derajat putih yang dihasilkan dengan proses membran memberikan hasil lebih tinggi dibandingkan dengan metode konvensional. Hal ini membuktikan, proses pemurnian dengan teknologi membran jauh lebih baik dibandingkan proses konvensional (Uju 2005).
1.2. Tujuan
Tujuan dilakukannya penelitian ini yaitu:
1) Mengetahui jumlah alginat maksimum yang dihasilkan oleh bakteri Pseudomonas aeruginosa.
2. TINJAUAN PUSTAKA
2.1. Alginat
Alginat merupakan biopolymer yang telah banyak diaplikasikan pada bidang industri makanan, minuman, tekstil, kertas, cat dan farmasi. Alginat pertama kali ditemukan oleh Stanford pada awal tahun 1880. Asam alginat
merupakan copolymer yang tersusun dari dua monomer yaitu asam D-mannuronic (M) dan L-guluronic (G) yang dihubungkan dengan C1 dan C4.
Alginat juga disekresikan oleh bakteri Gram negatif, Pseudomonas aeruginosa dan Azotobacter vinelandii. Polisakarida (alginat) yang
berasal dari bakteri ini mempunyai sifat-sifat fisika mirip dengan polisakarida
yang berasal dari rumput laut, hanya berbeda dalam struktur kimia. Polisakarida (alginat) yang berasal dari bakteri terdiri dari kopolimer asam D-mannuronat dan asam L-guluronat yang mempunyai grup O-asetil yang dihubungkan oleh asam D-mannuronat (Sabra 1998).
Alginat dari bakteri P. aeruginosa merupakan suatu eksopolisakarida yang merupakan polimer dari guluronic acid dan mannuronic acid, berbentuk gel kental di sekeliling bakteri. Alginat ini memungkinkan bakteri untuk membentuk biofilm, yaitu kumpulan koloni sel-sel mikroba yang menempel pada suatu permukaan misalnya jaringan paru. Alginat dapat melindungi bakteri dari pertahanan tubuh inang, seperti limfosit, fagosit, silia, di saluran pernafasan, antibodi dan komplemen. Koloni yang dibentuk halus dan berwarna kehijau-hijauan (Natalia 2008).
Penelitian struktur alginat dari beberapa spesies bakteri, menunjukkan bahwa polisakarida mempunyai beberapa tipe polimer yang berbeda, semuanya dengan komposisi kimia yang sama. Semuanya disusun dari dua asam uronat yang sama seperti alginat dari rumput laut, tetapi ada sedikit perbedaan dengan rumput laut yaitu bahwa beberapa darinya memiliki grup asetil yang tinggi dan beberapa grup asetil yang hanya mengandung residu D-mannuronat saja dalam polimer (Sabra 1998).
Sintesa polimer seperti alginat oleh bakteri pertama kali dilaporkan oleh
polisakarida dari galur Pseudomonas aeruginosa sama dengan asam alginat dari rumput laut. Berdasarkan hasil analisis menunjukkan adanya grup asetil dan ternyata polimer yang dihasilkan mirip dengan alginat yang berasal dari rumput laut dari segi komposisi, struktur dan sifat-sifat fisikanya.
Alginat yang dihasilkan dari bakteri juga memiliki kelebihan dari pada alginat yang dihasilkan rumput laut. Alginat yang dihasilkan dari bakteri bersifat lebih pseudoplastik dibandingkan alginat yang dihasilkan dari rumput laut. Jika digunakan pada industri makanan, alginat yang berasal dari bakteri memberikan tekstur dan rasa yang memuaskan di dalam mulut dibandingkan alginat yang dihasilkan dari rumput laut.
Menurut Clementi et al. (1995), alginat yang dihasilkan dari bakteri
Azotobacter vinelandii DSM 576 dapat mencapai 4,98 g/l dengan metode fermentasi bacth bioreactor. Hal ini juga didukung oleh Parente et al. (1998) yang menghasilkan alginat sebanyak 3,9 g/l dengan residu gula 20 g/l (glukosa). Bakteri Pseudomonas mampu menghasilkan alginat sebanyak 5 g/l dengan metode flasks (Fett and Wijey 1995 diacu dalam Sabra 1998) dan 20 g/l dengan metode bacth bioreactor (Sengha et al. 1989 diacu dalam Sabra 1998).
2.2. Bakteri Pseudomonas aeruginosa sebagai Penghasil Alginat
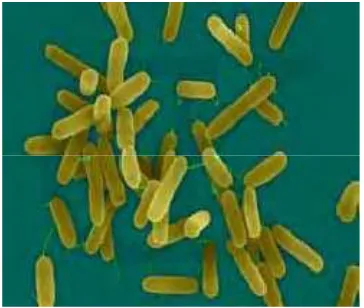
Pseudomonas aeruginosa berbentuk batang dengan ukuran sekitar 0,6 x 2 μm (Gambar 1). Bakteri ini terlihat sebagai bakteri tunggal, berpasangan, dan terkadang
membentuk rantai yang pendek. Pseudomonas aeruginosa termasuk bakteri Gram
negatif yang bersifat aerob, katalase positif, oksidase positif, tidak mampu memfermentasi tetapi dapat mengoksidasi glukosa/karbohidrat lain dan tidak berspora. Bakteri ini dapat tumbuh di air suling dan akan tumbuh dengan baik dengan
adanya unsur N dan C. Pseudomonas aeruginosa mudah tumbuh pada berbagai media
pembiakan karena kebutuhan nutrisinya sangat sederhana dan tumbuh sangat baik
Gambar 1. Bakteri Pseudomonas aeruginosa Sumber: http://jazzroc.files.wordpress.com
Klasifikasi Pseudomonas aeruginosa menurut Bergey’s Manual (1974) diacu dalam Hadioetomo (1990) adalah sebagai berikut:
Dunia : Prokaryote Divisi : Bakteria
Family : Pseudomonadaceae Genus : Pseudomonas
Spesies : Pseudomonas aeruginosa
Galur mucoid dari P. aeruginosa ditemukan bersifat patogen, khususnya pada saluran pernafasan yang terinfeksi. Selain itu galur mucoid ini dapat juga diisolasi dari kultur non mucoid berdasarkan ketahanannya terhadap racun, bakteriosin dan phage (Desniar 2003).
Bila bakteri ini tumbuh pada media tanpa sukrosa akan terdapat lapisan lendir polisakarida ekstraselular (alginat). Struktur dinding sel sama dengan famili Enterobacteriaceae. Strain yang diisolasi dari bahan klinik sering mempunyai pili untuk perlekatan pada permukaan sel dan memegang peranan penting dalam resistensi terhadap fagositosis. Pseudomonas aeruginosa merupakan organisme yang sangat mudah beradaptasi dan dapat memakai 80 gugus organik yang
2.3. Penggunaan Alginat dalam Industri
Alginat dalam industri pangan berfungsi sebagai bahan untuk memperkuat tekstur atau stabilitas produk olahan seperti es krim, sari buah, pastel isi dan kue-kue. Sifat pengikatan air yang baik dari alginat dapat menghasilkan tekstur yang lembut dan lunak pada kue isian, mempertahankan tekstur pada produk pangan yang dibekukan, mencegah pengerasan dan kerapuhan makanan kering. Penggunaan pada industri kertas dapat mengendalikan pembentukan lapisan, memperbaiki sifat-sifat permukaan, daya serap tinta dan kelembutan. Penggunaan pada tekstil dapat menghasilkan gambar yang halus dan baik. Selain itu alginat juga digunakan dalam bidang farmasi, pembuatan pasta dan obat-obatan (King 1983 diacu dalam Nurjanah 1993).
Produk makanan yang banyak menggunakan alginat adalah jenis makanan pelangsing tubuh atau dietetic foods berkalori rendah. Alginat memiliki nilai kalori yang rendah, yaitu sekitar 1,4 kkal/gram. Penggunaan alginat dalam makanan biasanya kurang dari 1%, sehingga sumbangan kalorinya sangat kecil. Penambahan alginat dapat membantu cita rasa produk dengan kalori rendah. Beberapa contoh makanan yang berkalori rendah yang mengandung alginat adalah bumbu selada (salad dressing) kalori rendah, imitasi french dressing, dietetic jellies, selai (jam), sirup, pudding, saus, icing dan berbagai permen (Winarno 1990).
Dalam industri kosmetika, alginat juga mempunyai peranan penting dalam pembuatan krim, lotion dan shampoo. Alginat merupakan bahan pengental yang efektif dalam pembuatan shampoo bila digunakan dalam konsentrasi 0,5–1% (McNeely dan Pettitt 1973 diacu dalam Hendri 1995). Alginat termasuk ke dalam kelompok GRAS (Generally Recognized as Safe). Dari hasil analisis dan percobaan pada binatang, natrium alginat dan propilen glikol alginat terbukti aman untuk dikonsumsi dan tidak bersifat alergi atau bersifat racun (Winarno 1990).
2.4. Teknologi Membran
Membran adalah selaput semi permeabel yang melewatkan komponen tertentu yang berukuran lebih kecil dan menahan komponen lain yang berukuran
1999). Larutan yang mengandung komponen yang tertahan disebut konsentrat dan larutan yang mengalir disebut permeat. Filtrasi dengan menggunakan membran selain berfungsi sebagai sarana pemisahan juga berfungsi sebagai sarana pemekatan dan pemurnian dari suatu larutan yang dilewatkan pada membran tersebut. Sistem kerja membran secara umum diilustrasikan pada Gambar 2.
Gambar 2. Prinsip kerja sistem membran secara umum
Menurut Mulder (1996) pengelompokan membran dapat diklasifikasikan berdasarkan material asal, morfologi, bentuk, fungsi dan ada tidaknya pori. Berdasarkan material asal, membran dibagi menjadi dua, yaitu membran alami
dan membran sintetik. Fungsi dari membran alami adalah untuk melindungi isi sel dari pengaruh luar dan membantu proses metabolisme dengan sifat permeabelnya, sedangkan membran sintetis merupakan membran yang dibuat sesuai dengan kebutuhan manusia.
Berdasarkan morfologinya membran terbagi menjadi dua, yaitu membran simetrik dan membran asimetrik. Membran simetrik merupakan membran dengan pori yang lebih seragam, sedangkan membran asimetrik adalah membran dengan pori yang tidak seragam.
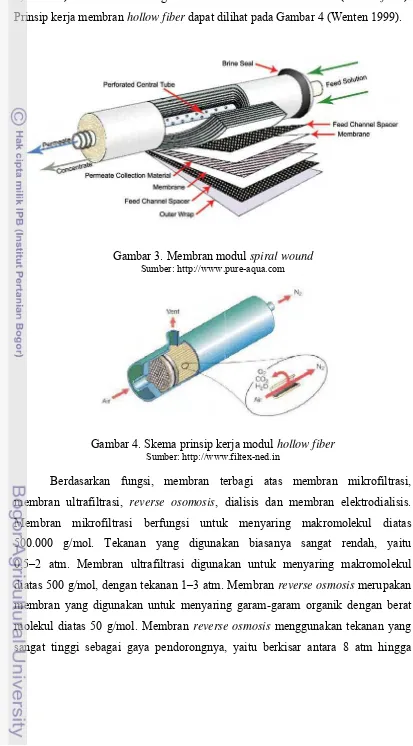
Klasifikasi membran berdasarkan bentuknya terdiri atas dua, yaitu membran bentuk datar dan membran bentuk tubular. Membran bentuk datar merupakan membran yang memiliki bentuk melebar dengan penampang lintang yang besar. Ada dua macam konfigurasi datar yang biasa digunakan, yaitu membran yang menyerupai alat filtrasi yang sering disebut jenis plate and frame dan spiral wound (Gambar 3). Membran bentuk tubular terdiri atas membran serat berongga dengan diameter lebih kecil dari 0,5 mm, membran kapiler (diameter
Umpan
Filtrasi
Membran
Kon
sen
trat
0,5–5 mm) dan membran dengan diameter lebih tebal dari 5 mm (hollow fiber). Prinsip kerja membran hollow fiber dapat dilihat pada Gambar 4 (Wenten 1999).
Gambar 3. Membran modul spiral wound Sumber: http://www.pure-aqua.com
Gambar 4. Skema prinsip kerja modul hollow fiber Sumber: http://www.filtex-ned.in
Berdasarkan fungsi, membran terbagi atas membran mikrofiltrasi, membran ultrafiltrasi, reverse osomosis, dialisis dan membran elektrodialisis. Membran mikrofiltrasi berfungsi untuk menyaring makromolekul diatas 500.000 g/mol. Tekanan yang digunakan biasanya sangat rendah, yaitu 0,5–2 atm. Membran ultrafiltrasi digunakan untuk menyaring makromolekul
120 atm. Membran dialisis dan elektrodialisis digunakan untuk menyaring larutan koloid yang mengandung elektrolit dengan berat molekul kecil. Membran dialisis menggunakan gradien konsentrasi sebagai gaya pendorongnya, sedangkan membran elektrodialisis menggunakan gaya gerak listrik sebagai gaya pendorongnya.
Menurut Renner dan El-Salam (1991) membran dikelompokkan kedalam tiga kelas berdasarkan kisaran ukuran partikel yang direjeksi, yaitu mikrofiltrasi, ultrafiltrasi dan revers osmosis. Beberapa parameter yang menjadi indikator pengelompokkan membran disajikan pada Tabel 1.
Tabel 1. Pengelompokkan proses membran berdasarkan kisaran ukuran partikel yang direjeksi
Parameter Mikrofiltrasi Ultrafiltrasi Reverse Osmosis
Ukuran partikel tertahan
>106 Da 0,01-10 µm
103-106 Da 0,001-0,02 µm
< 103 Da < 0,001 µm
Tekanan (bar) < 2 1-15 > 20
Mekanisme penahanan
Penyaringan molekul
Penyaringan molekul
Difusi / Penyaringan molekul
Fluks (1 m-2h-1) > 300 30-300 3–30
Sumber : Renner dan El-Salam 1991
Mikrofiltrasi digunakan pada berbagai macam aplikasi di industri,
terutama untuk pemisahan partikel berukuran > 0,1 µm dari larutannya. Membran ini dapat menahan koloid, mikroorganisme dan suspended solid. Salah satu aplikasi utamanya dibidang industri adalah sterilisasi dan klarifikasi pada industri makanan dan obat-obatan, klarifikasi juice, recovery logam dalam bentuk koloid, pengolahan limbah cair, fermentasi kontinyu, ataupun pemisahan minyak dan air (Wenten 1999).
Reverse osmosis merupakan proses yang memerlukan tekanan sebagai daya dorong utama, menahan semua ion, melepaskan/meloloskan air. Proses ini praktis untuk menghilangkan zat organik, bakteri, dan juga koloid. Teknik ini tidak memerlukan energi panas, tidak banyak menggunakan bahan kimia, sangat baik untuk memisahkan partikel koloid serta tidak dijumpai masalah kerak dan buih, hanya terjadi peningkatan konsentrasi partikel padat pada dinding membran. Namun, hal ini relatif mudah diatasi, misalnya dengan menaikkan tekanan operasi, begitu pula dengan limbah yang mudah menguap (Winduwati et al. 2000).
2.4.1. Sistem membran
Proses pemisahan dengan menggunakan membran merupakan suatu proses yang efisien dalam penggunaan energi, karena tidak terjadi perubahan fase dalam proses pemisahannya. Biaya operasi yang digunakan dalam proses membran relatif rendah karena tidak menggunakan bahan kimia tambahan sehingga proses ini merupakan proses yang ramah lingkungan. Selain itu, metode pemisahan dengan menggunakan membran dapat dilakukan dalam ruang instalasi yang relatif kecil dan proses dapat berlangsung secara kontinyu.
Wenten (1999) menyatakan bahwa terdapat empat jenis desain membran,
yaitu dead-end, cross- flow, hibrid dead-end cross flow dan cascade. Perbedaan aliran pada sistem dead-end dan cross-flow diilustrasikan pada Gambar 5.
Gambar 5. Sistem desain operasi (a) dead-end (b) cross-flow
Sumber: http://www.memos-filtration.de
Pada pengaliran umpan dengan sistem dead end semua air dalam aliran umpan dipaksa melewati membran penyaring, sedangkan pada cross-flow filtration sebagian air dalam aliran umpan digunakan untuk “mengangkut” komponen-komponen yang menyumbat pori-pori permukaan membran. Dengan teknik tersebut, akumulasi penumpukan komponen-komponen yang ditolak
membran pada permukaan membran dapat dikurangi. Meskipun pencucian membran secara periodik adalah suatu keharusan, teknik cross-flow filtration dapat memperpanjang usia membran dan cukup ekonomis (Anonim 2004).
Kecepatan cross-flow merupakan salah satu faktor yang mempengaruhi nilai fluks. Semakin tinggi kecepatan cross-flow maka semakin besar nilai fluks yang diberikan, karena semakin banyak partikel di permukaan membran yang dapat digerakkan oleh aliran umpan.
2.4.2. Proses pemisahan membran
Prinsip operasi pemisahan dengan menggunakan membran adalah memisahkan bagian tertentu dari umpan (feed) menjadi retentat dan permeat. Umpan adalah larutan yang berisi satu atau lebih campuran molekul atau partikel yang akan dipisahkan. Permeat adalah bagian yang dapat melewati pori membran
Jv = fluks volume (l/m2.jam) A = luas permukaan membran (m2) t = waktu (jam)
V = volume permeat (l)
sedangkan retentat adalah bagian yang tidak dapat melewati pori membran (Pranowo 2006).
Parameter utama yang digunakan dalam penilaian kinerja membran filtrasi adalah fluks dan rejeksi (Osada dan Nagawa 1992). Fluks adalah jumlah volume permeat yang diperoleh pada operasi membran per satuan waktu per luas permukaan membran. Fluks dapat dinyatakan sebagai berikut:
Keterangan,
Menurut Wenten (1999) fluks dipengaruhi oleh beberapa faktor antara lain
konsentrasi umpan, tekanan transmembran, kecepatan cross-flow, temperatur umpan dan waktu. Nilai fluks akan meningkat jika tekanan yang diberikan bertambah, kemampuan melewati membran meningkat dan konsentrasi padatan pada larutan rendah. Nilai fluks yang melewati membran tergantung pada daya kelarutan kemampuan molekul yang dialirkan untuk melewati membran serta perbedaan antara tekanan osmosis cairan dengan nilai tekanan yang diberikan pada operasi.
Selektifitas membran (rejeksi) merupakan parameter yang penting. Selektifitas membran merupakan ukuran kemampuan membran untuk memisahkan komponen tertentu dari aliran umpan (Wenten 1999). Selektivitas membran dinyatakan sebagai berikut:
% %
Keterangan,
Nilai rejeksi (R) tidak tergantung terhadap satuan konsentrasi yang digunakan. Nilai rejeksi bervariasi antara 0 sampai 100 persen. Nilai rejeksi 100 persen berarti pemisahan partikel sempurna, dalam hal ini membran bersifat
R = presentasi rejeksi
semipermeabel ideal dan 0 persen berarti seluruh partikel larutan dapat melewati membran secara bebas (bersama-sama).
2.4.3. Membran reverse osmosis
Proses yang terjadi pada reverse osmosis merupakan kebalikan dari proses osmosis biasa. Pada proses osmosis yang terjadi adalah perpindahan pelarut dari larutan yang lebih encer ke larutan yang lebih pekat sedangkan pada reverse osmosis yang terjadi adalah sebaliknya, yaitu pelarut dipaksa berpindah dari larutan pekat ke larutan yang lebih encer dengan bantuan tekanan kerja (Wenten 1999). Perbandingan proses osmosis dan reverse osmosis terlihat pada Gambar 6.
Gambar 6. Prinsip kerja membran reverse osmosis (RO)
Sumber: http://www.RoplantWater.org
Reverse osmosis memiliki ukuran pori kurang dari 0,0001–0,001 µm atau tidak berpori. Membran ini dapat menahan zat terlarut yang memiliki bobot molekul rendah seperti sukrosa dan glukosa dari larutannya (Wenten 1999). Menurut Fellows (1992), reverse osmosis adalah suatu proses dimana air dipisahkan dari komponen terlarut melalui selaput atau membran semi permeabel. Untuk proses ini diperlukan tekanan tinggi, berkisar antara 4000 sampai dengan 8000 kPa.
Berdasarkan kajian ekonomi menunjukkan reverse osmosis mempunyai keuntungan sebagai berikut (Agustina et al. 2009) ;
2) Untuk umpan padatan total terlarut di atas 400 ppm, dengan penurunan padatan total terlarut 10% semula, reverse osmosis sangat menguntungkan dibanding dengan deionisasi
3) Untuk umpan berapa pun konsentrasi padatan total terlarut, disertai kandungan organik lebih daripada 15 g/liter, reverse osmosis sangat baik untuk praperlakuan deionisasi.
4) Reverse osmosis sedikit berhubungan dengan bahan kimia, sehingga lebih praktis.
Menurut Brantd et al. (1993), reverse osmosis dapat digunakan untuk proses pemekatan yang bertujuan untuk membuang air dari bahan. Pengaplikasian membran reverse osmosis untuk memekatkan susu skim dilakukan oleh
Guirguis et al. (1987) pada tekanan 3,0 MPa serta temperature 50 oC. Hasil yang didapatkan adalah membran reverse osmosis mampu memekatkan susu skim sebesar 2,6 kali.
2.4.4. Faktor-faktor yang mempengaruhi kinerja membran
Faktor-faktor yang mempengaruhi kinerja membran merupakan faktor yang berpengaruh terhadap nilai fluks dan rejeksi. Faktor-faktor tersebut antara lain tekanan transmembran, temperatur, kecepatan cross-flow, konsentrasi larutan, fouling dan polarisasi konsentrasi.
Secara umum temperatur yang lebih tinggi akan menghasilkan harga fluks yang lebih tinggi pula, baik pada pressure controlled region maupun mass-transfer controlled region. Hal ini berlaku dengan asumsi bahwa tidak terjadi pengaruh tertentu lainnya secara simultan, seperti fouling pada membran sebagai akibat dari pengendapan garam tak larut pada temperatur yang tinggi. Dalam pressure controlled region, temperatur berpengaruh melalui harga densitas dan viskositas. Energi aktivasi baik untuk fluks maupun viskositas pada rentang 20–50 oC berkisar antara 3.400 kalori/mol, atau dengan kata lain fluks akan meningkat menjadi dua kali lipat setiap kenaikan suhu temperatur 30–40 oC (Wenten 1999). Penggunaan membran pada temperatur tinggi dapat meningkatkan nilai fluks tetapi mempercepat umur membran.
Kecepatan cross-flow mempunyai pengaruh yang berarti terhadap fluks. Hal ini dikarenakan semakin tinggi kecepatan cross-flow akan mengurangi akumulasi partikel pada permukaan membran. Aliran umpan sejajar terhadap permukaan membran akan “menyapu” padatan terakumulasi di atas permukaan membran sehingga mengurangi ketebalan pada lapisan batas dan semakin tinggi kecepatan cross-flow semakin banyak partikel yang dapat digerakkan. Peningkatan laju alir/turbulensi merupakan salah satu metode untk mengendalikan polarisasi konsentrasi yang paling sederhana dan efektif (Wenten 1999; Erliza et al. 2001).
Konsentrasi juga merupakan faktor penting dalam proses membran. Konsentrasi bahan yang tinggi menyebabkan penurunan fluks. Fluks akan menurun eksponensial jika konsentrasi umpan meningkat. Dengan mengetahui kondisi optimum proses membran maka fluks maksimum akan dapat tercapai.
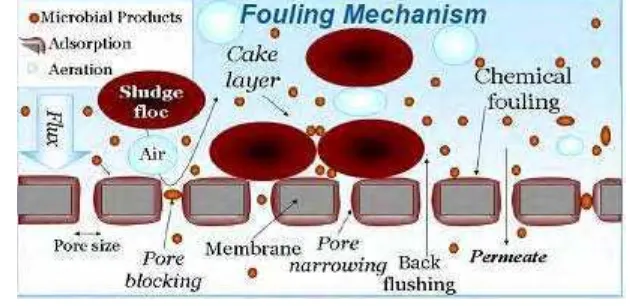
Gambar 7. Lokasi terjadinya fouling pada membran
Sumber: http://www.ete.wur.nl
Peristiwa fouling terjadi dalam tiga tahapan. Tahap pertama adalah polarisasi konsentrasi, kemudian diikuti oleh perpindahan padatan dari permukaan membran ke dalam material membran dan dilanjutkan oleh proses adsorbsi padatan pada pori membran sehingga terjadi penyempitan dan penyumbatan pori (Wenten 1999).
Polarisasi konsentrasi dan fouling dapat membatasi proses pemisahan dengan membran karena menyebabkan nilai fluks menurun sehingga kinerja membran jadi rendah. Polarisasi konsentrasi merupakan peristiwa pembentukan gradien konsentrasi dari komponen-komponen umpan yang tertahan di dekat permukaan membran. Gejala polarisasi konsentrasi dimulai dengan
3. METODOLOGI PENELITIAN
3.1. Waktu dan Tempat
Penelitian dilaksananakan pada bulan Maret-Juni 2009 di Laboratorium Diagnostik, Departemen Ilmu dan Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Laboratorium Bioteknologi Hasil Perairan, Laboratorium Biokimia Hasil Perairan dan Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2. Alat dan Bahan
Peralatan yang digunakan pada penelitian ini yaitu cawan petri, erlenmeyer 1 liter, inkubator shaker, oven, sentrifuse, timbangan, viskometer gilmont (bola jatuh), gelas ukur, kertas saring Whatman 42, satu unit membran
Reverse osmosis (CSM Model No: RE75-1812-50GPD) dengan nilai rejeksi 95% NaCl dan luas permukaan 0,38 m² (Lampiran 1), termostat, baker glass 2 liter
dan chromameter Minolta CR 300.
Bahan-bahan yang dilakukan dalam penelitian ini adalah bakteri Pseudomonas aeruginosa yang diperoleh dari laboratorium Mikrobiologi Medik, FKH-IPB, media pertumbuhan bakteri yaitu NA (Nutrien Agar) dan BHI (Brain Heart Infusion) Broth, etanol 96%, akuades dan NaOH.
3.3. Metode Penelitian
Penelitian ini dilaksanakan dalam dua tahap. Tahap pertama, yaitu produksi alginat dari bakteri P. aeruginosa dan tahap kedua pemekatan alginat dengan teknologi membran.
3.3.1. Produksi alginat dari Pseudomonas aeruginusa
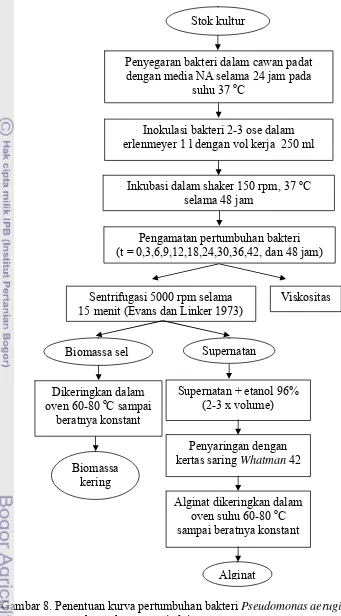
a. Penentuan kurva pertumbuhan dan pengukuran konsentrasi alginat (Modifikasi Hassett 1996)
Inokulum yang diperoleh dari stok kultur FKH disegarkan dalam cawan padat dengan media NA selama 24 jam pada suhu 37 oC. Mikroba tersebut diinokulasikan ke dalam 250 ml media BHI broth dalam erlenmeyer 1 liter dan
37 oC. Selama inkubasi dilakukan pengamatan pada jam ke-0, ke-3, ke-6, ke-9, ke-12, ke-18, ke-24, ke-30, ke-36, ke-42 dan ke-48. Parameter yang diamati selama inkubasi, yaitu biomassa kering bakteri, konsentrasi alginat dan viskositas. Parameter tersebut diamati untuk mengetahui laju pertumbuhan bakteri dan laju pembentukan produk (alginat) yang nantinya digunakan untuk penetapan waktu proses optimal pada produksi alginat skala besar. Diagram penentuan kurva pertumbuhan dan pengukuran konsentrasi alginat dapat dilihat pada Gambar 8.
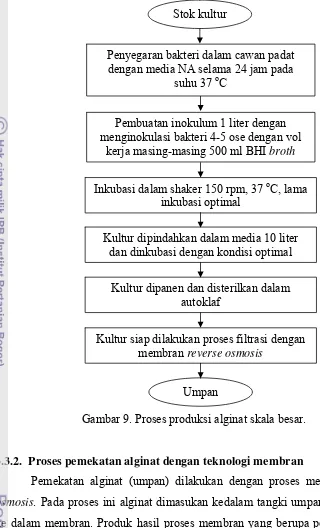
b. Produksi alginat skala besar.
Proses ini dilakukan setelah mengetahui kondisi optimal pertumbuhan bakteri dan konsentrasi alginat yang didapatkan. Tahap ini diawali dengan pembuatan inokulum sebanyak 10% dari jumlah total media yang ada. Untuk
Gambar 8. Penentuan kurva pertumbuhan bakteri Pseudomonas aeruginosa dan pengukuran konsentrasi alginat.
Stok kultur
Inokulasi bakteri 2-3 ose dalam erlenmeyer 1 l dengan vol kerja 250 ml
Inkubasi dalam shaker 150 rpm, 37 oC selama 48 jam
Pengamatan pertumbuhan bakteri (t = 0,3,6,9,12,18,24,30,36,42, dan 48 jam)
Viskositas Penyegaran bakteri dalam cawan padat dengan media NA selama 24 jam pada
suhu 37 oC
Sentrifugasi 5000 rpm selama 15 menit (Evans dan Linker 1973)
Dikeringkan dalam oven 60-80 oC sampai
beratnya konstant
Supernatan
Alginat dikeringkan dalam oven suhu 60-80 oC sampai beratnya konstant Biomassa sel
Supernatan + etanol 96% (2-3 x volume)
Penyaringan dengan kertas saring Whatman 42 Biomassa
kering
Gambar 9. Proses produksi alginat skala besar.
3.3.2. Proses pemekatan alginat dengan teknologi membran
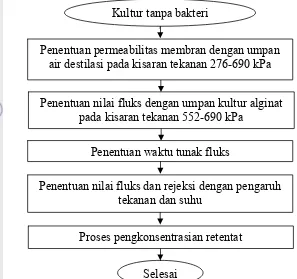
Pemekatan alginat (umpan) dilakukan dengan proses membran reverse osmosis. Pada proses ini alginat dimasukan kedalam tangki umpan dan dialirkan ke dalam membran. Produk hasil proses membran yang berupa permeat (bagian yang dapat melewati pori membran) dan retentat (bagian yang tidak dapat melewati pori membran) diresirkulasikan ke dalam tangki umpan. Pada waktu tertentu dilakukan sampling terhadap permeat dan retentat untuk pengukuran fluks dan nilai rejeksi. Diagram alir proses pemekatan alginat dengan teknologi membran dapat dilihat pada Gambar 10.
Kultur dipindahkan dalam media 10 liter dan dinkubasi dengan kondisi optimal
Kultur siap dilakukan proses filtrasi dengan membran reverse osmosis
Kultur dipanen dan disterilkan dalam autoklaf
Stok kultur
Pembuatan inokulum 1 liter dengan menginokulasi bakteri 4-5 ose dengan vol
kerja masing-masing 500 ml BHI broth
Inkubasi dalam shaker 150 rpm, 37 oC, lama inkubasi optimal
Penyegaran bakteri dalam cawan padat dengan media NA selama 24 jam pada
suhu 37 oC
Gambar 10. Diagram alir proses pemekatan alginat dengan teknologi membran.
A. Karakteristik membran
a) Penentuan permeabilitas (Uju 2005)
Permeabilitas membran diukur untuk mengetahui kemampuan membran dalam melewati air destilasi. Permeabilitas membran diukur dengan cara menggunakan air destilasi sebanyak 600 ml sebagai umpan. Proses pengukuran dilakukan dengan kisaran tekanan transmembran yang digunakan 276–690 kPa. Pada setiap tekanan transmembran yang diujikan, besarnya fluks permeat diukur.
Nilai permeabilitas membran (K) ditentukan dengan cara menghitung gradien plot grafik antara nilai fluks (J) sebagai sumbu Y dan tekanan transmembran (∆P) sebagai sumbu X.
b) Pengaruh tekanan transmembran terhadap nilai fluks.
Pengaruh tekanan transmembran dilihat dengan mencobakan beberapa nilai tekanan pada proses recovery, yaitu 552-690 kPa. Sampel yang digunakan adalah kultur alginat sebanyak 600 ml. Setiap tekanan yang dicobakan diukur nilai fluksnya.
Kultur tanpa bakteri
Penentuan nilai fluks dengan umpan kultur alginat pada kisaran tekanan 552-690 kPa
Penentuan nilai fluks dan rejeksi dengan pengaruh tekanan dan suhu
Selesai
Penentuan permeabilitas membran dengan umpan air destilasi pada kisaran tekanan 276-690 kPa
Penentuan waktu tunak fluks
c) Penentuan waktu tunak
Penentuan waktu tunak fluks dilakukan dengan menghitung fluks permeat sejak kondisi variabel terpasang. Jeda waktu pengukuran lima menit dan penghitungan fluks permeat dilakukan setiap satu menit sekali selama 60 menit. Fluks dianggap tunak jika 5-10 kali pengukuran memperoleh nilai yang sama.
B. Pengaruh variabel operasi
a) Pengaruh tekanan transmembran dan suhu terhadap nilai fluks
Pengaruh tekanan transmembran dan suhu dilihat dengan mencobakan beberapa nilai tekanan pada proses recovery, yaitu pada tekanan 552, 620 dan 690 kPa dengan suhu 35, 40 dan 45oC. Setiap perlakuan yang dicobakan diukur nilai fluksnya.
b) Pengaruh tekanan transmembran dan suhu terhadap nilai rejeksi
Pengaruh tekanan transmembran dan suhu dilihat dengan mencobakan beberapa nilai tekanan pada proses recovery, yaitu pada tekanan 552, 620 dan 690 kPa dengan suhu 35, 40 dan 45oC. Setiap perlakuan yang dicobakan diukur nilai rejeksinya.
C. Proses pengkonsentrasian retentat (alginat) a) Fluks (Cheryan 1998)
Fluks didefenisikan sebagai jumlah volume cairan yang berhasil melewati membran (fraksi permeat) untuk setiap satuan luasan membran dan satuan waktu. Nilai fluks (J) dihitung dengan menggunakan persamaan :
∑
b) Rejeksi (Cheryan 1998)
Rejeksi merupakan kemampuan suatu membran dalam menahan partikel terlarut tertentu. Nilai konsentrasi alginat diukur dengan cara:
c) Karakteristik warna retentat
Warna diukur dengan menggunakan alat chromameter Minolta CR 300. Sampel diletakkan pada tempat yang tersedia. Setelah menekan tombol start akan diperoleh nilai L, a dan b, masing-masing dengan kisaran 0 sampai 100 (putih). Pada dasarnya jenis warna dibentuk dari tiga warna dasar, yaitu merah (X), hijau (Y), dan biru (Z). kemudian nilai skala warna X, Y, Z dikonversikan menjadi notasi warna Hunter yang terdiri dari tiga parameter, yaitu nilai a, b dan L. konversi nilai-nilai tersebut dikonversi dengan rumus:
, , √ , ,
√
L = 10 √Y Keterangan:
(a+) = merah (a-) = hijau (L) = Kecerahan (b+) = kuning (b-) = biru
3.4. Analisis Data
Rancangan percobaan yang dilakukan dalam penelitian ini adalah two level
factorial design (Box et al. 1979). Parameter yang diteliti, yaitu tekanan transmembran dan suhu dengan respon yang diukur adalah fluks (J) dan rejeksi membran (Robs). Sementara itu, batasan taraf nilai variabel yang digunakan disajikan dalam Tabel 2.
Tabel 2. Penentuan tarif nilai variabel yang digunakan
Parameter Nilai pengkodean dan taraf sebenarnya
-1 0 +1
TMP (kPa) 552 621 690
i i<j
Model rancangan percobaan untuk mengetahui hubungan liner dari variable tekanan transmembran dan laju alir bahan terhadap respon nilai fluks dan rejeksi diberikan pada persamaan berikut:
Y = ao + aixi + aijxixj
Keterangan:
Y = respon dari masing-masing perlakuan xi ; xj = variable bebas
ao = intersep
ai = koefisien regresi orde pertama
aij = koefisien interaksi untuk interaksi variable i dan j
3.5. Prosedur Analisis
a) Bobot biomassa kering (Modifikasi Evans dan Linker 1973)
Proses pemanenan sel setelah kultur fermentasi mencapai lama fermentasi yang ditentukan. Kultur mula-mula diukur volumenya, sebanyak 10 ml. Massa sel dipisahkan melalui sentrifugasi pada kecepatan 5000 rpm selama 5 menit. Hasil pemisahan berupa fase padat adalah massa sel, yang selanjutnya dikeringkan pada oven dengan suhu 60–80 oC sampai beratnya konstan dan dinyatakan sebagai berat sel kering.
b) Pengukuran konsentrasi alginat
Konsentrasi alginat diukur dengan cara mengambil filtrat yang didapatkan dari pengukuran massa kering sel sebanyak 10 ml, kemudian ditambahkan dengan etanol 96% sebanyak 30 ml, lalu diaduk dan di saring dengan menggunakan kertas saring 42 Whatman. Etanol ditambahkan untuk mengendapkan alginat. Kertas saring hasil saringan dioven dengan suhu 60–80 oC selama 24 jam, kemudian ditimbang untuk mengetahui berat alginat yang dihasilkan.
c) Penentuan viskositas (Uju 2005)
Viskositas larutan/sampel dihitung dengan menggunakan persamaan:
η = K(ρf – ρ) t Keterangan :
η = viskositas cairan (cP) K = konstanta viskometer = 3,3
ρf = densitas bola (stainless steel : 8,02)
ρ
= densitas cairan4. HASIL DAN PEMBAHASAN
4.1. Produksi Alginat dari Pseudomonas aeruginusa
4.1.1. Biomassa kering P. aeruginosa
Biomassa P. aeruginosa yang dihasilkan pada penelitian ini berkisar antara 0,23–1,5 g/l selama 48 jam waktu inkubasi pada kultur cair medium BHI (Brain Heart Infusion) broth (Lampiran 2). Pengukuran biomassa dilakukan untuk mendapatkan kurva pertumbuhan bakteri P. aeruginosa. Kurva pertumbuhan bakteri P. aeruginosa dapat dilihat pada Gambar 11.
Gambar 11. Grafik hubungan waktu inkubasi dengan biomassa kering bakteri.
Pertumbuhan bakteri P. aeruginosa dalam media BHI broth menghasilkan biomassa kering optimum sebanyak 1,5 g/l pada jam ke-6 dan minimum pada jam ke-48 sebanyak 0,23 g/l. Bakteri P. aeruginosa pada penelitian ini berasal dari perairan tawar. Pertumbuhan P. aeruginosa dengan media BHI broth lebih cepat dibandingkan pertumbuhan P. aeruginosa dengan media lain. Hal ini terbukti bahwa pada penelitian sebelumnya dengan media glukosa dan penambahan ekstrak khamir, pertumbuhan optimum bakteri ini baru didapatkan pada jam ke-96 dengan biomassa kering sebanyak 1,75 g/l (Hendri 1995). Selain itu, Desniar (2003) melaporkan bahwa jumlah biomassa kering optimum yang didapatkan sebanyak 4,34 g/l yang diinkubasi dalam media tetes tebu dan urea selama 72 jam waktu inkubasi.
0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6
0 3 6 9 12 18 24 30 36 42 48
Biomassa kering (g/l)
Kurva pertumbuhan bakteri biasanya mengikuti pertumbuhan jasad renik. Fase log (eksponensial) P. aeruginosa terjadi pada waktu inkubasi jam ke-0 hingga jam ke-6 dengan biomassa yang didapatkan 0,5–1,5 g/l. Pseudomonas aeruginosa mulai mengalami fase stationer pada jam ke-6 hingga jam ke-12 dan fase kematian pada jam ke-12 hingga jam ke-48 waktu inkubasi. Fase lag (fase adaptasi) tidak terlihat pada kurva pertumbuhan di atas. Hal ini karena sebelum proses kultur P. aeruginosa dilakukan proses inokulasi dengan media dan kondisi yang sama, sehingga pada proses kultur bakteri sudah tidak lagi beradaptasi dengan media kultur.
Fase logaritmik pada penelitian ini sudah dimulai dari awal proses kultur. Sel jasad renik membelah sangat cepat dan konstan pada fase logaritmik. Jumlah
sel akan meningkat, mula-mula perlahan dan semakin lama semakin meningkat. Fase logaritmik pada penelitian ini lebih lama dan mengalami peningkatan yang signifikan dibandingkan dengan yang dilaporkan oleh Hendri (1995) maupun Sabra (1998). Fase logaritmik pertumbuhan P. aeruginosa pada penelitian yang dilakukan oleh Hendri terjadi dari jam ke-3 hingga jam ke-7 dengan biomassa yang didapatkan berkisar antara 0,4–1,3 g/l. Fase logaritmik pada penelitian Sabra dengan menggunakan bakteri Azotobacter vinelandii terjadi dari jam ke-10 hingga jam ke-22 dengan biomassa kering sel, yaitu 1,0-7,5 g/l. Fase logaritmik pada penelitian ini terjadi mulai dari awal kultur, yaitu jam ke-0 hingga jam ke-6 dengan biomassa 0,5-1,5 g/l. Hal ini terjadi karena adanya perbedaan media dan juga metode yang digunakan. Fase logaritmik terjadi pada saat terdapat kelebihan semua bahan nutrien, yang sangat dipengaruhi oleh medium tempat tumbuhnya seperti pH dan kandungan nutrien, juga kondisi lingkungan termasuk suhu dan kelembaban udara (Fardiaz 1989).
Fase stasioner terjadi ketika jumlah sel yang tumbuh sama banyak dengan jumlah sel yang mati. Hal ini ditunjukkan dengan garis datar pada kurva pertumbuhan. Fase stasioner pada penelitian ini terjadi selama 6 jam, yaitu dari jam ke-6 hingga jam ke-12 waktu inkubasi, sedangkan fase stasioner pada penelitian Hendri (1995) terjadi selama 5 jam yaitu dari jam 11 hingga jam ke-16 waktu inkubasi. Fase stasioner pada penelitian Sabra (1998) dengan
ke-17 hin a jumlah se engakibatka l yang tumb ase terakhir decline or d
at memprod
2. Grafik hu
asil ini lebi selama 7 ja
Hendri 199 dengan bak
ke-30 wakt tetap mem el konstan s an sel kem buh pada fa
dari kurva death). Fase duksi sel ba itian ini terj berbeda den lkan yaitu se
ubungan lam
ih tinggi d am inkubasi 95), 3,00 g kteri Azotob
tu inkubasi
e ini terjadi aru dan jum jadi dari jam ngan yang
6 waktu ink
selama 48 onsentrasi a inkubasi, se
ebesar 4.04
ma inkubasi
dari pada p i dalam me ik (Fardiaz han bakteri i ketika nut mlah sel da m ke-12 hin
dilaporkan
kubasi.
8 jam in alginat men etelah itu ce
g/l pada jam
i dengan ka
enelitian se edia glukos
25 jam da andii (Sabr
jadi lebih zat nutrisi s
Kurangny ai komposis
1989). i, yaitu fase trien habis
lam kultur ngga ke-48
oleh Hend
nkubasi be nunjukkan p
enderung m m ke-3 (Gam
adar alginat
ebelumnya, sa dan pena alam NRM ra et al. 200
kecil pada sudah habis ya nutrien d si yang be
e kematian sehingga ba berkurang.
waktu inku dri (1995),
selama 7 berkisar a 1,13 cP (L silkan. Hal akan bakteri on yang dig
dengan n fosfat yan erdasarkan
n, waktu in
da proses ku
skositas skositas ku antara 1,18 Lampiran 4 Viskositas skositas yan akan bakter hat pada Ga
Gambar 13.
skositas da ntuk algina njang dari al
dalam NF ii (Cheze-L media yang ini sesuai d i Azotobact
unakan aka
continuous-ng limit akan biomassa k nkubasi sel ri Azotobact ambar 13. kering dan lama 6 jam
at skala besa
alami kenai kemudian as tertinggi asil penelitia kan oleh Sea
ter vineland h jumlah alg
menunjukka kan produks konsentras m dipilih se
ar.
ikan dari ja menurun h i terlihat pa an ini lebih anez et al. ( dii. Hasil pe
tu inkubasi
bentukan ge n oleh Sabr variasi sumb ginat yang d an bahwa si alginat ya si alginat m ebagai wak
am ke-0 hin hingga jam ada jam ke h rendah jik 2001) sebes engukuran
dengan visk
el merupak ruhi oleh s tas alginat d
dengan ba ut menunju onsentrasi al ra (2001) de ber pepton, f dihasilkan.
media de ang maksim maksimum ktu panen k
ngga jam k m ke-48 me 24 dengan ka dibandin sar 7 cPs de viskositas k
karena ada n pada penel
kteristik M meabilitas lai fluks me bran. Gam yai nilai gra
naikan teka 059 l.m-2.h
-Gambar 14. P
enten (1999 gel yang leb
(Yunizal 2 a alginat y mannuronat
litian ini me
Membran
rsi asam gul bkan sema lkan gel y nya, semak bih lemah d 2004 dikutip
yang dihas yang ting enjadi renda
cara linier d menunjukk 9 terhadap membran seb
ekanan trans
kan bahwa s nan berband semakin tin
luronat (G). akin kuat in
yang lebih kin tinggi k dan lebih ela
p oleh Sub besar 1 kPa
smembran t
secara umu ding lurus ggi tekanan
. Semakin t nteraksi an kuat dan kandungan a astis sehing n yang diber
inggi kandu
as alginat
ngkatnya tek transmem ut menunju ningkatkan
lai fluks.
bilitas air m kanan hidro rikan maka
juga aka bran tidak b
ngaruh teka asil analisis
yang nyata kkan tekanan kkan setiap
sar 0,016 l ka dibanding
Hal ini ter
bkan larutan nutupi pori bkan muncu kkan nilai n ng permeat an pada pros
tinggi ko a terhadap n
n transmem ses ini diseb
onsentrasi an osmotik.
garuh tekan
Hasil ana h signifikan
dap nilai fl kkan bahwa
nilai fluks mbran memp ekanan tran amun demik an pelarut ai na adanya k
enjadi lebih n terhadap n
luks
a tekanan t (P < 0.05) punyai nilai
nsmembran kian, gradie ir murni ya kandungan
h kental dan ginat yang
Hal ini terl uhkan tekan n membran
akin besar t rut (algina
mbran terha
unjukkan ilai fluks.
transmembr
n diduga al terlarut dal lihat dari ni nan yang le n. Tingginy
tekanan osm at) maka
adap nilai fl
bahwa tek
ran membe n 5). Gamb 016. Hal ter kPa maka ebih besar u ya tekanan motik zat ter
4.2.3. Pen ada menit ke
6. Pola per tekanan
danya perbe apat polaris (1989) yang da proses m
smosis sang
aruh Varia
aktu tunak han nilai fl
pada selang proses ini permeat be ni berbeda d s filtrasi den
e 10. uh yang sign
punyai nilai kat sebesar
(steady stat
fluks yang g waktu 60 i cenderung erkisar an dengan yan ngan memb
ai fluks per bran
u tunak dika trasi. Hal te an bahwa po i dan ultra
si
membran d is terlihat b nifikan terha
i gradien 0 r 0,3 l.m-2
rmeat yang
arenakan da ersebut didu olarisasi kon afiltrasi sed
dan suhu te bahwa tekan adap nilai fl
0,3. Hal ter 2
.h-1 untuk
n oleh per at dilihat p mengalami p
l.m-2.h-1 an oleh Jay iltrasi, dima
disebabkan
alam proses ukung oleh nsentrasi pe k setiap ke
rubahan tek
n oleh perub
reverse osm piran 6).Tek
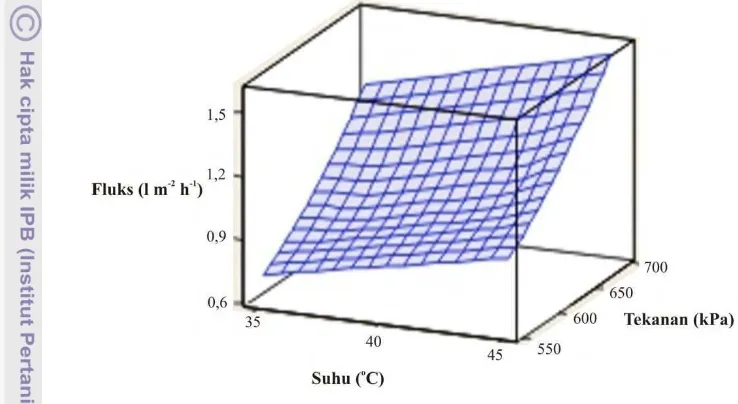
transmembran sebesar 1 kPa. Sedangkan suhu mempunyai nilai gradien 0,12. Hal ini berarti fluks akan meningkat sebesar 0,12 l.m-2.h-1 untuk setiap kenaikan suhu sebesar 1 oC. Hasil analisis juga menunjukkan bahwa interaksi antara tekanan dan suhu tidak berpengaruh signifikan. Pengaruh tekanan transmembran dan suhu umpan terhadap nilai fluks dapat dilihat pada Gambar 17.
Gambar 17. Pengaruh tekanan transmembran dan suhu umpan terhadap nilai fluks.
Gambar 17 menunjukkan bahwa semakin meningkat tekanan transmembran dan suhu yang diberikan nilai fluks akan semakin meningkat. Peningkatan nilai fluks seiring dengan peningkatan tekanan terjadi karena semakin besar tekanan maka semakin besar pula daya dorong larutan menuju permukaan membran. Adanya peningkatan tekanan juga dapat mempercepat akumulasi solute dipermukaan membran. Hasil tersebut sesuai dengan penelitian yang dilakukan oleh Jayarajah dan Lee (1999) dimana tekanan transmembran
yang dioperasikan dengan suhu tertentu meningkatkan nilai fluks secara linier dengan kenaikan tekanan dan suhu yang diberikan.
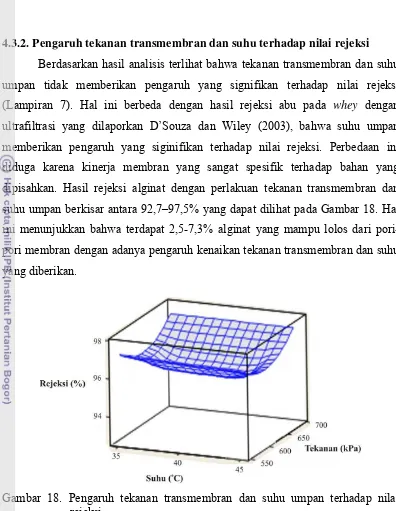
4.3.2. Pengaruh tekanan transmembran dan suhu terhadap nilai rejeksi Berdasarkan hasil analisis terlihat bahwa tekanan transmembran dan suhu umpan tidak memberikan pengaruh yang signifikan terhadap nilai rejeksi (Lampiran 7). Hal ini berbeda dengan hasil rejeksi abu pada whey dengan ultrafiltrasi yang dilaporkan D’Souza dan Wiley (2003), bahwa suhu umpan memberikan pengaruh yang siginifikan terhadap nilai rejeksi. Perbedaan ini diduga karena kinerja membran yang sangat spesifik terhadap bahan yang dipisahkan. Hasil rejeksi alginat dengan perlakuan tekanan transmembran dan suhu umpan berkisar antara 92,7–97,5% yang dapat dilihat pada Gambar 18. Hal ini menunjukkan bahwa terdapat 2,5-7,3% alginat yang mampu lolos dari pori-pori membran dengan adanya pengaruh kenaikan tekanan transmembran dan suhu
yang diberikan.
Gambar 18. Pengaruh tekanan transmembran dan suhu umpan terhadap nilai rejeksi.
4.4. Proses Pengkonsentrasian Alginat
Proses pemekatan hasil kultur alginat menghasilkan konsentrat. Kinerja proses juga diteliti berdasarkan indikator kinerja membran, yaitu fluks dan rejeksi yang terjadi. Setelah itu dilakukan karakteristik pada konsentrat yang dihasilkan. 4.4.1. Respon fluks
bahwa sem tersebut y
fouling ya
4.4.2. Res tabil pada m
Gambar 1
nurunan flu nit berikutn ng melapor es dan cend engaruh teka
sehingga yang akhirny ang diakibat
spon rejeks asil rejeksi ksi alginat p alginat den 1,4 µm, yai ebut diduga an bahan ba
a waktu pro menit-menit anan yang m
terjadi pen ya dapat m tkan oleh se
si aku yang be
ses pemeka terakhir.
h lamanya w
gi terjadi p isi ini sam a penurunan l pada meni mendorong
numpukan menyebabkan
emakin men
ama proses itian ini men
ggunakan r 42–71% ( pengaruh je erbeda pula.
atan, nilai fl
waktu filtras
pada awal ma dengan n fluks seca
it-menit ber partikel-par partikel p n terjadinya enis dan ka
.
fluks semak
si terhadap
proses dib hasil pene ara tajam te
rikutnya. Ha rtikel terlaru pada permu
a polarisasi kadar algina
n terlihat p %. Hasil ini erjadi pada
al ini diseba ut ke permu ukaan mem konsentras at dalam um
Ha n sebagai alt
21. Konsent membra
0. Pengaruh
didukung p nat hasil p at yang be
membran dip gan membr
dilakukan ali. Hasil pe membran emekatan d elum dipro
peroleh seb ran hanya
dengan enelitian m
mampu m mbuktikan
uk memeka
t sebelum d
waktu filtrasi
i terhadap r
alginat y n bahwa alg
pengguna knologi me
t dari bakter
h pengkons ejeksi.
yang dihas uh lebih ba n. Alginat
4.4.3. Viskositas dan warna alginat
Viskositas alginate yang dihasilkan pada akhir penelitian ini sebesar 1,08 cP. Nilai ini lebih rendah dibandingkan nilai viskositas awal sebesar 1,38 cP. Penurunan viskositas ini dapat diakibatkan karena adanya kenaikan suhu selama proses filtrasi membran. Suhu berpengaruh terhadap viskositas larutan, semakin tinggi suhu maka viskositas larutan akan semakin rendah. Alginate dari rumput laut memiliki tiga tingkatan berdasarkan nilai viskositasnya, yaitu viskositas rendah (< 250 cP), viskositas sedang (250-3500 cP) dan viskositas tinggi untuk (3500-14000 cP) (Rasyid dan Rachmat 2002). Berdasarkan pembagian tersebut, maka viskositas alginat pada penelitian ini termasuk dalam viskositas rendah.
Alginat yang diperoleh berwarna cerah merah kekuningan yang terlihat pada
Tabel 3. Nilai L (kecerahan) sebesar 54,09 telah memenuhi standar yang
ditetapkan oleh Food Chemical Chodex (1981) diacu dalam King (1983) sebesar 52,80.
Tabel 3. Hasil pengukuran warna alginat
Keterangan Nilai
L 54,09 + 0,0707
a (+) 3,61 + 0,0070
b (+) 32,76 + 0,0777
Keterangan : L = Kecerahan
5. KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan biomassa kering dan konsentrasi alginat maksimum yang didapatkan, waktu inkubasi selama 6 jam dipilih sebagai waktu panen kultur alginat dari bakteri Pseudomonas aeruginosa pada proses kultur alginat skala besar.
Selama proses filtrasi, faktor tekanan transmembran dan suhu berpengaruh terhadap nilai fluks yang dihasilkan. Waktu tunak pada proses ini cenderung tidak mengalami perubahan yang signifikan. Tekanan transmembran dan suhu umpan mempengaruhi besarnya fluks permeat yang dihasilkan. Pada
penelitian ini fluks meningkat sebesar 0,3 l.m-2.h-1 untuk setiap kenaikan tekanan transmembran sebesar 1 kPa, dan 0,12 l.m-2.h-1 untuk setiap kenaikan suhu sebesar 1 oC. Tekanan transmembran dan suhu umpan tidak berpengaruh signifikan terhadap perubahan nilai rejeksi alginat. Alginat yang dihasilkan menggunakan membran reverse osmosis memiliki nilai rejeksi antara 92,7–97,5%. Alginat pada penelitian ini memiliki tingkat kecerahan 54,07 dengan viskositas 1,08 cP, berwarna merah kekuningan.
Hasil penelitian menunjukkan bahwa alginat yang telah dipekatkan dengan membran mampu mengurangi penggunaan etanol 96% sebanyak 40%. Hal ini membuktikan bahwa teknologi membran mampu digunakan sebagai alternatif untuk memekatkanalginat dari bakteri dan mereduksi penggunaan etanol 96%.
5.2. Saran
DAFTAR PUSTAKA
[DKP] Departemen Perikanan dan Kelautan. 2005. Artikel Seaweed. www.rumputlaut.org [10 Juni 2008].
[MnTAP] Minnesota Technical Assistance Program. 1995. Membrane filtration system. http://www.mntap.umn.edu [25 Oktober 2009]
Adrianto. 2005. Kajian pengaruh konsentrasi polimer terhadap fluksi dan rejeksi membran selulosa asetat. [skripsi]. Bogor: Fakultas Teknologi Pertanian. Institut Pertanian Bogor.
Aerospace. 2009. How hollow fibre membranes work. http://www.filtex-ned.nl [27 Oktober 2009]
Agustina S, Sri P R, Tri W, Trisni A. Penggunaan teknologi membran pada pengolahan air limbah industri kelapa sawit. Workshop Teknologi Industri Kimia dan Kemasan. http://www.bbkk-litbang.go.id [27 Oktober 2009]
Anggadiredja J T, Zatnika A, Purwoto H, Istini S. 2006. Rumput Laut. Jakarta: Penebar Swadaya.
Anonim. 2004. Membran processing. http://www.foodsci.uoguelph.ca [27 Oktober 2009]
Anonima. 2009. Ultrfiltration W.A.T.-FM modul system. Pure water from any source at any location. http://www.krivarochem.be. [25 Oktober 2009]
Anonimb. 2009. Membrane cleaning skid. Pure aqua, Inc. http://www.pure-aqua.com [27 Oktober 2009]
Box GEP, Hunter HG, Hunter JS. 1979. Statistical for Experimenters : An Introduction to Design, Data Analysis, and Model Building. Canada: John Wiley and Sons, Inc.
Brandt D C, Leitner G F, Leitner W E. 1993. Reverse osmosis membran state of the art. Didalam: Amjad Z, editor. Reverse osmosis membrane technology, water chemistry, and industrial applications. New York: Chapman and Hall.
Chen W P, J Y Chen, S C Chang, C L Su. 1985. Bacterial alginate produced by a mutant of Azotobacter vinelandii. Appl Environ J Microbiol. 49: 543-546.
Cheze-Lange H, Beunard D, Dhuster P, Guillochon D, Caze AM, Moercellet M, Saude N, Junter GA. 2002. Production of microbial alginate in a membrane bioreactor. Enzyme and Microbial Technology. New York: 30:656-661.
Clementi F, Fantozzi P, Mancini F, Moresi M. 1995. Optimal condition for alginate production by Azotobacter vinelandii. Enzyme and Microbial Technology. New York. 17:983-988.
D’Souza N M, Wiley D E. 2000. Whey Ultrafiltration : Effect of operating parameters on flux and rejection. Proceeding of the 5 th International Membrane Science and Technology Conference. Australia. Sydney.
Desniar. 2003. Pemanfaatan tetes tebu (molase) dan urea secagai sumber karbon
dan nitrogen dalam produksi alginat oleh bakteri Pseudomonas aeruginosa. [tesis]. Bogor: Program Pascasarjana, Institut
Pertanian Bogor.
Erliza N, Greiche D K. 2001. Pemekatan sirup glukosa dengan proses mikrofiltrasi crossflow. [laporan penelitian]. Bogor: Jurusan Teknologi Industri Pertanian. Fakultas Teknologi Pertanian. Institut Pertanian Bogor.
Evans L R, Linker A. 1973. Production and characterization of the slime polysaccharide of Pseudomonas aeruginosa. J Bacteriol. 166: 915-924.
Fardiaz S. 1989. Mikrobiologi Pangan. Bogor: PAU Pangan dan Gizi, Institut Pertanian Bogor.
Fellows P J. 1992. Food Processing Technology, Principle and Practice. New York: Ellis Horwood.
Guirguis N, Versteeg K, Hickey M W. 1987. The manufacture of yoghurt using reverse osmosis concentrated skim milk. Australian J Dairy Technology 42(1-2):7-10.
Hadietomo R S. 1990. Mikrobiologi Dasar Dalam Praktek. Teknik dan Prosedur Dasar Laboratorium. Jakarta: PT Gramedia.
Hassett D J. 1996. Anaerobic production of alginate by Pseudomonas aeruginosa: alginate restricts diffusion of oxygen. J of Bacteriology. 178:7322-7325.
Hendri J. 1995. Mempelajari pengaruh konsentrasi ekstrak khamir terhadap produksi alginat yang dihasilkan oleh bakteri Pseudomonas aeruginosa. [skripsi]. Bogor: Program Studi Pengolahan Hasil Perikanan, Fakultas Perikanan, Institut Pertanian Bogor.
Jazzroc. 2008. Jazzroc versus “Chemtrails”. http://www.jazzroc.wordpress.com. [20 Januari 2009].
King A H. 1983. Brown Seaweed Extract (Alginat). Didalam: Glicksman M, editor. Food Hidrocolloids. Volume II. Florida: CRC Press Inc.
Memos 2009. Membran filtration-crossflow system. http://www.memos-filtration.de [25 Oktober 2009]
Mulder M. 1996. Basic Principles of Membrane Technology. Nederland: Kluwer Academic Publishers.
Natalia L. 2008. Pseudomonas aeruginosa, penyebab infeksi nosokomial. http://www.mikroba.files.wordpress.com [3 Maret 2009].
Nurjanah. 1993. Telaah alginat kasar hasil produksi Azotobacter vinelandii. [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Osada Y, T Nagawa. 1992. Membrane Science and Technology. Ibaraki: Marcell Dekker Inc.
Parente E, Crudele M A, Aquino M Clementi F. 1998. Alginate production by Azotobacter vinelandii DSM576 in batch fermentation. J of Industrial Microbiology & Biotechnology. 20:171-176.
Pranowo D. 2006. Kajian kinerja membran ultrafiltrasi untuk penjernihan cuka apel. [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Purbosari N. 2009. Optimasi proses reverse osmosis pada recovery dan pemekatan komponen flavor limbah cair pasteurisasi rajungan. [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Rautenbach R, R Alberecht. 1989. Membran Process. New York: John Wiley and Sons. 459 hal.
Renner E, El Salam MHA. 1991. Application of Ultrafiltration I the Dairy Industry. London: Elsevier Applied Science.
Sabra W, Zeng A P, Deckwer W D. 2001. Bacterial alginate: physiology, product quality and process aspects. J of Industrial Microbiology & Biotechnology. 56:315-325.
Sabra W. 1998. Microaerophilic production of alginate by Azotobacter vinelandii. [disertasi]. Agypten: Aus Alexandria.
Sirio. 2009. Memahami reverse osmosis. http://www.RoplantWater.org [19 Juni 2009]
Uju. 2005. Kajian pemurnian dan pengkonsentrasian karaginan dengan membran mikrofiltrasi. [tesis]. Bogor: Sekolah Pascasarjana. Institut Pertanian Bogor.
Wenten I G. 1999. Teknologi Membran Industrial. Bandung: Institut Teknologi Bandung.
Winarno F G. 1990. Teknologi Pengolahan Rumput Laut. Jakarta: Pustaka Sinar Harapan.
Winduwati S, Yohan, Rifaid M N. 2000. Krakteristik osmosis balik membran spiral wound. Pusat Pengembangan Pengelolaan Limbah Radioaktif.
Lampiran 1. Membran Reverse osmosis (CSM Model No: RE75-1812-50GPD)
Lampiran 2. Data pengaruh waktu inkubasi dengan biomassa kering
Pseudomonas aeruginosa.
Waktu inkubasi (jam)
Biomassa (g/l)
Lampiran 3. Data pengaruh waktu inkubasi dengan konsentrasi alginat yang dihasilkan
Waktu inkubasi (jam)
Konsentrasi alginat (g/l)
0 3.02 3 4.04 6 3.94 9 3.07 12 2.88 18 3.59 24 3.39 30 2.69 36 2.47 42 2.34 48 2.30
Lampiran 4. Data pengaruh waktu inkubasi dengan viskositas Waktu inkubasi
(jam)