SEBAGAI PAKAN TAMBAHAN AYAM PEDAGING:
PENAMPILAN PRODUKSI DAN
STATUS KESEHATAN AYAM
IIS YUANITA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Pemanfaatan Ampas Buah Merah (Pandanus conoideus) sebagai Pakan Tambahan Ayam Pedaging: Penampilan Produksi dan Status Kesehatan Ayam adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2009
ABSTRACT
IIS YUANITA. The Use of Red Fruit (Pandanus conoideus) Waste as Feed Additive in Broiler Diets: Performances and Health Status of Chicken. Under direction of IMAN RAHAYU HIDAYATI SOESANTO, and SRI MURTINI
Red fruit (Pandanus conoideus) is special fruit from Papua island, which is rich in oil and carotenoids as well as vitamin E. Carotenoids and vitamin E of red fruit are used as antioxidation to prevent free radical agents and immune system. Red fruit waste is by-product of red fruit extraction process. The experiment was conducted to investigate the effect of red fruit waste in broiler diets with different level on performances and health status of chicken. The experiment used 200 Ross strain day old chicks which were randomly devided into 5 treatments and 4 replications, with 10 chicks in each replicate. The treatments were T0 (basal diet as a control), T1 (basal diet + 0.5% red fruit waste),
T2 (basal diet + 1.0% red fruit waste), T3 (basal diet + 1.5% red fruit waste) and T4
(basal diet + 2.0% red fruit waste). Data were collected during 35 days to obtain performance data, villi surface area of small intestine, blood profile (erythrocyte, hemoglobin, hematocrit, total amount of leukocyte and differentiation of leukocyte) and antibody titre against ND. The data were analyzed by a Completely Randomized Design and continued with Duncan’s Multiple Range Test for differences. The results showed that there were no significantly effect on the performances and health status of chickens, but there was significantly effect (P<0.05) on the villi surface area of small intestine. Finally, diet containing 1.5% red fruit waste (T3) increased body and carcass weight, carcass percentage,
performance index but decreased the mortality of chicken, while no effect on blood profile and antibody titre against ND of chicken. Diets containing red fruit waste increased the villi surface area of small intestine and gave more efficient nutrient digestion and absorption for carcass formation.
RINGKASAN
IIS YUANITA. Pemanfaatan Ampas Buah Merah (Pandanus conoideus) sebagai Pakan Tambahan Ayam Pedaging: Penampilan Produksi dan Status Kesehatan Ayam. Dibimbing oleh IMAN RAHAYU HIDAYATI SOESANTO dan SRI MURTINI
Pemberian pakan tambahan pada ayam harus memberikan efisiensi penggunaan pakan yang lebih baik dan peningkatan kesehatan serta tidak menimbulkan residu pada karkas ayam. Penggunaan tanaman obat ternyata tidak meninggalkan residu dan memiliki toksisitas yang rendah dibandingkan bahan-bahan kimia organik yang lain. Buah merah merupakan buah khas yang berasal dari Papua yang kaya akan minyak, karotenoid dan vitamin E. Zat aktif karotenoid dan vitamin E yang terkandung dalam buah merah berfungsi sebagai antioksidan yang mampu menangkal radikal bebas dan meningkatkan kekebalan tubuh. Ampas buah merah (ABM) merupakan produk samping dari proses ekstraksi buah merah. Penelitian dilakukan untuk mengetahui pengaruh dari pemberian ampas buah merah terhadap performa dan status kesehatan ayam broiler.
DOC (day old chick) strain Ross sebanyak 200 ekor dibagi dalam 5 perlakuan dan 4 ulangan yang setiap ulangan perlakuan terdiri atas 10 ekor. Ransum perlakuan terdiri dari T0 (ransum basal sebagai kontrol), T1 (ransum basal
+ ABM 0.5%), T2 (ransum basal + ABM 1.0%), T3 (ransum basal + ABM 1.5%)
dan T4 (ransum basal + ABM 2.0%). Peubah yang diamati adalah data performa
(konsumsi ransum, pertambahan bobot badan, konversi ransum, bobot badan akhir, persentase karkas, tingkat kematian dan indeks performa), luas permukaan villi usus halus, jumlah sel darah merah, hemoglobin, hematokrit, jumlah sel darah putih dan diferensiasinya serta titer antibodi terhadap ND. Data yang diperoleh dianalisis statistik dengan menggunakan Rancangan Acak Lengkap (RAL) dan diuji lanjut menggunakan Duncan’s Multiple Range Test (DMRT) bila terdapat perbedaan diantara perlakuan.
Hasil penelitian menunjukkan bahwa tidak ada perbedaan terhadap performa ayam dan status kesehatannya, kecuali pada luas permukaan villi usus halus nyata lebih luas (P<0.05) pada perlakuan ABM dibandingkan kontrol. Kesimpulan penelitian ini bahwa perlakuan ransum basal ditambah ABM 1.5% (T3) meningkatkan bobot badan, persentase karkas, indeks performa dan
menurunkan persentase kematian ayam, tetapi tidak mempengaruhi profil darah dan titer antibodi terhadap ND ayam. Penambahan ABM memperluas permukaan villi usus halus, sehingga meningkatkan pencernaan dan penyerapan bahan makanan untuk pembentukan karkas.
@ Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber:
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
PEMANFAATAN AMPAS BUAH MERAH (
PANDANUS CONOIDEUS
)
SEBAGAI PAKAN TAMBAHAN AYAM PEDAGING:
PENAMPILAN PRODUKSI DAN
STATUS KESEHATAN AYAM
IIS YUANITA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Mayor Ilmu Produksi dan Teknologi Peternakan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pemanfaatan Ampas Buah Merah (Pandanus Conoideus) sebagai Pakan Tambahan Ayam Pedaging: Penampilan Produksi dan Status Kesehatan Ayam
Nama : Iis Yuanita
NIM : D151070021
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Iman Rahayu HS, M.S. Dr. drh. Sri Murtini, M.Si.
Ketua Anggota
Diketahui
Ketua Program Studi
Ilmu Produksi dan Teknologi Peternakan
Dr. Ir. Rarah Ratih A. Maheswari, DEA.
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Penelitian yang telah dilaksanakan sejak bulan Januari 2009 ini diberi judul Pemanfaatan Ampas Buah Merah (Pandanus Conoideus) sebagai Pakan Tambahan Ayam Pedaging: Penampilan Produksi dan Status Kesehatan Ayam, yang berdasarkan pada tema pemanfaatan hasil samping dari ekstraksi bahan herbal sebagai pakan tambahan pakan ayam pedaging. Mengingat saat ini konsep organik kembali dikembangkan untuk dapat mengganti bahan-bahan anorganik seperti antibiotik dalam pakan ternak sehingga mampu meningkatkan produktivitas ternak dan menghasilkan karkas yang aman bagi konsumen.
Terima kasih kepada Prof. Dr. Ir. Iman Rahayu Hidayati Soesanto, MS dan Dr. drh. Sri Murtini, M.Si selaku komisi pembimbing yang telah banyak memberikan arahan serta meluangkan waktu kepada penulis dalam pelaksanaan penelitian hingga penyusunan tesis ini. Terima kasih kepada Prof. Dr. Ir. Wiranda G. Piliang, M.Sc yang telah bersedia menjadi penguji pada ujian tesis. Terima kasih juga penulis sampaikan kepada Drs. I Made Budi, MS yang telah dengan rela hati menyediakan bahan baku ampas buah merah sehingga penelitian ini dapat terlaksana. Kepada Bapak dan Ibu staf maupun teknisi kandang dan laboratorium yang tidak dapat penulis sebutkan satu persatu yang telah membantu penulis dalam pelaksanaan penelitian dan analisa semua bahan penelitian, penulis mengucapkan terimakasih. Terima kasih kepada Rektor, Dekan Fakultas Pertanian, Ketua Jurusan dan Ketua Program Studi serta rekan-rekan staf Pengajar Faperta, Jurusan BDP, Prodi Peternakan Universitas Palangka Raya. Terimakasih kepada Direktorat Pendidikan Tinggi (DIKTI) atas program BPPS yang membantu penulis selama pendidikan.
Karya sederhana ini penulis persembahkan kepada Ayah (alm), Ibu, mba Neng, bung Beni sekeluarga, bung Adi sekeluarga, dan adikku Yesa tercinta serta bung Teddy, yang telah menemani penulis selama ini. Tidak lupa penulis haturkan terima kasih sebesar-besarnya atas segala doa, dukungan dan pengorbanan seluruh keluarga. Kepada teman dan sahabat mahasiswa SPs IPB mayor IPTP 2007, teh Wieda, teh Dian, pak Said, pak Hatta, Ogie, Rohmat, pak Rajab dan Agus, serta untuk seluruh teman dan sahabat yang tidak dapat dituliskan satu persatu (terutama kepada bu Uyu, mba Hastin, mba Mul, mba Pien, Nina dan Lala), semoga Tuhan selalu beserta kita.
Semoga karya ilmiah ini bermanfaat bagi pembaca.
Bogor, Agustus 2009
RIWAYAT HIDUP
Penulis dilahirkan di Palangka Raya pada tanggal 14 Januari 1981 dari pasangan Ayah Ishak Obidaka (alm) dan Ibu Margaritha. Penulis merupakan putri keempat dari empat bersaudara.
Tahun 1998 penulis lulus dari SMU Negeri 1 Palangka Raya dan pada tahun yang sama masuk Universitas Gadjah Mada melalui seleksi Penyaringan Bibit Unggul Daerah (PBUD) lulus pada tahun 2003. Penulis memilih Fakultas Peternakan Jurusan Produksi Ternak. Kesempatan untuk melanjutkan ke program Magister Sains pada Mayor Ilmu Produksi dan Teknologi Peternakan Institut Pertanian Bogor penulis dapatkan pada tahun 2007 dengan Beasiswa Pendidikan Pascasarjana (BPPs) yang diperoleh dari Direktorat Pendidikan Tinggi (DIKTI).
DAFTAR ISI
Halaman
HALAMAN PERNYATAAN ... i
ABSTRACT ... ii
RINGKASAN ... iii
HALAMAN HAK CIPTA ... iv
HALAMAN JUDUL ... v
HALAMAN PENGESAHAN ... vi
PRAKATA ... vii
RIWAYAT HIDUP ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Manfaat ... 2
Hipotesis ... 2
TINJAUAN PUSTAKA ... 3
Buah Merah (Pandanus conoideus) ... 3
Senyawa Antioksidan dan Mekanismenya ... 6
Feed Additive, Karotenoid, Tokoferol dan Penampilan Ternak ... 8
Respon Kekebalan dan Profil Darah Ayam ... 11
BAHAN DAN METODE ... 16
Waktu dan Tempat Penelitian ... 16
Materi Penelitian ... 16
Metode Penelitian ... 18
HASIL DAN PEMBAHASAN ... 25
Pemanfaatan Ampas Buah Merah dalam Pakan terhadap Performa Ayam Pedaging ... 25
Pemanfaatan Ampas Buah Merah dalam Pakan terhadap Status Kesehatan Ayam Pedaging ... 30
Jumlah Butir Darah Merah ... 30
Hemoglobin ... 32
Hematokrit ... 32
Jumlah Butir Darah Putih ... 33
Heterofil, Limfosit dan Rasio H/L ... 34
DAFTAR TABEL
1 Kandungan senyawa aktif dalam ekstrak minyak buah merah ... 4
2 Komposisi kimia ampas buah merah ... 5
3 Kandungan senyawa aktif dalam ampas buah merah ... 6
4 Perbandingan jumlah leukosit berdasarkan jenis kelamin ... 13
5 Perbandingan jumlah leukosit berdasarkan umur ayam ... 13
6 Analisa kandungan nutrisi ampas buah merah ... 17
7 Analisa kandungan nutrisi ransum percobaan ... 18
8 Tahap pengumpulan data selama penelitian ... 20
9 Hasil pengamatan performa dan luas permukaan usus halus ayam pedaging pedaging selama penelitian ... 25
10 Kandungan senyawa aktif dalam karkas ... 28
11 Persentase kematian ayam selama penelitian ... 29
DAFTAR LAMPIRAN
1 Gambar ampas buah merah dan ransum percobaan ... 43
2 Perbandingan lemak pada gizzard ayam perlakuan kontrol dan perlakuan ABM 1.5% ... 43
3 Gambaran histopat villi usus halus ayam yang diberi perlakuan ABM 1.5%, dan ayam perlakuan tanpa ABM ... 43
4 Komposisi zat gizi buah merah dan ampas buah merah ... 44
5 Analisis ragam konsumsi ransum kumulatif ... 44
6 Analisis ragam pertambahan bobot badan ... 44
7 Analisis ragam konversi ransum ... 45
8 Analisis ragam bobot badan akhir ... 45
9 Analisis ragam persentase karkas ... 45
10 Analisis ragam persentase kematian ... 46
11 Analisis ragam indeks performa... 46
12 Analisis ragam luas permukaan villi usus ... 46
13 Analisis ragam jumlah butir darah merah hari ke- 7, 14, 21, 28 setelah perlakuan ... 47
14 Analisis ragam kadar hemoglobin hari ke- 7, 14, 21, 28 setelah perlakuan ... 48
15 Analisis ragam kadar hematokrit hari ke- 7, 14, 21, 28 setelah perlakuan ... 49
16 Analisis ragam jumlah butir darah putih hari ke- 7, 14, 21, 28 setelah perlakuan ... 50
17 Analisis ragam jumlah heterofil hari ke- 7, 14, 21, 28 setelah perlakuan ... 51
18 Analisis ragam jumlah limfosit hari ke- 7, 14, 21, 28 setelah perlakuan ... 52
19 Analisis ragam rasio H/L hari ke- 7, 14, 21, 28 setelah perlakuan ... 53
PENDAHULUAN
Latar Belakang
Pakan tambahan (feed additive) dalam pakan ternak mempunyai tujuan sebagai pemacu pertumbuhan, memperbaiki efisiensi penggunaan pakan dan pencegahan terhadap infeksi patogen. Penggunaan pakan tambahan berupa antibiotika mulai memberikan masalah serius, dengan ditemukannya residu pada karkas ternak. Residu antibiotika pada daging yang dikonsumsi akan meningkatkan resisten bakteri terhadap antibiotika.
Berbagai alternatif mulai dikembangkan untuk mencari bahan pakan tambahan yang lebih aman, antara lain dengan penggunaan enzim, probiotik, prebiotik, asam-asam organik, rempah-rempah dan ekstrak tanaman obat (Wenk 2000). Pada ternak unggas, penambahan bahan pakan tambahan yang diberikan merupakan salah satu usaha untuk meningkatkan performa serta ketahanan kesehatan. Salah satu bahan pakan tambahan yang bisa diberikan pada ayam pedaging yaitu ampas buah merah (Pandanus conoideus), yang diperoleh dari proses ekstraksi buah merah dalam pembuatan sari atau minyak buah merah.
aktivitas limfosit yang disebut sel-sel T. Sel-sel ini bila berinteraksi dengan antigen spesifik akan berdiferensiasi menjadi sel-sel yang berinteraksi langsung dengan sel atau jaringan asing kemudian merusaknya. Sel-sel T bersifat sitotoksik atau sel killer (Noble dan Noble 1989).
Penelitian terhadap buah merah membuktikan bahwa buah merah mengandung zat-zat alami yang dapat meningkatkan kekebalan tubuh, dan banyak digunakan untuk menunjang faktor kesehatan manusia. Zat aktif yang terkandung dalam buah merah diantaranya tokoferol (vitamin E), alfatokoferol dan betakaroten berfungsi sebagai antioksidan yang mampu menangkal radikal bebas dan meningkatkan kekebalan tubuh (Budi dan Paimin 2005). Hasil samping dari ekstraksi buah merah yaitu ampas buah merah masih memiliki nilai nutrisi dan zat antioksidan yang dapat dimanfaatkan sebagai pakan tambahan ternak dan diharapkan mampu meningkatkan performa dan status kesehatan pada ayam pedaging. Sampai saat ini belum ada laporan percobaan ampas buah merah yang diberikan pada ayam pedaging, sehingga penelitian ini diharapkan dapat memberikan informasi dalam upaya meningkatkan performa serta kesehatan ayam pedaging.
Tujuan
Mengetahui efektivitas pemberian ampas buah merah (ABM) sebagai pakan tambahan terhadap performa dan status kesehatan ayam pedaging.
Manfaat
Memperoleh informasi tentang penggunaan ABM (sebagai limbah) dalam fungsinya untuk meningkatkan performa dan status kesehatan ayam pedaging.
Hipotesis
TINJAUAN PUSTAKA
Buah Merah (Pandanus conoideus)
Buah merah adalah jenis buah khas yang berasal dari Papua, yang disebut kuansu atau sauk eken oleh masyarakat Wamena. Tanaman buah merah adalah tanaman yang masih satu famili dengan tanaman pandan. Buah merah di habitat aslinya tumbuh dari dataran rendah dekat pantai sampai dataran tinggi, seperti di lereng pegunungan Jayawijaya yang memiliki ketinggian 2 500 m dari permukaan laut. Tanaman berkayu ini tumbuh bercabang, daunnya berbentuk pita yang pinggirnya berduri-duri kecil. Tinggi tanaman bisa mencapai 15 meter. Akarnya berbentuk akar udara yang menggantung dengan ketinggian satu meter dari pangkal batang. Tanaman ini berbuah saat berumur tiga tahun sejak ditanam (Wiryanta 2008) dan buahnya tersembunyi di antara daun.
Klasifikasi ilmiah buah merah seperti tertera di bawah ini (http://id.wikipedia.org/wiki/Buah_Merah_Papua 2008):
dunia : Plantae
filum : Mognoliophyta kelas : Liliopsida ordo : Pandanales famili : Pandanaceae genus : Pandanus
species : Pandanus conoideus
Buah merah umumnya berbentuk panjang lonjong atau agak persegi, dengan ukuran panjang buah 30-120 cm dan diameter buah 10-25 cm. Buah ini umumnya berwarna merah, merah kecokelatan dan ada pula yang berwarna kuning. Kulit buah bagian luar menyerupai buah nangka. Di Papua, beberapa daerah yang menjadi sentra buah merah adalah daerah-daerah yang berada di sepanjang lereng pegunungan Jayawijaya, diantaranya Kelila, Bokondini, Karubaga, Kobakma, Kenyam dan Pasema (Wiryanta 2008). Berdasarkan data
dari pemerintah provinsi Papua luas areal perkebunan buah merah pada tahun 2006 adalah 4 518 ha dengan jumlah produksi buah merah sebesar 1 889
Buah merah yang sebelumnya hanya dimanfaatkan sebagai pakan ternak, khususnya ternak babi, menjadi fenomena dalam pengobatan alternatif setelah munculnya hasil penelitian seorang ahli gizi dan dosen Universitas Cendrawasih pada tahun 1998. Hasil penelitian Surono et al. (2008) menunjukkan bahwa ekstrak minyak buah merah memiliki kandungan komposisi antioksidan dengan kandungan senyawa aktif seperti pada Tabel 1.
Tabel 1 Kandungan senyawa aktif dalam ekstrak minyak buah merah
Senyawa Aktif Jumlah
α-karoten (μg/100 g) β-karoten (μg/100 g) β-cryptoxanthin (μg/100 g) α-tokoferol (μg/100 g)
130 1 980 1 460 21.2
Sumber : Surono et al. (2008)
Sekitar 94% yang terkandung dalam ekstrak adalah minyak, sisanya sekitar 5% adalah karbohidrat dan tidak ditemukan adanya protein dan sebagai karotenoid, ditemukan alpha dan betakaroten, dan beta-cryptoxanthin (Surono et al. 2008). Tokoferol, alfatokoferol, dan betakaroten yang terkandung dalam buah merah berfungsi sebagai antioksidan yang mampu menangkal radikal bebas. Ketiga senyawa inilah yang membantu proses penyembuhan penyakit kanker, tumor dan HIV/AIDS. Senyawa antioksidan ini bekerja menekan dan membunuh sel-sel kanker yang berbahaya. Budi dan Paimin (2005) menyatakan bahwa dengan mengkonsumsi betakaroten 30-60 mg/hari selama 2 bulan akan membuat tubuh memiliki sel-sel pembunuh alami lebih banyak serta sel-sel T-helpers dan limfosit yang lebih aktif.
Tokoferol yang ada di dalam buah merah tersebut adalah vitamin E alami yang bisa mengencerkan darah. Hal ini baik untuk penderita stroke. Sementara itu, betakaroten di dalam tubuh akan diubah menjadi vitamin A yang tidak bisa diproduksi oleh tubuh manusia. Tokoferol juga dapat menurunkan kolesterol LDL (low density lypoprotein) dan meningkatkan HDL (high density lypoprotein) (Budi dan Paimin 2005).
ada dalam buah merah sangat tinggi dan bisa membantu mencegah dan mengobati osteoporosis. Surono et al. (2008) menyatakan bahwa buah merah kaya akan karotenoid, terutama β-cryptoxanthin, yaitu suatu agen pencegah kanker yang melawan kanker paru-paru bagi perokok berat serta memperbaiki kejadian osteoporosis setelah menopause.
Ampas buah merah adalah produk samping dari proses ekstraksi buah merah dalam pembuatan sari/jus/minyak buah merah. Menurut Budi dan Paimin (2005), proses ekstraksi buah merah adalah buah merah matang dipisahkan dari empulurnya (bagian kayu di tengah buah) kemudian dipotong-potong dan dicuci sampai bersih. Daging buah dikukus di atas api sedang selama 1-2 jam, setelah itu dipisahkan dari biji buah dengan cara dikucek dan diperas. Air ditambahkan hingga ketinggian 5 cm di atas permukaan bahan dan diperoleh sari buah merah yang menyerupai santan, kemudian dimasak kembali dengan api sedang selama 5-6 jam sambil diaduk sampai muncul minyak berwarna kehitaman di permukaan bahan. Setelah didiamkan selama satu hari, akan terbentuk tiga lapisan, yaitu air di lapisan bawah, ampas di lapisan tengah dan minyak di lapisan atas. Hasil samping dari proses ekstraksi buah merah yaitu pada lapisan tengah inilah yang dinamakan ampas buah merah (Budi dan Paimin 2005).
Komposisi kimia yang terkandung dalam ampas buah merah seperti terlihat pada Tabel 2, sedangkan kandungan senyawa aktifnya dapat dilihat pada Tabel 3.
Tabel 2 Komposisi kimia ampas buah merah
Komponen Jumlah Bahan Kering (%)
Abu (%)
Protein Kasar (%) Serat Kasar (%) Lemak Kasar (%)
Bahan Ekstrak Tanpa Nitrogen (%) Kalsium (%)
Fosfor (%)
Energi Bruto (kkal/kg)
23.12 0.91 3.11 0.21 7.60 11.30
0.14 0.89 6 316
Tabel 3 Kandungan senyawa aktif dalam ampas buah merah
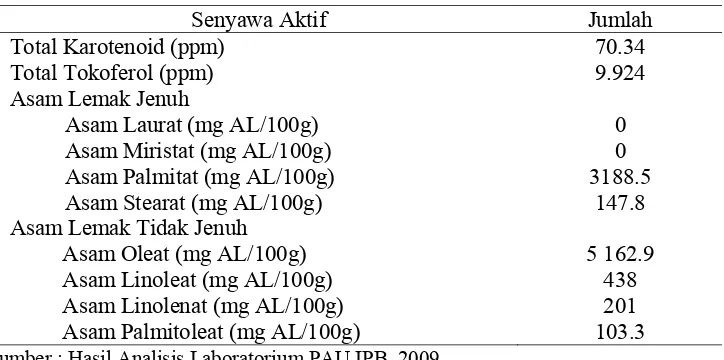
Senyawa Aktif Jumlah
Total Karotenoid (ppm) Total Tokoferol (ppm) Asam Lemak Jenuh
Asam Laurat (mg AL/100g) Asam Miristat (mg AL/100g) Asam Palmitat (mg AL/100g) Asam Stearat (mg AL/100g) Asam Lemak Tidak Jenuh
Asam Oleat (mg AL/100g) Asam Linoleat (mg AL/100g) Asam Linolenat (mg AL/100g) Asam Palmitoleat (mg AL/100g)
70.34
Sumber : Hasil Analisis Laboratorium PAU IPB, 2009
Ampas buah merah sebagai pakan imbuhan pada ayam petelur dapat diberikan sampai 4% menunjukkan performa yang baik dengan produksi telur 85%, mortalitas 0%, meningkatkan titer antibodi serta menunjukkan pertumbuhan sel-sel limfoid aktif organ hati, ginjal, limpa dan ovari (Iman Rahayu, unpublish).
Senyawa Antioksidan dan Mekanismenya
Menurut Cuppert (1997) dalam Widjaya (2003), antioksidan dinyatakan sebagai senyawa yang dapat menunda, memperlambat dan mencegah proses oksidasi lipid. Menurut Pratt dan Hudson (1990), kebanyakan senyawa antioksidan yang diisolasi dari sumber alami adalah berasal dari tumbuhan. Antioksidan alami tersebar di beberapa bagian tanaman, seperti pada kayu, kulit kayu, akar, daun, buah, bunga, biji dan serbuk sari (Pratt 1992). Salah satu tanaman yang mengandung antioksidan alami yaitu buah merah (Pandanus conoideus) yang dalam bentuk ekstrak minyak buah merah memiliki kandungan komposisi antioksidan berupa senyawa karotenoid dan tokoferol yang tinggi (Surono et al. 2008).
Ketengikan dapat mengakibatkan kualitas suatu pakan berkurang, yaitu menurunnya nilai gizi atau nutrisi dan palatabilitas. Ketengikan juga dapat menyebabkan dampak negatif pada ternak yang umumnya disebabkan oleh kandungan lemak dari ransum yang dikonsumsi oleh ternak. Hal ini terjadi bila komponen cita rasa dan bau yang mudah menguap terbentuk sebagai akibat kerusakan oksidatif dari lemak dan minyak tak jenuh. Komponen-komponen itu menyebabkan bau dan cita rasa yang tidak diinginkan dalam lemak dan minyak, serta produk-produknya.
Betakaroten adalah pencegah penyakit degeneratif seperti stroke, jantung koroner dan kanker, juga berfungsi untuk memperlambat berlangsungnya penumpukan flek pada arteri sehingga aliran darah, baik ke jantung maupun ke otak, bisa berlangsung lancar tanpa sumbatan. Betakaroten juga berfungsi untuk meningkatkan kekebalan tubuh karena adanya interaksi vitamin A dengan protein (asam-asam amino) yang berfungsi dalam pembentukan antibodi (Budi dan Paimin 2005).
Sesuai mekanisme kerjanya, antioksidan memiliki dua fungsi. Fungsi pertama merupakan antioksidan primer yaitu sebagai pemberi atom hidrogen (AH). Senyawa ini dapat memberikan atom hidrogen secara cepat ke radikal lipida (R*, ROO*) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A*) tersebut memiliki keadaan lebih stabil dibanding radikal lipida. Fungsi kedua merupakan antioksidan sekunder, yaitu memperlambat laju autooksidasi dengan berbagai mekanisme diluar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Gordon 1990 dalam Trilaksani 2003).
Mekanisme oksidasi lipida tidak jenuh diawali dengan tahap inisiasi, yaitu berbentuknya radikal bebas (R*) bila lipida kontak dengan panas, cahaya, ion metal dan oksigen. Reaksi ini terjadi pada group metilen yang berdekatan dengan ikatan rangkap –C=C-.
Tahap selanjutnya adalah tahap propagasi dimana autooksidasi berawal ketika radikal lipida (R*) hasil tahap inisiasi bertemu dengan oksigen membentuk radikal peroksida (ROO*). Reaksi oksigenasi ini terjadi sangat cepat dengan energi aktivitas hampir nol sehingga konsentrasi ROO* yang terbentuk jauh lebih besar dari konsentrasi R* dalam sistem makanan dimana oksigen berada (Gordon 1990 dalam Trilaksani 2003). Radikal peroksida yang terbentuk akan mengekstrak ion hidrogen dari lipida lain membentuk hidroperoksida (ROOH) dan molekul radikal lipida baru. Selanjutnya reaksi autooksidasi ini akan berulang sehingga merupakan reaksi berantai.
Tahap terakhir oksidasi lipida adalah tahap terminasi, dimana hidroperoksida yang sangat tidak stabil terpecah menjadi senyawa organik berantai pendek seperti aldehid, keton, alkohol dan asam.
Feed Additive, Karotenoid, Tokoferol dan Penampilan Ternak
Negara Eropa telah menerapkan larangan penggunaan antibiotik untuk memacu laju pertumbuhan ternak dan sebagai tindakan pencegahan terhadap kemungkinan infeksi mikroorganisme patogen (Cook 2000). Berbagai alternatif telah dikembangkan untuk mencapai tujuan ini, antara lain melalui pemakaian enzim, probiotik, asam-asam organik, serat kasar, rempah-rempah dan tanaman obat (Wenk 2000). Manfaat tanaman obat sebagai bahan pakan tambahan timbul dari aktifitas biologis, karena adanya zat-zat aktif seperti mikronutrien, zat-zat yang bekerja menyerupai kerja hormon, zat-zat yang bekerja sebagai antioksidan dan perangsang kekebalan. Pembuktian dengan teknik-teknik modern menunjukkan bahwa penggunaan tanaman obat ternyata tidak meninggalkan residu dan mempunyai toksisitas yang rendah bila dibandingkan dengan antibiotika dan bahan-bahan kimia anorganik yang lain (Wenk 2000).
Karotenoid dan tokoferol (vitamin E), seperti yang terkandung dalam buah merah berfungsi sebagai antioksidan yang mampu menangkal radikal bebas (Budi dan Paimin 2005). Penambahan alfa tokoferol sebesar 160-200 mg/kg dalam pakan meningkatkan perlindungan lemak terhadap oksidasi lemak dan kandungan alfa tokoferol dalam karkas (Surai dan Sparks 2000). Tokoferol (vitamin E) dapat menguatkan dinding kapiler darah dan mencegah terjadinya hemolisis sel darah merah (Wahju 2004) serta berperan dalam pembentukan sel darah merah (Winarno 2008).
Beberapa penelitian menyatakan bahwa senyawa antioksidan betakaroten mampu meningkatkan proliferasi limfosit bursal dan limpa (Haq et al. 1996) dan vitamin E mampu meningkatkan kekebalan humoral (Boa-Amponsem et al. 2001) serta meningkatkan status antioksidan ayam (Surai et al. 1999).
Salah satu cara yang digunakan untuk mengetahui tingkat keberhasilan dalam usaha ternak adalah dengan menghitung indeks performa. Performance index (PI) atau yang sering disebut juga indeks produksi adalah angka yang menunjukkan suatu prestasi yang dicapai pada akhir pemeliharaan. Nilai tersebut dihitung dari komponen besarnya rataan bobot badan siap potong, konversi ransum, umur panen dan jumlah persentase ayam hidup selama satu periode pemeliharaan (North dan Bell 1990). Nilai IP yang tinggi menunjukkan bahwa produksi yang dihasilkan pada satu periode pemeliharaan ayam pedaging tercapai taraf maksimum. Indeks produksi dinyatakan istimewa apabila nilainya mencapai >200 (Arifien 1997). IP yang tinggi dapat dicapai apabila ayam mampu menggunakan ransum untuk menghasilkan bobot potong yang optimal dalam waktu relatif singkat dengan tingkat kematian yang rendah.
Respon Kekebalan dan Profil Darah Ayam
Sistem imun adalah semua mekanisme dalam mempertahankan keutuhan tubuh sebagai perlindungan terhadap bahaya yang ditimbulkan dari berbagai bahan dalam lingkungan hidup (Baratawidjaja 2006). Sistem pertahanan meliputi sistem imun non spesifik dan spesifik. Kekebalan non spesifik secara alami ada di dalam tubuh, tetapi tidak selalu dapat memberikan perlindungan terhadap penyakit. Semua bibit penyakit yang masuk tubuh akan dihancurkan olehnya, sehingga proteksi yang diberikan tidak spesifik terhadap penyakit tertentu. Kekebalan non spesifik ini diberikan antara lain melalui enzim-enzim tubuh, sel darah putih, serta pH lambung yang rendah. Kekebalan spesifik terbagi menjadi dua, yaitu kekebalan humoral (humoral mediated immunity), serta kekebalan selular (cell mediated immunity). Kekebalan humoral dilakukan oleh limfosit yang disebut sel-sel B. Sel-sel B yang teraktivasi karena masuknya bahan asing akan berubah menjadi sel-sel plasma yang mensekresikan antibodi untuk proses eliminasi. Kekebalan seluler dihasilkan oleh aktivitas limfosit yang disebut sel-sel T. Sel-sel ini bila berinteraksi dengan antigen spesifik akan berdiferensiasi menjadi sel-sel yang berinteraksi langsung dengan sel atau jaringan asing kemudian merusaknya (Noble dan Noble 1989).
Tanggap kebal humoral unggas dicirikan antibodi yang dihasilkan oleh limfosit B dibawah kontrol bursa fabrisius (Sharma 1991). Respon yang paling mudah diukur terhadap imunitas tubuh ayam adalah profil darahnya.
internal seperti pertambahan umur, status gizi, kesehatan, stres, dan suhu tubuh. Secara eksternal misalnya akibat infeksi kuman serta perubahan suhu lingkungan. Unggas mengalami berbagai tekanan dalam hidupnya. Tekanan ini dapat menyebabkan perubahan hormon, penurunan konsumsi pakan, menurunkan metabolisme nutrisi dan menekan fungsi imun. Hal-hal inilah yang menyebabkan para peneliti meneliti berbagai cara untuk menekan dampak yang merugikan ini. Keadaan-keadaan tersebut dapat mempengaruhi proses pembentukan darah, adapun mekanisme pembentukan darah secara normal berlangsung dalam sumsum tulang.
Tiga grup sel yang terdapat dalam darah yaitu sel darah merah atau eritrosit, sel darah putih atau leukosit dan keping-keping darah atau trombosit. Ada dua kelas leukosit, yaitu yang mengandung granula dalam sitoplasmanya (granulosit) dan agranulosit yang tidak mengandung granula. Granulosit dari leukosit terdiri dari heterofil (pada manusia dikenal sebagai netrofil), eosinofil dan basofil, sedangkan agranulosit dari leukosit terdiri dari limfosit dan monosit. Ketika melaksanakan fungsinya, monosit dan heterofil ini keluar melalui dinding kapiler di area terjadinya kerusakan jaringan, bila telah bebas dalam jaringan mereka mulai fagositosis. Heterofil berfungsi sebagai pertahanan tubuh terhadap bakteri yang masuk dengan cara fagositosis.
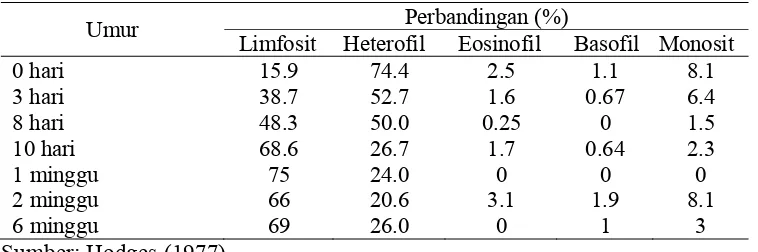
Aktivitas otot dengan peningkatan denyut jantung dan respirasi, penyakit serta stres dapat meningkatkan jumlah leukosit. Faktor lain yang mempengaruhi jumlah leukosit adalah lingkungan, gizi dan pengaruh hormonal (Hodges 1977). Selanjutnya dinyatakan bahwa jumlah leukosit ayam betina dewasa lebih tinggi daripada jantan. Peningkatan kebutuhan leukosit yang mungkin dipengaruhi faktor-faktor di atas sesuai dengan manfaat sesungguhnya dari leukosit yaitu kebanyakan leukosit secara khusus diangkut menuju daerah-daerah yang mengalami peradangan yang berat untuk menyediakan pertahanan yang cepat dan kuat (Guyton dan Hall 1997).
Jumlah leukosit yang normal pada ayam bekisar antara 12 000 - 30 000/mm3. Jumlah leukosit meningkat seiring dengan bertambahnya
Tabel 4 Perbandingan jumlah leukosit berdasarkan jenis kelamin
Ayam Perbandingan (%)
Limfosit Heterofil Eosinofil Basofil Monosit
Betina dewasa 59.1 20.9 1.9 1.7 10.2
Jantan dewasa 64.4 22.8 1.9 1.7 8.9
Betina White Leghorn 64.0 25.8 1.4 2.4 6.4 Jantan White Leghorn 76.1 13.1 2.5 2.4 5.7 Sumber: Sturkie (1976)
Tabel 5 Perbandingan jumlah leukosit berdasarkan umur ayam
Umur Perbandingan (%)
Limfosit Heterofil Eosinofil Basofil Monosit
0 hari 15.9 74.4 2.5 1.1 8.1
3 hari 38.7 52.7 1.6 0.67 6.4
8 hari 48.3 50.0 0.25 0 1.5
10 hari 68.6 26.7 1.7 0.64 2.3
1 minggu 75 24.0 0 0 0
2 minggu 66 20.6 3.1 1.9 8.1
6 minggu 69 26.0 0 1 3
Sumber: Hodges (1977)
Perubahan lingkungan sosial, kondisi yang merugikan, stimulasi berbahaya, dan keadaan lain yang dapat menimbulkan stres menyebabkan ayam lebih mudah menderita infeksi. Tingkat dan sistem kekebalan terbentuk ketika ayam merespon untuk melindungi diri terhadap organisme patogen yang spesifik. Sel-sel leukosit berperan penting dalam sistem kekebalan ayam sebagai sistem pertahanan tubuh (Guyton dan Hall 1997).
Leukosit bersama dengan makrofag dan jaringan limfoid merupakan suatu sistem khusus yang dapat memberantas bermacam-macam infeksi dan bahan-bahan yang toksik. Leukosit dalam mencegah penyakit, mempunyai dua fungsi yaitu merusak agen yang menyerbu melalui proses fagositosis dan membentuk antibodi (kekebalan) (Guyton dan Hall 1997).
Hall (1997) mengemukakan bahwa masa hidup limfosit selama 100-300 hari bahkan sampai bertahun-tahun. Lebih lanjut menurut Tizard (1982) limfosit memiliki fungsi kompleks dengan fungsi utama yaitu memproduksi antibodi (limfosit B) atau sebagai sel efektor khusus dalam menanggapi antigen yang melekat pada makrofag (limfosit T). Persentase jumlah limfosit dalam darah ayam pada umur 2-21 minggu berkisar 55%-60% (Swenson 1984). Limfosit membentuk antibodi, bergerak motil dan amuboid, tetapi tidak fagosit.
Nilai hematokrit atau volume sel packed, adalah suatu istilah yang artinya persentase (berdasar volume) dari darah, yang terdiri atas sel-sel darah merah. Penentuannya dilakukan dengan mengisi tabung hematokrit dengan darah, kemudian dilakukan sentrifuse sampai sel-sel mengumpul di bagian dasar. Nilai hematokrit kemudian dapat diketahui secara langsung ataupun secara tidak langsung dari tabung itu. Nilai hematokrit biasanya dianggap sama manfaatnya dengan hitungan sel darah merah total (Frandson 1992). Kadar hematokrit ditentukan dengan memutar darah yang terdapat di dalam tabung kapiler selama 10 sampai 15 menit kemudian mengukur tinggi butir-butir darah merah dan membandingkannya dengan ketinggian butir-butir darah merah bersama plasmanya (Piliang dan Djojosoebagio 2006b).
Hematokrit ialah fraksi darah yang terdiri dari sel-sel darah merah, yang ditentukan melalui sentrifugasi darah di tabung hematokrit sampai sel-sel ini besar-benar mampat di bagian bawah tabung. Sel darah merah tidak mungkin dimampatkan semua, karena sekitar 3-4% plasma tetap terjebak diantara sel, dan hematokrit sebenarnya hanya sekitar 96%dari hematokrit yang terukur (Guyton dan Hall 1997). Semakin besar persentase sel dalam darah maka semakin besar hematokrit dan semakin banyak gesekan yang terjadi antara berbagai lapisan darah, dan gesekan ini menunjukkan viskositas. Viskositas darah meningkat hebat dengan meningkatnya hematokrit. Bila hematokrit meningkat sampai 60 atau 70%, viskositas darah menjadi 10 kali lebih besar daripada air dan alirannya melalui pembuluh darah menjadi sangat terhambat.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Januari sampai bulan Maret 2009 di kandang blok B (unggas) Fakultas Peternakan Institut Pertanian Bogor, analisa bahan pakan dan ransum yang digunakan dilakukan di Laboratorium Ilmu dan Teknologi Pakan Fakultas Peternakan IPB. Analisa darah dan serologi dilakukan di Laboratorium Terpadu Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, sedangkan gambar mikroanatomi organ usus dianalisa di Laboratorium Patologi Klinik dan Bagian Patologi Departemen Klinik Reproduksi dan Patologi FKH-IPB.
Materi Penelitian
Ayam Pedaging
Penelitian menggunakan 200 ekor DOC (day old chick) ayam pedaging strain Ross. Jumlah ayam tersebut dibagi menjadi 5 kelompok perlakuan dan 4 ulangan, masing-masing kelompok perlakuan ulangan terdiri atas 10 ekor.
Kandang dan Peralatan
Ampas Buah Merah
Ampas buah merah (ABM) berasal dari produk samping dari proses ekstraksi buah merah dalam pembuatan sari atau minyak buah merah. ABM diperoleh dari proses ekstraksi buah merah, yaitu buah merah matang dipisahkan dari empulurnya (bagian kayu di tengah buah) kemudian dipotong-potong dan dicuci sampai bersih. Daging buah dikukus di atas api sedang selama 1-2 jam, setelah itu dipisahkan dari biji buah dengan cara dikucek dan diperas. Air ditambahkan hingga ketinggian 5 cm di atas permukaan bahan dan diperoleh sari buah merah yang menyerupai santan, kemudian dimasak kembali dengan api sedang selama 5-6 jam sambil diaduk sampai muncul minyak berwarna kehitaman di permukaan bahan. Setelah didiamkan selama satu hari, akan terbentuk tiga lapisan, yaitu air di lapisan bawah, ampas di lapisan tengah dan minyak di lapisan atas. Hasil samping dari proses ekstraksi buah merah yaitu pada lapisan tengah inilah yang dinamakan ampas buah merah (Budi dan Paimin 2005). Hasil analisa ampas buah merah ditunjukkan pada Tabel 6.
Tabel 6 Analisa kandungan nutrisi ampas buah merah
Nilai nutrisi Jumlah
Bahan Kering (%) Abu (%)
Protein Kasar (%) Serat Kasar (%) Lemak Kasar (%)
Bahan Ekstrak Tanpa N (%) Kalsium (%)
Fosfor (%)
Energi Bruto (kkal/kg)
23.12 0.91 3.11 0.21 7.60 11.30 0.14 0.89 6 316
Sumber: Hasil Analisis Laboratorium Ilmu dan Teknologi Pakan Fakultas Peternakan IPB, 2009
Ransum Percobaan
Bahan penyusun ransum terdiri dari jagung, dedak, tepung ikan, bungkil kedelai, minyak, kalsium fosfat, CaCO3, asam amino, vitamin dan mineral.
T0 = Ransum basal (kontrol)
T1 = Ransum basal + ABM 0.5%
T2 = Ransum basal + ABM 1.0%
T3 = Ransum basal + ABM 1.5%
T4 = Ransum basal + ABM 2.0%
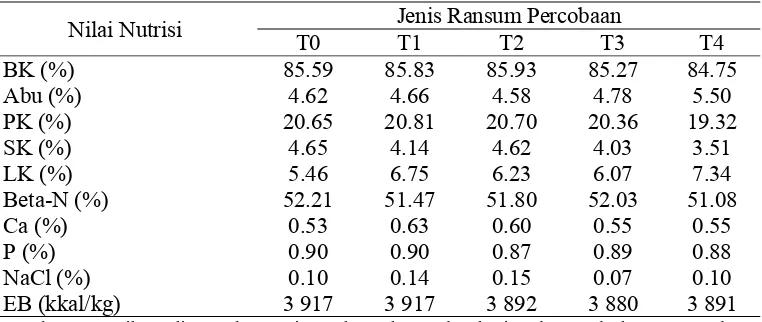
Ransum dianalisa di laboratorium. Hasil analisa kelima ransum percobaan ditunjukkan secara lengkap pada Tabel 7.
Tabel 7 Analisa kandungan nutrisi ransum percobaan
Nilai Nutrisi Jenis Ransum Percobaan
T0 T1 T2 T3 T4
Sumber : Hasil analisa Laboratorium Ilmu dan Teknologi Pakan Fakultas Peternakan IPB, 2009
Metode Penelitian
Pelaksanaan Penelitian
Sebanyak 200 ekor anak ayam umur sehari (DOC) strain Ross dibagi secara acak dalam 5 perlakuan. Masing-masing perlakuan terdiri dari 4 ulangan, dan setiap unit percobaan (perlakuan-ulangan) terdiri dari 10 ekor yang telah ditimbang untuk mengetahui bobot badan awal dan ditempatkan pada satu petak kandang ukuran 1x1x1 meter. Selama penelitian, ayam pedaging dipelihara dalam kandang litter selama 35 hari. Vaksinasi yang digunakan selama penelitian ini adalah vaksinasi ND strain La-Sota, vaksin ND I diberikan pada umur 4 hari (tetes mata) dan vaksin ND II diberikan pada umur 21 hari (injeksi intra-muskular). Pada umur 14 hari dilakukan pula vaksin IBD melalui tetes mata.
dilakukan penimbangan sisa pakan untuk mengukur pakan yang dikonsumsi. Pada akhir penelitian ayam dipotong untuk mengetahui persentase karkas dan pengamatan organ dalam.
Peubah yang diamati meliputi konsumsi ransum, pertambahan bobot badan, konversi ransum, bobot badan akhir, persentase karkas, tingkat kematian, indeks performa, luas permukaan villi usus halus, jumlah butir darah merah, kadar hemoglobin, kadar hematokrit, jumlah butir darah putih dan diferensiasinya (heterofil, limfosit dan rasio herofil/limfosit), serta titer kekebalan terhadap ND. Pengambilan darah untuk mengukur titer kekebalan dan gambaran darah awal dilakukan sebelum ayam di vaksinasi ND I, selanjutnya dilakukan setiap minggu.
Rancangan Percobaan
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) dengan 5 (lima) perlakuan dan 4 (empat) ulangan, sehingga model matematis yang digunakan adalah
Yij = μ + τi + εij
i = 1, 2, 3, 4, 5 ; j = 1,2,3,4
Yij = Respon pengamatan satuan percobaan yang memperoleh perlakuan ke-i
dan ulangan ke-j μ = Rataan umum
τi = Pengaruh perlakuan ke-i
εij = Perlakuan galat
Data yang diperoleh dianalisis sidik ragam dan apabila ada perbedaan diantara perlakuan, diuji lanjut dengan uji Duncan’s Multiple Range Test (DMRT) (Steel dan Torrie 1993).
Peubah dan Prosedur Pengukuran
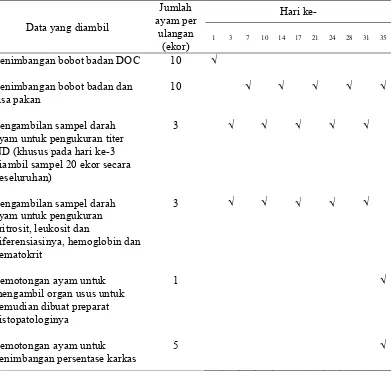
rasio herofil/limfosit), serta titer kekebalan terhadap ND. Diamati pula luas permukaan villi usus. Tahap-tahap pengumpulan data yang dilakukan pada saat penelitian seperti terdapat pada Tabel 8. Tingkat kematian diketahui dengan melakukan pengamatan dan dicatat jumlah kematian yang terjadi setiap hari.
Tabel 8 Tahap pengumpulan data selama penelitian
Data yang diambil
Penimbangan bobot badan DOC
Penimbangan bobot badan dan sisa pakan
Pengambilan sampel darah ayam untuk pengukuran titer ND (khusus pada hari ke-3 diambil sampel 20 ekor secara keseluruhan) mengambil organ usus untuk kemudian dibuat preparat
1 Konsumsi Ransum Kumulatif
2 Pertambahan Bobot Badan
Pertambahan bobot badan setiap ayam pedaging dihitung dari bobot badan pada akhir pemeliharaan dikurangi bobot badan awal.
3 Feed Conversion Ratio (FCR)
FCR dihitung berdasarkan perbandingan antara konsumsi ransum dengan pertambahan bobot badan.
4 Bobot Badan Akhir
Bobot badan akhir dihitung berdasarkan bobot badan pada akhir pemeliharaan.
5 Persentase Karkas
Persentase karkas dihitung berdasarkan perbandingan antara bobot karkas dengan bobot hidup ayam pedaging pada akhir penelitian dikalikan 100%. Bobot karkas diperoleh berdasarkan bobot potong pada akhir penelitian dikurangi bulu, kepala, kaki (shank), darah, alat pencernaan dan organ-organ tubuh bagian dalam kecuali ginjal dan paru-paru.
6 Persentase Kematian
Persentase kematian diperoleh berdasarkan perbandingan antara jumlah ayam yang mati dengan jumlah ayam semula.
7 Indeks Performa
Indeks performa untuk ayam pedaging diperoleh dari rumus (North dan Bell 1990):
IP = bobot hidup rata-rata (kg) x % ayam hidup x 100% FCR x umur panen rata-rata (hari)
8 Profil Darah
Pemeriksaan sel darah merah dan leukosit menggunakan hemasitometer, kadar hemoglobin dengan metode Sahli.
Pengukuran jumlah leukosit dan diferensiasinya melalui pembuatan preparat ulas darah tipis dengan pewarnaan May Grunwald-Giemsa dengan metode Benjamin (1980). Pembuatan ulas darah adalah sebagai berikut, setetes darah diteteskan pada gelas objek pertama dengan posisi mendatar, gelas objek yang lainnya ditempatkan pada darah yang pertama dengan membentuk sudut 30-45o sehingga darah menyebar sepanjang garis kontak antar gelas objek. Selanjutnya, gelas objek di dorong kearah depan sehingga terbentuk usapan darah tipis diatas gelas objek. Ulasan darah tersebut dikering udarakan kemudian di fiksasi. Fiksasi dilakukan dengan menggunakan metanol. Supaya ulas darah melekat pada gelas objek, gelas objek direndam dalam metanol selama 2-5 menit. Setelah dilakukan fiksasi, langsung dilakukan pewarnaan dengan menggunakan giemsa. Gelas objek yang telah difiksasi direndam dalam larutan giemsa selama 15-30 menit. Hasil rendaman dialiri dengan air sampai berwarna pink lalu dikeringkan di udara atau dengan kertas tisu, kemudian dilakukan penghitungan jenis leukosit di bawah mikroskop.
Nilai hematokrit diukur menggunakan metode mikrohematokrit. Pengisian pipa mikrokapiler dilakukan dengan memiringkan tabung yang berisi sampel darah dengan menempatkan ujung mikrokapiler yang bertanda merah. Pipa diisi sampai mencapai 3/5 bagian, kemudian ujung pipa disumbat dengan crestaseal, selanjutnya pipa mikrokapiler tersebut disentrifuse selama 5 menit. Nilai hematokrit ditentukan dengan mengukur persentase volume eritrosit dari darah dengan menggunakan alat baca micro-hematocrit tube reader. Uji ini dilakukan secara duplo.
9 Respon Kebal terhadap ND dengan Uji Penghambatan Aglutinasi (HI-test) Uji HI dalam penelitian ini ditujukan untuk mengukur banyaknya antibodi
HA-Unit. Pengukuran titer antibodi dilakukan setiap minggu setelah diberi vaksin ND pertama (primer) umur 4 hari dan vaksin ND kedua (sekunder) umur 21 hari. Masing-masing unit percobaan diambil tiga ekor ayam setiap minggu untuk diambil sampel darahnya sebanyak 1 ml melalui pembuluh darah vena untuk diukur titer antibodi dengan metode HI.
Metode HA-test adalah sebagai berikut, PBS dengan volume 0.025 ml dimasukkan dalam semua sumur piring mikrotitrasi dasar V. Suspensi virus ditambahkan sebanyak 0.025 ml pada sumur pertama, ini akan membuat larutan dengan konsentrasi pengenceran 1:5. Suspensi virus dengan volume 0.025 ml diencerkan secara serial kelipatan dua, kemudian 0.025 ml PBS dimasukkan ke dalam setiap sumur. Sel darah merah ayam dengan volume 0.025 ml 1% dimasukkan ke dalam semua sumur, kemudian piring digoyangkan dengan perlahan dan dibiarkan selama 40 menit pada suhu ruang. Kontrol yang digunakan adalah 0.05 ml 1% sel darah merah dan 0.05 ml PBS, larutan ini akan membentuk endapan utuh seperti kancing di dasar sumur yang menunjukkan tidak terjadinya aglutinasi. Titer HA dibaca dengan cara piring ditegakkan dan diamati ada tidaknya aliran (tear drop) SDM. Titer HA dibaca berdasarkan pengenceran tertinggi yang memberikan HA sempurna (tidak ada streaming). Nilai ini menunjukkan nilai 1 HA unit (HAU) dan dapat dihitung secara tepat berdasarkan pengenceran awal (OIE 2000).
menyertakan serum kontrol negatif, yang tidak boleh memberikan titer lebih besar dari 4 (22 atau log 2) dan serum kontrol positif harus menunjukkan titer yang tidak berbeda satu kali pengenceran dari titer yang diketahui (OIE 2000).
10 Luas Permukaan Villi Usus
Perhitungan luas permukaan per villi usus halus dilakukan dengan membuat preparat histopatologi usus dan diwarnai dengan hematoksilin dan eosin (HE). Perhitungan luas permukaan per villi dihitung menggunakan mikroskop dengan pembesaran objektif 4 kali dan video mikrometer pada 8 lapang pandang dari setiap preparat histopatologi dan setiap lapang pandang dihitung 2 villi, kemudian dihitung luas permukaan villi dengan menggunakan perhitungan menurut metode Iji et al. (2001).
Luas permukaan per villi = (c + b) (b x a) Dimana : a = tinggi villi
b = lebar apikal villi c = lebar basal villi
Gambar 1 Gambaran villi permukaan usus ayam; tinggi villi (a), lebar apikal villi (b), lebar basal villi (c).
a b
HASIL DAN PEMBAHASAN
Pemanfaatan Ampas Buah Merah dalam Pakan terhadap Performa Ayam Pedaging
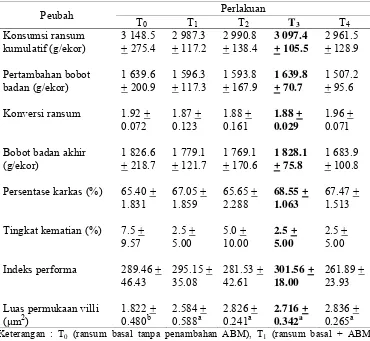
Hasil pengamatan penelitian selama 5 minggu pemeliharaan dengan penambahan ampas buah merah (ABM) dalam ransum basal ayam pedaging terhadap performa ayam tercantum pada Tabel 9.
Tabel 9 Hasil pengamatan performa dan luas permukaan villi usus halus ayam pedaging selama penelitian
Peubah Perlakuan
Keterangan : T0 (ransum basal tanpa penambahan ABM), T1 (ransum basal + ABM
0.5%), T2 (ransum basal + ABM 1.0%), T3 (ransum basal + ABM 1.5%)
dan T4 (ransum basal + ABM 2.0%); Superskrip yang berbeda pada baris
yang sama menunjukkan perbedaan yang nyata (P<0.05)
dengan semua perlakuan ABM (T1, T2, T3 dan T4) memiliki luas permukaan villi
usus halus yang nyata lebih luas dibanding perlakuan kontrol (T0).
Saluran cerna merupakan alat penghubung antara lingkungan internal dan eksternal dengan fungsi utamanya sebagai penyerap zat-zat makanan. Karakteristik morfologi saluran cerna terutama usus halus pada ayam menentukan fungsi usus pada pertumbuhan ayam (Yamuchi dan Isshiki 1991). Morfologi mukosa usus halus terdiri atas villi yang berfungsi memperluas area penyerapan nutrien pakan dan pada permukaan villi terdapat mikrovilli sebagai penjuluran sitoplasma yang dapat meningkatkan efisiensi penyerapan. Semakin luas permukaan villi usus semakin besar peluang terjadinya absorbsi pada saluran cerna Silva et al. (2007). Hasil yang berbeda nyata antara semua perlakuan penambahan ABM terhadap luas permukaan villi usus halus dibandingkan dengan perlakuan kontrol disebabkan karena kandungan zat aktif ABM berupa senyawa karotenoid yang merupakan pro vitamin A dan di dalam tubuh dapat diubah menjadi vitamin A yang berfungsi untuk pertumbuhan dan memelihara membran mukosa yang normal (Wahju 2004). Karotenoid dan tokoferol (vitamin E) juga berfungsi sebagai antioksidan yang mampu menangkal radikal bebas yang dapat terjadi juga dalam saluran pencernaan, sehingga mukosa usus halus ayam yang diberi tambahan ABM dalam ransumnya dapat berkembang lebih baik.
Ransum yang dikonsumsi adalah untuk memenuhi kebutuhan nutrisi untuk hidup pokok, produksi dan pertumbuhan. Tabel 9 menunjukkan bahwa perlakuan T0, T1, T2, T3 dan T4 tidak berpengaruh terhadap konsumsi ransum, meskipun
susunan ransum pada T4 tidak sama kadar protein kasarnya (tidak iso protein).
NRC (1994) merekomendasikan kebutuhan energi metabolis untuk ayam pedaging sebesar 2.800-3.200 kkal/kg dan protein kasar berkisar 20-23%. Secara numerik, nilai konsumsi ransum perlakuan ABM 1.62-5.94% lebih rendah daripada perlakuan T0 (tanpa panambahan ABM). Konsekuensi tinggi rendahnya
konsumsi ransum adalah terhadap tinggi rendahnya pertambahan bobot badan, namun pertambahan bobot badan pada perlakuan T3 (ransum basal + ABM 1.5%)
yaitu 1 639.8 + 70.7 g/ekor atau lebih tinggi 0.012% dari perlakuan kontrol (T0).
lebih tinggi dari T0). Hal ini mengindikasikan bahwa efisiensi penggunaan ransum
pada perlakuan T3 lebih baik dibandingkan perlakuan kontrol dan didukung oleh
nilai FCR yang lebih rendah 2.08% daripada T0, dengan demikian efisiensi
penggunaan ransum untuk menambah bobot badan dan membentuk karkas lebih tinggi pada perlakuan T3. Tabel 9 menunjukkan nilai persentase karkas semua
taraf perlakuan ABM lebih tinggi (0.38-4.82%) dibandingkan kontrol, hal ini menunjukkan bahwa pemberian ABM cenderung mengurangi pemanfaatan bahan makanan untuk pertumbuhan bulu, kaki, kepala dan organ dalam dimana bagian-bagian tersebut dihilangkan serta meningkatkan pemanfaatan bahan makanan untuk mendapatkan karkas. Hasil ini berkaitan dengan luas permukaan villi usus halus pada semua taraf perlakuan ABM secara nyata lebih luas dibandingkan dengan kontrol, yang menyebabkan kesempatan ransum untuk diserap oleh usus lebih besar untuk menghasilkan bobot karkas yang lebih baik.
Penambahan ABM 1.5% dalam ransum basal (T3) menunjukkan suatu
prestasi performa yang baik pada akhir pemeliharaan secara numerik, yaitu bobot badan akhir tertinggi dan konversi ransum serta persentase ayam yang mati rendah. Hasil ini didukung dengan menghitung indeks performa ayam. Indeks performa (IP) pada perlakuan T3 yaitu 301.56 + 18.00 atau 4.18% lebih tinggi dari
kontrol. Nilai indeks performa yang tinggi akan memberikan keuntungan yang lebih optimal sehingga keuntungan yang didapatkan peternak akan lebih besar. Menurut Arifien (1997), nilai indeks performa dapat digolongkan sebagai berikut: ≤ 120 (prestasi sangat jelek), 121-140 (prestasi jelek), 141-160 (prestasi cukup), 161-180 (prestasi baik), 181-200 (prestasi sangat baik) dan >200 (prestasi istimewa). Nilai indeks performa semua ransum perlakuan seperti terlihat pada Tabel 9 memiliki prestasi yang istimewa, namun yang tertinggi adalah indeks performa ayam perlakuan T3.
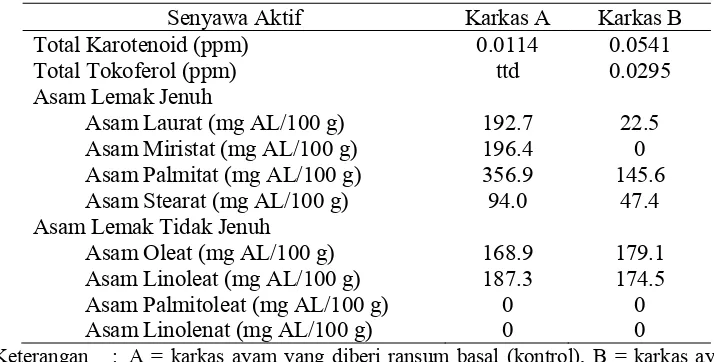
Perbedaan diantara perlakuan T3 dan perlakuan kontrol juga tampak pada
perlakuan kontrol) senyawa karotenoid dan 0.0294 ppm tokoferol sedangan pada perlakuan kontrol tidak terdeteksi adanya tokoferol. Berdasarkan penelitian ini tampak bahwa ransum dengan penambahan ABM menghasilkan karkas dengan kandungan karotenoid dan tokoferol yang lebih tinggi. Adanya karotenoid dan tokoferol dalam karkas meningkatkan mutu karkas, kedua zat tersebut berperan sebagai antioksidan. Karkas perlakuan kontrol mengandung lemak jenuh lebih tinggi dibandingkan dengan perlakuan ABM, sedangkan kandungan lemak tak jenuh (asam oleat dan linoleat) tidak jauh berbeda. Asam-asam lemak tidak jenuh dalam peroksidasi lipida, terlebih dahulu mengalami pengurangan hidrogen sehingga terjadi pembentukan radikal bebas (Wahju 2004).
Tabel 10 Kandungan senyawa aktif dalam karkas
Senyawa Aktif Karkas A Karkas B Total Karotenoid (ppm)
Total Tokoferol (ppm) Asam Lemak Jenuh
Asam Laurat (mg AL/100 g) Asam Miristat (mg AL/100 g) Asam Palmitat (mg AL/100 g) Asam Stearat (mg AL/100 g) Asam Lemak Tidak Jenuh
Asam Oleat (mg AL/100 g) Asam Linoleat (mg AL/100 g) Asam Palmitoleat (mg AL/100 g) Asam Linolenat (mg AL/100 g)
0.0114
Keterangan : A = karkas ayam yang diberi ransum basal (kontrol), B = karkas ayam yang diberi ransum basal + ABM 2.0% (T4), ttd = tidak terdeteksi.
Sumber : Hasil Analisis Laboratorium PAU IPB, 2009
Secara umum dapat dinyatakan bahwa ransum dengan penambahan ABM dapat meningkatkan nilai nutrien karkas berupa kandungan karotenoid dan tokoferol serta menurunkan kandungan asam lemak jenuh dalam karkas. Surai dan Sparks (2000) menyatakan bahwa penambahan alfa tokoferol 160-200 mg/kg dalam pakan meningkatkan perlindungan lemak terhadap oksidasi lemak dan kandungan alfa tokoferol yang terdapat di dalam karkas.
Tingkat kematian merupakan faktor penting dan harus diperhatikan dalam suatu usaha peternakan ayam. Pada Tabel 9 terlihat persentase kematian tertinggi terjadi pada kelompok perlakuan T0 (kontrol). Jumlah kematian setiap minggu
Tabel 11 Persentase kematian ayam selama penelitian
Minggu ke- Perlakuan
T0 T1 T2 T3 T4 Tabel 11 menunjukkan kematian pada dua minggu awal kemungkinan disebabkan oleh faktor adaptasi dan ayam kalah berkompetisi sehingga menyebabkan ayam kerdil karena kekurangan gizi dan akhirnya menyebabkan kematian. Kematian sering terjadi pada minggu keempat dan kelima, berdasarkan pengamatan di lapangan gejala yang dialami sebelum mati ayam terlihat sesak nafas, keluar cairan dari hidung, lesu, kepala menunduk, sayap terkulai. Berdasarkan tanda-tanda klinisnya, kematian ayam disebabkan terkena penyakit ngorok atau CRD (chronic respiratory disease), sesuai dengan pendapat Akoso (1998), penyakit CRD mempunyai tanda-tanda klinis seperti nafas ngorok, bersin dan kepala tunduk atau dikibaskan untuk mengeluarkan cairan yang mengganggu pernafasan. Selain itu terdapat pula ayam yang mati tanpa menunjukkan gejala-gejala klinis sebelumnya. Kematian ini disebabkan oleh sindrom kematian mendadak (sudden death syndrome). Menurut Akoso (1998) sindrom kematian mendadak merupakan penyakit metabolik karena peristiwa lipogenesis, keutuhan selaput sel dan keseimbangan elektrolit intraseluler, ayam tidak menunjukkan gejala klinis sebelumnya dan secara tiba-tiba menjulurkan leher, tersengal dan mati.
Pemanfaatan Ampas Buah Merah dalam Pakan terhadap Status Kesehatan Ayam Pedaging
Status kesehatan ayam pedaging penelitian dapat dilihat dari perubahan pada profil darah. Profil darah selama penelitian terlihat pada Tabel 12.
Jumlah Butir Darah Merah
Jumlah butir darah merah (juta/mm3) ayam pedaging yang diberi ABM dapat dilihat pada Tabel 12. Rataan jumlah butir darah merah sebelum diberikan perlakuan adalah 1.652 juta/mm3. Hasil penelitian menunjukkan pada hari ke-14 setelah perlakuan terdapat perbedaan yang sangat nyata (P<0.01) antara perlakuan T2 (ransum basal + ABM 1.0%) dengan perlakuan kontrol. Vitamin E (tokoferol)
dapat menguatkan dinding kapiler darah dan mencegah terjadinya hemolisis sel darah merah (Wahju 2004) dan berperan dalam pembentukan sel darah merah (Winarno 2008). Jumlah butir darah merah setiap perlakuan masih berada pada kisaran normal, yang menurut Mangkoewidjojo dan Smith (1988) bahwa jumlah butir darah merah berkisar antara 2-3.2 juta/mm3. Berdasarkan penelitian Talebi et al. (2005), butir darah merah ayam pedaging strain Ross secara nyata meningkat dengan bertambahnya umur, berkisar antara 1.97-2.83 juta/mm3. Pada pengamatan hari ke-28 setelah perlakuan (sebelum panen) menunjukkan tidak terdapat perbedaan pada semua perlakuan terhadap jumlah butir darah merah. Jumlah butir darah merah pada semua perlakuan masih dalam kisaran normal sehingga dapat melakukan fungsi darah dengan baik sebagai pengantar zat-zat makanan ke seluruh jaringan maupun mengangkut hasil limbahnya.
Tabel 12 Profil darah ayam pedaging selama penelitian
Hemoglobin
Hemoglobin (Hb) berada di dalam butir darah merah yang berfungsi membawa oksigen ke jaringan dan mensekresikan CO2 dari jaringan
(Cunningham 2002). Meningkatnya kadar hemoglobin menyebabkan kemampuan membawa oksigen ke dalam jaringan lebih baik dan ekskresi CO2 lebih efisien
sehingga keadaan dan fungsi sel akan lebih baik.
Rataan kadar Hb sebelum diberikan perlakuan adalah 6.549 g%. Hasil penelitian menunjukkan kadar hemoglobin tidak berbeda antar kelompok penelitian disemua waktu pengamatan. Sintesis hemoglobin dipengaruhi oleh keberadaan zat gizi dalam pakan, seperti keberadaan zat besi. Mangkoewidjojo dan Smith (1988) menyatakan bahwa kadar hemoglobin normal berkisar antara 7.30-10.90 g%, sehingga secara umum kadar hemoglobin semua perlakuan masih dalam kisaran normal.
Menurut Piliang dan Djojosoebagio (2006b), zat besi di dalam darah berada dalam bentuk hemoglobin yang terdapat di dalam butir-butir darah merah transferin di dalam plasma darah dan dalam bentuk ferritin. Kandungan zat besi yang ada di dalam buah merah cukup tinggi (Budi dan Paimin 2005), namun kemungkinan kandungan zat besi di dalam ABM lebih rendah sehingga hemoglobin pada ternak perlakuan tidak berbeda nyata dengan kontrol.
Hematokrit
Hematokrit merupakan persentase sel darah merah dari total volume darah. Nilai hematokrit biasanya dianggap sama manfaatnya dengan hitungan sel darah merah total (Frandson 1992). Semakin besar persentase sel dalam darah berarti semakin besar hematokrit dan semakin banyak gesekan yang terjadi antara berbagai lapisan darah.
menguatkan dinding kapiler darah dan mencegah terjadinya hemolisis sel darah merah (Wahju 2004) serta berperan dalam pembentukan sel darah merah (Winarno 2008). Menurut Talebi et al. (2005) rataan kadar hematokrit ayam pedaging strain Ross adalah 30.73% (28.28-35.43%), sedangkan menurut Mangkoewidjojo dan Smith (1988) menyatakan bahwa kadar hematokrit normal berkisar antara 24-43%. Salah satu penyebab perbedaan kadar hematokrit adalah temperatur lingkungan percobaan. Temperatur tinggi akan menyebabkan evaporasi cairan dalam tubuh dan berakibat pada meningkatnya jumlah hematokrit dalam darah. Pada hari ke-28 setelah perlakuan (sebelum panen), kadar hematokrit tidak berbeda diantara perlakuan dan kadar hematokrit ayam selama penelitian ini masih dalam kisaran yang normal dan ayam dalam kondisi yang sehat.
Jumlah Butir Darah Putih
Jumlah butir darah putih (ribu/mm3) ayam pedaging yang diberi ABM selama 35 hari dapat dilihat pada Tabel 12. Rataan jumlah butir darah putih sebelum diberikan perlakuan adalah 27.834 ribu/mm3. Jumlah butir darah putih ayam pedaging selama penelitian menunjukkan perbedaan yang nyata (P<0.05) pada hari ke-14 dan sangat nyata (P<0.01) pada hari ke-21 setelah perlakuan. Jumlah butir darah putih semua perlakuan secara umum berada dalam kisaran normal, yang menurut Hodges (1977) jumlah butir darah putih normal pada ayam berkisar antara 12 000-30 000 /mm3.
proliferasi limfosit menjadi terhambat. Stres diakibatkan oleh kerja hati yang lebih keras untuk menetralisir zat-zat yang terakumulasi dari ABM. Pada hari ke-28 setelah perlakuan (sebelum panen) jumlah butir darah putih kembali berada pada kisaran normal dan ayam dalam kondisi sehat.
Heterofil, Limfosit dan Rasio H/L
Tabel 12 menunjukkan bahwa tidak ada pengaruh perlakuan yang diberikan terhadap jumlah heterofil. Diduga hal ini terjadi karena ayam tidak mengalami infeksi bakteri patogen yang dapat menyebabkan peningkatan jumlah heterofil. Jumlah heterofil semua perlakuan masih dalam kisaran normal. Menurut Talebi et al. (2005) rataan jumlah heterofil pada ayam strain Ross adalah 7.78 ribu/mm3 (5.53-10.6 ribu/mm3). Pengamatan menunjukkan kecenderungan peningkatan heterofil pada semua kelompok perlakuan pada hari ke-28 setelah perlakuan. Menurut Jackson (2007) heterofil dapat meningkat karena pengeluaran epinefrin dan kortikosteroid, trauma maupun infeksi.
Jumlah heterofil (ribu/mm3) ayam pedaging yang diberi ABM selama 35 hari dapat dilihat pada Tabel 12. Rataan jumlah heterofil sebelum diberi perlakuan adalah 4.388 ribu/mm3. Heterofil berfungsi sebagai jajaran pertama dalam sistem pertahanan tubuh yang langsung bereaksi apabila terdapat partikel-partikel asing yang masuk ke dalam tubuh dengan cara migrasi ke daerah-daerah yang sedang mengalami serangan oleh bakteri, menembus dinding pembuluh darah dan menyerang bakteri untuk dihancurkan dengan cara fagositosis (Frandson 1992). Heterofil dapat dianggap sebagai garis pertahanan pertama, bergerak cepat ke arah benda asing dan menghancurkannya segera, tetapi tidak mampu bertahan lama (Tizard 1982). Pada saat stres dan terjadi inflamasi atau peradangan diketahui bahwa jumlah heterofil meningkat dengan cepat.
pembentukan limfosit. Beberapa penelitian menyatakan bahwa senyawa antioksidan betakaroten mampu meningkatkan proliferasi limfosit bursal dan limpa (Haq et al. 1996) dan vitamin E mampu meningkatkan kekebalan humoral (Boa-Amponsem et al. 2001) serta meningkatkan status antioksidan ayam (Surai et al. 1999). Terdapat perbedaan nyata (P<0.05) jumlah limfosit pada hari ke-21 setelah perlakuan yaitu perlakuan T0 (17.249 + 2.337 ribu/mm3) lebih tinggi
jumlah limfositnya dibandingkan dengan T2, T3 dan T4, tetapi T0 tidak berbeda
dengan T1. Penurunan jumlah limfosit terjadi pada semua perlakuan ABM dalam
jangka waktu 21-28 hari, seperti halnya jumlah butir darah putih. Faktor yang mempengaruhi penurunan jumlah limfosit diantaranya stres.
Talebi et al. (2005) menyatakan rataan jumlah limfosit pada ayam strain Ross adalah 12.58 ribu/mm3 (6.67–20.36 ribu/mm3). Jumlah limfosit pada semua perlakuan masih dalam kisaran normal sehingga dapat dikatakan bahwa dengan perlakuan ABM ayam menunjukkan status kesehatan yang baik, kecuali perlakuan T3 (ransum basal + ABM 1.5%) pada pengamatan hari ke-21 dan 28 setelah
perlakuan memiliki jumlah limfosit di bawah kisaran normal yang memperlihatkan bahwa ayam pada saat itu mengalami kondisi stres, hal ini didukung oleh rasio H/L ayam yang tinggi.
Rasio H/L merupakan indikator untuk mengetahui tingkat cekaman yang dialami ayam (Graczyk et al. 2003). Cekaman dapat menyebabkan involusi jaringan-jaringan limfoid sehingga terjadi penurunan jumlah sirkulasi limfosit dan peningkatan jumlah heterofil (Siegel 1980). Peningkatan jumlah heterofil menyebabkan ayam kebal terhadap infeksi, tetapi tidak terhadap virus (Zulkifli dan Siegel 1995).
Rasio H/L sebelum diberikan perlakuan adalah 0.269. Tabel 12 menunjukkan bahwa pada hari ke-28 setelah pemberian ABM kelompok T3 secara
nyata lebih tinggi dari semua perlakuan. Pada hari ke-28 sesudah pemberian ABM kelompok T3 memiliki rasio H/L sebesar 2.28, ini berarti bahwa pemberian ABM
ayam penelitian masih dalam kisaran normal. Kecuali perlakuan T3 pada
pengamatan hari ke-28 setelah perlakuan, nilai H/L di atas kisaran normal yang menunjukkan bahwa ayam mengalami stres namun tidak mempengaruhi kondisi kesehatan ayam.
Terjadinya stres akibat pemberian ABM secara terus-menerus dapat menyebabkan organ hati bekerja lebih keras untuk menetralisir zat-zat yang terakumulasi dari ABM. Adanya stres ini menyebabkan terjadinya reaksi neural dan hormonal pada hipotalamus yang akan melepaskan CRF (corticotropin releasing factor) dan menstimulir adenohypophysis untuk memproduksi ACTH (adrenocorticotropin hormon). Proliferasi limfosit terhambat akibat adanya ACTH yang menstimulasi kelenjar adrenal korteks untuk menghasilkan glukokortikoid yang berikatan dengan kofaktor pembentuk limfosit.
Titer Antibodi terhadap ND
Pemberian ABM tidak mempengaruhi pembentukan antibodi terhadap ND pada kelompok ayam yang divaksin ND (Tabel 12). Hal ini sejalan dengan hasil pengamatan terhadap jumlah limfosit dari ayam penelitian yang tidak meningkat dengan pemberian ABM. Ampas buah merah dengan demikian tidak menstimulasi pembentukan limfosit yang berdampak pada pembentukan antibodi oleh sel limfosit tersebut.
Metode yang dapat digunakan untuk mengukur tingginya titer antibodi ND di dalam serum adalah uji hambat hemaglutinasi (HI) untuk menggambarkan tingkat kekebalan ayam setelah divaksinasi dengan vaksin ND (Villegas 1987).
Titer ND ayam pedaging yang diberi ABM selama penelitian dapat dilihat pada Tabel 12. Rataan titer ND sebelum diberi perlakuan adalah 24.9. Rataan titer antibodi sebelum perlakuan (umur 3 hari) cukup tinggi, kekebalan anak ayam itu berasal dari antibodi asal induknya (maternal immunity). Hal ini menunjukkan bahwa anak ayam memiliki kekebalan yang cukup terhadap ND. Seiring waktu pemeliharaan antibodi menurun. Antibodi asal induk berada dalam tubuh anak ayam sampai dengan umur 21 hari (Scanes et al. 2004).
T4,namun tidak berbeda dengan kontrol. Data titer ND menunjukkan bahwa ayam
dengan perlakuan ABM yang divaksin ND melalui tetes mata maupun injeksi belum mampu menginduksi kekebalan mukosa (seluler) maupun kekebalan humoralnya.
KESIMPULAN DAN SARAN
Kesimpulan
Penambahan ampas buah merah (ABM) (sampai 2.0%) dalam ransum tidak mempengaruhi performa dan status kesehatan ayam, namun secara nyata memperluas permukaan villi usus halus. Perlakuan penambahan ABM sebesar 1.5% dalam ransum ayam pedaging (T3) memberikan penampilan produksi berupa
pertambahan bobot badan, indeks performa, bobot badan akhir dan persentase karkas (0.012%; 4.18%; 0.082%; dan 4.82%) daripada T0.Penambahan ABM 2%
juga meningkatkan kualitas karkas, terutama kandungan karotenoid dan tokoferol serta menurunkan asam lemak jenuh.
Pemberian ABM dalam jangka waktu 7 hari mampu meningkatkan produksi butir darah putih, sebaliknya pemberian ampas buah merah secara terus-menerus selama 28 hari cenderung menekan produksi butir darah putih dan menyebabkan stres pada ayam serta belum mampu memicu kekebalan tubuh ayam.
Saran
DAFTAR PUSTAKA
Akoso BT. 1998. Kesehatan UnggasPanduan bagi Petugas Teknis, Penyuluh dan Peternak. Jakarta: Penerbit Kanisius.
Arifien M. 1997. Kiat menekan konversi pakan pada ayam broiler. Poult Indones. Edisi Januari: 11-12.
Baratawidjaja KG. 2006. Imunologi Dasar. Ed ke-7. Jakarta: Balai Penerbit FK UI.
Belitz HD, Grosch W. 1987. Food Chemistry. Ed ke-2. Berlin: Springer Verlag.
Benjamin MM. 1980. Outline of Veterinary Clinical Pathology. Iowa: The Iowa State University.
Boa-Amponsem K, Price SE, Geraert PA, Picard M, Siegel PB. 2001. Antibody responses of hens fed vitamin E and passively acquired antibodies of their chicks. J Avian Dis 45:122-127.
Budi IM, Paimin FR. 2005. Buah Merah. Jakarta: Penebar Swadaya.
Cook ME. 2000. The interplay between modern management practices and the chicken: how immune response and the physiological mechanism for growth and efficiency have adapted over time. Where do we go from here? In: Biotechnology in the Feed Industry. Proceedings of Altech’s 16th. Annual Symposium pp. 97-109.
Cunningham JG. 2002. Textbook of Veterinary Physiology. Ed ke-3. Philadelphia: WB Saunders Company.
Dellman HD, Brown EM. 1992. Buku Teks Histologi Veteriner. Ed ke-3. R. Hartono, penerjemah. Jakarta: UI Pr. Terjemahan dari: Textbook of Veterinary Histology.
Denbow DM. 2000. Gastrointestinal Anatomy and Physiology. Di dalam: Sturkie’s Avian Physiology. Whittow JC, editor. London: Academic Pr. Frandson RD. 1992. Anatomi dan Fisiologi Ternak. Ed ke-4. Srigandono B,
Praseno K, penerjemah; Soedarsono, editor. Yogyakarta: GMU Press. Terjemahan dari: Anatomy and Physiology of Farm Animals.
Guyton AC, Hall JE. 1997. Buku Ajar Fisiologi Kedokteran. Ed ke-9. Irawati S, Ken AT, Alex S, penerjemah; Irawati S, editor. EGC: Penerbit Buku Kedokteran. Terjemahan dari: Textbook of Medical Physiology.
Haq A, Bailey CA, Chinnah A. 1996. Effect of β-carotene, canthaxanthin, lutein and vitamin E on neonatal immunity of chick when supplemented in the broiler breeder. J Poult Sci 75:1092-1097.
Harper HA, VW Rodwell, PA Mayer. 1980. Biokimia. Martin Mulyawan, penerjemah. EGC: Penerbit Buku Kedokteran. Terjemahan dari: Review of Physiological Chemistry.
Hodges RD. 1977. Normal Avian (Poultry) Haematology. Comparative Clinical Haematology. Oxford: Blackwell Scientific Pub.
Iji PA, Hughes RJ, Choet M, Tivey DR. 2001. Intestinal structure and function of broiler chickens on wheat-based diets supplemented with a microbial enzyme. Asian-AustJ Animal Sci 14:54-60.
Jackson ML. 2007. Veterinary Clinical Pathology: an Introduction. USA: Blackwell Pub.
Mangkoewidjojo S, Smith JB. 1988. Pemeliharaan, Pembiakan dan Penggunaan Hewan Percobaan di Daerah Tropis. Jakarta: UI Pr.
Noble ER, Noble GA. 1989. Parasitologi: Biologi Parasit Hewan. Ed ke-5. Wardiarto, penerjemah. Yogyakarta: GMU Pr. Terjemahan dari: Parasitology: The Biology of Animal Paracites.
North MO, Bell DD. 1990. Commercial Chicken Production Manual. Ed ke-4. Westport, Connecticut: The Avi Pub Co Inc.
[NRC] National Research Council. 1994. Nutrient Requirements of Poultry. Ed ke-9. Washington DC: National Academy Pr.
[OIE] Office International Des Epizooties. 2000. Manual of standards for diagnostic tests and vaccines. pp. 212-219.
Piliang WG, Djojosoebagio S. 2006a. Fisiologi Nutrisi.Volume ke-1. Bogor: IPB Pr.
Piliang WG, Djojosoebagio S. 2006b. Fisiologi Nutrisi.Volume ke-2. Bogor: IPB Pr.