KITOSAN TERTAUT SILANG
UREA FORMALDEHIDA DAN
ASAM SULFAT SEBAGAI PENJERAP
CIBACRON RED
DIAN RACHMAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA *
Dengan ini saya menyatakan bahwa skripsi berjudul Kitosan Tertaut Silang Urea-Formaldehida dan Asam Sulfat Sebagai Penjerap Cibacron Red adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skiripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2012
Dian Rachmawati
ABSTRAK
DIAN RACHMAWATI. Kitosan Tertaut Silang Urea-Formaldehida dan Asam Sulfat Sebagai Penjerap Cibacron Red. Dibimbing oleh MOHAMMAD KHOTIB dan AHMAD SJAHRIZA.
Modifikasi kitosan tertaut silang urea-formaldehida dan asam sulfat telah dibuat melalui pembentukan bahan penaut-silang urea, formaldehida, dan asam sulfat dengan nisbah 1:2:1. Nisbah kitosan dan bahan penaut-silang yang digunakan ialah, 2:1, 1:1, dan 1:2. Modifikasi ini dilakukan untuk meningkatkan kapasitas dan efisiensi adsorpsi terhadap cibacron red. Peningkatan kadar N pada kitosan termodifikasi sejalan dengan peningkatan tambahan bahan penaut-silangnya. Berdasarkan hasil uji Fourier transform infrared spectroscopy, terbentuk puncak serapan gugus C-O-S dengan bilangan gelombang 896.33 cm-1 yang menunjukkan ikatan taut-silang antara HOSO3- dan metilolurea, dan pada
1120-1130 cm-1 yang menunjukkan ikatan ionik antara kitosan dan rantai samping, +NH3-OSO3-2. Kondisi adsorpsi terbaik terhadap cibacron red diperoleh
selama 120 menit dengan bobot adsorben 0.1 g pada nisbah adsorben 1:1. Kapasitas dan efisiensi adsorpsi kitosan termodifikasi terhadap cibacron red
memiliki nilai yang lebih baik dibandingkan kitosan tanpa modifikasi. Model isoterm adsorpsi kitosan tertaut silang-formaldehida dan asam sulfat terhadap
cibacron red mengikuti persamaan isoterm Langmuir.
Kata kunci: cibacron red, isoterm Langmuir, kitosan, penaut-silang.
ABSTRACT
DIAN RACHMAWATI. Chitosan Crosslinked with Urea-Formaldehyde and Sulfuric Acid as an Adsorbent of Cibacron Red. Supervised by MOHAMMAD KHOTIB and AHMAD SJAHRIZA.
Modified chitosan cross-linked with urea-formaldehyde and sulfuric acid has been prepare through an establishment of cross-linker material of urea, formaldehyde, and sulfuric acid with the ratio 1:2:1. The ratio of chitosan:cross-linker material used were, 2:1, 1:1, and 1:2. This modification was done to increase the capacity and efficiency cibacron red adsorption. Increasing the addition of N levels, was in line with the addition of cross-linker agent. Based on the Fourier transform infrared spectroscopy, there was an absorption peak of C-O-S group with wavenumber 896.33 cm-1, which shows the cross-link bonds between HOSO-3 and metilolurea, and at 1120-1130 cm-1 that indicates the ionic bonds between the chitosan side chains, +NH3-OSO3-2. Best adsorption conditions
for cibacron red was obtained for 120 minutes and 0.1 g adsorbent to adsorbent ratio of 1:1. Capacity modified chitosan and adsorption efficiency of the cibacron red have better value than unmodified chitosan. The adsoprtion isotherm model of chitosan cross-linked urea-formaldehyde and sulfuric acid toward cibacron red followed the Langmuir isotherm equation.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
KITOSAN TERTAUT SILANG
UREA FORMALDEHIDA DAN
ASAM SULFAT SEBAGAI PENJERAP
CIBACRON RED
DIAN RACHMAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NIM : G 44080057
Disetujui oleh
M. Khotib, S.Si, M.Si Drs. Ahmad Sjahriza
Pembimbing I Pembimbing II
Diketahui oleh
Prof. Dr. Ir. Tun Tedja Irawadi, MS Ketua Departemen
Puji dan syukur penulis panjatkan kepada Allah SWT atas nikmat dan karunia-Nya sehingga karya ilmiah yang berjudul “Kitosan Tertaut Silang Urea-Formaldehida dan Asam Sulfat Sebagai Penjerap Cibacron Red” dapat diselesaikan. Karya ilmiah ini merupakan hasil penelitian yang dilaksanakan sejak bulan Februari–Agustus 2012 di Laboratorium Kimia Analitik, Laboratorium Bersama Departemen Kimia, FMIPA IPB, Laboratoriun Pusat Studi Biofarmaka dan Laboratorium Terpadu IPB.
Penulis mengucapkan terima kasih kepada Bapak M. Khotib, S.Si, M.Si dan Bapak Drs. Ahmad Sjahriza selaku pembimbing yang telah memberikan masukan, arahan, dan dorongan selama penelitian dan penulisan karya ilmiah ini. Ungkapan terima kasih penulis ucapkan kepada seluruh keluarga, Bunda, Ayah, Nurul, Sonia, Fara, atas dukungan baik moril maupun materil, serta kasih sayang, dan doanya. Penghargaan penulis sampaikan kepada seluruh staf dan laboran Kimia Fisik dan Lingkungan, yaitu Pak Ismail, Bu Ai, Pak Nano atas bantuannya selama penulis melaksanakan penelitian. Terima kasih penulis sampaikan kepada Aji, Bani, Miranty, Dinov, Retno, Ammar, Ka Riky, Ka Ayas, dan teman-teman seperjuangan penelitian di Laboratorium Kimia Fisik dan Lingkungan atas kebersamaan, saran, dan semangatnya, serta semua pihak yang telah membantu.
Semoga karya ilmiah ini bermanfaat. Terima kasih.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, pada tanggal 16 April 1990 dari ayah Sunardjo dan bunda Dewi Ratna Sari. Penulis merupakan putri pertama dari empat bersaudara. Tahun 2008 penulis lulus dari SMA Islamic Village Tangerang dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) dengan Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL iv
DAFTAR GAMBAR iv
DAFTAR LAMPIRAN v
PENDAHULUAN 1
METODE 2
Alat dan Bahan 2
Metode Penelitian 2
HASIL DAN PEMBAHASAN 5
Kitosan Hasil Isolasi Cangkang Udang 5
Kitosan Tertaut Silang Urea-Formaldehida dan Asam Sulfat 6
Aplikasi Adsorben Termodifikasi terhadap Cibacron Red 8
Isoterm Adsorpsi 10
SIMPULAN DAN SARAN 11
Simpulan 11 Saran 11
DAFTAR PUSTAKA 11
DAFTAR TABEL
Halaman
1 Perbandingan kitosan hasil isolasi dan komersial 5 2 Hasil kapasitas dan efisiensi adsorpsi kitosan termodifikasi 9
DAFTAR GAMBAR
Halaman
1 Analisis gugus fungsi kitosan hasil isolasi 6
2 Reaksi urea dengan formaldehida 6
3 Reaksi urea-forrmaldehida dan asam sulfat 7
4 Skema taut-silang kitosan 7
5 Kadar N hasil teori dan analisis Kjeldahl 8 6 Analisis gugus fungsi kitosan tertaut silang urea-formaldehida dan asam
sulfat
8
7 Optimisasi waktu adsorpsi 9
8 Optimisasi bobot adsorben 9
9 Kapasitas adsorpsi terhadap cibacron red 9
10 Isoterm Langmuir adsorpsi cibacron red 10 11 Isoterm Freunlich adsorpsi cibacron red 10
DAFTAR LAMPIRAN
Halaman
1 Bagan alir penelitian 14
2 Rendemen kitin dan kitosan hasil isolasi 15 3 Analisis proksimat kitosan hasil isolasi 15
4 Penentuan derajat deasetilasi 16
5 Penetuan bobot molekul 17
6 Penentuan kadar asam sulfat teknis 18
7 Penentuan kadar N kitosan termodifikasi 19
8 Data absorbas pada pembuatan kurva standar cibacron red 20
9 Penentuan adsorpsi optimum 20
PENDAHULUAN
Limbah tekstil menyebabkan pencemaran lingkungan antara lain akibat kandungan zat warna dalam limbah tersebut. Zat warna yang banyak digunakan industri tekstil merupakan zat warna azo yang mengandung gugus reaktif. Industri tekstil menghasilkan zat warna limbah sebesar 10-15% sebagai sisa hasil proses produksi sehingga menyebabkan perubahan sifat kimia dan fisika limbah cair. Zat warna azo bersifat karsinogenik dan genotoksik. Oleh karena itu, dibutuhkan penanganan yang tepat untuk mengurangi dampak pencemaran (Rosa et al. 2008). Peraturan Pemerintah No 82 Tahun 2010 tentang Pengelolaan Kualitas Air dan Pengendalian Pencemaran, ada 5 parameter yang digunakan untuk evaluasi kualitas badan air, yaitu fisika, kimia anorganik, kimia organik, mikrobiologi, dan radioaktivitas. Kelima parameter tersebut, tidak ada aturan untuk warna, padahal warna merupakan salah satu parameter penting sebagai indikator pencemaran.
Metode adsorpsi menggunakan limbah pertanian banyak diteliti untuk menanggulangi limbah tekstil khususnya untuk menghilangkan zat warna. Hasil penelitian menggunakan limbah kulit kacang mampu menjerap biru metilena dengan kapasitas 476.34 µg/g (Susanti 2009). Penggunaan kitosan sebagai penjerap Direct Black 38 memiliki kapasitas 4.21 mg/g (Arifin 2012). Kitosan yang diperoleh dari limbah cangkang udang memiliki kegunaan yang sangat luas dalam kehidupan sehari-hari misalnya sebagai adsorben logam berat, zat warna, antijamur, kosmetik, farmasi, flokulan, antikanker, dan antibakteri (Prashanth dan Tharanathan 2007).
Modifikasi kitosan tertaut-silang dapat meningkatkan kapasitas adsorpsinya. Kitosan yang tertaut silang epiklorohidrin mampu menjerap zat warna reaktif RR222 dengan kapasitas 2252 g/kg pada 30 °C dan pH 3 (Chiou et al. 2003). Kitosan tertaut silang etilenadiamina (EDA) mampu menjerap eosin Y dengan kapasitas 294.12 mg/g pada 25 °C (Huang et al. 2011). Kitosan yang dibentuk menjadi garam kuaterner dan tertaut-silang dengan glutaraldehida mampu menjerap zat warna reaktif RO16 dengan kapasitas sebesar 1060 mg/g (Rosa et al. 2008). Bahan penaut-silang yang tersedia di pasaran umumnya mahal dan sulit untuk diperoleh. Pemilihan urea, formaldehida, dan asam sulfat diharapkan dapat mengganti bahan penaut-silang komersil karena harganya yang relatif murah dan mudah untuk diperoleh, serta memiliki kemampuan untuk membentuk ikatan taut-silang dengan kitosan.
Penelitian ini menggunakan zat warna cibacron red sebagai model dalam proses adsorpsi zat warna tekstil. Cibacron red atau cibacron briliant red 3B-A (C32H19ClN8Na4O14S4) tergolong zat warna bisfungsional dengan 2 gugus reaktif,
yaitu monoklorotriazina dan vinil sulfon dan merupakan zat warna reaktif dalam kelas azo. Cibacron Red merupakan bubuk berwarna merah yang memiliki pH 6-7 dan kelarutan dalam air 100 g/L (Ciba 2002).
METODE
Alat dan Bahan
Alat-alat yang digunakan pada penelitian ini terdiri atas alat-alat gelas, hot plate, Spectronic 20D+ model Thermo Electron Corporation, pengaduk magnet, dan Fourier Transform Infrared Spectroscopy model IRPrestige-21 Shimadzu. Bahan-bahan yang digunakan antara lain cangkang udang putih (Penaeus vannamei), NaOH teknis, HCl teknis, asam asetat glasial, C2H5OH, CO(NH2)2
43.49% N, CH2O teknis 4%, H2SO4 pekat 17 M, dan cibacron red.
Metode Penelitian
Isolasi Kitosan (Hargono et al.2008).
Deproteinasi. Limbah cangkang udang dibersihkan lalu dikeringkan dengan bantuan sinar matahari kemudian digiling dan diayak. Serbuk cangkang udang ditambahkan larutan NaOH 3% dengan nisbah 1:10 (g serbuk/mL NaOH). Proses ini dilakukan pada suhu 60-70 °C sambil diaduk selama 60 menit. Endapan hasil deproteinasi disaring, dicuci dengan akuades hingga pH netral, kemudian dikeringkan.
Demineralisasi. Residu hasil deproteinasi ditambahkan dengan larutan HCl 3% pada suhu 25-30 °C dengan nisbah 1:10 (g serbuk/mL HCl) sambil diaduk selama 120 menit. Campuran disaring untuk diambil endapannya. Endapan hasil demineralisasi (kitin) dicuci dengan akuades hingga pH netral kemudian dikeringkan.
Deasetilasi. Sebanyak 50 g kitin ditimbang, kemudian ditambahkan larutan NaOH 50 % (b/v), dan digodok sambil diaduk selama 3 jam pada suhu 90-100 °C. Hasilnya yang berupa bubur (slurry)disaring, endapannya dicuci dengan akuades hingga pH netral kemudian dikeringkan. Hasilnya berupa serbuk kitosan berwarna kuning pucat.
Pencirian Kitosan
Pencirian kitosan yang dilakukan meliputi kadar air (AOAC 2006), kadar abu (AOAC 2006), dan kadar nitrogen (Kjeldahl), derajat deasetilasi ditentukan menggunakan FTIR (Hargono et al. 2008) dengan rumus sebagai berikut:
DD = 1- A1588
A1588 = absorbans pada panjang gelombang 1588 cm-1 untuk serapan gugus
amida/asetamida (CH3CONH)
A3410 = absorbans pada panjang gelombang 3410 cm-1 untuk serapan gugus
hidroksil (OH)
Viskositas relatif ηr = η/η0≈t/t0
Modifikasi Kitosan Tertaut Silang Urea-Formaldehida dan Asam Sulfat (Rao
et al 2010)
Disiapkan campuran urea-formaldehida dengan nisbah 1:2 yang diaduk menggunakan pengaduk magnet. Ke dalam campuran tersebut ditambahkan larutan kitosan 1% dalam asam asetat 2% dan ditambahkan H2SO4 1.12 M tetes
demi tetes. Bahan penaut-silang urea-formaldehida dan asam sulfat dibuat dengan nisbah mol yang tetap yakni 1:2:1. Campuran kemudian diaduk dengan pengaduk magnet hingga homogen selama 60 menit. Setelah itu, disaring dan endapan dikeringankan pada suhu 60 °C. Hasilnya dihaluskan dan adsorben siap diaplikasikan. Dibuat 3 variasi adsoben berdasarkan nisbah mol kitosan dengan bahan penaut-silang 2:1, 1:1, dan 1:2.
Optimisasi Parameter Penjerapan
Waktu. Disiapkan larutan cibacron red dengan konsentrasi 20 ppm sebanyak 50 mL. Sebanyak 0.1 g adsorben hasil modifikasi, dimasukan ke dalam larutan cibacron red lalu dikocok selama 15, 30, 60, 120, 240, 360, dan 720 menit, didekantasi, dan larutan diambil perlahan untuk dianalisis menggunakan
Spectronic 20D+ pada panjang gelombang maksimumnya. Waktu penjerapan optimum, yakni saat adsorben sudah dalam kondisi jenuh ditandai dengan kurva yang semakin landai.
Bobot. Disiapkan larutan cibacron red dengan konsentrasi 20 ppm sebanyak 50 mL. Ditimbang sebanyak 0.05, 0.1, 0.15, 0.2, 0.25, dan 0.3 g adsobren hasil modifikasi. Kemudian adsorben dimasukan ke dalam larutan
cibacron red lalu dikocok selama waktu penjerapan optimum, didekantasi, dan larutan diambil perlahan untuk dianalisis menggunakan Spectronic 20D+ pada panjang gelombang maksimumnya. Penentuan bobot optimum yakni terjadi pada perpotongan antara kurva kapasitas (Q) dan efisiensi adsorpsinya (E).
Konsentrasi. Disiapkan larutan cibacron red dengan konsentrasi 5, 10, 20, 30, 40, 50, 70, 80 ppm kemudian diukur absorpsinya dengan Spectronic 20D+ (sebagai data C0). Adsorben hasil modifikasi (2:1, 1:1 dan 1:2) ditambahkan
dengan bobot dan waktu optimum yang diperoleh ke dalam larutan cibacron red. Kapasitas adsorpsi dihitung dengan menggunakan persamaan sebagai berikut:
Q=V(Co-C)
m
Efisiensi penjerapan dihitung dengan menggunakan persamaan sebagai berikut:
E= Co-C
Penentuan Isoterm Adsorpsi Zat Warna
Pola isoterm adsorpsi diperoleh dengan membuat persamaan regresi linearnya. Isoterm adsorpsi Langmuir dilakukan dengan membuat kurva hubungan C
x/m terhadap C. Konstanta α dan ß pada persamaan isoterm Langmuir dapat ditemukan dari kurva hubungan C
x/m terhadap C dengan persamaan:
= jumlah adsorbat yang teradsorpsi per g adsorben
C = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm) α,ß = konstanta empiris
Isoterm adsorpsi Freundlich dilakukan dengan membuat kurva hubungan log x/m terhadap log C. Konstanta n dan k, diperoleh dengan persamaan:
C = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi (ppm)
k,n = konstanta empiris
Pencirian kitosan termodifikasi
Analisis Gugus Fungsi (FTIR). Sebanyak 0.5 g kitosan dicampurkan dengan KBr kemudian dibentuk menjadi pellet, setelah itu diukur serapannya menggunakan FTIR.
Penentuan Kadar N cara Kjeldhal. Sebanyak 0.1 g sampel dimasukkan ke dalam labu kjeldhal kemudian ditambahkan 2 sudip bubuk selenium dan 10 mL asam sulfat pekat kemudian, didestruksi hingga warna larutan menjadi hijau bening. Larutan kemudian ditambahkan 150 mL akuades dan 50 mL NaOH 40%, lalu dilakukan distilasi hingga diperoleh volume 125 mL larutan dalam 20 mL asam borat 2% dan indikator campuran BCG-MM. Setelah itu dititrasi dengan HCl 0.1 N. Kadar N ditentukan dengan rumus sebagai berikut:
Kadar N = V-Vblangko ×NHCl×0.014
HASIL DAN PEMBAHASAN
Kitosan Hasil Isolasi Cangkang Udang
Kitosan diisolasi dari cangkang udang melalui proses deproteinasi, demineralisasi, dan deasetilasi. Deproteinasi dilakukan menggunakan NaOH 3% dan menghasilkan rendemen sebesar 49.68%. Larutan NaOH mampu memecah ikatan hidrogen antara gugus karboksil dari protein dengan amino pada glukosamin, menghasilkan Na-proteinat yang larut. Protein dalam cangkang udang termasuk skleroprotein yang dapat larut dalam basa encer dan panas sehingga ekstraksi dengan NaOH panas akan menghasilkan filtrat protein. Proses deproteinasi berkorelasi dengan kadar N dari kitosan. Kadar N kitosan hasil isolasi sebesar 8.19%. Nilai kadar N literatur 7.06%-7.97% (No dan Meyers 1989). Kadar N menggambarkan sisa protein yang terikat yakni, protein membentuk ikatan kovalen dan kompleks yang stabil dengan kitosan pada gugus amino (No et al. 1998).
Demineralisasi menggunakan HCl 3% untuk melarutkan mineral yang terkandung dalam cangkang udang berupa CaCO3 sebagai mineral utama dan
Ca(PO4)2 dalam jumlah kecil. Mineral tersebut berikatan secara fisik pada kitin,
penggunaan HCl akan melarutkan mineral. Proses demineralisasi menghasilkan busa akibat terbentuknya gas CO2 selama reaksi berlangsung, sesuai dengan reaksi
[CaCO3 + 2HCl CaCl2 + CO2 ( ) + H2O] (No et al. 1998). Proses ini dilakukan
pada suhu kamar, penggunaan asam dengan konsentrasi tinggi menyebabkan depolimerisasi sebagian. Produk demineralisasi berupa kitin dengan rendemen sebesar 17.39%. Hasil demineralisasi berkorelasi dengan kadar abu yang merupakan parameter penting kitosan. Abu yang bersisa memengaruhi kelarutan, viskositas, dan produk akhir (No et al. 1989).
Deasetilasi kitin menggunakan NaOH 50% untuk menghidrolisis ikatan amida menghasilkan amina primer dan garam asetat. Penggunaan NaOH (40%-50%) pada 100 ºC selama 30 menit mampu menghilangkan gugus asetil pada polimer (No dan Meyers 1989). Deasetilasi pada penelitian ini menggunakan NaOH 50% pada 100 ºC selama 3 jam menghasilkan rendemen kitosan yang diperoleh sebesar 56.76% berdasarkan bobot kitin. Bobot molekul kitosan hasil isolasi, yaitu sebesar 1,34×106 gmol-1 dan telah memenuhi persyaratan kitosan komersial, yaitu 1×106 gmol-1 (Manullang 1997). Kitosan hasil isolasi memiliki kadar air dan abu berturut-turut sebesar 4.35%. dan 0.85%, serta derajat deasetilasi sebesar 91.65%. Hal ini memenuhi syarat kitosan komersial (Tabel 1).
Tabel 1 Perbandingan kitosan hasil isolasi dan komersial
Spesifikasi Hasil isolasi Komersial
Bentuk Serbuk Serpihan sampai
bubuk
Kadar air % 4.35 ≤10
Kadar abu % 0.85 ≤ 2
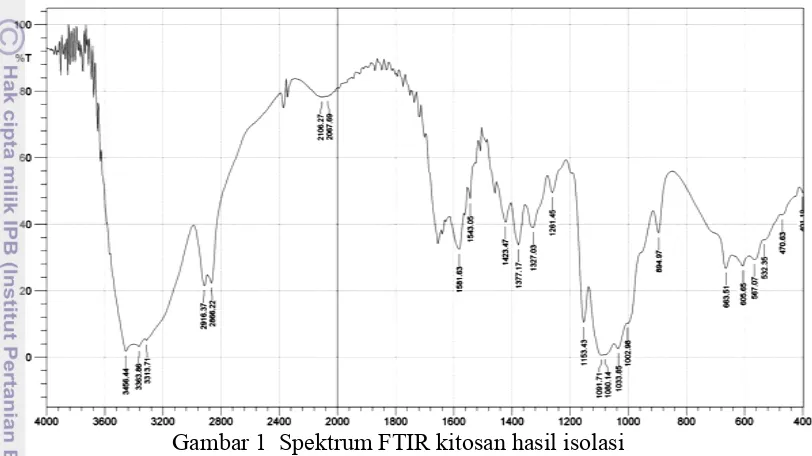
Analisis gugus fungsi menggunakan FTIR (Gambar 1), menunjukkan adanya serapan pada gugus karbonil (O=C-NHR) pada bilangan gelombang 1581.63 cm-1 dan gugus amina (-NH2) pada bilangan gelombang 1543.05 cm-1
yang merupakan ciri utama kitosan (Boonsongrit et al. 2007). Terdapat puncak serapan kuat pada bilangan gelombang 3456.44 cm-1 yang menunjukkan vibrasi regang –OH, serapan pada bilangan gelombang 3363.86 cm-1 untuk vibrasi ulur N-H dan ikatan hidrogen intermolekular pada polisakarida (Rao et al. 2010).
Gambar 1 Spektrum FTIR kitosan hasil isolasi
Kitosan Tertaut Silang Urea-Formaldehida dan Asam Sulfat
Metode modifikasi mengacu pada Rao et al, (2010), namun tidak ada penambahan bahan pencangkok yakni asam akrilamidoglikolat (AGA). Rao et al,
H2
Gambar 3 Reaksi urea-formaldehida dan asam sulfat
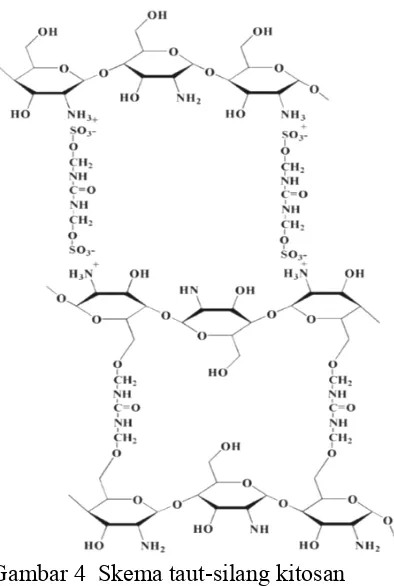
Gambar 4 Skema taut-silang kitosan
Terbentuknya ikatan taut-silang dicirikan melalui kadar N cara Kjeldahl dan analisis gugus fungsinya menggunakan FTIR. Kadar N semakin meningkat dengan meningkatnya nisbah bahan penaut-silang 2:1, 1:1, dan 1:2. Nilai kadar N digunakan untuk melihat adanya reaksi sebelum dan setelah modifikasi. Gambar 5 menunjukkan bahwa terdapat perbedaan antara kadar N teoritis dengan hasil analisis.
Gambar 5 Kadar N hasil teori dan analisis Kjeldahl
Analisis gugus fungsi kitosan termodifikasi dengan FTIR (Gambar 6) memperlihatkan puncak pada daerah serapan di sekitar 1200-1500 cm-1 yang merupakan serapan kuat gugus -CH2, dan adanya serapan pada 1120-1130 cm-1
yang menunjukkan terbentuknya ikatan ionik antara kitosan dengan rantai samping, yaitu +NH3-OSO3-. Serapan pada bilangan gelombang 896.33 cm-1
menunjukkan puncak C-O-S yang merupakan ikatan taut-silang antara HOSO3
-dengan metilolurea (Rao et al. 2010). Adanya gugus sulfat -SO4-2 ditandai
munculnya serapan pada daerah bilangan gelombang 1383.92 cm-1 dan gugus ester sulfat O=S=O pada daerah bilangan gelombang 1210-1260 cm-1 (Tuvikene
et al. 2006). Analisis gugus fungsi membuktikan telah terbentuk ikatan taut-silang antara bahan penaut-silang dengan kitosan.
Gambar 6 Spektrum FTIR kitosan tertaut-silang urea-formaldehida dan asam sulfat
Aplikasi Adsorben Termodifikasi terhadap Cibacron Red
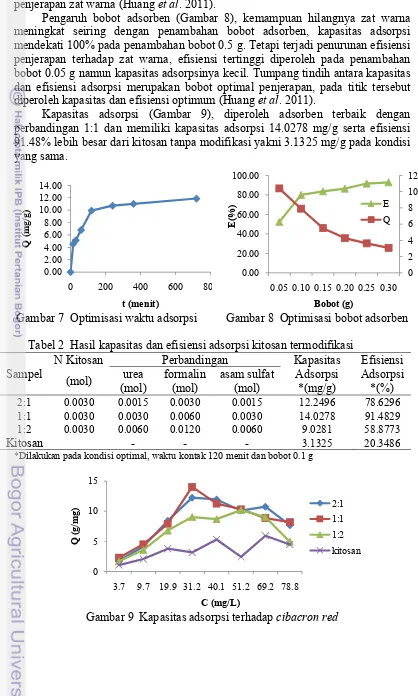
Optimisasi waktu dan bobot adsorben diperoleh pada 120 menit dengan bobot 0.1 g. Pengaruh lama waktu penjerapan terhadap cibacron red, (Gambar 7) terjadi peningkatan kapasitas adsorpsi yang sangat cepat pada 60 menit kemudian mulai terjadi peningkatan kapasitas adsorpsi yang tidak signifikan.
0 5 10 15
2:1 1:1 1:2
Kadar N
(%
)
analisis
Kesetimbangan adsorpsi terjadi setelah 120 menit ditandai dengan tidak adanya penambahan kapasitas adsorpsi yang signifikan. Kondisi ini sesuai untuk penjerapan zat warna (Huang et al. 2011).
Pengaruh bobot adsorben (Gambar 8), kemampuan hilangnya zat warna meningkat seiring dengan penambahan bobot adsorben, kapasitas adsorpsi mendekati 100% pada penambahan bobot 0.5 g. Tetapi terjadi penurunan efisiensi penjerapan terhadap zat warna, efisiensi tertinggi diperoleh pada penambahan bobot 0.05 g namun kapasitas adsorpsinya kecil. Tumpang tindih antara kapasitas dan efisiensi adsorpsi merupakan bobot optimal penjerapan, pada titik tersebut diperoleh kapasitas dan efisiensi optimum (Huang et al. 2011).
Kapasitas adsorpsi (Gambar 9), diperoleh adsorben terbaik dengan perbandingan 1:1 dan memiliki kapasitas adsorpsi 14.0278 mg/g serta efisiensi 91.48% lebih besar dari kitosan tanpa modifikasi yakni 3.1325 mg/g pada kondisi yang sama.
Gambar 7 Optimisasi waktu adsorpsi Gambar 8 Optimisasi bobot adsorben Tabel 2 Hasil kapasitas dan efisiensi adsorpsi kitosan termodifikasi
Sampel
N Kitosan Perbandingan Kapasitas Efisiensi (mol) urea
2:1 0.0030 0.0015 0.0030 0.0015 12.2496 78.6296
1:1 0.0030 0.0030 0.0060 0.0030 14.0278 91.4829
1:2 0.0030 0.0060 0.0120 0.0060 9.0281 58.8773
Kitosan - - - 3.1325 20.3486
*Dilakukan pada kondisi optimal, waktu kontak 120 menit dan bobot 0.1 g
Gambar 9 Kapasitas adsorpsi terhadap cibacron red
0.00
0.05 0.10 0.15 0.20 0.25 0.30
Isoterm Adsorpsi
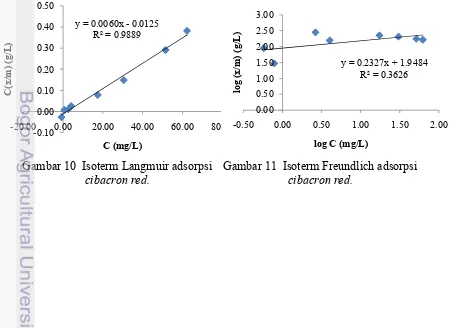
Tipe isoterm cibacron red menggunakan adsorben kitosan termodifikasi (Gambar 10 dan 11), linearitas tipe isoterm Langmuir sebesar 98.89% dan tipe isoterm Freundlich sebesar 36.26%. Berdasarkan linearitasnya maka diperoleh
cibacron red mengikuti tipe isoterm Langmuir. Isoterm Langmuir adsorpsinya berlangsung secara kimisorpsi satu lapisan. Kimisorpsi merupakan adsorpsi yang terjadi melalui ikatan kimia yang sangat kuat antara sisi aktif permukaan dengan molekul adsorbat. Adsorpsi satu lapisan terjadi karena ikatan kimia biasanya bersifat spesifik, sehingga permukaan adsorben dapat mengikat adsorbat dengan ikatan kimia (Atkins 1999).
Beberapa tipe isoterm kitosan termodifikasi yakni kitosan tertaut silang etilenadiamina (EDA) mengikuti tipe isoterm Langmuir, yang menunjukkan penjerapan pada daerah satu lapisan permukaan dengan daerah pengadsorpsi yang terdistribusi secara homogen pada permukaan adsorben. Kapasitas adsorpsi maksimum yakni 294.12 mg/g pada 25 °C dengan nilai koefisien korelasi yang lebih dari 0.99 (Huang et al. 2011). Kitosan tertaut silang epiklorohidrin mengikuti tipe isoterm Langmuir dengan nilai β sebesar 0.125 dan koefisien korelasi 0.999 (Chiou et al. 2003). Kitosan dibentuk menjadi garam kuarterner dan tertaut silang dengan glutaraldehida juga mengikuti tipe isoterm Langmuir dengan orde kedua semu (Rosa et al. 2008).
Nilai konstanta dapat dihitung dari persamaan regresi Langmuir dan Freundlich. Nilai α menggambarkan jumlah yang dijerap atau kapasitas adsorpsi untuk membentuk lapisan sempurna pada permukaan adsorben. Persamaan regresi Langmuir yang diperoleh nilai α sebesar 166.66 yang menggambarkan jumlah yang dijerap atau kapasitas adsorpsi untuk membentuk lapisan sempurna pada permukaan adsorben. Nilai β sebesar 0.4802 menggambarkan kekuatan ikatan molekul adsorbat dengan permukaan adsorben.
Gambar 10 Isoterm Langmuir adsorpsi
cibacron red.
Gambar 11 Isoterm Freundlich adsorpsi
cibacron red.
-20.00 0.00 20.00 40.00 60.00 80
C(x/m) (g/L)
-0.50 0.00 0.50 1.00 1.50 2.00
log (x/m) (g/L)
SIMPULAN DAN SARAN
Simpulan
Modifikasi kitosan tertaut silang urea-formaldehida dan asam sulfat terbukti meningkatkan kapasitas dan efisiensi adsorpsi terhadap cibacron red.
Kemampuan adsorpsi optimum pada 120 menit dan bobot 0.1 g. dengan kapasitas dan efisiensi terbesar yakni, 14.0278 mg/g dan 91.48% dengan rasio 1:1. Isoterm yang berlaku pada penelitian ini yaitu mengikuti tipe isoterm Langmuir dengan nilai α, β, n, dan k berturut-turut sebesar 166.66, 0.4802, 4.2974 dan 88.797.
Saran
Penelitian lanjutan perlu dilakukan pengujian derajat taut-silang untuk meyakinkan terbentuknya ikatan taut-silang antara kitosan dengan urea-formaldehida dan asam sulfat. Optimisasi variasi perbandingan antara bahan penaut-silang perlu dilakukan yakni urea: formaldehida: asam sulfat untuk memeroleh perbandingan yang terbaik.
DAFTAR PUSTAKA
Arifin Z, Irawan D, Rahim M, Ramantiya F. 2012. Adsorption of Direct Black 38 Dye by Using Chitosan Isolated from Shrimp Waste of Mahakam Delta.
Jurnal Sains dan Terapan 6:35-45.
Astuti P. 2007. Adsobsi Limbah Zat Warna Tekstil Jenis Procion Red MX 8B oleh Kitosan Sulfat Hasil Deasetilasi Kitin Cangkang Bekicot (Achatina fullica) [skripsi]. Surakarta: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret.
Atkins PW. 1999. Kimia Fisik Jilid II Kartohadiprodo I, penerjemah. Rohadyan T, Hadiyana K, editor. Jakarta: Erlangga. Terjemahan dari: Physical Chemistry. AOAC. 2006. Official Methods of Analysis of AOAC International. 5th Revision. Volume 2. Cunnif P, editor. Maryland: AOAC International.
Boonsongrit Y, Mueller BW, dan Mitrevej A. 2007. Characterization of drug– chitosan interaction by 1H NMR, FTIR and isothermal titration calorimetry.
EuropeanJ of Pharmaceutics and Biopharmaceutics 69:388-395.
BRKP. 2006. Badan Riset Kelautan dan Perikanan. Jakarta: Departemen Kelautan dan Perikanan.
[Ciba] Specialty Chemicals Indonesia. 2002. Cibacron red B-E. [terhubung berkala].http://agrippina.bcs.deakin.edu.au/bcs_admin/msds/msds_docs/Cibac ron%20Red%20B-E.pdf [15 Mei 2012].
Chiou MS, Kuo WS, Li HY. 2003. Removal or reactive dye from wastewater by adsorption using ECH cross-linked chitosan beads as medium. J of Environ
Sci and Health. Vol.A38:2621-2631.
Hargono, Abdullah, Sumantri I. 2008. Pembuatan kitosan dari limbah cangkang udang serta aplikasinya dalam mereduksi kolesterol lemak kambing. Reaktor. Vol.12:53-57.
Huang XY, Binb JP, Buc HT, Jianga GB, Zengd MH. 2011. Removal of anionic dye eosin Y from aqueous solution using ethylenediamine modified chitosan. J Carbohydrate Polymers. 84:1350–1356
Manullang EH. 1997. Optimasi proses pembuatan kitin dari limbah udang (Penaid sp) dengan menggunakan bahan teknis [skripsi]. Bogor. Fakultas Perikanan, Institut Pertanian Bogor.
No. HK, Meyers SP. 1989. Crawfish Chitosan as a Coagulant in Recovery of Organic Compounds from Seafood Processing Streams. J Agric Food Chem.
Vol.3 37:580-583.
No HK, Samuel PM, Lee KS (1989) Isolation and characterization of chitin from crawfish shell waste. J Agric and Food Chem. Vol.3 37:575.
Prashanth KVH, Tharanathan RN. 2007. Chitin/Chitosan Modifications and Their Unlimited Application Potential-An Overview. Food SciTech. 18:117-131 [PPRI]. 2001. Peraturah Pemerintah Republik Indonesia Nomor 82 Tentang
Pengelolaan Kualitas Air dan Pengendalian Pencemaran Air. Jakarta: PPRI. Rao KKSV, Rao KM, Kumar PVN, Chung Il-Doo. 2010. Novel chitosan-based pH sensitive micro-networks for the controlled released of 5-Fluorouracil.
Iranian Polymer J. 19:265-276.
Rosa S, Laranjeira MCM, Riela HG, Fávre VT. 2008. Cross-linked quarternary chitosan as an adsorbent for the removal of reactive dye from aqueous solution.
J of Hazardous Materials. 155:253-260.
Susanti A. 2009. Potensi kulit kacang tanah sebagai adsorben zat warna reaktif
cibacron red [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut PertanianBogor.
Tuvikene R, Truus K, Vaher M, Kailas T, Martin G, Kersen P. 2006. Extraction and quantification of hybrid carrageenans from the biomass of the red algae
Lampiran 1 Bagan alir penelitian
Deproteinasi
Demineralisasi
Deasetilasi
Analisis Proksimat
Kadar Air Kadar Abu Derajat Deasetilasi Bobot Molekul Isolasi Kitin
Modifikasi Kitosan
Kadar N FTIR Optimisasi Kapasitas Adsorpsi Isoterm
Analisis Data Preparasi Kulit Udang
Lampiran 2 Rendemen kitin dan kitosan hasil isolasi Hasil deproteinasi kulit udang dengan NaOH 3% (1:20) Bobot kulit udang kering = 500.1511 g Bobot sampel setelah deproteinasi = 248.4734 g Rendemen = Bobot sampel hasil deproteinasi
Bobot kulit udang kering ×100% =248.4734 g
500.1511 g×100%
= 49.68%
Hasil demineralisasi kulit udang dengan HCl 4% (1:10) Bobot sampel hasil deproteinasi = 467.6026 g
Bobot sampel setelah demineralisasi = 81.3161 g Rendemen = Bobot sampel hasil demineralisasi
Bobot kulit udang hasil deproteinasi×100% = 81.3161 g
467.6026 g×100%
= 17.39%
Hasil deasetilasi kitin dengan NaOH 50% (1:10) Bobot sampel hasil demineralisasi = 56.8235 g Bobot sampel setelah deasetilasi = 32.2536 g Rendemen = Bobot sampel hasil deasetilasi
Bobot kitin ×100% = 32.2536 g
56.8235 g×100%
= 56.76%
Lampiran 3 Analisis proksimat kitosan hasil isolasi Penentuan kadar air (AOAC 2006)
Penentuan kadar abu (AOAC 2006)
Kadar abu = 100%
Ulangan 1
Kadar abu = 100%
= 100%
= 0.85%
Ulangan 2
Kadar abu = 100%
= 100%
= 0.85%
Kadar abu =
= 0.85%
Lampiran 4 Penentuan derajat deasetilasi Data puncak serapan FTIR kitosan
DD = - × 100%
= - × 100%
= 91.65%
Keterangan:
A = log (P0/P) absorbans
A1588 =Absorbans pada panjang gelombang 1588 cm-1 untuk serapan gugus
amida/asetamida (CH3CONH)
A3410 =Absorbans pada panjang gelombang 3410 cm-1 untuk serapan gugus
Lampiran 5 Penetuan bobot molekul
Penentuan laju alir larutan kitosan dalam asam asetat 1%
Larutan Ulangan Laju alir
1 2 3 δ (detik)
asam asetat 1% 74.30 74.41 74.57 74.43
0.01% 88.21 88.18 88.19 88.19
0.02% 107.22 107.38 107.33 107.31
0.03% 125.53 125.74 125.98 125.75
0.04% 144.51 144.45 144.97 144.64
Penentuan viskositas larutan polimer dalam asam asetat 1% C (g/ml) Rerata δ Η ηsp ηred
0.0000 74.43 1.0000 0.0000 -
0.0002 88.19 1.1849 0.1849 924.3585
0.0004 107.31 1.4418 0.4418 1104.3934
0.0006 125.75 1.6895 0.6895 1149.1782
0.0008 144.64 1.9433 0.9433 1179.1280
Grafik hubungan konsentrasi larutan kitosan dalam asam asetat 1% dengan ηred
K = 111.5 mL/g
α = 0.147 [η] = KMvα
886.9911 = 111.5 mL/g Mv0.147 M = 1.339.160,459 g/mol M = 1.34 ×106 g/mol
y = 404,546.7777x + 886.9911 R² = 0.8374
0.0000 200.0000 400.0000 600.0000 800.0000 1000.0000 1200.0000 1400.0000
0.0000 0.0002 0.0004 0.0006 0.0008 0.0010
ηred
Lampiran 6 Penentuan kadar asam sulfat teknis Standardisasi NaOH
Ulangan Volume (COOH)2 [NaOH] N awal akhir terpakai
1 10.20 20.10 9.90 1.0109
awal akhir terpakai
Lampiran 7 Penentuan kadar N kitosan termodifikasi Kadar N dalam Urea
Ulangan Volume HCl Kadar N
bobot sampel ×100% = 31.6-0.05 ×0.1022×0.014
0.1037 ×100%
= 43.53%
Kadar N kitosan termodifikasi dan teoritis
Perbandingan Volume HCl Kadar N %
mol/mol awal akhir terpakai Analisis Teoritis
2:1 6.4 9.55 3.15 4.33 3.99
1:1 3.4 7.2 3.8 5.14 5.83
1:2 14.2 20.9 6.7 7.49 11.45
Contoh Perhitungan
Kadar N (2:1) = V-Vblangko ×NHCl×0.014
bobot sampel ×100% = 3.15-0.05 ×0.1002×0.014
0.1005 ×100%
= 4.33%
Kadar N teoritis hasil modifikasi kitosan tertaut silang urea-formaldehida dan asam sulfat
Kadar N kitosan = 8.19% Kadar N urea = 43.49% Perbandingan 1:1
Bobot kitosan = 0.5000 g Bobot urea = 0.174 g
Bobot hasil termodifikasi = 0.6047 g Kadar N kitosan Total kadar N teoritis
Lampiran 8 Data absorbansi pada pembuatan kurva standar cibacron red
Kurva hubungan konsentrasi (ppm) dan absorbansi cibacron red
Lampiran 9 Penentuan penjerapan optimum Penentuan waktu penjerapan optimum
t Bobot A Q (mg/g) E (%)
Penentuan bobot penjerapan optimum
Bobot (g) A Q (mg/g) E (%)
0.0502 0.1385 10.3968 52.19 0.1013 0.0706 7.8987 80.01 0.1518 0.0618 5.5076 83.60 0.2012 0.0552 4.2903 86.32 0.2517 0.0422 3.6405 91.63 0.3010 0.0391 3.0875 92.93
Lampiran 10 Data kapasitas adsorpsi terhadap cibacron red
C (mg/L) Kapasitas adsorpsi (mg/g)
2:1 1:1 1:2 Kitosan
3.7481 1.752819 2.271785 1.653949 1.03052
9.7100 4.127682 4.491058 3.553059 2.052358
19.8853 8.391799 7.897792 6.772374 3.748998
31.1889 12.24961 14.02778 9.028109 3.132527
40.1352 11.94702 11.2589 8.673603 5.27449
51.1550 10.08228 10.30944 10.17011 2.400383
69.2345 10.73907 8.845657 9.010902 5.896528
C (mg/L) m (g) A c x x/m c/(x/m) log c log x/m c c/(x/m) log c log x/m
3.7481 0.1001 0.0097 -0.9950 2.7531 27.5036 -0.0362 -0.0022 1.4394
3.7481 0.1001 0.0123 -0.7759 2.9722 29.6921 -0.0261 -0.1102 1.4726 -0.8000 -0.0275 -0.1046 1.4685 3.7481 0.1001 0.0141 -0.6291 3.1190 31.1586 -0.0202 -0.2013 1.4936
9.7100 0.1015 0.0306 0.7200 8.9900 88.5714 0.0081 -0.1427 1.9473
9.7100 0.1015 0.0269 0.4157 9.2943 91.5690 0.0045 -0.3812 1.9617 0.5932 0.0066 -0.2384 1.9533
9.7100 0.1015 0.0297 0.6437 9.0663 89.3232 0.0072 -0.1913 1.9510
19.8853 0.1004 0.0706 3.9984 15.8869 158.2356 0.0253 0.6019 2.1993
19.8853 0.1004 0.0726 4.1664 15.7189 156.5631 0.0266 0.6198 2.1947 4.0265 0.0255 0.6048 2.1985
19.8853 0.1004 0.0696 3.9148 15.9705 159.0689 0.0246 0.5927 2.2016 31.1889 0.1017 0.0545 2.6829 28.5060 280.2950 0.0096 0.4286 2.4476
31.1889 0.1017 0.0565 2.8447 28.3442 278.7039 0.0102 0.4540 2.4451 2.6564 0.0095 0.4234 2.4480
31.1889 0.1017 0.0516 2.4416 28.7473 282.6680 0.0086 0.3877 2.4513 40.1352 0.1009 0.2248 16.6356 23.4996 232.9004 0.0714 1.2210 2.3672
40.1352 0.1009 0.2518 18.8534 21.2818 210.9193 0.0894 1.2754 2.3241 17.4147 0.0777 1.2402 2.3521
40.1352 0.1009 0.2262 16.7552 23.3800 231.7145 0.0723 1.2241 2.3650 51.1550 0.1000 0.3915 30.3011 20.8539 208.5386 0.1453 1.4815 2.3192
51.1550 0.1000 0.3958 30.6536 20.5014 205.0140 0.1495 1.4865 2.3118 30.5361 0.1481 1.4848 2.3143
51.1550 0.1000 0.3958 30.6536 20.5014 205.0140 0.1495 1.4865 2.3118 69.2345 0.1004 0.6459 51.1550 18.0795 180.0742 0.2841 1.7089 2.2555
69.2345 0.1004 0.6536 51.7907 17.4438 173.7426 0.2981 1.7143 2.2399 51.4724 0.2910 1.7116 2.2477
69.2345 0.1004 0.6498 51.4715 17.7630 176.9226 0.2909 1.7116 2.2478 78.7842 0.1007 0.7696 61.2911 17.4931 173.7153 0.3528 1.7874 2.2398
78.7842 0.1007 0.7959 63.4492 15.3350 152.2842 0.4166 1.8024 2.1827 62.2930 0.3818 1.7944 2.2136
78.7842 0.1007 0.7799 62.1387 16.6455 165.2981 0.3759 1.7934 2.2183
Persamaan garis isoterm Langmuir yang diperoleh y = 0.0060x – 0.0125 dengan r2= 0.9889 maka dari persamaan C
x/m= 1
α ß + 1
α C , diperoleh nilai α= 166.66 dan β= 0.4802
Persamaan garis isoterm Freundlich yang diperoleh y = 1.9484 + 0.2327x dengan r2= 0.3626 maka dari persamaan log x
m=logk+ 1
n log C , diperoleh nilai n = 4.2974 dan k = 88.797