KITINASE DARI
Beauveria bassiana
NUNI LAWATI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pemurnian Parsial dan Karaterisasi Enzim Kitinase dari Beauveria bassiana adalah besar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan tercantum dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2013
ABSTRAK
NUNI LAWATI. Pemurnian Parsial dan Karakterisasi Enzim Kitinase dari Beauveria bassiana. Dibimbing oleh EMAN KUSTAMAN dan YADI SURYADI.
Beauveria bassiana merupakan cendawan entomopatogen yang memproduksi enzim kitinase saat menginfeksi inangnya. Tujuan penelitian ini adalah melakukan pemurnian parsial dan mengkarakterisasi enzim kitinase dari isolat Beauveria bassiana. Hasil uji aktivitas kitinase secara kualitatif menunjukkan bahwa Beauveria bassiana memproduksi enzim kitinase ekstraselular dengan indeks kitinolitik 1.035. Tahap pemurnian dengan pengendapan garam amonium sulfat menghasilkan tingkat kemurnian 1.2 kali dibandingkan ekstrak kasar enzim dan tahap pemurnian dengan dialisis dapat meningkatkan kemurnian enzim hingga 1.9 kali dibandingkan ekstrak kasar. Hasil uji karakterisasi menunjukkan enzim kitinase memiliki pH optimum 4, suhu optimum 50oC, waktu inkubasi optimum 90 menit, penambahan ion logam Mn2+ bersifat sebagai aktivator, serta enzim kitinase Beauveria bassiana memiliki nilai Km sebesar 0.225 mg/L dan Vmaks sebesar 0.069 mg/L detik. Enzim kitinase dari
Beauveria bassiana memiliki bobot molekul 60.255 kDa.
Kata Kunci : Beauveria bassiana, kitinase, pemurnian parsial, dan karakterisasi enzim.
ABSTRACT
NUNI LAWATI. Partial Purification and Characterization of Chitinase Enzyme from Beauveria bassiana. Supervised by EMAN KUSTAMAN and YADI SURYADI.
Beauveria bassiana si an entomopathogenic fungus that produces chitinase enzyme when infecting its host. The purpose of this study was to perform partial purification and characterization of chitinase enzyme from Beauveria bassiana. The result activity chitinase enzyme of qualitative assay shown that Beauveria bassiana produced ekstracelluler chitinase enzyme with chitinolytic index of 1.035. Purification with ammonium sulfate precipitation produce purity level by 1.2 times than the crude enzyme extract and purification with dialisis techniques can increased the purity of enzim by 1.9 times than the crude enzyme extract. The result of characterization assays shown that chitinase enzyme had an optimum activity of pH 4, temperature 50oC, incubation time 90 minutes, the addition of metal ions Mn2 + served as activators, and chitinase enzyme from Beauveria bassiana had Km of 0.225 mg/L and Vmax of 0.069 mg/L sec. Chitinase enzyme
from Beauveria bassiana had a molecular weight at 60.255 kDa.
PEMURNIAN PARSIAL DAN KARAKTERISASI ENZIM
KITINASE DARI
Beauveria bassiana
NUNI LAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pemurnian Parsial dan Karakterisasi Enzim Kitinase dari Beauveria bassiana.
Nama : Nuni Lawati NIM : G84080055
Disetujui Komisi Pembimbing
Ir. Eman Kustaman Ketua
Ir. Yadi Suryadi, M.Sc Anggota
Diketahui
Dr. Ir. I Made Artika, M.App. Sc Ketua Departemen Biokimia
PRAKATA
Alhamdulilahirabil alamin, puja dan puji syukur penulis panjatkan kepada Allah SWT dan Nabi Muhammad SAW yang telah memberikan rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah ini disusun berdasarkan hasil penelitian yang telah dilaksanakan dari bulan Februari 2012 sampai dengan bulan Juni 2012 di Laboratorium Mikrobiologi, BB Biogen, Cimanggu-Bogor dengan judul Pemurnian Parsial dan Karakterisasi Enzim Kitinase dari Beauveria bassiana.
Penulis mengucapkan terimakasih kepada Ir. Eman Kustaman selaku pembimbing utama di Departemen Biokimia atas segala bimbingan dan arahan dalam penyusunan karya ilmiah ini. Terimakasih kepada Ir. Yadi Suryadi, M.Sc selaku pembimbing kedua di Balai Besar Biogen atas segala bimbingan, arahan, dan fasilitas selama penelitian. Ucapan terimakasih pula saya berikan kepada kedua orang tua saya yaitu Bapak Alam dan Ibu Surpi atas doa, motivasi, dan kasih sayang mereka yang tidak terputus. Terimakasih kepada Kakak Anah, Kakak Nur Badriyah, Mas Anjar Bayu Diyono, Anis Lestari, Nindy Aziz, dan Wulan Widianti atas bantuan dan motivasi kepada penulis.
Penulis juga mengucapkan terimakasih kepada Ibu Susi, Ibu Aminah, Bapak Jajang, dan Mas Alam sebagai Staf Laboratorium Mikrobiologi Balai Besar Biogen atas bantuan penggunaan alat selama penelitian berlangsung. Semoga karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, April 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis Penelitian 2
METODE PENELITIAN 3
Bahan 3
Alat 3
Waktu Penelitian dan Lokasi Penelitian 3
Prosedur Penelitian 3
HASIL DAN PEMBAHASAN 7
Indeks Kitinolitik Enzim Kitinase dari Beauveria bassiana 7
Hasil Pemurnian Enzim Kitinase Secara Parsial 9
Karakter Enzim Kitinase 12
Bobot Molekul Enzim Kitinase dari Beauveria bassiana 18
SIMPULAN DAN SARAN 19
Simpulan 19
Saran 20
DAFTAR PUSTAKA 20
LAMPIRAN 23
DAFTAR TABEL
1 Komposisi gel SDS-PAGE 6
2 Pemurnian enzim kitinase Beauveria bassiana 11
DAFTAR GAMBAR
1 Hasil uji kualitatif aktivitas kitinase isolat Beauveria bassiana 8 2 Hasil peremajaan Beauveria bassiana pada media PDA 9 3 Pengendapan ekstrak kasar kitinase pada variasi konsentrasi amonium
sulfat 10
4 Pengaruh pH terhadap aktivitas enzim kitinase 13 5 Hasil pengaruh suhu terhadap aktivitas enzim kitinase 14 6 Hasil stabilitas waktu inkubasi terhadap aktivitas enzim kitinase 16 7 Hasil pengujian pengaruh ion logam terhadap aktivitas enzim kitinase 17
8 Kurva double reciprocal Lineawever-Burk 18
9 Elektroforegram SDS-PAGE 18
DAFTAR LAMPIRAN
1 Strategi penelitian 23
2 Aktivitas kitinolitik Beauveria bassiana (Mubarik et al 2010) 24 3 Hasil uji aktivitas kitinase pada perlakuan dengan pengendapan garam
amonium sulfat 25
4 Hasil analisis statistik pengaruh konsentrasi amonium sulfat 25 5 Pengukuran aktivitas kitinase Modifikasi Spindler (Toharisman et al
2005) 27
6 Pengukuran kadar protein (Bradford 1976) 29
7 Karakterisasi kitinase berdasarkan pH 30
8 Hasil analisis statistik pengaruh pH 30
9 Karakteristik kitinase berdasarkan suhu 32
10 Hasil analisis statistik pengaruh suhu 32
11 Karakterisasi kitinase berdasarkan waktu inkubasi 34 12 Hasil analisis statistik pengaruh waktu inkubasi 34 13 Karakterisasi kitinase berdasarkan pengaruh ion logam 35 14 Hasil analisis statistik pengaruh ion logam 35
15 Kinetika enzim 37
Latar Belakang
Indonesia merupakan negara dengan tingkat megabiodiversitas yang tinggi. Hal ini dapat dilihat dari banyaknya keragaman lingkungan dengan berbagai jenis mikroorganisme sebagai sumber enzim. Pencarian isolat mikroorganisme sebagai sumber enzim bernilai ekonomi tinggi terus dilakukan hingga saat ini. Salah satu jenis enzim yang memiliki nilai ekonomi tinggi yaitu enzim kitinase. Enzim kitinase mampu menghidrolisis ikatan β-1,4-asetamido-2-deoksi-D-glikosida pada kitin dan oligomer kitin (Bielka et al 1984). Enzim ini dapat diperoleh dari berbagai makhluk hidup, seperti bakteri, hewan vertebrata, moluska, artropoda, tumbuhan, alga, dan beberapa jenis cendawan tertentu.
Polimer kitin tersusun atas unit N-asetil-D-glukosamin dengan ikatan β(1,4). Senyawa kitin di alam jumlahnya sangat berlimpah, karena senyawa ini merupakan komponen penyusun dari berbagai organisme, seperti bakteri, hewan vertebrata, moluska, artropoda, tumbuhan, alga, dan beberapa jenis cendawan tertentu, sehingga senyawa ini diproduksi secara terus menerus dan berpotensi besar untuk diuraikan menjadi produk akhir yang lebih bermanfaat. Pada umumnya hidrolisis kitin dilakukan secara kimiawi dengan menggunakan asam pekat HCl pada suhu tinggi, namun metode ini kurang ramah lingkungan karena bahan kimia yang digunakan untuk menghidrolisis kitin lebih banyak serta tidak spesifik sehingga produk kitooligomer yang dihasilkan lebih sedikit dan umumnya jenis produk kitooligomer yang banyak dihasilkan adalah D-glukosamin.
Penggunaan enzim dalam menghidrolisis polimer kitin lebih dikembangkan dibandingkan dengan menggunakan cara kimia, karena menggunaan enzim dalam menghidrolisis polimer kitin lebih spesifik dalam menghasilkan produk serta tidak memiliki hasil samping yang dapat mengakibatkan pencemaran lingkungan. Enzim kitinase menghasilkan produk hasil hidrolisis polimer kitin berupa monomer N-asetil-D-glukosamin. Monomer ini telah banyak dimanfaatkan terutama dalam bidang medis yang dimanfaatkan untuk mengobati penyakit autoimun disease, ditambahkan pada produk kosmetik karena N-asetil-D-glukosamin memiliki aktivitas antipenuaan, serta sebagai bahan tambahan dalam produk susu karena senyawa N-asetil-D-glukosamin bersifat manis dan stabil (Patil et al 2000).
menginfeksi inangnya. Enzim kitinase menghidrolisis senyawa polimer kitin pada dinding sel serangga, sehingga dinding sel patah dan rusak. Proses kerusakan dinding sel dilanjutkan dengan pembentukan miselium yang akan membungkus tubuh serangga (Prayogo 2006).
Penelitian virulensi Beauveria bassiana terhadap organisme pengganggu tanaman (OPT) sudah banyak dilakukan. Salah satunya penelitian yang telah dilakukan oleh Indriyati (2009), cendawan ini dapat menimbulkan kematian pada kutu daun dan kepik hijau masing-masing 78.8% dan 76%. Penelitian terhadap enzim kitinase yang diproduksi oleh Beauveria bassiana belum banyak dilakukan, sehingga mendorong untuk dilakukan penelitian lebih lanjut terhadap enzim kitinase yang diproduksi oleh isolat ini.
Rumusan Masalah
Timbulnya kekhawatiran akan pencemaran lingkungan yang disebabkan hasil samping dari penggunaan bahan kimia dalam menghidrolisis polimer kitin, mendorong untuk dilakukannya pencariaan isolat yang menghasilkan enzim pendegradasi polimer kitin. Beauveria bassiana merupakan salah satu jenis cendawan entomopatogen yang telah lama diaplikasikan sebagai agen pengendali hama serangga. Isolat Beauveria bassiana akan mengeluarkan enzim kitinase pada saat menginfeksi inangnya serta pengujian virulensi Beauveria bassiana terhadap organisme pengganggu tanaman telah banyak dilakukan sehingga mendorong untuk dilakukan penelitian lanjutan akan potensi enzim kitinase yang diproduksinya.
Tujuan Penelitian
Penelitian ini bertujuan melakukan pemurnian enzim kitinase secara parsial dan mengkarakterisasi enzim kitinase dari isolat Beauveria bassiana dengan menganalisa aktivitas optimalnya pada beberapa uji karakterisasi.
Manfaat Penelitian
Manfaat penelitian ini adalah memberi informasi ilmiah mengenai potensi Beauveria bassiana sebagai penghasil enzim kitinase ekstraseluler, memberikan informasi pemurnian optimal enzim kitinase, dan memberikan data mengenai karakteristik enzim kitinase yang diproduksinya.
Hipotesis Penelitian
METODE PENELITIAN
Bahan
Bahan-bahan yang digunakan dalam penelitian adalah biakan Beauveria bassiana koleksi Laboratorium Mikrobiologi BB Biogen asal Sukamandi-Jawa Barat, kentang, dextrose, bacto agar, kitin, HCl pekat, NaOH, akuades, N-asetil-D-glukosamin, NaCl, NH4Cl, MgSO4.7H2O, K2HPO4, CaCl2, Na2HPO4.2H2O,
(NH4)2SO4, bufer sitrat fosfat pH 3-7, bufer glisin-NaOH pH 8-10, bufer fosfat pH
7, reagen Schales, reagen Bradford, serum bovine albumin, kantong selofan, EDTA, KCl, MnCl2, MgCl2, CuSO4, FeSO4, ZnCl2, Akrilamida, bis akrilamida,
Tris HCl, sodium dedocyll sulphates (SDS), Amonium persulfat (APS), tetrametiletilendiamina (TEMED), biru bromoferol, perak nitrat (AgNO3), dan
marker spectra multicolour broad range protein ladder.
Alat
Alat-alat yang digunakan adalah beberapa peralatan gelas, magnetic stirrer, penangas air, vorteks, inkubator bergoyang, neraca analitik, pipet mikro, autoklaf, tabung Eppendorf, botol semprot, laminar air flow cabinet, lemari pendingin, spektrofotometer UV-Vis, pH meter, sentrifugasi, dan elektroforesis.
Waktu Penelitian dan Lokasi Penelitian
Penelitian ini dilaksanakan mulai bulan Februari 2012 sampai bulan Juni 2012 di Laboratorium Mikrobiologi Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Cimanggu-Bogor.
Prosedur Penelitian
Penelitian yang dilakukan meliputi melakukan teknik pemurnian enzim secara parsial yaitu pengendapan protein dengan garam amonium sulfat pada tingkat kejenuhan 0, 10, 30, 50, hingga 70% dan teknik dialisis dengan membran selofan. Tiap tingkat kejenuhan garam amonium sulfat ditentukan aktivitas kitinase dan sampel yang memiliki aktivitas kitinase tinggi digunakan untuk perlakuan pemurnian selanjutnya. Setiap tahap ditentukan tingkat kemurniannya. Sampel kitinase dikarakterisasi aktivitas berdasarkan pH, suhu, stabilitas waktu inkubasi, pengaruh penambahan ion logam, dan kinetika enzim. Selanjutnya enzim kitinase ditentukan berat molekulnya dengan menggunakan elektroforesis SDS-PAGE. Adapun strategi penelitian disajikan dalam Lampiran 1.
Peremajaan dan Produksi Enzim Kitinase
bassiana dari stok agar miring yang diletakkan pada bagian tengah cawan Petri. Cawan Petri diinkubasi pada suhu ruang selama 7 hari.
Sebanyak dua cockborer kultur padat Beauveria bassiana diinokulasikan dalam 20 ml media kitin cair. Media kitin cair dibuat dengan mencampurkan 125 ml koloidal kitin 0.3%, 0.65 gram Na2HPO4.2H2O, 1.5 gram KH2PO4, 0.25 gram
NaCl, 0.5 gram NH4Cl, 0.12 gram MgSO4.7H2O dan 0.005 gram CaCl2 dilarutkan
dalam akuades hingga volume satu liter. Kultur diinkubasi selama 5 hari dalam inkubator bergoyang dengan kecepatan 120 rpm pada suhu ruangan. 10 ml kultur primer dipipet dan diinokulasikan ke dalam 1000 ml media kitin cair dengan teknik aseptik. Kultur diinkubasi dalam inkubator bergoyang pada suhu ruangan selama 5 hari. Kultur disentrifus dengan kecepatan 10000 rpm selama 5 menit. Supernatan yang dihasikan sebagai ekstrak enzim kasar.
Pemurnian Parsial
Pemurnian parsial dilakukan dengan menggunakan dua tahapan utama pemurnian yaitu dengan pengendapan garam amonium sulfat dan dialisis. Ekstrak enzim kasar yang diperoleh dipresipitasi dengan beberapa tingkat kejenuhan garam amonium sulfat (NH4)2SO4 yaitu 0, 10, 30, 50, dan 70%. Penambahan
amonium sulfat dilakukan sedikit demi sedikit dan dilakukan pengadukan dengan magnetic stirrer pada suhu 4oC. Sampel presipitasi selanjutnya disimpan dalam suhu 4oC selama 24 jam dan disentrifus dengan kecepatan 10000 rpm selama 10 menit pada suhu 4oC. Protein yang dihasilkan berupa pelet ditambahkan dengan 8 ml bufer fosfat pH 7. Suspensi protein disimpan pada suhu -21oC untuk pengujian selanjutnya.
Tahapan pemurnian dengan proses dialisis dilakukan dengan menggunakan sampel enzim pengendapan amonium sulfat optimal. Proses diawali dengan penyiapan kantong selofan, kantong dipotong sesuai kebutuhan dan direbus selama 5 menit dengan larutan EDTA alkali (5mM EDTA dan 200 mM natrium bikarbonat). Selanjutnya kantung dibilas dengan akuades dan diisi dengan sampel enzim. Kantung selofan yang telah terisi oleh sampel dimasukkan dalam gelas piala yang terisi larutan buffer fosfat 50 mM pH 7 diaduk dengan bantuan magnetic stirrer. Bufer digantikan 4 kali dalam 24 jam dan hasil dialisis disimpan pada suhu -21oC untuk pengujian selanjutnya.
Uji Aktivitas Enzim Kitinase
Uji aktivitas enzim kitinase dilakukan secara kualitiatif dan kuatitatif. Uji secara kualitatif dilakukan dengan menentukan indeks kitinolitik (Mubarik et al 2010). Isolat Beauveria bassiana hasil peremajaan diambil 2 ose dan dimasukkan dalam tabung Eppendorf steril yang telah berisi 100 µl akuades steril. 5 µl isolat Beauveria bassiana yang diencerkan dimasukkan pada sumur dalam media agar yang mengandung koloid kitin. Media agar yang mengandung koloid kitin dibuat dengan mencampurkan 125 ml koloid kitin, 0.65 gram Na2HPO4.2H2O, 1.5 gram
KH2PO4, 0.25 gram NaCl, 0.12 gram NH4Cl, 0.12 gram MgSO4.7H2O, 0.005
gram CaCl2, 20 gram bacto agar, kemudian dilarutkan akuades hingga volume
diperoleh berdasarkan perbandingan antara diameter zona bening dengan diameter koloni.
Pengukuran aktivitas enzim kitinase secara kuantifikasi ditentukan dengan metode Modifikasi Spindler (Toharisman et al 2005). Pengujian diawali dengan pembuatan serangkaian larutan standar N-asetil-D-glukosamin untuk menentukan kurva standar. Rangkaian konsentrasi standar yang dibuat yaitu 0, 10, 20, 30, 40, 50, 60, 70, 80, 90, dan 100 ppm. Setiap larutan dengan konsentrasi tertentu ditambahkan pereaksi Schales. Larutan dipanaskan hingga suhu 100oC selama 10 menit untuk menghentikan reaksi. Larutan didinginkan dan diukur nilai absorbansinya pada panjang gelombang 420 nm. Kurva standar dibuat dengan menghubungkan konsentrasi standar terhadap absorbansi terkoreksi (Nurderbyandaru 2008).
Uji enzim pada sampel dilakukan tiga kali ulangan dengan mencampur 150 µl sampel enzim, 150 µl bufer fosfat pH 7, dan 300 µl koloid kitin 0.3%. Campuran divorteks dan diinkubasi pada water bath selama 30 menit dengan suhu 37oC. Campuran enzim disentrifus dengan kecepatan 5000 rpm selama 5 menit dan supernatan yang dihasilkan dipipet sebanyak 500 µl. Supernatan sebanyak 500 µl di masukkan dalam tabung reaksi, kemudian ditambah dengan 500 µl akuades dan 1000 µl pereaksi Schales. Campuran langsung dididihkan pada suhu 100oC selama 10 menit. Campuran reaksi didinginkan untuk selanjutnya diukur absorbansinya pada panjang gelombang 420 nm. Blanko dibuat dengan mencampurkan 1000 µl akuades dengan 1000 µl pereaksi Schales. Satu unit aktivitas enzim kitinase didefinisikan sebagai jumlah enzim yang dapat membebaskan N-asetil-D-glukosamin sebesar satu µmol per menit.
Pengukuran Konsentrasi Total Protein (Bradford 1976).
Pengukuran konsentrasi protein dilakukan dengan membuat kurva standar dari bovine serum albumin (BSA). Deret konsentrasi yang dibuat terdiri atas 0, 10, 20, 30, 40, 50, 60, 70, 80, 90 dan 100 ppm. Setiap larutan standar kemudian ditambahkan reagen Bradford. Reagen Bradford dibuat dari 100 mg Coomassie Brilliant Blue G-250, 25 ml etanol 95%, 100 ml 85% (b/v) asam fosfat, dan NaOH 1M. Campuran uji dihomogenkan dengan vorteks dan diinkubasi selama 30 menit pada suhu ruangan. Nilai absorbansi diukur dengan menggunakan pada panjang gelombang 595 nm. Kurva standar dibuat dengan cara menghubungkan konsentrasi standar dengan nilai absorbansi terkoreksi.
Pengukuran konsentrasi protein pada sampel dilakukan dengan 10µl ekstrak enzim dipipet dan dicampur dengan 500 µl reagen Bradford. Sampel diinkubasi selama 30 menit pada suhu ruangan dan nilai absorbansi diukur pada panjang gelombang 595 nm. Konsentrasi protein sampel dihitung berdasarkan kurva standar serum bovine albumin (BSA). Setelah konsentrasi protein ditentukan, maka aktivitas spesifik enzim dapat ditentukan.
Uji Karakterisasi Enzim Kitinase
kitinase ditentukan dengan metode modifikasi Spindler.
Uji pengaruh suhu terhadap aktivitas enzim kitinase dilakukan dengan cara mereaksikan enzim, substrat koloid kitin 0.3%, dan bufer fosfat pH 7, pada rentang suhu uji (25, 30, 35, 40, 45, 50, 55, dan 60oC) selama 30 menit. Aktivitas enzim kitinase ditentukan dengan metode modifikasi Spindler.
Uji stabilitas waktu inkubasi terhadap aktivitas enzim kitinase dilakukan dengan mereaksikan enzim, substrat koloid kitin 0.3%, dan bufer pH optimal. Inkubasi dilakukan pada suhu optimal dan dilakukan pada rentang waktu inkubasi (15, 30, 60, 120, 150 menit). Aktivitas enzim kitinase ditentukan dengan metode modifikasi Spindler.
Uji pengaruh ion logam terhadap aktivitas enzim kitinase dilakukan dengan mereaksikan enzim, substrat, bufer fosfat pH 7, dan garam ion logam uji (EDTA, KCl, MnCl2, MgCl2, CuSO4, FeSO4, ZnCl2, dan NaCl) dengan konsentrasi 10
mM. Inkubasi dilakukan pada suhu 37oC selama 30 menit. Aktivitas enzim kitinase ditentukan dengan menggunakan metode modifikasi spindler.
Studi kitinetika enzim kitinase dengan mereaksikan enzim, bufer fosfat pH 7 dan substrat kitin dari konsentrasi 0.1-1.0% dengan interval 0.2% dalam volume reaksi 600 µL. Campuran diinkubasi pada suhu 37oC selama 30 menit. Aktivitas enzim kitinase dilakukan dengan menentukan konsentrasi N-asetil-D-glukosamin berdasarkan metode Spindler. Nilai Km dan Vmaks ditentukan berdasarkan
persamaan Lineweaver-Burk yang merupakan grafik hubungan antara 1/[S] dan 1/V.
Penentuan Bobot Molekul Protein dengan SDS-PAGE
Tahap awal penentuan bobot molekul protein dengan SDS-PAGE adalah penyiapan gel SDS-PAGE. Metode yang digunakan dalam pembuatan gel adalah metode Bollag & Edelstein (1991). Gel yang digunakan ada dua jenis yaitu stacking gel dan separating gel. Komposisi gel SDS-PAGE dapat dilihat pada Tabel 1.
Persiapan sampel dilakukan dengan menyiapkan 20 µl sampel kitinase dicampur dengan 5 µl bufer sampel. Campuran dipanaskan dalam air mendidih 100oC selama 5 menit. Proses pendidihan dilakukan untuk mereduksi protein sampel, sehingga protein yang ada akan bermuatan negatif. Protein bermuatan negatif akan bermigrasi ke arah kutub positif ketika dilakukan proses elektroforesis. Selanjutnya, sampel didinginkan pada suhu ruangan dan dipipet 10 µl sampel untuk dimasukkan dalam sumur gel elektroforesis.
Tabel 1 Komposisi gel SDS-PAGE
Proses elektroforesis dilakukan dengan menempatkan gel ke dalam kotak gel, kemudian reservoir atas dan bawah diisi dengan bufer pemisah yang dibuat dari campuran (basa tris 30.3 g, glisin 144.0 g, SDS 10 g, dan akuades 1L). Proses elektroforesis dilanjutkan dengan dihubungkan arus listrik bertegangan 60 Volt, 30 mA selama ± 4 jam. Elektroforesis dihentikan setelah pewarna protein standar (biru bromofenol) hingga mencapai batas bawah gel elektroforesis.
Proses pewarnaan gel diawali dengan merendam gel dalam larutan fiksasi selama semalaman sambil digoyang dengan kecepatan 100 rpm. Gel selanjutnya dicuci dengan ddH2O selama 10 menit dan gel direndam dalam larutan sensitizing
solution yang dibuat dari 100 ml etanol dan 400 ml ddH2O selama 1 menit
kemudian dibilas kembali dengan ddH2O selama 20 menit. Gel diinkubasi dalam
kulkas dengan diberi pewarna perak nitrat (AgNO3) 0.1% selama 20 menit dan
dicuci dengan ddH2O selama 20 menit. Selanjutnya setelah pewarnaan cukup
dilakukan penambahan larutan stop solution (60 ml asam asetat glasial dan 440 ml ddH2O) selama 5 menit dan dicuci kembali dengan ddH2O selama 2 menit.
Penentuan bobot molekul didasarkan pada perhitungan dengan menggunakan persamaan garis antara nilai Rf dan Log bobot molekul.
Analisis Statistik (mattjik & Sumertajaya 2006)
Analisis statistik yang digunakan pada penelitian ini dilakukan dengan menggunakan Analisis of Variance (ANOVA) dan rancangan percobaan yang digunakan adalah model RAL (rancangan acak lengkap), selanjutnya dilakukan uji Duncan terhadap parameter yang dianalisis meliputi hubungan perlakuan terhadap nilai aktivitas enzim kitinasse asal isolat Beauveria bassiana. Setiap perlakuan dilakukan 3 ulangan. Analisis statistik dilakukan dengan menggunakan program SPSS 16.0. Adapun model dari RAL tersebut adalah sebagai berikut:
Yij = µ + τi + εij
Dimana : i = 1,2,…. dan j = 1,2,…
Yij = Pengamatan pada perlakuan ke-i dan ulangan ke-j
µ = Rataan umum
τi = Pengaruh perlakuan ke-i
εij = Pengaruh acak pada perlakuan ke-I dan ulangan ke-j
HASIL DAN PEMBAHASAN
Indeks Kitinolitik Enzim Kitinase dari Beauveria bassiana
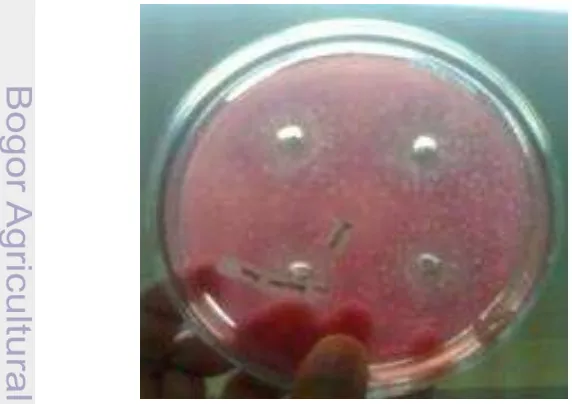
bassiana ditandai zona bening disekeliling koloni tumbuh seperti yang diperlihatkan pada Gambar 1. Gambar ini memperlihatkan cawan setelah diberi larutan congo red 0.1% untuk memperjelas zona bening yang terbentuk.
Indeks kitinolitik umumnya digunakan sebagai salah satu metode skrining. Metode ini banyak digunakan karena mampu menskrining isolat kitinolitik dalam jumlah banyak dalam waktu singkat. Uji aktivitas kitinolitik diawali dengan menumbuhkan isolat Beauveria bassiana pada media agar yang mengandung koloid kitin 0.3% dengan waktu inkubasi selama 7 hari pada suhu ruang. Substrat kitin pada medium fermentasi mampu menginduksi kelompok enzim kitinolitik, seperti eksokitinase dan endokitinase (Chernin et al 1995). Substrat kitin dalam medium fermentasi umumnya digunakan dalam bentuk koloid kitin (Harman et al 1995).
Berdasarkan penelitian yang dilakukan oleh Widhyastuti (2010) terhadap aktivitas enzim kitinase dari Aspergillus sp. menyatakan bahwa kadar N-asetil-D-glukosamin yang dihasilkan dari hidrolisis kitin dari bubuk kitin lebih rendah dibandingkan kadar N-asetil-D-glukosamin yang dihasilkan dari hidrolisis koloid kitin. Hal ini disebabkan oleh bentuk rantai polimer kitin.
Zona bening yang merupakan parameter adanya aktivitas kitinolitik terbentuk akibat degradasi koloidal kitin menjadi monomer N-asetil-D-glukosamin oleh isolat Beauveria bassiana. Fungsi enzim ekstraseluler menurut Pelezar & Chan (1986) yaitu mengubah sumber nutrien disekitarnya menjadi nutrien yang siap untuk memasuki sel.
Penambahan pelarut congo red 0.1% berfungsi sebagai pewarna medium, sehingga zona bening terlihat jelas. Mekanisme pewarnaan congo red menurut Downie et al (1994) adalah congo red (C32H22N6O6S2Na2) akan berikatan dengan ikatan β-1,4 pada substrat kitin, sehingga media yang mengandung polimer kitin akan terwarnai warna merah. Bagian media agar kitin yang terhidrolisis oleh enzim kitinase tidak akan terwarnai oleh congo red, karena pada zona ini mengandung N-asetil-D-glukosamin yang tidak memiliki ikatan β-1,4 sehingga larutan congo red tidak berikatan. Pembilasan dengan akuades dan NaCl digunakan untuk melunturkan congo red terutama di daerah sekitar koloni yang mengandung gula reduksi sehingga terlihat zona bening (Sumardi 2004).
Hasil Pemurnian Enzim Kitinase Secara Parsial
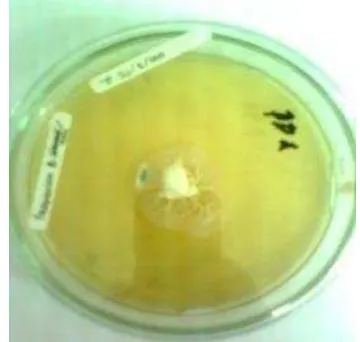
Tahap awal pemurnian enzim kitinase Beauveria bassiana secara parsial dimulai dengan peremajaan isolat Beauveria bassiana pada media potato dextrose agar. Peremajaan isolat bertujuan untuk memperoleh spora yang baik. Peremajaan isolat Beauveria bassiana dengan melakukan inkubasi selama 7 hari pada suhu ruangan. Hasil peremajaan isolat Beauveria bassiana disajikan pada Gambar 2. Berdasarkan hasil peremajaan Beauveria bassiana memiliki pola pertumbuhan kesegala arah dengan diameter pertumbuhan isolat Beauveria bassiana selama inkubasi sebesar 2.3 cm.
Diameter pertumbuhan isolat Beauveria bassiana ini cukup besar, karena jika dibandingkan pada penelitian yang pernah dilakukan oleh Nuraida & Hasyim (2009) jenis Beauveria (BPP1 dan BAP5) yang ditumbuhkan pada media SDA (Saboround Dekstrose Agar) memiliki diameter pertumbuhan yang lebih kecil masing-masing 1.1 cm dan 2 cm. Namun diameter isolat ini lebih lambat diameter pertumbuhannya jika dibandingkan dengan jenis cendawan entomopatogen lain, seperti Metarhizium (MAP1), Fusarium (FPP3), dan Paecilomyces (PPP4).
Tahapan berikutnya dilanjutkan dengan bioproduksi enzim kitinase dari Beauveria bassiana secara fermentasi pada media cair yang mengandung koloidal kitin 0.3% dengan waktu inkubasi selama 5 hari pada suhu ruangan. Menurut Leopold & Anna (1970) waktu inkubasi 4-5 hari merupakan waktu inkubasi optimal produksi kitinase pada miselium dewasa Beauveria bassiana.
Pemisahan enzim ekstraseluler kitinase relatif mudah dilakukan, karena tidak memerlukan proses penghancuran sel. Enzim ekstraseluler kitinase dipisahkan dari isolat Beauveria bassiana dan pengotor lain non-enzim dengan teknik sentrifugasi. Teknik ini dilakukan pada suhu 4oC untuk mencegah protein terdenaturasi. Isolat Beauveria bassiana memiliki bobot molekul yang kecil, sehingga ketika dilakukan sentrifugasi enzim tetap terlarut pada supernatan. Supernatan yang dihasilkan merupakan ekstrak kasar enzim kitinase.
Ekstrak kasar enzim kitinase selanjutnya dimurnikan secara parsial. Pemurnian parsial yang dilakukan meliputi dua tahapan pemurnian yaitu pemurnian dengan pengendapan garam amonium sulfat dan teknik dialisis. Pemurnian dengan pengendapan garam amonium sulfat dilakukan optimasi pengendapan secara bertahap mulai dari konsentrasi 10, 30, 50, dan 70%.
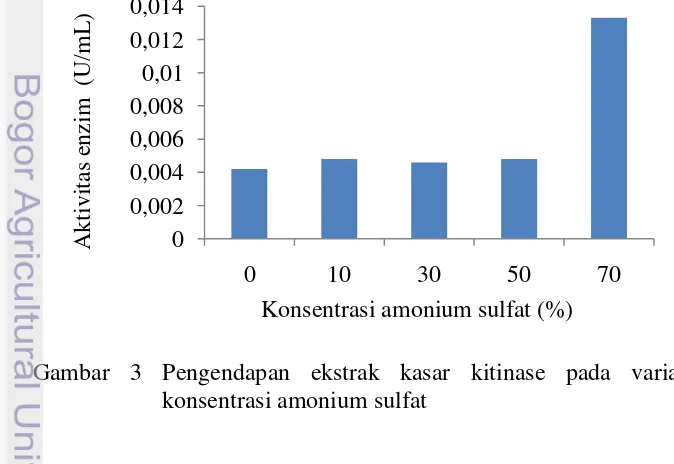
Ekstrak kasar enzim kitinase hingga sampel dengan pengendapan garam amonium sulfat 70% diuji aktivitas kitinase secara kuantitatif. Aktivitas enzim kitinase pada setiap sampel disajikan pada Gambar 3. Berdasarkan hasil aktivitas enzim kitinase pada perlakuan konsentrasi garam amonium 0 sampai 50% memiliki aktivitas enzim kitinase yang rendah dan aktivitas enzim kitinase meningkat secara drastis pada perlakuan konsentrasi garam amonium sulfat 70% dengan nilai aktivitas kitinase sebesar 0.0133 U/mL.
Hasil analisis statistik ANOVA menunjukkan nilai p-value yang dihasilkan sebesar 0.00 atau lebih kecil dari nilai alpha 5% (Lampiran 4), sehingga dapat diartikan bahwa setiap perlakuan konsentrasi garam amonium sulfat berpengaruh terhadap aktivitas enzim kitinase. Hasil uji statistik Duncan menunjukkan bahwa perlakuan dengan konsentrasi garam amonium sulfat 70% berbeda nyata dengan perlakuan konsentrasi garam 0 sampai 50%, hal ini dibuktikan dengan nilai p-value >0.05.
Pengendapan enzim kitinase dengan konsentrasi garam amonium sulfat 10-50% belum dapat mengendapkan enzim kitinase secara keseluruhan atau protein masih mengalami salting in, hal ini dibuktikan dari aktivitas kitinase yang rendah. Saat salting in ion garam yang dihasilkan pada konsentrasi garam rendah akan melindungi molekul protein dan mencegah bersatunya molekul protein sehingga protein masih banyak yang melarut dan enzim banyak terbuang pada saat pemisahan. Pengendapan dengan konsentrasi 70% garam amonium sulfat dapat mengendapkan sebagaian besar enzim kitinase (salting out). Saat salting out ion garam yang dihasilkan akan meningkatkan muatan listrik disekitar protein yang berakibat tertariknya mantel air dari protein, sehingga terjadi interaksi hidrofobik dan menurunkan kelarutan protein (Suhartono et al 1992).
Hal ini lah yang menyebabkan ketika isolasi enzim kitinase, enzim kitinase yang terisolasi semakin banyak, dan meningkatkan aktivitas kitinase. Perlakuan dengan pengendapan amonium sulfat 70% merupakan suatu perlakuan yang optimal, karena telah dibuktikan melalui uji statistik. Berdasarkan penelitian yang dilakukan oleh Lyoyd et al (1965) pemekatan protein dengan 70% amonium sulfat merupakan konsentrasi yang optimum, karena dapat mengendapkan sebagian besar protein dan memiliki aktivitas yang besar.
0
Penggunaan garam amonium sulfat digunakan untuk pengendapan enzim kitinase, karena garam ini memiliki beberapa keuntungan yaitu mudah larut, tidak toksik, dan stabil terhadap enzim karena tidak mempengaruhi struktur proteinnya. Proses pengendapan enzim kitinase dengan garam amonium sulfat ditambahkan dalam bentuk kristal halus, hal ini bertujuan agar volume sampel tidak bertambah terlalu besar. Penambahan garam amonium sulfat dilakukan secara perlahan dan sambil diaduk dengan magnetic stirrer yang berfungsi agar kontak antara protein dengan garam dapat berlangsung baik. Suhu yang dingin sekitar 4oC digunakan juga pada saat pengendapan protein yang bertujuan menjaga agar protein yang terendapkan tidak mengalami kerusakan (Kristanti 2001).
Penentuan tingkat kemurnian dilakukan dengan melakukan uji aktivitas kitinase secara kuantitatif dan konsentrasi protein pada sampel. Pengukuran aktivitas enzim kitinase secara kuantitatif didasarkan pada pengukuran produk hidrolisis enzim kitinase yaitu N-asetil-D-glukosamin selama waktu tertentu. Penentuan kadar N-asetil-D-glukosamin dihitung berdasarkan persamaan garis y=-0.003+4.082x10-3x (Lampiran 5). Penambahan pereaksi Schales digunakan untuk membantu pendeteksian produk, kandungan K3Fe(CN)6 dalam suasana
alkali akan membentuk larutan berwarna kuning kehijauan, bentuk ion Fe3+ yang ada pada pereaksi Schales akan tereduksi oleh adanya N-asetil-D-glukosamin sebagai gula pereduksi menjadi ion Fe2+ yang akan membentuk warna bening. Pendeteksian didasarkan pada warna pereaksi Schales, sehingga peningkatan konsentrasi N-asetil-D-glukosamin akan menurunkan nilai absorbansi. Perlakuan dengan pemanasan 100oC selama 10 menit bertujuan untuk menghentikan reaksi sehingga pengukuran produk oleh spektrofotometer lebih akurat. Penentuan konsentrasi protein ditentukan berdasarkan metode Bradford (1976). Penentuan kadar protein dihitung berdasarkan persamaan garis y=-9.909x10-3 + 0.847x (Lampiran 6).
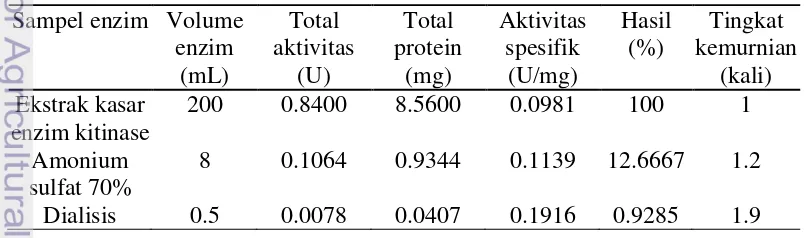
Efisiensi tingkat kemurnian dapat dilihat dari nilai hasil rendemen dan tingkat kemurnian yang dihasilkan. Hasil pemurnian enzim kitinase Beauveria bassiana dari ekstrak kasar enzim kitinase hingga tahap dialisis disajikan pada Tabel 2. Pemurnian kitinase dengan pengendapan amonium sulfat 70% dapat meningkatkan kemurnian kitinase sebesar 1.2 kali dibandingkan ekstrak kasar enzim kitinase dengan hasil rendemen sebesar 12.6667%. Pemurnian enzim kitinase dengan teknik dialisis terbukti dapat meningkatkan tingkat kemurnian enzim kitinase lebih tinggi sebesar 1.9 kali dibandingkan ekstrak kasar enzim kitinase dengan hasil rendemen sebesar 0.9285%.
Tabel 2 Pemurnian enzim kitinase Beauveria bassiana
Tingkat kemurnian enzim kitinase diperoleh dari perbandingan aktivitas spesifik tiap proses pemurnian dengan aktivitas spesifik ekstrak kasar enzim kitinase, sehingga apabila aktivitas spesifik meningkat maka tingkat kemurnian enzim kitinase pun meningkat. Berdasarkan hasil yang diperoleh aktivitas spesifik pada sampel 70% amonium sulfat sebesar 0.1139 U/mg dan nilai aktivitas spesifik pada sampel dialisis meningkat sebesar 0.1916 U/mg, sehingga tingkat kemurniannya meningkat.
Hasil rendemen enzim kitinase diperoleh dari perbandingan total aktivitas tiap proses pemurnian kitinase dengan total aktivitas ekstrak kasar kitinase dikalikan dengan 100%. Berdasarkan hasil yang diperoleh menunjukkan hasil rendemen setiap tingkat pemurnian menunjukkan penurunan. Penurunan hasil rendemen pada sampel 70% amonium sulfat dapat disebabkan oleh enzim kitinase hanya sebagian yang dapat terendapkan dan diisolasi. Hal ini dapat dilihat dengan total aktivitas dan total protein yang menurun dibandingkan total aktivitas ekstrak kasar kitinase. Penurunan hasil rendemen pada sampel dialisis disebabkan hilangnya beberapa protein selama proses dialisis berlangsung dan hal ini dapat dilihat dari nilai total aktivitas dan total protein yang dihasilkan. Menurut Kristanti (2001) penurunan protein pada sampel dialisis dapat disebabkan oleh adanya beberapa protein yang hilang selama proses dialisis. Ukuran pori-pori kantung selofan adalah 10 kDa. Adanya protein yang keluar dari kantong selofan diduga protein yang memiliki ukuran yang lebih kecil dibandingkan pori-pori kantung selofan.
Mekanisme pemurnian dengan metode dialisis adalah adanya konsentrasi garam yang lebih pekat dalam kantung selofan dibandingkan konsentrasi garam diluar kantung mengakibatkan garam yang ada dalam kantung akan keluar dan digantikan dengan larutan bufer hingga mencapai keseimbangan yaitu konsentrasi garam di dalam kantung dan diluar sama. Teknik pemurnian dialisis dilakukan empat kali penggantian bufer, hal ini bertujuan agar ion garam amonium sulfat dapat dikeluarkan dari dalam sampel secara maksimal.
Dialisis dilakukan dengan menggunakan sampel pengendapan amonium sulfat 70%. Penggunaan sampel 70% amonium sulfat karena merupakan sampel enzim kitinase yang optimal, karena memiliki aktivitas kitinase yang besar yang menandakan banyaknya enzim kitinase yang terisolasi, sehingga akan meningkatkan tingkat kemurnian enzim. Merurut Situmorang (2003) penggunaan 70% garam amonium sulfat dalam perlakuan pemurnian kitinase dari Rhizopus oryzae merupakan konsentrasi optimal untuk meningkatkan tingkat kemurnian enzim kitinase.
Karakter Enzim Kitinase pH
NaOH-glisin dengan rentang pengujian pH 3-10 dengan konsentrasi 50 mM.
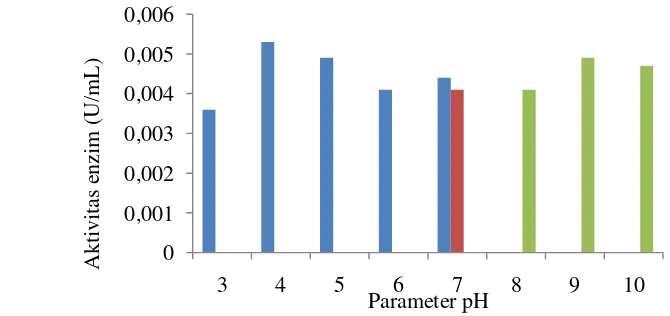
Hasil uji aktivitas enzim kitinase terhadap pH disajikan pada Gambar 4. Berdasarkan hasil yang diperoleh menunjukkan aktivitas enzim kitinase meningkat hingga mencapai pH optimumnya yaitu pH 4 dengan aktivitas enzim kitinase sebesar 0.0053 U/mL, selanjutnya aktivitas menurun seiring dengan meningkatnya pH. Penggunaan bufer sitrat fosfat dan bufer fosfat dengan pH 7 masing-masing sebesar 0.0044 U/mL dan 0.0041 U/mL. Aktivitas enzim kitinase kembali mengalami peningkatan pada pH 9 sebesar 0.0049 U/mL dan aktivitasnya menurun kembali pada pH 10.
Hasil analisis statistik ANOVA menunjukkan hasil p-value sebesar 0.00 atau bernilai lebih kecil dibandingkan nilai α 5% (Lampiran 8 ), sehingga dapat diartikan bahwa perlakuan pH berpengaruh terhadap aktivitas enzim kitinase dari Beauveria bassiana. Hasil analisis statistik lanjutan yaitu dengan uji Duncan menunjukkan pada pH 4 aktivitas kitinase berbeda nyata terhadap perlakuan pH lain yang diujikan. Hal ini dibuktikan dengan nilai p-value >0.05.
Enzim kitinase dari Beauveria bassiana optimal aktif mengkatalisis substrat kitin pada pH asam, karena memiliki aktivitas kitinase yang tinggi pada pH 4 dan berdasarkan analisis statistik pH 4 merupakan perlakuan optimal karena nilai aktivitasnya berbeda nyata dengan perlakuan yang lain. Karakterisasi enzim kitinase dari Beauveria bassiana yang telah dilakukan oleh Michael et al (1993) menghasilkan aktivitas optimum pada pH asam yaitu pH 5. Hasil yang berbeda oleh Suresh dan Chandrasekaran (1999) menunjukkan aktivitas optimal kitinase basa yaitu pH 9.2. Adanya pH optimum yang berbeda ini lah yang diduga enzim kitinase dapat mempertahankan bentuk sisi aktifnya dari pH asam hingga pH basa. Perbedaan pH optimum yang dihasilkan dapat disebabkan oleh lingkungan tempat tumbuh isolat Beauveria bassiana yang diisolasi.
Peningkatan aktivitas enzim kitinase kembali pada pH 9 diduga karena penggunaan jenis bufer yang berbeda. Ion pada bufer akan memberi perubahan ion enzim dan ion substrat. Perubahan kondisi ion enzim dapat terjadi pada residu asam amino dan karboksil yang berfungsi katalitik mengikat substrat atau berfungsi mempertahankan struktur tersier dan kwartener enzim aktif, sehingga ketika dilakukan penambahan bufer glisin-NaOH sisi katalitik enzim menjadi teraktifkan kembali dan aktivitasnya meningkat.
Peningkatan aktivitas enzim kitinase kembali pada pH 9 diduga karena penggunaan jenis bufer yang berbeda. Ion pada bufer akan memberi perubahan ion enzim dan ion substrat. Perubahan kondisi ion enzim dapat terjadi pada residu asam amino dan karboksil yang berfungsi katalitik mengikat substrat atau berfungsi mempertahankan struktur tersier dan kwartener enzim aktif, sehingga ketika dilakukan penambahan bufer glisin-NaOH sisi katalitik enzim menjadi teraktifkan kembali dan aktivitasnya meningkat.
Suhu
Enzim dalam melakukan reaksinya dipengaruhi oleh suhu. Setiap enzim memiliki kisaran suhu tertentu untuk mencapai aktivitas yang optimum. Faktor suhu terhadap aktivitas enzim sangat kompleks, karena adanya peningkatan suhu dapat meningkatkan kecepatan reaksi enzim hingga mencapai aktivitas optimum dan disisi lain peningkatan suhu dapat mempercepat inaktivasi enzim. Rentang suhu yang diujikan dimulai dari 25oC hingga 60oC selama 30 menit. Hasil pengaruh suhu terhadap aktivitas enzim kitinase disajikan pada Gambar 5. Aktivitas enzim kitinase mengalami peningkatan seiring bertambahnya suhu hingga dicapai aktivitas optimal pada suhu 50oC sebesar 0.0081 U/mL dan aktivitas enzim kitinase menurun setelah mencapai aktivitas maksimum.
Hasil analisis statistik ANOVA menunjukkan hasil p-value sebesar 0.00 atau bernilai lebih kecil dibandingkan nilai α 5% (Lampiran 10), sehingga dapat diartikan bahwa perlakuan suhu berpengaruh terhadap aktivitas enzim kitinase dari Beauveria bassiana. Hasil analisis statistik lanjutan yaitu dengan uji Duncan menunjukkan pada suhu 50o C menghasilkan aktivitas kitinase berbeda nyata terhadap perlakuan suhu lain yang dibuktikan dengan nilai p-value >0.05.
Berdasarkan hasil uji yang diperoleh dan analisis statistik, enzim kitinase dari Beauveria bassiana memiliki suhu optimal 50oC. Penelitian yang telah dilakukan oleh Michael et al (1993), enzim kitinase yang diproduksi dari Beauveria bassiana memiliki aktivitas optimal 47oC. Menurut Dewi (2008) enzim kitinase yang diisolasi dari bakteri yang diisolasi dari sumber air panas Tinggi Raja, Sumatera Utara menghasilkan enzim kitinase bersifat termostabil dengan aktivitas optimal pada suhu 65oC.
Aktivitas enzim kitinase menurun setelah suhu 50oC, namun berdasarkan hasil yang diperoleh nilai aktivitasnya masih terlihat besar. Hal ini diduga terjadi adanya peningkatan suhu akan mempercepat kecepatan reaksi enzim, karena energi kinetik yang dihasilkan akan memberbesar frekuensi enzim dengan substrat bereaksi namun disisi lain adanya peningkata suhu inaktivasi juga meningkat, Sehingga aktivitas yang masih terlihat besar setelah aktivitas optimal disebabkan oleh enzim memiliki kecepatan reaksi yang cepat pada tahap awal inkubasi namun karena kecepatan inaktivasinya juga tinggi, sehingga nilai aktivitasnya lebih rendah dibandingkan aktivitas optimum.
Waktu inkubasi
Semua enzim memiliki kemampuan untuk mempertahankan stabilitas sisi aktifnya dalam waktu tertentu. Kemampuan ini bersifat spesifik dan berbeda antara enzim satu dengan enzim yang lain. Pengujian stabilitas waktu inkubasi terhadap aktivitas enzim kitinase dilakukan dari rentang waktu inkubasi 15 menit hingga 150 menit dengan pH 4 dan suhu 50oC yang merupakan pH dan suhu optimum.
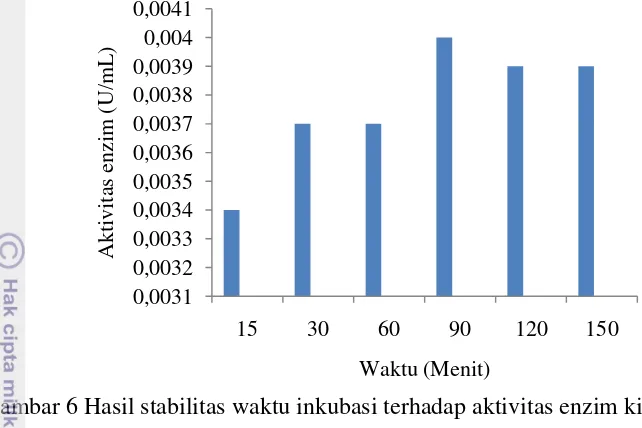
Hasil uji stabilitas enzim kitinase terhadap waktu inkubasi disajikan pada Gambar 6. Hasil yang diperoleh memperlihatkan bahwa enzim kitinase dari Beauveria bassiana relatif stabil hingga menit ke 150 waktu inkubasi dengan aktivitas tertinggi dicapai pada waktu inkubasi 90 menit dengan aktivitas enzim kitinase sebesar 0.0040 U/mL. Berdasarkan hasil analisis statistik ANOVA menunjukkan hasil p-value sebesar 0.207 atau bernilai lebih besar dibandingkan nilai α 5% (Lampiran 12), sehingga dapat diartikan bahwa perlakuan rentang waktu inkubasi 15 hingga 150 menit tidak berpengaruh terhadap aktivitas enzim kitinase dari Beauveria bassiana.
Aktivitas enzim kitinase terus meningkat dari 15 menit inkubasi hingga mencapai waktu inkubasi optimum. Pada awal waktu inkubasi enzim kitinase yang bereaksi dengan substrat masih sedikit dan seiring dengan penambahan waktu inkubasi enzim yang bereaksi dalam menghidrolisis substrat juga semakin meningkat hingga mencapai waktu inkubasi optimum. Aktivitas enzim kitinase dari Beauveria bassiana cenderung stabil, hal ini dapat dilihat dari hasil uji aktivitas kitinase yang dihasilkan setelah aktivitas tertinggi dicapai pada waktu inkubasi 90 menit, aktivitas sedikit menurun dan stabil hingga waktu inkubasi 150 menit. Adanya penggunaan pH dan suhu optimum yaitu pH 4 dan suhu 50oC, sehingga enzim kitinase bersifat stabil dan tidak cepat mengalami penurunan aktivitas kitinase. Menurut Chasanah et al (2002) penggunaan suhu optimum dapat meningkatkan kinerja enzim secara maksimal dan dengan bentuk tertentu sisi aktif enzim tersebut dalam keadaan yang sempurna.
Gambar 6 Hasil stabilitas waktu inkubasi terhadap aktivitas enzim kitinase
Pengaruh ion logam
Enzim memerlukan gugus prostetik untuk mengaktivasi aktivitasnya dalam menghidrolisis substratnya, salah satu jenis gugus prostetik adalah kofaktor. Kofaktor merupakan senyawa anorganik, seperti ion logam. Uji pengaruh penambahan ion logam dilakukan dengan menggunakan EDTA, K+, Mn2+, Mg2+, Cu2+, Fe2+, Zn2+, dan Na+ dengan konsentrasi 10 mM. Sebagai kofaktor ion logam dapat berperan sebagai aktivator atau inhibitor enzim.
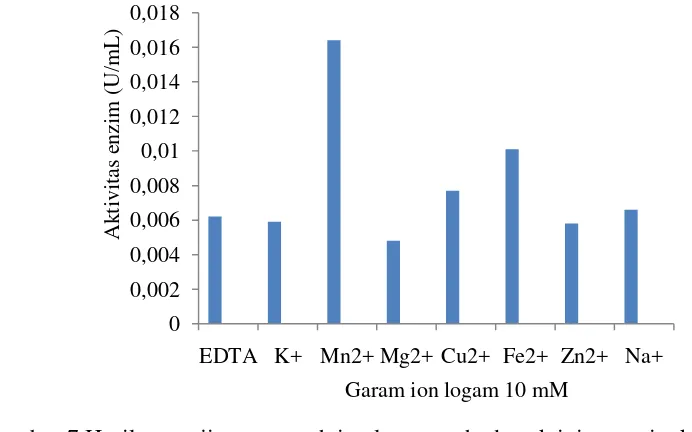
Hasil uji pengaruh penambahan ion logam terhadap aktivitas enzim kitinase Beauveria bassiana disajikan pada Gambar 7. Berdasarkan hasil yang diperoleh penambahan ion logam Mn2+ tidak memberi reaksi penghambatan terhadap aktivitas enzim kitinase. Secara signifikan ion logam Mn2+ lebih bersifat sebagai aktivator, sehingga memberikan aktivitas enzim kitinase tertinggi yaitu 0.0164 U/mL, hal ini pula didukung oleh hasil analisis statistik. Pada hasil analisis statistik yang diawali oleh statistik ANOVA menunjukkan bahwa hasil p-value sebesar 0.00 atau bernilai lebih kecil dibandingkan nilai α 5% (Lampiran 13), sehingga dapat diartikan bahwa perlakuan penambahan ion logam berpengaruh terhadap aktivitas enzim kitinase dari Beauveria bassiana. Hasil analisis statistik dilanjutkan dengan uji Duncan, namun dari hasil uji Duncan menunjukkan penambahan jenis ion logam Mn2+ dan Fe2+ memberikan hasil aktivitas kitinase yang berbeda nyata terhadap perlakuan penambahan ion logam yang lain, hal ini dibuktikan dengan nilai p-value >0.05 sehingga ion Fe2+ juga bersifat sebagai aktivator.
Aktivitas tertinggi terdapat pada sampel enzim dengan ditambahkan ion Mn2+ , hal ini diduga terjadi karena ketika ion logam Mn2+ terikat secara sempurna dan membentuk kompleks holoenzim sehingga aktivitas kitinase menjadi sangat besar. Komplek holoenzim yaitu enzim yang aktif mengkatalisis produk sehingga pada saat ditambahkan ion logam Mn2+ aktivitas kitinase mejadi besar. Hasil penelitian berbeda oleh Michael et al (1993) penambahan Mg2+, Zn2+, dan EDTA dengan konsentrasi 10 mM tidak memberi penghambatan aktivitas kitinase atau bersifat aktivator. Perbedaan reaksi yang ditimbulkan dari penambahan garam ion diduga dipengaruhi oleh beberapa faktor, seperti lingkungan tempat tumbuh.
Gambar 7 Hasil pengujian pengaruh ion logam terhadap aktivitas enzim kitinase
Penambahan ion logam EDTA, K+, Mg2+, Cu2+, Zn2+, Na+ memberikan efek penghambatan terhadap aktivitas enzim kitinase. Penghambatan aktivitas enzim kitinase terbesar terdapat pada ion Mg2+ dengan aktivitas enzim sebesar 0.0048 U/mL, namun aktivitas penghambatannya tidak secara signifikan, karena aktivitas kitinase dari Beauveria bassiana setelah penambahan ion Mg2+ masih memperlihatkan aktivitas kitinase. Hal ini diduga terjadi karena ketika enzim kitinase mengikat ion logam Mg2+ sebagai inhibitor, ion ini tidak terikat secara sempurna dan diduga terlepas kembali sehingga enzim kitinase masih dapat mengkatalisis substratnya.
Kinetika enzim
Kinetika enzim dapat ditentukan dengan menentukan nilai Km dan Vmaks.
Pada penelitian ini digunakan persamaan Lineweaver-Burk untuk menentukan nilai Km dan Vmaks. Penggunaan persamaan Lineweaver-Burk memiliki
keuntungan karena lebih mudah secara matematis. Hasil penentuan kinetika enzim kitinase disajikan dalam bentuk kurva double reciprocal Lineawever-Burk pada Gambar 8. Kurva double reciprocal Lineawever-Burk dihasilkan dari plot invers sederet konsentrasi substrat koloid kitin (1/[S]) dengan invers kecepatan reaksi kitinase (1/V) menghasilkan persamaan linier y=14.307+3.260x. Berdasarkan perhitungan (Lampiran 15) diperoleh nilai Vmaks sebesar 0.069 mg/L detik dan Km
sebesar 0.225 mg/L. Kemiringan yang dihasilkan dari perbandingan Km/Vmaks
yaitu 3.261 dengan intersep pada kurva (0, 14.307) dan (-4.444,0).
Nilai Vmaks yang dihasilkan sebesar 0.069 mg/L didefinisikan sebagai suatu
kondisi optimum enzim kitinase Beauveria bassiana dapat mengubah substrat koloid kitin menjadi monomer N-asetil-D-glukosamin sebesar 0.069 mg/L setiap detiknya. Nilai Km yang diperoleh dari enzim kitinase Beauveria bassiana
menunjukkan nilai yang lebih kecil jika dibandingkan Km enzim kitinase sebesar
0.463 mg/L yang telah dilakukan oleh Michael et al (1993). Nilai Km kitinase dari
M AS AS D D
Gambar 8 Kurva double reciprocal Lineawever-Burk
Bobot Molekul Enzim Kitinase dari Beauveria bassiana
Penentuan bobot molekul enzim kitinase dari Beauveria bassiana ditentukan dengan metode SDS-PAGE (Sodium dedocyl sulphates polyacrylamide gel electrophoresis). Sampel enzim kitinase yang dianalisis jumlah pita dan bobot molekulnya adalah sampel dari pengendapan 70% amonium sulfat dan sampel dialisis. Penggunaan dua sampel ini diharapkan bobot molekul enzim kitinase dapat ditentukan secara tepat.
Penentuan bobot molekul enzim kitinase digunakan jenis marker Spectra Multicolor Broad Range Protein Ladder. Marker jenis ini memiliki memiliki 10 jenis protein dengan bobot molekul mulai dari 10, 15, 25, 35, 40, 50, 70, 100, 140, dan 260 kDa. Marker jenis ini dilabel dengan empat warna yaitu jingga, merah, biru, dan hijau. Hasil analisis penentuan bobot molekul enzim kitinase dengan metode SDS-PAGE disajikan pada Gambar 9. Kedua sampel menghasilkan jarak Rf yang sama yaitu 1.7 cm sehingga berdasarkan perhitungan (Lampiran 16), enzim kitinase dari Beauveria bassiana memiliki bobot molekul sebesar 60.255 kDa.
Gambar 9 Elektroforegram SDS-PAGE. (M) Marker, (AS) Pengendapan amonium sulfat 70%, dan (D) Dialisis
y=14.307+3.260x R=99.1%
-5 5 15 25 35 45 55
-10 -5 0 5 10 15
1/
V
1/[Koloid kitin]
260 kDa 140 kDa 100 kDa 70 kDa 50 kDa 40 kDa 35 kDa 25 kDa
15 kDa
Pita protein yang dihasilkan dari kedua sampel memperlihatkan satu pita dengan bobot molekul yang sama, sehingga isolat Beauveria bassiana hanya mengsekresikan satu jenis enzim. Bobot molekul kitinase yang dihasilkan mendekati bobot molekul enzim N-asetil-D-glukosamidase yang telah dilakukan oleh Michael et al (1993) dengan bobot molekul antara 64-66 kDa, namun hasil penelitian lain menghasilkan bobot molekul enzim kitinase yang berbeda seperti penentuan bobot molekul yang dilakukan oleh Hayukkala et al (1993) dengan metode elektroforesis gel SDS-Poliakrilamid menghasilkan bobot molekul 45 kDa. Adanya perbedaan bobot molekul enzim kitinase yang dihasilkan dapat diduga akibat isolasi enzim kitinase dari jenis Beauveria bassiana yang berbeda.
Dua jenis gel yang digunakan pada proses elektroforesis yaitu gel penahan (stacking gel) 5% dan gel pemisah (separating gel) 12.5%. Gel poliakrilamid terbentuk akibat terjadinya proses polimerisasi akrilamida dengan bisakrilamida. Fungsi amonium persulfat adalah sebagai inisiator dan TEMED (tetrametiletilendiamina) berfungsi sebagai katalisator pembentukan gel poliakrilamida (Janson &Ryden 1998).
Tahap persiapan sampel, sampel ditambah dengan bufer sampel yang berisi SDS, β-merkaptoetanol dengan perlakuan pemanasan 100oC selama 5 menit yang berfungsi untuk merusak struktur tiga dimensi protein yang akan dianalisis. β -merkaptoetanol berfungsi untuk merusak protein dengan memutuskan ikatan disulfida menjadi sulfidril. Adanya SDS bertujuan untuk memberikan muatan negatif pada protein yang dianalisa dan protein yang terdenaturasi sempurna akan mengikat SDS dalam jumlah yang setara dengan bobot molekul protein tersebut sehingga pemisahannya berdasarkan bobot molekul. Glisin pada bufer sampel berfungsi untuk miningkatkan berat jenis sampel sehingga mudah dimasukkan ke dalam sumur gel. Penambahan bromofenol biru pada bufer sampel digunakan untuk memonitoring jalannya proses elektroforesis, apabila pewarna telah mencapai batas bawah gel maka elektroforesis dihentikan.
Pewarnaan gel dilakukan hanya pada sampel uji yaitu dengan menggunakan pewarna perak nitrat. Menurut Wenk & Fernandis (2007) penggunaan pewarna perak nitrat lebih sensitif dibandingkan pewarna coomassie brilliant blue. Pewarna coomassie brilliant blue hanya dapat mendeteksi 1-10 µg protein dalam satu band protein, sedangkan pewarna perak nitrat dapat mendeteksi 10-100 ng. Mekanisme pewarnaannya adalah protein yang terdapat pada gel akan mengkatalisis proses reduksi AgNO3 pada larutan pewarna menjadi metalik silver
yang dapat tervisualisasi.
SIMPULAN DAN SARAN
Simpulan
bassiana memiliki pH optimum 4, suhu optimum 50oC, dan waktu inkubasi optimum 90 menit. Penambahan ion logam Mn2+ berperan sebagai aktivator, sementara ion logam EDTA, K+, Mg2+, Cu2+, Fe2+, Zn2+, dan Na+ bersifat sebagai inhibitor. Enzim kitinase memiliki nilai Km sebesar 0.225 mg/L dan Vmaks sebesar
0.069 mg/L detik. Protein enzim kitinase memiliki bobot molekul 60.255 kDa.
Saran
Isolat Beauveria bassina hanya mengsekresikan satu jenis protein berdasarkan hasil SDS_PAGE, sehingga analisis yang perlu dilakukan pada penelitian selanjutnya adalah analisis elektroforesis zimogram untuk melengkapi informasi bobot molekul enzim kitinase dari Beauveria bassiana secara spesifik. Karakterisasi enzim kitinase yang dihasilkan Beauveria bassiana perlu dilakukan optimasi terhadap suhu dan pH, serta perlu dilakukan optimasi waktu inkubasi enzim kitinase dengan rentang waktu pengamatan yang lebih lama.
DAFTAR PUSTAKA
Bielka et al. 1984. Enzyme Nomenclature. New York: Academic Press. Bollag DM, Edelstein SJ. 1991. Protein Methods. New York: Wiley-Liss.
Bradford MM. 1976. A Rapid and Sensitive Method of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal. Biochem 12: 248-254.
Chasanah E, Suhartono MT, Huang JK, Pyun YR. 2002. Characterization of Chitosanase Enzyme from Thermophile Bacteria Bacillus licheniformis MB-2. Biotechnology 2: 87-93.
Chernin LSZ, Ismailov S, Haran, Chet. 1995. Chitinolytic Enterobacter agglomerans Antagonistic to Fungal Plant Pathogens. Applied and Environmental Microbiology 61(5): 1720-1726.
Dewi MI. 2008. Isolasi Bakteri dan Uji Aktivitas Kitinase Termofilik Kasar dari Sumber Air Panas Tinggi Raja, Simalungun Sumatera Utara [skripsi]. Sumatera utara: Universitas Sumatera Utara.
Downie B, Hilhorst HWM, Bewley JD. 1994. A New Assay for Quantifiying Endo-β-D-mananase Activiying using congo red dye. Phytochemistry 36: 829-835.
Harman GE et al. 1995. Chitinolytic Enzymes of Trichoderma harzianum: Purification of Chitobiosidase and Endochitinase. Phytopathology 83: 203-254.
Hayukkala I, Mitamura C, Hara S, Hirayae, Nishizawa, Hibi. 1993. Induction and Purification of Beauveria bassiana Chitinolytic Enzymes. Journal of Invertebrate Pathology 97-102.
Indriyati. 2009. Virulensi Jamur Entomopatogen Beauveria bassiana (Balsamo) Vuillemin (Deuteromycotina: Hyphomycetes) Terhadap Kutu Daun (Aphis spp.) dan Kepik Hijau (Nezara viridula) [skripsi]. Lampung: Jurusan Proteksi Tanaman, Universitas Lampung.
Methods, and Applications, 2th Ed. New York: John Wiley & Sons.
Kristanti ND. 2001. Pemurnian Parsial dan Karakterisasi Lipase Ekstraseluler dari Kapang R. oryzae TR 32 [tesis]. Bogor: Program Pascasarjana Ilmu Pangan, Institut Pertanian Bogor.
Leopold L, Anna S. 1970. Quantitative estimation of Chitinase and Several Other Enzymes In the Fungus Beauveria bassiana. Journal of Invertebrate Pathology 15: 34-42.
Lyoyd et al. 1965. Lysis of Fungal Mycelium by Streptomyces sp. and Their Chitinase Systems. Phytopathology 55:871-875.
Mubarik NR, Irni M, Amaryllis A, Sugeng S, Imam R. 2010. Chitinolytic Bacteria Isolated from Chili Rhizosphere: Chitinase Characterization and Its Application as Biocontrol for Whitefly (Bemisia tabaci Genn.). America Journal of Agricultural and Biological Sciences, Science Publications 5(4): 430-435.
Mattjik AA, Sumertajaya IM. 2006. Perancangan Percobaan dengan Aplikasi SAS dan MINITAB. Bogor: IPB Press.
Michael J, Bidochka, Kit I, Tong, George G, Khachatourians. 1993. Partial purification and Charaterization of Two Extracellular N-acetyl-D-glucosaminidases Produced by The Entomopathogenic Fungus Beauveria bassiana. Canadian Journal of Microbiology 39(1): 40-45.
Nurderbyandaru N. 2008. Pemanfaatan Bakteri Kitinolitik Asal Perakaran Tanaman Cabai Sebagai Biokontrol Kutu Daun (Aphis gossypii Glover) [Skripsi]. Bogor: Departemen Biologi, Institut Pertanian Bogor.
Nuraida, Hasyim A. 2009. Isolasi, Identifikasi, dan Karakterisasi Jamur Entomopatogen dari Rizosfir Pertanaman Kubis. J Hort 19(4): 419-432. Patidar P, Agrawal D, Banerjee T, Shrindar P. 2003. Chitinase Production by
Beauveria bassiana RD 101 Optimization of Parameter Under Solid Substrate Fermentation Conditions. World Journal of Microbiology and Biotechnology 21: 93-95.
Patil RS, Ghormade V, Deshpande MV. 2000. Chitinolytic Enzymes: An Exploration. Technol 26: 473-483.
Pelezar MJ, Chan ECS. 1986. Dasar-Dasar Mikrobiologi. Hadioetomo RS et al, penerjemah. Jakarta: UI Press. Terjemahan dari: Elements of Microbiology. Prayogo Y. 2006. Upaya Mempertahankan Keefektifan Cendawan
Entomopatogen untuk Mengendalikan Hama Tanaman Pangan. Litbang Pertanian 25 (2): 47-54.
Spindler KD. 1997. Chitinase and Chitosanase Assays. Muzarelli RAA and MG Peter, editor. Chitin Handbook. Alda Tecnografica 229-235.
Sumardi. 2004. Isolasi, Karakterisasi, dan Produksi β-mananase Ekstraseluler dari Geobacillus strearothermophilus 1-07 [disertasi]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Suhartono MT, Suwanto A, Widjaja H. 1992. Struktur dan Biokimiawi Protein [skripsi]. Bogor: Institut Pertanian Bogor.
Situmorang SH. 2003. Karakterisasi Enzim Kitinase Termostabil Isolat Bacillus licheniformis MB-2 dari Tompaso, Sulawesi Utara Menggunakan Teknik Zimogram [Skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Production by an Alkalophilic Marine Beauveria bassiana in Solid State Fermentation. Process Biochemistry 34: 257-267.
Toharisman A, Suhartono MT, Spindler-Barth, Hwang, Pyun YR. 2005. Purification and Characterization of Thermostable Chitinase from Bacillus litcheniformis Mb-2. World J. Microbiol, Biotechnol 21: 733-738.
Wenk MR, Fernandis AZ. 2007. A Manual for Biochemistry Protocols. Singapura: World Scientific.
Lampiran 1 Strategi penelitian
Peremajaan isolat Beauveria bassiana pada media PDA
Uji kualitatif aktivitas kitinolitik
Produksi dan isolasi enzim kitinase
Ekstrak kasar enzim kitinase
Pengendapan amonium sulfat 10, 30, 50, dan 70%
Dialisis
Karakterisasi enzim kitinase pH Suhu
Waktu inkubasi Pengaruh ion logam Kinetika enzim
Penentuan aktivitas
kitinase Penentuan
tingkat
kemurnian Penentuan
bobot molekul
Lampiran 2 Aktivitas kitinolitik Beauveria bassiana (Mubarik et al 2010)
Ulangan
Diameter koloni (cm)
Diameter zona
bening (cm) Rataan diameter koloni (cm)
Rataan diameter zona bening
(cm)
Indeks kitinolitik
Rataan indeks kitinolitik 1 2 1 2
1 2.5 2.5 2.6 2.6 2.5 2.6 1.040
1.035±4.000 2 2.5 2.5 2.57 2.6 2.5 2.585 1.034
3 2.6 2.7 2.65 2.8 2.65 2.725 1.028 4 2.6 2.6 2.7 2.7 2.6 2.7 1.038
Contoh perhitungan aktivitas kitinolik ulangan 1
Indeks kitinolitik =
Diketahui :
Rataan diameter zona bening : 2.6 cm
Rataan diameter koloni : 2.5 cm
Maka, indeks kitinolitik =
Lampiran 3 Hasil uji aktivitas kitinase pada perlakuan dengan pengendapan garam
Ulangan Absorban Absorban terkoreksi
Lampiran 4 Hasil analisis statistik pengaruh konsentrasi amonium sulfat
Hasil analisis statistik dengan ANOVA
Sum of Squares df Mean Square F Sig.
Between Groups .000 4 .000 523.845 .000
Within Groups .000 10 .000
Total .000 14
H0 : perlakuan tidak berpengaruh terhadap aktivitas enzim H1 : perlakuan berpengaruh terhadap nilai aktivitas enzim
Karena nilai Sig. kurang dari alpha 5%, maka tolak H0 yang berarti perlakuan konsentrasi amonium sulfat berpengaruh terhadap nilai aktivitas enzim.
Hasil pengaruh konsentrasi amonium sulfat berdasarkan uji Duncan dengan selang kepercayaan 95%
Faktor N Subset
1 2
Amonium
Amonium
sulfat 10% 3 .004600
Amonium
sulfat 30% 3 .004767
Amonium
sulfat 50% 3 .004767
Amonium
sulfat 70% 3 .013333
Sig. .054 1.000
Means for groups in homogeneous subsets are displayed. Based on observed means.
Lampiran 5 Pengukuran aktivitas kitinase Modifikasi Spindler (Toharisman et al 2005)
diinkubasi pada suhu 370C selama 30 menit
disentrifus dengan kecepatan 5000 rpm, selama 5 menit.
Bahan Sampel (µL) Blanko (µL) Campuran Enzim 500 -
Aquades 500 1000
Reagen Schales 1000 1000
dididihkan selama 10 menit
ukur pada λ = 420 nm
Rumus perhitungan:
Aktivitas enzim
Y (Absorbansi terkoreksi) = (Absorban blanko-Absorban sampel) X = konsentrasi N-asetil-D-glukosamin (mg/L)
mmol/ml =
Aktivitas enzim (U/mL) =
Total aktivitas enzim (U) : aktivitas enzim (U/mL) x volume enzim (mL) Total protein : protein (mg/mL) x volume enzim (mL)
Aktivitas spesifik
U/mg =
Keterangan :
U : sejumlah enzim yang menghasilkan N-asetilglukosamin sebesar satu µmol/menit
C : konsentrasi sampel (mmol/ml T : waktu inkubasi (menit) A : volume total reaksi (ml) B : volume supernatan (ml)
D : volume enzim yang direaksikan (ml) Bahan Sampel (µL) Substrat koloidal
kitin 300
Buffer fosfat 150
Data standar N-asetil- D-glukosamin λ= 420 nm (Toharisman et al 2005).
No. [N-asetil-D-glukosamin]
(mg/mL) Absorbansi Absorbansi terkoreksi
1 0 0.419 0
2 10 0.375 0.044
3 20 0.344 0.075
4 30 0.321 0.098
5 40 0.251 0.168
6 50 0.212 0.207
7 60 0.188 0.231
8 70 0.121 0.298
9 80 0.084 0.335
10 90 0.062 0.357
11 100 0.020 0.399
Kurva standar N-asetil-D-glukosamin
Y=-0.003 + 4.082x10-3X
R=99.67%
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35 0,4 0,45
0 50 100 150
Absor
ba
nsi
ter
kore
ksi
(A
)
Lampiran 6 Pengukuran kadar protein (Bradford 1976)
Data standar serum albumin
No. [Serum albumin]
Kurva standar serum albumin
Lampiran 7 Karakterisasi kitinase berdasarkan pH
No. Jenis bufer
PH Ulangan Absorbansi Absorban terkoreksi
Lampiran 8 Hasil analisis statistik pengaruh pH
Hasil analisi statistik dengan ANOVA
Sum of Squares df Mean Square F Sig.
Between Groups .000 7 .000 31.429 .000
Within Groups .000 16 .000
H0 : perlakuan tidak berpengaruh terhadap aktivitas enzim H1 : perlakuan berpengaruh terhadap nilai aktivitas enzim
Nilai Sig. kurang dari alpha 5%, maka tolak H0 yang berarti perlakuan pH berpengaruh terhadap nilai aktivitas enzim
Hasil pengaruh pH berdasarkan uji Duncan dengan selang kepercayaan 95%
Faktor N Subset
1 2 3 4 5 6
pH 3 3 .003567
pH 8 3 .004067
pH 6 3 .004133 .004133
pH 7 3 .004433 .004433
pH 10 3 .004733 .004733
pH 9 3 .004900
pH 5 3 .004967
pH 4 3 .005333
Sig. 1.000 .653 .056 .056 .147 1.000
Means for groups in homogeneous subsets are displayed. Based on observed means.
Lampiran 9 Karakteristik kitinase berdasarkan suhu
No. Suhu Ulangan absorbansi Absorban
terkoreksi
Lampiran 10 Hasil analisis statistik pengaruh suhu
Hasil analisis statistik dengan ANOVA
Sum of Squares df Mean Square F Sig.
Between Groups .000 7 .000 25.798 .000
Within Groups .000 16 .000
Total .000 23
H0 : perlakuan tidak berpengaruh terhadap aktivitas enzim H1 : perlakuan berpengaruh terhadap nilai aktivitas enzim
Hasil pengaruh suhu berdasarkan uji Duncan dengan selang kepercayaan
95%
Faktor N Subset
1 2 3 4 5
25oC 3 .004433
60oC 3 .005467
30oC 3 .005500
40oC 3 .005800
35oC 3 .006500
55oC 3 .006533
45oC 3 .007333
50oC 3 .008133
Sig. 1.000 .346 .920 1.000 1.000
Means for groups in homogeneous subsets are displayed. Based on observed means.
Lampiran 11 Karakterisasi kitinase berdasarkan waktu inkubasi
No.. Waktu
(menit)
Ulangan Absorbansi Absorban terkontrol
Lampiran 12 Hasil analisis statistik pengaruh waktu inkubasi
Hasil analisis statistik dengan ANOVA
Sum of Squares df Mean Square F Sig.
Between Groups .000 5 .000 1.708 .207
Within Groups .000 12 .000
Total .000 17
H0 : perlakuan tidak berpengaruh terhadap nilai aktivitas enzim H1 : perlakuan berpengaruh terhadap nilai aktivitas enzim
Lampiran 13 Karakterisasi kitinase berdasarkan pengaruh ion logam
No.
Jenis garam ion
logam
Ulangan Absorbansi Absorban
terkoreksi
Lampiran 14 Hasil analisis statistik pengaruh ion logam
Hasil analisis statistik dengan ANOVA
Sum of Squares df Mean Square F Sig.
Between Groups .000 7 .000 39.398 .000
Within Groups .000 16 .000
Total .000 23
H0 : perlakuan tidak berpengaruh terhadap nilai aktivitas enzim H1 : perlakuan berpengaruh terhadap nilai aktivitas enzim
Hasil pengaruh ion logam berdasarkan Uji Duncan dengan selang kepercayaan 95%
faktor N Subset
1 2 3 4
Mg2+ 3 .004833
Zn2+ 3 .005800 .005800
K+ 3 .005867 .005867
EDTA 3 .006167 .006167
Na+ 3 .006600 .006600
Cu2+ 3 .007667
Fe2+ 3 .010100
Mn2+ 3 .016400
Sig. .078 .064 1.000 1.000
Means for groups in homogeneous subsets are displayed. Based on observed means.
Lampiran 15 Kinetika enzim
Kurva linear antara 1/[koloid kitin] dengan 1/V Kurva double reciprocal Lineawever-Buk
Perhitungan pada koloid kitin 0.1% : Absorban terkoreksi = Ablanko– Asampel
Absorban terkoreksi ulangan 1 = 0.423 – 0.264 = 0.159
Absorban terkoreksi ulangan 2 = 0.423 – 0.290 = 0.133
[NAG] diperloleh dari persamaan standar N-Aseti-D-Glukosamin
V ulangan 2 = 0.016
Persamaan Lineweaver-Burk : Y= 14.307+3.260x 1/Vmaks = 14.307
Vmaks = 1/14.307
Vmaks = 0.069 mg/L detik
Km/Vmaks = 3.260 Km = 3.260x0.069 Km = 0.225 mg/L
Kemiringan = Km/ V, maka 0.225/0.069 = 3.261