RAFITAH HASANAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Telur Ikan Tambakan (Helostoma temminckii C.V) Nama : Rafitah Hasanah
NRP : C351070021
Disetujui, Komisi Pembimbing
Dr. Ir. Linawati Hardjito, M.Sc Dr. Ir. Bustami Ibrahim, M.Sc
Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Hasil Perairan
Dr. Tati Nurhayati, S.Pi, MSi Dr. Ir. Dahrul Syah, M.Sc. Agr
IDENTIFIKASI BAKTERI DAN KOMPOSISI KIMIA
PRODUK FERMENTASI TELUR IKAN TAMBAKAN
(Helostoma temminckii C.V)
RAFITAH HASANAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Identifikasi Bakteri dan Komposisi Kimia Produk Fermentasi Telur Ikan Tambakan (Helostoma
temminckii C.V) adalah karya saya dengan arahan dari komisi pembimbing dan
belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini
Bogor, September 2011
@ Hak Cipta milik Institut Pertanian Bogor Tahun 2011 Hak
Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulisan ini tanpa mencantumkan atau menyebut sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah b. Pengutipan tidak merugikan kepentingan yang wajar IPB
Penulis dilahirkan di Balikpapan pada tanggal 20 November 1980 dari Ayah H. Sjachrim dan ibu Hj. Surimah (Alm). Penulis merupakan putri kesepuluh dari sebelas bersaudara.
Tahun 1999 penulis lulus dari SMU Negeri 3 Balikpapan dan pada tahun 2004 penulis lulus dari Fakultas Perikanan dan Ilmu Kelautan, Jurusan Pengolahan Hasil Perikanan Universitas Lambung mangkurat. Pada tahun 2007 penulis melanjutkan Pendidikan sekolah Pascasarjana (S2) di Teknologi Hasil Perairan IPB dengan sponsor BPPS.
ABSTRACT
RAFITAH HASANAH. Bacteria identification and Chemical Composition of
Fermented Kissing Gourami Fish Roes (Helostoma temminckii C.V). Supervised
by LINAWATI HARDJITO and BUSTAMI IBRAHIM
This research aimed to identify bacteria found in fermented kissing gourami fish roes. Furthermore, chemical composition of fermented product was reported. The parameters analyzed were metal content and proximate of fresh fish roes. Analyzed parameter of fermented product included proximate, Cl content, pH, amino acid, free amino acid, fatty acid and minerals (Mg, Ca, K, Na) contents. The results described 5 (five) different colony of bacteria grew dominantly. Those colonies were isolated using tryptic soy agar (TSA) media and determined using BBL Crystal method. The bacteria were identified as Bacillus megaterium, Leifsonia aquatic (Corynebacterium aquaticum), Corynebacterium
propinquum, Lysinibacillus sphaericus (Bacillus sphaericus). The chemical
analysis of fresh fish roes showed it contained Hg<0,001 mg/Kg, Pb<0,01 mg/Kg, Cd<0,01 mg/Kg. The moisture, protein, fat and ash content were 43,82±0,01%, 12,64±0,47%, 21,73±2,19%, 0,99±0,04% respectively. Based on the results it was concluded that fish roes was in a good condition and safe to be consumed. The chemical composition of the fermented product were 39,26±0,47%, 11,84±1,92%, 15,14±1,92%, 12,45±0,38% for moisture, protein, fat and ash respectively. Minerals contents were 0,08%, 0,06%, 0,15%, 4,76% for K, Ca, Mg, Na respectively. Cl content was 10,25 % and pH of 5,26. The higher amino acid content of fermented fish roes protein was glutamic acid (2,02% of total amino acid) and the limiting amino acids were threonine and leucine. In addition it also contained free amino acid. Fatty acid composition of fermented showed that palmitoleic acid was higher than the others.
RAFITAH HASANAH. Identifikasi Bakteri dan Komposisi Kimia Produk Fermentasi Telur Ikan Tambakan (Helostoma temminckii c.v). Dibimbing oleh
LINAWATI HARDJITO dan BUSTAMI IBRAHIM.
Fermentasi telur ikan tambakan adalah salah satu bentuk upaya meningkatkan jual produk. Penelitian ini bertujuan untuk mengisolasi dan mengidentifikasi bakteri setelah proses fermentasi setahun pada telur ikan tambakan secara spontan dan nantinya dapat diaplikasikan sebagai starter. Penelitian ini dilakukan empat tahap yaitu: pembuatan produk fermentasi telur ikan tambakan, isolasi bakteri, identifikasi bakteri, dan analisis kimia telur segar serta telur fermentasi.
Proses pembuatan fermentasi telur Tambakan adalah sebagai berikut : telur tambakan dibersihkan terlebih dahulu. Telur yang telah bersih kemudian diberi garam rakyat sebanyak 250 gram untuk 1 Kg telur ikan. Campuran antara telur tambakan dan garam kemudian dimasukan ke dalam botol kaca yang sudah bersih lalu ditutup rapat dan disinilah dimulai proses fermentasi. Produk fermentasi yang digunakan pada penelitian ini menggunakan sampel yang telah difermentasi selama setahun.
Bakteri dikembangbiakkan dengan menginokulasikan bakteri ke agar TSA, dengan teknik cawan tuang lalu diinkubasi dalam keadaan aerob selama 24 jam. Koloni tunggal yang terbentuk diperiksa menggunakan pewarnaan Gram untuk melihat warna dinding sel dan bentuk dari sel tersebut. Pengamatan dinding sel bakteri, menggunakan mikroskop cahaya perbesaran sebesar 1000x dan menggunakan minyak emersi. Bakteri kultur murni yang telah diperoleh, diidentifikasi untuk mengetahui jenis bakteri pada produk fermentasi telur ikan tambakan. Metode identifikasi ini menggunakan kit BBL Crystal Garam positif.
Analisis kimia menggunakan metode AOAC 1995, pada telur segar ikan tambakan meliputi analisis logam berat dan analisis proksimat sedangkan analisis kimia untuk fermentasi telur ikan tambakan meliputi kadar proksimat, Cl, pH, mineral (Mg, Ca, K dan Na), asam amino, asam amino bebas, asam lemak.
Hasil perhitungan total plate count (TPC) jumlah koloni yang tumbuh adalah 117 x 102 koloni untuk 0% NaCl, 149 x 102 koloni untuk 5% NaCl, 134 x 102 untuk 10% NaCl. Jenis bakteri yang telah diidentifikasi dari produk fermentasi telur ikan tambakan pada media TSA yang ditambahkan 5% NaCl adalah Bacillus megaterium, Leifsonia aquatic (Corynebacterium aquaticum),
Corynebacterium propinquum, Lysinibacillus sphaericus (Bacillus sphaericus).
Hasil analisis untuk logam berat dari telur ikan segar memiliki kadar air raksa (Hg) < 0,001 mg/Kg; timbal (Pb) < 0,01 mg/Kg; kadmium (Cd) <0,01 mg/Kg. Berdasarkan SNI tahun 2009 tentang batas maksimun cemaran logam berat dalam pangan, maka dapat disimpulkan bahwa telur ikan segar masih aman jika dikonsumsi baik dalam kondisi segar ataupun dalam bentuk olahan. Hasil analisis untuk kadar air 43,82±0,01%, kadar protein 12,64±0,47%, kadar lemak 21,73±2,19%, kadar abu 0,99±0,04%, karbohidrat 20,82%.
karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2010 sampai April 2011 ini ialah Identifikasi Bakteri dan Komposisi Kimia Produk Fermentasi Telur Ikan Tambakan (Helostoma temminckii c.v).
Terima kasih penulis ucapkan kepada Dr. Ir. Linawati Hardjito, M.Sc dan Dr. Ir. Bustami Ibrahim, M.Sc selaku pembimbing, serta Dr. Tati Nurhayati, S.Pi. M.Sc selaku ketua Program Studi, yang telah banyak memberi saran dan motivasi. Ungkapan terima kasih juga disampaikan kepada kedua orangtuaku, kakak, adik, serta teman-teman, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2011
DAFTAR ISI
3.3.1 Pembuatan produk fermentasi telur ikan tambakan ...14
3.3.2 Isolasi bakteri (BSN 2009) ...14
3.3.3 Identifikasi bakteri ...16
(1) Pewarnaan Gram (BSN 2009) ...16
(2) Uji motilitas (BSN 2009) ...17
(3) Uji katalase (BSN 2009) ...17
(4) Uji oksidase (BSN 2009) ...17
(5) Uji oksidatif-fermentatif (BSN 2009) ...18
(6) BBL crystal kit system ...18
3.3.4 Analisis Kimia ...20
(1) Pengukuran nilai pH (AOAC 1995) ...20
(2) Kadar garam (Cl) (AOAC 1995) ...20
(3) Kadar air (AOAC 1995) ...20
(4) Kadar abu (AOAC 1995) ...21
(5) Kadar protein (AOAC 1995) ...21
(6) Kadar lemak (AOAC 1995) ...22
(7) Analisis logam berat (AOAC 1995) ...22
(8) Analisis mineral (AOAC 1995) ...23
(9) Analisis asam amino (AOAC 1995) ...23
4.3 Karakteristik Bakteri ... 30
4.3.1 Pewarnaan Gram ... 30
4.3.2 Uji motilitas ... 31
4.3.3 Uji katalase... 32
4.3.4 Uji oksidase ... 33
4.3.5 Uji oksidatif-fermentatif ... 34
4.3.6 BBL crystal kit sistem ... 35
4.4 Sifat Kimiawi Telur Ikan Segar dan Produk Fermentasi Telur Ikan Tambakan ... 42
4.4.1 Kandungan logam berat telur ikan tambakan segar ... 42
4.4.2 Proksimat, mineral dan pH produk fermentasi telur ikan tambakan ... 43
4.4.3 Kandungan asam amino dan asam amino bebas ... 46
4.4.4 Kandungan asam lemak pada produk fermentasi telur ikan tambakan ... 48
5 SIMPULAN DAN SARAN ... 51
DAFTAR PUSTAKA ... 53
DAFTAR TABEL
Halaman
1 Sifat morfologi koloni yang diisolasi ... 30
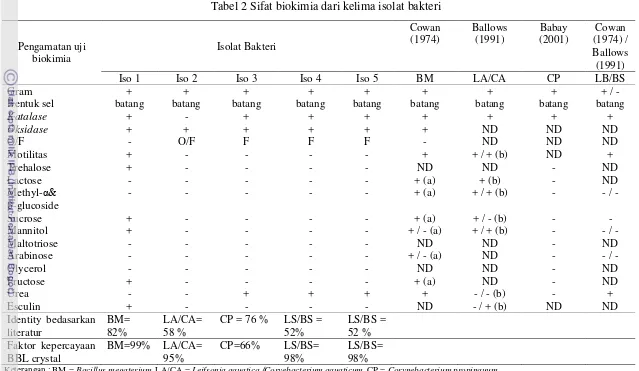
2 Sifat biokimia kelima isolat bakteri ... 37
3 Hasil identifikasi bakteri ... 38
4 Komposisi logam barat pada telur ikan tambakan segar ... 42
5 Proksimat telur segar dan telur fermentasi ikan tambakan ... 43
6 Kadar mineral fermentasi telur ikan tambakan ... 45
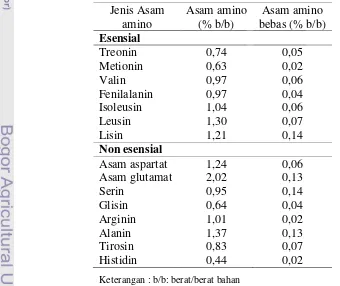
7 Kandungan asam amino dan asam amino bebas fermentasi telur ikan tambakan ... 46
8 Klasifikasi asam amino berdasarkan sifatnya ... 48
9 Skor kimia asam amino esensial ... 48
1 Kerangka pemikiran penelitian ... 4
2 Ikan tambakan ... 6
3 Telur ikan tambakan hasil fermentasi ... 7
4 Kurva pertumbuhan mikroba ... 12
5 Diagram alir proses pembuatan fermentasi telur ikan tambakan ... 15
6 Diagram alir pengujian mikrobiologi kuantitatif (A) dan kualitatif (B)...19
7 Produk fermentasi telur ikan tambakan... 27
8 Koloni yang diisolasi ... 28
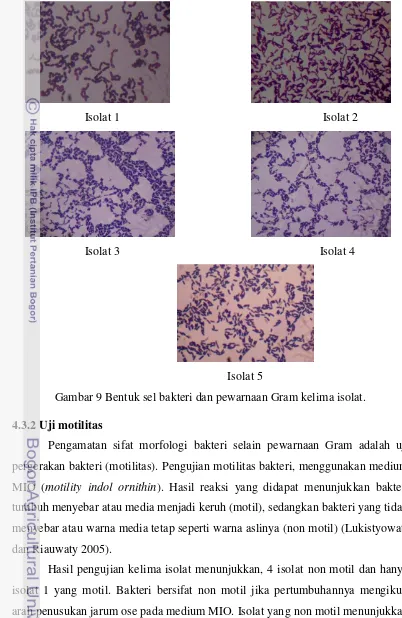
9 Bentuk sel bakteri dan pewarnaan Gram kelima isolat ... 31
10 Hasil reaksi uji motilitas... 32
11 Hasil reaksi oksidatif fermentatif dan non-oksidatif fermentatif ... 35
DAFTAR LAMPIRAN
Halaman
1 Komposisi media yang digunakan pada penelitian ... 60
2 Dokmentasi pembuatan produk fermentasi telur ikan tambakan ... 61
3 Prosdur total plate count (BSN 2009) ... 62
4 Prosedur pewarnaan Gram (BSN 2009) ... 65
5 Prosedur uji motilitas (BSN 2009)... 67
6 Prosedur uji katalase (BSN 2009) ... 68
7 Prosedur uji oksidase (BSN 2009) ... 69
8 Prosedur uji oksidatif-fermentatif (BSN 2009) ... 70
9 Prosedur BBL crystal ID GP ... 71
16 Hasil perubahan warna dan deteksi menggunakan sinar UV (ultra violet) setelah diinkubasi ... 83
17 Kunci identifikasi bakteri Gram positif (Cowan 1974) ... 84
18 Hasil identifikasi BBL crystal isolat 1 ... 85
19 Hasil identifikasi BBL crystal isolat 2 ... 86
20 Hasil identifikasi BBL crystal isolat 3 ... 87
21 Hasil identifikasi BBL crystal isolat 4 ... 88
22 Hasil identifikasi BBL crystal isolat 5 ... 89
23 Hasil perubahan warna dan sinar serta hasil identifikasi bakteri ... 90
24 Kromatogram asam amino produk fermentasi telur ikan tambakan .. 93
25 Kromatogram asam amino bebas produk fermentasi telur ikan tamabakan ... 94
1. PENDAHULUAN
1.1 Latar Belakang
Aryanta (2000) diacu dalam Wulandari (2005) menyatakan bahwa Indonesia terkenal dengan berbagai macam makanan tradisional fermentasi yang tersedia di pasar tradisional maupun pasar modern. Mayoritas makanan tradisional fermentasi tersebut diproduksi dalam skala kecil atau skala rumah tangga. Makanan tradisional fermentasi tersebut memegang peranan penting dalam memenuhi kebutuhan makanan sehari-hari masyarakat dan banyak mengandung protein, karbohidrat dan vitamin.
Kalimantan Timur memiliki produk makanan tradisonal pada dipasar-pasar tradisional. Macam makanan tradisional yang tersedia antara lain, ikan asin tipis, ikan asap, terasi, telur tambakan, amplang, lempok durian, abon kepiting, abon ikan gabus. Fermentasi telur ikan tambakan merupakan salah satu produk khas dari samarinda-Kalimantan Timur biasa disebut telur biawan.
Ikan tambakan merupakan ikan yang memiliki nilai ekonomis tinggi karena selain dibudidayakan, juga dijadikan sebagai ikan hias. Data hasil tangkapan ikan tambakan di Kutai Kartanegara pada tahun 2010 adalah sebesar 3.443,1 ton (Dinas Perikanan dan Kelautan Kutai Kartanegara 2010).
Selain dagingnya dikonsumsi dalam bentuk segar, ikan tambakan juga dibuat dalam bentuk produk olahan sampingan sebagai ikan asin, sedangkan telurnya dimanfaatkan sebagai produk fermentasi yang dikenal dengan nama telur biawan. Proses pembuatannya dilakukan dengan cara membelah perut ikan dan mengeluarkan telurnya dari isi perut selanjutnya telur dibersihkan dari kotoran dan darah dengan air lalu dimasukkan dalam wadah tertutup dan diberi garam (25%) dari berat telur ikan. Telur yang telah diberi garam dibiarkan selama seminggu atau sampai beberapa bulan bahkan sampai setahun (proses fermentasi). Produk fermentasi telur ikan tambakan ini umumnya dikonsumsi sebagai lauk pendamping.
2
dilakukan terhadap ikan-ikan kecil, ikan murah yang kurang baik mutunya jika diolah langsung keadaan utuh, dan ikan pada waktu penangkapan yang terdiri dari campuran berbagai jenis ikan.
Pada proses fermentasi ditambahkan garam untuk menghambat pertumbuhan mikroorganisme pembusuk dan patogen. Garam dapat menyebabkan terjadinya penarikan air dalam bahan pangan sehingga aw (aktivitas air) bahan pangan akan menurun dan mikroorganisme pembusuk tidak akan tumbuh (Adawyah 2008).
Studi fermentasi dimasa mendatang akan menjadi semakin penting, disamping untuk pengawetan diharapkan juga untuk memperkaya produk pangan dengan menghasilkan sumber pangan yang baru. Produk-produk fermentasi yang diproses dengan metode dan kondisi yang tepat memiliki banyak keunggulannya dalam hal keawetannya. Proses fermentasi ini tidak terlepas dari peranan bakteri yang memiliki sifat yang berbeda. Bakteri-bakteri yang terlibat dalam fermentasi ini sangat berpengaruh pada mutu produk akhir. Oleh karena itu, penelitian ini dilakukan untuk mengetahui jenis-jenis bakteri yang terlibat dalam proses fermentasi telur ikan tambakan serta peranannya dalam menghasilkan senyawa-senyawa kimia yang mempengaruhi produk akhir.
1.2Perumusan Masalah
Hasil perikanan merupakan makanan perishable food atau makanan yang mudah rusak. Kerusakan hasil perikanan disebabkan oleh aktivitas enzim, mikroorganisme, dan oksidasi dalam tubuh ikan itu sendiri. Sifat mudah rusak yang dimiliki hasil perikanan dapat menghambat usaha pemasaran bahkan kerugian besar terutama di saat produksi melimpah. Oleh karena itu, diperlukan proses pengolahan dan pengawetan hasil perikanan untuk memperpanjang daya simpan dan menganekaragamkan produk olahan hasil perikanan.
Telur tambakan merupakan produk hasil perikanan yang diolah dengan cara fermentasi. Fermentasi pada telur tambakan terjadi secara spontan, dimana pembuatannya hanya menambahkan garam. Penambahan garam dalam pembuatan telur tambakan mengakibatkan hanya mikroba tertentu saja yang dapat tumbuh. Selama proses fermentasi, diharapkan bakteri yang tumbuh adalah yang menguntungkan, sehingga perlu dilakukan isolasi dan identifikasi,untuk mengetahui bakteri apa yang terlibat didalamnya. Berkaitan dengan produk fermentasi telur tambakan, diperlukan penelitian yang dapat memberikan informasi tentang keamanan dan mutu produk fermentasi telur tambakan yang dihasilkan oleh pengolah tradisional di Kalimantan Timur.
1.3 Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk mengidentifikasi bakteri dan mengkarakterisasi kimiawi produk fermentasi telur tambakan. Penelitian ini diharapkan dapat memberikan jenis bakteri yang berperan selama fermentasi spontan dan karekteristik kimia produk yang dihasilkan.
1.4 Hipotesis
Fermentasi diduga berpengaruh terhadap karakteristik bakteri dan kimia pada produk fermentasi telur tambakan (Helostomatemmincki C.V).
1.5 Kerangka Pemikiran
4
Gambar 1 Kerangka pemikiran penelitian Telur ikan tambakan segar
Fermentasi
Proses mikrobiologis dan enzimatis
Asam laktat Asam lemak
Asam amino
protein Lemak karbohidrat
2. TINJAUAN PUSTAKA
2.1 Ikan Tambakan
Ikan tambakan merupakan salah satu jenis ikan hias penyusun sarang busa yang cukup terkenal dikalangan pembudidaya ikan hias dan dikenal dengan nama dagang kissing gourami sedangkan di Indonesia dikenal dengan nama ikan tambakan. Ikan ini mempunyai kebiasaan yang unik di akuarium. Ikan tambakan menempelkan bibirnya pada benda-benda dalam akuarium, misalnya batu-batuan, kaca, dan filter. Ikan tambakan merupakan ikan yang kosmopolit, mudah ditemukan pada segala macam perairan, ikan tambakan ini dapat hidup pada perairan tergenang yang miskin oksigen (Susanto dan Lingga 1987).
Ikan tambakan (Helostoma temmincki C.V) menurut Saanin (1984) mempunyai susunan taksonomi sebagai berikut :
Filum : Chordata
Kelas : Pisces
Sub kelas : Teleostei
Ordo : Percomorphoidei
Sub-ordo : Anabantoidea
Famili : Anabantidei
Genus : Helostoma
Species : Helostoma temminckii Cuvier dan Valenciennes
6
Gambar 2 Ikan Tambakan (sumber: koleksi pribadi).
Warna dasar badannya kekuningan hingga perak kehijauan, antara bagian atas dan bawah badan mempunyai warna yang tidak rata. Pada sebelah atas badannya mempunyai warna yang lebih gelap atau berwarna hijau zaitun, sedangkan perutnya selalu berwarna putih. Sirip-siripnya berwarna kehijauan atau kuning pucat. Khusus sirip punggung dan anus pada sebelah depannya mempunyai pinggiran berwarna gelap. Matanya berwarna coklat, agak kuning. Pada lingkungan yang baik, tambakan akan memperlihatkan sebentuk garis berwarna gelap pada bagian belakang sirip pungging dan anus, juga pada sirip ekor. Sisiknya agak kasar, jika diraba terasa ada durinya. Sisik ini tergolong sisik ctenoid (Susanto et al. 1987).
Bentuk badan tambakan tinggi dan gepeng, sirip dorsal panjang dengan 16-18 jari keras dan 13-16 jari lunak, sirip anal dengan 13–15 jari keras dan 17–19 jari lunak. Sirip dada besar, membulat dan sirip ekor cekung. Garis sisi terbagi atas 2 bagian, bagian posterior mulai di bawah ujung bagian anterior, melalui 43–48 sisik. Tidak ada tanda yang jelas untuk membedakan jenis kelamin, tetapi ikan betina umumnya lebih gemuk. Ada 2 macam warna pada ikan ini yaitu hijau dengan dengan garis pada sisi abu-abu dan sirip coklat gelap, dan ada yang berwarna merah jambu albino dengan sisik keperakan (Gaffar 2007).
mengambil algae yang menempel dengan menggunakan bibirnya. Ikan jantan menonjolkan bibir sebagai upaya dominasi dan teritorialitas. Pemijahan terjadi pada awal musim hujan bulan September sampai Oktober, telur ditebar di perairan terbuka. Pemijahan dimulai oleh ikan betina pada perairan yang tertutup tanaman air. Telur ikan tambakan berbentuk speris, berwarna kuning muda, lunak dan terapung. Satu hari setelah fertilisasi telur akan menetas, dan anakan akan mulai berenang 2 hari kemudian (Syahraini et al. 2005).
2.2 Telur Ikan
Kaitaranta (1980); Tocher, Sergeant (1984); Bledsoe, Rascoe (2003) diacu dalam Shirai et al. (2006) menyatakan bahwa telur ikan telah banyak dikonsumsi diberbagai belahan negara dan caviar merupakan salah satu nama yang biasa digunakan untuk menyebut telur ikan. Telur ikan yang telah digarami dan paling banyak dikonsumsi oleh orang jepang berasal dari ikan salmon, Pollock, flyingfish (ikan terbang) dan herring. Kandungan nutrisi yang terdapat pada telur ikan lebih banyak berupa lemak, telur ikan banyak sekali mengandung eicosapentaenoic acid (C20:5n-3) dan docosahexaenoic acid (C22:6n-3). Asam lemak ini memiliki peran penting dalam mencegah dan mengobati penyakit kardiovaskular.
Salah satu ikan air tawar yang ada di daerah Kalimantan Timur adalah ikan tambakan. Ikan ini banyak dikonsumsi oleh masyarakat baik dalam bentuk segar maupun dalam bentuk olahan ikan asin, selain dagingnya dikonsumsi telurnya juga dimanfaatkan oleh masyarakat. Pemanfaatan telur ikan tambakan secara tradisional telah dilakukan oleh masyarakat di daerah Kalimantan Timur dengan cara fermentasi yang hanya di beri garam. Telur ikan tambakan berbentuk speris, lunak dan berwarna kuning muda. Telur ikan tambakan yang telah difermentasi disajikan pada Gambar 3.
8
2.3 Fermentasi
Steinkraus (1996) diacu dalam Riebroy et al. (2007) menyatakan bahwa fermentasi merupakan cara yang tertua disamping pengeringan yang dipraktekkan manusia untuk tujuan pengawetan dan pengolahan. Penelitian di bidang fermentasi makanan telah mengungkapkan bahwa melalui proses fermentasi, bahan makanan akan mengalami perubahan-perubahan fisik dan kimia yang menguntungkan seperti flavor, aroma, tekstur, daya cerna dan daya tahan simpan.
Syah (2004) menyatakan bahwa pada prinsipnya fermentasi adalah proses perubahan substrat organik yang kompleks menjadi komponen yang lebih sederhana dengan adanya aktivitas enzim dan mikroba dalam keadaan yang terkontrol. Bahan-bahan atau komponen yang dihasilkan dapat menghambat kegiatan mikroba pembusuk. Selain menghambat pertumbuhan mikroorganisme yang tidak diinginkan, perubahan yang terjadi dapat memperbaiki nilai gizi produk.
Lay (2002) diacu dalam Lee et al. (2009) menyatakan bahwa fermentasi terjadi sebagai hasil metabolisme tipe anaerobik, dimana mikroba dapat mencerna glukosa sebagai bahan baku energinya tanpa oksigen, sebagai hasilnya hanya sebagian glukosa yang dipecah dan menghasilkan sejumlah kecil energi, CO2, air
dan produk akhir metabolisme lainnya. Jika kedalam bahan mentahnya ditambahkan sumber karbohidrat, misalnya pati atau nasi, maka selama fermentasi akan terjadi pemecahan pati menjadi komponen-komponen yang lebih sederhana seperti asam dan alkohol, sedangkan lemak dipecah menjadi gliserol dan asam-asam lemak.
dimana mikroba tersebut akan berkembang biak dan aktif dalam mengubah bahan yang difermentasi menjadi produk yang diinginkan.
Proses fermentasi merupakan proses biokimia dengan menggunakan kelompok bakteri asam laktat, sehingga hasilnya dapat dijadikan sebagai salah satu cara pemanfaatan sumber bahan makanan. Fermentasi dianggap sebagai usaha untuk pengawetan bahan makanan paling murah, mudah dan sederhana, serta tidak tergantung pada tempat dan musim. (Ruddle et al. 2005).
Seveline (2005) menyatakan bahwa dalam proses fermentasi untuk pengolahan makanan dan minuman dapat melibatkan bakteri asam laktat. Peranan utama bakteri asam laktat adalah sebagai kultur starter produk-produk yang melibatkan proses fermentasi untuk memperoleh produk akhir pangan dengan konsistensi yang tinggi, tahan lama, awet dan umumnya bakteri ini tergolong aman. Pengklasifikasian bakteri asam laktat berdasarkan beberapa hal yaitu : morfologinya, fermentasi glukosa, perbedaan tumbuh pada suhu-suhu tertentu, konfigurasi produksi asam laktat, kemampuan untuk tumbuh pada konsentrasi garam tinggi dan kemampuan toleransinya terhadap asam dan basa.
Cooke, Twiddy, Rielly (1987); Gelman, Drabkin, Glatman (2000); Muller, Madsen, Sophanodora, Gram, Moller (2002); diacu dalam Hu et al. (2008) menyatakan bahwa proses pengawetan ikan dengan cara fermentasi mempunyai beberapa keuntungan diantaranya :proses pengolahannya tidak mahal, menghasilkan bahan buangan dalam jumlah kecil, teknik pembuatannya sederhana dan mudah diterapkan secara tradisional, produk fermentasi mempunyai daya simpan panjang, suhu dan kelembaban yang tinggi di daerah tropis dapat merangsang pertumbuhan mikroorganisme yang berperan dalam proses fermentasi, produk dapat diterima oleh semua lapisan masyarakat, dan tidak memerlukan pengepakan dan distribusi khusus.
10
2.4 Peranan Garam dalam Fermentasi
Proses fermentasi pada umumnya disertai dengan penggaraman, pengawetan produk fermentasi diperoleh dari efek penggaraman yang akan menahan perkembangan bakteri patogen, selain itu garam juga berfungsi sebagai antimikroba (Huda 2004). Pendapat ini didukung juga oleh Heruwati (2002) menyatakan bahwa penambahan garam dalam fermentasi ikan mempunyai beberapa fungsi, yaitu meningkatkan rasa ikan, membentuk tekstur yang diinginkan, mengontrol pertumbuhan mikroorganisme yang diinginkan yang berperan dalam fermentasi, dan menghambat pertumbuhan mikroorgansime pembusuk dan patogen.
Garam dapat berfungsi sebagai penghambat pertumbuhan mikroorganisme pembusuk dan patogen karena mempunyai sifat-sifat antimikroba sebagai berikut: a) garam dapat meningkatkan tekanan osmotik substrat, b) garam dapat menyebabkan terjadinya penarikan air dari dalam bahan pangan sehinggga aw
bahan pangan akan menurun dan mikroorganisme tidak akan tumbuh, c) garam mengakibatkan terjadinya penarikan air dari dalam sel mikroorganisme, sehingga sel akan kehilangan air dan mengalami pengerutan, d) ionisasi garam akan menghasilkan ion khlor yang beracun terhadap mikroorganisme dan e) garam dapat menganggu kerja enzim proteolitik karena dapat mengakibatkan terjadinya denaturasi protein (Adawyah 2008).
Kim et al. (1997); Morioko et al. (1999); diacu dalam Dissaraphong et al.
(2006) menyatakan bahwa proses fermentasi biasanya dilakukan selama beberapa minggu atau beberapa bulan, tergantung jenis produk. Daya awet produk ini juga bervariasi antara beberapa minggu hingga beberapa bulan. Produk seperti kecap ikan bahkan dapat disimpan hingga lebih dari satu tahun.
2.5 Bakteri
Bakteri dapat dianggap sebagai mikroorganisme yang mempunyai populasi terbanyak, berukuran kecil dan mempunyai bentuk yang relatif sederhana. Bakteri mempunyai ciri-ciri morfologi sebagai berikut :
b. Ukuran : ukuran sel bakteri bervariasi. Ukuran yang digunakan mikrometer (µm) yang setara dengan 1/1000 mm. Ukuran bakteri umumnya sekitar 0,5-1,0 µm x 2,0-5,0 µm. Bakteri bentuk bola diameternya 0,75-1,25 µm, bentuk batang lebar 0,5-1,0 µm dan panjang 1,0-2,0 µm (Murni et al. 2008).
Pertumbuhan sel merupakan puncak aktivitas fisiologis yang saling mempengaruhi secara berurutan. Proses pertumbuhan ini sangat kompleks mencakup pemasukan nutrien dasar dari lingkungan kedalam sel, konversi bahan-bahan nutrien menjadi energi dan berbagai konstituen vital sel serta perkembangbiakan. Pertumbuhan mikrobial ditandai dengan peningkatan jumlah dan massa sel serta kecepatan pertumbuhan tergantung pada lingkungan fisik dan kimia (Murni et al. 2008). Pertumbuhan bakteri ditandai melalui beberapa fase yaitu :
a. Fase adaptasi; pemindahan mikroba dari suatu medium ke medium lain, menyebabkan mikroba akan mengalami fase adaptasi untuk melakukan penyesuaian dengan substrat dan kondisi lingkungan sekitar. Pada fase ini belum terjadi pembelahan sel karena beberapa enzim mungkin belum disentesis. Jumlah sel pada fase ini mungkin tetap tetapi kadang-kadang menurun. Lama fase ini bervariasi, dapat cepat atau lambat tergantung dari kecepatan penyesuaian dengan lingkungan sekitar. Medium lingkungan pertumbuhan dan jumlah inokulum mempengaruhi lama adaptasi.
b. Fase pertumbuhan awal; setelah mengalami fase adaptasi, sel mulai membelah dengan kecepatan yang masih rendah karena baru tahap penyesuaian diri.
c. Fase pertumbuhan logaritmik; sel mikroba membelah dengan cepat dan konstan dan pertambahan jumlahnya mengikuti kurva logaritmik. Pada fase ini pertumbuhan sangat dipengaruhi oleh kondisi medium tumbuh (pH dan kandungan nutrien) dan kondisi lingkungan (suhu dan kelembaban udara). Sel membutuhkan energi yang lebih banyak dibandingkan dengan fase lain dan sel paling sensitif terhadap lingkungan.
12
medium sudah sangat berkurang dan adanya hasil-hasil metabolisme yang mungkin racun yang dapat menghambat pertumbuhan mikroba. Pertumbuhan pada fase ini tidak stabil, tetapi jumlah populasi masih naik karena jumlah sel yang tumbuh masih lebih banyak dari jumlah sel yang mati.
e. Fase pertumbuhan tetap; jumlah populasi mikroba tetap karena jumlah sel yang tumbuh sama dengan jumlah sel yang mati. Ukuran sel pada fase ini menjadi lebih kecil karena sel tetap membelah meskipun zat nutrisi sudah mulai habis. Karena kekurangan zat nutrisi, sel kemungkinan mempunyai komposisi berbeda dengan sel yang tumbuh pada fase logaritmik. Sel-sel menjadi lebih tahan terhadap keadaan ekstrem seperti panas, dingin, radiasi dan bahan kimia.
f. Fase menuju kematian dan fase kematian; sebagian populasi mikroba mulai mengalami kematian yang disebabkan oleh nutrien di dalam medium dan energi cadangan di dalam sel sudah habis. Kecepatan kematian dipengaruhi oleh kondisi nutrien, lingkungan, dan jenis jasad renik. Kurva pertumbuhan mikroba disajikan pada Gambar 4.
Gambar 4 Kurva pertumbuhan mikroba.
3.1 Waktu Dan Tempat Penelitian
Analisis laboratorium dilaksanakan di Laboratorium Bioteknologi Hasil Perairan, Mikrobiologi Hasil Perairan Program Studi THP, Laboratorium Teknologi Industri Pertanian dan Laboratorium Terpadu Institut Pertanian Bogor. Penelitian ini dilaksanakan pada bulan Agustus 2010 hingga April 2011.
3.2 Bahan dan Alat
Bahan baku yang digunakan pada penelitian ini adalah telur tambakan
(Helostoma temminckii C.V) segar yang diperoleh dari pasar Pagi
Samarinda-Kalimantan Timur. Bahan pembantu yang digunakan adalah garam rakyat yang diperoleh dari pasar Segiri-Samarinda. Bahan yang digunakan untuk analisis adalah kalium khromat 5%, AgNO3 0,1 N, KH2PO4, H2SO4, NaOH, H3BO3, HCl,
NaCl, asam asetat, asam sulfinat, alkohol 96%, H2O2 3%, K2SO4, H3BO3 4%,
pereaksi biuret, violet Kristal, lugol, safranin, akuades, heksana, kertas saring, tablet kjedhal. Medium agar yang digunakan dalam penelitian ini meliputi
trypticase soy agar (TSA), MIO medium (Motility Indole Ornithine), OF basal
medium (Oxidation Fermentation). Komposisi media agar yang digunakan dalam penelitian ini dapat dilihat pada Lampiran 1.
Alat yang digunakan dalam penelitian ini adalah botol kaca ukuran 500 liter, baskom, timbangan, cawan petri, tabung reaksi, pipet transfer, gelas erlenmeyer, gelas ukur, gelas piala, gelas pengaduk, labu takar, jarum ose, Bunsen, autoklaf, water bath, spectrophotometer, vortex, mikroskop, timbangan analitik, lemari es dan BBL crystal Gram positif kit (BD).
3.3 Metode Penelitian
14
3.3.1 Pembuatan produk fermentasi telur ikan tambakan
Produk fermentasi telur ikan tambakan diperoleh dari pengolah di daerah Pasar Pagi Samarinda Kalimantan Timur. Dokumentasi proses pembuatan produk fermentasi telur ikan tambakan dapat dilihat pada Lampiran 2. Pembuatan produk fermentasi telur tambakan diawali dengan mempersiapkan bahan dan alat yang digunakan untuk pembuatan produk tersebut. Persiapan bahan dan alat dilakukan secara higienis untuk mengurangi kontaminasi bakteri patogen dan bakteri kontaminan lain.
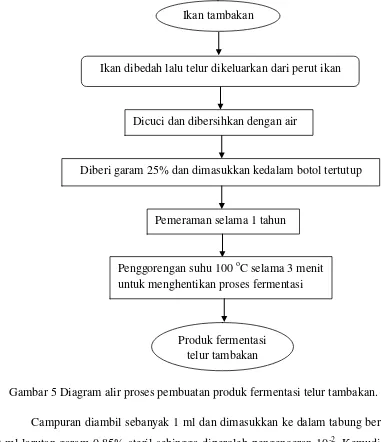
Cara pembuatan produk fermentasi telur tambakan adalah sebagai berikut: bahan baku telur tambakan segar dibersihkan terlebih dahulu. Telur tambakan yang telah dibersihkan tersebut kemudian diberi garam rakyat dengan perbandingan setiap 1 kg telur ikan untuk 250 gram. Campuran antara telur tambakan dan garam kemudian dimasukkan ke dalam botol kaca yang sudah bersih kemudian ditutup rapat, dan dimulai proses fermentasi. Proses fermentasi berlangsung selama setahun dan penghentian proses fermentasi dilakukan dengan cara penggorengan produk fermentasi telur tambakan pada suhu 100 oC selama 3 menit. Diagram alir proses pembuatan produk fermentasi telur tambakan dapat dilihat pada Gambar 5.
3.3.2 Isolasi bakteri (BSN 2009)
Telur ikan tambakan yang telah difermentasi selama setahun kemudian diisolasi bakterinya untuk mendapatkan isolat bakteri yang kemudian akan diidentifikasi jenisnya. Isolat bakteri murni yang tumbuh dominan selama fermentasi dipilih berdasarkan jumlah koloni yang paling banyak tumbuh. Morfologi koloni diamati berdasarkan bentuk koloni, bentuk permukaan, bentuk kemunculan diatas permukaan agar dan warna koloni.
Uji mikrobiologis dilakukan dengan perhitungan jumlah mikroba (Total
plate count) yang ada dalam sampel dengan pengenceran sesuai keperluan dan
Gambar 5 Diagram alir proses pembuatan produk fermentasi telur tambakan. Campuran diambil sebanyak 1 ml dan dimasukkan ke dalam tabung berisi 9 ml larutan garam 0,85% steril sehingga diperoleh pengenceran 10-2. Kemudian dilakukan prosedur serupa untuk pengenceran 10-3 dan seterusnya hingga pengenceran 10-5. Sebanyak 1 ml suspensi sel diteteskan ke dalam cawan kosong. Media yang masih cair (54 0C) dituang ke cawan kemudian putar cawan untuk menghomogenkan suspensi bakteri dan media, kemudian diinkubasi dengan posisi terbalik didalam inkubator pada suhu 37 oC selama 24 jam. Jumlah koloni dihitung berdasarkan rumus :
Ikan tambakan
Dicuci dan dibersihkan dengan air
Diberi garam 25% dan dimasukkan kedalam botol tertutup
Pemeraman selama 1 tahun
Produk fermentasi telur tambakan
Ikan dibedah lalu telur dikeluarkan dari perut ikan
16
Koloni yang terpilih dari hasil kultur bakteri kemudian diisolasi dengan metode goresan kuadran. Cawan petri yang telah berisi media TSA steril yang telah padat dan diinkubasi pada suhu 37 oC selama 24 jam, untuk mendapatkan koloni yang terpisah.
3.3.3 Identifikasi Bakteri
Identifikasi pada tahap awal dilakukan pemurnian dan pewarnaan Gram untuk melihat kemurnian bakteri. Pewarnaan Gram juga dilakukan untuk melihat bentuk bakteri dan reaksi terhadap pewarnaan Gram. Bakteri yang sudah murni selanjutnya dilakukan uji biokimia untuk menentukan genus dan spesies dari masing-masing bakteri (Cowan 1974).
(1) Pewarnaan Gram (BSN 2009)
Pewarnaan Gram pada bakteri dilakukan dengan cara mengamati sel-sel bakteri yang telah mati dan diwarnai. Dengan cara tersebut, bentuk sel akan menjadi lebih jelas karena warna sel dibuat kontras dengan medium disekelilingnya, sehingga lebih mudah dilihat dibawah mikroskop. Bakteri yang mempunyai sel dengan ukuran relatif kecil akan mudah dilihat. Pada pewarnaan Gram diperlukan empat jenis larutan yaitu zat warna basa (kristal violet), larutan iodium (lugol), alkohol dan safranin.
(2) Uji motilitas (BSN2009)
Uji motilitas merupakan uji yang digunakan untuk melihat sifat pergerakan bakteri yang dapat dilihat dengan pergerakan selnya. reaksi positif ditandai oleh adanya pertumbuhan bakteri yang menyebar sedangkan untuk reaksi yang negatif menunjukkan bakteri hanya tumbuh pada daerah tusukan saja. Pengujian ini dilakukan dengan cara sebagai berikut: secara aseptis menggunakan ose yang lurus bagian ujungnya, isolat bakteri ditusukkan ke dalam MIO media. Selanjutnya diinkubasikan pada suhu 35ºC selama dua hari. Bila pertumbuhan menyebar, maka bakteri tersebut bergerak atau motil, dan bila pertumbuhan bakteri tidak menyebar, hanya berupa garis saja, maka bakteri tersebut bersifat tidak bergerak (non motil). Prosedur uji motilitas (BSN 2009) secara lengkap dapat dilihat pada Lampiran 5.
(3) Uji katalase (BSN 2009)
Uji katalase digunakan untuk mengetahui adanya enzim katalase pada bakteri, dimana enzim ini berperan dalam memecah hidrogen peroksida menjadi air dan oksigen. Uji ini penting dilakukan untuk mengetahui sifat bakteri terhadap kebutuhan akan oksigen. Secara aseptis diambil satu ose kultur bakteri dari agar miring dan dipindahkan pada gelas obyek. Kemudian diteteskan 1-3 tetes larutan H2O2 3%. Keberadaan enzim katalase ditandai dengan terbentuknya
gelembung-gelembung kecil oksigen yang terlihat seperti busa sabun. Prosedur uji katalase (BSN 2009) secara lengkap dapat dilihat pada Lampiran 6.
(4) Uji oksidase (BSN 2009)
Uji oksidase berfungsi untuk menentukan oksidase sitokrom yang biasanya terdapat pada mikroorganisme patogen. Secara aseptis diambil satu ose kultur bakteri lalu digoreskan pada kertas saring yang sudah diberi pereaksi
oksidase atau biasa digunakan juga stik oksidase. Hasil reaksi dinyatakan negatif
18
(5) Uji oksidatif-fermentatif (BSN 2009)
Uji ini dilakukan untuk mengetahui kemampuan mikroorganisme dalam menggunakan karbohidrat dengan cara fermentasi atau oksidasi. Bakteri yang akan diuji, secara aseptis dengan menggunakan ose diinokulasikan kedalam medium tegak yang sudah disiapkan terlebih dahulu. Setiap bakteri yang akan diuji ditusukkan ke dalam dua tabung yang berisi media OF, tabung pertama ditutupi dengan parafin 3-5 ml, sedangkan tabung kedua tanpa parafin. Inkubasi dilakukan pada suhu 30 ºC selama 24 jam. Bila terjadi perubahan warna (terbentuk warna kuning) pada kedua tabung, maka bakteri bersifat fermentatif. Bila hanya tabung tanpa parafin yang berubah warna (terbentuk warna kuning) maka bakteri bersifat oksidatif sedangkan bila tidak terjadi perubahan warna pada kedua tabung tersebut berarti uji oksidatif-fermentatif bersifat negatif. Prosedur uji oksidatif fermentatif(BSN 2009) secara lengkap dapat dilihat pada Lampiran 8.
(6) BBL crystal kit system
Bakteri kultur murni yang telah diperoleh, diidentifikasi untuk mengetahui jenis bakteri pada produk fermentasi telur ikan tambakan. Metode identifikasi ini menggunakan kit BBL crystal yang di produksi oleh perusahaan BD (Becton,
Dickinson and Company). Kit BBL crystal terdiri dari 29 microplates (mikro
cawan) yang berisi substrat biokimia dan enzim. Pengujian menggunakan kit ini berdasarkan pada kemampuan mikrobia dalam memanfaatkan dan mendegradasi substrat spesifik yang dapat dideteksi menggunakan berbagai macam sistem indikator warna. Prosedur BBL Crystal ID GP secara lengkap dapat dilihat pada Lampiran 9.
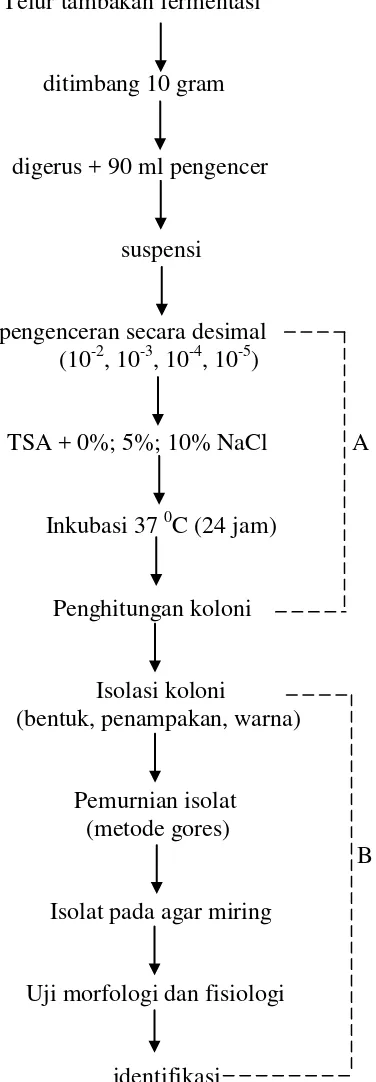
Telur tambakan fermentasi
ditimbang 10 gram
digerus + 90 ml pengencer
suspensi
pengenceran secara desimal (10-2, 10-3, 10-4, 10-5)
TSA + 0%; 5%; 10% NaCl A
Inkubasi 37 0C (24 jam)
Penghitungan koloni
Isolasi koloni
(bentuk, penampakan, warna)
Pemurnian isolat (metode gores)
B Isolat pada agar miring
Uji morfologi dan fisiologi
identifikasi
20
3.3.4 Analisis kimia
(1) Pengukuran nilai pH (AOAC 1995)
Terlebih dahulu pH meter dinyalakan, kemudian elektroda pH meter dimasukkan dalam buffer 4,31 dan 6,86 lalu sampel sebanyak 5 gram ditimbang dan diberi aquades sebanyak 100 ml, setelah itu dihaluskan. Setelah itu elektroda dicelupkan pada larutan sampel dan dibiarkan beberapa saat sampai diperoleh pembacaan yang stabil. Nilai yang diperoleh dari pembacaan pada pH meter sampai angka digital menunjukkan nilai pH tetap.
(2) Kadar garam (Cl) (AOAC 1995)
Penetapan kadar garam sampel yang dilakukan berdasarkan metode Mohr terdiri dari langkah-langkah berikut ini: sebanyak 5 gram sampel dimasukkan ke dalam cawan porselin untuk diabukan pada suhu 600 oC selama 12 jam. Abu yang diperoleh tersebut dilarutkan dengan aquades sampai volumenya mencapai 100 mL dan kemudian disaring. Hasil dari penyaringan tersebut dipipet sebanyak 10 mL kedalam beaker glass 50 ml, kemudian ditambahkan 3 mL K2CrO4 (kalium
khromat) 5%. Selanjutnya kedalam beaker glass dititrasi dengan larutan perak nitrat (AgNO3) 0,2 N. Titik akhir titrasi tercapai setelah terbentuk endapan perak
khromat (Ag2CrO4) yang berwarna oranye atau jingga.
Rumus yang digunakan untuk menghitung kadar NaCl yaitu :
(k) Pengukuran Nilai pH (AOAC 1995)
(3) Kadar air (AOAC 1995)
Prosedur penentuan kadar air adalah sebagai berikut: Sampel yang sudah homogen ditimbang 5 gram dan diletakkan di dalam cawan kosong yang sudah ditimbang beratnya, dimana cawan dan tutupnya sudah dikeringkan di dalam oven serta didinginkan di dalam desikator. Cawan yang berisi sampel kemudian ditutup dan dimasukkan ke dalam oven dengan suhu 100 ºC selama 5 jam atau sampai beratnya konstan. Cawan lalu didinginkan di dalam desikator dan setelah dingin cawan ditimbang.
x 100% Titer x Normalitas AgNO3 x 58,5 x 10
Kadar air ditentukan dengan rumus:
(4) Kadar abu (AOAC 1995)
Kadar abu ditentukan dengan prosedur sebagai berikut: Sampel sebanyak 5 gram dimasukkan ke dalam cawan pengabuan yang telah ditimbang dan dibakar di dalam tanur serta didinginkan dalam desikator. Cawan yang berisi sampel dimasukkan ke dalam tanur pengabuan dan dibakar sampai didapat abu yang berwarna keabu-abuan. Suhu pemanasan dinaikkan secara bertahap sampai suhu mencapai 550 ºC dan dibiarkan selama 1 jam. Setelah suhu tungku pengabuan turun sekitar 200 °C, cawan yang berisi abu tersebut didinginkan di dalam desikator selama 30 menit dan kemudian ditimbang beratnya.
Kadar abu ditentukan dengan rumus:
(5) Kadar protein (AOAC 1995)
Penentuan kadar protein dilakukan dengan metode mikrokjeldahl, dengan prosedur sebagai berikut: Sampel ditimbang sebanyak 1-2 gram, kemudian dimasukkan ke dalam labu kjeldahl. Lalu di tambahkan berturut-turut 15 gram NaSO4, 1 gram CuSO4, satu atau dua butir batu didih dan 25 ml asam sulfat pekat.
Larutan dididihkan sampai cairan menjadi jernih tidak berwarna atau hijau muda (minimum 2 jam dan tidak kurang 30 menit). Setelah larutan didinginkan, ditambahkan 200 mL air secara hati-hati. Untuk alat destilasi, 100 mL HCl 0,1 N dipipet ke dalam erlenmeyer 500 mL. Satu ml indikator Conway ditambahkan ke dalamnya. Labu dilengkapi dengan kondensor dan diletakkan sehingga ujung kondensor tercelup ke dalam larutan asam. Labu Kjeldahl yang berisi contoh yang sudah didestruksi diletakkan di dalam sistem, kemudian ditambahkan NaCl 50 %, kocok hati-hati campuran dengan gerakan memutar. Dipanaskan hingga semua gelembung ammonia keluar (sampai jumlah destilat kira-kira 150 mL). Setelah selesai, rangkaian destilasi dibongkar hati-hati, ujung kondensor dicuci
22
dengan akuades, dan kelebihan larutan HCl dititrasi dalam destilat dengan larutan NaOH standar. Kadar protein ditentukan dengan rumus:
(6) Kadar lemak (AOAC 1995)
Penentuan kadar lemak dilakukan menggunakan metode ekstraksi soxhlet. Cara penentuannya adalah dimasukkan sebanyak 5 g sampel yang sudah dibungkus dengan kertas saring kedalam alat soxhlet, kemudian 50 mL pelarut dietil eter dituang ke dalam labu lemak. Selanjutnya direfluks selama minimum 5 jam sampai pelarut yang turun kembali ke labu lemak berwarna jernih. Pelarut yang ada di labu lemak tersebut didestilasi, labu yang berisi hasil ekstraksi dipanaskan dalam oven pada suhu 100 ºC selama 60 menit atau sampai beratnya tetap. Setelah didinginkan dalam desikator, labu lemak tersebut ditimbang sampai memperoleh berat yang konstan. Kadar lemak ditentukan dengan rumus:
(7) Analisis logam berat (AOAC 1995)
Sampel ditimbang sebanyak 5 gram lalu dimasukkan ke dalam cawan kemudian ditambahkan 5 mL MgNO3 10 % dalam etanol lalu dikeringkan dalam
oven selanjutnya diabukan pada suhu 600 0C. Hasil pengabuan kemudian ditambahkan 2 mL HNO3, lalu dipanaskan kembali sampai kira-kira volume
(8) Analisis mineral (AOAC 1995)
Metode ini dilakukan dengan menggunakan spektrofotometer absorpsi atom untuk menentukan kadar mineral yang terdapat didalam bahan pangan. Prinsip alat ini adalah sesudah penghilangan bahan-bahan organik dengan pengabuan kering atau basah, residu dilarutkan dalam asam encer. Larutan disebarkan dalam nyala api yang ada didalam alat SSA sehingga absorpsi atau emisi logam dapat dianalisis dan diukur pada panjang gelombang tertentu.
Sampel ditimbang sebanyak 5 gram lalu dimasukkan ke dalam cawan kemudian ditambahkan 5 mL MgNO3 10 % dalam etanol. sampel dikeringkan
dalam oven, selanjutnya diabukan pada suhu 600 0C. Hasil pengabuan kemudian ditambahkan 3 mL HNO3, dipanaskan kembali sampai kira-kira volume tinggal
1 mL setelah itu dinginkan. Setelah dingin kemudian tambahkan 10 mL HCl 3N dan dipanaskan lagi sampai kira-kira volume tinggal setengahnya. Setelah itu dinginkan kembali, dan diencerkan dengan aquades sampai 50 mL dan disaring, untuk pengujian Mg, Ca, Na dan K, pipet larutan yang telah disaring sebanyak 25 mL lalu ditambahkan 1 mL lantannum 5% dan diencerkan hingga 50 mL setelah itu di ukur dengan SSA.
(9) Analisis asam amino (AOAC 1995)
Prosedur analisis asam amino terdiri dari beberapa tahap yang secara rinci dapat dilihat pada Lampiran 10, tahapan prosedur analisis asam amino tersebut yaitu: (1) preaparsi sampel, (2) pembuatan pereaksi OPA, (3) pembuatan buffer sebagai fase mobil, (4) pengaturan alat HPLC, (5) analisis asam amino, (6) perhitungan asam amino. Hasil analisis asam amino bisa ditingkatkan dengan memanfaatkan reaksi pra kolom gugus amino dengan pereaksi tertentu membentuk suatu derivat yang dapat menyerap sinar UV atau berflouresensi. Salah satu pereaksi pra kolom yang sangat populer dalam analisis asam amino adalah ortoftalaldehida (OPA). Pereaksi OPA akan bereaksi dengan asam amino primer dalam suasana basa yang mengandung merkaptoetanol membentuk senyawa yang berfluoresensi, sehingga deteksinya dapat dilakukan dengan detektor flouresensi.
24
Buffer Kalium Borat pH 10,4 ditambahkan dengan perbandingan 1:1. Lalu kedalam vial kosong yang bersih dimasukkan 10 µL sampel dan ditambahkan 25 µ L pereaksi OPA, dibiarkan selama 1 menit agar derivatisasi berlangsung sempurna. sebanyak 5 µ L diinjeksikan ke dalam kolom HPLC kemudian ditunggu sampai pemisahan semua asam amino selesai. Waktu yang diperlukan sekitar 25 menit. Konsentrasi asam amino (dinyatakan dalam µmol AA) dalam sampel. Prosedur analisis asam amino (AOAC 1995) secara lengkap dapat dilihat pada Lampiran 10.
Konsentrasi asam amino (dinyatakan dalam µmol AA) dalam sampel
Persen asam amino dalam sampel adalah:
= µmol AA x Mr. AA x 100 µg sampel
(10) Analisis asam lemak (AOAC 1995)
Analisis dengan kromatografi gas didasarkan pada partisi komponen-komponen dari suatu cairan di antara fase gerak berupa gas dan fasa
diam berupa zat padat atau cairan yang tidak mudah menguap yang melekat pada bahan pendukung inert. Komponen-komponen yang dipisahkan harus mudah menguap pada suhu pemisahan yang dilakukan, sehingga suhu operasi biasanya lebih tinggi dari suhu kamar dan biasanya dilakukan derivatisasi untuk contoh yang sulit menguap. Dalam hal analisis asam lemak, maka mula-mula lemak/minyak dihidrolisis menjadi asam lemak, kemudian ditransformasi menjadi bentuk esternya yang bersifat lebih mudah menguap. Dalam metode ini, transformasi dilakukan dengan cara metilasi sehingga diperoleh metil ester asam lemak (FAME). Selanjutnya FAME ini dianalisis dengan alat kromatografi gas.
pelarut sampai ke tengah puncak komponen yang dipertimbangkan.Penentuan kandungan komponen dalam contoh dapat dilakukan dengan teknik standar eksternal atau internal standar. Luas puncak dari masing-masing komponen adalah berbanding lurus dengan jumlah komponen tersebut dalam contoh. Untuk meminimalkan kesalahan akibat volume injeksi, preparasi sampel, pengenceran dan sebagainya, lebih baik digunakan teknik standar internal. Disamping itu koreksi terhadap respon detektor dan interaksi antar komponen dalam matrik contoh selama melewati kolom juga harus dilakukan. Prosedur analisis asam lemak (AOAC 1995) secara lengkap dapat dilihat pada Lampiran 11. Metode internal standar, jumlah dari masing-masing komponen dalam sampel dapat dihitung dengan cara sebagai berikut :
Keterangan :
Cx = kosentrasi komponen x
Cs = kosentrasi standar internal
Ax = luas puncak komponen x
As = luas puncak standar internal
4 HASIL DAN PEMBAHASAN
4.1 Produk Fermentasi Telur Ikan Tambakan
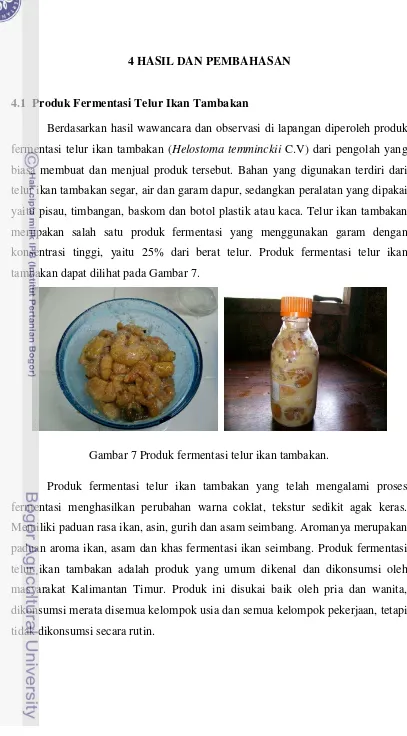
Berdasarkan hasil wawancara dan observasi di lapangan diperoleh produk fermentasi telur ikan tambakan (Helostoma temminckii C.V) dari pengolah yang biasa membuat dan menjual produk tersebut. Bahan yang digunakan terdiri dari telur ikan tambakan segar, air dan garam dapur, sedangkan peralatan yang dipakai yaitu pisau, timbangan, baskom dan botol plastik atau kaca. Telur ikan tambakan merupakan salah satu produk fermentasi yang menggunakan garam dengan konsentrasi tinggi, yaitu 25% dari berat telur. Produk fermentasi telur ikan tambakan dapat dilihat pada Gambar 7.
Gambar 7 Produk fermentasi telur ikan tambakan.
4.2 Hasil Isolasi Bakteri
Isolasi merupakan tahap awal sebelum dilakukan karakterisasi dan identifikasi bakteri. Koloni yang tumbuh pada saat penghitungan jumlah koloni dianggap terdiri dari berbagai sel mikroba yang berkumpul menjadi satu. Isolasi bertujuan untuk memisahkan sel-sel bakteri yang masih tercampur. Isolasi diawali dengan pengenceran pada sampel fermentasi telur ikan dengan larutan pengencer (0,85% NaCl) steril, kemudian dilanjutkan dengan penanaman sampel ke media agar tryptic soy agar (TSA). Pengenceran ini dilakukan untuk mengetahui perkiraan jumlah koloni bakteri yang terdapat dalam sampel fermentasi telur ikan. Hal ini juga bertujuan agar koloni bakteri yang tumbuh pada agar tidak terlalu padat dan memudahkan dalam pengidentifikasian bakteri selanjutnya. Pengenceran dilakukan dari 10-1 hingga 10-5, sehingga diperoleh jumlah koloni bakteri 117 x 102 koloni untuk 0% NaCl, 149 x 102 koloni untuk 5% NaCl, 134 x 102 untuk 10% NaCl. Contoh penghitungan total bakteri dapat dilihat pada Lampiran 12.
Jumlah koloni yang dapat dijadikan acuan untuk penentuan jumlah koloni bakteri per ml sampel adalah jumlah koloni yang berkisar antara 30-300, yaitu pada pengenceran 10-2. Bakteri dengan jumlah koloni lebih dari 300, pertumbuhan bakteri terlalu padat dan mengakibatkan terjadinya pertumbuhan koloni yang saling menumpuk satu sama lain sehingga tidak seluruh koloni dapat terhitung. Berdasarkan alasan tersebut, maka nilai dianggap tidak valid. Apabila koloni bakteri yang tumbuh dengan jumlah koloni kurang dari 30, data yang didapat juga tidak valid karena pertumbuhan bakteri yang sangat sedikit dan tidak representatif (Dwipayana dan Ariesyady 2009).
29
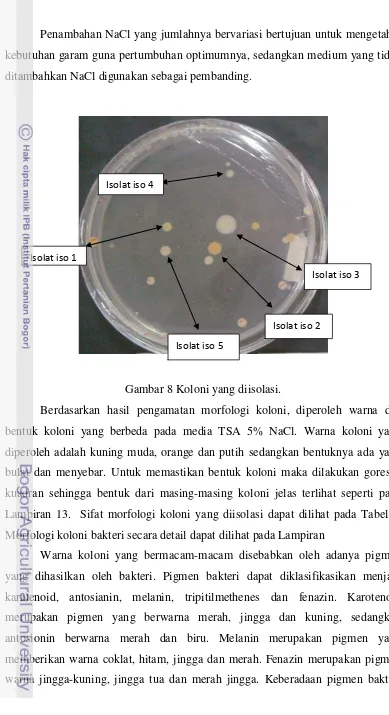
Penambahan NaCl yang jumlahnya bervariasi bertujuan untuk mengetahui kebutuhan garam guna pertumbuhan optimumnya, sedangkan medium yang tidak ditambahkan NaCl digunakan sebagai pembanding.
Gambar 8 Koloni yang diisolasi.
Berdasarkan hasil pengamatan morfologi koloni, diperoleh warna dan bentuk koloni yang berbeda pada media TSA 5% NaCl. Warna koloni yang diperoleh adalah kuning muda, orange dan putih sedangkan bentuknya ada yang bulat dan menyebar. Untuk memastikan bentuk koloni maka dilakukan goresan kuadran sehingga bentuk dari masing-masing koloni jelas terlihat seperti pada Lampiran 13. Sifat morfologi koloni yang diisolasi dapat dilihat pada Tabel 1. Morfologi koloni bakteri secara detail dapat dilihat pada Lampiran
Warna koloni yang bermacam-macam disebabkan oleh adanya pigmen yang dihasilkan oleh bakteri. Pigmen bakteri dapat diklasifikasikan menjadi karatenoid, antosianin, melanin, tripitilmethenes dan fenazin. Karotenoid merupakan pigmen yang berwarna merah, jingga dan kuning, sedangkan antosionin berwarna merah dan biru. Melanin merupakan pigmen yang memberikan warna coklat, hitam, jingga dan merah. Fenazin merupakan pigmen warna jingga-kuning, jingga tua dan merah jingga. Keberadaan pigmen bakteri
Isolat iso 3 Isolat iso 4
Isolat iso 5
tersebut akan dicirikan pada warna koloni yang tumbuh (Salle 1961 diacu dalam Christanti 2006).
Tabel 1 Sifat morfologi koloni yang diisolasi
Koloni Warna Bentuk dari atas Bentuk dari pinggir Bentuk penonjolan
Kelima isolat yang telah diketahui morfologi koloninya, selanjutnya diamati morfologi selnya. Morfologi sel yang diamati meliputi bentuk sel, sifat pewarnaan Gram, dan uji motilitas. Seluruh koloni bakteri yang tumbuh pada masing-masing hasil pengenceran, diambil beberapa koloni berbeda untuk kemudian diidentifikasi. Pemilihan koloni yang berbeda didasarkan pada morfologinya. Berdasarkan pemilihan tersebut, didapat 5 koloni bakteri, yang diberi nama iso 1, iso 2, iso 3, iso 4, dan iso 5.
4.3.1 Pewarnaan Gram
31
Isolat 1 Isolat 2
Isolat 3 Isolat 4
Isolat 5
Gambar 9 Bentuk sel bakteri dan pewarnaan Gram kelima isolat. 4.3.2 Uji motilitas
Pengamatan sifat morfologi bakteri selain pewarnaan Gram adalah uji pergerakan bakteri (motilitas). Pengujian motilitas bakteri, menggunakan medium MIO (motility indol ornithin). Hasil reaksi yang didapat menunjukkan bakteri tumbuh menyebar atau media menjadi keruh (motil), sedangkan bakteri yang tidak menyebar atau warna media tetap seperti warna aslinya (non motil) (Lukistyowati dan Riauwaty 2005).
Gambar 10 Hasil reaksi uji motilitas.
Flagella adalah salah satu struktur utama di luar sel bakteri yang menyebabkan terjadinya pergerakan (motilitas) pada sel bakteri. Flagella terbuat dari sub unit protein yang disebut flagelin. Bacillus dan Spirilum merupakan sebagian besar bakteri yang memiliki flagella sebagai alat geraknya. Flagella jarang ditemukan pada bakteri yang berbentuk kokus (Pelczar dan Chan 2008).
Flagella ditemukan hampir disemua jenis berbentuk lengkung dan sebagian pada bakteri yang berbentuk batang. Flagella berukuran sangat kecil dan tidak terlihat menggunakan mikroskop biasa, rata-rata mempunyai ketebalan antara 0,02–0,1 mikron dengan panjang tidak melebihi selnya. Pergerakan flagella disebabkan oleh suatu sistem pergerakan berbentuk cakram yang terdapat pada dinding sel bagian dalam, sehingga gerakannya hanya dapat mengarah kedua jurusan saja (Suriawiria 2005).
4.3.3 Uji katalase
Uji katalase digunakan untuk mengetahui aktivitas katalase pada bakteri yang diuji. Sebagian besar bakteri memproduksi enzim katalase yang dapat memecah H2O2 menjadi H2O dan O2. Enzim katalase diduga penting untuk
pertumbuhan aerobik karena H2O2 yang dibentuk dengan pertolongan berbagai
enzim pernafasan bersifat racun bagi sel mikroba (Partic 2008). Hasil uji katalase terhadap lima isolat bakteri yang diisolasi menunjukkan bahwa hanya empat yang positif dan satu negatif.
Selama respirasi aerobik (proses fosforilasi oksidatif), mikroorganisme menghasilkan hidrogen peroksida, bahkan ada yang menghasilkan superoksida
33
yang beracun. Senyawa ini dalam jumlah besar akan menyebabkan kematian pada mikroorganisme. Senyawa ini dihasilkan oleh mikroorganisme aerobik, fakultatif aerob maupun mikroaerofilik yang menggunakan jalur respirasi aerobik (Irianto 2008)
Bakteri katalase positif seperti S. aureus dapat menghasilkan gelembung-gelembung oksigen karena adanya pemecahan H2O2 (hidrogen peroksida) oleh
enzim katalase yang dihasilkan oleh bakteri itu sendiri. Komponen H2O2 ini dapat
menghambat pertumbuhan bakteri karena bersifat toksik, sehingga komponen ini harus dipecah agar tidak bersifat toksik lagi. Bakteri katalase negatif tidak menghasilkan gelembung-gelembung. Hal ini berarti H2O2 yang diberikan tidak
dipecah oleh bakteri katalase negatif, misalnya, L.casei sehingga tidak menghasilkan oksigen. Bakteri katalase negatif tidak memiliki enzim katalase yang menguraikan H2O2 (Partic 2008).
Bakteri yang memiliki kemampuan memecah H2O2 dengan enzim katalase
akan segera membentuk suatu sistem pertahanan dari toksik H2O2 yang
dihasilkannya. Bakteri katalase positif akan memecah H2O2 menjadi H2O dan O2
dimana parameter yang menunjukkan adanya aktivitas katalase tersebut adalah adanya gelembung-gelembung oksigen (Sodyc dan Acun 2010). Reaksi penguraian H2O2 oleh enzim katalase adalah sebagai berikut:
2H2O2 2H2O + O2
4.3.4 Uji oksidase
Uji oksidase bertujuan untuk mengetahui kemampuan bakteri menghasilkan enzim oksidase sitokrom. Hasil uji oksidase menunjukkan bahwa kelima isolat mampu menghasilkan enzim oksidase sitokrom, yang berarti bakteri tersebut malakukan metabolisme energi melalui respirasi.
reaksi yang ditimbulkan setelah pemberian reagen oksidase pada koloni bakteri. Enzim ini merupakan bagian dari kompleks enzim yang berperan dalam proses fosforilasi oksidatif. Reagen yang digunakan adalah
tetramethyl-D-phenylenediamine dihydrocloride. Reagen akan mendonorkan elektron terhadap
enzim ini sehingga akan teroksidasi membentuk senyawa yang berwarna biru kehitaman. Positif tertunda (warna biru muncul antara 10-60 detik setelah ditetesi) menandakan bahwa bakteri uji memiliki sedikit enzim. Tidak adanya perubahan warna mengindikasikan bahwa hasil uji yang dilakukan negatif (Irianto 2008).
Enzim oksidase mempunyai peranan penting pada sistem transpor elektron selama respirasi aerobik. Enzim oksidase sitokrom berperan sebagai katalisator dalam transfer atom hidrogen dari sitokrom yang terakhir ke molekul oksigen. Sitokrom merupakan senyawa organik yang terdapat dalam sel hidup dan berperan dalam transfer atom hidrogen dari substrat ke molekul oksigen membentuk air. Bakteri aerob, beberapa bakteri anaerobik fakultatif dan mikroarofilik, menunjukkan adanya aktivitas karena memiliki oksidase (Cappucino dan Sherman 1983 diacu dalam Prihardini 2008).
4.3.5 Uji oksidatif – fermentatif
Uji oksidatif-fermentatif bertujuan untuk mengetahui sifat oksidasi atau fermentasi bakteri terhadap gula. Uji ini juga berguna untuk membedakan bakteri oksidatif dan bakteri fermentatif serta untuk melihat kemampuan bakteri dalam mencerna karbohidrat dalam situasi aerob dan anaerob (Lukistyowati dan Riauwaty 2005).
35
Gambar 11 Hasil reaksi oksidatif fermentatif dan non-oksidatif fermentatif. Fermentasi adalah suatu reaksi reduksi – oksidasi di dalam biologi yang menghasilkan energi, dimana donor dan aseptor elektron yang digunakan adalah senyawa organik. Senyawa organik yang umumnya digunakan adalah karbohidrat dalam bentuk glukosa. Saat keadaan anaerobik, senyawa tersebut akan diubah oleh reaksi reduksi-oksidasi dengan katalis enzim menjadi senyawa asam. Sel-sel yang melakukan fermentasi mempunyai enzim-enzim yang akan mengubah hasil reaksi reduksi-oksidasi tersebut menjadi suatu senyawa yang mempunyai muatan lebih positif sehingga dapat menangkap elektron atau bertindak sebagai aseptor elektron terakhir dan menghasilkan energi (Winarno dan Fardiaz 1984 diacu dalam Candra et al. 2007).
4.3.6 BBL Crystal kit system
Identifikasi bakteri adalah membandingkan sifat-sifat bakteri yang belum teridentifikasi dengan sifat-sifat bakteri sesuai dengan kunci identifikasi bakteri. Hasil karakterisasi kelima isolat murni dicocokkan dengan panduan buku manual dan literatur hasil penelitian yang telah dilakukan sebelumnya.
Kelima isolat yang telah diisolasi diidentifikasi spesiesnya dengan menggunakan sistem BBL crystal kit. BBL crystal adalah alat identifikasi bakteri dengan prinsip menanam bakteri pada microplates (lubang mikro) yang berisi berbagai substrat biokimia dan enzim. Aktivitas bakteri dalam menghidrolisis substrat tertentu akan mengubah kandungan warna dalam lubang mikro sehingga didapatkan data warna-warna yang akan dicocokkan pada tabel warna yang memiliki nilai tertentu. Nilai-nilai tersebut akan dimasukkan dalam bank data
(software) BBL crystal sehingga didapatkan hasil identifikasi bakteri hingga
tingkat spesies. Sebelum melakukan uji BBL crystal kit, dipilih dahulu jenis BBL crystal kit yang sesuai dengan hasil pewarnaan Gram agar mempermudah dalam identifikasi hingga tingkat spesies. Apabila hasil dari pewarnaan gram menunjukkan bahwa bakteri tersebut termasuk dalam Gram positif, maka menggunakan BBL crystal Gram positif. Apabila hasil dari pewarnaan Gram menunjukkan bahwa bakteri bersifat Gram negative, maka menggunakan BBL crystal Gram negative. Bakteri yang bersifat anaerob diuji menggunakan BBL crystal kit anaerob.
Uji pewarnaan Gram menunjukkan bahwa bakteri yang diperoleh merupakan bakteri Gram positif, sehingga menggunakan BBL crystal ID kit Gram positif. BBL crystal ID kit Gram positif memiliki 30 microplates (lubang mikro) yang mengandung substrat yang didehidrasi. Bakteri yang akan diuji disegarkan terlebih dahulu dalam media TSA selama 24 jam. Bakteri yang tumbuh pada media TSA diambil menggunakan jarum ose steril dan dilarutkan dalam medium cair BBL crystal hingga mencapai kekeruhan 0,5 McFarland standar (sesuai standar kekeruhan BBL crystal). Detail standar McFarland dapat dilihat pada Lampiran 15. Lubang mikro BBL crystal GP diisi oleh cairan medium sebanyak 0,15 ml pada tiap lubang, kemudian diinkubasi selama 24 jam. Sifat biokimia dari kelima isolat bakteri dapat dilihat pada Tabel 2.
Tabel 2 Sifat biokimia dari kelima isolat bakteri
Bentuk sel batang batang batang batang batang batang batang batang batang
Katalase + - + + + + + + +
Keterangan : BM = Bacillus megaterium, LA/CA = Leifsonia aquatica /Coryebacterium aquaticum, CP = Corynebacterium propinquum, LS/BS = Lysinibacillus sphaericus / Bacillus sphaericus. ND = tidak ada data. O = oksidatif, F = fermentatif, (a) = Sanni et al. (2002), b) = Giammanco et al. (2006),
Tabel 3 Hasil identifikasi bakteri
Isolat iso 1 yang diuji menggunakan BBL crystal ID teridentifikasi sebagai bakteri B. megaterium. Bakteri ini merupakan bakteri Gram positif, berbentuk batang, menghasilkan spora, banyak ditemukan dalam tanah dan daerah permukaan. Bakteri ini dapat bertahan hidup dalam kondisi ekstrim. Bacillus
megaterium jua dapat memproduksi penisilin amidase sehingga dapat digunakan
dalam industri pembuatan penisilin (Glogowski 2010).
Klasifikasi bakteri B. megaterium menurut kamus klasifikasi bakteri yang diacu dalam Glogowski (2001) adalah sebagai berikut:
Filum : Firmicutes terbuat dari ikan air tawar yang ditambahkan garam sebanyak 30% dan umumnya digunakan sebagai bumbu penyedap dimakanan seperti yam, cocoyam, dan
apentum. Hasil bakteri yang telah diisolasi pada momoni adalah bakteri dari jenis
Bacillus yaitu Bacillus subtilis, Bacillus licheniformis, Bacillus pumilis dan
Bacillus megaterium. Bakteri dari spesies Bacillus ini dapat tumbuh dalam
39
Bacillus megaterium biasanya terdapat pada produk fermentasi, seperti
kecap ikan, dan terasi (Adawyah 2008). Anihouvi et al. (2007) menyatakan bahwa bakteri dari spesies Bacillus termasuk dalam golongan halofilik karena dapat tumbuh dalam kondisi garam dengan konsentrasi tinggi dan dapat memanfaatkan protein sebagai sumber energi. Hal ini berarti bakteri ini bersifat proteolitik, hasil aktivitas proteolitik ini dapat membentuk aroma dan flavor pada produk fermentasi. Sekhon et al. (2006) menambahkan bahwa Bacillus megaterium juga mampu menghasilkan lipase pada kisaran pH 4-11 dan menghasilkan lipase tertinggi pada kisaran pH 6,5-8.
Leifsonia aquatica
Uji isolat iso 2 berdasarkan data bank BBL crystal diperoleh data bahwa isolat iso 2 merupakan bakteri Leifsonia aquatica. Bakteri ini merupakan bakteri Gram positif, berbentuk batang, bakteri non-motil. Luckman dan Wehle (2007) menyatakan bahwa bakteri Leifsonia aquatica ini merupakan bakteri dari turunan Corynebacterium aquaticum.
Klasifikasi bakteri menurut Leifsonia aquatica menurut Garrity (2006). Kingdom : Bacteria
Leifsoniaaquatica merupakan bakteri Gram positif yang berbentuk batang sering
ditemukan dalam air suling, tebu dan kolam. Spesies Leifsonia memilki koloni agak keruh dan berwarna kuning dan dapat tumbuh pada suhu 35-37 0C.
Leifsonia aquatica merupakan bakteri turunan Corynebacteria, bakteri
Corynebacteri merupakan bakteri yang dapat menghasilkan indol, dapat
Shewan (1977) diacu dalam Kaseger (1986) diacu dalam Sumanti (1988) menyatakan bahwa salah satu mikroba yang terdapat pada kulit ikan adalah bakteri jenis Coryneform, sehingga diduga dalam proses pembuatan bekasang jenis Corynebacterium terikut dan dapat tahan hidup pada kondisi lingkungan yang mengandung garam.
Beberapa spesies dari Corynebacterium telah digunakan untuk memproduksi asam amino, termasuk asam L-glutamat yang merupakan bahan tambahan pada makanan. Jalur metabolisme pada Corynebacterium dimanipulasi untuk menghasilkan L-Lisin dan L-treonin (Burkovski 2008).
Corynebacteriumpropinquum
Isolat iso 3 diidentifikasi sebagai bakteri Corynebacterium propinquum. Babay (2001) menyatakan bahwa bakteri ini merupakan Gram positif, berbentuk batang, tidak memiliki spora dan non motil. Koloni bakteri ini berwarna koloni putih dan bersifat katalase positif, dapat menghidrolisis tirosin tetapi tidak dapat menghidrolisis urea atau eskulin serta tidak memfermentasi gula.
Spesies Corynebacterium yang non-patogen banyak digunakan oleh industri makanan untuk memproduksi asam amino asam glutamat.
Corynebacterium dari spesies C. glutamicum banyak digunakan oleh industri
untuk menghasilkan asam glutamat yang digunakan sebagai penyedap makanan (Burkovski 2008). Klasifikasi bakteri Corynebacterium propinquum menurut Garrity (2006) adalah: Specific descriptor : propinquum