LAMPIRAN 1
DATA HASIL PERCOBAAN
L1.1 DATA HASIL PERCOBAAN BET
Tabel L1.1 Data Hasil Analisa BET
No Jenis Analisa Suhu (ᴼC)
110 500 800
1 Luas Permukaan (m2/g) 725,436 807,948 803,822
2 Volume pori (cc/g) 1,803 2,041 1,995
3 Radius Pori (Å) 18,224 18,229 18,110
L1.2 DATA HASIL PERCOBAAN BERAT JENIS
Tabel L1.2 Data Hasil Percobaan Berat Jenis Adsorben 110ᴼC
No M1 (gr) M2 (gr) M3 (gr) M4 (gr)
1 20,9785 49,3250 32,5672 56,4360
2 20,9785 49,3250 32,9474 56,5896
3 20,9785 49,3250 32,7616 56,7585
Tabel L1.3 Data Hasil Percobaan Berat Jenis Adsorben 500ᴼC
No M1 (gr) M2 (gr) M3 (gr) M4 (gr)
1 20,9785 49,3250 28,2310 53,7350
2 20,9785 49,3250 29,8500 54,7861
3 20,9785 49,3250 29,8890 54,8208
Tabel L1.4 Data Hasil Percobaan Berat Jenis Adsorben 800ᴼC
No M1 (gr) M2 (gr) M3 (gr) M4 (gr)
1 20,9785 49,3250 29,6811 54,3892
2 20,9785 49,3250 28,8079 53,8527
Keterangan :
M1 = berat dari piknometer (gr)
M2 = berat dari piknometer + berat aquadest (gr)
M3 = berat dari piknometer + berat adsorben yang diaktivasi (gr)
M4 = berat dari piknometer + berat adsorben yang diaktivasi + berat aquadest (gr) L1.3 DATA HASIL PERCOBAAN KADAR AIR
Tabel L1.5 Data Hasil Percobaan Penentuan Kadar Air No Adsorben
( ᴼC )
Berat Cawan ( gr)
Berat cawan + 1 g adsorben
sebelum pemanasan
Berat cawan + 1 g adsorben
sesudah Pemanasan
Hasil %
penguapan air
1 110 33,7275 34,7703 34,7631 1,0355 0,6919
2 500 33,4629 34,4635 34,4472 0,9843 1,6929
3 800 33,4589 34,4595 34,4424 0,9834 1,7125
L1.4 DATA HASIL PERCOBAAN KADAR ABU
Tabel L1.6 Data Hasil Percobaan Penentuan Kadar Abu No Adsorben
( ᴼC)
Berat Cawan ( gr)
Berat cawan + 1 g adsorben
sebelum pemanasan
Berat cawan + 1 g adsorben sesudah Pemanasan
Hasil % penguapan abu
1 110 33,4690 34,4698 34,3858 0,9168 8,3931
2 500 33,3853 34,4518 34,3671 0,9818 7,9390
55
L1.5 DATA HASIL PENENTUAN JUMLAH LOGAM Cd2+ DAN Pb2+ YANG
TERJERAP ADSORBEN
L1.5.1 Data hasil Percobaan Penentuan Jumlah Logam Cd2+ yang
Terjerap oleh Adsorben
Tabel L1.7 Data Deret Standar Logam Cd2+ No Absorbansi Konsentrasi (ppm)
Std 1 0,2000 0,0755 Std 2 0,4000 0,1508 Std 3 0,6000 0,2347 Std 4 0,8000 0,2996 Std 5 1,0000 0,3764
Tabel L1.8 Data Hasil Absorbansi Adsorben 110ᴼC terhadap Logam Cd2+ No Konsentrasi Awal
(ppm)
Absorbansi Konsentrasi Akhir
(ppm)
1 60 0,0087 0,0206
2 80 0,0127 0,0312
3 100 0,0550 0,1440
Tabel L1.9 Data hasil Absorbansi Adsorben 500ᴼC terhadap Logam Cd2+ No Konsentrasi Awal
(ppm)
Absorbansi Konsentrasi Akhir
(ppm)
1 60 0,1409 0,3704
2 80 0,3014 0,7984
3 100 0,4100 1,0880
Tabel L1.10 Data hasil Absorbansi Adsorben 800ᴼC terhadap Logam Cd2+ No Konsentrasi Awal
(ppm)
Absorbansi Konsentrasi Akhir
(ppm)
1 60 0,0180 0,0427
L1.5.2 Data hasil Percobaan Penentuan Jumlah Logam Pb2+ yang Terjerap
oleh Adsorben
Tabel L1.11 Data Deret Standar Logam Pb2+ No Absorbansi Konsentrasi (ppm)
Std 1 0,2000 0,0053 Std 2 0,4000 0,0093 Std 3 0,6000 0,0134 Std 4 0,8000 0,0178 Std 5 1,0000 0,0219
Tabel L1.12 Data Hasil Absorbansi Adsorben 500ᴼC Terhadap Logam Pb2+ No Konsentrasi Awal
(ppm)
Absorbansi Konsentrasi Akhir
(ppm)
1 60 0,0115 0,0077
2 80 0,0153 0,0268
LAMPIRAN 2
CONTOH PERHITUNGAN
L2.1 PERHITUNGAN BERAT JENIS ( DENSITAS ) ADSORBEN
Dalam penelitian ini, akan dihitung densitas dari masing – masing adsorben yang diaktivasi dengan menggunakan persamaan 3.1 , adapaun data yang digunakan adalah data pengukuran untuk adsorben 110ᴼC.
Tabel L2.1 Data hasil percobaan berat jenis ( densitas) adsorben 110ᴼC
No M1 (gr) M2 (gr) M3 (gr) M4 (gr)
1 20,9785 49,3250 32,5672 56,4360
2 20,9785 49,3250 32,9474 56,5896
3 20,9785 49,3250 32,7616 56,7585
Data Percobaan : Berat adsorben (A) = 1 g
Volume piknometer (B) = 25 ml Berat piknometer ( M1) = 20,9785 g Berat piknometer + air (M2) = 49,3250 g Berat piknometer + adsorben (M3) = 32,7587 g
Berat piknometer + aquades + adsorben (M4) = 56,5947 g
Perhitungan berat jenis aquades :
aqudes=
piknometer V
air m
= , − ,
Perhitungan berat jenis adsorben :
Padsorben = ( M3– M1) / {(M2– M1) – (M4– M3)} x Paquades
= (32,7587 - 20,9785) / { (49,3250 - 20,9785) – (56,5947 - 32,7587)} x 1,13 = 11,7802 / ( 28,3465 – 23,836) x 1,13
= 11,7802 / 4,5096 x1,13 = 2,95 g/ml
Dengan cara yang sama, maka dihitung densitas untuk adsorben 500ᴼC dan 800ᴼC sehingga diperoleh data seperti pada dengan tabel L1.3 dan L1.4.
L2.2 PERHITUNGAN KADAR AIR ADSORBEN
Berikut merupakan data hasil penentuan kadar air untuk adsorben 500ᴼC Data percobaan :
Berat cawan kosong = 33,4629 g
Berat cawan + adsorben sebelum pengeringan = 34,4635 g Berat cawan + adsorben setelah pengeringan = 34,4472 g
% Air = � � � � − � � ℎ � � � � %
% Air = , , − , � %
% Air = 1,6929 %
L2.3 PERHITUNGAN KADAR ABU ADSORBEN
Berikut merupakan data hasil penentuan kadar abu untuk adsorben 500ᴼC Data percobaan :
Berat cawan kosong = 33,3853 g
59
% Abu = � � �� − � �� ℎ � � � %
% Abu = , ,− , � % , % Abu = 7,9390 %
L2.4 PERHITUNGAN JUMLAH LOGAM Cd2+ DAN Pb2+ YANG TERJERAP
ADSORBEN
L2.4.1 Perhitungan Jumlah Logam Cd2+ yang Terjerap Adsorben
Dalam penentuan jumlah logam Cd2+ yang terjerap maka akan digunakan salah satu adsorben yaitu adsorben 500ᴼC dengan konsentrasi awal (Co) yang ditentukan sebesar 60 ppm dengan menggunakan rumus pada persamaan 3.2 akan diperoleh hasil sesuai dengan tabel L2.2 di bawah.
Tabel L2.2 Data Pengukuran Jumlah Logam Cd2+ yang Terjerap No Co ( ppm) C (ppm) v (ml) b (g) Wads (mg/g)
1 60 0,3704 50 1 2,98148
2 80 0,7984 50 1 3,96008
3 100 1,088 50 1 4,9456
Berikut contoh perhitungannya, diketahui: B = 1 g
Co = 60 ppm
C = 0,3704 ppm ( Hasil Analisa Absorpsi Serapan Atom ) V = 50 ml
Dengan menggunakan rumus pada persamaan 3.2, maka akan diperoleh:
B 1 x V x 1.000
C Co Wads
� = − ,. � �
L2.4.2 Perhitungan Jumlah Logam Pb2+ yang Terjerap Adsorben
Dalam penentuan jumlah logam Pb2+ yang terjerap maka akan digunakan salah satu adsorben yaitu adsorben 500ᴼC dengan konsentrasi awal (Co) yang ditentukan sebesar 80 ppm dengan menggunakan rumus pada persamaan 3.2 akan diperoleh hasil sesuai dengan tabel L2.3 di bawah.
Tabel L2.3 Data Pengukuran Jumlah Logam Pb2+ yang Terjerap No Co ( ppm) C (ppm) v (ml) b (g) Wads (mg/g)
1 60 0,0077 50 1 2,9996
2 80 0,0268 50 1 3,9986
3 100 0,1177 50 1 4,9941
Berikut contoh perhitungannya, diketahui: B = 1 g
Co = 80 ppm
C = 0,0268 ppm ( Hasil Analisa Absorpsi Serapan Atom ) V = 50 ml
Dengan menggunakan rumus pada persamaan 3.2, maka akan diperoleh:
B 1 x V x 1.000
C Co Wads
� = − ,. � �
LAMPIRAN 3
FOTO HASIL PENELITIAN
L3.1 FOTO PERLAKUAN AWAL CANGKANG KERANG BULU
Gambar L3.1 Cangkang Kerang
Gambar L3.2 Ball Mill Cangkang Kerang
L3.2 FOTO PROSES PEMANASAN CANGKANG KERANG BULU
Gambar L3.7 Adsorben Hasil Pemanasan Suhu 500ᴼC L3.3 FOTO KARAKTERISASI ADSORBEN
Gambar L3.8 Penentuan Berat Jenis Adsorben Suhu 500ᴼC dengan Piknometer Gambar L3.5 Furnace pada Pemanasan
Suhu 500ᴼC
63
Gambar L3.9 Penimbangan Adsorben dalam Penentuan Kadar Air dan Abu
L3.4 FOTO PROSES ADSORPSI TERHADAP ION LOGAM Cd2+ DAN Pb2+
Gambar L3.12 Filtrat yang Akan Dianalisa dengan AAS
DAFTAR PUSTAKA
[1] Hiroaki Onoda, Hironari nakanishi (2012). “Preparation of calcium phospate
with oyster shells”. Journal scientific Research, 3, 71 – 74. Diakses 27 Oktober 2013
dari Scientific Research.
[2] Muntamah. “Sintesis Dan Karakterisasi Hidroksiapatit Dari Limbah Cangkang
Kerang Darah”. Skripsi, Program Pascasarjana fakultas Pertanian IPB, Bogor, 2011, hal 16.
[3] Ratanapom Yuangsawad, Duangkamol Na – Ranong (2011). “Recycling osyter
shell as adsorbent for phosphate removal”. Diakses 27 Oktober 2013, dari the 21st
Thai Institute of Chemical Engineering and Applied Chemistry.
[4] Mustakimah Mohamed, Suzana Yusup, Saikat Maitra (2012). “Decomposition
study of calcium carbonate in cockle shell”. Journal of Engineering science and
Tecnology, Vol 7, No. 1, Diakses 27 Oktober 2013 dari Proquest.
[5] Yong Sik Ok, dkk (2010). “Effect of natural and calcined oyster shells on Cd and
Pb immobilization in contaminated soils”. Journal of Environment Earth Sciences,
61, 1301 – 1308. Diakses 27 Oktober 2013 dari Springer.
[6] Stevens A Odoemelam, Nnabuk Okon Eddy (2009). “Studies on the use of oyster, snail and periwinkle shells as adsorbents for the removal of Pb 2+ from
aqueous solution”. E - J.Chem, 6(1), 213 – 222. Diakses 27 Oktober 2013 dari E – j
Chem.
[7] Raditya Derifa Jannatin, Mohammad Razif, Mahirul Mursid. “Uji Efisiensi
Removal Adsorpsi Arang Batok Kelapa untuk Mereduksi Warna dan Permanganat Value dari Limbah Cair Industri Batik. Fakultas Teknik ITS, Surabaya, 2012, hal 3-4.
[8] Bobby Wahyu Saputra. “ Desain Sistem Adsorpsi”. Program Sarjana Fakultas Teknik UI, Depok, 2007, hal 2-3.
[9] Lisna Rosmayati, Yayun Andriani, (2012). “Rancang Bangun adsorben Nano Partikel untuk Merkuri Removal”. Lembaran Publikasi Minyak dan Gas Bumi. Vol 46, No.1, Hal 12
[10] Rizki Anshari. “Penentuan Kapasitas Penyerapan Zat Warna Tekstil Remazol
Briliant (RB) Red F3B Oleh Zeolit.” Skripsi, Program Sarjana Fakultas Teknik ITB,
51
[11] Nor Adilla Rashidi. M. Mohamed and S.Yusup. 2012. The Kinetic Model of Calcination And Carbonation of Anadara Granosa. Department of Chemical Engineering, Universiti Teknologi PETRONAS. INTERNATIONAL JOURNAL of RENEWABLE ENERGY RESEARCH
[12] Jasinda. “Pembuatan Dan karakterisasi Adsorben Cangkang Telur Bebek yang
Diaktivasi Secara Termal”. Skripsi, Program Sarjana Fakultas Teknik USU, Medan,
2013.
[13] Mohan Hilman, M.R Widiatmo, Yusi A.L, Gamma A.J, Sulaeman. “Palentologi Bivalvia”. Fakultas Teknik Geologi Universitas Padjajaran, Bandung, 2009, hal 4. [14] “Kerang Pasar Cemerlang, Pasokan Kurang”. Kementrian kelautan dan Perikanan. Warta Pasar ikan volume 79, Maret 2010. Hal 12-13.
[15] Nurjanah, Zulhamsyah, kustiyariyah. 2005. “Kandungan Mineral dan Proksimat Kerang Darah (Anadara granosa) yang Diambil dari Kabupaten Boalemo,
Gorontalo”. Buletin Teknologi Hasil Perikanan volume VII no 2. Hal 1- 6.
[16] Muzamil Agus. “Dampak Limbah Cair Pabrik Tekstil PT Kenaria Terhadap Kualitas Air Sungai Winong Sebagai Irigasi Pertanian Di Desa Purwosuman Kecamatan Sidoharjo Kabupaten Sragen”. Skripsi, Program Sarjana Pendidikan Geografi, Universitas Sebelas Maret, Surakarta, 2010, hal 1.
[17] “Status Lingkungan Hidup Indonesia 2012 Pilar Lingkungan Hidup”. Kementerian Lingkungan Hidup, 5 Juni 2013, hal 24 - 32.
[18] Esty Rahmawati, Leny Yuanita (2013). “Adsorpsi Pb(II) Oleh Arang Aktif Sabut Siwalan (Borassus flabellifer)”. Program Studi Kimia Fmipa. Universitas Negeri Surabaya, Surabaya. UNESA Journal Of Chemistry, Vol 2, No. 3, hal 3. [19] Zaidan, “Pedoman Praktikum Fisika Universitas,” Universitas Airlangga, Surabaya, 2009: hal 19 - 21.
[20] Rosita Idrus, Boni Pahlanop Lapanporo, Yoga Satria Putra (2013). “Pengaruh Suhu Aktivasi Terhadap Kualitas karbon Aktif Berbahan Dasar Tempurung Kelapa”. Program Studi Fmipa. Universitas TanjungPura, Pontianak. Prisma Fisika, Vol 1, No. 1, hal 50 – 55.
[21] Ryan Hendra. “Pembuatan Karbon Aktif Berbahan Dasar Batubara Indonesia Dengan Metode Aktivasi Fisika Dan Karakteristiknya”. Skripsi, Program Sarjana Fakultas Teknik UI, Jakarta, 2008, hal 29.
[22] Mikrajuddin Abdullah, dan Khairurrijal, (2009). “Review: Karakterisasi
Nanomaterial”. Journal ofNanosains & Nanoteknologi, Vol 2, No.1, Februari, hal 9.
Likuida Lignoselulosa.” Tesis, Program Magister Fakultas Teknik UI, Depok, 2012. Hal 44.
[24] David Hugh Young, Roger A. Freedman., Sears and Zemansky’s University Physics. (New York: Addison-wesley, 2000), hal 10.
[25] Sudrajat, R. Gustan Pari, Arang Aktif, Teknologi Pengolahan dan Masa Depannya (Jakarta: Badan Penelitian dan Pengembangan Kehutanan, 2012), hal.29.
[26] Murni Handayani dan Eko Sulistiyono (2009). “Uji Persamaan Langmuir Dan
Freundlich Pada Penyerapan Limbah Chrom (VI) oleh Zeolit”. Prosiding Seminar Nasional Sains dan Teknologi Nuklir. Pusat Penelitian Metalurgi-LIPI, hal 134. [27] Geankoplis, C.J. Transport Process and Unit Operation. (New York: Allyn and
BAB III
METODOLOGI PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Penelitian dilakukan di Laboratorium Penelitian, Laboratorium Operasi Teknik Kimia dan Laboratorium Kimia Analisa, Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara, Medan. Penelitian ini dilakukan selama lebih kurang 6 bulan.
3.2 BAHAN
Pada penelitian ini bahan yang digunakan antara lain:
1. Cangkang kerang bulu dari penjual makanan Seafood yang berada di kawasan
Jalan klambir V Medan 2. Aquadest
3. Larutan logam Cd(II) 4. Larutan logam Pb(II)
3.3 PERALATAN
Pada penelitian ini peralatan yang digunakan antara lain: 1. Peralatan Analisa BET (Brunaer, Emmet, dan Teller) 2. Spektrofotometer Serapan Atom (SSA)
3. Oven
4. Furnace
5. Ball Mill
6. Ayakan 140 mesh 7. Desikator
8. Piknometer 10 ml 9. Magnetic Stirrer
10.Kertas Saring Whatman 42
11.Beaker Glass
14.Batang Pengaduk 15.Corong Gelas 16.Pipet Tetes 17.Stopwatch
18.Erlenmeyer 19.Lumpang dan Alu 20.Cawan Porselen 21.Kuvet
22.Penjepit Tabung 23.Spatula
3.4PROSEDUR PENELITIAN
3.4.1 Pembuatan Adsorben Cangkang Kerang Bulu
Prosedur pembuatan adsorben cangkang kerang bulu dilakukan dengan mengadopsi prosedur yang dilakukan oleh Yong [5], Mustakimah, [4] yaitu :
1. Cangkang kerang bulu dicuci dengan air keran beberapa kali hingga bersih dan lapisan membran dilepas dan dipisahkan dari cangkangnya.
2. Cangkang kerang bulu dianginkan hingga kering.
3. Cangkang kerang bulu dihancurkan menjadi lebih kecil dengan lumpang dan alu serta digiling menjadi serbuk dengan ball mill.
4. Serbuk cangkang kerang bulu diayak dengan ayakan yang berukuran 140 mesh.
5. Hasil ayakan yang lolos dipanaskan pada suhu 110ᴼC di oven, 500ᴼC dan
800ᴼC di Pirolisa selama 4 jam.
23
3.5PROSEDUR ANALISA
3.5.1 Karakterisasi Adsorben Cangkang Kerang Bulu
Prosedur karakterisasi adsorben cangkang kerang dilakukan dengan cara mengirim hasil adsorben cangkang kerang pada suhu 1100C, 5000C, dan 8000C ke laboratorium Instrumentasi dan Analisis, Departemen Teknik Kimia, UGM. kemudian diukur dengan menggunakan Peralatan Analisa BET (Braunner, Emmet dan Teller) untuk mengetahui luas permukaan adsorben.
3.5.2 Penentuan Berat Jenis (Densitas) Adsorben Cangkang Kerang Bulu
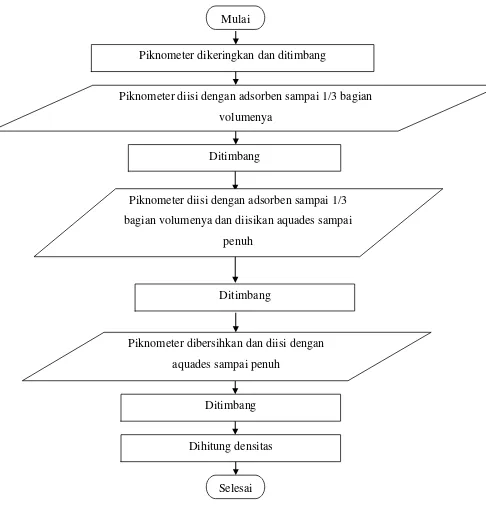
Prosedur penentuan berat jenis (densitas) adsorben cangkang kerang bulu dilakukan dengan mengadopsi prosedur yang dilakukan oleh zaidan [19] yaitu :
1. Timbang piknometer yang bersih dan kering bersama tutupnya. 2. Isi piknometer dengan adsorben sampai 1/3 bagian volumenya.
3. Timbang piknometer berisi adsorben beserta tutupnya. Isikan aquades perlahan-lahan ke dalam piknometer berisi adsorben, kocok-kocok, dan isi sampai penuh sehingga tidak ada gelembung udara di dalamnya.
4. Timbang piknometer berisi adsorben dan aquades tersebut beserta tutupnya. 5. Bersihkan piknometer dan isi penuh dengan aquades hingga tidak ada
gelembung di dalamnya.
6. Timbang piknometer berisi penuh aquades dan tutupnya.
7. Bersihkan dan keringkan piknometer dan dihitung dengan rumus :
ᵖ
adsorben = ( M3– M1) / {(M2– M1) – (M4– M3)} xᵖ
aquades (3.1) M1 = massa piknometer kosong beserta tutupnya.M2 = massa piknometer penuh air beserta tutupnya. M3 = massa piknometer berisi adsorben beserta tutupnya.
3.5.3 Penentuan Kadar Air
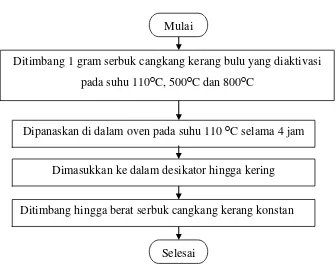
Sebanyak satu gram adsorben cangkang Kerang Bulu yang diaktivasi pada
suhu 110ᴼC, 500ᴼC dan 800ᴼC ditimbang dan dianggap sebagai massa mula- mula,
kemudian dipanaskan dalam oven pada suhu 110°C selama 4 jam. Selanjutnya adsorben cangkang kerang bulu tersebut dimasukkan dalam desikator hingga kering dan diperoleh massa yang konstan [20].
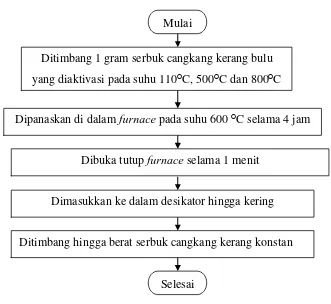
3.5.4 Penentuan Kadar Abu
Sebanyak satu gram adsorben cangkang kerang bulu yang diaktivasi pada suhu 110ᴼC, 500ᴼC dan 800ᴼC ditimbang dan dianggap sebagai massa mula- mula, kemudian dipanaskan pada suhu 600°C selama 4 jam. setelah selesai tutup furnace dibuka selama satu menit untuk menyempurnakan proses pengabuan. Selanjutnya dimasukkan dalam desikator hingga kering dan diperoleh massa konstan sebagai massa abu [20].
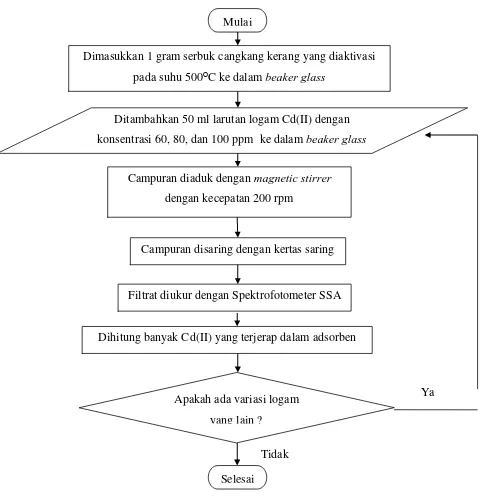
3.5.5 Penentuan Jumlah Logam Cd(II) dan Pb(II) yang Terjerap dalam Adsorben
Prosedur penentuan jumlah logam Cd(II) yang terjerap dalam adsorben dilakukan dengan mengadopsi prosedur yang dilakukan oleh Steven [6] dan Jasinda [12] yaitu:
1. Ke dalam beaker glass 100 ml dimasukkan 1 gram sampel serbuk cangkang
kerang bulu pada suhu 1100C.
2. Ditambahkan 50 ml larutan Cd(II) atau Pb(II) dengan konsentrasi 60, 80, dan 100 ppm ke dalam beaker glass yang telah berisi sampel.
3. Campuran diaduk dengan magnetic stirrer dengan kecepatan 200 rpm suhu 25
ᴼC.
4. Hasil pengadukan disaring dengan menggunakan kertas saring.
5. Filtrat diambil untuk mengukur konsentrasi akhir Cd(II) dan Pb(II) dengan menggunakan Spektrofotometer Serapan Atom (SSA).
6. Hasil pengukuran akan berupa konsentrasi dari filtratnya.
25
B
1 x V x 1.000
C C Wads 1 2
(3.2)
Keterangan :
Wads = berat Cd(II) atau Pb(II) yang terjerap oleh satu gram sampel (mg/g) B = berat sampel yang digunakan (g)
3.6FLOWCHART PENELITIAN
3.6.1 Flowchart Pembuatan Adsorben Cangkang Kerang Bulu yang Diaktivasi secara Termal dan Karakterisasi
Gambar 3.1 Flowchart Pembuatan Adsorben Cangkang Kerang Bulu yang Diaktivasi Secara Termal dan Karakterisasi
Mulai
Cangkang kerang bulu dicuci dengan air keran beberapa kali
Cangkang kerang bulu yang telah bersih dianginkan hingga kering
Setelah kering, cangkang kerang bulu dihancurkan dengan lumpang dan alu serta digiling dengan ball mill
Hasil gilingan diayak dengan ayakan 140 mesh
Hasil ayakan yang lolos dipanaskan pada suhu 1100C di oven, 5000C dan 8000C di Pirolisa selama 4 jam.
Hasil pemanasan disimpan dalam desikator
Selesai
27
3.6.2 Flowchart Penentuan Berat Jenis (Densitas) Adsorben Cangkang Kerang Bulu
Gambar 3.2 Flowchart Penentuan Berat Jenis Adsorben Cangkang Kerang bulu. Piknometer dikeringkan dan ditimbang
Ditimbang
Selesai
Piknometer diisi dengan adsorben sampai 1/3 bagian volumenya
Ditimbang
Piknometer diisi dengan adsorben sampai 1/3 bagian volumenya dan diisikan aquades sampai
penuh Mulai
Piknometer dibersihkan dan diisi dengan aquades sampai penuh
Ditimbang
3.6.3 Flowchart Penentuan Kadar Air
Gambar 3.3 Flowchart Penentuan Kadar Air Mulai
Ditimbang 1 gram serbuk cangkang kerang bulu yang diaktivasi pada suhu 110ᴼC, 500ᴼC dan 800ᴼC
Dipanaskan di dalam oven pada suhu 110 ᴼC selama 4 jam
Dimasukkan ke dalam desikator hingga kering
Ditimbang hingga berat serbuk cangkang kerang konstan
29
3.6.4 Flowchart Penentuan Kadar Abu
Gambar 3.4 Flowchart Penentuan Kadar Abu Mulai
Ditimbang 1 gram serbuk cangkang kerang bulu yang diaktivasi pada suhu 110ᴼC, 500ᴼC dan 800ᴼC
Dipanaskan di dalam furnace pada suhu 600 ᴼC selama 4 jam
Dimasukkan ke dalam desikator hingga kering
Ditimbang hingga berat serbuk cangkang kerang konstan
Selesai
3.6.5 Flowchart Penentuan Jumlah Logam Cd(II) dan Pb(II) yang Terjerap dalam Adsorben
Gambar 3.6 Flowchart Penentuan Jumlah Logam Cd(II) dan Pb(II) yang Terjerap dalam Adsorben
Ditambahkan 50 ml larutan logam Cd(II) dengan konsentrasi 60, 80, dan 100 ppm ke dalam beaker glass
Campuran diaduk dengan magnetic stirrer
dengan kecepatan 200 rpm
Campuran disaring dengan kertas saring
Dihitung banyak Cd(II) yang terjerap dalam adsorben
Selesai Mulai
Filtrat diukur dengan Spektrofotometer SSA
Apakah ada variasi logam yang lain ?
Tidak
Ya Dimasukkan 1 gram serbuk cangkang kerang yang diaktivasi
BAB IV
HASIL DAN PEMBAHASAN
4.1 AKTIVASI ADSORBEN CANGKANG KERANG BULU
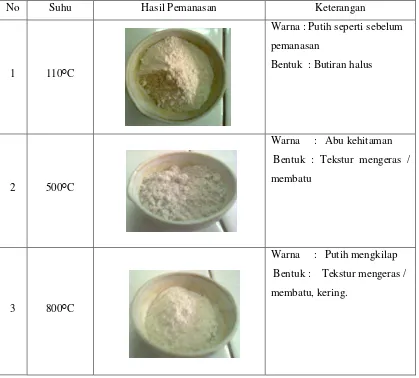
Pada penelitian ini, dilakukan aktivasi cangkang kerang bulu secara fisika yaitu dengan cara memanaskannya dengan variasi tiga suhu yang berbeda, dengan waktu pemanasan selama 4 jam. Adapun besaran variasi dari ketiga jenis suhu tersebut adalah sebesar 110ᴼC, 500ᴼC dan 800ᴼC. Hasil dari pemanasan tersebut dilihat pada gambar 4.1 berikut.
No Suhu Hasil Pemanasan Keterangan
1 110ᴼC
Warna : Putih seperti sebelum pemanasan
Bentuk : Butiran halus
2 500ᴼC
Warna : Abu kehitaman Bentuk : Tekstur mengeras / membatu
3 800ᴼC
Warna : Putih mengkilap Bentuk : Tekstur mengeras / membatu, kering.
Dari gambar 4.1 diatas terlihat bahwa setiap adsorben yang telah dipanaskan dengan suhu yang berbeda menghasilkan karakteristik yang berbeda – beda satu dengan yang lain, ini terlihat dari segi warna dan bentuknya yang dihasilkan. Aktivasi adsorben cangkang kerang bulu dilakukan secara fisika yaitu dengan cara pemanasan. Dimana pemanasan ini dilakukan pada suhu 110ᴼC, 500ᴼC dan 800ᴼC.
Aktivasi ini dilakukan untuk memperbesar pori dari permukaan dari cangkang kerang bulu tersebut sehingga mampu menjerap senyawa – senyawa logam semisal Cd2+, Cu2+ dan Pb2+.
Pada penelitian ini, terlihat adsorben yang telah dipanaskan secara fisika pada suhu 110ᴼC memiliki karakteristik yang bewarna putih yang sama dengan warna sebelum pemanasan, dan setelah pemanasan dari furnace adsorben tidak mengeras / membatu, tetapi tetapi berbentuk butiran – butiran halus.
Pada proses aktivasi fisika suhu 110ᴼC belum terjadi proses kalsinasi - karbonasi, belum terjadi perubahan komposisi sifat dari cangkang kerang, sehingga warna dari cangkang kerang itu sendiri masih sama seperti sebelum pemanasan.
Adsorben yang dipanaskan pada suhu 500ᴼC memiliki karakteristik yaitu berwarna abu kehitaman dan berbeda dengan warna sebelum pemanasan. Setelah pemanasan didalam furnace adsorben mengeras/ membatu, dan setelah didinginkan strukturnya menjadi rapuh sehingga mudah untuk dipecahkan menjadi butiran – butiran halus.
Proses karbonasi adalah proses yang bersifat reversibel dimana proses ini merupakan pengabuan zat. Menurut Martin (2008) karbonasi adalah proses pirolisis pada temperatur 400 – 900ᴼC, dimana tujuan karbonasi adalah untuk menghilangkan zat – zat yang mudah menguap (volatile matter) yang terkandung dalam bahan dasar
[21]. Adapun reaksi karbonasi sesuai persamaan 2.3 sebagai berikut [11]: Karbonasi eksotermik:
33
Hasil ini sesuai dengan proses aktivasi pada suhu 500ᴼC, dimana cangkang kerang yang dihasilkan berwarna abu kehitaman. Kemudian luas permukaannya pun telah berbeda dari suhu sebelumnya yaitu 110ᴼC, hal ini dapat dilihat dari hasil dalam analisa BET.
Adsorben yang dipanaskan pada suhu 800ᴼC memiliki karakteristik yaitu berwarna putih mengkilap dan memiliki warna yang hampir sama dengan sebelum pemanasan. Setelah pemanasan dari furnace, adsorben mengeras/ membatu. Kemudian dilakukan pendinginan dan strukturnya menjadi rapuh sehingga mudah dipecahkan menjadi berbentuk butiran – butiran halus.
Proses kalsinasi pada cangkang kerang adalah proses reversibel dimana penguraian senyawa CaCO3 menjadi senyawa CaO dan senyawa CO2. Menurut Martin (2008) aktivasi adalah bagian dari proses pembuatan adsorben yang bertujuan untuk memperbesar ukuran dan distribusi pori serta memperluas permukaan adsorben dengan proses heat treatment pada temperatur 800 - 1200ᴼC [21]. Adapun
reaksi dari proses kalsinasi sesuai persamaan 2.2 sebagai berikut [11]: Kalsinasi endotermik:
CaCO3(s) ↔ CaO (s) + CO2(g) ΔH = 178 kJ/mol
Pada aktivasi cangkang kerang suhu 800ᴼC, telah terjadi proses kalsinasi, hal ini terlihat dari tidak adanya lagi warna adsorben yang bewarna kehitaman akibat pemanasan.
4.2 KARAKTERISASI ADSORBEN CANGKANG KERANG BULU DENGAN PERALATAN BET
Dalam penelitian ini, dilakukan analisa terhadap adsorben cangkang kerang bulu dari ketiga variasi suhu yaitu 110ᴼC, 500ᴼC dan 800ᴼC menggunakan peralatan BET. Hal ini dilakukan untuk mengetahui luas permukaan masing – masing adsorben dari ketiga variasi suhu tersebut.
padat. Banyaknya molekul gas yang dijerap akan berbanding lurus dengan luas permukaan yang dimiliki zat padat tersebut. Sehingga hal ini dapat mengukur luas permukaan dari zat padat tersebut. Untuk material berpori, luas permukaan spesifik ditentukan oleh porositas zat padat. Dengan demikian metode BET juga dapat digunakan untuk menentukan porositas zat padat [22].
Tabel 4.1 data hasil analisa BET dari cangkang kerang yang telah diaktivasi pada berbagai variasi suhu.
Tabel 4.1 Data Hasil Analisa BET
No Jenis Analisa Suhu (ᴼC)
110 500 800
1 Luas Permukaan ( m2/g) 725,436 807,948 803,822
2 Volume Pori (cc/g) 1,803 2,041 1,995
3 Radius Pori (Å) 18,224 18,229 18,110
Dari data tabel 4.1 diatas terlihat bahwa proses pengaktifan cangkang kerang bulu secara fisika menghasilkan perbedaan luas permukaan, volume pori, dan radius pori cangkang kerang yang berbeda antara satu dengan yang lain. Dimana dalam proses ini yang berperan adalah perbedaan suhu. Terlihat bahwa suhu 500ᴼC memiliki luas permukaan yang paling besar, yaitu 807,948 m2/g. Data yang diperoleh menunjukkan bahwa nilai luas permukaan pada temperatur aktivasi 800ᴼC tidak jauh berbeda daripada 500ᴼC. Sehingga dengan adsorben yang diaktivasi pada suhu 500ᴼC sudah dapat digunakan untuk menjerap logam.
35
Tabel 4.2 Syarat Adsorben Komersil Berdasarkan Luas Permukaan [21]
No Peneliti Luas permukaannya
1 Rouquerol, et al., (1998) 2000 m2/g 2 Yang, (2003), 300 – 400 m2/g 3 sedangkan Bansal, et al., (2005) 800 – 1500 m2/g
Dengan demikian, maka luas permukaan adsorben dari ketiga jenis suhu yaitu 110ᴼC, 500ᴼC, dan 800ᴼC telah memenuhi luas permukaan minimal untuk menjadi adsorben yang efektif dan komersil.
Pada adsorben mempunyai pori-pori yang saling berhubungan. Pori-pori tersebut yaitu pori makro, pori mikro, pori transisi. Melalui pori-pori inilah tejadinya peristiwa penjerapan. Pori makro dapat menjerap absorbat dan pelarut yang berhubungan dengan permukaan luar dari partikel adsorben. Pori mikro merupakan cabang dari pori makro dan dapat menjerap pelarut dan absorbat dengan ukuran yang lebih kecil sedangkan pori transisi merupakan cabang dari pori mikro yang hanya dapat menjerap molekul pelarut yang lebih kecil [9].
Jenis pori adsorben berdasarkan ukuran porinya terbagi atas 3 jenis, hal ini terlihat dari tabel 4.3 dibawah ini.
Tabel 4.3 Penggolongan Adsorben Berdasarkan Ukuran Pori [9]
No Jenis Radius Pori (ɷ)
1 Mikropori ɷ < 20 Å
2 Mesopori 20 < ɷ < 500 Å
3 Makropori ɷ > 500 Å
Dari hasil kriteria tersebut maka ketiga adsorben termasuk ukuran mikropori. Dengan demikian, adsorben dari ketiga suhu aktivasi sesuai dalam ukuran pori untuk menjerap logam Cd2+ dan Pb2+.
[image:30.595.183.450.323.400.2]4.3 PENENTUAN BERAT JENIS DARI CANGKANG KERANG BULU Dalam penelitian ini ditentukan berat jenis dari masing – masing adsorben yang telah diaktivasi suhunya sebesar 100ᴼC, 500ᴼC, dan 800ᴼC. Adapun peralatan yang digunakan adalah piknometer untuk menentukan berat jenis adsorben masing – masing suhu. Data berat jenis dari masing – masing adsorben terdapat dalam tabel 4.4 di bawah ini.
Tabel 4.4 Data Hasil Pengukuran Berat Jenis dari Adsorben No Suhu ( ᴼC) Berat Jenis (g/ml)
1 110 2,96
2 500 2,93
3 800 2,68
Dari tabel 4.4 diatas terlihat bahwa semakin tinggi suhu maka semakin rendah nilai densitas yang diperoleh. Hal ini disebabkan, aktivasi termal (fisika) bertujuan memperbesar volume pori seiring bertambahnya suhu.
Hal ini dapat dilihat dari analisa BET, pada Adsorben 110ᴼC volume pori sebesar 1,803 cc/g, ketika adsorben 500ᴼC volume pori sebesar 2,041 cc/g. Walaupun terjadi penurunan volume pori pada 800ᴼC hal ini kemungkinan disebabkan kesalahan pengukuran pada proses degassing. Oleh karena itu, jika sesuai dengan rumus [24] :
� = � (4.1)
37
4.4 PENENTUAN KADAR AIR
[image:31.595.180.441.250.329.2]Dalam penelitian ini, ditentukan banyaknya kadar air yang dikandung dalam bahan pembuatan adsorben yaitu cangkang kerang bulu yang telah dihaluskan seukuran 140 mesh. Kemudian, dilakukan percobaan dengan cara memanaskan adsorben sebanyak 1 gram pada suhu 110ᴼC selama 4 jam. Adapun data dari percobaan ini dapat dilihat dalam tabel 4.5 dibawah ini.
Tabel 4.5 Data Hasil Pengukuran Penentuan Kadar Air No Adsorben ( ᴼC ) % Penguapan Air
1 110 0,6919
2 500 1,6929
3 800 1,7125
Penentuan kadar air ini dilakukan untuk menentukan seberapa banyak air yang teruapkan sehingga air yang menutupi pori pada adsorben dapat dihilangkan. Hilangnya senyawa air yang terdapat pada pori – pori adsorben menyebabkan luas permukaan pori bertambah luas. Sehingga kemampuan adsorben dalam menjerap senyawa bertambah baik [20].
Tabel 4.6 Standar Kualitas Arang Aktif menurut SNI (1995) [25]
No Uraian Prasyarat Kualitas
Butiran Serbuk 1 Bagian yang hilang pada pemanasan 950ᴼC, (%) Maks. 15 Maks.25
2 Kadar Air ( %) Maks.4,5 Maks.15
3 Kadar Abu (%) Maks.2,5 Maks.10
4 Bagian tidak mengarang 0 0
5 Daya serap terhadap I2, (mg/g) Min.750 Min.750
6 Karbon aktif murni, (%) Min.80 Min.65
7 Daya serap terhadap Benzena, % Min.25 -
8 Daya serap terhadap biru metilen (mg/g) Min.60 Min.120 9 Berat jenis curah, g/ml 0,45 – 0,55 0,3 – 0,35
10 Lolos mesh 325, (%) - Min.90
11 Jarak mesh, (%) 90 -
12 Kekerasan, (%) 80 -
39
4.5 PENENTUAN KADAR ABU
[image:33.595.187.453.250.327.2]Dalam penelitian ini, ditentukan banyaknya kadar abu yang dikandung dalam bahan pembuatan adsorben yaitu cangkang kerang bulu yang telah dihaluskan seukuran 140 mesh. Kemudian, dilakukan percobaan dengan cara memanaskan adsorben sebanyak 1 gram pada suhu 600ᴼC selama 4 jam. Adapun data percobaan ini dapat dilihat dalam tabel 4.7 di bawah ini.
Tabel 4.7 Data Hasil Pengukuran Penentuan Kadar Abu No Adsorben ( ᴼC) % Penguapan Abu
1 110 8,3931
2 500 7,9390
3 800 7,8641
Penentuan kadar abu dilakukan untuk menentukan seberapa banyak mineral ataupun pengotor lainnya yang terdapat dalam adsorben. Pada adsorben terdapat lapisan monolayer yang membentuk pori yang biasanya terdapat mineral ataupun pengotor lainnya yang menutupi pori. Ketika terjadi proses aktivasi, pengotor pada lapisan tersebut akan menguap yang menyebabkan pori bertambah luas. Sehingga kemampuan adsorben menjerap senyawa akan semakin baik [20].
Berdasarkan tabel 4.7 diperoleh bahwa % penguapan kadar abu dari masing - masing adsorben suhu 110ᴼC, 500ᴼC dan 800ᴼC adalah 8,39 %, 7,93%, dan 7,86 %.
Berdasarkan kualitas yang diberikan oleh Lembaga Standar Nasional
Indonesia (SNI) nomor 06 - 3730 – 1995 bahwa kadar abu untuk arang aktif (Karbon Aktif) berbentuk serbuk maks 10 % [25]. Hal ini terlihat dalam tabel 4.8
Tabel 4.8 Standar Kualitas Arang Aktif menurut SNI (1995) [25]
No Uraian Prasyarat Kualitas
Butiran Serbuk 1 Bagian yang hilang pada pemanasan 950ᴼC, (%) Maks. 15 Maks.25
2 Kadar Air ( %) Maks.4,5 Maks.15
3 Kadar Abu (%) Maks.2,5 Maks.10
4 Bagian tidak mengarang 0 0
5 Daya serap terhadap I2, (mg/g) Min.750 Min.750
6 Karbon aktif murni, (%) Min.80 Min.65
7 Daya serap terhadap Benzena, % Min.25 -
8 Daya serap terhadap biru metilen (mg/g) Min.60 Min.120 9 Berat jenis curah, g/ml 0,45 – 0,55 0,3 – 0,35
10 Lolos mesh 325, (%) - Min.90
11 Jarak mesh, (%) 90 -
12 Kekerasan, (%) 80 -
41
4.6 PENENTUAN JUMLAH LOGAM Cd2+ DAN Pb2+ YANG TERJERAP
OLEH ADSORBEN
Dalam penelitian ini, diaplikasikan hasil aktivasi adsorben secara fisika pada suhu yang telah ditentukan sebelumnya yaitu 500ᴼC ke dalam larutan yang mengandung ion Kadmium (Cd2+) dan Timbal (Pb2+) dengan konsentrasi yang telah ditentukan yaitu sebesar 60, 80 dan 100 ppm dari masing – masing larutan sintesis tersebut. Pemakaian adsorben dengan suhu 500ᴼC dalam menjerap senyawa Cd2+ dan senyawa Pb2+ disebabkan hasil luas permukaan dari adsorben tersebut memiliki nilai yang terbesar.
[image:35.595.164.493.333.522.2]4.6.1 Penentuan Jumlah Logam Cd2+ Dan Pb2+ Yang Terjerap Oleh Adsorben
Gambar 4.2 Data Hasil Adsorpsi Adsorben terhadap Cd2+ dengan Menggunakan 1 gr Adsorben pada Suhu Kamar
Gambar 4.2 diatas merupakan kurva penjerapan senyawa Cd2+ dengan menggunakan adsorben yang diaktivasi pada suhu 500ᴼC. Semakin besar konsentrasi larutan, semakin banyak jumlah zat terlarut yang dapat diadsorpsi sehingga tercapai keseimbangan tertentu, dimana laju zat yang dijerap sama dengan zat yang dilepas dari adsorben pada suhu tertentu [26]. Dari gambar 4.2 diatas untuk menentukan % penjerapan terhadap logam Cd2+ digunakan rumus perhitungan berikut [27] :
% =� −� � % (4.2) y = 0.0179x - 0.6829
R² = 0.9878
0.0 0.2 0.4 0.6 0.8 1.0 1.2
0 20 40 60 80 100 120
K on sen tr as i Akhi r (C, p p m )
Konsentrasi Awal (Co, ppm)
Konsentrasi Awal Vs Akhir 500 C
maka akan diperoleh persentase hasil penjerapan dari konsentrasi awal 60, 80, 100 ppm sebesar 99,38 % ; 99 % ; 98,91 %. Sehingga dapat dikatakan bahwa adsorben cangkang kerang pada suhu aktivasi 500ᴼC sangat baik dalam menjerap logam Cd2+.
Gambar 4.3 Data Hasil Adsorpsi Adsorben terhadap Pb2+ dengan Menggunakan 1 gr Adsorben pada Suhu Kamar
Gambar 4.3 merupakan konsentrasi akhir larutan Pb2+ setelah diadsorpsi menggunakan adsorben dengan suhu aktivasi 500ᴼC. Dengan menggunakan rumus perhitungan 4.1 akan diperoleh persentase hasil penjerapan terhadap logam Pb2+ dari konsentrasi awal 60, 80, 100 ppm adalah sebesar 99,98 % ; 99,96 % ; 99,88 %. Sehingga dapat dikatakan bahwa adsorben cangkang kerang juga sangat baik dalam menjerap logam Pb2+.
Tabel 4.9 Data Hasil Persentase Penjerapan Logam Cd2+ dan Pb2+ No Konsentrasi Awal
(ppm)
Persentase Penjerapan
Cd2+ Pb2+
1 60 99,38 % 99,98 %
2 80 99 % 99,96 %
y = 0.0028x - 0.1693 R² = 0.8756
0.00 0.02 0.04 0.06 0.08 0.10 0.12 0.14
0 20 40 60 80 100 120
K o n sen tr asi Akh ir ( C, p p m )
Konsentrasi Awal (Co, ppm)
Adsorben 500 C
[image:36.595.159.482.634.742.2]43
4.6.2 Penentuan Adsorpsi Isoterm Logam Cd2+ Dan Pb2+ Yang Terjerap Oleh
Adsorben
A. Isoterm Langmuir
Isoterm Langmuir secara teoritis seperti persamaan berikut [27] :
[image:37.595.158.442.315.508.2]=� ��+� (4.3) Dimana qo adalah kg adsorbate/kg padatan; dan K adalah konstanta, kg/m3. Dengan memplot 1/q dengan 1/C, dimana akan diperoleh slope K/qo dan intercept 1/qo [26]. Gambar 4.4 merupakan grafik Isoterm Langmuir terhadap logam Cd2+.
Gambar 4.4 Data Hasil Adsorpsi Isoterm Langmuir Adsorben terhadap Cd2+ Dari gambar 4.4 diperoleh persamaan y = 0,069x + 0,150. Dengan slope 0,069 dan intercept 0,150. Dimana slope K/qo = 0,069 dan intercept adalah 1/qo = 0,150. Data percobaan dan perhitungan penentuan Isoterm Langmuir adsorpsi ion Cd2+ dengan adsorben cangkang kerang dapat dilihat pada tabel L1.9 dan tabel 4.10.
y = 0.0695x + 0.1504 R² = 0.958
0.00 0.10 0.20 0.30 0.40
0.00 0.50 1.00 1.50 2.00 2.50 3.00
1/q
1/C
adsorben 500 C
Gambar 4.5 Data Hasil Adsorpsi Isoterm Langmuir Adsorben terhadap Pb2+ Gambar 4.5 merupakan grafik Isoterm Langmuir terhadap logam Pb2+. Dari gambar diatas diperoleh persamaan y = 0,001x + 0,199. Dengan slope 0,001 dan intercept 0,199. Dimana slope K/qo = 0,001 dan intercept adalah 1/qo = 0,199. Data percobaan dan perhitungan penentuan Isoterm Langmuir adsorpsi ion Pb2+ dengan adsorben cangkang kerang dapat dilihat pada tabel L1.12 dan tabel 4.10.
Tabel 4.10 Nilai Isoterm Langmuir Cd2+ dan Pb2+
No Isoterm Nilai Regresi
1 Langmuir Cd2+ qo = 6,667
0,958 K = 0,46
2 Langmuir Pb2+ qo = 5,025
0,977 K = 5 x 10-3
y = 0.001x + 0.1998 R² = 0.9776
0.00 0.10 0.20 0.30 0.40
0 50 100 150
1/q
1/ C
adsorben 500 C
[image:38.595.185.454.463.562.2]45
B. Isoterm Freundlich
Isoterm Freundlich persamaannya adalah [27] :
[image:39.595.129.507.290.499.2]q = � � (4.4) Persamaan diatas sering digunakan untuk banyak adsorpsi fisika dan sangat berguna untuk cairan. K dan n adalah konstan dan harus dijelaskan secara eksperimen. Jika diplot log q dengan log C, maka slope adalah eksponen n. Nilai dari K bergantung dari nilai n [27]. Gambar 4.6 merupakan adsorpsi Isoterm Freundlich terhadap Cd2+.
Gambar 4.6 Data Hasil Adsorpsi Isoterm Freundlich Adsorben terhadap Cd2+ Dari gambar 4.6 diperoleh persamaan y = 0,450x + 0,662. Dengan slope 0,450 dan intercept 0,662. Dimana slope n = 0,450 dan intercept adalah Log K = 0,662. Data percobaan dan perhitungan penentuan Isoterm Freundlich adsorpsi ion Cd2+ dengan adsorben cangkang kerang dapat dilihat pada tabel L1.9 dan tabel 4.11.
y = 0.4506x + 0.6628 R² = 0.9711
0 0.2 0.4 0.6 0.8
-0.5 -0.4 -0.3 -0.2 -0.1 0 0.1
Log q
Log C
adsorben 500 C
Gambar 4.7 Data Hasil Adsorpsi Isoterm Freundlich Adsorben terhadap Pb2+ Gambar 4.7 merupakan adsorpsi Isoterm Freundlich terhadap Pb2+. Dari gambar diatas diperoleh persamaan y = 0,185x + 0,878. Dengan slope 0,185 dan intercept 0,878. Dimana slope n = 0,185 dan intercept adalah Log K = 0,878. Data percobaan dan perhitungan penentuan Isoterm Freundlich dalam adsorpsi ion Pb2+ dengan adsorben cangkang kerang dapat dilihat pada tabel L1.12 dan tabel 4.11.
Tabel 4.11 Nilai Isoterm Freundlich Cd2+ dan Pb2+
Pengujian persamaan adsorpsi Isoterm Langmuir dan Isoterm Freundlich untuk ion logam Cd2+ dibuktikan dengan grafik linierisasi yang baik dan mempunyai harga koefisien regresi 0 ≤ R2 ≥ 0.9 (mendekati angka 1). Dari Gambar 4.4 dan 4.6 terlihat bahwa persamaan adsorpsi ion logam Cd2+ oleh adsorben 500ᴼC memenuhi persamaan adsorpsi Langmuir dengan R2 = 0,958 dan juga persamaan adsorpsi Freundlich dengan R2 = 0,971. Sedangkan persamaan adsorpsi Isoterm Langmuir dan Isoterm Freundlich untuk ion logam Pb2+ dibuktikan dari gambar 4.5 dan 4.7
No Isoterm Nilai Regresi
1 Freundlich Cd2+ n = 0,45
0,971 K = 4,59
2 Freundlich Pb2+ n = 0,185
0,985 K = 7,5
y = 0.1858x + 0.8783 R² = 0.985
0.00 0.20 0.40 0.60 0.80
-2.50 -2.00 -1.50 -1.00 -0.50 0.00
Log q
Log C
Adsorben 500 C
47
persamaan adsorpsi Langmuir dengan R2 = 0,977 dan persamaan adsorpsi Freundlich dengan R2 = 0,985. Hal ini menunjukkan bahwa persamaan Isoterm Langmuir mempunyai koefisien regresi lebih kecil daripada Isoterm Freundlich. Sehingga dapat disimpulkan persamaan adsorpsi terhadap ion logam Pb2+ lebih baik mengikuti persamaan adsorpsi Isoterm Freundlich.
Model persamaan Freundlich mengasumsikan bahwa terdapat lebih dari satu lapisan permukaan (multilayer) dan sisi bersifat heterogen, yaitu adanya perbedaan energi pengikat pada tiap-tiap sisi sedangkan persamaan adsorpsi Langmuir dilakukan terhadap lapisan tunggal zat yang teradsorpsi dari ion logam Cd2+ dan Pb2+ pada setiap permukaan adsorben dalam satuan mg ion logam yang teradsorp/gram adsorben [26].
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Adapun kesimpulan yang dapat diperoleh dari penelitian ini adalah:
1. Hasil analisa dengan peralatan BET menunjukkan luas permukaan dari adsorben yang diaktivasi pada suhu 500ᴼC diperoleh sebesar 807,94 m2/g.
2. Nilai luas permukaan terbesar diperoleh pada suhu aktivasi 500ᴼC dengan ukuran adsorben 140 mesh.
3. Semakin tinggi suhu aktivasi termal cangkang kerang maka nilai densitas adsorben yang diperoleh semakin menurun.
4. Hasil analisa kadar air menunjukkan semakin tinggi suhu aktivasi termal cangkang kerang maka semakin kecil nilai kadar air yang terdapat dalam cangkang kerang.
5. Hasil analisa kadar abu menunjukkan semakin tinggi suhu aktivasi termal cangkang kerang maka nilai persentase kadar abu yang diperoleh semakin menurun.
6. Karakteristik dari masing - masing adsorben
No Analisa Suhu Aktivasi (ᴼC) SNI
110 500 800
1 Luas Permukaan (m2/kg) 725,43 807,94 803,822 -
2 Berat Jenis (g/ml) 2,96 2,93 2,68 -
3 Kadar Air (%) 0,69 1,69 1,71 Maks 15 %
4 Kadar Abu (%) 8,39 7,93 7,86 Maks 10 %
49
8. Nilai Isoterm Langmuir dan Freundlich untuk penjerapan ion logam Cd2+
9. Nilai Isoterm Langmuir dan Freundlich untuk penjerapan ion logam Pb2+ No Isoterm Nilai
1 Langmuir qo = 5,025 K = 5 x 10-3 2 Freundlich n = 0,185
K = 7,5
10. Adsorben dari cangkang kerang dengan suhu aktivasi 500ᴼC lebih baik mengikuti persamaan adsorpsi Isoterm Freundlich.
5.2 SARAN
Adapun saran yang dapat diberikan dari penelitian ini adalah :
1. Disarankan untuk memvariasikan ukuran, tidak hanya sebesar 140 mesh.
2. Disarankan untuk melakukan proses aktivasi termal tanpa adanya udara (vakum).
3. Disarankan untuk melakukan aktivasi secara kimia terhadap adsorben dan membandingkannya dengan aktivasi secara fisika.
4. Disarankan untuk menvariasikan waktu aktifasi No Isoterm Nilai
1 Langmuir qo = 6,667 K = 0,46 2 Freundlich n = 0,45
BAB II
TINJAUAN PUSTAKA
2.1 ADSORPSI
Adsorpsi adalah pengumpulan substansi pada permukaan adsorban berbentuk padatan, sedangkan absorpsi adalah perembesan dari pengumpulan substansi ke dalam padatan. Adsorpsi diklasifikasikan menjadi dua yaitu adsorpsi fisik dan kimia. Adsorpsi fisik terutama dikarenakan oleh gaya van der waals dan terjadi bolak balik (reversibel). Ketika gaya antar molekul dari interaksi antara solute (zat yang
dilarutkan) dan adsorban lebih besar daripada gaya atraksi antara solute dan solvent. Solute akan diserap pada permukaan adsorban. Contoh dari adsorpsi fisik adalah
adsorpsi oleh karbon aktif.
Kinetika adsorpsi dapat dijelaskan sebagai tingkat perpindahan molekul dari larutan ke dalam pori-pori partikel, adsorban. Terdapat tiga mekanisme yang terjadi pada proses adsorpsi yaitu:
1. Molekul-molekul zat yang diserap dipindahkan dari bagian terbesar larutan ke permukaan luar dari adsorban. Fase ini disebut sebagai difusi film atau difusi eksternal.
2. Molekul-molekul zat yang diserap dipindahkan pada kedudukan adsorpsi pada permukaan adsorban ke bagian yang lebih dalam yaitu pada bagian pori. Fase ini disebut dengan difusi pori. Molekul-molekul zat yang diadsorpsi menempel pada permukaan partikel [7].
2.1.1 Jenis-Jenis Adsorpsi a. Adsorpsi Fisik
6
b. Adsorpsi Kimia
Adsorpsi kimia adalah adsorpsi yang terjadi akibat interaksi kimia antara molekul adsorben dengan molekul adsorbat. Proses ini pada umumnya menurunkan kapasitas dari adsorben karena gaya adhesinya yang kuat sehingga proses ini tidak reversibel [8].
2.1.2 Faktor Yang Mempengaruhi Adsorpsi Fisik
Ada banyak faktor yang mempengaruhi adsorpsi secara fisik, yaitu: a. Suhu
Pada umumnya, naiknya suhu menyebabkan berkurangnya kemampuan adsorpsi karena molekul dari adsorban mempunyai energi getaran lebih besar dan oleh karena itu, akan keluar dari permukaan. Semua aplikasi dari adsorpsi ini berada dibawah kondisi isoterm yaitu biasanya pada suhu ambien. Kemampuan adsorpsi akan berkurang pada suhu yang tinggi.
b. Sifat Pelarut
Pelarut mempunyai pengaruh penting karena akan berkompetisi dengan karbon aktif dalam atraksinya terhadap solute. Jadi adsorpsi dari solute organik akan lebih
rendah dari pada adsorpsi pada zat cair lain. Bagaimanapun akan banyak pelarut dalam air, oleh karena itu tidak perlu dikhawatirkan terlalu jauh pelarut dalam air. c. Area Permukaan
Jumlah substansi yang adsorben dapat serap, secara langsung terjadi pada area permukaan internal. Hal ini tidak sepenuhnya benar. Pada penyerapan molekul besar, banyak dari area permukaan internal yang kemungkinannya tidak dapat terjadi. d. Struktur Pori
Struktur pori merupakan bagian penting dikarenakan diameter pori yang mempunyai range 10 sampai 100.000 Å, kontrol ukuran molekul yang sesuai.
e. Sifat dari Solute
Senyawa anorganik menunjukkan range luas dari adsorpsi. Di satu sisi, pemisahan kuat garam seperti sodium chloride dan potasium nitrat tidak semua diadsorpsi oleh karbon aktif. Di sisi yang lain solute yang tidak dipisahkan dengan kuat seperti iodin
dan merkuri klorida sangat bagus diadsorpsi. Faktor kunci terlihat apakah solute ada
f. Pengenceran pH
Pengaruh pada pengenceran pH sangat penting ketika adsorpsi merupakan untuk zat yang dapat terion. Diketahui bahwa adsorpsi akan rendah pada bentuk terion. Pada umumnya tingkat adsorpsi akan meningkat apabila pH diturunkan [7].
2.1.3 Prinsip Adsorpsi Berdasarkan Ukuran Pori
Adsorben berperan besar dalam proses adsorpsi karena dalam adsorben terdapat pori – pori. Pori – pori tersebut tidak seragam, melainkan terdistribusi menjadi beberapa ukuran pori. Menurut IUPAC, ukuran pori terbagi atas tiga bagian besar yaitu untuk ukuran radius kurang dari 2 nm disebut dengan mikropori, untuk ukuran radius diantara 2 sampai 50 nm disebut mesopori, dan untuk ukuran radius yang lebih dari 50 nm disebut makropori.
Pori – pori suatu adsorben akan memberikan tempat terjerapnya suatu molekul adsorbat. Berhasilnya suatu proses adsorpsi juga bergantung pada besarnya molekul adsorbat yang akan diserap dan tergantung juga pada jenis pori – pori pada adsorben.
Pada adsorben mempunyai pori-pori yang saling berhubungan. Pori-pori tersebut yaitu pori makro, pori mikro, pori transisi. Melalui pori-pori inilah tejadinya peristiwa penjerapan. Pori makro dapat menjerap absorbat dan pelarut yang berhubungan dengan permukaan luar dari partikel adsorben. Pori mikro merupakan cabang dari pori makro dan dapat menjerap pelarut dan absorbat dengan ukuran yang lebih kecil sedangkan pori transisi merupakan cabang dari pori mikro yang hanya dapat menjerap molekul pelarut yang lebih kecil [9].
2.1.4 Isoterm Adsorpsi
8
a. Isoterm Langmuir
Isoterm ini berdasar asumsi bahwa:
a. Adsorben mempunyai permukaan yang homogen dan hanya dapat mengadsorpsi satu molekul adsorbat untuk setiap molekul adsorbennya. Tidak ada interaksi antara molekul-molekul yang terserap.
b. Semua proses adsorpsi dilakukan dengan mekanisme yang sama. c. Hanya terbentuk satu lapisan tunggal saat adsorpsi maksimum.
Namun, biasanya asumsi-asumsi sulit diterapkan karena hal-hal berikut: selalu ada ketidaksempurnaan pada permukaan, molekul teradsorpsi tidak inert dan
mekanisme adsorpsi pada molekul pertama sangat berbeda dengan mekanisme pada molekul terakhir yang teradsorpsi.
Langmuir mengemukakan bahwa mekanisme adsorpsi yang terjadi adalah sebagai berikut: A
(g) + S AS, dimana A adalah molekul gas dan S adalah permukaan adsorpsi.
b. Isoterm Brunauer, Emmet, dan Teller (BET)
Isoterm ini berdasar asumsi bahwa adsorben mempunyai permukaan yang homogen. Perbedaan isoterm ini dengan Langmuir adalah BET berasumsi bahwa molekul-molekul adsorbat bisa membentuk lebih dari satu lapisan adsorbat di permukaannya. Pada isoterm ini, mekanisme adsoprsi untuk setiap proses adsorpsi berbeda-beda. Mekanisme yang diajukan dalam isoterm ini adalah:
A
(g) + S AS A
(g) + AS A2S A
(g) + A2S A3S dan seterusnya
Isoterm Langmuir biasanya lebih baik apabila diterapkan untuk adsorpsi kimia, sedangkan isoterm BET akan lebih baik daripada isotherm Langmuir bila diterapkan untuk adsoprsi fisik
c. Isoterm Freundlich
Persamaan ini merupakan persamaan yang paling banyak digunakan saat ini [10]. Persamaannya adalah :
� = �1 (2.1)
dengan x = banyaknya zat terlarut yang teradsorpsi (mg) m = massa dari adsorben (mg)
C = konsentrasi dari adsorbat yang tersisa dalam kesetimbangan k,n,= konstanta adsorben
Dari persamaan tersebut, jika konstentrasi larutan dalam kesetimbangan diplot sebagai ordinat dan konsentrasi adsorbat dalam adsorben sebagai absis pada koordinat logaritmik, akan diperoleh gradien n dan intersep k. Dari isoterm ini, akan diketahui kapasitas adsorben dalam menyerap air. Isoterm ini akan digunakan dalam penelitian yang akan dilakukan, karena dengan isoterm ini dapat ditentukan efisiensi dari suatu adsorben [10].
2.2 KALSINASI - KARBONASI
Senyawa kalsium karbonat (CaCO3) yang banyak terdapat di alam kemudian diadopsi dalam industri proses yang digunakan sebagai padatan adsorben melalui proses kalsinasi dan karbonasi yang bersifat reversibel seperti dalam proses dibawah
ini [11]. Berikut ini merupakan persamaan reaksi kimia dari kalsinasi dan karbonasi yaitu:
Kalsinasi endotermik:
CaCO3(s) ↔ CaO (s) + CO2(g) ΔH = 178 kJ/mol (2.2) Karbonasi eksotermik:
10
Menurut Yan dkk (2012) bahwa kalsinasi dijelaskan dalam lima langkah proses [11] yaitu:
1. Perpindahan panas dari lingkungan ke permukaan eksternal partikel.
2. Perpindahan panas dari permukaan ekternal partikel ke bagian dalam dari permukaan sampel.
3. Penyerapan panas dan dekomposisi termal pada permukaan partikel. 4. Pembentukan difusi oleh CO2 melalui lubang CaO
5. Difusi CO2 menuju lingkungan.
[image:49.595.113.500.402.675.2]Temperatur kalsinasi konvensial untuk kalsium adalah 900oC. Konversi sempurna dari kalsium karbonat dan kalsium oksida terjadi pada suhu 1200oC dengan pH berkisar 12,4 [12]. Tabel 2.1 merupakan tabel dari suhu kalsinasi yang dilakukan pada tiga tahapan pemanasan.
Tabel 2.1 Suhu kalsinasi pada tiga tahapan pemanasan [12] 100oC 400oC 500oC 650oC 700oC 850oC 1200oC
CaCO3 pH 6,5 - 7,78 pH pH 8 -
pH 11,5 50% CaCO3 50% CaO 100% CaO dengan meningkat-nya porositas, lebih besar luas permukaan
MgCO3 pH 6,9 -
75% MgCO3 25% MgO pH 10-11 Sifat bakterios-tatik, ukuran pori meningkat, kelarutan meningkat - -
ZnCO3 -
364oC ZnO
100% agen bakteriostatik
pH 8,25
2.3 KERANG ( BIVALVIA / PELECYPODA)
Bivalvia adalah kelas dalam moluska yang mencakup semua
kerang-kerangan: memiliki sepasang cangkang (nama "bivalvia" berarti dua cangkang). Nama lainnya adalah Lamellibranchia, Pelecypoda, atau bivalva. Ke dalam
kelompok ini termasuk berbagai kerang, kupang, remis, kijing, lokan, simping, tiram, serta kima, meskipun variasi di dalam bivalvia sebenarnya sangat luas.
Kerang-kerangan banyak bermanfaat dalam kehidupan manusia sejak masa dulu. Dagingnya dimakan sebagai sumber protein. Cangkangnya dimanfaatkan sebagai perhiasan, bahan kerajinan tangan, bekal kubur, serta alat pembayaran pada masa lampau. Mutiara dihasilkan oleh beberapa jenis tiram. Pemanfaatan modern juga menjadikan kerang-kerangan sebagai biofilter terhadap polutan.
Kerang yang hidup di laut dan remis yang hidup di air tawar adalah contoh kelas Bivalvia. Hewan Bivalvia bisa hidup di air tawar, dasar laut, danau, kolam, atau
sungai yang banyak mengandung zat kapur. Zat kapur ini digunakan untuk membuat cangkoknya.
Hewan ini memiliki dua kutub (bi = dua, valve = kutub) yang dihubungkan
oleh semacam engsel, sehingga disebut Bivalvia. Kelas ini mempunyai dua cangkok
yang dapat membuka dan menutup dengan menggunakan otot aduktor dalam tubuhnya. Cangkok ini berfungsi untuk melindungi tubuh. Cangkok di bagian dorsal tebal dan di bagian ventral tipis. Kepalanya tidak nampak dan kakinya berotot. Fungsi kaki untuk merayap dan menggali lumpur atau pasir
Cangkok ini terdiri dari tiga lapisan, yaitu :
a. Periostrakum adalah lapisan terluar dari zat kitin yang berfungsi sebagai
pelindung.
b. Lapisan prismatik tersusun dari kristal – kristal kapur berbentuk prisma.
c. Lapisan nakreas atau sering disebut lapisan induk mutiara, tersusun dari
12
2.3.1 SEJARAH KERANG
Kerang merupakan makanan yang umumnya dijumpai di daerah pantai. Terdapat berbagai macam jenis kerang seperti :
a. Kerang Hijau
Merupakan salah satu jenis kerang yang digemari masyarakat, memiliki nilai ekonomis dan kandungan gizi yang sangat baik untuk dikonsumsi. Kerang hijau mengandung protein cukup tinggi, rata-rata 67 gr per 100 gr bobot kering. Kandungan gizi lainnya yang dimiliki kerang hijau antara lain: karbohidrat 2%, lemak 0,45%, air 78%. Ada pun mineral utama yang dikandung oleh kerang hijau yaitu kalsium (133 mg) dan fosfor (170 mg). Dengan mengkonsumsi kerang hijau secara teratur, kita akan mendapat asupan kalsium yang memadai sehingga penyakit keropos tulang (osteoporosis) dapat dihindari [14].
b. Kerang Darah (Anadara granosa)
Merupakan salah satu jenis kerang yang berpotensi dan bernilai ekonomis untuk dikembangkan sebagai sumber protein dan mineral untuk memenuhi kebutuhan pangan masyarakat Indonesia. Kerang darah banyak ditemukan pada substrat yang berlumpur di muara sungai dengan tofografi pantai yang landai sampai kedalaman 20 m. Disebut kerang darah karena kelompok kerang ini memiliki pigmen darah merah/haemoglobin yang disebut
bloody cockles, sehingga kerang ini dapat hidup pada kondisi kadar oksigen
yang relatif rendah, bahkan setelah dipanen masih bisa hidup walaupun tanpa air. Ciri-ciri kerang darah adalah sebagai berikut:
1. mempunyai 2 keping cangkang yang tebal, ellifs dan kedua sisi sama.
2. cangkang berwarna putih ditutupi periostrakum yang berwarna kuning kecoklatan sampai coklat kehitaman.
3. Ukuran kerang dewasa 6-9 cm [15].
Limbah cangkang kerang darah tersebut mengandung senyawa kalsium karbonat (CaCO3) sebesar 95 – 99% berat, dimana dapat dijadikan sebagai sumber bahan baku adsoprsi [4].
Tabel 2.2. Komposisi dari cangkang kerang darah [11]
c. Tiram ( Osyter )
Mentah mengandung berbagai macam mineral antara lain kalsium, besi, magnesium, phosphor, potassium, sodium, seng, tembaga dan Selenium. Komposisi nutrisi tiram per 100 gram adalah air 74,56 gram, energi 105 k.kal, protein 17,1 gram, lemak 0,76 gram, seng atau zinc (Zn) 16,62 mg [14].
Cangkang tiram kaya akan senyawa kalsium karbonat (CaCO3) yang mana senyawa tersebut sangat sesuai sebagai bahan baku untuk menghilangkan senyawa fosfat. Hal ini disebabkan senyawa CaCO3 dapat dijadikan senyawa CaO yang merupakan senyawa aktif dalam hal penghilangan senyawa fosfat dengan teknik adsorpsi. Dengan banyaknya sisa cangkang kerang tiram yang terbuang akan menyebabkan polusi lingkungan. Sehingga cangkang tiram dapat dimanfaatkan kembali sebagai bahan baku adsorpsi. Tiram ini diperoleh dari provinsi Surat Thani di Thailand. Kandungan CaCO3 dari cangkang tiram ini sebesar 93,3% dengan senyawa lain sebesar 6,7% [3].
Komposisi kimia yang telah diteliti oleh Yong Sik ok, dkk (2010) menunjukkan bahwa tiram yang diperoleh setelah dikasinasi merupakan faktor utama dalam cangkang kerang sebesar 96% [5]. Tabel 2.3 dibawah menunjukkan komposisi dari cangkang tiram yaitu:
Tabel 2.3. Komposisi dari cangkang tiram [5]
Sumber/ Mineral Ca+C Mg Na P K Lain – lain
Penang 98.770 0.0476 0.9192 0.0183 0.0398 0.1981 Kuala Selangor 98.8007 0.0477 0.9076 0.0176 0.0392 0.1871 Malacca 98.7834 0.0437 0.9386 0.0178 0.0380 0.1894
14
2.3.2 KONSUMSI KERANG
[image:53.595.108.527.541.684.2]Kerang/siput merupakan salah satu jenis ikan yang tercantum dalam daftar Survei Sensus Ekonomi Nasional (SUSENAS). Melalui data SUSENAS, dapat dilakukan penghitungan konsumsi pangan, termasuk diantaranya kelompok pangan dari ikan. Hasil perhitungan SUSENAS 2009 menunjukkan bahwa penyerapan pasar untuk komoditas kerang/siput di tingkat rumah tangga mencapai 25.450 ton dengan konsumsi rata-rata 0,11 kg/kapita. Selama periode tahun 2006 – 2009, tingkat konsumsi tahun 2009 merupakan tingkat konsumsi yang terendah. Sedangkan tahun 2007 merupakan tingkat konsumsi kerang/siput tertinggi yaitu mencapai 0,25 kg/kapita. Dari perkembangan tingkat konsumsi tersebut, rata-rata pertumbuhan untuk konsumsi kerang/ siput adalah -16,06% [14]. Perkembangan konsumsi kerang/siput tahun 2006 – 2009 tersaji dalam Gambar 2.1 dibawah.
Gambar 2.1. Data Konsumsi Kerang / Siput Tahun 2006 – 2009 [14]
Gambaran tingkat konsumsi dan besarnya serapan pasar kerang/siput menurut provinsi berdasarkan data SUSENAS 2008 tersaji dalam Gambar 2.2 dibawah.
Gambar 2.1 dan 2.2 menunjukkan bahwa dengan nilai konsumsi kerang yang tinggi sehingga dihasilkan limbah cangkang kerang yang tinggi, dengan limbah yang tinggi tersebut dapat dimanfaatkan sebagai pembuatan adsorben dari cangkang kerang.
2.4 Peraturan Pemerintah Tentang Pengelolaan Limbah Cair
Menurut PP No. 20 tahun 1990, Air adalah semua air yang terdapat didalam atau berasal dari sumber air, dan terdapat di atas permukaan tanah, tidak termasuk dalam pengertian ini adalah air yang terdapat di bawah tanah dan air laut [16].
Pada umumnya terdapat tiga masalah klasik yang umumnya terjadi pada air yang disebut 3T: too much, too little, too dirty. Too much berarti di suatu tempat, air
terlalu berlebih. Too little berarti di suatu tempat, air sangat kurang. Too dirty yang
berarti air terlalu kotor. Secara global, pencemaran air berasal dari sumber – sumber seperti :
1. limbah cair domestik
2. Pengelolaan industri yang tidak baik 3. Sampah domestik
4. Pemakaian air berlebihan
5. Penataan fungsi lahan yang tidak baik.
Hal ini berdampak pada kualitas air yang menurun serta buruk dan ganjilnya siklus hidrologi, berpotensi mengganggu kesehatan, misalnya Penyakit diare, identik dengan kualitas air yang buruk, kurangnya ketersediaan air bersih, dan diperburuk dengan perilaku tidak higienis [17].
16
Gambar 2.3 Persentase titik pantau air sungai di Indonesia dengan status tercemar berat berdasarkan Kriteria mutu Air Kelas II PP 82 Tahun 2001 [17]
Secara umum untuk berbagai pemanfaatanya ditetapkan adanya Peraturan Pemerintah (PP) Nomor 82 Tahun 2001 tentang pengelolaan kualitas air dan pengendalian pencemaran air dibedakan menjadi 4 kelas yaitu:
1) Kelas I
Air yang peruntukannya dapat digunakan untuk air baku air minum, dan atau peruntukkan lain yang mempersyaratkan mutu air yang sama dengan kegunaan tersebut.
2) Kelas II
Air peruntukannya dapat digunakan untuk sarana/prasarana rekreasi air, pembudidayaan ikan air tawar, peternakan, air untuk mengairi pertanaman, dan atau peruntukan lain yang mempersyaratkan mutu air yang sama dengan kegunaan tersebut.
3) Kelas III
Air yang peruntukannya dapat digunakan untuk pembudidayaan ikan air tawar, peternakan, air untuk mengairi pertanaman, dan atau peruntukan lain yang mempersyaratkan mutu air yang sama dengan kegunaan tersebut.
4) Kelas IV
[image:55.595.160.462.93.220.2]2.5 PENELITIAN YANG TELAH DILAKUKAN MENGGUNAKAN CANGKANG KERANG
No Peneliti Tahun Topik penelitian
Hasil penelitian 1 Ratanapom
Yuangsawad, Duangkamol Na- rong
2011 Recycling osyter shells as adsorbent for phospate removal
1. Telah berhasil menghilangkan senyawa fosfat dalam sistem kontiniu.
2. Suhu dan jenis gas mempengaruhi banyaknya senyawa fosfat yang dihilangkan.
2 Hiroaki Onoda, Hironari Nakanishi
2012 Preparation of calcium phospate with osyter shells
1. kalsium fosfat dibuat dari asam fosfat dan cangkang tiram. 2. Pengaruh kondisi persiapan
konsentrasi asam fosfat dan pH dipelajari sebagai hasil kalsium fosfat dan karbonat yang tidak bereaksi, dan rasio Ca / P di endapan.
3. Hasil dari kalsium fosfat dan karbonat yang rendah disebabkan kondisi persiapan dengan konsentrasi asam fosfat 0,1 mol/l 3 Yong Sik Ok
Sang-Eun Oh • Mahtab Ahmad • Seunghun Hyun • Kwon-Rae Kim • Deok Hyun Moon • Sang Soo Lee • Kyoung Jae Lim • Weon -Tai Jeon • Jae E. Yang,
2010 Effect of natural and calcined osyter shells on Cd and Pb Immobilition in
contaminated soils
1. kalsinasi NOSP yang dikonversi pada suhu 770 °C menyebabkan senyawa CaCO3 kurang reaktif daripada kereaktifan senyawa CaO.
2. COSP lebih efektif dalam menghilangkan senyawa Cd dan Pb dalam tanah yang terkontaminasi daripada NOSP 3. limbah cangkang tiram bisa
didaur ulang menjadi tanah amelioran yang efektif.
4 Stevens A. Odoemelam and Nnabuk Okon Eddy
2008 Studies on the use of osyter, snail and periwinkle shells as adsorbents for the removal of Pb 2+ from
18
5 Mustakimah Mohamed, Suzana Yusup, Saikat Maitra
2012 Decomposition study of
calcium carbonate in cockle shell
1. empat ukuran partikel berbeda yaitu 0,125-0,25 mm, 0.25-0.5 mm, 1-2 mm, dan 2-4 mm
2. Reaktivitas dekomposisi dilakukan dengan menggunakan Thermal Gravimetri Analyzer ( TGA ) pada tingkat pemanasan 20°C / menit di dalam atmosfer N2 ( Nitrogen ) yang inert
3. Energi aktivasi, E, proses itu ditemukan bervariasi dari 179,38 - 232,67 kJ / mol
2.9 ANALISA BIAYA
Saat ini, ketertarikan akan sumber – sumber bahan baku yang berasal dari limbah semakin meningkat. Sebagai contoh, cangkang hewan laut yang dapat digunakan sebagai bahan baku yang dapat dimanfaatkan kembali. Di negara maju seperti Jepang hewan laut seperti tiram digunakan kembali sebagai bahan baku pembuatan adsorben yang disebabkan cangkang tiram merupakan sumber kalsium [1]. Produksi kerang - kerangan di Indonesia dari tahun 2002 ke tahun berikutnya semakin meningkat. Hal ini terlihat dari data produksi dari tahun 2002 sampai dengan 2006 secara berturut – turut, sebesar 7.00 ton, 12,86 ton, 12,99 ton, 16,35 ton dan 18,87 ton. Dari jumlah produksi kerang yang semakin meningkat maka akan dihasilkan limbah cangkang yang semakin meningkat pula dan cangkang kerang dengan komposisi kalsium oksida dapat dimanfaatkan sebagai bahan baku pembuatan adsorben [2].
Kandungan CaCO3 pada cangkang kerang sebesar 95 – 99% berat, sehingga sangat baik untuk dijadikan sebagai bahan baku adsorben. Dengan cara kalsinasi, maka akan dihasilkan senyawa pengaktif yaitu CaO [4].
[image:57.595.107.527.83.253.2]Untuk itu perlu dilakukan kajian potensi ekonomi adsorben dari limbah cangkang kerang bulu. Tabel 2.4 merupakan harga pembelian bahan baku produksi:
Tabel 2.4 Harga Bahan Baku
Bahan Baku Harga Satuan Kebutuhan Biaya
Cangkang Kerang Bulu
Berikut ini akan dibahas harga kebutuhan listrik sesuai dengan peraturan menteri ESDM Tahun 2014 untuk kebutuhan industri dengan kebutuhan daya sebesar 3500 VA yang terdapat pada tabel 2.5 dibawah:
Tabel 2.5 Harga Kebutuhan Listrik Peralatan
No. Peralatan Harga/kWh Kebutuhan (kW) Waktu (jam) Biaya
1. Ball mill Rp.1.112,00 0,18 3 Rp 600.48,00
2. Furnace Rp.1.112,00 0,8 4 Rp 3.558,4,00
Total Keseluruhan Rp. 4.158,88 Maka perhitungan biaya total produksi yaitu :
Total Biaya Produksi = Biaya Bahan Baku + Total Biaya listrik = Rp 4.000,00 + Rp 4.158,88
= Rp 8.158,88 /kg
Harga produksi pembuatan adsorben cangkang kerang bulu sebesar : Rp 8.158,88 /kg. Berikut merupakan harga masing-masing jenis ads



![Tabel 4.6 Standar Kualitas Arang Aktif menurut SNI (1995) [25]](https://thumb-ap.123doks.com/thumbv2/123dok/835499.606977/32.595.105.532.104.374/tabel-standar-kualitas-arang-aktif-menurut-sni.webp)
![Tabel 4.8 Standar Kualitas Arang Aktif menurut SNI (1995) [25]](https://thumb-ap.123doks.com/thumbv2/123dok/835499.606977/34.595.105.532.104.375/tabel-standar-kualitas-arang-aktif-menurut-sni.webp)