AKTIVITAS ANTIJERAWAT FORMULA CAMPURAN
TEMU LAWAK DAN MENIRAN SERTA PENENTUAN
SIDIK JARI KROMATOGRAFINYA
NI LUH PUTU DEBBY PRABANDARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
NI LUH PUTU DEBBY PRABANDARI Aktivitas Antijerawat Formula
Campuran Temu Lawak dan Meniran serta Penentuan Sidik Jari Kromatografinya.
Dibimbing oleh LATIFAH K DARUSMAN dan WULAN TRI WAHYUNI.
Aktivitas antijerawat dari ekstrak campuran temu lawak dan meniran
dipelajari melalui uji aktivitas antioksidan dan antibakteri. Proses ekstraksi
dilakukan dengan metode maserasi menggunakan pelarut etanol 96% dengan dua
metode maserasi berbeda, yaitu metode Indonesia dan
traditional chinese
medicine
(TCM). Formula 6 (2/3 temu lawak:1/6 meniran:1/6 pati) merupakan
formula teraktif sebagai antijerawat dengan nilai IC
50untuk antioksidan sebesar
93.17 ppm, konsentrasi hambat minimum untuk
Staphylococcus epidermidis
sebesar 0.25 mg/mL, dan konsentrasi bunuh minimum sebesar 0.50 mg/mL.
Metode maserasi TCM memberikan hasil yang lebih baik dibandingkan teknik
Indonesia berdasarkan hasil kedua uji aktivitas yang dilakukan. Analisis sidik jari
dari formula terbaik telah dilakukan menggunakan metode kromatografi lapis
tipis. Fase gerak optimum yang digunakan untuk pemisahan formula campuran
temu lawak dan meniran adalah kloroform dengan jumlah pita sebanyak 9 buah.
Analisis menggunakan kromatografi cair kinerja tinggi menggunakan kolom C18
dan fase gerak gradien asetonitril dan air menunjukkan peningkatan luas area
puncak filantin dan kurkumin ketika standar diadisikan ke dalam sampel.
ABSTRACT
NI LUH PUTU DEBBY PRABANDARI Anti-acne Activity of Formulae
Curcuma xanthorriza
and
Phyllanthus niruri
and the Chromatography
Finger-print Analysis. Supervised by LATIFAH K DARUSMAN and WULAN TRI
WAHYUNI.
AKTIVITAS ANTIJERAWAT FORMULA CAMPURAN
TEMU LAWAK DAN MENIRAN SERTA PENENTUAN
SIDIK JARI KROMATOGRAFINYA
NI LUH PUTU DEBBY PRABANDARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul skripsi : Aktivitas Antijerawat Formula Campuran Temu Lawak dan
Meniran serta Penentuan Sidik Jari Kromatografinya
Nama
: Ni Luh Putu Debby Prabandari
NIM
: G44080007
Disetujui,
Pembimbing I
Pembimbing II
Prof Dr Ir Latifah K. Darusman, MS Wulan Tri Wahyuni, SSi, MSi
NIP 19530824 197603 2 003
Diketahui,
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa karena
atas rahmat dan karunia-Nya penulis dapat menyelesaikan karya ilmiah dengan
judul “Aktivitas Antijerawat Formula Campuran Temu
Lawak dan Meniran serta
Penentuan Sidik Jari Kromatografinya
”. Penelitian ini dilaksanakan dari bula
n
Februari hingga Juni 2012, bertempat di Laboratorium Kimia Analitik,
Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam dan
Laboratorium Pusat Studi Biofarmaka, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Prof Dr Ir Latifah K.
Darusman, MS dan Wulan Tri Wahyuni, SSi, MSi selaku pembimbing yang
senantiasa memberikan arahan, dorongan, masukan, semangat, serta doa selama
penelitian dan penyusunan karya ilmiah ini. Terima kasih kepada Pusat Studi
Biofarmaka (PSB) yang telah melibatkan penulis pada tema penelitian kosmetika
bahan alam. Penulis juga mengucapkan terima kasih kepada laboran
di
Laboratorium Kimia Analitik, juga kepada laboran dan segenap pegawai di PSB
yang telah banyak membantu dalam penelitian ini. Ucapan terima kasih tak
terhingga penulis ucapkan kepada Mama, Bapak, serta adik atas dukungan materi
dan moral. Terima kasih kepada teman-teman terdekat, rekan-rekan di
Laboratorium Kimia Analitik, serta keluarga besar Kimia 45 atas segala dukungan
dan bantuan dalam proses pengerjaan dan penyelesaian karya tulis ini.
Penulis berharap, karya ilmiah ini dapat bermanfaat bagi perkembangan
ilmu pengetahuan.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan di Negara, Provinsi Bali pada tanggal 1 Desember 1990
dari pasangan I Gede Nyoman Sumertika dan Ni Ketut Minarni. Penulis
merupakan anak pertama dari dua bersaudara.
Penulis lulus dari SMAN 1 Negara pada tahun 2008 dan pada tahun yang
sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur
Undangan Seleksi Masuk IPB dan diterima di Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 1
Temu lawak (Curcuma xanthorriza Roxb.) ... 1
Meniran (Phyllanthus niruri) ... 2
Ekstraksi dan Formulasi ... 2
Jerawat (Acne vulgaris) ... 3
Staphylococcus epidermidis dan Antibakteri ... 3
Radikal Bebas dan Antioksidan ... 4
Analisis Sidik Jari dengan Kromatografi ... 4
BAHAN DAN METODE ... 5
Alat dan Bahan ... 5
Metode ... 6
HASIL DAN PEMBAHASAN ... 8
SIMPULAN DAN SARAN ... 15
Simpulan ... 15
Saran ... 15
DAFTAR PUSTAKA ... 15
DAFTAR TABEL
Halaman
1 Formula campuran yang digunakan dalam percobaan ... 6
2 Komposisi fase gerak dengan SCD ... 8
3 Fitokimia ekstrak temu lawak, meniran dan campurannya ... 9
4 Nilai IC
50(ppm) formula uji ... 10
5 Aktivitas antibakteri formula uji ... 11
6 Jumlah noda pada elusi fase gerak tunggal untuk formula 6 ... 12
7 Jumlah noda pada elusi formula 6 dengan menggunakan
fase gerak campuran berdasarkan SCD ... 12
DAFTAR GAMBAR
Halaman
1 Rimpang temu lawak (Curcuma xanthorriza Roxb.) ... 2
2 Struktur kimia kurkumin ... 2
3 Daun meniran (Phyllanthus niruri L) ... 2
4 Struktur kimia filantin ... 2
5 Bakteri Staphylococcus epidermidis ... 3
6 Reaksi penangkapan radikal DPPH ... 4
7 Proses kerja kromatografi lapis tipis ... 4
8 Bagian-bagian instrumen KCKT ... 5
9 Titik eksperimen berdasarkan SCD ... 5
10 Rendemen ekstrak temu lawak, meniran, dan formula
campuran dengan teknik TCM ... 9
11 Reaksi penangkapan radikal bebas DPPH
oleh molekul asam askorbat ... 11
12 Profil KLT formula 6 dengan menggunakan fase gerak
campuran berdasarkan SCD pada = 366 nm ... 12
13 Profil KLT dari elusi formula 6 menggunakan fase gerak
klorofom sebanyak 6 kali ulangan pada = 366 nm ... 12
14 Struktur kimia kurkumin, demetoksikurkumin, dan
bis-demetoksikurkumin ... 13
DAFTAR LAMPIRAN
Halaman
1 Bagan alir lingkup kerja penelitian ... 20
2 Kadar air dan abu sampel temu lawak dan meniran ... 21
3 Rendemen ekstrak kasar etanol temu lawak dan meniran ... 22
4 Hasil uji aktivitas antioksidan formula 5 ... 23
5 Hasil uji perbandingan berganda Duncan ... 24
6 Profil KLT elusi formula 6 menggunakan fase gerak tunggal pada
366 nm (a) dan 254 nm (b)... 25
7 Daftar perbandingan komposisi eluen yang telah
digunakan selain SCD ... 26
8 Profil kromatogram dari standar filantin (1), standar kurkumin (2),
standar campuran (3), dan sampel formula 6 (4) ... 27
9 Pola kromatogram sampel dan standar yang dihasilkan dari
hasil analisis metode KCKT ... 28
PENDAHULUAN
Salah satu masalah kulit yang sering melanda remaja adalah jerawat. Jerawat (Acne vulgaris) merupakan penyakit kulit yang umumnya melibatkan peradangan kelenjar
polisebasea. Patogenesis dari jerawat
dipengaruhi oleh banyak faktor, antara lain peningkatan produksi sebum, komedogenesis, dan peradangan (Leyden 2003). Penyakit ini tidak berbahaya, namun dapat menyebabkan berkurangnya kepercayaan diri seseorang (Lachman et al. 1994). Dreno dan Poli (2003) bahkan menyatakan bahwa jerawat adalah gangguan paling umum pada kulit manusia
yang dapat memengaruhi hingga 80%
kehidupan seseorang.
Antijerawat merupakan salah satu
komponen yang dapat mengatasi timbulnya jerawat. Suatu komponen yang bersifat
antijerawat harus mampu menghambat
pertumbuhan bakteri, menghambat aktivitas lipase, dan menghambat stres oksidatif (Katzman & Logan 2007). Salah satu bakteri
penyebab jerawat adalah Staphylococcus
epidermidis. Bakteri tersebut akan memicu terjadinya radang pada kulit (Wasistaatmadja 2002) sehingga jerawat akan menjadi lebih parah. Pengobatan yang lazim dilakukan untuk mengobati penyakit infeksi adalah dengan menggunakan antibiotik. Namun demikian, penggunaan antibiotik yang kurang tepat dan dalam dosis yang cukup tinggi dapat menyebabkan resistensi. Timbulnya resistensi populasi bakteri terhadap berbagai jenis antibiotik menyebabkan banyak masalah dalam pengobatan penyakit infeksi.
Jerawat juga dapat disebabkan oleh kondisi stres oksidatif, yaitu suatu kondisi saat antioksidan di dalam tubuh tidak mampu menetralisasi peningkatan konsentrasi radikal bebas sehingga dapat merusak komponen sel (Chen et al. 1996). Penggunaan antioksidan sintetik mulai dibatasi karena dapat bersifat toksik dan memberikan efek buruk terhadap kesehatan (Chen et al. 1992; Kahl & Kappus
1993; Miyake & Shibamoto 1997).
Penggunaan antibakteri dan antioksidan alami sebagai obat tradisional dapat menjadi solusi kedua permasalahan tersebut. Jenis tumbuhan
yang umum digunakan sebagai obat
tradisional antara lain temu lawak dan meniran.
Temu lawak (Curcuma xanthorriza Roxb.) merupakan tanaman yang memiliki aktivitas sebagai antibakteri, penghambat enzim lipase, dan antioksidan (Batubara et al. 2009). Senyawa aktif dalam temu lawak yang
berperan sebagai antibakteri adalah xantorizol (Hwang et al. 2000), sedangkan kandungan kurkumin pada temu lawak berperan sebagai
antioksidan. Temu lawak juga tidak
menyebabkan iritasi sehingga aman bagi kulit (Tilaar et al. 2008). Tanaman meniran (Phyllanthus niruri L) juga memiliki aktivitas antibakteri. Senyawa aktif yang berperan sebagai antibakteri pada meniran adalah filantin (Murugaiyah & Chan 2007) dan terpenoid (Gunawan et al. 2008).
Kelemahan penggunaan bahan alam
sebagai obat dibandingkan dengan bahan sintetik adalah komponen aktif penyusunnya dipengaruhi oleh beberapa faktor seperti lingkungan tempat tumbuh, pemilihan bibit, umur tumbuhan, dan penanganan pascapanen. Oleh karena itu, analisis sidik jari penting dilakukan untuk kontrol kualitas (autentisitas, identitas, mutu, dan reliabilitas) obat herbal. Metode kromatografi dapat digunakan sebagai alat bantu untuk mengetahui konsistensi kualitas dan stabilitas ekstrak atau produk herbal lewat pengamatan secara visual (kromatogram) dengan membandingkan pola sidik jari sampel dengan sidik jari standar (Rajkumar & Sinha 2010).
Berdasarkan latar belakang di atas, penelitian ini bertujuan memastikan formula campuran temu lawak dan meniran terbaik sebagai antijerawat dengan melakukan uji aktivitas antibakteri dan antioksidan. Analisis sidik jari kromatografi dari komponen aktif formula terbaik antara temu lawak dan meniran juga dilakukan.
TINJAUAN PUSTAKA
Temu Lawak (Curcuma xanthorriza Roxb.)
Temu lawak (C. xanthorriza Roxb.)
merupakan salah satu tumbuhan aromatik asli Indonesia yang umumnya ditemukan di daerah Jawa, Bali, dan Maluku. Temu lawak diklasifikasikan ke dalam kingdom Plantae,
divisi Spermatophyta, subdivisi
Bagian yang digunakan adalah rimpang (Gambar 1).
Gambar 1 Rimpang temu lawak (C.
xanthorriza Roxb.).
Rukmana (1995) menyatakan bahwa komponen utama rimpang temu lawak adalah zat kuning (kurkumin), pati, dan minyak atsiri.
Minyak atsiri rimpang temu lawak
mengandung xantorizol dan oleoresin (BPOM 2004). Kandungan kurkumin (Gambar 2) dari ekstrak rimpang temu lawak memiliki berbagai khasiat. Tanaman temu lawak
dipergunakan oleh masyarakat maupun
produsen obat tradisional dan kosmetika dalam menjaga dan meningkatkan kesehatan. Selain sebagai bahan baku industri seperti minuman dan pewarna alami, manfaat lain temu lawak adalah dapat meningkatkan sistem kekebalan tubuh, antibakteri, antidiabetes, antihepatotoksik, antiradang, antioksidan,
antitumor, diuretika, depresan, dan
hipolipodemik (Purnomowati & Yoganingrum 1997; Raharjo & Rostiana 2003).
Gambar 2 Struktur kimia kurkumin. Meniran (Phyllanthus niruri L.) Meniran merupakan tumbuhan liar yang berasal dari Asia Tropik dan tersebar di seluruh Asia, termasuk Indonesia (Kardinan & Kusuma 2004). Meniran (Gambar 3) memiliki batang berbentuk bulat, basah, dan tingginya kurang dari 50 cm. Daun bersirip genap dan setiap satu tangkai daun terdiri atas daun majemuk yang berukuran kecil dan berbentuk lonjong (Yuniarti 2008). Senyawa yang terkandung dalam meniran antara lain lignin, terpena, flavonoid, lipid, alkaloid, steroid, tanin, serta vitamin C dan K (Kardinan & Kusuma 2004). Murugaiyah & Chan (2007) menyatakan bahwa meniran mengandung senyawa aktif antara lain filantin, hipofilantin,
filtetralin, dan niranrin. Struktur kimia filantin dapat dilihat pada Gambar 4.
Gambar 3 Daun meniran (Phyllanthus niruri L).
Meniran memiliki aktivitas sebagai
antibakteri, terutama untuk Staphylococcus aureus, Salmonella thypi, dan Escherichia coli (Gunawan et al. 2008; Sumathi & Paravathi 2010) dan sebagai antioksidan (Harish & Shivanandappa 2006). Aktivitas antibakteri yang dimiliki meniran dapat diteliti lebih lanjut sebagai antijerawat sebab jerawat umumnya disebabkan oleh infeksi bakteri Propionibacterium acnes dan S. epidermidis. Bakteri S. epidermidis tergolong satu genus
dengan S. aureus. Aktivitas sebagai
antioksidan juga berfungsi mengurangi
oksidasi pada jerawat (Katzman & Logan 2007).
Gambar 4 Struktur kimia filantin. Ekstraksi dan Formulasi
Ekstraksi atau penyarian merupakan
peristiwa perpindahan massa zat dari dalam bahan oleh cairan penyari sehingga zat-zat aktif larut dalam cairan penyari. Prinsip ekstraksi mengikuti prinsip kelarutan, yaitu
1 cm
pelarut polar melarutkan senyawa polar,
sedangkan pelarut nonpolar melarutkan
senyawa nonpolar (Harborne 1987). Hal-hal yang perlu diperhatikan dalam pemilihan
pelarut adalah selektivitas, kemampuan
mengekstraksi, toksisitas, kemudahan untuk diuapkan, dan harga. Pada penelitian ini digunakan metode ekstraksi maserasi. Metode ini digunakan untuk mengekstraksi komponen kimia yang tidak tahan panas dengan
menggunakan peralatan sederhana.
Kekurangan teknik ini ialah banyak
menggunakan pelarut pengekstrak dan
membutuhkan waktu ekstraksi yang relatif lama (Zahid & Gray 2006).
Formulasi campuran dibuat dengan 2 cara ekstraksi, cara Indonesia dan cara traditional chinese medicine (TCM). Pada cara Indonesia, formula campuran dibuat dengan melakukan ekstraksi dari sampel tunggal, kemudian ekstrak yang diperoleh dicampur dengan
berbagai formulasi untuk menghasilkan
campuran yang diinginkan. Sementara cara
TCM merupakan konsep pengobatan
tradisional dari Cina yang mencampurkan
semua simplisia tumbuhan obat yang
digunakan, baru kemudian diekstraksi hingga menghasilkan ramuan obat tertentu. Teknik tersebut kemudian diadaptasi menjadi sebuah teknik ekstraksi komponen aktif tumbuhan.
Jerawat (Acne vulgaris)
Jerawat adalah penyakit kulit akibat peradangan menahun folikel polisebasea (kelenjar sebasea atau kelenjar minyak) yang ditandai dengan adanya erupsi komedo, papul, pustul, nodus, dan kista (Rosyad 2009). Jerawat disebabkan oleh kondisi abnormal kulit akibat produksi berlebihan minyak kulit (sebum) oleh kelenjar minyak sehingga menyumbat saluran folikel rambut dan pori-pori kulit (Harmanto 2006). Jerawat tidak hanya menyerang wajah, tetapi dapat juga menyerang punggung, dada, dan lengan atas.
Terjadinya jerawat dipengaruhi oleh
mikroorganisme seperti P. acne, S.
epidermidis atau Pityrosporum ovale, dan S. aureus (Rosyad 2009). Sistem pertahanan tubuh dengan antioksidan yang lemah dapat
pula menyebabkan timbulnya jerawat.
Senyawa antioksidan tersebut berfungsi
mengatasi faktor stres oksidatif pada penderita jerawat (Katzman & Logan 2007). Stres oksidatif merupakan keadaan saat mekanisme antioksidan tidak cukup untuk memecah spesi oksigen reaktif (Halliwel et al. 1995).
Produksi minyak yang berlebih oleh kelenjar minyak akan menyebabkan pori-pori
banyak menimbun kotoran dan juga
mengandung bakteri. Kondisi tersebut akan menimbulkan radang. Asam lemak dan minyak kulit tersumbat dan mengeras. Jika jerawat disentuh, peradangan akan meluas sehingga padatan asam lemak dan minyak kulit yang mengeras akan semakin membesar (Brook et al. 2005). Potensi antijerawat dapat dilihat dari aktivitas sebagai antibakteri, penghambat aktivitas lipase, dan antioksidan (Batubara et al. 2009).
Beberapa bahan telah digunakan sebagai obat antijerawat seperti belerang yang memiliki sifat antijamur, benzoil peroksida yang bersifat antibakteri, dan zink yang dapat mengurangi peradangan jerawat (Abbasi et al. 2010). Namun, penggunaan bahan yang sifatnya tidak alami tersebut dikhawatirkan dapat menyebabkan racun bagi tubuh.
Staphylococcus epidermidis dan Antibakteri
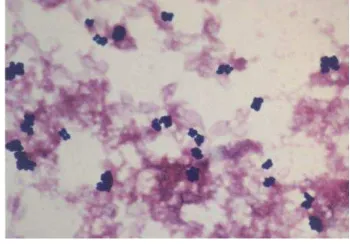
S. epidermidis (Gambar 5) diketahui dapat menyebabkan infeksi oportunistik (menyerang individu dengan sistem kekebalan tubuh yang lemah) (Lindsay 2008). Beberapa karakteristik bakteri ini adalah fakultatif, koagulase negatif,
Gram positif, berbentuk kokus, dan
berdiameter 0.5-1.5 µm (Shimeld & Rodgers 1998). Bakteri ini secara alami hidup pada kulit dan membran mukosa manusia (Lindsay 2008). Infeksi bakteri S. epidermidis dapat menyebabkan kerusakan pada kulit, seperti
terbentuknya jerawat atau luka pada
permukaan kulit (Burkhart et al.1999).
Gambar 5 Bakteri S. epidermidis (Nilsson et al. 1998).
Antibakteri adalah zat yang dapat
mengganggu pertumbuhan atau bahkan
mematikan bakteri dengan cara mengganggu
metabolisme mikrob yang merugikan
bakterilitik (Pelczar & Chan 1986).
Pengukuran aktivitas antibakteri dapat
dilakukan dengan metode difusi dan metode pengenceran (British Pharmacopeia 1993). Metode pengenceran atau dilusi dilakukan dengan membuat pengenceran antibakteri pada media cair yang ditambahkan bakteri uji. Aktivitas antibakteri dapat ditentukan dari nilai konsentrasi hambat minimum (KHM) dan konsentrasi bunuh minimum (KBM). Semakin rendah nilai KHM dan KBM, semakin baik kerja senyawa tersebut sebagai antibakteri. Faktor-faktor yang memengaruhi aktivitas senyawa antibakteri antara lain pH, suhu stabilitas bakteri tersebut, lamanya inkubasi, dan metabolisme bakteri (Madigan 2005).
Radikal Bebas dan Antioksidan Radikal bebas merupakan molekul yang sangat reaktif karena mempunyai satu atau lebih elektron yang tidak berpasangan (Masuda et al. 1992). Radikal bebas dalam jumlah berlebih di dalam tubuh sangat berbahaya karena menyebabkan kerusakan sel, asam nukleat, protein, dan jaringan lemak. Reaksi radikal bebas yang berlangsung-terus
menerus dapat menimbulkan berbagai
penyakit kulit seperti jerawat yang bila dibiarkan dapat berkembang menjadi kanker kulit (Ng et al. 2000; Pourmorad et al. 2006).
Oleh karena itu, tubuh memerlukan
antioksidan yang mampu menangkal radikal
bebas tersebut sehingga tidak dapat
menginduksi penyakit (Jitoe et al. 1992). Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau lebih elektron kepada radikal bebas sehingga radikal bebas tersebut dapat dihambat. Komponen kimia yang berperan sebagai antioksidan adalah senyawa golongan fenolik dan polifenolik. Senyawa golongan tersebut banyak terdapat di alam, terutama pada
tumbuhan dan memiliki kemampuan
menangkap radikal bebas (Shahidi & Naczk 1995).
Salah satu metode yang digunakan untuk pengujian aktivitas antioksidan adalah metode
2,2-difenil-1-pikrilhidrazil (DPPH).
Prinsipnya adalah reaksi penangkapan
hidrogen dari senyawa antioksidan oleh radikal bebas DPPH yang mengubahnya menjadi 2,2-difenil-1-pikrilhidrazina (Gambar 6). Kontrol positif yang dapat digunakan berupa vitamin C, kuersetin, tokoferol, dan butil hidroksi toluena (BHT) (Rahman et al.
2008). Aktivitas antioksidan dinyatakan
dengan nilai IC50, yaitu konsentrasi ekstrak
yang dibutuhkan untuk menurunkan
konsentrasi DPPH sebesar 50% (Blois 1958).
2,2-Difenil-1-pikrilhidrazil 2,2-Difenil-1-pikrilhidrazina
Gambar 6 Reaksi penangkapan radikal DPPH (Yamaguchi et al. 1998).
Analisis Sidik Jari dengan Kromatografi
Kromatografi adalah pemisahan
komponen-komponen secara fisik melalui pendistribusian di antara 2 fase (Day & Underwood 2002). Analisis sidik jari dapat dimanfaatkan untuk evaluasi dan kontrol kualitas multikomponen tanaman obat (Liang et al. 2004). Analisis ini memberikan informasi komponen kimia dalam bentuk spektrum, kromatogram, dan grafik lainnya yang diperoleh dari teknik analitik yang menentukan identitas, kualitas, dan keaslian tanaman obat (Borges et al. 2007). Analisis
sidik jari dapat dilakukan dengan
menggunakan kromatografi lapis tipis (KLT) dan kromatografi cair kinerja tinggi (KCKT). Kromatografi Lapis Tipis
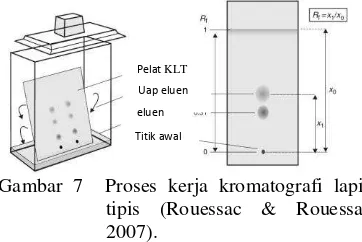
Kromatografi lapis tipis memisahkan campuran komponen berdasarkan distribusi di antara fase diam dan fase gerak. Pemisahan dilakukan pada lapisan tipis fase stasioner, umumnya pada silika gel yang ditempatkan pada pelat kaca, plastik, atau aluminium
dengan ukuran 11 m. Untuk mempertahankan
fase diam dan untuk menjamin kohesi partikel, pengikat lembam seperti gipsum (atau pengikat organik) dicampur ke dalam fase diam selama pembuatan pelat tipis (Rouessac & Rouessac 2007). Proses kerja KLT dapat dilihat pada Gambar 7.
Gambar 7 Proses kerja kromatografi lapis tipis (Rouessac & Rouessac 2007).
(antioksidan)
Pelat KLT
Uap eluen
eluen
Pergerakan zat relatif terhadap garis depan pelarut dalam sistem KLT didefinisikan sebagai nilai retention faktor (Rf). Rf merupakan nisbah jarak tempuh zat dengan jarak tempuh garis depan pelarut. KLT
memiliki banyak keuntungan dalam
menganalisis tanaman herbal, antara lain mudah, cepat, preparasinya tidak rumit, dan dapat digunakan untuk menganalisis berbagai macam sampel (Funk & Droeschel 1991). Kromatografi Cair Kinerja Tinggi
Kromatografi cair kinerja tinggi termasuk yang paling sering digunakan dalam teknik analisis, menggunakan cairan sebagai fase
gerak untuk memisahkan komponen
campuran. Fase diam dapat berbentuk cair atau padat. Komponen dilarutkan kemudian dipaksa untuk mengalir melalui kolom kromatografi di bawah tekanan tinggi. Di dalam kolom campuran dipisahkan ke dalam
komponen-komponennya (Rouessac &
Rouessac 2007). Bagian-bagian instrumen
KCKT dapat dilihat pada Gambar 8.
Gambar 8 Bagian-bagian instrumen KCKT (Harvey 2000).
Elusi dapat dilakukan dengan cara isokratik (komposisi fase gerak tetap selama elusi) atau gradien (komposisi fase gerak berubah-ubah selama elusi) yang analog dengan pemrograman suhu pada kromatografi
gas. Elusi gradien digunakan untuk
meningkatkan resolusi campuran yang
kompleks terutama jika sampel mempunyai kisaran polaritas yang luas (Kenkel 2002). Daya elusi dan resolusi ini ditentukan oleh polaritas keseluruhan pelarut, polaritas fase diam, dan sifat komponen-komponen sampel. Untuk fase normal (fase diam lebih polar daripada fase gerak), kemampuan elusi meningkat dengan meningkatnya polaritas pelarut. Sementara untuk fase terbalik (fase diam kurang polar daripada fase gerak),
kemampuan elusi menurun dengan
meningkatnya polaritas pelarut.
Desain Campuran (Simplex Centroid
Design)
Desain campuran digunakan pada
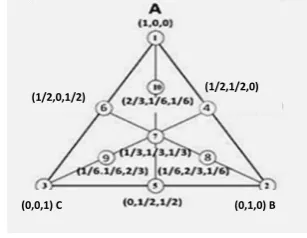
percobaan dengan beberapa parameter. Pada penelitian ini, desain campuran digunakan dalam penentuan eluen terbaik. Desain campuran terdiri atas simplex lattice, simplex centroid, dan extreme vertices. Simplex centroid design (SCD) diperkenalkan untuk memberikan ulasan percobaan dari respons permukaan di bagian pusat bidang. Salah satu cara pemodelan SCD (Gambar 9) adalah dengan mempertimbangkan struktur dari percobaan 3 faktor. Rancangan 3 komponen dapat digambarkan dengan segi tiga sama sisi dalam 2 dimensi (Soares et al. 2007).
Gambar 9 Titik eksperimen berdasarkan SCD (Borges et al. 2007).
BAHAN DAN METODE
Alat dan Bahan
Peralatan yang digunakan adalah neraca analitik, eksikator, tanur, pembakar bunsen, penguap putar, bejana KLT, cawan porselen, oven, inkubator, microplate reader, autoklaf, 96-well-plates, mikropipet, sentrifus, Camag Linomat 5, Camag Reprostar 3, dan KCKT Shimadzu.
Bahan yang digunakan adalah rimpang temu lawak (C. xanthorriza Roxb.) dan tanaman meniran (P. niruri L.) yang berasal dari kebun Biofarmaka, bakteri S. epidermidis yang berasal dari koleksi laboratorium Fakultas Kedokteran Universitas Indonesia, media trypticase soy broth (TSB), standar kurkumin, standar filantin, etanol, metanol, n -heksana, kloroform, etil asetat, dietil eter, diklorometana, asam asetat, HCl, amil alkohol, serbuk Mg, H2SO4, NaOH, FeCl3 1%, anhidrida asetat, pereaksi Mayer, Wagner,
(0,0,1) C (0,1,0) B
Dragendorf, dimetil sulfoksida (DMSO),
DPPH, vitamin C (asam askorbat),
klindamisin, dan silika gel G60F254 dari Merck.
Metode
Metode penelitian yang dilakukan meliputi penentuan kadar air dan abu, ekstraksi sampel menggunakan metode maserasi dengan teknik Indonesia dan teknik TCM, serta uji fitokimia ekstrak temu lawak, meniran, dan campuran keduanya. Formula yang diperoleh diuji in vitro yang terdiri atas uji antibakteri dan uji antioksidan. Analisis sidik jari kromatografi dari formula terbaik dilakukan dengan kromatografi lapis tipis dan kromatografi cair kinerja tinggi (Lampiran 1).
Preparasi Sampel
Sampel rimpang temu lawak dan daun meniran dibersihkan kemudian diiris tipis dan dikeringkan. Setelah kering, sampel digiling hingga menjadi serbuk dengan ukuran 40 mesh. Sampel siap digunakan untuk analisis selanjutnya.
Penentuan Kadar Air (AOAC 2007) Cawan porselen dikeringkan pada suhu 105 °C selama 30 menit lalu didinginkan dalam eksikator dan ditimbang. Sebanyak 2 g
contoh dimasukkan dalam cawan dan
dipanaskan pada suhu 105 °C selama 5 jam, kemudian didinginkan dalam eksikator dan ditimbang. Proses ini dilakukan sampai diperoleh bobot konstan. Penentuan kadar air ini dilakukan berdasarkan bobot kering contoh dan dilakukan sebanyak 3 kali ulangan (triplo).
Kadar air (%) = 100%
A B A
Keterangan:
A = bobot contoh sebelum dikeringkan (g) B = bobot contoh setelah dikeringkan (g) Penentuan Kadar Abu (AOAC 2007)
Cawan porselen dikeringkan di dalam tanur listrik bersuhu 600 °C selama 30 menit.
Selanjutnya cawan didinginkan dalam
eksikator selama 30 menit dan ditimbang bobot kosongnya. Sebanyak 2 g contoh dimasukkan ke dalam cawan, kemudian dipijarkan di atas nyala api pembakar bunsen sampai tidak berasap lagi. Setelah itu, dimasukkan ke dalam tanur listrik dengan suhu 600 °C selama 2 jam. Setelah abu berwarna putih, cawan berisi abu diangkat dari dalam tanur, didinginkan dalam eksikator,
lalu ditimbang. Penentuan kadar abu
dilakukan sebanyak 3 kali ulangan (triplo).
Kadar abu (%) = × 100%
Keterangan:
A = bobot contoh (g) B = bobot abu (g) Ekstraksi
Pada cara Indonesia, simplisia temu lawak (formula 1) dan meniran (formula 2) masing-masing dimaserasi, kemudian kedua ekstrak
yang diperoleh dicampurkan dengan
komposisi tertentu (formula 3 dan 4). Pada cara TCM, kedua simplisia contoh dicampur dengan nisbah tertentu kemudian dimaserasi (formula 5 dan 6). Formula yang digunakan dapat dilihat pada Tabel 1.
Tabel 1 Formula campuran yang digunakan dalam percobaan
Formula Komposisi (b/b/b)
Temu lawak Meniran Pati
F1 1 0 0
F2 0 1 0
F3 1/2 1/2 0
F4 2/3 1/6 1/6
F5 1/2 1/2 0
F6 2/3 1/6 1/6
Proses ekstraksi dilakukan dengan
mencampurkan 50 g sampel yang sudah dikeringkan dan dihaluskan dengan 250 mL etanol 96%. Campuran dimaserasi secara
dinamik selama 6 jam dan secara
statik/didiamkan hingga 24 jam. Maserasi dilakukan 3 kali ulangan. Selanjutnya filtrat dikumpulkan dan dipekatkan dengan penguap putar.
Uji Fitokimia (Harborne 1987)
Uji Flavonoid dan Saponin. Sebanyak
0.1 g ekstrak ditambahkan 10 mL air panas kemudian disaring. Sebanyak 10 mL filtrat ditambahkan 0.5 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat-kuat. Uji positif terhadap flavonoid ditandai dengan munculnya warna merah, kuning, atau jingga pada lapisan amil alkohol. Sebanyak 10 mL filtrat dikocok selama 10 menit dengan keadaan tertutup. Jika terbentuk buih yang stabil, berarti ekstrak mengandung saponin.
Uji Alkaloid. Sejumlah 1 g ekstrak
ditambah dengan 10 mL CHCl3 dan beberapa
ditambahkan dengan pereaksi Mayer (positif jika terbentuk endapan putih), pereaksi Wagner (positif jika terbentuk endapan cokelat), dan pereaksi Dragendorf (positif jika terbentuk endapan merah jingga).
Uji Tanin. Sebanyak 10 mL ekstrak
dipanaskan selama 10 menit. Selanjutnya campuran tersebut disaring dan filtratnya ditambahkan dengan FeCl3 1%. Jika terbentuk warna biru tua atau hijau, berarti ekstrak mengandung tanin.
Uji Steroid dan Terpenoid. Sampel
diekstraksi dengan 10 mL etanol panas, disaring, dan diuapkan hingga kering. Residu yang dihasilkan dilarutkan dalam eter, lalu ditambahkan 1 tetes H2SO4 serta 3 tetes anhidrida asetat. Jika terbentuk warna biru atau hijau, berarti ekstrak positif mengandung steroid. Jika terbentuk warna ungu, berarti ekstrak positif mengandung terpenoid. Uji Aktivitas Antibakteri (Batubara et al.
2009)
Bakteri yang digunakan adalah S.
epidermidis dengan media TSB. Sebanyak 100 µL media steril, 40 µL sampel dilarutkan dalam DMSO 20 % atau kontrol dan 5 µL inokulum bakteri dimasukkan ke dalam setiap sumur pada 96-well plate. Inokulum telah disiapkan pada konsentrasi 10-2 CFU/mL. S. epidermidis diinkubasi dalam media selama 48 jam pada suhu 37 °C. Konsentrasi ekstrak yang tidak menunjukkan pertumbuhan bakteri (bening) secara visual dideskripsikan sebagai konsentrasi hambat minimum (KHM).
Sebanyak 100 µL dari media yang tidak
menunjukkan pertumbuhan bakteri
diinokulasikan pada 100 µL media baru, kemudian diinkubasi selama 48 jam pada suhu 37 °C. Konsentrasi yang tidak menunjukkan pertumbuhan bakteri setelah inokulasi kedua dideskripsikan sebagai konsentrasi bunuh minimum (KBM). Kontrol negatif yang
digunakan adalah DMSO dan kontrol
positifnya adalah klindamisin.
Uji Aktivitas Antioksidan (Salazar-Aranda
et al. 2009)
Ekstrak pekat dibuat larutan dengan konsentrasi berkisar 0.1–1000 µg/mL dalam etanol dari larutan stok 1 mg/mL. Sebanyak 100 µL larutan DPPH 125 µM dalam etanol dicampurkan dengan 100 µL larutan ekstrak sehingga volume total menjadi 200 µL. Campuran dikocok dan diinkubasi pada suhu 37 °C dalam gelap selama 30 menit. Serapan kemudian diukur pada panjang gelombang
517 nm. Vitamin C digunakan sebagai kontrol positif.
Kapasitas penangkapan radikal DPPH dihitung menurut Batubara et al. (2009) dengan rumus
Aktivitas penghambatan (%) = [1 – (As– Ak)/(Ab– Akl)] × 100% Keterangan:
As = Absorbans sampel Ak = Absorbans kontrol Ab = Absorbans blangko
Absorbans blangko adalah absorbans
DPPH dalam etanol sebagai blangko,
Absorbans sampel adalah absorbans DPPH yang ditambah sampel uji, dan A kontrol adalah absorbans DPPH yang ditambah
vitamin C sebagai kontrol. Aktivitas
penangkapan radikal pada setiap konsentrasi dialurkan dan nilai IC50 dihitung.
Analisis Sidik Jari Formula Antijerawat dengan KLT
Pemilihan Fase Gerak Terbaik.
Sebanyak 7 macam fase gerak tunggal diujikan, yaitu n-heksana, dietil eter, metanol, aseton, diklorometana, etil asetat, dan kloroform. Pelat KLT silika gel yang telah ditotolkan ekstrak dimasukkan ke dalam bejana kromatografi yang telah dijenuhkan
oleh fase gerak tunggal. Setelah
pengembangan dilakukan, pelat diangkat dan
dikeringkan. Deteksi dan dokumentasi
komponen dilakukan di bawah lampu UV menggunakan Camag Reprostar 3 pada panjang gelombang 254 dan 366 nm untuk melihat jumlah noda yang muncul pada pelat. Tiga fase gerak terbaik dipilih, yaitu fase gerak yang memberikan noda terbanyak dan terpisah sempurna satu sama lain.
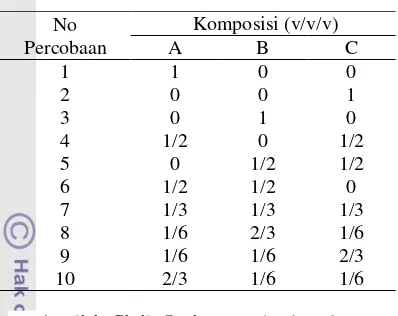
Tabel 2 Komposisi fase gerak dengan SCD No
Percobaan
Komposisi (v/v/v)
A B C
1 1 0 0
2 0 0 1
3 0 1 0
4 1/2 0 1/2
5 0 1/2 1/2
6 1/2 1/2 0
7 1/3 1/3 1/3
8 1/6 2/3 1/6
9 1/6 1/6 2/3
10 2/3 1/6 1/6
Analisis Sidik Jari. Formula ekstrak yang memiliki aktivitas terbaik diaplikasikan pada pelat KLT dengan KLT aplikator (Camag Linomat 5). Setelah kering, pelat KLT tersebut langsung dielusi dalam bejana kromatografi yang telah dijenuhkan oleh uap eluen pengembang. Hasil elusi diamati pada panjang gelombang 254 dan 366 nm sehingga diperoleh sidik jari kromatogram terbaik. Proses elusi dilakukan sebanyak 6 kali ulangan untuk melihat konsistensi pemisahan.
Standar kurkumin, filantin, campuran, dan sampel kemudian diaplikasikan pada 1 pelat dan dielusi bersama menggunakan eluen terbaik. Hasil elusi diamati pada panjang
gelombang 254 dan 366 nm. Pola
kromatogram dari masing-masing standar kemudian dibandingkan dengan sampel. Analisis Sidik Jari Formula Antijerawat dengan KCKT
Sebanyak 100 mg formula yang memiliki aktivitas terbaik dilarutkan dengan 50 mL metanol dan disaring menggunakan syringe dengan filter berpori ukuran 0.45 m. Selanjutnya sampel diinjeksikan ke dalam KCKT (Shimadzu) dengan volume injeksi 10 µL. Masing-masing standar, yaitu kurkumin, filantin dan campuran juga diinjeksikan. Laju alir diatur sebesar 1 mL/menit. Digunakan KCKT fase terbalik dengan kolom C18 dan fase gerak asetonitril:air yang dielusikan secara gradien selama 90 menit pada panjang gelombang 220 nm sehingga diperoleh sidik jari KCKT terbaik. Detektor yang digunakan adalah detektor rangkaian diode.
HASIL DAN PEMBAHASAN
Preparasi Sampel
Sampel temu lawak (Curcuma xanthorriza
Roxb.) dan daun meniran (Phyllanthus niruri
L.) dari kebun Biofarmaka, diiris tipis,
dikeringkan, kemudian digiling hingga
berukuran 40 mesh. Pengirisan berfungsi mempercepat proses pengeringan sampel,
sedangkan penggilingan berfungsi
memperkecil ukuran sampel agar semakin
banyak komponen aktif yang dapat
terekstraksi. Semakin kecil ukuran sampel,
semakin luas permukaan sampel yang
bertumbukan dengan pelarut sehingga
memudahkan senyawa aktif terekstraksi.
Ekstraksi bahan alam umumnya
menggunakan sampel berukuran 40– 60 mesh. Jika ukuran sampel terlalu kecil, maka dikhawatirkan proses pemisahan filtrat dengan endapan akan sulit dilakukan. Partikel yang terlalu kecil dapat menyumbat pori-pori kertas saring sehingga proses penyaringan menjadi terhambat.
Penentuan Kadar Air dan Abu Kadar air sampel rimpang temu lawak dan daun meniran digunakan sebagai faktor
koreksi dalam menentukan rendemen
sebenarnya dari proses ekstraksi. Penentuan kadar air juga berfungsi untuk memperkirakan cara penyimpanan terbaik dari setiap sampel. Simplisia tanaman dikeringkan di bawah suhu 50 °C hingga kandungan airnya kurang dari 10%, kemudian digiling dan ditentukan kadar
airnya menggunakan metode gravimetri
taklangsung pada suhu 105 °C. Kadar air dari sampel rimpang temu lawak diperoleh sebesar 9.00% sedangkan daun meniran 7.60% (Lampiran 2). Hasil tersebut masih berada di bawah persyaratan maksimum kadar air untuk bahan baku obat tradisional yaitu, 10% (SK Menkes RI No 661/IMENKES/SK/VII/1994). Pengeringan akan menguapkan air dalam sampel sehingga menghambat pertumbuhan mikrob dan memperpanjang masa simpan sampel. Wadah penyimpanan sampel juga
harus kering dan tidak lembap agar
pertumbuhan mikrob dapat dihambat.
Penentuan kadar abu sampel berfungsi untuk memperkirakan kandungan mineral dalam sampel. Umumnya penentuan kadar
abu digunakan sebagai langkah awal
penentuan kadar logam menggunakan teknik
spektroskopi atom. Hasil penelitian
7.74% (Lampiran 2). Kadar abu yang diperoleh memenuhi standar DepKes RI yang tercantum dalam Materia Medika Indonesia. DepKes (1978) menyatakan bahwa kadar abu pada herba meniran tidak lebih dari 8.3%. Kadar abu rimpang temu lawak tidak lebih dari 4.4% menurut DepKes (1979).
Ekstraksi
Metode ekstraksi maserasi digunakan
dalam penelitian ini digunakan untuk
memecah dinding sel sampel sehingga komponen aktif yang diharapkan dapat terekstraksi dengan optimum.
Pelarut yang digunakan dalam penelitian adalah etanol 96%. Etanol dipilih karena memiliki kepolaran yang mirip dengan senyawa aktif pada temu lawak seperti kurkumin serta senyawaan lignan pada meniran. Kurkumin tidak dapat larut dalam air, tetapi dapat larut dalam etanol (Joe et al. 2004; Chattopadhyay et al. 2004). Kemiripan polaritas diharapkan dapat mengoptimumkan proses ekstraksi komponen aktif dari setiap sampel. Batubara et al. (2009) menyatakan, ektrak etanol temu lawak memiliki aktivitas antibakteri yang lebih baik dari ekstrak metanolnya. Selain itu, menurut Darusman et al. (2001), etanol adalah pelarut yang umum digunakan dalam pembuatan jamu dan obat-obatan fitofarmaka.
Ekstraksi dilakukan selama 3 kali 24 jam untuk 4 buah formula, yaitu formula 1, 2, 5, dan 6. Formula 1 berisi sampel tunggal temu lawak, formula 2 berisi sampel tunggal meniran, formula 5 merupakan campuran temu lawak:meniran (1:1) sedangkan formula 6 merupakan campuran temu lawak:meniran (2/3:1/6). Formula 5 dan 6 diperoleh dengan metode ekstrasi TCM, maka simplisia sampel
sudah digabung sejak awal ekstraksi.
Rendemen hasil ekstraksi keempat formula terhadap bentuk simplisianya diberikan pada Lampiran 3, grafiknya diperlihatkan pada Gambar 10. Semakin tinggi rendemen, semakin banyak komponen dalam sampel yang memiliki kemiripan kepolaran dengan pelarut yang digunakan. Rendemen tertinggi diperoleh pada ekstraksi rimapang temu
lawak, yaitu hampir mencapai 14%,
sedangkan rendemen terendah diperoleh pada sampel daun meniran sebesar 7.83%.
Gambar 10 Rendemen ekstrak temu lawak, meniran, dan formula campuran dengan cara TCM.
Uji Fitokimia
Uji fitokimia bertujuan menentukan
golongan senyawa metabolit sekunder yang terkandung di dalam ekstrak contoh. Hasil uji pendahuluan ini dapat digunakan sebagai dasar pendugaan golongan senyawa yang memiliki aktivitas sebagai antibakteri dan antioksidan.
Uji fitokimia ekstrak temu lawak
menunjukkan kandungan flavonoid, alkaloid, steroid, dan terpenoid. Hasil ini sesuai dengan yang dilaporkan Nur (2006). Sementara ekstrak daun meniran didapati mengandung flavonoid, alkaloid, tanin, dan steroid. Tidak ditemukan adanya terpenoid sebagaimana
yang dilaporkan oleh Puspita (2009).
Perbedaan hasil uji fitokimia ini dapat disebabkan keberadaan terpenoid dalam ekstrak daun meniran jumlahnya sedikit sehingga sulit dideteksi secara visual.
Jika hasil uji fitokimia kedua ekstrak digabungkan, maka campuran keduanya akan
mengandung flavonoid, alkaloid, tanin,
steroid, dan terpenoid. Hal tersebut sesuai dengan hasil uji fitokimia pada ekstrak campuran kedua sampel (Tabel 3).
Tabel 3 Fitokimia ekstrak temu lawak, meniran, dan campurannya Uji
Fitokimia
Hasil uji Temu
lawak Meniran Campuran
Flavonoid +++ +++ +++
Saponin - - -
Alkaloid + + ++
Tanin - +++ +++
Steroid + ++ +
Terpenoid +++ - ++
Ket: (-): negatif (+): positif dengan intensitasnya. 0 2 4 6 8 10 12 14
13.81 12.88
7.83
Aktivitas Antioksidan
Penentuan aktivitas antioksidan dilakukan
dengan metode DPPH (2,2
difenil-1-pikrilhidrazil). Metode ini dipilih karena mudah, cepat, dan sensitif untuk pengujian
aktivitas antioksidan senyawa tertentu
(Koleva et al. 2001). DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna ungu gelap. Penangkapan radikal bebas menyebabkan elektron menjadi
berpasangan yang akan berkurangnya
intensitas atau hilangnya warna sebanding dengan jumlah elektron yang diambil (Sunarni 2005). Warna berubah dari ungu menjadi kekuningan diikuti dengan penurunan serapan. Dari penurunan serapan tersebut, aktivitas penangkapan radikal bebas dapat ditentukan.
Aktivitas antioksidan dinyatakan dengan nilai IC50, yaitu konsentrasi ekstrak yang dibutuhkan untuk menurunkan konsentrasi DPPH sebesar 50%. Nilai IC50 diperoleh dari
persamaan kurva hubungan konsentrasi
sampel dengan persentase penangkapan
radikal bebas (% inhibisi). Semakin kecil nilai IC50, semakin tinggi aktivitas antioksidannya (Molyneux 2004). Nilai IC50 dari masing-masing formula uji dan standar vitamin C disajikan dalam Tabel 4.
Tabel 4 Nilai IC50 (ppm) formula uji
Formula Nilai IC50
F1 95.32±4.66d
F2 56.70±4.58c
F3 10.08±0.83ab
F4 120.03±0.62e
F5 8.17±0.77a
F6 93.17±0.90d
Vitamin C 3.06±0.29
Sampel dengan nilai IC50 diikuti huruf yang sama pada Tabel menunjukkan nilai yang tidak berbeda nyata berdasarkan uji perbandingan berganda Duncan pada P = 0.05.
Formula 5 memiliki aktivitas antioksidan tertinggi dengan nilai IC50 sebesar 8.17 ppm. Penentuan nilai IC50 dari formula 5 dapat
dilihat pada Lampiran 4. Formula 5
merupakan campuran temu lawak:meniran (1:1), serupa dengan formula 3. Perbedaan keduanya terletak dari teknik maserasi yang digunakan. Hal yang sama terjadi pada formula 4 dan 6. Komposisi campuran keduanya sama, namun teknik maserasi yang digunakan berbeda. Formula 3 dan 4 menggunakan cara Indonesia, sedangkan formula 5 dan 6 menggunakan cara TCM.
Berdasarkan nilai IC50, cara TCM
memberikan aktivitas antioksidan yang lebih baik dibandingkan dengan cara Indonesia pada komposisi campuran yang sama.
Hasil uji perbandingan berganda Duncan menunjukkan bahwa formula 3 tidak berbeda nyata dengan formula 5 pada taraf nyata 5%, sedangkan formula 4 berbeda nyata dengan formula 6 pada taraf nyata 5% (Lampiran 5). Hal ini mungkin disebabkan meniran (formula 2) memiliki aktivitas antioksidan yang lebih baik daripada temu lawak (formula 1) sehingga pada formula 4 dan 6 yang
komposisi menirannya lebih sedikit,
perubahan teknik maserasi dapat
menghasilkan nilai IC50 yang berbeda secara signifikan.
Aktivitas antioksidan ekstrak meniran yang lebih baik daripada ekstrak temu lawak menyebabkan ketika dicampurkan, formula dengan komposisi meniran lebih banyak memiliki aktivitas antioksidan lebih tinggi. Pati yang ditambahkan pada formula 4 dan 6 hanya berfungsi sebagai bahan pengisi. Amilosa dan amilopektin yang merupakan
kandungan utama pati tidak mampu
menangkap radikal bebas DPPH sehingga pati tidak memiliki aktivitas aktioksidan. Pati merupakan bahan pengisi yang umum, aman, dan mudah digunakan dalam industri makanan dan farmasi.
Keenam formula menunjukkan aktivitas antioksidan yang tinggi karena memiliki nilai IC50 kurang dari 150 ppm (Blois 1958). Hal tersebut dapat disebabkan oleh kandungan flavonoid yang cukup tinggi pada ekstrak temu lawak, meniran, maupun campurannya yang berperan besar sebagai antioksidan (Tabel 3).
Gambar 11 Reaksi penangkapan radikal bebas DPPH oleh molekul
asam askorbat
(Brand-Williams et al. 1995). Aktivitas Antibakteri
Analisis antibakteri dilakukan dengan menggunakan metode dilusi menggunakan microplate. Dalam metode ini, media, inokulum bakteri, dan sampel disatukan di dalam microplate sebagai sumur. Media cair yang digunakan adalah trypticase soy broth (TSB). Media ini mengandung kasein dan pepton kedelai yang menyediakan asam amino
dan sumber nitrogen lainnya bagi
mikroorganisme. Media TSB yang awalnya jernih jika ditambahkan inokulum bakteri akan menjadi keruh. Suatu zat yang bersifat antibakteri akan mampu mengembalikan media yang keruh karena bakteri menjadi jernih kembali. Aktivitas antibakteri tersebut dapat diamati secara visual pada konsentrasi tertentu. Bakteri yang digunakan dalam uji aktivitas antibakteri ini adalah S. epidermidis.
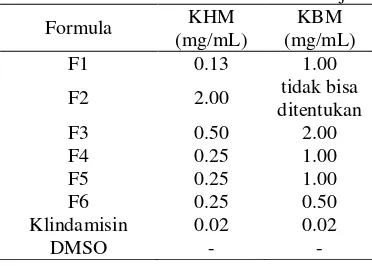
Aktivitas antibakteri ditentukan
berdasarkan nilai konsentrasi hambat
minimum (KHM) dan konsentrasi bunuh minimum (KBM). Nilai KHM dan KBM
berbanding terbalik dengan aktivitas
antibakterinya. Semakin rendah nilai KHM dan KBM, semakin tinggi aktivitas antibakteri dari sampel. Hasil uji aktivitas antibakteri pada Tabel 5 menunjukkan bahwa formula 1 dan 6 teraktif karena memiliki nilai KHM dan KBM paling rendah. Formula 1 memiliki nilai KHM 0.13 mg/mL dan KBM 1.0 mg/mL sedangkan formula 6 memiliki nilai KHM 0.25 mg/mL dan KBM 0.5 mg/mL. Teknik TCM (formula 5 dan 6) memberikan hasil
yang lebih baik dibandingkan teknik
Indonesia (formula 3 dan 4) karena
menghasilkan nilai KHM dan KBM yang lebih rendah pada komposisi campuran yang sama.
Sampel dibandingkan aktivitas
antibakterinya dengan klindamisin sebagai kontrol positif. Klindamisin merupakan obat infeksi serius yang disebabkan oleh bakteri streptokokus, stafilokokus, dan pneumokokus. Penggunaan klindamisin secara terus-menerus sebagai antibakteri dapat mengakibatkan
resistensi. Selain itu, obat sintetik ini dapat menyebabkan efek samping seperti kulit kemerahan jika digunakan secara berlebihan (Sugiarto 2009). Oleh karena itu, formula 1 dan 6 dapat digunakan sebagai alternatif obat antibakteri walaupun nilai KHM dan KBM klindamisin masih lebih rendah.
Tabel 5 Aktivitas antibakteri formula uji
Formula KHM
(mg/mL)
KBM (mg/mL)
F1 0.13 1.00
F2 2.00 tidak bisa
ditentukan
F3 0.50 2.00
F4 0.25 1.00
F5 0.25 1.00
F6 0.25 0.50
Klindamisin 0.02 0.02
DMSO - -
Berdasarkan aktivitas antioksidan dan antibakteri yang tinggi dapat dikatakan bahwa formula 6 (2/3 temu lawak:1/6 meniran:1/6 pati) memiliki aktivitas antijerawat yang paling baik. Formula 5 juga dapat dikatakan memiliki aktivitas antijerawat walaupun aktivitas antibakterinya tidak sebaik formula 6, sebab formula 5 memiliki aktivitas antioksidan yang paling tinggi. Aktivitas antibakteri formula 1 cukup baik yang ditunjukkan dengan nilai KHM yang paling rendah, namun nilai KBM formula 6 lebih rendah dibandingkan formula 1. Formula 6
dipilih karena bakteri S. epidermidis
merupakan bakteri yang harus dibunuh agar tidak dapat menginduksi terjadinya jerawat.
Wulandari (2011) menyatakan bahwa formula campuran 1/2 temu lawak dan 1/2 meniran merupakan formula antijerawat teraktif. Hasil tersebut berbeda dari hasil penelitian yang diperoleh. Hal ini disebabkan karena perbedaan cara maserasi menyebabkan perbedaan hasil yang diperoleh.
Analisis Sidik Jari menggunakan KLT Silika gel yang dilapiskan pada logam digunakan sebagai fase diam KLT dan pelarut
atau campuran pelarut dalam bejana
pengembang sebagai fase geraknya. Formula yang dianalisis sidik jari adalah formula dengan aktivitas antijerawat terbaik, yaitu formula 6. Analisis sidik jari dengan KLT diawali dengan melakukan penentuan fase
gerak terbaik sehingga diperoleh pola
kromatografi yang baik. Asam askorbat Semi-dehidra
asam askorbat
Penentuan Fase Gerak Terbaik
Tujuh jenis pelarut tunggal digunakan sebagai fase gerak, yaitu n-heksana, aseton, diklorometana, dietil eter, kloroform, etil asetat, dan metanol. Hasil pemisahan KLT ketujuh fase gerak tunggal dapat dilihat pada Lampiran 6; jumlah noda yang didapat ditunjukkan pada Tabel 6.
Tabel 6 Jumlah noda pada elusi formula 6 dengan fase gerak tunggal
Fase Gerak Jumlah
noda
n-heksana 1
Aseton 3
Diklorometana 6
Dietil eter 8
Kloroform 9
Etil asetat 4
Metanol 4
Fase gerak diklorometana, dietil eter, dan kloroform menunjukkan jumlah noda yang lebih banyak dan keterpisahan yang lebih baik dibandingkan dengan fase gerak n-heksana, aseton, etil asetat, dan metanol. Ketiga pelarut tersebut kemudian dipilih untuk dimasukkan
ke dalam model simplex centroid design
(SCD). Model SCD bertujuan menghasilkan komposisi campuran fase gerak terbaik dari 3 fase gerak tunggal yang telah dipilih. Hasil pemisahan berdasarkan permodelan SCD diperlihatkan pada Gambar 12 dan jumlah noda yang terbentuk ditunjukkan pada Tabel 7.
*elusi secara menaik (ascending).
Gambar 12 Profil kromatogram formula 6
dengan menggunakan fase
gerak campuran berdasarkan SCD pada = 366 nm.
Tabel 7 Jumlah noda pada elusi formula 6 dengan menggunakan fase gerak campuran berdasarkan SCD
Dari 10 komposisi permodelan SCD, fase gerak kloroform memiliki jumlah noda dan
keterpisahan yang paling baik. Untuk
memastikan fase gerak kloroform sebagai fase gerak terbaik, formula 6 juga dielusi menggunakan beberapa nisbah campuran pelarut di luar permodelan SCD. Hasilnya ditunjukkan pada Lampiran 7. Fase gerak kloroform tetap memberikan jumlah noda dan keterpisahan yang paling baik. Oleh karena itu, fase gerak kloroform dipilih untuk analisis sidik jari formula 6 dengan metode KLT.
*elusi secara menaik (ascending).
Gambar 13 Profil kromatogram dari elusi formula 6 menggunakan fase gerak klorofom sebanyak 6 kali ulangan pada = 366 nm. No
Perco- baan
Perbandingan Komposisi
(v/v/v) ∑
noda CH2Cl2 Eter CHCl3
1 1 0 0 6
2 0 1 0 8
3 0 0 1 9
4 ½ 0 1/2 6
5 0 1/2 1/2 4
6 ½ 1/2 0 3
7 1/3 1/3 1/3 5
8 1/6 2/3 1/6 4
9 1/6 1/6 2/3 4
Tabel 8 Nilai Rf dari masing-masing noda pada elusi formula 6 menggunakan fase gerak kloroform
Formula 6 dielusi sebanyak 6 kali ulangan dengan menggunakan fase gerak kloroform untuk mengetahui konsistensi nilai Rf setiap noda berdasarkan nilai standar deviasi yang diperoleh. Profil kromatogram KLT yang diperoleh ditunjukkan pada Gambar 13. Nilai standar deviasi dari setiap noda (Tabel 8) cukup kecil, maka dapat dikatakan bahwa konsistensi masing-masing noda cukup baik.
Keberadaan kurkumin dan filantin juga dianalisis pada formula yang memiliki aktivitas antijerawat terbaik. Kualitas meniran ditentukan berdasarkan kandungan senyawa
penanda tunggal dari golongan lignan
(Elfahmi 2006; Murugaiyah 2008). Lignan utama dari genus ini adalah filantin dan hipofilantin. Filantin merupakan senyawa identitas dalam menganalisis ekstrak herba meniran (BPOM 2004). Kurkumin merupakan salah satu produk senyawa metabolit sekunder dari tanaman Zingiberaceae, khususnya kunyit dan temu lawak. Kurkumin memiliki aktivitas farmakologi anti radang, anti-imunodefisiensi, antivirus, antibakteri, antijamur, antioksidan, anti karsinogenik dan anti infeksi (Joe et al. 2004; Chattopadhyay et al. 2004; Araujo dan Leon 2001) dan telah dimanfaatkan dalam industri farmasi, makanan, parfum, dan lain-lain.
Standar kurkumin, standar filantin, standar campuran, dan sampel dielusi secara bersama
menggunakan kloroform sebagai fase
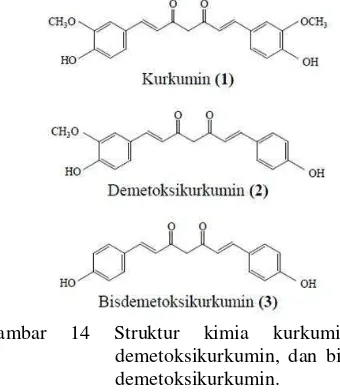
geraknya. Profil kromatogram yang dihasilkan ditunjukkan pada Lampiran 8. Pada standar kurkumin terdeteksi adanya 3 noda. Ketiga noda diduga merupakan noda kurkumin beserta turunannya yaitu, demetoksikurkumin dan bis-demetoksikurkumin (Gambar 14).
Standar filantin tidak terdeteksi pada
konsentrasi 200 ppm dengan volume injeksi 20 L pada UV 254 dan 366 nm.
Gambar 14 Struktur kimia kurkumin,
demetoksikurkumin, dan bis-demetoksikurkumin.
Noda kurkumin memiliki nilai Rf yang
paling besar dibandingkan
desmetoksikurkumin dan
bis-demetoksikurkum. Hal ini disebabkan karena struktur kurkumin memiliki polaritas yang
lebih rendah dibandingkan
demetoksikurkumin dan
bis-demetoksikurkumin sehingga berinteraksi
lebih lemah dengan fase diam silika gel. Fase gerak kloroform yang digunakan lebih nonpolar dibandingkan fase diamnya. Oleh karena itu, semakin nonpolar senyawanya semakin besar nilai Rf yang dihasilkan. Keberadaan kurkumin dapat dideteksi pada Rf sebesar 0.33, sedangkan keberadaan filantin tidak dapat terdeteksi. Keberadaan filantin tidak bisa terdeteksi karena konsentrasi filantin yang digunakan berada di bawah limit deteksi dari KLT. Selain itu filantin bersifat
kurang stabil sehingga sulit dideteksi
menggunakan metode KLT.
Analisis Sidik Jari menggunakan Metode KCKT
Analisis sidik jari juga dilakukan
menggunakan metode KCKT terhadap standar kurkumin, filantin, campuran, dan formula 6 sebagai formula antijerawat terbaik. Elusi
dilakukan secara gradien dengan
menggunakan eluen asetronitril:air. Pola kromatogram standar kemudian dibandingkan terhadap pola kromatogram formula 6 (Lampiran 8). Pola kromatogram formula 6 berbeda dibandingkan dengan standar. Hal ini mungkin disebabkan oleh perbedaan kondisi
matriks sampel dan standar. Untuk
No- da
Pelat (Nilai Rf)
rerata sd
1 2 3 4 5 6
mengurangi galat analisis akibat perbedaan matriks, dilakukan penambahan standar ke dalam sampel formula 6. Larutan formula 6 dicampur dengan larutan standar pada nisbah 1:1 kemudian diinjeksi bersama ke dalam instrumen KCKT. Pola yang dihasilkan
selanjutnya dibandingkan dengan pola
kromatogram formula 6 tanpa penambahan standar (Gambar 15).
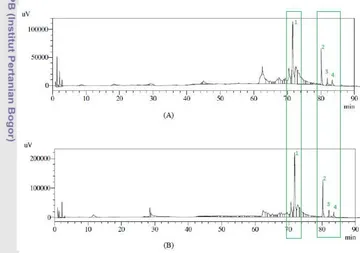
Berdasarkan pola kromatogram yang
dihasilkan terdapat kemiripan antara
kromatogram formula 6 setelah penambahan standar (A) dan tanpa penambahan standar
(B). Kedua kromatogram menunjukkan
adanya puncak pada daerah menit ke-70 hingga 80. Puncak pada menit ke 71.601 pada kromatogram (A) dan menit 71.795 pada
kromatogram (B) diduga merupakan puncak filantin. Puncak pada menit 80.116, 81.943, 83.392 pada kromatogram (A) dan menit 80.208, 82.049, 83.518 pada kromatogram (B) diduga merupakan puncak milik kurkumin,
demetoksikurkumin, dan
bis-demetoksikurkumin. Puncak-puncak tersebut
mengalami kenaikan luas area setelah
dilakukan adisi standar ke dalam sampel (Lampiran 10).
Jayaprakasha et al. (2002) menyatakan
bahwa kurkumin merupakan golongan
kurkuminoid utama yang kelimpahannya lebih banyak dibandingkan demetoksikurkumin dan bis-demetoksikurkumin sehingga kurkumin menghasilkan puncak dengan luas area yang lebih besar.
.
Ekstrak campuran temu lawak dan meniran yang memiliki aktivitas antijerawat terbaik berdasarkan aktivitas antioksidan dan antibakteri adalah formula 6 dengan nilai IC50 sebesar 93.17 ppm dan nilai KHM, KBM berturut-turut sebesar 0.25 mg/mL, 0.50 mg/mL. Hasil uji aktivitas antioksidan dan antibakteri menunjukkan bahwa teknik TCM memberikan hasil yang lebih baik dibanding teknik Indonesia. Fase gerak terbaik untuk pemisahan ekstrak campuran temu lawak dan meniran pada analisis sidik jari menggunakan KLT adalah kloroform. Kondisi pemisahan KCKT untuk standar kurkumin dan filantin yang digunakan untuk analisis sidik jari formula tidak memberikan pola pemisahan yang mirip dengan pola kromatografi dari sampel. Terjadi peningkatan luas area pada
puncak filantin dan kurkumin ketika
dilakukan adisi standar ke dalam sampel. Saran
Perlu dilakukan uji aktivitas inhibisi lipase
untuk memastikan kemampuan sampel
sebagai formula antijerawat. Pemilihan fase gerak yang sesuai untuk analisis sidik jari formula campuran perlu ditentukan lebih lanjut sehingga dihasilkan pemisahan dan pola kromatogram yang lebih baik.
DAFTAR PUSTAKA
Abbasi MA et al. 2010. Preparation of new formulations of anti-acne creams and their
efficacy. African J of Pharm and
Pharmacology 4(6):298-303.
Araujo CAC, Leon LL. 2001. Biological activities of Curcuma longa L. Mem Inst Oswaldo Cruz 96(5)723-728.
[AOAC] Association of Official Analytical
Chemist. 2007. Official Methods of
Analysis. Ed ke-14. Arlington: AOAC. Batubara I, Mitsunaga T, Ohasi H. 2009.
Screening antiacne potency of Indonesian medicinal plants: antibacterial, lipase inhibition, and antioxidant activities. J Wood Sci 55:230-235.
Blois MS. 1958. Antioxidant determinations by the use of a stable free radical. Nature 181: 1199-1200
chromatographic mobile phases and
extraction solutions for Camellia
sinensis. Anal Chim Acta 595:28-37. [BPOM] Badan Pengawas Obat dan Makanan.
2004. Monografi Ekstrak Tumbuhan Obat Indonesia. Jakarta: BPOM.
Brand-Williams W, Cuvelier ME, Berset C. 1995. Use of a free radical method to evaluate antioxidant activity. Lebensmittel-Wissenschaft und-Technologie/Food Sci Technol 28:25-30.
British Pharmacopeia. 1993. British
Pharmacopeia. Vol ke-2. London: Her Majesty’s Stationery Office.
Brook GF, Butel JS, Morse SA. 2005. Mikrobiologi Kesehatan. Mudihardi E, penerjemah. Jakarta: Salemba Medika. Terjemahan dari: Medical Microbiology. Burkhart CG, Burkhart CN, Lehmann PF.
1999. Acne: a review of immunologic and
microbiologic factors. Postgrad Med
J75:328-331.
Chattopadhyay I, Biswas K, Bandyopadhyay U, and Banerjee RK. 2004. Turmeric and
Curcumin:Biological actions ans
medicinal applications. Curr Sci 87(1):44-53.
Chen HM, Muramoto K, Yamauchi F, Nokihara K. 1996. Antioxidant activity of
designed peptides based on the
antioxidative peptide isolated from digests of a soybean protein. J Agric Food Chem 44(9):2619-1613.
Chen C, Pearson AM, Gray JI. 1992. Effects of synthetic antioxidant (BHA, BHT, and PG) on the mutagenicity of IQ-like compounds. Food Chem 43:177-183. Dalimartha S. 2005. Atlas Tumbuhan Obat
Indonesia Jilid 1. Jakarta
:
Trubus Agriwidya.Darusman LK, Rohaeti E, Sulistiyani. 2001. Kajian senyawa golongan flavonoid asal tanaman bangle sebagai senyawa peluruh lemak melalui aktivitas lipase. Bogor: Pusat Studi Biofarmaka, LPPM IPB.
Day RA, Underwood AL. 2002. Analisis
editor. Jakarta: Erlangga. Terjemahan dari: Quantitative Analysis, Sixth edition. [DepKes] Departemen Kesehatan. 1979.
Materia Medika Indonesia Jilid III. Jakarta: BPOM.
[DepKes] Departemen Kesehatan. 1978. Materia Medika Indonesia Jilid II. Jakarta: BPOM.
Dreno B, Poli F. 2003. Epidemiology of acne. Dermatology 206:7-10.
Elfahmi. 2006. Phytochemical and
biosynthetic studies of lignans with a focus on Indonesia medicinal plants. [tesis]. Groningen: Faculty of Mathematics and
Natural Sciences, University of
Groningen.
Funk W, Droeschel B. 1991. Modern TLC 4. J. Planar Chromatogr 123:206-212. Gunawan IWG, Bawa AG, Sutrisnayanti NL.
2008. Isolasi dan identifikasi senyawa terpenoid yang aktif antibakteri meniran (Phyllanthus niruri Linn.). J Kim 2(1):31-39.
Halliwel B, Aeschbach R, Lolinger J, Auroma
OI. 1995. Toxicology. J Food Chem
33:601.
Harbone JB. 1987. Metode Fitokimia. Edisi
ke-2. Padmawinata K, Soediro I,
penerjemah; Bandung: Penerbit ITB. Terjemahan dari: Phytochemical Method.
Harish R, Shivanandappa T. 2006.
Antioxidant activity and hepatoprotective potential of Phyllanthus niruri. Food Chem 95:180-185.
Harmanto N. 2006. SHK: Ibu Sehat dan
Cantik dengan Herbal. Jakarta: Elex Media Komputindo.
Harvey D. 2000. Modern Analytical
Chemistry. New York: McGraw-Hill. Hwang JK, Shim JS, Pyun YR. 2000.
Antibacterial activity of xanthorrhizol from Curcuma xanthorriza againt oral pathogens. Fitoterapia 71:321-323. Jayaprakasha GK., Rao LJM, Sakariah KK..
2002. Improved HPLC method for the
determination of curcumin,
demethoxycurcumin, and
bisdemethoxycurcumin. J Agric Food
Chem 50:3668-3672.
Jitoe A, Masuda T, Tengah IGP, Suprapta
DN, Gara IW, Nobuji N. 1992.
Antioxidant activity of tropical ginger extracts and analysis of the container curcuminoids. J Agric Food Chem 40: 1337-1340.
Joe B, Vijaykumar M and Lokesh BR. 2004. Biological properties of curcumin-cellular and molecular mechanisms of action. Critical Rev Food Sci Nutr. 44(2):97-112. Kahl R, Kappus H. 1993. Toxicology of the
synthetic antioxidants BHA and BHT in comparison with the natural antioxidant vitamin E. Zeitschrift fur Lebensmittel-Untersuchung und Forschung 196(4):329-338.
Kardinan A, Kusuma FR. 2004. Meniran
Penambah Daya Tahan Tubuh Alami. Jakarta: Agromedia Pustaka.
Katzman M, Logan AC. 2007. Acne vulgaris: nutritional factors may be influencing psychological sequelae. Med Hypotheses 69:1080-1084.
Kenkel J. 2002. Analytical Chemistry for Technicians. Ed ke-3. NewYork: CRC Press.
Koleva II, van Beek TA, Linssen JPH, de Groot A, Evstatieva LN. 2001. Screening of plant extracts for antioxidant activity: a comparative study on three testing methods. Phytochem Anal 13:8-17. Lachman L, Lieberman HA, Kanig JL. 1994.
Teori dan Praktek Industri Farmasi. Ed ke-2. Suyatmi S, penerjemah. Jakarta: UI Pr. Terjemahan dari: Theory and Pratice of Pharmaceutical Industry.
Leyden J. 2003. A review of the use of combination therapies for the treatment of Acne vulgaris. J Am Acad Dermatology 49(3):200-210.
Liang YZ, Xie P, Chan K. 2004. Quality control of herbal medicines. J Chromatogr 812:53-70.
Lindsay JA. 2008. Staphylococcus: molecular genetics. Inggris: Caister Aca Pr.
Madigan M. 2005. Brock Biology of
Microorganisme. London: Prentice Hall. Masuda T, Isobe J, Jitoe A, Nakatani N. 1992.
Antioxidative curcuminoide from
rhizomes of Curcuma xanthorrhiza.
Miyake T, Shibamoto T. 1997. Antioxidative activities of natural compounds found in plants. J Agric Food Chem. 45(5):1819-1822.
Molyneux P. 2004. The use of the stable free radical diphenylpicrylhydrazyl (DPPH) for estimating antioxidant activity. J Sci Technol 26(2):211-219.
Murugaiyah V. 2008. Phytochemical,
pharmacological, and pharmacokinetic studies of Phyllanthus niruri Linn. lignans as potential antihyperuricemic agents. [tesis]. Minden: Jurusan Ilmu Pengetahuan Murni dan Terapan, University Sains Malaysia.
Murugaiyah V, Chan KL. 2007. Analysis of ligans from Phyllanthus niruri L. in plasma using a simple HPLC method with fluorescence detection and its application in a pharmacokinetic study. J. Chromatogr B 852:138-144.
Nilsson, Lars, Flock, Pei, Lindberg, Guss A. 1998. Fibrinogen-Binding Protein of Staphylococcus epidermidis. Infection and Immunity 66(6):2666-2673.
Ng TB, Liu F, Wang ZT. 2000. Antioxidative activity of natural products from plants. Life Sci 66(8):709-723.
Nur SW. 2006. Perbandingan sistem ekstraksi dan validasi penentuan xantorizol dari temu lawak secara kromatografi cair kinerja tinggi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Pelczar MJ, Chan ECS. 1986. Dasar-dasar Mikrobiologi 2. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta: Penerbit Universitas Indonesia.
Terjemahan dari: The Basics of
Microbiology 2nd.
Pourmorad F, Hosseinimehr SJ, Shahabimajd N. 2006. Antioxidant activity, phenol and flavonoid contents of some selected
Iranian medicinal plants. African
Biotechnol 5(11):1142-1145.
Purnomowati S, Yoganingrum A. 1997. Temu
lawak (Curcuma xanthorrhiza Roxb.). Jakarta: Pusat Dokumentasi dan Informasi Ilmiah, LIPI.
Puspita MDA. 2009. Pengoptimuman fase
gerak kromatografi lapis tipis
menggunakan desain campuran untuk pemisahan komponen ekstrak meniran
[skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rahardjo M, Rostiana O. 2005. Budidaya Tanaman Temu lawak. Bogor: Balai Penelitian dan Pengembangan Obat dan Aromatika.
Rahman F, Logawa ED, Hegartika H,
Simanjuntak P. 2008. Aktivitas
antioksidan ekstrak tanaman tunggal dan kombinasinya dari tanaman Curcuma spp. J Ilmu Kefarmasian Indones 6(2):69-74.
Rajkumar T, Sinha BN. 2010.
Chromatographic finger print analysis of budmunchiamines in Albizia amara by HPTLC technique. Int J Res Pharm Sci 1(3):313-316.
Rosyad PGY. 2009. Formulasi gel obat jerawat minyak atsiri daun jeruk nipis (Citrus aurantifolia Swingle.) dan uji coba antibakteri (Propionibacterium acne) secara in vitro [skripsi]. Surakarta:
Fakultas Farmasi, Universitas
Muhammadiyah Surakarta.
Rouessac F, Rouessac A. 2007. Chemical Analysis: Modern Instrumentation Methods and Techniques. Ed ke-2. Chichester: J Wiley.
Rukmana R. 1995. Temu lawak Tanaman
Obat dan Obat. Yogyakarta: Kanisius. Salazar-Aranda R, Perez-Lopez LA,
Lopez-Arroyo J, Alanis-Garza BA, Torres NW.
2009. Antimicrobial and antioxidant
activities of plants from northeast of Mexico. eCAM 10:1-6. <