YANG DIKULTIVASI MENGGUNAKAN AIR LIMBAH
HASIL PENAMBANGAN TIMAH DI PULAU BANGKA
MUHAMMAD REZZA FACHRULLAH
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Penghasil Biofuel Jenis Chlorella sp. dan Nannochloropsis sp. yang
Dikultivasi Menggunakan Air Limbah Hasil Penambangan Timah di Pulau Bangka. Dibimbing oleh MUJIZAT KAWAROE dan ADRIANI
SUNUDDIN.
Penelitian dengan topik kultivasi mikroalga penghasil biofuel jenis
Chlorella dan Nannochloropsis dengan menggunakan air limbah tailing timah ini
dilakukan pada bulan Februari - April 2011 di Laboratorium PT. TIMAH Tbk. Bangka. Penghitungan kepadatan sel mikroalga menggunakan haemacytometer dan mikroskop. Parameter fisika dan kimia yang diukur meliputi suhu ruangan, salinitas, derajat keasaman (pH), dan kadar logam berat (Pb, Cu, Cd, dan Cr). Analisis yang digunakan meliputi penghitungan kepadatan, laju pertumbuhan spesifik, kapasitas biosorpsi, dan uji validitas Pearson terhadap kualitas air media.
Kultivasi sel Chlorella dan Nannochloropsis dilakukan dengan tiga perlakuan, yaitu kontrol, menggunakan pupuk, dan tanpa pupuk. Perlakuan kontrol menggunakan media kultur non-limbah yang disesuaikan dengan
keadaaan optimum pertumbuhan mikroalga dengan kualitas air pH 8 dan salinitas 27‰. Kualitas air media perlakuan limbah logam berat dengan menggunakan pupuk dan tanpa pupuk disesuaikan dengan keadaaan kualitas air di lokasi pengambilan sampel, yaitu dengan pH 6 dan salinitas 37‰.
Kultivasi dengan menggunakan Chlorella memperlihatkan bahwa pada perlakuan kontrol sel memiliki kepadatan maksimum tertinggi sebesar 31×106 sel/ml. Media dengan perlakuan memperlihatkan bahwa Chlorella memiliki kepadatan sel maksimum sebesar 16,72×106 sel/ml, sedangkan media tanpa perlakuan pupuk memiliki kepadatan sel maksimum terendah yaitu sebesar 1,71×106 sel/ml.
Kultivasi dengan menggunakan sel Nannochloropsis memperlihatkan bahwa dengan perlakuan kontrol sel memiliki kepadatan sel maksimum tertinggi sebesar 42,50×106 sel/ml. Media perlakuan pupuk memperlihatkan bahwa sel
Nannochloropsis memiliki kepadatan sel maksimum sebesar 9,30×106 sel/ml, sedangkan media tanpa perlakuan pupuk memiliki kepadatan sel maksimum terendah sebesar 1,26×106 sel/ml.
Logam berat Pb, Cu, dan Cd mampu diserap oleh sel Chlorella maupun
Nannochloropsis mencapai lebih dari 80%. Nannochloropsis memiliki kapasitas
penyerapan logam berat lebih besar dibandingkan Chlorella untuk semua jenis logam, yaitu Pb 99%, Cu 99%, Cd 98,73%, dan Cr 52,63%. Kapasitas serapan terendah sel mikroalga terdapat pada logam berat Cr.
YANG DIKULTIVASI MENGGUNAKAN AIR LIMBAH
HASIL PENAMBANGAN TIMAH DI PULAU BANGKA
MUHAMMAD REZZA FACHRULLAH
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Dengan ini Saya menyatakan bahwa Skripsi yang berjudul:
LAJU PERTUMBUHAN MIKROALGA PENGHASIL BIOFUEL JENIS Chlorella sp. DAN Nannochloropsis sp. YANG DIKULTIVASI
MENGGUNAKAN AIR LIMBAH HASIL PENAMBANGAN TIMAH DI PULAU BANGKA
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, September 2011
© Hak Cipta milik IPB. Tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan
atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau
tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan
yang wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis
Judul Skripsi: Laju Pertumbuhan Mikroalga Penghasil Biofuel Jenis
Chlorella sp. dan Nannochloropsis sp. yang Dikultivasi
Menggunakan Air Limbah Hasil Penambangan Timah di Pulau Bangka
Nama Mahasiswa: Muhammad Rezza Fachrullah Nomor Pokok: C54070074
Departemen: Ilmu dan Teknologi Kelautan
Menyetujui,
Dosen Pembimbing
Dr. Ir. Mujizat Kawaroe, M.Si. Adriani Sunuddin, S.Pi., M.Si. NIP. 19551213199403 2 002 NIP. 19790206 200604 2 013
Mengetahui,
Prof. Dr. Ir. Setyo Budi Susilo, M.Sc. NIP. 19580909 198303 1 003
vii
rahmat dan karunianya, penulis dapat menyelesaikan skripsi ini. Skripsi yang berjudul “Laju Pertumbuhan Mikroalga Penghasil Biofuel Jenis Chlorella sp. dan Nannochloropsis sp. yang Dikultivasi Menggunakan Air Limbah Hasil
Penambangan Timah di Pulau Bangka” diajukan sebagai salah satu syarat
untuk mendapatkan gelar sarjana.
Penulis mengucapkan terima kasih sebesar-besarnya kepada orang tua dan keluarga. Tidak lupa ucapan terima kasih juga penulis ucapkan kepada Ibu Mujizat Kawaroe selaku dosen pembimbing utama, Ibu Adriani Sunuddin selaku pembimbing anggota, Bapak Adrianis dan Ibu Henny Kristin selaku pembimbing lapang dan juga yang telah memberikan izin tempat untuk melakukan kegiatan penelitian, Rama, Barok, Ari, Adit, Maemar, Dori, Alvi, Dina, Agus, Ryan, Ikbal, Ayu, Hera, Mbak Dwi, Bang Yoga, keluarga besar ITK khususnya angkatan 44, staf karyawan PT. TIMAH Tbk. Bangka, serta semua pihak yang telah membantu dalam pelaksanaan kegiatan dan penyusunan skripsi penelitian ini.
Penulis menyadari skripsi ini jauh dari kesempurnaan, oleh karena itu saran dan kritik sangat diharapkan demi kesempurnaan skripsi ini. Akhir kata penulis berharap agar skripsi ini dapat berguna bagi diri sendiri maupun orang lain dan dapat dikembangkan untuk penelitian selanjutnya.
Bogor, September 2011
ix
3.4. Analisis Data ... 32
4. HASIL DAN PEMBAHASAN ... 33
4.1. Kepadatan dan Laju Pertumbuhan Spesifik Chlorella sp. dalam Media ... 33
4.1.1. Kepadatan dan Laju Pertumbuhan Spesifik Chlorella sp. dengan Perlakuan Kontrol ... 34
4.1.2. Kepadatan dan Laju Pertumbuhan Spesifik Chlorella sp. dengan Perlakuan Menggunakan Pupuk dalam Media Logam Berat ... 35
4.1.3. Kepadatan dan Laju Pertumbuhan Spesifik Chlorella sp. dengan Perlakuan Tanpa Menggunakan Pupuk dalam Media Logam Berat ... 38
4.2. Kepadatan dan Laju Pertumbuhan Spesifik Nannochloropsis sp. dalam Media ... 39
4.2.1. Kepadatan dan Laju Pertumbuhan Spesifik Nannochloropsis sp. dengan Perlakuan Kontrol ... 40
4.2.2. Kepadatan dan Laju Pertumbuhan Spesifik Nannochloropsis sp. dengan Perlakuan menggunakan Pupuk dalam Media Logam Berat ... 41
4.2.3. Kepadatan dan Laju Pertumbuhan Spesifik Nannochloropsis sp. dengan Perlakuan Tanpa Menggunakan Pupuk dalam Media Logam Berat ... 42
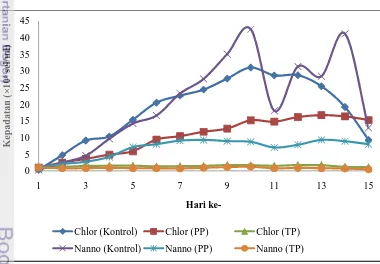
4.3. Perbandingan Kepadatan Sel Mikroalga (Chlorella sp. dan Nannochloropsis sp.) ... 43
4.3.1. Kultivasi Chlorella sp. dengan Nannochloropsis sp. pada Media Kontrol ... 44
4.3.2. Kultivasi Chlorella sp. dengan Nannochloropsis sp. Menggunakan Pupuk dalam Media Limbah Logam Berat .. 46
4.3.3. Kultivasi Chlorella sp. dengan Nannochloropsis sp. Tanpa Pupuk dalam Media Limbah Logam Berat ... 48
x
1. Alat dan bahan yang digunakan ... 22
2. Konsentrasi logam Timbal (Pb), Kadmium (Cd), Tembaga (Cu), dan Kromium (Cr ) pada media limbah logam berat ... 50
3. Indeks Korelasi Pearson pengaruh salinitas dan pH pada Chlorella sp. ... 60
4. Kepadatan dan laju pertumbuhan spesifik Chlorella sp. perlakuan kontrol ... 71
5. Kepadatan dan laju pertumbuhan spesifik Chlorella sp. perlakuan pupuk pada media limbah logam berat ... 72
6. Kepadatan dan laju pertumbuhan spesifik Chlorella sp. perlakuan tanpa pupuk pada media limbah logam berat ... 73
7. Kepadatan dan laju pertumbuhan spesifik Nannochloropsis sp. perlakuan kontrol ... 74
8. Kepadatan dan laju pertumbuhan spesifik Nannochloropsis sp. perlakuan pupuk pada media limbah logam berat ... 75
9. Kepadatan dan laju pertumbuhan spesifik Nannochloropsis sp. perlakuan tanpa pupuk pada media limbah logam berat ... 76
10. Salinitas pada media limbah logam berat ... 77
11. Derajat keasaman (pH) pada media limbah logam berat ... 78
xi
1. Bentuk sel Chlorella sp. ... 3
2. Bentuk sel Nannochloropsis sp. ... 5
3. Fase pertumbuhan mikroalga ... 10
4. Peta lokasi pengambilan sampel air limbah logam brerat di pulau bangka ... 21
5. Alat penyaring sampel air laut ... 23
6. Autoclave ... 25
7. Haemacytometer ... 26
8. Pemindahan bibit sel mikroalga ke dalam media limbah ... 29
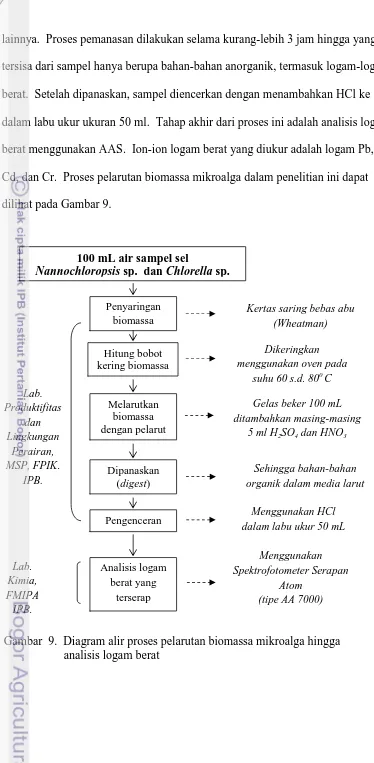
9. Diagram alir proses pelarutan biomassa mikroalga hingga analisis logam berat ... 31
10. Grafik kepadatan sel Chlorella sp. ... 33
11. Grafik kepadatan sel Nannochloropsis sp. ... 39
12. Kepadatan sel Chlorella sp. dan Nannochloropsis sp. dengan perlakuan kontrol, menggunakan pupuk, dan tanpa pupuk ... 43
13. Grafik kepadatan sel Chlorella sp. dan Nannochloropsis sp. dengan perlakuan kontrol ... 44
14. Grafik Kepadatan Sel Chlorella sp. dan Nannochloropsis sp. dengan perlakuan pupuk ... 46
15. Grafik kepadatan sel Chlorella sp. dan Nannochloropsis sp. dengan perlakuan tanpa pupuk ... 49
16. Salinitas pada medium Chlorella sp. dan Nannochloropsis sp. perlakuan kontrol, menggunakan pupuk, dan tanpa pupuk ... 55
xii
1. Penghitungan kepadatan Chlorella sp. dan Nannochloropsis sp. .... 66
2. Penghitungan laju pertumbuhan spesifik mikroalga ... 67
3. Penghitungan kapasitas bioabsorpsi logam berat ... 68
4. Uji validitas Pearson dan uji lanjut regresi ... 69
5. Kepadatan dan laju pertumbuhan spesifik Chlorella sp. dan Nannochloropsis sp. ... 71
6. Kualitas air media kultivasi ... 77
7. Komposisi kimiawi pupuk analis (Walne Media) ... 79
8. Dokumentasi foto alat dan bahan, serta kegiatan penelitian ... 80
1.
PENDAHULUAN
1.1. Latar Belakang
Pulau Bangka dikenal sebagai pulau yang kaya dengan sumber daya alam
mineral, khususnya timah, sehingga menjadikan penambangan sebagai roda
penggerak ekonomi masyarakat dan pemerintah pulau ini. Sisa dari aktivitas
penambangan ini berupa tailing (buangan pasir yang tidak digunakan) yang
mengandung logam berat seperti timbal (Pb), kadmium (Cd), tembaga (Cu), dan
kromium (Cr), yang berdampak mencemari biota dan lingkungan laut. Adanya
Perda No. 6 Tahun 2001 yang mengizinkan kegiatan penambangan timah rakyat,
menjadikan aktivitas penambangan timah berkembang pesat dan tidak terkendali.
Hal ini dilihat dari adanya sejumlah penambang liar yang tidak memiliki izin dan
kurangnya kapasitas dalam menangani buangan sisa hasil penambangan, sehingga
menumpuknya tailing dan mayoritas tidak melalui proses pengelolaan yang layak.
Salah satu upaya yang perlu dilakukan dalam pengendalian lingkungan
adalah melakukan analisis mineral atau unsur (logam berat) terutama yang
terdapat di wilayah sekitar penambangan. Selanjutnya, upaya analisis mineral
tersebut dapat dikembangkan menjadi upaya pemulihan bahan pencemar
logam-logam berat, sehingga antisipasi adanya akumulasi logam-logam berat di dalam tubuh
mahluk hidup menjadi lebih kecil. Pemulihan kondisi lingkungan dari
pencemaran logam berat dapat dilakukan dengan memanfaatkan makhluk hidup
atau dikenal dengan istilah bioremediasi. Upaya bioremediasi terbagi menjadi
dua sistem, yaitu bioaugmentasi dan biostimulasi. Penelitian ini dikembangkan
sehingga organisme yang digunakan untuk rekoveri dapat bertahan hidup di dalam
media kultur limbah logam berat.
Sistem kultivasi umumnya telah dikembangkan menggunakan mikroalga.
Beberapa jenis mikroalga seperti Chlorella sp. dan Nannochloropsis sp. memiliki
toleransi yang baik terhadap lingkungan ekstrim. Kemudahan dalam mengkultur
mikroalga ini memungkinkan untuk dilakukan penelitian terhadap kedua jenis
mikroalga tersebut. Selanjutnya, dengan kandungan lemaknya yang tinggi,
mikroalga berpotensi untuk menghasilkan biofuel sebagai salah satu solusi dalam
mengatasi krisis sumber daya minyak (Kawaroe et al., 2010).
Sistem kultivasi mikroalga memiliki peran penting dalam upaya perbaikan
lingkungan perairan yang tercemar logam berat. Namun sebelum pengembangan
ini dilakukan, kajian biologi mikroalga seperti kemampuan penyerapan logam
berat dan adaptasi terhadap media tumbuh yang tercemar logam berat sangat perlu
dilakukan. Oleh karena itu, penelitian ini dilakukan untuk mengetahui
kemampuan tumbuh dan bioabsorben mikroalga Chlorella sp. dan
Nannochloropsis sp. yang ditumbuhkan di media kultivasi tercemar logam berat.
1.2. Tujuan
Tujuan dari penelitian ini adalah:
1. Membandingkan laju pertumbuhan dua jenis mikroalga (Chlorella sp. dan
Nannochloropsis sp.) yang dikultivasi menggunakan limbah tailing timah;
2. Membandingkan kapasitas penyerapan logam berat Pb, Cu, Cd, dan Cr oleh
Chlorella sp. dan Nannochloropsis sp.;
3. Menentukan pengaruh parameter fisika dan kimia media kultivasi terhadap
2. TINJAUAN PUSTAKA
2.1. Biologi, Morfologi, dan Habitat Chlorella sp.
Menurut Vashista (1979) dalam Rostini (2007), Chlorella sp. termasuk
dalam:
Filum : Chlorophyta
Kelas : Chlorophyceae
Ordo : Chlorococcales
Famili : Chlorellaceae
Genus : Chlorella sp.
Sel Chlorella sp. berbentuk bulat, hidup soliter, berukuran 2-8 m. Sel
Chlorella sp. di dalamnya mengandung 50% protein, lemak serta vitamin A, B, D,
E dan K, di samping banyak terdapat pigmen hijau (klorofil) yang berfungsi
sebagai katalisator dalam proses fotosintesis (Sachlan, 1982 dalam Rostini, 2007).
Setiap berat kering yang sama, Chlorella sp. mengandung vitamin A, B, D, E, dan K,
yaitu 30 kali lebih banyak dibandingkan yang terdapat dalam hati anak sapi, serta
empat kali vitamin yang terkandung dalam sayur bayam (Watanabe, 1978 dalam
Rostini, 2007).
Mikroalga Chlorella sp. memiliki potensi sebagai pakan alami, pakan
ternak, suplemen, penghasil komponen bioaktif, bahan farmasi dan kedokteran.
Hal tersebut disebabkan Chlorella sp. mengandung berbagai nutrien seperti
protein, karbohidrat, asam lemak tak jenuh, vitamin, klorofil, enzim, dan serat
yang tinggi (Kawaroe, 2010). Chlorella sp. juga menghasilkan suatu antibiotik
yang disebut Chlorellin, yaitu suatu zat yang dapat melawan penyakit-penyakit
yang disebabkan oleh bakteri (Vashista, 1979 dalam Rostini, 2007). Protoplas sel
dikelilingi oleh membran yang selektif, sedangkan di luar membran sel terdapat
dinding yang tebal terdiri dari selulosa dan pektin. Di dalam sel terdapat suatu
protoplas yang tipis berbentuk seperti cawan atau lonceng dengan posisi
menghadap ke atas. Pineroid-pineroid stigma dan vakuola kontraktil tidak ada
(Vashista, 1979 dalam Rostini, 2007).
Chlorella sp. dapat tumbuh pada salinitas 25 ‰. Alga tumbuh lambat pada
salinitas 15 ‰, dan hampir tidak tumbuh pada salinitas 0 ‰ dan 60 ‰. Chlorella
sp. tumbuh baik pada suhu 20 oC, tetapi tumbuh lambat pada suhu 32 oC. Tumbuh sangat baik sekitar 20-23 oC (Hirata, 1981 dalam Rostini, 2007). Pemanfaatan Chlorella sp. dilakukan menggunakan teknik kultur. Keberhasilan
teknik kultur bergantung pada kesesuaian antara jenis mikroalga yang
dibudidayakan dan beberapa faktor lingkungan. Salah satu hal yang perlu
diperhatikan adalah faktor derajat keasaman (pH) agar metabolisme sel mikroalga
tidak terganggu. Derajat keasaman (pH) media menentukan kelarutan dan
ketersediaan ion mineral sehingga mempengaruhi penyerapan nutrien oleh sel.
Perubahan nilai pH yang drastis dapat mempengaruhi kerja enzim serta dapat
2.2. Biologi, Morfologi, dan Habitat Nannochloropsis sp.
Klasifikasi Nannochloropsis sp. menurut Adehoog dan Simon (2001)
dalam Anon et al. (2009) adalah sebagai berikut:
Filum : Chromophyta
Kelas : Eustigmatophyceae
Ordo : Eustigmatales
Famili : Eustigmataceae
Genus : Nannochloropsis sp.
Nannochloropsis sp. memiliki sejumlah kandungan pigmen dan nutrisi
seperti protein (52,11%), karbohidrat (16%), lemak (27,64%), vitamin C (0,85%),
dan klorofil A (0,89%). Nannochloropsis sp. merupakan sel berwarna kehijauan,
tidak motil, dan tidak berflagel. Selnya berbentuk bola dan berukuran kecil.
Organisme ini merupakan divisi yang terpisah dari Nannochloris karena tidak
adanya klorofil b. Nannochloropsis sp. merupakan pakan yang populer untuk
rotifer, artemia, dan pada umumnya merupakan organisme filter feeder
(penyaring) (Anon et al., 2009).
Nannochloropsis sp. memiliki ukuran sel 2-4 mikron, berwarna hijau dan
memilki dua flagella (Heterokontous) yang salah satu flagella berambut tipis.
Nannochloropsis sp. memiliki kloroplas dan nukleus yang dilapisi membran.
Kloroplas memiliki stigma (bintik mata) yang bersifat sensitif terhadap cahaya.
Nannochloropsis sp. dapat berfotosintesis karena memiliki klorofil. Ciri khas dari
Nannochloropsis sp. adalah memiliki dinding sel yang terbuat dari komponen
selulosa.
Nannochloropsis sp. bersifat kosmopolit dapat tumbuh pada salinitas 0-35
‰. Salinitas optimum untuk pertumbuhannya adalah 25-35 ‰, dan suhu 25-30
o
C merupakan kisaran suhu yang optimal. Mikroalga ini dapat tumbuh baik pada
kisaran pH 8-9,5 dan intensitas cahaya 100-10000 lux. Nannochloropsis sp. lebih
dikenal dengan nama Chlorella sp. laut dikultur untuk pakan Barchionus plicatilis
atau Rotifer karena mengandung Vitamin B12. Kepadatan optimum yang dapat
dicapai untuk skala laboratrium 50-60 juta sel/mL, skala semi massal 20-25 juta
sel/mL dan massal 15-20 juta sel/mL dengan masa kultur 4-7 hari (Anon, 2009).
Nannochloropsis sp. memiliki kandungan lipid yang cukup tinggi yaitu
antara 31-68% berat kering (Campbell, 2008; Kawaroe, 2007; Rao, 2008).
Persentase PUFA (Poly Unsaturated Fattc Acid) utama pada Nannochloropsis sp.
tetap stabil pada kondisi dengan keterbatasan cahaya, tetapi pada kondisi dengan
intensitas cahaya jenuh kandungan PUFA menurun yang diikuti dengan kenaikan
proporsi SFA dan MUFA (Mono Unsaturated Fatty Acid). Nannochloropsis sp.
mengandung Vitamin B12 dan Eicosapentaenoic acid (EPA) sebesar 30,5 % dan
total kandungan omega 3 HUFAs sebesar 42,7%, serta mengandung protein
2.3. Kultivasi Mikroalga
2.3.1. Syarat Kultivasi Mikroalga
Kultivasi mikroalga dipengaruhi oleh beberapa faktor umum seperti faktor
eksternal (lingkungan) yang biasa dikenal. Faktor-faktor lingkungan tersebut
berpengaruh terhadap laju pertumbuhan dan metabolisme dari makhluk hidup
mikro ini. Faktor-faktor tersebut antara lain:
(1) Derajat Keasaman (pH)
Derajat keasaman atau pH digambarkan sebagai keberadaan ion hidrogen.
Variasi pH dalam media kultur dapat mempengaruhi metabolisme dan
pertumbuhan kultur mikroalga antara lain mengubah keseimbangan karbon
anorganik, mengubah ketersediaan nutrien dan mempengaruhi fisiologi sel.
Kisaran pH untuk kultur alga biasanya antara 7-9, kisaran optimum untuk alga
laut berkisar antara 7,8-8,5. Secara umum kisaran pH yang optimum untuk kultur
mikroalga adalah antara 7–9.
(2) Salinitas
Kisaran salinitas yang berubah-ubah dapat mempengaruhi pertumbuhan
mikroalga. Beberapa mikroalga dapat tumbuh dalam kisaran salinitas yang tinggi
tetapi ada juga yang dapat tumbuh dalam kisaran salinitas yang rendah. Namun,
hampir semua jenis mikroalga dapat tumbuh optimal pada salinitas sedikit
dibawah habitat asal. Pengaturan salinitas pada media yang diperkaya dapat
dilakukan dengan pengenceran dengan menggunakan air tawar. Kisaran salinitas
yang paling optimum untuk pertumbuhan mikroalga adalah 25-35‰ (Sylvester et
(3) Suhu
Suhu merupakan salah satu faktor penting yang mempengaruhi
pertumbuhan mikroalga. Perubahan suhu berpengaruh terhadap proses kimia,
biologi dan fisika, peningkatan suhu dapat menurunkan suatu kelarutan bahan dan
dapat menyebabkan peningkatan kecepatan metabolisme dan respirasi mikroalga
di perairan. Secara umum suhu optimal dalam kultur mikroalga berkisar antara
20-24 oC.
Suhu dalam kultur diatur sedemikian rupa bergantung pada media yang
digunakan. Suhu di bawah 16 oC dapat menyebabkan kecepatan pertumbuhan turun, sedangkan suhu diatas 36 oC dapat menyebabkan kematian (Taw, 1990).
(4) Cahaya
Cahaya merupakan sumber energi dalam proses fotosintesis yang berguna
untuk pembentukan senyawa karbon organik. Intensitas cahaya sangat
menentukan pertumbuhan mikroalga yaitu dilihat dari lama penyinaran dan
panjang gelombang yang digunakan untuk fotosintesis. Cahaya berperan penting
dalam pertumbuhan mikroalga, tetapi kebutuhannya bervariasi yang disesuaikan
dengan kedalaman kultur dan kepadatannya.
(5) Karbondioksida
Karbondioksida diperlukan oleh mikroalga untuk memenbantu proses
fotosintesis. Karbondioksida dengan kadar 1-2% biasanya sudah cukup digunakan
dalam kultur mikroalga dengan intensitas cahaya yang rendah. Kadar
karbondioksida yang berlebih dapat menyebabkan pH kurang dari batas optimum
(6) Nutrien
Mikroalga memperoleh nutrien dari air laut yang sudah mengandung
nutrien yang cukup lengkap. Namun pertumbuhan mikroalga dalam kultur dapat
mencapai optimum dengan mencampurkan air laut dengan nutrien yang tidak
terkandung dalam air laut tersebut.
Nutrien tersebut dibagi menjadi makro nutrien dan mikro nutrien. Unsur
makro nutrien terdiri atas N (meliputi nitrat), P (Posfat), K (Kalium), C (Karbon),
Si (silikat), S (Sulfat) dan Ca (Kalsium). Unsur mikro nutrien terdiri atas Fe
(Besi), Zn (Seng), Cu (Tembaga), Mg (Magnesium), Mo (Molybdate), Co
(Kobalt), B (Boron), dan lainnya (Sylvester et al., 2002; Edhy et al., 2003;
Cahyaningsih, 2009).
(7) Aerasi
Aerasi dalam kultivasi mikroalga digunakan dalam proses pengadukan
media kultur. Pengadukan sangat penting dilakukan bertujuan untuk mencegah
terjadinya pengendapan sel, nutrien tersebar dengan baik sehingga mikroalga
dalam kultur mendapatkan nutrien yang sama, mencegah sratifikasi suhu, dan
meningkatkan pertukaran gas dari udara ke media (Taw, 1990).
Pertumbuhan mikroalga dalam media kultur dapat ditandai dengan
bertambah besarnya ukuran sel atau bertambah banyaknya jumlah sel. Kepadatan
sel dalam kultur Nannochloropsis sp. dan Chlorella sp. digunakan untuk
mengetahui pertumbuhan jenis mikroalga hijau tersebut. Kecepatan tumbuh
dalam kultur ditentukan dari media yang digunakan dan dapat dilihat dari hasil
pengamatan kepadatan Nannochloropsis sp. dan Chlorella sp. yang dilakukan
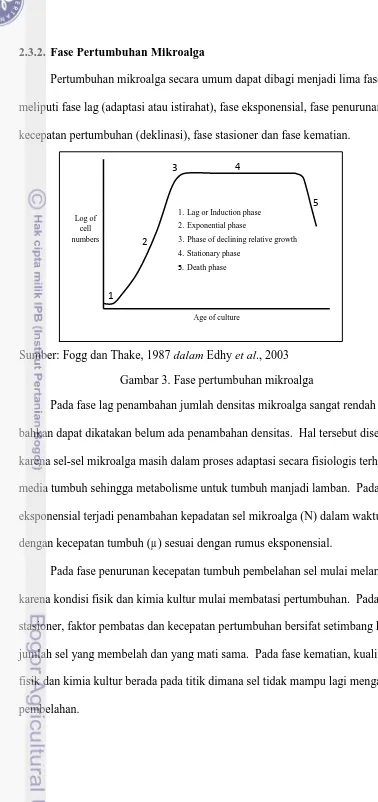
2.3.2. Fase Pertumbuhan Mikroalga
Pertumbuhan mikroalga secara umum dapat dibagi menjadi lima fase yang
meliputi fase lag (adaptasi atau istirahat), fase eksponensial, fase penurunan
kecepatan pertumbuhan (deklinasi), fase stasioner dan fase kematian.
Gambar 3. Fase pertumbuhan mikroalga
Pada fase lag penambahan jumlah densitas mikroalga sangat rendah atau
bahkan dapat dikatakan belum ada penambahan densitas. Hal tersebut disebabkan
karena sel-sel mikroalga masih dalam proses adaptasi secara fisiologis terhadap
media tumbuh sehingga metabolisme untuk tumbuh manjadi lamban. Pada fase
eksponensial terjadi penambahan kepadatan sel mikroalga (N) dalam waktu (t)
dengan kecepatan tumbuh (µ) sesuai dengan rumus eksponensial.
Pada fase penurunan kecepatan tumbuh pembelahan sel mulai melambat
karena kondisi fisik dan kimia kultur mulai membatasi pertumbuhan. Pada fase
stasioner, faktor pembatas dan kecepatan pertumbuhan bersifat setimbang karena
jumlah sel yang membelah dan yang mati sama. Pada fase kematian, kualitas
fisik dan kimia kultur berada pada titik dimana sel tidak mampu lagi mengalami
pembelahan.
Sumber: Fogg dan Thake, 1987 dalam Edhy et al., 2003 1
2
3 4
5
1.Lag or Induction phase 2.Exponential phase
2.3.3. Biofuel dari mikroalga
Mikroalga berpotensi menghasilkan biofuel dalam jumlah yang sangat
besar. Biofuel yang dapat terbarukan dapat menggantikan minyak yang dijadikan
bahan bakar yang berkontribusi pada pemanasan global dan ketersediannya yang
terbatas. Biodiesel dan Bioethanol merupakan bahan bakar yang berpotensi dapat
diperbaharui yang menarik perhatian dunia. Biodiesel dan bioethanol diproduksi
oleh tanaman pertanian menggunakan metode yang ada dan keberadaannya tidak
dapat menggantikan minyak fosil yang dijadikan bahan bakar.
Tingginya potensi bahan dari mikroalga ini telah dikemukakan oleh Umdu
et al. (2008) bahwa minyak mikroalga mengandung lipid yang cocok untuk
esterifikasi atau transesterifikasi.
Mikroalga merupakan biota yang menjanjikan hasil lebih baik karena:
1. Memiliki laju pertumbuhan tinggi (Umdu et al., 2008).
2. Kandungan lipid dapat disesuaikan dengan mengubah komposisi media untk tumbuh (Umdu et al., 2008).
3. Dapat dipanen lebih dari satu kali dalam satu tahun (Umdu et al., 2008).
4. Dapat menggunakan air laut atau air limbah (Umdu et al., 2008).
2.3.4. Teknik Kultivasi Mikroalga
Kultivasi (kegiatan kultur) mikroalga dalam skala laboratorium
membutuhkan kondisi lingkungan yang stabil, sehingga diperlukan pendingin
ruangan (AC) agar suhu ruangan selalu terkendali dan ruangan terisolasi dari
lingkungan luar. Selain itu, ada beberapa mikroalga yang dapat tumbuh baik pada
Pupuk yang digunakan pada skala laboratorium terbuat dari bahan kimia
PA (Pro Analis) dengan dosis pemakaian 1ml/L volume kutur. Jenis dan formula
pupuk adalah yang telah distandarkan dan umum digunakan yaitu Conwy
(Walne’s Media), Guilard, dan Rhyter modifikasi F. Penggunaan pupuk pada
skala laboratorium dimanfaatkan agar pertumbuhan mikroalga optimal sehingga
didapatkan bibit (starter) yang bermutu tinggi untuk skala kultur selanjutnya.
2.4. Logam Berat
2.4.1. Deskripsi Logam Berat
Keberadaan logam berat dalam lingkungan dapat berasal dari dua sumber,
yaitu berasal dari proses alamiah seperti pelapukan secara kimiawi dan kegiatan
geokimiawi serta dari tumbuhan dan hewan yang membusuk, dan berikutnya
berasal dari hasil aktivitas manusia terutama hasil limbah industri. Berdasarkan
sudut pandang toksikologi, logam berat dapat dibagi dalam dua jenis. Jenis
pertama adalah logam berat esensial, di mana keberadaannya dalam jumlah
tertentu sangat dibutuhkan oleh organisme hidup, namun dalam jumlah yang
berlebihan dapat menimbulkan efek racun. Contoh logam berat ini adalah Zn, Cu,
Fe, Co, Mn, dan lain sebagainya. Sedangkan jenis kedua adalah logam berat tidak
esensial atau beracun, dimana keberadaannya dalam tubuh masih belum diketahui
manfaatnya atau bahkan dapat bersifat racun, seperti Hg, Cd, Pb, Cr, dan lain-lain.
Logam berat yang masuk ke dalam lingkungan perairan akan mengalami
pengendapan, pengenceran dan dispersi, kemudian diserap oleh organisme yang
hidup di perairan tersebut. Pengendapan logam berat di suatu perairan terjadi
karena adanya anion karbonat hidroksil dan klorida (Hutagalung, 1995). Logam
dasar perairan dan bersatu dengan sedimen sehingga kadar logam berat dalam
sedimen lebih tinggi dibanding dalam air (Hutagalung, 1995).
2.4.2. Pencemaran Logam Berat Aktivitas Penambangan di Pulau Bangka
Pulau Bangka dikenal sebagai daerah penghasil timah sejak 3 abad silam
yang dimulai pada pemerintahan Kolonial Belanda. Seiring bergulirnya roda
pemerintahan, yang pada awalnya penambangan timah tidak diperbolehkan untuk
skala rakyat. Berdasarkan Perda No. 6 Tahun 2001, Pemprov Bangka
membolehkan penambangan timah rakyat untuk tujuan kemakmuran, sehingga
aktivitas penambangan tumbuh pesat, khususnya oleh penambang skala kecil.
Keadaan ini terlihat dengan semakin maraknya kegiatan penambangan
rakyat yang sifatnya ilegal, dan cenderung mengabaikan pengelolaan hasil
samping penambanganyang dapat mencemari lingkungan. Eksplorasi timah di
daerah laut secara besar-besaran telah menghasilkan limbah tailing yang besar
pula dan dibuang langsung ke laut tanpa pengolahan terlebih dahulu. Hal tersebut
menyebabkan terjadinya sedimentasi pada sebagian Laut Bangka. Di samping
limbah tailing, tumpahan oli dan solar dari aktivitas penambangan juga turut
memperparah pencemaran terutama berkaitan dengan pencemaran logam berat di
perairan Pulau Bangka.
Kegiatan penambangan timah di pulau Bangka ini telah berlangsung sejak
zaman kolonial Belanda hingga sekarang. Pulau Bangka merupakan pulau
penghasil timah terbesar di Indonesia. Dari luas Pulau Bangka sebesar 1.294.050
ha, sekitar 27,56 % daratan pulau ini merupakan areal Kuasa Penambangan (KP)
timah PT. Tambang Timah menguasai lahan seluas 321.577 ha dan PT. Kobatin
Selain kedua perusahan tersebut, izin kuasa penambangan (KP) timah juga
diberikan kepada perusahaan swasta. Sampai dengan pertengahan tahun 2007,
jumlah KP timah mencapai 101 izin dengan luas pencadangan 320.219 ha, dan
yang telah ditambang 6.084 ha.
2.4.3. Beberapa Karakteristik Logam Berat, Sumber, dan Dampaknya
2.4.3.1. Timbal (Pb)
Timbal merupakan logam berat beracun yang dapat dideteksi secara praktis
pada seluruh benda mati di lingkungan dan seluruh sistem biologis. Logam ini
merupakan racun yang mudah terakumulasi dan akan mengalami peningkatan
jumlah dalam tubuh, hingga akhirnya mencapai suatu titik dimana telah terjadi
kerusakan sistem tubuh. Mobilitas timbal di tanah dan tumbuhan cenderung
lambat dengan kadar normalnya pada tumbuhan berkisar 0,5 – 3,0 ppm
(Suhendrayatna, 2001). Sumber utama timbal adalah dari makanan dan minuman
yang terkontaminasi timbal (Suhendrayatna, 2001).
Selain itu menurut Vinithkumar (2004), timbal juga terdapat di udara bebas
sebagai akibat dari penggunaan bahan bakar kendaraan dan industri yang tidak
bebas timbal. Timbal menimbulkan efek beracun pada sistem syaraf,
hemetologik, hemetotoksik, dan mempengaruhi kerja ginjal serta paru-paru,
bahkan gangguan pertumbuhan pada anak-anak dan bayi (Vinithkumar, 2004).
Mobilitas timbal di tanah dan tumbuhan cendrung lambat dengan kadar
2.4.3.2 Kadmium (Cd)
Kadmium lebih mudah diakumulasi oleh tanaman dibandingkan dengan
timbal dan lebih banyak dijumpai pada permukaan sampel tanah yang diambil
dekat penambangan bijih seng (Suhendrayatna, 2001). Sumber dari logam ini
antara lain berasal dari industri baterai, pewarnaan, plastik, dan pengolahan
logam. Logam kadmium tergolong berbahaya karena memiliki resiko tinggi pada
pembuluh darah. Kadmium berpengaruh terhadap tubuh manusia dalam jangka
waktu panjang dan dapat terakumulasi dalam tubuh, khususnya di hati dan ginjal.
Logam berat ini bersama timbal dan merkuri sebagai the big three heavy
metal yang memiliki tingkat bahaya tertinggi pada kesehatan manusia. Kadmium
adalah logam beracun yang merupakan polutan yang berbahaya bagi lingkungan
karena bersifat toksik selain dapat membahayakan makhluk hidup dan ekosistem
perairan. Kadmium dapat meleleh pada 320 oC dan bersifat sangat elektropositif. Logam-logam kadmium cenderung membentuk kompleks dengan NH3, ion halida
dan CN-. Kadmium dapat melarut lambat dalam asam encer dengan melepaskan hidrogen.
2.4.3.3 Kromium (Cr)
Logam kromium di alam ditemukan dalam bentuk chromite (FeO.Cr2O3).
Kromium adalah logam yang berwarna putih, tak begitu liat (keras tapi rapuh),
dan tak dapat ditempa. Logam ini memiliki titik leleh di atas 1800 oC. Logam kromium larut dalam asam klorida encer atau pekat. Jika tidak terkena udara,
akan terbentuk ion-ion kromium.
Logam kromium tidak dapat teroksidasi oleh udara yang lembab dan
yang sangat sedikit. Logam kromium mudah larut dalam HCl, sulfat, dan
perklorat. Sesuai dengan tingkat oksidasinya, logam atau ion kromium yang telah
membentuk senyawa, mempunyai sifat-sifat yang berbeda sesuai dengan tingkat
oksidasinya.
Sebagai logam berat, kromium termasuk logam yang mempunyai daya
racun tinggi. Umumnya dijumpai di alam dalam bentuk bervalensi tiga yang sifat
racunnya lebih rendah daripada 6 valensi. Meskipun demikian, kromium terutama
yang bervalensi 6 dapat mengakibatkan kanker saluran pencernaan, penyakit kulit,
dan bisul serta radang pada membran mukus nasal (Vinithkumar, 2004).
2.4.3.4 Tembaga (Cu)
Tembaga di alam dapat ditemukan dalam bentuk logam bebas, akan tetapi
lebih banyak ditemukan dalam bentuk persenyawaan atau sebagai senyawa padat
dalam bentuk mineral. Secara global, sumber masuknya logam Cu ke dalam
lingkungan dapat terjadi secara alamiah (akibat berbagai peristiwa alam) seperti:
erosi batuan, mineral, debu atau partikulat Cu yang ada di udara. Sumber Cu di
alam kini lebih banyak dipengaruhi aktifitas manusia, khususnya buangan industri
yang memakai Cu dalam proses produksinya, seperti industri galangan kapal,
industri pengolaan kayu, buangan rumah tangga, pertambangan, dan lainnya.
Cu digolongkan sebagai logam berat esensial, yang berarti walaupun
termasuk logam berat yang berbahaya tetapi unsur ini dibutuhkan oleh tubuh
dalam jumlah sedikit. Manusia memerlukan Cu sebagai metalloenzim dalam
sistem metabolismenya atau sistem enzim oksidatif. Selain itu, Cu juga sebagai
kompleks Cu protein yang mempunyai fungsi tertentu dalam pembentukan
logam Cu dalam metabolismenya akan berbalik menjadi bahan racun untuk
manusia bila masuk dalam jumlah berlebihan (Palar, 1994 dalam Yefrida, 2008).
Tembaga bersifat racun terhadap semua tumbuhan pada konsentrasi larutan di atas
0,1 ppm. Konsentrasi normal komponen ini di tanah berkisar 20 ppm, sedangkan
konsentrasi yang aman bagi air minum manusia adalah < 1 ppm.
2.5. Adsorpsi Logam Berat Oleh Mikroorganisme
2.5.1. Faktor-Faktor yang Mempengaruhi Proses Bioabsorpsi
Adsorpsi secara umum adalah proses pengumpulan benda-benda terlarut
yang terdapat dalam larutan antara dua fase, yaitu fase padat (adsorben) dan fase
cair (pelarut, biasanya air) yang mengandung spesies terlarut yang akan diserap
(adsorbat, ion logam). Dalam penelitian ini, adsorbatnya adalah ion logam Pb
(Timbal), Cd (Cadmium), Cr (Chromium), dan Cu (Tembaga / Cuprum) dan
mikroalga sebagai adsorbennya. Jenis interaksi yang terjadi antara logam dengan
permukaan sel adalah interaksi ionik, interaksi pengomplekan, interaksi
pertukaran ion dan pengendapan.
Secara umum ada dua jenis adsorpsi logam berat oleh mikroorganisme
yaitu yang tidak bergantung pada mikroorganisme (metabolism-independent)
yang terjadi pada permukaan sel dan adsorpsi yang bergantung pada metabolisme
(metabolism-dependent) yang menyebabkan logam terakumulasi di dalam sel
(Lestari et al., 2002 dalam Triani, 2006). Proses tersebut terjadi pada dinding sel
dan permukaan eksternal lainnya melalui mekanisme kimia dan fisika misalnya
pertukaran ion (kation exchangeable), pembentukan kompleks (dengan
Proses adsorpsi dipengaruhi oleh faktor-faktor sebagai berikut:
(1) pH (Derajat Keasaman)
Derajat keasaman (pH) mempunyai pengaruh besar dalam proses adsorpsi
karena pH mampu mempengaruhi terjadinya interaksi ion logam dengan gugus
aktif adsorben. pH optimum untuk adsorpsi tembaga oleh Chlorella sp. yang
diimobilisasi pada silika gel dicapai pada pH 5 (Triyatno, 2004).
(2) Konsentrasi Logam
Konsentrasi logam sangat berpengaruh terhadap penyerapan logam oleh
adsorben. Pada permukaan penyerap (biomassa mikroalga) terdapat sejumlah sisi
aktif yang proporsional dengan luas permukaan penyerap. Jadi dengan
memperbesar konsentrasi larutan serapan logam akan meningkat secara linier
hingga konsentrasi tertentu.
(3) Waktu Kontak
Waktu kontak antara adsorbat dengan adsorben selama proses adsorpsi
berlangsung dipertahankan konstan. Triyatno (2004) melaporkan bahwa adsorpsi
maksimum Cu2+ dalam Chlorella sp. yang terimobilisasi silika gel dicapai setelah 20 menit.
(4) Tumbukan Antar Partikel
Proses adsorpsi tergantung pada banyaknya tumbukan yang terjadi antara
partikel-partikel adsorbat dan adsorben. Tumbukan antar partikel ini dapat
(5) Karakteristik dari Adsorben
Ukuran partikel dan luas permukaan adsorben akan mempengaruhi proses
adsorpsi. Semakin kecil ukuran partikel akan semakin cepat proses adsorpsi yang
terjadi dan semakin besar luas permukaan adsorben maka penyerapan yang terjadi
semakin merata.
2.5.2. Mekanisme Proses Adsorpsi
Mekanisme adsorpsi logam berat menggunakan biomassa mikroalga telah
banyak dikembangkan, namun masih memiliki kelemahan dan resiko terkait
akumulasi logam berat terhadap sel mikroalga. Metode yang digunakan adalah
absorbsi kation logam berat oleh dinding sel media bio (mikroalga) yang
bermuatan negatif dari gugus karboksil, hidroksil, sulfidril, amina dan fosfat.
Hal demikian dapat terjadi pada mikroorganisme dari golongan alga
(fitoplankton). Dalam tulisannya, Oswald (1988) menyebutkan bahwa alga atau
ganggang memiliki permukaan yang bermuatan negatif tinggi sehingga dapat
menarik logam berat yang memiliki muatan positif yang kuat. Melalui tingginya
tingkat resirkulasi di perairan, logam berat terserap oleh alga dan mendiami
tempat yang bersifat fakultatif atau di bawah kondisi lingkungan normal.
Mekanisme active uptake atau proses bioremoval terjadi pada berbagai sel
hidup dan secara simultan terjadi sejalan dengan konsumsi ion logam untuk
pertumbuhan mikroorganisme dan/atau akumulasi intraselular ion logam tersebut.
Proses ini tergantung pada energi yang terkandung dan sensitifitasnya terhadap
parameter-parameter yang berbeda seperti suhu, pH, kekuatan ikatan ionik,
Proses bioabsorpsi dapat dihambat dengan suhu rendah, tidak tersedianya
sumber energi, dan penghambat-penghambat metabolisme sel. Di sisi lain,
bioabsorpsi logam berat dengan sel hidup ini terbatas dikarenakan oleh akumulasi
ion yang menyebabkan racun terhadap mikroorganisme, sehingga dapat
menghalangi pertumbuhan mikroorganisme disaat keracunan terhadap ion logam
tercapai. Mikroorganisme yang tahan terhadap efek racun ion logam akan
dihasilkan berdasarkan prosedur seleksi yang ketat terhadap pemilihan jenis
3.
BAHAN DAN METODE
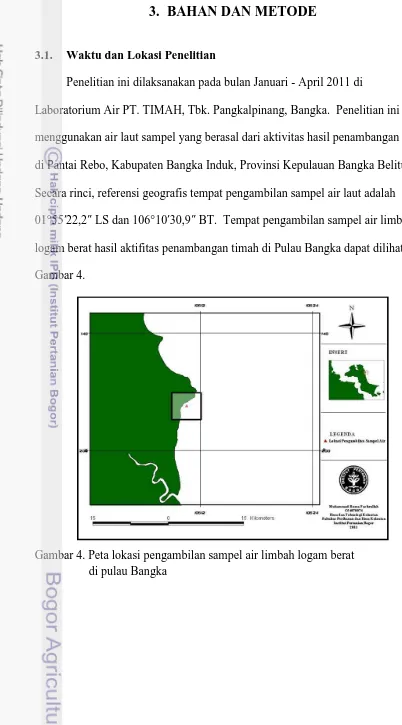
3.1. Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada bulan Januari - April 2011 di
Laboratorium Air PT. TIMAH, Tbk. Pangkalpinang, Bangka. Penelitian ini
menggunakan air laut sampel yang berasal dari aktivitas hasil penambangan timah
di Pantai Rebo, Kabupaten Bangka Induk, Provinsi Kepulauan Bangka Belitung.
Secara rinci, referensi geografis tempat pengambilan sampel air laut adalah
01°55′22,2″ LS dan 106°10′30,9″ BT. Tempat pengambilan sampel air limbah
logam berat hasil aktifitas penambangan timah di Pulau Bangka dapat dilihat pada
Gambar 4.
3.2. Alat dan Bahan
Alat dan bahan yang digunakan pada penelitian ini disajikan pada Tabel 1.
Tabel 1. Alat dan bahan yang digunakan dalam penelitian
Alat dan Bahan Spesifikasi Jumlah Unit
Aerator Air Pump AC-9902 4
Haemacytometer Assistant (Neubauer) 25x10-4 mm2 1
Handcounter - 1
Refraktometer Hand Refraktometer Atago 1
Thermometer Air Raksa (Hg) 1
Sprayer - 1
Tabung Durham Iwaki 15 mL 18
Timbangan Analitik AND EK-3000i 1
Air laut - 60 L
Kertas Saring Millipore Wheatman 150
3.3. Prosedur Penelitian
3.3.1. Pengambilan Air Limbah di Daerah Penambangan Timah
Pengambilan sampel air laut dilakukan tanggal 6 Februari 2011, pukul
14:30 WIB dengan menggunakan perahu nelayan. Sampel air laut diambil
menggunakan wadah polietilen berukuran 35 Liter.
3.3.2. Filterisasi
Filterisasi merupakan suatu metode yang dilakukan untuk menyaring air
laut dengan tujuan menghilangkan partikel-partikel sedimentasi yang ada di dalam
sampel tersebut. Metode ini menggunakan prinsip penyaringan dengan kertas
Millipore. Penggunaan kertas saring dimaksudkan agar partikel-partikel suspensi
dapat tersaring, sehingga yang terlarut akan menjadi media bagi kultivasi
mikroalga.
Alat yang digunakan dalam proses filterisasi ini adalah penyaring air laut.
Bagian-bagiannya terdiri atas pompa vakum, gelas media tampungan (sebagai
wadah filtrat), selang silikon (penghubung pompa vakum dengan gelas filtrat),
dan kertas saring Millipore.
Metode filterisasi tidak bertujuan untuk membunuh bakteri, karena hal
tersebut bertujuan agar partikel yang berukuran lebih dari 0,45 µm akan tersaring,
dan kurang dari 0,45 µm akan menjadi bagian partikel terlarut, termasuk ion atau
logam-logam berat di dalamnya. Proses filterisasi dimulai dengan mengalirkan
air limbah yang mengandung suspensi ke filtering apparatus, selanjutnya air
filtrat (yang tersaring) akan digunakan sebagai media kultur yang sebelumnya
akan melalui tahap sterilisasi (autoclave) agar air sampel limbah bebas dari
patogen dan sel plankton lainnya yang memiliki ukuran sel kurang dari 0,45 µm.
3.3.3. Sterilisasi
Sterilisasi bertujuan untuk menyucihamakan alat serta bahan yang akan
digunakan untuk isolasi maupun kultur mikroalga dari mikroorganisme serta
bahan kimia yang dapat menjadi kontaminan (Kawaroe, 2008). Metode sterilisasi
dapat dilakukan dengan dua cara yaitu melalui pemanasan sederhana (air tawar
untuk sterilisasi alat dan wadah) dan menggunakan autoclave (panas bertekanan)
untuk media air laut dan peralatan yang tahan panas lainnya.
Pemanasan air tawar atau akuades digunakan untuk sterilisasi alat dan
wadah kultur, terdiri atas: selang dan batu aerasi, pipet mohr 1 mL; 2 mL; 5 mL;
10 mL; dan 25 mL, tabung reaksi, penutup tabung reaksi, dan erlenmeyer volume
2800 mL. Sterilisasi dimulai dengan pemanasan air tawar dengan menggunakan
hot plate hingga mendidih. Wadah dan alat yang sebelumnya telah dicuci dan
dibilas dengan air tawar, selanjutnya dialirkan air panas dari hot plate (membunuh
bakteri yang ada di wadah) dan ditiriskan. Sterilisasi menggunakan autoclave
merupakan suatu metode yang memanfaatkan uap panas bertekanan, dengan suhu
Metode ini digunakan untuk peralatan kultivasi dan air media, yang
bertujuan untuk menghilangkan kontaminasi dari patogen yang ada di dalam
media. Media autoclave dapat digunakan setiap pemakaian selama kurang-lebih
30 menit. Dengan luas penampang kira-kira 2 liter media.
3.3.4. Proses Kultur Nannochloropsis sp. dan Chlorella sp.
(1) Persiapan Wadah Kultur
Wadah kultur (250 mL, 750 mL, 1500 mL, dan 2800 mL) yang telah
disterilkan, baik menggunakan autoclave maupun pemanas disusun sesuai dengan
kebutuhan pengkulturan. Wadah kultur terbagi menjadi dua, yaitu wadah bagi
media Chlorella sp. dan Nannochloropsis sp. Wadah yang telah disiapkan diberi
air laut sesuai dengan kapasitas masing-masing wadah. Tahap awal kultur dimulai
dari media 250 mL, atau dari gelas erlenmeyer 250 mL. Selanjutnya, media 250
mL diberi pupuk Pro Analis. Dalam penelitian ini, wadah yang digunakan berisi
pupuk dari media Conwy (Walne’s media) sebanyak 1 mL untuk 1000 mL air
sampel. Setelah mencapai masa puncak populasi, media 250 mL dapat dikultur
kembali dengan menggunakan media 2000 mL, dan selanjutnya media dapat
digunakan untuk keperluan penelitian.
(2) Persiapan Pupuk (Conwy atau Walne) Untuk Kultivasi Mikroalga
Pupuk yang digunakan mengandung campuran dari beberapa bahan-bahan
kimia yang berfungsi untuk memberikan nutrisi dalam mendukung pertumbuhan
mikroalga. Tempat penyimpanan bahan-bahan kimia biasanya disediakan khusus
agar tidak menimbulkan kontaminasi dengan benda-benda sekitarnya. Larutan
media ini dicampurkan ke dalam wadah kultur sesuai dengan volume media
kultur. Selanjutnya media tersebut dapat dihitung jumlah kepadatan sel secara
rutin dengan menggunakan haemacytometer.
3.3.5. Perhitungan Kepadatan Sel Mikroalga
Perhitungan kepadatan bertujuan untuk menentukan kondisi mikroalga
setiap harinya (sel yang bertambah besar dan bertambah banyak). Perhitungan sel
mikroalga menggunakan haemacytometer dan alat bantu handcounter untuk
mencatat jumlah perhitungan. Haemacytometer terbuat dari gelas yang dibagi
menjadi kotak-kotak pada dua tempat bidang pandang untuk menghitung jumlah
kepadatan sel.
Kotak tersebut berbentuk bujur sangkar dengan sisi 1 mm dan tinggi 0,1
mm, sehingga bila ditutup dengan cover glass, akan menghasilkan volume
ruangan 0,1 mm3 atau 10-4 ml. Kotak tersebut dibagi lagi menjadi dua puluh lima kotak bujur sangkar, yang masing-masing dibagi lagi menjadi enam belas kotak
bujur sangkar yang lebih kecil (Isnansetyo, 1995). Contoh penghitungan
kepadatan Chlorella sp. dan Nannochloropsis sp. dapat dilihat pada Lampiran 1.
Estimasi kepadatan sel mikroalga dapat digambarkan dalam perhitungan pada persamaan (1) sebagai berikut:
1. Dalam 400 kotak (bila kepadatan rendah)
Jumlah sel x 104/ml = N sel/mL ………
(1)
2. Dalam beberapa (80) kotak (bila kepadatan terlalu tinggi) Rata-rata jumlah sel (dari 80 kotak) x 400 x 104/ml = N sel/mL
3.3.6. Pengukuran Parameter Fisika dan Kimia Media Kultivasi Mikroalga
Pengukuran parameter ini bertujuan untuk menentukan pengaruh dari
masing-masing parameter terhadap pertumbuhan dari mikroalga (Chlorella sp.
dan Nannochloropsis sp.). Selain itu, pengukuran ini juga berperan penting dalam
membandingkan pengaruh keadaan yang terkontrol dan fluktuatif terhadap
kehidupan mikroalga. Pengukuran parameter dilakukan setiap hari dengan
menggunakan thermometer untuk parameter suhu (oC), Refraktometer untuk salinitas (‰), dan pH meter untuk parameter keasaman air sampel limbah dalam
media kultivasi.
3.3.7. Pemanenan Populasi Mikroalga
Pemanenan dilakukan apabila hasil kultivasi telah mencapai tahap
maksimum. Hal tersebut dikarenakan, masa pertumbuhan mikroalga Chlorella sp.
atau kematian). Apabila pemanenan mikroalga terlalu cepat atau belum mencapai
puncak populasi, sisa zat hara masih cukup besar sehingga dapat membahayakan
organisme yang memanfaatkannya sebagai pakan alami. Pemanenan dilakukan
agar diperoleh bibit awal yang sesuai dengan kualitas yang baik, dan selanjutnya
dapat digunakan sebagai bibit kultur untuk perlakuan penelitian dengan media
yang tecemar logam berat.
3.3.8. Pemindahan Populasi Kultur ke Dalam Media Limbah Logam Berat
Populasi mikroalga akan mencapai masa puncak populasi. Hal ini
dimaksudkan kepadatan sel akan mencapai maksimum dan dapat digunakan untuk
keperluan penelitian menggunakan media limbah logam berat dari air laut sampel.
Selanjutnya populasi dari masing-masing jenis mikroalga (Chlorella sp. dan
Nannochloropsis sp.) dikontakkan ke dalam media khusus yang tercemar logam.
Jumlah sel (ml sampel mikroalga) yang dimasukkan ke dalam media sesuai
dengan kepadatan sel yang diperoleh ketika mencapai puncak populasi.
Ketepatan pemindahan jumlah sel dapat menggunakan formula pengenceran air
media dengan sampel bibit mikroalga. Semakin tinggi kepadatan sel mikroalga,
maka semakin sedikit inokulan (sel) yang ditambahkan.
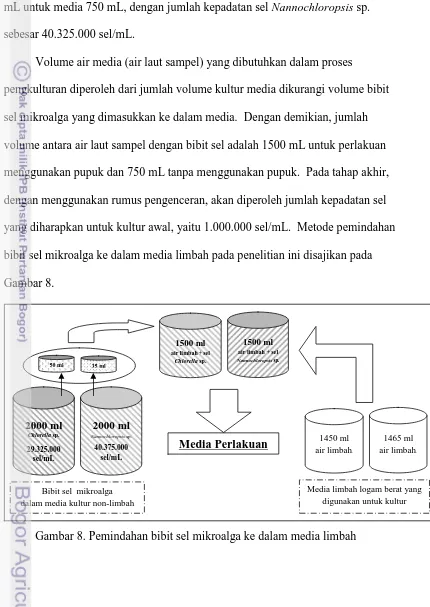
Pemindahan bibit (inokulasi bibit sel) Chlorella sp. dan Nannochloropsis
sp. ke dalam wadah 1500 mL (perlakuan pupuk) dan 750 mL (tanpa pupuk)
dihitung berdasarkan kepadatan Chlorella sp. dan Nannochoropsis dalam wadah
inokulum. Dengan demikian, perhitungan dapat dimulai dengan menggunakan
rumus pengenceran (N1×V1 = N2×V2). Volume awal Chlorella sp. yang diperoleh
dari rumus pengenceran adalah sebesar 51 mL dalam media 1500 mL dan 25,575
1.000.000 sel/mL dalam media kultur dari limbah). Volume ini diperoleh dari
jumlah sel Chlorella sp. sebesar 29.325.000 sel/mL. Berbeda hal nya sel
Nannochloropsis sp. bervolume 35 ml untuk wadah media 1500 mL, dan 18,570
mL untuk media 750 mL, dengan jumlah kepadatan sel Nannochloropsis sp.
sebesar 40.325.000 sel/mL.
Volume air media (air laut sampel) yang dibutuhkan dalam proses
pengkulturan diperoleh dari jumlah volume kultur media dikurangi volume bibit
sel mikroalga yang dimasukkan ke dalam media. Dengan demikian, jumlah
volume antara air laut sampel dengan bibit sel adalah 1500 mL untuk perlakuan
menggunakan pupuk dan 750 mL tanpa menggunakan pupuk. Pada tahap akhir,
dengan menggunakan rumus pengenceran, akan diperoleh jumlah kepadatan sel
yang diharapkan untuk kultur awal, yaitu 1.000.000 sel/mL. Metode pemindahan
bibit sel mikroalga ke dalam media limbah pada penelitian ini disajikan pada
Gambar 8.
Gambar 8. Pemindahan bibit sel mikroalga ke dalam media limbah
2000 ml
Dengan demikian, kepadatan sel awal yang diperoleh dalam media air laut
limbah 1500 mL dan 750 mL adalah 1.000.000 sel/mL. Selanjutnya akan
dilakukan perhitungan harian, dimana jumlah sel diduga akan terus bertambah
hingga mencapai masa puncak populasi sel dan dilakukan pemanenan serta
perhitungan kapasitas ion logam berat yang diserap oleh mikroalga.
3.3.9. Perhitungan Laju Serapan Sel Mikroalga terhadap Logam Berat
Perhitungan laju serapan (kapasitas bioabsorpsi) ini dilakukan setelah
populasi dari Chlorella sp. dan Nannochloropsis sp. mencapai masa puncaknya.
Sehingga ion logam berat yang terserap dapat dihitung menggunakan AAS
(Spektrofotometer Serapan Atom) yang diperoleh dari biomassa sampel air
(mikroalga) yang sebelumnya telah dilakukan penyaringan dan pengasaman
sampai proses pelarutan bahan organik, sehingga yang tersisa adalah bahan-bahan
anorganik termasuk logam berat.
Langkah awal yang dilakukan adalah menyiapkan sampel mikroalga
Chlorella sp. dan Nannchloropsis sp. Selanjutnya sampel tersebut disaring
menggunakan alat penyaring sampel air dan kertas saring Whatman bebas abu.
Setelah disaring, hitung berat biomassa yang telah dikeringkan dengan
menggunakan oven pada suhu 60 - 80 oC. Setelah kering biomassa ditimbang menggunakan neraca analitik (sebelumnya, kertas saring ditimbang terlebih
dahulu untuk mengetahui berat kering dari kertas saring).
Proses pelarutan (melepaskan) logam yang menempel pada mikroalga
memerlukan asam kuat, yakni asam sulfat (H2SO4) 98% dan asam nitrat pekat
(HNO3) masing-masing sebanyak 5 ml. Proses berikutnya dilanjutkan di ruang
lainnya. Proses pemanasan dilakukan selama kurang-lebih 3 jam hingga yang
tersisa dari sampel hanya berupa bahan-bahan anorganik, termasuk logam-logam
berat. Setelah dipanaskan, sampel diencerkan dengan menambahkan HCl ke
dalam labu ukur ukuran 50 ml. Tahap akhir dari proses ini adalah analisis logam
berat menggunakan AAS. Ion-ion logam berat yang diukur adalah logam Pb, Cu,
Cd, dan Cr. Proses pelarutan biomassa mikroalga dalam penelitian ini dapat
dilihat pada Gambar 9.
Gambar 9. Diagram alir proses pelarutan biomassa mikroalga hingga analisis logam berat
100 mL air sampel sel
Nannochloropsis sp. dan Chlorella sp.
3.4. Analisis Data
Analisis dilakukan dengan cara membandingkan laju pertumbuhan spesifik
(µ), serta serapan logam berat dari spesies Chlorella sp. dan Nannochloropsis sp.
Perbandingan tersebut digambarkan dengan menggunakan grafik, laju
pertumbuhan spesifik (µ), dan kapasitas bioabsorpsi (mg logam berat/g biomassa
Chlorella sp. dan Nannochloropsis sp.). Kualitas air dianalisis menggunakan uji
validitas Pearson untuk melihat korelasi yang terjadi dan uji lanjut regresi untuk
melihat pengaruh parameter kualitas air terhadap kelimpahan dengan nilai p=0,05.
Laju pertumbuhan spesifik (µ) mikroalga dihitung dengan formula menurut
Krichnavaruk et al. (2004), pada persamaan (2). Contoh penghitungan dapat
dilihat pada lampiran 2.
µ =
……….
(2)Kapasitas bioabsorpsi mikroalga (qe) dihitung menurut model adsorpsi
isothermal dengan rumus menurut Vijayaraghavan, et al. (2004) pada persamaan
(3). Contoh penghitungan dapat dilihat pada Lampiran 3.
W
V = Volume larutan dalam wadah gelas atau erlenmeyer dengan kontak batch (ml);
Ci = Konsentrasi ion (Pb, Cd, Cr, Cu) dalam larutan (mg/l);
Ce = Konsentrasi akhir atau keseimbangan ion (Pb, Cd, Cr, Cu) dalam
4.
HASIL DAN PEMBAHASAN
4.1. Kepadatan dan Laju Pertumbuhan Spesifik Chlorella sp.
Penelitian ini mendapati bahwa mikroalga Chlorella sp. memiliki laju
pertumbuhan spesifik dan kepadatan yang cukup baik untuk setiap perlakuan.
Laju pertumbuhan spesifik dan kepadatan sel Chlorella sp. dapat dilihat pada
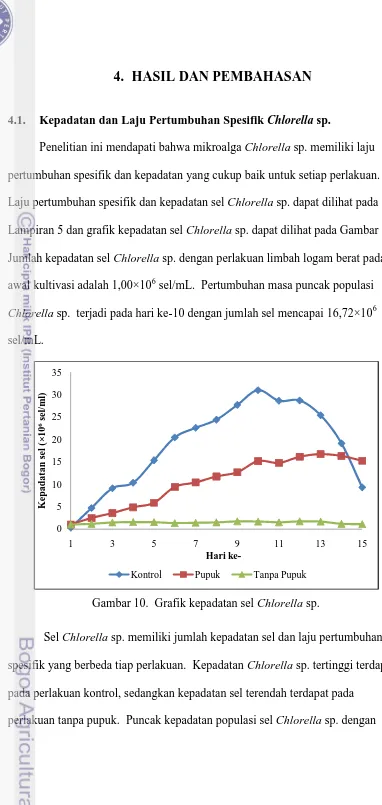
Lampiran 5 dan grafik kepadatan sel Chlorella sp. dapat dilihat pada Gambar 10.
Jumlah kepadatan sel Chlorella sp. dengan perlakuan limbah logam berat pada
awal kultivasi adalah 1,00×106 sel/mL. Pertumbuhan masa puncak populasi
Chlorella sp. terjadi pada hari ke-10 dengan jumlah sel mencapai 16,72×106
sel/mL.
Gambar 10. Grafik kepadatan sel Chlorella sp.
Sel Chlorella sp. memiliki jumlah kepadatan sel dan laju pertumbuhan
spesifik yang berbeda tiap perlakuan. Kepadatan Chlorella sp. tertinggi terdapat
pada perlakuan kontrol, sedangkan kepadatan sel terendah terdapat pada
perlakuan tanpa pupuk. Puncak kepadatan populasi sel Chlorella sp. dengan
perlakuan kontrol terjadi pada hari ke-10, sedangkan untuk perlakuan pupuk dan
tanpa pupuk pada hari ke-13 dan hari ke-9. Sel mengalami penurunan jumlah
secara signifikan pada hari ke-15 untuk perlakuan kontrol. Perlakuan
menggunakan pupuk dan tanpa pupuk tidak mengalami penurunan jumlah
kepadatan sel secara signifikan hingga akhir pengamatan.
Jumlah sel media perlakuan kontrol dan perlakuan menggunakan pupuk
menunjukkan adanya peningkatan setiap harinya. Hal ini berbeda dengan
perlakuan tanpa pupuk dengan jumlah kepadatan sel cenderung stagnan atau tetap.
Hal tersebut dapat diduga karena pengaruh nutrisi, serta kualitas air pada media
kultur, sehingga mempengaruhi pertumbuhan Chlorella sp. pada media tumbuh.
4.1.1. Kepadatan dan Laju Pertumbuhan Spesifik Chlorella sp. dengan Perlakuan Kontrol
Kepadatan puncak mikroalga Chlorella sp. untuk perlakuan kontrol tercatat
mencapai 30×106 sel/mL, yang merupakan nilai tertinggi dibandingkan dengan kultivasi pada perlakuan lain. Hal tersebut diduga karena keadaan lingkungan
yang terkontrol meliputi suhu, salinitas, dan pH yang optimum untuk
pertumbuhan mikroalga. Sesuai dengan penelititan yang dilakukan Sylvester et
al. (2002) bahwa keadaan mikroalga laut yang dapat hidup normal pada salinitas
optimum 25-35 ‰, suhu optimum 25-32 oC, dan pH optimum berkisar 7-8. Chlorella sp. dengan perlakuan kontrol memiliki adaptasi yang sangat baik
terhadap media kultur, dapat dilihat dari nilai laju pertumbuhan spesifik pada hari
ke-1 sebesar 2,751. Hal tersebut menggambarkan bahwa dalam waktu yang
kurang dari satu hari, Chlorella sp. memiliki adaptasi yang sangat baik terhadap
selama kurang dari 24 jam. Hal tersebut dibuktikan pada hari ke-2, jumlah
populasi mikroalga terus meningkat hingga memasuki fase pertumbuhan
eksponensial. Salah satu faktor yang menentukan lamanya fase adaptasi adalah
umur kultur yang digunakan sebagai inokulum. Fase adaptasi akan menjadi lebih
singkat atau bahkan tidak terlihat apabila sel-sel yang diinokulasikan berasal dari
kultur yang berada dalam fase eksponensial (Fogg dan Thake, 1987 dalam
Prihantini et al., 2005).
Fase adaptasi tidak terlihat secara jelas pada media perlakuan kontrol yang
mungkin disebabkan oleh cepatnya kemampuan sel mikroalga menyesuaikan
dirinya terhadap media kultur yang baru, sehingga mampu tumbuh dan
berkembang dengan cepat. Pertumbuhan sel terus bertambah hingga hari ke-10,
dan diikuti Chlorella sp. fase stasioner pada hari ke-11 dan ke-12, karena jumlah
sel yang bertambah seimbang dengan jumlah sel yang mati. Chlorella sp. mulai
memasuki fase kematian pada hari ke-13, ditandai dengan jumlah sel yang
menurun secara drastis, karena ketersediaan nutrien yang telah jauh berkurang di
dalam media kultur. Turunnya laju pertumbuhan Chlorella sp. juga dapat
disebabkan oleh beberapa hal, seperti adanya toksik yang dihasilkan oleh
mikroalga sebagai hasil dari metabolisme yang meracuni mikroalga itu sendiri dan
berkurangnya proses fotosintesis akibat bertambahnya jumlah sel sehingga hanya
bagian tertentu saja yang memperoleh cahaya.
4.1.2. Kepadatan dan Laju Pertumbuhan Spesifik Chlorella sp. dengan Perlakuan Pupuk dalam Media Logam Berat
Jumlah kepadatan sel mikroalga Chlorella sp. pada perlakuan logam berat
pertumbuhan ini berlangsung relatif lambat, dengan jumlah kepadatan awal sel
1,00×106 sel/mL dari hari pertama kultur. Laju pertumbuhan yang lambat ini diduga karena faktor lingkungan pada media kultur. Media kultur Chlorella sp.
menggunakan air sampel limbah pada lokasi penelitian dengan salinitas sebesar
37 ‰, dan pH 6. Hal tersebut dapat menghambat laju pertumbuhan mikroalga
dan didukung kontaminasi logam berat dari hasil penambangan yang cenderung
dapat mempengaruhi jumlah kepadatan sel. Menurut Connel (1990) dalam
Haryoto (2004), pada konsentrasi logam yang tinggi, akumulasi dapat menganggu
pertumbuhan sel, karena sistem perlindungan organisme tidak mampu
mengimbangi efek toksisitas logam.
Selanjutnya laju pertumbuhan meningkat relatif lambat di hari ke-2 sampai
hari ke-5. Hal tersebut menunjukkan sel mengalami fase adaptasi terhadap
lingkungan kultur, sehingga pertambahan jumlah kepadatan sel relatif lebih
lambat. Hari ke-6, sel memasuki fase eksponensial, dengan laju pertumbuhan
spesifik mencapai 0,468 dan terus meningkat hingga hari ke-10 dengan jumlah sel
mencapai 15,16×106 sel/mL. Pada hari ke-11, jumlah sel mengalami penurunan. Penurunan jumlah sel ini diduga karena adanya pemanfaatan nutrien yang
berlebih dari hari-hari sebelumnya, sehingga ketersediaan nutrien berkurang dari
kebutuhan sel mikroalga untuk hari berikutnnya.
Pada hari ke-12 hingga ke-15, jumlah sel relatif bertambah tidak signifikan
dari sebelumnnya dan selanjutnya berkurang memasuki fase stasioner, yang
diduga karena sel memasuki periode kriptik dimana sel-sel Chlorella sp. yang
masih hidup memanfaatkan tambahan nutrisi dari sel Chlorella sp. yang lisis
(Annisa, 2005). Fase deklinasi (penurunan kecepatan petumbuhan) dapat terjadi
karena nutrisi pada media kultur berkurang dan telah terbentuk senyawa NH4+
dalam konsentrasi tinggi dan adanya produk esktraseluler dari mikroalga yang
meracuni diri sendiri sehingga dapat meningkatkan mortalitas Chlorella sp.
(Fogg, 1965 dalam Panggabean, 2000 dan Suantika, 2009), sehingga dalam waktu
kurang dari tiga hari sel mengalami penurunan jumlah manjadi 15,26×106 sel/mL. Pertumbuhan sel kultur di dalam media logam berat sangat dipengaruhi
oleh nilai pH. Hal tersebut dapat dilihat melalui perbandingan antara grafik media
kontrol dengan perlakuan limbah logam berat pada Gambar 10. Grafik perlakuan
kontrol menunjukkan jumlah kepadatan sel jauh lebih tinggi dibandingkan dengan
perlakuan logam berat. Rendahnya kepadatan sel dapat disebabkan adanya nilai
pH yang rendah (asam), sehingga laju pertumbuhan sel semakin lambat.
Penelitian Wong dan Lay (1980) dalam Prihantini et al. (2005) menunjukkan
bahwa Chlorella pyrenoidosa yang ditumbuhkan dalam media Bristol dengan pH
7 memiliki kerapatan sel yang lebih tinggi dibandingkan dengan media dengan pH
6,4.
Hal demikian disebabkan pada lingkungan netral (pH internal sel netral
adalah 7,15), CO2 berada dalam bentuk bebas sehingga dapat berdifusi dengan
mudah ke dalam sel mikroalga (Reynolds, 1984 dalam Prihantini et al., 2005).
Hal tersebut menyebabkan CO2 sebagai sumber karbon utama bagi proses
fotosintesis mikroalga cukup tersedia sehingga proses metabolisme dapat
berlangsung cepat dan kerapatan sel meningkat. Selain itu, jenis karbon
anorganik yang paling banyak terdapat pada media asam (pH 4-6) adalah asam
karbonat pada kisaran pH tersebut umumnya berada dalam bentuk senyawa yang
sangat mudah masuk ke dalam sel sehingga membuat pH internal sel menjadi
asam. Kondisi pH asam mengakibatkan proses biokimia sel terganggu sehingga
mempengaruhi pertumbuhan sel (Lane, 1981 dalam Prihantini et al., 2005). Hal
tersebut diduga merupakan penyebab rendahnya kerapatan sel pada media
perlakuan limbah logam berat dengan pH awal 6.
Secara umum sejak pengamatan hari ke-7 hingga hari ke-15 seluruh media
logam berat dengan perlakuan pupuk mengalami peningkatan pH. Meningkatnya
pH kemungkinan disebabkan adanya aktivitas fotosintesis Chlorella sp. Pada saat
fotosintesis, CO2 bebas merupakan jenis karbon anorganik utama yang digunakan
mikroalga. Mikroalga juga dapat menggunakan ion karbonat (CO32-) dan ion
bikarbonat (HCO3-). Penyerapan CO2 bebas dan bikarbonat oleh mikroalga
menyebabkan penurunan konsentrasi CO2 terlarut dan mengakibatkan
peningkatan nilai pH (Sze, 1993 dalam Prihantini et al., 2005).
4.1.3. Kepadatan dan Laju Pertumbuhan Spesifik Chlorella sp. dengan Perlakuan Tanpa Pupuk dalam Media Logam Berat
Jumlah sel Chlorella sp. dengan perlakuan tanpa pupuk relatif lebih rendah
dibandingkan dengan perlakuan lainnya. Media perlakuan tanpa pupuk memiliki
batasan ketersedian nutrien yang bermanfaat untuk memacu pertumbuhan
mikroalga. Air laut yang tercemar logam berat juga turut mempengaruhi
kepadatan sel dari media kultur. Media limbah logam berat pada perlakuan tanpa
pupuk ini memiliki salinitas 37 ‰ dan pH 6-7. Dengan demikian, hal tersebut
membuktikan bahwa selain kurangnya ketersediaan nutrien, faktor lingkungan
lingkungan yang optimum untuk pertumbuhan mikroalga adalah salinitas berkisar
25-35 ‰, suhu optimum 25-32 oC, dan pH optimum berkisar 7-8 (Sylvester et al., 2002).
Laju pertumbuhan mikroalga relatif konstan dan bahkan menurun setiap
hari waktu pengamatan, yang dapat ditunjukkan dari laju pertumbuhan spesifik
mikroalga (negatif) dari setiap pertambahan sel nya. Kepadatan sel maksimum
terjadi pada hari ke-9 dengan jumlah sel 1,72×106 sel/mL dan kepadatan sel menurun hingga hari ke-15 dengan jumlah 1,12×106 sel/mL.
4.2. Kepadatan dan Laju Pertumbuhan Spesifik Nannochloropsis sp.
Penelitian ini mendapati bahwa mikroalga Nannochloropsis sp. memiliki
laju pertumbuhan spesifik dan kepadatan yang cukup baik untuk setiap perlakuan.
Laju pertumbuhan spesifik dan kepadatan sel Nannochloropsis sp. dapat dilihat
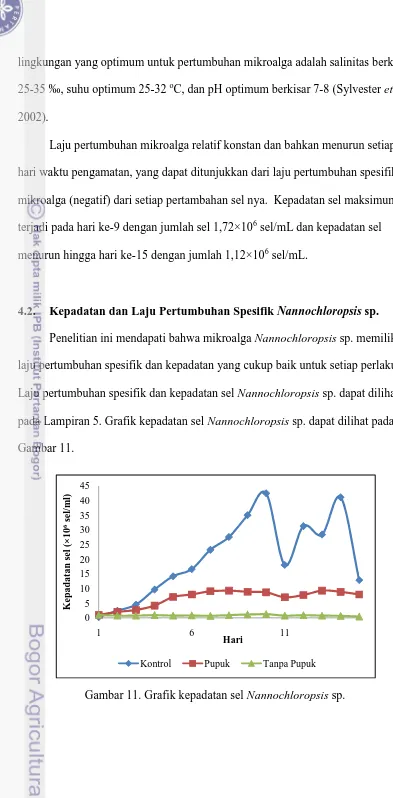
pada Lampiran 5. Grafik kepadatan sel Nannochloropsis sp. dapat dilihat pada
Gambar 11.
Sel Nannochloropsis sp. juga memiliki jumlah kepadatan dan laju
pertumbuhan spesifik yang berbeda tiap perlakuan. Jumlah kepadatan sel
Nannochloropsis sp. dengan perlakuan limbah logam berat pada awal kultivasi
adalah 1,00×106 sel/mL. Masa puncak populasi sel Nannochloropsis sp. terjadi pada hari ke-8 dengan jumlah sel mencapai 9,28×106 sel/mL. Jumlah kepadatan sel tertinggi terdapat pada perlakuan kontrol, sedangkan jumlah kepadatan sel
terendah pada perlakuan tanpa pupuk. Puncak kepadatan populasi
Nannochloropsis sp. untuk perlakuan kontrol teramati pada hari ke-10 dan hari
ke-14, sedangkan untuk perlakuan pupuk pada hari ke-13 dan perlakuan tanpa
pupuk pada hari ke-10.
4.2.1. Kepadatan dan Laju Pertumbuhan Spesifik Nannochloropsis sp. dengan Perlakuan Kontrol
Jenis mikroalga ini memiliki laju pertumbuhan yang sangat tinggi. Hal ini
dapat dilihat dari jumlah kepadatan sel yang sangat dominan pada hari ke-10 dan
hari ke-14. Jumlah kepadatan sel maksimum pada puncak pertama sebesar
42,50×106 sel/mL, dan diikuti puncak populasi kedua sebesar 41,15×106 sel/mL. Kepadatan optimum kultur Nannochloropsis sp. yang dapat dicapai untuk skala
laboratrium adalah 50 - 60×106 sel/mL, skala semi massal 20 - 25×106 sel/mL dan massal 15 - 20×106 sel/mL dengan masa kultur 4-7 hari (Anon et al., 2009).
Gambar 11 juga menggambarkan adanya adaptasi yang baik oleh
Nannochloropsis sp., yang dibuktikan dengan laju pertumbuhan spesifik pada hari
ke-2 yang meningkat signifikan sebesar 2,092. Hal tersebut menunjukkan bahwa
dalam waktu kurang dari 24 jam, sel Nannochloropsis sp. mampu menambah